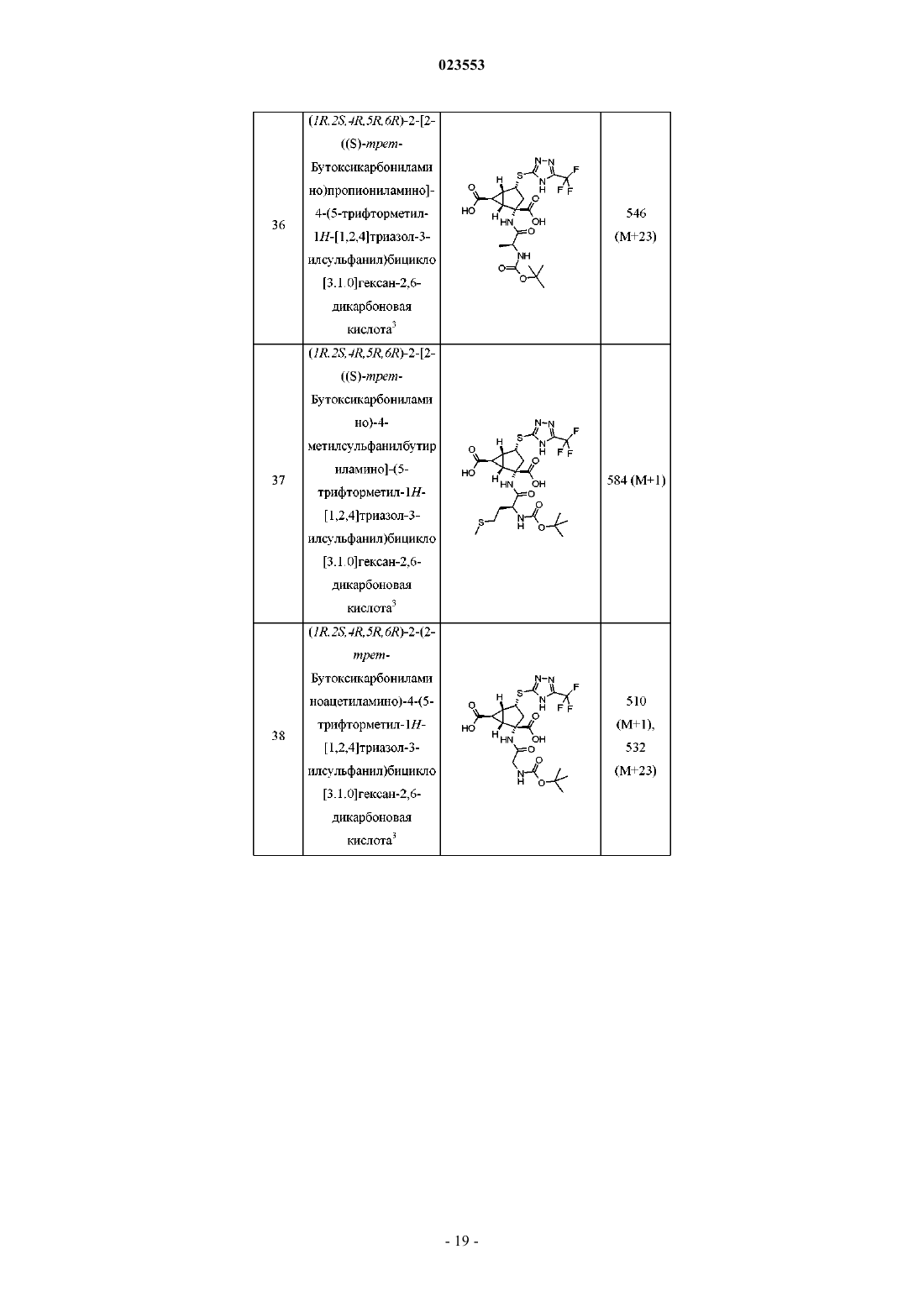
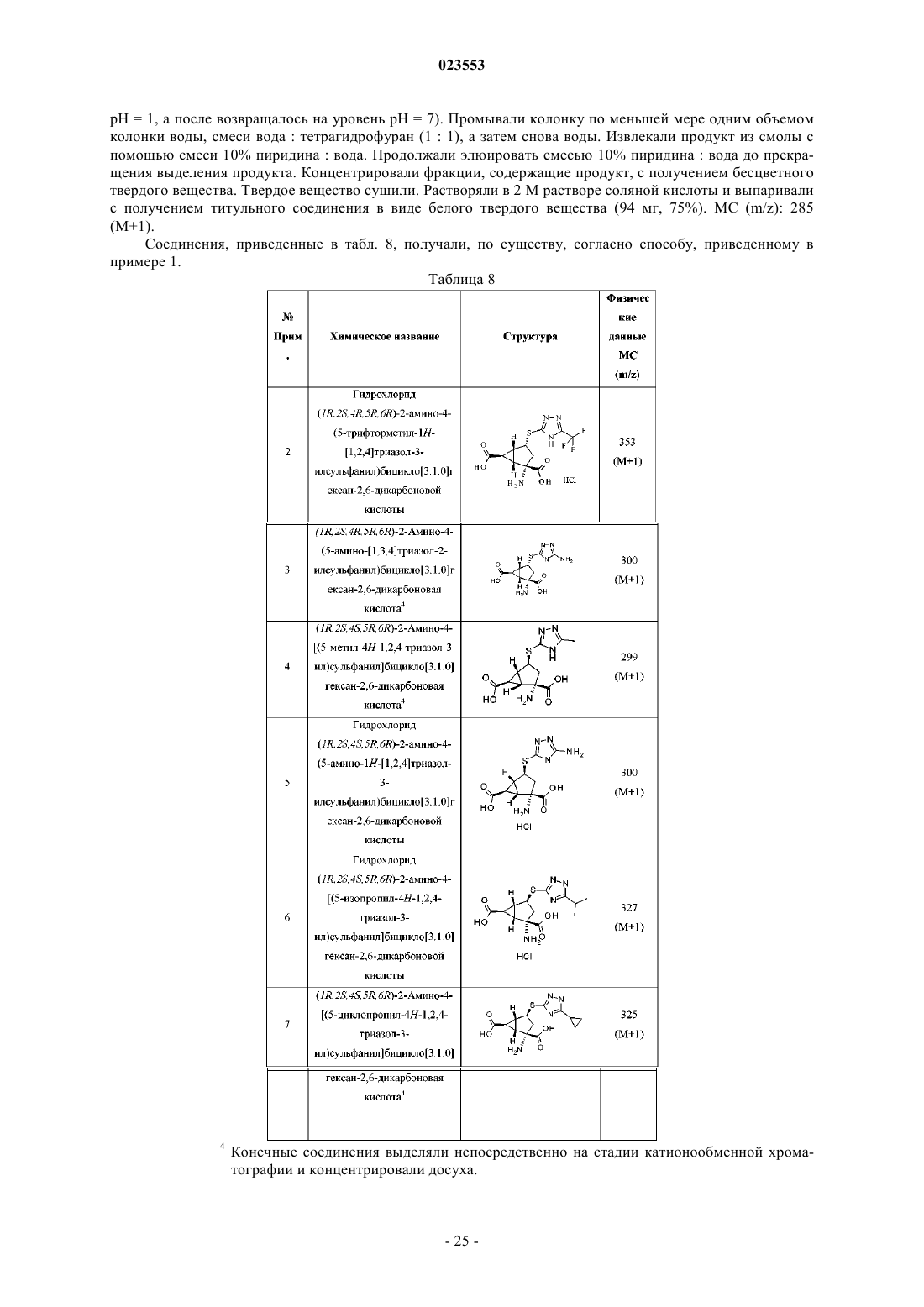
Агонисты рецептора mglu2
Номер патента: 23553
Опубликовано: 30.06.2016
Авторы: Прието Лурдес, Ман Тереза Тсе Кл, Монн Джеймс Аллен, Монтеро Сальгадо Карлос, Вальтон Лесли, Таппер Дэвид Эдвард
Формула / Реферат
1. Соединение формулы
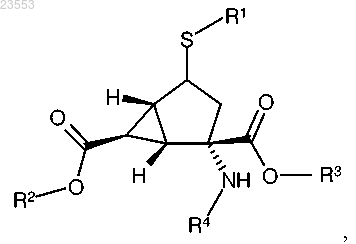
где R1 представляет собой
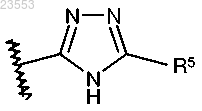
или
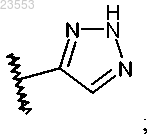
R2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкилом, возможно замещенным 1-3 атомами фтора, или -C1-C3 алкокси;
R3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкилом, возможно замещенным 1-3 атомами фтора, или -C1-C3 алкокси;
R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил;
R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил;
при условии, что если R2 и/или R3 не являются водородом, то R4 представляет собой водород; и
при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации;
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, отличающееся тем, что
R1 представляет собой

или
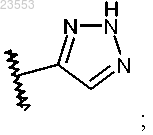
R2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкилом, возможно замещенным 1-3 атомами фтора, или -C1-C3 алкокси;
R3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкилом, возможно замещенным 1-3 атомами фтора, или -C1-C3 алкокси;
R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил;
R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил;
при условии, что если R2 и/или R3 не являются водородом, то R4 представляет собой водород;
или фармацевтически приемлемая соль указанного соединения.
3. Соединение по любому из пп.1, 2, отличающееся тем, что
R2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; и
R3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3;
или фармацевтически приемлемая соль указанного соединения.
4. Соединение по любому из пп.1-3, отличающееся тем, что R1 представляет собой
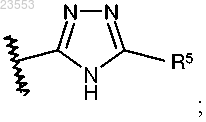
или фармацевтически приемлемая соль указанного соединения.
5. Соединение по любому из пп.1-4, отличающееся тем, что R2 представляет собой водород; или фармацевтически приемлемая соль указанного соединения.
6. Соединение по любому из пп.1-5, отличающееся тем, что R3 представляет собой водород; или фармацевтически приемлемая соль указанного соединения.
7. Соединение по любому из пп.1-6, отличающееся тем, что R4 представляет собой водород; или фармацевтически приемлемая соль указанного соединения.
8. Фармацевтическая композиция для лечения неврологических или психических расстройств, содержащая соединение по любому из пп.1-7 или фармацевтически приемлемую соль указанного соединения, а также фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
9. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли указанного соединения в терапии неврологических или психических расстройств.
10. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли указанного соединения для лечения психического расстройства, выбранного из группы, состоящей из биполярного расстройства, шизофрении и генерализованного тревожного расстройства.
11. Применение по п.10 для лечения биполярного расстройства.
12. Применение по п.10 для лечения шизофрении.
13. Применение по п.10 для лечения генерализованного тревожного расстройства.
Текст
В настоящем изобретении предложены новые агонисты mGlu2, подходящие для применения для лечения биполярного расстройства, шизофрении и генерализованного тревожного расстройства. Ман Тереза Тсе Кл, Монн Джеймс Аллен, Монтеро Салгадо Карлос,Прието Лурдес, Вальтон Лесли,Таппер Дэвид Эдвард (US) Лыу Т.Н., Угрюмов В.М., Кондакова Е.В. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к агонистам рецептора mGlu2, их конкретным пролекарствам и их солям, а также к фармацевтическим композициям и терапевтическому применению таких соединений,конкретных пролекарств и их солей.L-глутамат является основным возбуждающим нейротрансмиттером в центральной нервной системе и относится к возбуждающим аминокислотам. Метаботропные глутаматные рецепторы (mGlu) представляют собой сопряженные с G-белком рецепторы, которые модулируют нейронную возбудимость. Лечение неврологических или психических расстройств связывают с селективной активацией рецепторов mGlu, возбуждаемых аминокислотой. Различные исследования подтверждают факт активации рецепторов mGlu Группы II (которая включает mGlu2 и/или mGlu3) при лечении шизофрении. В частности,недавно полученные данные свидетельствуют о том, что агонист рецепторов mGlu2/3 обладает антипсихотическими свойствами и может обеспечивать новый альтернативный способ лечения шизофрении. Исследования на мышах с нокаутом рецепторов mGlu2 и mGlu3 позволяют предположить, что активность агонистов рецепторов mGlu2/3, подобная антипсихотической, опосредована mGlu2. Исследования также демонстрируют, что агонисты mGlu2/3 обладают успокаивающими, антидепрессивными и нейропротекторными свойствами. Таким образом, агонисты рецептора mGlu2 могут подходить для лечения психических расстройств, таких как биполярное расстройство (также известное как маниакальнодепрессивное расстройство), также известное как маниакально-депрессивное расстройство, шизофрения и генерализованное тревожное расстройство. В WO 9717952 предложены некоторые 4-замещенные бицикло[3.1.0]гексаны, указанные в качестве антагонистов или агонистов метаботропных глутаматных рецепторов. В WO 3104217 предложены бицикло[3.1.0]гексаны и гетеробицикло[3.1.0]гексаны, указанные в качестве пролекарственных форм агонистов рецептора mGlu2. Избыточный глутаматергический тонус связывают со многими болезненными состояниями центральной нервной системы; тем не менее, в клинической практике наблюдается недостаток эффективных агентов для коррекции таких патофизиологических состояний. В частности, клиническое применение не было реализовано в связи с отсутствием агонистов mGlu2 с подходящими лекарственными свойствами. Таким образом, по-прежнему существует потребность в сильных агонистах mGlu2. Также существует потребность в эффективных агонистах mGlu2. В настоящем изобретении предложены новые 4 замещенные бицикло[3.1.0]гексаны, в том числе конкретные пролекарства указанных соединений, которые обеспечивают повышенную биодоступность, подходящую для клинических исследований, и которые являются сильными и эффективными агонистами mGlu2. Такие новые соединения согласно настоящему изобретению способны удовлетворить потребность в сильных и эффективных средствах для лечения психических расстройств, таких как биполярное расстройство, шизофрения и генерализованное тревожное расстройство. В настоящем изобретении предложено соединение формулыR2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, или-C1-C3 алкокси; R3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, или -C1-C3 алкокси; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4 метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собойR2 и/или R3 не являются водородом, то R4 представляет собой водород; при условии, что если R4 не является водородом, то R2 и/или R3 представляют собой водород; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или фармацевтически приемлемая соль указанного соединения. В настоящем изобретении предложен способ лечения психических расстройств, выбранных из группы, состоящей из биполярного расстройства, шизофрении и генерализованного тревожного расстройства, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения. Также в настоящем изобретении предложен способ лечения боли, включающий введение пациенту,нуждающемуся в этом, эффективного количества соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения. Также в настоящем изобретении предложен способ лечения злоупотребления психоактивными веществами, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения. В настоящем изобретении предложена фармацевтическая композиция соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения. В настоящем изобретении предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или фармацевтически приемлемую соль указанного соединения, в сочетании с одним или более фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами. В одном конкретном варианте реализации состав дополнительно содержит один или более других терапевтических агентов. В настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения в терапии, в частности для лечения психических расстройств. Кроме того, в настоящем изобретении предложено применение соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения для получения лекарственных средств для лечения психических расстройств. Также в настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения при лечении психических расстройств. Также в настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения в терапии, в частности для лечения боли. Кроме того, в настоящем изобретении предложено применение соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения для получения лекарственных средств для лечения боли. Также в настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения при лечении боли. В настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения в терапии, в частности для лечения злоупотребления психоактивными веществами. Кроме того, в настоящем изобретении предложено применение соединения согласно настоящему изобретению или фармацевтически приемлемой соли указанного соединения для получения лекарственных средств для лечения злоупотребления психоактивными веществами. Также в настоящем изобретении предложено соединение согласно настоящему изобретению или фармацевтически приемлемая соль указанного соединения для применения при лечении злоупотребления психоактивными веществами. Кроме того, в настоящем изобретении предложен фармацевтический состав, предназначенный для лечения психических расстройств. Кроме того, в настоящем изобретении предложены предпочтительные варианты реализации способов и применений согласно настоящему описанию, в которых психическое расстройство выбрано из группы, состоящей из биполярного расстройства, шизофрении и генерализованного тревожного расстройства. Кроме того, в настоящем изобретении предложен фармацевтический состав, предназначенный для лечения боли. Кроме того, в настоящем изобретении предложен фармацевтический состав, предназначенный для лечения злоупотребления психоактивными веществами. Общие химические термины, используемые в приведенных выше формулах и на всем протяжении настоящего описания, имеют свои традиционные значения. Например, термин "-C1-C3 алкил" представляет собой -C1-C3 алкильную группу и относится к метилу, этил, пропилу и изопропилу. Термин "-C1-C3 алкокси" представляет собой -C1-C3 алкильную группу, связанную с атомом кислорода, и относится к метокси, этокси, пропокси и изопропокси. Термины "защитная группа для азота" или "защитная группа для аминогруппы" и "защитная группа для кислорода" или "защитная группа для карбоксильной группы" означают фрагмент, который является устойчивым к предполагаемым условиям реакции и при этом может быть селективно удален при помощи реагентов и условий реакции, совместимых с восстановленным амином или кислотой. Такие группы хорошо известны специалистам в данной области техники и описаны в литературе. См., например, Greeneand Wuts, Protective Groups in Organic Synthesis, четвертое издание, John WileySons, Inc., (2007). Специалисту в данной области техники понятно, что соединения согласно настоящему изобретению могут существовать в таутомерных формах, например, как показано ниже в (1). Если в настоящей заявке приведена любая ссылка на один из конкретных таутомеров соединений согласно настоящему изобретению, то это подразумевает охват обеих таутомерных форм и всех смесей указанных соединений. Специалисту в данной области техники понятно, что соединения согласно настоящему изобретению содержат ядро, которое содержит по меньшей мере пять хиральных центров Соединения с абсолютной конфигурацией атомов, пронумерованных от 2 до 5, как показано выше в(2), являются предпочтительными соединениями согласно настоящему изобретению. Атом под номером 1 находится в R-конфигурации, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в нижнем положении относительно плоскости расположения кольца, что обозначают при помощи пунктирной линии. Наоборот, S-конфигурация наблюдается, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в верхнем положении относительно плоскости расположения кольца, что обозначают при помощи жирной линии в форме клина. Кроме того, специалисту в данной области техники понятно, что в соединениях согласно настоящему изобретению путем выбора конкретных заместителей можно формировать дополнительные хиральные центры. В таком случае настоящее изобретение охватывает все индивидуальные энантиомеры и диастереомеры, а также смеси энантиомеров и диастереомеров указанных соединений, включая рацематы. Также специалисту в данной области техники понятно, что обозначения (R) и (S) согласно номенклатуре Кана-Ингольда-Прелога для всех хиральных центров будут изменяться в зависимости от схем замещения для конкретного соединения. Индивидуальные энантиомеры или диастереомеры могут быть получены на основе хиральных реагентов или при помощи стереоселективных или стереоспецифических способов синтеза. Альтернативно, индивидуальные энантиомеры или диастереомеры могут быть выделены из смесей при помощи стандартных способов хиральной хроматографии или кристаллизации на любой подходящей стадии синтеза соединений согласно настоящему изобретению. Индивидуальные энантиомеры или диастереомеры соединений согласно настоящему изобретению являются предпочтительным вариантом реализации настоящего изобретения. Соединения согласно настоящему способны взаимодействовать, например, с рядом неорганических или органических кислот с образованием фармацевтически приемлемых солей присоединения кислоты или солей присоединения основания. Фармацевтически приемлемые соли и общепринятые способы получения указанных соединений хорошо известны в данной области техники. См., например, P. Stahl et al."Pharmaceutical Salts" Journal of Pharmaceutical Sciences, Вып. 66,1, январь 1977. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные соляной кислотой. Хотя все соединения согласно настоящему изобретению подходят для применения в качестве агонистов mGlu2, некоторые классы соединений являются предпочтительными. В следующих абзацах описываются такие предпочтительные классы:R2 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3;R2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3;R2 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 илиR3 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3;R3 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 илиR3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3;R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; Соединение согласно настоящему изобретению представляет собой фармацевтически приемлемую соль; Соединение согласно настоящему изобретению представляет собой хлористо-водородную соль. Предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, или-C1-C3 алкокси; R3 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, где бензил возможно замещен одним или двумя атомами фтора, -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, или -C1-C3 алкокси; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4 метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собойR2 и/или R3 не являются водородом, то R4 представляет собой водород; при условии, что если R4 не является водородом, то R2 и/или R3 представляют собой водород; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, гдеR2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -ОСН 3; R3 представляет собой водород, 2,2 диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -ОСН 3; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собой -C1-C3 алкил,возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что если R2 и/или R3 не являются водородом, то R4 представляет собой водород; при условии, что если R4 не является водородом,-4 023553 то R2 и/или R3 представляют собой водород; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, гдеR2 представляет собой водород, 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R3 представляет собой водород, 2,2 диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -ОСН 3; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собой -C1-C3 алкил,возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что если R2 и/или R3 не являются водородом, то R4 представляет собой водород; при условии, что если R4 не является водородом,то R2 и/или R3 представляют собой водород; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R3 представляет собой водород или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4 метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собойR2 и/или R3 не являются водородом, то R4 представляет собой водород; при условии, что если R4 не является водородом, то R2 и/или R3 представляют собой водород; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -ОСН 3; R3 представляет собой водород или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R4 представляет собой водород, (2S)-2-аминопропаноил, (2S)-2-амино-4 метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2-аминоацетил; R5 представляет собой родом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R3 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R3 представляет собой 2,2-диметилпропионилоксиметил или бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или -OCH3; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Дополнительный предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или OCH3; R3 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или OCH3; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или-ОСН 3; R3 представляет собой бензил, возможно замещенный одним или двумя атомами фтора, -CF3 или-OCH3; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Другой предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой (2S)-2 аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2 аминоацетил; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; или к фармацевтически приемлемой соли указанных соединений. Дополнительный предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой (2S)-2 аминопропаноил, (2S)-2-амино-4-метилсульфанилбутаноил, (2S)-2-амино-4-метилпентаноил или 2 аминоацетил; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Особенно предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; или к фармацевтически приемлемой соли указанных соединений. Особенно предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Другой особенно предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляет собойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; или к фармацевтически приемлемой соли указанных соединений. Другой особенно предпочтительный вариант реализации относится к соединениям согласно настоящему изобретению, где R1 представляетсобойR2 представляет собой водород; R3 представляет собой водород; R4 представляет собой водород; R5 представляет собой -C1-C3 алкил, возможно замещенный 1-3 атомами фтора, -NH2 или циклопропил; при условии, что R5 может являться водородом, если атом серы присоединен к кольцевой системе бицикло[3.1.0]гексана в S-конфигурации; или к фармацевтически приемлемой соли указанных соединений. Соединения согласно настоящему изобретению или соли указанных соединений могут быть получены при помощи различных способов, известных в данной области техники, некоторые из которых проиллюстрированы в приведенных ниже схемах, примерах получения и примерах. Конкретные стадии синтеза для каждого из описанных способов могут быть объединены различными способами или могут сочетаться со стадиями из различных схем для получения соединений согласно настоящему изобретению или солей указанных соединений. Продукты каждой стадии на приведенных ниже схемах можно выделять при помощи стандартных способов, в том числе экстракции, выпаривания, осаждения, хроматографии, фильтрации, растирания и кристаллизации. Для ясности на приведенных ниже схемах некоторые стереохимические центры оставлены неотмеченными, а некоторые заместители удалены, что никоим образом не ограничивает схемы. Кроме того,индивидуальные изомеры, энантиомеры или диастереомеры могут быть разделены на любой подходящей стадии синтеза соединений согласно настоящему изобретению при помощи способов, таких как хиральная хроматография. Кроме того, промежуточные соединения, описанные в следующих схемах, содержат ряд защитных групп для карбоксильных и аминогрупп. Защитные группы могут быть одинаковыми или различными в каждом случае в зависимости от конкретных условий реакции и конкретных осуществляемых превращений. Условия введения и снятия защиты хорошо известны специалисту в данной области техники и описаны в литературе. См., например, Greene and Wuts, Protective Groups in Organic Synthesis, выше. Сокращения, используемые в настоящем описании, определяются в соответствии с Aldnchimica Acta, Вып. 17,1, 1984. Другие сокращения определяются следующим образом: "тозилат" обозначает nтолуолсульфонил; "мезилат" обозначает метансульфонил; "ДИПЭА" относится к диизопропилэтиламину; "ДИК" относится к диизопропилкарбодиимиду; "HATU" относится к 2-(1H-7-азабензотриазол-1-ил)1,1,3,3-тетраметилуронийгексафторфосфату метанаминия; "HBTU" относится к O-бензотриазолN,N,N',N'-тетраметилуронийгексафторфосфату; "HOAt" относится к 1-гидрокси-7-азабензотриазолу;"РуВОР" относится к гексафторфосфату бензотриазол-1-илокситрипирролидинофосфония; "PyBrOP" относится к гексафторфосфату бром-триспирролидинофосфония; "ДМАП" относится к 4 диметиламинопиридину; "ТГФ" относится к тетрагидрофурану; "SCX" относится к сильному катионному обмену; "Прим. получ. " обозначает номер примера получения; "Прим. " обозначает номер примера. В приведенных ниже схемах все заместители, если не указано иное, являются такими, как определено ранее. Реагенты и исходные вещества, как правило, являются легкодоступными для специалиста в данной области техники. Остальные могут быть получены при помощи обычных способов органической химии и химии гетероциклов, которые аналогичны способам синтеза известных структурно схожих соединений и способам, описанным в следующих примерах получения и примерах, включая любые новые На схеме I приведен общий способ синтеза соединения формулы 5. "ЗГ 1" означает защитную группу, разработанную для карбоксильной группы, такую как сложные эфиры. "ЗГ 2" означает защитную группу, разработанную для аминогруппы, такую как карбаматы и амиды. Такие защитные группы хорошо известны и признаны в данной области техники. "УГ" обозначает уходящую группу, такую как тозилат или мезилат. Таким образом, "УГ-галид" представляет собой реагент, такой как паратолуолсульфонилхлорид или метансульфонилхлорид. Соединение формулы 1 взаимодействует с соединением формулы 2 в присутствии подходящего основания, такого как диметиламинопиридин или триэтиламин, в подходящем растворителе, таком как дихлорметан, с образованием соединения формулы 3. Соединение формулы 5 образуется в результате взаимодействия соединения формулы 3 с подходящим соединением формулы 4 в присутствии подходящего основания, такого как карбонат калия или карбонат натрия, в подходящем растворителе, таком как диметилформамид, обеспечивающем условия для облегчения снятия защитных групп, которые хорошо известны и признаны в данной области техники. Соединение формулы 5 может быть выделено в виде свободного основания или в виде подходящей соли, такой как гидрохлорид. Схема II На схеме II приведен общий способ синтеза соединения формулы 7. "ЗГ 1" и "ЗГ 2" являются такими,как определено в схеме I выше. Соединение формулы 1 взаимодействует с трифенилфосфином и Br2 в подходящем растворителе,таком как толуол или тетрагидрофуран, с образованием бромированного соединения формулы 6. Соединение формулы 7 образуется в результате взаимодействия соединения формулы 6 с подходящим соединением формулы 4 в присутствии подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как диметилформамид, обеспечивающем условия для облегчения снятия защитных групп, которые хорошо известны и признаны в данной области техники. Соединение формулы 7 может быть выделено в виде свободного основания или в виде подходящей соли, такой как гидрохлорид. Схема III На схеме III приведен общий способ синтеза соединения формулы 11. "ЗГ 1" и "ЗГ 2" являются такими, как определено в схеме I, выше. R4 не является водородом. Соединение формулы 8 подвергают воздействию подходящих условий снятия защиты для удаления"ЗГ 2" с получением соединения формулы 9. Такие условия хорошо известны и признаны в данной области техники. Соединение формулы 11 образуется в результате взаимодействия соединения формулы 9 с соединением формулы 10 в подходящих условиях проведения сочетания, обеспечивающих условия для облегчения снятия защитных групп, которые хорошо известны и признаны в данной области техники. Специалисту в данной области техники понятно, что существует целый ряд способов и реагентов для образования амида в результате взаимодействия карбоновых кислот и аминов. Например, подходящие условия проведения сочетания включают взаимодействие подходящего соединения формулы 9 с подходящей кислотой формулы 10 в присутствии связующего реагента и аминного основания, такого как ДИПЭА или триэтиламин. Связующие реагенты включают карбодиимиды, такие как ДЦК (дициклогексилкарбодиимид), ДИК (диизопропилкарбодиимид), ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид), и ароматические связующие реагенты, такие как ГОБТ (1-гидрокисбензотриазол) и ГОАТ (1 гидрокси-7-азабензотриазол). Кроме того, вместо более традиционных связующих реагентов могут быть использованы соли урония или фосфония ненуклеофильных анионов, такие как HBTU, HATU, РуВОР иPyBrOP. Для усиления взаимодействий можно применять добавки, такие как ДМАП. Соединение фор-9 023553 мулы 11 может быть выделено в виде свободного основания или в виде подходящей соли, такой как гидрохлорид. Схема IV На схеме IV приведен общий способ синтеза соединения формулы 14. "ЗГ 1" и "ЗГ 2" являются такими, как определено в схеме I, выше. Соединение формулы 12 получают путем воздействия на соединение формулы 8 в подходящих условиях снятия защиты, при которых происходит исключительно снятие защиты с кислотных групп. Такие условия хорошо известны и признаны в данной области техники. Соединение формулы 13 получают путем этерификации полученного свободного фрагмента карбоновой кислоты с R2OH в подходящих условиях. Следует отметить, что R2 = R3. Специалисту в данной области техники понятно, что существует целый ряд способов и реагентов для проведения этерификации свободной карбоновой кислоты. Например, к реакционной смеси может быть добавлен избыток одного из реагентов, например, спирта. Альтернативно, при помощи дистилляции или дегидратирующего агента можно удалять получающуюся воду. Наконец, полученное соединение формулы 13 подвергают воздействию подходящих условий снятия защиты с аминогруппы. Такие условия хорошо известны и признаны в данной области техники. Соединение формулы 14 может быть выделено в виде свободного основания или в виде подходящей соли, такой как гидрохлорид. Альтернативно, путем селективного и постадийного осуществления введения и снятия защиты в соответствующем промежуточном соединении, таком как соединение формулы 7, может быть получен диэфир, в котором R2 и R3 различны. Такие условия хорошо известны и признаны в данной области техники. Понятно, что соединения формулы 1 могут быть быстро получены при помощи способов, аналогичных описанным в настоящей заявке, и при помощи процедур, которые хорошо известны и признаны в данной области техники. Понятно, что стадии для получения соединений согласно настоящему изобретению зависят от конкретного синтезируемого соединения, исходного соединения и относительной лабильности замещенных фрагментов. Примеры получения и примеры Следующие примеры получения и примеры дополнительно иллюстрируют настоящее изобретение. Названия примерных соединений согласно настоящему изобретению образованы при помощи программного обеспечения SYMYXDraw 3.2 или ACD/Name version 12. Пример получения 1. Ди-трет-бутил-(1S,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4-(n-толилсульфонилокси)бицикло[3.1.0]гексан-2,6-дикарбоксилат В двугорлую круглодонную колбу в атмосфере азота вносили да-трет-бутил-(1S, 2S,4S,5R,6R)-2(трет-бутоксикарбониламино)-4-гидроксибицикло[3.1.0]гексан-2,6-дикарбоксилат (20,7 г, 0,5 моль, подробности синтеза см. в международной заявке на патент WO03/104217/A2), 4-диметиламинопиридин(10,4 г, 0,85 моль), триэтиламин (6,98 мл, 0,5 ммоль) и n-толуолсульфонилхлорид (10,6 г, 0,55 моль) в дихлорметане (200 мл) и перемешивали смесь при комнатной температуре в течение ночи. Добавляли 1 н. раствор гидросульфата калия (200 мл), воды (100 мл) и экстрагировали органический слой. Промывали водой (200 мл), солевым раствором (200 мл), сушили над сульфатом магния, фильтровали и выпаривали досуха. Добавляли тетрагидрофуран (30 мл), а затем гептан (90 мл). Смесь нагревали при 60C и медленно добавляли гептан (200 мл). Смесь охлаждали до комнатной температуры. Твердое вещество отфильтровывали и высушивали при пониженном давлении с получением титульного соединения в виде белого твердого вещества (24,6 г, 87%). MC (m/z): 590 (М+23). Пример получения 2. Ди-трет-бутил-(1R, 2S, 4R, 5R, 6R)-4-бром-2-(трет-бутоксикарбониламино)бицикло[3.1.0]гексан 2,6-дикарбоксилат Трифенилфосфин (41,97 г, 158,4 ммоль) растворяли в свежеприготовленном толуоле (660 мл) и добавляли бром (8,14 мл, 158,4 ммоль) до образования устойчивой желтой окраски. В течение 45 мин по каплям добавляли раствор ди-трет-бутил-(1S,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4-гидроксибицикло[3.1.0]гексан-2,6-дикарбоксилата (32,75 г, 79,2 ммоль) в толуоле (176 мл) и безводном пиридине(528 мл). Реакционную смесь перемешивали при 75C в течение ночи. Охлаждали до комнатной температуры, разбавляли этилацетатом, фильтровали и концентрировали досуха. Неочищенный продукт суспендировали в метил-трет-бутиловом эфире, фильтровали для удаления твердых веществ и фильтрат концентрировали досуха. Неочищенный продукт очищали при помощи хроматографии на силикагеле(750 г) при элюировании смесью гексан : этилацетат (от 0:100 до 80:20) с получением титульного соединения в виде белого твердого вещества (29,52 г, 78%). MC (m/z): 498, 500 (М+23). Пример получения 3. Ди-трет-бутил-(1R,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4-(1H-1,2,4-триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилат К раствору ди-трет-бутил-(1R,2S,4R,5R,6R)-4-бром-2-(трет-бутоксикарбониламино)бицикло[3.1.0]гексан-2,6-дикарбоксилата (2 г, 4,20 ммоль) в диметилформамиде (10 мл) добавляли 1H-1,2,4 триазол-3-тиол (525 мг, 5,04 ммоль) и карбонат калия (1,16 г, 8,4 ммоль) Смесь перемешивали при 80C в течение ночи Охлаждали до комнатной температуры и разбавляли этилацетатом, промывали 10% лимонной кислотой и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха Очищали при помощи хроматографии на силикагеле (80 г кварцевая капиллярная колонка) при элюировании смесью гексан этилацетат (от 80 20 до 0 100) с получением титульного соединения (1,64 г, 78%) MC (m/z) 497 (М+1) Соединения, приведенные ниже в табл. 1, получали из соединений согласно примеру получения 1 или примеру получения 2, по существу, согласно способу, приведенному в примере получения 3. Таблица 1 В реакции в качестве основания применяли Na2CO3. Реакционную смесь нагревали в микроволновом реакторе. Раствор ди-трет-бутил-(1R,2S,4R,5R,6R)-2-(трет-бутоксикарбониламино)-4-(2H-триазол-4-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (11,8 мг, 20,77 ммоль) и раствор натриевой соли 1Hмеркапто-(трифторметил)-4H-1,2,4-триазола (7,7 г, 38,5 ммоль) в диметилформамиде (100 мл) продували азотом и перемешивали при 70C в течение ночи. Охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Органический слой промывали водой, солевым раствором, сушили над сульфатом магния и концентрировали досуха. Очищали при помощи колоночной флэшхроматографии при элюировании смесью изогексан : этилацетат (от 94 : 5 до 60 : 40) с получением титульного соединения (10,9 г, 93,5%). MC (m/z): 587 (М+23). Соединения, приведенные в табл. 2, получали, по существу, согласно способу, приведенному в примере получения 13. Реакционную смесь нагревали в микроволновом реакторе. Пример получения 18. Гидрохлорид диэтил-(1R,2S,4S,5R,6R)-2-амино-4-(1H-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата В круглодонную колбу вносили ди-трет-бутил-(1R,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4(4H-1,2,4-триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилат (3,7 г, 7,45 ммоль) и этанол(50 мл). Медленно добавляли тионилхлорид (2,71 мл, 37,25 ммоль) (экзотермическая реакция до 45C) и смесь перемешивали при 80C в течение ночи. Растворитель удаляли под вакуумом с получением титульного соединения в виде белого твердого вещества (2,8 г, 99%). MC (m/z): 341 (М+1). К гидрохлориду диэтил-(1R,2S,4S,5R,6R)-2-амино-4-(4H-1,2,4-триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (0,869 г, 2,31 ммоль) добавляли тетрагидрофуран (11,5 мл) и смесь охлаждали до 0-5C на ледяной бане. Добавляли 2-хлор-4,6-диметокси-1,3,5-триазин (404,9 мг, 2,31 ммоль) и (2S)-2-(трет-бутоксикарбониламино)уксусную кислоту (0,404 г, 2,31 ммоль). Медленно добавляли N-метилморфолин (0,55 мл, 5,07 ммоль) и перемешивали в течение 2 ч. Смесь фильтровали и белое твердое вещество промывали тетрагидрофураном. Твердое вещество отбрасывали и раствор концентрировали досуха. Очищали при помощи картриджа OASIS HLB (опускали в ДМСО и элюировали с градиентом смесями буферный раствор бикарбоната аммония pH=9/ацетонитрил). Целевое соединение элюировали смесью 3 : 1 (бикарбонат аммония/ацетонитрил). Удаляли растворитель. Остаток растворяли в дихлорметане и промывали водой. Отбрасывали водную фазу. Смесь сушили над сульфатом магния,фильтровали и концентрировали досуха с получением титульного соединения в виде белого твердого вещества (440 мг, 38%). MC (m/z): 498 (М+1), 520 (М+23). Пример получения 22. Диэтил-(1R,2S,4S,5R,6R)-2-S)-2-трет-бутоксикарбониламинопропиониламино)-4-(4H-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилат рат 1-гидроксибензотриазола (219 мг, 1,41 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (208 мг, 1,34 ммоль) объединяли в дихлорметане (9 мл) и добавляли триэтиламин (373 мкл, 2,68 ммоль). Смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Промывали 10% раствором лимонной кислоты, насыщенным раствором гидрокарбоната натрия и солевым раствором. Водные слои отбрасывали, органический слой фильтровали при помощи картриджа с диатомовой землей и удаляли растворитель под вакуумом. Очищали при помощи флэш-хроматографии при элюировании смесью дихлорметан : метанол (1-15%) с получением титульного соединения (412,5 мг,90,2%). MC (m/z): 552 (М+1), 534 (М+23). Соединения, приведенные в табл. 4, получали, по существу, согласно способу, приведенному в примере получения 22. Таблица 4 Гидрохлорид диэтил-(1R,2S,4R,5R,6R)-2-амино-4-(5-трифторметил-1 Н-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (657 мг, 1,48 ммоль), О-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилуронийгексафторфосфат (730 мг, 1,92 ммоль) и (2S)-2-(трет-бутоксикарбониламино)пропионовую кислоту (363 мг, 1,92 ммоль) объединяли в безводном диметилформамиде (12 мл) при комнатной температуре, добавляли диизопропилэтиламин (3,0 мл, 17,20 ммоль) и смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Реакционную смесь разбавляли этилацетатом (60 мл) и промывали насыщенным раствором гидрокарбоната натрия (30 мл). Водную фазу экстрагировали этилацетатом. Органические фазы объединяли, промывали водой (30 мл) и солевым раствором (30 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и удаляли растворитель под вакуумом. Очищали при помощи хроматографии на силикагеле (110 г кварцевая капиллярная колонка) при элюировании смесью изогексан : этилацетат (от 95 : 5 до 10 : 90) с получением титульного соединения (321 мг, 38%). MC (m/z): 602 (М+23). Соединения, приведенные в табл. 5, получали, по существу, согласно способу, приведенному в примере получения 25. К суспензии гидрохлорида диэтил-(1R,2S,4S,5R,6R)-2-амино-4-(1H-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (2,04 г, 5,41 ммоль) в 1,4-диоксане (27,07 мл, 317,02 ммоль) добавляли ди-трет-бутилдикарбонат (2,39 г, 10,83 ммоль) и карбонат калия (1,89 г, 13,53 ммоль). Через десять минут добавляли воду (27,07 мл, 1,50 моль) и перемешивали при комнатной температуре в течение 2 дней. Диоксан удаляли и остаток разбавляли этилацетатом. Слои разделяли и сушили над сульфатом магния, фильтровали и концентрировали. Получали титульное соединение в виде белого твердого вещества (1,97 г, 83%). MC (m/z): 441 (М+1). Диэтил-(1R,2S,4S,5R,6R)-22-(трет-бутоксикарбониламино)ацетил]амино]-4-(4H-1,2,4-триазол-3 илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилат (0,420 г, 0,84 ммоль) растворяли в тетрагидрофуране (7 мл), а затем добавляли 2,5 М гидроксид лития (6,7 мл, 16,88 ммоль). Смесь перемешивали при комнатной температуре в течение 3,5 ч. Реакционную смесь разбавляли водой и промывали этилацетатом. Органический слой отбрасывали. Водный слой доводили до pH = 2 с помощью 1 н. раствора соляной кислоты и экстрагировали этилацетатом. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали досуха с получением титульного соединения в виде белого твердого вещества В реакции в качестве основания применяли 2,0 М LiOH. К раствору диэтил-(1R,2S,4S,5R,6R)-2-трет-бутоксикарбониламино-4-(1H-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (1,9 г, 4,31 ммоль) в тетрагидрофуране (20 мл) добавляли 2,5 М водный раствор гидроксида лития (20,70 мл, 51,76 ммоль) и перемешивали при комнатной температуре в течение ночи. Тетрагидрофуран выпаривали. Смесь разбавляли водой и промывали этилацетатом. Органический слой отбрасывали. Водную фазу доводили до pH = 2 с помощью 5 М раствора соляной кислоты и экстрагировали этилацетатом. Слои разделяли и сушили над сульфатом магния, фильтровали и концентрировали. Получали титульное соединение в виде белого твердого вещества (1,58 г,95%). MC (m/z): 385 (М+1). К раствору ди-трет-бутил-(1S,2S,5R,6R)-2-(трет-бутоксикарбониламино)-4-оксобицикло[3.1.0]гексан-2,6-дикарбоксилата (2,0 г, 4,86 ммоль) в тетрагидрофуране (24,3 мл) и этаноле (9,72 мл) при перемешивании добавляли 2,5 М гидроксида натрия (15,55 мл, 38,88 ммоль). Реакционную смесь нагревали до 60C и перемешивали в течение ночи. Нагревание продолжали в течение 4 ч, а затем смесь промывали этилацетатом. Водную фазу охлаждали на ледяной бане и подкисляли до pH = 2-3 с помощью 1 н. раствора соляной кислоты. Экстрагировали этилацетатом (3 раза), органический слой сушили над сульфатом натрия, фильтровали и концентрировали с получением титульного соединения в виде оранжевого твердого вещества (1,4 г, 96%). MC (m/z): 322 (М+23). Пример получения 44. Дибензил-(1S,2S,5R,6R)-2-трет-бутоксикарбониламино-4-оксобицикло[3.1.0]гексан-2,6-дикарбоксилат(1S,2S,5R,6R)-2-(трет-бутоксикарбониламино)-4-оксобицикло[3.1.0]гексан-2,6 дикарбоновой кислоты (7,27 г, 24,3 ммоль) и карбоната цезия (15,83 г, 48,6 ммоль) в сухом N,Nдиметилформамиде (60 мл) по каплям при перемешивании добавляли бензилбромид (8,69 мл, 72,9 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Реакцию гасили водой и смесь разбавляли этилацетатом. Водную фазу экстрагировали этилацетатом (3 раза) и органические слои промывали солевым раствором и водой. Сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного материала в виде бледно-коричневой маслянистой жидкости. Очищали при помощи флэш-хроматографии при элюировании смесью этилацетат : гексан (от 20 : 80 до 30 : 70) с получением титульного соединения в виде вязкой желтой пены (9,15 г,78,5%). MC (m/z): 502 (М+23). Пример получения 45. Дибензил-(1S,2S,4S,5R,6R)-2-трет-бутоксикарбониламино-4-гидроксибицикло[3.1.0]гексан-2,6-дикарбоксилат К раствору бис-[(фенил)метил]-(1S,2S,5R,6R)-2-(трет-бутоксикарбониламино)-4-оксобицикло[3.1.0]гексан-2,6-дикарбоксилата (9,15 г, 19,08 ммоль) в тетрагидрофуране (20 мл) при -78C по каплям при перемешивании добавляли 1 М раствор L-селектрида в ТГФ (30 мл, 30 ммоль). Полученную оранжевую смесь перемешивали в атмосфере азота в течение 1 ч 45 мин. Реакцию гасили насыщенным раствором гидрокарбоната натрия при -78C. Смесь разбавляли водой и этилацетатом. Слои разделяли и органическую фазу промывали солевым раствором и водой. Сушили над сульфатом натрия, фильтровали и концентрировали досуха с получением неочищенного материала в виде бледно-желтой маслянистой жидкости. Объединенный материал очищали при помощи флэш-хроматографии при элюировании смесью этилацетат : гексан (от 20 : 80 до 50 : 50) с получением титульного соединения в виде индивидуального изомера (9,19 г, 100%). MC (m/z): 504 (М+23). Пример получения 46. Дибензил-(1S,2S,4S,5R,6R)-2-трет-бутоксикарбониламино-4-(толуол-4 сульфонилокси)бицикло[3.1.0]гексан-2,6-дикарбоксилат К раствору дибензилового сложного эфира (1S,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4(тозилокси)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (0,6 г, 0,943 ммоль) в безводном диметилформамиде (8 мл) при перемешивании добавляли дигидрат натриевой соли 1H-5-меркапто-1,2,3-триазола(0,174 г, 1,42 ммоль) и нагревали при 70C в течение ночи. Реакционную смесь разбавляли этилацетатом(60 мл) и органический слой промывали NaHCO3 (30 мл) и солевым раствором (30 мл), сушили над безводным Na2SO4, концентрировали и очищали при помощи хроматографии на силикагеле (40 г кварцевая капиллярная колонка) при элюировании 0-60% этилацетатом в изогексане с получением титульного соединения в виде бесцветной смолы (0,405 г,76% выход). MC (m/z): 587 (М+23). Пример получения 48. бис-(4-Метоксибензил)-(1R,2S,4R,5R,6R)-2-трет-бутоксикарбониламино-4(1H-[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилат(0,365 г, 2,59 ммоль) и смесь перемешивали при комнатной температуре в течение ночи Растворитель удаляли и смесь при помощи хроматографии на силикагеле (12 г картридж с силикагелем) при элюировании с градиентом смесями дихлорметан / метанол с получением титульного соединения (240 мг, 40%)(1R,2S,4S,5R,6R)-2-трет-бутоксикарбониламино-4-(1H-[1,2,4]триазол-3-илсульфанил)бицикло[3 1 0]гексан-2,6-дикарбоновой кислоты (0,300 г, 0,780 ммоль) в 3 мл сухого диметилформамида добавляли бикарбонат натрия (0,393 г, 4,68 ммоль), иодид натрия (0,351 г, 2,34 ммоль) и 2,2 диметилхлорметиловый сложный эфир пропионовой кислоты (352,60 мг, 2,34 ммоль). Полученную однородную смесь перемешивали в течение 18 ч. Растворитель удаляли под вакуумом, добавляли воды и экстрагировали этилацетатом. Слои разделяли и органическую фазу сушили над сульфатом магния,фильтровали и концентрировали. Неочищенный продукт очищали путем пропускания через 5 г картридж с нормальной фазой Phenomenex STRATA при элюировании смесью 50% гексан : этилацетат с получением титульного соединения (96 мг, 20%). MC (m/z): 613 (М+1). Пример получения 51. Гидрохлорид 2-трет-бутил-6-этил-(1R,2S,4S,5R,6R)-2-амино-4-(1H[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата К раствору ди-трет-бутил-(1R,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-4-(1H-1,2,4-триазол-3 илсульфанил)бицикло[3.1.0]гексан-4,6-дикарбоксилата (1,3 г, 2,62 ммоль) в этаноле (9,14 мл) по каплям добавляли ацетилхлорид (1,12 мл, 15,71 ммоль). Смесь нагревали в запаянной трубке при 50C в течение 2 ч. Удаляли растворитель с получением титульного соединения (950 мг, 90%). MC (m/z): 369 (М+1). Пример получения 52. Гидрохлорид (1R,2S,4S,5R,6R)-4-амино-6-этоксикарбонил-2-(1H-1,2,4 триазол-3-илсульфанил)бицикло[3.1.0]гексан-4-карбоновой кислоты газообразного хлороводорода в этилацетате (8 мл) и перемешивали при комнатной температуре в течение 25 ч. Удаляли растворитель с получением титульного соединения (831 мг, 101%). MC (m/z): 313 К суспензии гидрохлорида (1R,2S,4S,5R,6R)-4-амино-6-этоксикарбонил-2-(1 Н-1,2,4-триазол-3 илсульфанил)бицикло[3.1.0]гексан-4-карбоновой кислоты (740 мг, 2,12 ммоль) в 1,4-диоксане (10,61 мл) добавляли ди-трет-бутилдикарбонат (935,39 мг, 4,24 ммоль) и карбонат калия (888,5 мг, 6,36 ммоль). Смесь перемешивали при комнатной температуре. Через десять минут добавляли воду (10,61 мл) и перемешивали при комнатной температуре в течение 2 дней. Диоксан удаляли и смесь разбавляли этилацетатом, доводили до кислотного pH с помощью 5 М раствора HCl. Слои разделяли и органическую фазу сушили над сульфатом магния, фильтровали и концентрировали с получением титульного соединения Суспензию (1R,2S,4S,5R,6R)-2-(трет-бутоксикарбониламино)-6-этоксикарбонил-4-(1H-1,2,4-триазол-3-илсульфанил)бицикло[3.1.0]гексан-2-карбоновой кислоты (270 мг, 0,654 ммоль), О-(7 азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфата (0,373 г, 0,982 ммоль), диизопропилэтиламина (0,342 мл, 1,96 ммоль) в дихлорметане (6,55 мл) перемешивали в течение 15 мин при комнатной температуре и добавляли бензиловый спирт (0,101 мл, 0,982 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли и продукт очищали сперва при помощи колоночной хроматографии на силикагеле (4 г картридж с силикагелем) при элюировании с градиентом смесями дихлорметан / метанол (целевое соединение элюируется смесью с 6% метанола), а затем при помощи картриджа Waters OASIS HLB при элюировании смесью 3 : 1 ацетонитрил / вода. Получали титульное соединение в виде белого твердого вещества (100 мг, 30%). MC (m/z): 503 (М+1). Пример 1. Гидрохлорид К раствору ди-трет-бутил-(1R,2S,4R,5R,6R)-2-трет-бутоксикарбониламино-4-(2H-[1,2,3]триазол-4 илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (194 мг, 0,39 ммоль) в дихлорметане (30 мл) при перемешивании добавляли дибромид цинка (0,88 г, 3,91 ммоль). Смесь перемешивали в течение ночи при 50C. Дополнительно добавляли дибромид цинка (0,44 г, 1,95 ммоль) и продолжали перемешивание при 50C до полного израсходования исходного вещества. Растворитель выпаривали и остаток перемешивали в 2 М водном растворе соляной кислоты (5 мл) при 50C до момента присутствия в остатке только целевого продукта. Реакционную смесь охлаждали и остаток очищали при помощи катионообменной хроматографии (DOWEX 50WX8-100). Пропускали соединение через колонку при скорости, равной примерно 1 капле каждые 1-2 с. После того, как исходный загруженный объем раствора взаимодействовал с поверхностью смолы, колонку промывали водой (от 5 до 10 мл) и процедуру повторяли 3 раза. Отслеживали pH элюата и продолжали промывать водой до завершения процедуры (наблюдаемый цикл изменения pH: для элюата, выходящего из колонки, первоначально pH = 7, затем значение опускалось доpH = 1, а после возвращалось на уровень pH = 7). Промывали колонку по меньшей мере одним объемом колонки воды, смеси вода : тетрагидрофуран (1 : 1), а затем снова воды. Извлекали продукт из смолы с помощью смеси 10% пиридина : вода. Продолжали элюировать смесью 10% пиридина : вода до прекращения выделения продукта. Концентрировали фракции, содержащие продукт, с получением бесцветного твердого вещества. Твердое вещество сушили. Растворяли в 2 М растворе соляной кислоты и выпаривали с получением титульного соединения в виде белого твердого вещества (94 мг, 75%). MC (m/z): 285 Конечные соединения выделяли непосредственно на стадии катионообменной хроматографии и концентрировали досуха. К раствору соляной кислоты (4M в диоксане) добавляли ди-трет-бутил-(1R,2S,4R,5R,6R)-2-(третбутоксикарбониламино)-4-5-(дифторметил)-4H-1,2,4-триазол-3-ил]сульфанил]бицикло[3.1.0]гексан-2,6 дикарбоксилат (0,356 г, 651,3 мкмоль) в 1,4-диоксане (1,63 мл). Смесь при перемешивании нагревали до 50C. Вскоре после начала нагревания из раствора выпадал твердый осадок. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле (40 г SiO2) при элюировании с градиентом смесями 0-20% соляной кислоты (0,01 М водный раствор) в ацетонитриле в течение 60 мин при скорости потока 40 мл/мин. Раствор концентрировали при пониженном давлении с получением неочищенного маслянистого продукта. Проводили повторную очистку в аналогичных условиях. Раствор концентрировали при пониженном давлении с получением титульного соединения в виде белого твердого вещества (0,196 г, 93%). MC (m/z): 335 (М+1). Соединение, приведенное в табл. 9, получали, по существу, согласно способу, приведенному в примере 8. Таблица 9 К раствору ди-трет-бутил-(1R,2S,4S,5R,6R)-2-трет-бутоксикарбониламино-4-(1H-[1,2,4]триазол-3 илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоксилата (1,64 г, 3,30 ммоль) в 1,4-диоксане (20 мл) добавляли 4 М раствор соляной кислоты в 1,4-диоксане (20 мл) и смесь перемешивали при 50C в течение ночи. Раствор концентрировали досуха. Очищали при помощи катионообменной хроматографии(DOWEX Marathon С, форма Na+, сильнокислая). Остаток растворяли в минимальном количестве воды для растворения продукта и наносили в смолу. Смолу последовательно промывали 2 объемами колонки воды, а затем 2 объемами колонки смеси вода : тетрагидрофуран (1 : 1) и 2 объемами колонки воды. Целевой продукт элюировали 2 объемами колонки 10% раствора пиридина в воде с получением титульного соединения в виде белого твердого вещества MC (m/z) 285 (М+1) 1H-ЯМР(300 МГц, D2O) 4,25 (d, J=7,3 Гц, 1H), 2,53-2,38 (m, 3H), 2,23 (dd, J=8,1, 16,1 Гц, 1H), 1,95 (t, J=3,3 Гц, 1 Н) Соединения, приведенные в табл. 10, получали, по существу, согласно способу, приведенному в примере 10. К полученному раствору добавляли 2 М раствор HCl и концентрировали при пониженном давлении. Ди-трет-бутил-(1R,2S,4R,5R,6R)-2-(трет-бутоксикарбониламино)-4-[(5-метил-4H-1,2,4-триазол-3 ил)сульфанил]бицикло[3.1.0]гексан-2,6-дикарбоксилат (85 мг, 0,166 ммоль) растворяли в уксусной кислоте (1 мл) и воде (1 мл). Смесь нагревали до 160C при примерно 40 Вт в микроволновом реакторе BIOTAGE Initiator в течение 6 мин. Реакционную смесь концентрировали при пониженном давлении. Дважды добавляли воду и удаляли при пониженном давлении для удаления избытка уксусной кислоты с получением титульного соединения в виде белого твердого вещества (40 мг, 88,6%). MC (m/z): 299(1R,2S,4R,5R,6R)-2-[2-S)-трет-Бутоксикарбониламино)пропиониламино]-4-(5-трифторметил-1H[1,2,4]триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (340 мг, 0,65 ммоль) обрабатывали водным раствором соляной кислоты (2 М, 7 мл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха и остаток очищали при помощи катионообменной хроматографии (DOWEX50WX8-100). Соединение растворяли в воде и доводили до pH = 2. Пропускали соединение через колонку при скорости, равной примерно 1 капле каждые 1-2 с. После того, как исходный загруженный объем раствора взаимодействовал с поверхностью смолы, колонку промывали водой (от 5 до 10 мл) и процедуру повторяли 3 раза. Отслеживали pH элюата и продолжали промывать водой до завершения процедуры (наблюдаемый цикл изменения pH: для элюата, выходящего из колонки, первоначально pH = 7,затем значение опускалось до pH = 1, а после возвращалось на уровень pH = 7). Промывали колонку по меньшей мере одним объемом колонки воды, смеси вода : тетрагидрофуран (1 : 1), а затем снова воды. Извлекали продукт из смолы с помощью смеси 10% пиридина : вода. Продолжали элюировать смесью 10% пиридина : вода до прекращения выделения продукта. Концентрировали фракции, содержащие продукт, с получением бесцветного твердого вещества (204 мг). Твердое вещество растворяли в воде и добавляли 2 М раствор соляной кислоты (1,5 экв) и путем сублимационной сушки в течение 48 часов получали титульное соединение в виде белого твердого вещества (225 мг, 75,4%). MC (m/z): 424 (М+1). Соединения, приведенные в табл. 12, получали, по существу, согласно способу, приведенному в примере 16. Таблица 12(1R,2S,4S,5R,6R)-22-(трет-бутоксикарбониламино)ацетил]амино]-4-(4 Н-1,2,4-триазол-3-илсульфанил)бицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (220 мг, 0,49 ммоль) растворяли в насыщенном растворе газообразного хлороводорода в этилацетате (7 мл) и перемешивали при комнатной температуре в течение 2 ч. Удаляли растворитель с получением титульного соединения в виде белого твердого вещества (180 мг, 98%). MC (m/z): 342 (М+1). Соединения, приведенные в табл. 13, получали, по существу, согласно способу, приведенному в примере 22. Таблица 13
МПК / Метки
МПК: A61P 25/24, C07D 249/04, C07D 249/12, A61P 25/22, A61K 31/4196, A61P 25/18, A61K 31/4192
Метки: mglu2, агонисты, рецептора
Код ссылки
<a href="https://eas.patents.su/30-23553-agonisty-receptora-mglu2.html" rel="bookmark" title="База патентов Евразийского Союза">Агонисты рецептора mglu2</a>
Предыдущий патент: Усиление действия ингибиторов прорастания картофельных клубней путем применения различных комбинаций агентов
Следующий патент: Формованный и покрытый металлический материал, композит и способ изготовления формованного и покрытого металлического материала и композита
Случайный патент: Удаление кислорода