Способ получения ингибитора цитохром p450 монооксигеназы и промежуточные соединения, применяемые в этом способе
Номер патента: 22739
Опубликовано: 29.02.2016
Авторы: Истон Лия, Кент Кеннет, Польняшек Ричард, Каллен Аарон, Чжоу Чжунсинь, Дауди Эрик, Трэн Дуонг, Юй Ричард, Корде Даг, Пфайфер Стивен
Формула / Реферат
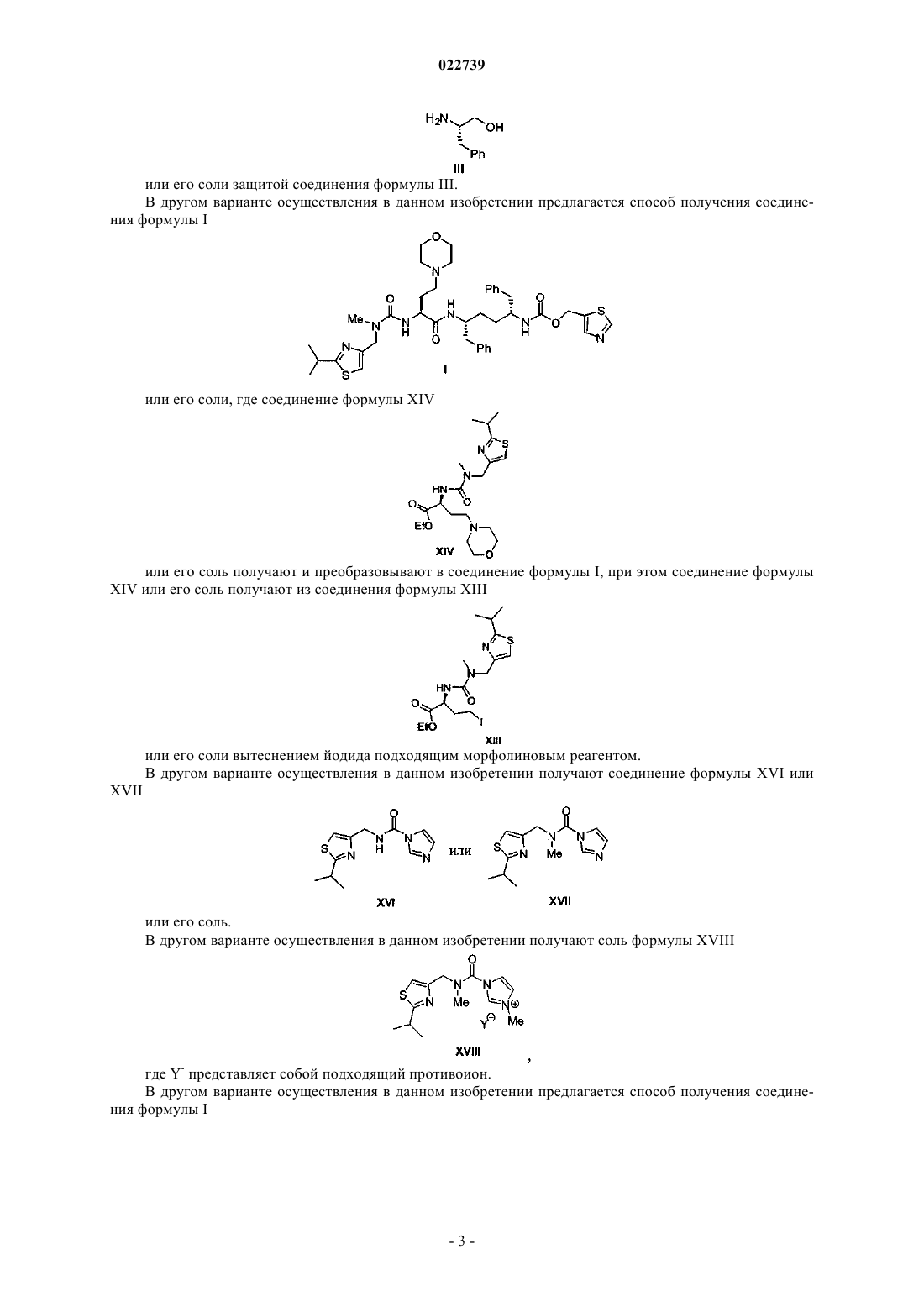
1. Способ получения соединения формулы I
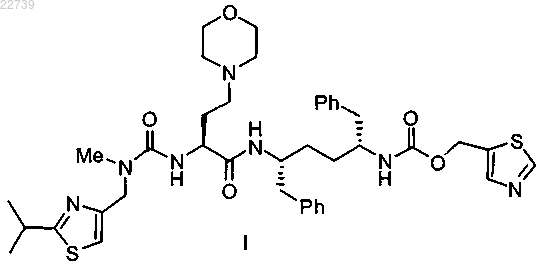
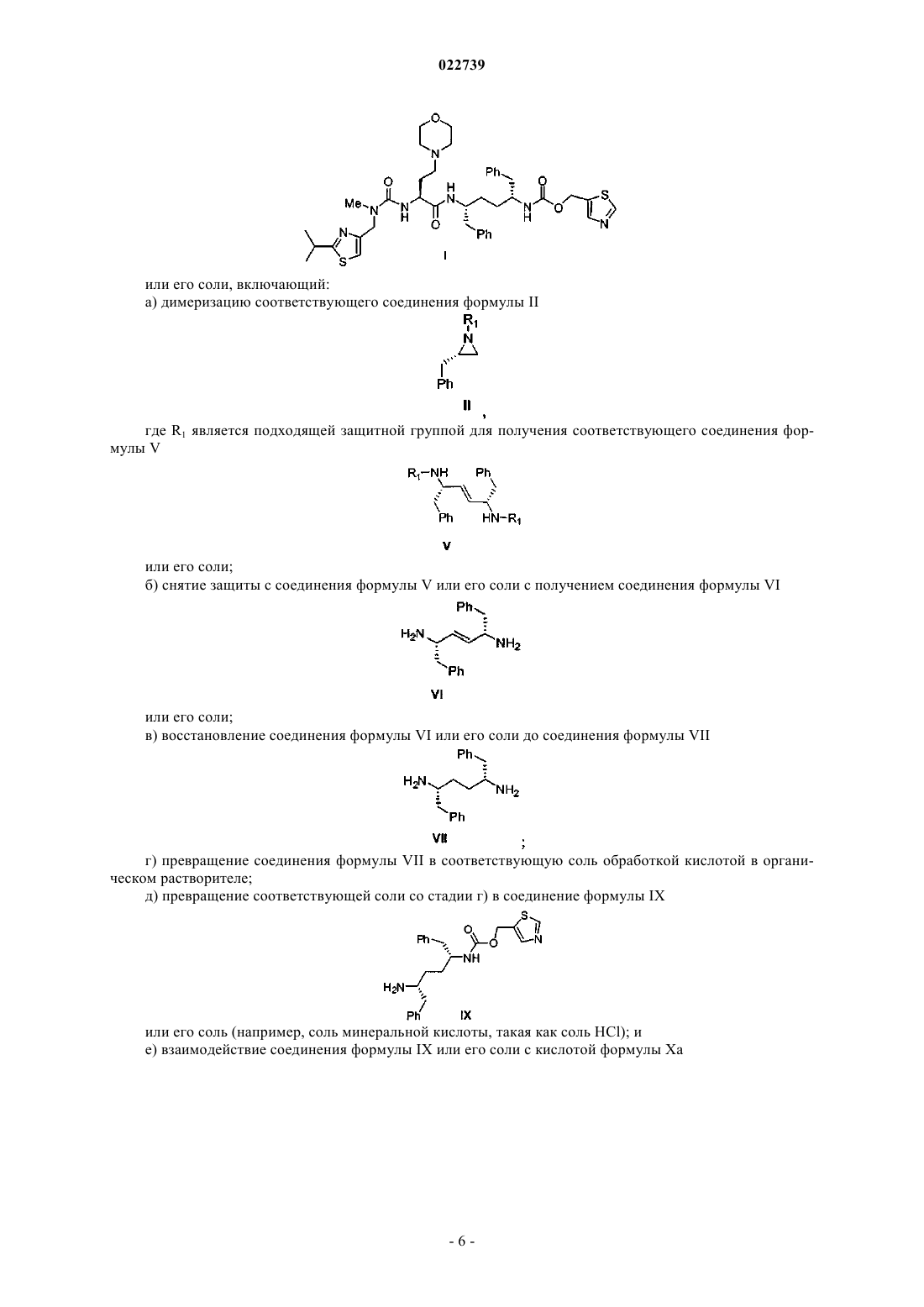
или его соли, включающий:
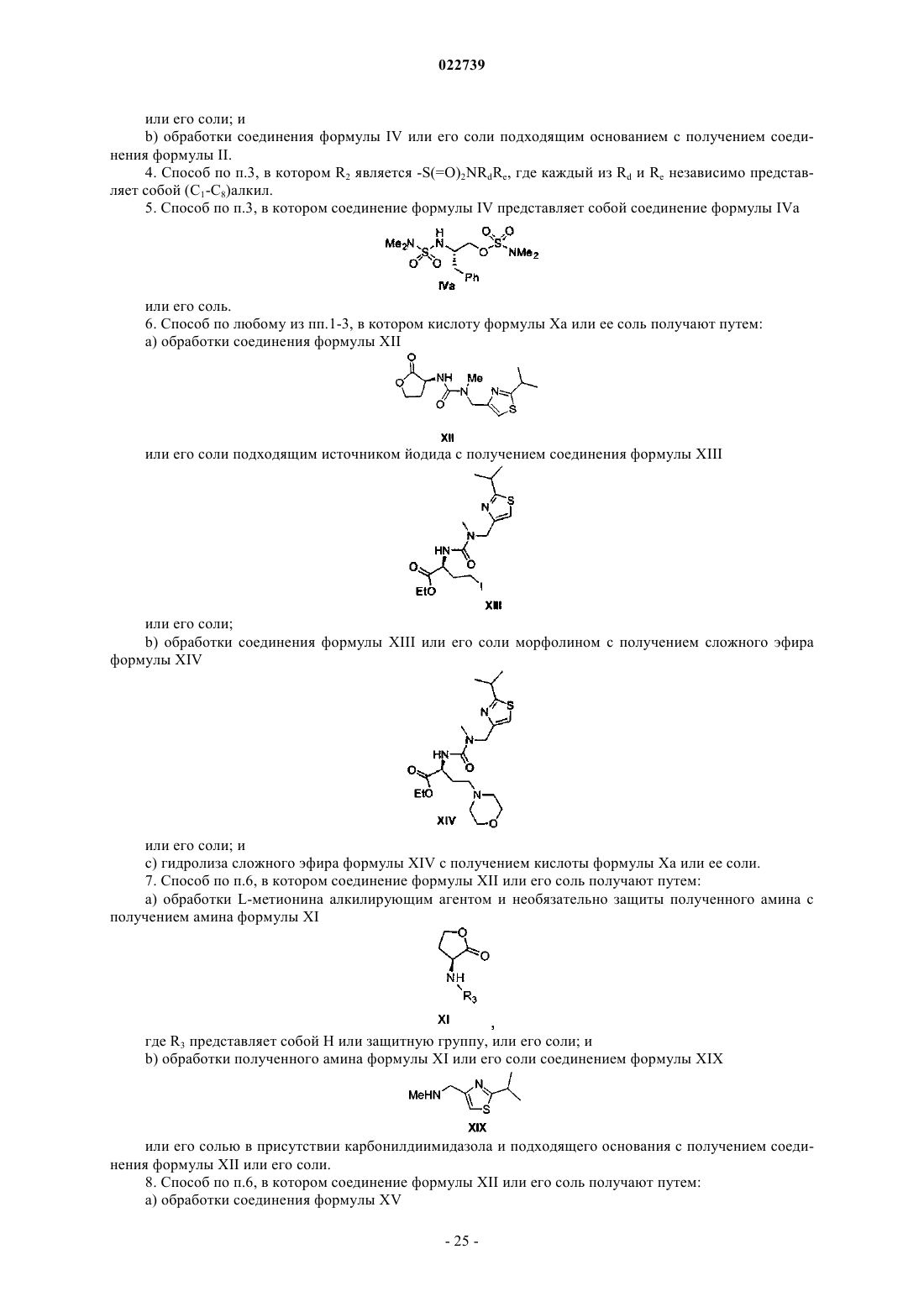
а) стадию димеризации соответствующего соединения формулы II
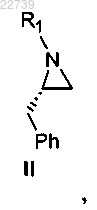
при этом R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С1-С8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, в присутствии ненуклеофильного основания с получением соответствующего соединения формулы V
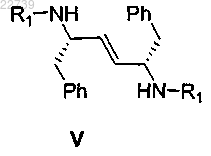
или его соли;
b) стадию снятия защиты с соединения формулы V или его соли с получением соединения формулы VI
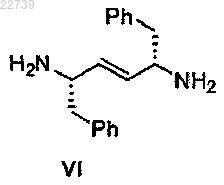
или его соли;
с) стадию каталитического восстановления соединения формулы VI или его соли с получением соединения формулы VII
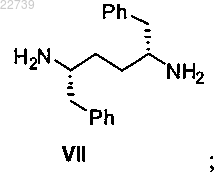
d) стадию превращения соединения формулы VII в соответствующую соль путем обработки кислотой в органическом растворителе;
e) стадию взаимодействия соответствующей соли со стадии d) с соединением формулы VIII
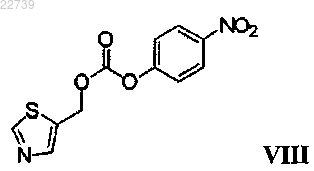
с получением соединения формулы IX
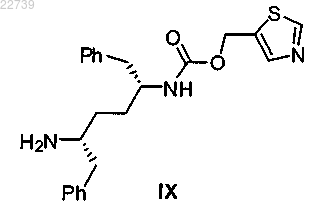
или его соли; и
f) стадию взаимодействия соединения формулы IX или его соли с кислотой формулы Ха
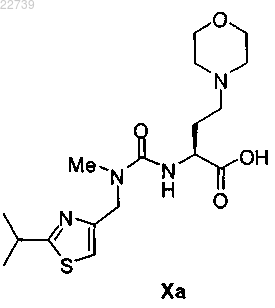
или ее солью с получением соединения формулы I.
2. Способ по п.1, в котором соединение формулы II получают путем осуществления взаимодействия (S)-2-бензилазиридина с соответствующим соединением R1-X, где X является уходящей группой и R1 является -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С1-С8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, с получением соединения формулы II.
3. Способ по п.1, в котором соединение формулы II получают путем:
а) обработки соединения формулы III
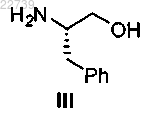
или его соли соответствующим соединением формулы R1-X и R2-X, где X является уходящей группой и R1 является -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С1-С8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, и R2 является -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой (С1-С8)алкил; или Rd и Re вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, с получением соответствующего соединения формулы IV
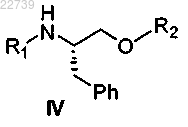
или его соли; и
b) обработки соединения формулы IV или его соли подходящим основанием с получением соединения формулы II.
4. Способ по п.3, в котором R2 является -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой (С1-С8)алкил.
5. Способ по п.3, в котором соединение формулы IV представляет собой соединение формулы IVa
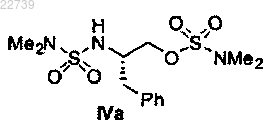
или его соль.
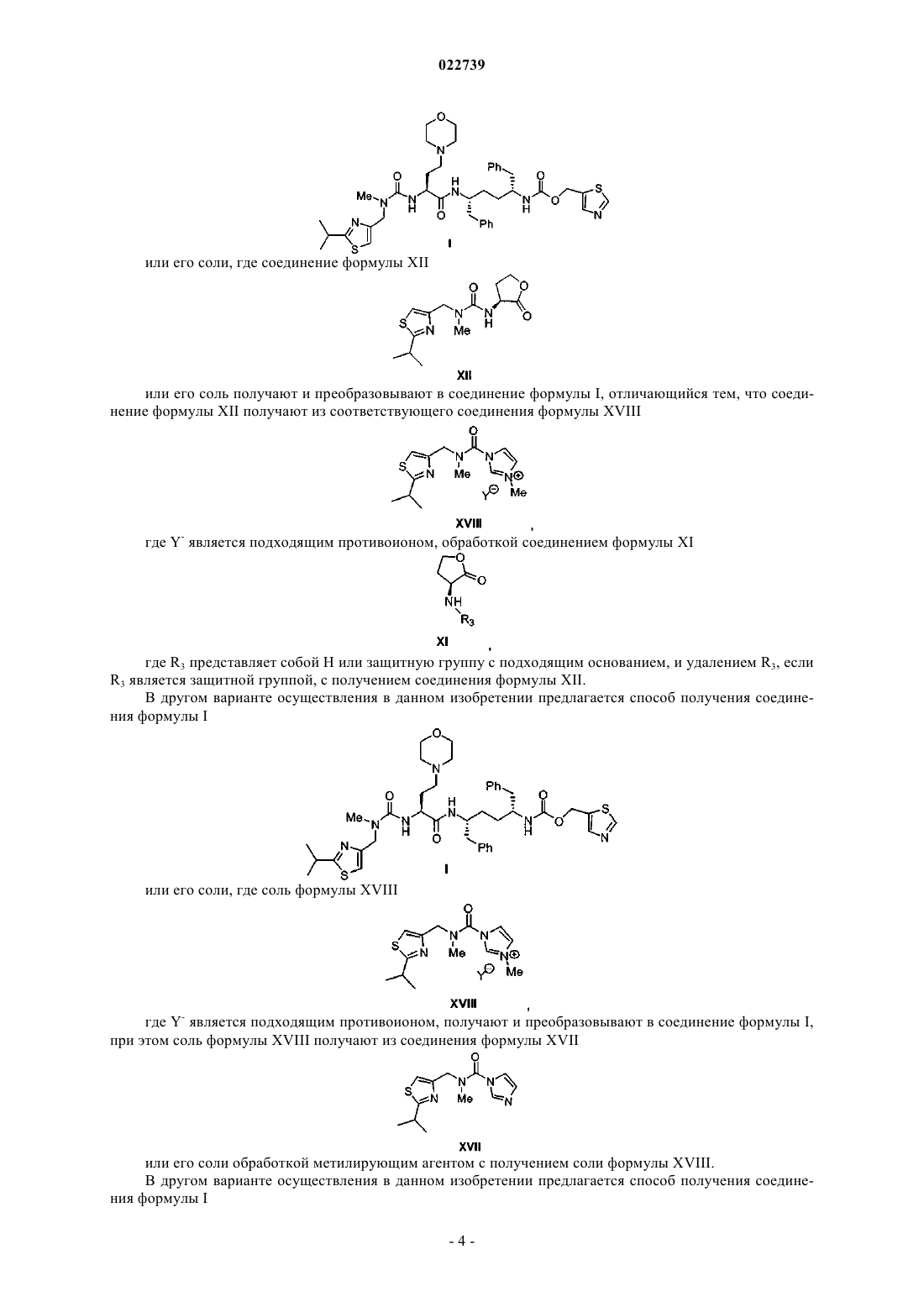
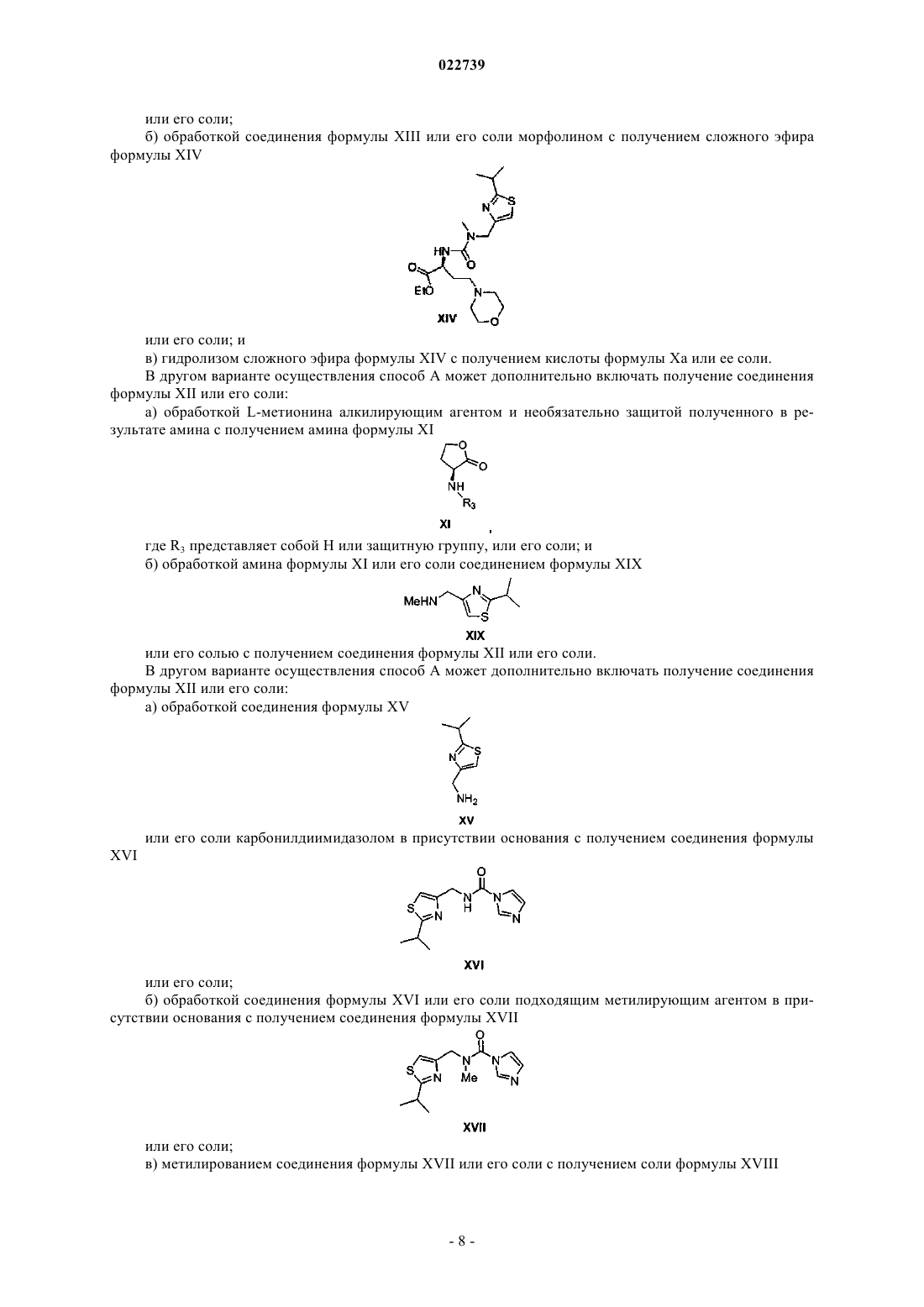
6. Способ по любому из пп.1-3, в котором кислоту формулы Xa или ее соль получают путем:
а) обработки соединения формулы XII
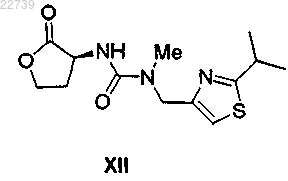
или его соли подходящим источником йодида с получением соединения формулы XIII
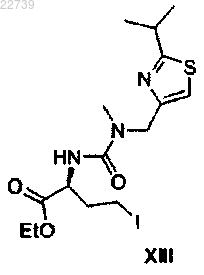
или его соли;
b) обработки соединения формулы XIII или его соли морфолином с получением сложного эфира формулы XIV
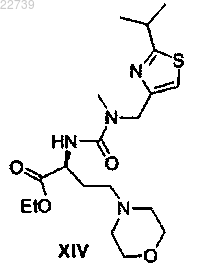
или его соли; и
с) гидролиза сложного эфира формулы XIV с получением кислоты формулы Xa или ее соли.
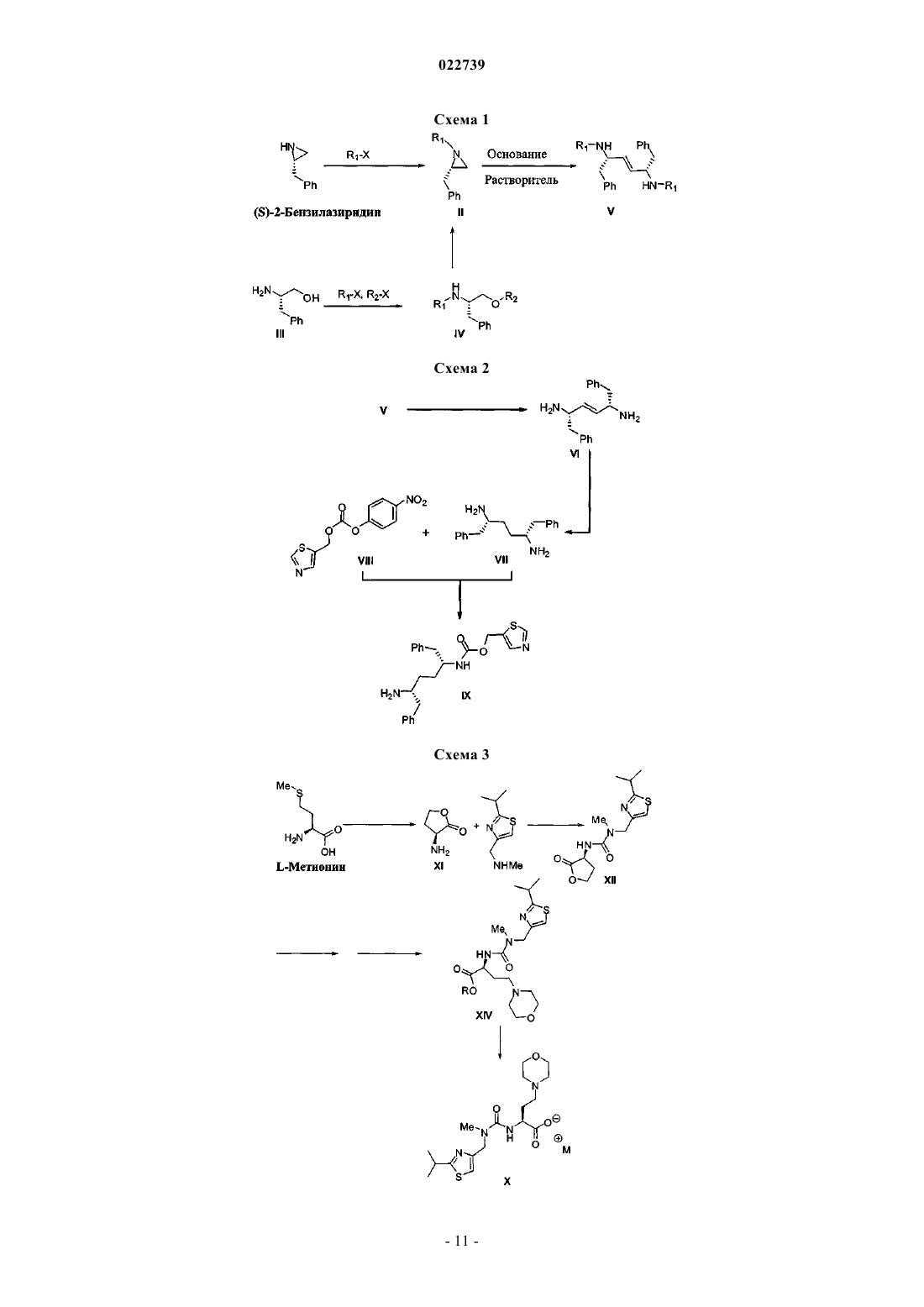
7. Способ по п.6, в котором соединение формулы XII или его соль получают путем:
а) обработки L-метионина алкилирующим агентом и необязательно защиты полученного амина с получением амина формулы XI
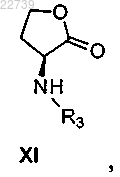
где R3 представляет собой H или защитную группу, или его соли; и
b) обработки полученного амина формулы XI или его соли соединением формулы XIX
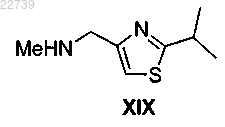
или его солью в присутствии карбонилдиимидазола и подходящего основания с получением соединения формулы XII или его соли.
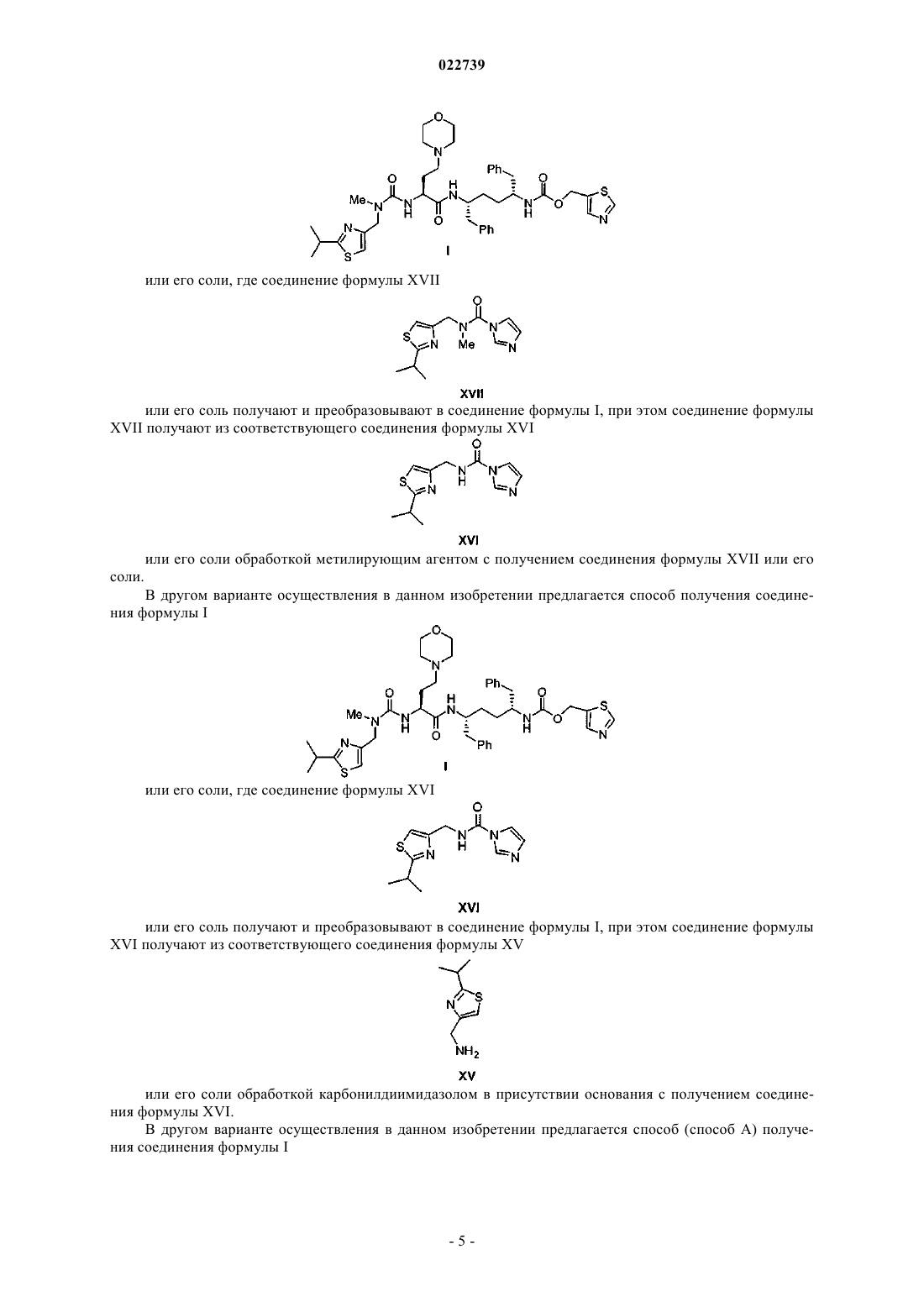
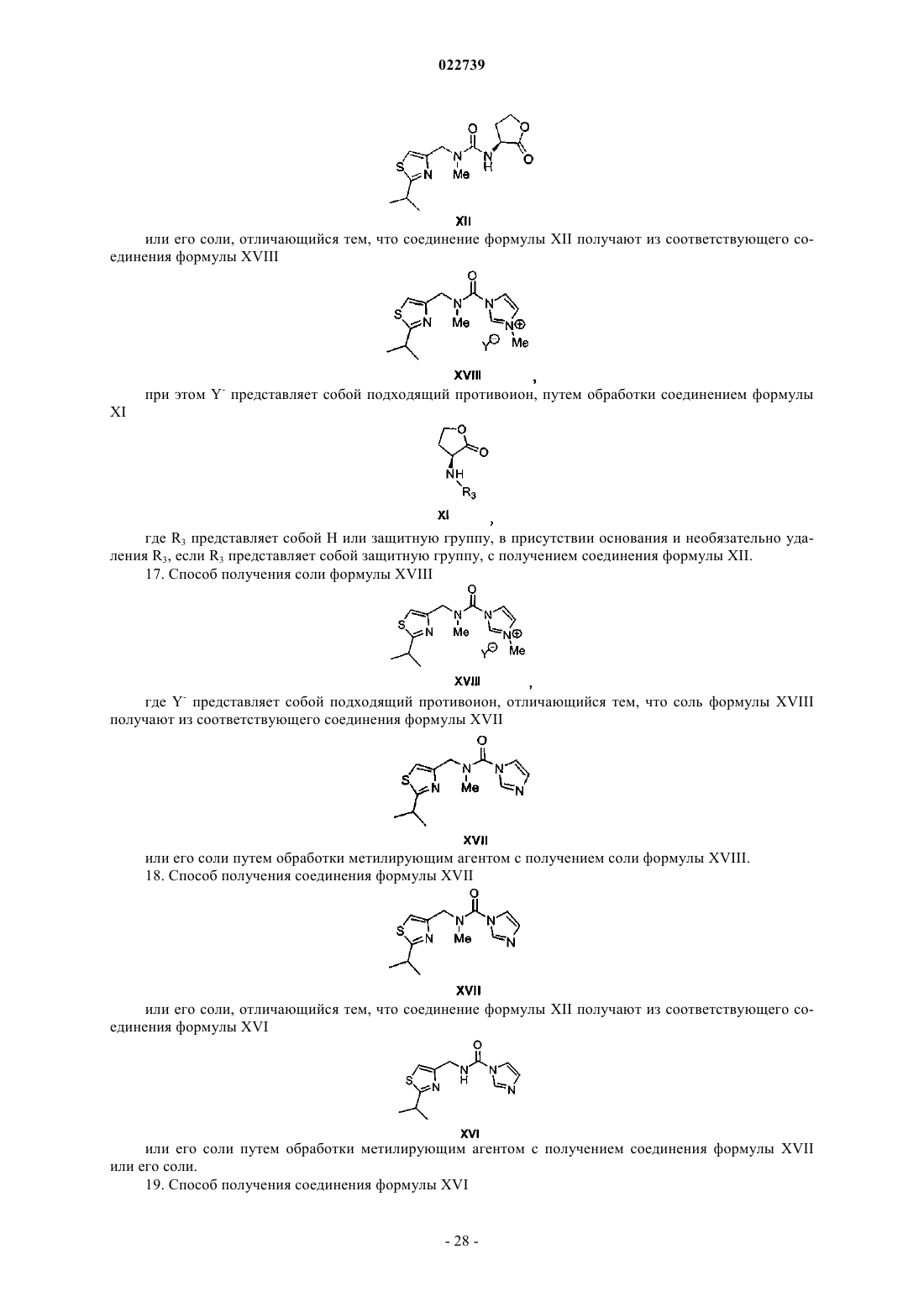
8. Способ по п.6, в котором соединение формулы XII или его соль получают путем:
а) обработки соединения формулы XV
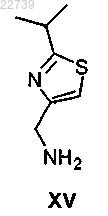
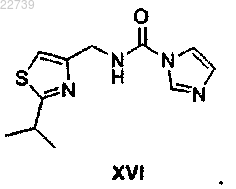
или его соли карбонилдиимидазолом в присутствии основания с получением соединения формулы XVI
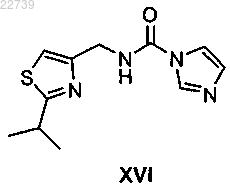
или его соли;
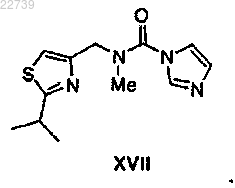
b) обработки соединения формулы XVI или его соли подходящим метилирующим агентом в присутствии основания с получением соединения формулы XVII
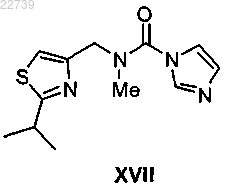
или его соли;
с) метилирования соединения формулы XVII или его соли с получением соли формулы XVIII
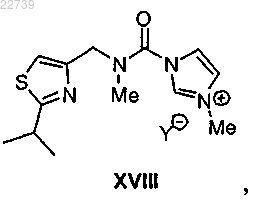
где Y- представляет собой подходящий противоион; и
d) обработки соли формулы XVIII амином формулы XI
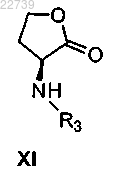
или его солью, где R3 представляет собой H или защитную группу с подходящим основанием, и снятие защиты с удалением R3, если R3 представляет собой защитную группу, с получением соединения формулы XII или его соли.
9. Способ по п.6, в котором соль соединения формулы XIV представляет собой оксалатную соль.
10. Способ по п.1, в котором указанное ненуклеофильное основание представляет собой ТМР (2,2,2,6-тетраметилпиперидин) или LTMP (литий тетраметилпиперидин).
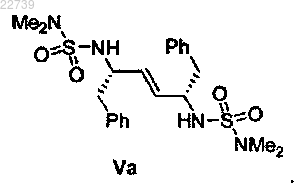
11. Способ по п.1, отличающийся тем, что соединение формулы V представляет собой соединение формулы Va
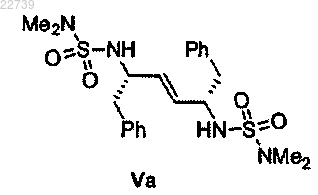
или его соль.
12. Соединение формулы IVa или его соль

13. Способ получения соединения формулы V
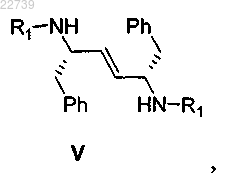
где R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С1-С8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, или его соли, отличающийся тем, что соединение формулы V получают из соответствующего соединения формулы II

или его соли путем димеризации соединения формулы II.
14. Способ получения соединения формулы IV
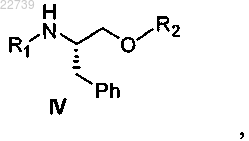
где R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С1-С8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, и R2 представляет собой -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой (С1-С8)алкил; или Rd и Re вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, отличающийся тем, что соединение формулы IV получают из соединения формулы III
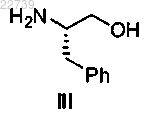
или его соли путем защиты соединения формулы III.
15. Способ получения соединения формулы XIV
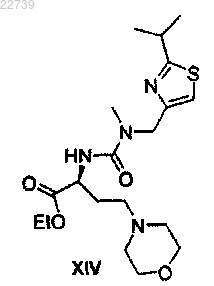
или его соли, отличающийся тем, что соединение формулы XIV или его соль получают из соответствующего соединения формулы XIII
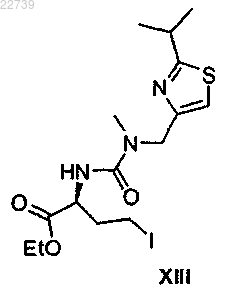
или его соли путем замещения йодида морфолином.
16. Способ получения соединения формулы XII
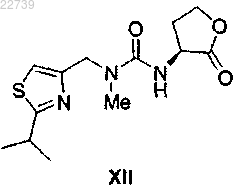
или его соли, отличающийся тем, что соединение формулы XII получают из соответствующего соединения формулы XVIII
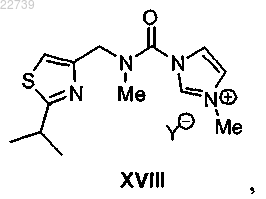
при этом Y- представляет собой подходящий противоион, путем обработки соединением формулы XI
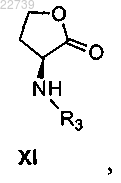
где R3 представляет собой H или защитную группу, в присутствии основания и необязательно удаления R3, если R3 представляет собой защитную группу, с получением соединения формулы XII.
17. Способ получения соли формулы XVIII
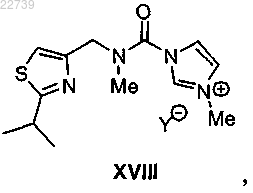
где Y- представляет собой подходящий противоион, отличающийся тем, что соль формулы XVIII получают из соответствующего соединения формулы XVII
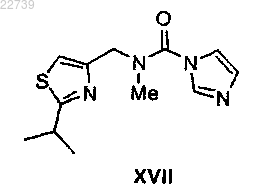
или его соли путем обработки метилирующим агентом с получением соли формулы XVIII.
18. Способ получения соединения формулы XVII
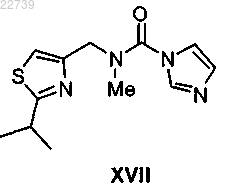
или его соли, отличающийся тем, что соединение формулы XII получают из соответствующего соединения формулы XVI
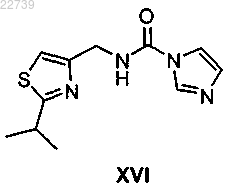
или его соли путем обработки метилирующим агентом с получением соединения формулы XVII или его соли.
19. Способ получения соединения формулы XVI
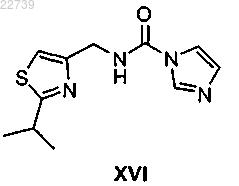
или его соли, отличающийся тем, что соединение формулы XVI получают из соответствующего соединения формулы XV
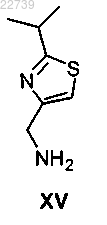
или его соли путем обработки карбонилдиимидазолом в присутствии основания с получением соединения формулы XVI.
20. Соединение формулы Va или его соль
21. Соединение формулы XIV

где указанное соединение представляет собой оксалатную соль.
22. Соединение формулы XVI или его соль
23. Соединение формулы XVII или его соль
24. Соль формулы XVIII
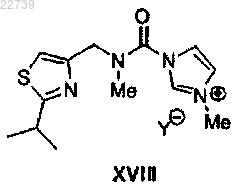
где Y- представляет собой подходящий противоион.
25. Способ получения соединения формулы I
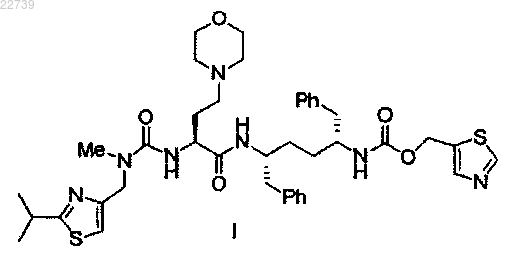
или его соли, включающий стадию сочетания соединения формулы IX
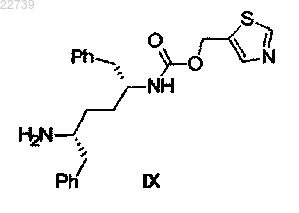
или его соли с солью формулы X
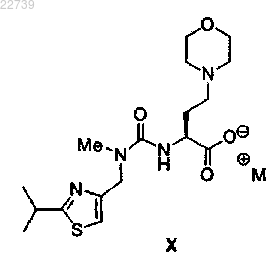
где М+ представляет собой подходящий противоион, в дихлорметане или толуоле или их смеси с получением соединения формулы I.
26. Способ по п.25, отличающийся тем, что М+ представляет собой K+.
27. Способ по п.25, отличающийся тем, что указанное сочетание проводят в дихлорметане при температуре от примерно -30 до примерно 20°C в присутствии реагента сочетания.
28. Способ по п.25, отличающийся тем, что указанный реагент сочетания представляет собой EDC HCl и HOBt или циклический ангидрид н-пропанфосфоновой кислоты.
Текст
СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА ЦИТОХРОМ P450 МОНООКСИГЕНАЗЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ПРИМЕНЯЕМЫЕ В ЭТОМ СПОСОБЕ В данном изобретении предлагаются способы и промежуточные химические соединения, которые применимы для получения соединения формулы I Уровень техники В публикации международной заявки на патент WO 2008/010921 и публикации международной заявки на патент WO 2008/103949 раскрывают определенные соединения, которые по имеющимся данным пригодны для модификации фармакокинетики совместно введенного лекарственного средства, например ингибированием цитохром P450 монооксигеназы. Одним конкретным соединением, определенным в данном описании, является соединение следующей формулы I: В настоящее время существует необходимость в улучшенных синтетических способах и промежуточных химических соединениях, которые могут использоваться для получения соединения формулы I и его солей. Также существует необходимость в улучшенных способах получения промежуточных химических соединений, которые могут использоваться для получения соединения формулы I и его солей. Улучшенные способы и промежуточные химические соединения могут снижать стоимость, время и/или количество отходов, связанных с существующими способами получения соединения формулы I и его солей. Краткое описание изобретения Был найден улучшенный синтетический путь для получения соединения формулы I и его солей. При этом улучшенном синтетическом пути применяются новые промежуточные химические соединения формулы IV, V, XIV, XVI, XVII и XVIII, определенные в данном описании ниже. Этот путь снижает стоимость, время и количество отходов, связанных с получением соединения формулы I и его солей. Соответственно, в одном варианте осуществления в данном изобретении получают соединение формулы IV где каждый R1 и R2 независимо является подходящей защитной группой; или его соль. В другом варианте осуществления в данном изобретении получают соединение формулы V где каждый R1 представляет собой подходящую защитную группу, отличную от третбутилсульфонила; или его соль. В другом варианте осуществления в данном изобретении получают соединение формулы XIV где R представляет собой (С 2-С 8)алкил; или его соль. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы V где каждый R1 является подходящей защитной группой, отличной от трет-бутилсульфонила, или его соли, включающий димеризацию соответствующего соединения формулы II с получением соединения формулы V или его соли. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы V где R1 является подходящей защитной группой; или его соль получают и преобразовывают в соединение формулы I, при этом соединение формулы V получают из соответствующего соединения формулы димеризацией соединения формулы II. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы IV где каждый R1 и R2 независимо является подходящей защитной группой, или его соль получают и преобразовывают в соединение формулы I, при этом соединение формулы IV получают из соединения формулы III или его соли защитой соединения формулы III. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы XIV или его соль получают и преобразовывают в соединение формулы I, при этом соединение формулыXIV или его соль получают из соединения формулы XIII или его соли вытеснением йодида подходящим морфолиновым реагентом. В другом варианте осуществления в данном изобретении получают соединение формулы XVI или или его соль. В другом варианте осуществления в данном изобретении получают соль формулы XVIII где Y- представляет собой подходящий противоион. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы XII или его соль получают и преобразовывают в соединение формулы I, отличающийся тем, что соединение формулы XII получают из соответствующего соединения формулы XVIII где Y- является подходящим противоионом, обработкой соединением формулы XI где R3 представляет собой H или защитную группу с подходящим основанием, и удалением R3, еслиR3 является защитной группой, с получением соединения формулы XII. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соль формулы XVIII где Y- является подходящим противоионом, получают и преобразовывают в соединение формулы I,при этом соль формулы XVIII получают из соединения формулы XVII или его соли обработкой метилирующим агентом с получением соли формулы XVIII. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы XVII или его соль получают и преобразовывают в соединение формулы I, при этом соединение формулыXVII получают из соответствующего соединения формулы XVI или его соли обработкой метилирующим агентом с получением соединения формулы XVII или его соли. В другом варианте осуществления в данном изобретении предлагается способ получения соединения формулы I или его соли, где соединение формулы XVI или его соль получают и преобразовывают в соединение формулы I, при этом соединение формулыXVI получают из соответствующего соединения формулы XV или его соли обработкой карбонилдиимидазолом в присутствии основания с получением соединения формулы XVI. В другом варианте осуществления в данном изобретении предлагается способ (способ А) получения соединения формулы I или его соли, включающий: а) димеризацию соответствующего соединения формулы II где R1 является подходящей защитной группой для получения соответствующего соединения формулы V или его соли; б) снятие защиты с соединения формулы V или его соли с получением соединения формулы VI или его соли; в) восстановление соединения формулы VI или его соли до соединения формулы VII г) превращение соединения формулы VII в соответствующую соль обработкой кислотой в органическом растворителе; д) превращение соответствующей соли со стадии г) в соединение формулы IX или его соль (например, соль минеральной кислоты, такая как соль HCl); и е) взаимодействие соединения формулы IX или его соли с кислотой формулы Ха или ее солью, где M+ является подходящим противоионом, с получением соединения формулы I. В одном конкретном варианте осуществления данного изобретения соль соединения формулы IX (например, соль HCl) можно соединить с солью формулы X с получением соединения формулы I. В другом варианте осуществления способ А может дополнительно включать получение соединения формулы II реакцией (S)-2-бензилазиридина с соответствующим соединением R1-X, где X является уходящей группой (например, Cl), с получением соединения формулы II. В другом варианте осуществления способ А может дополнительно включать получение соединения формулы II: а) защитой соединения формулы III или его соли с получением соответствующего соединения формулы IV где каждый R1 и R2 независимо представляют собой подходящую защитную группу, или его соли; и б) обработкой соединения формулы IV или его соли подходящим основанием с получением соединения формулы II. В другом варианте осуществления способ А может дополнительно включать получение соли формулы X: а) обработкой соединения формулы XII или его соли подходящим источником йодида в присутствии спирта ROH с получением соединения формулы XIII или его соли; б) обработкой соединения формулы XIII или его соли морфолином с получением сложного эфира формулы XIV или его соли; и в) гидролизом сложного эфира формулы XIV с получением кислоты формулы Xa или ее соли. В другом варианте осуществления способ А может дополнительно включать получение соединения формулы XII или его соли: а) обработкой L-метионина алкилирующим агентом и необязательно защитой полученного в результате амина с получением амина формулы XI где R3 представляет собой H или защитную группу, или его соли; и б) обработкой амина формулы XI или его соли соединением формулы XIX или его солью с получением соединения формулы XII или его соли. В другом варианте осуществления способ А может дополнительно включать получение соединения формулы XII или его соли: а) обработкой соединения формулы XV или его соли карбонилдиимидазолом в присутствии основания с получением соединения формулы или его соли; б) обработкой соединения формулы XVI или его соли подходящим метилирующим агентом в присутствии основания с получением соединения формулы XVII или его соли; в) метилированием соединения формулы XVII или его соли с получением соли формулы XVIII где Y- представляет собой подходящий противоион; и г) обработкой соли формулы XVIII амином формулы XI или его солью, где R3 представляет собой H или защитную группу с подходящим основанием, и снятием защиты для удаления R3, если R3 является защитной группой, с получением соединения формулы XII или его соли В данном изобретении также обеспечили новые синтетические промежуточные химические соединения, описанные в данном документе, а также способы получения таких промежуточных химических соединений. Подробное описание В том значении, в каком они используется в данном документе, алкил, алкокси и т.д. означает и прямые, и разветвленные группы; но ссылка на отдельный радикал, такой как пропил, включает только радикал с прямой цепью, а на изомер с разветвленной цепью, такой как изопропил, ссылается явным образом. Галоалкил означает алкильную группу, которая замещена одной или более (например, 1, 2, 3, 4 и т.д.) галогеновыми группами. Арил означает фенильный радикал или слитый в орто-положении бициклический карбоциклический радикал, имеющий приблизительно от девяти до десяти кольцевых атомов,в котором по меньшей мере одно кольцо является ароматическим. Определенные значения, изложенные ниже для радикалов, заместителей, и диапазоны присутствуют только в качестве иллюстрации; они не исключают другие определенные значения или другие значения в определенных диапазонах для радикалов и заместителей. В частности, (С 1-С 8)алкил может представлять собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, 3-пентил, гексил, гептил или октил; (C1-С 8)алкокси может представлять собой метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, пентокси, гексилокси, гептилокси или октилокси; гало(C1-С 8)алкил может представлять собой фторметил, дифторметил и трифторметил; арил(C1-С 8)алкокси может представлять собой бензилокси; и арил может представлять собой фенил, инденил или нафтил. Конкретное значение R1 представляет собой N,N-двузамещенную аминосульфонильную группу. Другое конкретное значение R1 представляет собой N,N-диалкиламиносульфонильную группу. Другое конкретное значение R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb представляет собой независимо (С 1-С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют 3- или 4-членное насыщенное кольцо или 5-, 6-или 7-членное насыщенное или частично ненасыщенное кольцо, содержащее 1 или 2 гетероатома (например, азиридин, азетидин, пиперидин, морфолин,тиоморфолин, пирролидин, гомопиперазин, гомопиперидин или пиперазин). В одном варианте осуществления данного изобретения R1 не представляет собой трет-бутилсульфонил (например, для соединения формулы V). Другое конкретное значение R1 представляет собой Другое конкретное значение R1 представляет собой -S(O)2N(CH3)2. Другое конкретное значение R1 представляет собой бензилоксикарбонил. Конкретное значение для R2 представляет собой N,N-двузамещенную аминосульфонильную группу. Другое конкретное значение R2 представляет собой N,N-диалкиламиносульфонильную группу. Другое конкретное значение R2 представляет собой -S(=O)2NRaRb, где каждый Ra и Rb независимо представляет собой (С 1-С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют 3- или 4-членное насыщенное кольцо или 5-, 6- или 7-членное насыщенное или частично ненасыщенное кольцо, содержащее 1 или 2 гетероатома (например, азиридин, азетидин, пиперидин, морфолин, тиоморфолин, пирролидин, гомопиперазин, гомопиперидин или пиперазин). Другое конкретное значение R2 представляет собой уходящую группу, такую как 4 метилфенилсульфонил, метилсульфонил, трифторметилсульфонил. Другое конкретное значение R2 представляет собой Конкретное значение R3 представляет собой H. Соединение формулы I или его соль можно получить, как проиллюстрировано на схемах 1-4 ниже. Получение соединения формулы IV Соединение формулы III можно защитить любыми подходящими защитными группами (R1 и R2,которые могут быть одинаковыми или отличаться) при стандартных условиях для получения соответствующего соединения формулы IV. Например, реакцию(и) можно проводить в подходящем растворителе в присутствии основания. Подходящие растворители включают апротонные растворители, такие как дихлорметан, тетрагидрофуран и 2-метилтетрагидрофуран, а также другие апротонные органические растворители и их смеси. Подходящие основания включают триалкиламины, такие как триэтиламин, диизопропилэтиламин и N-метилморфолин, а также гидридные основания, такие как гидрид натрия. Реакцию можно подходящим образом проводить при температуре приблизительно -20-40C. Подходящие защитные группы включают трет-бутилсульфонильную (Bus) группу, Nдиалкилсульфамоильные группы,такие какN,N-диизопропилсульфамоильные,Nазиридинилсульфамоильные и другие сульфамоильные группы, содержащие N-гетероцикл (такой как пирролидин или пиперидин), а также N-этил- и N-метилсульфамоильные группы и другие смешанные Nалкилсульфамоильные группы. Получение соединения формулы II Соединение формулы II можно получить из соединения формулы IV обработкой основанием в подходящем растворителе. Подходящие основания включают гидриды металлов, такие как гидрид натрия и гидрид калия; лития 2,2,6,6-тетраметилпиперидид; алкоксиды, такие как натрия трет-бутоксид или лития трет-бутоксид, гексаметилдисилазиды, такие как лития гексаметилдисилазид, и карбонатные основания,такие как карбонат калия или карбонат цезия. Подходящие растворители включают апротонные растворители, такие как дихлорметан, тетрагидрофуран и 2-метилтетрагидрофуран, а также другие апротонные органические растворители и их смеси. Реакцию можно подходящим образом проводить при температуре приблизительно 0-22C. Подходящие R1 группы включают трет-бутилсульфонильную (Bus) группу, N,Nдиалкилсульфамоильные группы,такие какN,N-диизопропилсульфамоильная,Nазиридинилсульфамоильная и другие сульфамоильные группы, содержащие N-гетероцикл (такой как пирролидин или пиперидин), а также N-этил- и N-метилсульфамоильные группы и другие смешанные Nалкилсульфамоильные группы. Полученное в результате соединение формулы II можно очистить с помощью перекристаллизации из подходящего растворителя или смеси растворителей. Например, могут использоваться комбинации эфирного и неполярного растворителей, таких как изопропиловый эфир/гептан, а также кристаллизация из концентрированных растворов чистых эфирных растворителей, таких как трет-бутилметиловый эфир. Альтернативное получение соединения формулы II Исходный азиридин можно защитить любой подходящей защитной группой (R1), например, обработкой соединением R1-X, где X представляет собой уходящую группу, при стандартных условиях для получения соответствующего соединения формулы II. Например, реакцию можно проводить в подходящем растворителе в присутствии основания. Подходящие растворители включают апротонные раствори- 12022739 тели, такие как дихлорметан, тетрагидрофуран, этиловый эфир, трет-бутилметиловый эфир, тетрагидропиран, 1,4-диоксан, 1,2-дихлорэтан и их смеси. Подходящие основания включают триалкиламины, такие как триэтиламин, N-метилморфолин, хинуклидин, N-метилпиперидин, N,N-диизопропилэтиламин и Nметилпирролидин; а также другие слабые, ненуклеофильные основания, такие как карбонат калия и бикарбонат натрия. Реакцию можно подходящим образом проводить при температуре приблизительно -10-40C. Полученное в результате соединение формулы II можно очистить перекристаллизацией из подходящего растворителя или смеси растворителей. Например, могут использоваться комбинации эфирного и неполярного растворителей, таких как этиловый эфир, н-бутиловый эфир, тетрагидрофуран, тетрагидропиран, 1,2-диметоксиэтан, гексаны, трет-бутилметиловый эфир, гептан, пентан, циклогексан, толуол. Получение соединения формулы V Исходный азиридин можно димеризовать обработкой ненуклеофильным амидным основанием в подходящем растворителе. Подходящие растворители включают эфиры, такие как этиловый эфир, третбутилметиловый эфир, н-бутиловый эфир, тетрагидропиран и тетрагидрофуран, а также углеводороды,такие как гексаны и гептан и их смеси. Подходящее ненуклеофильное амидное основание включает лития диизопропиламид, лития 2,2,6,6-тетраметилпиперидид, лития гексаметилдисилазид, натрия гексаметилдисилазид, калия гексаметилдисилазид, лития ди-трет-бутиламид и лития изопропилциклогексиламид. Реакцию можно подходящим образом проводить при температуре приблизительно -78-22C. Полученное в результате соединение формулы V можно очистить перекристаллизацией из подходящего растворителя или смеси растворителей. Например, могут использоваться комбинации эфирного и неполярного растворителей, таких как этиловый эфир, н-бутиловый эфир, тетрагидрофуран, тетрагидропиран, 1,2-диметоксиэтан и трет-бутилметиловый эфир. Получение соединения формулы VI С исходного соединения формулы V можно снять защиту при стандартных условиях с получением соответствующего соединения формулы VI. Реакцию можно проводить в растворителе, который содержит амин; например, моноамин, такой как этаноламин, диамин, такой как 1,3-диаминопропан, этилендиамин, 1,2-диаминоциклогексан, 1,2-фенилендиамин, путрисцин или кадаверин, или полиамин, такой как диэтилентриамин, триэтилентриамин или полиэтиленимин. Растворитель может также содержать толуол, анизол или подобное, или их смеси. Реакцию можно подходящим образом проводить при температуре приблизительно 100-140C. Гидрирование с получением соединения формулы VII Исходный алкен VI можно гидрировать при стандартных условиях. Например, гидрирование можно проводить с применением металла, содержащего катализатор в спиртовом растворителе. Подходящие растворители включают метанол, этанол, изопропанол, н-пропанол, бутанол, этилацетат, толуол, диоксан и анизол и их смеси. Подходящие катализаторы включают палладий на углероде, платину на углероде,никель Ренея, катализатор Вилкинсона и палладия гидроксид. Реакцию можно подходящим образом проводить при давлении приблизительно от давления окружающей среды до 60 ф/кв.д. Соединение формулы VII можно подходящим образом выделить обработкой кислотой в органическом растворителе с получением соответствующей соли. Подходящие кислоты включают хлористоводородную кислоту, бромисто-водородную кислоту, йодисто-водородную кислоту и серную кислоту. Подходящие растворители включают дихлорметан, этиловый эфир, тетрагидрофуран, третбутилметиловый эфир, 1,4-диоксан, 1,2-диметоксиэтан, хлороформ, 1,2-дихлорэтан, толуол и анизол и их смеси. Преобразование в соль можно подходящим образом проводить при температуре приблизительно Получение соединения формулы VIII Смешанный карбонат формулы VIII можно получить обработкой 5-гидроксиметилтиазола подходящим карбонатом или эквивалентом карбоната, имеющего уходящую группу, примыкающую к карбонильному углероду, такому как фосген в присутствии основания. Например, подходящие карбонаты включают бис-(4-нитрофенил)карбонат и дисукцинимидилкарбонат. Реакцию можно подходящим образом проводить в подходящем апротонном органическом растворителе, таком как дихлорметан, тетрагидрофуран, 1,2-дихлорэтан или диэтиловый эфир или их смеси. Подходящие основания включают основания триалкиламина, такие как диизопропилэтиламин, N-метилморфолин и триэтиламин. Получение соединения формулы IX или его соли Соединение формулы IX или его соль можно получить из соединения формулы VII или его соли обработкой карбонатом формулы VIII или его соли в присутствии подходящего основания в подходящем растворителе. Подходящие основания включают карбонатные основания (например, карбонат калия) и триалкиламины (например, диизопропилэтиламин или N-метилморфолин). Подходящие растворители включают растворители, такие как дихлорметан, тетрагидрофуран, 1,2-дихлорэтан, изопропилацетат и диэтиловый эфир и их смеси. Получение соединения формулы XI Соединение формулы XI, где R3 представляет собой Н, или его соль можно получить обработкой Lметионина алкилирующим агентом в присутствии воды и уксусной кислоты. Подходящие алкилирующие агенты включают алкилбромиды (бромуксусная кислота), алкилйодиды, алкилхлориды и диметилсульфат. Реакцию можно подходящим образом проводить в растворителе, который содержит спирт (например, изопропанол), воду и уксусную кислоту. Реакцию можно подходящим образом проводить при температуре приблизительно 22-90C. Соединение формулы XI, где R3 представляет собой защитную группу (например, карбаматную, амидную или бензильную защитную группу), или его соль можно получить защитой соответствующего соединения формулы XI, где R3 представляет собой водород, с получением соединения формулы XI, где R3 является защитной группой, или его соли. Получение соединения формулы XII Соединение формулы XII можно получить обработкой соединения формулы XI, где R3 представляет собой H или защитную группу (например, карбаматную, амидную или бензильную защитную группу),или его соли соединением формулы XIX или его солью в апротонном растворителе при температуре приблизительно 0-30C в присутствии подходящего основания и источника карбонила, такого как CDI. Когда R3 является защитной группой, R3 можно впоследствии удалить с получением соединения формулы XII или его соли. Подходящие основания включают гидриды металлов (например, гидрид натрия) и триалкиламины (например, диизопропилэтиламин, триэтиламин, N-метилморфолин или DBU). Подходящие апротонные растворители включают тетрагидрофуран, 2-метилтетрагидрофуран и дихлорметан и их смеси. Получение соединения формулы XIII Соединение формулы XIII можно получить обработкой соединения формулы XII или его соли подходящим источником йодида (например, триметилсилил йодид, йодид водорода или йодид натрия и триметилсилил хлорид) в апротонном растворителе в присутствии спирта ROH с получением соединения формулы XIII, где R представляет собой этил. Подходящие апротонные растворители включают тетрагидрофуран, 2-метилтетрагидрофуран, дихлорметан и ацетонитрил и их смеси. Реакцию можно, как правило, проводить при температуре приблизительно 0-22C. Получение соединения формулы XIV или его соли Соединение формулы XIV или его соль можно получить обработкой соединения формулы XIII, гдеR представляет собой этил, морфолином с получением соединения формулы XIV или его соли. Полученное в результате соединение формулы XIV можно преобразовать в соответствующую соль обработкой кислотой (например, органической кислотой, такой как щавелевая кислота, лимонная кислота или фумаровая кислота, или минеральной кислотой) в органическом растворителе. Подходящие растворители включают трет-бутилметиловый эфир, метиленхлорид, тетрагидрофуран, ацетон, ацетонитрил, толуол,гептаны, изопропил ацетат, этилацетат и спирты и их смеси. Образование соли можно типично проводить при температуре приблизительно 22-60C. Получение соединения формулы X Соединение формулы X, где М+ представляет собой противоион, или его соль, можно получить гидролизом сложного эфира формулы XIV, где R представляет собой этил, или его соли при стандартных условиях. Например, гидролиз можно проводить в водном растворителе (например, вода и дихлорметан) в присутствии основания (например, гидроксид калия или гидроксид лития) при температуре приблизительно -10-28C. Получение соединения формулы I Соединение формулы I или его соль можно получить сочетанием кислой соли формулы X, где M+ представляет собой противоион, с амином формулы IX с образованием соответствующего амида. Эту реакцию образования амида можно проводить при стандартных условиях. Например, ее можно проводить в подходящем органическом растворителе (например, дихлорметан) в присутствии подходящего реагента сочетания (например, EDCHCl и HOBt). Другие подходящие амидные реагенты и условия для сочетания известны в данной области. Реакцию можно, как правило, проводить при температуре приблизительно -30-20C. Когда реакцию проводят в дихлорметане или толуоле или их смеси, эта реакция сочетания неожиданно обеспечивает улучшенные результаты по сравнению с соединением в тетрагидрофуране, что описано на с. 254 публикации международной заявки на патент WO 2008/103949. Соответственно, в одном варианте осуществления в данном изобретении предлагается способ получения соединения формулы I,включающий сочетание кислой соли формулы X с амином формулы IX или его соли в дихлорметане или толуоле или их смеси. Эту реакцию можно подходящим образом проводить в присутствии реагента сочетания (например, EDCHCl и HOBt) при температуре приблизительно -30-20C. Полученное в результате соединение формулы I можно выделить, применяя стандартные способы. Соединение формулы I можно выделить, используя твердый материал подложки, как описано в публикации международной заявки на патент WO 2009/135179. Альтернативное получение соединения формулы I Соединение формулы I или его соль можно получить сочетанием кислоты формулы Xa или его соли с амином формулы IX или его солью с образованием соответствующего амида. Эту реакцию образования амида можно проводить при стандартных условиях. Например, ее можно проводить в подходящем органическом растворителе (например, дихлорметан) в присутствии подходящего реагента сочетания(например, EDCHCl и HOBt). Другие подходящие амидные реагенты и условия для сочетания известны в данной области техники. Реакцию можно, как правило, проводить при температуре приблизительно-30-20C. Альтернативное получение соединения формулы XII. Соединение формулы XII, показанное на схеме III выше, можно также получить, как показано на схеме V. Схема V Получение соединения формулы XII. Амин формулы XV или его соль можно обработать карбонилдиимидазолом в присутствии подходящего основания (например, триалкиламина, такого как триэтиламин, N-метилморфолин, диизопропилэтиламин или DBU; гидридного основания, такого как гидрид натрия; или амидного основания, такого как LiHMDS) в апротонном растворителе (например, тетрагидрофуран или 2-метилтетрагидрофуран) с получением мочевины формулы XVI. Алкилирование мочевины формулы XVI подходящим метилирующим средством (например, метилйодид) в присутствии основания в апротонном растворителе обеспечивает соединение формулы XVII. Дополнительное алкилирование подходящим метилирующим средством (например, метилйодид) обеспечивает соль формулы XVIII. Обработка соли формулы XVIII Nнезащищенным амино -лактоном формулы XI или соответствующим N-защищенным амино -лактоном(например, карбамат, амид или бензиламин) в подходящем апротонном растворителе (например, тетра- 16022739 гидрофуран или 2-метилтетрагидрофуран) в присутствии подходящего основания (например, триалкиламин, такой как триэтиламин, N-метилморфолин, диизопропилэтиламин или DBU) обеспечивает соединение формулы XII. Если N-защищенный амино -лактон применяли на ранее описанном этапе (т.е. R3 представляет собой защитную группу), с полученного в результате защищенного продукта можно снять защиту с получением соединения формулы XII. Данное изобретение будет показано в следующих неограничивающих примерах. Пример 1. Получение защищенного(L)-фенилаланинола IVaL-фенилаланинол III (5,0 г) растворили в дихлорметане (150 мл). Полученный в результате раствор охладили до 0C, диизопропилэтиламин (21,4 г) загрузили в реакционную смесь, а затем N,Nдиметилсульфамоилхлорид (10 г). Реакцию нагрели до комнатной температуры и перемешивали. Через 20 ч реакцию погасили насыщенным водным хлоридом аммония (100 мл) и водой (50 мл). Затем слои разделили и органическую фазу промыли 1 М HCl (210 объемов) и водой (250 мл). Затем органику высушили над сульфатом натрия. Твердые частицы отфильтровали и жидкости концентрировали в вакууме с выходом 97% соединения IVa в виде желто-оранжевого масла. Затем соединение Iva, как правило, применяли без дополнительной очистки. 1 Н ЯМР (CDCl3):7,26 (m, 5H), 4,94 (d, 1 Н, J=8 Гц), 3,75 (m, 1H), 3,57 (m, 2H), 2,94 (s, 6H), 2,85 (m,2H), 2,54 (s, 6H). Пример 2. Получение (S)-2-бензил-N,N-диметилазиридин-1-сульфонамида IIa Защищенный аминоспирт IVa (10 г) растворили в 2-MeTHF (300 мл). Полученный в результате раствор охладили до 0C. Затем порционно загрузили гидрид натрия (2,0 г). Затем реакцию нагрели до комнатной температуры и перемешивали. Через 4,5 ч реакцию охладили до 0C и погасили насыщенным водным раствором хлорида аммония (150 мл) и водой (100 мл). Слои разделили и органический слой промыли 1 М HCl (150 мл), затем насыщенным водным NaCl (150 мл). Органику высушили над сульфатом натрия. Твердые частицы отфильтровали и фильтрат концентрировали. Дополнительную очистку можно завершить или колоночной хроматографией с элюированием 100% дихлорметаном, или перекристаллизацией из МТВЕ/гексанов, с получением в конечном итоге 64% соединения IIa в виде белого твердого вещества. 1 Н ЯМР (CDCl3):7,30 (m, 5H), 2,94 (dd, 1 Н, J=14, 5 Гц), 2,83 (m, 1H), 2,71 (dd, 1H, J=14, 7 Гц), 2,66 К охлажденному (-10C) раствору (S)-2-бензилазиридина (100 г, 0,751 моль) и N,Nдиметилсульфамоилхлорида (84,5 мл, 0,787 моль) в дихлорметане (100 мл) добавили N,Nдиизопропилэтиламин (131 мл, 0,751 моль). Полученный в результате желтый раствор перемешивали при -10C минимум 16 ч. После этого периода времени добавили 0,5 М раствора лимонной кислоты (500 мл) и фазы разделили. Органическую фазу затем промыли 1,0 М раствором бикарбоната натрия (500 мл). Затем в органической фазе растворитель заменили на трет-бутилметиловый эфир (500 мл). Раствор затем охладили до 0C и гептан (100 мл) добавляли по каплям за период времени 2 ч. Смесь затем выдерживали дополнительно 2 ч при 0C, а затем охладили (-10C) для осаждения соединения IIa в виде белого кристаллического твердого вещества (27,8 г, 77%). ТСХ анализ: Rf: 0,53 (SiO2; 1:1 гептанэтилацетат,KMnO4). Н ЯМР (400 МГц, CDCl3):7,20-7,29 (m, 5H), 2,94 (dd, J=14, 5 Гц, 1H), 2,80-2,88 (m, 1H), 2,70 (dd,J=14, 7 Гц, 1H), 2,66 (s, 6H), 2,56 (d, J=7 Гц, 1H), 2,14 (d, J=4 Гц, 1 Н). 13 С ЯМР (100 МГц, CDCl3):137,4, 129,3, 128,9, 127,2, 40,6, 38,3, 38,1, 33,0. Пример 4. Получение защищенного диамина Va К охлажденному (0C) раствору 2,2,6,6-тетраметилпиперидина (5,5 мл) в тетрагидрофуране (14 мл) добавили н-бутиллития (10 М в гексанах, 3,1 мл). Полученный в результате мутный желтый раствор нагрели до 22C и перемешивали при такой температуре 20 мин. К охлажденному (-10C) мутному раствору IIa (5,0 г) в тетрагидрофуране (7 мл) добавили заранее полученный тетраметилпиперидид лития (LTMP) по каплям при помощи шприцевого насоса (скорость добавления: 40 мл/ч, LTMP температура: 22C). Во время добавления реакция постепенно превращается в багрово-коричневый раствор. Реакцию затем медленно нагрели до 0C за 45 мин. 10% (вес./об.) раствор лимонной кислоты (15 мл) затем добавили к холодной реакции, и полученный в результате ярко-желтый раствор энергично перемешивали при 0C несколько минут. Двухфазную смесь затем разбавили этилацетатом (75 мл) и фазы разделили. Органическую фазу промыли 10% (вес./об.) лимонной кислотой(115 мл), насыщенным бикарбонатом натрия (215 мл) и солевым раствором (115 мл). Органическую фазу впоследствии высушили над сульфатом натрия, отфильтровали и концентрировали при сниженном давлении с получением ярко-желтого твердого вещества. Сырую смесь суспендировали в горячем третбутилметиловом эфире, охладили до -16C и отфильтровали с получением Va в виде белого порошка(3,2 г, 64%). ТСХ анализ: Rf: 0,32 (SiO2, 1:1 гептан:этилацетат, KMnO4). 1 Н ЯМР (400 МГц, CDCl3):7,10-7,35 (m, 10H), 5,59 (s, 2H), 3,95-4,10 (m, 4H), 2,80 (ddd, J=22, 13,6 Гц, 4H), 2,59 (s, 12H). 13 С ЯМР (100 МГц, CDCl3):136,7, 132,0, 129,9, 128,9, 127,2, 57,0, 42,4, 38,1. Пример 5. Альтернативное получение защищенного диамина Va К охлажденной (-10C) взвеси IIa (10,0 г) и 2,2,6,6-тетраметилпиперидина (2,1 мл) в 1:3 тетрагидрофуране:гептане (30 мл) медленно добавили н-бутиллитий (2,6 М в гексанах, 19 мл) в течение 3 ч. Во время добавления реакция постепенно превращается в багрово-коричневый раствор; после завершения полученную в результате смесь перемешивали при этой температуре дополнительно 20 мин. Ледяную уксусную кислоту (4,0 мл) затем добавили к холодной реакции и полученную в результате ярко-желтую суспензию энергично перемешивали при 5C в течение нескольких минут. Смесь затем фильтровали и твердое вещество промыли 3:1 трет-бутилметиловым эфиром:гептаном (230 мл), водой(330 мл) и снова 3:1 трет-бутилметиловым эфиром:гептаном (230 мл). Отфильтрованный осадок затем тщательно высушили с получением Va в виде белого порошка (7,22 г, 72%). ТСХ анализ: Rf: 0,32 (SiO2,1:1 гептан:этилацетат, KMnO4). 1 Н ЯМР (400 МГц, CDCl3):7,10-7,35 (m, 10H), 5,59 (s, 2H), 3,95-4,10 (m, 4H), 2,80 (ddd, J=22, 13, 6 Гц, 4H), 2,59 (s, 12H). 13 С ЯМР (100 МГц, CDCl3):136,7, 132,0, 129,9, 128,9, 127,2, 57,0, 42,4, 38,1. Пример 6. Получение ненасыщенного диамина VI Раствор защищенного диамина Va (2,0 г) в 1,3-диаминопропане (4 мл) нагрели до 110C и перемешивали при такой температуре в течение 90 мин. После охлаждения желтого раствора до 22C добавили воду (16 мл), а затем дихлорметан (20 мл). Фазы разделили и водную фазу промыли дополнительной частью дихлорметана (110 мл). Объединенные органические фазы высушили над сульфатом натрия, отфильтровали и концентрировали при сниженном давлении с получением VI густого желтого масла (1,1 г,100%). Этот материал применяли прямо в следующей реакции без дополнительной очистки. ТСХ анализ: К раствору ненасыщенного диамина VI (1,1 г) в метаноле (8,2 мл) добавили 10% палладия на углероде (110 мг, 10 вес.%). Полученную в результате черную суспензию продули газом водородом и удерживали в атмосфере водорода (баллон) 16 ч. Реакцию затем отфильтровали через целит и концентрировали при сниженном давлении с получением VII густого желтого масла (1,11 г, 100%). Этот материал перенесли в следующую реакцию без дополнительной очистки. ТСХ анализ: Rf: 0,60 (SiO2, 4:1 К охлажденному (0C) раствору VII (1,11 г) в дихлорметане (14 мл) добавили раствор 4 М хлористо-водородной кислоты в диоксане (2,6 мл). Полученную бледно-розовую суспензию нагрели до 22C и перемешивали при этой температуре 90 мин. Смесь затем отфильтровали; осадок промыли обильным количеством дихлорметана и высушили в вакууме с получением VIIa в виде бледно-розового порошка 5-Гидроксиметилтиазол (5 кг) растворили в дихлорметане (210 кг). К этому раствору добавили бис(4-нитрофенил)карбонат (15 кг) и триэтиламин (7,5 кг). Реакционную смесь перемешивали всю ночь. После окончания реакции реакционную смесь промыли 1,0 М водным раствором K2CO3 (50 кг) для полного удаления 4-нитрофенола. Органический слой затем промыли 1,0 М водной лимонной кислотой, пока pH органического раствора не стал менее 8. Органический слой высушили над Na2SO4. Затем твердые вещества отфильтровали и в органическом слое растворитель заменили на изопропилацетат и концентрировали до объема приблизительно 4 объемов. К этому раствору медленно добавили н-гептан (100 л) и выдержали 5 или более часов. Это дало VIII в виде твердого вещества, которое впоследствии можно выделить при помощи фильтрации. 1 Н ЯМР (CDCl3):8,89 (s, 1H), 8,26 (d, 2H), 7,99 (s, 1H), 7,37 (d, 2H), 5,51 (s, 2H). Пример 10a. Получение монокарбамата гидрохлорида IXa. Диамин дигидрохлорид VIIa (2,37 кг), водный карбонат калия (1 М, 27 кг) и дихлорметан (68 кг) перемешивали в течение 1 ч при 20C. Слой дихлорметана отделили, высушили над сульфатом натрия (7,1 кг) и отфильтровали с получением диаминового свободного основания. В этот раствор загрузили дополнительный дихлорметан (66 кг) и смешанный карбонат VIII (1,95 кг). Как только все твердые вещества растворились, добавили диизопропилэтиламин (1,1 кг, 8,3 моль) и реакцию наблюдали при помощи ТСХ анализа (SiO2, 80% этилдихлорметан в метаноле как элюент, продукт Rf: = 0,73, визуальное отображение при помощи УФ). Содержимое реакции промыли 0,25N водным NaOH, пока присутствие остаточныхVIII и 4-нитрофенола не определялось ТСХ анализом. Органический слой промыли водой, высушили над сульфатом натрия (7 кг), отфильтровали, концентрировали и растворили в изопропилацетате (приблизительно 50 л) и разбавили дихлорметаном (47 кг). В этот раствор загрузили HCl (1,88 кг 4N HCl в диоксане, приблизительно 8,2 моль HCl), чтобы вызвать осаждение. Продукт IXa отфильтровали, промыли изопропилацетатом (21 кг) и высушили под вакуумом с получением белого порошка (2,57 кг, 83% выход). 1 Н ЯМР (CD3OD):9,0 (s, 1H), 7,8 (s, 1H), 7,4-7,14 (m, 10H), 5,2 (d, 1H), 4,8 (s, 5H) 3,7 (m, 1H), 3,6C ЯМР (CD3OD):154,4, 143,2, 129,6, 128,0, 126,0, 58,0, 52,4, 44,3, 41,6, 33,8, 30,5. Пример 10b. Получение монокарбамата гидрохлорида IXa. Диамин дигидрохлорид VIIa (2,0 г), водный натрия гидроксид (3 М, 4,1 г) и дихлорметан (13,3 г) встряхивали в течение 1 ч при 20C. Слой дихлорметана отделили и впоследствии промыли водой (10 г) с получением диаминового свободного основания. В этот раствор загрузили дополнительный дихлорметан (26,6 г) и смешанный карбонат VIII (1,72 г). Полученный в результате раствор нагревали до 40C и удерживали при такой температуре, пока не посчитают, что реакция закончилась, при помощи ВЭЖХ. Растворитель затем удалили в вакууме, совместно дистиллировали с тетрагидрофураном (17,8 г) и затем повторно разбавили тетрагидрофураном (35,6 г). К этому раствору затем добавили концентрированную хлористо-водородную кислоту (12 М, 0,588 г), чтобы вызвать осаждение. Продукт IXa отфильтровали,промыли 1% H2O в 1:1 THF:CH2Cl2 (240 мл) и высушили под вакуумом с получением белого порошка К раствору L-метионина (46 кг) в воде (69 кг), при окружающей температуре загрузили бромуксусную кислоту (46,0 кг), 2-пропанол (69,0 кг) и уксусную кислоту (69,0 кг). Полученную в результате смесь нагревали до кипения (85-95C) и взбалтывали при этой температуре, пока реакцию не сочли завершенной при помощи 1 Н ЯМР. Смесь концентрировали при сниженном давлении и совместно выпарили с 2 пропанолом. 2-Пропанол (161,0 кг) загрузили в концентрированную смесь, с последующим медленным добавлением 10 вес.% раствора HCl/диоксан (102 кг) при комнатной температуре. Полученную в результате взвесь нагревали приблизительно до 60C и перемешивали приблизительно 4 ч. Температуру резервуара регулировали приблизительно до 22C и взбалтывали приблизительно 2 ч. Продукт XIa отфильтровали, промыли двумя частями 2-пропанола (28 кг каждой части) и высушили под вакуумом при 40C с получением от белого до беловатого твердого вещества (39,3 кг, 70% выход). 1 Н ЯМР (D2O):4,79 (s, 2H), 4,61 (dd, 1H), 4,49-4,41 (m, 2H), 2,80 (m, 1H), 2,42 (m, 1H). Пример 12. Получение мочевины XII(28,8 кг). Реакционную смесь охладили до приблизительно 10C и карбонилдиимидазол (27,1 кг) добавляли порционно, пока температура содержимого поддерживалась при 25C или менее. Полученную в результате смесь взбалтывали, пока реакцию не сочли завершенной. Загрузили метиламинометилтиазолXIX (21,0 кг), поддерживая температуру содержимого при 25C или менее, и взбалтывали. При окончании реакционную смесь промыли водой (63,0 кг), затем дважды 20 вес.% водным раствором лимонной кислоты (63,0 кг). Все водные слои объединили и экстрагировали дихлорметаном (63,0 кг). Органические слои объединили и один раз промыли 8 вес.% водным раствором бикарбоната натрия (63,0 кг) и один раз водой (63,0 кг). Органический слой концентрировали при пониженном давлении до 3 объемов и совместно выпарили с дихлорметаном. Продукт XII сбросили как основной раствор в дихлорметане (33,4 кг,91% выход). 1 Н ЯМР (CDCl3):7,02 (s, 1H), 4,55-4,41 (m, 4H), 4,27 (m, 1H), 3,29 (септет, 1H), 2,98 (s, 3H), 2,78(m, 1H), 2,20 (m, 1H), 1,38 (d, 6H). Пример 13. Получение оксалатной соли L-тиазолморфолин этилового сложного эфира XIVa(150 кг) и абсолютный этанол (33,4 кг). Температуру содержимого отрегулировали приблизительно до 10C с последующим медленным добавлением TMSI (78,8 кг), тогда как температуру содержимого поддерживали при 22C или менее и взбалтывали, пока реакцию не сочли завершенной. Температуру содержимого отрегулировали приблизительно до 10C с последующим медленным добавлением морфолина(49,1 кг), тогда как температуру содержимого поддерживали при 22C или менее. При окончании реакционную смесь отфильтровали для удаления морфолинасоли HI и осадок на фильтре промыли двумя частями дихлорметана (33,4 кг). Фильтрат промыли дважды водой (100 кг). Органический слой концентрировали под вакуумом досуха. Ацетон (100 кг) затем загрузили в концентрат и раствор концентрировали при пониженном давлении досуха. Ацетон (233,8 кг) загрузили в концентрат с последующим медленным добавлением раствора щавелевой кислоты (10 кг) в ацетоне (100 кг). Полученную в результате взвесь кипятили с обратным холодильником приблизительно 1 ч перед охлаждением приблизительно до 3C для выделения. Продукт XIVa отфильтровали, промыли ацетоном (66,8 кг) и высушили под вакуумом при 40C с получением от белого до беловатого твердого вещества (40 кг, 71% выход). 1 Н ЯМР (CDCl3):7,00 (s, 1H), 6,35 (широкая часть, 1H), 4,60-4,40 (m, 3H), 4,19 (квартеты, 2H),4,00-3,90 (m, 4H), 3,35-3,10 (m, 7H), 3,00 (s, 3H), 2,40-2,30 (m, 1H), 2,15-2,05 (m, 1H), 1,38 (d, 6H), 1,25 В раствор оксалатной соли L-тиазолморфолин этилового сложного эфира XIVa (35,6 кг) в воде (66,0 кг) загрузили дихлорметан (264 кг) с последующим медленным добавлением 15 вес.% раствора KHCO3(184,8 кг). Полученную в результате смесь взбалтывали приблизительно 1 ч. Слои разделили и органический слой промыли водой (132 кг). Органический слой концентрировали под вакуумом досуха. Загрузили воду (26,5 кг) и температуру содержимого отрегулировали приблизительно до 10C с последующим медленным добавлением 45% раствора KOH (9,8 кг), при этом поддерживая температуру содержимого при 20C или менее. Смесь взбалтывали при 20C или менее, пока реакцию не сочли завершенной при помощи HPLC. Реакционную смесь концентрировали под вакуумом досуха и совместно выпарили пять раз с дихлорметаном (132 кг каждый раз) при сниженном давлении досуха. Совместное выпаривание с дихлорметаном (132 кг) продолжали, пока содержание воды не стало 4% при титровании по Karl Fischer. Загрузили дополнительный дихлорметан (264 кг) и температуру содержимого отрегулировали до(-18)-(-20)C с последующим добавлением монокарбаматасоль HCl IXa (26,4 кг). Полученную в результате смесь взбалтывали при (-18)-(-20)C приблизительно 1 ч. Загрузили HOBt (11,4 кг) и реакционную смесь снова взбалтывали при (-18)-(-20)C приблизительно 1 ч. Предварительно охлажденный раствор(-20C) EDCHCl (21,4 кг) в дихлорметане (396 кг) добавили к реакционной смеси, тогда как температуру содержимого поддерживали при -20C или менее. Реакционную смесь взбалтывали при (-18)-(-20)C,пока реакцию не сочли завершенной. Температуру содержимого отрегулировали приблизительно до 3C,и реакционную смесь погасили 10 вес.% водным раствором лимонной кислоты (290 кг). Слои разделили и органический слой промыли один раз 15 вес.% раствором бикарбоната калия (467 кг) и водой (132 кг). Органический слой концентрировали при сниженном давлении и затем совместно выпарили с абсолютным этанолом. Продукт I выделили как основной раствор в этаноле (35,0 кг продукта, 76,1% выход). 1 Н ЯМР (d-DMSO):9,05 (s, 1H), 7,85 (s, 1H), 7,52 (d, 1H), 7,25-7,02 (m, 12H), 6,60 (d, 1H), 5,16 (s,2H), 4,45 (s, 2H), 4,12-4,05 (m, 1H), 3,97-3,85 (m, 1H), 3,68-3,59 (m, 1H), 3,57-3,45 (m, 4H), 3,22 (септеты,1H), 2,88 (s, 3H), 2,70-2,55 (m, 4H), 2,35-2,10 (m, 6H), 1,75 (m, 1H), 1,62 (m, 1H), 1,50-1,30 (m, 4H), 1,32 (d,6H). 13C ЯМР (CD3OD):180,54, 174, 160,1, 157,7, 156,9, 153,8, 143,8, 140,1, 140,0, 136,0, 130,53, 130,49,129,4, 127,4, 127,3, 115,5, 67,7, 58,8, 56,9, 55,9, 54,9, 53,9, 51,6, 49,8, 42,7, 42,0, 35,4, 34,5, 32,4, 2,1, 29,1,23,7. Пример 15. Альтернативное получение мочевины XII Также мочевину формулы XII можно получить, как описано на этапах А-Г ниже. А. Во взвесь карбонилдиимидазола (8,5 г, 0,052 моль, 1,2 экв.) в тетрагидрофуране (100 г) при приблизительно 10C загрузили триэтиламин (6,6 г, 0,065 моль, 1,5 экв.), при этом температуру реакции поддерживали приблизительно при 10C. Полученную в результате взвесь загрузили частями с исходным аминоизопропилтиазолом ди-HCl (XVa, 10 г, 0,044 моль) в резервуар с температурой, поддерживаемой приблизительно при 10C. Как только завершили добавление, температуру резервуара нагрели до комнатной температуры, и реакционную смесь встряхивали при данной температуре, пока реакцию не сочли завершенной при помощи HPLC (цель: исходный материал 1%). При завершении триэтиламиновую HCl соль отфильтровали. Влажный осадок на фильтре промыли THF (80 кг) и фильтрат концентрировали под вакуумом приблизительно при 40C и совместно выпарили с этилацетатом (50 кг). В полученную в результате взвесь загрузили этилацетат (20 кг), затем охладили приблизительно до 0C и встряхивали при данной температуре приблизительно 1 ч. Продукт отфильтровали и промыли гептаном(20 кг). Осадок на фильтре вытянули сухим на фильтре под вакуумом. Б. Вышеописанный влажный осадок на фильтре суспендировали в тетрагидрофуране (80 г) и температуру резервуара отрегулировали приблизительно до 0C. В эту взвесь медленно загрузили третBuOK (6,9 г, 0,061 моль, 1,4 экв.), тогда как температуру реакции поддерживали приблизительно при 0C с последующим добавлением метилйодида (8,7 г, 0,061 моль, 1,4 экв.) приблизительно при 0C. Как только добавление завершили, реакционную смесь нагрели до окружающей температуры и встряхивали при этой температуре, пока реакцию не сочли завершенной при помощи HPLC (цель: продукт 70%). При завершении реакционную смесь отрегулировали приблизительно до 3C и встряхивали при этой температуре приблизительно 1 ч. Соль йодида калия отфильтровали и осадок на фильтре промыли THF(20 г). Маточный раствор, содержащий продукт, собрали и перенесли прямо на следующий этап. В. В вышеупомянутый маточный раствор загрузили метилйодид (18,6 г, 0,131 моль, 3 экв.) и реакционную смесь нагревали до приблизительно 35C и встряхивали при этой температуре, пока реакцию не сочли завершенной при помощи HPLC (цель: исходный материал 1%, приблизительно 24 ч). При за- 22022739 вершении реакционную смесь довели до комнатной температуры и отфильтровали. Продукт осадка на фильтре промыли THF (20 г). Осадок на фильтре вытянули сухим на фильтре под вакуумом. Г. В вышеупомянутый влажный осадок на фильтре загрузили THF (80 г), а затем порционно добавили L-аминолактон, XI (7 г, 0,038 моль, 0,9 экв.). В полученную в результате смесь медленно загружали диизопропилэтиламин (8,5 г, 0,066 моль, 1,5 экв.), тогда как температуру реакции поддерживали ниже 30C. Как только добавление завершили, температуру реакции отрегулировали до комнатной и взбалтывали, пока реакцию не сочли завершенной при помощи HPLC (цель: исходный материал 1%, приблизительно 48 ч). При завершении реакционную смесь концентрировали под вакуумом приблизительно до 3 объемов при температуре бани, установленной на максимум (40C). Концентрат затем отрегулировали до комнатной температуры и загрузили метиленхлоридом (50 г). Полученный в результате органический раствор промыли 20% раствором лимонной кислоты (30 г), а затем водой (30 г). Водные слои объединили и обратно экстрагировали с метиленхлоридом (50 г). Органические слои объединили и концентрировали при сниженном давлении приблизительно до 3 объемов при температуре бани, установленной при 40C. Концентрирование повторяли, пока не достигли предела KF (цель: KF 0,5%). Как только достигли предела KF, продукт XII отбросили как основной раствор метиленхлорида (5,8 г, 45% выход). 1 Н ЯМР (CDCl3):7,02 (s, 1H), 4,55-4,41 (m, 4H), 4,27 (m, 1H), 3,29 (септеты, 1H), 2,98 (s, 3H), 2,78(m, 1H), 2,20 (m, 1H), 1,38 (d, 6H). Все публикации, патенты и патентные документы включены ссылкой в данное описание, как если бы каждый отдельно был включен ссылкой. Данное изобретение описали со ссылкой на различные специфические и предпочтительные варианты осуществления и техники. Однако нужно понимать, что можно сделать много вариаций и модификаций, в то же время, не отходя от сущности и объема данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I или его соли, включающий: а) стадию димеризации соответствующего соединения формулы II при этом R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С 1-С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, в присутствии ненуклеофильного основания с получением соответствующего соединения формулы Vb) стадию снятия защиты с соединения формулы V или его соли с получением соединения формулы или его соли; с) стадию каталитического восстановления соединения формулы VI или его соли с получением соединения формулы VIId) стадию превращения соединения формулы VII в соответствующую соль путем обработки кислотой в органическом растворителе;e) стадию взаимодействия соответствующей соли со стадии d) с соединением формулы VIII с получением соединения формулы IXf) стадию взаимодействия соединения формулы IX или его соли с кислотой формулы Ха или ее солью с получением соединения формулы I. 2. Способ по п.1, в котором соединение формулы II получают путем осуществления взаимодействия(S)-2-бензилазиридина с соответствующим соединением R1-X, где X является уходящей группой и R1 является -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С 1-С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина,азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, с получением соединения формулы II. 3. Способ по п.1, в котором соединение формулы II получают путем: а) обработки соединения формулы III или его соли соответствующим соединением формулы R1-X и R2-X, где X является уходящей группой и R1 является -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С 1-С 8)алкил; илиRa и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, и R2 является -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой(С 1-С 8)алкил; или Rd и Re вместе с азотом, к которому они присоединены, образуют насыщенное кольцо,выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, с получением соответствующего соединения формулы IVb) обработки соединения формулы IV или его соли подходящим основанием с получением соединения формулы II. 4. Способ по п.3, в котором R2 является -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой (С 1-С 8)алкил. 5. Способ по п.3, в котором соединение формулы IV представляет собой соединение формулы IVa или его соль. 6. Способ по любому из пп.1-3, в котором кислоту формулы Xa или ее соль получают путем: а) обработки соединения формулы XII или его соли подходящим источником йодида с получением соединения формулы XIIIb) обработки соединения формулы XIII или его соли морфолином с получением сложного эфира формулы XIV или его соли; и с) гидролиза сложного эфира формулы XIV с получением кислоты формулы Xa или ее соли. 7. Способ по п.6, в котором соединение формулы XII или его соль получают путем: а) обработки L-метионина алкилирующим агентом и необязательно защиты полученного амина с получением амина формулы XIb) обработки полученного амина формулы XI или его соли соединением формулы XIX или его солью в присутствии карбонилдиимидазола и подходящего основания с получением соединения формулы XII или его соли. 8. Способ по п.6, в котором соединение формулы XII или его соль получают путем: а) обработки соединения формулы XV или его соли карбонилдиимидазолом в присутствии основания с получением соединения формулыb) обработки соединения формулы XVI или его соли подходящим метилирующим агентом в присутствии основания с получением соединения формулы XVII или его соли; с) метилирования соединения формулы XVII или его соли с получением соли формулы XVIII где Y- представляет собой подходящий противоион; иd) обработки соли формулы XVIII амином формулы XI или его солью, где R3 представляет собой H или защитную группу с подходящим основанием, и снятие защиты с удалением R3, если R3 представляет собой защитную группу, с получением соединения формулы XII или его соли. 9. Способ по п.6, в котором соль соединения формулы XIV представляет собой оксалатную соль. 10. Способ по п.1, в котором указанное ненуклеофильное основание представляет собой ТМР(2,2,2,6-тетраметилпиперидин) или LTMP (литий тетраметилпиперидин). 11. Способ по п.1, отличающийся тем, что соединение формулы V представляет собой соединение формулы Va 13. Способ получения соединения формулы V где R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С 1 С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, или его соли, отличающийся тем, что соединение формулы V получают из соответствующего соединения формулы II или его соли путем димеризации соединения формулы II. 14. Способ получения соединения формулы IV где R1 представляет собой -S(=O)2NRaRb, где каждый из Ra и Rb независимо представляет собой (С 1 С 8)алкил; или Ra и Rb вместе с азотом, к которому они присоединены, образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, и R2 представляет собой -S(=O)2NRdRe, где каждый из Rd и Re независимо представляет собой (С 1-С 8)алкил; или Rd и Re вместе с азотом, к которому они присоединены,образуют насыщенное кольцо, выбранное из азиридина, азетидина, пиперидина, морфолина, тиоморфолина, пирролидина, гомопиперазина, гомопиперидина или пиперазина, отличающийся тем, что соединение формулы IV получают из соединения формулы III или его соли путем защиты соединения формулы III. 15. Способ получения соединения формулы XIV или его соли, отличающийся тем, что соединение формулы XIV или его соль получают из соответствующего соединения формулы XIII или его соли путем замещения йодида морфолином. 16. Способ получения соединения формулы XII или его соли, отличающийся тем, что соединение формулы XII получают из соответствующего соединения формулы XVIII при этом Y- представляет собой подходящий противоион, путем обработки соединением формулы где R3 представляет собой H или защитную группу, в присутствии основания и необязательно удаления R3, если R3 представляет собой защитную группу, с получением соединения формулы XII. 17. Способ получения соли формулы XVIII где Y- представляет собой подходящий противоион, отличающийся тем, что соль формулы XVIII получают из соответствующего соединения формулы XVII или его соли путем обработки метилирующим агентом с получением соли формулы XVIII. 18. Способ получения соединения формулы XVII или его соли, отличающийся тем, что соединение формулы XII получают из соответствующего соединения формулы XVI или его соли путем обработки метилирующим агентом с получением соединения формулы XVII или его соли. 19. Способ получения соединения формулы XVI или его соли, отличающийся тем, что соединение формулы XVI получают из соответствующего соединения формулы XV или его соли путем обработки карбонилдиимидазолом в присутствии основания с получением соединения формулы XVI. 20. Соединение формулы Va или его соль где указанное соединение представляет собой оксалатную соль. 22. Соединение формулы XVI или его соль где Y- представляет собой подходящий противоион. 25. Способ получения соединения формулы I
МПК / Метки
МПК: C07D 417/12, C07C 307/06
Метки: применяемые, промежуточные, соединения, этом, способе, получения, способ, монооксигеназы, ингибитора, цитохром
Код ссылки
<a href="https://eas.patents.su/30-22739-sposob-polucheniya-ingibitora-citohrom-p450-monooksigenazy-i-promezhutochnye-soedineniya-primenyaemye-v-etom-sposobe.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения ингибитора цитохром p450 монооксигеназы и промежуточные соединения, применяемые в этом способе</a>
Предыдущий патент: Солюбилизатор для ионов металлов
Следующий патент: Устройство для очистки короткого волокна от костры и неволокнистых примесей
Случайный патент: Способ множественного доступа и многоточечной передачи данных по электрической сети