Бис-(фторалкил)-1,4-бензодиазепиноновые соединения
Номер патента: 22530
Опубликовано: 29.01.2016
Авторы: Ким Сун-Хунь, Ли Фрэнсис, Кеснелль Клод, Гаваи Ашвиникумар
Формула / Реферат
1. Соединение формулы (I)
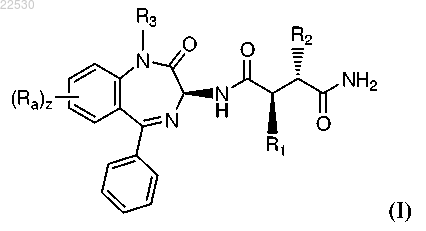
где R1 представляет собой -CH2CF3 или -CH2CH2CF3;
R2 представляет собой -CH2CF3, -CH2CH2CF3 или -CH2CH2CH2CF3;
R3 представляет собой Н или -CH3;
каждый Ra независимо представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3;
z равно 0, 1 или 2.
2. Соединение по п.1, в котором R1 представляет собой -CH2CF3 или -CH2CH2CF3 и R2 представляет собой -CH2CF3 или -CH2CH2CF3.
3. Соединение по п.1, в котором z равно 0 или 1.
4. Соединение по п.1, в котором R1 представляет собой -CH2CH2CF3 и R2 представляет собой -CH2CH2CF3.
5. Соединение по п.4, в котором z равно 0 или 1.
6. Соединение по п.1, в котором z равно 1 или 2.
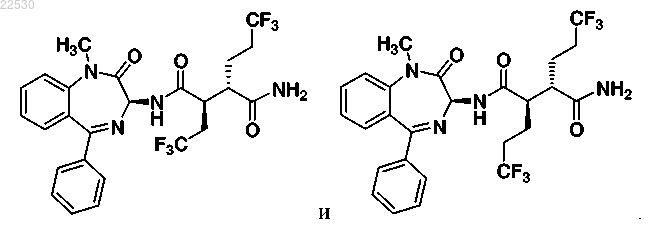
7. Соединение по п.1, выбранное из
(2R,3S)-N-((3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (1);
(2R,3S)-N-((3S)-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (2);
(2R,3S)-N-((3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2-(2,2,2-трифторэтил)-3-(3,3,3-трифторпропил)сукцинамида (3);
(2R,3S)-N-((3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1Н-1,4-бензодиазепин-3-ил)-3-(2,2,2-трифторэтил)-2-(3,3,3-трифторпропил)сукцинамида (4);
(2R,3S)-N-((3S)-1-(2H3)метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (5);
(2R,3S)-N-((3S)-7-хлор-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (6);
(2R,3S)-N-((3S)-8-метокси-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (7);
(2R,3S)-N-((3S)-8-фтор-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (8);
(2R,3S)-N-((3S)-7-метокси-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (9);
(2R,3S)-N-((3S)-7-фтор-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (10);
(2R,3S)-N-((3S)-8-хлор-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (11);
(2R,3S)-N-((3S)-9-метокси-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (12);
(2R,3S)-N-((3S)-8-метокси-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (13);
(2R,3S)-N-((3S)-7-метокси-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (14);
(2R,3S)-N-((3S)-8-циано-9-метокси-2-оксо-5-фенил-2,3-дигидро-1Н-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (15);
(2R,3S)-N-((3S)-8,9-дихлор-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (16);
(2R,3S)-N-((3S)-9-фтор-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (17);
(2R,3S)-N-((3S)-9-хлор-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (18);
(2R,3S)-N-((3S)-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-3-(4,4,4-трифторбутил)-2-(3,3,3-трифторпропил)сукцинамида (19);
(2R,3S)-N1-((3S)-8-метокси-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-3-(4,4,4-трифторбутил)-2-(3,3,3-трифторпропил)сукцинамида (20) и
(2R,3S)-N-((3S)-9-((2-метоксиэтил)амино)-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил)-2,3-бис-(3,3,3-трифторпропил)сукцинамида (21).
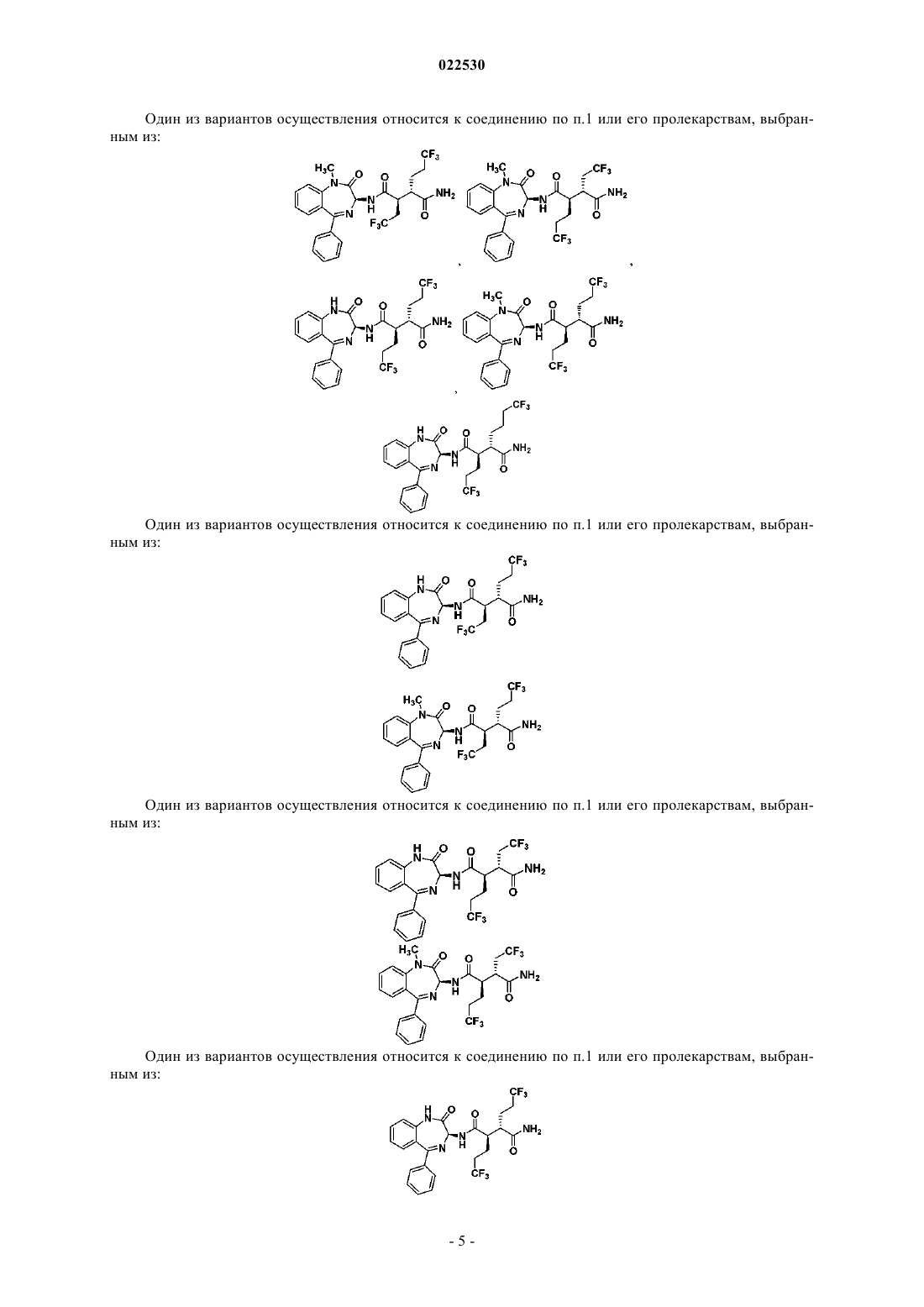
8. Соединение по п.1, выбранное из:
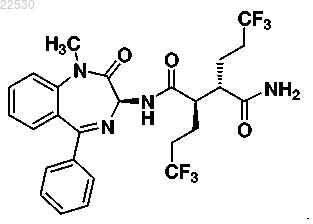
9. Соединение по п.8, где указанное соединение представляет собой
10. Соединение по п.9, где указанное соединение находится в кристаллической форме N-1, которая характеризуется одним из следующих:
a) симулированной порошковой рентгеновской дифрактограммой, по существу, такой, как показано на фиг. 1, и/или наблюдаемой картиной PXRD, по существу, такой, как показано на фиг. 1;
b) порошковой рентгеновской дифрактограммой, содержащей четыре или более, предпочтительно пять или более значений 2θ (CuKα l=1,5418 Å), выбранных из 5,7±0,2, 7,5±0,2, 10,3±0,2, 10,7±0,2, 15,2±0,2, 16,8±0,2, 20,2±0,2 и 20,7±0,2, где порошковая рентгенограмма формы N-1 измеряется при температуре около 20°С;
c) параметрами элементарной ячейки, по существу, равными следующим:
размеры ячейки:
а = 9,41 Å,
b = 17,74 Å,
с = 31,94 Å,
α = 90,0°,
β = 98,4°,
γ = 90,0°;
пространственная группа: Р21;
молекулы указанного соединения/асимметричную единицу: 4,
где параметры элементарной ячейки формы N-1 измеряются при температуре около 10°С; и/или
d) относительными координатами атомов, по существу, как перечислены в следующей далее таблице, при температуре около 25°С.
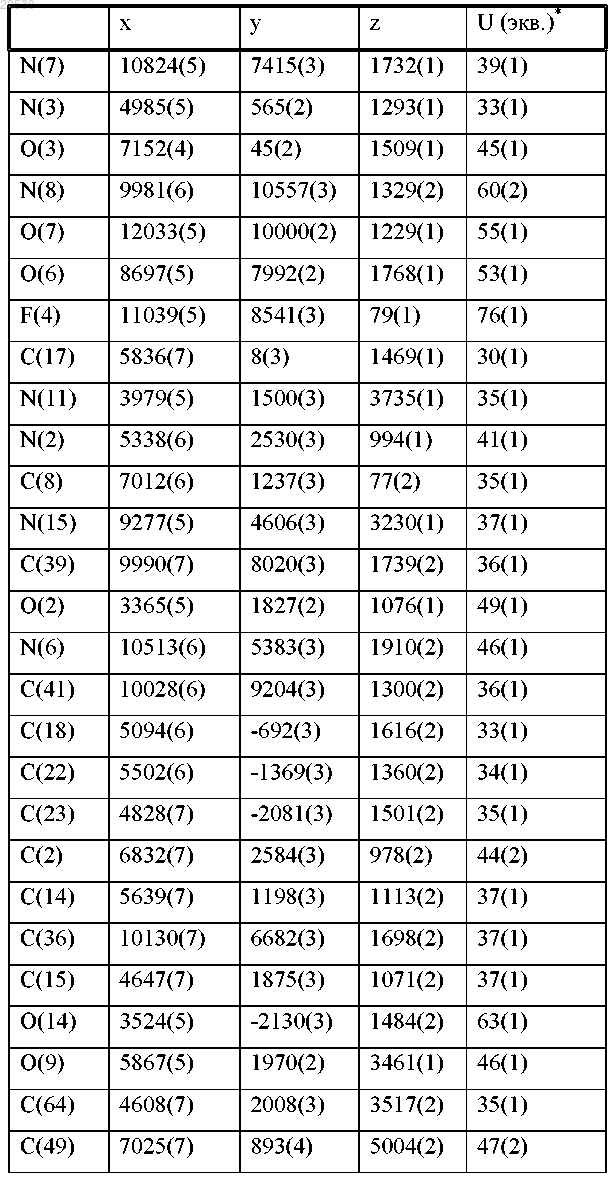

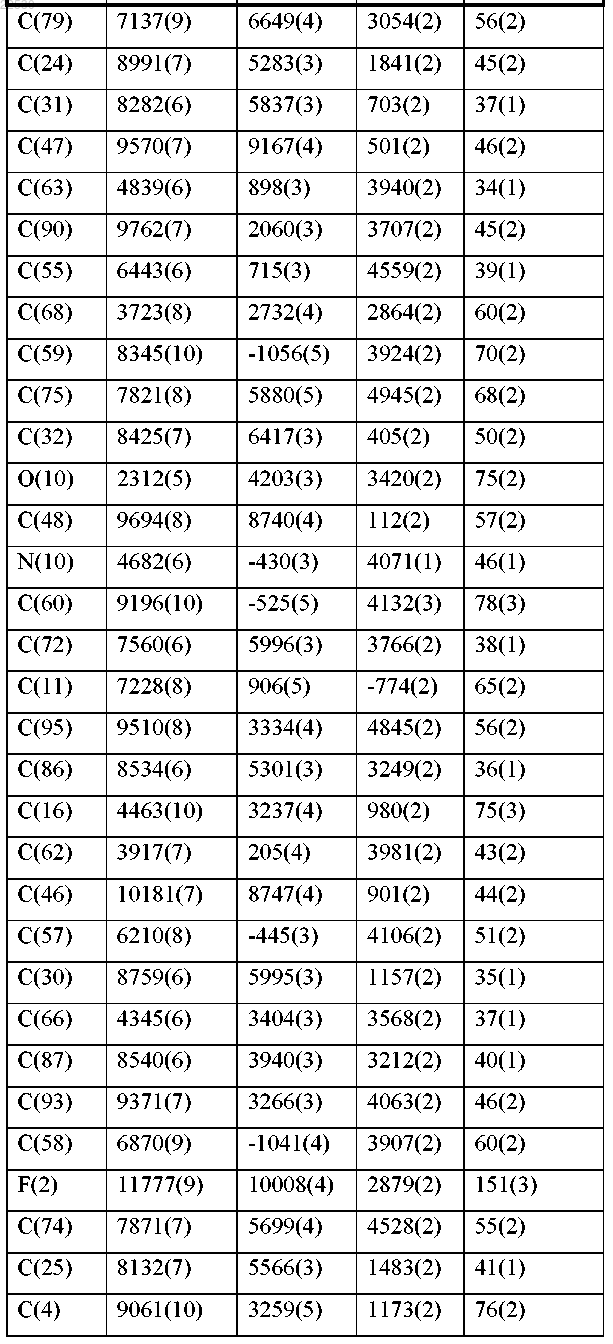
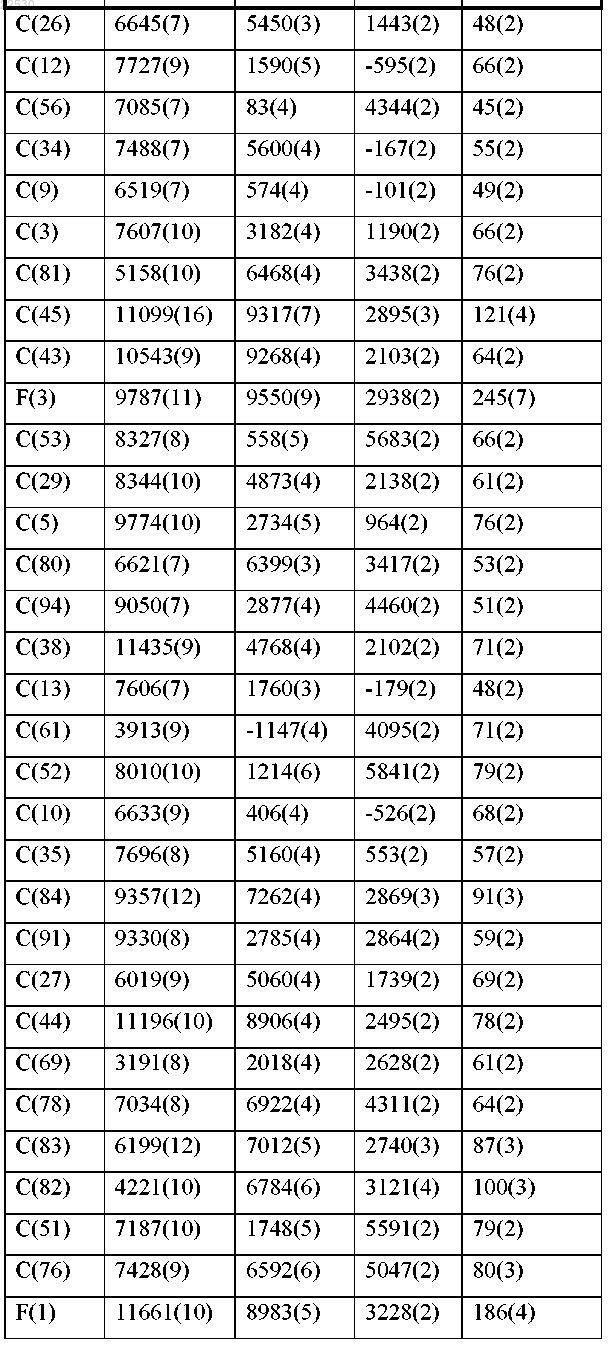


11. Фармацевтическая композиция для лечения рака, содержащая соединение по любому из пп.1-10 и фармацевтически приемлемый носитель.
12. Применение соединения по любому из пп.1-10 в терапии при лечении рака.
13. Применение соединения по любому из пп.1-10 в изготовлении лекарственного средства для лечения рака.
14. Комбинация соединения по любому из пп.1-10 с одним или более дополнительных агентов, выбранных из дазатиниба, паклитаксела, тамоксифена, дексаметазона и карбоплатина, для лечения рака для последовательного или параллельного введения.
Текст
Описаны соединения формулы (I) или их пролекарства где R1 представляет собой -CH2CF3 или -CH2CH2CF3; R2 представляет собой -CH2CF3, -CH2CH2CF3 или -CH2CH2CH2CF3; R3 представляет собой H или -CH3; каждый Ra независимо представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3 и z равно 0, 1 или 2. Описаны также способы применения таких соединений для ингибирования Notch-рецепторов и фармацевтические композиции, содержащие такие соединения. Эти соединения являются полезными для лечения,предотвращения или замедления прогрессирования заболевания или нарушения в различных терапевтических областях, таких как рак. Настоящее изобретение в целом относится к бензодиазепиноновым соединениям, полезным в качестве ингибиторов Notch. Кроме того, изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение в соответствии с настоящим изобретением, которое является полезным для лечения состояний, связанных с Notch путем, таких как рак и другими пролиферативными заболеваниями.Notch сигнализация вовлечена в различные клеточные процессы, такие как определение судьбы клетки, дифференцировка, пролиферация, апоптоз и ангиогенез (Bray, Nature Reviews Molecular CellBiology, 7:678-689 (2006); Fortini, Developmental Cell, 16:633-647 (2009. Notch белки представляют собой один раз пронизывающие гетеродимерные трансмембранные молекулы. Семейство Notch включает в себя четыре рецептора Notch 1-4, которые активируются при связывании лигандов из семейства DSL(Delta-like 1, 3, 4 и Jagged 1 и 2). Активация и созревание Notch требует серию стадий процессинга, в том числе стадии протеолитического расщепления, опосредованного гамма-секретазой, мультибелкового комплекса, содержащего пресенилин 1 или пресенилин 2, никастрин, АРН 1 и PEN2. После того как Notch расщепляется, внутриклеточный домен Notch (NICD) освобождается из мембраны. Высвободившийся NICD транслоцируется в ядро, где он функционирует как активатор транскрипции совместно с членами семейства CSL (RBPSUH,suppressor of hairless" и LAG1). Гены Notch-мишеней включают членов семейства HES, таких какHES-1. HES-1 функционирует в качестве транскрипционных репрессоров генов, таких как HERP1 (также известного как HEY2), HERP2 (также известного как HEY1) и НАТН 1 (также известного как АТОН 1). Аберрантная активация пути Notch способствует онкогенезу. Активация сигнализации Notch вовлекается в патогенез различных солидных опухолей, включая опухоли яичников, поджелудочной железы, а также рака молочной железы и гематологических опухолей, таких как лейкозы, лимфомы, и множественной миеломы. Роль ингибирования Notch и его применение при лечении различных солидных и гематологических опухолей описаны в Miele, L. et al., Current Cancer Drug Targets, 6:313-323 (2006); Bolos, V. et al.,Endocrine Reviews, 28:339-363 (2007); Shih, I.-M. et al., Cancer Research, 67:1879-1882 (2007);al., Drug Development Research, 69:319-328 (2008). Остается потребность в соединениях, которые являются полезными в качестве ингибиторов Notch и которые имеют достаточную метаболическую стабильность, чтобы обеспечить эффективные уровни лекарственного воздействия. Кроме того, существует потребность в соединениях, полезных в качестве ингибиторов Notch, которые могут быть введены пациенту перорально или внутривенно. Патент США 7053084 В 1 раскрывает сукциноиламинобензодиазепиновые соединения, полезные для лечения неврологических расстройств, таких как болезнь Альцгеймера. Ссылка раскрывает, что эти сукциноиламинобензодиазепиновые соединения ингибируют активность гамма-секретазы и процессинг белкапредшественника амилоида, связанного с формированием неврологических отложений амилоидного белка. Ссылка не раскрывает использование этих соединений для лечения пролиферативных заболеваний, таких как рак. Заявители обнаружили эффективные соединения, которые обладают активностью в качестве ингибиторов Notch и достаточно высокой метаболической стабильностью, чтобы обеспечить эффективные уровни воздействия лекарственного средства при внутривенном или пероральном введении. Эти соединения предназначены быть полезными в качестве фармацевтических средств с желательными стабильностью, биодоступностью, терапевтическим индексом и значениями токсичности, которые являются важными для их способности стать лекарственными препаратами. Сущность изобретения Настоящее изобретение удовлетворяет вышеупомянутым потребностям посредством обеспечения бис-(фторалкил)-1,4-бензодиазепиноновых соединений, которые являются полезными в качестве селективных ингибиторов сигнального пути Notch, включая пролекарства. Настоящее изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и по меньшей мере одно соединение формулы (I) или его пролекарство. Настоящее изобретение также обеспечивает способ лечения заболевания или расстройства, связанного с активностью Notch-рецептора, включающий введение пациенту-млекопитающему соединения формулы (I) или его фармацевтически приемлемых пролекарств. Настоящее изобретение также обеспечивает способы и промежуточные соединения для получения соединений формулы (I) или его пролекарства. Настоящее изобретение также обеспечивает соединения формулы (I) или его пролекарства для применения в терапии. Настоящее изобретение также обеспечивает применение соединений формулы (I) или его пролекарства для производства лекарственного средства для лечения рака.Notch, которые могут быть использованы в лечении, профилактике или исцелении различных состояний,связанных с Notch-рецептором. Фармацевтические композиции, содержащие эти соединения, полезны для лечения, предупреждения или замедления прогрессирования заболеваний или расстройств в различных терапевтических областях, таких как рак. Эти и другие отличительные признаки изобретения будут изложены в развернутом виде по мере продолжения раскрытия. Краткое описание чертежей Настоящее изобретение проиллюстрировано посредством ссылки на прилагаемые чертежи, описанные ниже. Фиг. 1 показывает экспериментальные (при температуре около 25 С) и симулированные(приблизительно при 25 С) дифрактограммы PXRD (CuK =1,5418 ) из N-1 формы соединения примера 1. Фиг. 2 показывает экспериментальные (при температуре около 25 С) и симулированные(приблизительно при 25 С) дифрактограммы PXRD (CuK =1,5418 ) А-2 формы соединения примера 1. Фиг. 3 показывает экспериментальные (при температуре около 25 С) и симулированные(приблизительно при 25 С) дифрактограммы PXRD (CuK =1,5418 ) ЕА-3 формы соединения примера 1. Фиг. 4 показывает экспериментальные (при температуре около 25 С) и симулированные(приблизительно при 50 С) дифрактограммы PXRD (CuK =1,5418 ) в ТГФ 2 форма соединение примера 1. Фиг. 5 показаны экспериментальные (при температуре около 25 С) и симулированные(приблизительно при 25 С) дифрактограммы PXRD (CuK =1,5418 ) М 2-1 формы соединения примера 2. Фиг. 6 показывает противоопухолевую эффективность соединения примера 1 против человеческого Т-клеточного острого лимфобластного лейкоза TALL 1. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; пример 1, 5 мг/кг/введение, QD3, IV. Фиг. 7 показывает in vivo противоопухолевую активность соединения примера 2 в клеточной линии Т-клеточной острой лимфобластной лейкемии TALL1. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; пример 2, 12 мг/кг, QD15; пример 2, 6 мг/кг, QD15; пример 2, 3 мг/кг,QD15; пример 2, 1,5 мг/кг, QD15; (о) пример 2, 0,75 мг/кг, QD15. Фиг. 8 показывает in vivo противоопухолевая активность соединения примера 2 в линии клеток карциномы молочной железы человека MDA-MB-157. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; пример 2, 24 мг/кг,пример 2, 18 мг/кг; пример 2, 12 мг/кг. Фиг. 9 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и дазатиниба в Т-клеточной лимфобластной лейкемии ALL-SIL. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; пример 1, 3,75 мг/кг/введение, QD3, раз в неделю в течение 7 недель, РО,дазатиниб, 10 мг/кг/введение, QD49, РО,пример 1, 3,75 мг/кг/введение, QD3, раз в неделю в течение 7 недель, РО + дазатиниб 10 мг/кг/введение, QD49, РО. При приеме в тот же день два агента давали более или менее одновременно (соединение примера 1 предшествовало дазатинибу менее чем на 1 ч). Фиг. 10 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и дазатиниба в Т-клеточной лимфобластной лейкемии ALL-SIL. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; пример 1, 7,5 мг/кг/введение QD3, раз в неделю в течение 7 недель, РО,дазатиниб, 10 мг/кг/введение, QD49, РО,пример 1, 7,5 мг/кг/введение, QD3, раз в неделю в течение 7 недель, РО + дазатиниб 10 мг/кг/введение, QD49, РО. При приеме в тот же день два агента давали более или менее одновременно (соединение примера 1 предшествовало дазатинибу менее чем на 1 ч). Фиг. 11 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и паклитаксела в карциноме молочной железы человека MDA-MB-468. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; паклитаксел, 12 мг/кг/введение, Q7D6, IV; пример 1, 3,75 мг/кг/введение,QD3, раз в неделю в течение 7 недель, РО,комбинация соединения примера 1 и паклитаксела. Фиг. 12 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и паклитаксела в карциноме молочной железы человека MDA-MB-468. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; паклитаксел, 12 мг/кг/введение, Q7D6, IV; пример 1, 7,5 мг/кг/введение, QD3,раз в неделю в течение 7 недель, РО,комбинация соединения примера 1 и паклитаксела. Фиг. 13 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и тамоксифена в карциноме молочной железы человека MCF7. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; тамоксифен, 20 мг/кг/введение, Q2D12, IP; пример 1, 3,75 мг/кг/введение,QD3, еженедельно в течение 3 недель, РО; комбинация соединения примера 1 и тамоксифена. Фиг. 14 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и тамоксифена в карциноме молочной железы человека MCF7. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; тимоксифен, 20 мг/кг/введение, Q2D12, IP; пример 1, 7,5 мг/кг/введение,комбинация соединения примера 1 и тамоксифена.QD3, еженедельно в течение 3 недель, РО Фиг. 15 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и дексаметазона (Dexa) в ксенотрансплантатах человеческой T-ALL лейкемии Т HPB-ALL. Каждый символ представляет среднее опухолевой массы группы по 6-8 мышей: контроль; дексаметазон, 7,5 мг/кг/введение, QD14, IP; пример 1, 3,75 мг/кг/введение,комбинация соединения примера 1 и дексаметазона.QD3, еженедельно в течение 3 недель, РО,Фиг. 16 показывает синергетическую противоопухолевую эффективность комбинированной химиотерапии соединения примера 1 и карбоплатина в тератокарциноме яичников человека РА-1. Каждый символ представляет среднее опухолевой массы группы из 8 мышей: контроль; карбоплатин, 90 мг/кг/введение, Q7D3, IV; ( ) пример 1, 1 мг/кг/введение,QD21, РО; комбинация соединения примера 1 и карбоплатина. Подробное описание изобретения Согласно первому аспекту настоящее изобретение относится к соединениям формулы(I)R3 представляет собой Н или -CH3; каждый Ra независимо представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3;z равно 0, 1 или 2. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R1 представляет собой -CH2CF3; a R2, R3, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, в которых R2 представляет собой -CH2CF3 или-CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R1 представляет собой -CH2CH2CF3; a R2, R3, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, в которых R2 представляет собой -CH2CF3 или-CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R2 представляет собой -CH2CF3; a R2, R3, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, в которых R1 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R2 представляет собой -CH2CH2CF3; a R2, R3, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, где R1 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R2 представляет собой -CH2CH2CH2CF3; a R1, R3, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, где R1 представляет собой-CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R3 представляет собой Н; a R1, R2, Ra и z определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, где R1 представляет собой дейтерий (D) или тритий(Т). Кроме того, в данном варианте осуществления включаются соединения, в которых R1 представляет собой -CH2CH2CF3 и R2 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, в которых R3 представляет собой -CH3; a R1, R2 и z определяются в соответствии с первым аспектом. R3 включает метильные группы, в которых один или несколько атомов водорода изотопно замещены дейтерием(D) и/или тритием (Т). В одном примере этого варианта R3 представляет собой -CD3. Кроме того, в данном варианте осуществления включаются соединения, в которых R1 представляет собой -CH2CH2CF3 иR2 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, гдеz равно 2, и каждый Ra независимо представляет собой F, Cl, -CN, -OCH3, и/или -NHCH2CH2OCH3 и R1,R2, и R3 имеют значения, определенные в первом аспекте. В этом варианте осуществления включаются соединения, где R1 представляет собой -CH2CH2CF3 и R2 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, гдеz равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 или -NHCH2CH2OCH3 и R1, R2 и R3 определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, где R1 представляет собой -CH2CH2CF3 и R2 представляет собой -CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, гдеz равно 0, и R1, R2 и R3 определяются в соответствии с первым аспектом. В этом варианте осуществления включаются соединения, где R1 представляет собой -CH2CH2CF3 и R2 представляет собой -CH2CF3 или-CH2CH2CF3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CF3, R3 представляет собой Н или -CH3 и z равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CH2CF3, R3 представляет собой Н или -CH3 иz равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CH2CH2CF3, R3 представляет собой Н или -CH3 и z равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CF3, R3 представляет собой Н или -CH3 иz равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CH2CF3, R3 представляет собой Н или -CH3 и z равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CH2CH2CF3, R3 представляет собой Н или-CH3 и z равно 0. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CF3, R3 представляет собой Н или -CH3; z равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CH2CF3, R3 представляет собой Н или -CH3;z равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CF3, R2 представляет собой -CH2CH2CH2CF3, R3 представляет собой Н или -CH3;z равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CF3, R3 представляет собой Н или -CH3;z равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CH2CF3, R3 представляет собой Н или -CH3;z равно 1 и Ra представляет собой F, Cl, -CN, -OCH3 и/или -NHCH2CH2OCH3. Один вариант осуществления относится к соединению формулы (I) или его пролекарствам, где R1 представляет собой -CH2CH2CF3, R2 представляет собой -CH2CH2CH2CF3, R3 представляет собой Н или Один из вариантов осуществления относится к соединению по п.1 или его пролекарствам, выбранным из: Один из вариантов осуществления относится к соединению по п.1 или его пролекарствам, выбранным из: Один из вариантов осуществления относится к соединению по п.1 или его пролекарствам, выбранным из: Один из вариантов осуществления относится к соединению по п.1 или его пролекарствам, выбранным из: Один вариант осуществления относится к соединению формулы (I), выбранному из:(2R,3S)-N-3S)-9-2-метоксиэтил)амино)-2-оксо-5-фенил-2,3-дигидро-1 Н-1,4-бензодиазепин-3-ил)2,3-бис-(3,3,3-трифторпропил)сукцинамида (21) и пролекарства из одного или нескольких из указанных выше соединений. Настоящее изобретение может быть осуществлено в других конкретных формах без отхода от сущности или его существенных признаков. Настоящее изобретение включает все комбинации аспектов и/или вариантов осуществления изобретения, отмеченных в настоящем описании. Следует понимать, что все и любые варианты осуществления настоящего изобретения могут быть приняты в сочетании с любыми другими вариантами осуществления или вариантами осуществления для описания других дополнительных вариантов осуществления. Кроме того, следует понимать, что каждый отдельный элемент из вариантов осуществления предназначен для объединения с любыми другими элементами из любого варианта осуществления для описания дополнительного варианта осуществления. Определения. Отличительные признаки и преимущества изобретения могут быть более легко понятны специалистами в данной области техники при чтении следующего подробного описания. Следует отметить, что некоторые отличительные признаки изобретения, которые для прояснения обоснований, описанных выше и ниже в контексте отдельных вариантов осуществлений, также могут быть объединены в одном осуществлении. Наоборот, различные отличительные признаки изобретения, которые для краткости обоснований описываются в контексте одного осуществления, также могут быть объединены так, чтобы сформировать их подкомбинации. Варианты осуществления, определенные в настоящем изобретении как иллюстративные или предпочтительные, являются иллюстративными, а не ограничивающими. Если специально указано иное, упоминание в единственном числе может также включать в себя множественное число. Если не указано иначе, что для любого гетероатома с ненасыщенными валентностями предполагается, что он имеет достаточно атомов водорода для насыщения валентностей. Определения, изложенные в настоящем изобретении, имеют преимущество перед определениями,изложенными в любом патенте, патентной заявке и/или опубликованной патентной заявке, включенной в настоящее описание посредством ссылки. Ниже приведены определения различных терминов, используемых для описания настоящего изобретения. Эти определения относятся к терминам, которые используются в описании (если они не ограничены на других основаниях в определенных случаях) либо индивидуально, либо в составе более крупной группы. По всему описанию группы и их заместители могут быть выбраны специалистом в данной области техники, чтобы обеспечить стабильные остатки и соединения. используется в струкВ соответствии с соглашением, используемым в данной области техники,турных формулах, представленных в настоящем изобретении, чтобы изобразить связь, которая является точкой присоединения остатка или заместителя к структуре скелета или структуре основной цепи. Термины "гало" и "галоген", используемые в настоящем изобретении, относятся к F, Cl, Br или I. Термин "алкил", используемый в настоящем изобретении, относится как к разветвленной, так и неразветвленной цепи насыщенных алифатических углеводородных групп, содержащих, например, от 1 до 12 атомов углерода, от 1 до 6 атомов углерода и от 1 до 4 атомов углерода. Примеры алкильных групп включают, но не ограничиваются этим, метил (Me), этил (Et), пропил (например, н-пропил и изопропил),бутил (например, н-бутил, изобутил, втор-бутил и трет-бутил), а также пентил (например, н-пентил,изопентил, неопентил), н-гексил, 2-метилпентил, 2-этилбутил, 3-метилпентил и 4-метилпентил. Когда номера появляются в индексе после символа "С", индекс определяет более конкретное количество атомов углерода, которое определенная группа может содержать. Например, "C1-6 алкил" означает прямую или разветвленную алкильную группу с 1-6 атомами углерода. Термин "фармацевтически приемлемый" используется в настоящем изобретении для ссылки на те соединения, материалы, композиции и/или лекарственные формы, которые с медицинской точки зрения являются пригодными для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемой или осложнениями, соразмерными с разумным соотношением польза/риск. Соединения формулы (I) могут обеспечиваться в виде аморфных твердых веществ или кристаллических твердых веществ. Лиофилизация может использоваться для обеспечения соединений формулы (I) в виде твердого вещества. Любое соединение, которое может превращаться in vivo с обеспечением биологически активного агента (т.е. соединения формулы (I, является пролекарством в пределах объема и сущности настоящего изобретения. Различные формы пролекарств хорошо известны в данной области техники и описаны в:d) Testa, B. et al., Hydrolysis in Drug and ProdrugMetabolism, Wiley-VCH (2003). Кроме того, соединения формулы (I) после их получения предпочтительно выделяются и очищаются для получения композиции, содержащей количество по массе равное или большее чем 99% соединения формулы (I) ("по существу, чистое"), которое затем используется или формулируется, как описано в настоящем изобретении. Такие "по существу, чистые" соединения формулы (I) также рассматриваются в настоящем изобретении как часть настоящего изобретения."Стабильное соединение" и "стабильная структура" предназначаются, чтобы указывать на соединение, которое достаточно устойчиво, чтобы выдержать выделение до нужной степени чистоты из реакционной смеси и превращение в эффективный терапевтический агент. Настоящее изобретение предназначено для воплощения стабильных соединений. Выражение "терапевтически эффективное количество" предназначается для включения количества соединения в соответствии с настоящим изобретением одно или количество комбинации заявленных соединений или количества соединения в соответствии с настоящим изобретением в комбинации с другими активными ингредиентами для эффективного действия в качестве ингибитора для Notch-рецептора или эффективного для лечения или профилактики пролиферативных заболеваний, таких как рак. В настоящем изобретении "врачевание" или "лечение" охватывает лечение болезненного состояния у млекопитающего, в частности человека, и включает (а) предупреждение наступления болезненного состояния у млекопитающего, в частности, если указанное млекопитающее предрасположено к болезненному состоянию, но еще не диагностировано, что имеет его; (b) ингибирование болезненного состояния, т.е. прекращение его развития; и/или (с) облегчение болезненного состояния, т.е. регрессию болезненного состояния. Соединения в соответствии с настоящим изобретением включают в себя все изотопы атомов в соответствии с настоящим изобретением. Изотопы включают атомы, имеющие одинаковый атомный номер,но разные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают дейтерий (D) и тритий (Т). Изотопы углерода включают 13 С и 14 С. Меченные изотопами соединения в соответствии с настоящим изобретением могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными описанным в настоящем изобретении, с использованием соответствующего изотопно-меченого реагента вместо немеченного реагента,который обычно используется. Кристаллические формы соединение примера 1. В одном варианте осуществления соединение примера 1 обеспечивается в виде кристаллического вещества, содержащего одну или несколько кристаллических форм. Примеры подходящих кристаллических форм соединения примера 1 включают формы N-1, А-2 и ЕА-3. В одном варианте осуществления соединение примера 1 обеспечивается в виде кристаллического вещества, содержащего первую кристаллическую форму. Первая кристаллическая форма соединения примера 1 содержит чистую кристаллическую форму, называемую в настоящем изобретении "формаN-1" или "N-1 форма". В одном варианте осуществления N-1 форма соединения примера 1 характеризуется параметрами элементарной ячейки, приблизительно равными следующим. Размеры ячейки:a = 9,41 ,b = 17,74 ,с = 31,94 , = 90,0, = 98,4, = 90,0. Пространственная группа: P21. Молекулы примера 1/асимметричная ячейка: 4. Объем/число молекул в элементарной ячейке = 659 3. Плотность (расчетная) = 1,402 г/см 3,где параметры элементарной ячейки формы N-1 измеряются при температуре около -10 С. В другом варианте N-1 форма соединения примера 1 характеризуется симулированной дифрактограммой порошковой рентгеновской дифракции (PXRD), по существу, в соответствии с дифрактограммой, показанной на фиг. 1, и/или наблюдаемой дифрактограммой PXRD, по существу, в соответствии с дифрактограммой, показанной на фиг. 1 В еще одном варианте осуществления N-1 форма соединения примера 1 характеризуется порошковой рентгеновской дифрактограммой (CuK =1,5418 при температуре около 25 С), содержащей четыре или более, предпочтительно пять или более, значений 2, выбранных из 5,70,2, 7,50,2, 10,30,2,10,70,2, 15,20,2, 16,80,2, 20,20,2 и 20,70,2, где порошковая рентгеновская дифрактограмма формыN-1 измеряется при температуре около 20 С. В еще одном варианте осуществления N-1 форма примера 1 характеризуется относительными координатами атомов, по существу, перечисленными в табл. 1. Таблица 1 Относительные координаты атомов формы N-1 примера 1,рассчитанные при температуре около 25 С; координаты атомов (104) и эквивалентные параметры изотропного замещения (2103)U(экв.) определяется как одна треть следа ортогонализованного тензора U1J. В еще одном варианте осуществления N-1 форма соединения примера 1 является, по существу, чистой. В еще одном варианте осуществления N-1 форма соединения примера 1 содержит по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу формы N-1 соединения примера 1. В еще одном варианте осуществления, по существу, чистая форма N-1 соединения примера 1 имеет,по существу, значительную фазовую гомогенность менее чем около с 10%, предпочтительно менее чем около 5% и более предпочтительно менее чем около 2% общей площади пика экспериментально измеренной дифрактограммы PXRD, вытекающие из пиков, которые отсутствуют в симулированной дифрактограмме PXRD. Наиболее предпочтительно, чтобы, по существу, чистая кристаллическая форма N-1 имела, по существу, значительную фазовую гомогенность менее чем примерно с 1% от общей площади пика экспериментально измеренной дифрактограммы порошковой рентгеновской дифракции, вытекающей из пиков, которые отсутствуют в симулированной порошковой рентгеновской дифрактограммы. В другом варианте осуществления изобретения кристаллическая форма соединения примера 1 в основном состоит из формы N-1. Кристаллическая форма этого варианта осуществления может содержать по меньшей мере примерно 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу кристаллической формы, форму N-1 соединения примера 1. В еще одном варианте осуществления фармацевтическая композиция обеспечивает форму N-1 соединения примера 1 и по меньшей мере один фармацевтически приемлемый носитель и/или разбавитель. В еще одном варианте осуществления фармацевтическая композиция содержит, по существу, чистую форму N-1 соединения примера 1 и по меньшей мере один фармацевтически приемлемый носитель и/или разбавитель. В еще одном варианте терапевтически эффективное количество формы N-1 соединения примера 1 комбинируется по меньшей мере с одним фармацевтически приемлемым носителем и/или разбавителем,чтобы обеспечить по меньшей мере одну фармацевтическую композицию. В одном варианте осуществления соединение примера 1 обеспечивает вторую кристаллическую форму. Вторая кристаллическая форма представляет собой кристаллическую форму ацетонового сольвата, называемую в настоящем изобретении "форма А-2" или "А-2 форма". А-2-форма содержит приблизительно одну молекулу ацетона на каждую молекулу примера 1. В одном варианте А-2 форма характеризуется параметрами элементарной ячейки, приблизительно составляющими следующее. размеры ячейки: а = 9,25 ,b= 17,11 ,с= 19,63 ,а = 90,0, = 99,2, = 90,0. Пространственная группа: P21. Молекулы примера 1/асимметричная ячейка: 2. Объем/число молекул в элементарной ячейке = 767 3. Плотность (расчетная) = 1,331 г/см 3,где параметры элементарной ячейки формы А-2 измеряются при температуре около -50 С. В другом варианте осуществления А-2 форма характеризуется симулированной картиной порошковой рентгеновской дифракции (PXRD), по существу, в соответствии со схемой, показанной на фиг. 2,и/или наблюдаемой дифрактограммой PXRD, по существу, в соответствии со схемой, показанной на фиг. 2. В еще одном варианте осуществления форма А-2 примера 1 характеризуется относительными координатами атомов, по существу, перечисленными в табл. 2. Таблица 2 Относительные координаты атомов формы А-2 примера 1, рассчитанные при температуре около 25 С; координаты атомов (104) и эквивалентные параметры изотропного замещения (2103)U (экв.) определяется как одна треть следа ортогонализованного тензора U1j. В еще одном варианте осуществления А-2 форма соединения примера 1, по существу, является чистой. В еще одном варианте осуществления А-2 форма соединения примера 1 содержит по меньшей мере примерно 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в пересчете на массу второй кристаллической формы, формы А-2. В еще одном варианте осуществления, по существу, чистая вторая кристаллическая форма имеет,по существу, однородную гомогенную фазу менее чем около с 10%, предпочтительно менее чем около 5% и более предпочтительно менее чем около 2% от общей площади пика экспериментально измеренных картин PXRD, вытекающих из пиков, которые отсутствуют в симулированной картине PXRD. Наиболее предпочтительно, чтобы, по существу, чистая вторая кристаллическая форма имела, по существу, значительную фазовую гомогенность менее чем около с 1% от общей площади пика экспериментально измеренной порошковой рентгенограммы, вытекающей из пиков, которые отсутствуют в симулированной порошковой рентгенограмме. В другом варианте осуществления вторая кристаллическая форма соединения примера 1 в основном состоит из формы А-2. Вторая кристаллическая форма этого варианта осуществления может содержать по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в пересчете на массу второй кристаллической формы,формы А-2. В одном варианте осуществления соединение примера 1 обеспечивает третью кристаллическую форму. Третья кристаллическая форма представляет собой кристаллическую форму этилацетатного сольвата, называемом в настоящем изобретении "форма ЕА-3" или "ЕА-3 форма". ЕА-3 форма содержит примерно одну молекулу этилацетата на каждую молекулу примера 1. В одном варианте осуществления ЕА-3 форма характеризуется параметрами элементарной ячейки,приблизительно равными следующему: размеры ячейки: а = 8,84 ,b = 15,95 ,с = 22,38 , = 90,0,- 17022530= 90,0, = 90,0; пространственная группа: P212121; молекулы примера 1/асимметричная ячейка: 1; объем/число молекул в элементарной ячейке = 789 3; плотность (расчетная) = 1,357 г/см 3,где параметры элементарной ячейки формы ЕА-3 измеряются при температуре около -50 С. В другом варианте осуществления ЕА-3 форма характеризуется симулированной картиной порошковой рентгеновской дифракции (PXRD), по существу, в соответствии со схемой показано на фиг. 3,и/или наблюдаемой картиной PXRD, по существу, в соответствии со схемой, показанной на фиг. 3. В еще одном варианте осуществления ЕА-3 форма соединения примера 1 характеризуется порошковой рентгенограммой (CuK =1,5418 при температуре около 25 С), содержащей четыре или более,предпочтительно пять или более значений 2, выбранных из 6,80,2, 9,60,2, 10,60,2, 15,40,2, 20,50,2,21,00,2 и 24,80,2, где порошковая рентгенограмма формы N-1 измеряется при температуре около 20 С. В еще одном варианте осуществления ЕА-3 форма соединения примера 1 характеризуется относительными координатами атомов, по существу, перечисленными в табл. 3. Таблица 3 Относительные координаты атомов формы ЕА-3 примера 1, рассчитанные при температуре около 25 С; координаты атомов (104) и эквивалентные параметры изотропного замещения (2103)U (экв) определяется как одна треть следа ортогонализованного тензора U1J. В еще одном варианте осуществления ЕА-3 форма соединения примера 1 является, по существу,чистой. В еще одном варианте осуществления ЕА-3 форма соединения примера 1 содержит по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу третьей кристаллической формы, формы ЕА-3. В еще одном варианте, по существу, чистая форма ЕА-3 имеет, по существу значительную фазовую гомогенность менее чем около с 10%, предпочтительно менее чем около 5% и более предпочтительно менее чем около 2% от общей площади пика экспериментально измеренных PXRD, вытекающие из пиков, которые отсутствуют в симулированной картине PXRD. Наиболее предпочтительно, чтобы, по существу кристаллическая форма ЕА-3 имела, по существу, значительную фазовую гомогенность менее чем около с 1% от общей площади пика экспериментально измеренной порошковой рентгенограммы,- 19022530 вытекающей из пиков, которые отсутствуют в симулированной порошковой рентгенограмме. В другом варианте осуществления третья кристаллическая форма соединения примера 1 в основном состоит из формы ЕА-3. Третья кристаллическая форма этого варианта осуществления может содержать по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.%, в расчете на массу третьей кристаллической формы, формы ЕА-3. В одном варианте осуществления соединение примера 1 обеспечивает четвертую кристаллическую форму. Четвертая кристаллическая форма обеспечивает кристаллическую форму тетрагидрофуранового сольвата, называемой в настоящем изобретении "форма THF-2" или "THF-2 форма". THF-2 форма содержит примерно одну молекулу тетрагидрофурана на каждую молекулу примера 1. В одном варианте осуществления THF-2 форма характеризуется параметрами элементарной ячейки,приблизительно равными следующим: размеры ячейки: а = 9,34 ,b = 16,44 ,с = 20,60 , = 90,0, = 102,8, = 90,0; пространственная группа: P21; молекулы примера 1/асимметричная ячейка: 2; молекулы тетрагидрофурана/асимметричная ячейка: 2; объем = 3082 3,где параметры элементарной ячейки формы THF-2 измеряются при температуре около -50 С. В другом варианте осуществления THF-2 форма характеризуется картиной симулированной порошковой рентгеновской дифракции (PXRD) ,существу, в соответствии со схемой, показанной на фиг. 4,и/или наблюдаемой картиной PXRD, существу, в соответствии со схемой, показанной на фиг. 4. В еще одном варианте осуществления THF-2 форма соединения примера 1 характеризуется порошковой рентгенограммой (CuK =1,5418 при температуре около 25 С), содержащий четыре или более,предпочтительно пять или более, значений 2, выбранных из 6,90,2, 9,60,2, 11,20,2, 12,60,2,16,60,2, 21,40,2 и 24,20,2, где дифрактограмма PXRD формы N-1 измеряется при температуре около 20 С. В еще одном варианте осуществления THF-2 форма примера 1 характеризуется относительными координатами атомов, по существу, перечисленными в табл. 4. Таблица 4 Относительные координаты атомов формы THF-2 соединения примера 1 (не включая молекулы растворителя),рассчитанные при температуре около -50 С; координаты атомов (104) и эквивалентные параметры изотропного замещения (2103)U (экв) определяется как одна треть следа ортогонализованного тензора U1J. В еще одном варианте осуществления THF-2 форма соединения примера 1 является, по существу,чистой. В еще одном варианте осуществления THF-2 форма соединения примера 1 содержит по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу четвертой кристаллической формы, формы THF-2. В еще одном варианте, по существу, чистая форма THF-2 имела, по существу, значительную фазовую гомогенность менее чем примерно с 10%, предпочтительно менее чем приблизительно 5% и более предпочтительно менее чем примерно 2% от общей площади пика экспериментально измеренной дифрактограммы PXRD, вытекающие из пиков, которые отсутствуют в симулированной картине PXRD. Наиболее предпочтительно, чтобы, по существу, кристаллическая форма THF-2 имела, по существу, значительную фазовую гомогенность менее чем около с 1% от общей площади пика экспериментально измеренной порошковой рентгенограммы, вытекающей из пиков, которые отсутствуют в симулированной порошковой рентгенограмме. В другом варианте четвертая кристаллическая форма соединения примера 1 в основном состоит из формы THF-2. Четвертая кристаллическая форма этого варианта осуществления может содержать по меньшей мере около 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу четвертой кристаллической формы, формыTHF-2. Кристаллическая форма соединения примера 2. В одном варианте осуществления соединение примера 2 обеспечивается в виде кристаллического вещества, содержащего кристаллическую форму. Примером подходящей кристаллической формы соединения примера 2 является форма М 2-1. М 2-1 форма содержит около двух молекул метанола на каждую молекулу соединения примера 2. В одном варианте осуществления М 2-1 форма соединения примера 2 характеризуется параметрами элементарной ячейки, приблизительно равными следующим:a = 8,44 ,b = 21,02 ,с = 17,52 , = 90,0, = 90,88, = 90,0; пространственная группа: P21; молекулы примера 2/асимметричная ячейка: 2; объем/число молекул в элементарной ячейке = 777 3; плотность (расчетная) = 1,297 г/см 3,где параметры элементарной ячейки формы М-1 измеряются при температуре около -50 С. В другом варианте осуществления М 2-1 форма характеризуется картиной симулированной порошковой рентгеновской дифракции (PXRD), существу, в соответствии со схемой, показанной на фиг. 5,и/или наблюдаемой картиной PXRD, существу, в соответствии со схемой, показанной на фиг. 5. В еще одном варианте осуществления М 2-1 форма соединения примера 2 характеризуется порошковой рентгенограммой (CuK =1,5418 при температуре около 25 С), содержащий четыре или более,предпочтительно пять или более, значений 2, выбранных из 8,20,2, 12,20,2, 14,20,2, 15,10,2,16,80,2, 17,30,2 и 23,00,2, где порошковая рентгенограмма формы М 2-1 измеряется при температуре около 20 С. В еще одном варианте осуществления М 2-1 форма соединения примера 2 характеризуется относительными координатами атомов, по существу, перечисленными в табл. 5. Таблица 5 Относительные координаты атомов формы М 2-1,рассчитанные при температуре около 25 С; координаты атомов (104) и эквивалентные параметры изотропного замещения (2103) примера 2, форма М 2-1U (экв) определяется как одна треть следа ортогонализованного тензора U1J. В еще одном варианте осуществления М 2-1 форма соединения примера 2 является, по существу,чистой. В еще одном варианте осуществления М 2-1 форма соединения примера 2 содержит по меньшей мере примерно 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу кристаллической формы, формы М 2-1. В еще одном варианте, по существу, чистая кристаллическая форма М 2-1 имеет, по существу, значительную фазовую гомогенность менее чем примерно с 10%, предпочтительно менее чем приблизительно 5% и более предпочтительно менее чем примерно 2% от общей площади пика экспериментально измеренной PXRD, вытекающие из пиков, которые отсутствуют в симулированной картине PXRD. Наиболее предпочтительно, чтобы, по существу, чистая кристаллическая форма М 2-1 имела, по существу,значительную фазовую гомогенность менее чем примерно с 1% от общей площади пика экспериментально измеренной порошковой рентгенограммы, вытекающей из пиков, которые отсутствуют в симулированной порошковой рентгенограмме. В другом варианте осуществления изобретения кристаллическая форма соединения примера 2, по существу, состоит из формы М 2-1. Кристаллическая форма этого варианта осуществления может содержать по меньшей мере примерно 90 мас.%, предпочтительно по меньшей мере около 95 мас.%, более предпочтительно по меньшей мере около 99 мас.% в расчете на массу кристаллической формы, формы М 2-1. Соединения в соответствии с формулой (I) могут быть введены любым способом, пригодным для состояния, подлежащего лечению, которое может зависеть от необходимости сайт-специфического лечения или количества соединения формулы (I), которое должно быть доставлено. Кроме того, настоящим изобретением охватывается класс фармацевтических композиций, содержащих соединение формулы (I) или его пролекарство и один или несколько нетоксичных фармацевтически приемлемых носителей, и/или разбавителей, и/или вспомогательных веществ (совместно именуемых в настоящем изобретении как "носители") и, при желании, другие активные ингредиенты. Соединения формулы (I) могут быть введены любым подходящим путем, предпочтительно в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предназначенного лечения. Соединения и композиции в соответствии с настоящим изобретением могут, например, быть введены перорально, через слизистые оболочки, или парентерально, в том числе внутривенно, внутривенно, внут- 27022530 рибрюшинно, подкожно, внутримышечно, внутригрудинно и в виде стандартных доз, содержащих обычные фармацевтически приемлемые носители, адъюванты и наполнители. Например, фармацевтический носитель может содержать смесь маннита или лактозы и микрокристаллическую целлюлозу. Смесь может содержать дополнительные компоненты, такие как смазывающее вещество, например стеарат магния, и дезинтегрирующий агент, такой как кросповидон. Смесь носителей может быть загружена в желатиновую капсулу или спрессована в виде таблетки. Фармацевтическая композиция может быть введена в виде пероральной лекарственной формы или инфузии, например. Для перорального введения фармацевтическая композиция может находиться в форме, например,таблетки, капсулы, суспензии или жидкости. Фармацевтическая композиция предпочтительно изготовляется в виде единичной дозы, содержащей конкретное количество активного ингредиента. Например,фармацевтическая композиция может быть представлена в виде таблетки или капсулы, содержащей количество активного ингредиента в интервале от около 1 до 2000 мг, предпочтительно от около 1 до 500 мг и более предпочтительно от около 5 до 150 мг. Подходящая суточная доза для человека или другого млекопитающего может широко варьироваться в зависимости от состояния пациента и других факторов, но может быть определена с помощью стандартных методов. Любую фармацевтическую композицию, рассматриваемую в настоящем изобретении, можно, например, вводить перорально через любые приемлемые и удобные пероральные препараты. Типичные препараты для перорального введения включают, но не ограничиваются этим, например, таблетки, пастилки, леденцы, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии,твердые и мягкие капсулы, сиропы и эликсиры. Фармацевтические композиции, предназначенные для перорального введения, могут быть получены в соответствии с любыми способами, известными в данной области техники для производства фармацевтических композиций, предназначенных для перорального введения. Для того чтобы обеспечить препараты с фармацевтически привлекательным вкусом, фармацевтическая композиция в соответствии с настоящим изобретением может содержать по меньшей мере один агент, выбранный из подсластителей, ароматизаторов, красителей, мягчительных средств, антиоксидантов и консервантов. Таблетка может, например, быть получена посредством смешивания по меньшей мере одного соединения формулы (I) по меньшей мере с одним нетоксичным фармацевтически приемлемым вспомогательным веществом, подходящим для изготовления таблеток. Типичные вспомогательные вещества включают, но не ограничиваются этим, например, инертные разбавители, такие как,например, карбонат кальция, карбонат натрия, лактоза, фосфат кальция и фосфат натрия; гранулирующие и дезинтегрирующие агенты, такие как, например, микрокристаллическая целлюлоза, кроскармеллоза натрия, кукурузный крахмал и альгиновая кислота, связующие агенты, такие как, например, крахмал,желатин, поливинилпирролидон и гуммиарабик, и смазывающие агенты, такие как, например, стеарат магния, стеариновая кислота и тальк. Кроме того, таблетки могут быть либо без покрытия, либо с покрытием с помощью известных методик, чтобы замаскировать плохой вкус неприятного вкуса лекарственной субстанции либо чтобы задержать дезинтеграцию и абсорбцию активного ингредиента в желудочнокишечном тракте, поддерживая тем самым эффект активного ингредиента в течение длительного периода. Примеры растворимых в воде материалов, маскирующих вкус, включают, но не ограничиваются этим, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу. Примеры материалов для задержки дезинтеграции включают, но не ограничиваются этим, этилцеллюлозу и ацетат бутират целлюлозы. Твердые желатиновые капсулы могут, например, быть приготовлены посредством смешивания по меньшей мере одного соединения формулы (I) по меньшей мере с одним инертным твердым разбавителем, таким как, например, карбонат кальция, фосфат кальция и каолин. Мягкие желатиновые капсулы могут, например, быть приготовлены посредством смешивания по меньшей мере одного соединения формулы (I) по меньшей мере с одним водорастворимым носителем,таким как, например, полиэтиленгликоль и по меньшей мере с одной масляной средой, такой как, например, арахисовое масло, жидкий парафин и оливковое масло. Водная суспензия может быть приготовлена, например, посредством смешивания по меньшей мере одного соединения формулы (I) по меньшей мере с одним вспомогательным веществом, пригодным для изготовления водных суспензий. Примеры вспомогательных веществ, пригодных для изготовления водных суспензий, включают, но не ограничиваются этим, например, суспендирующие агенты, такие как,например, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, альгиновая кислота, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующие или смачивающие агенты, такие как, например, природные фосфатиды, например лецитин,продукты конденсации алкиленоксида с жирными кислотами, такие как, например, стеарат полиоксиэтилена, продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, такие как,например, гептадекаэтиленоксиэтанол; продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гекситола, такие как, например, полиоксиэтилен-сорбитмоноолеат, и продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гекситола, такие как, например, полиэтилен-сорбитан-моноолеат. Водная суспензия может также содержать по меньшей мере один консервант, такой как, например, этил- и н-пропил- п-гидроксибензоат, по меньшей мере одно окрашивающее вещество, по меньшей мере один ароматизатор и/или по меньшей мере один подсластитель, включая, но не ограничиваясь этим, например,сахарозу, сахарин и аспартам. Масляные суспензии могут, например, быть получены посредством суспендирования по меньшей мере одного соединения формулы (I), в либо растительном масле, таком как,например, арахисовое масло, оливковое масло, кунжутное масло и кокосовое масло или в минеральном масле, таком как, например, жидкий парафин. Масляная суспензия может также содержать по меньшей мере один загуститель, такой как, например, пчелиный воск, твердый парафин и цетиловый спирт. Для того чтобы обеспечить масляной суспензии приемлемый вкус можно добавить к масляной суспензии по меньшей мере один из подсластителей, уже описанных выше, и/или по меньшей мере один ароматизатор. Масляная суспензия может дополнительно содержать по меньшей мере один консервант, включая, но не ограничиваясь этим, например, антиоксидант, такой как, например, бутилированный гидроксианизол и альфа-токоферол. Диспергируемые порошки и гранулы, могут, например, быть получены посредством смешивания по меньшей мере одного соединения формулы (I) по меньшей мере с одним диспергирующим и/или смачивающим агентом; по меньшей мере с одним суспендирующим агентом и/или по меньшей мере с одним консервантом. Подходящие диспергирующие агенты, смачивающие агенты и суспендирующие агенты являются теми, которые уже описаны выше. Типичные консерванты включают, но не ограничиваются этим, например, антиоксиданты, например аскорбиновую кислоту. Кроме того, диспергируемые порошки и гранулы могут также содержать по меньшей мере одно вспомогательное вещество, включая, но не ограничиваясь этим, например, подсластители, ароматизаторы и красители. Эмульсия по меньшей мере одного соединения формулы (I) может, например, быть получена в виде эмульсии масло-в-воде. Масляная фаза эмульсий, содержащая соединения формулы (I), может быть составлена из известных ингредиентов известным способом. Масляная фаза может быть предоставлена, но не ограничивается этим, например, растительным маслом, таким как, например, оливковое масло и арахисовое масло, минеральным маслом, таким как, например, жидкий парафин, а также их смесями. В то время как фаза может содержать только эмульгатор, она может содержать смесь по меньшей мере одного эмульгатора с жиром или маслом или как с жиром, так и маслом. Подходящие эмульгаторы включают,но не ограничиваются этим, например, природные фосфатиды, например соевый лецитин, сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гекситола, такие как,например, моноолеат сорбитана, и продукты конденсации неполных эфиров с этиленоксидом, такие как,например, моноолеат полиоксиэтиленсорбитана. Предпочтительно гидрофильный эмульгатор включается вместе с липофильным эмульгатором, который действует в качестве стабилизатора. Кроме того, предпочтительно включать как масло, так и жир. Вместе эмульгатор(ы) с или без стабилизатора(ов) готовят так называемый эмульгирующий воск, и воск вместе с маслом и жиром образуют так называемую эмульгирующую мазевую основу, которая образует масляную дисперсную фазу кремовых составов. Эмульсия может также содержать подсластитель, ароматизирующий агент, консервант и/или антиоксидант. Эмульгаторы и стабилизаторы эмульсии, пригодные для использования в композиции в соответствии с настоящим изобретением, включают Tween 60, Span 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат, лаурилсульфат натрия, глицерилдистеарат, один или вместе с воском, или другими материалами, хорошо известными в данной области техники. Соединения формулы (I) могут, например, также доставляться внутривенно, подкожно и/или внутримышечно посредством любой фармацевтически приемлемой и пригодной инъекционной формы. Типичные формы для инъекций включают, но не ограничиваются этим, например, стерильные водные растворы, содержащие приемлемые носители и растворители, такие как, например, вода, раствор Рингера и изотонический раствор хлорида натрия; стерильные микроэмульсии масло-в-воде и водные или масляные суспензии. Композиции для парентерального введения могут быть в виде водных или неводных изотонических стерильных инъекционных растворов или суспензий. Эти растворы и суспензии могут быть приготовлены из стерильных порошков или гранул с использованием одного или нескольких носителей или разбавителей, упоминающихся для использования в композициях для перорального введения или посредством использования других подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Эти соединения могут быть растворены в воде, полиэтиленгликоле, пропиленгликоле, этаноле,кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, хлориде натрия, трагакантовой камеди и/или в различных буферах. Другие адъюванты и способы введения хорошо и широко известны в фармацевтической области. Активный ингредиент может также вводиться посредством инъекции в виде композиции с подходящими носителями, включая физиологический раствор,декстрозу, или воду, или с циклодекстрином (т.е. CAPTISOL), сорастворителем солюбилизации (например, пропиленгликолем) или мицеллярной солюбилизации (например, Tween 80). Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей сре- 29
МПК / Метки
МПК: A61P 35/00, A61K 31/5513, C07D 243/24
Метки: бис-(фторалкил)-1,4-бензодиазепиноновые, соединения
Код ссылки
<a href="https://eas.patents.su/30-22530-bis-ftoralkil-14-benzodiazepinonovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Бис-(фторалкил)-1,4-бензодиазепиноновые соединения</a>
Предыдущий патент: Устройство для ввода внутриматочной системы
Следующий патент: Способ определения сейсмического атрибута по сейсмическим сигналам
Случайный патент: Цитрат 5,8,14-триазатетрацикло-(10.3.1.02,11.04,9)-гексадека-2 (11),3,5,7,9-пентаена