Солевые формы органического соединения
Формула / Реферат
1. Твердая соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина и фармацевтически приемлемой кислоты в стехиометрии 1:1, в форме сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата.
2. Твердая кислотно-аддитивная соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина с кислотой, выбранной из бромисто-водородной кислоты, фосфорной кислоты, азотной кислоты, серной кислоты, уксусной кислоты, 2,2-дихлоруксусной кислоты, адипиновой кислоты, аскорбиновой кислоты (D- или L-формы), аспартановой кислоты (D- или L-формы), бензолсульфоновой кислоты, бензойной кислоты, 4-ацетамидобензойной кислоты, камфорной кислоты ((+)- или (-)-формы), камфор-10-сульфоновой кислоты ((+)- или (-)-формы), каприновой кислоты (декановой кислоты), капроновой кислоты (гексановой кислоты), каприловой кислоты (октановой кислоты), угольной кислоты, коричной кислоты, лимонной кислоты, цикламиновой кислоты, додецилсерной кислоты, этан-1,2-дисульфоновой кислоты, этансульфоновой кислоты, 2-гидроксиэтансульфоновой кислоты, муравьиной кислоты, фумаровой кислоты, галактаровой кислоты, гентизиновой кислоты, глюкогептановой кислоты (D- или L-формы), глуконовой кислоты (D- или L-формы), глукуроновой кислоты (D- или L-формы), глутаминовой кислоты, глутаровой кислоты, 2-оксоглутаровой кислоты, глицерофосфорной кислоты, гликолевой кислоты, гиппуровой кислоты, изомасляной кислоты, молочной кислоты (D- или L-формы), лактобионовой кислоты, лауриновой кислоты, малеиновой кислоты, яблочной кислоты (D- или L-формы), малоновой кислоты, манделовой кислоты (D- или L-формы), метансульфоновой кислоты, нафталин-1,5-дисульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1-гидрокси-2-нафталиновой кислоты, никотиновой кислоты, олеиновой кислоты, оротовой кислоты, оксалиновой кислоты, пальмитиновой кислоты, памовой кислоты (эмбоновой кислоты), пропионовой кислоты, пироглутаминовой кислоты (D- или L-формы), салициловой кислоты, 4-аминосалициловой кислоты, себациновой кислоты, стеариновой кислоты, янтарной кислоты, винной кислоты (D- или L-формы), тиоциановой кислоты, толуолсульфоновой кислоты и ундециленовой кислоты, в форме ее сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата.
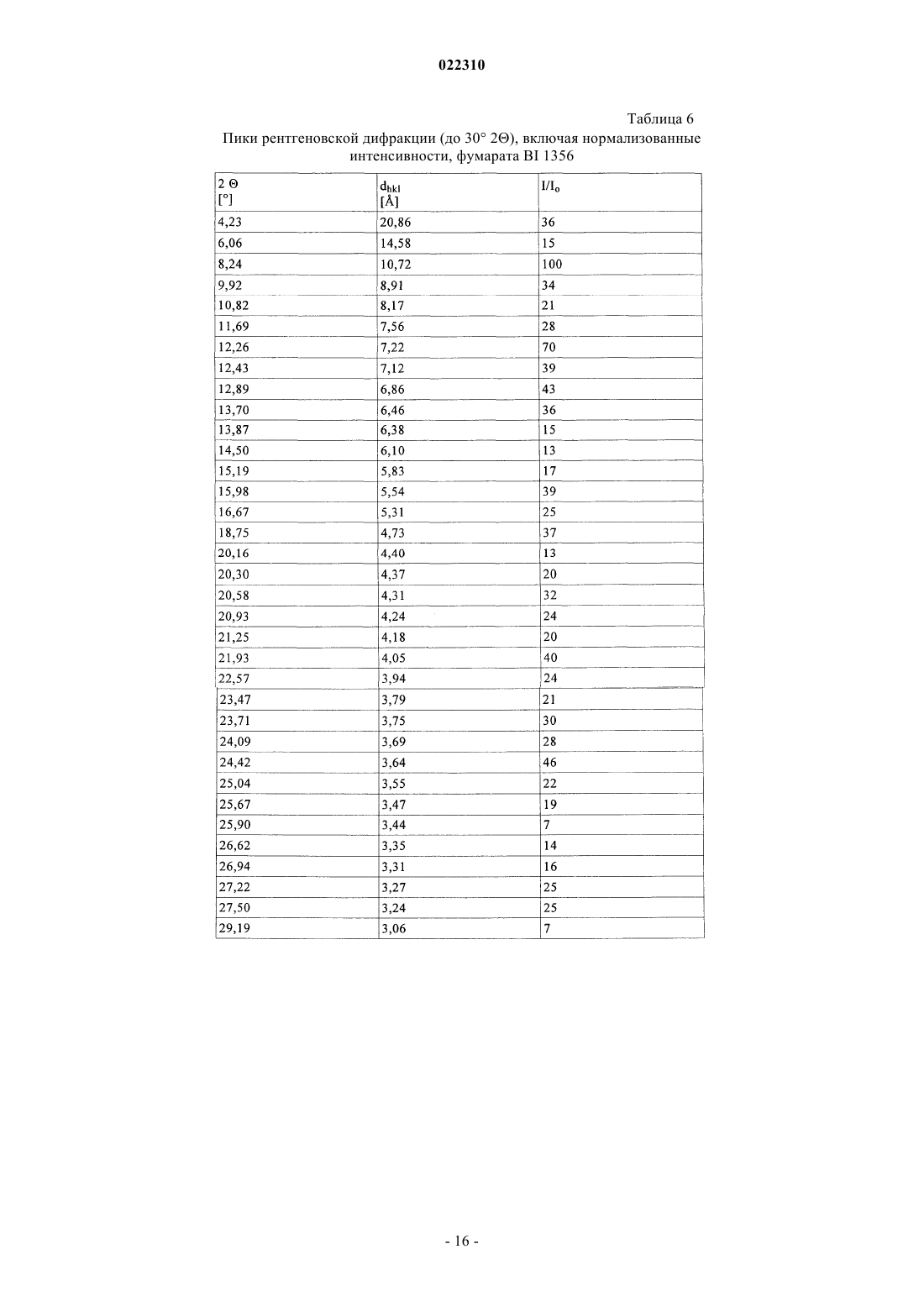
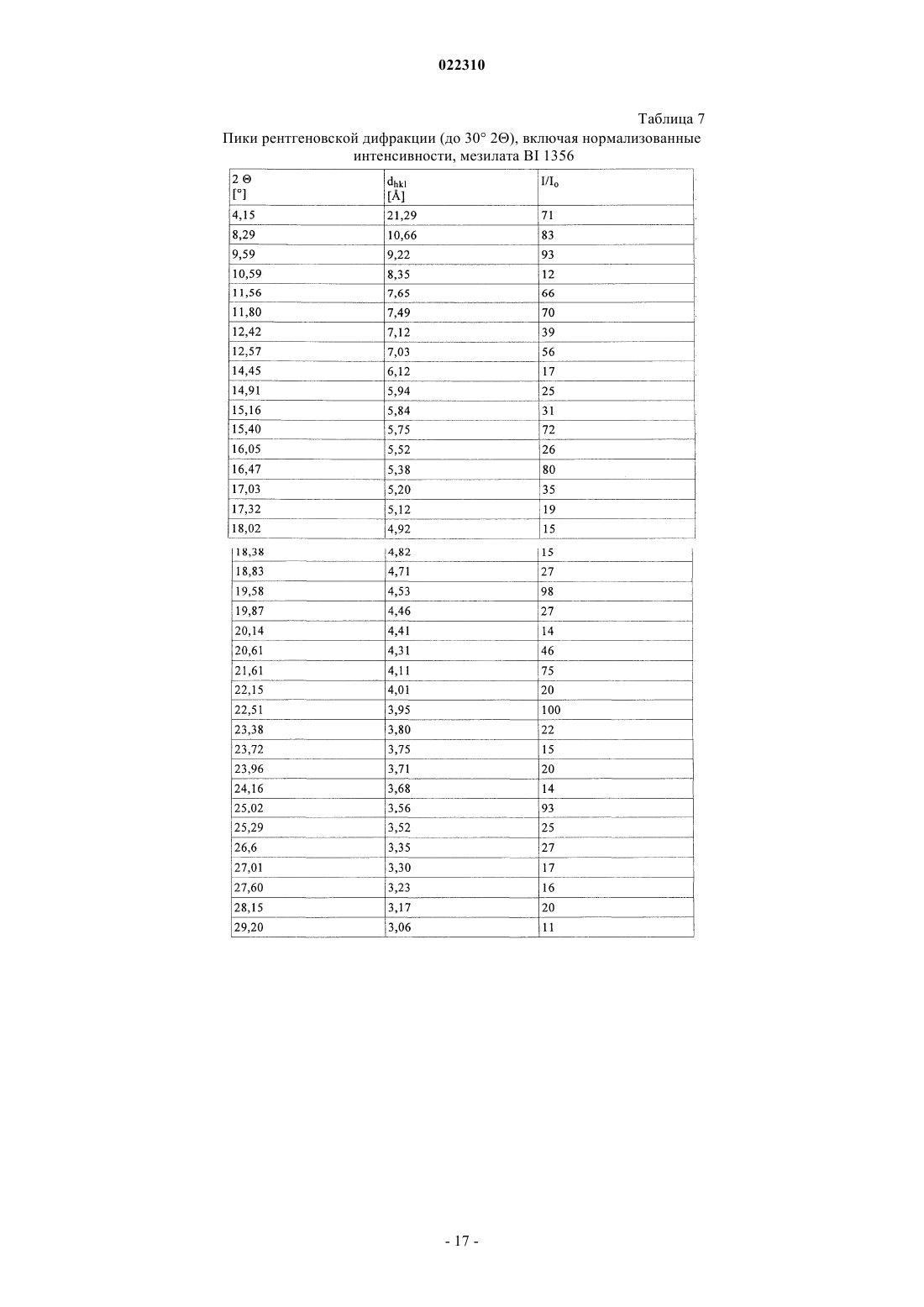
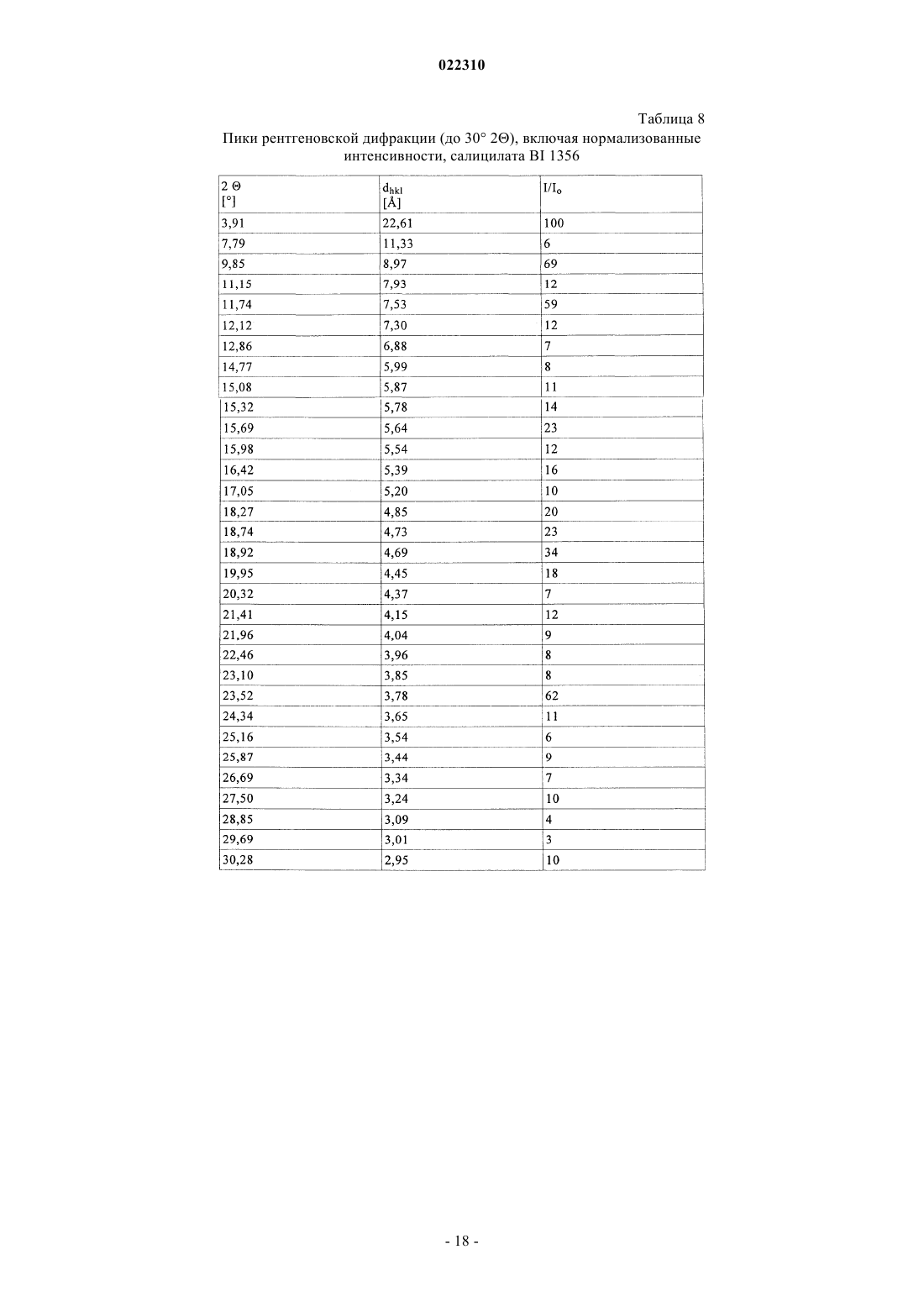
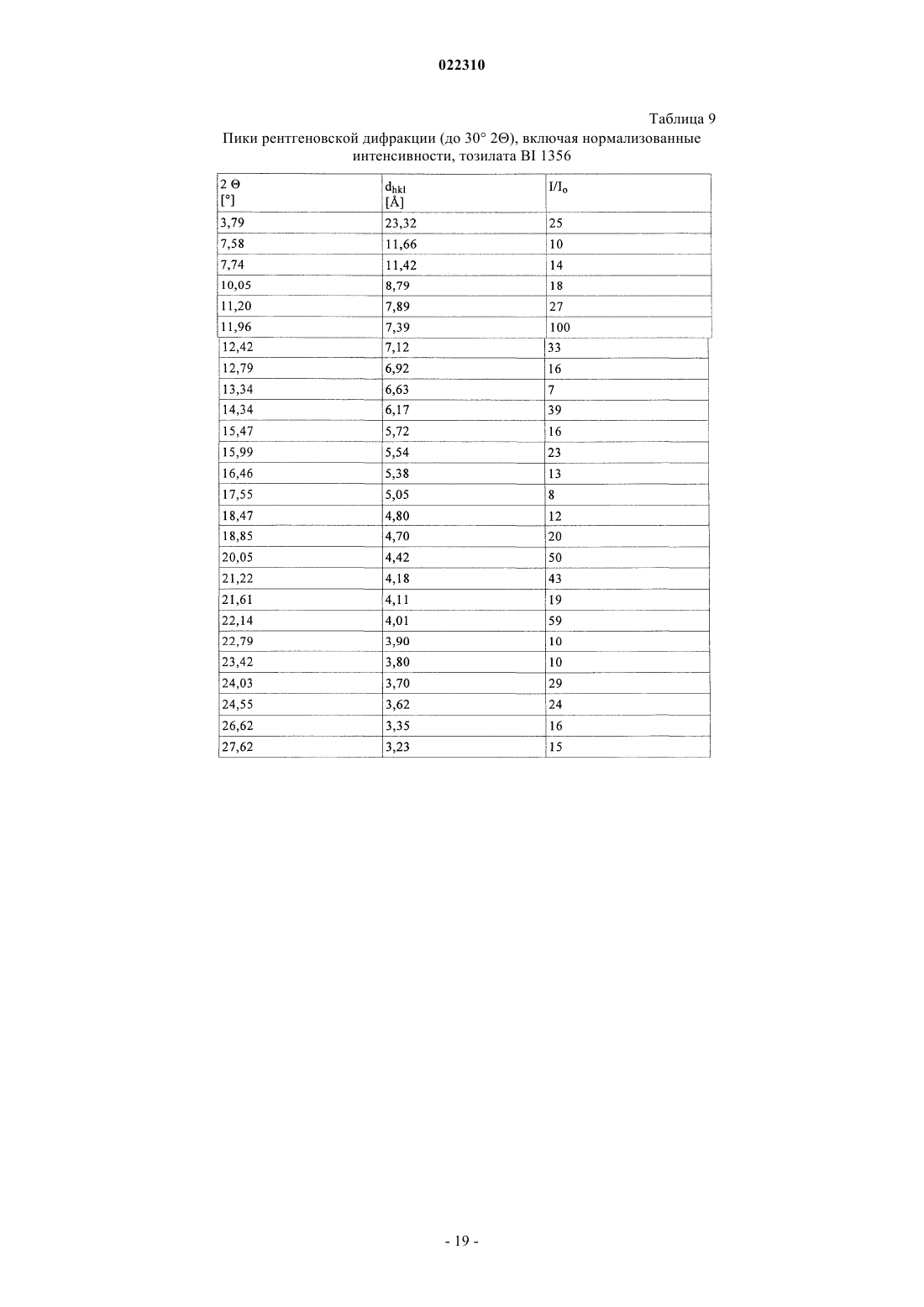
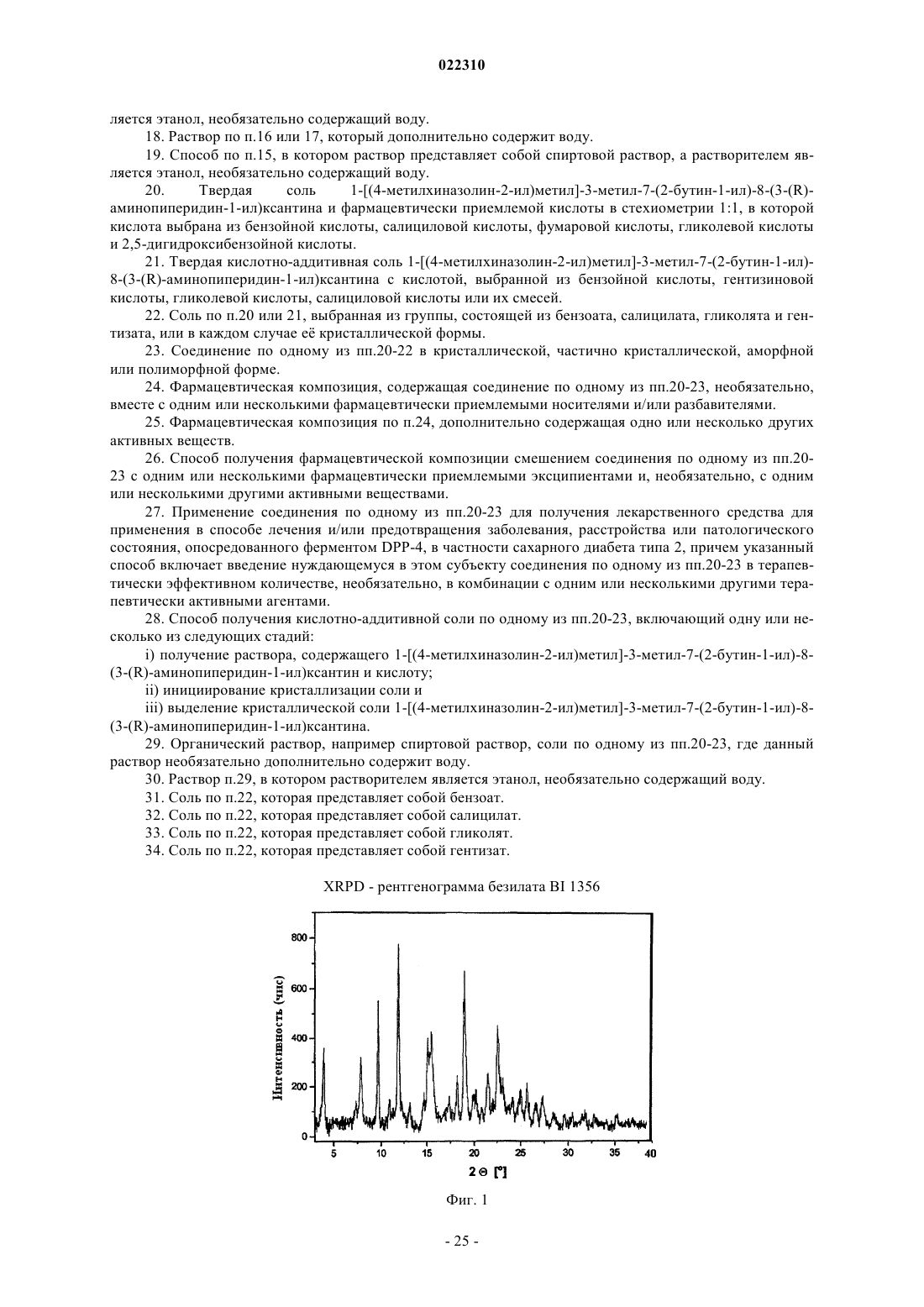
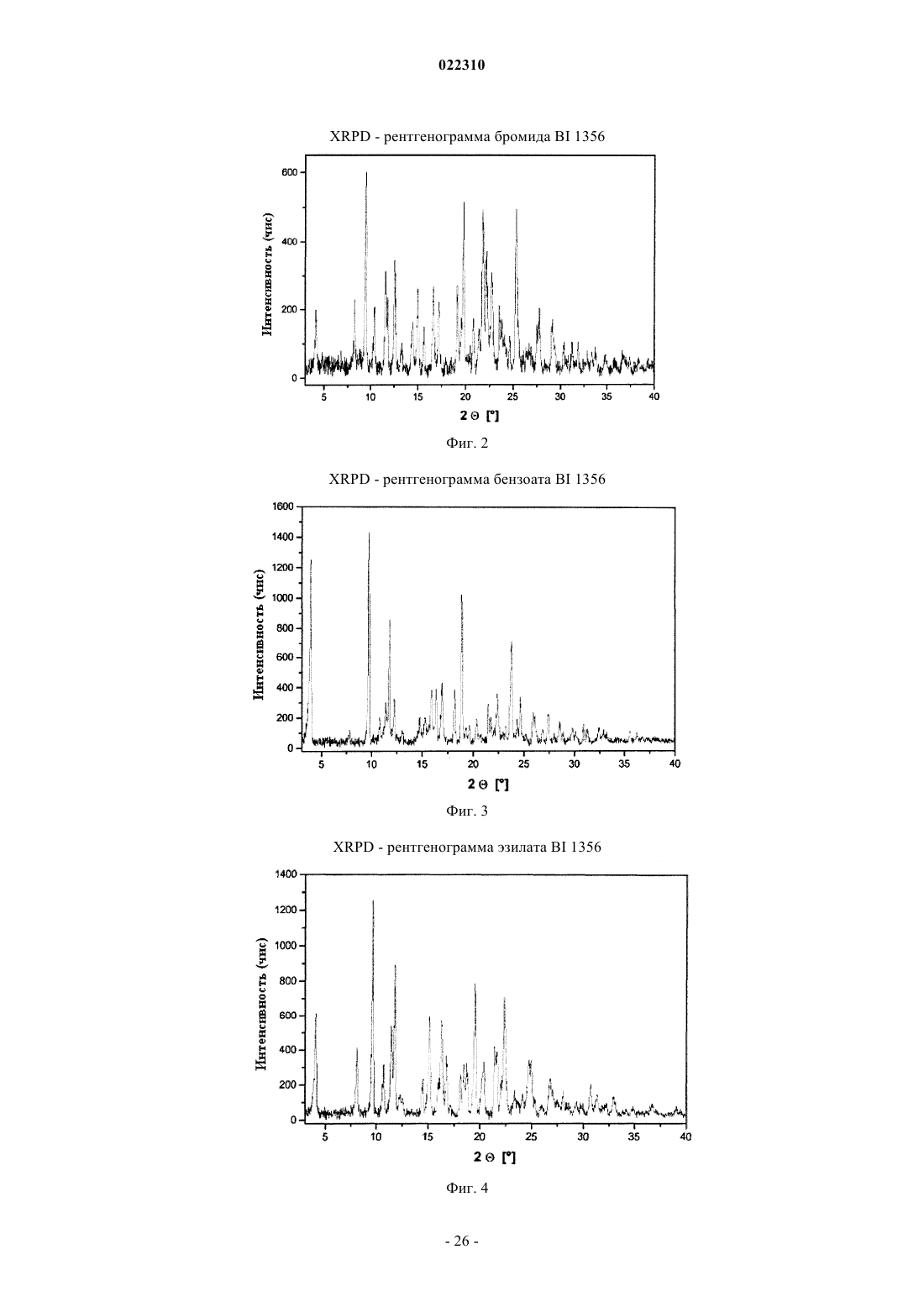
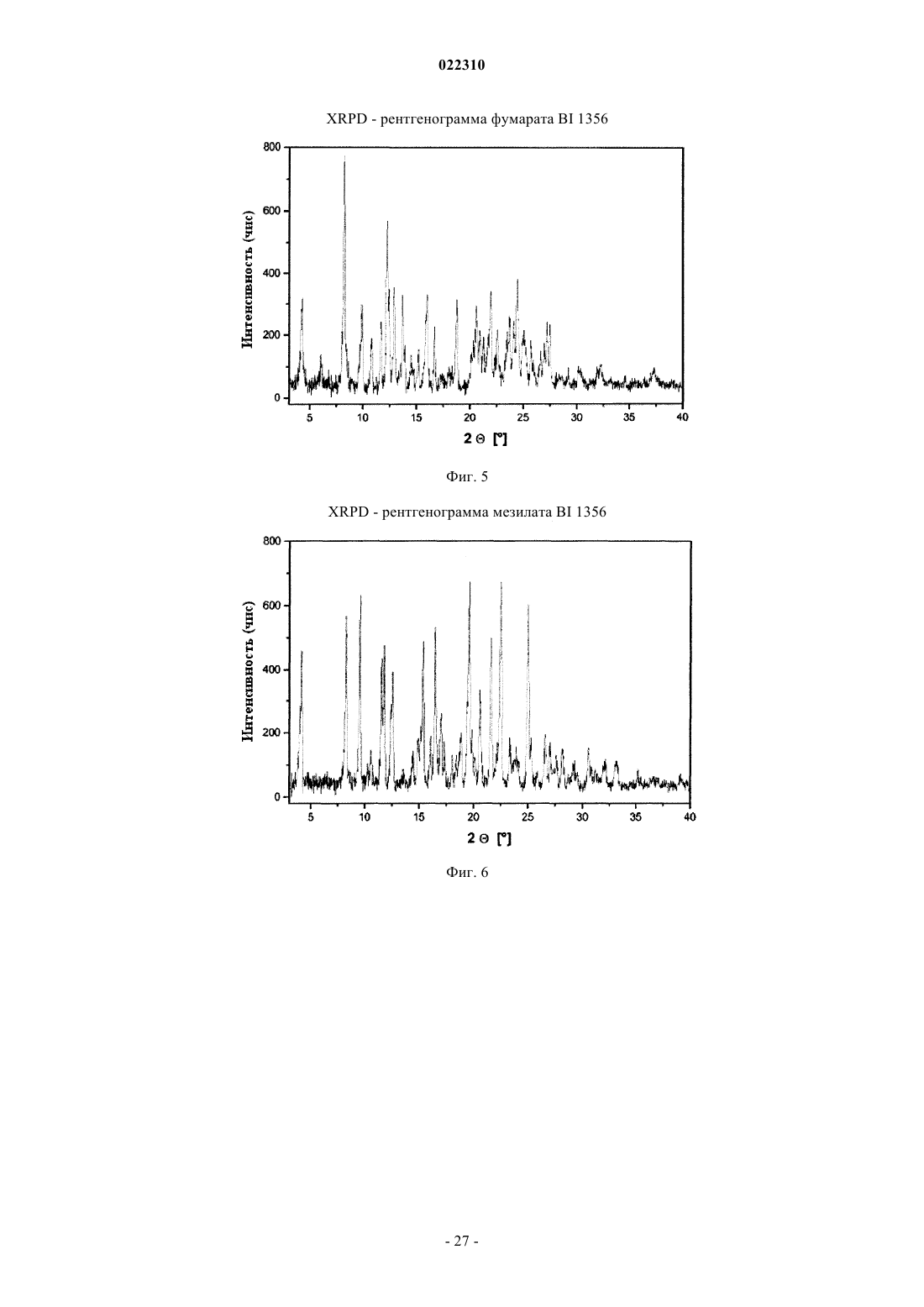
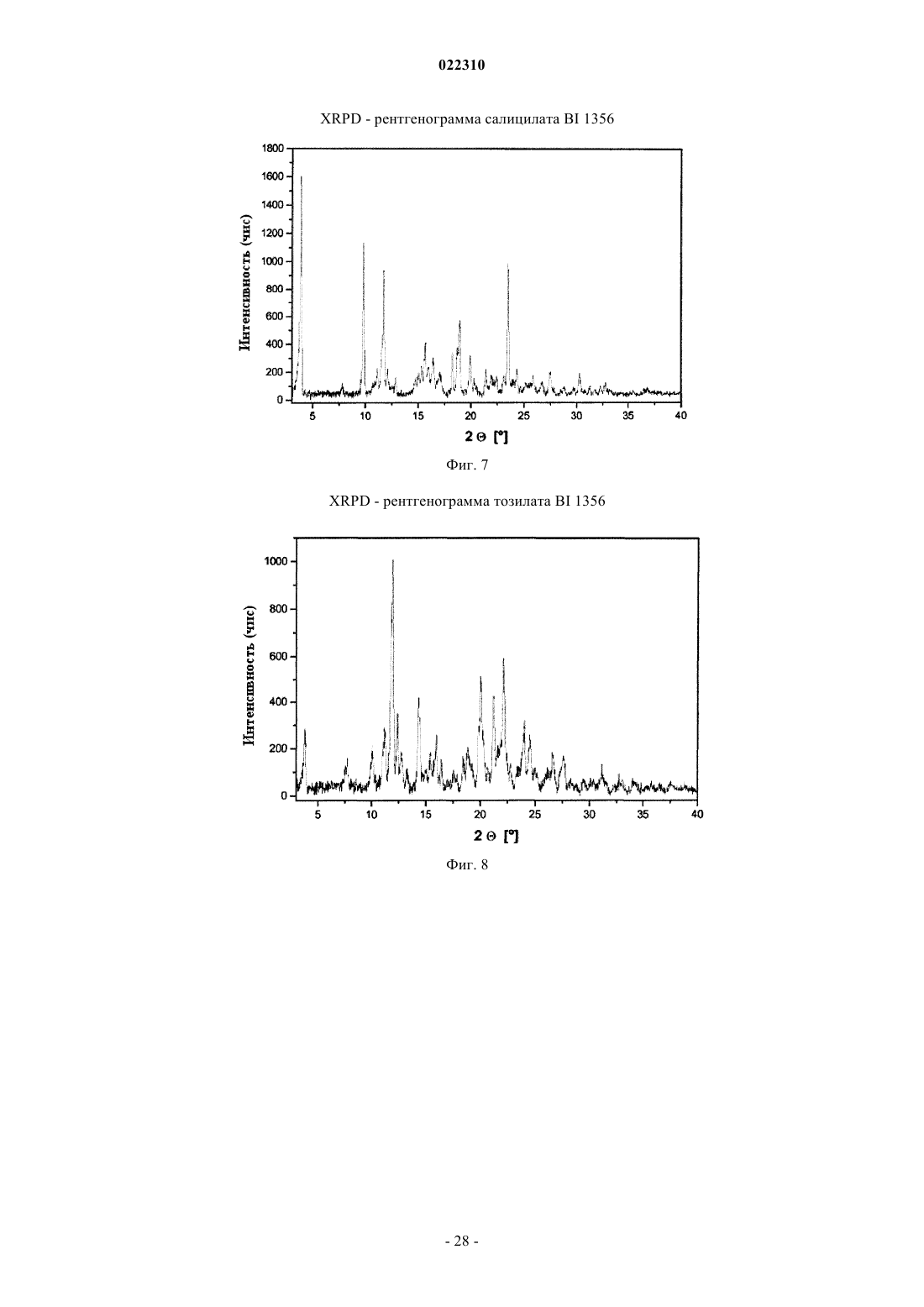
3. Соль по п.1 или 2, выбранная из группы, состоящей из безилата, гидробромида, бензоата, эзилата, фумарата, мезилата, салицилата, тозилата, гидрохлорида, гликолята, малоната и гентизата, в форме ее сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата, или в каждом случае ее кристаллические формы.
4. Соль по одному из пп.1-3 в форме сольвата.
5. Соль по одному из пп.1-4 в форме органического сольвата.
6. Соль по одному из пп.1-4 в форме этанолата.
7. Соль по одному из пп.1-4 в форме гидрата.
8. Соль по одному из пп.1-6 в форме смешанного гидрата/органического сольвата.
9. Соль по одному из пп.1-6 в форме смешанного гидрата/этанолата.
10. Соединение по одному из пп.1-9 в кристаллической, частично кристаллической, аморфной или полиморфной форме.
11. Фармацевтическая композиция, содержащая соединение по одному из пп.1-10, необязательно вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями.
12. Фармацевтическая композиция по п.11, дополнительно содержащая одно или несколько других активных веществ.
13. Способ получения фармацевтической композиции смешением соединения по одному из пп.1-10 с одним или несколькими фармацевтически приемлемыми эксципиентами и, необязательно, с одним или несколькими другими активными веществами.
14. Применение соединения по одному из пп.1-10 для получения лекарственного средства для применения в способе лечения и/или предотвращения заболевания, расстройства или патологического состояния, опосредованного ферментом DPP-4, в частности сахарного диабета типа 2, причем указанный способ включает введение нуждающемуся в этом субъекту соединения по одному из пп.1-10 в терапевтически эффективном количестве, необязательно, в комбинации с одним или несколькими другими терапевтически активными агентами.
15. Способ получения кислотно-аддитивной соли по одному из пп.1-10, включающий одну или несколько из следующих стадий:
i) получение раствора, содержащего 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин и кислоту;
ii) инициирование кристаллизации соли и
iii) выделение кристаллической соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина.
16. Органический раствор соли по одному из пп.1-10.
17. Раствор по п.16, в котором, раствор представляет собой спиртовой раствор, а растворителем является этанол, необязательно содержащий воду.
18. Раствор по п.16 или 17, который дополнительно содержит воду.
19. Способ по п.15, в котором раствор представляет собой спиртовой раствор, а растворителем является этанол, необязательно содержащий воду.
20. Твердая соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина и фармацевтически приемлемой кислоты в стехиометрии 1:1, в которой кислота выбрана из бензойной кислоты, салициловой кислоты, фумаровой кислоты, гликолевой кислоты и 2,5-дигидроксибензойной кислоты.
21. Твердая кислотно-аддитивная соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина с кислотой, выбранной из бензойной кислоты, гентизиновой кислоты, гликолевой кислоты, салициловой кислоты или их смесей.
22. Соль по п.20 или 21, выбранная из группы, состоящей из бензоата, салицилата, гликолята и гентизата, или в каждом случае ее кристаллической формы.
23. Соединение по одному из пп.20-22 в кристаллической, частично кристаллической, аморфной или полиморфной форме.
24. Фармацевтическая композиция, содержащая соединение по одному из пп.20-23, необязательно, вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями.
25. Фармацевтическая композиция по п.24, дополнительно содержащая одно или несколько других активных веществ.
26. Способ получения фармацевтической композиции смешением соединения по одному из пп.20-23 с одним или несколькими фармацевтически приемлемыми эксципиентами и, необязательно, с одним или несколькими другими активными веществами.
27. Применение соединения по одному из пп.20-23 для получения лекарственного средства для применения в способе лечения и/или предотвращения заболевания, расстройства или патологического состояния, опосредованного ферментом DPP-4, в частности сахарного диабета типа 2, причем указанный способ включает введение нуждающемуся в этом субъекту соединения по одному из пп.20-23 в терапевтически эффективном количестве, необязательно, в комбинации с одним или несколькими другими терапевтически активными агентами.
28. Способ получения кислотно-аддитивной соли по одному из пп.20-23, включающий одну или несколько из следующих стадий:
i) получение раствора, содержащего 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин и кислоту;
ii) инициирование кристаллизации соли и
iii) выделение кристаллической соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина.
29. Органический раствор, например спиртовой раствор, соли по одному из пп.20-23, где данный раствор необязательно дополнительно содержит воду.
30. Раствор п.29, в котором растворителем является этанол, необязательно содержащий воду.
31. Соль по п.22, которая представляет собой бензоат.
32. Соль по п.22, которая представляет собой салицилат.
33. Соль по п.22, которая представляет собой гликолят.
34. Соль по п.22, которая представляет собой гентизат.
Текст
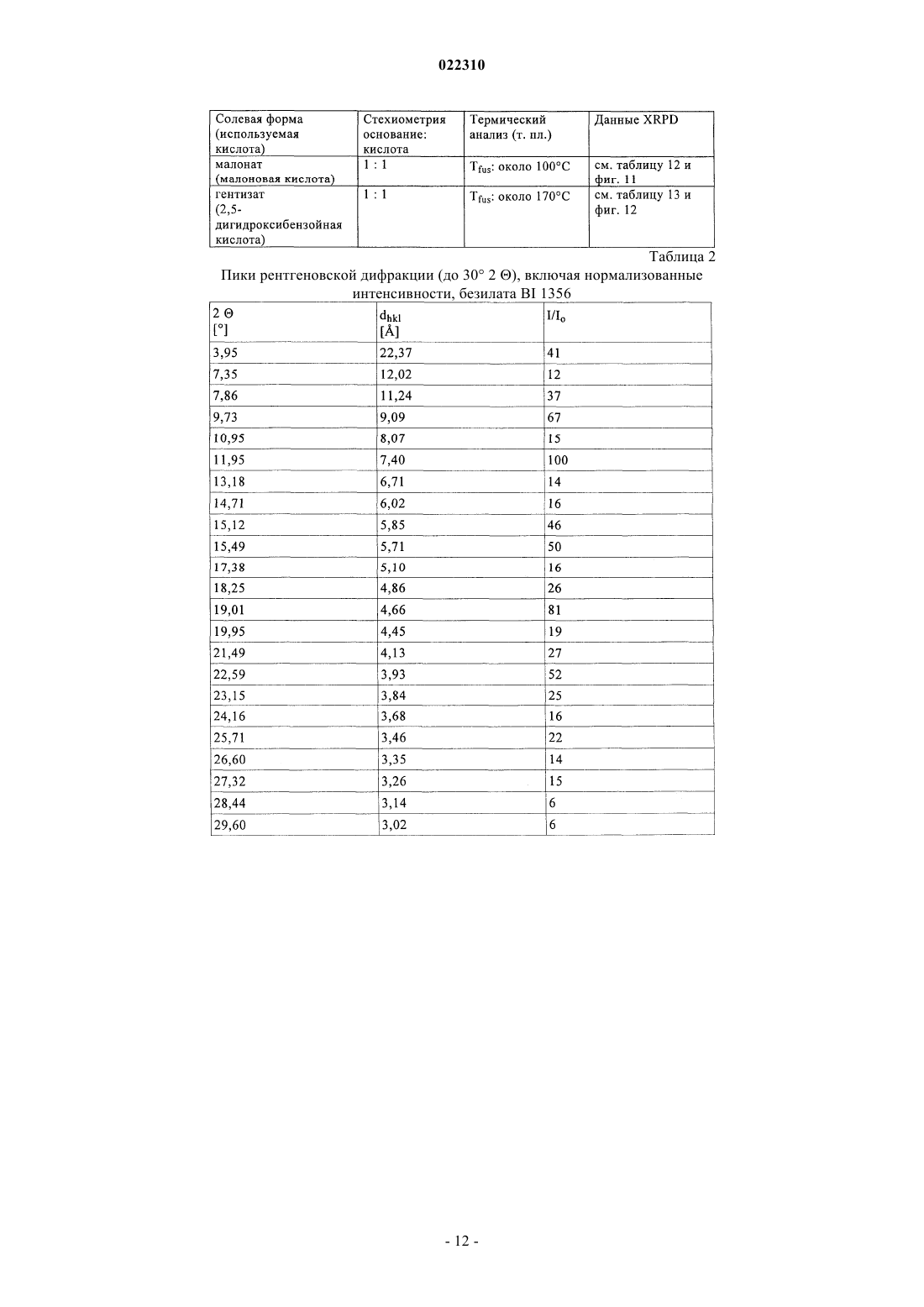
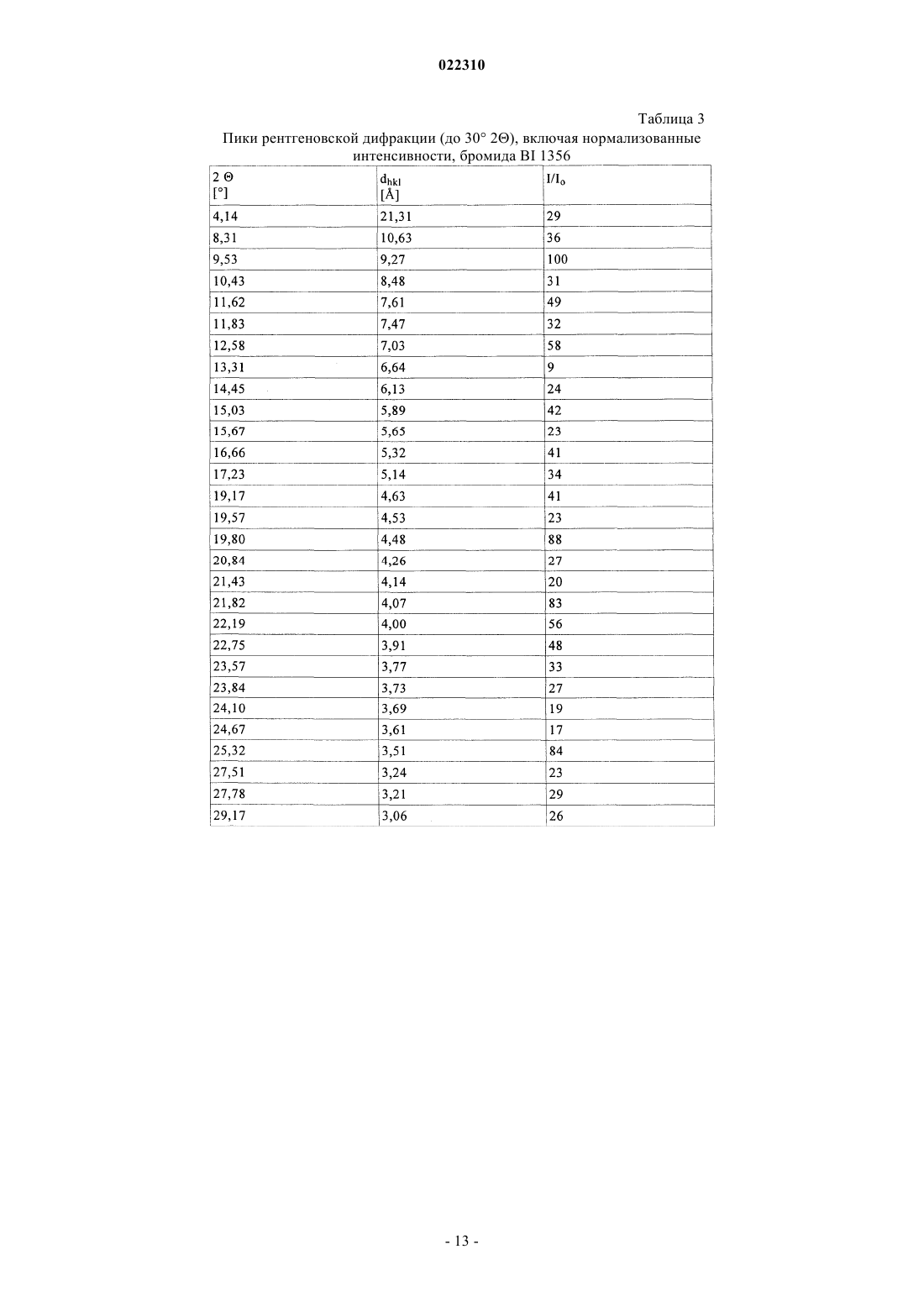
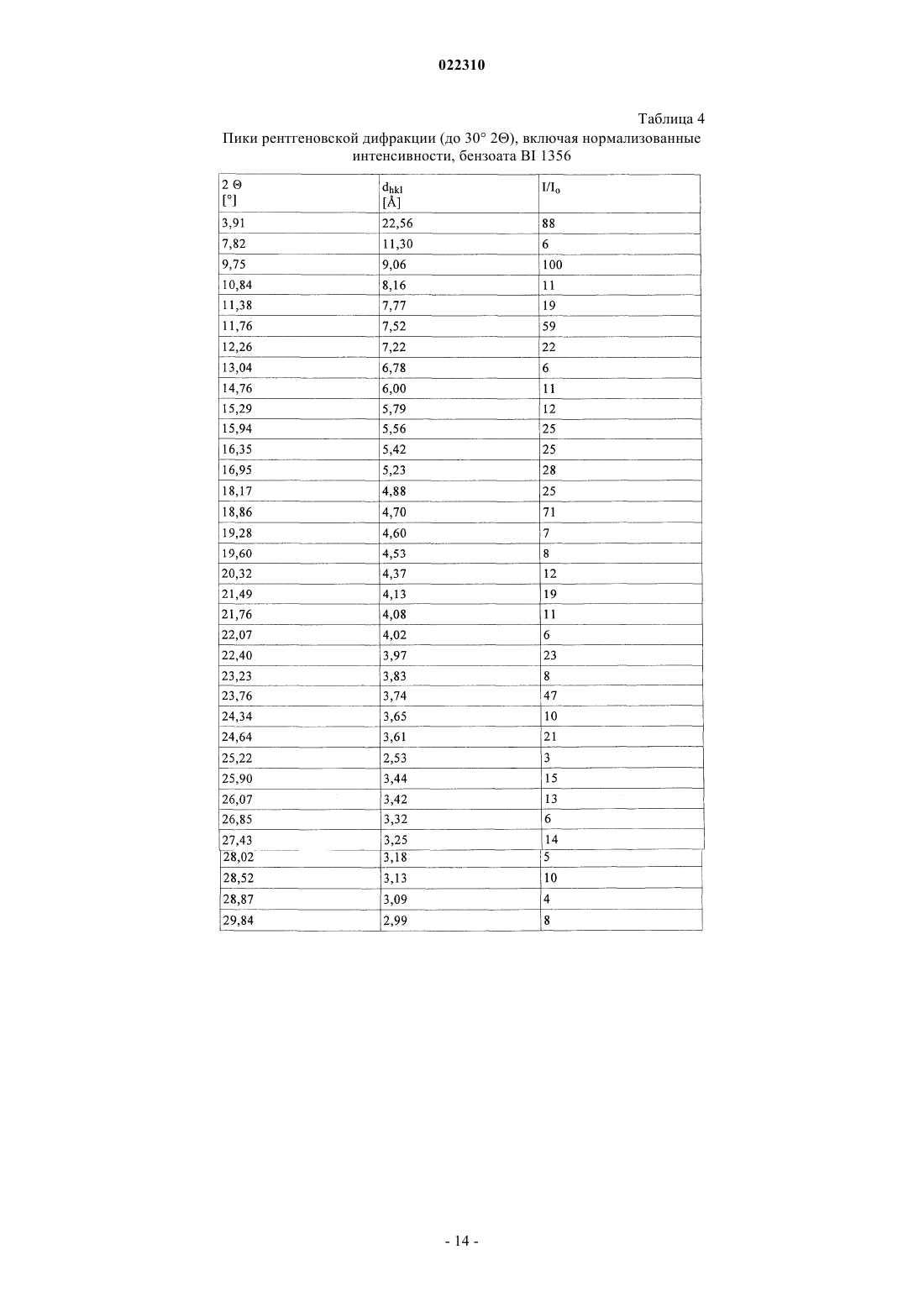
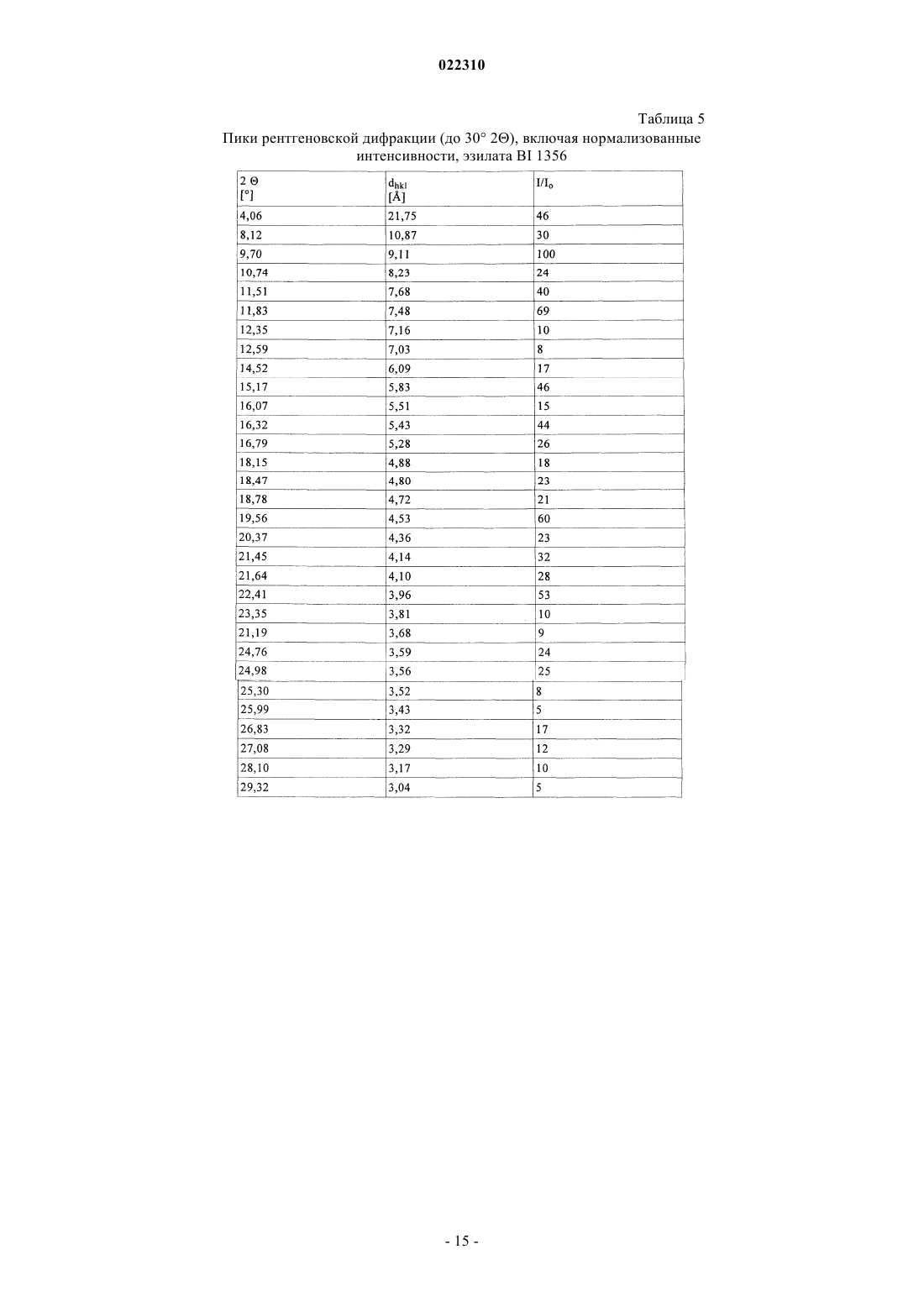
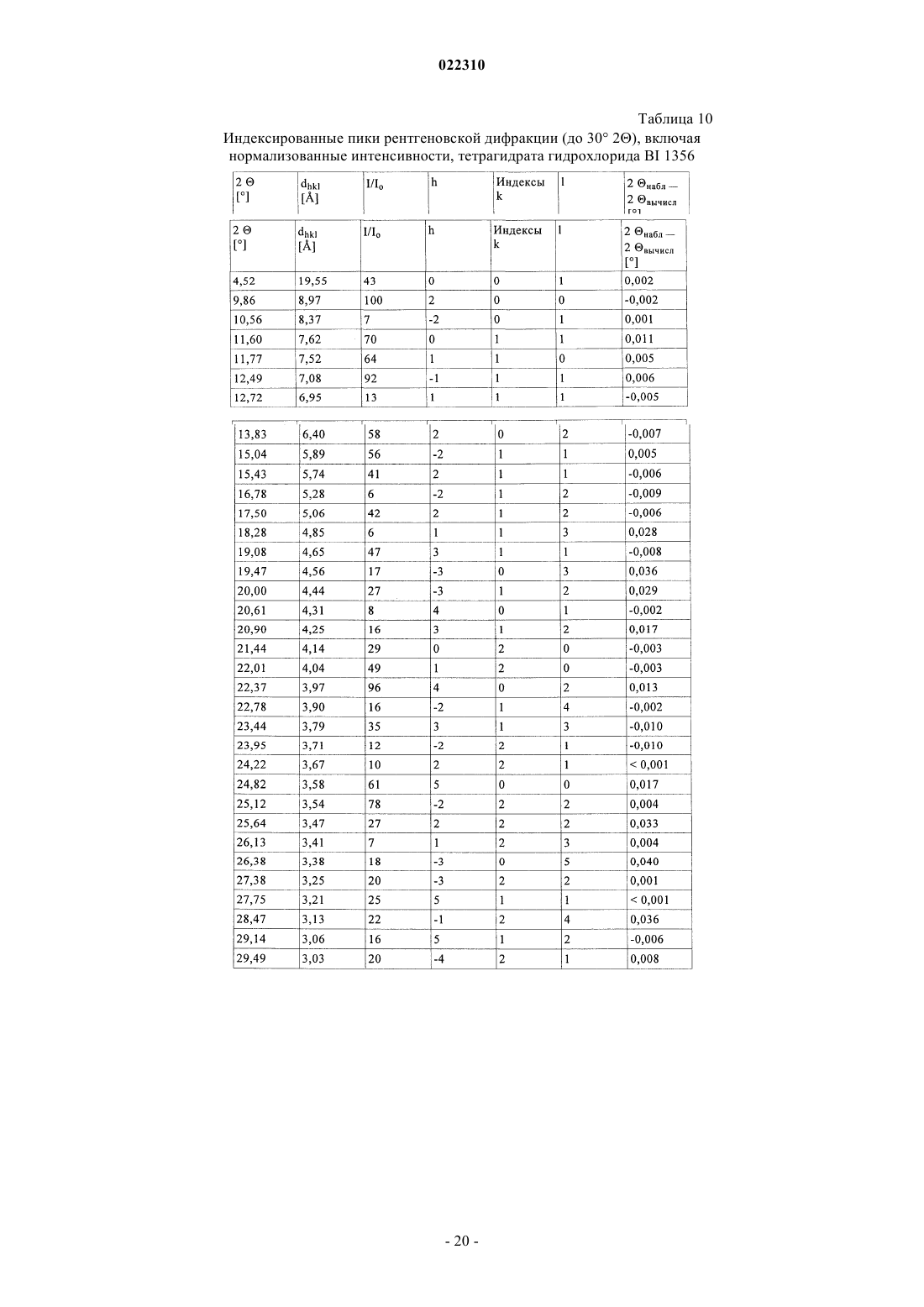
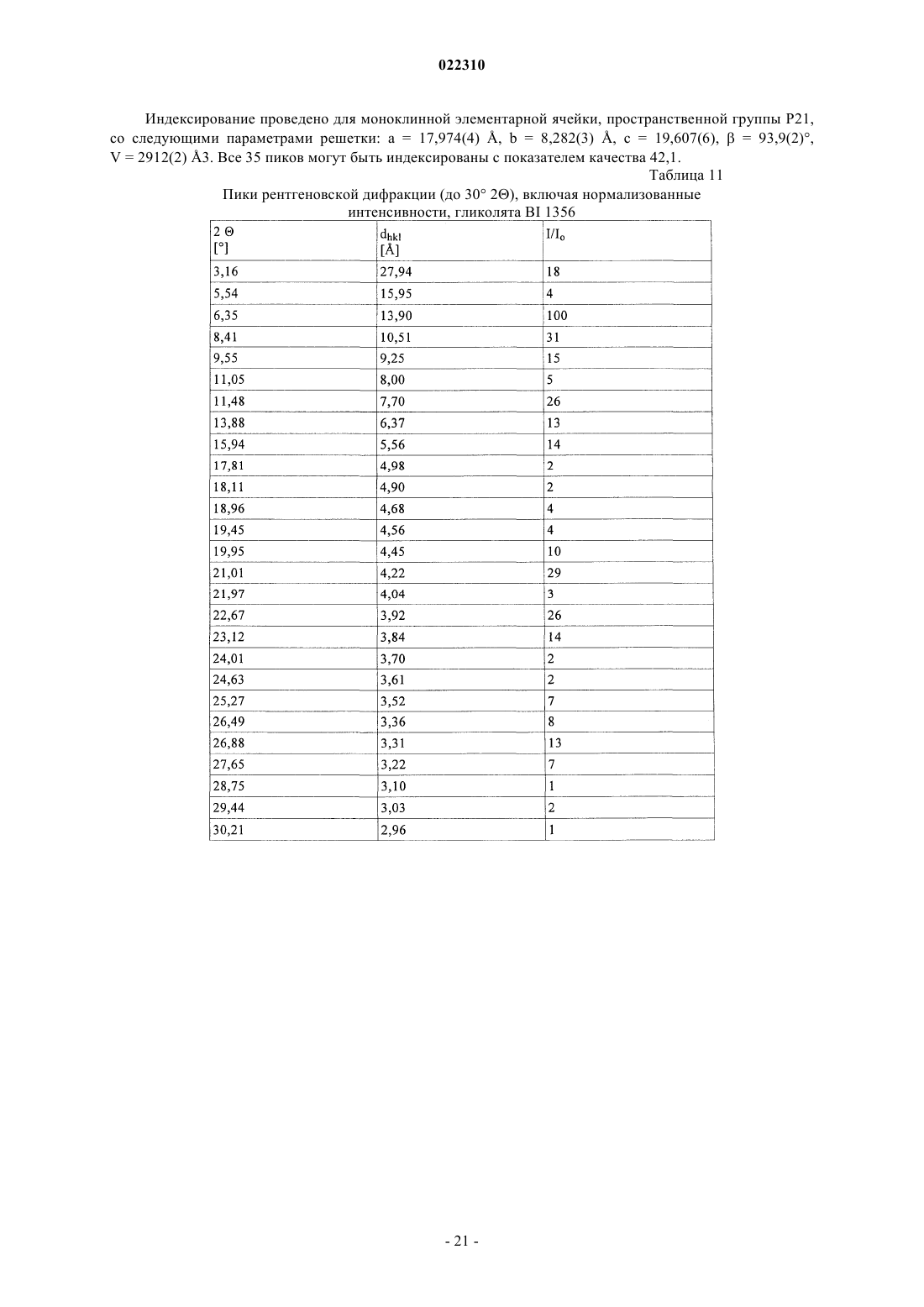
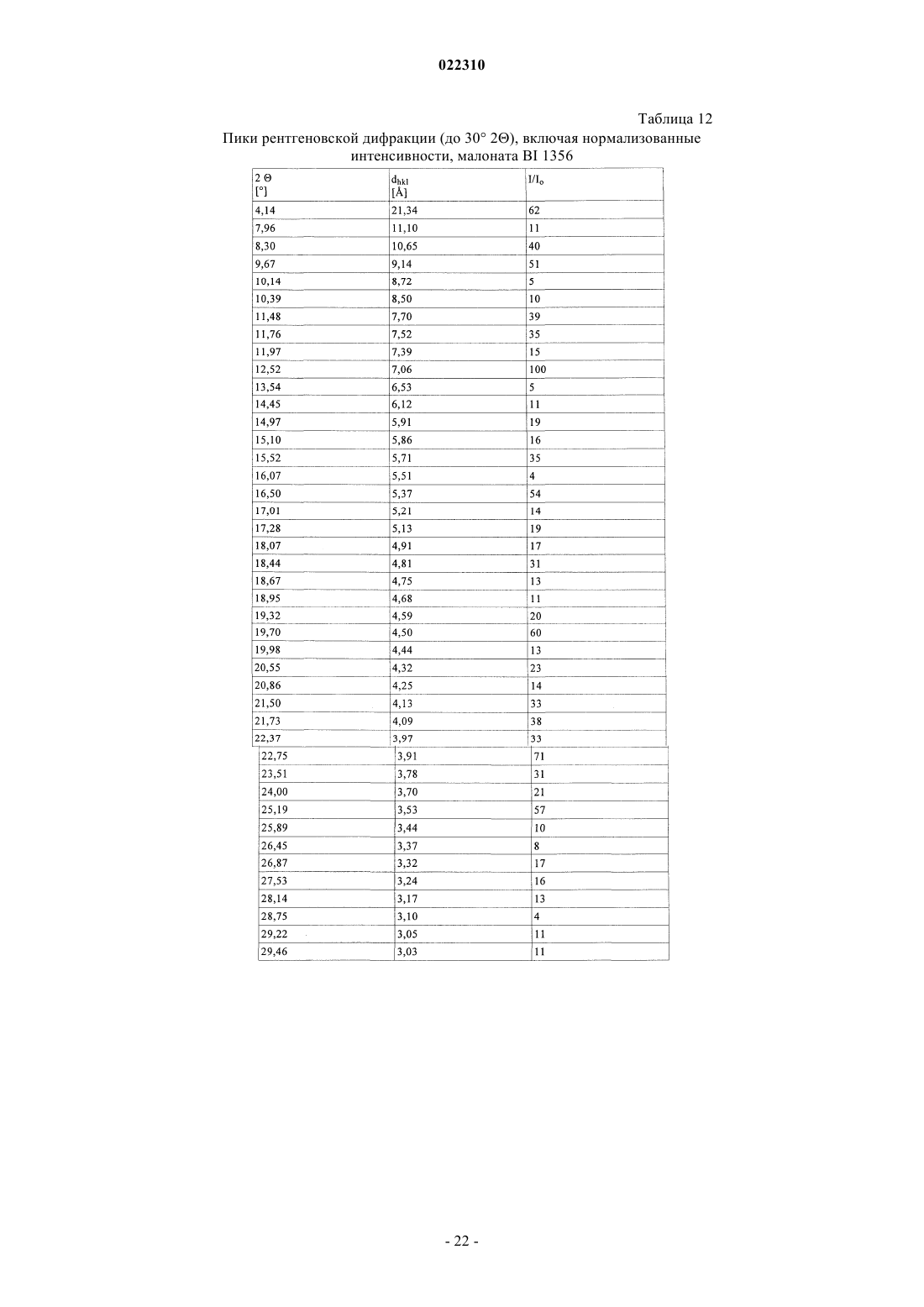
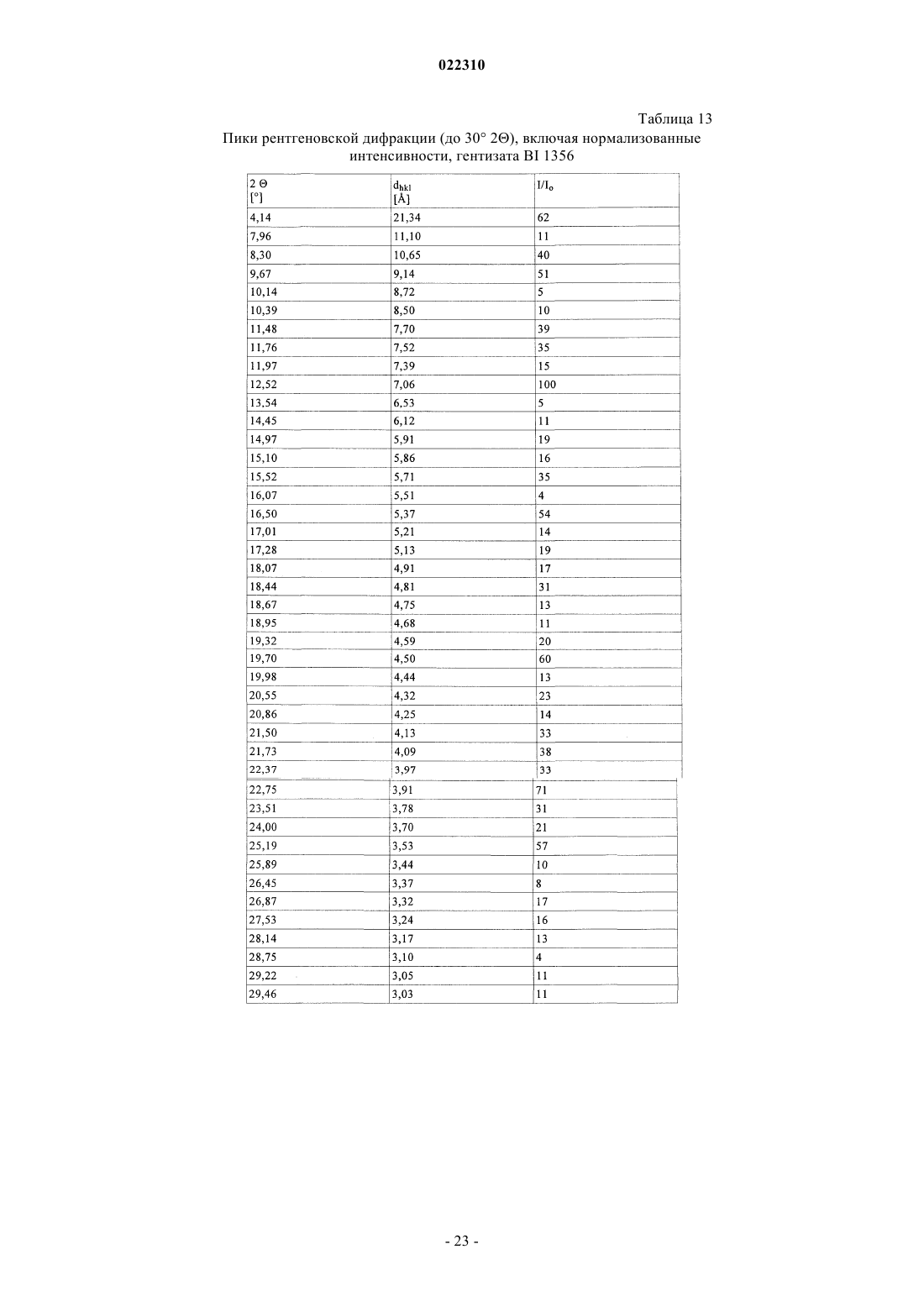
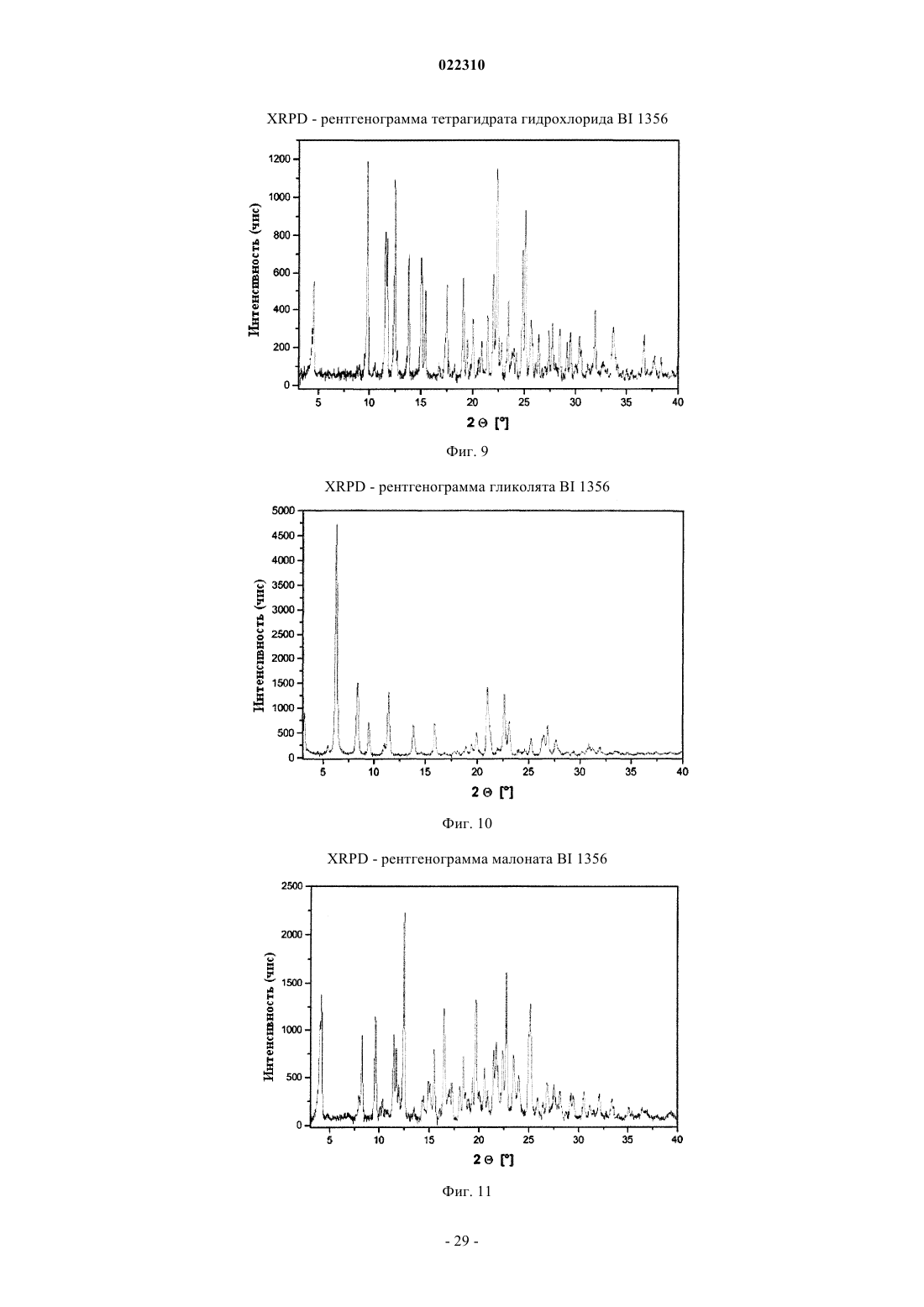
СОЛЕВЫЕ ФОРМЫ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ В изобретении описаны новые солевые формы ингибитора DPP-4 - 1-[(4-метилхиназолин-2 ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина, их применение в фармацевтических композициях, пригодных для лечения диабета типа 2, а также их получение.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к определенным солевым формам производного ксантина,а именно к определенным солевым формам фармацевтически активного соединения - 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантина, включая его аморфную и кристаллические формы (включая сольватные и гидратные формы), к способам их получения, а также к их применению в фармацевтических композициях. Также предложены способы лечения и/или предотвращения заболеваний, связанных с ферментом дипептидилпептидазы IV (DPP-4), таких как метаболические заболевания, в частности диабет (особенно сахарный диабет типа 2) и связанные с ним заболевания, с использованием данных соединений, необязательно, в комбинации с одним или несколькими другими активными соединениями. В основном соли, сольваты, гидраты, полиморфы, кристаллические и аморфная формы данного соединения зачастую отличаются строением кристаллов и/или свойствами кристаллического твердого состояния, и, таким образом, они могут обладать различными физическими и фармацевтическими свойствами, такими как форма, плотность, твердость, способность к деформации, стабильность, чистота, гигроскопичность, сыпучесть, слеживаемость, растворимость и/или разложение и т.п., которые могут оказывать влияние, например, на их получение, пригодность для переработки, фармакокинетический профиль(например, биодоступность), стабильность лекарственного средства (срок хранения), способность к введению и/или к образованию составов и т.п., как, например, их пригодность в виде твердой, полутвердой или жидкой фармацевтической лекарственной формы, например, в виде таблеток, капсул, суспензий,растворов, суппозиториев или других фармацевтических лекарственных форм (включая составы с замедленным высвобождением или комбинацию составов, включающих другой активный ингредиент). Ряд производных ксантина в качестве ингибиторов DPP-4 известен из уровня техники. Фермент DPP-4 (дипептидилпептидазы IV), также известный как GD26, представляет собой серинпротеазу, способствующую отщеплению дипептида от N-терминального конца ряда белков, содержащих на N-терминальных концах пролиновый или аланиновый остаток. Благодаря данному свойству ингибиторы DPP-4 влияют на уровень плазмы биоактивных пептидов, включая пептид GLP-1, и могут быть рассмотрены в качестве перспективных лекарственных средств для лечения сахарного диабета. Например, ингибиторы DPP-4 и их применение, в частности их применение в метаболических (особенно диабетических) заболеваниях, раскрыты в WO 2002/068420, WO 2004/018467, WO 2004/018468,WO 2004/018469, WO 2004/041820, WO 2004/046148, WO 2005/051950, WO 2005/082906,WO 2005/063750, WO 2005/085246, WO 2006/027204, WO 2006/029769, WO 2007/014886,WO 2004/050658, WO 2004/111051, WO 2005/058901, WO 2005/097798, WO 2006/068163,WO 2007/071738, WO 2008/017670, WO 2007/128721 или WO 2007/128761. 1-[(4-Метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантин является орально активным ингибитором DPP-4, терапевтически значимым для лечения сахарного диабета типа 2, ожирения и родственных заболеваний. В настоящее время обнаружено, что определенные соли 1-[(4-метилхиназолин-2-ил)метил]-3 метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина обладают неожиданными и полезными свойствами. Так, настоящее изобретение относится к соединениям, представляющим собой кислотноаддитивные соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин 1-ил)ксантина, в частности фармацевтически приемлемым кислотно-аддитивным солям с органическими или неорганическими кислотами. Особо следует отметить физиологически приемлемые соли с неорганическими или органическими кислотами, обычно используемыми в фармацевтике, такими как, например,упомянутые далее неорганические и органические кислоты. Соли включают водонерастворимые и особенно водорастворимые соли. Неорганические кислоты, обычно используемые для получения фармацевтически приемлемых кислотно-аддитивных солей, включают, в качестве примера и без ограничения, соляную кислоту, бромистоводородную кислоту, фосфорную кислоту, азотную кислоту, серную кислоту и т.п. Органические кислоты, обычно используемые для получения фармацевтически приемлемых кислотно-аддитивных солей, включают, в качестве примера и без ограничения, уксусную кислоту,2,2-дихлоруксусную кислоту, адипиновую кислоту, аскорбиновую кислоту (D- или L-форму, особенно(D- или L-форму), малоновую кислоту, манделовую кислоту (D- или L-форму), метансульфоновую кислоту,нафталин-1,5-дисульфоновую кислоту,нафталин-2-сульфоновую кислоту,1-гидрокси-2-нафталиновую кислоту, никотиновую кислоту, олеиновую кислоту, оротовую кислоту, оксалиновую кислоту, пальмитиновую кислоту, памовую кислоту (эмбоновую кислоту), пропионовую кислоту, пироглутаминовую кислоту (D- или L-форму, особенно L-форму), салициловую кислоту,4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, винную кислоту (D- или L-форму), тиоциановую кислоту, толуолсульфоновую кислоту (в частности, н-изомер),ундециленовую кислоту и т.п. Класс упомянутых выше органических кислот включает карбоновые кислоты и их производные. Другой класс упомянутых выше органических кислот включает сульфоновые кислоты и их производные. Кислоты могут быть одноосновными или полиосновными, примерами полиосновных кислот являются двухосновные или трехосновные кислоты. Полиосновные кислоты могут быть в зависимости от природы, по существу, один, два и три раза депротонированы, обычно один раз депротонированы. Например, в солях карбоновых кислот кислоты могут быть моно- или поликарбоновыми кислотами,имеющими одну или, соответственно, две или более карбоксильных группы. В первом подклассе солей поликарбоновых кислот поликарбоновые кислоты могут быть, по существу, один раз депротонированы,как, например, в случае соли дикарбоновой кислоты, имеющей стехиометрическое соотношение свободного соединения и дикарбоновой кислоты 1:1. Во втором подклассе солей поликарбоновых кислот стехиометрическое соотношение полиосновной карбоновой кислоты и свободного соединения может, по существу, составлять 1:1, независимо от количества карбоксильных групп в кислоте. Подгруппа вышеупомянутых неорганических или органических кислот включает, в качестве примера и без ограничения, уксусную, адипиновую, L-аскорбиновую, капроновую, угольную, лимонную,фумаровую, галактаровую, D-глукогептановую, D-глуконовую, D-глукуроновую, глутаминовую, глицерофосфорную, гиппуровую, соляную, D- или L-молочную, лауриновую, малеиновую, (-)-L-яблочную,фосфорную, себациновую, янтарную, серную, (+)-L-винную и тиоциановую кислоту. Другая подгруппа вышеупомянутых неорганических или органических кислот включает, в качестве примера и без ограничения, альгининовую, бензолсульфоновую, (+)-камфорную, каприловую, цикламиновую, додецилсерную, этан-1,2-дисульфоновую, этансульфоновую, 2-гидроксиэтансульфоновую, гентизиновую, 2-оксоглутаровую, изомасляную, лактобионовую, малоновую, метансульфоновую, нафталин 1,5-дисульфоновую, нафталин-2-сульфоновую, 1-гидрокси-2-нафтойную, никотиновую, олеиновую, оротовую, памовую, пропионовую, (-)-L-пироглутаминовую и п-толуолсульфоновую кислоту. Кислоты используются для получения солей в зависимости, являются ли они моно- или полиосновными, и от вида требуемой соли, в эквимолярном количественном отношении или отличаться от него на единицу. Таким образом, в кислотно-аддитивных солях настоящего изобретения кислота и свободное соединение могут находиться в стехиометрическом соотношении, составляющем, по существу, 1:1 или отличаться от него на единицу, например от около 1:2 до около 2:1. Также возможны дробные стехиометрические соотношения, такие как, например, 1:1,5 или 1,5:1. Определенная подгруппа кислотно-аддитивных кислот неорганических или органических кислот включает, в качестве примера и без ограничения, гидрохлорид, мезилат, гидробромид, ацетат, фумарат,сульфат, сукцинат, цитрат, фосфат, малеат, тартрат, лактат, бензоат и карбонат. Другая определенная подгруппа кислотно-аддитивных кислот неорганических или органических кислот включает, в качестве примера и без ограничения, гидрохлорид, сульфат, тартрат, малеат, цитрат,фосфат, ацетат, лактат и фумарат. Изобретение также включает смеси солей. Кроме того, любая указанная в настоящем описании соль включает все таутомеры, гидраты, сольваты, кристаллические, аморфные и полиморфные формы, а также их смеси. Специалист в данной области может предположить, какое органическое соединение может быть выделено совместно с молекулами растворителя или может образовать комплексы с растворителями, в которых они вступают в реакции или в которых они выпадают в осадок, из которых кристаллизуются или выделяются. В соответствии со знаниями эксперта некоторые соли настоящего изобретения могут содержать, например, в случае выделения в твердой форме переменное или фиксированное количество растворителей (включая водные и/или неводные растворители). В объем настоящего изобретения также включены сольваты (включая гидраты, органические сольваты и смешанные гидраты/органические сольваты) солей настоящего изобретения. Сольваты солевых форм настоящего изобретения включают стехиометрические и нестехиометрические сольваты. Предпочтительно используемым(и) растворителем(ями) является(ются) фармацевтически приемлемый(ые) растворитель(и), например вода и/или этанол и т.п. Настоящее изобретение охватывает как несольватированные, так и все сольватированные формы. Также настоящее изобретение охватывает все гидратные, безводные, гигроскопичные и/или негигроскопичные формы. Другой объект настоящего изобретения относится к соединениям, представляющим собой сольваты солей данного изобретения или в простой, как, например, сольваты, включающие один органический растворитель или только воду, или в смесевой форме, как, например, смешанные сольваты, включающие по меньшей мере один органический растворитель, такой как, например, низкомолекулярный алифатический спирт, с водой (например, смешанные гидраты/сольваты) или смешанные сольваты, включающие по меньшей мере два разных органических растворителя, с или без воды, в любом смесевом соотношении, включая гомосольваты (сольваты, в которых исключительно один тип растворителя) или гетеросольваты (сольваты, содержащие два или более различных типа растворителей). В качестве более конкретного примера сольваты солей настоящего изобретения включают гидраты и алкоголяты (сольваты со спиртом, например, таким как этанол), а также их смеси (включая смешанные гидраты/алкоголяты). Один или несколько растворителей могут присутствовать в нестехиометрическом или стехиометрическом количестве, таком как, например, молярное соотношение 0,5:1, 1:1, 1,5:1, 2:1, 3:1 или 4:1, исходя из количества несольватированной соли. В том случае, если кристаллические формы сольватированы,они могут содержать, например, до четырех молекул растворителя, чаще до двух или трех молекул, например одну молекулу растворителя или две молекулы растворителей. Также могут быть получены нестехиометрические сольваты, в которых количество молекул растворителя составляет меньше одного или даже не целое число. Так, например, если присутствует менее одной молекулы растворителя, то может быть, например, 0,4, 0,5, 0,6, 0,7, 0,8 или 0,9 молекул растворителя на молекулу соединения. Например, сольваты или гидраты солей настоящего изобретения включают, без ограничения, полу-, моно-, сескви-, ди-, три- и тетрасольваты или гидраты соответственно. Стехиометрические и нестехиометрические смешанные сольваты таких гидратов с одним или несколькими органическими растворителями (например, со спиртом, в частности этанолом) в любой смеси также рассматриваются в настоящем изобретении. В конкретном варианте настоящее изобретение относится к гидратам, сольватам с этанолом (этанолатам) и смешанным гидратам/этанолатам солей изобретения. В сольватах настоящего изобретения молекулы растворителя могут быть включены в твердую структуру (например, они могут удерживаться в кристаллах после выделения) или нет (например, они могут удерживаться на поверхности кристаллов). Когда растворитель или вода являются прочно связанными, данный комплекс будет иметь хорошо определенную стехиометрию, независимо от влажности. Однако, когда растворитель или вода являются слабо связанными, как в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях нестехиометрические количества будут нормой. Фармацевтически неприемлемые соли (включая их сольваты и гидраты), которые могут быть получены, например, в качестве продуктов процесса при производстве в промышленном масштабе, могут быть превращены в фармацевтически приемлемые соли (включая их сольваты и гидраты), с использованием хорошо известных специалисту из уровня техники методов, например, посредством обмена или замены соли и/или растворителя, или через свободное от соли и/или растворителя соединение (без или с выделением). Соли (включая сольваты, гидраты и/или другие формы), которые не пригодны для фармацевтических применений, но могут быть использованы, например, для выделения свободного 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина или его фармацевтически приемлемых солей (включая сольваты, гидраты и/или другие формы), также входят в настоящее изобретение. Конкретный вариант осуществления изобретения относится к кислотно-аддитивной соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина,выбранной из безилата, гидробромида, бензоата, эзилата, фумарата, мезилата, салицилата, тозилата, гидрохлорида, гликолята, малоната и гентизата, также как к ее сольватам, в частности органическим сольватам, гидратам и смешанным органическим сольватам/гидратам. Соли (включая их сольваты, гидраты и/или иные формы) настоящего изобретения могут быть получены хорошо известными специалисту методами для получения кислотно-аддитивных солей. Так, данные соли могут быть получены (например, in situ) в результате заключительной реакции, удаления защитной группы, выделения, очистки и/или другой переработки свободного соединения (или пролекарства, прекурсора или соединений, содержащих защитную группу) или посредством взаимодействия свободного соединения с необходимой кислотой или подходящим анионообменным реагентом, например посредством способа, включающего одну или более стадий, описанных в настоящем документе. Обычно свободное соединение объединяют с необходимой кислотой, например, посредством растворения, диспергирования или суспендирования свободного соединения в подходящем растворителе или смеси растворителей, содержащем(ей) необходимую кислоту, или необходимую кислоту (необязательно растворенную в подходящем растворителе или смеси растворителей) добавляют после, или наоборот, с или без нагревания. Так, растворение, смешение и/или взаимодействие могут быть осуществлены при температуре окружающей среды или при повышенной температуре (например, от 30 до 70 С или от 40 до 60 С) или при температуре кипения используемого(ых) растворителя(ей). Так, для получения растворов могут быть использованы температуры вплоть до 100 С. Соли могут быть выделены фильтрованием, кристаллизацией, осаждением, например перекристаллизацией из подходящего растворителя для перекристаллизации или смеси растворителей, с использованием общепринятой методики (например, методики, аналогичной или подобной описанной ранее) и/или, при необходимости, способ может дополнительно включать на соответствующем этапе удаление и отделение любого нежелательного материала или нежелательных примесей, и в заключение, необязательно, соли промывают и/или сушат. В основном растворители, которые могут быть рассмотрены специалистом в данном изобретении,могут включать, без ограничения, органические, неводные или водные, протонные или апротонные, полярные или неполярные растворители, такие как кетоны, например ацетон, метилэтилкетон, метилпропилкетон, метилтрет- или изобутилкетон и т.п., лактоны, например валеролактон, простые эфиры, например диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран,диоксан и т.п., углеводороды, например толуол, гексан и т.п., хлорированные углеводороды, например метиленхлорид, хлороформ и т.п., низкомолекулярные алифатические спирты, например метанол, этанол, 1-пропанол, изопропанол, бутанол и т.п., сложные эфиры, например низшие алкиловые эфиры уксусной кислоты (например, этилацетат) и т.п., амиды или лактамы, такие как N,N-диметилформамид, Nметил-2-пирролидон и т.п., нитрилы, например ацетонитрил и т.п., или сульфоксиды, например ДМСО и т.п., или их смеси. Подходящие растворители или нерастворители могут быть определены посредством теста на растворимость в различных растворителях. В данном изобретении в качестве конкретных растворителей могут быть отмечены органические растворители, полностью или частично смешивающиеся с водой. Так, например, подходящим растворителем для образования соли и/или кристаллизации является низкомолекулярный алифатический спирт,например этанол, необязательно, в комбинации с водой. Другой объект настоящего изобретения относится к способу получения соли изобретения, в частности, в кристаллической форме, включающему одну или несколько из следующих стадий:i) получают раствор, содержащий 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3(R)-аминопиперидин-1-ил)ксантин и кислоту, такую как любая из описанных в настоящем документе фармацевтически приемлемых кислот, в частности кислоту, используемую в приведенных далее примерах;iii) выделяют кристаллическую соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8(3-(R)-аминопиперидин-1-ил)ксантина. В варианте осуществления данного способа 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин 1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин и кислота имеют стехиометрическое соотношение 1:1. В другом варианте осуществления данного способа взаимодействие и/или (пере)кристаллизация могут быть осуществлены в спирте (в частности, этаноле), необязательно, в присутствии воды. Полученные соли могут быть превращены в другие соли, например, посредством реакции с соответствующей кислотой или при помощи подходящего ионообменника. Подобным образом полученные соли могут быть превращены в свободные соединения (например, через нейтрализацию подходящим основанием, с или без выделения свободного основания, например экстракцией), которые в свою очередь могут быть превращены в соли посредством добавления кислоты. Данным образом физиологически неприемлемые соли могут быть превращены в физиологически приемлемые соли. Еще один объект настоящего изобретения относится к солям изобретения (включая их сольваты и гидраты) в твердой форме, включая аморфные, полуаморфные, полиморфные, полукристаллические и кристаллические формы, а также их смеси. Для более детального примера изобретение относится к солям (включая их сольваты и гидраты,смешанные или нет) изобретения, в частично кристаллической форме (например, в которых содержание кристаллического вещества составляет от около 5 до 20%), также как и, по существу, в кристаллической форме (например, в которых содержание кристаллического вещества составляет более чем приблизительно 20, 30, 40, 50, 60, 70, 80, 90 или 95%). Наличие кристаллических форм и степень (%) кристалличности могут быть определены специалистом посредством порошковой рентгеновской дифракции (XRPD). Также могут быть использованы другие методы, такие как ЯМР твердого тела, Фурье-ИК-спектроскопия, рамановская спектроскопия, дифференциальная сканирующая калориметрия (ДСК) и микрокалориметрия. Кристаллические формы и полиморфы солей настоящего изобретения могут быть охарактеризованы температурой плавления (полученной, например, методом ДСК) или соответствующими данными или порошковой рентгенограммой, включающей основные пики (например, с относительной интенсивностью более чем или равной примерно 10, 20 или 25% или т.п.), как показано далее в примерах. В качестве примера кристаллическая форма гидрохлорида настоящего изобретения имеет такую порошковую рентгенограмму, как, по существу, определена в табл. 10 и/или, по существу, представлена на фиг. 9. Кристаллические формы и полиморфы могут быть получены посредством кристаллизации соединения настоящего изобретения. Могут быть использованы различные методики кристаллизации для получения и выделения кристаллических соединений и полиморфов, например методики, описанные в настоящем документе, такие как кристаллизация или осаждение из подходящего растворителя или смеси растворителей, перемешивание суспензии (фазовое равновесие), суспендирование, выпаривание растворителя, самопроизвольное или принудительное охлаждение до необходимой температуры для инициирования кристаллизации, применение подходящих режимов регулирования охлаждением от очень быстрой до очень медленной скорости охлаждения при кристаллизации, воздействие подходящим давлением,применение затравочных кристаллов, перекристаллизация, фильтрование, промывка (например, в кристаллизационном растворе) и/или сушка (например, при пониженном давлении и/или при повышенной температуре). Кристаллические формы также могут быть получены нагреванием или плавлением полученных форм, с последующим постепенным или быстрым охлаждением. Данным образом одна полиморфная или одна кристаллическая форма может быть превращена в другую. Другой объект изобретения относится к солям изобретения (включая их сольваты, гидраты, полиморфы, кристаллические и аморфные формы), по существу, в чистой форме (например, по существу,свободной от примесей и/или других форм), например, при степени чистоты соответствующей формы примерно 80, 85, 90, 95, 98 или 99%. Еще один объект настоящего изобретения относится к солям изобретения (включая их сольваты,гидраты, полиморфы, кристаллические и аморфные формы), по существу, в чистой форме, что означает,например, что соответствующая форма включает менее чем 20%, менее чем 10%, менее чем 5%, менее чем 3% или менее чем 1 мас.% любых примесей или других физических форм. Также настоящее изобретение относится к соли, описанной в настоящем документе, для применения для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2. Кроме того, настоящее изобретение относится к применению соли, описанной в настоящем документе, для получения фармацевтической композиции для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2. Также настоящее изобретение относится к фармацевтической композиции для применения для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2, при этом данная фармацевтическая композиция содержит соль, описанную в настоящем документе, и необязательно один или несколько фармацевтически приемлемых носителей и/или разбавителей. Кроме того, настоящее изобретение относится к фиксированной или нефиксированной комбинации,включающей набор частей для применения для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2, при этом данная комбинация содержит соль, описанную в настоящем документе, и необязательно одно или несколько других активных соединений, например любых из описанных в настоящем документе. Также настоящее изобретение относится к применению соли, описанной в настоящем документе, в комбинации с одним или несколькими иными активными соединениями, такими как, например, любые из упомянутых в данном описании, для получения фармацевтической композиции для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2. Настоящее изобретение также относится к фармацевтической композиции для применения для лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2, при этом данная фармацевтическая композиция содержит соль, описанную в настоящем документе, и необязательно одно или несколько других активных соединений, например любых из описанных в настоящем документе. Кроме того, настоящее изобретение относится к способу лечения и/или предотвращения метаболических заболеваний, в частности сахарного диабета типа 2, при этом данный способ включает введение нуждающемуся в этом субъекту (в частности, человеку) эффективного количества соли, описанной в настоящем документе, необязательно раздельно, последовательно, одновременно, параллельно или хронологически с эффективным количеством одного или нескольких других активных соединений, например любых из перечисленных в данном описании. Соли, описанные в настоящем документе, также могут быть пригодны для одного или нескольких следующих методов: для предотвращения, медленного развития, замедления или лечения метаболического заболевания; для улучшения гликемического контроля и/или снижения уровня глюкозы плазмы натощак или после приема пищи и/или гликогемоглобина HbA1c; для предотвращения, медленного, замедленного или обратимого развития от нарушения толерантности к глюкозе, резистентности к инсулину и/или от метаболического синдрома до сахарного диабета типа 2; для предотвращения, медленного развития, замедления или лечения состояния или расстройства,выбранного из осложнений сахарного диабета; для снижения или предотвращения увеличения массы или для содействия снижению массы; для предотвращения или лечения дегенерации бета-клеток поджелудочной железы, и/или для улучшения, и/или восстановления функциональности бета-клеток поджелудочной железы, и/или стимуляции, и/или восстановления функциональности секреции инсулина поджелудочной железой и/или для поддержания и/или улучшения чувствительности к инсулину и/или для лечения или предотвращения гиперинсулинемии и/или резистентности к инсулину. Примеры указанных метаболических заболеваний или расстройств, подлещах лечению согласно данному изобретению, могут включать, без ограничения, диабет типа 1, диабет типа 2, нарушение толерантности к глюкозе, резистентность к инсулину, гиперинсулинемию, гиперлипидемию, гиперхолестеринемию, дислипидемию, метаболический синдром X, ожирение, гипертензию, хроническое системное воспаление, ретинопатию, невропатию, нефропатию, атеросклероз, эндотелиальную дисфункцию и остеопороз. 1-[(4-Метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантин (согласно примеру 2(142) WO 2004/018468), который также известен как BI 1356, имеет следующую формулу: Специалисту известны способы синтеза 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1 ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина. Преимущественно 1-[(4-метилхиназолин-2-ил)метил]-3 метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин получают посредством синтетического способа, описанного в литературе. Например, он может быть получен так, как описано в заявкахWO 2004/068420, WO 2004/018468 и WO 2006/048427, описание которых включено в настоящий документ посредством ссылки. Для фармацевтического применения для теплокровных позвоночных, в частности для человека,может быть использована дозировка активного соединения, обычно составляющая от 0,001 до 100 мг/кг массы тела, предпочтительно 0,1-15 мг/мг, в каждом случае от 1 до 4 раз в день. Для данной цели соединения, необязательно, в комбинации с другими активными веществами, могут быть введены вместе с одним или несколькими традиционными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой, глюкозой, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жирными веществами, такими как твердый жир, или с их подходящими смесями, в виде традиционных галеновых препаратов, таких как обычные таблетки или таблетки с покрытием,капсулы, порошки, суспензии или суппозитории. Обычно жидкие или твердые материалы носителя являются не только неорганическими, но также и органическими. Так, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве материала носителя для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Типичными материалами носителя для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы(в зависимости от природы активного ингредиента данные носители могут и не использоваться, однако они необходимы в случае мягких желатиновых капсул). Обычными материалами носителя для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и т.п. Типичные материалы носителя растворов для инъекций представляют собой, например, воду, спирты, полиолы,глицерин и растительные масла. Типичными материалами носителя для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы. Фармацевтические композиции настоящего изобретения, содержащие соли, описанные в данном патенте, соответствующего типа, например, необходимого состава или типа введения, могут быть получены специалистом с использованием фармацевтически приемлемых эксципиентов для составов, описанных в уровне технике, например, упомянутых ранее или перечисленных далее в настоящем описании. Количество активного(ых) соединения(ий) предпочтительно составляет от 0,1 до 95 мас.% (массовые проценты в конечной дозированной форме), в частности от 1 до 60 мас.%. Посредством выбора эксципиента возможно получение фармацевтической формы для введения, адаптированной к активному(ым) ингредиенту(ам) и/или к желаемому началу и/или продолжительности действия. Примеры таких эксципиентов включают, без ограничения, эксципиенты, широко используемые для твердых фармацевтических форм (например, таблеток), такие как разбавители, наполнители, связующие вещества, носители, смазочные материалы, дезинтеграторы, активаторы текучести, глиданты и/или агенты для покрытия, эксципиенты, широко используемые для жидких фармацевтических форм (например, сиропов или эликсиров),такие как гелеобразователи, увлажнители, противовспениватели, красители, адсорбенты, загустители,-6 022310 отдушки и/или подсластители, эксципиенты, широко используемые для растворов для инъекции или инфузии, такие как диспергаторы, эмульгаторы, консерванты, солюбилизаторы, буферные вещества и/или изотонические регуляторы, и другие вспомогательные эксципиенты, такие как стабилизаторы и/или растворители. Один из вариантов осуществления настоящего изобретения относится к дозированным формам для орального введения соединений изобретения. Таблетки, таблетки с покрытием, драже, пилюли, крахмальные капсулы, капсулы, каплеты, гранулы, растворы, эмульсии и суспензии пригодны для орального введения. Особенно следует отметить такие твердые дозированные формы для орального введения, как капсулы, таблетки, пилюли, порошки и гранулы. При необходимости указанные составы также могут быть адаптированы для нахождения, например,в энтеральной форме, форме с немедленным высвобождением, в форме с замедленным высвобождением,в форме с повторяющимся высвобождением доз, в форме с пролонгированным высвобождением или в форме с непрерывным высвобождением. Данные формы могут быть получены, например, посредством нанесения покрытия на таблетки, матричным методом, разделением таблеток (например, их ядер и/или покрытия) в различные отсеки, которые могут быть разделены послойной дезинтеграцией в различных условиях (например, условия рН) или сопряжением соединения изобретения с биоразлагаемым полимером. В конкретном варианте осуществления соединение изобретения предпочтительно находится в форме таблетки. Обычно такие таблетки содержат активный(ые) ингредиент(ы) с одним или несколькими разбавителями, наполнителями и/или носителями и, необязательно, с одним или несколькими связующими веществами, одним или несколькими смазочными материалами, одним или несколькими дезинтеграторами и/или одним или несколькими глидантами, также как, при необходимости, пленочным покрытием. Данные таблетки могут быть получены, например, смешением активного(ых) ингредиента(ов) с известными эксципиентами, например, выбранными из перечисленных в настоящем описании. Таблетки с покрытием могут быть получены нанесением на ядра (которые могут быть получены также как таблетки) соединений, обычно используемых для покрытия таблеток (например, пленкообразующих агентов, пластификаторов, глидантов и/или пигментов). Таблетка (включая ее ядро и покрытие) также может содержать различные слои (например, моно-,двойной или тройной слой), например, для обеспечения замедленного высвобождения или предотвращения несовместимости. Обычно в качестве разбавителей/наполнителей могут быть рассмотрены одно или несколько из следующих веществ: маннит, лактоза, сахароза, мальтодекстрин, сорбит, ксилит, измельченная целлюлоза, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза, карбоксиэтилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, метилгидроксиэтилцеллюлоза, крахмал, натрий гликолят крахмала, прежелатинизированный крахмал, фосфат кальция, карбонат металла, оксид металла или алюмосиликат металла. Обычно в качестве связующих могут быть рассмотрены одно или несколько из следующих веществ: поливинилпирролидон, коповидон, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза,сшитая поли(акриловая кислота), гуммиарабик, сенегальская камедь, трагакантовая камедь, лецитин,казеин, поливиниловый спирт, желатин, каолин, целлюлоза, метилцеллюлоза, гидроксиметилцеллюлоза,карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, натрий карбоксиметилцеллюлоза, фталат гидроксипропилцеллюлозы, гидроксиэтилцеллюлоза, метилгидроксиэтилцеллюлоза, окремненная микрокристаллическая целлюлоза, крахмал, мальтодекстрин, декстрины, микрокристаллическая целлюлоза или сорбит. В основном в качестве дезинтеграторов могут быть рассмотрены одно или несколько из следующих веществ: кроскармеллоза натрия, кармелоза кальция, кросповидон, альгиновая кислота, альгинат натрия,альгинат калия, альгинат кальция, ионообменная смола, шипучая система на основе пищевых кислот и карбоната щелочного металла, глина, тальк, крахмал, прежелатинизированный крахмал, натрий гликолят крахмала, целлюлозный флокулянт, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, силикат кальция, карбонат металла, бикарбонат натрия, цитрат кальция или фосфат кальция. В основном в качестве смазывающих материалов могут быть рассмотрены одно или несколько из следующих веществ: стеариновая кислота, стеарат металла, натрия стеарилфумарат, жирные кислоты,жирные спирты, эфиры жирных кислот, глицерил бегенат, минеральное масло, растительное масло, парафин, лейцин, диоксид кремния, силиконовая кислота, тальк, эфиры пропиленгликоля и жирных кислот,полиэтиленгликоль, полипропиленгликоль, полиалкиленгликоль или хлорид натрия. При необходимости может быть реализовано прямое сжатие или гранулирование смеси и/или компонентов, которые могут быть осуществлены традиционными методами гранулирования, известными специалисту в данной области. Например, метод сухого гранулирования включает, но не ограничивается этим, сжатие смешанного порошка при высоком давлении или посредством вальцевания или "комкования" на сверхмощном таблеточном прессе. Метод влажного гранулирования включает, но не ограничивается этим, гранулирование с большим усилием сдвига, однореакторную обработку, гранулирование с распылением сверху, гранулирование с распылением снизу, гранулирование с распылением в псевдоожиженном слое, экструзию/сферонизацию и роторное гранулирование. Примеры подходящих разбавителей для соединений настоящего изобретения могут включать измельченную целлюлозу, гидрофосфат кальция, эритрит, гидроксипропилцеллюлозу с низкой степенью замещения, маннит, прежелатинизированный крахмал и ксилит. Примеры подходящих смазочных материалов для соединений настоящего изобретения могут включать тальк, полиэтилегликоль, бегенат кальция, стеарат кальция, гидрированное касторовое масло и стеарат магния. Примеры подходящих связующих веществ для соединений настоящего изобретения могут включать коповидон (сополимеризаты винилпирролидона с другими винилпроизводными), гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу (ГПЦ), поливинилпирролидон (повидон), прежелатинизированный крахмал и гидроксипропилцеллюлозу с низкой степенью замещения (L-ГПЦ). Примеры подходящих дезинтеграторов для соединений настоящего изобретения могут включать кукурузный крахмал и кросповидон. Подходящими методами получения фармацевтических составов соединений настоящего изобретения могут быть следующие: непосредственное таблетирование активного вещества в порошковых смесях с подходящими эксципиентами для таблеток; гранулирование с подходящими эксципиентами с последующим смешением с подходящими эксципиентами и таблетированием, а также покрытием пленкой; упаковка порошковых смесей или гранул в капсулы. Подходящими методами гранулирования являются следующие: влажное гранулирование в высокопроизводительном смесителе, с последующей сушкой в псевдоожиженном слое; гранулирование в одном реакторе; гранулирование в псевдоожиженном слое или сухое гранулирование (например, вальцеванием) с подходящими эксципиентами и последующее таблетирование или упаковка в капсулы. Конкретные составы и их получение описаны в патентной заявке WO 2007/128724, содержание которой включено в описание настоящего изобретения для всех целей в полном объеме. В данном изобретении доза активного ингредиента, обычно необходимая для внутривенного введения, составляет от 0,1 до 10 мг, предпочтительно от 0,25 до 5 мг, а при оральном введении - от 0,5 до 100 мг, предпочтительно от 2,5 до 50 мг, более предпочтительно от 1 до 5 мг, в каждом случае от 1 до 4 раз в день. Так, дозировка 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)аминопиперидин-1-ил)ксантина при оральном введении составляет от 0,5 до 10 мг на пациента в день,предпочтительно от 2,5 до 10 мг или от 1 до 5 мг на пациента в день. Дозированная форма, полученная с фармацевтической композицией, содержащей соль, упомянутую в данном описании, содержит активный ингредиент в дозировке 0,1-100 мг. Так, конкретные дозировки 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина составляют 0,5, 1, 2,5, 5 и 10 мг. Конкретный вариант осуществления настоящего изобретения относится к оральному введению ингибиторов DPP-4, терапевтически эффективных в небольших дозах, например при дозировке 100 или 70 мг на пациента в день, предпочтительно 50 мг, более предпочтительно 30 или 20 мг, еще более предпочтительно от 1 до 10 мг, в частности от 1 до 5 мг (более конкретно 5 мг) активного ингредиента на пациента в день, преимущественно при оральном введении раз в день, более предпочтительно - при введении в любое время суток, с или без приема пищи. Более подробно для дозированных форм, составов и типов введения активных веществ, в частности,упомянутых в настоящем описании, даны ссылки на соответствующую научную литературу и/или опубликованные патентные документы, в частности, процитированные в настоящем документе. Поскольку различные метаболические функциональные расстройства зачастую протекают одновременно, зачастую имеются показания к комбинированию ряда различных активных начал друг с другом. Так, в зависимости от диагностированного функционального расстройства более качественные результаты лечения могут быть получены в случае комбинирования ингибитора DPP-4 с традиционными активными веществами для соответствующего расстройства, например с одним или несколькими активными вещества, выбранными среди иных антидиабетических веществ, в частности активных веществ,снижающих уровень сахара или уровень липидов в крови, повышающих уровень HDL в крови, снижающих кровяное давление или показанных для лечения атеросклероза или ожирения. Соединения настоящего изобретения, кроме их применения в монотерапии, также могут быть использованы совместно с другими активными веществами, что приводит к получению улучшенных результатов лечения. Такое комбинированное лечение может быть назначено в виде свободной комбинации веществ или в виде фиксированной комбинации, например в виде таблетки или капсулы. Необходимые для этой цели фармацевтические составы комбинации веществ могут быть получены в промышлен-8 022310 ном масштабе в виде фармацевтических композиций или могут быть составлены специалистом с использованием традиционных методов. Активные вещества, которые могут быть получены в промышленном масштабе в виде фармацевтических композиций, неоднократно описаны в уровне техники, например в списке лекарственных средств ("Rote Liste"), ежегодно выпускаемом федеральной ассоциацией фармацевтической промышленности, или в ежегодно обновляемом списке информации производителей о рекомендованных лекарственных средствах, известном как "Physicians' Desk Reference". Примерами антидиабетических веществ, входящих в комбинацию, являются метформин; сульфонилмочевины, такие как глибенкламид, толбутамид, глимепирид, гликвидон, глиборнурид и гликлазид; натеглинид; репаглинид; тиазолидиндионы, такие как розиглитазон и пиоглитазон; PPAR-гамма модуляторы, такие как метаглидазы; PPAR-гамма агонисты, такие как GI 262570; PPAR-гамма антагонисты;PPAR-гамма/альфа/дельта модуляторы; AMPK-активаторы, такие как AICAR; ингибиторы ацетил-СоА карбоксилазы (АСС 1 и АСС 2); ингибиторы диацилглицерол-ацетилтрансферазы (DGAT); агонисты бетаклеток поджелудочной железы GCRP, такие как агонисты рецептора SMT3 и GPR119; 11-HSD-ингибиторы; агонисты FGF19 или аналоги; блокаторы альфа-глюкозадазы, такие как акарбоза,воглибоза и миглитол; альфа 2-антагонисты; инсулин и аналоги инсулина, такие как инсулин человека,лизпроинсулин, инсулин глулизин, r-DNA-инсулин аспарт, NPH-инсулин, инсулин детемир, инсулин цинк суспензия и инсулин гларгин; гастроингибирующий пептид (GIP); пирамлинтид; амилин или GLP-1 и аналоги GLP-1, такие как Exendin-4; SGLT2-ингибиторы, такие как KGT-1251; ингибиторы протеин тирозин фосфатазы; ингибиторы глюкозо-6-фосфатазы; модуляторы фруктозо-1,6-бисфосфатазы; модуляторы гликоген-фосфорилазы; антагонисты рецептора глюкагона; ингибиторы фосфоенолпируваткарбоксикиназы (PEPCK); ингибиторы пируватдегидрогеназы (PDK); ингибиторы тирозинкиназ (50-600 мг),такие как киназа PDGF-рецептора (см. ЕР-А-564409, WO 98/35958, US 5093330, WO 2004/005281 иWO 2006/041976); модуляторы глюкокиназы/регуляторного белка, включая активаторы глюкокиназы; ингибиторы гликогенсинтазкиназы; ингибиторы SH-2-доменсодержащей инозитол 5-фосфатазы типа 2; ингибиторы IKK, такие как высокодозированный салицилат; ингибиторы JNK1; ингибиторы протеинкиназы С-тета; агонисты бета 3, такие как ритобегрон, YM 178, солабегрон, талибегрон, N-5984, GRC-1087,рафабегрон, FMP825; ингибиторы альдосередуктазы, такие как AS 3201, зенарестат, фидарестат, эпалрестат, ранирестат, NZ-314, СР-744809 и СТ-112; ингибиторы SGLT-1 или SGLT-2; ингибиторыIV. Метформин обычно назначают в дозировке, варьирующейся от около 500 до 2000 мг и вплоть до 2500 мг в день с использованием различных режимов дозировки от около 100 до 500 мг, или от 200 до 850 мг (1-3 раза в день), или от около 300 до 100 мг один или два раза в день, а дозировка метформина замедленного высвобождения составляет от около 100 до 1000 мг, или предпочтительно от 500 до 1000 мг один или два раза в день или от около 500 до 2000 мг один раз в день. Конкретные дозировки гидрохлорида метформина могут составлять 250, 500, 625, 750, 850 и 1000 мг. Дозировка пиоглитазона обычно составляет около 1-10, 15, 30 или 45 мг один раз в день, например,при использовании в виде гидрохлорида. Глибенкламид (глибурид) обычно назначают в дозировке от 2,5 до 20 мг один (или два) раз в день(стандартная дозировка составляет 1,25, 2,5 и 5 мг), а микронизированный глибенкламид в дозировке от 0,75 до 12 мг один раз в день (стандартная дозировка составляет 1,5, 3, 4,5 и 6 мг). Глипизид обычно назначают в дозировке от 2,5 до 40 мг один (или два) раз в день, стандартная дозировка составляет 5 и 10 мг), а глибенкламид пролонгированного действия в дозировке от 5 до 20 мг один раз в день (стандартная дозировка составляет 2,5, 5 и 10 мг). Глимепирид обычно назначают в дозировке от 1 до 8 мг один раз в день (стандартная дозировка составляет 1, 2 и 4 мг). Двойную комбинацию глибенкламид/метформин обычно назначают в дозировке от 1,25/250 один раз в день до 10/1000 мг два раза в день. Двойную комбинацию глипизид/метформин обычно назначают в дозировке от 2,5/250 до 10/1000 мг дважды в день. Двойную комбинацию глимепирид/метформин обычно назначают в дозировке от 1/250 до 4/1000 мг дважды в день. Двойную комбинацию розиглитазон/глимепирид обычно назначают в дозировке от 4/1 один раз в день до 4/2 мг дважды в день. Двойную комбинацию пиоглитазон/глимепирид обычно назначают в дозировке от 30/2 до 30/4 мг один раз в день. Двойную комбинацию розиглитазон/метформин обычно назначают в дозировке от 1/500 до 4/1000 мг два раза в день. Двойную комбинацию пиоглитазон/метформин обычно назначают в дозировке от 15/500 один или два раза в день до 15/850 мг три раза в день. Несульфонилмочевинный секретогог натеглинид обычно назначают в дозировке от 60 до 120 мг при приеме пищи; репаглинид обычно назначают в дозировке от 0,5 до 4 мг при приеме пищи. Акарбозу и миглитол обычно назначают в дозировке от 25 до 100 мг при приеме пищи. Примерами веществ, снижающих уровень липидов в крови, входящих в комбинацию, являются ингибиторы HMG-CoA-редуктазы, такие как симвастатин, аторвастатин, ловастатин, флювастатин, правастатин и розувастатин; фибраты, такие как безафибрат, фенофибрат, клофибрат, гемифибролиз, этофибрат и этофиллинклофибрат; никотиновая кислота и ее производные, такие как аципимокс; агонистыPPAR-альфа; агонисты PPAR-дельта; ингибиторы ацилкоэнзим А: холестеролтрансфераза (АСАТ; ЕС 2.3.1.26), такие как авасимиб; ингибиторы резорбции холестерина, такие как эзетиниб; вещества, связывающие желчные кислоты, такие как холестирамин, колестипол и колесевелам; ингибиторы транспортировки желчных кислот; активные вещества, модулирующие HDL, такие как D4F, обратный D4F, активные вещества, моделирующие LXR и FXR; ингибиторы СЕТР, такие как торцетрапиб, JTT или соединение 12, известное из WO 2007/005572; модуляторы рецептора LDL и антисмысловая РНК, кодирующая АроВ 100. Дозировка аторвастатина обычно составляет от 1 до 40 мг или от 10 до 80 мг один раз в день. Примерами веществ, снижающих кровяное давление, входящих в комбинацию, являются бетаблокаторы, такие как атенолол, бисопролол, целипролол, метопролол и карведилол; диуретики, такие как гидрохлортиазид, хлорталидон, ксипамид, фуросемид, пиретамид, торасемид, спиронолактон, эплеренон,амилорид и триамтерен; блокаторы кальциевых каналов, такие как амлодипин, нифедипин, нитрендипин,низолдипин, никардипин, фелодипин, дацидипин, лерканипидин, манидипин, израдипин, нилвадипин,верапамил, галлопамил и дилтиазем; ингибиторы АСЕ, такие как рамиприл, лизиноприл, цилазаприл,хинаприл, каптоприл, эналаприл, беназеприл, периндоприл, фозиноприл и трандораприл, также как блокаторы рецептора антиотензина II (ARB), такие как телмисартан, кандесартан, валсартан, лосартан, ирбесартан, олмесартан и эпросартан. Как правило, дозировка телмисартана составляет от 20 до 320 мг или от 40 до 160 мг/день. Примерами веществ, повышающих уровень HDL в крови, входящих в комбинацию, являются ингибиторы транспортного белка холестериновых эфиров (СЕРТ); ингибиторы эндотелиальной липазы; регуляторы АВС 1; антагонисты LXR-альфа; агонисты LXR-бета; агонисты PPAR-дельта; регуляторы LXR-альфа/бета и вещества, увеличивающие экспрессию и/или концентрацию в плазме аполипопротеина A-I. Примерами веществ для лечения ожирения, входящих в комбинацию, являются сибутрамин; тетрагидролипстатин (орлистат); ализим; дексфенфлурамин; аксокайн; антагонисты каннабиноидного рецептора 1, такие как СВ 1-антагонист римонобанта; антагонисты рецептора МСН-1; агонисты рецептора МС 4; антагонисты NPY5 и NPY2; агонисты бета 3-AR, такие как SB-418790 и AD-9677; агонисты рецептора 5 НТ 2 с, такие как APD 356; ингибиторы миостатина; Acrp30 и адипопектин; ингибиторы стероилСоА-десатуразы (SCD1); ингибиторы жирнокислотной синтазы (FAS); агонисты рецептора CCK; модуляторы рецептора грелина; Руу 3-36; антагонисты рецептора орексина и тезофензин. Примерами веществ для лечения атеросклероза, входящих в комбинацию, являются ингибиторы фосфолипазы А 2; ингибиторы тирозинкиназы (от 50 до 600 мг), такие как PDGF-рецепторная киназа (см. ЕР-А-564409, WO 98/35958, US 5093330, WO 2004/005281, WO 2006/041976); антитела oxLDL и вакциныoxLDL; apoA-1 Milano; ASA и ингибиторы VCAM-1. Следует понимать, что другие активные вещества, упомянутые в данном описании в качестве соучастников комбинации солей настоящего изобретения, также включают их фармацевтически приемлемые соли, а также их гидраты, сольваты и полиморфные формы. Объем настоящего изобретения не ограничивается конкретными вариантами осуществления, представленными в настоящем описании. Различные модификации изобретения в дополнение к представленным могут быть очевидны специалисту в данной области из описания настоящего изобретения. Такие модификации также входят в объем представленной формулы изобретения. Для устранения любых сомнений описание каждого из упомянутых документов и патентных заявок специальным образом полностью включено в настоящее описание посредством ссылки. Дополнительные варианты осуществления, особенности и преимущества настоящего изобретения следуют из примеров, приведенных далее. Данные примеры служат для иллюстрации принципов настоящего изобретения, без его ограничения. Примеры Синтез/Получение. 0,5 г свободного основания BI 1356 суспендируют при комнатной температуре в 4 мл EtOH. Полученную суспензию нагревают при кипении до получения прозрачного раствора, который обычно образуется в течение нескольких минут. После этого к горячему раствору BI 1356 добавляют 1 моль эквивалента соответствующей кислоты (см. табл. 1), растворенной либо в EtOH, либо в воде. Затем нагревание прекращают, раствор медленно охлаждают и выдерживают в течение ночи при комнатной температуре. В том случае если наблюдается выпадение осадка, полученные кристаллы удаляют фильтрованием и затем сушат в течение ночи в условиях окружающей среды. В том случае если осадок не образуется, раствор частично выпаривают (приблизительно на 50%), а затем выдерживают еще ночь в рефрижераторе(4 С). Выпавшие кристаллы также удаляют фильтрованием, а затем сушат в течение ночи в условиях окружающей среды. Полученные кристаллы исследуют микроскопией в поляризованном свете, порошковой рентгеновской дифракцией и термическим анализом. Оборудование, используемое для проведения порошковой рентгеновской дифракции. Порошковый дифрактометр STOE Stadi P с позиционно-чувствительным детектором, работающим в режиме передачи, и изогнутым германиевым (111) первичным монохроматором; используемая длина волны: CuKa1 mit = 1,540598 ; режим работы рентгеновской трубки: 40 кВ, 40 мА; интервал 2: 3-40. Для градуировки порошковых рентгенограмм, из которых следуют данные о монокристаллической структуре, используют программу TREOR, которая является частью программного обеспечения STOEStadi P. В табл. 2-13 представлены характеристические рентгеновские пики, включая нормализованные интенсивности, до 30 в 2. Соответствующие порошковые рентгенограммы представлены на фиг. 1-12 в приложении. Оборудование, используемое для проведения термоанализа. Используют прибор DSC 822 от Fa. Mettler Toldeo. Применяют следующие стандартные параметры: скорость нагрева: 10 К/мин; тип тигля: алюминиевый тигель с микроотверстием; атмосфера: N2, скорость потока: 80 мл/мин; обычная масса навески: 3-10 мг. Используют анализатор TGA/SDTA 851 от Mettler Toldeo, снабженный спектрометром Nicolet FTIR 4700 (для анализа летучих веществ). Применяют следующие стандартные параметры: скорость нагрева: 10 К/мин; тип тигля: открытый алюмооксидный тигель; атмосфера: N2, скорость потока: 20 мл/мин; обычная масса навески: 15-25 мг. Температуры плавления (= Tfus), измеренные посредством ДСК, приведены в табл. 1. Таблица 1 Полученные соли BI 1356 Таблица 2 Пики рентгеновской дифракции (до 30 2 ), включая нормализованные интенсивности, безилата BI 1356 Таблица 3 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, бромида BI 1356 Таблица 4 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, бензоата BI 1356 Таблица 5 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, эзилата BI 1356 Таблица 6 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, фумарата BI 1356 Таблица 7 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, мезилата BI 1356 Таблица 8 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, салицилата BI 1356 Таблица 9 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, тозилата BI 1356 Таблица 10 Индексированные пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, тетрагидрата гидрохлорида BI 1356 Индексирование проведено для моноклинной элементарной ячейки, пространственной группы Р 21,со следующими параметрами решетки: а = 17,974(4) , b = 8,282(3) , с = 19,607(6),= 93,9(2),V = 2912(2) 3. Все 35 пиков могут быть индексированы с показателем качества 42,1. Таблица 11 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, гликолята BI 1356 Таблица 12 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, малоната BI 1356 Таблица 13 Пики рентгеновской дифракции (до 30 2), включая нормализованные интенсивности, гентизата BI 1356 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)аминопиперидин-1-ил)ксантина и фармацевтически приемлемой кислоты в стехиометрии 1:1, в форме сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата. 2. Твердая кислотно-аддитивная соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)8-(3-(R)-аминопиперидин-1-ил)ксантина с кислотой, выбранной из бромисто-водородной кислоты, фосфорной кислоты, азотной кислоты, серной кислоты, уксусной кислоты, 2,2-дихлоруксусной кислоты,адипиновой кислоты, аскорбиновой кислоты (D- или L-формы), аспартановой кислоты (D- или Lформы), бензолсульфоновой кислоты, бензойной кислоты, 4-ацетамидобензойной кислоты, камфорной кислоты +)- или (-)-формы), камфор-10-сульфоновой кислоты +)- или (-)-формы), каприновой кислоты (декановой кислоты), капроновой кислоты (гексановой кислоты), каприловой кислоты (октановой кислоты), угольной кислоты, коричной кислоты, лимонной кислоты, цикламиновой кислоты, додецилсерной кислоты,этан-1,2-дисульфоновой кислоты,этансульфоновой кислоты,2 гидроксиэтансульфоновой кислоты, муравьиной кислоты, фумаровой кислоты, галактаровой кислоты,гентизиновой кислоты, глюкогептановой кислоты (D- или L-формы), глуконовой кислоты (D- или Lформы), глукуроновой кислоты (D- или L-формы), глутаминовой кислоты, глутаровой кислоты, 2 оксоглутаровой кислоты, глицерофосфорной кислоты, гликолевой кислоты, гиппуровой кислоты, изомасляной кислоты, молочной кислоты (D- или L-формы), лактобионовой кислоты, лауриновой кислоты,малеиновой кислоты, яблочной кислоты (D- или L-формы), малоновой кислоты, манделовой кислоты (Dили L-формы), метансульфоновой кислоты, нафталин-1,5-дисульфоновой кислоты, нафталин-2 сульфоновой кислоты, 1-гидрокси-2-нафталиновой кислоты, никотиновой кислоты, олеиновой кислоты,оротовой кислоты, оксалиновой кислоты, пальмитиновой кислоты, памовой кислоты (эмбоновой кислоты), пропионовой кислоты, пироглутаминовой кислоты (D- или L-формы), салициловой кислоты, 4 аминосалициловой кислоты, себациновой кислоты, стеариновой кислоты, янтарной кислоты, винной кислоты (D- или L-формы), тиоциановой кислоты, толуолсульфоновой кислоты и ундециленовой кислоты,в форме ее сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата. 3. Соль по п.1 или 2, выбранная из группы, состоящей из безилата, гидробромида, бензоата, эзилата,фумарата, мезилата, салицилата, тозилата, гидрохлорида, гликолята, малоната и гентизата, в форме ее сольвата, органического сольвата, гидрата или смешанного гидрата/органического сольвата, или в каждом случае е кристаллические формы. 4. Соль по одному из пп.1-3 в форме сольвата. 5. Соль по одному из пп.1-4 в форме органического сольвата. 6. Соль по одному из пп.1-4 в форме этанолата. 7. Соль по одному из пп.1-4 в форме гидрата. 8. Соль по одному из пп.1-6 в форме смешанного гидрата/органического сольвата. 9. Соль по одному из пп.1-6 в форме смешанного гидрата/этанолата. 10. Соединение по одному из пп.1-9 в кристаллической, частично кристаллической, аморфной или полиморфной форме. 11. Фармацевтическая композиция, содержащая соединение по одному из пп.1-10, необязательно вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями. 12. Фармацевтическая композиция по п.11, дополнительно содержащая одно или несколько других активных веществ. 13. Способ получения фармацевтической композиции смешением соединения по одному из пп.1-10 с одним или несколькими фармацевтически приемлемыми эксципиентами и, необязательно, с одним или несколькими другими активными веществами. 14. Применение соединения по одному из пп.1-10 для получения лекарственного средства для применения в способе лечения и/или предотвращения заболевания, расстройства или патологического состояния, опосредованного ферментом DPP-4, в частности сахарного диабета типа 2, причем указанный способ включает введение нуждающемуся в этом субъекту соединения по одному из пп.1-10 в терапевтически эффективном количестве, необязательно, в комбинации с одним или несколькими другими терапевтически активными агентами. 15. Способ получения кислотно-аддитивной соли по одному из пп.1-10, включающий одну или несколько из следующих стадий:ii) инициирование кристаллизации соли иiii) выделение кристаллической соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8(3-(R)-аминопиперидин-1-ил)ксантина. 16. Органический раствор соли по одному из пп.1-10. 17. Раствор по п.16, в котором, раствор представляет собой спиртовой раствор, а растворителем яв- 24022310 ляется этанол, необязательно содержащий воду. 18. Раствор по п.16 или 17, который дополнительно содержит воду. 19. Способ по п.15, в котором раствор представляет собой спиртовой раствор, а растворителем является этанол, необязательно содержащий воду. 20. Твердая соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)аминопиперидин-1-ил)ксантина и фармацевтически приемлемой кислоты в стехиометрии 1:1, в которой кислота выбрана из бензойной кислоты, салициловой кислоты, фумаровой кислоты, гликолевой кислоты и 2,5-дигидроксибензойной кислоты. 21. Твердая кислотно-аддитивная соль 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)8-(3-(R)-аминопиперидин-1-ил)ксантина с кислотой, выбранной из бензойной кислоты, гентизиновой кислоты, гликолевой кислоты, салициловой кислоты или их смесей. 22. Соль по п.20 или 21, выбранная из группы, состоящей из бензоата, салицилата, гликолята и гентизата, или в каждом случае е кристаллической формы. 23. Соединение по одному из пп.20-22 в кристаллической, частично кристаллической, аморфной или полиморфной форме. 24. Фармацевтическая композиция, содержащая соединение по одному из пп.20-23, необязательно,вместе с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями. 25. Фармацевтическая композиция по п.24, дополнительно содержащая одно или несколько других активных веществ. 26. Способ получения фармацевтической композиции смешением соединения по одному из пп.2023 с одним или несколькими фармацевтически приемлемыми эксципиентами и, необязательно, с одним или несколькими другими активными веществами. 27. Применение соединения по одному из пп.20-23 для получения лекарственного средства для применения в способе лечения и/или предотвращения заболевания, расстройства или патологического состояния, опосредованного ферментом DPP-4, в частности сахарного диабета типа 2, причем указанный способ включает введение нуждающемуся в этом субъекту соединения по одному из пп.20-23 в терапевтически эффективном количестве, необязательно, в комбинации с одним или несколькими другими терапевтически активными агентами. 28. Способ получения кислотно-аддитивной соли по одному из пп.20-23, включающий одну или несколько из следующих стадий:ii) инициирование кристаллизации соли иiii) выделение кристаллической соли 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8(3-(R)-аминопиперидин-1-ил)ксантина. 29. Органический раствор, например спиртовой раствор, соли по одному из пп.20-23, где данный раствор необязательно дополнительно содержит воду. 30. Раствор п.29, в котором растворителем является этанол, необязательно содержащий воду. 31. Соль по п.22, которая представляет собой бензоат. 32. Соль по п.22, которая представляет собой салицилат. 33. Соль по п.22, которая представляет собой гликолят. 34. Соль по п.22, которая представляет собой гентизат.XRPD - рентгенограмма тетрагидрата гидрохлорида BI 1356
МПК / Метки
МПК: C07D 473/04
Метки: органического, солевые, соединения, формы
Код ссылки
<a href="https://eas.patents.su/30-22310-solevye-formy-organicheskogo-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Солевые формы органического соединения</a>
Предыдущий патент: Применение 2-(1-гидроксипентил)бензоат калия (dl-phpb) для предупреждения и лечения болезни альцгеймера
Следующий патент: Оксабициклогептаны и оксабициклогептены, их получение и применение
Случайный патент: Способы и скважинные флюиды на водной основе для уменьшения поглощения скважинного флюида и поглощения фильтрата