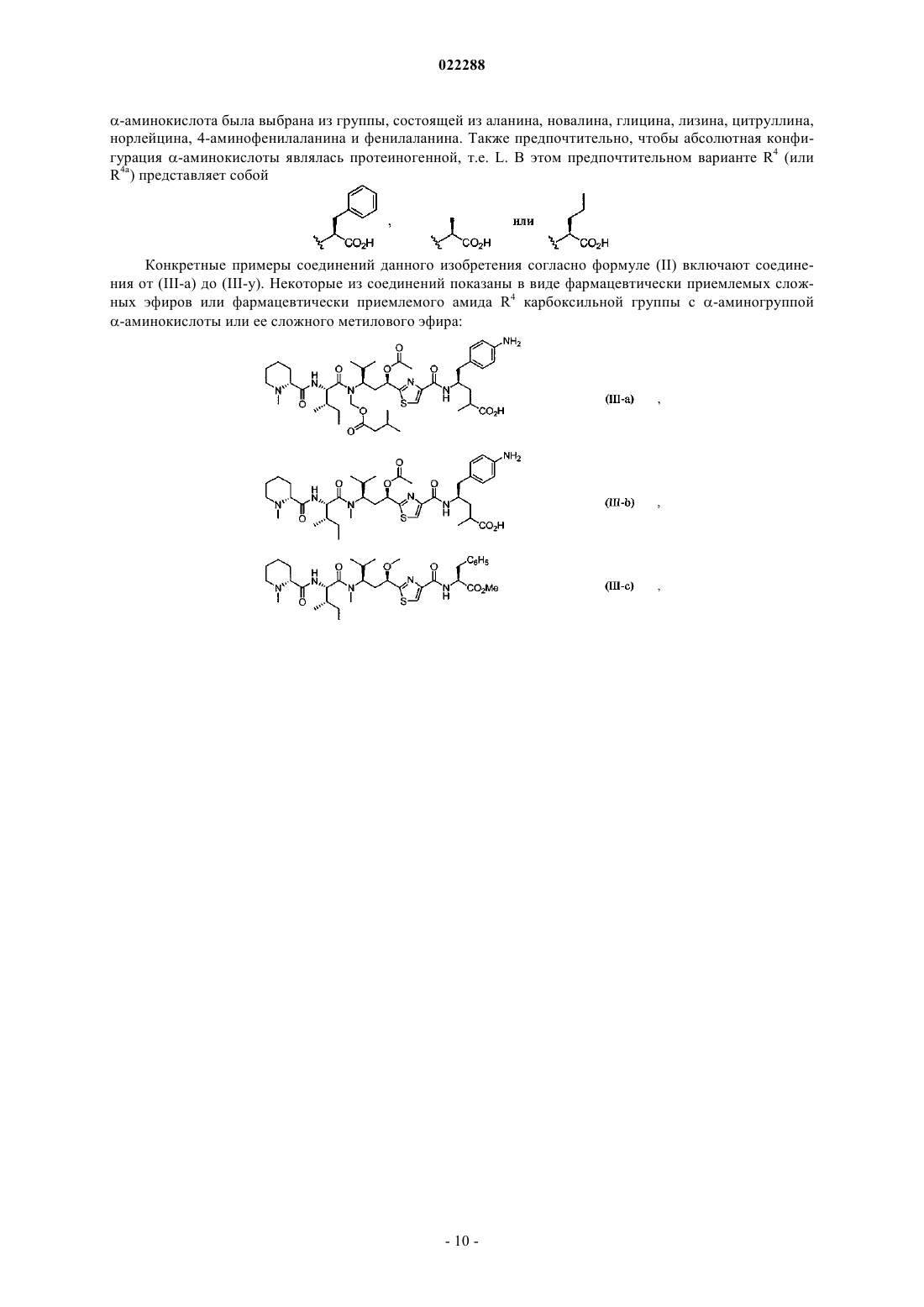
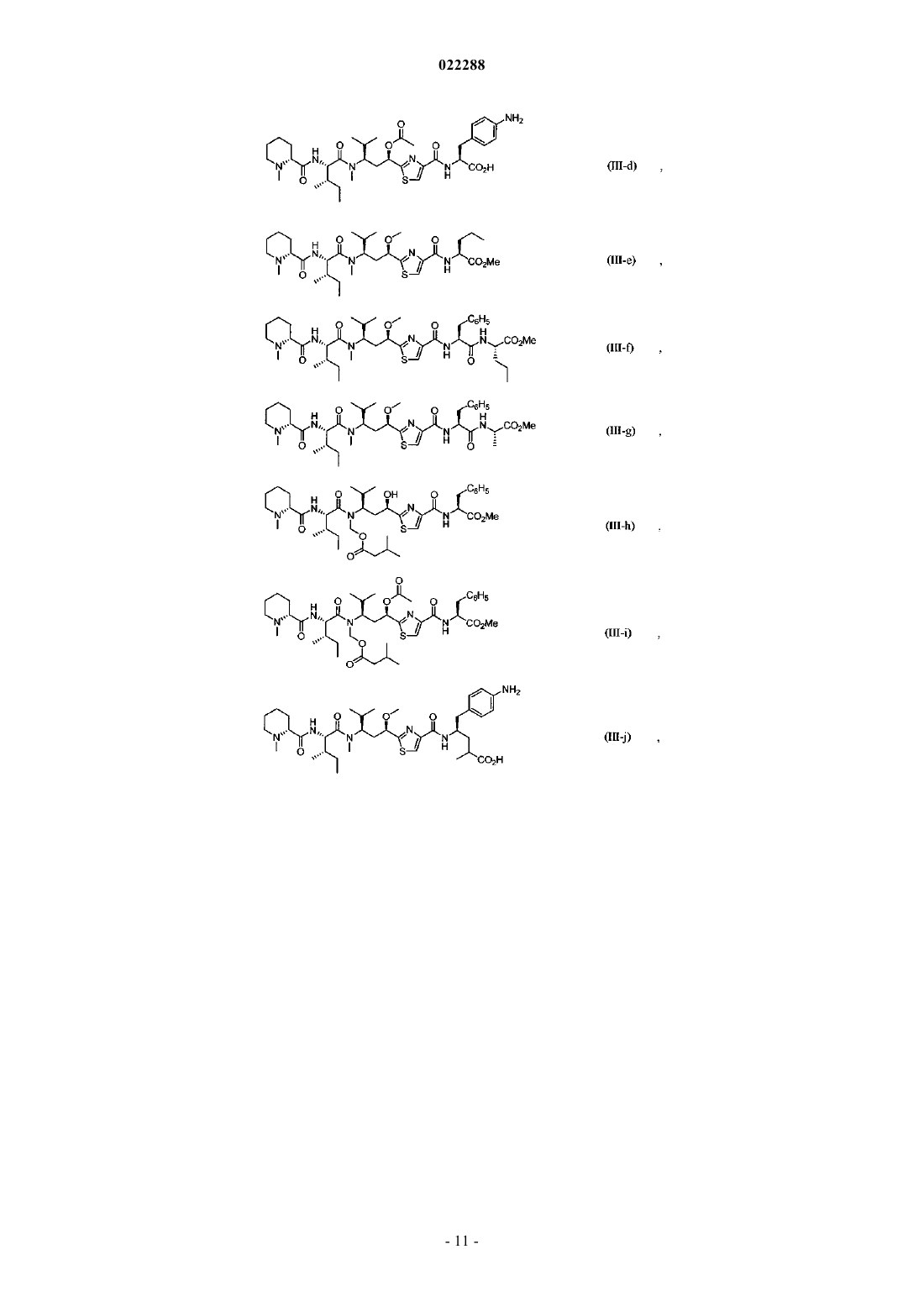
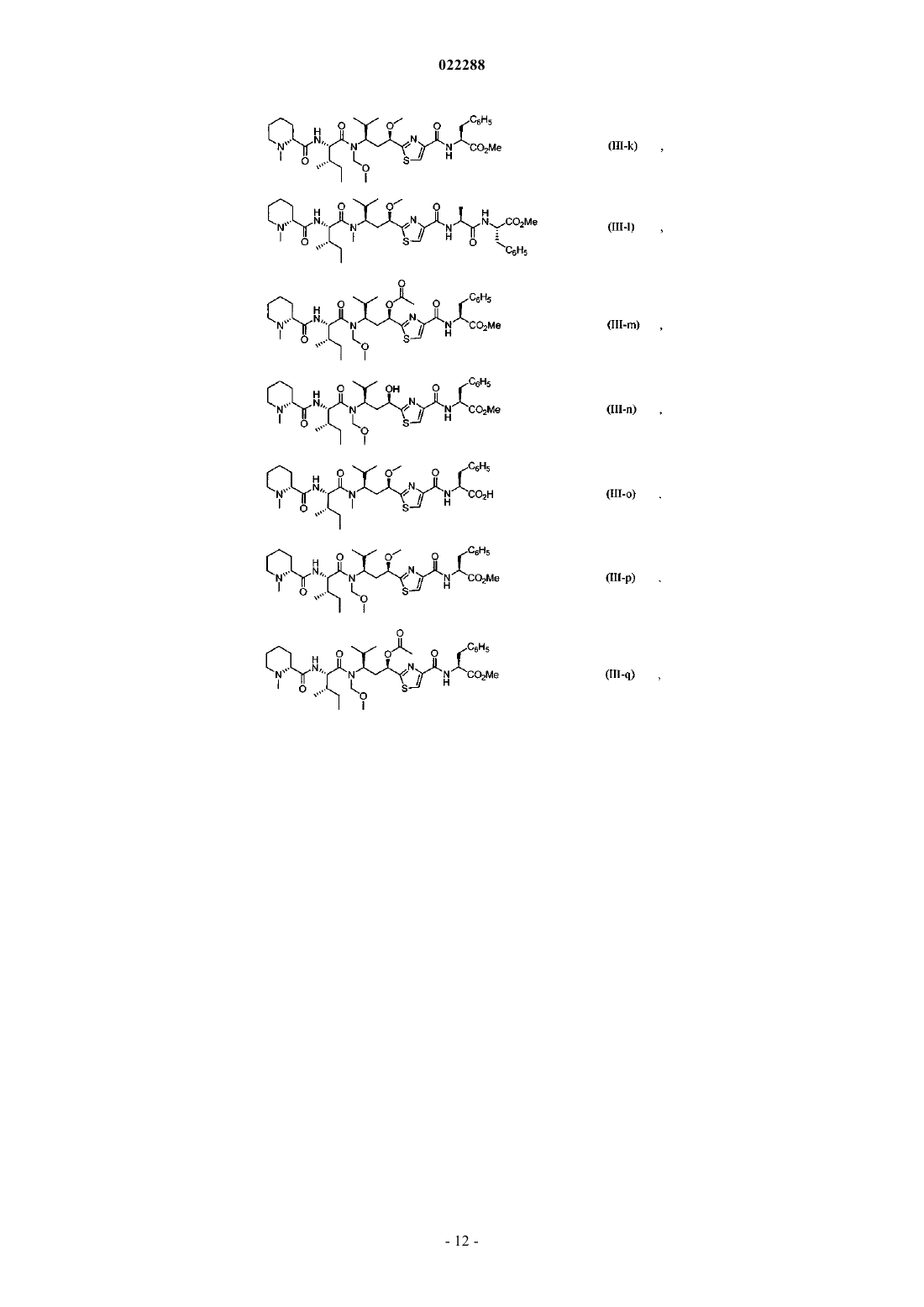
Антипролиферативные соединения, их конъюгаты, способы их получения и их применение
Формула / Реферат
1. Соединение, имеющее структуру, представленную формулой (II)
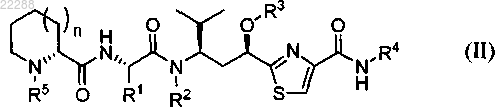
где n равно 1;
R1 представляет собой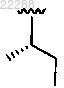 ;
;R2 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, CH2O-(C1-C5-алкил), CH2O-(C2-C5-алкенил), CH2O(C=O)-(C1-C5-алкил) или CH2OC(=O)-(C2-C5-алкенил);
R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил;
R4 представляет собой
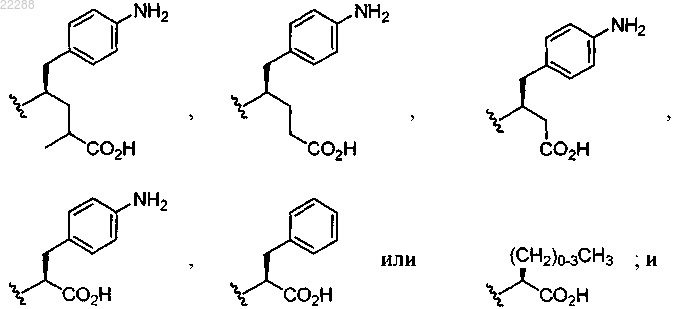
R5 представляет собой C1-C5-алкил,
или его фармацевтически приемлемый C1-C5-алкильный, C2-C5-алкенильный или C2-C5-алкинильный сложный эфир или его фармацевтически приемлемая соль.
2. Соединение по п.1, имеющее структуру, представленную формулой (II-а)

где R4a представляет собой
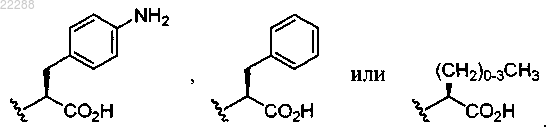
3. Соединение по п.2, имеющее структуру, представленную формулой (II-а')

где R2 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, CH2O-(C1-C5-алкил), CH2O-(C2-C5-алкенил), CH2O(C=O)-(C1-C5-алкил) или CH2OC(=O)-(C2-C5-алкенил);
R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил.
4. Соединение по п.1, имеющее структуру, представленную формулой (II-b)
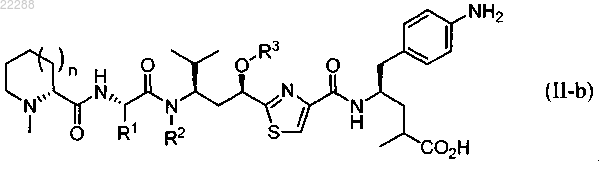
5. Соединение по п.4, имеющее структуру, представленную формулой (II-b')
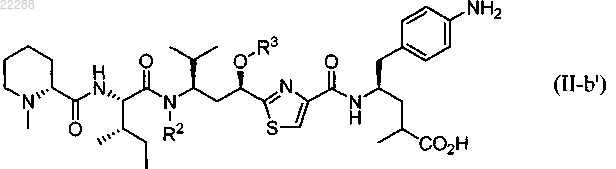
где R2 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, CH2O-(C1-C5-алкил), CH2O-(C2-C5-алкенил), CH2O(C=O)-(C1-C5-алкил) или CH2OC(=O)-(C2-C5-алкенил);
R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил.
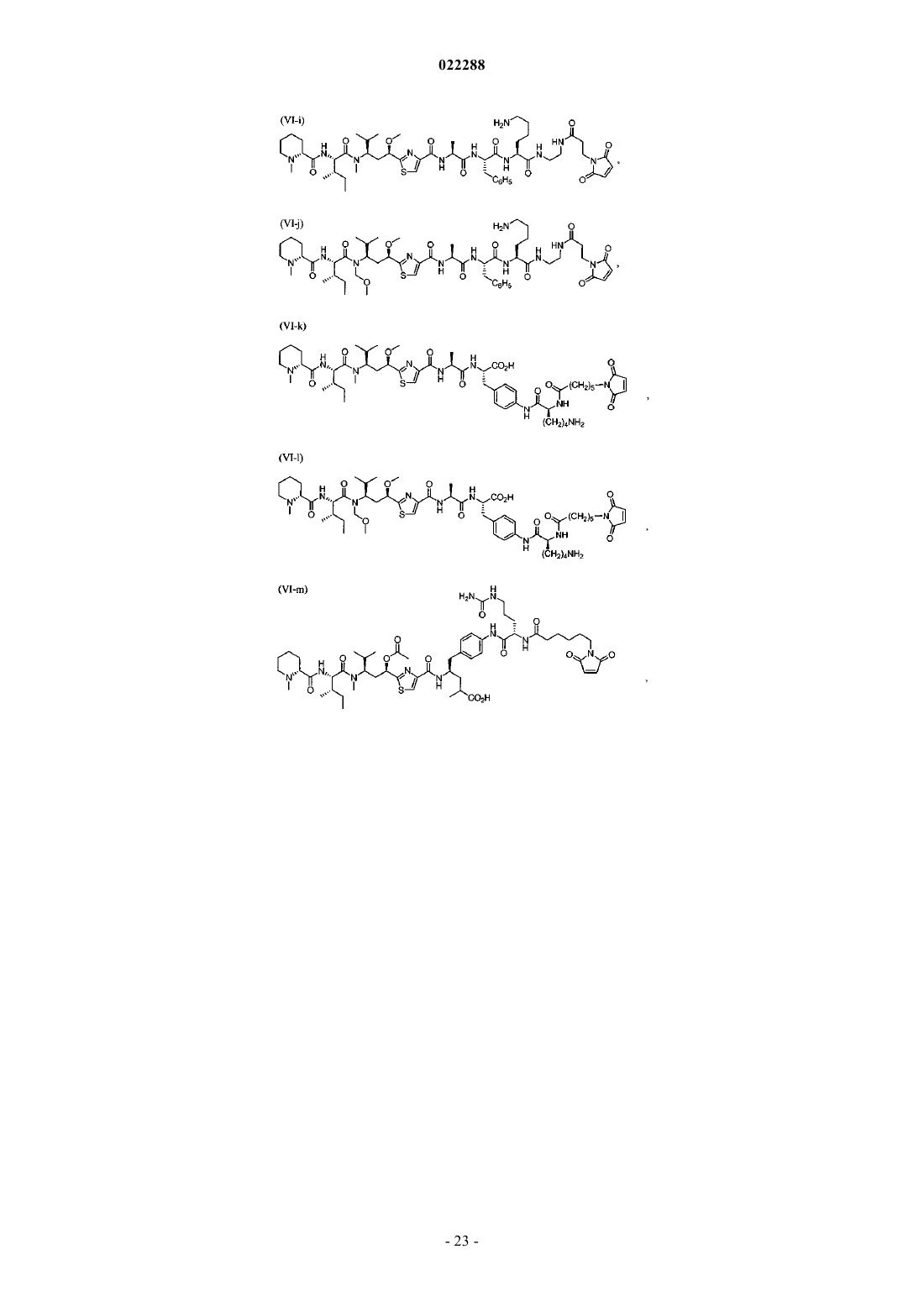
6. Соединение по п.1, имеющее структуру, выбранную из группы, состоящей из:
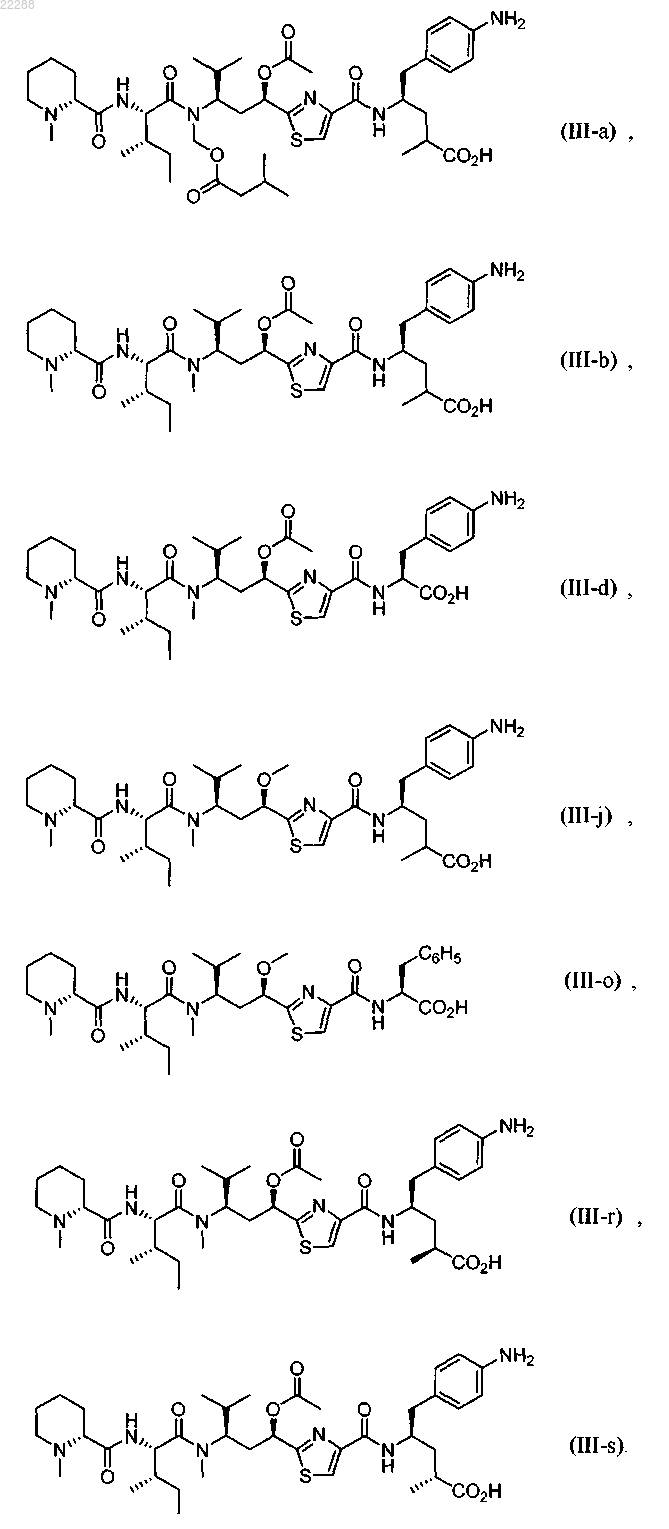
7. Соединение по п.1, имеющее структуру, представленную формулой (II-с)
где R13 представляет собой Me, n-Pr, CH2OMe или CH2OC(=O)CH2CH(Me)2;
R14 представляет собой Me или С(=O)Ме;
R15 представляет собой Н.
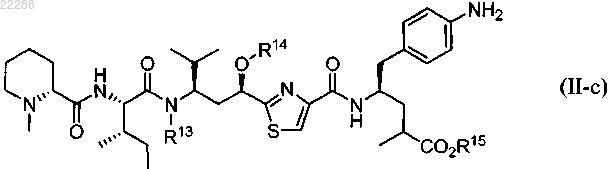
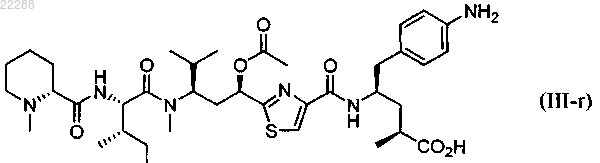
8. Соединение по п.1, имеющее структуру, представленную формулой (III-r)
9. Соединение, имеющее структуру, представленную формулой (V-b)
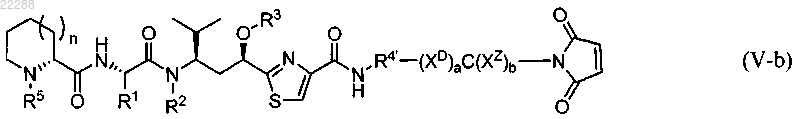
где n равно 1;
R1 представляет собой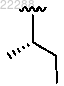 ;
;R2 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, CH2O-(C1-C5-алкил), CH2O-(C2-C5-алкенил), CH2O(C=O)-(C1-C5-алкил) или CH2OC(=O)-(C2-C5-алкенил);
R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил;
R4' представляет собой
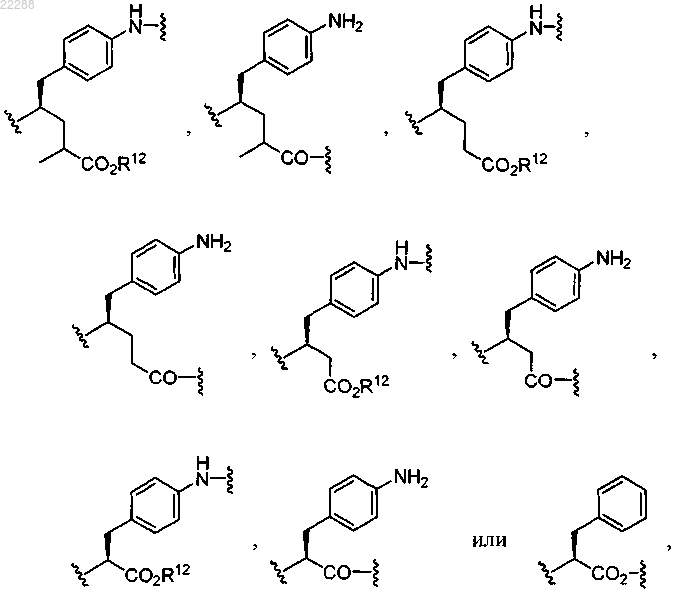
где R12 представляет собой Н;
R5 представляет собой C1-C5-алкил;
XD и XZ представляют собой спейсерные группы, выбранные из группы, состоящей из
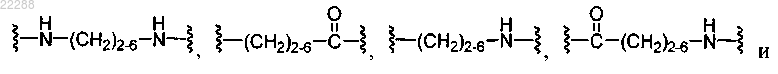
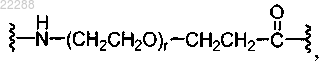
где индекс r равен от 1 до 24;
С представляет собой пептидную группу, выбранную из группы, состоящей из Val-Cit, Ala-Val, Val-Ala-Val, Lys-Lys, Ala-Asn-Val, Val-Leu-Lys, Cit-Cit, Val-Lys, Ala-Ala-Asn, Lys, Cit, Ser и Glu;
а и b независимо равны 0 или 1,
при этом группа R4' связана через карбоксильную или аминогруппу с группой XD в случае, когда а равно 1, или с группой С в случае, когда а равно 0.
10. Соединение, имеющее структуру, представленную формулой (V-d)
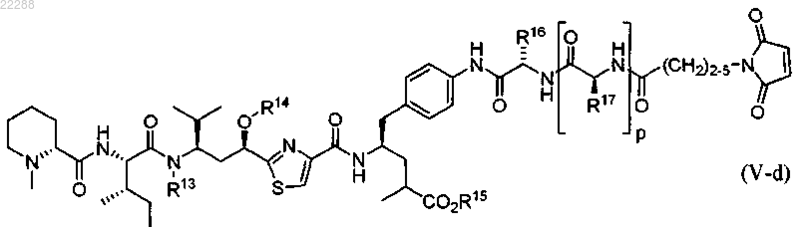
где R13 представляет собой Me, n-Pr, CH2OMe или CH2OC(=O)CH2CH(Me)2;
R14 представляет собой Me или C(=O)Me;
R15 представляет собой Н;
R16 представляет собой (CH2)4NH2 или (CH2)3NHC(=O)NH2;
R17 представляет собой С(Me)2 или Me;
p равно 0 или 1.
11. Соединение по п.10, выбранное из группы, состоящей из:
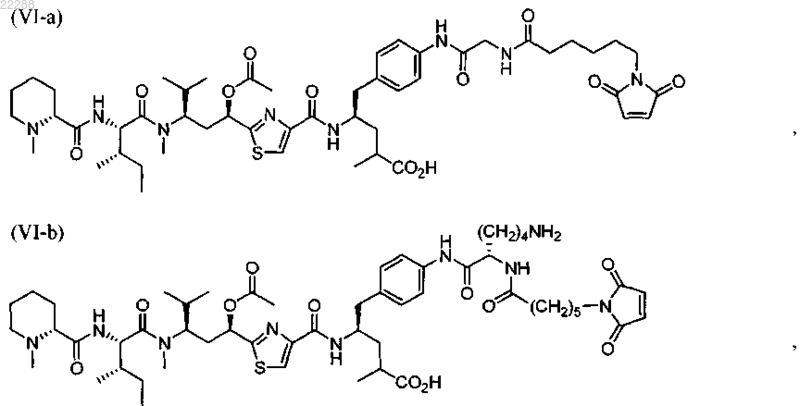
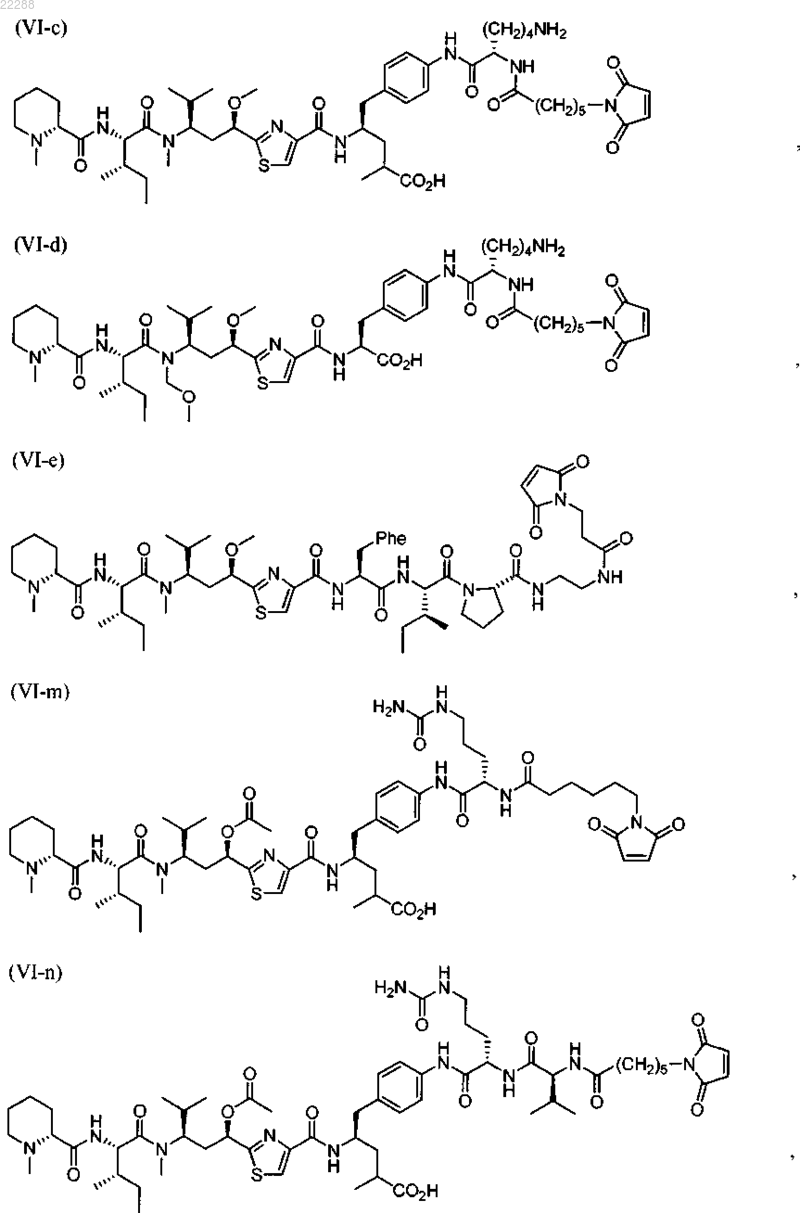
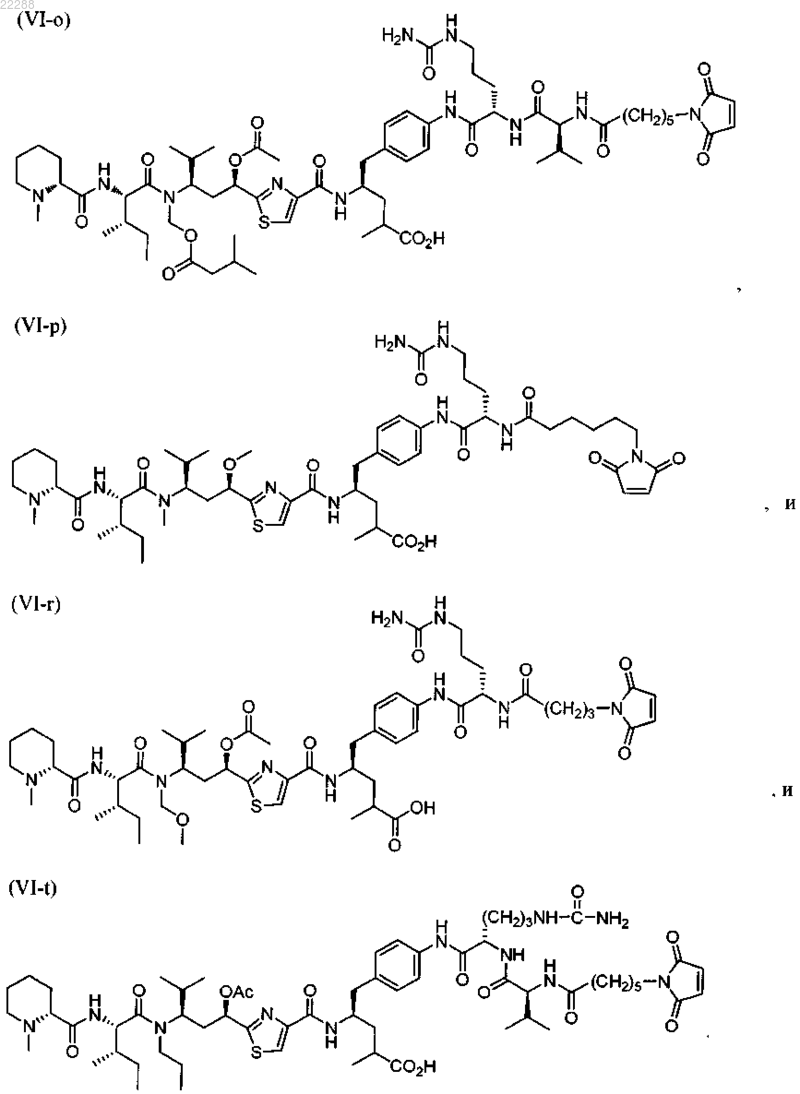
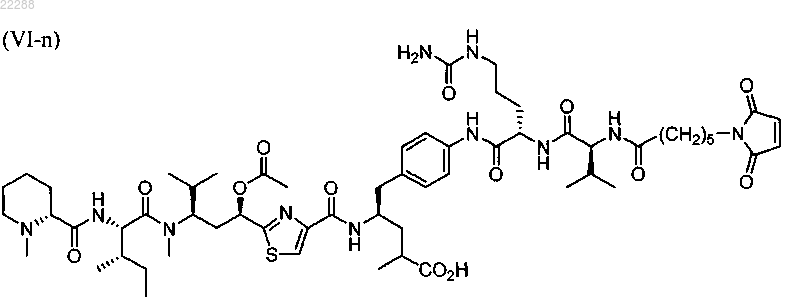
12. Соединение по п.9, имеющее структуру, представленную формулой (VI-n)
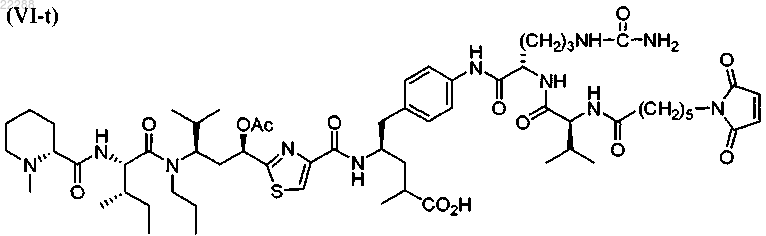
13. Соединение по п.9, имеющее структуру, представленную формулой (VI-t)
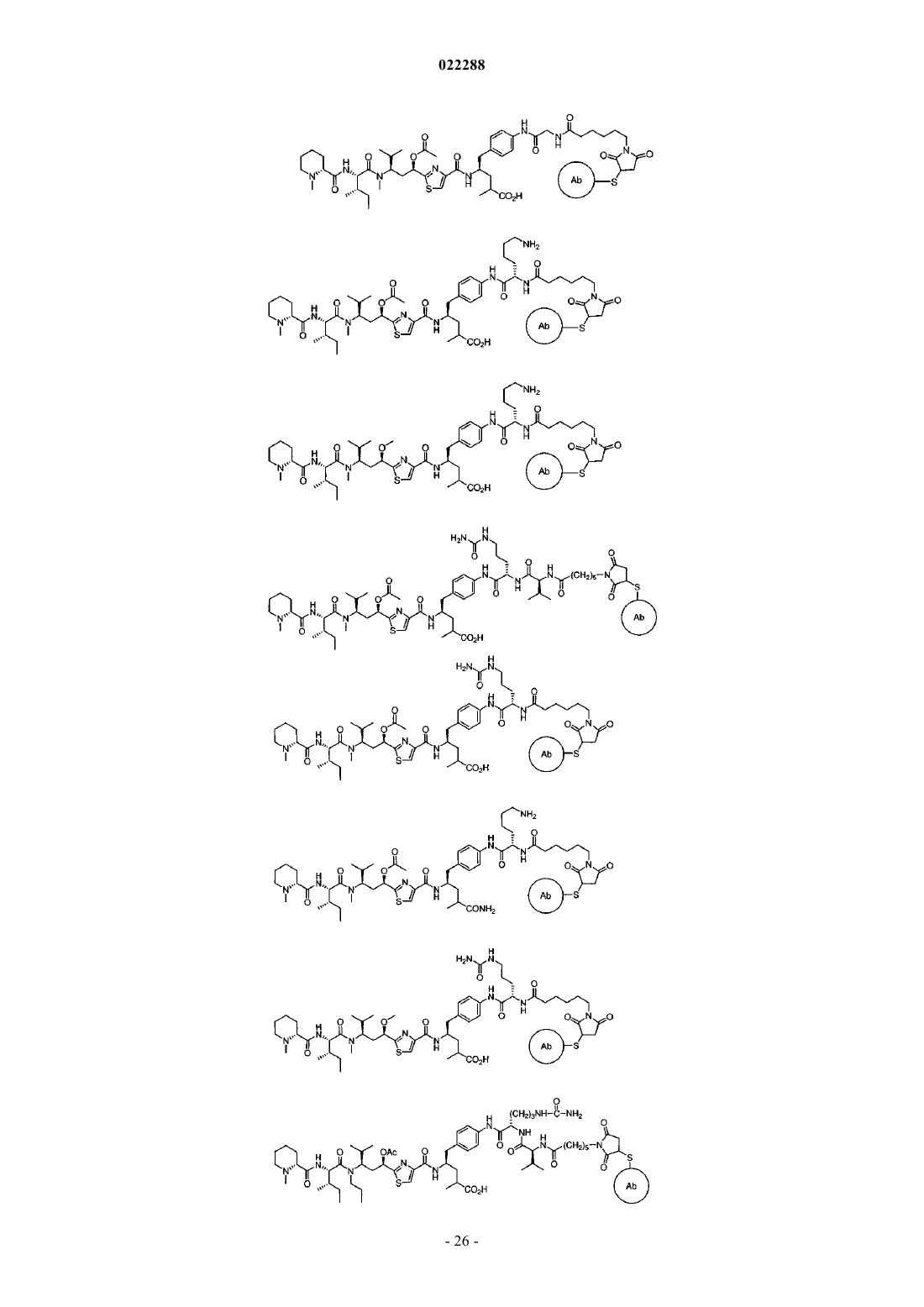
14. Конъюгат, содержащий соединение по п.9, конъюгированное с антителом через малеимидную группу формулы (V-b).
15. Конъюгат, содержащий соединение по п.13, конъюгированное с антителом через малеимидную группу формулы (VI-t).
16. Конъюгат по п.15, где антитело представляет собой антимезотелин антитело 6А4.
17. Способ лечения рака у субъекта, страдающего от него, предусматривающий введение субъекту терапевтически эффективного количества соединения по п.1.
18. Способ лечения рака у субъекта, страдающего от него, предусматривающий введение субъекту терапевтически эффективного количества конъюгата по п.14.
19. Способ лечения рака у субъекта, страдающего от него, предусматривающий введение субъекту терапевтически эффективного количества конъюгата по п.15.
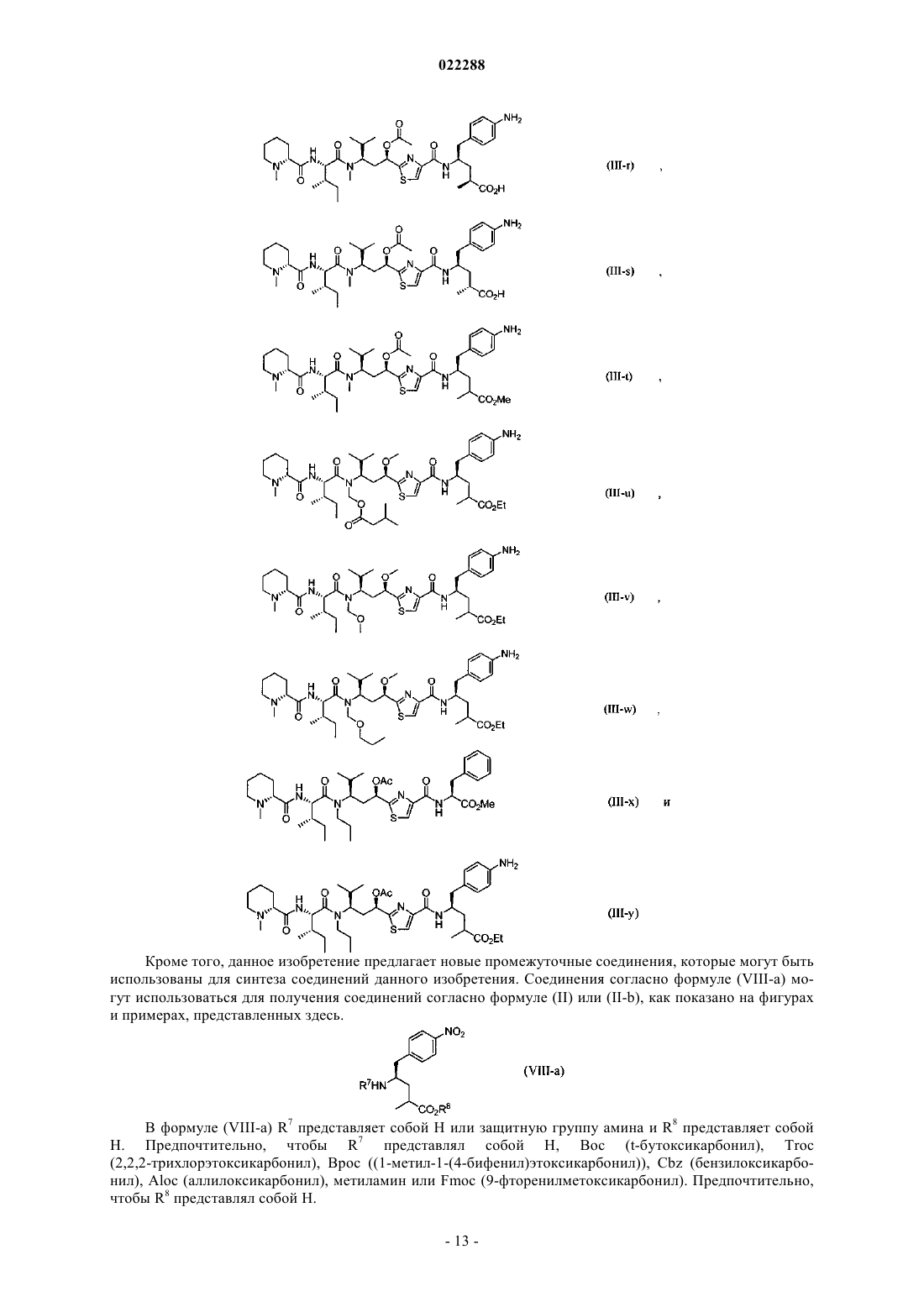
20. Соединение, имеющее структуру согласно формуле (VIII-a)
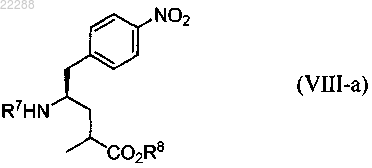
где R7 представляет собой Н или защитную группу амина, выбранную из группы, состоящей из Boc (t-бутоксикарбонил), Troc (2,2,2-трихлорэтоксикарбонил), Bpoc (1-метил-1-(4-бифенил)этоксикарбонил), Cbz (бензилоксикарбонил), Aloc (аллилоксикарбонил), метиламина и Fmoc (9-фторенилметоксикарбонил);
R8 представляет собой Н.
21. Соединение, имеющее структуру согласно формуле (VIII-b)
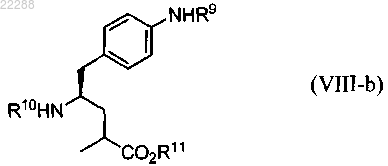
где R9 и R10 независимо выбраны из группы, состоящей из Н, защитной группы амина, выбранной из группы, состоящей из Boc, Troc, Врос, Cbz, Aloc, метиламина и Fmoc;
R11 представляет собой Н.
Текст
АНТИПРОЛИФЕРАТИВНЫЕ СОЕДИНЕНИЯ, ИХ КОНЪЮГАТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ Изобретение относится к антипролиферативным соединениям, имеющим структуру,представленную формулой (II), где n, R1, R2, R3, R4 и R5 являются такими, как определено в описании, которые могут применяться для лечения опухолей, необязательно при конъюгировании с лигандом, таким как антитело: Уровень техники Данное изобретение относится к структурно родственным тубулизинам соединениям, их конъюгатам с лигандом, способам их получения и применению таких соединений и конъюгатов, а также композициям, содержащим такие соединения и конъюгаты. Тубулизины представляют собой цитотоксины, первоначально выделенные из культур миксобактерии Archangium gephyra или Angiococcus disciformis, с каждым организмом, вырабатывающим различную смесь тубулизинов (Sasse et al., 2000, Reichenbach et al., 1998). Была установлена их кристаллическая структура и путь биосинтеза (Steinmetz et al., 2004) и определена последовательность их генов биосинтеза (Hoefle et al., 2006b). Было показано, что претубулизин, биосинтетический предшественник тубулизинов, также обладает значительной активностью сам по себе (Ullrich et al., 2009). (Полный перечень документов, размещенных здесь первым автором или изобретателем, и год приведены в конце описания). Тубулизины принадлежат к группе природных антимитотических полипептидов и депсипептидов,которые включают фомопсины, доластатины и криптофицины (Hamel, 2002). Также существуют антимитотические агенты, отличные от полипептидов или депсипептидов, например паклитаксел, майтанзины и эпотилоны. Во время митоза микротрубочки клетки реоганизуются с формированием митотического веретена, процесса, требующего быстрой сборки и разборки микротрубочек, состоящих из белка, - и-тубулина. Антимитотические агенты блокируют этот процесс и предотвращают процесс митоза клеток,несмотря на то, что на молекулярном уровне точный механизм блокировки может отличаться от одного агента к другому. Тубулизины предотвращают сборку тубулинов в микротрубочки, вызывая накопление поврежденных клеток в G2/M фазе и апоптоз (Khalil et al., 2006). Напротив, паклитаксел достигает такого же конечного результата путем связывания с микротрубочками и предотвращения их разборки. Тубулизины имеют тетрапептидильный остов, состоящий из субъединиц одной протеиногенной и трех непротеиногенных аминокислот: N-метилпипеколиновой кислоты (Mep), изолейцина (Ile), тубувалина (Tuv) и рубуфенилаланина (Tup, RA равно Н в формуле (I) ниже) или тубутирозина (Tut, RA равноOH). Известно около десятка природных тубулизинов (обозначенные А, В и т.д.), при этом участки структурных изменений находятся на остатках RA, RB и RC, как показано в формуле (I) и табл. 1.Kaur et al. в 2006 году исследовал антипролиферативные свойства тубулизина А и обнаружил, что тутулизин А являлся более сильным, чем другие антимитотические агенты, такие как паклитаксел и винбластин, и был активным в анализах ксенотрансплантата в отношении разных линий раковых клеток. Кроме того, тубулизин А индуцировал апоптоз в раковых клетках, но не в нормальных клетках, и проявил значительные потенциальные антиантиогенные свойства в анализах in vitro. Кроме того, были оценены антимитотические свойства других тубулизинов и было обнаружено, что в целом они выигрывали при сравнении с не содержащими тубулизин антимитотическими агентами (см., например, Balasubramanian et al., 2009; Steinmetz et al., 2004; Wipf et al., 2004). По этим причинам имеется значительный интерес к тубулизинам как противораковым агентам (см., например, Domling et al., 2005c; Hamel, 2002). Многочисленные публикации описывают усилия, направленные на синтез тубулизинов, в том числеSani et al., 2007; Sasse et al., 2007; Shankar et al., 2009; Shibue et al., 2009 и Wipf et al., 2004. Другие публикации описывают исследования зависимости активности от структуры (SAR) путем приготовления и оценки аналогов тубулизина или производных: Balasubramanian et al., 2008 и 2009; Domling 2006;Domling et al., 2005a; Ellman et al., 2009; Hoefle et al., 2001 и 2006a; Patterson et al., 2007 и 2008; Richter,2008; Vlahov et al., 2009; Wang et al., 2007 и Wipf et al., 2007 и 2010. В исследованиях SAR в основном использованы структурные изменения в Mep кольце, остатках RB и RC Tuv субъединицы и ароматическом кольце или алифатической углеродной цепи Tup/Tut субъединицы.Domling et al., 2005 предложил конъюгаты тубулизинов с партнерской молекулой, в целом описанные как полимер или биомолекула, но конкретные примеры ограничивались полиэтиленгликолем (PEG) в качестве партнерской молекулы. Другими документами, описывающими конъюгаты тубулизинов, являются Boyd et al., 2008 и 2010; Vlahov et al., 2008a, 2008b и 2010; Leamon et al., 2008 и 2009; Reddy et al.,2009 и Low et al., 2009. Leung et al., 2002 предложил полианионные полипептиды, которые могут быть конъюгированы с лекарственными средствами (включая тубулизины) для улучшения их биоактивности и растворимости в воде.Davis et al., 2008 и Schluep et al., 2009 предложили составы на основе циклодекстрина, в которых тубулизины ковалентно присоединены к циклодекстрину посредством гидразид-дисульфидной линкерной группы, присоединенной к Tup/Tut карбоксильной группе. Сущность изобретения Настоящее изобретение предлагает новые антипролиферативные соединения, структурно родственные тубулизинам, которые являются цитотоксичными или цитостатичными в отношении многих раковых клеток, и, как полагают, обладают антимитотическим механизмом действия. Данные соединения могут быть конъюгированы с лигандами, такими как антитела, для направленной доставки против раковых клеток. В одном варианте данное изобретение предлагает соединение, имеющее структуру, представленную формулой (II)R5 представляет собой C1-C5-алкил; или его фармацевтически приемлемый сложный эфир или его фармацевтически приемлемую соль. Предпочтительно, чтобы R4 представлял собой со стереохимией метильной группы в альфа-положении к карбоксильной, являющейся более предпочтительной, чем группа, соответствующая природным тубулизинам, а именно: Настоящее изобретение также предлагает новые промежуточные соединения, эффективные для синтеза соединений согласно формуле (II). В другом варианте изобретение предлагает соединение данного изобретения, конъюгированное через линкерную группу с лигандом (предпочтительно антителом, более предпочтительно моноклональным антителом и более всего предпочтительно человеческим моноклональным антителом) для его селективной доставки в целевую клетку, такую как раковая клетка. В другом варианте предложен способ лечения рака у субъекта, страдающего от него, предусматривающий введение субъекту терапевтически эффективного количества соединения изобретения или его конъюгата с лигандом (в частности, антителом). В другом варианте предложено применение соединения данного изобретения (или его конъюгата с лигандом (в частности, антителом для приготовления лекарственного средства для лечения рака. В этих вариантах раком может быть колоректальный рак, рак печени, рак предстательной железы, рак молочной железы, меланома, глиобластома, рак легкого, рак поджелудочной железы, рак яичника, множественная миелома, рак почки, лейкоз или лимфома. Когда лигандом является антитело, предпочтительно, чтобы антитело связывалось с антигеном, экспрессирующимся раковыми клетками. Краткое описание чертежей На фиг. 1 а и 1b показана, в комбинации, схема 1 получения соединений данного изобретения. На фиг. 2 и 3 показаны схемы 2 и 3 соответственно также для получения соединений данного изобретения. На фиг. 4 показана схема 4, подходящая для присоединения пептидильного линкера и малеимидной реакционноспособной группы к соединениям данного изобретения. На фиг. 5-7 показаны схемы 5-7 соответственно для получения соединений данного изобретения. На фиг. 8 а, 8b и 8 с показаны схемы 8, 9 и 10 соответственно для получения промежуточных соединений, эффективных для приготовления соединений данного изобретения. На фиг. 9 и 10 показаны схемы 11 и 12, соответственно иллюстрирующие способ получения соединений данного изобретения из промежуточных соединений, показанных на фиг. 8 а-8 с. На фиг. 11 а и 11b показаны графики для анализов пролиферации методом по включению 3 Нтимидина для первого набора соединений данного изобретения в отношении двух разных типов раковых клеток. На фиг. 12 а и 12b показаны графики для анализов пролиферации при помощи люминесцентного АТР-анализа для второго набора соединений данного изобретения в отношении двух разных типов раковых клеток. На фиг. 12 с и 12d показаны графики для анализов пролиферации методом по включению 3 Н-тимидина для этого же второго набора соединений и в отношении этих же двух типов раковых клеток. На фиг. 13 показана активность конъюгатов соединений данного изобретения в отношении раковых клеток почки в анализах пролиферации методом по включению 3 Н-тимидина. На фиг. 14 показана активность конъюгатов соединений данного изобретения в отношении раковых клеток почки в исследованиях ксенотрансплантата. На фиг. 15 показана схема 13 получения промежуточных соединений, эффективных для получения соединений данного изобретения. На фиг. 16 показана схема 14 получения соединений данного изобретения из промежуточных соединений, полученных согласно схеме 13. На фиг. 17 и 18 показаны схемы 15 и 16 соответственно получения соединений данного изобретения, готовых к конъюгированию. На фиг. 19 показана схема 17 получения промежуточного соединения, эффективного для получения соединений данного изобретения. На фиг. 20 а и 20b показана в комбинации схема 18 приготовления соединений данного изобретения из промежуточного соединения схемы 17. На фиг. 21 показана схема 19 получения промежуточного соединения, которое использовали в схеме 18. На фиг. 22 показана схема 20 синтеза промежуточного соединения, которое использовали для получения соединений данного изобретения. На фиг. 23 показана схема 21 получения соединений данного изобретения из промежуточного соединения схемы 20. На фиг. 24 показана схема 22 получения еще другого промежуточного соединения, эффективного для получения соединений данного изобретения. На фиг. 25 показана схема 23 получения соединений данного изобретения из промежуточного соединения схемы 22. Подробное описание изобретения Определения. Термин "антитело" включает целые антитела и любой антигенсвязывающий фрагмент (т.е. "антигенсвязывающую часть") или их одиночные цепи. Целое антитело относится к гликопротеину, содержащему по меньшей мере две тяжелые (H) и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи, состоящей из трех доменов, CH1 CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (VL или VK) и константной области легкой цепи, состоящей из одного домена CL. Области VH и VL дополнительно можно подразделить на участки гипервариабельности, называемые областями, определяющими комплементарность (CDR), разбросанные между участками, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трехCDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1,FR2, CDR2, FR3, CDR3 и FR4. Вариабельные области содержат связывающий домен, который взаимодействует с антигеном. Константные области могут опосредовать связывание антитела с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента. Антитело "специфически связывается" с антигеном X, если антитело связывается с антигеном X с аффинностью (KD) 510-8 М или меньше, более предпочтительно 110-8 М или меньше, более предпочтительно 610-9 М или меньше, более предпочтительно 310-9 М или меньше, даже более предпочтительно 210-9 М или меньше. Антитело может быть химерным, гуманизированным или предпочтительно человеческим. Константная область тяжелой цепи может быть разработана для воздействия на тип или степень гликолизирования, для увеличения периода полужизни антитела, для усиления или уменьшения взаимодействий с эффекторными клетками или комплементарной системой или для модулирования некоторого другого свойства. Инжиниринг может быть выполнен путем замены, добавления или делеции одной или более аминокислот, или путем замены домена на домен другого типа иммуноглобулина или комбинацией вышеперечисленного. Термины "фрагмент антитела" и "антигенсвязывающая часть" антитела (или просто "часть антитела") относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами антитела полной длины, такими как (i) Fab фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2 фрагмент, бивалентный фрагмент, содержащий два Fab фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fab' фрагмент, который в основном является Fab с частью шарнирной области (см., например, Abbas et al. Cellular and(v) Fv фрагмент, состоящий из VL и VH доменов одного плеча антитела; (vi) dAb фрагмент (Ward et al.,(1989), Nature, 341:544-546), который состоит из VH домена; (vii) выделенные участки, определяющие комплементарность (CDR); и (viii) нанотело, вариабельный участок тяжелой цепи, содержащий один вариабельный участок и два константных участка. Кроме того, хотя два домена Fv фрагмента VL и VH кодируются отдельными генами, их можно объединить, используя рекомбинантные методы, посредством синтетического линкера, что позволяет выполнить их в виде одной белковой цепи, в которой VL и VH области образуют пару для формирования моновалентных молекул (известных как одноцепочечные Fv или scFv); см., например, Bird et al. (1988), Science, 242:423-426 и Huston et al. (1988), Proc. Natl. Acad.Sci. USA, 85:5879-5883). Предполагается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающая часть" антитела. Термин "выделенное антитело" означает антитело, которое практически не содержит другие антитела, имеющие отличные антигенные специфичности (например, выделенное антитело, которое специфически связывается с антигеном X, практически не содержит антитела, которые специфически связываются с антигенами, отличными от антигена X). Выделенное антитело, которое специфически связывается с антигеном X, может, однако, обладать перекрестной реактивностью с другими антигенами, выделенными у других видов. В определенных вариантах выделенное антитело специфически связывается с человеческим антигеном X и не имеет перекрестной реактивности с другими (нечеловеческими) антигенами антигена X. Более того, выделенное антитело, как правило, практически не содержит другой клеточный материал и/или химические вещества. Термин "моноклональное антитело" или "композиция моноклонального антитела" относится к препарату молекул антител одного молекулярного состава, который демонстрирует одну связывающую специфичность и аффинность для конкретного эпитопа. Термин "человеческое антитело" относится к антителу, имеющему вариабельные участки, в которых оба, каркасный и CDR учаски (и константный участок в случае наличия) выделены из последовательностей зародышевого иммуноглобулина человека. Человеческие антитела могут включать последующие модификации, включающие природные или синтетические модификации. Человеческие антите-4 022288 ла могут включать остатки аминокислот, не кодируемые последовательностями зародышевого иммуноглобулина человека (например, мутации, интродуцированные ненаправленным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo). Однако термин "человеческое антитело" не включает антитела, в которых последовательности CDR, выделенные из эмбрионов других видов млекопитающих, таких как мышь, были пересажены на человеческие скелетные последовательности."Человеческое моноклональное антитело" относится к антителу, проявляющему одну связывающую специфичность, которое имеет вариабельную и константную области, выделенные из последовательностей иммуноглобулина человеческих зародышевых линий. В одном варианте человеческие моноклональные антитела продуцируются гибридомой, которая включает В-клетку, полученную от трансгенного животного, отличного от человека, например трансгенной мыши, геном которой содержит трансген человеческой тяжелой цепи и трансген легкой цепи, слитую с иммортализованной клеткой."Алифатическая" означает углеводородную неароматическую группировку с прямой или разветвленной цепью, которая является насыщенной или ненасыщенной, имеющую определенное количество атомов углерода (например, "С 3-алифатическая", "C1-C5-алифатическая" или "от C1 доC5-алифатическая", причем последние два выражения являются синонимами для обозначения алифатической группировки, имеющей от 1 до 5 атомов углерода), или, в случае когда количество атомов углерода не указано, от 1 до 4 атомов углерода (от 2 до 4 атомов углерода в случае ненасыщенных алифатических группировок)."Алкил" означает насыщенную алифатическую группировку с тем же самым принципом обозначения количества атомов углерода. Так, в качестве иллюстрации C1-C4-алкильные группировки включают метил, этил, пропил, изопропил, изобутил, t-бутил, 1-бутил, 2-бутил и т.п., но ими не ограничиваются."Алкенил" означает алифатическую группировку, имеющую по меньшей мере одну двойную связь углерод-углерод, с тем же самым принципом обозначения количества атомов углерода. Так, в качестве иллюстрации C2-C4-алкенильные группировки включают этенил (винил), 2-пропенил (аллил или проп-2-енил), цис-1-пропенил, транс-1-пропенил, Е- (или Z-)-2-бутенил, 3-бутенил, 1,3-бутадиенил(бут-1,3-диенил) и т.п., но ими не ограничиваются."Алкинил" означает алифатическую группировку, имеющую по меньшей мере одну тройную связь углерод-углерод, с тем же самым принципом обозначения количества атомов углерода. Так, в качестве иллюстрации C2-C4-алкинильная группа включает этинил (ацетиленил), пропаргил (проп-2-инил),1-пропинил, бут-2-инил и т.п., но ими не ограничиваются."Циклоалифатическая группировка" означает насыщенную или ненасыщенную неароматическую углеводородную группу, имеющую от 1 до 3 колец, каждое из которых содержит от 3 до 8 (предпочтительно от 3 до 6) атомов углерода. "Циклоалкил" означает циклоалифатическую группировку, в которой каждое кольцо является насыщенным. "Циклоалкенил" означает циклоалифатическую группировку, в которой по меньшей мере одно кольцо содержит по меньшей мере одну двойную связь углерод-углерод."Циклоалкинил" означает циклоалифатическую группировку, в которой по меньшей мере одно кольцо содержит по меньшей мере одну тройную связь углерод-углерод. Так, в качестве иллюстрации циклоалифатические группировки включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклооктил и адамантил, но не ограничиваются ими. Предпочтительными циклоалифатическими группировками являются циклоалкильные группировки, особенно циклопропил, циклобутил, циклопентил и циклогексил."Гетероциклоалифатическая группировка" означает циклоалифатическую группировку, по меньшей мере в одном кольце которой вплоть до трех (предпочтительно 1 или 2) атомов углерода заменены гетероатомом, независимо выбранным из N, О или S, где N и S возможно могут быть окислены и N возможно может быть кватернизирован. Аналогично, "гетероциклоалкил", "гетероциклоалкенил" и "гетероциклоалкинил" означают циклоалкильную, циклоалкенильную или циклоалкинильную группировки соответственно, в которых по меньшей мере одно из их колец модифицировано указанным образом. Примеры гетероциклоалифатической группировки включают азиридинил, азетидинил, 1,3-диоксанил, оксетанил, тетрагидрофурил, пирролидинил, пиперидинил, пиперазинил, татрагидропиранил, тетрагидротиопиранил, тетрагидротиопиранилсульфон, морфолинил, тиоморфолинил, тиоморфолинилсульфоксид,тиоморфолинилсульфон, 1,3-диоксоланил, тетрагидро-1,1-диоксотиенил, 1,4-диоксанил, тиетанил и т.п."Арил" означает углеводородную группировку, содержащую моно-, би- или трициклическую кольцевую систему, где каждое кольцо имеет от 3 до 7 атомов углерода и по меньшей мере одно кольцо является ароматическим. Кольца в такой кольцевой системе могут быть конденсированы друг с другом (как в нафтиле) или могут быть связаны друг с другом (как в бифениле) и могут быть конденсированы или связаны с неароматическими кольцами (как в инданиле или циклогексилфениле). В качестве дополнительной иллюстрации арильные группировки включают, без ограничения ими, фенил, нафтил, тетрагидронафтил, инданил, бифенил, фенантрил, антраценил или аценафтил."Гетероарил" означает группировку, содержащую моно-, би- или трициклицескую кольцевую систему, где каждое кольцо содержит от 3 до 7 атомов углерода и по меньшей мере одно кольцо является ароматическим кольцом, содержащим от 1 до 4 гетероатомов, независимо выбранных из N, О или S, гдеN и S возможно могут быть окислены и N возможно может быть кватернизирован. Такое содержащее по меньшей мере один гетероатом ароматическое кольцо может быть конденсировано с другими типами колец (как в бензофураниле или тетрагидроизохинолиле) или непосредственно соединено с другими типами колец (как в фенилпиридиле или 2-цикпопентилпиридиле). В качестве дополнительной иллюстрации гетероарильные группировки включают пирролил, фуранил, тиофенил (тиенил), имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, тетразолил, пиридил, N-оксопиридил,пиридазинил, пиримидинил, пиразинил, хинолинил, изохинолинил, хиназолинил, циннолинил, хинозалинил, нафтиридинил, бензофуранил, индолил, бензотиофенил, оксадиазолил, тиадиазолил, фенотиазолил, бензимидазолил, бензотриазолил, дибензофуранил, карбазолил, дибензотиофенил, акридинил и т.п. Если указано, что группировка может быть замещена, например, посредством использования терминов "замещенный или незамещенный" либо "возможно замещенный" в выражениях типа "замещенный или незамещенный C1-C5-алкил" или "возможно замещенный гетероарил", то это означает, что такая группировка может иметь один или более независимо выбранных заместителей, предпочтительно в количестве от одного до пяти, более предпочтительно в количестве один или два. Для получения соединений, которые являются химически стабильными и которые могут быть синтезированы способами, известными в данной области, такими как способы, раскрытые в данном описании, специалистом могут быть выбраны заместители и варианты замещения, подходящие для группировки, к которой этот заместитель присоединен."Арилалкил", "(гетероциклоалифатическая группировка)алкил", "арилалкенил", "арилалкинил","биарилалкил" и тому подобные термины означают соответственно алкильные, алкенильные или алкинильные группировки, замещенные арильной, гетероциклоалифатической, биарильной и т.д. группировками, соответственно с открытой (несвязанной) валентностью на алкильной, алкенильной или алкинильной группировке, например, как в бензиле, фенетиле, N-имидазоилэтиле, N-морфолиноэтиле и т.п. И наоборот, "алкиларил", "алкенилциклоалкил" и т.п. означает арильную, циклоалкильную и т.д. группировку, соответственно замещенную алкильной, алкенильной и т.д. группировкой, соответственно, например,как в метилфениле"Гидроксиалкил","галоалкил","алкиларил", "цианоарил" и т.п. означает алкильную, арильную и т.д. группировку, соответственно замещенную одним или более из числа указанных заместителей (гидроксил, галогено и т.д. соответственно). В качестве иллюстрации допустимые заместители включают, без ограничения ими, алкил (особенно метил или этил), алкенил (особенно аллил), алкинил, арил, гетероарил, циклоалифатическую группировку. гетероциклоалифатическую группировку, галогено (особенно фтор), галогеноалкил (особенно трифторметил), гидроксил, гидроксиалкил (особенно гидроксиэтил), циано, нитро, алкокси,-O-(гидроксиалкил), -O-(галогеноалкил) (особенно -OCF3), -O-(циклоалкил), -O-(гетероциклоалкил),-O-(арил), алкилтио, арилтио, =O, =NH, =N-(алкил), =NOH, =NO(алкил), -C(=O)-(алкил). -C(=O)Н, CO2H,-C(=O)NHOH,-C(=O)O-(алкил),-C(=O)O-(гидроксиалкил),-C(=O)NH2,-C(O)NH-(алкил),-C(=O)N-(алкил)2,-OC(=O)-(алкил),-OC(=O)-(гидроксиалкил),-OC(=O)O-(алкил),-OC(=O)O-(гидроксиалкил), -OC(=O)NH2, -OC(=O)NH-(алкил), -OC(=O)N-(алкил)2, азидо, -NH2,-NH-(алкил), -N-(алкил)2, -NH-(арил), -NH-(гидроксиалкил), -NHC(=O)-(алкил), -NHC(=O)H,-NHC(=O)NH2, -NHC(=O)NH-(алкил), -NHC(=O)N-(алкил)2, -NHC(=NH)NH2, -OSO2-(алкил), -SH,-S-(алкил), -S-(арил), -S-(циклоалкил), -S(=O)-алкил, -SO2-(алкил), -SO2NH2, -SO2NH-(алкил),-SO2N-(алкил)2 и т.п. Если замещенная группировка представляет собой алифатическую группировку, то предпочтительными заместителями являются арил, гетероарил, циклоалифатическая группировка, гетероциклоалифатическая группировка, галогено, гидроксил, циано, нитро, алкокси, -O-(гидроксиалкил),-O-(галогеноалкил), -O-(циклоалкил), -O-(гетероциклоалкил), -O-(арил), алкилтио, арилтио, =O, =NH,=N-(алкил). =NOH, =NO-(алкил), -CO2H, -C(=O)NHOH, -C(=O)O-(алкил), -C(=O)O-(гидроксиалкил),-C(=O)NH2, -C(=O)NH-(алкил), -C(=O)N-(алкил)2, -OC(=O)-(алкил), -OC(=O)-(гидроксиалкил),-OC(=O)O-(алкил), -OC(=O)O-(гидроксиалкил), -OC(=O)NH2, -OC(=O)NH-(алкил), -OC(=O)N-(алкил)2,азидо, -NH2, -NH-(алкил), -N-(алкил)2, -NH-(арил), -NH-(гидроксиалкил), -NHC(=O)-(алкил), -NHC(=O)H,-NHC(=O)NH2, -NHC(=O)NH-(алкил), -NHC(=O)N-(алкил)2, -NHC(=NH)NH2, -OSO2-(алкил), -SH,-S-(алкил), -S-(арил), -S(=O)-алкил, -S-(циклоалкил), -SO2-(алкил), -SO2NH2, -SO2NH-(алкил) и-SO2N-(алкил)2. Более предпочтительными заместителями являются галогено, гидроксил, циано, нитро, алкокси,-O-(арил),=O,=NOH,=NO-(алкил),-OC(=O)-(алкил),-OC(=O)O-(алкил),-OC(=O)NH2,-OC(=O)NH-(алкил), -OC(=O)N-(алкил)2, азидо, -NH2, -NH-(алкил), -N-(алкил)2, -NH-(арил),-NHC(=O)-(алкил), -NHC(=O)H, -NHC(=O)NH2, -NHC(=O)NH-(алкил), -NHC(=O)N-(алкил)2 и Если замещенная группировка представляет собой циклоалифатическую группировку, гетероциклоалифатическую группировку, арильную или гетероарильную группировку, то предпочтительными заместителями являются алкил, алкенил, алкинил, галогено, галогеноалкил, гидроксил, гидроксиалкил,циано, нитро, алкокси, -O-(гидроксиалкил), -O-(галогеноалкил), -O-(арил), -O-(циклоалкил),-O-(гетероциклоалкил), алкилтио, арилтио, -C(=O)-(алкил), -C(=O)H, -CO2H, -C(=O)NHOH,-C(=O)O-(алкил), -C(=O)O-(гидроксиалкил), -C(=O)NH2, -C(=O)NH-(алкил), -C(=O)N-(алкил)2,-OC(=O)-(алкил),-OC(=O)-(гидроксиалкил),-OC(=O)O-(алкил),-OC(=O)O-(гидроксиалкил),-OC(=O)NH2, -OC(=O)NH-(алкил), -OC(=O)N-(алкил)2, азидо, -NH2, -NH-(алкил), -N-(алкил)2, -NH-(арил),-NH-(гидроксиалкил),-NHC(=O)-(алкил),-NHC(=O)H,-NHC(=O)NH2,-NHC(=O)NH-(алкил),-NHC(=O)N-(алкил)2, -NHC(=NH)NH2, -OSO2-(алкил), -SH, -S-(алкил), -S-(арил), -S-(циклоалкил),-S(=O)-алкил, -SO2-(алкил), -SO2NH2, -SO2NH-(алкил) и -SO2N-(алкил)2. Более предпочтительными заместителями являются алкил, алкенил, галогено, галогеноалкил, гидроксил, гидроксиалкил, циано, нитро, алкокси, -O-(гидроксиалкил), -C(O)-(алкил), -C(=O)Н, -CO2H,-C(=O)NHOH,-C(=O)O-(алкил),-C(=O)O-(гидроксиалкил),-C(=O)NH2,-C(=O)NH-(алкил),-C(=O)N-(алкил)2,-OC(=O)-(алкил),-OC(=O)-(гидроксиалкил),-OC(=O)O-(алкил),-OC(=O)O-(гидроксиалкил), -OC(=O)NH2, -OC(=O)NH-(алкил), -OC(=O)N-(алкил)2, -NH2, -NH-(алкил),-N-(алкил)2, -NH-(арил), -NHC(=O)-(алкил), -NHC(=O)H, -NHC(=O)NH2, -NHC(=O)NH-(алкил),-NHC(=O)N-(алкил)2 и -NHC(=NH)NH2. Когда указан диапазон, как в выражениях "(от C1 до С 5)алкил" или "от 5 до 10%", то такой диапазон включает конечные точки диапазона, как в С 1 и С 5 в первом случае и 5 и 10% во втором случае. За исключением случаев, когда конкретно указаны отдельные стереоизомеры (например, посредством жирной или пунктирной связи по соответствующему стереоцентру в структурной формуле, посредством описания двойной связи как имеющей Е- или Z-конфигурацию в структурной формуле или путем использования обозначающей стереохимию номенклатуры), все стереоизомеры включены в объем изобретения как в виде чистых соединений, так и в виде их смесей. Если не указано иное, все индивидуальные энантиомеры, диастереомеры, геометрические изомеры и их комбинации охвачены настоящим изобретением. Опытные специалисты в данной области должны учесть, что соединения могут иметь таутомерные формы (например, кето- и энольные формы), резонансные формы и цвиттер-ионные формы, которые эквиваленты тем, которые отражены структурной формулой, используемой здесь, и что структурная формула охватывает такие таутомерные, резонансные или цвиттер-ионные формы.vivo (например, в организме человека) для получения родительского соединения или его соли, или имеетper se активность, аналогичную активности родительского соединения. Пригодные сложные эфиры включают C1-C5-алкильные, C2-C5-алкенильные или C2-C5-алкинильные сложные эфиры, особенно метил, этил или н-пропил."Фармацевтически приемлемая соль" означает соль соединения, пригодную для фармацевтической композиции. Когда соединение имеет одну или более основных функциональных групп, такая соль может представлять собой соль присоединения кислоты, такую как сульфат, гидробромид, тартрат, мезилат, малеат, цитрат, фосфат, ацетат, памоат (эмбонат), гидройодид, нитрат, гидрохлорид, лактат, метилсульфат, фумарат, бензоат, сукцинат, мезилат, лактобионат, суберат, тозилат и т.п. Если соединение имеет одну или более кислотных группировок, то указанная соль может представлять собой такую соль, как соль кальция, соль калия, соль магния, соль меглумина, соль аммония, соль цинка, соль пиперазина, соль трометамина, соль лития, соль холина, соль диэтиламина, соль 4-фенилциклогексиламина, соль бензатина, соль натрия, соль тетраметиламмония и т.п. Полиморфные кристаллические формы и сольваты также входят в объем данного изобретения. Соединения Предпочтительный вариант соединений формулы (II) представлен формулой (II-а) где n, R1, R2 и R3 являются такими, которые определены здесь выше в отношении формулы (II), и В соединениях формулы (II-а) субъединица, соответствующая Tup/Tut в природных тубулизинах,была уменьшена по размеру и липофильности по меньшей мере на два атома углерода путем удаления двух алифатических атомов углерода, следующих за карбоксильной группой, т.е. аминогруппа находится в -положении относительно карбоксильной группы вместо -положения относительно нее. В случае,-7 022288 когда R4 представляет собой 4-аминофенилаланин, аминогруппа составляет полярную группировку, которая затем уменьшает липофильность. Исследования SAR показали, что липофильность является важным фактором в биологической активности тубулизинов, а также их аналогов и производных. Steinmetzet al., 2004 и Neri et al., 2006 обнаружили, что более липофильные природные тубулизины, т.е. такие, которые имеют Tup субъединицу (RA равно Н в формуле I) вместо Tut субъединицы (RA равно OH в формуле I), проявляли большую биологическую активность. Кроме того, различия в активностях сохранялись благодаря размеру и липофильности 11-ацилокси остатка (группа RC в формуле (I в Tuv субъединице (Steinmetz et al., 2004). Эти результаты показывают, что липофильная Tup/Tut субъединица является особенно важным элементом SAR. Указанные выше наблюдения частично подтвердились в двух исследованиях, проведенныхBalasubramanian et al. В первом исследовании (Balasubramanian et al., 2008) аналоги, диметилированные по углероду в альфа-положении к карбоксильной группе в Tup субъединице, сравнивали с другими идентичными аналогами, десметилированными по такому же положению. Диметилированные аналоги обладали большей антипролиферативной активностью, несмотря на то, что значения IC50 для in vitro ингибирования тубулина были сравнимыми, что можно было ожидать на основе их относительных липофильностей. Однако этому направлению не соответствовало второе исследование (Balasubramanian et al.,2009), в котором было произведено сравнение трех аналогов (один десметилированный по -углероду,один монометилированный и один диметилированный). Самым активным аналогом был десметилированный, в то время как монометилированный - т.е. с природной Tup субъединицей - был намного менее активным. Тем не менее, последний аналог имел дополнительные модификации в другом месте в молекуле, делающие ее преимущественно неактивной, делая неясным, какие выводы SAR могут быть сделаны.Patterson et al., 2007 и Ellman et al., 2009 сравнили цитотоксичности тубулизина D и аналогов, в которых только фенетильная или -карбоксигруппа удерживались в Tup субъединице. Аналог с удерживаемой фенетильной группой оказался от 3,6 до 13,6 раз менее активным, чем тубулизин D в отношении трех линий раковых клеток, но когда удерживалась менее липофильная -карбоксильная группа, наблюдалась даже большая потеря активности, аналог оказался от 25,7 до 62,5 раз менее активным. Таким образом, порядок активности был следующим: На основании указанных выше документов можно предположить, по отдельности и в комбинации,что липофильность в Tup локусе является особенно важной для биологической активности тубулизинов. Соответственно, известный уровень техники предполагает, что замена Tup субединицы на фенилаланин(Phe), 4-аминофенилаланин (4-NH2Phe). норвалин или другую субъединицу R4 в соответствии с формулой (II-а) является нежелательным, так как в каждом случае будет приводить к потере по меньшей мере двух алифатических атомов углерода и последующему уменьшению липофильности в Tup/Tut локусе. Другой предпочтительный вариант соединений формулы (II) представлен формулой (II-b) где n, R1, R2 и R3 являются такими, которые определены здесь выше в отношении формулы (II). Несмотря на то что химическую формулу можно найти в литературе, охватывающей -NH2 группу в 4-положении Tup ароматического кольца (Domling, 2005a и 2005b), раскрытия получения соединения,имеющего такой признак, не было сделано. В формулах (II), (II-а) и (II-b) R1 предпочтительно представляет собой Н, C1-C5-алкил,C2-C5-алкенил или C2-C5-алкинил и более предпочтительно представляет собой изолейцильный остаток,а именно-8 022288 В формулах (II), (II-а) и (II-b) R2 предпочтительно представляет собой Н, C1-C5-алкил,C2-C5-алкенил,CH2O(C1-C5-алкил),CH2O-(C2-C5-алкенил),CH2O(C=O)-(C1-C5-алкил) илиCH2OC(=O)-(C2-C5-алкенил); более предпочтительно представляет собой Н, Me, Et, n-Pr, CH2OMe,CH2OEt, CH2O(n-Pr), CH2OC(=O)i-Bu, CH2OC(=O)n-Pr, CH2OC(=O)CH=CH2 или CH2OC(=O)Me, при этомMe, n-Pr, CH2OMe, CH2OC(=O)i-Bu, и CH2O(n-Pr) являются более предпочтительными. В формулах (II), (II-а) и (II-b) R3 предпочтительно представляет собой Н, C1-C5-алкил,C2-C5-алкенил, C(=O)C1-C5-алкил или С(=O)C2-C5-алкенил; более предпочтительно представляет собой Н, Me, Et или С(=O)Me. Предпочтительно, чтобы в формулах (II) и (II-а) R4 и R4a представляли собой: В формулах (II), (II-а) и (II-b) n предпочтительно равно 1 и в случае формулы (II) R5 предпочтительно представляет собой метил; т.е. кольцо в Mep субъединице предпочтительно представляет собойN-метилпиперидинильное кольцо. Предпочтительный вариант соединений согласно формуле (II-а) представлен формулой (II-а') где R4a является таким, который определен выше в отношении формулы (II-а);R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)C1-C5-алкил или С(=O)C2-C5-алкенил. Предпочтительно, чтобы R2 представлял собой Н, Me, Et, n-Pr, CH2OMe, CH2OEt, CH2OC(=O)i-Bu,CH2OC(=O)n-Pr, CH2OC(=O)CH=CH2 или CH2OC(=O)Me; более предпочтительно Me, n-Pr, CH2OMe,CH2OC(=O)i-Bu или CH2O(n-Pr). Предпочтительно, чтобы R3 представлял собой Н, Me, Et или С(=O)Me. Предпочтительный вариант соединений согласно формуле (II-b) представлен формулой (II-b')R3 представляет собой Н, C1-C5-алкил, C2-C5-алкенил, C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил. Предпочтительно, чтобы R2 представлял собой Н, Me, Et, n-Pr, CH2OMe, CH2OEt, CH2OC(=O)i-Bu,CH2OC(=O)n-Pr, CH2OC(=O)CH=CH2 или CH2OC(=O)Me и R3 представлял собой Н, Me, Et или С(=O)Me. Если карбоксильная группа в R4 является этерифицированной, предпочтительно, чтобы сложный эфир представлял собой C1-C5-алкильный сложный эфир, такой как Me, Et или Pr сложный эфир. Или же карбоксильная группа может быть амидирована аммиаком или алкиламином. В другом варианте данное изобретение предлагает соединение, имеющее структуру, представленную формулой (II-с)R15 представляет собой Н или C1-C5-алкил (предпочтительно Н, Me или Et). В формулах (II-b), (II-b') и (II-с) стереохимия метила, находящегося в альфа-положении к карбоксилу, предпочтительно является такой, которая соответствует природным тубулизинам, т.е. В предпочтительном варианте соединение данного изобретения находится в форме амида карбоксильной группы в R4 (или R4a, в зависимости от конкретного случая) с -аминогруппой-аминокислоты. -Аминокислота может быть выбрана из группы, состоящей из протеиногенной аминокислоты, 4-аминофенилаланина, норвалина, норлейцина и цитруллина. Предпочтительно, чтобы-аминокислота была выбрана из группы, состоящей из аланина, новалина, глицина, лизина, цитруллина,норлейцина, 4-аминофенилаланина и фенилаланина. Также предпочтительно, чтобы абсолютная конфигурация -аминокислоты являлась протеиногенной, т.е. L. В этом предпочтительном варианте R4 (или Конкретные примеры соединений данного изобретения согласно формуле (II) включают соединения от (III-а) до (III-у). Некоторые из соединений показаны в виде фармацевтически приемлемых сложных эфиров или фармацевтически приемлемого амида R4 карбоксильной группы с -аминогруппой-аминокислоты или ее сложного метилового эфира: Кроме того, данное изобретение предлагает новые промежуточные соединения, которые могут быть использованы для синтеза соединений данного изобретения. Соединения согласно формуле (VIII-а) могут использоваться для получения соединений согласно формуле (II) или (II-b), как показано на фигурах и примерах, представленных здесь. В формуле (VIII-а) R7 представляет собой Н или защитную группу амина и R8 представляет собой Н. Предпочтительно, чтобы R7 представлял собой Н, Boc (t-бутоксикарбонил), Troc Другое новое промежуточное соединение, эффективное для синтеза соединений данного изобретения, имеет структуру согласно формуле (VIII-b). Применение соединений формулы (VIII-b) для получения соединений данного изобретения показано в фигурах и примерах, представленных здесь. В формуле (VIII-b) R9 и R10 независимо представляют собой Н или защитную группу амина и R11 представляет собой Н. Предпочтительно, чтобы R9 и R10 были независимо выбраны из Н, Boc, Troc, Врос,Cbz, Aloc, метиламина и Fmoc. Предпочтительно, чтобы R11 представлял собой Н или C1-C5-алкил (особенно Me). Предпочтительно, чтобы в случае, когда каждый R9 и R10 представляет собой защитную группу амина, они были разными защитными группами. Дополнительные подходящие защитные группы амина для соединений формул (VIII-а) и (VIII-b) раскрыты в Greene and Wuts, Protective Groups in Organic Synthesis, 3rd edition, p. 464-653 (John WileySons, New York, 1999), раскрытие которых включено здесь в виде ссылки. Конъюгаты. В другом аспекте предложен конъюгат, содержащий цитотоксическое соединение согласно данному изобретению, и лиганд, представленный формулой (IV) где Z представляет собой лиганд;D представляет собой цитотоксическое соединение согласно данному изобретению и(XD)aC(XZ)b совместно называется "линкерной группой" или "линкером", так как они связываютZ и D. В пределах линкера С представляет собой отщепляемую группу, которая должна отщепляться в месте предполагаемого биологического действия соединения D; XD и XZ называются спейсерными группами (или "спейсерами"), так как они отделяют D и С и С и Z соответственно; нижние индексы а и b независимо равны 0 или 1 (т.е. присутствие XD и/или XZ является необязательным) и нижний индекс m равен 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 (предпочтительно 1, 2, 3 или 4). D, XD, С, XZ и Z более подробно описаны далее. Лиганд Z, например антитело, выполняет нацеливающую функцию. Путем связывания с целевой тканью или клеткой, где расположен его антиген или рецептор, лиганд Z направляет туда конъюгат. Предпочтительно, чтобы целевой тканью или клеткой являлась раковая ткань или клетка и антигеном или рецептором являлся опухоль-ассоциированный антиген, т.е. антиген, который экспрессируется только раковыми клетками или сверхэкспрессируется раковыми клетками, по сравнению с нераковыми клетками. При отщеплении группы С в целевой ткани или клетке происходит высвобождение соединения D,которое локально проявляет свое цитотоксическое действие. В некоторых случаях конъюгат интернализован в целевую клетку путем эндоцитоза и отщепление происходит в пределах целевой клетки. Таким образом, точная доставка соединения D достигается в месте предполагаемого действия, снижая необходимую дозу. Также соединение D обычно является биологически неактивным (или значительно менее активным) в конъюгированном состоянии, тем самым уменьшая нежелательную токсичность в отношении нецелевых тканей или клеток. Поскольку, как правило, противораковые лекарственные средства являются высокотоксичными для клеток, это является важным фактором. Как отражено нижним индексом m, каждая молекула лиганда Z может быть конъюгирована более чем с одним соединением D, в зависимости от количества доступных для конъюгирования сайтов D и используемых экспериментальных условий. Опытные в данной области специалисты должны учесть,что, несмотря на то что каждая отдельная молекула лиганда Z конъюгирована с целым числом соединений D, при анализе состав конъюгата может иметь не целое значение соотношения соединений D к лиганду Z, отражая статистическое среднее значение. Лиганд Z и его конъюгирование. Предпочтительно, чтобы лиганд Z представлял собой антитело. Для удобства и краткости, но не ограничения, подробное последующее описание конъюгирования лиганда Z представлено при условии, что лиганд является антителом, но опытному специалисту будет понятно, что могут быть конъюгированы другие типы лиганда Z, mutatis mutandis. Например, конъюгаты с фолиевой кислотой в качестве лиганда могут поражать клетки, имеющие фолатный рецептор на их поверхностях (Vlahov et al., 2008a, 2008b и 2010; Leamon et al., 2009). По этой же причине подробное последующее описание представлено при условии соотношения 1:1 антитела Z к соединению D. Предпочтительно, чтобы лиганд Z представлял собой антитело против опухоль-ассоциированного антигена, что позволяет конъюгату, содержащему такой лиганд Z, селективно поражать раковые клетки. Примеры таких антигенов включают мезотелин, простатаспецифичный мембранный антиген (PSMA),CD19, CD22, CD30, CD70, В 7 Н 4 (также известный как О 8 Е), протеин-тирозин киназу 7 (PTK7), RG1,- 14022288CTLA-4 и CD44. Антитело может быть животного происхождения (например, мышиным), гибридным,гуманизированным или предпочтительно человеческим. Антитело предпочтительно является моноклональным, особенно моноклональным человеческим антителом. Приготовление человеческих моноклональных антител против некоторых перечисленных выше антигенов раскрыто в Korman et al.,US 2009/0074660 A1 (B7H4); Rao-Naik et al., US 2009/0142349 A1 A2 (CD19); King et al., WO 2008/070569(RG1); Terrett et al., WO 2009/045957 A1 (мезотелин) и Xu et al., US 2010/0092484 A1 (CD44); раскрытия которых включены здесь в виде ссылки. Лиганд Z также может представлять собой фрагмент антитела или миметик антитела, например аффитело, доменное антитело (dAb), нанотело, Unibody, DARPin, антикалин, Versabody, дуокалин, липокалин или авимер. Любая из нескольких разных реакционноспособных групп на лиганде Z может быть сайтом конъюгирования, включая -аминогруппы лизиновых остатков, концевые углеводные группы, карбоксильные группы, дисульфидные группы и тиольные группы. Каждый тип реакционноспособной группы является вариантом, имеющим некоторые преимущества и недостатки. Для обзора реакционноспособных групп антител, пригодных для конъюгирования, см., например, Garnett, Adv. Drug Delivery Rev. 53 (2001), 171216 and Dubowchik and Walker, PharmacologyTherapeutics, 83 (1999), 67-123, раскрытия которых включены здесь в виде ссылки. В одном варианте лиганд Z конъюгирован через -аминогруппу лизина. Большинство антител имеют -аминогруппы лизина, которые могут быть конъюгированы через амидные, мочевиновые, тиомочевиновые или карбаматные связи способами, известными в данной области, включая модификацию гетеробифункциональным агентом (как описано здесь далее). Однако трудно контролировать, какие и сколько -аминогрупп прореагировало, что приводит к возможной вариабельности между группами в составах конъюгатов. Кроме того, конъюгирование может вызвать нейтрализацию протонированной -аминогруппы, важной для сохранения нативной конформации антитела, или может происходить в лизине около или в антигенсвязывающем участке, что также является нежелательным. В другом варианте лиганд Z может быть конъюгирован через углеводную боковую цепь, так как много антител являются гликозилированными. Углеводная боковая цепь может быть окислена периодатом для получения альдегидной группы, которая, в свою очередь, может взаимодействовать с аминами с образованием иминогруппы, такой как в семикарбазоне, оксиме или гидразоне. При желании, иминогруппу можно конвертировать в более стабильную аминогруппу путем восстановления цианоборогидридом натрия. Для дополнительного раскрытия конъюгирования через углеводные боковые цепи, см., например, Rodwell et al., Proc. Nat'l Acad. Sci. USA, 83, 2632-2636 (1986); раскрытие которых включено здесь полностью в виде ссылки. В отношении -аминогрупп лизина существуют проблемы, связанные с воспроизводимостью расположения участка(ов) конъюгирования и стехиометрией. В еще другом варианте лиганд Z может быть конъюгирован через карбоксильную группу. В одном варианте концевая карбоксильная группа функционализирована для получения карбогидразида, который затем взаимодействует с несущей альдегид группой конъюгирования. См. Fisch et al., BioconjugateChemistry, 1992, 3, 147-153. В еще другом варианте антитело Z может быть конъюгировано через дисульфидную группу, связывая цистеиновый остаток на антителе Z и серу на другой части конъюгата. Некоторые антитела не содержат свободных тиольных (сульфгидрильных) групп, но имеют дисульфидные группы, например, в шарнирной области. В таком случае свободные тиольные группы могут быть получены путем восстановления нативных дисульфидных групп. Тиольные группы, полученные таким способом, могут затем использоваться для конъюгирования. См., например, Packard et al., Biochemistry, 1986, 25, 3548-3552; Kinget al., Cancer Res. 54, 6176-6185 (1994) и Doronina et al., Nature Biotechnol. 21(7), 778-784 (2003); раскрытия которых включены здесь в виде ссылки. Существует проблемы, связанные с расположением участка конъюгирования, стехиометрией и возможным разрушением нативной конформации антитела. Известен ряд способов введения свободных тиольных групп в антитела без нарушения нативных дисульфидных связей, способов, которые могут осуществляться на практике с лигандом Z данного изобретения. В зависимости от используемого способа, возможно введение прогнозируемого количества свободных сульфгидрилов в заданные участки. В одном подходе были приготовлены мутированные антитела, в которых цистеин замещен другой аминокислотой. См., например, Eigenbrot et al., US 2007/0092940 A1; Chilkoti et al., Bioconjugate Chem. 1994, 5, 504-507; Urnovitz et al., US 4698420 (1987);Biol. Chem., 269 (10), 7610-7618 (1994); Poon et al., J. Biol. Chem., 270 (15), 8571-8577 (1995). В другом подходе дополнительный цистеин добавлен к С-концу. См., например, Cumber et al., J. Immunol, 149, 120126 (1992); King et al., Cancer Res., 54, 6176-6185 (1994); Li et al., Bioconjugate Chem., 13, 985-995 (2002);(2004). Предпочтительный способ введения свободных цистеинов представлен в Liu et al.,WO 2009/026274 A1, в котором цистеин, несущий аминокислотную последовательность, добавлен к С-концу тяжелой цепи антитела. В этом способе вводится известное число цистеиновых остатков (один на тяжелую цепь) в известный участок, удаленный от антигенсвязывающего участка. Раскрытия документов, размещенных в этом разделе, включены здесь в виде ссылки. В еще другом варианте -аминогруппы лизина могут быть модифицированы гетеробифункциональными реагентами, такими как 2-иминотиолан или N-сукцинимидил-3-(2-пиридилдитио)пропионат(SPDP), конвертируя -аминогруппу в тиольную или дисульфидную группу - создавая цистеиновый имитатор. Однако этот способ имеет такие же ограничения по участку конъюгирования и стехиометрии, связанные с -аминогруппами. В еще другом предпочтительном варианте лиганд Z конъюгирован через продукт нуклеофильного присоединения тиольной группы к акцепторной группе. Предпочтительная акцепторная группа представляет собой малеимидную группу, взаимодействие которой с тиольной группой антитела в целом проиллюстрировано ниже. Тиольная группа может быть нативной или введенной, как описано выше. Линкер -(XD)aC(XZ)b-. Как отмечено выше, линкерная часть конъюгата данного изобретения содержит до трех элементов: отщепляемую группу С и необязательные спейсеры XZ и XD. Ощепляемая группа С представляет собой группу, которая отщепляется под воздействием физиологических условий, и предпочтительно выбрана таким образом, что является относительно стабильной при нахождении конъюгата в общей циркуляции в плазме крови, но легко отщепляется при достижении конъюгатом своего участка предполагаемого действия, а именно около или в пределах целевой клетки. Предпочтительно, чтобы конъюгат был интернализован путем эндоцитоза целевой клеткой при связывании антитела Z с антигеном, расположенным на поверхности целевой клетки. Следовательно, отщепление группы С возникает в везикулярном теле целевой клетки (ранняя эндосома, поздняя эндосома или в особенности лизосома). В одном варианте группа С является pH-чувствительной группой. РН в плазме крови немного выше нейтрального, в то время как pH внутри лизосомы является кислым, примерно 5. Таким образом, группа С, чье отщепление является кислотно-катализируемым, будет отщепляться внутри лизосомы со скоростью, которая на несколько порядков выше, чем в плазме крови. Примеры пригодных чувствительных к кислотности групп включают цис-аконитил амиды и гидразоны, как описано в Shen et al., US 4631190Yang et al., Proc. Natl Acad. Sci (USA), 85, 1189-1193 (1988); раскрытия которых включены здесь в виде ссылки. В другом варианте группа С представляет собой дисульфид. Дисульфиды могут отщепляться реакцией тиол-дисульфидного обмена при скорости, зависящей от концентрации окружающего тиола. Так как внутриклетчная концентрация глутатиона и других тиолов выше, чем их сывороточные концентрации, скорость отщепления дисульфида будет выше внутриклеточно. Кроме того, скорость реакции тиолдисульфидного обмена может модулироваться установлением стерических и электронных характеристик дисульфида (например, алкил-арил дисульфид в сравнении с алкил-алкил дисульфидом; замещение на арильном кольце и др.), что позволяет конструировать дисульфидные связи, которые имеют повышенную стабильность в сыворотке или конкретную скорость отщепления. Для дополнительных раскрытий,относящихся к дисульфидным отщепляемым группам в конъюгатах, см., например, Thorpe et al., CancerRes. 48, 6396-6403 (1988); Santi et al., US 2005/0287155 A1; Ng et al., US 6989452 B2 (2006); Ng et al.,WO 2002/096910 A1; Boyd et al., US 7691962 B2 и Sufi et al., WO 2008/083312 A2; раскрытия которых включены здесь в виде ссылки. Предпочтительная группа С содержит пептидную связь, которая отщепляется преимущественно протеазой в предполагаемом участке действия, в отличие от отщепления протеазой в сыворотке. Как правило, группа С содержит от 1 до 20 аминокислот, предпочтительно от 1 до 6 аминокислот, более предпочтительно от 1 до 3 аминокислот. Аминокислота(ы) может быть природной и/или неприродной-аминокислотой. Природными аминокислотами являются аминокислоты, которые кодируются генетическим кодом, а также аминокислоты, которые впоследствии являются модифицированными, например гидроксипролин, -карбоксиглутамат, цитруллин и О-фосфосерин. Термин "аминокислота" также включает аналоги аминокислоты и миметики. Аналоги аминокислот относятся к соединениям, которые имеют такую же основную химическую структуру H2N(R)CHCO2H, как природная аминокислота, за исключением того, что R группа не обнаружена среди природных аминокислот. Примеры аналогов включают гомосерин, норлейцин, метионинсульфоксид и метионинметилсульфоний. Миметики аминокислот отно- 16022288 сятся к химическим соединениям, которые имеют структуру, отличную от общей химической структуры-аминокислоты, но действуют подобно природной аминокислоте. Термин "неприродная аминокислота" представляет "D"-стереохимическую форму, природные аминокислоты имеют "L" форму. Предпочтительно, чтобы группа С содержала аминокислотную последовательность, которая является распознаваемой последовательностью для отщепления протеазой. Много распознаваемых последовательностей для отщепления известно в данной области. См., например, Matayoshi et al. Science, 247: 954 (1990); Dunn et al. Meth. Enzymol. 241: 254 (1994); Seidah et al. Meth. Enzymol. 244: 175 (1994);Enzymol. 244: 412 (1994) и Bouvier et al. Meth. Enzymol. 248: 614 (1995); раскрытие которых включено здесь в виде ссылки. Для конъюгатов, которые не предполагаются быть интернализованными клеткой, группа С может быть выбрана таким образом, чтобы отщепляться протеазой, присутствующей во внутриклеточном матриксе вблизи от целевой ткани, например протеазой, высвобождаемой расположенными рядом умирающими клетками или опухоль-ассоциированной протеазой. Примерами внутриклеточных опухольассоциированных протеаз являются матриксные металлопротеиназы (ММР), тимет-олигопептидаза(ТОР) и CD10. Для конъюгатов, которые разработаны, чтобы быть интернализованными клеткой, группа С предпочтительно содержит аминокислотную последовательность, выбранную для отщепления эндосомальной или лизосомальной протеазой, в особенности последней. Неограничивающие примеры таких протеаз включают катепсины В, С, D, H, L и S, в особенности катепсин В. Катепсин В преимущественно отщепляет пептиды в последовательности -АА 2-АА 1-, где АА 1 является основной или аминокислотой с прочными водородными связями (такой как лизин, аргинин или цитруллин) и АА 2 является гидрофобной аминокислотой (такой как фенилаланин, валин, аланин, лейцин или изолейцин), например Val-Cit (гдеCit обозначает цитруллин) или Val-Lys. (Здесь аминокислотные последовательности написаны в N-к-C направлении, как в H2N-AA2-AA1-CO2H, если контекст не указывает иначе). Для дополнительной информации относительно расщепляемых катепсином групп см. Dubowchik et al., Biorg. Med. Chem. Lett. 8,3341-3346 (1998); Dubowchik et al., Bioorg. Med. Chem. Lett., 8, 3347-3352 (1998) и Dubowchik et al.,Bioconjugate Chem. 13, 855-869 (2002); раскрытия которых включены в виде ссылки. Другим энзимом,который может использоваться для отщепления пептидильных линкеров, является легумин, лизосомальная цистеинпротеаза, которая преимущественно отщепляет в Ala-Ala-Asn. В одном варианте группа С представляет собой пептид, содержащий две аминокислотные последовательности -АА 2-АА 1-, где АА 1 представляет собой лизин, аргинин или цитруллин и АА 2 представляет собой фенилаланин, валин, аланин, лейцин или изолейцин. В другом варианте С состоит из последовательности от одной до пяти аминокислот, выбранных из группы, состоящей из Val-Cit, Ala-Val,Val-Ala-Val, Lys-Lys, Ala-Asn-Val, Val-Leu-Lys, Cit-Cit, Val-Lys, Ala-Ala-Asn, Lys, Cit, Ser и Glu. Приготовление и дизайн отщепляемых групп С, состоящих из одной аминокислоты, раскрыт в Chenet al., US 2010/0113476 A1, раскрытие которой включено здесь в виде ссылки. Группа С может также быть фотоотщепляемой, например нитробензиловый эфир, который отщепляется при воздействии света. Группа С может быть непосредственно соединена с антителом Z или соединением D; а именно,спейсеры XZ и XD в некоторых случаях могут отсутствовать. Например, если группа С представляет собой дисульфид, один или два атома серы могут быть цистеиновым остатком или его имитатором на антителе Z. Или же группа С может быть соединена гидразоном с альдегидом на углеводной боковой цепи антитела. Или же группа С может быть пептидной связью, образованной с -аминогруппой лизина антитела Z. В предпочтительном варианте соединение D непосредственно соединено с группой С посредством пептидильной связи с карбоксильной или аминогруппой в соединении D. В случае присутствия спейсер XZ обеспечивает пространственное разделение между группой С и антителом Z, чтобы образователь стерически не препятствовал связыванию антигена последним или последний стерически не препятствовал отщеплению образователя. Кроме того, спейсер XZ может использоваться для наделения конъюгатов свойствами повышенной растворимости или пониженной агрегации. Спейсер XZ может содержать один или более молулярных сегментов, которые могут собираться в любое количество комбинаций. Примерами пригодных сегментов для спейсера XZ являются: где индекс r равен от 1 до 24, предпочтительно от 2 до 4. Эти сегменты могут быть объединены для получения спейсеров XZ, таких как: Спейсер XD в случае присутствия обеспечивает пространственное разделение между группой С и соединением D, чтобы последнее не препятствовало стерически или электронно отщеплению образователя. Спейсер X также может служить для введения дополнительной молекулярной массы и функциональности в конъюгат. В целом дополнительная масса и функциональность будут влиять на период полураспада в сыворотке и другие свойства конъюгата. Таким образом, период полураспада в сыворотке конъюгата может быть модулирован путем тщательного отбора спейсерных групп. Спейсер XD также может собираться из раздельных сегментов, как описано выше в отношении спейсера XZ. Один из спейсеров XZ или XD или оба могут содержать самоуничтожаемую группу. Самоуничтожаемая группа представляет собой группу, которая (1) присоединена к группе С и антителу Z или цитотоксину D и (2) имеет такую структуру, при которой отщепление от группы С инициирует последовательность реакций, приводящих к нарушению связей самоуничтожаемой группы с антителом Z или цитотоксином D, в засисимости от ситуации. Другими словами, реакция в участке, удаленном от антитела Z или цитотоксина D (отщепление от группы С), вызывает разрушение связи XZ-Z или XD-D. Присутствие самоуничтожаемой группы является желательным в случае спейсера XD, так как, если после отщепления конъюгата спейсер XD или его часть остаются присоединенными к цитотоксину D, биологическая активность последнего может быть ослаблена. Использование самоуничтожаемой группы особенно желательно в случае, когда отщепляемая группа С представляет собой полипептид. Примеры самоуничтожаемых групп (i)-(v), присоединенных к гидроксильной или аминогруппе на партнерской молекуле D, показаны ниже: Самоуничтожаемая группа представляет собой структуру, расположенную между точечными линиями а и b, с примыкающими структурными особенностями. Самоуничтожаемые группы (i) и (v) присоединены к соединению D-NH2 (т.е. соединение D конъюгировано через аминогруппу), в то время как самоуничтожаемые группы (ii), (iii) и (iv) присоединены к соединению D-OH (т.е. соединение D конъюгировано через гидроксильную или карбоксильную группу). При отщеплении амидной связи по точечной линии b происходит высвобождение амидного азота как аминового азота, инициирующее последовательность реакций, приводящих к отщеплению связи по точечной линии а, и последующее высвобождение D-OH или D-NH2, в зависимости от ситуации. Для дополнительных раскрытий в отношении самоуничтожаемых групп см. Carl et al., J. Med. Chem., 24 (3), 479-480 (1981); Carl et al., WO 81/01145 (1981);A2; Feng, US 7375078 B2 и Senter et al., US 2003/0096743 A1; раскрытие которых включено здесь в виде ссылки. Соединение D - линкерные композиции. Конъюгаты данного изобретения предпочтительно приготовлены сначала объединением соединения D и линкера (XD)aC(XZ)b для образования композиции лекарственное средство-линкер, представленной формулой (V-a) где R31 представляет собой функциональную группу, пригодную для реакции с функциональной группой на антителе Z для формирования конъюгата. Примеры подходящих групп R31 включают: где R32 представляет собой Cl, Br, F, мезилат или тозилат и R33 представляет собой Cl, Br, I, F, OH,- 18022288-O-N-сукцинимидил, -О-(4-нитрофенил), -О-пентафторфенил или -О-тетрафторфенил. Химические вещества, в целом пригодные для приготовления подходящих групп D-(XD)aC(XZ)b-R31,раскрыты в Ng et al., US 7087600 B2 (2006); Ng et al., US 6989452 B2 (2006); Ng et al., US 7129261 B2et al., US 2008/0293800 A1; Sufi et al., WO 2008/083312 A2 и Chen et al., US 2010/0113476 A1; раскрытие которых включено здесь в виде ссылки. В предпочтительном варианте R31 представляет собой малеимидную группу и молекула цитотоксическое соединение-линкер может быть представлена формулой (V-b)R1, R2 и R3 независимо представляют собой Н, незамещенный или замещенный C1-C10-алкил, незамещенный или замещенный C2-C10-алкенил, незамещенный или замещенный C2-C10-алкинил, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный (CH2)1-2O-(C1-C10-алкил), незамещенный или замещенный (CH2)1-2O-(C2-C10-алкенил),незамещенный или замещенный(CH2)1-2OC(=O)-(C2-C10-алкинил), незамещенный или замещенный C(=O)-(C1-C10-алкил), незамещенный или замещенный С(=O)-(С 2-C10-алкенил), незамещенный или замещенный С(=O)-(С 2-C10-алкинил), незамещенную или замещенную циклоалифатическую группировку, незамещенную или замещенную гетероциклоалифатическую группировку, незамещенный или замещенный арилалкил или незамещенный или замещенный алкиларил;XD и XZ представляют собой спейсерные группы; С представляет собой отщепляемую группу и а и b независимо равны 0 или 1,при этом группа R4' соединена через карбоксильную или аминогруппу с группой XD в случае, когда а равно 1, или с группой С, когда а равно 0. Предпочтительно, чтобы связь между карбоксильной или аминогруппой в R4 и группой XD или С, в зависимости от ситуации, была через амидную связь. В структурах стереохимия метальной группы в альфа-положении к карбоксильной группе предпочтительно соответствует природным тубулизинам, т.е. Предпочтительно в формулах (V-b) n равно 1, R1 представляет собой изолейцильный остаток, а равно 0, b равно 1 и С содержит от одной до пяти аминокислот (предпочтительно от одной до двух),R4 соединен с С пептидильной связью, которая является энзиматически отщепляемой, R5 представляет собой Me. Этот предпочтительный вариант представлен формулой (V-c) где R2, R3 и R4' являются такими, которые определены в отношении формулы (V-b); каждый АА независимо представляет собой природную аминокислоту иXZ представляет собой CH2CH2NHC(=O)(CH2)2-5 или С(=O)(СН 2)2-5. Предпочтительные аминокислоты АА представляют собой лизин, цитруллин, аланин, валин, глицин и фенилаланин. В формуле (V-b) R1 предпочтительно представляет собой Н, C1-C5-алкил, C2-C5-алкенил илиC2-C5-алкинил, более предпочтительно изолейцильный остаток, а именно: В формулах (V-b) и (V-c) R2 предпочтительно представляет собой Н, C1-C5-алкил, C2-C5-алкенил,CH2O-(C1-C5-алкил), CH2O-(C2-C5-алкенил), CH2O(C=O)-(C1-C5-алкил) или CH2OC(=O)-(C2-C5-алкенил) и более предпочтительно Н, Me, Et, CH2OMe, CH2OEt, CH2OC(=O)i-Bu, CH2OC(=O)n-Pr,CH2OC(=O)CH=CH2 или CH2OC(=O)Me. В формулах (V-b) и (V-c) R3 предпочтительно представляет собой Н, C1-C5-алкил, C2-C5-алкенил,C(=O)-C1-C5-алкил или С(=O)-C2-C5-алкенил и более предпочтительно Н, Me, Et или С(=O)Me. В формулах (V-b) и (V-c) R4' предпочтительно представляет собой, и R12, тождественным Н, Me или Et, являющимся особенно предпочтительным. В формуле (V-b) n предпочтительно равно 1 и R5 предпочтительно представляет собой метил; т.е. кольцо в Mep субъединице предпочтительно представляет собой N-метилпиперидинильное кольцо. В другом варианте данное изобретение обеспечивает соединение, имеющее структуру, представленную формулой (V-d)R16 представляет собой лизиновую CH2)4NH2) или цитруллиновую CH2)3NHC(=O)NH2) группу боковой цепи;R17 представляет собой валиновую (С(Me)2) или аланиновую (Me) группу боковой цепи;p равно 0 или 1. Примеры специфических конструкций цитотоксическое соединение-линкер данного изобретения показаны ниже в формулах от (VI-а) до (VI-t). Соединение-линкер (VI-n) является особенно предпочтительным. Они имеют малеимидную группу и готовы для конъюгирования с антителом через сульфгидрильную группу способом, описанным ниже. Приготовление конъюгатов. Следующие иллюстративные способы основаны на введении свободных тиольных групп в антитело путем взаимодействия -аминогрупп лизина с 2-иминотиоланом с последующим взаимодействием с малеимид-содержащим конъюгатом лекарственное средство-линкерная группа, как описано выше. Сначала буфер антитела заменяли на 0,1 М фосфатный буфер (pH 8,0), содержащий 50 мМ NaCl и 2 мМ диэтилентриаминпентауксусную кислоту (DTPA), и концентрировали до 5-10 мг/мл. Тиолирование достигали путем добавления к антителу 2-иминотиолана. Количество 2-иминотиолана, подлежащее добавлению,- 24022288 может быть определено с помощью предварительного эксперимента и отличаться от антитела к антителу. В предварительном эксперименте к антителу добавляли возрастающие количества 2-иминотиолана с последующей инкубацией с антителом в течение 1 ч при КТ (комнатной температуре, примерно 25C),затем антитело обессоливали на колонке SEPHADEX G-25, уравновешенной 50 мМ HEPES, pH 6,0 и количество введенных тиольных групп легко определяли путем реакции с дитиодипиридином (DTDP). Взаимодействие тиольных групп с DTDP привело к высвобождению тиопиридина, которое контролировали при 324 нм. Как правило, использовали образцы с концентрацией белка 0,5-1,0 мг/мл. Для точного определения концентрации белка в образцах использовали поглощение при 280 нм, а затем аликвоту каждого образца (0,9 мл) инкубировали с 0,1 мл DTDP (5 мМ исходного раствора в этаноле) в течение 10 мин при КТ. Образцы сравнения, содержащие только буфер плюс DTDP, также инкубировали. Через 10 мин измеряли поглощение при 324 нм и рассчитывали количество тиольных групп с помощью коэффициента экстинкции для тиопиридина 19800 М-1. Обычно требуется степень тиолирования три тиольные группы на антитело. Например, для некоторых антител это достигается добавлением 15-кратного молярного избытка 2-иминотиолана с последующей инкубацией при КТ в течение 1 ч. Антитело затем инкубировали с 2-иминотиоланом при необходимом молярном соотношении и затем обессоливали в конъюгационный буфер (50 мМ HEPES буфер pH 6,0, содержащий 5 мМ глицин и 2 мМ DTPA). Тиолированный материал выдерживали на льду во время определения количества введенных тиолов, как описано выше. После проверки количества введенных тиолов конъюгат лекарственное вещество-линкерная группа добавляли в 3-кратном молярном избытке на тиол. Реакцию конъюгирования проводили в конъюгационном буфере, также содержащем конечную концентрацию 5% диметилсульфоксида (DMSO) или аналогичный альтернативный растворитель. Обычно исходный раствор лекарственное средство-линкер растворяют в 100% DMSO. Исходный раствор добавляли непосредственно к тиолированному антителу, которое содержало достаточное количество добавленного DMSO для доведения конечной концентрации до 10%, или предварительно разбавляли в конъюгационном буфере, содержащем конечную концентрацию 10% DMSO, с последующим добавлением к равному объему тиолированного антитела. Конъюгационную реакционную смесь инкубировали при КТ в течение 2 ч при перемешивании. После инкубирования конъюгационную реакционную смесь центрифугировали и фильтровали через фильтр 0,2 мкм. Очистку конъюгата можно осуществить хроматографическими методами. В одном способе конъюгат очищали гель-эксклюзионной хроматографией на колонке SEPHACRYL S200, предварительно уравновешенной 50 мМ HEPES буфером pH 7,2, содержащим 5 мМ глицин и 50 мМ NaCl. Хроматографию проводили с линейной скоростью потока 28 см/ч. Фракции, содержащие конъюгат, собирали,объединяли и концентрировали. В альтернативном способе очистку можно осуществить посредством ионообменной хроматографии. Условия изменяются от антитела к антителу и должны быть оптимизированы в каждом случае. Например, реакционную смесь конъюгата антитело-лекарственное средство наносили на колонку SP-SEPHAROSE, предварительно уравновешенную в 50 мМ HEPES pH 5,5, 5 мМ глицин. Конъюгат с антителом элюировали, используя градиент 0-1 М NaCl в равновесном буфере при pH 5,5. Фракции, содержащие конъюгат, объединяли и буфер заменяли буфером (50 мМ pH 7,2 HEPES буфер, содержащий 5 мМ глицин и 100 мМ NaCl). Опытному специалисту в данной области будет понятно, что описанные выше условия и методы явлются примерами и не ограничением и что в данной области известны другие подходы к конъюгированию и могут применяться в настоящем изобретении. С помощью последующих методов соединения данного изобретения были конъюгированы с использованием антител 2 А 10, анти-PSMA антитела (Huang et al., US 2009/0297438); 2H5, анти-CD70 антитела (Terrett et al., US 2009/0028872); 1F4, анти-CD70 антитела (Coccia et al., WO 2008/074004) или 6 А 4,антимезотелин антитела (Terrett et al., WO 2009/045957). Полученные конъюгаты можно представить следующими формулами, в которых Ab является антителом. Опытному специалисту будет понятно, что в этих формулах соотношение цитотоксин-соединение антитела показано как 1:1 для примера, но фактически соотношение обычно больше, например такое как между 2 и 3. Фармацевтическая композиция. В другом аспекте настоящее изобретение представляет фармацевтическую композицию, содержащую соединение настоящего изобретения, составленное вместе с фармацевтически приемлемым вспомогательным веществом. Композиция необязательно может содержать один или более дополнительных фармацевтически активных ингредиентов, таких как антитело или другое лекарственное средство. Фармацевтические композиции могут вводиться в комбинаторной терапии с другим терапевтическим агентом, в особенности другим противораковым агентом. Фармацевтическая композиция может содержать один или более вспомогательных веществ. Вспомогательные вещества, которые могут использоваться, включают носители, поверхностно-активные агенты, загустители или эмульгаторы, твердые связующие, диспергирующие или суспендирующие добавки, солюбилизаторы, красители, ароматизаторы, образующие покрытие агенты, дезинтегрирующие агенты, смазывающие вещества, подсластители, консерванты, изотонические агенты и их комбинации. Выбор и использование пригодных вспомогательных веществ представлено в Gennaro, ed., Remington:The Science and Practice of Pharmacy, 20th Ed. (Lippincott WilliamsWilkins, 2003), раскрытие которых включено здесь в виде ссылки. Предпочтительно, чтобы фармацевтическая композиция была пригодной для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например,путем инъекции или инфузии). В зависимости от пути введения активное соединение может быть покрыто материалом для защиты соединения от действия кислот и других естественных условий, которые могут его инактивировать. Выражение "парентеральное введение" означает способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включает без ограничения внутривенную,внутримышечную, внутриартериальную, внутриоболочечную, внутрикапсульную, внутриглазничную,внутрисердечную, интрадермальную, интраперитонеальную, транстрахеальную, подкожную, субэпителиальную, внутрисуставную, субкапсульную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. Или же фармацевтическая композиция может вводиться не парентеральным способом, таким как местное, эпидермальное или мукозальное введение, например интраназальное,оральное, вагинальное, ректальное, сублингвальное или местное. Фармацевтические композиции могут быть в форме стерильных водных растворов или дисперсий. Также они могут быть составлены в микроэмульсии, липосоме или других упорядоченных структурах,пригодных для достижения высокой концентрации лекарственного средства. Количество активного ингредиента, которое можно объединить с материалом носителя для получения единичной лекарственной формы, будет изменяться в зависимости от субъекта, проходящего лечение, и конкретного способа введения, и в целом будет представлять такое количество, которое вырабатывает терапевтический эффект. Как правило, из 100%, это количество будет изменяться примерно от 0,01 до 99% активного ингредиента, предпочтительно примерно от 0,1 до 70%, более всего предпочтительно примерно от 1 до 30% активного ингредиента в комбинации с фармацевтически приемлемым носителем. Режимы дозирования регулируют для обеспечения терапевтического ответа. Например, в течение некоторого времени может вводиться один болюс, несколько разделенных доз или доза может быть пропорционально уменьшена или увеличена в зависимости от ситуации. Особенно предпочтительно, чтобы парентеральная композиция была составлена в единичной лекарственной форме для легкого введения и равномерности дозирования. "Стандартная лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов, подлежащих лечению; при этом каждая единица содержит заранее определенное количество активного соединения, рассчитанное на получение желаемого терапевтического ответа, в сочетании с необходимым фармацевтическим носителем. Дозы изменяются примерно от 0,0001 до 100 мг/кг, еще чаще от 0,01 до 5 мг/кг массы тела хозяина. Например, дозы могут составлять 0,3, 1, 3, 5 или 10 мг/кг массы тела или находиться в диапазоне 1-10 мг/кг. Примерами режимов лечения являются введение один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз в месяц, один раз каждые 3 месяца или один раз каждые от 3 до 6 месяцев. Предпочтительные схемы приема включают 1 мг/кг массы тела или 3 мг/кг массы тела путем внутривенного введения с использованием одного из следующих режимов дозирования: (i) каждые четыре недели по шесть доз, затем каждые три месяца; (ii) каждые три недели; (iii) 3 мг/кг массы тела однократно с последующим 1 мг/кг массы тела каждые три недели. В некоторых способах доза регулируется для достижения концентрации антитела в плазме примерно 1-1000 мкг/мл и в некоторых способах примерно 25-300 мкг/мл."Терапевтически эффективное количество" соединения изобретения предпочтительно приводит к уменьшению тяжести симптомов заболевания, увеличению частоты и продолжительности периодов без симптомов заболевания или предупреждению нарушения или недееспособности из-за заболевания. Например, для лечения опухоль-несущих субъектов "терапевтически эффективное количество" предпочтительно ингибирует рост опухоли по меньшей мере на 20%, более предпочтительно по меньшей мере на 40%, еще более предпочтительно по меньшей мере на 60% и еще более предпочтительно по меньшей мере на 80% по сравнению с субъектами, не проходящими лечение. Терапевтически эффективное коли- 27022288 чество терапевтического соединения может уменьшать размер опухоли или иным образом ослаблять симптомы у субъекта, которым обычно является человек, но может быть другое млекопитающее. Фармацевтическая композиция может представлять собой состав с контролируемым или замедленным высвобождением, включая имплантаты, трансдермальные пластыри и системы микроинкапсулированной доставки. Могут применяться биоразлагаемые, биосовместимые полимеры, такие как этиленвинил ацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полиуксусная кислота. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed, Marcel Dekker,Inc., New York, 1978. Терапевтические композиции могут вводиться посредством медицинских устройств, таких как(1) безыгольные устройства для подкожного введения (например, US 5399163; 5383851; 5312335; 5064413; 4941880; 4790824 и 4596556); (2) микроинфузионные помпы (US 4487603); (3) трансдермальные устройства (US 4486194); (4) инфузионные аппараты (US 4447233 и 4447224) и (5) осмотические устройства (US 4439196 и 4475196); раскрытие которых включено здесь в виде ссылки. В некоторых вариантах фармацевтическая композиция может быть составлена для обеспечения нужного распределения in vivo. Например, для обеспечения пересечения гематоэнцефалического барьера терапевтические соединения изобретения могут быть составлены в липосомах, которые могут дополнительно содержать целевые группы для усиления селективной доставки в определенные клетки или органы. См., например, US 4522811; 5374548; 5416016 и 5399331; V.V. Ranade (1989), J. Clin. Pharmacol. 29:685; Umezawa et al. (1988), Biochem. Biophys. Res. Commun. 153:1038; Bloeman et al. (1995), FEBS Lett. 357:140; M. Owais et al. (1995), Antimicrob. Agents Chemother. 39:180; Briscoe et al. (1995), Am. J. Physiol. 1233:134; Schreier et al. (1994), J. Biol. Chem. 269:9090; Keinanen and Laukkanen (1994), FEBS Lett. 346:123 и Killion and Fidler (1994), Immunomethods, 4:273. Применение. Соединения данного изобретения или их конъюгаты могут применяться для лечения заболеваний,таких как, без ограничения, гиперпролиферативные заболевания, в том числе злокачественные опухоли головы и шеи, включающие опухоли головы, шеи, полости носа, околоносовых пазух, носоглотки, полости рта, ротоглотки, гортани, гортанной части глотки, слюнных желез и параганглиомы; злокачественные опухоли печени и желчных протоков, в частности гепатоклеточная карцинома; злокачественные опухоли кишечника, в частности рак прямой и ободочной кишки; рак яичника; мелкоклеточный и немелкоклеточный рак легкого (SCLC и NSCLC); рак молочной железы, саркомы, такие как фибросаркома,злокачественная фиброзная гистиоцитома, эмбриональная рабдомиосаркома, леймиосаркома, нейрофибросаркома, остеосаркома, злокачественная синовиома, липосаркома и альвеолярная саркома мягких тканей; лейкоз, такой как острый промиелоцитарный лейкоз (APL), острый миелобластный лейкоз (AML),острый лимфобластный лейкоз (ALL) и хронический миелолейкоз (CML); новообразования центральной нервной системы, в частности рак головного мозга; множественная миелома (ММ), лимфомы, такие как лимфома Ходжкина, лимфоплазмацитоидная лимфома, фолликулярная лимфома, лимфома лимфоидных тканей слизистых оболочек, лимфома из клеток мантийной зоны, крупноклеточная лимфома из клеток В-клеточной линии дифференцировки, лимфосаркома Беркитта и Т-клеточная анапластическая крупноклеточная лимфома. Клинически, практическое осуществление способов и применение описанных здесь композиций приводит к снижению размера или количества злокачественных опухолей и/или к ослаблению связанных симптомов (где возможно). Патологически, практическое осуществление способов и применение описанных здесь композиций приводит к патологически соответствующей реакции, такой как ингибирование пролиферации раковых клеток, снижение размера опухолевого образования или опухоли, предотвращение дальнейшего метастазирования и ингибирование опухолевого ангиогенеза. Способ лечения таких заболеваний предусматривает введение субъекту терапевтически эффективного количества комбинации изобретения. Способ может быть повторен по мере необходимости. В частности,злокачественная опухоль может представлять собой рак прямой и ободочной кишки, рак печени, рак предстательной железы, рак молочной железы, меланому, глиобластому, рак легкого, рак поджелудочной железы, рак яичника, множественную миелому, рак почки, лейкоз (в особенности ALL, APL илиAML) или лимфому. Соединения данного изобретения или их конъюгаты можно вводить в сочетании с другими противораковыми или цитотоксическим агентами, включающими антитела, алкилирующие агенты, ингибиторы ангиогенеза, антиметаболиты, расщепляющие ДНК средства, сшивающие ДНК средства, интеркалирующие в ДНК средства, связывающиеся с малой бороздкой в ДНК средства, ингибиторы белка теплового шока 90, ингибиторы деацетилазы гистонов, иммуномодуляторы, стабилизаторы микротрубочек, аналоги нуклеозидов (пурина или пиримидина), ингибиторы ядерного экспорта, ингибиторы протеосомы,ингибиторы топоизомеразы (I или II), ингибиторы тирозинкиназы и ингибиторы серин-треонинкиназы. Конкретные противораковые или цитотоксические средства включают -лапакон, ансамитоцин Р 3, ауристатин, бикалутамид, блеомицин, бортезомиб, бусульфан, каллистатин А, камптотецин, капецитабин,СС-1065, цисплатин, криптофицины, даунорубицин, дисоразол, доцетаксел, доксорубицин, дуокармицин, динемицин А, эпотилоны, этопозид, флоксуридин, флударабин, фторурацил, гефитиниб, гелданамицин,17-аллиламино-17-деметоксигелданамицин деметоксигелданамицин (17-DMAG), гемцитабин, гидроксимочевину, иматиниб, интерфероны, интерлейкины, иринотекан, мейтанзин, метотрексат, митомицин С, оксалиплатин, паклитаксел, субероиланилид гидроксамовую кислоту (SAHA), тиотепу, топотекан, трихостатин А, винбластин, винкристин, виндезин, леналидомид (REVLIMID), бевацизумаб (AVASTIN), трастузумаб (HERCEPTIN) и цетуксимаб (ERBITUX). Примеры Практическое осуществление данного изобретения может быть более понятным при обращении к следующим примерам, которые представлены для иллюстрации и не являются ограничением. Пример 1. Схема 1. На схеме 1 (фиг. 1 а и 1b) показан способ получения соединений данного изобретения. Тиоамид 2. 2,2-Диэтоксиацетонитрил 1 (25 г, 193 ммоль) смешивали с (NH4)2S (40 мл, 265 ммоль, 45%-ный водный раствор) в 300 мл метанола (MeOH) при комнатной температуре (КТ). После выдерживания в течение ночи реакционную смесь концентрировали в вакууме и остаток помещали в этилацетат (EtOAc). Раствор EtOAc отмывали насыщенным раствором NaHCO3, затем солевым раствором и высушивали над безводным Na2SO4. EtOAc выпаривали для получения тиоамида 2 (26 г, 159 ммоль, 82%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3):5,01 (s, 1H), 3,67 (m, 4H), 1,22 (t, J=7,2 Гц, 6H). Метил 2-(этоксиметил)тиазол-4-карбоксилат 3. 100 г молекулярных сит (3 ) добавляли в реакционную смесь тиоамида 2 (25 г, 153 ммоль) и метилбромпирувата (20 мл, 163 ммоль) в 300 мл MeOH. После нагревания с обратным холодильником в течение 1,5 ч смесь охлаждали и фильтровали через CELITE. Фильтрат концентрировали и пропускали через колонку (дихлорметан (DCM):EtOAc, 8:1) для получения тиазол-карбоксилата 3 (34,5 г, 140 ммоль,91%) в виде твердого вещества, которое использовали на следующей стадии без дальнейшей очистки. Метил 2-формилтиазол-4-карбоксилат 4. Тиазол-4-карбоксилат 3 (30 г, 122 ммоль) растворяли в 300 мл ацетона, в который добавляли водный раствор HCl (21 мл, 2 М). После выдерживания реакционной смеси при КТ в течение ночи реакционную смесь нагревали и выдерживали при 60C в течение 2 ч. Реакционную смесь затем охлаждали и выпаривали в вакууме для получения остатка, который помещали в 200 мл DCM. Раствор DCM затем отмывали насыщенным раствором NaHCO3, затем солевым раствором и высушивали над безводнымNa2SO4. Раствор DCM фильтровали и концентрировали в вакууме для получения концентрированного раствора, который растирали с эфиром для получения метил 2-формилтиазол-4-карбоксилата 4 (14 г,82 ммоль, 54% для двух стадий) в виде белого твердого вещества. 1(THF), в который добавляли Ti(OEt)4 (27 мл, 130 ммоль) и 3-метил-2-бутанон 6 (8 г, 41 ммоль) при КТ. Реакционную смесь нагревали с обратным холодильником в течение ночи, затем охлаждали и добавляли в солевой раствор. Полученную смесь фильтровали и кек отмывали EtOAc. Органическую фазу концентрировали для получения остатка, который подвергали колоночной хроматографии на силикагеле(DCM:EtOAc, 4:1) для получения сульфинимина 7 (9,5 г, 37 ммоль, 75%) в виде масла. 1MS (ES+) m/z, расчетное: m+1, 190,12, обнаруженное: 190. Соединение 8. Диизопропил-амид лития ("LDA", 60 мл, 108 ммоль, 1,8 М) добавляли в 200 мл эфира при -78C с последующим сульфинимином 7 (18,9 г, 100 ммоль) в 200 мл эфира и полученную реакционную смесь перемешивали в течение 40 мин. В реакционную смесь добавляли ClTi(OiPr)3 (203 ммоль, 48,4 мл) и раствор перемешивали в течение 60 мин. Раствор метил 2-формилтиазол-4-карбоксилата 4 (12,5 г,72,6 ммоль) в 180 мл THF медленно добавляли в реакционную смесь. Еще через 2 ч при -78C добавляли смесь уксусной кислоты и THF (1/5 об./об., 4,9 мл). Смесь нагревали до 5C в течение 1 ч и затем заливали в солевой раствор. Требуемый продукт затем экстрагировали из солевого раствора эфиром и раствором EtOAc. Органическую фазу затем сушили над безводным MgSO4, фильтровали и выпаривали. Остаток пропускали через 2 колонки (DCME:tOAc и гексан:EtOAc) для получения соединения 8 (19,6 г,54 ммоль, 75%) в виде масла.MS (ES+) m/z, расчетное: m+1, 361,12, обнаруженное: 361. Соединение 9. Раствор соединения 8 (19 г, 52,7 ммоль) в 200 мл THF охлаждали до -78C, после чего медленно добавляли Ti(OEt)4 (21,7 мл, 105 ммоль). Через 60 мин, после того как раствор становился прозрачным, добавляли NaBH4 (31 ммоль, 1,17 г), через 2 ч добавляли (более длительное время реакции вызывало восстановление сложного эфира) 10 мл MeOH. Смесь затем нагревали до 0C, заливали в 1 мл НОАс в дос- 29
МПК / Метки
МПК: A61K 47/48, C07K 5/02, C07K 5/06
Метки: соединения, способы, конъюгаты, получения, применение, антипролиферативные
Код ссылки
<a href="https://eas.patents.su/30-22288-antiproliferativnye-soedineniya-ih-konyugaty-sposoby-ih-polucheniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антипролиферативные соединения, их конъюгаты, способы их получения и их применение</a>