Неорганические водородные соединения, способы получения и применение
Формула / Реферат
1. Соединение, содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, выбранную из группы, содержащей
(a) атом водорода, имеющий энергию связи примерно 13,6 эВ/(1/р)2,
где р - целое число, больше 1;
(b) гидрид-ион (Н- ) с увеличенной энергией связи, имеющий энергию (Е) связи, равную
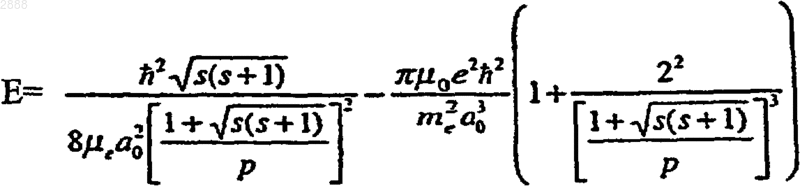
где s=1/2, p - пи, ħ - постоянная Планка, деленная на 2p, mo - проницаемость вакуума, mе - масса электрона, me - приведенная масса электрона, аo - радиус Бора и е - элементарный заряд;
(c) разновидность водорода с увеличенной энергией связи Н4+(1/р);
(d) разновидность водорода с увеличенной энергией связи, Н3+(1/р), имеющий энергию связи примерно 22,6/(1/р)2 эВ, где р - целое;
(e) молекулу водорода с увеличенной энергией связи, имеющую энергию связи примерно 15,5/(1/р)2 эВ; и
(f) молекулярный ион водорода с энергией связи около 16,4/(1/р)2 эВ и, по крайней мере, один другой элемент.
2. Соединение по п.1, отличающееся тем, что разновидность водорода с увеличенной энергией связи выбрана из группы, содержащей Нn, Н- n и Н+n, где n - целое число от одного до трех.
3. Соединение по п.1, отличающееся тем, что разновидность водорода с увеличенной энергией связи выбрана из группы, содержащей гидрид-ион, имеющий энергию связи, большую примерно 0,8 эВ; атом водорода, имеющий энергию связи, большую примерно 13,6 эВ; молекулу водорода, имеющую первую энергию связи, большую примерно 15,5 эВ; и молекулярный ион водорода, имеющий энергию связи, большую примерно 16,4 эВ.
4. Соединение по п.3, отличающееся тем, что разновидность водорода с увеличенной энергией связи представляет гидрид-ион, имеющий энергию связи около 3, 7, 11, 17, 23, 29, 36, 43, 49, 55, 61, 66, 69, 71 или 72 эВ.
5. Соединение по п.4, отличающееся тем, что разновидность водорода с увеличенной энергией связи представляет гидрид-ион, имеющий энергию связи
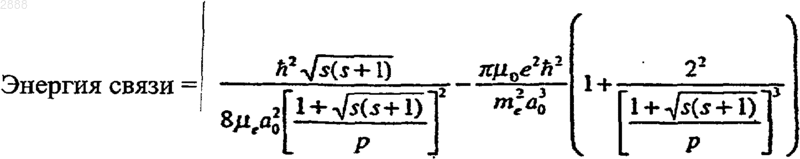
где р - целое больше единицы, s=1/2, p - пи, ħ - постоянная Планка, деленная на 2, mo - проницаемость вакуума, mе - масса электрона, me -приведенная масса электрона, аo - радиус Бора и е - элементарный заряд.
6. Соединение по п.1, отличающееся тем, что р равно от 2 до 200.
7. Соединение по п.1, которое имеет чистоту более 50 атомных процентов.
8. Соединение по п.7, которое имеет чистоту более 90 атомных процентов.
9. Соединение по п.8, которое имеет чистоту более 98 атомных процентов.
10. Соединение по п.1, отличающееся тем, что разновидность водорода с увеличенной энергией связи является отрицательно заряженной.
11. Соединение по п.10, содержащее, по меньшей мере, один катион.
12. Соединение по п.11, отличающееся тем, что катионом является протон, H3+, H4+(1/p), Н3+(1/р) или H2*[2c'=2ao/p]+.
13. Соединение по п.1, отличающееся тем, что, по крайней мере, один другой элемент представляет собой атом обычного водорода или обычную молекулу водорода.
14. Соединение по п.3, имеющее формулу, выбранную из группы формул, содержащей МН, МН2 или М2Н2, где М - щелочной катион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
15. Соединение по п.3, имеющее формулу МНn, где n - 1 или 2, М - щелочно-земельный катион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
16. Соединение по п.3, имеющее формулу МНХ, где М - щелочной катион, Х - нейтральный атом, молекула или одиночный отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
17. Соединение по п.3, имеющее формулу МНХ, где М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
18. Соединение по п.3, имеющее формулу МНХ, где М - щелочно-земельный катион, Х - двойной отрицательно заряженный анион и Н - атом водорода с увеличенной энергией связи.
19. Соединение по п.3, имеющее формулу М2НХ, где М - щелочной катион, Х - одиночный отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
20. Соединение по п.1, имеющее формулу МНn, где n - целое от 1 до 5, М - щелочной катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
21. Соединение по п.1, имеющее формулу М2Нn, где n - целое от 1 до 4, М - щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
22. Соединение по п.1, имеющее формулу М2ХНn, где n - целое от 1 до 3, М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
23. Соединение по п.1, имеющее формулу М2Х2Нn, где n - 1 или 2, М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
24. Соединение по п.1, имеющее формулу М2Х3Н, где М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
25. Соединение по п.1, имеющее формулу М2ХНn, где n - 1 или 2, М - щелочно-земельный катион, Х - двойной отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
26. Соединение по п.3, имеющее формулу M2XX'H, где М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион, X' - двойной отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
27. Соединение по п.1, имеющее формулу MM'Hn, где n - целое от 1 до 3, М - щелочно-земельный катион, M' - катион щелочного металла и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
28. Соединение по п.1, имеющее формулу MM'XHn, где n - 1 или 2, М - щелочно-земельный катион, М' - катион щелочного металла, Х - одиночный отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
29. Соединение по п.3, имеющее формулу MM'XH, где М - щелочно-земельный катион, М' - катион щелочного металла, Х - двойной отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
30. Соединение по п.3, имеющее формулу MM'XX'H, где М - щелочно-земельный катион, М' - катион щелочного металла, Х и X' - одиночный отрицательно заряженный анион и Н выбран из группы, содержащей гидрид-ион с увеличенной энергией связи и атом водорода с увеличенной энергией связи.
31. Соединеэшх по п.1, имеющее формулу HnS, где n - 1 или 2 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
32. Соединение по п.1, имеющее формулу MXX'Hn, где n - целое от 1 до 5, М - щелочь или щелочно-земельный катион, Х - одиночный или двойной отрицательно заряженный анион, X' выбран из группы, содержащей Si, Al, Ni, переходный элемент, внутренний переходный элемент и редкоземельный элемент, и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
33. Соединение по п.1, имеющее формулу MAlHn, где n - целое от 1 до 6, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
34. Соединение по п.1, имеющее формулу МНn, где n - целое от 1 до 6, М выбран из группы, содержащей переходный элемент, внутренний переходный элемент, редкоземельный элемент и Ni, и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
35. Соединение по п.1, имеющее формулу MNiHn, где n - целое от 1 до 6, М выбран из группы, содержащей катион щелочи, щелочно-земельный катион, кремний или алюминий, и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
36. Соединение по п.1, имеющее формулу МХНn, где n - целое от 1 до 6, М выбран из группы, содержащей катион щелочи, щелочно-земельный катион, кремний и алюминий, Х выбран из группы, содержащей переходный элемент, внутренний переходный элемент или катион редкоземельного элемента, и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
37. Соединение по п.1 или 2, имеющее формулу MXAlX'Hn, где n - 1 или 2, М - щелочь или щелочно-земельный катион, Х и X' - либо одиночный отрицательно заряженный анион, либо двойной отрицательно заряженный анион и водород, представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
38. Соединение по п.1, имеющее формулу TiHn, где n - целое от 1 до 4 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
39. Соединение по п.1, имеющее формулу Аl2Нn, где n - целое от 1 до 4 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
40. Соединение по пп.16, 17, 18, 22, 23, 24, 26, 28, 30, 32 или 37, отличающееся тем, что одиночный отрицательно заряженный анион выбран из группы, содержащей ион галогена, ион гидроокиси, ион карбоната водорода и ион нитрата.
41. Соединение по пп.18, 25, 26, 29, 32 или 37, отличающееся тем, что двойной отрицательно заряженный анион выбран из группы, содержащей ион карбоната, окись и ион сульфата.
42. Соединение по п.1, имеющее формулу [KНmKСО3]n, где m и n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
43. Соединение по п.1, имеющее формулу [KHmKNO3]+n nX-, где m и n - каждое целое, Х - одиночный отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
44. Соединение по п.1, имеющее формулу [KHKNO3]n, где n - целое и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
45. Соединение по п.1, имеющее формулу [КНКОН]n, где n - целое и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
46. Соединение по п.1, имеющее формулу [MHmM'X]n, где m и n - целое число, М и М' - щелочь или щелочно-земельный катион, Х - одиночный или двойной отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
47. Соединение по п.1, имеющее формулу [MHmM'X']+n nХ-, где m и n - целое число, М и М' - щелочь или щелочно-земельный катион, Х и X' - одиночный или двойной отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
48. Соединение по пп.43, 46 или 47, отличающееся тем, что одиночный отрицательно заряженный анион выбран из группы, содержащей ион галогена, ион гидроокиси, ион карбоната водорода и ион нитрата.
49. Соединение по п.46 или 47, отличающееся тем, что двойной отрицательно заряженный анион выбран из группы, содержащей ион карбоната, окись и ион сульфата.
50. Соединение по п.1, имеющее формулу MXSiX'Hn, где n - 1 или 2, М - щелочь или щелочно-земельный катион, Х и X' - одиночный отрицательно заряженный анион либо двойной отрицательно заряженный анион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
51. Соединение по п.1, имеющее формулу MSiHn, где n - целое число от 1 до 6, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
52. Соединение по п.1, имеющее формулу SinH4n, где n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
53. Соединение по п.1, имеющее формулу SinH3n, где n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
54. Соединение по п.1, имеющее формулу SinН3nОm, где n и m - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
55. Соединение по п.1, имеющее формулу SixH4x-2yOy, где х и у - целое число и водород, представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
56. Соединение по п.1, имеющее формулу SixH4xOy, где х и у - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
57. Соединение по п.1, имеющее формулу SinH4nН2О, где n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
58. Соединение по п.1, имеющее формулу SinH2n+2 где n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
59. Соединение по п.1, имеющее формулу SixH2x+2Oy, где х и у - целое число иводород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
60. Соединение по п.1, имеющее формулу SinH4n-2O, где n - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
61. Соединение по п.1, имеющее формулу MSi4nH10nOn, где n - целое число, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
62. Соединение по п.1, имеющее формулу МSi4nН10nОn+1, где n - целое число, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
63. Соединение по п.1, имеющее формулу MqSinHmOp, где q, n, m и р - целое число, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
64. Соединение по п.1, имеющее формулу MqSinHm, где q, n и m - целое число, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одэющ разновидностью водорода с увеличенной энергией связи.
65. Соединение по п.1, имеющее формулу SinHmOp, где n, m и р - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
66. Соединение по п.1, имеющее формулу SinHm, где n и m - целое число и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
67. Соединение по п.1, имеющее формулу MSiHn, где n - целое число от 1 до 8, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
68. Соединение по п.1, имеющее формулу Si2Hn, где n - целое число от 1 до 8 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
69. Соединение по п.1, имеющее формулу SiHn, где n - целое число от 1 до 8 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
70. Соединение по п.1, имеющее формулу SiO2Hn, где n - целое число от 1 до 6 и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
71. Соединение по п.1, имеющее формулу MSiO2Hn, где n - целое число от 1 до 6, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
72. Соединение по п.1, имеющее формулу MSi2Hn, где n - целое число от 1 до 14, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
73. Соединение по п.1, имеющее формулу M2SiHn, где n - целое число от 1 до 8, М - щелочь или щелочно-земельный катион и водород представлен, по меньшей мере, одной разновидностью водорода с увеличенной энергией связи.
74. Соединение по п.51, отличающееся тем, что одиночный отрицательно заряженный анион выбран из группы, содержащей ион галогена, ион гидроокиси, ион карбоната водорода и ион нитрата.
75. Соединение по п.50, отличающееся тем, что двойной отрицательно заряженный анион выбран из группы, содержащей ион карбоната, окись и ион сульфата.
76. Соединение по п.50, имеющее наблюдаемую характеристику, отличную от характеристики соответствующего обычного соединения, в котором содержание водорода представлено только обычным водородом, причем наблюдаемая характеристика зависит от разновидности водорода с увеличенной энергией связи.
77. Соединение по п.76, отличающееся тем, что наблюдаемая характеристика является, по меньшей мере, одной из группы, содержащей стехиометрическую характеристику, характеристику термостабильности и характеристику реакционной способности.
78. Способ приготовления соединения по п.1, содержащего, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, выбранную из группы, содержащей
(a) атом водорода, имеющий энергию связи примерно 13,6 эВ/(1/р)2, где р - целое число больше 1;
(b) гидрид-ион (Н-) с увеличенной энергией связи, имеющий энергию (Е) связи примерно
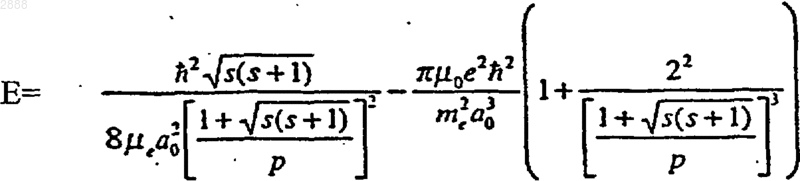
где s=1/2, p - пи, ħ - постоянная Планка, деленная на 2p, mо - проницаемость вакуума, mе - масса электрона, mе - приведенная масса электрона, ао - радиус Бора и е - элементарный заряд;
(c) разновидность водорода с увеличенной энергией связи H4+(1/p);
(d) молекулярный ион разновидности водорода с увеличенной энергией связи, H3+(1/p), имеющий энергию связи примерно 22,6/(1/р)2 эВ, где р - целое;
(e) молекулу водорода с увеличенной энергией связи, имеющую энергию связи примерно 15,5/(1/р)2 эВ; и
(f) молекулярный ион водорода с энергией связи около 16,4/(1/р)2 эВ и,
по меньшей мере, один другой элемент, заключающийся в
(a) реагировании атомарного водорода с катализатором, имеющим чистую энтальпию реакции, по меньшей мере, m/2 х 27 эВ, где m - целое, для получения атомарного водорода, имеющего энергию связи около 13,6 эВ/(1/р)2, где р - целое число больше 1,
(b) реагировании полученного атомарного водорода с электроном для получения гидрид-иона, имеющего энергию связи более 0,8 эВ, и
(c) реагировании полученного гидрид-иона с одним или более катионами.
79. Способ по п.78, отличающийся тем, что m равно от 2 до 400, а р равно от 2 до 200.
80. Способ приготовления молекул водорода с увеличенной энергией связи, заключающийся в реагировании протонов с соединением, содержащим ион гидрида с увеличенной энергией связи.
81. Способ приготовления молекул водорода с увеличенной энергией связи, заключающийся в термическом или химическом разложении соединения, содержащего ион гидрида с увеличенной энергией связи.
82. Способ по п.78, отличающийся тем, что этап (b) осуществляют в электролитической ячейке, имеющей катод и восстанавливающий реагент для восстановления полученного атомарного водорода и этап (b) включает контактирование полученного атомарного водорода с катодом или восстанавливающим реагентом.
83. Способ по п.78, отличающийся тем, что этап (b) осуществляют в газовой ячейке, содержащей восстанавливающий реагент для восстановления полученного атомарного водорода, и этап (b) включает контактирование полученного атомарного водорода с восстанавливающим реагентом.
84. Способ по п.78, отличающийся тем, что этап (b) осуществляют в газоразрядной ячейке, имеющей катод, плазменные электроны и восстанавливающий реагент, и этап (b) включает контактирование полученного атомарного водорода с катодом, восстанавливающим реагентом или плазменными электронами.
85. Способ по пп.82, 83 или 84, отличающийся тем, что восстанавливающий реагент выбирают из группы, содержащей материал ячейки, компоненты ячейки или восстановитель, внешний по отношению к действию ячейки.
86. Способ по п.78, отличающийся тем, что этап (с) осуществляют в электролитической ячейке и катионом является окисленная разновидность материала катода или анода ячейки, катион добавленного восстановителя, внешнего к ячейке, или катион электролита в ячейке.
87. Способ по п.86, отличающийся тем, что катионом электролита является катион катализатора.
88. Способ по п.78, отличающийся тем, что этап (с) осуществляют в газовой ячейке и катионом является окисленная разновидность материала ячейки, катион материала диссоциации молекулярного водорода, который производит молекулярный водород в ячейке, катион добавленного восстановителя, внешнего к ячейке, или катион катализатора в ячейке.
89. Способ по п.78, отличающийся тем, что этап (с) осуществляют в газоразрядной ячейке и катионом является окисленная разновидность материала катода или анода ячейки, катион добавленного восстановителя, внешнего к ячейке, или катион катализатора в ячейке.
90. Способ по п.78, отличающийся тем, что этап (с) осуществляют в ячейке с плазменной горелкой и катионом является окисленная разновидность материала катода или анода ячейки, катион добавленного восстановителя, внешнего к ячейке, или катион катализатора в ячейке.
91. Соединение, содержащее, по меньшей мере, один гидрид-ион с энергией связи примерно 0,65 эВ и, по меньшей мере, один другой элемент.
92. Способ приготовления соединения водорода с увеличенной энергией связи, содержащего гидрид-ион, имеющий энергию связи около 0,65 эВ, включающий следующие этапы: подачу атомов водорода с увеличенной энергией связи; осуществление реакции атомов водорода с первым восстановителем, тем самым образуя, по меньшей мере, один стабильный гидрид-ион, имеющий энергию связи более 0,8 эВ, и, яю меньшей мере, один нереактивный атомарный водород; сбор нереактивного атомарного водорода и осуществление реакции нереактивного атомарного водорода со вторым восстановителем, тем самым образуя стабильные гидрид-ионы, имеющие энергию связи около 0,65 эВ; и осуществление реакции полученного гидрид-иона с одним или более катионом, тем самым получая упомянутое соединение.
93. Способ по п.92, отличающийся тем, что первый восстановитель имеет высокий выход или положительную свободную энергию реакции с нереактивным атомарным водородом.
94. Способ по п.92, отличающийся тем, что первым восстановителем является металл, отличный от щелочного или щелочно-земельного металла.
95. Способ по п.94, отличающийся тем, что металлом является вольфрам.
96. Способ по п.92, отличающийся тем, что второй восстановитель содержит щелочной металл или щелочно-земельный металл.
97. Способ по п.92, отличающийся тем, что второй восстановитель содержит плазму.
98. Реактор для приготовления соединения, содержащего, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, выбранную из группы, содержащей
(a) атом водорода, имеющий энергию связи примерно 13,6 эВ/(1/р)2, где р - целое число больше 1;
(b) гидрид-ион (Н-) с увеличенной энергией связи, имеющий энергию связи примерно
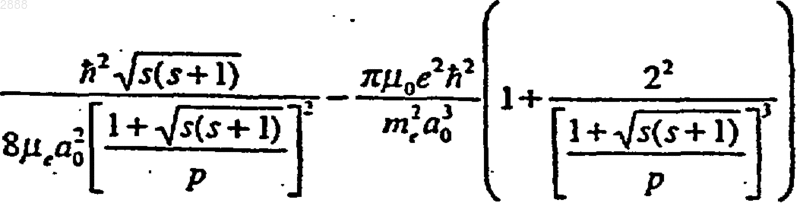
где s=1/2, p - пи, ħ - постоянная Планка, деленная на 2p, mо - проницаемость вакуума, mе - масса электрона, mе - приведенная масса электрона, aо - радиус Бора и е - элементарный заряд;
(c) разновидность водорода с увеличенной энергией связи H4+(1/p);
(d) молекулярный ион разновидности водорода с увеличенной энергией связи, H3+(1/p), имеющий энергию связи примерно 22,6/(1/р) эВ, где р - целое;
(e) молекулу водорода с увеличенной энергией связи, имеющую энергию связи примерно 15,5/(1/р)2 эВ; и
(f) молекулярный ион водорода с энергией связи около 16,4/(1/р)2 эВ и, по меньшей мере, один другой элемент,
причем указанный реактор содержит сосуд, заключающий в себе источник электронов и источник атомов водорода с увеличенной энергией связи, имеющих энергию связи около 13,6 эВ/(1/р)2, где р - целое число больше 1, тем самым электроны от источника электронов реагируют с атомами водорода с увеличенной энергией связи от упомянутого источника в сосуде, образуя упомянутые соединения.
99. Реактор по п.98, отличающийся тем, что разновидность водорода с увеличенной энергией связи представляет гидрид-ион, имеющий энергию связи, большую примерно 0,8 эВ.
100. Реактор по п.98 или 99, отличающийся тем, что источником атомов водорода с увеличенной энергией связи является ячейка катализа водорода, выбранная из группы, содержащей электролитическую ячейку, газовую ячейку, газоразрядную ячейку и ячейку с плазменной горелкой.
101. Реактор по п.100, отличающийся тем, что ячейка катализа водорода содержит второй сосуд, заключающий в себе источник атомарного водорода; по меньшей мере, один из твердого, расплавленного, жидкого или газообразного катализатора, имеющего чистую энтальпию реакции, по меньшей мере, m/2 x 27 эВ, где m - целое число, тем самым атомы водорода реагируют с катализатором во втором сосуде, образуя атом водорода, имеющий энергию связи около 13,6 эВ/(1/р)2, где р - целое число больше 1.
102. Электролитическая батарея, содержащая катод и катодное пространство, имеющее в качестве окислителя соединение по п.1 и, по меньшей мере, один другой элемент, анод и анодное пространство, имеющее восстановитель, и солевой мостик, образующий цепь между катодным пространством и анодным пространством.
Текст
I. 1. Область техники, к которой относится изобретение Изобретение относится к новому соединению, содержащему ион гидрида, имеющему энергию связи, большую примерно 0,8 эВ (далее"ион гидрино гидрида"). Новый ион гидрида также может быть комбинирован с катионом,таким как протон, для получения новых соединений. 2. Предшествующий уровень техники 2.1. Гидрины Атом водорода, имеющий энергию связи,даваемую уравнением где р - целое, большее 1, предпочтительно от 2 до 200, описан в работе Р. Милс (R. Mills), Итоговая объединенная теория классической квантовой механики, редакция Сентябрь 1996 ("96PCT/US 90/1998, полные описания которых используются здесь в качестве ссылок (далее"Предыдущие публикации Милса"). Энергия связи атома, иона или молекулы, также известная как энергия ионизации, представляет энергию, требуемую для удаления одного электрона от атома, иона или молекулы. Атом водорода, имеющий энергию связи,даваемую уравнением (1), далее рассматривается как атом гидрино или гидрино. Обозначение для гидрино радиуса ан/р, где ан - радиус обычного атома водорода, представляет Н[ан/р]. Атом водорода с радиусом ан далее рассматривается как "обычный атом водорода" или "нормальный атом водорода". Обычный атомарный водород характеризуется его энергией связи 13,6 эВ. Гидрины формируются путем реагирования обычного атома водорода с катализатором,имеющим результирующую энтальпию реакции около где m - целое. Такой катализ освобождает энергию с соответственным восстановлением до размера атома водорода, rn= n aн. Например, катализ Н(n=1) к Н(n=1/2) освобождает 40,8 эВ, а радиус водорода восстанавливается от aн до 1/2 ан. Одна такая каталитическая система включает калий. Вторичная энергия ионизации калия составляет 31,63 эВ и К+ освобождает 4,34 эВ, когда восстанавливается до К. Затем комбинация реакций К+ до К 2+ и К+ до К имеет чистую энтальпию реакции 27,28 эВ, которая является эквивалентом для m=1 в уравнении (2). 2 Полная реакция представляет Энергия, выделенная в процессе катализа,значительно больше, чем энергия, потерянная для катализатора. Освобожденная энергия велика по сравнению с обычными химическими реакциями. Например, когда газы водорода и кислорода подвергаются сгоранию для образования воды известная энтальпия образования воды составляет Hf = -286 кДж/моль или 1,48 эВ на атом водорода. В противоположность этому каждый(n=1) обычный атом водорода, подвергающийся катализу, освобождает 40,8 эВ. Более того, могут возникать дальнейшие каталитические переходы: Когда катализ начинается, гидрины далее аутокатализируют в процессе, названном диспропорционированием. Этот механизм аналогичен катализу неорганического иона. Однако катализ гидрино должен иметь большую интенсивность реакции, чем для катализа неорганического иона, из-за лучшего согласования энтальпии с m 27,2 эВ. 2.2. Ионы гидрида Ион гидрида содержит два неразличимых электрона, окружающих протон. Щелочь или щелочно-земельные гидриды сильно реагируют с водой для освобождения водородного газа,который сгорает на воздухе, зажигаясь от тепла реакции с водой. В типовом случае металлические гидриды распадаются при нагревании с температурой значительно ниже точки плавления исходного материала.II. Краткое содержание изобретения Созданы новые соединения, содержащие(а) по меньшей мере, нейтральную, положительную или отрицательную разновидность водорода (далее "разновидность водорода с увеличенной энергией связи"), имеющую энергию связи, (i) большую, чем энергия связи соответствующей обычной разновидности водорода или (ii) большую, чем энергия связи любой разновидности водорода, для которой соответствующая обычная разновидность водорода нестабильна или не наблюдается, поскольку энергия связи обычной разновидности водорода меньше тепловых энергий или отрицательна; и(b) по меньшей мере, один другой элемент. Соединения согласно изобретению ниже рассматриваются как "соединения водорода с увеличенной энергией связи"."Другой элемент" в этом контексте означает некоторый элемент, отличный от разновидности водорода с увеличенной энергией связи. Таким образом, другим элементом может быть разновидность обычного водорода или любой элемент, отличный от водорода. В одной группе соединений другой элемент и разновидность водорода с увеличенной энергией связи ней 3 тральны. В другой группе соединений другой элемент и разновидность водорода с увеличенной энергией связи заряжены. Другой элемент обеспечивает балансирующий заряд для формирования нейтрального соединения. Первая группа соединений характеризуется молекулярным и координатным связыванием; последняя группа характеризуется ионным связыванием. Разновидность водорода с увеличенной энергией связи образуется путем реакции одного или нескольких атомов гидрино с одним или более электроном, атомом гидрино, соединением, содержащим, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, и, по меньшей мере, другой атом, молекулу или ион, отличный от разновидности водорода с увеличенной энергией связи. В одном предпочтительном варианте осуществления изобретения соединение содержит одну или более разновидностей водорода с увеличенной энергией связи, выбранные из группы,содержащей Нn, Н-n и Н+n, где n-целое от одного до трех. В соответствии с предпочтительным вариантом создано соединение, содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, выбранную из группы, содержащей (а) ион гидрида, имеющий энергию связи, большую, чем примерно 0,8 эВ("ион гидрида с увеличенной энергией связи" или "ион гидрино гидрида"); (b) атом водорода,имеющий энергию связи, большую примерно 13,6 эВ ("атом водорода с увеличенной энергией связи" или "гидрино"); (с) молекулу водорода,имеющую первую энергию связи, большую примерно 15,5 эВ ("молекула водорода с увеличенной энергией связи" или "дигидрино"); и (d) молекулярный ион водорода, имеющий энергию связи, большую примерно 16,4 эВ ("молекулярный ион водорода с увеличенной энергией связи" или "молекулярный ион дигидрино"). Соединения согласно изобретению обладают одним или более уникальными свойствами, которые отличают их от того же соединения, содержащего обычный водород, если существует такое соединение обычного водорода. Уникальные свойства включают, например, (а) уникальную стехиометрию; (b) уникальную химическую структуру; (с) одно или более необычных химических свойств, таких как проводимость, точка плавления, точка кипения, плотность и коэффициент преломления; (d) уникальную реактивность к другим элементам и соединениям; (е) стабильность при комнатной температуре и выше; и (f) стабильность в воздухе и/или воде. Методы различения соединений,содержащих водород с увеличенной энергией связи, от соединений обычного водорода включают: 1) элементный анализ, 2) растворимость,3) реакционную способность, 4) точку плавления, 5) точку кипения, 6) давление пара как функция температуры, 7) коэффициент прелом 002888 4 ления, 8) рентгеновскую фотоэлектронную спектроскопию (XPS), 9) газовую хроматографию, 10) рентгеновскую дифракцию (XRD), 11) калориметрию, 12) инфракрасную спектроскопию (IR), 13) рамановскую спектроскопию, 14) мссбауэровскую спектроскопию, 15) эмиссионную и абсорбционную спектроскопию в крайнем ультрафиолете (EUV), 16) эмиссионную и абсорбционную спектроскопию в ультрафиолете (UV), 17) визуальную эмиссионную и абсорбционную спектроскопию, 18) спектроскопию ядерного магнитного резонанса, 19) масс-спектроскопию газовой фазы нагретого образца (масс-спектроскопия квадруполей твердого образца и магнитного сектора), 20) массспектроскопию по временам пролета вторичных ионов (TOFSIMS), 21) масс-спектроскопию по временам пролета при электрораспыленииионизации (ESITOFMS), 22) термогравиметрический анализ (TGA), 23) дифференциальный термический анализ (DTA) и 24) дифференциальную сканирующую калориметрию (DSC). В соответствии с изобретением получен ион гидрида (Н-), имеющий энергию связи более 0,8 эВ. Получены ионы гидрида, имеющие энергии связи около 3, 7, 11, 17, 23, 29, 36, 43, 49, 55,61, 66, 69, 71 и 72 эВ. Также получены композиции, содержащие новый ион гидрида. Энергия связи нового иона гидрида дается следующей формулой: где р-целое, большее единицы, s=1/2,- пи, постоянная Планка, деленная на 2, о - проницаемость вакуума, me -масса электрона, е приведенная масса электрона, ao -радиус Бора и е - элементарный заряд. Ион гидрида согласно изобретению образован путем реакции электрона с гидрино, то есть атома водорода, имеющего энергию связи около 13,6 эВ/n2, где n=1/р и р-целое, большее чем 1. 1. Полученный ион гидрида рассматривается как ион гидрино гидрида, ниже обозначенный как Н-(n=1/р) или Н-(1/р): Ион гидрино гидрида отличается от обычного иона гидрида, содержащего обычные ядра водорода и два электрона, имеющие энергию связи 0,8 эВ. Последний ниже рассматривается как "обычный ион гидрида" или "нормальный ион гидрида". Ион гидрино гидрида содержит ядро водорода и два неразличимых электрона при энергии связи согласно уравнению (7). Энергии связи иона гидрино гидрида Н-(n=1/р) как функция р, где р - целое, указаны в табл. 1. 5 Таблица 1. Представительная энергия связи иона гидрино гидрида Н-(n=1/р) как функция р, уравнение (7) Энергия связиb Длина волны Ион гидрида r1 (ао)a Получены новые соединения, содержащие один или более ионов гидрино гидрида и один или более других элементов. Такое соединение рассматривается как соединение гидрино гидрида. Обычные разновидности водорода характеризуются следующими энергиями связи: (а) ион гидрида, 0,754 эВ ("обычный ион гидрида");(b) атом водорода ("обычный атом водорода"),13,6 эВ; (с) двухатомная молекула водорода,15,46 эВ ("обычная молекула водорода"); (d) водородный молекулярный ион, 16,4 эВ ("обычный водородный молекулярный ион") и (е) Н 3+,22,6 эВ ("обычный трехводородный молекулярный ион"). Здесь, со ссылкой на формы водорода, "нормальный" и "обычный" являются синонимами. В соответствии с другим предпочтительным вариантом осуществления изобретения получено соединение, содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, выбранную из группы, состоящей из (а) атома водорода, имеющего энергию связи около 13,6 эВ/(1/р)2, где р-целое,предпочтительно целое от 2 до 200; (b) иона гидрида (Н-), имеющего энергию связи около где где р - целое, предпочтительно целое от 2 до 200, s = 1/2,- пи,- постоянная Планка, деленная на 2, о - проницаемость вакуума,me - масса электрона, е - приведенная масса электрона, aо - радиус Бора и е - элементарный заряд; (с) H+4(1/p); (d) молекулярного иона тригидрино, H3+(1/p), имеющего энергию связи около 22,6/(1/р)2 эВ, где р-целое, предпочтительно целое от 2 до 200; (е) дигидрино, имеющего энергию связи около 15,5/(1/р)2 эВ, где рцелое, предпочтительно целое от 2 до 200; (f) молекулярного иона дигидрино с энергией связи около 16,4/(1/р)2 эВ, где р - целое, предпочтительно целое от 2 до 200. "Около" в этом кон 002888 6 тексте означает +10% от вычисленного значения энергии связи. Соединения согласно изобретению имеют предпочтительно чистоту более чем 50 атомных процентов. Более предпочтительно соединения имеют чистоту более 90 атомных процентов. Наиболее предпочтительно соединения имеют чистоту более 98 атомных процентов. В соответствии с одним предпочтительным вариантом осуществления изобретения,при котором соединение содержит отрицательно заряженную разновидность водорода с увеличенной энергией связи, соединение далее содержит один или более катионов, таких как протон или Н 3+. Соединения согласно изобретению могут далее содержать один или более обычных атомов водорода и/или обычных молекул водорода в дополнение к разновидности водорода с увеличенной энергией связи. Соединение может иметь формулу МН,МН 2 или M2H2, где М - щелочной катион и Н ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу МНn,где n - 1 или 2, М - щелочно-земельный катион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу МНХ,где М - щелочной катион, Х - один нейтральный атом, такой как атом галогена, молекула или одиночный отрицательно заряженный анион,такой как анион галогена, и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу МНХ,где М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу МНХ,где М - щелочно-земельный катион, Х - двойной отрицательно заряжнный анион и Н - атом водорода с увеличенной энергией связи. Соединение может иметь формулу М 2 НХ,где М - щелочной катион, Х - одиночный отрицательно заряженный анион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу МНn,где n - целое от 1 до 5, М - щелочной катион, а водородное содержание Нn соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу М 2 Нn,где n - целое от 1 до 4, М - щелочно-земельный катион, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу М 2 ХНn,где n - целое от 1 до 3, М - щелочно-земельный 7 катион, Х - одиночный отрицательно заряженный анион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуM2X2Hn, где n - 1 или 2, М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу М 2 Х 3 Н,где М - щелочно-земельный катион, Х - одиночный отрицательно заряженный анион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу М 2 ХНn,где n - 1 или 2, М - щелочно-земельный катион,Х - двойной отрицательно заряженный анион и водородное содержание Нn соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуM2XX'H, где М - щелочно-земельный катион,Х - одиночный отрицательно заряженный анион, X' - двойной отрицательно заряженный анион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу MM'Hn,где n-целое от 1 до 3, М - щелочно-земельный катион, М' - катион щелочного металла и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMM'XHn, где n - 1 или 2, М - щелочно-земельный катион, М' - катион щелочного металла, X одиночный отрицательно заряженный анион и водородное содержание Нn соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMM'XH, где М - щелочно-земельный катион,М' - катион щелочного металла, X - двойной отрицательно заряженный анион и Н - ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулуMM'XX'H, где М - щелочно-земельный катион,М'-катион щелочного металла, Х и X' - одиночный отрицательно заряженный анион и Н-ион гидрида с увеличенной энергией связи или атом водорода с увеличенной энергией связи. Соединение может иметь формулу HnS, гдеn-1 или 2, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу МХХ'Нn, где n - целое от 1 до 5, М - щелочь или щелочно-земельный катион, Х - одиночный или двойной отрицательно заряженный анион, X' Si, Al, Ni, переходный элемент, внутренний пе 002888 8 реходный элемент или редкоземельный элемент и водородное содержание Нn соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу MAlHn,где n - целое от 1 до 6, М - щелочь или щелочноземельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу МНn,где n - целое от 1 до 6, М - переходной элемент,внутренний переходный элемент, редкоземельный элемент или Ni, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу MNiHn,где n - целое от 1 до 6, М - катион щелочи, щелочно-земельный катион, кремний или алюминий, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу МХНn,где n - целое от 1 до 6, М - катион щелочи, щелочно-земельный катион, кремний или алюминий, Х - переходный элемент, внутренний переходный элемент или катион редкоземельного элемента, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMXAlX'Hn, где n - 1 или 2, М - щелочь или щелочно-земельный катион, Х и Х' - либо одиночный отрицательно заряженный анион либо двойной отрицательно заряженный анион, а водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу TiHn,где n - целое от 1 до 4 и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу Al2Hn,где n - целое от 1 до 4 и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу[КНmКСО 3]n, где m и n - каждое целое и водородное содержание Hm соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу[КНmКNО 3]+n nХ-, где m и n - каждое целое, Х одиночный отрицательно заряженный анион и водородное содержание Нm соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу[КНКNО 3]n, где n - целое и водородное содер 9 жание Н соединения имеет, по меньшей мере,одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу[КНКОН]n, где n-целое и водородное содержание Н соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение, включающее анион и катион,может иметь формулу [МНmМ'Х]n, где m и n каждое целое, М и M' - каждое щелочь или щелочно-земельный катион, Х - одиночный или двойной отрицательно заряженный анион и водородное содержание Нm соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение, включающее анион и катион,может иметь формулу [MHmM'X']+n nХ-, где m иn - каждое целое, М и М' - каждое щелочь или щелочно-земельный катион, Х и X' - одиночный или двойной отрицательно заряженный анион, а водородное содержание Нm соединения имеет,по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMXSiX'Hn, где n - 1 или 2, М - щелочь или щелочно-земельный катион, Х и Х' - либо одиночный отрицательно заряженный анион, либо двойной отрицательно заряженный анион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу MSiHn,где n - целое от 1 до 6, М - щелочь или щелочноземельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SinH4n,где n - целое и водородное содержание Н 4n соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SinH3n,где n - целое и водородное содержание Н 3n соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSinН 3nОm, где n и m - целые и водородное содержание Н 3n соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSixH4x-2yOy, где х и у - каждое целое и водородное содержание Н 4 х-2 у соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу 10 мере одну, разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSinH4n H2O, где n - целое и водородное содержание Н 4n соединения имеет, по меньшей мере,одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SinH2n+2,где n - целое и водородное содержание Н 2n+2 соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSixH2x+2Oy, где х и у-каждое целое и водородное содержание Н 2 х+2 соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSinH4n-2O, где n - целое и водородное содержание Н 4n-2 соединения имеет, по меньшей мере,одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMSi4nH10nOn, где n - целое, М-щелочь или щелочно-земельный катион и водородное содержание Н 10n соединения имеет, по меньшей мере,одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMSi4nH10nOn+1, где n - целое, М-щелочь или щелочно-земельный катион и водородное содержание Н 10n соединения имеет, по меньшей мере,одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMqSinHmOp, где q, n, m и р - целые, М - щелочь или щелочно-земельный катион и водородное содержание Нm соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMqSinHm, где q, n и m - целые, М - щелочь или щелочно-земельный катион и водородное содержание Нm, соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуSinHmOp, где n, m и р - целые и водородное содержание Нm соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SinHm,где n и m - целые и водородное содержание Нm соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу MSiHn,где n - целое от 1 до 8, М-щелочь или щелочноземельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. 11 Соединение может иметь формулу Si2Hn,где n - целое от 1 до 8 и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SiHn,где n - целое от 1 до 8 и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу SiO2Hn,где n - целое от 1 до 6 и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулуMSiO2Hn, где n - целое от 1 до 6, М - щелочь или щелочно-земельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу MSi2Hn,где n - целое от 1 до 14, М - щелочь или щелочно-земельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение может иметь формулу M2SiHn,где n - целое от 1 до 8, М - щелочь или щелочноземельный катион и водородное содержание Нn соединения имеет, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. В МНХ, М 2 НХ, М 2 ХНn, M2X2Hn, М 2 Х 3 Н,M2XX'H, MM'XHn, MM'XX'H, MXX'Hn, MXAlX'Hn одиночный отрицательно заряженный анион может быть ионом галогена, ионом гидроокиси, ионом карбоната водорода или ионом нитрата. В МНХ, M2XHn, M2XX'H, MM'XH,MXX'Hn, MXAlX'Hn двойным отрицательно заряженным анионом может быть ион карбоната,окись или ион сульфата. В MXSiX'Hn, MSiHn, SinH4n, SinН 3n,SinН 3nОm, SixH4x-2yOy, SixH4xOe, SinH4n H2O,SinH2n+2, SixH2x+2Oe, SinH4n-2O, MSi4nH10nOn,MSi4nH10nOn+1, MqSinHmOp, MqSinHm, SinHmOp,SinHm, MSiHn, Si2Hn, SiHn, SiO2Hn, MSiO2Hn,MSi2Hn, M2SiHn наблюдаемые характеристики,такие как стехиометрия, термическая стабильность и/или реакционная способность, такая как реакционная способность с кислородом, отличны от характеристик соответствующего исходного соединения, где водородное содержание представляет только исходный водород Н. Уникальные наблюдаемые характеристики зависят от увеличенной энергии связи разновидности водорода. Применения соединений включают использование в батареях, топливных ячейках,режущих материалах, легких высокопрочных структурных материалах и синтетических во 002888 12 локнах, катодах для термоэлектронных генераторов, фотолюминисцентных соединениях, коррозионно-стойких покрытиях, термостойких покрытиях, фосфорах для освещения, оптических покрытиях, оптических фильтрах, в среде лазера крайнего ультрафиолета, оптоволоконных кабелях, магнитах и магнитной среде для накопителей компьютеров, а также в качестве средства травления, средства маскирования, в легирующих примесях при производстве полупроводников, топливе, взрывчатых веществах и ракетном топливе. Соединения водорода с увеличенной энергией связи полезны в химических синтетических методах обработки и методах очистки. Ион водорода с увеличенной энергией связи применяется как отрицательный ион электролита электролитической ячейки высокого напряжения. Избирательность разновидности водорода с увеличенной энергией связи в формировании связей со специфическими изотопами обеспечивает средство для очистки желательных изотопов элементов. В соответствии с другим аспектом изобретения дигидрины производятся при реагировании протонов с ионами гидрино гидрида или путем термического разложения ионов гидрино гидрида либо путем термического или химического разложения соединений водорода с увеличенной энергией связи. Создан способ приготовления соединения,содержащего, по меньшей мере, один ион гидрида с увеличенной энергией связи. Такие соединения ниже рассматриваются как "соединения гидрино гидрида". Способ заключается в реагировании атомарного водорода с катализатором, имеющим чистую энтальпию реакции около m/2 27 эВ, где m-целое, большее 1, предпочтительно целое менее 400, для получения атомарного водорода с увеличенной энергией связи, имеющего энергию связи около 13,6 эВ/(1/р)2, где р-целое, предпочтительно целое от 2 до 200. Атомарный водород с увеличенной энергией связи реагирует с электроном для получения иона гидрида с увеличенной энергией связи. Ион гидрида с увеличенной энергией связи реагирует с одним или более катионами для получения соединения, содержащего, по меньшей мере, один ион гидрида с увеличенной энергией связи. Изобретение также направлено на создание реактора для получения соединений водорода с увеличенной энергией связи, таких как соединения гидрино гидрида. Такой реактор ниже рассматривается как "реактор гидрино гидрида". Реактор гидрино гидрида содержит ячейку для создания гидринов и источник электронов. Реактор производит ионы гидрида,имеющие энергию связи согласно уравнению(7). Ячейка для создания гидринов может иметь форму, например, электролитической ячейки,газовой ячейки, газоразрядной ячейки или ячейки с плазменной горелкой. Каждая такая ячейка 13 содержит: источник атомарного водорода; по меньшей мере, один твердый, расплавленный,жидкий или газообразный катализатор для создания гидринов; и сосуд для реагирования водорода и катализатора при производстве гидринов. Как он использован здесь и как предполагается предметом изобретения, термин "водород", если не указано иное, включает не только легкий водород (1H), но также дейтерий и тритий. Электроны от источника электронов контактируют с гидринами и реагируют для образования ионов гидрино гидрида. Реакторы, описанные здесь как "реакторы гидрино гидрида", способны производить не только ионы гидрино гидрида и соединения, но также другие соединения водорода с увеличенной энергией связи согласно изобретения. Следовательно, определение "реакторы гидрино гидрида" не следует понимать как ограничивающее природу полученного соединения водорода с увеличенной энергией связи. В электролитической ячейке гидрины восстанавливаются (т.е.достигают электрона) для формирования ионов гидрино гидрида путем контактирования с любым из следующих элементов: 1) катодом, 2) восстановителем ячейки,3) любой компонентой реактора или 4) восстановителем, посторонним в отношении работы ячейки (т.е. потребительским восстановителем,добавленным к ячейке от внешнего источника)(пункты 2-4 ниже совместно рассматриваются как "реактив восстановления гидрино"). В газовой ячейке гидрины восстанавливаются до ионов гидрино гидрида при помощи реактива восстановления гидрино. В газоразрядной ячейке гидрины восстанавливаются до ионов гидрино гидрида путем 1) контактирования с катодом, 2) восстановления при помощи плазменных электронов или 3) контактирования с реактивом восстановления гидрино. В ячейке с плазменной горелкой гидрины восстанавливаются до ионов гидрино гидрида путем 1) восстановления при помощи плазменных электронов или 2) контактирования с реактивом восстановления гидрино. В одном предпочтительном варианте источник электронов, содержащий реактив восстановления ионов гидрино гидрида, эффективен только в присутствии атомов гидрино. Согласно одному аспекту изобретения новые соединения образуются из ионов гидрино гидрида и катионов. В электролитической ячейке катионом может быть либо подкисленная разновидность материала катода или анода ячейки, катион добавленного восстановителя,либо катион электролита (такой как катализатор, содержащий катион). Катионом электролита может быть катион катализатора. В газовой ячейке катион представляет подкисленную разновидность материала ячейки, катион, содержащий материал диссоциации молекулярного водорода, который производит атомарный водород, катион, содержащий добавленный вос 002888 14 становитель, или катион в ячейке (такой как катион катализатора). В разрядной ячейке катионом является либо подкисленная разновидность материала катода или анода, катион добавленного восстановителя, либо катион в ячейке (такой, как катион катализатора). В ячейке с плазменной горелкой катионом является либо подкисленная разновидность материала ячейки,катион добавленного восстановителя либо катион, представленный в ячейке (такой, как катион катализатора). Создана батарея, содержащая катод и катодное пространство с окислителем, анод и анодное пространство с восстановителем и солевой мостик, завершающий цепь между катодным и анодным пространствами. Соединения водорода с увеличенной энергией связи могут служить в качестве окислителей полуреакции катода батареи. Окислителем может быть соединение водорода с увеличенной энергией связи. Катион Мn+ (где n-целое), связанный с ионом гидрино гидрида, так что энергия связи катиона или атома М(n-1)+ меньше, чем энергия связи иона Н-(1/р) гидрино гидрида, может служить в качестве окислителя. Альтернативно ион гидрино гидрида может быть выбран для данного катиона, так что ион гидрино гидрида не подкислен катионом. Таким образом окислитель Mn+H(1/p)n содержит катион Мn+, где n-целое, и ион гидрино гидрида Н-(1/р), где р-целое, большее 1,то есть выбран так, что его энергия связи больше, чем эта энергия для М(n-1)+. Путем выбора стабильного соединения катион-анион гидрино гидрида создан окислитель батареи, где потенциал восстановления определяется энергиями связи катиона и аниона окислителя. Окислителем батареи может быть, например, соединение водорода с увеличенной энергией связи, содержащее молекулярный ион дигидрино, связанный с ионом гидрино гидрида,так что энергия связи восстановленного молекулярного иона дигидрино,молекулыH2[2c'= ао/р] дигидрино, меньше, чем энергия связи иона Н-(1/р') гидрино гидрида. Одним из таких окислителей является соединениеH2[2 с'= ао/р]+ Н-(1/р'), где р молекулярного иона дигидрино равно 2 и р' иона гидрино гидрида равно 13, 14, 15, 16, 17, 18 или 19. Альтернативно в случае He2+H- (1/p)2 или Fe4+ Н- (1/р)4 значение р иона гидрино гидрида может быть от 11 до 20, поскольку энергия связи Не+ и Fe3+ составляет 54,4 эВ и 54,8 эВ соответственно. Таким образом, в случае He2+H- (1/p)2 ион гидрида выбран с большей энергией связи, чем Не+ (54,4 эВ). В случае Fе 4+H- (1/p)4 ион гидрида выбран с большей энергией связи, чем Fe3+ (54,8 эВ). В одном предпочтительном варианте батареи ионы гидрино гидрида образуют цепь при работе батареи путем миграции от катодного пространства к анодному пространству через солевой мостик. Солевой мостик может содер 15 жать мембрану, проводящую анионы, и/или проводник анионов. Солевой мостик может быть сформирован из цеолита, борида лантанида (такого как MB6, где М - лантанид) или щелочно-земельного борида (такого как MB6, где м - щелочно-земельный элемент), которые выбраны как проводник анионов на основании малого размера аниона гидрино гидрида. Батарея по выбору сделана перезаряжаемой. В соответствии с предпочтительным вариантом перезаряжаемой батареи катодное пространство содержит восстановленный окислитель, а анодное пространство - окисленный восстановитель. Батарея далее содержит ион, такой как ион гидрино гидрида, который мигрирует для завершения цепи. Для обеспечения перезарядки батареи окислитель, содержащий соединения водорода с увеличенной энергией связи,должен быть способен образовываться путем приложения требуемого напряжения к батареи для получения желаемого окислителя. Представительное требуемое напряжение составляет примерно от одного вольта до 100 В. Окислитель Mn+H-(1/p)n содержит требуемый катион,сформированный при желательном напряжении,выбранном так, что n-ая энергия ионизации IPn для формирования катиона Мn+ из М(n-1)+, где nцелое, меньше, чем энергия связи иона Н-(1/р) гидрино гидрида, где р-целое, большее 1. Восстановленным окислителем может быть, например, металл железа, а окисленным восстановителем, имеющим источник ионов гидрино гидрида, может быть, например, гидрино гидрид калия (K+H-(1/p. Приложение требуемого напряжения подкисляет восстановленный окислитель (Fe) до желательного состояния окисления (Fe4+) для образования окислителяFe4+ (H- (1/p)4, где р иона гидрино гидрида целое от 11 до 20. Приложение требуемого напряжения также восстанавливает окисленный восстановитель (К+) до желаемого состояния (К) окисления для формирования восстановителя(металл калия). Ионы гидрино гидрида завершают цепь путем миграции от анодного пространства к катодному пространству через солевой мостик. В предпочтительном варианте батареи катодное пространство функционирует как катод. Соединения водорода с увеличенной энергией связи, обеспечивающие ион гидрино гидрида, могут быть использованы для синтеза желательных композиций вещества путем электролиза. Ион гидрино гидрида может служить в качестве отрицательного иона электролита электролитической ячейки высокого напряжения. Желательные соединения, такие как силициды фазы Зинтла (Zintl) и силаны, могут быть синтезированы с использованием электролиза без разложения аниона, электролита или электролитического раствора. Энергия связи иона гидрино гидрида больше, чем для любых обычных разновидностей, сформированных при ра 002888 16 боте ячейки. Ячейка работает при требуемом напряжении, которое формирует требуемый продукт без разложения иона гидрино гидрида. В случае, когда требуемым продуктом является катион Мn+ (где n-целое), ион гидрино гидрида Н-(1/р) выбран так, что его энергия связи превышает энергию связи М(n-1)+. Требуемые катионы, сформированные при требуемом напряжении, могут быть выбраны так, что n-ая энергия ионизации IРn для формирования катиона Мn+ изM(n-1)+ (где n-целое) меньше энергии связи иона Н-(1/р) гидрино гидрида. Альтернативно ион гидрино гидрида может быть выбран для желаемого катиона, так что он не окислен катионом. Например, в случае Не 2+ или Fe4+ значение р иона гидрино гидрида может быть от 11 до 20,поскольку энергии связи Не+ и Fe3+ составляют 54,4 эВ и 54,8 эВ соответственно. Таким образом, в случае желательного соединения Не 2+ (Н(1/р 2 ион гидрида выбран для получения большей энергии связи, чем Не+ (54,4 эВ). В случае желательного соединения Fe4+(Н-(1/р 4 ион гидрида выбран для получения большей энергии связи, чем Fe3+ (54,8 эВ). Ион гидрино гидрида выбран таким образом, что электролит не разлагается при работе для получения требуемого продукта. Топливная ячейка согласно изобретению содержит источник окислителя, катод в катодном пространстве при связи с источником окислителя, анод в анодном пространстве и солевой мостик, образующий цепь между катодным и анодным пространствами. Окислителями могут быть гидрины от источника окислителя. Гидрины вступают в реакцию для образования ионов гидрино гидрида в виде полуреакции катода. Соединения водорода с увеличенной энергией связи могут обеспечивать гидрины. Гидрины могут быть поданы к катоду от источника окислителя путем термического или химического разложения соединений водорода с увеличенной энергией связи. Альтернативно источником окислителя может быть электролитическая ячейка, газовая ячейка, газоразрядная ячейка или ячейка с плазменной горелкой реактора гидрино гидрида согласно изобретению. Альтернативный окислитель топливной ячейки содержит соединения водорода с увеличенной энергией связи. Например, катион Мn+ (где nцелое), связанный с ионом гидрино гидрида, так что энергия связи катиона или атома M(n-1)+ меньше энергии связи иона Н-(1/р) гидрино гидрида, может служить в качестве окислителя. Источником окислителя, таким как Mn+H-(1/p)n,может быть электролитическая ячейка, газовая ячейка, газоразрядная ячейка или ячейка с плазменной горелкой реактора гидрино гидрида согласно изобретению. В предпочтительном варианте топливной ячейки катодное пространство функционирует как катод. 17 Согласно другому предпочтительному варианту осуществления изобретения создано топливо, содержащее, по меньшей мере, одно соединение водорода с увеличенной энергией связи. Согласно другому аспекту изобретения энергия освобождается путем термического разложения или химической реакции, по меньшей мере, одного из следующих реагирующих веществ: (1) соединения водорода с увеличенной энергией связи, (2) гидрино, или (3) дигидрино. Разложение или химическая реакция производит, по меньшей мере, одно из следующего: (а) соединение водорода с увеличенной энергией связи при другой стехиометрии, чем реагирующие вещества, (b) соединение водорода с увеличенной энергией связи, имеющее ту же стехиометрию, содержащую одну или более разновидности с увеличенной энергией связи, которые имеют большую энергию связи, чем соответствующие разновидности реагирующего вещества(веществ), (с) гидрино, (d) дигидрино, имеющий большую энергию связи, чем дигидрино реагирующего вещества, или (е) гидрино, имеющий большую энергию связи, чем гидрино реагирующего вещества. Примеры соединений водорода с увеличенной энергией связи как реагирующих веществ и продуктов включают те, которые даны в разделе "Экспериментальные результаты" и в разделе "Дополнительные соединения с увеличенной энергией связи". Другой предпочтительный вариант изобретения представляет соединение водорода с увеличенной энергией связи, содержащее ион гидрида с энергией связи около 0,65 эВ. Другим предпочтительным вариантом осуществления изобретения является создание способа получения соединения, содержащего ион гидрида, имеющий энергию связи около 0,65 эВ. Способ заключается в подаче атомов водорода с увеличенной энергией связи и в реагировании атомов водорода с увеличенной энергией связи с первым восстановителем, тем самым образуя, по меньшей мере, один стабильный ион гидрида, имеющий энергию связи,большую 0,8 эВ, и, по меньшей мере, один нереактивный атомарный водород. Способ далее заключается в сборе нереактивного атомарного водорода и реагировании нереактивного атомарного водорода со вторым восстановителем,тем самым образуя стабильные ионы гидрида,включающие ион гидрида, имеющий энергию связи около 0,65 эВ. Первый восстановитель может иметь высокую работу выхода или положительную свободную энергию реакции с нереактивным водородом. Первый восстановитель может быть металлом, отличным от щелочи или щелочно-земельного металла, таким как вольфрам. Второй восстановитель может содержать плазму либо щелочь или щелочно-земельный металл. 18 Другим предпочтительным вариантом изобретения является способ взрывного освобождения энергии. Соединение водорода с увеличенной энергией связи, содержащее ион гидрида, имеющий энергию связи около 0,65 эВ, реагирует с протоном для получения молекулярного водорода, имеющего первую энергию связи около 8,928 эВ. Протон может поступать из кислоты или сверхкислоты. Кислота или сверхкислота может содержать, например, HF, HCl,Н 2SO4, НNО 3, продукт реакции HF и SbF5, продукт реакции HCl и Аl2 Сl6, продукт реакцииH2SO3F и SbF5, продукт реакции Н 2SО 4 и SO2 и их комбинации. Реакция протона кислоты или сверхкислоты может быть инициирована быстрым перемешиванием иона гидрида или соединения иона гидрида с кислотой или сверхкислотой. Быстрое перемешивание может быть достигнуто, например, путем детонации обычного взрывчатого вещества, ближайшего к иону гидрида или соединению иона гидрида и к кислоте или сверхкислоте. Другим предпочтительным вариантом осуществления изобретения является способ взрывного освобождения энергии, заключающийся в термическом разложении соединения водорода с увеличенной энергией связи, содержащего ион гидрида, имеющий энергию связи около 0,65 эВ. Разложение соединения производит молекулу водорода, имеющую первую энергию связи около 8,928 эВ. Термическое разложение может быть достигнуто, например, путем детонации обычного взрывчатого вещества,ближайшего к соединению иона гидрида. Термическое разложение может быть также достигнуто путем нагревания встряхиванием соединения иона гидрида. Нагревание встряхиванием может быть достигнуто, например, путем соударения метательного заостренного наконечника с соединением иона гидрида при условиях,приводящих к детонации при столкновении. Другим применением соединений водорода с увеличенной энергией связи является легирующая примесь при изготовлении термоэлектрического катода с другим более высоким напряжением, чем у исходного материала. Например, исходным материалом может быть вольфрам, молибден или их окислы. В предпочтительном варианте легированного термоэлектрического катода легирующей примесью является ион гидрино гидрида. Материалы, такие как металлы, могут быть легированы ионами гидрино гидрида путем ионной имплантации, эпитаксии или вакуумного осаждения для формирования высококачественного термоэлектрического катода. Специфичное значение р иона гидрино гидрида (Н-(n=1/р), где р-целое) может быть выбрано для обеспечения требуемого свойства,такого как легирование при слежении за напряжением. Другим применением соединений водорода с увеличенной энергией связи является леги 19 рующая примесь или компонента легирующей примеси при изготовлении легированных полупроводников, каждый с измененной запрещенной зоной относительно исходного материала. Например, исходным материалом может быть обычный полупроводник, обычный легированный полупроводник или обычная легирующая примесь, такая как кремний, германий, галлий,индий, мышьяк, вещества, содержащие трехвалентный фосфор, сурьма, бор, алюминий, элементы группы III, элементы группы IV или элементы группы V. В предпочтительном варианте легированного полупроводника легирующей примесью или компонентой легирующей примеси является ион гидрино гидрида. Материалы,такие как кремний, могут быть легированы ионами гидрино гидрида путем ионной имплантации, эпитаксии или вакуумного осаждения для формирования высококачественного легированного полупроводника. Специфичное значение р иона гидрино гидрида (Н-(n=1/р), где р-целое) может быть выбрано для обеспечения требуемого свойства, такого как легирование со слежением за запрещенной зоной. Способ разделения изотопов включает этап реагирования элемента или соединения,имеющего изотопную смесь, содержащую желательный элемент, с разновидностью водорода с увеличенной энергией связи в недостаточном количестве. Энергия связи продукта реакции зависит от изотопа требуемого элемента. Таким образом, реакция формирует преобладающим образом новое соединение, содержащее требуемый элемент, который обогащен в желательном изотопе, и, по меньшей мере, одну разновидность водорода с увеличенной энергией связи. Соединение, содержащее, по меньшей мере,одну разновидность водорода с увеличенной энергией связи и желательный изотопно обогащенный элемент, подвергается очистке. Это является путем получения обогащенного изотопа элемента. Или соединение, содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи и нежелательный изотопно обогащенный элемент, удаляется для получения желательного обогащенного изотопа элемента. Способ разделения изотопов элемента заключается в реагировании разновидности водорода с увеличенной энергией связи с элементарной изотопной смесью, содержащей молярный избыток желательного изотопа по отношению к разновидности водорода с увеличенной энергией связи для образования соединения, обогащенного желательным изотопом, и в очистке соединения, обогащенного желательным изотопом. Способ разделения изотопов элемента,присутствующего в нескольких соединениях,заключается в реагировании разновидности водорода с увеличенной энергией связи с соединениями, содержащими изотопную смесь, кото 002888 20 рая имеет молярное превышение желательного изотопа по отношению к разновидности водорода с увеличенной энергией связи, для образования соединения, обогащенного желательным изотопом, и в очистке соединения, обогащенного желательным изотопом. Способ разделения изотопов элемента заключается в реагировании разновидности водорода с увеличенной энергией связи с элементарной изотопной смесью, содержащей молярное превышение нежелательного изотопа по отношению к разновидности водорода с увеличенной энергией связи, для образования соединения, обогащенного нежелательным изотопом, и в удалении соединения, обогащенного нежелательным изотопом. Способ разделения изотопов элемента,представленного в соединениях, заключается в реагировании разновидности водорода с увеличенной энергией связи с соединениями, содержащими изотопную смесь, которая имеет молярное превышение нежелательного изотопа по отношению к разновидности водорода с увеличенной энергией связи, для образования соединения, обогащенного нежелательным изотопом,и в удалении соединения, обогащенного нежелательным изотопом. В одном предпочтительном варианте способа разделения изотопов разновидность водорода с увеличенной энергией связи представляет ион гидрино гидрида. Другие цели, особенности и характеристики настоящего изобретения, а также способов работы и функций соответствующих элементов будут более понятны из следующего ниже описания и прилагаемых пунктов формулы со ссылками на сопровождающие чертежи, которые образуют часть этого описания, причем аналогичные отсылочные позиции обозначают соответствующие части на различных фигурах.III. Краткое описание чертежей Фиг. 1 представляет схематический вид реактора гидрида в соответствии с изобретением. Фиг. 2 - схематический вид реактора гидрида с электролитической ячейкой в соответствии с изобретением. Фиг. 3 - схематический вид реактора гидрида с газовой ячейкой в соответствии с изобретением. Фиг. 4 - схематический вид реактора гидрида с экспериментальной газовой ячейкой в соответствии с изобретением. Фиг. 5 - схематический вид реактора гидрида с газоразрядной ячейкой в соответствии с изобретением. Фиг. 6 - схему реактора гидрида с экспериментальной газоразрядной ячейкой в соответствии с изобретением. Фиг. 7 - схематический вид реактора гидрида с ячейкой с плазменной горелкой в соответствии с изобретением. 21 Фиг. 8 - схематический вид реактора гидрида с другой ячейкой с плазменной горелкой в соответствии с изобретением. Фиг. 9 - схематический вид топливной ячейки в соответствии с изобретением. Фиг. 9 А - схематический вид батареи в соответствии с изобретением. Фиг. 10 показывает область энергии связи от 0 до 1200 эВ рентгеновского фотоэлектронного спектра (XPS) контрольного стекловидного углеродного стержня. Фиг. 11 - обзорный спектр катода из стекловидного углеродного стержня после электролиза электролита 0,57 М К 2 СО 3 (образец 1) с идентифицированными первичными элементами. Фиг. 12 - низкий диапазон энергии связи(0-285 эВ) катода из стекловидного углеродного стержня после электролиза электролита 0,57 М К 2 СО 3 (образец 1). Фиг. 13 - область энергии связи от 55 до 70 эВ рентгеновского фотоэлектронного спектра(XPS) катода из стекловидного углеродного стержня после электролиза электролита 0,57 М К 2 СО 3 (образец 1). Фиг. 14 - область энергии связи от 0 до 70 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для катода из стекловидного углеродного стержня после электролиза электролита 0,57 М К 2 СО 3 (образец 2). Фиг. 15 - область энергии связи от 0 до 70 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для катода из стекловидного углеродного стержня после электролиза электролита 0,57 М К 2 СО 3 и хранения в течение трех месяцев (образец 1). Фиг. 16 - обзорный спектр кристаллов,приготовленных путем фильтрации электролита из электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 4) с идентифицированными первичными элементами. Фиг. 17 - область энергии связи от 0 до 75 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для кристаллов,приготовленных путем фильтрации электролита из электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 4). Фиг. 18 - обзорный спектр кристаллов,приготовленных путем подкисления электролита из электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи, и концентрации подкисленного раствора до образования кристаллов при комнатной температуре (образец 5) с идентифицированными первичными элементами. 22 Фиг. 19 - область энергии связи от 0 до 75 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для кристаллов,приготовленных путем подкисления электролита от электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи, и концентрации подкисленного раствора до формирования кристаллов при комнатной температуре (образец 5). Фиг. 20 - обзорный спектр кристаллов,приготовленных путем концентрации электролита из электролитической ячейки К 2 СО 3, действующей от фирмы Thermacore, Inc., только до образования осаждения (образец 6) с идентифицированными первичными элементами. Фиг. 21 - область энергии связи от 0 до 75 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для кристаллов,приготовленных путем концентрации электролита из электролитической ячейки К 2 СО 3, действующей от фирмы Thermacore, Inc., только до образования осаждения (образец 6) с идентифицированными первичными элементами. Фиг. 22 - суперпозицию областей энергии связи от 0 до 75 эВ рентгеновского фотоэлектронного спектра (XPS) высокого разрешения для образца 4, образца 5, образца 6 и образца 7. Фиг. 23 - сборный рентгеновский фотоэлектронный спектр (XPS) высокого разрешения (область энергии связи от 0 до 75 эВ) в порядке от низа до верха образца 8, образца 9 и образца 9 А. Фиг. 24 - масс-спектр (m/е=0-110) паров от кристаллов из электролита реактора гидрино гидрида с электролитической ячейкой К 2 СО 3,которая имела 1 М LiNO3 и подкислена с НNО 3(образец 3 электролитической ячейки) при температуре нагревателя образца 200 С. Фиг. 25 А - масс-спектр (m/е=0-110) паров от кристаллов, отфильтрованных из электролита реактора гидрино гидрида с электролитической ячейкой К 2 СО 3 (образец 4 электролитической ячейки) при температуре нагревателя образца 185 С. Фиг. 25 В - масс-спектр (m/е=0-110) паров от кристаллов, отфильтрованных из электролита реактора гидрино гидрида с электролитической ячейкой К 2 СО 3 (образец 4 электролитической ячейки) при температуре нагревателя образца 225 С. Фиг. 25 С - масс-спектр (m/е=0-200) паров от кристаллов, отфильтрованных из электролита реактора гидрино гидрида с электролитической ячейкой К 2 СО 3 (образец 4 электролитической ячейки) при температуре нагревателя образца 234 С с распределениями основной компоненты гидрино гидрида силана и соединений силоксана и пиков фрагмента силана. Фиг. 25D - масс-спектр (m/е=0-200) паров от кристаллов, отфильтрованных из электролита 23 реактора гидрино гидрида с электролитической ячейкой К 2 СО 3 (образец 4 электролитической ячейки) при температуре нагревателя образца 249 С с распределениями основной компоненты гидрино гидрида силана и соединений силоксана и пиков фрагмента силана. Фиг. 26 А - масс-спектр (m/е=0-110) паров от желто-белых кристаллов, которые образуются на внешнем крае кристаллизационной чашки от подкисленного электролита электролитической ячейки К 2 СО 3, действующей от фирмыThermacore, Inc., которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 5 электролитической ячейки) при температуре нагревателя образца 220 С. Фиг. 26 В - масс-спектр (m/е=0-110) паров от желто-белых кристаллов, которые формируются на внешнем крае кристаллизационной чашки от подкисленного электролита электролитической ячейки К 2CО 3, действующей от фирмы Thermacore, Inc., которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 5 электролитической ячейки) при температуре нагревателя образца 275 С. Фиг. 26 С - масс-спектр (m/е=0-110) паров от желто-белых кристаллов, которые образуются на внешнем крае кристаллизационной чашки от подкисленного электролита электролитической ячейки К 2 СО 3, действующей от фирмыThermacore, Inc., которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 6 электролитической ячейки) при температуре нагревателя образца 212 С. Фиг. 26D - масс-спектр (m/е=0-200) паров от желто-белых кристаллов, которые образуются на внешнем крае кристаллизационной чашки от подкисленного электролита электролитической ячейки К 2 СО 3, действующей от фирмыThermacore, Inc., которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (образец 6 электролитической ячейки) при температуре нагревателя образца 147 С с распределениями основной компоненты соединений гидрино гидрида силана и пиков фрагмента силана. Фиг. 27 - масс-спектр (m/е=0-110) паров от кристаллов криогенной накачки, изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нитьW (образец 1 газовой ячейки) при динамическом нагревании образца от 90 до 120 С, тогда как сканирование получается в диапазоне массm/е=75-100. Фиг. 28 А - масс-спектр (m/е=0-110) образца, показанного на фиг. 27, с последовательным повторным сканированием, когда общее время каждого сканирования составляет 75 с. 24 Фиг. 28 В - масс-спектр (m/е=0-110) образца, показанного на фиг. 27, сканируемого на 4 мин позже при температуре образца 200 С. Фиг. 29 - масс-спектр (m/е=0-110) паров от кристаллов криогенной накачки, изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нитьW (образец 2 газовой ячейки) при температуре образца 225 С. Фиг. 30 А - масс-спектр (m/е=0-200) паров от кристаллов, приготовленных из темноокрашенной полосы на вершине реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нить W (образец 3 А газовой ячейки) при температуре нагревателя образца 253 С с распределениями основной компоненты соединений гидрино гидрида силана и пиков фрагмента силана. Фиг. 30 В - масс-спектр (m/е=0-200) паров от кристаллов, приготовленных из темноокрашенной полосы на вершине реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нить W (образец 3 В газовой ячейки) при температуре нагревателя образца 216 С с распределениями основной компоненты гидрино гидрида силана и соединений силоксана и пиками фрагмента силана. Фиг. 31 - масс-спектр (m/е=0-200) паров от чистых кристаллов иода, полученных сразу после спектра, показанного на фиг. 30 А и В. Фиг. 32 - масс-спектр (m/е=0-110) паров кристаллов от корпуса реактора гидрино гидрида с газовой ячейкой, содержащего катализаторKI, нитевые проволоки из нержавеющей стали и нить W (образец 4 газовой ячейки) при температуре нагревателя образца 226 С. Фиг. 33 - область энергии связи от 0 до 75 эВ рентгеновского фотоэлектронного спектра(XPS) высокого разрешения для перекристаллизованных кристаллов, приготовленных из реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нить W (образец 4 газовой ячейки), соответствующая масс-спектру,показанному на фиг. 32. Фиг. 34 А - масс-спектр (m/е=0-110) паров от кристаллов криогенной накачки, изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор RbI,нитевые проволоки из нержавеющей стали и нить W (образец 5 газовой ячейки) при температуре образца 205 С. Фиг. 34 В - масс-спектр (m/е=0-200) паров от кристаллов криогенной накачки, изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор RbI,нитевые проволоки из нержавеющей стали и нить W (образец 5 газовой ячейки) при температуре образца 201 С с распределениями основ 25 ной компоненты гидрино гидрида силана и соединений силоксана и фрагментов силана. Фиг. 34 С - масс-спектр (m/е=0-200) паров от кристаллов криогенной накачки, изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор RbI,нитевые проволоки из нержавеющей стали и нить W (образец 5 газовой ячейки) при температуре образца 235 С с распределениями основной компоненты гидрино гидрида силана и соединений силоксана и фрагментов силана. Фиг. 35 - масс-спектр (m/е=0-110) паров от кристаллов реактора гидрино гидрида с газоразрядной ячейкой, содержащего катализатор KI иNi электроды, при температуре нагревателя образца 225 С. Фиг. 36 - масс-спектр (m/е=0-110) паров от кристаллов реактора гидрино гидрида с ячейкой с плазменной горелкой -при температуре нагревателя образца 250 С с распределениями основной компоненты соединений гидрино гидрида алюминия и фрагментарных пиков. Фиг. 37 - масс-спектры как функция времени водорода (m/е=2 и m/е=1), воды (m/е=18,m/е=2 и m/е=1), двуокиси углерода (m/e=44 иm/e=12), фрагмента углеводорода СН+3 (m/е=15) и углерода (m/е=12), полученные после регистрации масс-спектров кристаллов от реакторов гидрино гидрида с электролитической ячейкой,газовой ячейкой, газоразрядной ячейкой и ячейкой с плазменной горелкой. Фиг. 38 - масс-спектр (m/е=0-50) газов отNi трубчатого катода электролитической ячейки К 2 СО 3 в реальном масштабе времени с массспектрометром. Фиг. 39 - масс-спектр (m/е=0-50) образцаMIT, содержащего нерекомбинируемый газ от электролитической ячейки К 2 СО 3. Фиг. 40 - выходная мощность в зависимости от времени в процессе катализа водорода и отклик на гелий в ячейке Калвета, содержащей нагретую платиновую нить и порошок КNО 3 в кварцевой лодочке, нагреваемой нитью. Фиг. 41 А - масс-спектр (m/е=0-50) газов из ячейки Калвета Университета Пенсильвании после катализа водорода, который собирается в откачанной колбе из нержавеющей стали. Фиг. 41 В - масс-спектр (m/е=0-50) газов из ячейки Калвета Университета Пенсильвании после катализа водорода, который собирается в колбе из нержавеющей стали при низком давлении образца. Фиг. 42 - масс-спектр (m/е=0-200) газов из ячейки Калвета Университета Пенсильвании после катализа водорода, который собирается в откачанной колбе из нержавеющей стали. Фиг. 43 - результаты измерения энтальпии реакции разложения соединений гидрино гидрида при использовании калориметра с адиабатной оболочкой при свежих никелевых проволоках и катодах из электролитической ячейки которые производят 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи. Фиг. 44 - результаты газового хроматографического анализа (колонна 60 м) газов, освобожденных из образца, собранного из коллектора плазменной горелки, когда образец нагревается до 400 С. Фиг. 45 - результаты газового хроматографического анализа (колонна 60 м) водорода высокой чистоты. Фиг. 46 - результаты газового хроматографического анализа (колонна 60 м) газов от термического разложения катода из никелевой проволоки электролитической ячейки К 2 СО 3,которая нагревается в вакуумном сосуде. Фиг. 47 - результаты газового хроматографического анализа (колонна 60 м) газов разряда водорода с катализатором (KI), когда реакция газов протекает через рекомбинатор 100% СuО и подвергается выборке газовым хроматографом в реальном масштабе времени. Фиг. 48 - рентгеновские дифракционные данные (XRD) до того, как водород проходит над ионным водородным каталитическим материалом с перекрывающим разрядом: 40% по весу азотно-кислый калий (КNО 3) на пленкеGrafoil с 5% по весу 1%-ой Pt на углероде в виде графита. Фиг. 49 - рентгеновские дифракционные данные (XDR) после прохождения водорода над ионным водородным каталитическим материалом с перекрывающим разрядом: 40% по весу азотно-кислый калий (KNO3) на пленке Grafoil с 5% по весу 1%-ой Pt на углероде в виде графита. Фиг. 50 - рентгеновский дифракционный образец (XDR) кристаллов от хранимого никелевого катода реактора гидрино гидрида с электролитической ячейкой К 2 СО 3 (образец 1 А) . Фиг. 51 - рентгеновский дифракционный образец (XDR) кристаллов, приготовленный путем концентрации электролита от электролитической ячейки К 2 СО 3, действующей от фирмыTermacore, Inc., только до образования осаждения (образец 2). Фиг. 52 показывает схему устройства, содержащего источник света с разрядной ячейкой,спектрометр крайнего ультрафиолета (EUV) для безоконной EUV спектроскопии и массспектрометр, используемый для наблюдения гидрино, иона гидрино гидрида, соединения гидрино гибрида и образований и переходов молекулярных ионов дигидрино. Фиг. 53 - EUV спектр (20-75 нм), зарегистрированный для нормального водорода и катализа водорода с катализатором KNO3, испаренным из резервуара катализатора путем нагревания. Фиг. 54 - EUV спектр (90-93 нм), зарегистрированный при катализе водорода с катализатором KI, испаренным от никелевого пенистого 27 металлического катода путем плазменного разряда. Фиг. 55 - EUV спектр (89-93 нм), зарегистрированный при катализе водорода с пятинаправленной ячейкой поперечного разряда из нержавеющей стали, которая служит в качестве анода, полым катодом из нержавеющей стали и катализатором KI, испаренным непосредственно в плазму полого катода от резервуара катализатора путем нагревания, действующего на четыре контрольных (отсутствие катализатора) трассы. Фиг. 56 - EUV спектр (90-92,2 нм), зарегистрированный при катализе водорода с катализатором KI, испаренным от полого медного катода путем плазменного разряда. Фиг. 57 - EUV спектр (20-120 нм), зарегистрированный для нормального водорода, возбужденного разрядной ячейкой, которая содержит пятинаправленную ячейку поперечного разряда из нержавеющей стали, служащую в качестве анода, с полым катодом из нержавеющей стали. Фиг. 58 - EUV спектр (20-120 нм), зарегистрированный для соединений гидрино гидрида,синтезированных с катализатором KI, испаренным из резервуара катализатора путем нагревания, когда переходы возбуждены плазменным разрядом в разрядной ячейке, которая выполнена в виде пятинаправленной ячейки поперечного разряда из нержавеющей стали, служащей в качестве анода, и полого катода из нержавеющей стали. Фиг. 59 - EUV спектр (120-124,5 нм), зарегистрированный при катализе водорода для формирования гидрино, который реагирует с протонами разрядной ячейки, где катализаторKI испарен от стенок ячейки путем плазменного разряда. Фиг. 60 - пакетированные спектры TOFSIMS m/e=94-99 в порядке от низа до верха образца 8 и образца 10. Фиг. 61 А - пакетированные спектры TOFSIMS m/e=0-50 в порядке от низа до верха образца 2, образца 4, образца 1, образца 6 и образца 8. Фиг. 61 В - пакетированные спектры TOFSIMS m/e=0-50 в порядке от низа до верха образца 10, образца 11 и образца 12. Фиг. 62 - пакетированные масс-спектры(m/e=0-200) паров от кристаллов, подготовленных из чашки реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нитьW при температуре нагревателя образца 157 С,в порядке от верха до низа при IР=30 эВ, IР=70 эВ и IР=150 эВ. Фиг. 63 - масс-спектр (m/e=0-50) паров от кристаллов, приготовленных путем концентрации 300 см 3 электролита K2CO3 из описанной ячейки, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи, используя ротационный 28 выпарной аппарат при 50 С только до образования осаждения (XPS образец 7, TOFSIMS образец 8) при температуре нагревателя образца 100 С и IР=70 эВ. Фиг. 64 - обзорный спектр кристаллов,приготовленных путем концентрации электролита из электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи с ротационным выпарным аппаратом, и формирования кристаллов при комнатной температуре (XPS образец 7) с идентифицированными первичными элементами. Фиг. 65 - область энергии связи от 675 эВ до 765 эВ рентгеновского фотоэлектронного спектра (XPS) кристаллов криогенной накачки,изолированных от чашки 40 С реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI, нитевые проволоки из нержавеющей стали и нить W (XSP образец 13) с идентифицированными пиками Fe 2p1 и Fe 2 р 3. Фиг. 66 - область энергии связи от 0 до 110 эВ рентгеновского фотоэлектронного спектра(XPS) кристаллов криогенной накачки, изолированных от чашки реактора гидрино гидрида с газовой ячейкой, содержащего катализатор KI,нитевые проволоки из нержавеющей стали и нить W (XSP образец 4). Фиг. 67 - область энергии связи от 0 до 80 эВ рентгеновского фотоэлектронного спектра(XSP) KI (XSP образец 15). Фиг. 68 - FTIR спектр образца 1, из которого выделен цифровым способом FTIR спектр эталонного карбоната калия. Фиг. 69 - наложение FTIR спектра образца 1 и FTIR спектра эталонного карбоната калия. Фиг. 70 - FTIR спектр образца 4. Фиг. 71 - пакетированный рамановский спектр 1) никелевой проволоки, которая удалена из катода электролитической ячейки К 2 СО 3,действующей от фирмы Termacore, Inc., промыта дистиллированной водой и просушена, где ячейка производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи, 2) никелевой проволоки, которая удалена из катода контрольной электролитической ячейки Nа 2 СО 3, действующей от фирмы BlackLight Power, Inc., промыта дистиллированной водой и просушена, и 3) той же никелевой проволоки (NI 200 0,0197 дюйма,HTN36NOAG1, фирма Al Wire Tech.Inc.), которая была использована в электролитических ячейках образца 2 и образца 3. Фиг. 72 - рамановский спектр кристаллов,приготовленных путем концентрации электролита от электролитической ячейки К 2 СО 3, которая производит 6,3108 Дж энтальпии образования соединений водорода с увеличенной энергией связи с ротационным выпарным аппаратом, и образования кристаллов при комнатной температуре (образец 4). 29 Фиг. 73 - NMR спектр кристаллов, приготовленных путем концентрации электролита из электролитической ячейки К 2 СО 3, действующей от фирмы Termacore, Inc., только до образования осаждения (образец 1). Фиг. 74 - область энергии связи 0-160 эВ обзорного рентгеновского фотоэлектронного спектра (XPS) образца 2 с идентифицированными пиками первичных элементов и дигидрино. Фиг. 75 - пакетированные TGA результаты 1) эталона, содержащего 99,999% КNО 3(TGA/DTA образец 1), 2) кристаллов из желтобелых кристаллов, образованных на внешнем крае кристаллизационной чашки из подкисленного электролита электролитической ячейки К 2 СО 3, действующей от фирмы Termacore, Inc.,которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (TGA/DTA образец 2). Фиг. 76 - пакетированные DTA результаты 1) эталона с 99,999% КNO3 (TGA/DTA образец 1), 2) кристаллов из желто-белых кристаллов,которые образованы на внешнем крае кристаллизационной чашки из подкисленного электролита электролитической ячейки К 2 СО 3, действующей от фирмы Termacore, Inc., которая производит 1,6109 Дж энтальпии образования соединений водорода с увеличенной энергией связи (TGA/DTA образец 2).IV. Подробное описание изобретения Образование иона гидрида, имеющее энергию связи, превышающую примерно 0,8 эВ, т.е. ион гидрино гидрида, позволяет производить щелочь или щелочно-земельные гидриды,имеющие повышенную стабильность или медленную реакционную способность в воде. Кроме того, с ионами гидрино гидридов могут быть получены очень стабильные металлические гидриды. Разновидность водорода с увеличенной энергией связи формирует очень сильные связи с определенными катионами и имеет уникальные свойства со многими применениями, такими как режущие материалы (например, как замену алмаза), структурные материалы и синтетические волокна, такие как новые неорганические полимеры. Из-за малой массы такого иона гидрино гидрида эти материалы легче имеющихся материалов, содержащих другие анионы. Разновидность водорода с увеличенной энергией связи имеет множество дополнительных применений, таких как катоды для термоэлектрических генераторов; образования фотолюминисцентных соединений (например, силициды фазы Зинтла и силаны, содержащие разновидность водорода с увеличенной энергией связи); коррозионно-стойкие покрытия; теплостойкие покрытия; фосфоры для освещения; оптические покрытия; оптические фильтры (например, вследствие уникальной эмиссии конти 002888 30 нуума и зон поглощения разновидности водорода с увеличенной энергией связи); среда лазера в крайнем ультрафиолете (например, как соединение с высоко положительно заряженным катионом); оптоволоконные кабели (например,как материал с низким затуханием для электромагнитного излучения и высоким коэффициентом преломления); магниты и магнитная среда хранения для компьютера (например, как соединение с ферромагнитным катионом, таким как железо, никель или хром); способы химической синтетической обработки и способы очистки. Специфичное значение р иона гидрино гидрида (Н-(n=1/р), где р-целое) может быть выбрано для обеспечения желательного свойства, такого как легирование при слежении за напряжением. Реакции, приводящие к образованию соединений водорода с увеличенной энергией связи, полезны в процессах химического травления,таких как, например, травление полупроводника для формирования компьютерных чипов. Ионы гидрино гидрида полезны как легирующие примеси для полупроводников при изменении энергий проводимости и валентных зон полупроводниковых материалов. Ионы гидрино гидрида могут использоваться в полупроводниковых материалах путем ионной имплантации, эпитаксии потока или вакуумного осаждения. Специфичное значение р иона гидрино гидрида (Н(n=1/р), где р-целое) может быть выбрано для обеспечения желательного свойства, такого как легирование со слежением за запрещенной зоной. Соединения гидрино гидрида являются полезными полупроводниковыми маскирующими реагентами. Может быть использован кремний с завершенной разновидностью гидрино (в зависимости от завершенного водорода). Высокостабильный ион гидрино гидрида имеет применение как отрицательный ион электролита электролитической ячейки высокого напряжения. В другом применении ион гидрино гидрида с крайней стабильностью представляет существенное усовершенствование как продукт полуреакции катода топливной ячейки или батареи по сравнению с обычными продуктами катода существующих батарей и топливных ячеек. Реакция гидрино гидрида по уравнению(8) освобождает гораздо больше энергии. Другим применением ионов гидрино гидрида в отношении усовершенствованной батареи является изготовление батарей. Батарея, содержащая в качестве соединения окислителя соединения гидрино гидрида,образованного из сильно окисленного катиона,и иона гидрино гидрида ("батарея с гидрино гидридом"), имеет меньший вес, повышенное напряжение, повышенную мощность и большую плотность энергии, чем обычная батарея. В одном предпочтительном варианте батарея гидрино гидрида имеет напряжение ячейки примерно 31 в 100 раз большее, чем обычные батареи. Батарея гидрино гидрида также имеет более низкое сопротивление, чем обычные батареи. Таким образом, мощность новой батареи составляет более чем 10000 от мощности обычных батарей. Более того, батарея гидрино гидрида может обладать плотностями энергии, превышающими 100000 ватт-часов на килограмм. Самые совершенные обычные батареи имеют плотности энергии менее 200 ватт-часов на килограмм. Вследствие быстрой кинетики и необычной экзотермической природы реакций соединений водорода с увеличенной энергией связи, в особенности соединений гидрино гидрида, другие применения включают военное имущество,взрывчатые вещества, ракетные топлива и твердые топлива. Селективность атомов гидрино и ионов гидрида при формировании связей со специфичными изотопами, основанная на разнице в энергиях связи, обеспечивает средства для очистки желательных изотопов элементов. 1. Ион гидрида Атом гидрино Н[ан/р] реагирует с электроном для формирования соответствующего иона гидрино гидрида Н-(n=1/р), как дается уравнением (8). Ионы гидрида представляют специальный случай двухэлектронных атомов, каждый из которых содержит ядро, "электрон 1" и"электрон 2". Вывод энергий связи двухэлектронных атомов приведен в '96 Mills GUT. Ниже следует краткий обзор получения энергии связи гидрида, где номера уравнений в форматеGUT. Ион гидрида содержит два неразличимых электрона, связанных с протоном Z=+1. Каждый электрон проявляет центробежную силу и балансирующая центростремительная сила (на каждый электрон) производится электрической силой между электроном и ядром. Кроме того,существует магнитная сила между двумя электронами, обуславливающая спаривание электронов. 1.1. Определение радиуса сферы орбиты, rn Рассмотрим связь второго электрона с атомом водорода для формирования иона гидрида. Второй электрон не проявляет центральной электрической силы, поскольку электрическое поле равно нулю вне радиуса первого электрона. Однако второй электрон проявляет магнитную силу из-за того, что электрон 1 обусловливает его спиновую пару с электроном 1. Таким образом, электрон 1 проявляет силу реакции электрона 2, которая действует как центробежная сила. Уравнение баланса сил может быть определено путем приравнивания общих сил, действующих на два связанных электрона,рассмотренных совместно. Уравнение баланса сил для сферы орбиты спаренных электронов получено путем приравнивания сил по массе и плотностям заряда. Центробежная сила обоих 32 электронов дается уравнением (7.1) и уравнением (7.2), где масса равна 2mе. Линии электрического поля заканчиваются на заряде. Поскольку оба электрона спарены на одном и том же радиусе, количество линий поля, заканчивающихся на плотности заряда электрона 1, равно их количеству, заканчивающемуся на плотности заряда электрона 2. Электрическая сила пропорциональна количеству линий поля; таким образом, центростремительная электрическая сила,Fele, между электронами и ядром составляетFele(electron 1,2) = где o - диэлектрическая проницаемость свободного пространства. Внешняя магнитная сила на два спаренных электрона дается отрицательной частью уравнения (7.15), где масса равна 2me. Внешняя центробежная сила и магнитные силы на электроны 1 и 2 сбалансированы электрической силой где Z=1. Решая для r2, имеем То есть окончательный радиус электрона 2, r2, дается уравнением (14); он также является окончательным радиусом электрона 1. 1.2. Энергия связи В процессе ионизации электрон 2 перемещается в бесконечность. При помощи правил выбора для поглощения электромагнитного излучения, диктуемых сохранением момента количества движения, поглощение фотона вызывает то, что спиновые оси антипараллельных парных электронов становятся параллельными. Энергия неспаренности, Eunpairing (магнитная),дается уравнением (7.30) и уравнением (14),умноженными на два, поскольку магнитная энергия пропорциональна квадрату магнитного поля, как получено в уравнениях (1.122-1.129). Отталкивательное магнитное поле присутствует на электроне, подлежащем ионизации, из-за параллельного выравнивания спиновых осей. Энергия для перемещения электрона 2 к радиусу, который бесконечно больше, чем радиус электрона 1, равна нулю. В этом случае силой,действующей на электрон, является только магнитная сила. Вследствие сохранения энергии изменение потенциальной энергии для перемещения электрона 2 в бесконечность при ионизации иона гидрида может быть вычислено из магнитной силы уравнения (13). Магнитная работа, Emagwork, является отрицательным интегралом от магнитной силы (второй член в правой части уравнения (13 в пределах от r2 до бесконечности где r2 дается уравнением (14). Результат интегрирования 33 где s=1/2. Путем перемещения электрона 2 в бесконечность электрон 1 движется к радиусу(7.30). В настоящем случае инверсного квадратичного центрального поля энергия связи составляет одну половину отрицательной величины потенциальной энергии [Г. Р. Фоулес(Fowles G.R.), Аналитическая механика, третье издание, Holt, Rinehart and Winston, Нью-Йорк,(1977), с. 154-156]. Таким образом, энергия связи дается вычитанием двух членов магнитной энергии из одной половины отрицательной величины магнитной работы, где me-уменьшенная масса электрона e, данная уравнением (1.167),из-за электродинамической магнитной силы между электроном 2 и ядром, даваемой одной половиной ее из уравнения (1.164). Фактор одной половины следует из уравнения (13). Энергия связи =- Emagwork-Eelectron 1 final (магнитная) - Eunpairing (магнитная) = Энергия связи обычного иона гидрида Н(n=1) равна 0,75402 эВ согласно уравнению (17). Экспериментальное значение, данное Дианом[John A. Dean, редактор, Справочник по химии,13-ое издание, McGraw-Hill Book Company,Нью-Йорк, (1995), с.3-10], составляет 0,754209 эВ, что соответствует длине волны = 1644 нм. Таким образом, оба значения приближены к энергии связи около 0,8 эВ. 1.3. Ион гидрино гидрида Атом гидрино Н(1/2) может формировать стабильный ион гидрида, именно, ион Н-(n=1/2) гидрино гидрида. Центральное поле атома гидрино является удвоенным по сравнению с атомом водорода и из уравнения (13) следует, что радиус иона гидрино гидрида Н-(n=1/2) составляет одну половину от радиуса обычного иона гидрида водорода, Н-(n=1), даваемого уравнением (14),Энергия следует из уравнения (17) и уравнения (18). Энергия связи = - Emagwork -Eelektron 1 final (магнитная) Eunpairing (магнитная) = Энергия связи иона гидрино гидрида Н(n=1/2) составляет 3,047 эВ согласно уравнению(19), которое соответствует длине волны =407 нм. В общем центральное поле атома гидрино Н-(n=1/р), р-целое, представляет р раз от поля атома водорода. Таким образом, уравнение баланса сил где Z=1, поскольку поле равно нулю для rr1. Решая для r2, имеем Из уравнения (21) радиус иона гидрино гидрида Н-(n=1/р), р-целое, составляет 1/р от радиуса гидрида атомарного водорода, Н-(n=1),даваемого уравнением (14). Энергия следует из уравнения (20) и уравнения (21). Энергия связи = - Emagwork - Eelectron 1 final Табл. 1 выше дает энергию связи иона гидрино гидрида Н-(n=1/р) как функцию р согласно уравнению (22). 2. Реактор гидрида Один предпочтительный вариант осуществления изобретения включает реактор гидрида,показанный на фиг. 1 и содержащий сосуд 52 со смесью 54 катализа. Смесь 54 катализа содержит источник 56 атомарного водорода, поступающего через проход 41 подачи катализатора. Катализатор 58 имеет чистую энтальпию реакции около m/2 . 27,21 эВ, где m-целое, предпочтительно целое, меньшее 400. Катализ включает реагирование атомарного водорода от источника 56 с катализатором 58 для формирования гидринов. Реактор гидрида также содержит источник 70 электронов для контактирования гидринов с электронами при восстановлении гидринов до ионов гидрино гидрида. Источником водорода может быть водородный газ, вода,обычный гидрид или растворы металл-водород. Вода может быть диссоциирована для формирования атомов водорода путем, например, термической диссоциации или электролиза. Согласно одному предпочтительному варианту осуществления изобретения молекулярный водород диссоциирован в атомарный водород при помощи катализатора диссоциации молекулярного водорода. Такой катализатор включает, например,благородные металлы, такие как палладий и платину, тугоплавкие металлы, такие как молибден и вольфрам, переходные металлы, такие как никель и титан, внутренние переходные металлы, такие как ниобий и цирконий, и другие такие металлы, перечисленные в предыдущих публикациях Милса (Prior Mills Publications). Согласно другому предпочтительному варианту осуществления изобретения при использовании реактора гидрида с газовой ячейкой или реактора гидрида с газоразрядной ячейкой, как показано на фиг. 3 и 5 соответственно, источник протонов диссоциирует молекулы водорода в атомы водорода. Во всех предпочтительных вариантах реактора гидрино гидрида согласно изобретению средством для формирования могут быть одна или более электрохимическая, химическая, фотохимическая, термическая, со свободными радикалами, звуковая или ядерная реакция (реакции) либо реакция (реакции) с неупругим рассеянием протона или частицы. 35 В двух последних случаях реактор гидрида содержит источник частиц и(или) источник 75 протонов, как показано на фиг. 1, для осуществления реакции в виде реакции неупругого рассеяния. В одном предпочтительном варианте реактора гидрино гидрида катализатор включает электрокаталитический ион или пару (пары) в расплавленном, жидком, газообразном или твердом состоянии, приведенные в таблицах предыдущих публикаций Милса (например,табл. 4 в заявке PCT/US 90/01998 и с. 25-46, 80108 в заявке PCT/US 94/02219). Когда катализ возникает в газовой фазе,катализатор сохраняется при давлении менее атмосферного, предпочтительно в диапазоне от 10 мкмм рт. ст. до 100 мм рт. ст. Реагирующее вещество атомарного и/или молекулярного водорода сохраняется при давлении ниже атмосферного, предпочтительно в диапазоне от 10 мкмм рт. ст. до 100 мм рт.ст. Каждый предпочтительный вариант реактора гидрино гидрида согласно изобретению(реактор гидрида с электролитической ячейкой,реактор гидрида с газовой ячейкой, реактор гидрида с газоразрядной ячейкой и реактор гидрида с ячейкой с плазменной горелкой) содержит следующее: источник атомарного водорода; по меньшей мере, один твердый, расплавленный, жидкий или газообразный катализатор для получения гидринов и сосуд для получения гидринов, включая перечисление эффективных катализаторов и источников атомарного водорода в предыдущих публикациях Милса. Также описаны методологии для идентификации гидринов. Таким образом полученные гидрины реагируют с электроном для образования ионов гидрино гидрида. Способы восстановления гидринов до ионов гидрино гидрида включают, например, следующее: в реакторе гидрида с электролитической ячейкой восстановление на катоде; в реакторе гидрида с газовой ячейкой химическое восстановление при помощи реагирующего вещества; в реакторе гидрида с газоразрядной ячейкой восстановление плазменными электронами или катодом газоразрядной ячейки; в реакторе гидрида с плазменной горелкой восстановление плазменными электронами. 2.1. Реактор гидрида с электролитической ячейкой. Реактор гидрида с электролитической ячейкой согласно настоящему изобретению показан на фиг. 2. Электрический ток проходит через электролитический раствор 102, содержащийся в сосуде 101, при приложении напряжения. Напряжение приложено к аноду 104 и катоду 106 от контролера 108 мощности, питаемого от источника 110 питания. Электролитический раствор 102 содержит катализатор для получения атомов гидрино. Согласно одному предпочтительному варианту реактора гидрида с электролитической ячейкой катод 106 образован из никелевого ка 002888 36 тода 106, а анод 104 - из платинированного титана или никеля. Электролитический раствор 102, содержащий около 0,5 м водного электролитического раствора К 2 СО 3 (катализаторK+/K+), подвергается электролизу. Ячейка действует в диапазоне напряжений от 1,4 до 3 В. В одном предпочтительном варианте электролитический раствор 102 расплавлен. Атомы гидрино формируются на катоде 106 через контакт катализатора электролита 102 с атомами водорода, образованными на катоде 106. Устройство реактора гидрида с электролитической ячейкой далее содержит источник электронов в контакте с гидринами, образованными в ячейке, для формирования ионов гидрино гидрида. Гидрины восстанавливаются (т.е. приобретают электрон) в электролитической ячейке до ионов гидрино гидрида. Восстановление возникает путем контактирования гидринов с любым из следующих элементов: 1) катодом 106, 2) восстановителем в сосуде 101 ячейки или 3) любой компонентой реактора, такой как такие особенности, которые обозначены как анод 104 или электролит 102, или 4) восстановителем 160, посторонним к работе ячейки (т.е. потребительским восстановителем, добавленным к ячейке от внешнего источника). Любой этот восстановитель может содержать источник электронов для восстановления гидринов до ионов гидрино гидрида. В электролитической ячейке может формироваться некоторое соединение между ионами гидрино гидрида и катионами. Катионы могут содержать, например, окисленную разновидность материала катода или анода, катион добавленного восстановителя или катион электролита (такой как катализатор, содержащий катион). 2.2. Реактор гидрида с газовой ячейкой. Согласно другому предпочтительному варианту осуществления изобретения реактор для производства ионов гидрино гидрида может иметь форму реактора гидрида с ячейкой водородного газа. Реактор гидрида с газовой ячейкой по настоящему изобретению показан на фиг. 3. Также конструкция и работа экспериментального реактора гидрида с газовой ячейкой, показанного на фиг. 4, описаны ниже в разделе "Идентификация соединений гидрино гидрида при помощи масс-спектроскопии" (образец газовой ячейки). В обоих ячейках гидрины реагирующего вещества обеспечиваются электрокаталитической реакцией и/или реакцией диспропорционирования. Катализ может возникать в газовой фазе. Реактор по фиг. 3 содержит сосуд 207 реакции, имеющий камеру 200, способную сохранять вакуум или давления выше атмосферного. Источник 221 водорода, связанный с камерой 200, доставляет водород к камере через проход 242 подачи водорода. Контроллер 222 установлен для управления давлением и потоком водо 37 рода в сосуде через проход 242 подачи водорода. Датчик 223 давления контролирует давление в сосуде. Вакуум-насос 256 используется для откачивания камеры через вакуумную линию 257. Устройство далее содержит источник электронов в контакте с гидринами для формирования ионов гидрино гидрида. Катализатор 250 для получения атомов гидрино может быть помещен в резервуар 295 катализатора. Катализатор в газовой фазе может содержать электрокаталитические ионы и пары,описанные в предыдущих публикациях Милса. Сосуд 207 реакции имеет проход 241 подачи катализатора для поступления газообразного катализатора от резервуара 295 катализатора к камере 200 реакции. Альтернативно катализатор может быть помещен в химически стойкий открытый контейнер, такой как лодочка, внутри сосуда реакции. Парциальные давления молекулярного и атомарного водорода в сосуде 207 реактора, а также парциальное давление катализатора предпочтительно поддерживаются в диапазоне от 10 ммм рт.ст. до 100 мм рт.ст. Наиболее предпочтительно парциальное давление водорода в сосуде 207 реакции поддерживается около 200 ммм рт.ст. Молекулярный водород может быть диссоциирован в сосуде в атомарный водород при помощи диссоциирующего материала. Материал диссоциации может содержать, например,благородный металл, такой как платина или палладий, переходный металл, такой как никель и титан, внутренний переходный металл, такой как ниобий и цирконий, или тугоплавкий металл, такой как вольфрам или молибден. Материал диссоциации может поддерживаться при повышенной температуре теплом, выделенным катализом водорода (генерация гидрино), и восстановлением гидрино, имеющим место в реакторе. Материал диссоциации может также поддерживаться при повышенной температуре средствами 230 контроля температуры, которые могут иметь форму нагревательной катушки,как показано на поперечном разрезе фиг. 3. Нагревательная катушка питается от источника 225 питания. Молекулярный водород может быть диссоциирован в атомарный водород путем подачи электромагнитного излучения, такого как ультрафиолетовые лучи, от источника 205 фотонов. Молекулярный водород может быть диссоциирован в атомарный водород при помощи нагретой нити или сетки 280, питаемой от источника 285 питания. Диссоциация водорода возникает так, что диссоциированные атомы водорода контактируют с катализатором, который находится в расплавленной, жидкой, газообразной или твердой форме, для получения атомов гидрино. Давление паров катализатора поддерживается при желательной величине путем контроля темпера 002888 38 туры резервуара 295 катализатора нагревателем 298 резервуара катализатора, питаемым от источника 272 питания. Когда катализатор содержится в лодочке внутри реактора, давление паров катализатора поддерживается при желательной величине путем контроля температуры лодочки при регулировании источника питания лодочки. Интенсивность производства гидринов реактором гидрида с газовой ячейкой может контролироваться путем контроля количества катализатора в газовой фазе и/или путем контроля концентрации атомарного водорода. Интенсивность производства ионов гидрино гидрида может контролироваться путем контроля концентрации гидринов, как и путем контроля интенсивности производства гидринов. Концентрация газообразного катализатора в камере 200 сосуда может контролироваться путем контроля первоначального количества летучего катализатора,присутствующего в камере 200. Концентрация газообразного катализатора в камере 200 может контролироваться путем контроля температуры катализатора или путем регулирования нагревателя 298 резервуара катализатора или при помощи регулирования нагревателя лодочки катализатора, когда катализатор содержится в лодочке внутри реактора. Давление пара летучего катализатора 250 в камере 200 определяется температурой резервуара 295 катализатора или температурой лодочки катализатора, поскольку каждый холоднее, чем сосуд 207 реактора. Температура сосуда 207 поддерживается при более высоком рабочем значении, чем резервуара 295 катализатора, теплом, выделяемым катализом водорода (генерацией гидрино) и восстановлением гидрино. Температура сосуда реактора также может поддерживаться средствами контроля температуры, такими как нагревательная катушка 230, показанная в поперечном сечении на фиг. 3. Нагревательная катушка 230 питается от источника 225 питания. Температура реактора далее контролирует интенсивности реакций,таких как диссоциация водорода и катализ. Предпочтительная рабочая температура зависит, в частности, от природы материала сосуда 207 реактора. Температура сосуда 207 из сплава из нержавеющей стали предпочтительно поддерживается при 200-1200 С. Температура сосуда 207 реактора из молибдена предпочтительно поддерживается при 200-1800 С. Температура сосуда 207 из вольфрама предпочтительно поддерживается при 200-3000 С. Температура сосуда 207 из кварца или керамики предпочтительно поддерживается при 200-1800 С. Концентрация атомарного водорода в камере 200 сосуда может контролироваться количеством атомарного водорода, обеспечиваемого материалом диссоциации водорода. Интенсивность диссоциации молекулярного водорода контролируется путем контроля площади по 39 верхности, температуры и выбора материала диссоциации. Концентрация атомарного водорода также может контролироваться количеством атомарного водорода, обеспечиваемого источником 280 атомарного водорода. Концентрация атомарного водорода может далее контролироваться количеством молекулярного водорода, поступающего от источника 221 водорода,управляемого контроллером 222 потока и датчиком 223 давления. Интенсивность реакции может контролироваться при помощи безоконной ультрафиолетовой эмиссионной спектроскопии для детектирования интенсивности эмиссии, обусловленной катализом, ионом гидрино гидрида и эмиссиями соединения. Реактор гидрида с газовой ячейкой далее содержит источник 260 электронов в контакте с полученными гидринами для формирования ионов гидрино гидрида. В реакторе гидрида с газовой ячейкой по фиг. 3 гидрины восстанавливаются до ионов гидрино гидрида путем контактирования с сосудом 207 реактора, содержащим восстановитель. Альтернативно гидрины восстанавливаются до ионов гидрино гидрида путем контакта с любой компонентой реактора,такой как источник 205 фотонов, катализатор 250, резервуар 295 катализатора, нагреватель 298 резервуара катализатора, нагретая нитевидная сетка 280, датчик 223 давления, источник 221 водорода, контролер 222 потока, вакуумнасос 256, вакуумная линия 257, проход 241 подачи катализатора или проход 242 подачи водорода. Гидрины также могут быть восстановлены путем контакта с восстановителем,посторонним к работе ячейки (т.е. потребительским восстановителем, добавляемым к ячейке от внешнего источника). Источник 260 электронов является таким восстановителем. В газовой ячейке могут быть сформированы соединения, содержащие анион гидрино гидрида и катион. Катион, который формирует соединение гидрино гидрида, может содержать катион материала ячейки, материал диссоциации молекулярного водорода с катионом, который производит атомарный водород, добавленный восстановитель с катионом или катион,присутствующий в ячейке (такой как катион катализатора). В другом предпочтительном варианте реактора гидрида с газовой ячейкой сосуд реактора представляет камеру сгорания двигателя внутреннего сгорания, ракетного двигателя или газовой турбины. Газообразный катализатор формирует гидрины из атомов водорода, произведенных пиролизом углеводорода в процессе сгорания последнего. Топливо с углеводородом или водородом содержит катализатор. Катализатор испаряется (становится газообразным) при сгорании. В другом предпочтительном варианте катализатором является термостабильная соль рубидия или калия, такая как RbF, RbCl, RbBr,RbI, Rb2S2, RbOH, Rb2SO4, Рb2 СО 3, Rb2 РО 4 и KF, 002888KCl, KBr, KI, K2S2, KOH, K2SO4, К 2 СО 3, К 3 РO4,K2GeF4. Дополнительные разновидности электрокаталитического иона или пары включают органические анионы, такие как смачивающие или эмульгирующие реагенты. В другом предпочтительном варианте использования двигателя сгорания для получения атомов водорода топливо с углеводородом или водородом далее содержит воду и сольватированный источник катализатора, такой как эмульгированные электрокаталитические ионы или пары. При пиролизе вода служит как другой источник атомов водорода, которые подвергаются катализу. Вода может быть диссоциирована в атомы водорода термически или каталитически на поверхности, такой как цилиндр или головка поршня. Поверхность может содержать материал для диссоциации воды на водород и кислород. Материал диссоциации воды может содержать элемент, соединение, сплав или смесь переходных элементов либо внутренних переходных элементов, таких как железо, платина, палладий, цирконий, ванадий, никель, титан, Sc, Cr, Мn, Со, Сu, Zn, Y, Nb, Mo, Тc, Ru,Rh, Аg, Cd, La, Hf, Та, W, Re, Os, Ir, Au, Нg, Се,Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Vr,Lu, Th, Pa, U, активированный растительный уголь (углерод) или Cs прослоечный углерод(графит). В другом предпочтительном варианте использования двигателя для получения атомов водорода через пиролиз испаренный катализатор выводится из резервуара 295 катализатора через проход 241 подачи катализатора в камеру 200 сосуда. Камера соответствует цилиндру двигателя. Это возникает в течение каждого цикла двигателя. Количество катализатора 250,использованного на цикл двигателя, может быть определено при помощи давления пара катализатора и газообразного объема смещения резервуара 295 катализатора. Давление пара катализатора может контролироваться путем контроля температуры резервуара 295 катализатора нагревателем 298 резервуара. Источник электронов, такой как реагент восстановления гидрино в контакте с гидринами, приводит к образованию ионов гидрино гидрида. 2.3. Реактор гидрида с газоразрядной ячейкой. Реактор гидрида с газоразрядной ячейкой согласно настоящему изобретению показан на фиг. 5, а экспериментальный реактор гидрида с газоразрядной ячейкой - на фиг. 6. Конструкция и работа экспериментального реактора гидрида с газоразрядной ячейкой, показанного на фиг. 6,описаны ниже в разделе "Идентификация соединений гидрино гидрида при помощи массспектроскопии" (образец разрядной ячейки). Реактор гидрида с газоразрядной ячейкой по фиг. 5 включает газоразрядную ячейку 307,содержащую заполненный газом светящийся разрядный вакуумный сосуд 313 с изотопом 41 водорода, имеющий камеру 300. Источник 322 водорода подает водород к камере 300 через управляющий клапан 325 по проходу 342 подачи водорода. Катализатор для получения гидринов, такой как соединения, описанные в предыдущих публикациях Милса (например, табл.4 заявки PCT/US 90/01998 и с. 25-46, 80-108 заявки PCT/US 94/02219), содержится в резервуаре 395 катализатора. Источник 330 напряжения и тока обеспечивает ток для прохождения между катодом 305 и анодом 320. Ток может быть реверсируемым. В одном предпочтительном варианте реактора гидрида с газоразрядной ячейкой стенка сосуда 313 является проводящей и служит анодом. В другом предпочтительном варианте катод 305 является пустотелым, таким как полый катод из никеля, алюминия, меди или нержавеющей стали. Катод 305 может быть покрыт катализатором для получения гидринов. Катализ для формирования гидринов возникает на поверхности катода. Для формирования атомов водорода при создании гидринов молекулярный водород диссоциируется на катоде. Для этого катод сформирован из материала диссоциации водорода. Альтернативно молекулярный водород диссоциируется разрядом. Согласно другому предпочтительному варианту осуществления изобретения катализатор для получения гидринов представлен в газообразной форме. Например, разряд может быть использован для испарения катализатора при обеспечении газообразного катализатора. Альтернативно газообразный катализатор производится разрядным током. Например, газообразный катализатор может быть получен путем разряда в металле калия для формирования К+/К+, металле рубидия для формирования Rb+ или в металле титана для формирования Ti2+. Атомы газообразного водорода для реакции с газообразным катализатором обеспечиваются путем разряда газа молекулярного водорода, так что катализ возникает в газовой фазе. Другой предпочтительный вариант реактора гидрида с газоразрядной ячейкой, где катализ возникает в газовой фазе, использует контролируемый газообразный катализатор. Атомы газообразного водорода для преобразования в гидрины получаются путем разряда газа молекулярного водорода. Газоразрядная ячейка 307 имеет проход 341 для подачи газообразного катализатора 350 от резервуара 395 катализатора к камере 300 реакции. Резервуар 395 катализатора нагревается нагревателем 392, имеющим источник 372 питания, для получения газообразного катализатора для камеры 300 реакции. Давление паров катализатора контролируется путем контроля температуры резервуара 395 катализатора,путем регулирования нагревателя 392 при помощи его источника 372 питания. Реактор далее 42 содержит клапан 301 селективного выброса в атмосферу. В другом предпочтительном варианте реактор гидрида с газоразрядной ячейкой, где катализ возникает в газовой фазе, использует контролируемый газообразный катализатор. Атомы газообразного водорода обеспечиваются разрядом газа молекулярного водорода. Химически стойкий (не реагирует или не деградирует при работе реактора) открытый контейнер, такой как вольфрамовая или керамическая лодочка, расположенный внутри газоразрядной ячейки, содержит катализатор. Катализатор в лодочке нагревается нагревателем лодочки с использованием средств соответствующего источника питания при получении газообразного катализатора для камеры реакции. Альтернативно светящаяся газоразрядная ячейка действует при повышенной температуре, так что катализатор в лодочке является возогнанным, выпаренным или испаренным в газовую фазу. Давление паров катализатора контролируется путем контроля температуры лодочки или разрядной ячейкой путем регулирования нагревателя его источником питания. Газоразрядная ячейка может действовать при комнатной температуре путем непрерывной подачи катализатора. Альтернативно для предотвращения конденсации катализатора в ячейке температура поддерживается выше температуры источника катализатора, резервуара 395 катализатора или лодочки катализатора. Например, температура ячейки из сплава нержавеющей стали составляет 0-1200 С; температура молибденовой ячейки - 0-1800 С; температура вольфрамовой ячейки - 0-3000 С и температура стеклянной, кварцевой или керамической ячейки 0-1800 С. Напряжение разряда может быть в диапазоне от 1 мкА до 1 А, предпочтительно около 1 мА. Устройство газоразрядной ячейки содержит источник электронов в контакте с гидринами для получения ионов гидрино гидрида. Гидрины восстанавливаются до ионов гидрино гидрида при контакте с катодом 305, с плазменными электронами разряда или с сосудом 313. Также гидрины могут быть восстановлены путем контакта с любыми компонентами реактора,такими как анод 320, катализатор 350, нагреватель 392, резервуар 395 катализатора, клапан 301 селективного выброса в атмосферу, управляющий клапан 325, источник 322 водорода,проход 342 подачи водорода или проход 341 подачи катализатора. Согласно еще одной вариации гидрины восстанавливаются при помощи восстановителя 360, постороннего к работе ячейки (например, потребительский восстановитель, добавленный к ячейке от внешнего источника). Соединения, содержащие анион гидрино гидрида и катион, могут быть образованы в газоразрядной ячейке. Катион, который формиру 43 ет соединение гидрино гидрида, может содержать подкисленную разновидность материала катода или анода, катион добавленного восстановителя или катион, присутствующий в ячейке(такой как катион катализатора). В одном предпочтительном варианте устройства газоразрядной ячейки в газоразрядной ячейке 307 приготавливается гидрино гидрид калия или рубидия. Резервуар 395 катализатора содержит катализатор KI или RbI. Давление паров катализатора в газоразрядной ячейке контролируется нагревателем 392. Резервуар 395 катализатора нагревается нагревателем 392 для поддержания давления паров катализатора вблизи катода 305 предпочтительно в диапазоне от 10 ммм рт. ст. до 100 мм рт. ст., более предпочтительно около 200 ммм рт.ст. В другом предпочтительном варианте катод 305 и анод 320 газоразрядной ячейки 307 покрыты катализатором KI или RbI. Катализатор выпаривается при работе ячейки. Подача водорода от источника 322 регулируется управляющим средством 325 для подачи водорода и поддержания давления водорода в диапазоне от 10 ммм рт. ст. до 100 мм рт.ст. В одном предпочтительном варианте устройства реактора гидрида с газоразрядной ячейкой катализ возникает в газоразрядной ячейке водорода при использовании катализатора с чистой энтальпией около 27,2 эВ. Катализатор(например, ионы калия) испаряется разрядом. Разряд также производит атомы водорода реагирующего вещества. Катализ с использованием ионов калия приводит к испусканию фотонов крайнего ультрафиолета. Помимо перехода реакция диспропорционирования, описанная в разделе диспропорционирования энергетических состояний заявки PCT/US 96/07949, вызывает дополнительное испускание в крайнем ультрафиолете при 912 и 304 . Фотоны крайнего ультрафиолета ионизируют водород, приводя к испусканию нормального спектра водорода, который включает видимый свет. Таким образом, испускание в крайнем ультрафиолете от катализатора наблюдается косвенно, как показано преобразованием крайнего ультрафиолета в видимый свет. В то же время гидрины реагируют с электронами для образования ионов гидрино гидрида, имеющих поглощение континуума и линии испускания, приведенные в табл.1 выше. Эти линии наблюдаются эмиссионной спектроскопией, которая идентифицирует катализ и соединения водорода с увеличенной энергией связи. 2.4. Реактор гидрида с ячейкой с плазменной горелкой. Реактор гидрида с ячейкой с плазменной горелкой согласно настоящему изобретению показан на фиг. 7. Плазменная горелка 702 обеспечивает плазму 704 изотопа водорода, заключенную в коллекторе 706. К горелке 702 44 поступают водород от подачи 738 водорода и плазменный газ от подачи 712 плазменного газа совместно с катализатором 714 для формирования гидринов. Плазма может содержать, например, аргон. Катализатор может содержать любое соединение, описанное в предыдущих публикациях Милса (например, табл.4 заявки PCT/US 90/01998 и с.25-46, 80-108 заявки PCT/US 94/02219). Катализатор содержится в резервуаре 716 катализатора. Резервуар снабжн механической мешалкой, такой как магнитный перемешивающий стержень 718, приводимый в действие двигателем 720. Катализатор поступает к плазменной горелке 702 через проход 728. Водород поступает к горелке 702 с помощью прохода 726 водорода. Альтернативно как водород, так и катализатор могут поступать через проход 728. Плазменный газ поступает к горелке при помощи прохода 726. Альтернативно как плазменный газ, так и катализатор могут поступать через проход 728. Водород проходит от подачи 738 водорода к резервуару 716 катализатора через проход 742. Расход водорода контролируется контроллером 744 расхода и клапаном 746. Плазменный газ поступает от подачи 712 плазменного газа через проход 732. Расход плазменного газа контролируется контроллером 734 и клапаном 736. Смесь плазменного газа и водорода поступает к горелке через проход 726 и к резервуару 716 катализатора через проход 725. Смесь контролируется смесителем водород-плазменный газ и регулятором 721 расхода смеси. Смесь водорода и плазменного газа служит как несущий газ для частиц катализатора, которые диспергированы в газовом потоке как малые частицы путем механического перемешивания. Аэрозольный катализатор и водородный газ смеси протекают в плазменную горелку 702 и становятся атомами газообразного водорода и ионами выпаренного катализатора (такими как ионы К+ из KI) в плазме 704. Плазма питается микроволновым генератором 724, где микроволновое излучение настраивается полостью 722. Катализ возникает в газовой фазе. Количество газообразного катализатора в плазменной горелке контролируется путем контроля скорости, с которой катализатор приходит в аэрозольное состояние при помощи механической мешалки. Количество газообразного катализатора также контролируется путем контроля интенсивности потока несущего газа, где несущий газ включает смесь водорода и плазменного газа (например, водород и аргон). Количество атомов газообразного водорода к плазменной горелке контролируется путем контроля интенсивности потока водорода и отношения водорода к плазменному газу в смеси. Интенсивность потока водорода и интенсивность потока плазменного газа к смесителю и регулятору 721 расхода смеси контролируются контроллерами 734 45 и 744 интенсивности потока и клапанами 736 и 746. Регулятор 721 смесителя контролирует смесь водород-плазма для горелки и резервуара катализатора. Скорость катализа также контролируется путем контроля температуры плазмы микроволновым генератором 724. Атомы гидрино и ионы гидрино гидрида производятся в плазме 704. Соединения гидрино гидрида криогенно накачаны в коллектор 706 или они поступают в ловушку 708 соединения гидрино гидрида через проход 748. Ловушка 708 связана с вакуум-насосом 710 через вакуумную линию 750 и клапан 752. Поток к ловушке 708 действует при градиенте давления, контролируемом вакуум-насосом 710, вакуумной линией 750 и вакуумным клапаном 752. В другом предпочтительном варианте реактора гидрида с ячейкой с плазменной горелкой, показанном на фиг. 8, по меньшей мере,одна плазменная горелка 802 или коллектор 806 имеет проход 856 для подачи газообразного катализатора от резервуара 858 катализатора к плазме 804. Катализатор в резервуаре 858 нагревается нагревателем 866, имеющим источник 868 питания, для обеспечения газообразного катализатора к плазме 804. Давление паров катализатора контролируется путем контроля температуры резервуара 858 катализатора при регулировании нагревателя 866 его источником 868 питания. Оставшиеся элементы по фиг. 8 имеют ту же структуру и функцию, что и соответствующие элементы по фиг. 7. Другими словами, элемент 812 фиг. 8 является подачей плазменного газа, соответствующей подачи 712 плазменного газа фиг. 7, элемент 838 фиг. 8 является подачей водорода, соответствующей подачи 738 водорода фиг. 7, и так далее. В другом предпочтительном варианте реактора гидрида с ячейкой с плазменной горелкой химически стойкий открытый контейнер,такой как керамическая лодочка, расположенная внутри коллектора, содержит катализатор. Коллектор плазменной горелки образует ячейку,которая действует при повышенной температуре, так что катализатор в лодочке сублимируется, выпаривается или испаряется в газовую фазу. Альтернативно катализатор в лодочке нагревается нагревателем, имеющим источник питания, для обеспечения газообразного катализатора к плазме. Давление паров катализатора контролируется путем контроля температуры ячейки нагревателем ячейки или путем контроля температуры лодочки при регулировании нагревателя лодочки соответствующим источником питания. Температура плазмы в реакторе гидрида с ячейкой с плазменной горелкой преимущественно поддерживается в диапазоне 500030000 С. Ячейка может работать при комнатной температуре путем непрерывной подачи катализатора. Альтернативно для предотвращения 46 конденсации катализатора в ячейке температура ячейки поддерживается выше температуры источника катализатора, резервуара 758 катализатора или лодочки катализатора. Рабочая температура зависит, в частности, от природы материала ячейки. Температура для ячейки из сплава нержавеющей стали составляет предпочтительно 0-1200 С. Температура для молибденовой ячейки составляет предпочтительно 0-1800 С. Температура для вольфрамовой ячейки составляет предпочтительно 0-3000 С. Температура для стеклянной, кварцевой или керамической ячейки составляет предпочтительно 0-1800 С. Там, где коллектор 706 открыт к атмосфере,давление в ячейке является атмосферным. Типовым плазменным газом для реактора гидрида с плазменной горелкой является аргон. Типовые интенсивности потока аэрозоля составляют 0,8 стандартных литров в минуту(л/мин) водорода и 0,15 л/мин аргона. Типовая интенсивность потока плазмы аргона составляет 5 л/мин. Типовая прямая входная мощность 1000 Вт, а типовая отраженная мощность - 10-20 Вт. В других предпочтительных вариантах реактора гидрида с плазменной горелкой механическая мешалка катализатора (магнитный перемешивающий стержень 718 и двигатель 720) заменена аспиратором, форсункой или распылителем для формирования аэрозоли катализатора 714, растворенной или взвешенной в жидкой среде, такой как вода. Среда содержится в резервуаре 716 катализатора. Или аспиратор, форсунка или распылитель инжектируют катализатор непосредственно в плазму 704. Распыленный катализатор переносится в плазму 704 несущим газом, таким как водород. Реактор гидрида с плазменной горелкой далее содержит источник электронов в контакте с гидринами для получения ионов гидрино гидрида. В ячейке с плазменной горелкой гидрины восстанавливаются до ионов гидрино гидрида путем контактирования 1) с коллектором 706, 2) с электронами плазмы или 3) с любой из компонент реактора, такой как плазменная горелка 702, проход 756 подачи катализатора или резервуар 758 катализатора, или 4) с восстановителем, посторонним к работе ячейки (например,потребительский восстановитель, добавляемый к ячейке от внешнего источника). Соединения, содержащие анион гидрино гидрида и катион, могут быть сформированы в газовой ячейке. Катион, который образует соединение гидрино гидрида, может содержать катион подкисленной разновидности материала горелки или коллектора, катион добавленного восстановителя или катион, присутствующий в плазме (такой как катион катализатора). 3. Очистка соединений водорода с увеличенной энергией связи Соединения водорода с увеличенной энергией связи, образованные в реакторе гидрида, 47 могут быть изолированы и очищены от катализатора, остающегося в реакторе, следующей операцией. В случае реакторов гидрида с электролитической ячейкой, газовой ячейкой, газоразрядной ячейкой и ячейкой с плазменной горелкой соединения водорода с увеличенной энергией связи получаются путем физического сбора, осаждения и перекристаллизации или центрифугирования. Соединения водорода с увеличенной энергией связи могут быть далее очищены способами, описываемыми ниже. Способ изолирования и очистки соединений водорода с увеличенной энергией связи описывается следующим образом. В случае реактора гидрида с электролитической ячейкой вода удаляется из электролита путем выпаривания для получения твердой смеси. Катализатор,содержащий соединение водорода с увеличенной энергией связи, взвешен в подходящем растворителе, таком как вода, который предпочтительно растворяет катализатор, но не соединение водорода с увеличенной энергией связи. Растворитель фильтруется и собираются нерастворимые кристаллы соединения водорода с увеличенной энергией связи. Согласно альтернативному способу изолирования и очистки соединений водорода с увеличенной энергией связи остающийся катализатор растворяется и соединения водорода с увеличенной энергией связи взвешены в подходящем растворителе, который предпочтительно растворяет катализатор, но не соединения водорода с увеличенной энергией связи. Затем кристаллам соединения водорода с увеличенной энергией связи позволяют расти на поверхностях ячейки. Далее растворитель застывает и собираются кристаллы соединения водорода с увеличенной энергией связи. Соединения водорода с увеличенной энергией связи могут быть также очищены от катализатора, например, такого как катализатор соли калия, путем процесса, который использует обмены различных катионов катализатора или соединения водорода с увеличенной энергией связи или обмены анионов катализатора. Обмены изменяют различия в растворимости соединений водорода с увеличенной энергией связи относительно катализатора и других ионов. Альтернативно соединения водорода с увеличенной энергией связи могут осаждаться и перекристаллизовываться с использованием различной растворимости в растворителях, таких как органические растворители и смеси органические растворители/водные растворы. Еще одним способом изолирования и очистки соединений водорода с увеличенной энергией связи от катализатора является использование тонкослойной, газовой или жидкостной хроматографии, такой как жидкостная хроматография высокого давления (HPLC). Соединения водорода с увеличенной энергией связи могут также очищаться путем дис 002888 48 тилляции, сублимирования или криогенной накачки при пониженном давлении,таком как от 10 мкмм рт.ст. до 1 мм рт.ст. Смесь соединений помещается в нагретый сосуд, имеющий вакуум и снабженный криогенной ловушкой. Криогенная ловушка может содержать холодный палец или секцию сосуда, имеющую температурный градиент. Смесь нагревается. В зависимости от относительной летучести компонентов смеси соединения водорода с увеличенной энергией связи собираются как сублимат или осадок. Если соединения водорода с увеличенной энергией связи более летучи, чем другие компоненты смеси, они собираются в криогенной ловушке. Если соединения водорода с увеличенной энергией связи менее летучи, другие компоненты смеси собираются в криогенной ловушке, а соединения водорода с увеличенной энергией связи собираются как осадок. Один такой способ очистки соединений водорода с увеличенной энергией связи от катализатора, такого как соль калия, включает дистилляцию или сублимирование. Катализатор,такой как соль калия, дистиллируется или сублимируется и остаются кристаллы соединения водорода с увеличенной энергией связи. Соответственно продукт реактора гидрида растворяется в растворителе, таком как вода, и раствор фильтруется для удаления частиц и/или примесей. Анион катализатора затем обменивается для увеличения разности в точках кипения соединений водорода с увеличенной энергией связи в зависимости от катализатора. Например,соль азотной кислоты может быть обменена на карбонат или иодид для уменьшения точки кипения катализатора. В случае аниона катализатора карбоната соль азотной кислоты может заменять карбонат с дополнением азотной кислоты. В случае аниона катализатора иодида соль азотной кислоты может заменять иодид с окислением иодида до иода с Н 2O2 и азотной кислотой для получения соли азотной кислоты. Нитрит заменяет ион иодида с дополнением только азотной кислоты. На последнем этапе способа преобразованная соль катализатора сублимируется и собираются оставшиеся кристаллы соединения водорода с увеличенной энергией связи. Другой предпочтительный вариант способа очистки соединения водорода с увеличенной энергией связи от катализатора, такого как соль калия, включает дистилляцию, сублимирование или криогенную накачку, где соединения водорода с увеличенной энергией связи имеют более высокое давление пара, чем катализатор. Кристаллы соединения водорода с увеличенной энергией связи являются дистиллятом или сублиматом, который собран. Разделение возрастает путем обмена аниона катализатора для увеличения его точки кипения. В другом предпочтительном варианте способа изолирования соединения водорода с уве 49 личенной энергией связи замещение аниона катализатора выполняется таким образом, что полученное соединение имеет низкую точку плавления. Смесь, содержащая соединения водорода с увеличенной энергией связи, расплавляется. Соединения водорода с увеличенной энергией связи нерастворимы в расплаве и, таким образом, осаждаются из последнего. Плавление производится в вакууме, так что продукт катализатора с обменным анионом, такой как нитрат калия, частично сублимируется. Смесь, содержащая осадок соединения водорода с увеличенной энергией связи, растворяется в минимальном объеме подходящего растворителя, такого как вода, который предпочтительно растворяет катализатор, но не кристаллы соединения водорода с увеличенной энергией связи. Или соединения водорода с увеличенной энергией связи осаждаются из растворенной смеси. Затем смесь фильтруется для получения кристаллов соединения водорода с увеличенной энергией связи. Один подход к очистке соединений водорода с увеличенной энергией связи включает осаждение и перекристаллизацию. В одном таком способе соединения водорода с увеличенной энергией связи перекристаллизуются из раствора иодида, содержащего соединения водорода с увеличенной энергией связи и один или более иодид калия, лития или соды, который не будет осаждаться до тех пор, пока концентрация не будет превышать примерно 10 М. Таким образом, соединения водорода с увеличенной энергией связи могут предпочтительно осаждаться. В случае раствора карбоната иодид может быть сформирован путем нейтрализации с иодистоводородной кислотой (HJ). Согласно одному такому предпочтительному варианту очистки соединений водорода с увеличенной энергией связи от катализатора иодида калия катализатор KI промывается из реактора гидрида с газовой ячейкой, газоразрядной ячейкой или плазменной горелкой и фильтруется. Затем концентрация фильтрата регулируется приблизительно до 5 Мпутем добавления воды или путем концентрации через выпаривание. Формируются кристаллы соединения водорода с увеличенной энергией связи. Затем осаждение фильтруется. В одном предпочтительном варианте соединения водорода с увеличенной энергией связи осаждаются из кислотного раствора (например, рН от 6 до 1) путем добавления кислоты, такой как азотная кислота, соляная кислота, иодистоводородная кислота или серная кислота. В альтернативном способе очистки соединения водорода с увеличенной энергией связи осаждаются из водной смеси путем добавления осаждающего аниона, катиона или соединения. Например, соединение растворимого сульфата,фосфата или нитрата добавляется для обеспечения предпочтительного осаждения соединений водорода с увеличенной энергией связи. Соеди 002888 50 нения водорода с увеличенной энергией связи изолируются от электролита электролитической ячейки К 2 СО 3 следующими этапами. Электролит К 2 СО 3 из электролитической ячейки делается приблизительно 1 М в катионе, который осаждает ион гидрино гидрида или соединения водорода с увеличенной энергией связи, такие как катион, обеспеченный LiNO3, NaNO3 или Мg(NО 3)2. Дополнительно или альтернативно электролит может быть подкислен кислотой,такой как НNО 3. Раствор концентрируется до формирования осадка. Раствор фильтруется для получения кристаллов. Альтернативно раствор может выпариваться на кристаллизационной чашке, так что соединения водорода с увеличенной энергией связи кристаллизуются отдельно от других соединений. В этом случае кристаллы разделены физически. Разновидность водорода с увеличенной энергией связи может быть связана с катионом,имеющим непарные электроны, таким как переходный или редкоземельный катион, для образования парамагнитного или ферромагнитного соединения. В одном предпочтительном варианте разделения соединения водорода с увеличенной энергией связи отделены от примесей путем магнитной сепарации в кристаллической форме при просеивании смеси над магнитом(например, электромагнитом). Соединения водорода с увеличенной энергией связи прилипают к магниту. Затем кристаллы удаляются механически или путем промывки. В последнем случае промывочная жидкость удаляется путем выпаривания. В случае электромагнитного разделения электромагнит отключается и собираются кристаллы соединения водорода с увеличенной энергией связи. В альтернативном предпочтительном варианте разделения соединения водорода с увеличенной энергией связи отделяются от примесей путем электростатической сепарации в кристаллической форме при просеивании смеси над заряженным коллектором (например, пластиной конденсатора). Соединения водорода с увеличенной энергией связи прилипают к коллектору. Затем кристаллы удаляются механически или путем промывки. В последнем случае промывочная жидкость удаляется путем выпаривания. В случае электростатической сепарации заряженный коллектор отключается и собираются кристаллы соединения водорода с увеличенной энергией связи. Соединения водорода с увеличенной энергией связи в основном чистые, когда они изолированы и очищены приведенными здесь типовыми способами. То есть изолированный материал содержит более 50 атомных процентов упомянутого соединения. Катион изолированного иона гидрино гидрида может быть замещен другим желательным катионом (например, К+ замещен на Li+) при помощи реакции с нагреванием и концентраци 51 ей раствора, содержащего желательный катион,либо посредством хроматографии ионного обмена. Способы очистки для удаления катионов и анионов при получении требуемых соединений водорода с увеличенной энергией связи включают способы, приведенные Байларом [Общая неорганическая химия, Editorial Board J.C. Bailar, H. J. Emeleus, R. Nyholm, A. F. TrotmanDickenson, Pergamon Press], включая с. 528-529,которые используются здесь в качестве ссылки. 4. Способ разделения изотопов Избирательность атомов гидрино и ионов гидрида для образования связей со специфическими изотопами на основе разницы в энергии связи обеспечивает возможность очистки желательных изотопов элементов. Термин изотопа,как он используется здесь, относится к любому изотопу, приведенному в CRC, которая здесь используется в качестве ссылки [R.C. Weast,редактор, CRC Справочник по химии и физике,58-е издание, CRC Press, (1977), с. B-270-B-354]. Дифференциальная энергия связи может возникать из разности в ядерных моментах изотопов и при достаточной разности они могут быть разделены. Способ разделения изотопов элемента включает: 1) реагирование разновидности водорода с увеличенной энергией связи с элементарной изотопной смесью, содержащей молярное превышение желательного изотопа по отношению к разновидности водорода с увеличенной энергией связи для формирования соединения,обогащенного желательным изотопом и содержащего, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, и 2) очистку упомянутого соединения, обогащенного желательным изотопом. Способ разделения изотопов, представленных в более чем одном соединении, включает: 1) реагирование разновидности водорода с увеличенной энергией связи с соединениями, содержащими изотопную смесь с молярным превышением желательного изотопа по отношению к разновидности водорода с увеличенной энергией связи для формирования соединения, обогащенного желательным изотопом и содержащего, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, и 2) очистку упомянутого соединения, обогащенного желательным изотопом. Источники реагирующего вещества разновидности водорода с увеличенной энергией связи включают реакторы гидрино гидрида с электролитической ячейкой, газовой ячейкой, газоразрядной ячейкой и ячейкой с плазменной горелкой согласно настоящему изобретению и соединения водорода с увеличенной энергией связи. Разновидностью водорода с увеличенной энергией связи может быть ион гидрида с увеличенной энергией связи. Соединение, содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи и тре 002888 52 буемый изотопно обогащенный элемент, очищается приведенными здесь способами с целью очистки соединений, содержащих разновидность водорода с увеличенной энергией связи. Очищенное соединение может далее реагировать для формирования различного изотопнообогащенного соединения или элемента путем реакции разложения, такой как реакция плазменного разряда или плазменной горелки либо реакция замещения разновидности водорода с увеличенной энергией связи. Этапы реакции и очистки, такие как они используются специалистами в данной области техники, могут быть повторены столько раз, сколько необходимо для достижения желательной чистоты требуемого изотопно обогащенного элемента или соединения. Например, газовая ячейка гидрино гидрида работает с катализатором KI. Образуются формы 39 КНn соединения водорода с увеличенной энергией связи при отсутствии 41 КНn (n-целое). Смесь катализатора и 39 КНn может быть растворена в воде и 39KHn может осаждаться для получения соединения, которое изотопно обогащено по 39 К. Другой способ разделения изотопов элемента включает: 1) реагирование разновидности водорода с увеличенной энергией связи с элементарной изотопной смесью, содержащей молярное превышение нежелательного изотопа (изотопов) по отношению к разновидности водорода с увеличенной энергией связи для образования соединения (соединений), обогащенного нежелательным изотопом (изотопами) и содержащих, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, и 2) удаление упомянутого соединения (соединений), обогащенного нежелательным изотопом (изотопами). Другой способ разделения изотопов элемента,присутствующего в более чем одном соединении, включает: 1) реагирование разновидности водорода с увеличенной энергией связи с соединениями, содержащими изотопную смесь,имеющую молярное превышение нежелательного изотопа (изотопов) по отношению к разновидности водорода с увеличенной энергией связи для образования соединения (соединений),обогащенного нежелательным изотопом (изотопами) и содержащего, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, и 2) удаление упомянутого соединения(соединений), обогащенного нежелательным изотопом (изотопами). Источники реагирующего вещества разновидности водорода с увеличенной энергией связи включают реакторы гидрино гидрида с электролитической ячейкой,газовой ячейкой, газоразрядной ячейкой и ячейкой с плазменной горелкой согласно изобретению и соединения водорода с увеличенной энергией связи. Разновидностью водорода с увеличенной энергией связи может быть ион 53 гидрида с увеличенной энергией связи. Соединение (соединения), изотопно-обогащенное нежелательным изотопом (изотопами) и содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, удаляется из смеси реакции приведенными здесь способами очистки соединений, содержащих разновидность водорода с увеличенной энергией связи. Альтернативно соединение, изотопно обогащенное желательным изотопом и не содержащее, по меньшей мере, одну разновидность водорода с увеличенной энергией связи, очищается от смеси продукта реакции. Очищенное соединение, изотопно-обогащенное желательным изотопом, может далее реагировать для формирования различного изотопно-обогащенного соединения или элемента при помощи реакции разложения или замещения. Этапы реакции и очистки, такие как используемые специалистами в данной области техники, повторяются столько раз, сколько необходимо для достижения требуемой чистоты желательного изотопнообогащенного элемента или соединения. Например, газовая ячейка гидрино гидрида действует с катализатором KI. Образуются формы соединения 39 КНn водорода с увеличенной энергией связи при отсутствии 41 КНn (nцелое). Смесь катализатора и 39 КНn может растворяться в воде и 39 КНn может осаждаться для получения соединения в растворе, которое изотопно обогащено 41 К. Дифференциальная энергия связи может возникать из разницы в ядерных моментах изотопов и при достаточной разнице они могут быть разделены. Этот механизм может быть усовершенствован при более низких температурах. Таким образом, разделение может быть улучшено путем образования соединений с увеличенной энергией связи и выполнения разделения при пониженной температуре. 5. Идентификация соединений водорода с увеличенной энергией связи Соединения водорода с увеличенной энергией связи могут быть идентифицированы различными способами, такими как 1) элементарный анализ, 2) растворимость, 3) реакционная способность, 4) точка плавления, 5) точка кипения, 6) давление пара как функция температуры,7) коэффициент преломления, 8) рентгеновская фотоэлектронная спектроскопия (XPS), 9) газовая хроматография, 10) рентгеновская дифракция (XRD), 11) калориметрия, 12) инфракрасная спектроскопия (IR), 13) рамановская спектроскопия, 14) мссбауровская спектроскопия, 15) спектроскопия крайнего ультрафиолетового(EUV) испускания и поглощения, 16) спектроскопия ультрафиолетового (UV) испускания и поглощения, 17) спектроскопия видимого испускания и поглощения, 18) спектроскопия ядерного магнитного резонанса, 19) массспектроскопия газовой фазы нагретого образца 54 и масс-спектроскопия магнитного сектора), 20) масс-спектроскопия по временам пролета вторичных ионов(TOFSIMS),21) массспектроскопия по временам пролета при электрораспылении-ионизации (ESITOFMS), 22) термогравиметрический анализ (TGA), 23) дифференциальный термический анализ (DTA) и 24) дифференциальная сканирующая калориметрия (DSC).XPS идентифицирует каждую разновидность водорода с увеличенной энергией связи в соединении при помощи его характеристической энергии связи. Масс-слектроскопия высокого разрешения, такая как TOFSIMS и ESITOFMS, обеспечивает абсолютную идентификацию соединения водорода с увеличенной энергией связи на основе его массы с высоким разрешением. Форма XRD каждого соединения гидрино гидрида уникальна и обеспечивает его абсолютную идентификацию. Спектроскопия ультрафиолетовой (UV) и видимой эмиссии возбужденных соединений водорода с увеличенной энергией связи однозначно идентифицирует их в присутствии характеристических линий континуума иона гидрино гидрида и/или характеристических линий эмиссии разновидности водорода с увеличенной энергией связи каждого соединения. Спектроскопическая идентификация соединений водорода с увеличенной энергией связи получена путем выполнения спектроскопии эмиссии в крайнем ультрафиолете (EUV) и ультрафиолете (UV) и массспектроскопии летучих очищенных кристаллов. Возбужденная эмиссия соединений водорода с увеличенной энергией связи наблюдается, когда источником возбуждения является плазменный разряд, и масс-спектр регистрируется массспектрометром в реальном масштабе времени для идентификации летучих соединений. На своем месте способ спектроскопической идентификации катализа водорода для образования гидринов и для идентификации ионов гидрино гидрида и соединений водорода с увеличенной энергией связи представляет EUV и UV спектроскопию в реальном масштабе времени и масс-спектроскопию реактора гидрино гидрида согласно изобретению. Регистрируются спектр эмиссии катализа водорода и эмиссии, обусловленной образованием и возбуждением соединений гидрино гидрида. Соединения водорода с увеличенной энергией связи идентифицируются рассмотренными способами, как это приведено в разделе "Экспериментальные результаты". 6. Дигидрино Теоретическое введение для дигидрино приведено в публикации '96 Mills GUT. Два атома гидрино Н[ан/р] могут реагировать для формирования двухатомной молекулы, рассматриваемой как дигидрино Н 2 [2 с'= ао/р]. 55 где р - целое. Дигидрино содержит молекулу водорода,имеющую общую энергию ЕтН 2[2 с'= аo/р],где 2 с'- междуядерное расстояние и ao-радиус Бора. Таким образом, относительные междуядерные расстояния (размеры) дигидринов являются дробными. Без учета коррекции из-за вибрации нулевого порядка энергия диссоциации связи, ЕDН 2[2 с' = ao/p], дается разностью между энергией двух атомов гидрино, каждая из которых определяется отрицательной частью уравнения (1), и общей энергией молекулы дигидрино, даваемой уравнением (24).(Энергия диссоциации связи определяется как энергия, требуемая для разрыва связи). Первая энергия связи, BE1, молекулярного иона дигидрино с учетом вибрации нулевого порядка составляет около где р - целое, большее 1, предпочтительно от 2 до 200. Без учета коррекции из-за вибрации нулевого порядка энергия диссоциации связи,EDH2[2c'=2ao/p]+, представляет разность между отрицательной частью энергии связи соответствующего атома гидрино, даваемой уравнением (1), и ЕтН 2[2 с'=2 ао/р]+, даваемой уравнением (26). 56 лярные ионы, сформированные путем дробления соединений водорода с увеличенной энергией связи в масс-спектрометре, как демонстрируется ниже в разделе "Идентификация соединений гидрино гидрида при помощи массспектроскопии" и в разделе "Идентификация молекулы дигидрино при помощи массспектроскопии". Молекула дигидрино Н 2 [2 с'= ао/р] также реагирует с протоном для образования молекулярного иона тригидрино Н 3+(1/p). Реакция представляет Энергия связи, BE, молекулярного иона тригидрино составляет около где р-целое, большее 1, предпочтительно от 2 до 200. Способ подготовки газа дигидрино из иона гидрино гидрида включает реагирование иона гидрино гидрида, содержащего соединение, с источником протонов. Протонами могут быть,например, протоны кислоты, протоны плазмы газоразрядной ячейки или протоны металлического гидрида. Реакция иона гидрино гидрида Н-(1/р) с протоном представляет Один путь генерации газа дигидрино из соединения гидрино гидрида осуществляется посредством разложения соединения. Например, гидрино гидрид калия нагревается до тех пор, пока не формируются металл калия и газ дигидрино. Пример реакции термического разложения соединения гидрино гидрида M+H-(1/p) представляет Вторая энергия связи, ВЕ 2, дается отрицательной частью уравнения (26). Первая энергия связи, BE1, молекулы дигидрино с рассмотрением вибрации нулевого порядка составляет около где М+ - катион. Гидрино может реагировать с протоном для образования иона дигидрино, который затем реагирует с электроном для образования молекулы дигидрино. где р - целое, большее 1, предпочтительно от 2 до 200. Дигидрино и ион дигидрино далее описаны в публикациях '96 Mills GUT, PCT/US 96/07949 и PCT/US 94/02219. Молекула дигидрино реагирует с молекулярным ионом дигидрино для образования атома дигидрино Н(1/р) и молекулярного иона Н 3+(1/p) с увеличенной энергией связи, содержащего три протона (три ядра с атомным номером один) и два электрона, где р соответствует этому значению гидрино, молекулы дигидрино и молекулярного иона дигидрино. Молекулярный ион Н 3+(1/p) ниже рассматривается какH4+(1/p) служит как обозначение присутствия молекул дигидрино и молекулярных ионов,таких как эти молекулы дигидрино и молеку Энергия реакции атома гидрино с протоном дается отрицательным значением энергии связи иона дигидрино (уравнение (28. Энергия, даваемая восстановлением иона дигидрино электроном, представляет отрицательную величину первой энергии связи (уравнение (30. Эти реакции выделяют ультрафиолетовое излучение. UV спектроскопия является средством контроля выделенного излучения. Реакция подготовки газа дигидрино дается уравнением (37). Источники протонов реагирующего вещества содержат, например, металлический гидрид (например, переходный металл, такой как гидрид никеля) и газоразрядную ячейку. В случае источника протона в виде металлического гидрида атомы гидрино образуются в электролитической ячейке, содержащей электролит катализатора и металлический катод, который формирует гидрид. Проникание атомов гидрино через металлический гидрид, 57 содержащий протоны, приводит к синтезу дигидринов согласно уравнению (37). Полученный газ гидрино может быть собран от внутренней части откачанного полого катода, который уплотнен на одном конце. Дигидрины, произведенные согласно уравнению (37), диффундируют в полость катода и собираются. Гидрины также диффундируют через катод и реагируют с протонами гидрида катода. В случае источника протонов с газоразрядной ячейкой гидрины формируются в водородной газоразрядной ячейке, где катализатор присутствует в паровой фазе. Ионизация атомов водорода газоразрядной ячейкой обеспечивает протоны для реагирования с гидринами в газовой фазе при образовании молекул дигидрино согласно уравнению (37). Газ дигидрино может быть очищен путем газовой хроматографии или путем сгорания нормального водорода с рекомбинатором, таким как рекомбинатор СuО. Согласно другому предпочтительному варианту осуществления изобретения дигидрино приготавливаются из соединений водорода с увеличенной энергией связи путем термического разложения соединения для освобождения газа дигидрино. Дигидрино может быть также приготовлен из соединений водорода с увеличенной энергией связи путем химического разложения соединения. Например, соединение химически разлагается путем реакции с катионом, таким как Li+, с NiH6 для выделения в свободном состоянии газа дигидрино согласно следующим способам: 1) осуществляют цикл работы электролитической ячейки 0,57 М К 2 СО 3 с никелевыми электродами в течение увеличенного периода времени, такого как один год; 2) делают электролит около 1 М в LiNO3 и подкисляют его с НNО 3; 3) выпаривают раствор для просушки; 4) нагревают полученную твердую смесь до ее плавления; 5) продолжают подавать тепло до тех пор, пока расплав не станет черным от разложения соединений водорода с увеличенной энергией связи, таких как NiH6 в NiO, газа дигидрино и гидрино гидрида лития; 6) собирают газ дигидрино и 7) идентифицируют дигидрино такими способами, как газовая хроматография,XPS в газовой фазе или рамановская спектроскопия. 6.1. Идентификация газа дигидрино Газ дигидрино идентифицируется как более высокая ионизирующая масса в массспектрометре. Дигидрино также идентифицируется при помощи масс-спектроскопии по присутствию пиков m/e=4 и m/e=2, которые разделяются при низком давлении. Пики газа дигидрино возникают при временах удерживания,отличных от нормального водорода, в процессе газовой хроматографии при криогенных температурах, после прохождения через 100% Н 2/О 2 рекомбинатор (например, рекомбинатор СuО). В случае Н 2[2c'= ao/2] газ дигидрино идентифицируется как разделение пика m/e=2 в масс 002888 58 спектрометре магнитного сектора высокого разрешения, как пик 62,2 эВ в XPS газовой фазы и как пик с 4-кратной вибрационной энергией нормального молекулярного водорода при помощи рамановской спектроскопии. В случае стимулированной рамановской спектроскопии возбуждение лазером YAG используется для наблюдения линий стоксов Рамана и антистоксов из-за вибрации дигидрино Н 2[2c'= ao/2] или D2[2 с'= ао/2], который разжижается на этапе спектроскопии с криогенной накачкой. Другой способ идентификации включает выполнение XPS (рентгеновской фотоэлектронной спектроскопии) на дигидрино, разжиженном на некотором этапе. Дигидрино могут быть далее идентифицированы при помощи XPS по их характеристическим энергиям связи, приведенным в табл.3, где дигидрино представлен в соединении, содержащим дигидрино и, по меньшей мере, один другой элемент. Дигидрино идентифицируется в разделе "Экспериментальные результаты". 7. Дополнительные соединения водорода с увеличенной энергией связи В другом предпочтительном варианте осуществления изобретения ионы гидрино гидрида реагируют или связаны с любым положительно заряженным атомом периодической таблицы, таким как щелочь или щелочно-земельный катон или протон. Ионы гидрино гидрида также могут реагировать или быть связанными с любой органической молекулой, неорганической молекулой, соединением, металлом, неметаллом или полупроводником для образования органической молекулы, неорганической молекулы, соединения, металла, неметалла или полупроводника. Дополнительно ионы гидрино гидрида могут реагировать или быть связанными с Н 3+, H3+(1/p), H4+(1/p) или молекулярными ионами дигидрино Н 2[2 с'= ао/р]+. Молекулярные ионы дигидрино могут быть связаны с ионами гидрино гидрида, так что энергия связи восстановленного молекулярного иона дигидрино, молекулы дигидрино Н 2[2c'= ao/p] меньше, чем энергия связи иона гидрино гидрида Н-(1/р) соединения. Реагирующие вещества, которые могут реагировать с ионами гидрино гидрида, включают нейтральные атомы, отрицательно и положительно заряженные атомарные и молекулярные ионы и свободные радикалы. В одном предпочтительном варианте для получения соединений, содержащих гидрино гидрид, ионы гидрино гидрида реагируют с металлом. Таким образом, в одном предпочтительном варианте реактора гидрида с электролитической ячейкой гидрино, ион гидрино гидрида или дигидрино,полученные при работе на катоде, реагируют с катодом для образования некоторого соединения и в одном предпочтительном варианте реактора гидрида с газовой ячейкой гидрино, ион гидрино гидрида или дигидрино, полученные 59 при работе, реагируют с материалом диссоциации или источником атомарного водорода для образования некоторого соединения. Таким образом производится материал металл-гидрино гидрид. Типичные виды соединений согласно изобретению включают следующие. Каждое соединение согласно изобретению включает, по меньшей мере, одну разновидность водорода Н,который является ионом гидрино гидрида или атомом гидрино; либо в случае соединений, содержащих две или более разновидности водорода Н, по меньшей мере, один такой Н представляет ион гидрино гидрида или атом гидрино и/или две или более разновидности водорода соединения представлены в соединении в форме молекулярного иона дигидрино (два водорода) и/или молекулы дигидрино (два водорода). Соединения, согласно изобретению, могут далее содержать обычный атом водорода или обычную молекулу водорода дополнительно к одной или более разновидности водорода с увеличенной энергией связи. В общем случае такой обычный атом (атомы) водорода и обычная молекула (молекулы) водорода следующих типовых соединений названы"водородом": Н-(1/p)H3+; МН, МН 2 и М 2 Н 2, где М - щелочной катион (в случае М 2 Н 2 щелочные катионы могут быть различными) и Н - ион гидрино гидрида или атом гидрино; МНn n=1 до 2, где М - щелочно-земельный катион и Н-ион гидрино гидрида или атом гидрино; МНХ, где М-щелочной катион, X-нейтральный атом или молекула или одиночный отрицательно заряженный анион, такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион соли азотной кислоты, и Н - ион гидрино гидрида или атом гидрино; МНХ, где М - щелочно-земельный катион, Х двойной отрицательно заряженный анион, такой как ион карбоната или ион сульфата, и Н-атом гидрино; М 2 НХ, где М - щелочной катион (щелочные катионы могут быть различными), Х одиночный отрицательно заряженный анион,такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион соли азотной кислоты, и Н - ион гидрино гидрида или атом гидрино; МНn n=1 до 5, где М - щелочной катион и Н - по меньшей мере один ион гидрино гидрида,атом гидрино, молекулярный ион дигидрино,молекула дигидрино, и может далее содержать обычный атом водорода или обычную молекулу водорода; М 2 Нn n=1 до 4, где М - щелочноземельный катион и Н - по меньшей мере один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино и может далее содержать обычный атом водорода или обычную молекулу водорода (щелочно-земельные катионы могут быть различными); М 2 ХНn, n=1 до 3, где М - щелочноземельный катион, Х - одиночный отрицательно заряженный анион, такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион 60 соли азотной кислоты, и Н - по меньшей мере один из иона гидрино гидрида, атома гидрино,молекулярного иона дигидрино, молекулы дигидрино и может далее содержать обычный атом водорода или обычную молекулу водорода(щелочноземельные катионы могут быть различными); М 2 Х 2 Нn n=1 до 2, где М - щелочноземельный катион и Н - по меньшей мере один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино и может далее содержать обычный атом водорода (щелочно-земельные катионы могут быть различными); М 2 Х 3 Н, где М - щелочноземельный катион, Х - одиночный отрицательно заряженный анион, такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион соли азотной кислоты, и Н - ион гидрино гидрида или атом гидрино (щелочно-земельные катионы могут быть различными); М 2 ХНn n=1 до 2, где М-щелочно-земельный катион, Х-двойной отрицательно заряженный анион, такой как ион карбоната или ион сульфата, и Н - по меньшей мере, один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино, и может далее содержать обычный атом водорода (щелочно-земельные катионы могут быть различными); M2XX'H, где М - щелочно-земельный катион, Х-одиночный отрицательно заряженный анион, такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион нитрата, X' - двойной отрицательно заряженный анион, такой как ион карбоната или ион сульфата, и Н - ион гидрино гидрида или атом гидрино (щелочно-земельные катионы могут быть различными); ММ'Нn n=1 до 3, где М щелочно-земельный катион, М' - катион металла щелочи и Н - по меньшей мере один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино, и может далее содержать обычный атом водорода или обычную молекулу водорода; MM'XHn n=1 до 2, где М - щелочно-земельный катион, M' катион металла щелочи, X - одиночный отрицательно заряженный анион, такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион нитрата, и Н - по меньшей мере, один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино и может далее содержать обычный атом водорода; MM'XH, где М - щелочно-земельный катион, М'-катион металла щелочи, Х-двойной отрицательно заряженный анион, такой как ион карбоната или ион сульфата, и Н-ион гидрино гидрида или атом гидрино; MM'XX'H, где Мщелочноземельный катион, Х и X' - каждый одиночный отрицательно заряженный анион,такой как ион галогена, ион гидроокиси, ион карбоната водорода или ион нитрата, и Н - ион гидрино гидрида или атома гидрино; HnSn=1 до 2, где Н - по меньшей мере один из иона гидрино гидрида, атома гидрино, молекулярного иона дигидрино, молекулы дигидрино и может далее
МПК / Метки
Метки: применение, водородные, получения, соединения, неорганические, способы
Код ссылки
<a href="https://eas.patents.su/30-2888-neorganicheskie-vodorodnye-soedineniya-sposoby-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Неорганические водородные соединения, способы получения и применение</a>
Предыдущий патент: Способ проведения платежей и устройство для его реализации
Следующий патент: Устройство расцепителя с воссозданием фазы и автоматический выключатель, содержащий такое устройство расцепителя
Случайный патент: Способ, программный продукт и устройство для изготовления защищенных документов












