Короткоцепочечные пептиды в качестве агониста рецептора паратиреоидного гормона (pth)
Номер патента: 22212
Опубликовано: 30.11.2015
Авторы: Пател Панкадж Р., Бахекар Раджеш, Джаин Мукул Р.
Формула / Реферат
1. Выделенный короткоцепочечный пептид, имеющий последовательность формулы (I)

где А представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин, или замещенную линейную или разветвленную (C1-18) алкильную цепь, или аминокислоты, такие как пироглутаминовая кислота (Pyr), Pro (Р), альфа-метил-пролин (αМе-Р), Val (V), N-метил-валин (NMe-V), альфа-метил-валин (αMe-V), Lys(биотин), Lys(алкил), Lys(ацетил); R3 выбран из линейной или разветвленной (C1-18) алкильной цепи, (C1-6) алкокси, (С3-С6) циклоалкильной, арильной, гетероарильной или арилалкильной групп, каждая из указанных групп дополнительно замещена подходящими заместителями;
В представляет собой -COOR2, -CONHR2 или CH2OR2, где R2 представляет собой Н или подходящие аминокислоты, выбранные из Val (V), альфа-метил-валина (αMe-V), Lys(биотин), Lys(алкил) и Lys(ацетил); каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Ser(S), альфа-метил-серина (αMe-S), Val (V), альфа-метил-валина (αMe-V), Pro (P), альфа-метил-пролина (αMe-P), Gly(G), Ala(A), α-аминоизомасляной кислоты (Aib), 1-аминоциклопропанкарбоновой кислоты (АС3С), 1-аминоциклопентанкарбоновой кислоты (АС5С), 1-аминоциклогексанкарбоновой кислоты (АС6С); Z2 представляет собой либо Val (V), либо αMe-Val (αMe-V); каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Glu (E), гомоглутаминовой кислоты (HoGlu), 2-амино-4-цианомасляной кислоты (Abu(CN)), Asp(D), Asn(N), Gln(Q), Aib; каждый из Z5, Z7 и Z9 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Leu(L), Ile(I), Nle (норлейцин), Nva (норвалин), HoLeu (гомолейцин), Abu(CN), His(H), Phe(F), групп альфа-метил-фенилаланина (-α-Me-Phe-), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-) или альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-) или 2-фторфенилаланина (-2F-Phe-);
Z8 представляет собой природную или неприродную аминокислоту Met, N-метил-Met ((NMe)M), альфа-метил-Met (αMe-М), альфа-метил-валина(αMe-V), Leu, Nle, N-метил-Nle((NMe)Nle), альфа-метил-норлейцина (αMe-Nle), Nva, HoLeu, этионина (EtMet), селенометионина (SMet), Val;
Z11 и Z13 могут быть одинаковыми или различными и независимо представляют собой природную или неприродную аминокислоту Aib, Pro(P), αМе-Pro, лизина (K), лизин-биотина (K(биотин)), лизина(нитро); K(NO2), аргинина (R), аргинина(нитро); (Arg(NO2)), гомоаргинина (Har), орнитина (Orn), орнитина(нитро); Orn(NO2), цитруллина (Cit), гомоцитруллина (HoCit), Phe (F), альфа-метил-фенилаланина (-α-Me-Phe-), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-) или альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-) или 2-фторфенилаланина (-2F-Phe-);
Z14 представляет собой природную или неприродную аминокислоту 2'-этил-4'-метокси-бифенилаланина (Bip(OMe)), α-метилированного Bip(OMe) [αMe-Bip(OMe)], αMe-Trp, альфа-метил-фенилаланина (-α-Me-Phe-), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-) или 2-фторфенилаланина (-2F-Phe-);
Z15 присутствует или отсутствует, и Z15, если присутствует, представляет собой природную или неприродную аминокислоту 2-амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2-метил-5-фенилвалериановой кислоты (α-Ме-АРРА).
2. Соединение формулы (I) по п.1, где А представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин или подходящие аминокислоты, выбранные из пироглутаминовой кислоты (Pyr), Pro (P) и Val (V).
3. Соединение формулы (I) по п.1, где R3 выбран из линейной или разветвленной (C1-18) алкильной цепи, которая дополнительно замещена.
4. Соединение формулы (I) по п.1, где В представляет собой -COOR2, -CONHR2, где R2 представляет собой Н или подходящие аминокислоты, выбранные из Val (V), альфа-метил-валина (αMe-V) или Lys (биотин).
5. Соединение формулы (I) по п.1, где каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Ala (А), α-аминоизомасляной кислоты (Aib), 1-аминоциклопропанкарбоновой кислоты (АС3С), 1-аминоциклопентанкарбоновой кислоты (АС5С), 1-аминоциклогексанкарбоновой кислоты (АС6С).
6. Соединение формулы (I) по п.1, где Z2 представляет собой Val (V).
7. Соединение формулы (I) по п.1, где каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Glu(E), Gln(Q) или Aib.
8. Соединение формулы (I) по п.1, где каждый из Z5, Z7 и Z9 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Leu (L), Ile (I), Nle, HoLeu (гомолейцин), His (H), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-) или альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-).
9. Соединение формулы (I) по п.1, где Z8 представляет собой природную или неприродную аминокислоту Met, альфа-метил-Met (αMe-M), Nle, N-метил-Nle ((NMe)Nle).
10. Соединение формулы (I) по п.1, где каждый из Z11 и Z13 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Aib, αMe-Pro, лизина (K), лизин-биотина (K(биотин)), K(NO2), аргинина (R), Arg(NO2), гомоаргинина (Har), орнитина (Orn), Orn(NO2), цитруллина (Cit), гомоцитруллина (HoCit), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-) или альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-).
11. Соединение формулы (I) по п.1, где Z14 представляет собой природную или неприродную аминокислоту 2'-этил-4'-метоксибифенилаланина (Bip(OMe)), α-метилированного Bip(OMe)[αMe-Bip(ОМе)], альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-) или альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-).
12. Соединение формулы (I) по п.1, где Z15 представляет собой природную или неприродную аминокислоту 2-амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2-метил-5-фенилвалериановой кислоты (α-Ме-АРРА).
13. Соединение формулы (I) по п.1, где арильная группа выбрана из фенильной, нафтильной, инданильной, флуоренильной или бифенильной групп.
14. Соединение формулы (I) по п.1, где гетероарильная группа выбрана из пиридильной, тиенильной, фурильной, имидазолильной, бензофуранильной групп.
15. Соединения формулы (I) по п.1, где заместители, если присутствуют, выбраны из гидроксильной, оксо, галогенной, тио, нитро, амино, алкильной, алкокси, галогеналкильной или галогеналкокси групп.
16. Соединения формулы (I) по п.1
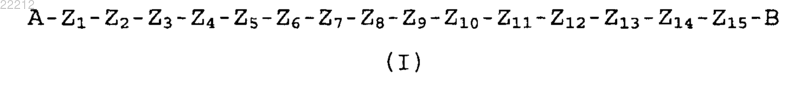
где А представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин или подходящие аминокислоты, выбранные из пироглутаминовой кислоты (Pyr), Pro (Р), Val (V); R3 выбран из необязательно замещенной линейной или разветвленной (C1-18) алкильной цепи; В представляет собой -COOR2, -CONHR2, где R2 является таким, как указано в п.1; каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой природные или неприродные аминокислоты Ala(А), α-аминоизомасляной кислоты (Aib), 1-аминоциклопропанкарбоновой кислоты (АС3С), 1-аминоциклопентанкарбоновой кислоты (АС5С), 1-аминоциклогексанкарбоновой кислоты (АС6С); Z2 представляет собой Val (V); каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой природную или неприродную аминокислоту Glu (E), Gln (Q), Aib; Z5, Z7 и Z9 могут быть одинаковыми или различными и независимо представляют собой природную или неприродную аминокислоту Leu (L), Ile (I), Nle, HoLeu (гомолейцин), His (H), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-); Z8 представляет собой природную или неприродную аминокислоту Met, альфа-метил-Met (αМе-М), Nle, N-метил-Nle ((NMe)Nle); Z11 и Z13 могут быть одинаковыми или различными и независимо представляют собой природную или неприродную аминокислоту Aib, αMe-Pro, лизина (K), лизин-биотина (K (биотин)), K(NO2), аргинина (R), Arg(NO2), гомоаргинина (Har), орнитина (Orn), Orn(NO2), цитруллина (Cit), гомоцитруллина (HoCit), альфа-метил-2-фторфенилаланина (-α-Me-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (-α-Ме-2,6-F-Phe-); Z14 представляет собой природную или неприродную аминокислоту 2'-этил-4'-метокси-бифенилаланина (Bip(OMe)), α-метилированного Bip(OMe) [αMe-Bip(OMe)], альфа-метил-2-фторфенилаланина (-α-Ме-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (-α-Me-2,6-F-Phe-); Z15, если присутствует, представляет собой природную или неприродную аминокислоту 2-амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2-метил-5-фенилвалериановой кислоты (α-Ме-АРРА).
17. Соединения формулы (I), выбранные из
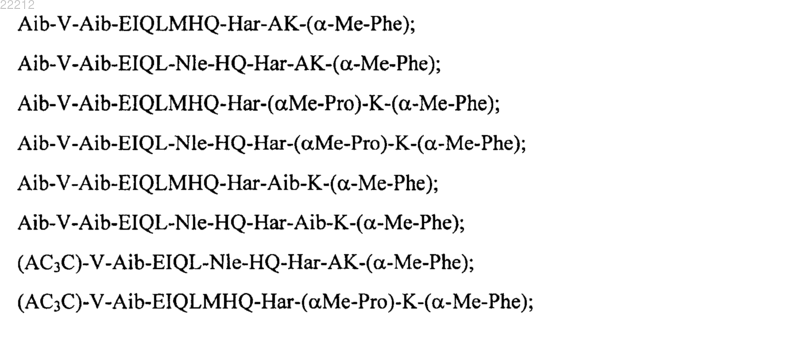































18. Фармацевтическая композиция, содержащая соединения формулы (I) по пп.1-17 и подходящий фармацевтически приемлемый эксципиент(ы), носители или разбавители для лечения остеопороза.
19. Соединения формулы (I) по пп.1-17 или их фармацевтические композиции по п.18, которые действуют как агонист рецептора РТН-1, использующиеся для лечения или замедления прогрессирования или появления остеопороза, в особенности первичного остеопороза, эндокринного остеопороза, постменопаузального остеопороза, наследственной и врожденной форм остеопороза.
20. Способ профилактики заболеваний, вызванных первичным остеопорозом, эндокринным остеопорозом, наследственными и врожденными формами остеопороза, остеопорозом в результате иммобилизации, хронического обструктивного легочного заболевания или ревматологических заболеваний (ревматоидный артрит, спондилит), остеомиелита или инфекционного повреждения кости, приводящих к осложнениям, связанным с потерей костной массы, включающий введение эффективного, нетоксичного количества соединения формулы (I) по пп.1-17 пациенту, который в этом нуждается.
21. Лекарственный препарат для лечения/смягчения любого из болезненных состояний, описанных в п.20, который включает введение соединения формулы (I) по пп.1-17 и фармацевтически приемлемого носителя, разбавителя, эксципиентов или сольвата пациенту, который в этом нуждается.
22. Применение соединений формулы (I) по пп.1-17, их фармацевтических композиций и лекарственных препаратов, содержащих их, в качестве лекарственного средства, подходящего для лечения заболеваний, упомянутых в любом из вышеуказанных пунктов.
Текст
КОРОТКОЦЕПОЧЕЧНЫЕ ПЕПТИДЫ В КАЧЕСТВЕ АГОНИСТА РЕЦЕПТОРА ПАРАТИРЕОИДНОГО ГОРМОНА (PTH) Изобретение предоставляет новые короткоцепочечные пептиды, которые действуют, главным образом, как агонист рецептора паратиреоидногс гормона (РТН/РТН-1). Указанные короткоцепочечные пептиды проявляют повышенную устойчивость к протеолитическому расщеплению. Обнаружено, что большинство короткоцепочечных пептидов оставались стабильными в плазме крови крысы в течение 24 ч (in vitro), проявляли повышенную устойчивость к действию ферментов GIT, таких как пепсин и кислое значение рН желудка, а также к действию микросом печени (in vitro). Благодаря повышенной метаболической устойчивости,не говоря о парентеральном способе введения, некоторые из короткоцепочечных пептидов также могут быть введены пероральными способами введения для лечения/профилактики гипопаратиреозе и заболеваний, характеризующихся уменьшением костной массы, таких как остеопороз, постменопаузальный остеопороз, и для стимуляции регенерации кости. A-Z1-Z2-Z3-Z4Z5-Z6-Z7-Z8-Z9-Z10-Z11-Z12-Z13-Z14-Z15-B.(71)(73) Заявитель и патентовладелец: КАДИЛА ХЕЛЗКЭР ЛИМИТЕД (IN) Область техники, к которой относится изобретение Настоящее изобретение относится к новым короткоцепочечным пептидам в качестве агониста рецептора РТН общей формулы (I), их фармацевтически приемлемым солям и содержащим их фармацевтическим композициям. Настоящее изобретение также относится к способам получения соединений общей формулы (I), их фармацевтически приемлемым солям и содержащим их фармацевтическим композициям. Уровень техники изобретения Остеопороз является костным нарушением, характеризующимся уменьшением костной массы,снижением минеральной плотности костей (BMD), снижением прочности костей, и связан с повышенным риском перелома костей (Lane J. M., et al., Clin. Orthop. Relat. Res., 372, 2000, 139-150). Наиболее часто встречаются остеопоротические переломы позвоночника, бедра или шейки бедра. Такие переломы существенно ухудшают качество жизни в связи с болью, продолжительной обездвиженностью и слабым восстановлением. Кость состоит из нескольких различных типов клеток. Остеобласт (костеобразование) формирует новую кость из минерала, представленного во внеклеточной среде вокруг клеток. Остеокласты (потеря костной массы) разрушают старую костную ткань, высвобождая минералы, накопленные в позвоночнике, во внеклеточный матрикс. Баланс между достаточным образованием новой костной ткани, которая откладывается, и старой костной тканью, которая удаляется, является тем, что придает кости ее необычайные положительные свойства. Остеопороз возникает, когда скорость резорбции кости больше, чем скорость образования кости (Seeman E., et al., N. Engl. J. Med., 354(21), 2006, 2250-22 61) . Постменопаузальный дефицит эстрогена является наиболее частой причиной остеопороза у женщин, поскольку эстроген накладывает ограничение на продолжительность жизни остеокласта. Другие основные факторы риска развития остеопороза включают: низкое поступление кальция, дефицит витамина D, диабет 1 типа, ревматоидный артрит, продолжительное применение лекарственных средств, таких как антиконвульсанты и кортикостероиды, и низкие уровни тестостерона у мужчин (ColeZ. A., et al., Curr. Rheumatol. Rep., 10(2), 2008, 92-96; Harvey, N., et al., Curr. Rheumatol. Rep., 5(1), 2003,75-81). Пациентам с остеопорозом принесли бы пользу новые методы лечения, разработанные для ускорения заживления переломов, или методы лечения, разработанные для предотвращения или снижения числа переломов, связанных с заболеванием (Lindsay R. , Lancet, 341(8848), 1993, 801-805). В настоящее время не существует эффективного лечения остеопороза, хотя эстроген, ралоксифен (модуляторы рецептора эстрогена), кальцитонин и бисфосфонаты (этидронат, алендронат и ризедронат) используются для лечения заболевания с переменным успехом путем их воздействия, направленного на снижение резорбции кости (Recker R. R., J. Clin. Endocrinol. Metab., 1993, 76(1), 14-16). Нативный человеческий паратиреоидный гормон (РТН) является полипептидом из 84 аминокислот,который действует как наиболее важный регулятор гомеостаза кальция в организме человека путем прямого воздействия на костную ткань и почки (Kronenberg Н. М., Bringhurst F. R., Nussbaum S. R., JuppnerH., Abou-Samra А. В., In Handbook of Experimental Pharmacology, Mundy, G. R., and Martin, T. J., (eds), pp. 185-201, Springer-Verlag, Heidelberg (1993. Синтез РТН и высвобождение из паращитовидных желез контролируются преимущественно уровнем кальция в сыворотке крови; низкий уровень стимулирует, а высокий уровень подавляет синтез гормона и его высвобождение. В свою очередь, РТН поддерживает сывороточный уровень кальция, прямо или косвенно способствуя поступлению кальция в кровь. РТН вносит вклад в конечную желудочно-кишечную абсорбцию кальция, способствуя почечному синтезу активной формы витамина D. РТН способствует реабсорбции кальция из кости опосредованно, путем стимулирования дифференцировки остеокластов (клеток, резорбирующих костную ткань). Введение РТН парентеральным путем эффективно увеличивает минеральную плотность кости (BMD), прочность кости и уменьшает число случаев новых остеопоротических переломов у пациентов с остеопорозомPTH проявляет все указанные эффекты, главным образом, путем взаимодействия с рецептором РТН на клеточной поверхности, который экспрессируется во многих тканях, наиболее обильно в почках, костной ткани и хондроцитами зоны роста. (Lanske В., et al., Crit. Rev. Eukaryot. Gene Expr., 8, 1998, 297320). Рецептор РТН гомологичен по первичной структуре ряду других рецепторов, которые связывают пептидные гормоны, такие как секретин, кальцитонин и глюкагон; вместе эти рецепторы образуют отдельное семейство, называемое семейством рецепторов, сопряженных с G-белком класса В(GPCR/GPCR) (Kolakowski L. F., Receptor Channels, 2, 1994, 1-7). GPCR включает внеклеточный Nконцевой домен из 100-160 остатков, соединенный с околомембранным доменом (J-домен) из семи пронизывающих мембрану -цепей с промежуточными петлями и С-концевого хвоста (Donnelly D., FEBSLetts., 409, 1997, 431-436). GPCR класса В активируются эндогенными пептидными лигандами среднего размера, обычно 30-40 аминокислот (Hoare, S. R. J., Drug. Discovery Today, 10, 2005, 423-427). Общий-1 022212 механизм взаимодействия пептидного лиганда с GPCR класса В известен и называется "двухдоменной" моделью. С-концевая часть пептида связывается с N-доменом рецептора, "подтверждает" связывание лиганда с рецептором, и N-концевая область лиганда связывается с J-доменом, взаимодействие, которое активирует рецептор и стимулирует внутриклеточную передачу сигнала (Ji Т. Н., et al., J. Biol. Chem.,273, 1988, 17299-17302; Hjorth, S. A., et al., Regulatory Peptides, 64, 1996, 70). РТН связывается с рецептором РТН с аффинностью в диапазоне значений нМ; занятый лигандом рецептор передает сигнал через клеточную мембрану внутриклеточным эффекторным ферментам с помощью механизма, который вовлекает интермедиарные гетеротримерные ГТФ-связывающие белки (Gбелки). Первичный внутриклеточный эффекторный фермент, активированный рецептором РТН в ответ на пептид РТН, является аденилатциклазой (АС) (Goltzman D., J. Bone Miner. Res., 15(3), 2000, 605-608). Таким образом, РТН вызывает увеличение вторичного мессенджера, циклического аденозинмонофосфата (цАМФ), который регулирует недостаточно описанные нисходящие клеточные процессы, задействованные в восстановлении костной ткани (Juppner H., et al., Science, 254, 1991, 1024-1026). Описаны другие пути передачи сигнала этого рецептора, такие как увеличение внутриклеточного кальция, активация протеинкиназы С, зависимая и независимая от фосфолипазы С. Поскольку РТН регулирует уровни кальция и фосфата в крови и проявляет сильные анаболические (формирующие костную ткань) эффекты,паратиреоидный гормон и его производные представляют собой перспективный терапевтический агент для лечения остеопороза (Slovik D. М., et al., J. Bone Miner. Res., 1, 1986, 377-381; Dempster D. W., et al.,Endocr. Rev., 14, 1993, 690-709). Синтетический РТН (1-34) проявляет полную биоактивность в большинстве систем клеточного анализа, оказывает мощные анаболические эффекты на костную массу у животных и, как недавно было показано, снижает риск переломов костей у женщин с остеопорозом в постменопаузе. В клинических испытаниях с участием постменопаузальных женщин ежедневные подкожные инъекции низких доз РТН(1-34), как было показано, приводят к впечатляющему костеобразованию в позвоночнике и шейке бедра с существенным снижением числа случаев переломов позвонков (Neer R. M., et al., N. Engl. J. Med., 344,2001, 1434-1441; Dempster D. W., et al., Endocr. Rev., 14, 1993, 690-709). Клинические данные раскрывают РТН в качестве одного из самых эффективных агентов, тестированных при остеопорозе. Под торговым названием Forteo (Eli Lilly) РТН (1-34) в форме ацетата терипаратида был утвержден для лечения остеопороза. Производные РТН включают полипептиды, которые имеют аминокислотные замены или усечены по сравнению с полноразмерной молекулой. Изучали как N-концевые, так и С-концевые усеченные формы РТН (1-34). Кроме того, аминокислотные замены в усеченных полипептидах также были изучены.(Azurani A., et al., J. Biol. Chem., 271, 1996, 14931-14936). Известно, что остатки в домене 15-34 пептида РТН значительно способствуют аффинности связывания рецептора, тогда как N-концевые аминокислоты 1-14 пептида РТН ответственны за активацию рецептора (Naussbaum S. R., et al., J. Biol. Chem., 255, 1980,10183-10187; Gardella T. J., et al., Endocrinology, 132, 1993, 2024-2030; Takasu H., et al., Biochemistry, 38,1999, 13453-13460; Hoare S. R. J., et al., J. Biol. Chem., 276, 2001, 7741-7753; Luck M. D., et al., MolecularEndocrinology, 13, 1999, 670-680). Производные усеченного РТН (1-34), такие как циклизованный РТН (117), РТН (1-28) и РТН (1-31), активны в большинстве систем исследования и способствуют костеобразованию (Whitfield J. F., et al., J. Bone Miner. Res., 12, 1997, 1246-1252; WO 2007/130113 A2; WO 2008/068487; Whitfield J. F., et al., Calcif. Tissue Int., 56, 1995, 227-231; Rixon R. H., et al. , J. Bone Miner.al., Calcif. Tissue Int., 58, 1996, 81-87). Но эти пептиды, тем не менее, являются слишком большими для эффективной доставки непарентеральным способом. Открытие агониста РТН еще меньшего размера явилось бы важным продвижением в работе по созданию новых видов лечения остеопороза. К сожалению, вследствие большого молекулярного веса пептида РТН его терапевтическое применение ограничено, поскольку его синтез технически сложен и, соответственно, дорог и единственным возможным способом введения является инъекционный способ введения. Кроме того, РТН очень чувствителен к воздействию протеазы и должен храниться при низкой температуре ввиду низкой стабильности. В дополнение к указанным техническим ограничениям, переносимость РТН ограничивается транзиторной мобилизацией кальция и гиперкальциемией, также токсикологические данные, и в особенности неблагоприятные результаты исследований канцерогенеза (повышенный риск остеосаркомы, зависящий от дозы и продолжительности лечения), заставляют применять РТН (1-34) с осторожностью (Vahle J. L.,Toxicol. Pathos., 32(4), 2004, 426-438; Whitfield J. F., Medscape Womens Health, 6(5), 2001, 7; Kuijpers G.,BMJ, 324(7335), 2002, 435-436). С другой стороны, низкомолекулярные пептиды, например, пептиды,состоящие из первых 14 или 11 аминокислот РТН (РТН(1-14) и PTH(1-11, оказались неактивными или проявляли очень низкую биологическую активность на животных моделях (Tregear G. W., et al., Endocrinology, 93, 1973, 1349-1353; Gardella Т. J., et al., J. Biol. Chem., 266, 1991, 13141-13146). Таким образом, на протяжении последнего десятилетия исследование было направлено на создание низкомолекулярных пептидов - производных РТН с улучшенным биологическим профилем, предпочтительно с пероральной биодоступностью, устойчивых к действию протеаз, легко синтезируемых и демонстрирующих более высокий индекс безопасности. Недавно было обнаружено, что активность низкомоле-2 022212 кулярных пептидов может быть увеличена с помощью введения спирали, стабилизирующей неприродные аминокислоты в определенных положениях. Например, аналоги РТН (1-11) ([Ala3, Gln10, Arg11]-РТНWO 04/093902). Было проведено несколько исследований для обнаружения низкомолекулярных пептидов с РТН-подобной активностью (Reidhaar-olson J. F., et al., Mol. Cell. Endocrinology., 160, 2000, 135-147;Shimizu M., et al., J. Biol. Chem., 275, 2000, 21836-21843; Shimizu M., et al., Endocrinology, 142, 2001, 30683074; Shimizu N., et al., J. Biol. Chem., 276, 2001, 49003-49012; WO 03/009804). Хотя короткоцепочечные аналоги, состоящие всего из 11 аминокислот (производные первых 1-11 остатков пептида РТН, Seq. ID.No.2), могут активировать рецептор РТН (in vitro) с низкой эффективностью (WO 04/067021), однако на животных моделях (in vivo) анаболическая активность указанных аналогов в отношении костной ткани не описана. В заключение, агонистическая активность в отношении цАМФ-сигнального пути рецептора РТН (in vitro) сама по себе совершенно непредсказуема в случае анаболической активности, касающейся костной ткани in vivo. В настоящем исследовании, как ни удивительно, авторы изобретения обнаружили, что гомологичное замещение (производные) N-концевой последовательности пептида РТН (1-34) (первые 1-14 или 1-15 остатков, Seq. ID. No. 3 и 4) неприродными аминокислотами привело в результате к определению нового класса короткоцепочечных пептидов, обладающих мощной агонистической активностью в отношении рецептора РТН, более конкретно, агонистической активностью рецептора РТН-1, с различной степенью избирательности. Для увеличения продолжительности действия и устойчивости к воздействию протеолитического фермента авторы изобретения осуществили сайт-специфическую модификацию короткоцепочечных пептидов неприродными аминокислотами и провели идентификацию метаболически стабильных и высокоэффективных короткоцепочечных пептидов. Некоторые из короткоцепочечных пептидов показали биодоступность даже при пероральном пути введения, в то же время, сохраняя РТН-1 рецепторные агонистические активности. Выравнивание последовательностей РТН (1-34), представленное ниже, отображает важнейшие структурные зависимости: Однобуквенные обозначения аминокислот можно найти в публикации Zubay, G., Biochemistry 2nded., 1988, MacMillan Publishing, New York, p. 33. Предшествующий уровень техники Описаны серии конформационно ограниченных аналогов и производных пептида паратиреоидного гормона (РТН) с общей формулой Xaa1-Xaa11 и/или Хаа 1-Хаа 14, где Xaa1-Xaa11 и/или Xaa1-Xaa14 представляют собой первые 1-11 и/или 1-14 N-концевые остатки пептида РТН (SVSEIQLMHNL; Seq. IDNo. 2 и SVSEIQLMHNLGKH; Seq. ID No. 3), с некоторыми аналогами, где Xaa1 и Хаа 3 представляют собой либо Aib, либо АС 5 С, Хаа 8 представляет собой Nle; Xaa10 представляет собой Q, Xaa11 представляет собой Har, Хаа 12 представляет собой Ala и Хаа 14 представляет собой W (WO 03/009804 А 2; US 2006/7153951 В 2; US 2007/0117157 А 1 ; US 2007/0203071 A1; US 2006/0019902 A1; US 2007/0161569 A1;US 2007/0111946 A1; публикации Gardella T. J., et al., J. Biol. Chem. 2000, 275, 21836-21843; Gardella T. J.,et al., Endocrinology, 2001, 142, 3068-3074; Gardella T. J., et al., J. Biol. Chem., 2001, 52, 49003-49012). В последнее время в литературе также описываются некоторые непептидные агонисты РТН, но ни один из них, как обнаружили, не обладает потенциалом на животных моделях in-vivo (US 2007/0099940 A1; WO 2005/077918 A1). Сущность изобретения Настоящее изобретение описывает группу новых короткоцепочечных пептидов, которые действуют как агонисты рецептора РТН, имеющие разную степень аффинности к рецептору РТН/РТН-1 и полезные для лечения остеопороза. Указанные короткоцепочечные пептиды описываются общей формулой (I),которая приведена ниже. Короткоцепочечные пептиды по настоящему изобретению полезны для лечения или предотвращения гипопаратиреоза и заболеваний, характеризующихся уменьшением костной массы или потерей костной массы, таких как остеопороз, постменопаузальный остеопороз, и для стимуляции восстановления костной ткани. Настоящее изобретение предоставляет новые короткоцепочечные пептиды формулы (I), которые действуют, главным образом, как агонисты рецептора РТН/РТН-1. Указанные короткоцепочечные пептиды проявляют повышенную метаболическую стабильность к действию протеолитических ферментов. Обнаружено, что большинство короткоцепочечных пептидов оставались стабильными в плазме крови крысы в течение 24 часов (in vitro), проявляли повышенную устойчивость к действию ферментов GIT,-3 022212 таких как пепсин и кислые значения рН в желудке, а также к действию микросом печени (in vitro). Благодаря повышенной метаболической устойчивости некоторые из указанных короткоцепочечных пептидов также могут быть доставлены в организм пероральным путем, не говоря уже о парентеральном пути введения. Предпочтительные варианты осуществления Предпочтительный вариант осуществления настоящего изобретения предоставляет новые короткоцепочечные пептиды общей формулы (I), новые промежуточные соединения, участвующие в их синтезе,их фармацевтически приемлемые соли и фармацевтические композиции, содержащие их или их смеси,подходящие для лечения/ослабления/контролирования заболеваний костей. В другом предпочтительном варианте осуществления предоставляются фармацевтические композиции, содержащие короткоцепочечные пептиды общей формулы (I), их фармацевтически приемлемые соли, сольваты и их смеси, содержащие фармацевтически приемлемые носители, растворители, разбавители, эксципиенты и другие среды, обычно применяемые в их производстве. В еще одном предпочтительном варианте осуществления представлено применение новых короткоцепочечных пептидов по настоящему изобретению в качестве агентов для стимуляции образования новой костной ткани и для лечения и/или предотвращения остеопороза и сопутствующих костных заболеваний путем введения терапевтически эффективного и нетоксичного количества короткоцепочечных пептидов формулы (I) или их фармацевтически приемлемых композиций млекопитающим, которые нуждаются в таком лечении. Используемые сокращения Следующие аббревиатуры используются в примерах и в описании: Краткое описание прилагаемых чертежей Фиг. 1 - определение in vitro DRC и ЕС 50 PTH (1-34) (фиг. А) и Seq. ID No. 111 (фиг. В) в тесте с РТН-1 R крысы (агонистическая активность, измеренная по количеству выделенного цАМФ). Фиг. 2 - примеры ортогонально защищенных аминокислот, используемых в твердофазном пептидном синтезе на основе Fmoc (SPPS) короткоцепочечных пептидов. Фиг. 3 - исследование in vivo DRC с Seq. ID No. 111 (фиг.А: % увеличения уровней Са 2+ в сыворотке крови; фиг. В: % снижения уровней PO4 в сыворотке крови) у самок крыс OVX. Фиг. 4 - изменения биохимических параметров и массы бедренной кости у крыс OVX после 6 недель лечения Seq. ID No. 111 и РТН (1-34). Фиг. 5 - гистологические срезы бедренной кости крыс OVX после 6 недель лечения Seq. ID No. 111. Фиг. 6 - гистологические срезы большеберцовой кости крыс OVX после 6 недель лечения Seq. IDNo. 111. Фиг. 7 - гистологические срезы поясничных позвонков крыс OVX после 6 недель лечения Seq. IDNo. 111. Подробное описание изобретения Согласно настоящему изобретению раскрыты синтетические короткоцепочечные пептиды, имеющие структурную формулу (I), которые проявляли РТН-1 рецепторную агонистическую активность. Указанные короткоцепочечные пептиды демонстрируют повышенную метаболическую устойчивость к протеолитическому расщеплению, поскольку обнаружили, что большинство короткоцепочечных пептидов оставались стабильными в плазме крови крысы в течение 24 ч (in vitro), проявляли повышенную устойчивость к действию ферментов GIT, таких как пепсин и кислое значение рН желудка, а также к действию микросом печени (in vitro). Благодаря повышенной метаболической устойчивости некоторые из указанных короткоцепочечных пептидов также могут быть доставлены в организм с помощью пероральных способов введения для лечения/профилактики гипопаратиреоза и заболеваний, характеризующихся уменьшением костной массы, таких как остеопороз, постменопаузальный остеопороз, и для стимуляции костной регенерации. Настоящее изобретение, таким образом, раскрывает новые короткоцепочечные пептиды в качестве агониста рецептора РТН, характеризующиеся следующей структурой (I) где А представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин или дополнительно замещенную линейную или разветвленную (C1-18) алкильную цепь, или подходящие аминокислоты, такие как пироглутаминовая кислота (Pyr), Pro (P), альфа-метил-пролин (Ме-Р),Val (V), N-метил-валин (NMe-V), альфа-метил-валин (Me-V), Lys(биотин), Lys(алкил), Lys(ацетил); R3 выбирают из необязательно замещенной, линейной или разветвленной (C1-18) алкильной цепи, (C1-6) алкокси, (С 3-С 6) циклоалкильной, арильной, гетероарильной или арилалкильной групп. В предпочтительном варианте осуществления арильную группу выбирают из фенильной, нафтильной, инданильной, флуоренильной или бифенильной групп; гетероарильную группу выбирают из пиридильной, тиенильной, фурильной, имидазолильной, бензофуранильной групп; арилалкильные группы представляют собой группы, в которых арильная группа присоединена к алкильным группам, как указано в другом месте в описании."В" представляет собой -COOR2, -CONHR2 или CH2OR2, где R2 представляет собой Н или подходящие аминокислоты, такие как Val (V), альфа-метил-валин (Me-V), Lys(биотин), Lys (алкил), Lys(ацетил) и т.п. Каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой встречающиеся или не встречающиеся в природе аминокислоты, выбранные из группы, состоящей из(АС 6 С); Z2 представляет собой Val (V) или Me-Val (Me-V). Каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей изGlu(E), гомоглутаминовой кислоты (HoGlu), 2-амино-4-цианомасляной кислоты (Abu(CN, Asp(D),Asn(N), Gln(Q), Aib. Каждый из Z5, Z7 и Z9 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей изZ8 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Met, N-метил-Met NMe)M), альфа-метил-Met (Me-M), альфа-метилвалин (Me-V), Leu, Nle, N-метил-Nle NMe)Nle), альфа-метил-норлейцина (Me-Nle), Nva, HoLeu, этионина (EtMet), селенометионина (SMet), Val;Z11 и Z13 могут быть одинаковыми или различными и независимо представляют собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Aib, Pro(P),Ме-Pro, лизина (K), лизин-биотина (K(биотин, лизин(нитро); K(NO2), аргинина (R), аргинин(нитро);Z14 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 2'-этил-4'-метокси-бифенилаланина (Bip(OMe, -метилированногоZ15 может присутствовать или отсутствовать. Z15, если присутствует, представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 2 амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2-метил-5-фенилвалериановой кислоты (Ме-АРРА); В варианте осуществления настоящего изобретения предоставляются модифицированные аналоги РТН формулы (I), где "А" представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин или подходящие аминокислоты, такие как пироглутаминовая кислота (Pyr), Pro (P), Val(V), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где R3 выбирают из необязательно замещенной линейной или разветвленной (C1-18) алкильной цепи, и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где В представляет собой -COOR2, -CONHR2, где R2 представляет собой Н или подходящие аминокислоты,такие как Val (V), альфа-метил-валин (Me-V), Lys(биотин), и все другие обозначения являются такими,как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой встречающиеся или не встречающиеся в природе аминокислоты, выбранные из группы, состоящей из Ala (А), аминоизомасляной кислоты (Aib), 1-аминоциклопропанкарбоновой кислоты (АС 3 С), 1-аминоциклопентанкарбоновой кислоты (АС 5 С), 1-аминоциклогексанкарбоновой кислоты (АС 6 С), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где Z2 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Val(V), и все другие обозначения являются такими, как указано выше.-7 022212 В еще одном варианте осуществления изобретения предоставляются соединения формулы (I), где каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Glu(E),Gln(Q), Aib, и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где каждый из Z5, Z7 и Z9 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Leu (L), Ile(I), Nle, HoLeu (гомолейцин), His (H), альфа-метил-2-фторфенилаланина (Me-2F-Phe-), альфа-метил 2,6-дифторфенилаланина (Ме-2,6-F-Phe-), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где Z8 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Met, альфа-метил-Met (Ме-М), Nle, N-метил-Nle NMe)Nle), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где каждый из Z11 и Z13 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Aib, MePro, лизина (K), лизин-биотина (K(биотин, K(NO2), аргинина (R), Arg(NO2), гомоаргинина (Har), орнитина (Orn), Orn(NO2), цитруллина (Cit), гомоцитруллина (HoCit), альфа-метил-2-фторфенилаланина (-Me-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (Me-2,6-F-Phe-), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где Z14 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 2'-этил-4'-метокси-бифенилаланина (Bip(OMe, -метилированного Bip(OMe)[Me-Bip(ОМе)], альфа-метил-2-фторфенилаланина (Me-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (Me-2,6-F-Phe-), и все другие обозначения являются такими, как указано выше. В другом варианте осуществления изобретения предоставляются соединения формулы (I), где Z15 присутствует и представляет собой встречающуюся или не встречающуюся в природе аминокислоту,выбранную из группы, состоящей из 2-амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2 метил-5-фенилвалериановой кислоты (-Ме-АРРА). В предпочтительном варианте осуществления настоящее изобретение раскрывает модифицированные аналоги РТН формулы (I), где А представляет собой группы -NH-R1 или R3-CO-NH-, где R1 представляет собой водород, биотин или подходящие аминокислоты, такие как пироглутаминовая кислота(Pyr), Pro (Р), Val (V); R3 выбирают из необязательно замещенной линейной или разветвленной (C1-18) алкильной цепи; В представляет собой -COOR2, -CONHR2, где R2 является таким, как указано выше; каждый из Z1, Z3 и Z12 может быть одинаковым или различным и независимо представляет собой встречающиеся или не встречающиеся в природе аминокислоты, выбранные из группы, состоящей из Ala(A),-аминоизомасляной кислоты (Aib), 1-аминоциклопропанкарбоновой кислоты (АС 3 С), 1-аминоциклопентанкарбоновой кислоты (АС 5 С), 1-аминоциклогексанкарбоновой кислоты (АС 6 С); Z2 представляет собой Val (V); каждый из Z4, Z6 и Z10 может быть одинаковым или различным и независимо представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы,состоящей из Glu(E), Gln(Q), Aib; Z5, Z7 и Z9 могут быть одинаковыми или различными и независимо представляют собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Leu (L), Ile (I), Nle, HoLeu (гомолейцин), His (H), альфа-метил-2 фторфенилаланина (Ме-2F-Phe-), альфа-метил-2,6-дифторфенилаланина (Ме-2,6-F-Phe-); Z8 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы,состоящей из Met, альфа-метил-Met (Ме-М), Nle, N-метил-Nle NMe)Nle); Z11 и Z13 могут быть одинаковыми или различными и независимо представляют собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из Aib, Me-Pro, лизина (K), лизин-биотина(Cit), гомоцитруллина (HoCit), альфа-метил-2-фторфенилаланина (Me-2F-Phe-), альфа-метил-2,6 дифторфенилаланина (Me-2,6-F-Phe-); Z14 представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 2'-этил-4'-метокси-бифенилаланина(Bip(OMe, -метилированного Bip(OMe) [Me-Bip(OMe)], альфа-метил-2-фторфенилаланина (Me2F-Phe-), альфа-метил-2,6-дифторфенилаланина (Me-2,6-F-Phe-); Z15, если присутствует, представляет собой встречающуюся или не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 2-амино-5-фенилвалериановой кислоты (АРРА) или 2-амино-2-метил-5-фенилвалериановой кислоты (-Ме-АРРА). Заместители в любой из указанных выше групп могут быть выбраны из гидроксильной, оксо, галогенной, тио, нитро, амино, алкильной, алкокси, галогеналкильной или галогеналкокси групп.-8 022212 Термин "природные аминокислоты" обозначает все двадцать аминокислот, которые представлены в природе. Термин "неприродные аминокислоты" или "ненатуральные аминокислоты" предпочтительно представляет собой либо замену L-аминокислот соответствующими D-аминокислотами, такую как замена LAla на D-Ala и т.п., либо подходящие модификации L- или D-аминокислот, аминоалкильные кислоты,либо с помощью -алкилирования, такого как замена Ala на -метил Ala (Aib), замена Met на -метилMet; замена боковой цепи аминокислоты, такая как замена боковой цепи ароматической аминокислоты галогеном, (C1-С 3) алкилом, арильными группами, более конкретно, замена Phe на галоген Phe. Различные группы, радикалы и заместители, используемые где-либо в описании, описываются в следующих абзацах. Термин "алкил", используемый в описании отдельно или в комбинации с другими радикалами, обозначает линейный или разветвленный радикал, содержащий от одного до восемнадцати атомов углерода,такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, амил, трет-амил, н-пентил,н-гексил, изогексил, гептил, октил, децил, тетрадецил, октадецил и т.п. Термин "циклоалкил", используемый в описании отдельно или в комбинации с другими радикалами, обозначает радикал, содержащий от трех до семи атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. Если не указано иное, термин "аминокислота", который используется в описании отдельно или как часть другой группы, включает без ограничения аминогруппу и карбоксильную группу, связанные с одним и тем же атомом углерода, обозначаемым как атом углерода . Абсолютную конфигурацию "S" атома углерода обычно называют "L" или природной конфигурацией. Конфигурацию "R" атома углерода обычно называют "D-аминокислотой. В случае если оба"-заместителя" являются одинаковыми, такими как водород или метил, аминокислоты представляют собой Gly или Aib и не являются хиральными. Несмотря на то что изобретение проиллюстрировано примерами, касающимися, главным образом,короткоцепочечных пептидов, также следует понимать, что пептидная связь между остатками может быть заменена непептидной связью при условии, что сохраняется способность воспроизводить активность агониста РТН. Специалисту в данной области известны такие подходящие модификации, как образование тиоамидной связи, N-метилирование амидных связей и т.п. Последовательности, содержащие консервативные замены аминокислот, также входят в объем изобретения при условии, что сохраняется биологическая активность. Следует понимать, что соединения по изобретению включают пептидные амиды и не амиды и пептидные аналоги, включая, но ими не ограничиваясь, следующие:a) соединения, в которых одна или более аминокислот заменены соответствующей Dаминокислотой. Специалисту в данной области понятно, что ретроинверсо аминокислотные последовательности могут быть синтезированы стандартными способами; см., например, публикацию Chorev M.,Acc. Chem. Res., 26, 1993, 266-273.;b) пептидомиметические соединения, в которых пептидную связь заменяют структурой, более устойчивой к метаболической деградации, см., например, публикацию Olson G. L., et al., J. Med. Chem.,36(21), 1993, 3039-3049 и с) соединения, в которых отдельные аминокислоты заменяют на аналогичные структуры, например,Ala на Aib; Met на -Ме-Met. Как правило, применение таких альтернативных структур может обеспечить значительно более продолжительный период полувыведения из организма, поскольку они более устойчивы к расщеплению в физиологических условиях, или увеличить биодоступность. В описании используется обычный однобуквенный и трехбуквенный код для обозначения природных аминокислот, а также используются общепринятые трехбуквенные коды для обозначения других неприродных аминокислот, таких как Har (гомоаргинин), Nle (норлейцин), -аминоизомасляная кислота(Aib). Термин "модулятор или агонист рецептора РТН" относится к соединению, которое воздействует на рецептор РТН-1 и/или РТН-2 для изменения его способности регулировать нисходящие сигнальные процессы, такие как продукция цАМФ. Пример модуляторов рецептора включает агонист, частичный агонист, обратный агонист и аллостерические потенциаторы. Согласно настоящему изобретению синтетические выделенные короткоцепочечные пептиды, описанные здесь, действуют, главным образом, как агонисты рецептора РТН. Указанные синтетические короткоцепочечные пептиды проявляют желаемую активность агониста рецептора РТН in vitro в клеткахUMR-106, в диапазоне концентраций 1-1000 нМ. Агонистическую РТН рецепторную активность определяют путем оценки количества цАМФ, высвобождаемого тестируемыми соединениями. Некоторые из полученных короткоцепочечных пептидов показали увеличение BMD и/или прочности кости при тестировании in vivo в модели на крысах OVX, что делает их идеальными терапевтическими кандидатами для лечения и профилактики остеопороза. Указанные новые классы короткоцепочечных пептидов могут-9 022212 быть введены с помощью перорального или других неинвазивных путей введения или с помощью парентеральных путей введения. Настоящее изобретение предоставляет короткоцепочечные пептиды формулы (I), фармацевтические композиции, содержащие такие короткоцепочечные пептиды либо отдельно, либо в комбинации, и способы применения таких короткоцепочечных пептидов. В частности, настоящее изобретение предоставляет фармацевтическую композицию, содержащую терапевтически эффективное количество короткоцепочечных пептидов формулы (I), отдельно или в комбинации (комбинациях) с фармацевтически приемлемым носителем. Кроме того, предлагается способ лечения или замедления прогрессирования или появления остеопороза, особенно первичного остеопороза, эндокринного остеопороза, постменопаузального остеопороза, наследственной и врожденной формы остеопороза, где терапевтически эффективное количество короткоцепочечных пептидов формулы (I) или их комбинации (комбинаций) может быть введено млекопитающему, например человеку, и пациенту, который нуждается в лечении. Получение короткоцепочечных пептидов Для получения короткоцепочечных пептидов по настоящему изобретению могут быть использованы несколько путей синтеза, хорошо известных специалисту в области пептидного синтеза. Короткоцепочечные пептиды формулы (I), где все обозначения являются такими, как указано выше, могут быть синтезированы с использованием способов, описанных ниже, наряду с общепринятыми методиками, известными специалистам в области пептидного синтеза, или их вариантами, которые понятны специалистами в данной области. Вышеупомянутые способы включают, но не ограничиваются способами, описанными ниже. Короткоцепочечные пептиды, описанные здесь, могут быть получены химическим синтезом с использованием соответствующих изменений жидкофазных способов (предпочтительно, с использованиемGrossJ. Meienhofer, Eds., Academic Press, New York, 1980; и в публикации J. M. Stewart and J. D. Young,"Solid-phase peptide synthesis" 2nd Ed., Pierce chemical Co., Rockford, II, 1984. Предпочтительная стратегия получения короткоцепочечных пептидов по настоящему изобретению базируется на применении подхода SPPS на основе Fmoc, где группа Fmoc (9-флуоренилметоксикарбонил) используется для временной защиты -аминогруппы, в комбинации с чувствительными к действию кислот защитными группами, такими как группы трет-бутоксикарбонил (Boc), трет-бутил (But) ,тритил (Trt) (фиг. 2), для временной защиты боковых цепей аминокислот, если они представлены (см.,например, Е. AthertonR.C. Sheppard, "The Fluorenylmethoxycarbonyl amino protecting group", в "The peptides: Analysis, synthesis, Biology"; Volume 9 - "Special methods in peptide synthesis, Part C", pp. 1-38, S. UndenfriendJ. Meienhofer, Eds., Academic Press, San Diego, 1987). Короткоцепочечные пептиды могут быть синтезированы поэтапным способом на нерастворимом полимерном носителе (смоле), начиная с С-конца пептида. В варианте осуществления синтез инициируется прикреплением С-концевой аминокислоты пептида к смоле путем образования амидной, сложноэфирной или простой эфирной связи. При этом обеспечивается последующее высвобождение получаемого пептида в виде С-концевого амида, карбоновой кислоты или спирта, соответственно. В SPPS на основе Fmoc предусматривается, что С-концевая аминокислота и все другие аминокислоты, используемые в синтезе, имеют дифференциально защищенные -аминогруппы и функциональные группы боковых цепей (если присутствуют) (ортогональная защита), так что -аминозащищающая группа может быть избирательно удалена во время синтеза с использованием подходящего основания,такого как 20% раствор пиперидина, без преждевременного отделения пептида от смолы или без удаления защитных групп боковых цепей, обычно защищенных чувствительными к действию кислот защитными группами. Присоединение аминокислоты осуществляют путем активации ее карбоксильной группы в виде активного сложного эфира и реакции с неблокированной -аминогруппой N-концевой аминокислоты, присоединенной к смоле. После каждого присоединения и снятия защиты пептидил-смолу отмывают избытком растворителей, таких как ДМФА, DCM и диэтиловый эфир. Чередование снятия защиты с осаминогруппы и присоединения повторяют до тех пор, пока не соберут желаемую пептидную последовательность (схема 1). Затем пептид отделяют от смолы с сопутствующим удалением защиты с функциональных групп боковых цепей, используя соответствующую расщепляющую смесь, обычно в присутствии подходящих поглотителей для ограничения побочных реакций. Полученный пептид в заключение очищают методом ВЭЖХ с обращенной фазой. В синтезе пептидил-смол, необходимых в качестве предшественников получаемых пептидов, используют коммерчески доступные полимерные смолы на основе поперечно сшитого полистирола (Novabiochem, San Diego, CA). Предпочтительной для использования в данном изобретении является смолаFmoc-PAL-PEG-PS, смола на основе 4-(2',4'-диметоксифенил-Fmoc-аминометил)феноксиацетил-п-метил- 10022212 бензгидриламина (смола Fmoc-Rink-амид-МВНА), 2-хлор-тритил-хлоридная смола или смола на основе п-бензилоксибензилового спирта (смола НМР), к которой может быть уже прикреплена или не прикреплена С-концевая аминокислота. Если С-концевая аминокислота не прикреплена, ее присоединение может быть осуществлено с помощью HOBt-активированного сложного эфира Fmoc-защищенной аминокислоты, образованного путем ее реакции с DIPCDI. В случае 2-хлор-тритиловой смолы, присоединение первой Fmoc-защищенной аминокислоты осуществляли с использованием DIPEA. Для присоединения следующей аминокислоты N-концевую защиту пептидил-смолы избирательно удаляли, используя 10-20% раствор пиперидина. После каждого присоединения и снятия защиты избыток аминокислот и связывающих агентов удаляли промывкой ДМФА, DCM и простым эфиром. Присоединение последующих аминокислот может быть выполнено с использованием активных форм сложных эфиров HOBt или НОАТ, полученных из DIPCDI/HOBt или DIPCDI/HOAT соответственно. В случае какого-либо сложного присоединения, особенно присоединения тех аминокислот, которые являются гидрофобными, или аминокислот с объемной защитой боковой цепью, полное присоединение может быть достигнуто с использованием комбинации высокоэффективных связывающих агентов, таких как HBTU, РуВОР или TBTU, с дополнительными компонентами, такими как DIPEA. Синтез короткоцепочечных пептидов, описанных в настоящем документе, может быть осуществлен путем использования устройства для пептидного синтеза с периодическим или непрерывным потоком,такого как синтезатор пептидов CS-Bio или ААРРТЕС, с применением стратегии защиты Fmoc/третбутил. Неприродные некоммерческие аминокислоты, представленные в другом положении, включали в пептидную цепь, используя один или более способов, известных в данной области. В одном подходеFmoc-защищенную неприродную аминокислоту получали в растворе с использованием соответствующих описанных в литературе методик. Например, Fmoc-защищенные аналоги АРРА, описанные выше,получали из L-пироглутаминовой кислоты с надлежащей энантиомерной чистотой, используя модифицированную описанную в литературе методику (Betsbrugge J.V., et al., Tetrahedron, 54, 1988, 1753-1762).Fmoc-защищенные -метилированные аминокислоты получали с использованием асимметричного синтеза по Штреккеру (Boesten, W.H.J., et al., Org. Lett., 3(8), 2001, 1121-1124; Cativiela C, Diaz-de-villegasM. D., Tetrahedron Asymmetry, 9, 1988, 3517-3599) . Получаемое производное затем использовали в пошаговом синтезе пептида. Альтернативно, требуемую неприродную аминокислоту формировали на смоле,непосредственно используя методы синтеза органической химии, и создавали линейную пептидную цепь. Предшественники "пептид-полимерная смола" соответствующих короткоцепочечных пептидов могут быть отщеплены и защитные группы могут быть удалены с использованием соответствующих изменений любого из стандартных способов отщепления, описанных в литературе (King D.S., et al., Int. J. Peptide Protein Res., 1990, 36, 255-266). Предпочтительным способом для использования в настоящем изобретении является использование смеси для отщепления с ТФУК в присутствии воды и TIPS в качестве поглотителей. Обычно пептидил-смолу инкубируют в смеси ТФУК/вода/TIPS (95:2,5:2,5) в течение 1,5-4 ч при комнатной температуре. Затем отщепленную смолу отфильтровывают и раствор ТФУК концентрируют или высушивают при пониженном давлении. Получаемый неочищенный пептид или осаждают, или промывают Et2O, или повторно растворяют непосредственно в ДМФА или в 50% водной уксусной кислоте для очистки методом препаративной ВЭЖХ. Короткоцепочечные пептиды желаемой чистоты могут быть получены очисткой с использованием препаративной ВЭЖХ. Раствор неочищенного пептида вводят в полупрепаративную колонку (Luna 10 мкм; C18; 100 ), размером 25050 мм, и элюируют линейным градиентом ACN в воде, которые забуферены 0,1% ТФУК, используя скорость потока 40 мл/мин с мониторингом элюируемого компонента детектором PDA при 220 нм. Структуры очищенных короткоцепочечных пептидов могут быть подтверждены анализом методом масс-спектроскопии с электрораспылением (ES-MS). Все полученные пептиды выделяли в виде трифторацетатной соли, с ТФУК в качестве противоиона, после очистки методом препаративной ВЭЖХ. Однако некоторые пептиды подвергали обессоливанию, пропуская через слой подходящей ионообменной смолы, предпочтительно через ионообменную смолу Dowex SBR Р(Cl) или соответствующую основную анионообменную смолу. В некоторых случаях противоионы ТФУК заменяли ацетатными ионами путем пропускания через подходящую ионообменную смолу, элюировали буфером на основе разведенной уксусной кислоты. Для получения гидрохлоридной соли пептидов на заключительной стадии получения выбранные пептиды с ацетатной солью обрабатывали 4 М HCl. Полученный раствор фильтровали через мембранный фильтр (0,2 мкм) и затем лиофилизировали с получением соли НС 1 белого или серовато-белого цвета. Следуя аналогичным способам и/или указанным подходящим модификациям, которые входят в сферу деятельности специалистов в данной области, получали другие подходящие фармацевтически приемлемые соли короткоцепочечных пептидов по настоящему изобретению. Общий способ получения короткоцепочечных пептидов с применением подхода SPPS Сборка короткоцепочечных пептидов на смоле Достаточное количество (50-100 мг) смолы Fmoc-PAL-PEG-PS или смолы Fmoc-Rink амид МВНА,загрузка: 0,5-0,6 ммоль/г, помещали для набухания в ДМФА (1-10 мл/100 мг смолы) в течение 2-10 мин. Удаляли Fmoc-группу на смоле путем инкубации смолы с 10-30% пиперидина в ДМФА (10-30 мл/100 мг смолы) в течение 10-30 мин. Лишенную защиты смолу фильтровали и промывали избытком ДМФА,DCM и эфира (50 мл 4). Промытую смолу инкубировали в свежеперегнанном ДМФА (1 мл/100 мг смолы), в атмосфере азота в течение 5 мин. К смоле добавляли 0,5 М раствор первой Fmoc-защищенной аминокислоты (1-3 экв.), предварительно активированной HOBt (1-3 экв.) и DIPCDI (1-2 экв.) в ДМФА, а затем смолу перемешивали, встряхивая в течение 1-3 ч в атмосфере азота. Завершение присоединения контролировали с помощью качественной реакции с нингидрином. После присоединения первой аминокислоты смолу промывали ДМФА, DCM и диэтиловым эфиром (50 мл 4). Для присоединения следующей аминокислоты, прежде всего, удаляли Fmoc-защиту на первой аминокислоте, соединенной с полимерной смолой, используя 10-20% раствор пиперидина, с последующим присоединением второй Fmocзащищенной аминокислоты, используя подходящие связывающие агенты, как описано выше. Повторные циклы удаления защиты, промывки, присоединения и промывки осуществляли до тех пор, пока не собирали желаемую пептидную цепь на смоле, согласно общей схеме 1, приведенной выше. В заключение, у Fmoc-защищенной пептидил-смолы, полученной, как описано выше, удаляли защиту обработкой 20% пиперидином, как описано выше, и пептидил-смолы промывали ДМФА, DCM и диэтиловым эфиром (50 мл 4). Смолу, содержащую желаемый пептид, сушили под давлением азота в течение 10-15 минут и подвергали отщеплению/удалению защиты. Используя приведенный выше протокол и его подходящие изменения, которые находятся в компетенции специалиста в данной области, короткоцепочечные пептиды, сконструированные в настоящем изобретении, были получены с применением подхода Fmoc-SPPS. В заключение, связанные с полимерной смолой короткоцепочечные пептиды отщепляли и удаляли защиту, очищали и характеризовали, используя протокол, описанный в следующем разделе. Показательный пример автоматизированного твердофазного синтеза пептидной последовательности ID. No. 18: H2N-(AC5C)-V-(АС 5 С)-EIQLMHQ-Har-(Me-Pro)-K-(-Me-Phe)-CONH2. Линейный короткоцепочечный пептид H2N-(AC5C)-V-(АС 5 С)-EIQLMHQ-Har-(Ме-Pro)-K-(-MePhe)-PAL-PEG-PS собирали на автоматизированном синтезаторе CS-Bio 536 PepSynthesiser с применением подхода Fmoc твердофазного пептидного синтеза (SPPS) (схема 2). Fmoc-аминокислоты и тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU) упаковывали вместе в пузырьки и помещали в аминокислотный модуль синтезатора. Схема 1. Общая схема SPPS на основе Fmoc- 12022212 Исходный раствор диизопропилэтиламина (DIPEA; 0,9 М) и ДМФА хранили во флаконах для реактивов, в атмосфере сухого азота. Смолу, Fmoc-PAL-PEG-PS (0,38 ммоль/г; 1 г), сушили над Р 2 О 5, в вакууме (1 ч) и помещали для набухания в свежеперегнанный ДМФА (5 мл). Набухшей смолой суспензионным способом заполняли стеклянную колонку и помещали в синтезатор. Все циклы синтеза осуществляли при скорости потока 5 млмин-1 (см. табл. 1). Смолу промывали свежеперегнанным ДМФА в течение 10 мин. Удаление защитной Fmoc-группы осуществляли с помощью 20% пиперидина в ДМФА в течение 10 мин и удаление защиты контролировали с помощью УФ-детектирования элюата при 304 нм. Таблица 1. Автоматизированные циклы твердофазного пептидного синтеза Избыток пиперидина удаляли с помощью трех дополнительных циклов промывки и цикла промывки перегнанным ДМФА, причем каждый цикл составлял 15 мин. Аминогруппу обрабатывали Fmocаминокислотой (4 эквивалента), предварительно активированной TBTU (3,9 эквивалента) в присутствииDIPEA (8 эквивалентов) и повторяли цикл в течение 120 мин. Избыток аминокислоты и растворимых побочных продуктов удаляли из колонки и петли с помощью четырех дополнительных циклов промывки и циклов промывки перегнанным ДМФА, причем каждый цикл составлял 10 мин. Кроме того, циклы синтеза (снятие защиты, промывка, ацилирование и промывка) повторяли до полной сборки линейного пептида. Заключительный цикл удаления защиты проводили с 20% пиперидином в ДМФА в течение 15 мин для удаления концевой Fmoc-группы, с последующим циклом промывки (104 минуты). Содержащую пептид смолу фильтровали через фильтр из пористого стекла, промывали три раза последовательно ДМФА, DCM, метанолом, ДМФА и диэтиловым эфиром (100 мл каждый). Смолу с пептидом сушили в вакууме над P2O5 (2 ч) и хранили при -20 С. Схема 2. SPPS для Seq. ID. No. 18 Проводили нингидриновый тест со смолой для проверки наличия свободной N-концевой аминогруппы у связанного со смолой пептида. Появление сине-фиолетового окрашивания раствора и гранулированной смолы служило признаком наличия свободной аминогруппы на пептиде, связанном со смолой,и рассматривалось как положительный результат теста. Осуществляли расщепление в небольшом объеме для оценки чистоты связанного со смолой пептида. Высушенную смолу с пептидом (приблизительно 10 мг) обрабатывали смесью (1 мл) ТФУК, воды,триизопропилсилана (95:2,5:2,5 об./об.) в течение 90 мин при комнатной температуре с осторожным пе- 13022212 ремешиванием круговыми движениями. Смолу фильтровали, тщательно промывали чистой ТФУК (1 мл) и весь фильтрат выпаривали при пониженном давлении. Остаточную ТФУК подвергали азеотропной перегонке три раза с диэтиловым эфиром (2 мл). Полученный остаток суспендировали в дистиллированной воде (2 мл) и экстрагировали водный слой три раза диэтиловым эфиром (3 мл). Водный слой отделяли и лиофилизировали с получением неочищенного пептида H2N-(AC5C)-V-(АС 5 С)-EIQLMHQ-Har(Me-Pro)-K-(-Me-Phe)-CONH2. Лиофилизированный пептид H2N-(AC5C)-V-(АС 5 С)-EIQLMHQ-Har(Me-Pro)-K-(-Ме-Phe)-CONH2 растворяли в 0,1% водной ТФУК (приблизительно 1 мг/1 мл), определяли его чистоту методом аналитической обращенно-фазной ВЭЖХ и описывали с помощью тандемной масс-спектрометрии с ионизацией электрораспылением (ESI-MS). Процент чистоты: 90% (неочищенный пептид). ESI-MS; Вычислено для H2N-(AC5C)-V-(АС 5 С)-EIQLMHQ-Har-(Me-Pro)-K-(-Ме-Phe)CONH2: 1790 (М+), 1812 (M+Na+) и 1828 (М+K+); найдено (m/z): 1790 (М+), 1812 (M+Na+) и 1828 (М+K+). Используя приведенный выше протокол и его подходящие изменения, которые находятся в компетенции специалиста в данной области, получали короткоцепочечные пептиды, разработанные в настоящем изобретении, с использованием подхода Fmoc-SPPS. Кроме того, связанные со смолой короткоцепочечные пептиды отщепляли и удаляли защитные группы, очищали и описывали с использованием нижеследующего протокола. Отщепление и удаление защитных групп Желаемые короткоцепочечные пептиды отщепляли и удаляли защитные группы из их соответствующих пептидил-смол путем обработки расщепляющей смесью ТФУК, как указано ниже. Раствор ТФУК/вода/триизопропилсилан (95:2,5:2,5) (10 мл/100 мг пептидил-смолы) добавляли к пептидил-смоле и смесь оставляли при комнатной температуре с периодическим перемешиванием. Смолу фильтровали,промывали расщепляющей смесью и объединенный фильтрат выпаривали досуха. Полученный остаток растворяли в 10 мл воды, водный слой экстрагировали 3 раза эфиром (20 мл каждый) и в заключение водный слой лиофилизировали. Неочищенный пептид, полученный после лиофилизации, очищали методом препаративной ВЭЖХ, как указано далее. Очистка методом препаративной ВЭЖХ неочищенных короткоцепочечных пептидов Препаративную ВЭЖХ проводили на жидкостном хроматографе Shimadzu LC-8A. Раствор неочищенного пептида, растворенного в ДМФА или в воде, вводили в полупрепаративную колонку (Luna 10 мкм; C18; 100 ), размером 25050 мм и элюировали линейным градиентом ACN в воде, которые были забуферены 0,1% ТФУК, используя скорость потока 15-50 мл/мин, с мониторингом элюата детекторомPDA при 220 нм. Использовали типичный градиент от 20 до 70% смеси вода-ACN, забуференной 0,1% ТФУК, в течение периода 50 мин, с изменением градиента 1% в минуту. Желаемый элюированный продукт собирали в одной фракции объемом 10-20 мл и чистые короткоцепочечные пептиды получали в виде аморфных белых порошков путем лиофилизации соответствующих фракций ВЭЖХ. Анализ методом ВЭЖХ очищенных короткоцепочечных пептидов. После очистки с помощью препаративной ВЭЖХ, как описано выше, каждый пептид анализировали методом аналитической обращенно-фазной ВЭЖХ в системе для проведения аналитической ВЭЖХShimadzu LC-IOAD. При анализе короткоцепочечных пептидов с помощью аналитической ВЭЖХ использовали колонку Luna 5 мкм; C18; 100 , размером 2504,6 мм, с линейным градиентом 0,1% ТФУК и буфера CAN, и сбор данных хроматограммы проводили при 220 нм, используя детектор PDA. Описание с помощью масс-спектрометрии Каждый пептид описывали методом тандемной масс-спектрометрии с ионизацией электрораспылением (ESI-MS), или в проточно-инъекционном режиме, или в режиме LC/MS. Тройные квадрупольные масс-спектрометры (API-3000 (MDS-SCIES, Canada) использовали во всех анализах в режиме положительной и отрицательной ионизации электрораспылением. Полные данные сканирования получали в диапазоне массовых чисел квадруполя, работающего при единичном разрешении. Во всех случаях экспериментально измеренная молекулярная масса отличалась не более чем на 0,5 Да от рассчитанной моноизотопной молекулярной массы. Количественный анализ масс-хроматограммы выполняли с использованием программного обеспечения Analyst 1.4.1. Используя способы синтеза, описанные в настоящем документе, наряду с другими общеизвестными методиками и соответствующими их вариантами, получали следующие новые короткоцепочечные пептиды [таблица 2 (i-xix)]. В настоящем списке указаны различные группы короткоцепочечных пептидов,которые могут быть получены в соответствии с настоящим изобретением, и предполагается, что они включают по меньшей мере очевидные изменения указанных короткоцепочечных пептидов. Однако такое раскрытие не следует истолковывать как ограничивающее объем изобретения каким-либо образом. В таблице 2 (i-xix) перечислены новые короткоцепочечные пептиды по настоящему изобретению вместе с их соответствующими Seq. ID. No.- 14022212 Таблица 2 (i). Список полученных короткоцепочечных пептидов- 15022212 Таблица 2 (ii). Список полученных короткоцепочечных пептидов Таблица 2 (iii). Список полученных короткоцепочечных пептидов- 17022212 Таблица 2 (iv) Список полученных короткоцепочечных пептидов- 18022212 Таблица 2 (v) Список полученных короткоцепочечных пептидов Таблица 2 (vi). Список полученных короткоцепочечных пептидов- 21022212 Таблица 2 (vii). Список полученных короткоцепочечных пептидов Таблица 2 (viii). Список полученных короткоцепочечных пептидов- 24022212 Таблица 2 (ix). Список полученных короткоцепочечных пептидов- 26022212 Таблица 2 (х). Список полученных короткоцепочечных пептидов- 28022212 Таблица 2 (xi). Список полученных короткоцепочечных пептидов
МПК / Метки
МПК: C07K 14/635, A61K 38/29
Метки: рецептора, pth, гормона, паратиреоидного, агониста, короткоцепочечные, качестве, пептиды
Код ссылки
<a href="https://eas.patents.su/30-22212-korotkocepochechnye-peptidy-v-kachestve-agonista-receptora-paratireoidnogo-gormona-pth.html" rel="bookmark" title="База патентов Евразийского Союза">Короткоцепочечные пептиды в качестве агониста рецептора паратиреоидного гормона (pth)</a>
Предыдущий патент: Вибрационное устройство для лечения заболеваний верхних дыхательных путей
Следующий патент: Новые конструкции белка вируса папилломы человека (hpv) и их применение в предупреждении заболевания, вызываемого hpv
Случайный патент: 1'-замещенные карбануклеозидные аналоги для противовирусной терапии












