Новые конструкции белка вируса папилломы человека (hpv) и их применение в предупреждении заболевания, вызываемого hpv
Номер патента: 22213
Опубликовано: 30.11.2015
Авторы: Джаннини Сандра, Коло Бриджит Дезире Альбер, Лекренье Николя Пьер Фернан, Дендуга Нажуа, Боду Ги Жан Мари Фернан Пьер
Формула / Реферат
1. Полипептид L1 вируса папилломы человека (HPV) типа 18 или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептида L2, вставленный в полипептид L1 HPV.
2. Полипептид по п.1, где белок L1 HPV содержит С-концевую делецию одной или более аминокислот.
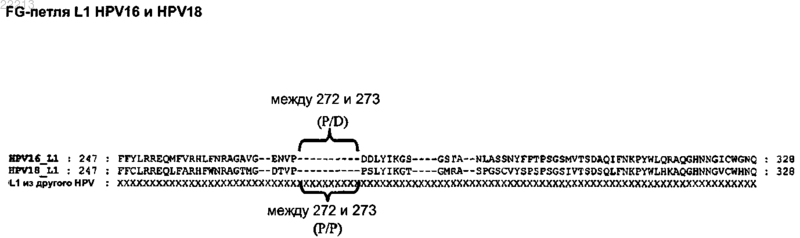
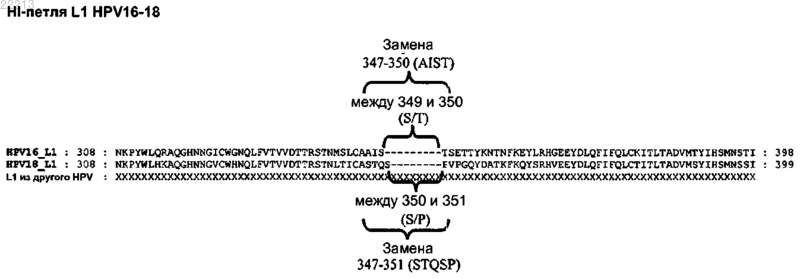
3. Полипептид по п.1 или 2, где по меньшей мере один пептид L2 вставлен в экспонированный участок полипептида L1.
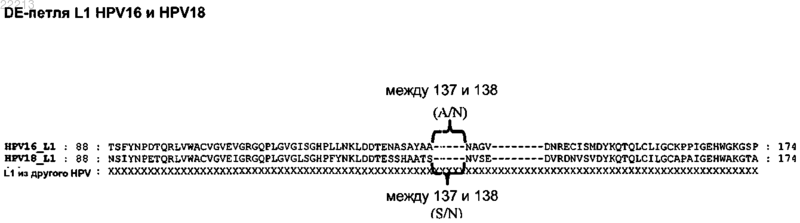
4. Полипептид по любому из пп.1-3, где по меньшей мере один пептид L2 вставлен в DE-петлю белка L1.
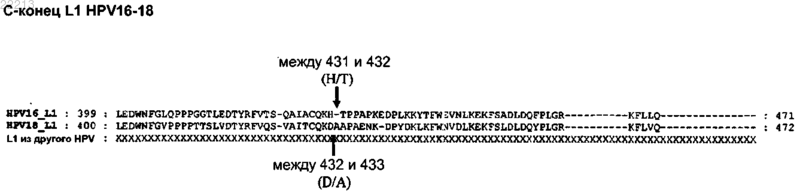
5. Полипептид по любому из пп.1-4, где по меньшей мере один пептид L2 вставлен в С-конец полипептида L1.
6. Полипептид по любому из пп.1-5, содержащий два или более пептида L2, вставленных в полипептид L1.
7. Полипептид по п.6, где два или более пептида L2 вставлены в разные сайты.
8. Полипептид по п.7, где первый пептид L2 вставлен в DE-петлю, а второй пептид L2 вставлен в С-конец полипептида L1.
9. Полипептид по любому из пп.6-8, где два или более пептида L2 являются разными.
10. Полипептид по любому из пп.1-9, где по меньшей мере один пептид L2 содержит по меньшей мере 8 последовательных аминокислот нативного полипептида L2.
11. Полипептид по любому из пп.1-10, где по меньшей мере один пептид L2 выбран из группы, состоящей из
пептида, содержащего аминокислотные остатки 17-36 полипептида L2 HPV;
пептида, содержащего аминокислотные остатки 56-75 полипептида L2 HPV;
пептида, содержащего аминокислотные остатки 96-115 полипептида L2 HPV; и
пептида, содержащего аминокислотные остатки 108-120 полипептида L2 HPV.
12. Полипептид по любому из пп.1-11, где по меньшей мере один пептид L2 состоит из аминокислот 17-36 из L2 HPV типа 33 и/или аминокислот 56-75 из L2 HPV типа 58.
13. Полипептид по любому из пп.1-12, где по меньшей мере один пептид L2 содержит два или более пептида L2.
14. Полипептид по любому из пп.1-13, где пептид L2 содержит по меньшей мере 8 последовательных аминокислот, и эти по меньшей мере 8 последовательных аминокислот содержат последовательность, идентичную полипептидам L2 по меньшей мере двух типов HPV.
15. Капсомер, содержащий полипептид по любому из пп.1-14.
16. Вирусоподобная частица (VLP), содержащая полипептид по любому из пп.1-14.
17. Иммуногенная композиция, содержащая полипептид, капсомер или VLP по любому из пп.1-14 и фармацевтически приемлемый эксципиент, разбавитель или носитель.
18. Молекула нуклеиновой кислоты, кодирующая полипептид по любому из пп.1-14.
19. Применение полипептида по любому из пп.1-14 в предупреждении, ослаблении или лечении HPV-инфекции или заболевания.
20. Способ получения полипептида по любому из пп.1-14, включающий введение вектора экспрессии, содержащего нуклеиновую кислоту по п.18, в клетку и реплицирование клетки в условиях, в которых продуцируется полипептид.
21. Иммуногенная композиция, содержащая:
(1) по меньшей мере одну вирусоподобную частицу (VLP), содержащую полипептид L1 вируса папилломы человека (HPV) или его фрагмент; и
(2) по меньшей мере один химерный полипептид, содержащий полипептид L1 вируса папилломы человека (HPV) или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептида L2, вставленный в полипептид L1 HPV.
22. Композиция по п.21, где VLP в (1) состоит из полипептида L1 или его фрагмента.
23. Композиция по п.21 или 22, где по меньшей мере один химерный полипептид в (2) представляет собой полипептид по любому из пп.1-14.
24. Композиция по любому из пп.21-23, где VLP HPV в (1) содержат VLP L1 HPV 16 и/или HPV 18.
25. Иммуногенная композиция по любому из пп.17 или 21-24, где каждая VLP и/или каждый химерный полипептид присутствует в количестве от 10 до 50 мкг на дозу для человека.
26. Иммуногенная композиция по любому из пп.21-25, дополнительно содержащая фармацевтически приемлемый эксципиент, разбавитель или носитель.
27. Иммуногенная композиция по п.17 или 26, дополнительно содержащая адъювант.
28. Иммуногенная композиция по п.27, где адъювант содержит соль алюминия.
29. Иммуногенная композиция по п.28, дополнительно содержащая 3D-MPL (3-деацилированный монофосфориллипид А).
30. Способ получения иммуногенной композиции, включающий объединение:
(1) по меньшей мере одной вирусоподобной частицы (VLP) L1 вируса папилломы человека (HPV) с
(2) по меньшей мере одним химерным полипептидом, содержащим полипептид L1 вируса папилломы человека (HPV) или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептида L2, вставленный в полипептид L1 HPV, и
(3) фармацевтически приемлемым разбавителем или носителем, и возможно
(4) адъювантом с получением иммуногенной композиции по любому из пп.21-29.
31. Применение иммуногенной композиции по любому из пп.17 или 21-29 в предупреждении, ослаблении или лечении HPV-инфекции или заболевания.
Текст
НОВЫЕ КОНСТРУКЦИИ БЕЛКА ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА (HPV) И ИХ ПРИМЕНЕНИЕ В ПРЕДУПРЕЖДЕНИИ ЗАБОЛЕВАНИЯ, ВЫЗЫВАЕМОГО HPV Согласно изобретению предложены конструкции белка вируса папилломы человека (HPV) и их применение в предупреждении заболевания, вызываемого HPV. Конструкции представляют собой химерные белки, содержащие белкиL1 с пептидом L2 HPV, вставленным в белок L1. Такие химерные белки могут быть получены в виде иммуногенных,например вакцинных, композиций и возможно приготовлены с вакцинами на основе VLP L1 HPV. Боду Ги Жан Мари Фернан Пьер, Коло Бриджит Дезире Альбер, Дендуга Нажуа,Джаннини Сандра, Лекренье Николя Пьер Фернан (BE) Предшествующий уровень техники Настоящее изобретение относится к области вакцин для человека. Более конкретно, настоящее изобретение относится к фармацевтическим и иммуногенным композициям для предупреждения или лечения инфекции или заболевания, вызываемых вирусом папилломы человека (HPV). Вирусы папилломы представляют собой небольшие, в высокой степени видоспецифичные, опухолеродные ДНК-содержащие вирусы. Вирусы папилломы являются ДНК-содержащими вирусами, которые инфицируют базальные эпителиальные (кожи или слизистой оболочки) клетки. Описано свыше 100 индивидуальных генотипов вирусов папилломы человека (HPV). HPV, как правило, специфичны либо в отношении сквазмозного эпителия кожи (например, HPV-1 и -2), либо поверхностей слизистых оболочек(например, HPV-6 и -11) и обычно вызывают образование доброкачественных опухолей (бородавок),которые персистируют в течение нескольких месяцев или лет. Персистирующая инфекция, вызываемая вирусом папилломы человека (HPV) онкогенного типа,является неизбежной причиной рака шейки матки, второй наиболее распространенной причиной смерти от рака среди женщин по всему миру. В мире существует единодушное мнение, что генотипы "высокого риска", включающие генотипы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 66, могут приводить к раку шейки матки и связаны с другими мукозальными аногентильными видами рака и видами рака в области головы и шеи. В мировых масштабах HPV-16 и HPV-18 являются преобладающими онкогенными типами, совокупно насчитывающими свыше 70-80% всех случаев инвазивного рака шейки матки. Инфекции, вызываемые другими генотипами, называемыми генотипами "низкого риска", могут вызывать образование доброкачественных или низкой степени злокачественности изменений ткани шейки матки и генитальных бородавок (остроконечных кондилом), которые представляют собой выросты на шейке матки, влагалище, вульве и анусе у женщин и на пенисе, мошонке или анусе у мужчин. Они также вызывают образование эпителиальных выростов на голосовых связках детей и взрослых (ювенильный респираторный папилломатоз или рекуррентный респираторный папилломатоз), которые требуют хирургического вмешательства. Недавно две профилактические вакцины против HPV получили разрешение на применение во многих странах. В обеих использованы вирусоподобные частицы (VLP), состоящие из рекомбинантных капсидных белков L1 индивидуальных типов HPV, для предупреждения вызываемых HPV-16 и -18 цервикальных предраковых поражений и видов рака. Cervarix (GlaxoSmithKline Biologicals) содержит VLPHPV-16 и -18, полученные в клеточном субстрате Trichoplusia ni с использованием бакуловирусной экспрессионной векторной системы и приготовленные в виде композиции с иммуностимулятором 3-Одезацил-4'-монофосфориллипидом A (MPL) и солью, представляющей собой гидрат окиси алюминия.Gardasil (Merck) содержит VLP HPV-16 и -18, полученные в дрожжах Saccharomyces cerevisiae и приготовленные в виде композиции с аморфной гидроксифосфатной сульфатной солью алюминия. Кроме того, Gardasil содержит VLP из неонкогенных типов HPV-6 и -11, которые вовлечены в 75-90% генитальных бородавок. В рандомизированных клинических испытаниях обеих вакцин была продемонстрирована защита от инфицирования онкогенными типами HPV-16 и HPV-18 и ассоциированных предраковых поражений. Список онкогенных типов HPV, которые ответственны за возникновение рака шейки матки, включает по меньшей мере типы HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 и 73, обнаруживаемые при раке шейки матки (Mahdavi et al., 2005; Quint et al., 2006). Существующие вакцины способны обеспечивать специфическую защиту от инфекции и/или заболевания, вызываемых некоторыми из этих типов HPV, в разной степени. Однако потенциально полезно иметь вакцину, которая либо содержит антигены из других типов HPV с целью дополнительного увеличения охвата против всех типов HPV, вызывающих рак шейки матки, либо обеспечивает широкую перекрестную защиту от родственных и неродственных типов HPV. Потенциально полезно иметь вакцину,которая также эффективна против типов HPV, вызывающих рак кожи, таких как HPV 5, или HPV 8, илиHPV 38, или любая комбинация двух или более из них. Помимо одобренных в настоящее время вакцин на основе VLP L1 пептиды L2 были предложены для применения в вакцине на основе HPV (см., например, WO 2003/097673, WO 2004/052395, WO 2006/083984, WO 2009/001867; Kondo et al., 2008 J. Med. Virol. 80, 841-846; Kondo et al., 2006 Virology 358, 266-272; Schellenbacher et al., 2009 International Papillomavirus Conference 8-14 May, Malmo, Sweden;Coursaget et al., 25th International Papillomavirus Conference 8-14th May, Malmo, Sweden; Slupetzky et al.,2007 Vaccine, 2001-2010; Xu et al., 2006 Arch. Virol. 151, 2133-2148; Gambhira et al., 2007 J. Virol. 81,13927-13931; Alphs et al., 2008 PNAS 105, 5850-5; Kawana et al., 2003 Vaccine 21, 4256-60; Kawana et al.,2001 Vaccine 19, 1496-1502). Краткое изложение сущности изобретения Настоящее изобретение относится к усовершенствованной вакцине против вируса папилломы человека, содержащей антигены, которая обеспечивает защиту от дополнительных типов HPV, вызывающих рак, и/или типов HPV низкого риска, ассоциированных с генитальными бородавками. Усовершенствованные вакцины содержат химерные полипептиды L1, в которые вставлен по меньшей мере один пептид,-1 022213 содержащий эпитоп полипептида L2. В одном из воплощений данного изобретения предложен полипептид L1 вируса папилломы человека (HPV) типа 18 или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептида L2, вставленный в полипептид L1 HPV. В одном из воплощений полипептид содержит по меньшей мере два пептида полипептида L2. В альтернативном воплощении данного изобретения предложен полипептид L1 вируса папилломы человека (HPV) типа 16 или его фрагмент, содержащий пептид, содержащий аминокислоты 56-75 из полипептида L2 HPV, вставленный в полипептид L1 HPV. Химерные полипептиды по изобретению могут быть представлены в виде капсомеров или вирусоподобных частиц (VLP). Такие полипептиды, капсомеры и VLP могут быть приготовлены в виде иммуногенных композиций. Способы их изготовления и их применение, например в приготовлении лекарственных средств для предупреждения HPV-инфекций, описаны. Согласно данному изобретению предложена также композиция, содержащая:(1) по меньшей мере одну вирусоподобную частицу (VLP) L1 вируса папилломы человека (HPV) и(2) по меньшей мере один химерный полипептид, капсомер или VLP L1 HPV, содержащий пептидL2 в последовательности L1. Согласно данному изобретению предложена также композиция, содержащая комбинацию двух или более химерных полипептидов, капсомеров или VLP L1 HPV, причем каждый L1 содержит пептид L2 в последовательности L1. Согласно данному изобретению предложена также композиция, содержащая:(1) по меньшей мере одну вирусоподобную частицу (VLP) L1 вируса папилломы человека (HPV) и(2) по меньшей мере один химерный полипептид, капсомер или VLP L1 HPV, содержащий пептидL2 в последовательности L1, для применения в предупреждении или лечении расстройства, связанного сHPV-инфекцией. Согласно данному изобретению предложена также композиция, содержащая комбинацию двух или более химерных полипептидов, капсомеров или VLP L1 вируса папилломы человека (HPV), содержащих пептид L2 в последовательности L1, для применения в предупреждении или лечении расстройства, связанного с HPV-инфекцией. Согласно данному изобретению предложено также применение(1) по меньшей мере одной вирусоподобной частицы (VLP) L1 вируса папилломы человека (HPV) и(2) по меньшей мере одного химерного полипептида, капсомера или VLP L1 HPV, содержащего пептид L2 в последовательности L1, в приготовлении лекарственного средства для предупреждения или лечения расстройства, связанного с HPV-инфекцией. Согласно данному изобретению предложено также применение комбинации двух или более химерных полипептидов, капсомеров или VLP L1 HPV, содержащих пептид L2 в последовательности L1, в приготовлении лекарственного средства для предупреждения или лечения расстройства, связанного сHPV-инфекцией. Согласно данному изобретению предложены также химерные полипептиды, капсомеры или VLP L1HPV, содержащие два или более пептидов L2 в последовательности L1. В еще одном аспекте данного изобретения предложен способ индуцирования антител против HPV у людей, включающий введение человеку иммуногенной композиции по данному изобретению. В еще одном аспекте данного изобретения предложен способ индуцирования нейтрализующих антител против HPV у людей, включающий введение человеку иммуногенной композиции по изобретению, описанной в данном документе. Такой способ может также индуцировать перекрестнонейтрализующие антитела. В еще одном аспекте данного изобретения предложен способ индуцирования клеточного иммунитета против HPV у людей, включающий введение человеку описанной иммуногенной композиции по данному изобретению. В еще одном аспекте данного изобретения предложен способ индуцирования выработки нейтрализующих антител и клеточного иммунитета против HPV у людей, включающий введение человеку иммуногенной композиции по изобретению, описанной в данном документе. Такой способ может также индуцировать перекрестно-нейтрализующие антитела. В еще одном аспекте данного изобретения предложен способ предупреждения HPV-инфекции илиHPV-заболевания, связанного с HPV-инфекцией, включающий введение человеку иммуногенной композиции по изобретению. Согласно данному изобретению предложен также способ получения иммуногенной композиции,включающий объединение (1) по меньшей мере одной вирусоподобной частицы (VLP) L1 вируса папилломы человека (HPV) с (2) по меньшей мере одним химерным полипептидом, капсомером или VLP L1HPV, содержащим пептид L2 в последовательности L1, и (3) фармацевтически приемлемым разбавителем или носителем и возможно (4) адъювантом с получением иммуногенной композиции, как описано в данном документе. Согласно данному изобретению предложены также способы очистки химерных полипептидов, как описано в данном документе, включающие анионообменную хроматографию и хрома-2 022213 тографию на гидроксиапатите. Согласно данному изобретению предложен также способ получения иммуногенной композиции,включающий объединение двух или более химерных полипептидов, капсомеров или VLP L1 HPV, содержащих пептид L2 в последовательности L1. Согласно данному изобретению предложен также способ получения композиции, включающий объединение полипептида L1 HPV, который содержит пептидный эпитоп полипептида L2, вставленный в полипептид L1, и фармацевтически приемлемый разбавитель или носитель. Краткое описание графических материалов На фиг. 1 представлена последовательность L1 с С-концевым усечением для HPV 16 и HPV 18. Нумерация аминокислот для последовательностей HPV 16 и HPV 18 на фиг. 1(а) и (b) соответственно использована по всему описанию изобретения в отношении L1 HPV 16 и HPV 18. На фиг. 2 представлены экспонированные петли L1 HPV 16 и HPV 18 и иллюстративные местоположения для вставки пептидов L2 в последовательность L1. На фиг. 3 представлено выравнивание последовательностей L1 для HPV типа 16, типа 18 и других типов в участках экспонированных петель и в участке С-концевого инвазивного плеча. Верхняя последовательность представляет собой последовательность L1 HPV 16, представленную на фиг. 1. На фиг. 4 представлены пептиды L2 из множества разных типов HPV. На фиг. 5 представлена блок-схема очистки химерных полипептидов L1/L2. Подробное описание изобретения Введение Данное изобретение относится к композициям и способам для предупреждения и лечения заболевания, вызванного инфицированием вирусом папилломы человека (HPV). Более конкретно, данное изобретение относится к химерным полипептидам, содержащим иммуногенные компоненты основного капсидного белка, L1, и минорного капсидного белка, обозначенного L2. Химерные полипептиды, раскрытые в данном документе, включают полипептид L1, в который вставлен по меньшей мере один пептид L2. Выбирают пептид L2, который содержит по меньшей мере один эпитоп полипептида L2. В одном из воплощений полипептид L1 представляет собой полипептид L1 HPV типа 18. Таким образом, химерный полипептид L1/L2 включает полипептид L1 HPV типа 18 или его фрагмент, в который вставлен по меньшей мере один пептид, содержащий эпитоп полипептида L2. Например, пептид L2 может представлять собой пептид L2 из HPV иного типа, чем тип 18 (то есть пептид L2 не-HPV типа 18). Подходящий полипептид L1/L2 способен индуцировать иммунный ответ на нативный белок, содержащий полипептид L2, из которого данный пептид отобран. Дополнительно, полипептид L1/L2 способен индуцировать иммунный ответ по меньшей мере на один дополнительный нативный белок L2. В одном из воплощений пептид(ы) L2 выбран(ы) из аминокислот 1-200 N-конца полипептида L2HPV, например из аминокислот 1-150 N-конца полипептида L2 HPV. В конкретных воплощениях пептид(ы) L2 выбран(ы) из группы, состоящей из пептида, содержащего аминокислотные остатки 17-36 полипептида L2 HPV; пептида, содержащего аминокислотные остатки 56-75 полипептида L2 HPV; пептида, содержащего аминокислотные остатки 96-115 полипептида L2 HPV; и пептида, содержащего аминокислотные остатки 108-120 полипептида L2 HPV. В различных воплощениях пептид или пептиды L2 включает(ют) аминокислотную последовательность, представленную в SEQ ID NO: 1-31. В одном иллюстративном воплощении пептид L2 состоит из аминокислот 17-36 из L2 HPV типа 33 (который идентичен аминокислотам 17-36 из L2 HPV типа 11). В другом иллюстративном воплощении пептид L2 состоит из аминокислот 56-75 из L2 HPV типа 58 (который идентичен аминокислотам 56-75 из L2 HPV типа 6). Более широко, может быть выбран пептид L2, содержащий по меньшей мере 8 последовательных аминокислот, которые идентичны полипептидам L2 по меньшей мере двух разных типов HPV (то есть консенсусная последовательность между двумя или более типами HPV). В еще одном воплощении химерный полипептид L1/L2 включает полипептид L1 HPV типа 16 или его фрагмент, в который вставлен пептид, содержащий аминокислоты 56-75 полипептида L2 HPV. Например, пептид L2 может включать аминокислоты 56-75 полипептида L2 HPV из HPV онкогенного типа,такого как HPV типа 58. В некоторых воплощениях пептид L2, который вставлен в полипептид L1 с образованием химерного полипептида L1/L2, имеет по меньшей мере одну аминокислотную вставку, делецию или замену по сравнению с нативным полипептидом L2. В одном воплощении пептид L2 имеет по меньшей мере одну аминокислотную вставку, делецию или замену, которая удаляет дисульфидную связь между двумя цистеинами или удаляет аминокислоты между цистеинами, способные образовывать дисульфидную связь. Предпочтительно полипептид, который включает пептид L2 с аминокислотной вставкой, делецией или заменой, способен индуцировать иммунный ответ по меньшей мере на один нативный белок L2 (или природный полипептид L2). В одном из воплощений белок L1 HPV имеет С-концевую делецию одной или более аминокислот. В некоторых воплощениях пептид(ы) L2 вставлен(ы) в экспонированный участок полипептида L1. В различных воплощениях экспонированная петля может представлять собой DE-петлю (например, между аминокислотами 132-142), FG-петлю (например, между аминокислотами 172-182), HI-петлю (например,-3 022213 между аминокислотами 345-359) и/или С-конец полипептида L1 (например, между аминокислотами 429 и 445). В одном из воплощений два или более пептидов L2 вставлены в полипептид L1. Например, два или более пептидов L2 могут быть вставлены в один и тот же сайт (например, в виде последовательного ряда аминокислот или конкатемера) или в разные сайты, например в DE-петлю и в С-конец полипептидаL1. Возможно, когда имеет место вставка в один и тот же сайт, два или более пептидов L2 могут быть соединены посредством по меньшей мере одной дополнительной аминокислоты, например посредством спейсера, содержащего множество аминокислот. Когда два или более пептидов L2 вставлены в полипептид L1, пептиды L2 могут быть одинаковыми или разными. В типичных случаях, пептид или пептиды L2 включает(ют) по меньшей мере 8 последовательных аминокислот нативного полипептида L2. В некоторых воплощениях пептид(ы) L2 вставлен(ы) в полипептид L1 без делеции аминокислоты полипептида L1. В других воплощениях пептид(ы) L2 вставлен(ы) в полипептид L1 с делецией одной или более аминокислот полипептида L1. В некоторых воплощениях химерный L1/L2 представляет собой супрамолекулярную совокупность химерных полипептидов, например в полипептидных частицах, таких как аморфные агрегаты или более упорядоченные структуры, например капсомер, или вирусоподобная частица (VLP), или небольшие неVLP структуры. В еще одном аспекте данное изобретение относится к молекулам нуклеиновых кислот, которые кодируют химерный полипептид L1/L2, как описано выше. Такие нуклеиновые кислоты могут присутствовать в прокариотическом или эукариотическом векторе экспрессии. Подходящие векторы экспрессии включают, например, рекомбинантный бакуловирус. Рекомбинантные нуклеиновые кислоты, например векторы экспрессии, могут быть введены (например, инфицированы, трансфицированы или трансформированы) в клетки-хозяева. Такие клетки-хозяева также являются отличительным признаком данного изобретения. Эти клетки-хозяева могут быть использованы для продуцирования химерных полипептидовL1/L2, например, путем реплицирования клетки-хозяина в условиях, подходящих для экспрессии рекомбинантного полипептида. Возможно, полипептид затем может быть изолирован и/или очищен, например,перед приготовлением иммуногенной композиции. Любой из химерных полипептидов L1/L2, раскрытых в данном документе, может быть использован в медицине, например в виде иммуногенных композиций (таких как вакцины) для предупреждения или лечения HPV-инфекции или заболевания. Эти композиции пригодны для применения в способах индуцирования антител против HPV у людей путем введения иммуногенной композиции субъекту-человеку. Предпочтительно введение иммуногенной композиции субъекту-человеку индуцирует антитела, которые предупреждают, ослабляют или лечат HPV-инфекцию или заболевание. Таким образом, согласно настоящему изобретению предложены также иммуногенные композиции для применения в предупреждении, ослаблении или лечении HPV-инфекции или заболевания. Такая иммуногенная композиция содержит химерный полипептид (например, белок), капсомер или VLP L1/L2,как описано выше, совместно с фармацевтически приемлемым эксципиентом, разбавителем или носителем. В некоторых воплощениях иммуногенная композиция также содержит адъювант. Подходящие адъюванты включают соль алюминия, такую как гидрат окиси алюминия, и/или 3-деацилированный монофосфориллипид A (3D-MPL). В одном из воплощений композиция содержит: (1) по меньшей мере одну вирусоподобную частицу(VLP), содержащую или состоящую из полипептида L1 вируса папилломы человека (HPV) или его фрагмента; и (2) по меньшей мере один химерный полипептид, содержащий полипептид L1 вируса папилломы человека (HPV) или его фрагмент, в который вставлен по меньшей мере один пептид, содержащий эпитоп полипептида L2. Любой из химерных полипептидов L1/L2, раскрытых в данном документе(включая вышеупомянутые супрамолекулярные совокупности, полипептидные частицы, капсомеры и/или VLP), пригоден для применения в композициях, содержащих VLP в комбинации с химерными полипептидами L1/L2. В одном из воплощений VLP для применения в комбинации с химерным полипептидом L1/L2 состоят из полипептидов L1 или их фрагментов. В конкретных воплощениях VLP L1 HPV представляют собой VLP L1 HPV 16 и/или HPV 18. Аналогично, химерные полипептиды могут также включать полипептид L1 HPV 16 или его фрагмент и/или полипептид L1 HPV 18 или его фрагмент. В одном из воплощений такая композиция в иллюстративном воплощении содержит по меньшей мере один химерный полипептид из (2), который состоит из полипептида L1 HPV 16 или его фрагмента,полипептида L1 HPV 18 или его фрагмента или обоих полипептида L1 HPV 16 или его фрагмента и полипептида L1 HPV 18 или его фрагмента, в который вставлен пептид L2. Как описано выше, химерные пептиды могут включать полипептид L1 с С-концевой делецией одной или более аминокислот полипептида L1. В одном конкретном воплощении иммуногенная композиция содержит как VLP L1 HPV 16, так и VLP L1 HPV 18 и химерные полипептиды как с полипептидом L1 HPV 16, так и полипептидом L1 HPV 18. В таком воплощении химерный полипептид с полипептидом L1 HPV 16 и химерный полипептид с полипептидом L1 HPV 18 могут содержать разные пептиды L2. Иллюстративные фрагменты L1 включают L1 HPV 16, лишенный С-концевых 34 аминокислот, или L1 HPV 18, лишенный С-концевых 35 аминокислот. Подобным образом, в другом воплощении иммуногенная композиция может содержать комбинацию двух или более химерных полипептидов, которые содержат полипептид L1 вируса папилломы человека (HPV) или его фрагмент по меньшей мере с одним пептидом, содержащим эпитоп полипептида L2,вставленным в полипептид L1 HPV. Например, комбинация может включать химерные полипептиды с одинаковыми или разными L1-компонентами. Аналогично, химерные полипептиды в комбинации могут содержать одинаковые или разные L2-компоненты. В одном конкретном воплощении химерные полипептиды содержат полипептиды L1 одного и того же типа HPV, а пептиды L2 являются разными. В иллюстративных воплощениях иммуногенные композиции содержат от 10 до 50 мкг каждогоVLP и/или химерного полипептида на дозу для человека. В одном воплощении каждый VLP и/или химерный полипептид присутствует в количестве приблизительно 20 мкг. Иммуногенные композиции, как описано в данном документе, могут быть получены путем объединения по меньшей мере одного химерного полипептида, содержащего полипептид L1 вируса папилломы человека (HPV) или его фрагмент, по меньшей мере с одним вставленным пептидом, содержащим эпитоп полипептида L2, вставленным в полипептид L1 HPV, по меньшей мере с одним другим химерным полипептидом или по меньшей мере с одной вирусоподобной частицей (VLP) L1 вируса папилломы человека (HPV) вместе с фармацевтически приемлемым разбавителем или носителем и возможно адъювантом. Термины Для лучшего понимания различных воплощений данного изобретения ниже даны разъяснения терминов. Дополнительные термины и разъяснения могут быть предоставлены в контексте данного описания изобретения. Если не дано иного разъяснения, все использованные в данном описании технические и научные термины имеют общепринятые значения, понятные специалисту в данной области (определения терминов, общепринятых в молекулярной биологии, можно найти в Benjamin Lewin, Genes V., published by(ISBN 1-56081-569-8. Термины, указанные в единственном числе, охватывают объекты во множественном числе, если контекст четко не диктует иное. Аналогично, слово "или" охватывает "и", если контекст четко не диктует иное. Термин "множество" относится к двум или более. Следует также иметь в виду, что все размеры оснований или размеры аминокислот и все значения молекулярного веса и молекулярной массы, приведенные для нуклеиновых кислот или полипептидов, являются приблизительными и приведены с целью описания изобретения. Дополнительно, числовые пределы, приведенные в отношении концентраций или уровней вещества, такого как антиген, являются приблизительными. Так, в тех случаях, когда указано,что концентрация составляет по меньшей мере, например, 200 пг, тогда это означает, что концентрация составляет по меньшей мере приблизительно (или "примерно", или ) 200 пг. Хотя на практике или при тестировании данного изобретения могут быть использованы способы и вещества, подобные или эквивалентные способам или веществам, описанным здесь, подходящие способы и вещества описаны ниже. Термин "содержит" означает "включает". Так, если контекст не требует иного, слово "содержит" и его варианты, такие как "содержат" и "содержащий(ая)", следует понимать как включение указанного(ой) соединения или композиции (например, нуклеиновой кислоты, полипептида,антигена), или стадии, или группы соединений или стадий, но не исключение любых других соединений,композиций, стадий или их групп. Слово "например" используется в данном описании, чтобы показать,что пример не является ограничивающим. Термин "вирус папилломы человека", сокращенно "HPV", относится к вирусам рода Papillomavirus,которые способны инфицировать людей. Существуют две основные группы HPV (генитальная и кожная группы), каждая из которых содержит множество "типов" или "штаммов" вируса (например, HPV 16,HPV 18, HPV 33, HPV 58 и т.д.), разделенные на категории по генетическому сходству. В контексте данного изобретения термин "тип" может быть использован для обозначения HPV и/или полипептида из конкретного указанного типа HPV. Когда термину предшествует "не-", тогда обозначенный HPV или полипептид представляет собой HPV или полипептид по меньшей мере одного другого или дополнительного типа HPV, отличающегося от упомянутого. Например, "полипептид L1 HPV типа 18" относится к полипептиду L1 вируса папилломы человека (HPV) типа 18. И наоборот, "полипептид L1 не-HPV типа 18" относится к полипептиду L1 любого типа, отличающегося от HPV типа 18. Термин "полипептид" относится к полимеру, в котором мономерами являются аминокислотные остатки, соединенные друг с другом амидными связями. Используемые здесь термины "полипептид" или"белок" охватывают любую аминокислотную последовательность и включают модифицированные последовательности, такие как гликобелки. Следует иметь в виду, что термин "полипептид" охватывает природные белки, а также рекомбинантные или синтетические белки. Термин "фрагмент" применительно к полипептиду относится к участку (то есть последовательности) полипептида. Термин "иммуногенный фрагмент" относится ко всем фрагментам полипептида, кото-5 022213 рые сохраняют по меньшей мере один преобладающий иммуногенный эпитоп полноразмерного эталонного белка или полипептида. Ориентация в пределах полипептида указана, как правило, в направлении от N-конца к С-концу, которое определяется ориентацией амино- и карбоксигруппировок индивидуальных аминокислот. Полипептиды транслируются от N- или аминоконца по направлению к С- или карбоксиконцу. Термины "полинуклеотид" и "последовательность нуклеиновой кислоты" относятся к полимерной форме нуклеотидов длиной по меньшей мере 10 пар оснований. Нуклеотиды могут представлять собой рибонуклеотиды, дезоксирибонуклеотиды или модифицированные формы любого нуклеотида. Этот термин охватывает одноцепочечную и двухцепочечную формы ДНК. Под "изолированным полинуклеотидом" подразумевается полинуклеотид, который не примыкает непосредственно к обеим кодирующим последовательностям, к которым он непосредственно примыкает (один на 5'-конце и один на 3'-конце) в природном геноме организма, из которого он происходит. В одном из воплощений полинуклеотид кодирует полипептид. 5' и 3' Направление нуклеиновой кислоты определяется ссылкой на связанность индивидуальных нуклеотидных единиц и обозначается в соответствии с положениями атомов углерода в дезоксирибозном (или рибозном) сахарном кольце. Информационное (кодирующее) содержимое полинуклеотидной последовательности считывается в направлении от 5' к 3'. Термин "гетерологичный", используемый применительно к нуклеиновой кислоте, полипептиду или другому клеточному компоненту, указывает, что компонент имеет место, где он в норме не обнаруживается в природе, и/или что он имеет происхождение из другого источника или вида. Термины "нативный" и "природный" относятся к элементу, такому как белок, полипептид или нуклеиновая кислота, который присутствует в таком же состоянии, как и в природе, то есть элемент не модифицирован искусственно. Следует иметь в виду, что в контексте данного изобретения существуют многочисленные нативные/природные типы HPV (и белки, и полипептиды HPV), например полученные из разных природных типов HPV."Вариант", когда он относится к нуклеиновой кислоте или полипептиду (например, нуклеиновой кислоте или полипептиду L1 или L2 HPV), представляет собой нуклеиновую кислоту или полипептид,которая(ый) отличается от эталонной нуклеиновой кислоты или эталонного полипептида. Обычно различие(я) между вариантом и эталонной нуклеиновой кислотой или эталонным полипептидом составляет(ют) пропорционально небольшое количество различий по сравнению с эталоном. Вариантная нуклеиновая кислота может отличаться от эталонной нуклеиновой кислоты, с которой ее сравнивают, добавлением, делецией или заменой одного или более нуклеотидов, или заменой искусственного аналога нуклеотида. Аналогично, вариантный полипептид может отличаться от эталонного полипептида, с которым его сравнивают, добавлением, делецией или заменой одной или более аминокислот, или заменой аналога аминокислоты."Антиген" представляет собой соединение, композицию или вещество, которое может стимулировать продуцирование антител и/или Т-клеточного ответа у животного, включая композиции, которые инъецируются, всасываются или иным образом вводятся в животное. Термин "антиген" охватывает все родственные антигенные эпитопы. Термин "эпитоп" или "антигенная детерминанта" относится к сайту на антигене, на который отвечают В- и/или Т-клетки. "Доминантными антигенными эпитопами" или"доминантными эпитопами" являются те эпитопы, на которые осуществляется функционально значимый иммунный ответ хозяина, например антительный ответ или Т-клеточный ответ. Таким образом, по отношению к защитному иммунному ответу против патогена доминантными антигенными эпитопами являются те антигенные группировки, которые при распознавании иммунной системой хозяина приводят к защите от заболевания, вызываемого патогеном. Термин "Т-клеточный эпитоп" относится к эпитопу,который, когда он связан с соответствующей молекулой МНС (главный комплекс гистосовместимости),специфически связывается Т-клеткой (через Т-клеточный рецептор). "В-клеточным эпитопом" является эпитоп, который специфически связывается антителом (или молекулой В-клеточного рецептора)."Иммунный ответ" представляет собой ответную реакцию клетки иммунной системы, такой как Вклетка, Т-клетка или моноцит, на стимул. Иммунный ответ может представлять собой В-клеточный ответ, который вызывает продуцирование специфических антител, таких как антиген-специфичные нейтрализующие антитела. Иммунный ответ может также представлять собой Т-клеточный ответ, такой какCD4+ ответ или CD8+ ответ. В некоторых случаях ответ является специфичным в отношении конкретного антигена (то есть "антиген-специфичный ответ"). Если антиген имеет происхождение из патогена, антиген-специфичный ответ представляет собой "патоген-специфичный ответ". "Защитный иммунный ответ" представляет собой иммунный ответ, который ингибирует вредную функцию или активность патогена, снижает инфицирование патогеном или уменьшает симптомы (включая смерть), которые являются результатом инфицирования патогеном. Защитный иммунный ответ может быть измерен, например, путем ингибирования вирусной репликации или бляшкообразования в анализе сокращения числа бляшек или анализе нейтрализации методом ELISA (твердофазный иммуноферментный анализ) или путем измерения устойчивости к заражению патогеном in vivo."Адъювант" представляет собой агент, который усиливает формирование иммунного ответа неспе-6 022213 цифическим образом. Обычные адъюванты включают суспензии минералов (квасцы, гидрат окиси алюминия, фосфат алюминия), на которых адсорбирован антиген; эмульсии, включая эмульсии типа вода-вмасле и типа масло-в-воде (и их варианты, включая двойные эмульсии и обратимые эмульсии), липосахариды, липополисахариды, иммуностимулирующие нуклеиновые кислоты (такие как CpG олигонуклеотиды), липосомы, агонисты Toll-подобных рецепторов (в частности, агонисты TLR2, TLR4, TLR7/8 иTLR9) и различные комбинации таких компонентов."Иммуногенная композиция" представляет собой композицию, подходящую для введения субъекту-человеку или субъекту-животному (например, в экспериментальной практике), которая способна вызывать специфический иммунный ответ, например, против патогена, такого как вирус папилломы человека. Как таковая иммуногенная композиция содержит один или более антигенов (например, антигенные субъединицы вирусов, например их полипептиды) или антигенных эпитопов. Иммуногенная композиция может также содержать один или более дополнительных компонентов, способных вызывать или усиливать иммунный ответ, таких как эксципиент, носитель и/или адъювант. В некоторых случаях иммуногенные композиции вводят, чтобы вызвать иммунный ответ, который защищает субъекта от симптомов или состояний, индуцированных патогеном. В некоторых случаях симптомы или заболевания, вызываемые патогеном, предупреждают (или лечат, например снижают или облегчают) путем ингибирования репликации патогена (например, вируса папилломы человека) после заражения субъекта патогеном. Например,в контексте данного изобретения некоторые воплощения иммуногенных композиций, которые предназначены для введения субъекту или популяции субъектов с целью формирования защитного или паллиативного иммунного ответа против вируса папилломы человека, представляют собой вакцинные композиции или вакцины. Химерные полипептиды L1/L2 Настоящее изобретение относится к полипептидам, которые могут быть включены в состав вакцинных композиций и которые удовлетворяют потребность в безопасных и эффективных вакцинных композициях для обеспечения защиты от инфекции и/или заболевания, вызываемых HPV, и которые отличаются от доступных в настоящее время коммерческих вакцин. В частности, настоящее изобретение относится к химерным полипептидам, которые содержат полипептид L1 HPV, в который вставлен по меньшей мере один пептид, который содержит антигенный эпитоп полипептида L2 HPV. Полипептиды L1 и L2 HPV, раскрытые в данном документе, могут представлять собой полипептиды из любого генотипа HPV, включая, в частности, вызывающие рак типы HPV высокого риска HPV 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 или 73, типы HPV, вызывающие образование бородавок,такие как HPV 6 или 11, и типы, вызывающие рак кожи, такие как типы HPV5 и HPV8, или даже типы 2 и 3, ассоциированные с обычными бородавками, и HPV76, ассоциированный с доброкачественными кожными бородавками. Например, в одном из воплощений настоящего изобретения предложен полипептид L1 вируса папилломы человека (HPV) типа 18 или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептида L2, вставленный в полипептид L1 HPV. Эпитоп полипептида L2 представляет собой пептид, который, когда он должным образом презентирован, способен индуцировать иммунный ответ, который будет распознавать нативный (например, полноразмерный) полипептид L2 из вируса папилломы человека, например природного вируса папилломы человека. В еще одном воплощении предложен полипептид L1 вируса папилломы человека (HPV) типа 16 или его фрагмент, содержащий по меньшей мере один пептид, содержащий аминокислоты 56-75 из полипептида L2 HPV. Полипептид L1 может представлять собой полноразмерный полипептид L1. В некоторых воплощениях полипептид L1 представляет собой фрагмент L1, например фрагмент, усеченный делецией одной или более аминокислот из N-или С-конца. Соответственно, в некоторых воплощениях полипептиды L1 представляют собой усечения, в которых одна или более аминокислот удалены из одного или обоих концов по сравнению с нативным белком (то есть белком, существующим в природе). В конкретном воплощении полипептид L1 имеет С-концевую делецию. Иллюстративная последовательность L1 HPV 16 приведена на фиг. 1 а. Иллюстративная последовательность L1 HPV 18 приведена на фиг. 1b. Усеченные белки L1 могут быть способными к самосборке, например в капсомеры или VLP. При исследовании под электронным микроскопом вирусоподобные частицы обычно имеют сходство с HPVвирусами. Как правило, они состоят из 72 капсомеров, которые, в свою очередь, состоят из полипептидовL1 в пентамерной единице. Соответственно, по меньшей мере один из белков L1, используемых здесь,содержит усеченный белок L1, и в тех случаях, когда присутствуют множественные VLP, химерные полипептиды или капсомеры HPV, предпочтительно все белки L1 в композиции являются усеченными белками L1. Подходящее усечение удаляет сигнал ядерной локализации. Подходящее усечение представляет собой С-концевое усечение. Подходящее С-концевое усечение удаляет менее 50 аминокислот, например менее 40 аминокислот. В одном конкретном воплощении С-концевое усечение удаляет 34 аминокислоты из HPV 16 и 35 аминокислот из HPV 18. Используемыми в данном изобретении усеченными белками L1 являются соответствующие функциональные производные или варианты белка L1. Функциональные производные или варианты белка L1 способны повышать иммунный ответ (возможно, при добавлении подходящего адъюванта), причем указанный иммунный ответ способен распознавать вирус, содержащий (или VLP, состоящую из) полноразмерный белок L1 и/или тип HPV, из которого белок L1 получен. Локализация пептида L2 в химерном полипептиде L1 HPV, раскрытом в данном документе, важна. В любом раскрытом здесь воплощении пептид L2 может быть расположен в одной из экспонированных петель или в С-концевом инвазивном плече белка L1. Петли и инвазивное плечо имеются, когдаL1 находится в форме капсомеров или вирусоподобных частиц (Chen et al., 2000 Mol. Cell 5, 557-567). В любом раскрытом здесь воплощении пептид L2 может быть локализован в положении, выбранном из приведенных ниже участков последовательности L1, где локализации относятся к эталонной последовательности L1 HPV 16 и HPV 18, представленной на фиг. 1, или в эквивалентном положении в другой последовательности L1 HPV:(6) С-концевое плечо в аминокислотах 429-445, например 423-440, в частности 423-424, 431-433 или 437-438 для HPV 16 и 424-425, 432-433 или 439-440 для HPV 18. В любом раскрытом здесь воплощении пептид L2 HPV может быть вставлен в последовательностьL1 без удаления аминокислот из последовательности L1. Альтернативно, пептид L2 может быть вставлен в последовательность L1 с удалением одной или более аминокислот из последовательности L1 в положении вставки, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот последовательности L1 могут быть удалены в локализации, где вставлен пептид L2. Таким образом, пептидL2 может заменять одну или более аминокислот в последовательности L1, например пептид L2 может заменять в L1 последовательность, имеющую длину, эквивалентную последовательности пептида L2. В тех случаях, когда два или более пептидов L2 присутствуют в химерном полипептиде L1/L2, тогда эти пептиды могут быть разными пептидами L2 из одного и того же типа HPV или они могут представлять собой пептиды из разных типов HPV, и в этом случае они могут представлять собой пептиды из соответствующего участка в разных типах HPV. В одном из воплощений пептид L2 вставлен в сайт, который допускает сборку супрамолекулярной совокупности химерных полипептидов, например, в полипептидные частицы, такие как капсомеры, или вирусоподобные частицы (VLP), или небольшие не-VLP-подобные структуры. Например, для сохранения VLP-структуры пептид L2 вставляют в полипептид L1 в сайт, который не мешает сайтам, вовлеченным в образование дисульфидных мостиков, которые вовлечены в сохранение межкапсомерных взаимодействий и, следовательно, конформации VLP. Такие супрамолекулярные структуры могут быть оценены электронной микроскопией (см., например, как описано в Sadeyen et al., 2003, Virology 309, 32-40;Slupetzky et al., 2007 Vaccine 25, 2001-2010; Varsani et al., 2003, J. of Virology 77, 8386-8393; Chen et al.,2000; Deschuyteneer M. et al., 2010, Human Vaccines 6:5, 407-419). Как правило, химерные VLP имеют сходный или идентичный размер по сравнению с нативными VLP, то есть VLP, в которых белок L1 является полноразмерным или усеченным, но не содержит пептид L2. Химерные VLP могут иметь диаметр в пределах 50 нм. В альтернативных воплощениях образованы небольшие не-VLP структуры диаметром от 20 до 35 нм. Сайт, в который вставлен пептид L2, может обеспечивать сохранение присутствия зависящих от конформации нейтрализующих эпитопов. Нейтрализующие эпитопы могут быть детектированы с использованием моноклональных антител, таких как V5, Н 16. Е 70 и U4 для HPV 16 (Christensen et al., 2001,Carter et al. 2003, 2006; Day et al., 2007) и J4 для HPV 16 (Combita et al., 2002). Дополнительные нейтрализующие эпитопы известны в данной области, и их присутствие или отсутствие может быть идентифицировано подобным образом с использованием моноклональных антител. Тем не менее, сохранение всех нейтрализующих эпитопов L1 на полипептиде L1 может быть необязательным, в частности, например, в композициях, описанных в данном документе, которые также содержат нехимерные L1 VLP. Подходящие сайты для вставки пептида L2 экспонируют пептид L2 на поверхности полипептида L1, в частности, когда он присутствует в виде VLP, например сайты, указанные в табл. 1. В табл. 1 и 2 указаны экспонированные участки L1 HPV (Carter et al., 2003; Bishop et al., 2007; Chenet al., 2000), которые могут предоставлять подходящие сайты вставки для пептида L2, и гипервариабельные участки в пределах этих участков. Предпочтительно пептид L2 вставлен в С-концевое инвазивное плечо, или в DE-петлю, или в FG-петлю, или в HI-петлю. Предпочтительно пептид L2 вставлен в гипервариабельный участок петли или С-концевого плеча. Участки, указанные в табл. 1, являются участками для HPV 16; сходные участки могут быть идентифицированы в L1 других типов HPV, и они определены для L2 HPV 18 в табл. 2. Предпочтительно пептид L2 может быть вставлен в химерный полипептид, капсомер или VLP L1,описанные в данном документе, или в участок иммунодоминантного эпитопа, такого как эпитоп HPV 16,распознаваемый моноклональным антителом V5. Это может приводить к потере иммунодоминантным эпитопом его иммунодоминантности, так что другой эпитоп L1 может стать иммунодоминантным, что, в свою очередь, может привести к лучшей перекрестной защите. Например, пептид L2, вставленный в FGпетлю в участке эпитопа, распознаваемого антителом V5, может приводить к потере эпитопом его иммунодоминантности и к тому, что субдоминантный эпитоп станет иммунодоминантным. В случаях, когда два или более пептидов L2 присутствуют в отдельных полипептидах (или капсомерах, или VLP) в композиции, описанной в данном документе, пептиды L2 могут находиться в L1 из разных типов HPV или в L1 из одного и того же типа HPV. В воплощении, включающем два или более пептидов L2 в одном полипептиде (или капсомере, илиVLP), пептиды L2 могут быть вставлены в один и тот же или в разные сайты в последовательности L1. В случаях, когда пептиды L2 вставлены в один и тот же сайт, он может находиться в одной и той же петле и может находиться в одном и том же гипервариабельном участке одной и той же петли. Предпочтительным может быть наличие короткого фрагмента аминокислот между пептидами L2, например 1, 2, 3, 4, 5,6, 7, 8, 9 или 10 аминокислот между пептидами L2. Выбирают пептиды L2, которые содержат по меньшей мере один антигенный эпитоп. Выбранный эпитоп (когда он встроен в полипептид L1), как правило, способен вызывать иммунный ответ по меньшей мере на один нативный полипептид L2, такой как полипептид L2, который содержит аминокислоты,присутствующие в выбранном эпитопе. Предпочтительно химерный полипептид L1/L2 способен вызывать иммунный ответ против по меньшей мере одного дополнительного нативного белка L2. Пептиды L2 для применения, описанного в данном документе, могут быть выбраны из следующих пептидов: пептид, содержащий аминокислотные остатки 17-36 из L2; пептид, содержащий аминокислотные остатки 56-75 из L2; пептид, содержащий аминокислотные остатки 96-115 из L2; пептид, содержащий аминокислотные остатки 108-120 из L2. Например, пептиды L2 для применения, описанного в данном документе, могут быть выбраны из следующих пептидов: пептид, состоящий из аминокислотных остатков 17-36 из L2; пептид, состоящий из аминокислотных остатков 56-75 из L2; пептид, состоящий из аминокислотных остатков 96-115 из L2; пептид, состоящий из аминокислотных остатков 108-120 из L2. На фиг. 3 представлена последовательность L2 HPV для пептидов L2 HPV 16 из положений с 17 по 36, с 56 по 75, с 96 по 115 и с 108 по 120 аминокислотных последовательностей L2 и для пептидов L2 из соответствующего участка различных других типов HPV. Последовательности, доступные в литературе для других известных типов HPV, могут быть использованы для конструирования соответствующих пептидов L2 из дополнительных типов HPV согласно последовательности L2 HPV 16 в качестве эталонной последовательности (см. SwissProt (Boeckmann et al., 2003) или Genbank (Benson et al., 2008. По всему тексту описания изобретения последовательность L2 HPV 16 использована в качестве эталонной последовательности для определения участка, из которого происходит последовательностьL2. Нумерация начинается на аминокислоте 1 на N-конце, с N-концом на левостороннем конце любых последовательностей, присутствующих здесь, и С-концом справа. Фактическая нумерация для некоторых эквивалентных пептидов из других типов HPV также приведена в перечнях конкретных пептидов ниже. Подходящий пептид L2 содержит или состоит из пептида L2 56-75, возможно модифицированного,как описано в данном документе, например SEQ ID NO: 8-15 или SEQ ID NO: 29. Пептид L2 56-75 демонстрирует существенную идентичность последовательности, т.е гомологию, между типами HPV. Пептиды L2 согласно настоящему изобретению могут содержать или состоять из одной или более или двух или более последовательностей, представленных в SEQ ID NO: 1-31. Пептид(ы) L2 может (могут) быть выбран(ы) из сегмента аминокислот между аминокислотами 1736 (например, 20-меры), например Пептид(ы) L2 может (могут) быть также выбран(ы) из сегмента аминокислот между аминокислотами 56-75 (например, 20-меры), например Пептид(ы) L2 может (могут) быть также короче чем 20 аминокислот. Например, пептиды L2 могут состоять из любого числа аминокислот, превышающего или равного 8 аминокислотам, например из 9 аминокислот, 10 аминокислот, 11 аминокислот, 12 аминокислот, 15 аминокислот, 20 аминокислот или вплоть до 30 аминокислот (или из целого числа аминокислот от 8 до 30). Например, пептид L2 может состоять из 8 аминокислот из сегмента аминокислот между аминокислотами 56-75, таких как приведенный в качестве примера следующий 8-мер: Пептид(ы) L2 может (могут) быть также выбран(ы) из сегмента аминокислот между аминокислотами 96-115 (например, 20-меры), например Пептид(ы) L2 может (могут) быть также выбран(ы) из сегмента аминокислот между аминокислотами 108-120 (например, 13-меры), например Любой из указанных выше пептидов может быть модифицирован добавлением, делецией или заменой по меньшей мере одной аминокислоты, например добавлением, делецией или заменой одной, двух или нескольких аминокислот. Например, в пептиде L2 17-36 участок (22-28) между двумя цистеинами один или оба цистеина могут быть удалены. Эта модификация показана для пептидов HPV 16 (SEQ IDNO: 24 и 25). В еще одном примере валин (V), расположенный через четыре аминокислоты от С-конца(т.е. в положении 32) пептида 17-36 HPV типа 51, может быть заменен изолейцином (I), который является аминокислотой, находящейся в этом положении во всех остальных типах HPV, указанных выше. В другом примере пептид L2 из 56-75 может быть уменьшен в размере (например, как в SEQ IDNO: 29) при условии, что участок GGLGI (SEQ ID NO: 32) на С-конце сохранен, поскольку было показано, что это важно для перекрестной реактивности между типами HPV (Kondo et al., 2007). Таким образом, пептид L2, как описано в данном документе, может содержать последовательность GGGLGI. Возможно, спейсер из одной или более аминокислот, такой как глициновые остатки, также может быть включен на N- или С-конце пептида L2. Например, пептиды могут дополнительно содержать одну,или две, или три добавленных спейсерных аминокислот, например один, или два, или три аминокислотных остатка, добавленные на амино- или карбоксиконце (или между связанными пептидами, если присутствуют два или более пептидов L2). Как правило, спейсер не обладает никакой специфической биологической активностью, он только соединяет иммуногенный пептид с последовательностью L1 или обеспечивает некоторую минимальную дистанцию или другое пространственное соотношение между ними. Спейсер может быть неоходимым или полезным для сохранения корректной конформации VLP L1 и/или эффективной или улучшенной презентации вставленного пептида L2, чем в отсутствие спейсера. Любой из указанных выше пептидов может быть модифицирован, например, посредством вставки(добавления), делеции или замены одной или более аминокислот. Например, пептиды L2 могут содержать аминокислоты, которые отличаются от последовательности L2 нативной (то есть природной) последовательности L2 HPV. Например, пептиды могут иметь одну или две аминокислотные вставки или замены в последовательности или делецию одной, или двух, или нескольких аминокислот, например 1, 2,3, 4, 5, 6, 7, 8 или вплоть до 10 аминокислот по сравнению с нативной последовательностью, например для удаления дисульфидной связи между двумя цистеинами и/или участка между цистеинами. В конкретных примерах модификации, имеющие место в пептидах L2 по настоящему изобретению относительно нативной последовательности L2, ограничены 1 или 2 аминокислотными вставками, делециями или заменами, и/или делецией вплоть до 10 последовательных аминокислот между двумя цистеиновыми остатками. Если в описанных здесь пептидах произведены модификации последовательности L2, то такие модификации могут быть ограничены в такой степени, что существенная доля или по меньшей мере 50%,или по меньшей мере 70%, или по меньшей мере 90%, или по меньшей мере 95% аминокислот в пептиде соответствуют аминокислотам в нативной последовательности L2. Альтернативно или дополнительно, любой конкретный пептид L2 может представлять собой химерный пептид из двух, или трех, или более пептидов L2, как описано в данном документе. В случае любой из этих модификаций последовательности L2 иммуногенный характер последовательности L2 сохраняется, т.е. эпитоп или эпитопы L2 в пептиде, который(ые) вызывает(ют) желаемый иммунный ответ,сохраняется(ются). Цель модификаций может заключаться в улучшении свойств пептида L2, например улучшения перекрестной реактивности с L2 из других типов HPV. Таким образом, пептиды L2 могут быть выбраны из следующих пептидов:(а) пептид, соответствующий аминокислотным остаткам 17-36 из L2, содержащий одну или более аминокислотных добавок, делеций и/или замен;(б) пептид, соответствующий аминокислотным остаткам 56-75 в L2, содержащий одну или более добавок, делеций и/или замен аминокислот; в) пептид, соответствующий аминокислотным остаткам 96-115 в L2, содержащий одну или более аминокислотных добавок, делеций и/или замен;(г) пептид, соответствующий аминокислотным остаткам 108-120 в L2, содержащий одну или более аминокислотных добавлений, делеций и/или замен; где имеют место одна или более аминокислотных добавок, делеций и/или замен по сравнению с нативным полипептидом L2. Ниже приведены примеры пептидов L2 с модификациями. Пептид L2 может также представлять собой конкатамер, выбранный из двух разных сегментов аминокислот, например из аминокислот 17-36 и аминокислот 56-75 (20-меры), например Тип 16: 17-QLYKTPPDIIPKVGGLGIGTG-63 [SEQ ID NO: 30] Тип 16: 17-QLYKTPPDVIPKVGGLGIGTG-63 [SEQ ID NO: 31](c I32V) Два пептида, представленные в SEQ ID NO: 30 и 31, являются химерными полипептидами из двух вышеуказанных пептидов и содержат участок из пептида 17-36 без обоих цистеинов и без участка (22-28) между цистеинами, вместе с участком 56-63 (консервативным между HPV) из пептида 56-75. Сходный пептид может быть сконструирован из других типов HPV. Очевидным является то, что перечисленные выше пептиды могут быть включены в полипептиды,капсомеры или VLP L1 HPV, как описано в данном документе, в любые сайты в последовательности L1,как обсуждается в данном документе. Если в композиции по настоящему изобретению присутствует множество пептидов L2, то этими пептидами могут быть два или более разных пептидов L2 из одного и того же типа HPV, т.е. пептидов из разных (включая перекрывающиеся) участков L2, или могут быть два или более разных пептидов L2 из одного и того же участка разных типов HPV, например участка 17-36. Если присутствуют более чем два пептида L2, то это может быть множество пептидов из одного и того же типа HPV и множество пептидов из разных типов HPV. Если в композиции по настоящему изобретению присутствуют два или более разных пептидов L2,то каждый пептид может присутствовать в VLP L1 HPV из разного типа HPV, например VLP L1 HPV 16 и HPV 18, или они могут присутствовать в VLP L1 HPV из одного и того типа HPV, например VLP L1HPV из HPV 16 и/или HPV 18. Соответственно, в любом раскрытом здесь воплощении пептиды L2 содержат по меньшей мере 8 последовательных аминокислотных остатков из белка L2. В любом раскрытом здесь воплощении пептид или пептиды L2 HPV могут быть длиной вплоть до 30 аминокислотных остатков. В любом раскрытом здесь воплощении пептиды L2 могут быть выбраны из аминокислот 1-200 изN-конца L2 HPV, в частности аминокислот 1-150 из L2 HPV. Таким образом, пептиды L2 могут содержать 8 или более аминокислотных остатков из участка 1-200 или 1-150 из L2 HPV, которые могут представлять собой 8 или более последовательных аминокислотных остатков из участка 1-200 или 1-150. Используемый в данном описании термин "пептид L2 может содержать по меньшей мере 8 аминокислотных остатков" относится к пептидам из любых 8 или более аминокислот из L2, хотя подходящими пептидами являются пептиды длиной по меньшей мере 9, 10, 11, 12, 13, 14, 15, 20 или более аминокислот. В одном из воплощений пептиды L2 по настоящему изобретению являются короткими пептидами из менее 100 аминокислот, предпочтительно менее 50 аминокислот или менее 40 аминокислот. Например,пептиды могут представлять собой пептиды длиной вплоть до 30 аминокислот или длиной вплоть до 20 или 21 аминокислот. Считается, что полноразмерный белок L2 не является пептидом L2 в контексте химерных полипептидов L1/L2, описанных в данном документе. Минимальное требование к пептиду L2 в настоящем изобретении состоит в том, он представляет собой пептид, который способен индуцировать иммунный ответ на нативный белок L2. Таким образом,пептиды L2 в типичных случаях содержат по меньшей мере 8 последовательных аминокислот полипептида L2 и содержат по меньшей мере один эпитоп. Один или более разных пептидов L2 в композиции по настоящему изобретению могут представлять собой пептиды L2 длиной вплоть до 25 аминокислот, или вплоть до 30, или вплоть до 40 аминокислот. В одном из воплощений все из разных пептидов L2, используемых в композиции по настоящему изобретению, являются пептидами длиной вплоть до 25 аминокислот, или вплоть до 30, или вплоть до 40 аминокислот. Соответственно, пептиды L2 по настоящему изобретению способны вызывать иммунный ответ против гомологичной HPV-инфекции, то есть против HPV-инфекции типа, из которого происходит данная последовательность. Соответственно, пептид L2 способен индуцировать иммунный ответ против по меньшей мере двух разных типов HPV. HPV классифицируются по типам на основе сходства нуклеиновых кислот. Многочисленные типы HPV описаны в литературе. Так, в контексте настоящего изобретения пептид L2 способен вызывать иммунный ответ против конкретного типа HPV, например конкретного указанного типаHPV, такого как HPV типа 18 (или любого другого указанного типа HPV). Кроме того, пептид L2, как он представлен в контексте химерного полипептида L1/L2, раскрытого в данном документе, также способен вызывать иммунный ответ против типа HPV, иного чем указанный тип. Для удобства, тип HPV, иной чем указанный тип HPV, упоминается как "не-HPV тип". Например, когда указанным типом HPV являетсяHPV 18, тогда любой другой тип, отличающийся от HPV 18, может упоминаться как пептид (или полипептид или вирус) не-HPV типа 18. Аналогично, по отношению к указанному типу HPV любой другой тип, отличающийся от указанного типа HPV, может упоминаться как не-HPV тип. Например, пептид L2 может индуцировать иммунный ответ против одного или более дополнительных белков L2 из разных типов HPV. В любом раскрытом здесь воплощении пептид или пептиды L2HPV могут быть способными индуцировать перекрестный реактивный, перекрестный нейтрализующий и/или перекрестный защитный ответ против другого типа HPV. Соответственно, выбирают пептид L2,который демонстрирует высокий уровень идентичности последовательностей ("гомологию") между типами HPV, составляющий более 80% между двумя (или более) типами. В некоторых случаях пептид L2 имеет более чем 85%-ную идентичность последовательностей между типами, или более чем 90%-ную идентичность последовательностей между типами, или более чем 95%-ную идентичность последовательностей между типами. В некоторых воплощениях выбранный пептид L2 имеет 100%-ную идентичность последовательностей между по меньшей мере двумя типами HPV. Такие пептиды L2 могут упоминаться в данном документе как "консенсусные" последовательности L2. Например, в конкретном воплощении пептид L2 представляет собой консенсусную последовательность, которая идентична (т.е. имеет 100%-ную идентичность последовательностей) между HPV типа 33 и HPV типа 11. Например, в конкретном иллюстративном воплощении консенсусная последовательность является идентичной между аминокислотами 17-36 из L2. В другом воплощении пептид L2 представляет собой консенсусную последовательность, которая идентична между HPV типа 58 и HPV типа 6. Например, в конкретном иллюстративном воплощении консенсусная последовательность является идентичной между аминокислотами 56-75 из HPV типа 58 и HPV типа 6. Перекрестно-реактивные пептиды L2, которые способны вызывать иммунный ответ против дополнительных типов HPV, могут быть идентифицированы согласно настоящему изобретению. Как показано в данном документе, для идентификации участков с высоким сходством между типами HPV последовательности L2 из разных типов HPV выравнивают (см. фиг. 3 и другие последовательности, представленные на фиг. 3). Для осуществления такого выравнивания и идентификации наличия гомологии последовательностей имеется множество компьютерных программ. Выравнивание дает возможность выбрать пептиды L2, которые в наибольшей степени сходны среди интересующих типов HPV и, следовательно,являются потенциально перекрестно-реактивными между некоторыми или всеми этими типами HPV. Пептиды L2 по настоящему изобретению могут представлять собой любые подходящие иммуногенные пептиды L2. Пептиды L2 могут быть протестированы в отношении иммуногенности и перекрестной реактивности стандартными методами, общеизвестными в данной области. Например, пептиды или химерные полипептиды, капсомеры или VLP L1, содержащие эти пептиды, могут быть инъецированы животным-моделям или людям, и антительные и/или клеточные иммунные ответы могут быть измерены,например, методом ELISA или анализом/измерением цитокинов соответственно. Методы скрининга антител общеизвестны в данной области. ELISA может быть использован для оценки перекрестной реактивности антител. Антитела могут быть протестированы в отношении нейтрализующих свойств и перекрестной нейтрализации с использованием, например, анализа на нейтрализацию псевдовирусов. Подходящие анализы на нейтрализацию псевдовирусов описаны (см. Dessy et al., 2008, и Pastrana et al., 2004). Уже идентифицирован целый ряд перекрестно-реактивных пептидов L2. Например, общенейтрализующий эпитоп для HPV 6 и 16 обнаружен в участке (а.к.) 108-120 в L2 из HPV 16 (Kawana etal., 1998, 1999, 2001). В другом примере иммунизация кроликов пептидами L2 с (а.к.) 17-36, 56-75, 96-115 из HPV 16 могла индуцировать выработку перекрестно-нейтрализующих антител (Kondo et al., 2007,2008). В другом примере участок (а.к.) 17-36 в L2 из HPV 16 был идентифицирован как защитный и широко перекрестно-нейтрализующий эпитоп после пассивной иммунизации и стимуляции у мышейBALB/c (Gambhira et al., 2007). Подобная защита была продемонстрирована у мышей BALB/C (Alphs etal., 2008) после вакцинации синтетической липопептидной вакцины, содержащей а.к. 17-36 в L2 из HPV 16. Соответственно, пептид или пептиды L2 являются перекрестно-реактивными пептидами, поэтому они способны вызывать иммунный ответ, который распознает не только L2 HPV генотипа, из которого происходит пептид L2, но и белок L2 или пептид L2 из HPV генотипа, иного чем генотип, из которого он происходит. Соответственно, пептид является перекрестно-реактивным с 1 или 2 или более другими генотипами, предпочтительно генотипом, ассоциированным с этиологией рака шейки матки, таким какHPV типа 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 или 73, или ассоциированным с генитальными бородавками, таким как HPV 6 или 11, или ассоциированным с раком кожи, таким как HPV 5, 8 или 38. В одном из воплощений один или более пептидов L2 выделены из HPV типа 16 или его модифицированного варианта и являются перекрестно-реактивными против по меньшей мере одного другого типаHPV, вызывающего рак, такого как тип, выбранный из HPV 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 или 73, и/или по меньшей мере одного типа HPV, вызывающего образование генитальных бородавок,такого как HPV 6 или 11, и/или по меньшей мере одного типа HPV, вызывающего рак кожи, такого какHPV 5, 8 или 38. В еще одном воплощении один или более пептидов L2 выделены из HPV типа 18 или его модифицированного варианта. Соответственно, пептиды L2, используемые в данном изобретении, способны вызывать перекрестно-нейтрализующий иммунный ответ, то есть иммунный ответ, который способен нейтрализовать HPV иного типа, чем тип HPV, из которого получен пептид L2. Перекрестная нейтрализация может быть протестирована анализами, известными в данной области, такими как анализ нейтрализации псевдовирионов, описанный в данном документе в примере 3. Соответственно, пептид L2 способен обеспечивать перекрестную защиту и предпочтительно содержит перекрестно-нейтрализующий эпитоп предпочтительно для одного или более типов HPV, ассоциированных с раком шейки матки, выбранных из HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 или 73, и/или по меньшей мере для одного типа HPV, вызывающего образование генитальных бородавок, такого как HPV 6 или 11, и/или по меньшей мере для одного типа HPV, вызывающего рак кожи, такого как HPV 5, 8 или 38. Перекрестная защита предпочтительно имеет место, когда пептид L2 способен создавать защитный иммунный ответ против инфекции/заболевания, вызываемых по меньшей мере двумя типами HPV. Например, в контексте химерного полипептида L1/L2 пептид L2 может индуцировать ответ, который защищает против типа, из которого получен L2, и по меньшей мере одного дополнительного типа HPV. Как обсуждалось выше, перекрестная защита может также иметь место, когда консенсусный пептид L2 выбран и презентирован в контексте химерного полипептида L1/L2. Перекрестная защита против других типов HPV, отличающихся от типа, из которого получен пептид L2 или VLP L1, может быть идентифицирована с использованием животной модели, например мышиной модели (см. в Alphs et al., 2008). Перекрестная защита может быть оценена путем сравнения инцидентности инфекции и/или заболевания для группы типов HPV (инфекция, являющаяся инцидентной или персистирующей инфекцией) у индивидуумов, вакцинированных данным пептидом L2, по сравнению с невакцинированной группой. Полная перекрестная защита против типа или группы типов не требуется согласно настоящему изобретению, поскольку на самом деле любой уровень перекрестной защиты приносит пользу. Предпочтительно наблюдаемый уровень перекрестной защиты таков, что вакцинированная группа имеет на 5% меньше случаев инфекции и/или заболевания, ассоциированных с невакцинным(и) типом или типами HPV, чем сравниваемая невакцинированная группа, более предпочтительно на вплоть до 10%, на вплоть до 15%, на вплоть до 20%, на вплоть до 25%, на вплоть до 30%, на вплоть до 35%, на вплоть до 40%, на вплоть до 45%, на вплоть до 50%, на вплоть до 55%, на вплоть до 60%, на вплоть до 65%, на вплоть до 70%, на вплоть до 80%, на вплоть до 90% или даже на вплоть до 100% меньше случаев инфекции и/или заболевания. Перекрестная защита может быть оценена путем детектирования присутствия нуклеиновой кислоты, специфичной к различным типам HPV, в вакцинированной и контрольной группе. Детектирование может быть осуществлено, например, с использованием методов, описанных в WO 03/014402 (US 2007031828 А 1), и в указанных там ссылках, в частности в отношении неспецифической амплификации ДНК HPV и последующего детектирования типов ДНК с использованием системы LiPA (как описано вWO 99/14377 (US 6482588 В 1) и в Kleter et al., Journal of Clinical Microbiology (1999), 37 (8): 2508-2517,полное содержание которых включено в данное описание посредством ссылки). Тем не менее, любой подходящий метод может быть использован для детекции ДНК HPV в образце, например типоспецифическая PCR (полимеразная цепная реакция) с использованием праймеров, специфичных к каждому интересующему типу HPV. Подходящие праймеры известны специалисту или легко могут быть сконструированы при условии, что последовательности разных типов HPV известны. Соответственно, перекрестная защита наблюдается у мужского и/или женского населения, предпочтительно у женщин, которые являются серонегативными в отношении HPV-инфекции или серонегативными в отношении HPV 16 и 18, предпочтительно подросткового возраста до наступления сексуальной активности. Перекрестная защита (которая оценена по защите, наблюдаемой в вакцинированной группе по сравнению с контрольной группой) соответственно наблюдается против онкогенных типов, таких как тип из группы типов высокого риска развития рака 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 или 73, или, совокупно, групп типов высокого риска развития рака, таких как любые 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12, 13, 14 или фактически все эти типы высокого риска развития рака. Предусматриваются все возможные конкретные комбинации 2, 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13 и 14 из этих типов высокого риска развития рака. Нуклеиновые кислоты, кодирующие полипептиды L1/L2 Еще одним отличительным признаком данного изобретения являются молекулы нуклеиновых кислот, которые кодируют любые вышеупомянутые химерные полипептиды L1/L2. Такие нуклеиновые кислоты могут быть "рекомбинантными" нуклеиновыми кислотами, имеющими последовательность, которая не встречается в природе, или имеющими последовательность, которая получена искусственным объединением двух иным образом выделенных сегментов последовательности. Например, рекомбинантные химерные нуклеиновые кислоты L1/L2 включают по меньшей мере одну последовательность нуклеиновой кислоты, которая кодирует пептид L2 HPV, функционально связанную по меньшей мере с одним (и часто по меньшей мере двумя) сегментом нуклеиновой кислоты, кодирующим полипептид L1 HPV (или его фрагменты). Это искусственное объединение может быть осуществлено путем химического синтеза или, в более общем смысле, путем искусственного манипулирования изолированными сегментами нуклеиновых кислот, например методами генной инженерии. Для точности,"рекомбинантный" белок представляет собой белок, который кодируется рекомбинантной нуклеиновой кислотой (и который может быть введен в клетку-хозяин, например бактериальную или эукариотиче- 14022213 скую клетку). В некоторых воплощениях рекомбинантные нуклеиновые кислоты, которые кодируют химерные полипептиды L1/L2, являются кодон-оптимизированными для экспрессии в выбранной прокариотической или эукариотической клетке-хозяине. Для способствования репликации и экспрессии нуклеиновые кислоты, которые кодируют химерные полипептиды L1/L2, могут быть введены в вектор, такой как прокариотический или эукариотический вектор экспрессии. Клетки-хозяева, содержащие нуклеиновые кислоты, которые кодируют химерный полипептид L1/L2, также являются отличительным признаком данного изобретения. Предпочтительные клетки-хозяева включают прокариотические (т.е. бактериальные) клетки-хозяева, такие как Е. coli, а также многочисленные эукариотические клетки-хозяева, включая клетки грибов (например, дрожжей),клетки насекомых и клетки млекопитающих (такие как клетки СНО, VERO и HEK293). Для способствования репликации и экспрессии нуклеиновые кислоты могут быть введены в вектор,такой как прокариотический или эукариотический вектор экспрессии. Хотя нуклеиновые кислоты, раскрытые в данном документе, могут быть включены в любой один из множества разных векторов (включая, например, бактериальные плазмиды; фаговую ДНК; бакуловирус; дрожжевые плазмиды; векторы,получаемые из комбинаций плазмид и фаговой ДНК, ДНК вируса, такого как вирус коровьей оспы, аденовирус, птичий поксвирус, инфекционный бульбарный паралич, аденовирус, адено-ассоциированный вирус, ретровирус и многие другие), чаще всего вектор будет представлять собой вектор экспрессии,подходящий для образования полипептидных экспрессионных продуктов. В векторе экспрессии нуклеиновая кислота, кодирующая химерный полипептид L1/L2, обычно расположена вблизи от и в ориентации к соответствующей последовательности, контролирующей транскрипцию (промотор и возможно один или более энхансеров), для прямого синтеза иРНК (информационная РНК). То есть интересующая полинуклеотидная последовательность функционально связана с соответствющей контролирующей транскрипцию последовательностью. Примеры таких промоторов включают предранний промотор CMV, LTR или промотор SV40, полигедриновый промотор бакуловируса, lac или trp промотор Е. coli, промотор PL фагов Т 7 и лямбда и другие промоторы, известные для контроля экспрессии генов в прокариотических или эукариотических клетках или их вирусах. Вектор экспрессии обычно также содержит сайт связывания рибосомы для инициации трансляции и терминатор транскрипции. Вектор возможно содержит соответствующие последовательности для амплификации экспрессии. Кроме того, векторы экспрессии возможно содержат один или более селектируемых маркерных генов для создания фенотипического признака для селекции трансформированных клеток-хозяев, такого как устойчивость к дигидрофолатредуктазе или неомицину для культуры эукариотических клеток, или такого как устойчивость к канамицину,тетрациклину или ампициллину в Е. coli. Вектор экспрессии может также содержать дополнительные экспрессионные элементы, например,для повышения эффективности трансляции. Эти сигнальные последовательности могут содержать, например, инициирующий кодон ATG и соседние последовательности. В некоторых случаях, например,кодон инициации трансляции и элементы ассоциированных последовательностей вставлены в соответствующий вектор экспрессии одновременно с интересующей полинуклеотидной последовательностью (например, нативный старт-кодон). В таких случаях дополнительные контролирующие трансляцию сигналы не требуются. Однако в тех случаях, когда вставлена только полипептид-кодирующая последовательность или ее участок, экзогенные контролирующие трансляцию сигналы, включая инициирующий кодонATG, предусмотрены для трансляции нуклеиновой кислоты, кодирующей химерный полипептид L1/L2. Инициирующий кодон помещают в надлежащую рамку считывания для обеспечения трансляции интересующей полинуклеотидной последовательности. Экзогенные трансляционные элементы и кодоны инициации могут быть различного происхождения, как природного, так и синтетического. Если желательно,эффективность экспрессии может быть дополнительно повышена путем включения энхансеров, соответствующих используемой клеточной системе (Scharf et al. (1994) Results Probl. Cell Differ, 20: 125-62; Bitter et al. (1987) Methods in Enzymol, 153: 516-544). В некоторых случаях нуклеиновая кислота (такая как вектор), которая кодирует химерный полипептид L1/L2, содержит один или более дополнительных элементов последовательности, выбранных для увеличения и/или оптимизации экспрессии кодируемого полипептида при введении в клетку-хозяин. Например, в некоторых воплощениях нуклеиновые кислоты, которые кодируют химерный полипептидL1/L2, содержат последовательность интрона, такую как последовательность интрона вируса герпеса человека (см., например, SEQ ID NO: 13). Было неоднократно продемонстрировано, что интроны усиливают экспрессию гомологичных и гетерологичных нуклеиновых кислот, когда они надлежащим образом позиционированы в рекомбинантной конструкции. Иллюстративные методики, достаточные для того, чтобы специалист в данной области смог получить рекомбинантные нуклеиновые кислоты, которые кодируют химерные полипептиды L1/L2, можно найти в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratorytocols in Molecular Biology, 4th ed., WileySons, 1999. Примеры последовательностей нуклеиновых кислот, которые кодируют полипептиды L1 и L2 HPV из разных типов HPV, известны в данной области. Например, многочисленные примеры описаны в литературе и общедоступны в базе данных GenBank. Они без труда могут быть идентифицированы специалистом в данной области путем соответствующего запроса с указанием термина "вирус папилломы человека" (или "HPV") и специфического белка (например, L1 или L2) интересующего типа. Эти нуклеиновые кислоты L1 и L2 могут быть использованы для получения нуклеиновых кислот, которые кодируют рекомбинантные химерные полипептиды L1/L2, как раскрыто выше. Дополнительные нуклеиновые кислоты, кодирующие химерные L1/L2 нуклеиновые варианты, которые имеют долю идентичности последовательностей с иллюстративным полипептидом L1 и L2, могут быть получены специалистами в данной области. В типичных случаях, варианты нуклеиновых кислот будут кодировать полипептиды, которые отличаются не более чем на 1%, или 2%, или 5%, или 10%, или 15%, или 20% аминокислотных остатков, присутствующих в химерном полипептиде L1/L2 (например, в участке полипептида L1). То есть кодируемые полипептиды имеют по меньшей мере 80%-ную или 85%ную, чаще по меньшей мере примерно 90%-ную или более, например 95%-ную или даже 98%-ную, или 99%-ную идентичность последовательностей с эталонным химерным полипептидом. Специалистам в данной области совершенно ясно, что полинуклеотидные последовательности, кодирующие химерные полипептиды L1/L2, сами могут иметь меньшую идентичность последовательностей из-за избыточности генетического кода. В некоторых случаях кодируемый полипептид L1/L2 имеет одну или более аминокислотных модификаций относительно аминокислотной последовательности природных полипептидов,из которых он происходит. Такие различия могут быть результатом добавления, делеции или замены одной или более аминокислот. Вариант обычно отличается не более чем примерно на 1%, или 2%, или 5%, или 10%, или 15%, или 20% нуклеотидных остатков. Например, нуклеиновая кислота, которая кодирует вариантный химерный полипептид L1/L2, может включать 1, или 2, или вплоть до 5, или вплоть до примерно 10, или вплоть до примерно 15, или вплоть до примерно 50, или вплоть до примерно 100 нуклеотидных различий (например, в участке L1 и/или для кодирования модифицированных пептидов L2,как описано выше). Таким образом, вариант в контексте нуклеиновой кислоты, которая кодирует химерный полипептид L1/L2, как раскрыто в данном документе, обычно имеет по меньшей мере 80%-ную или 85%-ную, чаще по меньшей мере примерно 90%-ную или более, например 95%-ную, или даже 98%-ную,или 99%-ную идентичность последовательности с эталонной последовательностью, состоящей из природных L1 и L2 компонентов. В дополнение к вариантным нуклеиновым кислотам, описанным выше, нуклеиновые кислоты, которые гибридизируются с одной или более нуклеиновыми кислотами, кодирующими химерные полипептиды L1/L2, с последовательностями L1 и L2, соответствующими природным полипептидам L1 и L2,также могут быть использованы для кодирования химерных полипептидов L1/L2. Специалисту в данной области понятно, что в дополнение к показателю % идентичности последовательностей, описанному выше, другим показателем сходства последовательностей между двумя нуклеиновыми кислотами является способность гибридизироваться. Чем более сходны последовательности двух нуклеиновых кислот,тем более строгими являются условия, при которых они будут гибридизироваться. Строгость условий гибридизации зависит от последовательностей и является разной при разных параметрах среды. Таким образом, условия гибридизации, обуславливающие конкретные степени строгости, будут варьировать в зависимости от природы выбранного метода гибридизации и от композиции и длины гибридизирующихся последовательностей нуклеиновых кислот. Как правило, температура гибридизации и ионная сила (в частности, концентрация Na+ и/или Mg) буфера для гибридизации будут определять строгость гибридизации, хотя время промывки также влияет на строгость. Обычно выбирают строгие условия, когда температура примерно на 5-20 С ниже, чем точка плавления (Tm), для конкретной последовательности при определенных ионной силе и рН. Tm означает температуру (при определенных ионной силе и рН),при которой 50% целевой последовательности гибридизируется с полностью сопоставимым зондом (условия для гибридизации нуклеиновых кислот и расчета строгостей можно найти, например, в SambrookShort Protocols in Molecular Biology, 4th ed., John WileySons, Inc., 1999). В целях настоящего изобретения термин "строгие условия" охватывает условия, при которых гибридизация будет происходить, если только имеется менее чем 25%-ное несоответствие между молекулой гибридизации и целевой последовательностью. "Строгие условия" могут быть подразделены на конкретные уровни строгости для более точного определения. Таким образом, используемыми здесь условиями"умеренной строгости" являются условия, в которых молекулы с более чем 25%-ным несоответствием последовательностей не будут гибридизироваться, условиями "средней строгости" являются условия, в которых молекулы с более чем 15%-ным несоответствием не будут гибридизироваться, и условиями"высокой строгости" являются условия, в которых последовательности с более чем 10%-ным несоответствием не будут гибридизироваться. Условиями "очень высокой строгости" являются условия, в которых последовательности с более чем 6%-ным несоответствием не будут гибридизироваться. В отличие от этого, нуклеиновые кислоты, которые гибридизируются в условиях "низкой строгости", включают условия с намного меньшей идентичностью последовательностей или с идентичностью последовательностей только по коротким субпоследовательностям нуклеиновой кислоты. Способы получения полипептидов L1/L2 Химерные полипептиды L1/L2, раскрытые в данном документе, могут быть получены с использованием общепризнанных методик экспрессии и очистки рекомбинантных белков. Методики, дающие достаточные инструкции для специалиста в данной области, можно найти в следующих публикациях:Harbor, NY, 200; и Ausubel et al., Short Protocols in Molecular Biology, 4th ed., John WileySons, Inc., 999. Дополнительные и конкретные подробности приведены в данном описании ниже. Рекомбинантные нуклеиновые кислоты, которые кодируют химерные полипептиды L1/L2, вводят в клетки-хозяева любым из множества различных методов, таких как электропорация, трансфекция, опосредованная липосомами (например, с использованием коммерчески доступного липосомального реагента трансфекции, такого как LIPOFECTAMINE2000 или TRANSFECTIN), преципитация фосфата кальция, инфицирование, трансфекция и тому подобное, в зависимости от выбора векторов и клетокхозяев. Клетки-хозяева, которые содержат нуклеиновые кислоты, кодирующие химерные полипептидыL1/L2, также являются отличительным признаком данного изобретения. Предпочтительные клеткихозяева включают прокариотические (т.е. бактериальные) клетки-хозяева, такие как клетки Е. coli, а также многочисленные эукариотические клетки-хозяева, включая клетки грибов (например, дрожжей, таких как Saccharomyces cerevisiae и Picchia pastoris), клетки насекомых, клетки растений и клетки млекопитающих (такие как клетки СНО и HEK293). Рекомбинантные нуклеиновые кислоты, которые кодируют химерные полипептиды L1/L2, вводят (например, трансдуцируют, трансформируют или трансфицируют) в клетки-хозяева, например посредством вектора, такого как вектор экспрессии. Как описано выше, вектор может представлять собой плазмиду, вирусную частицу, фаг, бакуловирус и т.д. Примеры подходящих экспрессионных хозяев включают клетки бактерий, таких как Е. coli, Streptomyces и Salmonella typhimurium; клетки грибов, таких как Saccharomyces cerevisiae, Pichia pastoris иNeurospora crassa; клетки насекомых, таких как Trichoplusia, Drosophila, Spodoptera frugiperda; клетки млекопитающих, такие как клетки 3 Т 3, COS, СНО, BHK, HEK293 или меланомы Бауэса (Bowes); клетки растений, включая клетки водорослей и т.д. Клетки-хозяева могут быть культивированы в стандартной питательной среде, модифицированной,если целесообразно, для активации промоторов, селекции трансформантов или амплификации вставленных полинуклеотидных последовательностей. Условия культивирования, такие как температура, рН и тому подобное, обычно являются условиями, ранее использованными с клеткой-хозяином, выбранной для экспрессии, и они известны специалистам в данной области и описаны в процитированных в данном описании публикациях (см., например, Freshney (1994) Culture of Animal Cells, a Manual of Basic Technique, third edition, Wiley-Liss, New York, и в процитированных там ссылках). Продукты экспрессии, соответствующие нуклеиновым кислотам по изобретению, также могут быть продуцированы в клетках, не являющихся клетками животных, таких как клетки растений, дрожжей, грибов, бактерий и т.п. В дополнение к Sambrook, Berger и Ausubel, подробности, относящиеся к клеточной культуре, можно найти вManual, Springer-Verlag (Berlin Heidelberg New York) and Atlas and Parks (eds). The Handbook of Microbiological Media (1993) CRC Press, Boca Raton, FL. В бактериальных системах несколько экспрессионных векторов может быть выбрано в зависимости от применения, для которого предназначены экспрессированные продукты. Например, когда большие количества полипептида или его фрагментов необходимы для продуцирования антител, предпочтительно использовать векторы, направляющие экспрессию высокого уровня химерных полипептидов L1/L2, которые легко очищаются. Такие векторы включают, без ограничения, многофункциональные Е. coli клонирующие и экспрессирующие векторы, такие как BLUESCRIPT (Stratagene), в которых интересующая кодирующая последовательность, например полинуклеотид по изобретению, как описано выше, может быть лигирована в вектор в пределах рамки считывания с последовательностями для метионина, инициирующего аминоконцевую трансляцию, и последующими 7 остатками бета-галактозидазы, продуцирующими каталитически активный бета-галактозидазный слитый белок; pIN векторы (Van HeekeSchuster (1989) J. Biol. Chem. 264: 5503-5509); pET векторы (Novagen, Madison WI), в которых аминоконцевой метионин лигирован внутри рамки считывания с гистидиновой меткой; и тому подобные. Аналогично, в дрожжах, таких как Saccharomyces cerevisiae, несколько векторов, содержащих конститутивные или индуцибельные промоторы, такие как альфа-фактор, алкогольоксидаза и PGH (простагландин Н), могут быть использованы для продуцирования желаемых продуктов экспрессии (см. обзорBerger, Ausubel и, например, Grant et al. (1987; Methods in Enzymology, 153: 516-544. В клетках-хозяевах млекопитающих могут быть использованы несколько экспрессионных систем, включая как плазмиды,- 17022213 так и системы на основе вирусов. Клетку-хозяина возможно выбирают по ее способности модулировать экспрессию вставленных последовательностей или осуществлять процессинг экспрессированного белка в желаемой модели. Такие модификации белка включают, без ограничения, гликозилирование (а также, например, ацетилирование,карбоксилирование, фосфорилирование, липидирование и ацилирование). Разные клетки-хозяева, такие как 3 Т 3, COS, CHO, HeLa, BHK, MDCK, 293, WI38 и т.д., имеют специфический клеточный аппарат и характеристические механизмы для таких видов посттрансляционной активности и могут быть выбраны для обеспечения точной модификации и процессинга введенного, чужеродного белка. В некоторых примерах нуклеиновые кислоты вводят в клетки посредством векторов, подходящих для введения и экспрессии в прокариотических клетках, например клетках Е. coli. Вектор экспрессии вводят (например, электропорацией) в подходящего бактериального хозяина. Многочисленные подходящие штаммы Е. coli доступны и могут быть выбраны специалистом в данной области (например,штаммы Rosetta и BL21 (DE3), признанные полезными для экспрессии рекомбинантных векторов, содержащих полинуклеотидные последовательности, которые кодируют химерный полипептид L1/L2). Более типично, полинуклеотиды, которые кодируют химерный полипептид L1/L2, вводят в векторы экспрессии, пригодные для введения и экспрессии в эукариотических клетках (например, в клетках насекомых или млекопитающих). Предпочтительно такие нуклеиновые кислоты являются кодоноптимизированными для экспрессии в выбранном(ой) векторе/клетке-хозяине. В качестве примера полинуклеотидную последовательность, которая кодирует химерный полипептид L1/L2, вводят в клетки насекомых с использованием бакуловирусной экспрессионной векторной системы (BEVS). Рекомбинантный бакуловирус, способный инфицировать клетки насекомых, может быть создан с использованием коммерчески доступных векторов, наборов и/или систем, таких как система BDBaculoGold от BD BioScience. Коротко, полинуклеотидную последовательность, кодирующую химерный полипептид L1/L2, вставляют в вектор переноса pAcSG2. Затем клетки-хозяева SF9 (Spodopterafrugiperda) ко-трансфицируют pAcSG2-химерной плазмидой и BD BaculoGold, содержащей линеаризованную геномную ДНК бакуловируса Autographa californica nuclear polyhedrosis virus (AcNPV). После трансфекции происходит гомологичная рекомбинация между pACSG2 плазмидой и геномом бакуловируса с образованием рекомбинантного вируса. В качестве примера антиген химерного полипептидаL1/L2 экспрессируют под регуляторным контролем полигидринового промотора (рН). Подобные векторы переноса могут быть продуцированы с использованием других промоторов, таких как основные (Ва) и plO промоторы. Подобным образом, могут быть использованы альтернативные клетки насекомых, такие как SF21, которые являются близкородственными с Sf9, и линия клеток High Five из совки капустной, Trichoplusia ni. Для долговременного с высоким выходом продуцирования рекомбинантных химерных полипептидов L1/L2, раскрытых в данном документе, обычно используют стабильные экспрессирующие системы. Например, линии клеток, стабильно экспрессирующие химерный полипептид L1/L2, вводят в клеткухозяин с использованием векторов экспрессии, которые содержат вирусные репликаторы или эндогенные экспрессирующие элементы и селектируемый маркерный ген. После введения вектора клетки оставляют расти в течение 1-2 суток в обогащенных средах, после чего их переносят в селективные среды. Назначение селектируемого маркера состоит в том, чтобы придавать устойчивость к селекции, и его присутствие обеспечивает рост и выделение клеток, которые успешно экспрессируют введенные последовательности. Например, устойчивые группы или колонии стабильно трансформированных клеток могут быть пролиферированы с использованием методов выращивания ткани, подходящих для данного типа клеток. Клетки-хозяева, трансформированные нуклеиновой кислотой, кодирующей химерный полипептид L1/L2, возможно выращивают в условиях, подходящих для экспрессии и выделения кодируемого белка из культуры клеток. После трансдукции подходящей линии клеток-хозяев и выращивания клеток-хозяев до соответствующей плотности клеток выбранный промотор индуцируют подходящими способами (например, температурным сдвигом или химическим индуцированием), и клетки культивируют в течение дополнительного периода времени. Секретированный полипептидный продукт затем выделяют и/или очищают из культуральной среды. Термин "очистка" (например, применительно к химерному полипептиду L1/L2 или нуклеиновой кислоте, кодирующей такой полипептид) относится к процессу удаления компонентов из композиции, присутствие которых нежелательно. Очистка является относительным понятием и не требует, чтобы все следовые количества нежелательного компонента были удалены из композиции. В контексте продуцирования белка очистка включает такие процессы, как центрифугирование, диализ, ионообменная хроматография и эксклюзионная хроматография, аффинная очистка или преципитация. Термин "очищенный" не требует абсолютной чистоты; это, скорее, относительное понятие. Так, например, очищенный полипептидный (или капсомерный, или VLP) препарат представляет собой препарат, в котором полипептид в большей степени обогащен, чем когда он находится в продуцирующей его среде, например в клетке или в популяции клеток, в которой он реплицируется в естественных условиях или в искусственной среде. Препарат, по существу, чистых химерных полипептидов L1/L2 может быть очищен таким образом, что желаемые химерные полипептиды составляют по меньшей мере 50% от общего содержания белка в препарате. В некоторых воплощениях химерный полипептид L1/L2 будет составлять по меньшей мере 60%,по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% или более от общего содержания белка в препарате. В процессе продуцирования и очистки химерного полипептида L1/L2 клетки могут быть собраны центрифугированием, разрушены физическими или химическими способами, и полученный неочищенный экстракт может быть сохранен для дальнейшей очистки. Эукариотические или микробиологические клетки, используемые в экспрессии белков, могут быть разрушены любым стандартным способом,включая подвергание циклам замораживания-оттаивания, обработку ультразвуком, механическое разрушение или использование агентов для лизиса клеток, или другими способами, которые известны специалистам в данной области. Экспрессированные химерные полипептиды L1/L2 затем могут быть выделены и очищены из культур рекомбинантных клеток любым из способов, известных в данной области, включая аммонийсульфатную или этанольную преципитацию, кислотную экстракцию, фильтрацию, ультрафильтрацию, центрифугирование, анионо- или катионообменную хроматографию, хроматографию на фосфоцеллюлозе,хроматографию с гидрофобным взаимодействием, аффинную хроматографию (например, с использованием любой из систем мечения, указанных в данном описании), хроматографию на гидроксиапатите и лектин-хроматографию. Если желательно, могут быть использованы стадии рефолдинга белка в законченную конфигурацию зрелого белка. Наконец, на финальных стадиях очистки может быть использована высокоэффективная жидкостная хроматография (ВЭЖХ). В дополнение к ссылкам, указанным выше, в данной области известны различные способы очистки, включая, например, способы, изложенные в Sandana (1997) Bloseparatlon of Proteins, Academic Press, Inc.; Bollag et al. (1996) Protein Methods, 2nd Edition(1998) Protein Protocols on CD-ROM Humana Press, NJ. В WO 2010/012780 (которая включена в данное описание посредством ссылки) описан способ очистки VLP HPV 16 и VLP HPV 18. Аналогичный способ можно применять для очистки химерных полипептидов, описанных в данном документе. Так, химерные полипептиды могут быть экстрагированы из клеток-хозяев в восстанавливающем (3-меркаптоэтанольном(ВМЕ) масле, а затем могут быть подвергнуты анионообменной и гидроксиапатитной хроматографии,после чего полученному продукту дают возможность созревать при удалении ВМЕ. Полученный продукт может быть стерилизован стерилизующей фильтрацией. Иммуногенные композиции и способы В еще одном аспекте настоящее изобретение относится к иммуногенным композициям, которые содержат химерные полипептиды L1/L2 (или капсомеры, или VLP, состоящие из химерных полипептидовL1/L2). Такие иммуногенные композиции могут содержать химерные полипептиды L1/L2 одни или в комбинации, например, с дополнительными химерными полипептидами L1/L2 и/или c VLP (например,VLP L1). В некоторых воплощениях любой из химерных полипептидов L1/L2, описанных здесь выше, является компонентом иммуногенной композиции. Например, иммуногенная композиция может содержать химерный полипептид L1/L2, который содержит полипептид L1 HPV типа 18 или его фрагмент, в который вставлен по меньшей мере один пептид, содержащий эпитоп полипептида L2 (например, пептид L2 не-HPV типа 18). Аналогично, иммуногенная композиция может содержать химерный полипептидL1/L2, который содержит полипептид L1 HPV типа 16 или его фрагмент, в который вставлен по меньшей мере один пептид, содержащий эпитоп полипептида L2 (например, пептид L2 не-HPV типа 16). В конкретных примерах пептид L2, вставленный в полипептид L1 HPV 16, содержит (например, состоит из) аминокислоты 56-75 (как они обозначены с учетом выравнивания с L2 HPV 16) полипептида L2. Дополнительные подходящие химерные полипептиды L1/L2 для применения в иммуногенных композициях включают любые полипептиды, описанные выше. В некоторых воплощениях химерные полипептиды L1/L2 присутствуют в иммуногенных композициях в комбинации с VLP HPV. Например, в одном из воплощений иммуногенная композиция содержит:(1) по меньшей мере одну вирусоподобную частицу (VLP), содержащую полипептид L1 вируса папилломы человека (HPV) или его фрагмент; и(2) по меньшей мере один химерный полипептид, содержащий L1 вируса папилломы человека(HPV) или его фрагмент, содержащий по меньшей мере один пептид, содержащий эпитоп полипептидаL2, вставленный в полипептид L1 HPV. В одном из воплощений химерный полипептид представляет собой полипептид, как он описан в данном документе. В предпочтительном воплощении по меньшей мере одна VLP содержит полипептид L1 VLP HPV 16 или его фрагмент. В другом воплощении по меньшей мере одна VLP содержит полипептид L1 HPV 18 или его фрагмент. Предпочтительно в таких композициях химерный полипептид собран в супрамолеку- 19022213 лярный комплекс, такой как капсомеры, или вирусоподобные частицы, или небольшую не-VLPподобную структуру. В одном из воплощений композиция содержит (1) по меньшей мере одну VLP L1 HPV и (2) две(а) химерных VLP, полипептида или капсомера L1 HPV, каждая(ый) из которых содержит пептид L2 в последовательности L1. В предпочтительном воплощении два химерных полипептида (или капсомера, илиVLP) L1 могут содержать разные пептиды L2 в полипептидах L1 из одного и того же типа HPV (например, из HPV 16 или HPV 18). Альтернативно, два химерных полипептида капсомера или VLP L1 могут содержать одинаковый пептид L2 в полипептиде L1 из двух разных типов HPV, таких как HPV 16 и HPV 18. В еще одном дополнительном воплощении два химерных полипептида, или капсомера, или VLP L1 могут содержать разные пептиды L2 в полипептидах L1 из двух разных типов HPV (таких как HPV 16 иHPV 18 и/или HPV 33 и HPV 58). В конкретных воплощениях пептиды L2 могут представлять собой пептиды L2 из HPV 33 или HPV 58 и могут быть вставлены в L1 HPV 18. В таких воплощениях разные пептиды L2 могут быть вставлены по одному в два разных полипептида L1 HPV типа 18 или они могут быть вставлены в одинаковые или разные сайты в одном и том же полипептиде L1 HPV типа 18. В некоторых воплощениях VLP HPV (в частности, только VLP L1 HPV) и химерные VLP, полипептиды или капсомеры, включенные в композиции по настоящему изобретению, могут включать одну или более VLP HPV 6, VLP HPV 11, VLP HPV 16 и VLP L1 HPV 18. Например, они могут включать VLPHPV 16 и 18, или HPV 6 и 11, или из всех 4 типов HPV. Подходящие VLP L1 HPV и химерные полипептиды L1 HPV представляют собой VLP L1 и химерные полипептиды L1 из HPV 16 и/или HPV 18.VLP HPV для применения, описанного в данном документе, либо химерные, либо нехимерные,также могут быть собраны из L2, или они могут представлять собой только VLP L1. Например, VLP могут быть собраны из смеси полипептидов L1 и L2 (и как таковые они не являются такими же, как химерные VLP L1/L2, описанные в данном документе, в которых пептид L2 вставлен в последовательностьL1). Альтернативно, VLP могут представлять собой химерные VLP, иные чем полипептид L1/L2, раскрытый в данном документе. Например, такие полипептиды не-L1/L2 могут содержать полипептид L1 и по меньшей мере одну дополнительную последовательность полипептида HPV, иного чем L1, например Е 7.L1 HPV в VLP или из химерных полипептидов, раскрытых в данном документе, могут быть образованы либо из полноразмерного белка L1 HPV, либо из некоторых производных L1, таких как фрагменты,стандартными способами, известными в данной области, например способами, раскрытыми в WO 03/077942 (US 7416846) или WO 99/13056 (US 7351533), которые включены в данное описание посредством ссылки. В частном воплощении композиции, раскрытой в данном документе, VLP L1 HPV содержат или состоят из VLP HPV 16 и HPV 18, и химерные VLP L1 HPV содержат или состоят из химерных VLP L1HPV 16 или химерных VLP L1 HPV 18, или и из тех и других. В тех случаях, когда присутствуют химерные VLP L1 как HPV 16, так и HPV 18, тогда в каждой из них пептиды L2 могут быть одинаковыми или разными и могут представлять собой любые пептиды L2, раскрытые в данном документе. Иммуногенные композиции, раскрытые в данном документе, обычно содержат по меньшей мере один фармацевтически приемлемый разбавитель или носитель и возможно адъювант. Иммуногенная композиция представляет собой композицию, которая повышает иммунный ответ при введении животному или человеку, и этот иммунный ответ может быть защитным иммунным ответом, который необязательно является полностью защитным против инфекции или заболевания, но по меньшей мере снижает инцидентность инфекции или заболевания. Адъювант для применения, описанного в данном документе, может содержать соль алюминия. Также подходящими являются адъюванты, которые стимулируют Th1-ответ, такие как 3-де-О-ацилированный монофосфориллипид A (3D-MPL) или QS21. Подходящим адъювантом является соль алюминия в комбинации с 3D-MPL, например гидрат окиси алюминия и 3D-MPL. Композиции по настоящему изобретению, содержащие такой адъювант, могут быть получены так, как описано, например, в WO 00/23105, которая включена в данное описание посредством ссылки.VLP L1 HPV и химерные VLP L1 HPV для применения, описанного в данном документе, могут быть адсорбированы на алюминийсодержащие адъюванты. Адъювант может быть добавлен к разнымVLP для их предварительной адсорбции, после чего разные VLP могут быть смешаны с образованием конечного вакцинного продукта. Иммуногенная композиция может также содержать алюминий или соединение алюминия в качестве стабилизатора, и настоящее изобретение также относится к стабилизированной композиции, где VLP адсорбированы на соль алюминия. Подходящие VLP после адсорбирования на соль алюминия более стабильны, чем в отсутствие алюминия. Иммуногенные композиции, описанные в данном документе, можно вводить в качестве вакцин любым из различных путей, таких как пероральный, местный, подкожный, мукозальный (обычно интравагинальный), внутривенный, внутримышечный, интраназальный, сублингвальный, интрадермальный и посредством суппозитория. Предпочтительными являются внутримышечный и интрадермальный пути доставки. Дозировка полипептидов, и/или капсомеров, и/или VLP и других белков может варьировать в зависимости от состояния, пола, возраста и массы тела индивидуума, пути введения и HPV вакцины. Дозировка полипептида и/или VLP, присутствующих в композициях, описанных в данном документе, может варьировать в зависимости от состояния, пола, возраста и массы тела индивидуума, пути введения и HPV вакцины. Количество также может варьировать в зависимости от числа типов VLP. Подходящей доставкой является доставка VLP в количестве, подходящем для вызывания иммунологически защитного ответа. Предпочтительно каждая доза вакцины содержит 1-100 мкг каждой VLP, предпочтительно по меньшей мере 5 мкг или по меньшей мере 10 мкг, например от 5 до 50 мкг каждой VLP, наиболее предпочтительно 10-50 мкг каждой VLP, например 5, 6, 10, 15, 20, 40 или 50 мкг. В некоторых воплощениях, если присутствуют и химерные, и нехимерные VLP, то эти количества отражают сумму VLP,присутствующих для каждого типа HPV, т.е. химерных VLP L1 с пептидами L2 и VLP L1 без пептидаL2. Например, композиция по настоящему изобретению может содержать в однократной дозе: 30 мкг VLP HPV 16,30 мкг VLP HPV 18,10 мкг химерных VLP HPV 16 с пептидом L2,10 мкг химерных VLP HPV 18 с пептидом L2,где пептид L2 в химерных VLP HPV 16 и HPV 18 является одинаковым или разным и может быть выбран из L2 56-75 и L2 17-36, как описано здесь выше, из одного и того же или разных типов HPV. В другом примере композиция по настоящему изобретению может содержать в однократной дозе: 20 мкг VLPHPV 16,20 мкг VLPHPV 18,10-20 мкг химерных VLP HPV 18 с пептидом L2,10-20 мкг химерных VLP HPV 16 с пептидом L2,где пептид L2 в химерных VLP HPV 16 и HPV 18 является одинаковым или разным и может быть выбран из L2 56-75 и L2 17-36, как описано здесь выше, из одного и того же или разных типов HPV. Подходящие вышеуказанные композиции дополнительно содержат адъювант, предпочтительно соль алюминия, предпочтительно гидрат окиси алюминия, предпочтительно в комбинации с Th1 адъювантом, таким как 3D-MPL. Композиции, описанные в данном документе, предпочтительно вызывают иммунный ответ у субъекта-человека или животного против 1, 2 или более генотипов HPV, предпочтительно против любых 1, 2 или 3, 4, 5 или более генотипов, выбранных из HPV 5, 6, 8, 11, 16, 18, 31, 33, 35, 38, 39, 45, 51, 52, 56, 58,59, 66, 68 и 73. Предпочтительно композиции могут вызывать иммунный ответ против одного или более из типов HPV 2, 3 и 73. Композиции, описанные в данном документе, предпочтительно обеспечивают защиту против инфекции и/или заболевания, вызываемых 1, 2 или более генотипами HPV, предпочтительно любыми 1, 2 или более генотипами, выбранными из HPV 5, 6, 8, 11, 16, 18, 31, 33, 35, 38, 39, 45, 51, 52, 56, 58, 59, 66,68 и 73. Предпочтительно композиции обеспечивают защиту против по меньшей мере HPV 16 или 18 и более предпочтительно против как HPV 16, так и HPV 18. Предпочтительно композиции, описанные в данном документе, обеспечивают защиту против HPV 16 и 18 и по меньшей мере одного другого типа HPV, выбранного из типа HPV, вызывающего рак, типовHPV, вызывающих образование генитальных бородавок, и типов HPV, вызывающих рак кожи. Предпочтительно в дополнение к HPV 16 и HPV 18 композиции обеспечивают защиту против одного или более из следующих типов HPV: HPV 5, 6, 8, 11, 31, 33, 35, 38, 39, 45, 51, 52, 56, 58, 59, 66, 68 и 73. Иммуногенные композиции и вакцины, описанные в данном документе, можно применять для лечения или предупреждения инфекции и/или заболевания, вызываемых HPV. Например, иммуногенная композиция может быть использована терапевтически для снижения вирусной нагрузки и/или инфекций,которые приводят к карциноме шейки матки или осложнению CIN III (цервикальная интраэпителиальная неоплазия III степени). Таким образом, настоящее изобретение относится к применению иммуногенных композиций, описанных в данном документе, в терапевтическом лечении заболеваний, связанных с HPVинфекцией, и в профилактике инфекции или заболевания. Предпочтительным является применение вакцины по настоящему изобретению в профилактике инфекции и/или заболевания. Используемый здесь термин "инфекция" соответственно относится к инцидентной инфекции и/или персистирующей инфекции. Инфекция может быть оценена, например, методом PCR. Используемый здесь термин "заболевание" может означать аномальную цитологию, ASCUS, CIN1, CIN2, CIN3 или рак шейки матки, связанный сHPV-инфекцией. Заболевание может быть оценено, например, путем гистологического исследования или анализа биомаркеров, таких как р 16. Возможно, иммуногенная композиция или вакцина может быть также приготовлена или совместно введена с другими антигенами HPV, такими как ранние антигены или антигены не-HPV. Соответственно,эти антигены не-HPV могут обеспечивать защиту против других заболеваний, наиболее предпочтительно заболеваний, передающихся половым путем, таких как вирус простого герпеса, хламидии и HIV (вирус иммунодефицита человека). В частности, вакцина содержит gD или его усечение из HSV (вирус простого герпеса). В этом случае вакцина обеспечивает защиту как против HPV, так и против HSV. Для всех вакцин, описанных в данном документе, вакцину подходящим образом применяют для вакцинации девочек-подростков в возрасте 10-15, предпочтительно 10-13 лет. Предпочтительно вакцина также пригодна для введения педиатрическому населению в возрасте 0-10 лет. Вакцину можно также вводить женщинам после аномального мазка Папаниколау или после хирургического вмешательства по удалению поражения, вызванного HPV. Таким образом, вакцина соответственно пригодна для серонегативного населения в качестве профилактической вакцины и/или для серопозитивного населения в терапевтическом плане. Вакцину можно также вводить субъектам мужского пола. Предпочтительно вакцину вводят в режиме введения 2 или 3 доз, например в режиме через 0, 1 или 0, 2, или 0, 3, или 0, 4, или 0, 5, или 0, 6 месяцев, или 0, 1 и 6 или 0, 2, 6 месяцев соответственно. Предпочтительно режим вакцинации включает реиммунизацию инъекцией через 5-10 лет, предпочтительно через 10 лет. Другие режимы с введением 4 или более доз также могут быть использованы. Предпочтительно вакцина представляет собой жидкую вакцинную композицию, хотя вакцина может быть лиофилизирована и разведена перед введением. Примеры Пример 1. Иллюстративные химерные полипептиды L1/L2 Векторы экспрессии, содержащие нуклеиновые кислоты, которые кодируют приведенные ниже иллюстративные химерные полипептиды L1/L2, получены с использованием методик молекулярной биологии и суммированы в табл. 3. Таблица 3GGLGIGTGSGTGGRTGYVPL (HPV 58/HPV 6) вставлен между положением 137 и положением 138 в L1 с С-концевым усечением из HPV 18. Химерный полипептид 2: химерный полипептид HPV 18 L1 HPV 58 L2 СТ, где пептид L2GGLGIGTGSGTGGRTGYVPL (HPV 58/HPV 6) вставлен между положениями 432 и 433 в L1 с Сконцевым усечением из HPV 18. Химерный полипептид 3: химерный полипептид HPV 18 L1 HPV 33 L2 и HPV 58 L2, где пептид L2QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 137 и 138, и пептид L2GGLGIGTGSGTGGRTGYVPL (из HPV 58 или HPV 6) вставлен между положениями 432-433 в L1 с Сконцевым усечением из HPV 18. Химерный полипептид 4: химерный полипептид HPV 16 L1 HPV 58 L2 СТ, где пептид L2GGLGIGTGSGTGGRTGYVPL (HPV 58/HPV 6) вставлен между положениями 431 и 432 в L1 с Сконцевым усечением из HPV 16. Химерный полипептид 5: химерный полипептид HPV 16 L1 HPV 33 L2 СТ, где пептид L2 QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 137 и 138 в L1 с С-концевым усечением из HPV 16. Химерный полипептид 6: химерный полипептид HPV 16 L1 HPV 33 L2 P/D, где пептид L2 QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 272 и 273 в L1 с С-концевым усечением из HPV 16. Химерный полипептид 7: химерный полипептид HPV 16 L1 HPV 33 L2 и HPV 58 L2, где пептид L2QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 137 и 138, и пептид L2GGLGIGTGSGTGGRTGYVPL вставлен между положениями 431-432 в L1 с С-концевым усечением изHPV 16. Химерный полипептид 8: химерный полипептид HPV 18 L1 HPV 33 L2 DE, где пептид L2 QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 137 и 138 в L1 с С-концевым усечением из HPV 18. Химерный полипептид 9: химерный полипептид HPV 18 L1 HPV 33 СТ, где пептид L2 QLYQTCKATGTCPPDVIPKV (HPV 33/HPV 11) вставлен между положениями 432-433 в L1 с С-концевым усечением из HPV 18. Химерный полипептид 10: химерный полипептид HPV16 L1 HPV58 L2, где пептид L2GGLGIGTGSGTGGRTGYVPL (HPV 58/HPV 6) вставлен между положениями 431 и 431 в L1 с Сконцевым усечением из HPV 16. Пример 2. Синтез, экспрессия, очистка и характеризация иллюстративных химерных полипептидов Получение рекомбинантных нуклеиновых кислот Нуклеиновые кислоты, кодирующие иллюстративные химерные полипептиды L1/L2, описанные в примере 1, были получены генным синтезом перед их клонированием стандартными генетическими приемами в бакуловирусный вектор экспрессии. Сайты вставки суммированы в табл. 3. С-концевое усечение каждого из полипептидов L1 предназначено для удаления сигнала ядерной локализации, а также ДНКсвязывающего домена, присутствующего на С-конце каждого из полипептидов L1 (С-концевые делеции аминокислот 34, 35 соответственно для HPV 16, 18). Усеченные аминокислотные последовательности L1HPV 16 и 18, использованные здесь, представлены на фиг. 1 а и 1b соответственно. Аминокислотные последовательности пептидов L2 HPV 33 и HVP 58 представлены на фиг. 2 (фиг. 2(а), 2(b) соответственно). Аминокислотные последовательности иллюстративных химерных полипептидов представлены в SEQ IDNO: 36-45. Сбор клеток Иллюстративные химерные полипептиды экспрессировали в клетках Trichoplusia ni (High Five)(при плотности 2000000 клеток на мл), инфицированных рекомбинантным бакуловирусом (MOI (множественность заражения) 0,05-0,5), кодирующим интересующие химерные полипептиды L1/L2 HPV 16 или 18. Клетки собирали на 4 сутки после инфицирования путем центрифугирования при низкой скорости. Полученные клеточные осадки хранили при -70 С. Экстракция антигена Иллюстративные химерные полипептиды экстрагировали из клеток High Five двухстадийным процессом экстракции и очистки. Стадию экстракции клеток осуществляли с использованием восстанавливающего и гипотонического буфера (Tris 20 мМ + 4% -меркаптоэтанола (ВМЕ), рН 8,5). Альтернативно, когда экстракция низкая, рН может составлять 8,7 и может быть добавлен детергент Empigen 2%. Для осуществления экстракции использовали объем, равный половине или эквивалентный объему культуры. Время контакта составляло минимум полчаса при комнатной температуре. Очистку осуществляли центрифугированием. Если надосадочная жидкость мутная, то возможно осуществление фильтрации через фильтр Millistak COHC (Millipore) или его эквивалент. Очистка и характеризация Режимы очистки очень сходные для разных химерных полипептидов L1/L2 и включают следующие стадии: анионообменная хроматография (ди- или триметиламиноэтил, т.е. DMAE или ТМАЕ) и хроматография на гидроксиапатите. Режимы образования супрамолекулярных структур слегка варьируют между химерными полипептидами, незначительно отличаясь добавлением NaCl и Tween, и включают следующие стадии: замена буфера и удаление ВМЕ посредством гель-фильтрации на Sephadex G25, созревание в течение ночи и стерилизующая фильтрация через фильтр 0,22 мкм. Процессы очистки осуществляли при комнатной температуре, и только созревание VLP происходило в течение ночи при +4 С. 4% об./об. ВМЕ добавляли ко всем, кроме конечных буферов, для предотвращения образования VLP. Использованные буферы фильтровали через фильтры 0,22 мкм. Перед каждой операцией очистки гель-смеси обеззараживали и уравновешивали подходящим буфером, после чего загружали образец. Анионообменная хроматография ТМАЕ или DMAE. Очищенный экстракт наносили на анионообменную колонку (диметиламиноэтил), предварительно уравновешенную в буфере Tris 20 мМNaCl 50 мМ 4% -меркаптоэтанола (ВМЕ), рН 8,00,2. После промывки для несвязанных полипептидов осуществляли градиентное элюирование буфером Tris 20 мМNaCl от 50 до 250 мМ 4% -меркаптоэтанола(ВМЕ), рН 8,00,2. Антиген элюировался в пределах градиента NaCl, и профиль элюирования отслеживали при 280 нм. Собранные фракции анализировали методом SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия). Положительные в отношении L1/L2 фракции собирали в пул и хранили при +4 С до следующей колонки. Хроматография на гидроксиапатите. Элюат с предыдущей стадии наносили на колонку с гидроксиапатитом типа 1 (НА), предварительно уравновешенную в буфере (TRIS 20 мМNaCl 180 мМ 4% ВМЕ), рН 8,00,2. После нанесения образца гель промывали уравновешивающим буфером и элюировали приблизительно 10 колоночными объемами буфера (фосфат Na 100 мМNaCl 30 мМ 4% ВМЕ), рН 6,00,2. НАэлюат немедленно разводили до 40 мл буфером для элюирования и хранили в течение ночи при комнатной температуре. НА-элюаты затем наносили на гель-фильтрационную колонку Sephadex G25 (М) (объем слоя 145 мл), уравновешенную в буфере (20 мМ Na фосфат 500 мМ NaCl, рН 6,0). В некоторых случаях буфер модифицировали до содержания NaCl 100 мМ. Профили элюирования отслеживали при 280 нм (для полипептида) и при 254 нм (для ВМЕ). Химерные L1/L2 антигены собирались в объеме пор, а ВМЕ элюировался на более поздней стадии и с другим спектром из общего объема (Vt). Созревание проводили путем хранения в течение ночи при +4 С. После созревания Sephadex-пулы, содержащие химерные L1/L2 антигены, фильтровали через стерилизующий фильтр 0,22 мкм и хранили при -70 С. В некоторых случаях перед фильтрованием добавляют 0,05% (об./об.) Tween 80. Упрощенная блок-схема способа очистки химерных L1/L2 антигенов из 800 мл культуры иллюстрируется на фиг. 5 (а)-(е). Характеризация химерных L1/L2 антигенов методом электронной микроскопии (ЕМ) Электронную микроскопию использовали, чтобы определить, что из очищенных химерных полипептидов L1/L2 образуются частицы, такие как полипептидные частицы, и/или капсомеры, и/или VLP,сходные с частицами, образованными белками L1 HPV-16 и HPV-18 с С-концевыми усечениями, использованными в качестве контролей. Размер химерной VLP может быть меньше или больше, чем размер контролей. Очищенные частицы химерных полипептидов L1/L2 разводили до 50 мкг/мл в их соответствующем буфере (как указано в табл. 3). Образцы готовили для ЕМ анализа негативного окрашивания согласно стандартному двухстадийному методу негативного окрашивания (Hayat M.A.Miller S.E.,1990) с использованием уранилацетата (UAc) в качестве контрастного агента. Коротко, никелевую сетку(400 меш) с покрытой углеродом формваровой пленкой флотировали на капле образца в течение 10 мин при комнатной температуре для обеспечения адсорбции вещества. Избыточный раствор удаляли, и вещество оставляли высушиваться на воздухе в течение менее 2 мин. Сетку затем кратковременно (менее 30 с) флотировали на капле дистиллированной воды для удаления солей, которые могут дать осадок красителя. Сетку переносили на каплю красителя, приготовленного согласно Harris (Harris, J.R., 1994): 2% UAc(мас./об.) в воде с добавлением 1% трегалозы (мас./об.). Через 30 с сухую сетку подвергали блоттингу. Вещество оставляли высушиваться полностью (в течение 1 ч) и исследовали под LEO Zeiss EM912 при 100 кВ. Репрезентативные поля визуализировали при стандартных 100 К первоначальных увеличениях. Результаты суммированы в табл. 4. ЕМ-результаты показали, что образованные химерные полипептидыL1/L2 не идентичны полипептидам, продуцированным диким типом VLP L1 HPV-16 или HPV-18, за исключением 5-L1-HPV16/L2DE17-36 и 8-L1-HPV18/L2DE17-36. Образованные частицы являются либо частицами в стадии VLP, аморфными структурами, либо небольшими и относительно гомогенными не-VLP структурами. Таблица 4. Суммарные результаты ЕМ: химерные полипептиды L1/L2 Характеризация химерных LI/L2 антигенов с использованием антител Антигенную характеризацию компонента L1 очищенных химерных конструкций L1/L2 проводили методом сэндвич-ELISA с использованием в качестве покрытия либо H16.V5 (нейтрализующее и конформационно-специфичное моноклональное антитело; а.к. 266-297 и 339-365, ответственные за связывание VLP L1 HPV-16), либо H18.J4 (нейтрализующее и конформационно-специфичное моноклональное антитело (локализация эпитопа неизвестна) на VLP L1 HPV-18), либо H16.U4 (нейтрализующее и конформационно-специфичное моноклональное антитело, неизвестный эпитоп на VLP L1 HPV-16), очищенное из гибридом, предоставленных доктором Neil Christensen (Chistensen et al., 1996, 2001). Анализ использовали, чтобы продемонстрировать присутствие конформационно-специфических эпитопов HPV16 или HPV-18 на различных химерных L1/L2 антигенах по сравнению с нативными препаратами VLPHPV-16 или HPV-18. L2-компонент очищенных химерных конструкций L1/L2 характеризовали с использованием прямого анализа ELISA путем покрытия планшетов химерными конструкциями с последующим детектированием с использованием кроличьего поликлонального антитела, направленного на пептид L2 а.к. 17-36 HPV33/HPV 11 или 56-75 HPV 58/HPV 6. Этот анализ показал, что эпитоп L2 хорошо экспонирован на поверхности химерного полипептида L1/L2, за исключением 9-L1-HPV18/L2Ct17-36. Таблица 5. Суммированные данные Пример 3. Метод тестирования иммуногенности и перекрестной реактивности химерных L1/L2 антигенов в животной модели Иммунизацию мышей ALB/c (обычно по меньшей мере 15 мышей на группу) выполняли внутримышечным введением (например, в мультидозовом трехразовом режиме в дни 0, 14 и 42) 2 или 10 мкг вышеуказанного химерного полипептида L1/L2, одного или вместе с Cervarix, с последующими двумя реиммунизациями через две и шесть недель. Через подходящий период времени (например, через 14 дней) после последней иммунизации специфические L1 антительные ответы, индуцированные вакцинацией, отслеживали анализом пептид- и/или белок-ELISA. Специфические и перекрестно-реактивные L2 антительные ответы, индуцированные вакцинацией, можно отслеживать анализом пептид- и/или белокELISA. ELISA-титры рассчитывали исходя из эталона с помощью SoftMaxPro (с использованием четырехпараметрического уравнения) и выражали в EU (эндотоксиновая единица)/мл. Альтернативно, двум новозеландским белым кроликам (NZW, 1,5-2 кг) проводили иммунизацию путем внутримышечного введения 20 или 100 мкг вышеуказанного химерного полипептида L1/L2, одного или вместе с Cervarix (например, в мультидозовом четырехразовом режиме в дни 0, 14, 28 и 42). Химерные полипептиды готовили в виде композиции с Specol (от Cedi Diagnostic), эмульсией масло-в-воде,используемой в качестве альтернативы адъюванту Фрейнда для гипериммунизации кроликов, приготовленной в соответствии с протоколами производителя. Серология (Ig ответ) против VLP Количественное определение антитела против VLP16 или VLP18 проводят анализом ELISA с использованием VLP HPV 16 или VLP HPV 18 в качестве покрывающего антигена. В табл. 6 и 7 суммированы данные, полученные у мышей и кролика соответственно. Таблица 6. Связывание мышиной антисыворотки, индуцированное химерными полипептидами L1/L2, с VLP L1 HPV-16, 18 в день 14 после последней иммунизации (ELISA) 100% мышиных сывороток реагировали с VLP L1 HPV 16 и HPV 18, что показывает, что вставка эпитопа L2 не влияет на HPV-L1 ответ. Таблица 7. Связывание кроличьей антисыворотки, индуцированное химерными полипептидами L1/L2, с VLP L1 HPV-16, 18 в день 14 после последней иммунизации (ELISA) 100% Кроличьих сывороток взаимодействовали с VLP L1 HPV 16 и HPV 18, демонстрируя, что вставка эпитопа L2 не влияет на HPV-L1 ответ. Серология (Ig ответ) против пептида L2 Количественное определение антитела против L2 осуществляли анализом ELISA с использованием пептида L2 (2 мкг/мл) из гомологичных (пептиды L2 аминокислоты 17-36 HPV 33/HPV 11 или пептиды L2 аминокислоты 56-75 HPV 58/HPV 6) или гетерологичных типов HPV для оценки специфических и перекрестнореактивных ответов. Для перекрестного L2 антительного ответа использовали следующие синтетические пептиды L2: аминокислоты 17-36 из HPV-5, 6, 16, 31, 35, 52 и 56 или аминокислоты 56-75 из HPV-58, 45, 33, 52, 5,11, 56 и 35.ELISA-измерение пептида L2 HPV Пептиды L2 (производимые Eurogentec) разводили в конечной концентрации 2 мкг/мл в PBS (забуференный фосфатами физиологический раствор) и адсорбировали в течение ночи при 4 С на лунки 96 луночных титрационных микропланшетов (Maxisorp Immuno-plate, Nunc, Denmark). Планшеты затем инкубировали в течение 1 ч при 37 С с PBS + 0,1% Tween20 +1% BSA (бычий сывороточный альбумин, буфер насыщения). Сыворотки, разведенные в буфере насыщения, добавляли в планшеты, покрытые пептидом L2HPV, и инкубировали в течение 1 ч 30 мин при 37 С. Планшеты промывали четыре раза PBS с 0,1% Tween20,и биотин-конъюгированное анти-Ig антитело, разведенное в буфере насыщения, добавляли в каждую лунку и инкубировали в течение 1 ч в случае антимышиного реагента (Dako, UK) или в течение 1 ч 30 мин в случае антикроличьего реагента (Amersham, UK) при 37 С. После стадии промывки добавляли стрептавидинпероксидазу хрена (Dako, UK), разведенную в буфере насыщения, в течение дополнительных 30 мин при 37 С. Планшеты промывали, как указано выше, и инкубировали в течение 20 мин при комнатной температуре с раствором 0,04% о-фенилендиамина (Sigma), 0,03% Н 2 О 2 в 0,1% Tween20, 0,05M цитратном буфере рН 4,5. Реакцию останавливали добавлением 2 н. H2SO4, и считывали данные при 492/620 нм. ELISA-титры рассчитывали исходя из эталона с помощью SoftMaxPro (с использованием четырехпараметрического уравнения) и выражали в EU/мл.VLP L1 HPV-16/18 разводили в конечной концентрации 1 мкг/мл в PBS и адсорбировали в течение ночи при 4 С на лунки 96-луночных титрационных микропланшетов (Maxisorp Immuno-plate, Nunc, Denmark). Планшеты затем инкубировали в течение 1 ч при 37 С с PBS + 0,1% Tween20 +1% BSA (буфер насыщения). Сыворотки, разведенные в буфере насыщения, добавляли в планшеты, покрытые пептидом L2 HPV, и инкубировали в течение 1 ч 30 мин при 37 С. Планшеты промывали четыре раза PBS с 0,1% Tween20, и биотинконъюгированное анти-Ig антитело, разведенное в буфере насыщения, добавляли в каждую лунку и инкубировали в течение 1 ч в случае антимышиного реагента (Dako, UK) или 1 ч 30 мин в случае анти-кроличьего реагента (Amersham, UK) при 37 С. После стадии промывки добавляли стрептавидин-пероксидазу хрена(Dako, UK), разведенную в буфере насыщения, в течение дополнительных 30 мин при 37 С. Планшеты промывали, как указано выше, и инкубировали в течение 20 мин при комнатной температуре с раствором 0,04% о-фенилендиамина (Sigma), 0,03% Н 2 О 2 в 0,1% Tween20, 0,05M цитратном буфере рН 4,5. Реакцию останавливали добавлением 2 н. H2SO4, и считывали данные при 492/620 нм. ELISA-титры рассчитывали исходя из эталона с помощью SoftMaxPro (с использованием четырехпараметрического уравнения) и выражали вEU/мл. В табл. 8 суммированы данные по иммуногенности у мышей. Все антигены химерные полипептиды L1/L2 вызывали значительные доза-зависимые L2 антительные ответы (титры в пределах 1687-18873) у мышей. Результаты продемонстрировали улучшенную иммуногенность после третьей и после четвертой иммунизации (данные не показаны). Таблица 8. Связывание мышиной антисыворотки, индуцированное химерными полипептидами L1/L2, с гомологичным пептидом L2 17-36 HPV 33 или пептидом L2 56-75 HPV 58 в день 14 после последней иммунизации (ELISA) В табл. 9 и 10 суммированы данные ELISA у кролика для пептидной последовательности 17-36 и 56-75 соответственно. Все химерные L1/L2-полипептидные антигены индуцировали значительные доза-зависимые специфические и перекрестно-реактивные L2 антительные ответы у кроликов. Ответ на L2 был специфическим, так как антисыворотки из кроликов, иммунизированных химерным полипептидом L1/L2, содержащим аминокислоты 17-36 L2, не взаимодействовали перекрестно с синтетическими пептидами L2,аминокислотами 56-75 L2, и наоборот (данные не показаны). Хорошая перекрестная реактивность наблюдалась с большинством синтетических пептидов L2 из аминокислот 17-36 последовательностей L2 (табл. 9). Реактивность может зависеть от аминокислоты в положении 30: Pro (Р), замененный другой аминокислотой такого класса, как S или Е, во всех синтетических аминокислотах с низкой перекрестной реактивностью или без перекрестной активности (L2 аминокислоты 17-36 HPV-31 и -56). Аналогично, относительно хорошая перекрестная реактивность наблюдалась со всеми синтетическими пептидами L2, аминокислотная последовательность 56-75 L2 (табл. 10). Реактивность может зависеть от аминокислоты в положении 70: Thr (T), замененный другими аминокислотами, такими как Ala (А), не были перекрестно-реактивными (L2-аминокислоты 56-75 HPV-11, 52 и -56). Таблица 9. Связывание кроличьей антисыворотки, индуцированное химерными полипептидами L1/L2, с пептидом L2 17-36 в день 14 после последней иммунизации (ELISA) 17-36 HPV 11/HPV 33 представляет собой гомологичный пептид L2 = тип специфичный Таблица 10. Связывание кроличьей антисыворотки, индуцированное химерными полипептидами L1/L2, с пептидом L2 56-75 в день 14 после последней иммунизации (ELISA) 56-75 HPV 58/HPV 6 представляет собой гомологичный пептид L2 = тип специфический Эксперимент по нейтрализации. Через две недели после третьей и/или четвертой иммунизации сыворотки разводили буфером для анализа нейтрализации (8 четырехкратных последовательных разведений, начальное разведение 1/10 для кроличьих сывороток и 1/40 для мышей) и смешивали с инфекционным псевдовирусом (PsV) из типов HPV, которые являются одинаковыми и разными по отношению к типу(ам), использованному(ым) во время иммунизации. Смесь подвергали взаимодействию в течение часа при 4 С и добавляли к клеткам 293 ТТ (30000 клеток на лунку), которые были нанесены на планшеты по меньшей мере за 2 ч до этого, но не более чем за 4,5 ч. После культивирования в течение 72 ч с 5% СО 2 надосадочную жидкость извлекали, и активность секретированной щелочной фосфатазы (SeAP) измеряли (анализ нейтрализации, по существу, такой, как описано в Pastrana et al., 2004, модифицированный тем, что относительные световые единицы оптимизировали так, чтобы они находились в линейном диапазоне (например, от 75 до 100 RLU (относительная световая единица). Нейтрализующие титры выражали в виде величины, обратной величине разведения сыворотки, приводящей к 50%-ному снижению сигнала активности SeAP, вызванного PsV-инфекцией в отсутствие сыворотки. Нейтрализующие титры ниже 40 считаются титрами ниже предела отсечения. В табл. 11 суммированы данные, полученные у мышей. Таблица 11. Нейтрализация псевдовирионов HPV-6, 11, 16, 18, 33, 58 антисывороткой,индуцированная химерными полипептидами L1/L2, у мышей в день 14 после третьей иммунизации Химерные L1/L2-полипептидные антигены 5-L1-HPV 16/L2DE17-36 и 8-L1-HPV 18/L2DE17-36, иммунизированные одни, индуцировали выработку детектируемых специфических нейтрализующих антител(титры в пределах 262-696) при тестировании у мышей (табл. 10), за исключением 2-L1-HPV 18/L2Ct56-75. При объединении с VLP L1 HPV 16/18 химерные L1/L2-полипептидные антигены 5-L1-HPV 16/L2DE17-36 и 8-L1-HPV 18/L2DE17-36 все еще индуцировали выработку детектируемых нейтрализующих антител, но в меньшей степени (титры в диапазоне 61-633).
МПК / Метки
МПК: A61K 39/12, C07K 14/025
Метки: конструкции, применение, заболевания, человека, вызываемого, белка, папилломы, предупреждении, hpv, вируса, новые
Код ссылки
<a href="https://eas.patents.su/30-22213-novye-konstrukcii-belka-virusa-papillomy-cheloveka-hpv-i-ih-primenenie-v-preduprezhdenii-zabolevaniya-vyzyvaemogo-hpv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые конструкции белка вируса папилломы человека (hpv) и их применение в предупреждении заболевания, вызываемого hpv</a>
Предыдущий патент: Короткоцепочечные пептиды в качестве агониста рецептора паратиреоидного гормона (pth)
Следующий патент: Пептид
Случайный патент: Способ производства строительного полимерного вяжущего и строительное полимерное вяжущее












