Дигидроэторфины и их получение
Номер патента: 22210
Опубликовано: 30.11.2015
Авторы: Уайтлок Стив, Хардинг Дебора Филлис, Тернер Карл Дэвид
Формула / Реферат
1. Способ получения соединения формулы (VI) или его фармацевтически приемлемой соли
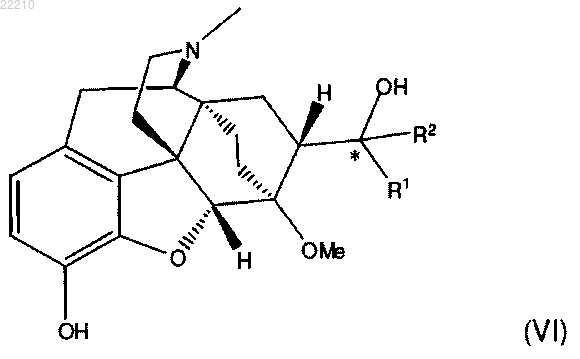
где R1 и R2 независимо представляют собой C1-8 алкил с прямой цепью и * представляет собой (S) стереоцентр, включающий взаимодействие соединения формулы (IV)
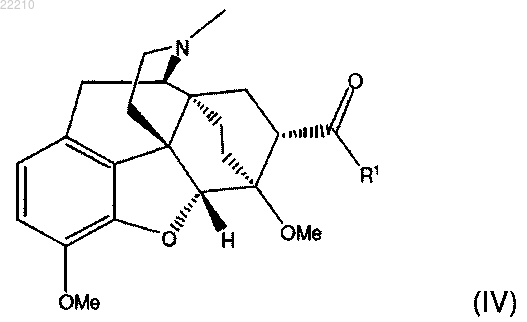
где R1 является таким, как определено выше;
с соединением формулы R2M(X)p, где R2 представляет собой С1-8 алкил с прямой цепью, М представляет собой щелочной или щелочно-земельный металл, X представляет собой галоген и р равно 1 или 0, с получением соединения формулы (V)
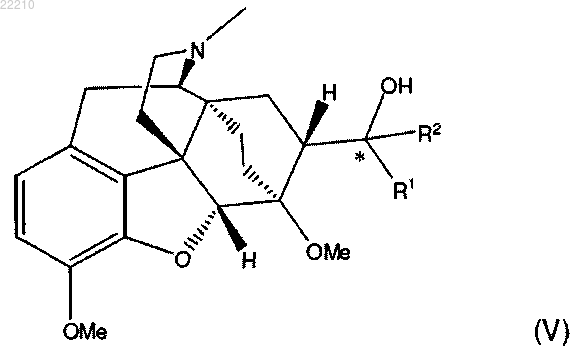
и гидролиз указанного соединения формулы (V) с получением соединения формулы (VI).
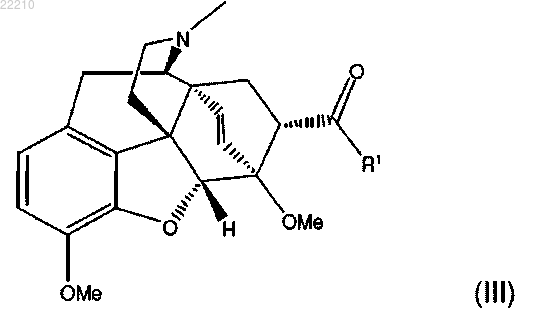
2. Способ по п.1, в котором указанное соединение формулы (IV) получают посредством восстановления соединения формулы (III)
где R1 является таким, как определено выше.
3. Способ по п.2, в котором указанное соединение формулы (III) получают посредством взаимодействия соединения формулы (I)
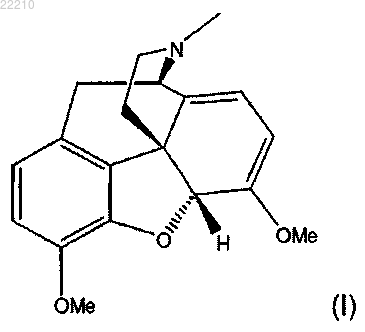
с соединением формулы (II)
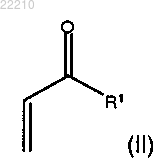
где R1 представляет собой C1-8 алкил с прямой цепью.
4. Способ по любому из пп.1-3, где М представляет собой магний или литий.
5. Способ по п.4, где R2Mg(X)p представляет собой R2MgCl, R2MgBr, R2MgI или R2Li.
6. Способ по любому из пп.1-5, дополнительно включающий стадию кристаллизации указанного соединения формулы (VI).
7. Способ по любому из пп.1-6, где R1 представляет собой С3-5 алкил.
8. Способ по любому из пп.1-7, в котором R1 представляет собой н-пропил.
9. Способ по любому из пп.1-8, в котором R2 представляет собой C1-2 алкил.
10. Способ по любому из пп.1-9, в котором R2 представляет собой метил.
11. Способ по любому из пп.1-10, в котором соединение формулы (V) получают в диастереомерном избытке по меньшей мере 90%.
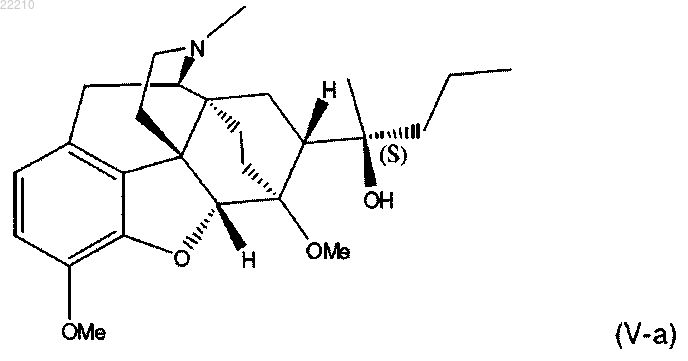
12. Способ по любому из пп.1-11, в котором соединение формулы (V) представляет собой
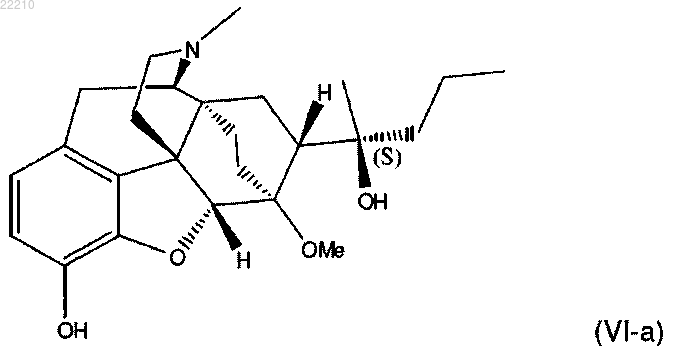
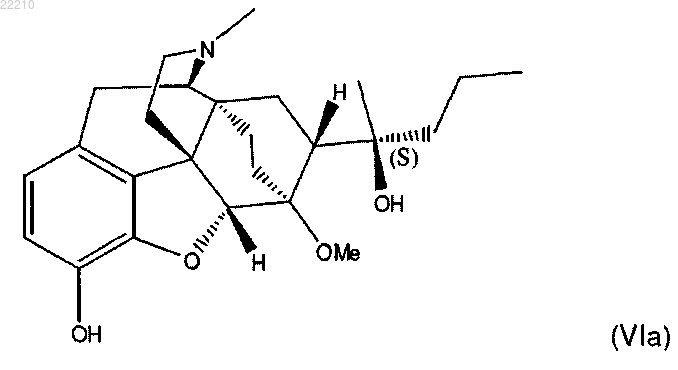
13. Способ по любому из пп.1-12, в котором соединение формулы (VI) представляет собой
14. Соединение формулы (VI) или его фармацевтически приемлемая соль

где R1 и R2 независимо представляют собой С1-8 алкил с прямой цепью, и * представляет собой (S)-стереоцентр.
15. Соединение по п.14 формулы (VI), или его фармацевтически приемлемая соль,
16. Соединение формулы (V) или его фармацевтически приемлемая соль
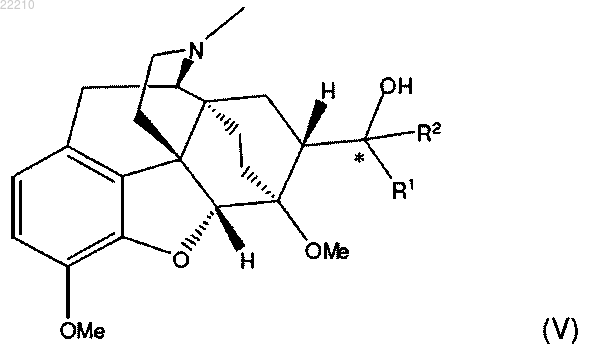
где R1 и R2 независимо представляют собой С1-8 алкил с прямой цепью, и (*) представляет собой (S)-стереоцентр.
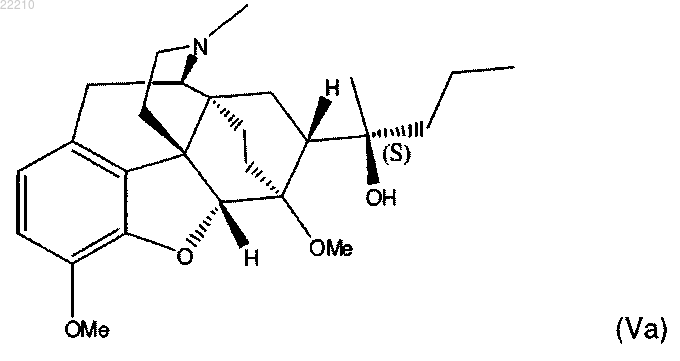
17. Соединение по п.16 формулы (Va) или его фармацевтически приемлемая соль
18. Соединение по любому из пп.14-17 в форме свободного основания.
19. Соединение по любому из пп.14-17 в виде фармацевтически приемлемой соли.
20. Соединение по п.19 в виде соли хлористо-водородной кислоты.
21. Соединение формулы (IV)
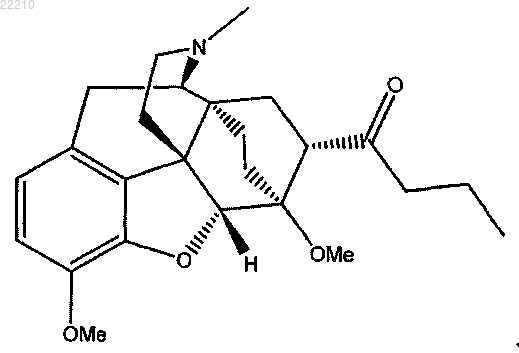
22. Фармацевтическая композиция для лечения субъекта, нуждающегося в ослаблении боли, содержащая терапевтически эффективное количество соединения по любому из пп.14-21.
23. Композиция по п.22 в дозированной форме, пригодной для трансдермального введения.
24. Применение соединения по любому из пп.14-21 в медицине для лечения субъекта, нуждающегося в ослаблении боли.
25. Применение соединения по любому из пп.14-21 в качестве анальгетика.
26. Применение соединения по любому из пп.14-21 для получения медикамента для лечения боли.
27. Способ лечения субъекта, нуждающегося в ослаблении боли, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.14-21.
Текст
Уайтлок Стив, Хардинг Дебора Филлис, Тернер Карл Дэвид (GB) Медведев В.Н. (RU) Изобретение предусматривает способ получения соединения формулы (VI) или его фармацевтически приемлемой соли, где R1 и R2 независимо представляют собой C1-8 алкил с прямой цепью, ипредставляет собой (S) стереоцентр. Изобретение относится к новому способу получения дигидроэторфина, по сути, (S)дигидроэторфину, а также к промежуточным соединениям, получаемым во время его синтеза.(R)-Дигидроэторфин (показан ниже) представляет собой сильнодействующее анальгетическое средство. Его используют, главным образом, в Китае, в сублингвальной форме при дозах, находящихся в пределах от 20 до 180 мкг. По сравнению с другими анальгетиками, как сообщается, он вызывает сильную анальгезию и относительно мягкие побочные воздействия. Использование (R)-дигидроэторфина в трансдермальных пластырях также описывается в JP-10-231248. Насколько известно заявителю, однако, такие пластыри не являются коммерчески доступными. Дигидроэторфин представляет собой один из вариантов эторфина. (R)-Эторфин представляет собой исключительно сильнодействующий опиоид, используемый для анестезирования животных, например слонов. Его разработали в 1960-х годах, и способы синтеза для его получения хорошо известны. Пример 12 из GB 925723, например, описывает синтез эторфина, где реагент Гриньяра (пропилмагниййодид) добавляется к производному тебаина, как показано ниже: Результаты, представленные в примере 12, утверждают, что -изомер получается при перетирании сырого продукта реакции с метанолом и что -изомер может кристаллизоваться из метанольных исходных растворов, когда их разбавляют водой и жидкость декантируют. По этой причине заявитель ожидал,что способ синтеза, описанный в GB 925723, может применяться к дигидроэторфину и что в результате могут быть получены как (R)-, так и (S)-диастереомеры. Обнаружено, однако, что этого не происходит. Вместо этого, добавление пропилмагния галогенида к производному дигидротебаину происходит при неожиданно высокой стереоселективности и получается только (R)-диастереомер. Насколько знают заявители, (S)-изомер дигидроэторфина никогда не был получен. По этой причине имеется необходимость в альтернативном способе синтеза, который дает (S)-дигидроэторфин, и в частности, в процедуре, которая дает (S)-дигидроэторфин при большом диастереомерном избытке. Этот изомер необходим для подтверждения стереохимии известных стереоизомеров. Теперь заявитель нашел способ, который удовлетворяет эти потребности. Кроме того, заявитель обнаружил, что (S)-изомер дигидроэторфина обладает полезными фармакологическими свойствами и, в частности, анальгетическими воздействиями. Таким образом, с точки зрения одного из аспектов, настоящее изобретение относится к способу получения соединения формулы (VI) или его фармацевтически приемлемой соли где R1 и R2 независимо представляют собой C1-8 алкил с прямой цепью, ипредставляет собой (S) стереоцентр, включающему взаимодействие соединения формулы (IV) где R1 является таким, как определено выше, с соединением формулы R2M(X)P, где R2 представляет собой C1-8 алкил с прямой цепью, М представляет собой щелочной или щелочно-земельный металл, X представляет собой галоген и р представляет собой 1 или 0, с получением соединения формулы (V) и гидролиз указанного соединения формулы (V) с получением соединения формулы (VI). В другом предпочтительном способе по настоящему изобретению соединение формулы (IV) получают посредством восстановления соединения формулы (III) где R1 является таким, как определено выше. Еще в одном предпочтительном способе по настоящему изобретению соединение формулы (III) получают посредством взаимодействия соединения формулы (I) где R1 представляет собой C1-8 алкил с прямой цепью. С точки зрения другого аспекта, настоящее изобретение относится к соединению формулы (VI) или его фармацевтически приемлемой соли, где R1 и R2 независимо представляют собой C1-8 алкил с прямой цепью, ипредставляет собой (S)стереоцентр. С точки зрения еще одного аспекта настоящее изобретение относится к соединениям, которые представляют собой промежуточные соединения в описанном выше способе, то есть к соединениям формул (V) и (IV) или, где это возможно, к их фармацевтически приемлемым солям, как показано ниже: где R1 и R2 независимо представляют собой C1-8 алкил с прямой цепью, ипредставляет собой (S)стереоцентр. Дополнительный аспект изобретения относится к соединению формулы (IV) С точки зрения другого аспекта настоящее изобретение относится к фармацевтическим композициям, содержащим новое соединение, как описано выше. С точки зрения другого аспекта настоящее изобретение относится к соединениям, как описано выше, для применения в медицине (например, в качестве анальгетика). С точки зрения еще одного аспекта настоящее изобретение относится к использованию соединения,как описано выше, для получения медикамента для лечения боли. Как используется в настоящем документе, термин "алкил" используется для упоминания имеющего прямую цепь, циклического или разветвленного, насыщенного, алифатического углеводорода. Алкиль-2 022210 ные группы, присутствующие в соединениях (II)-(VI), представляют собой алкильные группы с прямой цепью. Предпочтительные алкильные группы имеют формулу CnH2n+1, где n равно 1-8. Типичные алкильные группы включают метил, этил, пропил, бутил, пентил, гексил, гептил и октил. Предпочтительные алкильные группы в соединениях (II)-(VI) являются незамещенными. Соединение формулы (I) представляет собой тебаин и является коммерчески доступным, например,от Tasmanian Alkaloids, Pty. Альтернативное соединение формулы (I) может быть получено в соответствии с процедурами, описанными в литературе. В предпочтительном способе по настоящему изобретению R1 в соединении формулы (II), предпочтительно, представляет собой С 2-7 алкил, более предпочтительно С 3-5 алкил, в частности С 3 алкил (например, н-пропил). Особенно предпочтительное соединение формулы (II) представляет собой гексен-3 он. Оно является коммерчески доступным, например, от Sigma-Aldrich. Соединение формулы (I) взаимодействует с соединением формулы (II) с получением соединения формулы (III). Реакция, которой подвергаются эти соединения, как правило, упоминается как реакция Дильса-Альдера. Реакция Дильса-Альдера может осуществляться при обычных условиях, известных в данной области. Реакция соединений формул (I) и (II) может осуществляться, например, в любом обычном растворителе. Растворители, имеющие температуры кипения выше 60 С, являются предпочтительными (например, метанол и этанол). Этанол является особенно предпочтительным растворителем. В типичной реакции между соединениями формул (I) и (II) соединения нагревают с обратным холодильником в избытке растворителя, например, в течение 10-24 ч. Ход реакции может отслеживаться с использованием, например, ТСХ и/или 1 Н-ЯМР. В предпочтительной реакции используют 1,2-15 мол. экв., более предпочтительно 1,5-10 мол. экв. или 2-8 мол. экв. соединения формулы (II) по отношению к соединению формулы (I). В особенно предпочтительной реакции используют примерно 1,2-2 мол. экв.,более предпочтительно 1,3-1,8 мол.экв., например примерно 1,5 мол.экв. соединения формулы (II) по отношению к соединению формулы (I). Затем реакционную смесь охлаждают и концентрируют. Полученный продукт, соединение формулы (III), может быть получен с помощью обычной процедуры извлечения и необязательно очищен. Очистка может осуществляться, например, посредством кристаллизации из метанола или изопропилового спирта. Более предпочтительно, соединение формулы (III) кристаллизуется непосредственно из реакционного растворителя. Оно может необязательно перекристаллизовываться. Выход реакции предпочтительно составляет по меньшей мере 60%, более предпочтительно по меньшей мере 65%, например по меньшей мере 80%. Максимальный выход составляет 100%. Чистота соединения формулы (III) предпочтительно составляет по меньшей мере 95%, более предпочтительно по меньшей мере 97%, еще более предпочтительно по меньшей мере 99%, например 99,5%. Максимальная чистота составляет 100%. Чистоту предпочтительно определяют с использованием ВЭЖХ. В предпочтительном способе по настоящему изобретению соединение формулы (III) имеет формулу: где R1 является таким, как определено выше, например, R1 представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил с прямой цепью, в частности С 3 алкил с прямой цепью (например, н-пропил). Соединение формулы (III) может восстанавливаться с помощью любой соответствующей известной реакции восстановления, но, предпочтительно, восстанавливается с использованием реакции гидрирования (например, с использованием Н 2 в аппарате Парра или переноса водорода). Соединение формулы(III) может, например, гидрироваться в растворителе (например, этаноле) с помощью катализатора (например, палладия на угле) под давлением водорода (например, вплоть до 50 фунт/кв. дюйм (3,1 кг/кв. см) Н 2). Объем реакции предпочтительно находится в пределах 5-80 л, более предпочтительно 10-20 л, например составляет примерно 12 л. Количество используемого катализатора предпочтительно находится в пределах 10-60 мас.%, более предпочтительно 30-55 мас.%, например составляет примерно 50 мас.%. Реакция может осуществляться при температуре от 30 до 100 С, предпочтительно при температуре от 40 до 60 С, например при 50 или 65 С. По окончании реакции любой катализатор (например, палладий), используемый в ней, может удаляться посредством фильтрования. Продукт, соединение формулы (IV), может затем выделяться с помощью обычной процедуры извлечения. Соединение формулы (IV) необязательно очищается. Например, промывка C1-8 алканом, таким как гептан, удаляет этанол. Одно из преимуществ реакции гидрирования заключается, однако, в том, что соединение формулы (IV) может использоваться без очистки с помощью хроматографии и/или кристаллизации. Выход реакции предпочтительно составляет по меньшей мере 50%, более предпочтительно по меньшей мере 65%, еще более предпочтительно 85%, еще более предпочтительно по меньшей мере 90%. Максимальный выход составляет 100%. Соединение формулы (IV) предпочтительно получают с чистотой по меньшей мере 95%, более предпочтительно по меньшей мере 99%, например по меньшей мере 99,5%. Максимальная чистота составляет 100%. Чистоту предпочтительно определяют с использованием ВЭЖХ. В предпочтительном способе по настоящему изобретению соединение формулы (IV) имеет формулу где R1 является таким, как определено выше, например R1 представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил с прямой цепью, в частности С 3 алкил с прямой цепью (например, н-пропил). Соединение формулы (IV) взаимодействует с соединением формулы R2M(X)p, где R2 представляет собой C1-8 алкил с прямой цепью, М представляет собой металл (например, щелочной или щелочноземельный металл), X представляет собой галогенид и р равно 1 или 0, с получением соединения формулы (V). В предпочтительных соединениях формулы R2M(X)p, R2 представляет собой C1-3 алкил с прямой цепью, более предпочтительно C1-2 алкил, например метил. В других предпочтительных соединениях формулы R2M(X)p, M представляет собой магний или литий, предпочтительно магний. Когда М представляет собой Mg, p предпочтительно равно 1. Когда М представляет собой литий, р предпочтительно равно 0. Когда он присутствует, X предпочтительно, представляет собой Cl, Br или I. Метилмагнийгалогенид, в частности метилмагнийбромид и метилмагниййодид, является предпочтительным соединением формулы R2M(X)p, в особенности метилмагнийбромид. Реакция соединения формулы (IV) с соединением формулы R2M(X)p, как правило, упоминается как реакция нуклеофильного добавления. Когда М представляет собой Mg и X представляет собой галогенид, реакцию часто упоминают как реакцию добавления Гриньяра. Реакция добавления может осуществляться в любом обычном растворителе. Предпочтительные растворители являются неводными (например, представляют собой безводные растворители). Один из примеров предпочтительного растворителя представляет собой простой эфир, например, МТВЕ, ТГФ или простой диэтиловый эфир. МТВЕ или простой диэтиловый эфир являются предпочтительными. Простой диэтиловый эфир является особенно предпочтительным растворителем. ТГФ является особенно предпочтительным, когда используется соединение формулы R2M(X)p, где М представляет собой Mg, X представляет собой Cl и р равно 2. Реакцию добавления предпочтительно осуществляют при температуре в пределах от 20 до 60 С,более предпочтительно от 30 до 45 С, например примерно 35 С. Предпочтительно используется некоторый избыток соединения формулы R2M(X)p. В частности предпочтительно используют 1,2-4 эквивалента, более предпочтительно 1,5-3 эквивалента соединения формулы R2M(X)p по отношению к соединению формулы (IV). Соединение формулы (V) может выделяться с использованием обычных технологий. Оно необязательно может перетираться, например, вместе с метанолом. В дополнение к этому или альтернативно соединение формулы (V) может очищаться с помощью колоночной хроматографии. Соединение формулы (V) может также кристаллизоваться. Предпочтительно соединение формулы (V) кристаллизуется с помощью метанола. Выход реакции предпочтительно составляет по меньшей мере 20%, более предпочтительно по меньшей мере 30%, например 20-60%, еще более предпочтительно по меньшей мере 65%. Максимальный выход составляет 100%. Чистота соединения формулы (V), предпочтительно составляет по меньшей мере 95%, еще более предпочтительно по меньшей мере 99%, например по меньшей мере 99,5%. Максимальная чистота составляет 100%. Чистоту предпочтительно определяют с использованием ВЭЖХ. Реакция добавления генерирует новый стереоцентр в соединении формулы (V) на атоме углерода 19. Конфигурация этого стереоцентра зависит, по меньшей мере частично, от природы R1 и R2. В способах по настоящему изобретению (S)-стереоцентр генерируется на атоме углерода 19. В особенно предпочтительных способах (S)-стереоцентр генерируется на атоме углерода 19 в диастереомерном избытке по меньшей мере 85%, более предпочтительно по меньшей мере 90%, например по меньшей мере 95% или по меньшей мере 99%. Таким образом в предпочтительном способе соединение формулы(V) получается в отсутствие или, по существу, в отсутствие (R)-изомера. Предпочтительно в соединении формулы (V) присутствует менее 1 мас.%, еще более предпочтительно менее 0,5 мас.% (R)-изомера. В особенно предпочтительном способе по настоящему изобретению R1 представляет собой С 3-6 алкил с прямой цепью (например, пропил), R2 представляет собой C1-2 алкил (например, метил) и (S)стереоцентр генерируется в реакции добавления на атоме углерода 19 при диастереомерном избытке по меньшей мере 85%, более предпочтительно по меньшей мере 90%, например по меньшей мере 95% или по меньшей мере 99%. Таким образом, в предпочтительном способе по настоящему изобретению соединение формулы (V) имеет формулу где R1 и R2 являются такими, как описано выше, например, R1 представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил, в частности С 3 алкил с прямой цепью (например, нпропил), R2 представляет собой С 1-3 алкил с прямой цепью, более предпочтительно С 1-2 алкил, например метил, ипредставляет собой (S)-стереоцентр. В особенно предпочтительном способе по настоящему изобретению соединение формулы (V) представляет собой: Как упоминается выше, соединение формулы (V) может необязательно кристаллизоваться. В предпочтительном способе по настоящему изобретению соединение формулы (V) кристаллизуется. Для способа кристаллизации может использоваться любой обычный растворитель, например C1-4 спирты, вода,ацетон, ацетонитрил, DCM и МТВЕ. Метанол, этанол, вода и их смеси являются предпочтительными растворителями для кристаллизации, в частности, этанол/вода и этанол. В типичном способе кристаллизации некоторое количество соединения формулы (V), полученного от реакции добавления, растворяют в выбранном растворителе, предпочтительно в минимальном его количестве, и раствору позволяют постоять, например, в течение 3-4 дней. Предпочтительно кристаллизация осуществляется при температуре от-5 до 5 С, например от 0 до 4 С. Соединение формулы (V) предпочтительно гидролизуется с помощью гидроксида щелочного металла, с образованием соединения формулы (VI). Предпочтительный гидроксид щелочного металла представляет собой KOH. В реакции гидролиза, предпочтительно, используют некоторый избыток гидроксида щелочного металла, например избыток 10-40 эквивалентов по отношению к соединению формулы (V). Реакция может осуществляться в любом обычном растворителе. Предпочтительный растворитель представляет собой диэтиленгликоль. Реакцию гидролиза предпочтительно осуществляют при температуре в пределах 150-220 С, например примерно 180-200 С. Ход реакции может отслеживаться с помощью обычных технологий, например ТСХ, но как правило, она будет занимать 10-20 ч, например 12-18 ч. После завершения реакции соединение формулы (VI) может выделяться с использованием обычных технологий. Соединение формулы (VI) может перетираться. Выход реакции предпочтительно составляет по меньшей мере 40%, более предпочтительно по меньшей мере 45%, еще более предпочтительно 85% и еще более предпочтительно по меньшей мере 90%. Максимальный выход составляет 100%. Чистота соединения формулы (VI) предпочтительно составляет по меньшей мере 90%, еще более предпочтительно по меньшей мере 95%. Максимальная чистота составляет 100%. Чистоту предпочтительно определяют с использованием ВЭЖХ. Соединение формулы (VI) может также кристаллизоваться. Предпочтительные растворители для использования при кристаллизации представляют собой AcCN и МТВЕ. Более предпочтительно соединение формулы (VI) кристаллизуется с помощью C1-4 спирта и/или воды, например этанола и/или смеси этанол/вода. В предпочтительной реакции гидролиза стереохимия каждого из стереоцентров, присутствующих в соединении формулы (V), сохраняется. Предпочтительно соединение формулы (VI), например 19-Sдигидроэторфин, получают в отсутствие или, по существу, в отсутствие (R)-изомера. Предпочтительно присутствует меньше 1 мас.%, более предпочтительно меньше 0,5 мас.%, еще более предпочтительно меньше 0,01 мас.% (R)-изомера. Таким образом, в предпочтительном способе соединение формулы (VI) представляет собой: мой цепью, более предпочтительно С 3-5 алкил, в частности С 3 алкил с прямой цепью (например, нпропил), R2 представляет собой C1-3 алкил с прямой цепью, более предпочтительно C1-2 алкил, например метил, ипредставляет собой (S)-стереоцентр. Предпочтительно, соединение формулы (VI) имеет чистоту по меньшей мере 99%, например, как определяют с помощью ВЭЖХ. В особенно предпочтительном способе соединение формулы (VI) представляет собой Соединения (V) и (VI), описанные выше, могут преобразовываться в их фармацевтически приемлемые соли и производные с помощью технологий, хорошо известных в данной области. Производное, которое иногда получается в малых количествах (например, 5 мас.%), представляет собой 6 гидроксисоединение. Оно образуется, если реакция гидролиза дополнительно гидролизует 6 метоксигруппу. 6-гидроксипроизводное может выделяться посредством перекристаллизации. Предпочтительные фармацевтически приемлемые соли представляют собой такие, которые поддерживают биологическую эффективность и свойства соединений по настоящему изобретению и образуются из соответствующих нетоксичных органических или неорганических кислот. Предпочтительными являются кислотно-аддитивные соли. Репрезентативные примеры солей включают соли, полученные из неорганических кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота,и соли, которые получены из органических кислот, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота, трифторуксусная кислота и тому подобное. Модификация соединения в виде соли представляет собой технологию, хорошо известную химикам, для получения улучшенной физической и химической стабильности, гигроскопичности, текучести и растворимости соединений. Предпочтительные соединения по настоящему изобретению представляют собой соединения формул (VI), (V), (IV) и (III), как описано выше, где R1 предпочтительно представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил с прямой цепью, в частности С 3 алкил с прямой цепью(например, н-пропил). В предпочтительных соединениях формул (VI) и (V) R2 представляет собой C1-3 алкил с прямой цепью, более предпочтительно C1-2 алкил, например метил. В соединениях (VI) и (V) по настоящему изобретению стереоцентр на атоме углерода 19 представляет собой (S). Предпочтительное соединение формулы (VI) представляет собой соединение формулы где R1 и R2 являются такими, как описано выше (например, R1 представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил с прямой цепью, в частности С 3 алкил с прямой цепью (например, н-пропил), R2 представляет собой C1-3 алкил с прямой цепью, более предпочтительно С 1-2 алкил) ипредставляет собой (S)-стереоцентр. Особенно предпочтительное соединение формулы (VI) представляет собой соединение формулы Другие предпочтительные соединения по настоящему изобретению представляют собой соединения, которые являются промежуточными соединениями при получении соединений формулы (VI). Таким образом другие предпочтительные соединения по настоящему изобретению представляют собой соединения формулы (V-S) где R1 и R2 являются такими, как описано выше (например, R1 представляет собой С 2-7 алкил с прямой цепью, более предпочтительно С 3-5 алкил с прямой цепью, в частности С 3 алкил с прямой цепью (например, н-пропил), R2 представляет собой C1-3 алкил с прямой цепью, более предпочтительно С 1-2 алкил) ипредставляет собой (S)-стереоцентр. Особенно предпочтительное соединение формулы (V) представляет собой Другое предпочтительное промежуточное соединение представляет собой соединение формулы Как описано выше, соединения формулы (III), могут быть получены с помощью реакции ДильсаАльдера с соединением формулы (II). Предпочтения для R1 являются такими, как описано выше. Соединения по настоящему изобретению имеют различные применения. Соединения (VI-S) могут использоваться, например, для подтверждения (R)-хиральности известных продуктов дигидроэторфина. Использование соединений по настоящему изобретению таким образом иллюстрируется в примерах,которые следуют ниже. Соединения (III) и (IV) по настоящему изобретению также являются пригодными для использования при получении (R)-дигидроэторфина, который, как известно, имеет полезные фармацевтические свойства. Кроме того, соединения формул (VI-S), (V-S) и (IV), в частности соединения формулы (VI-S), могут включаться в фармацевтические композиции. Таким образом, настоящее изобретение также включает фармацевтические композиции, содержащие соединение по настоящему изобретению, как описано выше(например, соединения формул (VI-S), (V-S) и (IV), в частности, (VI-S и один или несколько фармацевтически приемлемых носителей. Соединения по настоящему изобретению, например, соединения формулы (VI-S), могут присутствовать по отдельности или в сочетании с другим активным ингредиентом в композиции. Фармацевтические композиции по настоящему изобретению могут принимать любые обычные формы. Предпочтительно, однако, композиции по настоящему изобретению приготавливаются в дозированной форме, пригодной для трансдермального введения. Альтернативные предпочтительные композиции по настоящему изобретению приготавливаются в дозированной форме, пригодной для парентерального, например, внутривенного, введения. Под "трансдермальной" доставкой подразумевается введение соединений, описанных выше, на поверхность кожи индивидуума, так что агент проходит через ткани кожи и в кровоток индивидуума. Термин "трансдермальный" предназначается для включения трансмукозального введения, то есть введения соединения на поверхность слизистой (например, сублингвально, буккально, вагинально, ректально) индивидуума, так что оно проходит через ткани слизистой и в кровоток индивидуума. Трансдермальные дозированные формы по настоящему изобретению включают, но, не ограничиваясь этим, лепешки, спреи, аэрозоли, кремы, примочки, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалистам в данной области. Дозированные формы, пригодные для лечения тканей слизистых в ротовой полости, могут приготавливаться в виде полосканий для рта или в виде пероральных гелей. Кроме того, трансдермальные дозированные формы включают пластыри "типа резервуара" или "типа матрицы", которые могут наноситься на кожу и носиться в течение конкретного периода времени, чтобы позволить проникновение желаемого количества активных ингредиентов. Соответствующие наполнители (например, носители и разбавители) и другие материалы, которые могут использоваться для получения трансдермальных дозированных форм, охватываемых настоящим изобретением, хорошо известны специалистам в области фармации и зависят от конкретных тканей, на которые будет наноситься данная фармацевтическая композиция или дозированная форма. Имея это в виду, типичные наполнители включают, но, не ограничиваясь этим, воду, ацетон, этанол, этиленгликоль,пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, для получения примочек, кремов, эмульсий, гелей или мазей, которые являются нетоксичными и фармацевтически приемлемыми. Увлажнители или влагоудерживающие агенты также могут добавляться к фармацевтическим композициям и дозированным формам, если это желательно. Примеры таких дополнительных ингредиентов хорошо известны в данной области. В зависимости от конкретной ткани, которую нужно лечить, дополнительные компоненты могут использоваться до или после лечения с помощью соединений по настоящему изобретению или одновременно с ним. Например, усилители проницаемости могут использоваться, чтобы помочь при доставке соединения к тканям. Соответствующие усилители проницаемости включают, но, не ограничиваясь этим: ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; сорта Kollidon (Povidone, Polyvidone); мочевину и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как Tween 80 (полисорбат 80) и Span 60 (сорбитан моностеарат). рН фармацевтической композиции или дозированной формы, или тканей, на которые наносится фармацевтическая композиция или дозированная форма, может также регулироваться для улучшения доставки одного или нескольких активных ингредиентов. Подобным же образом, полярность носителя растворителя, его ионная сила или тоничность могут регулироваться для улучшения доставки. Соединения, такие как стеараты, могут также добавляться к фармацевтическим композициям или дозированным формам для преимущественного изменения гидрофильности или липофильности одного или нескольких активных ингредиентов с целью улучшения доставки. В этой связи стеараты могут служить в качестве липидных носителей для препарата, в качестве эмульсифицирующего агента или поверхностноактивного вещества и в качестве агента для улучшения доставки или улучшения проницаемости. Различные соли, гидраты или сольваты активных ингредиентов могут использоваться для дополнительной регулировки свойств полученной композиции. Пероральные гели для сублингвального введения соединений по настоящему изобретению (например, соединений формул (VI-S могут приготавливаться посредством смешивания соединения с одним или несколькими соответствующими наполнителями, включая ароматизирующие агенты. Суппозитории для ректального введения соединений по настоящему изобретению (например, соединений формул (VIS могут приготавливаться посредством смешивания соединения с соответствующим наполнителем,таким как масло какао, салицилаты и полиэтиленгликоли. Препараты для вагинального введения могут находиться в форме препарата пессария, тампона, крема, геля, пасты, пены или спрея, содержащего, в дополнение к активному ингредиенту, такие пригодные для использования носители, как известно в данной области. Фармацевтическая композиция для местного введения, содержащая соединения по настоящему изобретению, может находиться в форме кремов, мазей, линиментов, примочек, эмульсий, суспензий,гелей, растворов, паст, порошков, спреев и капель, пригодных для введения на кожу, в глаза, уши или нос. Местное введение может также включать в себя трансдермальное введение с помощью таких средств, как трансдермальные пластыри. Доставка в этой форме является особенно предпочтительной. Под внутривенным введением подразумевается введение соединений, описанных выше, в форме жидкости непосредственно в вену. Дозированные формы, пригодные для внутривенного введения, включают, но, не ограничиваясь этим, растворы, эмульсии и суспензии. Таким образом настоящее изобретение предусматривает соединение, как определено выше, и в частности, соединения формулы (VI-S), для использования в качестве анальгетика, где указанное соединение вводится внутривенно. Как правило, композиции для внутривенного введения содержат стерильный изотонический водный буферный раствор. Когда это необходимо, композиции могут также содержать солюбилизирующий агент. Ингредиенты могут доставляться либо по отдельности, либо смешиваться вместе в стандартной единичной дозированной форме. Например, ингредиенты могут доставляться по отдельности в виде сухого лиофилизированного порошка или концентрата, не содержащего воды, в герметично закрытом контейнере, например, в ампуле или саше, показывающем количество активного агента, и в виде ампулы стерильной воды или буферного раствора для смешивания перед введением. Альтернативная композиция может доставляться в предварительно смешанной форме. Соединения по настоящему изобретению (например, соединения формул (VI-S могут использоваться в медицине, например, для получения анальгезии. Необходимые дозы соединений будут зависеть,например, от субъекта, которого нужно лечить, от тяжести боли, которую нужно лечить, от используемого соединения, от способа введения и тому подобное, но будет легко определена специалистами в данной области. Таким образом, с точки зрения другого аспекта, настоящее изобретение предусматривает способ лечения субъекта (например, млекопитающего), нуждающегося в ослаблении боли, включающий введе-8 022210 ние указанному субъекту терапевтически эффективного количества соединения, как описано выше (например, соединения формулы (VI-S. Также неожиданно обнаружено, что при стандартных исследованиях тошноты и рвоты на хорьках, ни R-DHE, ни S-DHE не вызывают тошноты или рвоты в диапазонах дозировок, сходных с теми, которые используют в исследованиях, описанных ниже. Соединения по настоящему изобретению являются особенно пригодными при лечении ноцицептивной и нейропатической боли. Настоящее изобретение будет теперь описываться со ссылками на следующие далее неограничивающие примеры и фигуры, где соединения (R) описаны в качестве ссылочных. Фиг. 1 показывает спектры 1H-HMP для (R)- и (S)-19-пропилдигидротевинола; фиг. 2 и 3 показывают структуру, полученную с помощью рентгеноструктурного анализа, (R)-19 пропилдигидротевинола; фиг. 4 и 5 - структуру, полученную с помощью рентгеноструктурного анализа, (S)-19-пропилдигидротевинола; фиг. 6 и 7 - структуру, полученную с помощью рентгеноструктурного анализа, (R)-дигидроэторфина; фиг. 8 и 9 - структуру, полученную с помощью рентгеноструктурного анализа, (S)-дигидроэторфина; фиг. 10 показывает стехиометрию всех хиральных атомов углерода, присутствующих в (R)- и (S)дигидроэторфине; фиг. 11-13 показывают кривые зависимости отклика от времени после внутривенного введения (R)или (S)-DHE или эталонного или сравнительного вещества; фиг. 14-17 - кривые доза-отклик после внутривенного введения (R)- или (S)-DHE или эталонного или сравнительного вещества; фиг. 18-23 - воздействия внутривенного введения (R)- или (S)-DHE или эталонного или сравнительного вещества в модели с лигированием спинального нерва для нейропатической боли. Примеры Получение (S)-дигидроэторфина. Стадия 1. Реакция Дильса-Альдера. Схема реакции Способ. Тебаин обрабатывают гексен-3-оном в растворителе, как указано в таблице ниже, и нагревают с обратным холодильником. После прохождения соответствующего количества времени (в течение ночи),реакционную смесь охлаждают и смесь выпаривают. Полученное масло растворяют в изопропилацетате(IPAc) и промывают 1 М раствором хлористо-водородной кислоты. Кислотные слои объединяют и промывают IPAc, затем подщелачивают раствором бикарбоната натрия и, наконец, экстрагируют дихлорметаном (DCM). Слой DCM выпаривают, с получением твердого продукта желтого цвета. Таблица 1. Обобщенные результаты экспериментов, стадия 1 При использовании этанола в качестве растворителя конечный выход выделенного продукта в виде твердого продукта светло-желтого цвета после извлечения составляет 70%, и качество согласно 1 Н-ЯМР выглядит очень хорошим. Стадия 2. Гидрирование. Способ. 19-Пропилтевинон (4,1 г), промежуточное соединение стадии 1, гидрируют в этаноле (60 мл) с использованием палладия на угле (1 г; 10%) при давлении водорода до 50 фунт/кв. дюйм (3,1 кг/кв. см). Температуру емкости поддерживают при приблизительно 50 С и давление поддерживают при 50 фунт/кв. дюйм (3,1 кг/кв. см) до тех пор, пока не будет отмечено отсутствие дальнейшего потребления водорода. Катализатор фильтруют и растворитель удаляют посредством отгонки в вакууме. Выход выделенного продукта в общем составляет 91%, что дает 3,8 г продукта. Таблица 2. Обобщенные результаты экспериментов, стадия 2 Стадия 3. Добавление Гриньяра Схема реакции Способ. 19-Пропилдигидротевинон (продукт стадии 2) растворяют в простом диэтиловом эфире (35 об.). К этому раствору добавляют метилмагнийбромид (92,6 моль, экв.) в течение 5 мин при 20-25 С (небольшая экзотермичность). Затем полученную смесь нагревают до внутренней температуры приблизительно 40 С в течение приблизительно 2 ч, перед охлаждением и гашением раствором хлорида аммония. Смесь экстрагируют 2-метил ТГФ и органические слои выпаривают в вакууме с получением вязкого масла. Таблица 3. Обобщенные результаты экспериментов, стадия 3 Единственный продукт добавления Гриньяра представляет собой (S)-энантиомер. (R)-энантиомера не обнаруживается. Стадия 4. Кристаллизация (R)- и (S)-19-пропилдигидротевинола. Для получения монокристалла высокого качества для рентгеноструктурного анализа осуществляют ряд экспериментов во множестве растворителей для определения наилучшей системы растворителей для роста монокристалла 19-пропилдигидротевинола. Результаты экспериментов кратко изложены в табл. 4 ниже. (R)-энантиомер получают с использованием альтернативного способа. Как правило, используемый способ кристаллизации представляет собой следующее: малое количество твердого 19-пропилдигидротевинола (полученного на стадии 3) растворяют в количестве растворителя, чуть превышающем минимальное. Раствору позволяют постоять в течение до 3-4 дней и растворитель удаляют посредством фильтрования или декантирования для выделения монокристаллов. Спектры 1 Н-ЯМР для каждого из диастереомеров показаны на фиг. 1. Стадия 5. Гидролиз (S)-19-пропилдигидротевинола. Схема реакции Способ. (S)-19-Пропилдигидротевинол (стадии 3) растворяют в диэтиленгликоле (17 об.) и обрабатывают гидроксидом калия (приблизительно 20 экв.), и нагревают до приблизительно 195 С в течение 12-18 ч. По прохождении этого времени реакционную смесь охлаждают до комнатной температуры и гасят водой (40 об.). Полученный в результате раствор подкисляют до рН 9-10 с использованием твердого хлорида аммония и смесь экстрагируют DCM (350 об.). Объединенные органические экстракты выпаривают в вакууме до получения сырого масла (чистота приблизительно 40%). Чистоту повышают с помощью многократных перетираний в метаноле до тех пор, пока не образуется и не будет выделен с хорошей чистотой (95%) твердый продукт желтого цвета. Продукт перекристаллизуют из нескольких растворителей и кристаллы получают из ацетонитрила. Они используются для исследований с помощью рентгеноструктурного анализа.(R)-энантиомер получают с использованием аналогичной реакции. Исследования с помощью рентгеноструктурного анализа. Все эксперименты по рентгеноструктурному анализу осуществляют на дифрактометре для монокристаллов Oxford Xcalibur или на дифрактометре Nonius Kappa. Оба прибора используют источники рентгеновских лучей молибдена К альфа и детекторы на основе CCD (цифровых камер).(R)- и (S)-19-пропилдигидротевинол. Несколько загрузок как (R)-, так и (S)-19-пропилдигидротевинола направляются для рентгеноструктурного анализа. Структуры, полученные с помощью рентгеноструктурного анализа, показаны на фиг. 2-5. Фиг. 2 и 3 показывают структуру, полученную с помощью рентгеноструктурного анализа (R)-19 пропилдигидротевинола. Из рентгеноструктурного анализа можно четко увидеть, что он имеет (R)конфигурацию на атоме углерода 19. Это может быть приписано хиральному простому метиловому эфиру, который сохраняет (R)-конфигурацию от исходного материала тебаина. Дополнительно на фиг. 3, где показаны атомы водорода, можно увидеть, что водород в положении 7 находится по ту же сторону, что и атом водорода в положении 5 (рядом с фурановым кольцом), давая(R)-конфигурацию. Таким образом, все хиральные атомы углерода теперь приписаны и изображены на фиг. 10. Таблица 6. Другая информация об (R)-19-пропилдигидротевиноле Фиг. 4 и 5 показывают структуру, полученную с помощью рентгеноструктурного анализа, (S)-19 пропилдигидротевинола. На фиг. 4 можно четко увидеть, что он имеет стереохимию (S)-конфигурации на атоме углерода 19,противоположную по отношению к кристаллу, показанному на фиг. 3. Это может быть приписано хиральному простому метиловому эфиру, который сохраняет (R)-конфигурацию от исходного материала тебаина. Опять же, атом водорода на атоме углерода в положении 7 (показан на фиг. 5) показывает, что конфигурация на этом атоме углерода также представляет собой (R), как и для первого диастереоизомера. По этой причине авторы могут теперь с уверенностью заключить, что единственное различие между 2 соединениями согласно рентгеноструктурному анализу заключается в стереоконфигурации на атоме углерода 19. Таблица 7. Другая информация об (S)-19-пропилдигидротевиноле(R)- и (S)-дигидроэторфин. Структуры, полученные с помощью рентгеноструктурного анализа, показаны на фиг. 6-9. Фиг. 6 и 7 показывают структуру, полученную с помощью рентгеноструктурного анализа, для (R)дигидроэторфина. На этих фигурах можно четко увидеть, что он имеет (R)-конфигурацию на атоме углерода 19. Это может быть приписано хиральному простому метиловому эфиру, который сохраняет (R)конфигурацию от начального исходного материала тебаина. Таблица 8. Другая информация об (R)-дигидроэторфине Фиг. 8 и 9 показывают структуру, полученную с помощью рентгеноструктурного анализа, для (S)дигидроэторфина. На этих фигурах можно четко видеть, что он имеет (S)-конфигурацию на атоме углерода 19. Это может быть приписано хиральному простому метиловому эфиру, который сохраняет (R)конфигурацию от начального исходного материала, тебаина. В дополнение к этому атом водорода на атоме углерода в положении 7 (показано на фиг. 9) показывает, что конфигурация на этом атоме углерода также представляет собой (R), как и для первого диастереоизомера. По этой причине можно заключить, что единственное различие между 2 соединениями согласно рентгеноструктурному анализу представляет собой стереоконфигурацию на атоме углерода 19. Таблица 9. Другая информация об (S)-дигидроэторфине Оптимизация способа Используются следующие способы и оборудование. Способ 38 ХВ и UFC-LC-MUN-1 представляют собой процедуры градиентной ВЭЖХ с обращенной фазой, с использованием колонки Xbridge C18 и подвижной фазы, состоящей из ацетонитрила и 0,01 М ацетата аммония, рН 9,2. ЯМР осуществляют с использованием спектрометра Bruker Avance 400 МГц. МС осуществляют с использованием масс-спектрометра ZMD Micromass. ЖХ осуществляют с использованием системы ВЭЖХ Agilent 1100. Стадия 1. Реакция Дильса-Альдера Используемый начальный способ является таким, как описано выше. Главная примесь идентифицируется как 7-изомер, показанный ниже: 20 этилтевинон (2). Впоследствии обнаружено, что как чистота, так и извлечение 20 этилтевинона могут быть улучшены посредством уменьшения загрузки 1-гексен-3-она от 2,8 до 1,8 эквивалента, таблица 10. Дополнительное улучшение достигается посредством использования 1,5 эквивалента 1-гексен-3-она (добавляют в 2 порции по 1,4 экв. и 0,1 экв.) и, при завершении реакции, удаления 0,5 об. растворителя с помощью отгонки. При охлаждении полученного раствора продукт осаждают в виде твердого продукта (состаривается в течение 1 часа) и отфильтровывается. Процедура В 1-л (3-горлую) колбу, соединенную с подвешенной сверху мешалкой и обратным холодильником,загружают следующее, тебаин (0,32 М, 100 г, 1 экв.), EtOH (250 мл) и 1-гексен-3-он (90%, 0,45 М, 58 мл,1,4 экв.). Смесь нагревают с обратным холодильником в течение 13 ч и анализируют с помощью 1 Н-ЯМР и обнаруживают, что она содержит исходный материал (приблизительно 4,5 мол.%). Добавляют дополнительно 0,1 экв. 1-гексен-3-она и смесь нагревают в течение дополнительных 2 ч, перед перемешиванием в течение ночи при комнатной температуре. Анализ показывает исходный материал (приблизительно(приблизительно 65 мл) удаляют в вакууме при 50 С, и полученный осажденный твердый продукт перемешивают при 5 С в течение 1 ч перед фильтрованием. Твердый продукт промывают охлажденным на льду EtOH (420 мл) и собирают сухим на фильтре в течение приблизительно 1,5 ч. Твердый продукт белого цвета (105,4 г, 80%). Таблица 10 Аналитические методы и проверки в ходе способа (IPC). Для IPC используют 1H-ЯМР (400 МГц) плюс метод ВЭЖХ 38 ХВ во время работы в лаборатории. Реакцию считают завершенной, когда остается 5% молярных исходных материалов согласно 1 НЯМР на основании сигналов при 5 5,05 м.д. и 5,3 м.д. (CDCl3). Для подтверждения чистоты и для работы ЖХ-МС используют метод UFC-LC-MUN-1 в аналитической лаборатории. ТСХ (5% МеОН/95% DCM) с окраской йодоплатинатом: Rf=0,25, тебаин, Rf=0,66, (7)-20 этилтевинон. Обобщенные аналитические результатыH-ЯМР (CDCl3; 400 МГц);= 0,80 (3 Н, т), 1,4 (1 Н, м), 1,6 (3 Н, секст.), 1,9 (1 Н, д), 2,0 (1 Н, ушир.),2,4-2,6 (8 Н, м), 2,9 (2 Н, ушир.), 3,35 (2 Н, д), 3,6 (3 Н, с), 3,85 (3 Н, с), 4,6 (1 Н, с), 5,6 (1 Н, д), 6,0 (1 Н, д),6,55 (1 Н, д), 6,7 (1 Н, д). 13 С-ЯМР (CDCl3; 75 МГц);= 13,71, 16,89, 22,49, 30,25, 43,26, 43,51, 45,57, 45,72, 47,40, 49,94,53,78, 56,68, 60,06, 81,52, 95,84, 113,61, 119,36, 125,89, 134,07, 135,53, 141,87, 148,07. МС; [М+Н]+=410,3. ЖХ; чистота 99,5%. ТСХ; 5:95; MeOH:DCM; rf=0,66 для одного пятна. Преимущества оптимизированного способа Увеличение выхода до 80%. Количество 1-гексен-3-она понижается до 1,5 эквивалента без уменьшения преобразования или выхода. Уменьшение количества эквивалентов 1-гексен-3-она делает возможным улучшение выделения(прямая кристаллизация из реакционного растворителя), что дает материал очень высокой чистоты. Объемная эффективность является очень высокой (максимум приблизительно 4 об. в общем). Чистота улучшается до 99% (согласно ВЭЖХ).IPC показывает завершение при преобразовании 97% согласно 1H-ЯМР (3% тебаина). Стадия 2. Гидрирование Результаты технологической работы для стадии гидрирования показаны в табл. 11 ниже. Реакцию сжимают как с точки зрения нагрузки катализатора, так и температуры реакции. В дополнение к этому посредством уменьшения объема реакции от 17 до 12 об. улучшается как качество продукта, так и выделение продукта. Интересно, что как исходный материал, так и продукт являются термически стабильными до приблизительно 80 С в течение 1-2 ч, что делает возможной более высокой температуру реакции, увеличивая растворимость, как исходного материала, так и продукта, во время реакции. Обнаружено, что в этом случае растворимость является ключом к хорошей реакционной способности и использованию более высоких температур во время масштабирования для достижения завершения реакции. При конечном масштабировании реакции температура повышается вне "нормального" диапазона во время начального нагрева реакционной емкости, и наблюдается быстрая реакция (потребление водорода). При понижении температуры до 55 С реакция значительно замедляется, и только при дополнительном добавлении катализатора и при увеличении температуры до приблизительно 65 С реакция достигает завершения. Выделение продукта упрощается посредством нагрева реакционной смеси до 77 С, что позволяет получение температуры чуть ниже температуры дефлегмации, а затем отфильтровывания катализатора из реакционной смеси. Полученный раствор сначала уменьшается в объеме посредством отгонки, однако, обнаружено, что раствор мог бы охлаждаться на ледяной бане, и материал высокой чистоты выделяется посредством фильтрования кристаллизовавшегося твердого продукта с хорошим выходом (72%). Процедура 20-этилтевинон (0,244 М, 100 г) загружают в 2-л аппарат Парра для гидрирования. 10% Pd/C (влажность 50%, 10 г) суспендируют в EtOH (200 мл) и загружают в емкость для гидрирования. EtOH (1 л) загружают в емкость, емкость герметизируют и заполняют инертным газом аргоном (4). Емкость повторно заполняют водородом до давления 50 фунт/кв. дюйм (3,1 кг/кв. см) (2) и, наконец, оставляют при давлении 50 фунт/кв. дюйм (3,1 кг/кв. см). Температуру устанавливают при 35 С. Внутреннюю температуру быстро доводят до 82 С, а затем дают возможность для охлаждения обратно до комнатной температуры в течение ночи (экзотермическое выделение тепла в емкости). Емкость повторно заполняют Н 2,отбирают образцы и анализируют их с помощью ЖХ, и обнаруживают, что реакция не завершается. Емкость нагревают до внутренней температуры 55-65 С и ход реакции отслеживают с помощью ЖХ - давление водорода поддерживают при 50 фунт/кв. дюйм (3,1 кг/кв. см) с помощью периодических повторных наполнений. Через 24 ч осуществляют дополнительную загрузку катализатора (5 г), и реакция продолжается. По прохождении дополнительных 16 ч реакция завершается согласно ЖХ и 1 Н-ЯМР. Внутреннюю температуру повышают до 68 С и смесь переносят в вакууме в 3-л емкости RBF. Аппарат Парра промывают горячим EtOH (200 мл) и промывку переносят в RBF. Смесь нагревают до 77 С перед фильтрованием (бумага GF/F). Слой катализатора промывают горячим EtOH (1300 мл) и фильтрату позволяют охлаждаться до комнатной температуры. Фильтрат охлаждается на ледяной бане в течение 50 мин перед фильтрованием. Собранный твердый продукт промывают охлажденным на льду EtOH (1100 мл),гептаном (1300 мл) и собирают сухим в течение 1,5 ч. Твердый продукт белого цвета (72 г, 72%). Таблица 11 Аналитические методы и проверки в ходе способа. Используют 1H-ЯМР (400 МГц) для IPC плюс метод ВЭЖХ 38 ХВ во время работы в лаборатории. Ход реакции отслеживают с помощью анализа ЖХ: реакция, осуществляемая в масштабе 100 г, показывает отсутствие 20-этилтевинона и 96% 20-этилдигидротевинона. Для подтверждения чистоты и для работы метода ЖХ-МС продукт реакции в масштабе 100 г используют в аналитической лаборатории. Аналитические результатыH-ЯМР (CDCl3, 400 МГц);= 0,75 (1 Н, т, т), 0,9 (1 Н, т), 1,35 (1 Н, т, д), 1,5-1,75 (7 Н, м), 2,1 (1 Н, т,д), 2,3 (5 Н, м), 2,5 (2 Н, кв.), 2,6-2,7 (3 Н, м), 3,0 (1 Н, кв., т), 3,1 (1 Н, д), 3,5 (3 Н, с), 3,9 (3 Н, с), 4,5 (1 Н, д),6,6 (1 Н, д), 6,7 (1 Н, д). 13 С-ЯМР (CDCl3, 75 МГц); =13,73, 16,99, 17,31, 21,98, 28,67, 30,70, 35,17, 35,66, 43,51, 45,24, 45,78,48,28, 48,91, 52,26, 56,76, 61,35, 94,96, 114,01, 119,16, 128,71, 132,47, 141,76, 146,80. ЖХ; чистота 99%. Остаточный растворитель (согласно 1 Н-ЯМР); остаточного этанола нет. Преимущества оптимизированного способа Уменьшение объема реакции от 17 до 12 об. позволяет прямую кристаллизацию продукта. Продукт выделяется с выходом 72%, с чистотой 99%. Температура примерно 65 С, видимо, является оптимальной для растворимости и реакционной способности. Сушка твердого продукта на фильтровальном слое и промывка гептаном удаляет следы этанола до приемлемого уровня, готового для следующей стадии. Стадии 3 и 4. Реакция Гриньяра и кристаллизация 1 Результаты работы приводятся в табл. 12, ниже. Исследуют различные эфирные растворители, при этом простой диэтиловый эфир дает материал, наилучший по качеству, хотя разница между простым диэтиловым эфиром и МТВЕ, как обнаружено, является относительно небольшой. Как правило, сырой материал, полученный при реакции Гриньяра, содержит две главных примеси(приблизительно 10% каждой, ЖХ-МС). Обе примеси имеют одинаковую массу ([М+Н]+=428,4) в качестве продукта). Одна из двух примесей экспериментально определяется как составляющий изомер, который возникает в результате реакции закрывания кольца и открывания кольца при избытке реагента Гриньяра на 20-этилдигидротевиноне. Вторая примесь, которая имеет время удерживания (ЖХ-МС), сходное с продуктом, как предполагается, является диастереоизомером (R)-19-пропилдигидротевинола. Обе примеси эффективно удаляются с помощью перекристаллизации из метанола. Роль температуры реакции исследуют с помощью простого диэтилового эфира, и обнаружено, что профили реакции, с точки зрения как хода реакции, так и примесей (анализ ЖХ) сравнимы при комнатной температуре и при температуре дефлегмации. Таким образом, наблюдаемые различия в чистоте, отмеченные в реакциях, как считается, возникают из различий в процедурах очистки (перекристаллизация с использованием масляной бани и нагрев с обратным холодильником с магнитной мешалкой, или перетирание посредством вращения в роторном испарителе с метанолом). Метилмагнийодид также используют, и он дает результаты, сравнимые с бромидом. Процедура 20-Этилдигидротевинон (0,073 М, 30 г) растворяют (мутный раствор) в безводном простом диэтиловом эфире (1050 мл; 35 об.). Метилмагнийбромид (0,189 М, 63 мл) добавляют по каплям в течение 1 ч,поддерживая внутреннюю температуру ниже 28 С. Полученную суспензию белого цвета нагревают с обратным холодильником в течение 5 ч, охлаждают до комнатной температуры и перемешивают в атмосфере азота в течение ночи. Аликвоту (приблизительно 0,3 мл) удаляют и гасят насыщенным NH4Cl(приблизительно 1,0 мл), и анализируют с помощью ЖХ (верхний слой от аликвоты разбавляют MeCN(приблизительно 1 мл). Реакцию продолжают до тех пор, пока уровень исходных материалов не станет меньше 5%. Реакцию гасят посредством добавления насыщенного раствора NH4Cl (138 мл) к реакционной смеси, поддерживая внутреннюю температуру ниже 30 С. Фазы смеси разделяют, водную фазу экстрагируют простым диэтиловым эфиром (1200 мл), а объединенную органическую фазу сушат (MgSO4). Раствор концентрируют в вакууме, с получением вязкого масла (33,4 г). Добавляют МеОН (100 мл) и смесь нагревают до температуры бани 60 С, перед охлаждением до комнатной температуры. Твердый продукт фильтруют, промывают охлажденным на льду МеОН (325 мл), промывают гептаном (125 мл) и сухой продукт собирают. Твердый продукт белого цвета (21 г, 68%). Таблица 12 Аналитические методы и проверки в ходе способа. Используют 1 Н-ЯМР (400 МГц) плюс метод ВЭЖХ 38 ХВ во время лабораторной работы. Реакцию отслеживают с помощью анализа ЖХ и гасят аликвоту реакции (насыщенный раствор NH4Cl): 2,0% 20 этилдигидротевинола и 71% (S)-19-пропилдигидротевинола. Для подтверждения чистоты и для работы ЖХ-МС используют метод UFC-LC-MUN-1 в аналитической лаборатории.(1 Н, с), 4,7 (1 Н, с), 6,5 (1 Н, д), 6,7 (1 Н, д). 13 С-ЯМР (CDCl3, 75 МГц);= 15,12, 16,96, 18,04, 21,91, 25,55, 29,88, 31,99, 35,53, 36,05, 38,97,43,53, 45,17, 46,19, 49,09, 50,77, 52,72, 56,93, 61,32, 80,34, 97,05, 114,21, 119,06, 128,84, 132,48, 141,63,146,97. ЖХ; чистота 99%. Преимущества оптимизированного способа Реакция работает в некотором диапазоне эфирных растворителей, хотя простой диэтиловый эфир,видимо, дает самый чистый сырой продукт. Материал превосходной чистоты получают после перекристаллизации из метанола. Стадия 5. Гидролиз Реакция осуществляется без значительных изменений (таблица 13). Перекристаллизацию осуществляют из смеси этанол/вода, а затем из этанола. Процедура(S)-DHE (10 г) добавляют к EtOH (60 мл) и нагревают с обратным холодильником до растворения. Вода (32 мл) образует мутный раствор, которому позволяют охлаждаться до комнатной температуры в течение приблизительно 2 ч. Твердый продукт белого цвета собирают с помощью фильтрования. (4,26 г,извлечение 42 мас.%). Чистота 98%. Общий выход равен 45 мас.%. Таблица 13 Аналитические методы и проверки в ходе способа. Для IPC во время работы в лаборатории используют 1 Н-ЯМР (400 МГц) плюс метод ВЭЖХ 38 ХВ. Реакцию отслеживают с помощью анализа ЖХ и затем гасят, когда не остается (S)-19 пропилдигидротевинола. Реакция завершается на 92%. Для подтверждения чистоты и для работы ЖХ-МС используют метод UFC-LC-MUN-1 в аналитической лаборатории. Аналитические результаты(1 Н, с), 6,0 (1 Н, ушир.), 6,4 (1 Н, д), 6,7 (1 Н, д). 13 С-ЯМР (CDCl3, 75 МГц);= 15,10, 16,95, 18,00, 21,99, 25,37, 29,82, 31,96, 35,43, 36,15, 38,93,43,51, 45,22, 46,50, 49,04, 52,72, 61,33, 80,42, 97,38, 116,61, 119,46, 127,92, 132,07, 137,56, 145,67. ЖХ; чистота 98,8%. Хиральная ЖХ; 99,44% (S)-DHE, 0,554 (R)-DHE. Преимущества оптимизированного способа Значительное улучшение чистоты сырого материала, полученного при реакции, до 95%. Устранение перетирания с метанолом - материал перекристаллизуется из смеси этанол/вода и из Увеличение содержания воды до приблизительно 35% (общий объем 9,2 об.) приводит к образованию твердого продукта белого цвета. Дополнительные перекристаллизации из этанола и смеси этанол/вода улучшают чистоту материала (таблица 14). Процедура(1) (S)-DHE (3,0 г) добавляют к EtOH (10 мл) и суспензию нагревают с обратным холодильником, с получением раствора оранжевого цвета. Раствору позволяют охлаждаться до комнатной температуры в течение 16 ч. Полученный твердый продукт белого цвета собирают посредством фильтрования (2,1 г, 70 мас.%). Чистота 99%.(2) (S)-DHE (1,8 г) добавляют к EtOH (7 мл) и смесь нагревают с обратным холодильником до получения раствора. Добавляют воду (2 мл) и мутному раствору позволяют охлаждаться до комнатной температуры в течение 2 ч. Полученный твердый продукт белого цвета собирают посредством фильтрования (1,29 г, 72 мас.%). Таблица 14 Аналитические методы и проверки в ходе способа Для IPC во время лабораторной работы используют 1 Н-ЯМР (400 МГц) плюс метод ВЭЖХ 38 ХВ. Для подтверждения чистоты и для работ ЖХ-МС используют метод UFC-LC-MUN-1 в аналитической лаборатории. Для подтверждения хиральной чистоты используют метод UFC-LC-MUN-2 в аналитической лаборатории. Аналитические результаты Преимущества оптимизированного способа Перекристаллизация из смеси этанол/вода или из этанола дает материал с хорошей общей чистотой и 0,02% (R)-DHE. Использование (R)- и (S)-дигидроэторфина при лечении боли. Воздействие (R)- и (S)-дигидроэторфина в тесте отдергивания хвоста для ноцицепции у крыс. Используемая модель для исследования хорошо известна в данной области и описывается в J.Pharmacol Exp Ther, 1941, 72, 74-79 (D' Amour et al, A method for determining loss of pain sensation). Целью этого исследования является оценка потенциальных анальгетических воздействий R- и Sизомеров дигидроэторфина (R-DHE и S-DHE), при дозах 0,1, 0,3 и 0,5 мкг/кг (R-DHE) и 3, 10 и 30 мкг/кг(S-DHE), в тесте отдергивания хвоста, разработанном для обнаружения воздействий на ноцицепцию у крыс. В качестве эталонного вещества используют морфин гидрохлорид, а в качестве сравнительного вещества используют фентанил цитрат. Исследуемые вещества и материалы Исследуемые вещества, эталонное вещество и носитель. Исследуемое вещество: дигидроэторфин (R-DHE бесцветная жидкость, используемая в виде свободного основания) и дигидроэторфин (S-DHE жидкость; используемая в виде свободного основания). Носитель для исследуемого вещества: цитратный буфер (моногидрат лимонной кислоты : цитрат натрия : хлорид натрия : вода для инфузии при отношении 0,03:0,10:0,86:90,01 (г:г:г:мл [моногидрат лимонной кислоты (порошок белого цвета, Sigma, UK), цитрат натрия (Sigma, UK), хлорид натрия (твердый продукт белого цвета; Merck), стерильная вода для инфузии (прозрачная жидкость; BaxterHealthcare, UK)]. Эталонное вещество: морфин гидрохлорид (порошок белого цвета; Macfarlan Smith, Edinburgh, UK). Сравнительное вещество: фентанил цитрат (порошок белого цвета; Sigma, UK). Хранение исследуемого, эталонного и сравнительного вещества Исследуемые вещества хранят при комнатной температуре, защищают от света, а эталонное и сравнительное вещества хранят при комнатной температуре. Способ введения и уровни дозировки Способ введения R- и S-изомерных форм DHE и носителя представляет собой внутривенное введение. Возможный способ введения людям представляет собой внутривенное введение. Дозы R-DHE составляют 0,1, 0,3 и 0,5 мкг/кг. Дозы S-DHE составляют 3, 10 и 30 мкг/кг. Доза морфина составляют 5 мг/кг. Способ введения морфина представляет собой внутривенное введение. Дозы фентанила составляют 0,5, 2 и 6 мкг/кг. Способ введения фентанила представляет собой внутривенное введение. Животные Вид: Крысы. Линия: Sprague-Dawley. Пол: мужской. Количество животных: для исследований предназначаются 111 животных; остальные 9 животных возвращают на ферму. Возрастной диапазон: 9-11 недель (на основании средней массы тела). Диапазон масс: 198-258 г. Акклиматизация: 6 дней после доставки, перед началом исследований. Источник: Harlan UK Ltd. Идентификация и случайное распределение животных. Каждому животному произвольным образом присваивается собственный идентификационный номер, который появляется на карточках с данными и на карточках на клетках. Животных идентифицируют с помощью водостойкой маркировки на хвосте. Здоровье животных и уход за ними Все исследования осуществляют в соответствии с указаниями Animals (Scientific Procedures) Act 1986, с UK Home Office Guidance относительно применения акта и со всеми применимыми Codes of Practice относительно ухода и содержания лабораторных животных. Процедура, применяемая в настоящих исследованиях, покрывается процедурой номер 213N, которая имеет умеренный предел тяжести. Содержание и окружающая среда Животных содержат группами по 5 в клетках с твердым дном, заполненных опилками. Во время акклиматизации комнаты и клетки чистят через регулярные интервалы для поддержания гигиены. Комнаты освещают с помощью набора флуоресцентных ламп, с получением 12-часового цикла свет-темнотаAct 1986. Воздух в комнатах кондиционируется, и температура воздуха и относительная влажность измеряются. Во время периода акклиматизации поддерживается комнатная температура (в пределах от 19 до 22 С) и уровни влажности находятся в пределах от 22 до 44%. Во время процедуры поддерживается комнатная температура (в пределах от 20 до 21 С) и уровни влажности находятся в пределах от 22 до 26%. Диета и вода Диета RM1(E) SQC (Special Diets Services, Witham, UK) и водопроводная вода из водопровода предлагаются по потребности. Каждую загрузку диеты доставляют с прилагающимся сертификатом анализа, детализирующим питательную композицию и уровни указанных загрязнений (например, тяжелых металлов, афлатоксина и инсектицидов). Воду периодически анализируют на примеси и загрязнения. Критерии для приемлемых уровней загрязнений в исходных материалах диеты и поставляемой воде находятся в пределах аналитических спецификаций, установленных производителем диеты и службой анализов воды соответственно. Состояние здоровья Животных проверяют по прибытии и перед исследованием; все животные здоровы и считаются пригодными для экспериментального использования. Постановка эксперимента Приготовление исследуемых, эталонных и сравнительных веществ. Цитратный буфер приготавливают посредством точного взвешивания соответствующих количеств каждого компонента и растворения их в стерильной воде для инфузии. Когда компоненты полностью растворяются, измеряют осмоляльность и рН раствора. Носитель считается приемлемым, поскольку рН составляет 5,01, что находится в диапазоне рН от 4,8 до 5,2, и осмоляльность составляет 96 мОсмол/кг, в пределах от 280 до 300 мОсмол/кг. Наконец, носитель фильтруют через модуль Stericup Millex GV при асептических условиях и хранят при 2-8 С до использования. Исследуемые вещества DHE (R- и S-изомеры) приготавливают для дозирования как растворы в цитратном буфере. Желаемые концетрации (0,02, 0,06 и 0,10 мкг/мл для R-DHE, и 0,6, 2 и 6 мкг/мл для SDHE) для дозирования получают посредством последовательного разбавления соответствующих исходных растворов, которые получают при приблизительной концентрации 20 мкг/мл. Исходные растворы пропускают через узел стерильного фильтрования 0,22 мкм Durapore Millex GV в стеклянные флаконы и каждое последующее разбавление стерильным цитратным буфером осуществляют с помощью стерильных манипуляций. Препараты приготавливают в пределах известного периода стабильности для R-DHE и хранят в холодильнике, приблизительно при 4 С, до тех пор, пока они не потребуются для дозирования. Эталонное вещество, морфин гидрохлорид, приготавливают для дозирования посредством растворения известного количества в цитратном буфере, с получением раствора 1 мг/мл. Используют коэффициент корректировки 1,32, чтобы дать возможность для выражения дозы морфина в терминах свободного основания. Растворы приготавливают непосредственно перед использованием и защищают от света. Сравнительное вещество, фентанил цитрат, приготавливают для дозирования посредством растворения известного количества в цитратном буфере, с получением концентрации исходного раствора 0,36 мг/мл. Этот исходный раствор затем последовательно разбавляют цитратным буфером, с получением конечных концентраций 0,1, 0,4 и 1,2 мкг/мл. Используют коэффициент корректировки 1,57, чтобы дать возможность для выражения дозы фентанила в терминах свободного основания. Растворы приготавливают непосредственно перед использованием и защищают от света. Размеры групп, дозы и идентификационные номера. Имеется 11 групп лечения, до 10 крыс в каждой группе. Каждой группе лечения присваивают букву(от А до K). Крысы распределяются случайным образом по группам лечения за день перед дозированием на основе фоновых значений перед дозированием для теста отдергивания хвоста (см. ниже). Носитель представляет собой цитратный буфер. Животных дозируют внутривенно в хвостовую вену с использованием объема дозы 5 мл/кг и полипропиленового шприца с иглой 25G Becton Dickinson(0,516 мм). Общий объем 5 мл/кг доставляют при скорости настолько постоянной, насколько это возможно в течение интервала времени 2 мин +10 с. Время начала и окончания для медленного введения болюса регистрируют. Время дозирования регистрируют в исходных данных. Организация лечения вслепую Дозируемые растворы кодируются (от А до K), так что наблюдатель не знает идентификации групп лечения. Массы тела Животных взвешивают перед исследованием и массы тела регистрируют в тот же день, когда вводятся вещества. Процедура 1. Акклиматизация. При первой возможности, перед поведенческим исследованием, каждое животное подвергают рутинным манипуляциям и акклиматизации в окружающей среде поведенческого исследования. 2. Фоновое поведенческое исследование. Крыс перемещают в комнату для процедур за 1 день до эксперимента. Затем крыс содержат, дозируют и наблюдают в комнате для процедур. Тест с отдергиванием хвоста (см. ниже) осуществляют на всех крысах в 3 отдельных случаях перед дозированием, для установления фоновых значений. Фоновые значения перед дозированием берутся как данные последнего исследования (данные от первого и второго исследований не включаются, но классифицируются как часть акклиматизации). Тест с отдергиванием хвоста. Каждую крысу слегка придерживают на поверхности устройства для теста с отдергиванием хвоста(Ugo Basile, Italy) так, что ее хвост располагается непосредственно над источником инфракрасного излучения. Затем источник инфракрасного излучения наводится на малую область на вентральной поверхности хвоста. Запуск источника инфракрасного излучения одновременно с ним запускает таймер, который автоматически регистрирует время, необходимое для отклонения хвоста (чтобы отодвинуть или отдернуть его). Латентность отдергивания хвоста отмечается для каждого животного. Интенсивность инфракрасного излучения устанавливается при IR50, и максимальная продолжительность экспонирования для ИК источника составляет 10 с. Следовательно, нереагирующие животные представляют собой таких животных, которые имеют латентность отодвигания 10 с. 3. Распределение по группам и критерии исключения. Животных случайным образом распределяют по группам лечения (от А до K) за день перед дозированием, на основе фоновых значений перед дозированием для теста отдергивания хвоста. 4. Дозирование и поведенческое исследование. Животных не кормят для этого исследования. Тесты отдергивания хвоста осуществляют приблизительно через 5, 10, 20, 30, 60 и 120 мин после дозирования (по отношению к началу дозирования), для исследования воздействия лечения. 5. Окончание исследований. Любых животных, не распределенных в группы лечения, забивают посредством смещения шейных позвонков по окончании исследования. Остальных животных возвращают на ферму после того, как делают выводы после конечного периода исследования. Статистический анализ Осуществляют статистическое сравнение между группами, дозируемыми DHE (R- и S-изомеры),морфином, фентанилом и группой, дозируемой носителем, с использованием параметрических или непараметрических статистических процедур. Выбор параметрических (односторонний анализ разброса(ANOVA), t-критерий Даннета) или непараметрических (статистика Крускала-Валлиса, критерий Данна и U-критерий Манна-Уитни) статистических процедур основывается на том, удовлетворяют ли группы,которые должны сравниваться, гомогенности критерия разброса (оценивается с помощью критерия Левена для среднего значения F-критерия). Статистическая значимость определяется как Р 0,05. В дополнение к этому данные преобразуются в % МРЕ (максимального возможного воздействия),определяемый как 100(исследование-контроль)/(порог-контроль), где "контроль" представляет собой наблюдение для группы, дозируемой носителем, "исследование" представляет собой наблюдение после дозирования и "порог" представляет собой максимальную продолжительность допускаемого стимула (10 с для отдергивания хвоста). Кривые доза-реакция для каждого изомера DHE (R- и S-изомеры) и фентанила генерируются для первых 4 временных точек наблюдения, и вычисляется ED50 (доза, соответствующая 50% МРЕ). Осуществляют анализ для log10 (доза 103), с использованием нелинейной регрессии(кривой наилучшей подгонки), для S-образной кривой доза-реакция. Поскольку данные после дозирования возвращаются к фоновым значениям для временных точек 60 и 120 мин, вычислений для этих данных не требуется. Результаты Данные, среднее значениестандартная ошибка для латентности отодвигания с отдергиванием хвоста у различных групп, приводятся в табл. 15. Значения ED50, вычисленные для R-DHE, S-DHE и фентанила, сравниваются для оценки их относительного сильнодействия (таблица 11). Графики временных зависимостей представлены на фиг. 11-13, и кривые доза-реакция и данные для ED50 (доза, соответствующая 50% МРЕ) представлены на фиг. 14-17. Таблица 15. Воздействие дигидроэторфина (R- и S-изомеры), фентанила и морфина на латентность отодвигания отдергиванием хвоста у крыс Носитель представляет собой цитратный буфер [моногидрат лимонной кислоты:цитрат натрия:хлорид натрия:вода для инфузии при отношении 0,03:0,10:0,86:99,01 (г:г:г:мл)]. Данные выражены как среднее значение SEM.N=10 животных в каждой группе, если в скобках не указано иного. Р 0,05 и Р 0,01, по сравнению с носителем (ANOVA и t-критерий Даннета). Р 0,05,Р 0,01 и Р 0,001, по сравнению с носителем (критерии Крускала-Валлиса и Данна). Р 0,05 и Р 0,001, по сравнению с носителем (U-критерий Манна-Уитни). Воздействие дигидроэторфина (R-DHE) на латентность отодвигания с отдергиванием хвоста(фиг. 11) Внутривенное введение R-DHE при дозе 0,1 мкг/кг вызывает значимое увеличение латентности отдергивания хвоста через 5 мин после дозирования (7,90,7 с; Р 0,05; ANOVA и t-критерий Даннета), по сравнению с данными для группы, дозируемой носителем (5,20,6 с). Внутривенное введение R-DHE при 0,3 мкг/кг вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста через 5 и 10 мин после дозирования (9,20,5 с; Р 0,01; ANOVA и t-критерий Даннета; 7,70,7 с; Р 0,05; критерии Крускала-Валлиса и Данна соответственно), по сравнению с данными для группы, дозируемой носителем(5,20,6 и 5,00,2 с соответственно), но не оказывает воздействия в каких-либо других временных точках. Внутривенное введение R-DHE при дозе 0,5 мкг/кг вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста при 5, 10, 20 и 30 мин после дозирования (9,410,6 с; Р 0,01; ANOVA иt-критерий Даннета; 9,70,3 с; Р 0,001; 8,80,5 с; Р 0,01; 8,20,8 с; Р 0,05; все - для критериев КрускалаВаллиса и Данна, соответственно), по сравнению с данными для группы, дозируемой носителем (5,210,6,5,0+0,2, 5,1+0,2 и 4,9+0,4 с, соответственно). Значимое уменьшение, наблюдаемое для латентности отдергивания хвоста через 60 мин после дозирования в группе с 0,5 мкг/кг, не считается фармакологически релевантным. Не наблюдается воздействия через 120 мин после дозирования. Эти данные показывают непосредственное наступление анальгезии с пиковым воздействием приблизительно через 5 и 10 мин после дозирования, с возвращением к фоновым значениям (сравнимым с контролем, дозируемым носителем) через 60 мин после временной точки дозирования. Оцениваемые значения ED50 для R-DHE, то есть 50% МРЕ, составляют 0,08, 0,23, 0,25 и 0,42 мкг/кг через 5, 10, 20 и 30 мин после дозирования соответственно. Реакция на дозирование во временных точках через 60 и 120 мин после дозирования отсутствует. Воздействие дигидроэторфина (S-DHE) на латентность отодвигания с отдергиванием хвоста (фиг. 12). Внутривенное введение S-DHE при дозе 3 мкг/кг не влияет значимо на латентность отодвигания с отдергиванием хвоста в любой исследуемой временной точке, по сравнению с данными для группы, дозируемой носителем. Внутривенное введение S-DHE при 10 мкг/кг вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста при 5 и 10 мин после дозирования (9,70,3 и 9,30,3 с соответственно; для обеих временных точек Р 0,01; критерии Крускала-Валлиса и Данна), по сравнению с данными для группы, дозируемой носителем (5,20,6 и 5,00,2 с соответственно). Значимое наблюдаемое уменьшение для латентности отодвигания с отдергиванием хвоста через 60 минут после дозирования не считается фармакологически релевантным. Внутривенное введение S-DHE при дозе 30 мкг/кг вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста через 5, 10, 20 и 30 мин после дозирования (10,00,0 с; Р 0,001; 9,20,8 с; Р 0,01; 9,10,6 с; Р 0,001; критерии Крускала-Валлиса и Данна, и 8,30,7 с; Р 0,01; ANOVA и t-критерий Даннета соответственно), по сравнению с данными для группы, дозируемой носителем (5,20,6, 5,00,2, 5,10,2 и 4,90,4 с соответственно). Эти данные показывают непосредственное наступление анальгезии с пиковым воздействием во временной точке через 5 мин после дозирования, с возвращением к фоновым значениям (сравнимым с контролем, дозируемым носителем) во временной точке через 60 мин после дозирования. Оцененные значения ED50 для DHE (S-изомер) то есть 50% МРЕ, составляет 2,17, 3,80, 7,52 и 20,95 мкг/кг через 5, 10, 20 и 30 мин после дозирования соответственно. Реакция на дозирование во временных точках через 60 и 120 мин после дозирования отсутствует. Воздействие фентанила на латентность отодвигания с отдергиванием хвоста (фиг. 13). Внутривенное введение фентанила при дозе 0,5 мкг/кг не влияет значимо на латентность отодвигания с отдергиванием хвоста в любой исследуемой временной точке, по сравнению с данными для группы, дозируемой носителем. Внутривенное введение фентанила при 2 мкг/кг приводит к значимому увеличению латентности отодвигания с отдергиванием хвоста через 5 и 10 мин после дозирования (9,00,7 с; Р 0,01 и 9,10,4 с; Р 0,001 соответственно; для обеих временных точек - критерии Крускала-Валлиса и Данна), по сравнению с данными для группы, дозируемой носителем (5,20,6 и 5,00,2 с соответственно). Внутривенное введение фентанила при дозе 6 мкг/кг вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста через 5, 10 и 20 мин после дозирования (10,00,0 с; Р 0,001; 8,40,7 с; Р 0,01; 8,10,7 с; Р 0,05 соответственно; все оценки - согласно критериям Крускала-Валлиса и Данна),по сравнению с данными для группы, дозируемой носителем (5,20,6, 5,00,2 и 5,10,2 с соответственно). Эти данные показывают непосредственное наступление анальгезии с пиковыми воздействиями во временной точке через 5 мин, с возвращением к фоновым значениям (сравнимым с контролем, дозируемым носителем) во временной точке через 60 мин после дозирования. Оцененные значения ED50 фентанила, то есть 50% МРЕ, составляют 1,14, 1,25, 3,11 и 9,68 мкг/кг через 5, 10, 20 и 30 мин после дозирования соответственно. Реакция на дозирование во временных точках через 60 и 120 мин после дозирования отсутствует. Сравнительное воздействие R-DHE, S-DHE и фентанила. Значения ED50, вычисленные для R-DHE, S-DHE и фентанила, сравнивают для оценки их относительного сильнодействия (табл. 16). Данные предполагают, что в течение первых 30 мин после однократного внутривенного введения каждого соединения самцу крысы, R-DHE имеет анальгетическое сильнодействие, которое в 5-23 раза выше, чем у фентанила, S-DHE имеет анальгетическое сильнодействие, которое составляет 0,3-0,5 от воздействия фентанила, и что R-DHE имеет анальгетическое сильнодействие, которое в 17-50 раз выше, чем у S-DHE. Таблица 16. Значения ED50 и сравнительные отношения ED50 для R-DHE, S-DHE и фентанила Воздействие морфина на латентность отодвигания с отдергиванием хвоста Внутривенное введение морфина (5 мг/кг) вызывает значимое увеличение латентности отодвигания с отдергиванием хвоста через 5, 10, 20, 30 (10,00,0 секунды; Р 0,001; U-критерий Манна-Уитни - для всех 4 временных точек) и через 60 мин после дозирования (8,70,9 с; Р 0,05; U-критерий МаннаУитни), по сравнению с данными для группы, дозируемой носителем (5,2+0,6, 5,00,2, 5,10,2, 4,90,4 и 5,60,4 с соответственно). Выводы Однократное внутривенное введение R-DHE при дозах 0,1, 0,3 и 0,5 мкг/кг и S-DHE при дозах 10 и 30 мкг/кг вызывает значимое зависимое от дозы увеличение латентности отодвигания с отдергиванием хвоста у самцов крыс вплоть до 30 мин после дозирования. Внутривенное введение фентанила при дозах 2 и 6 мкг/кг вызывает значимое зависимое от дозы увеличение латентности отодвигания с отдергиванием хвоста вплоть до 30 мин после дозирования. Значения ED50, вычисленные для R-DHE, S-DHE и фентанила, сравнивают для оценки их относительного сильнодействия (табл. 16). Данные предполагают, что в течение первых 30 мин после однократного внутривенного введения каждого соединения самцам крыс, R-DHE имеет анальгетическое сильнодействие, которое в 5-23 раза выше, чем для фентанила, S-DHE имеет анальгетическое сильнодействие, которое составляет 0,3-0,5 от сильнодействия фентанила, и что R-DHE имеет анальгетическое сильнодействие, которое в 17-50 раз выше, чем у S-DHE. Продолжительность опиоидной анальгетической активности R-DHE и S-DHE после внутривенного введения говорит о потенциальном выигрыше и о терапевтическом потенциале этих соединений при лечении острой боли. Воздействия, отмеченные после введения морфина, согласуются с его известной фармакологической активностью, и, таким образом, эта система исследований является чувствительной при обнаружении ноцицептивных воздействий. Воздействие (R)- и (S)-дигидроэторфина в модели нейропатический боли с лигированием спинального нерва Используемая модель исследования хорошо известна в данной области и описана в Pain 1992; 50: 355-363 (Kim S.H., Chung J.M., An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat). Исследуются потенциальные анальгетические воздействия дигидроэторфина после однократного внутривенного дозирования 0,1, 0,3 и 0,5 мкг/кг (R-изомер) и однократного внутривенного дозирования 3, 10 и 30 мкг/кг (S-изомер) в модели нейропатической боли с лигированием спинального нерва. Периферийная мононейропатия вызывается в левой задней конечности крыс посредством плотного лигирова- 24022210 ния спинальных нервов L5 и L6. Развитие механической аллодинии и тепловой гиперальгезии отслеживают с использованием установленных поведенческих исследований (тест фон Фрея и плантарный тест Гаргревса соответственно). Морфин используют в качестве эталонного вещества, и прегабалин используют в качестве сравнительного вещества. Исследуемые вещества и материалы Исследуемые вещества, эталонное вещество, сравнительное веществ и носители. Исследуемые вещества: дигидроэторфин (R-изомер) и дигидроэторфин (S-изомер). Носитель для исследуемых и эталонных веществ. Цитратный буфер (моногидрат лимонной кислоты:цитрат натрия:хлорид натрия:стерильная вода,при отношении 0,03:0,10:0,86:99,01 (г:г:г:мл); [моногидрат лимонной кислоты (порошок белого цвета;Sigma, UK), цитрат натрия (Sigma, UK), хлорид натрия (твердый продукт белого цвета; Merck), стерильная вода (прозрачная жидкость; Baxter Healthcare, UK)]. Эталонное вещество: морфин гидрохлорид (порошок белого цвета; Macfarlan Smith, Edinburgh, UK). Сравнительное вещество: прегабалин (торговое наименование Lyrica; капсулы белого цвета; производится Pfizer и поставляется LindsayGilmour Chemist, Juniper Green, Edinburgh). Носитель для сравнительного вещества: карбоксиметилцеллюлоза, 1% мас./об. (CMC, порошок;Sigma, UK). Хранение исследуемого, эталонного и сравнительного веществ. Исследуемые вещества хранят при комнатной температуре, защищают от света и эталонное и сравнительное вещества хранят при комнатной температуре. Способ введения и уровни дозирования Способ введения R- и S-изомерных форм дигидроэторфина и носителя (цитратного буфера) представляет собой внутривенное введение. Оно представляет собой потенциальный способ введения для людей. Дозы R-DHE составляют 0,1, 0,3 и 0,5 мкг/кг, и дозы S-DHE составляют 3, 10 и 30 мкг/кг. Способ введения морфина представляет собой внутривенное введение. Доза морфина составляет 5 мг/кг. Способ введения сравнительного вещества, прегабалина, представляет собой пероральное введение. В фазе 2 исследования, доза прегабалина составляет 30 мг/кг. Для фазы 3, уровни дозирования сравнительного вещества, прегабалина, составляют 30, 50 и 100 мг/кг. Животные Вид: Крысы. Линия: Sprague-Dawley. Пол: мужской. Количество животных: хирургически подготавливают 75 животных. Возрастной диапазон: 6-7 недель (для операции); 8-9 недель (фаза 1 дозирования); 9-10 недель (фаза 2 дозирования); 11-12 недель (фаза 3 дозирования). Диапазон масс: 139-183 г (для операции); 190-257 г (фаза 1 дозирования); 210-284 г (фаза 2 дозирования); 243-341 г (фаза 3 дозирования). Акклиматизация: 3 дня после доставки, перед началом поведенческого исследования. Источник: Harlan UK Ltd. Идентификация и случайное распределение животных Каждому животному произвольным образом присваивается собственный идентификационный номер, который появляется на карточках с данными и на карточках на клетках. Животные идентифицируются с помощью водостойкой маркировки на хвосте. Здоровье животных и уход за ними Все исследования осуществляют в соответствии с указаниями Animals (Scientific Procedures) Act 1986, с UK Home Office Guidance для применения акта и со всеми применимыми Codes of Practice относительно ухода и содержания лабораторных животных. Содержание и окружающая среда Животных содержат группами вплоть до 5 в клетках с твердым дном, заполненных опилками. Во время акклиматизации, комнаты и клетки очищают через регулярные интервалы времени для поддержания гигиены. Комнаты освещают набором флуоресцентных ламп, с получением 12-часового цикла светтемнота (включают в 7.00, выключают в 19.00), как рекомендуется в Home Office Animals (Scientific Procedures) Act 1986. В комнатах кондиционируют воздух и измеряют температуру воздуха и относительную влажность. Во время периода акклиматизации поддерживается комнатная температура (диапазон от 20 до 22 С), и уровни влажности находятся в диапазоне от 46 до 59%. В течение процедуры поддерживается комнатная температура (диапазон от 19 до 22 С) и уровни влажности находятся в диапазоне от 26 до 43%. Диета и вода Расширенную диету для грызунов RM1(Е) SQC (Special Diets Services, Witham, UK) и водопроводную воду из водопровода предлагают по потребности. Каждую загрузку диеты доставляют с прилагаю- 25022210 щимся сертификатом анализа (С of A), детализирующим питательную композицию и уровни указанных загрязнений (например, тяжелых металлов, афлатоксина и инсектицидов). Воду периодически анализируют на примеси и загрязнения. Критерии приемлемых уровней загрязнений в исходных материалах диеты и в поставляемой воде находятся в пределах аналитических спецификаций, установленных производителем диеты и службой анализов воды соответственно. Состояние здоровья Животных проверяют по прибытии и перед исследованием; все животные здоровы и считаются пригодными для экспериментального использования. Постановка эксперимента Приготовление исследуемых, эталонных и сравнительных веществ. Цитратный буфер приготавливают посредством точного взвешивания соответствующих количеств каждого компонента и их растворения в стерильной воде для инъекций. Когда компоненты полностью растворяются, измеряют осмоляльность и рН раствора. Носитель считается приемлемым, поскольку рН составляет 5,03, что находится в пределах от 4,8 до 5,2, и осмоляльность составляет 295 мОсмол/кг, в пределах от 280 до 300 мОсмол/кг. Наконец, носитель фильтруют через устройство Stericup Millex GV (фильтр 0,22 мкм) при асептических условиях и хранят при 2-8 С до использования. Исследуемые вещества, дигидроэторфин (R- и S-изомеры), приготавливают для дозирования в виде растворов в цитратном буфере. Желаемые концетрации (0,02, 0,06 и 0,10 мкг/мл для R-изомера и 0,6, 2 и 6 мкг/мл для S-изомера) для дозирования получают посредством последовательного разбавления соответствующих исходных растворов, которые получают при приблизительной концентрации 20 мкг/мл. Реальную концентрацию исходных растворов отмечают в исходных данных. Перед последовательным разбавлением исходные растворы пропускают через узел стерильного фильтрования Durapore 0,22 мкмMillex GV в стеклянные флаконы, и каждое последующее разбавление стерильным цитратным буфером осуществляют с помощью стерильных манипуляций. Коэффициенты корректировки не используют и препараты приготавливают в виде свободного основания. Препараты приготавливают заранее, до момента дозирования для исследований, и используют (через 1-2 дня после приготовления) в пределах известного периода стабильности для R-DHE, который составляет 11 дней. S-DHE используют в течение 1-2 дней после приготовления. Растворы для дозирования дигидроэторфина (R- и S-изомеры) хранят в холодильнике, приблизительно при 4 С, до тех пор, пока они не потребуются для дозирования. Эталонное вещество, морфин гидрохлорид, приготавливают для дозирования посредством растворения известного количества в цитратном буфере, с получением раствора 1 мг/мл. Применяют коэффициент корректировки 1,32, чтобы сделать возможным выражение дозировки морфина в терминах свободного основания. Растворы приготавливают непосредственно перед использованием и защищают от света. Сравнительное вещество, прегабалин, приготавливают для дозирования посредством суспендирования известного количества в 1% мас./об. CMC, с получением суспензии 3 мг/мл для фазы 2, и 3, 5 и 10 мг/мл суспензии приготавливают для фазы 3. Следовательно, не требуется коэффициента корректировки,поскольку прегабалин дозируется как свободное основание. Суспензии приготавливают непосредственно перед использованием и защищают от света. Размеры групп, дозы и идентификационные номера Имеются 5 групп лечения, максимум 10 крыс в каждой группе. Каждой группе лечения присваивают букву (фаза 1: от А до Е, фаза 2: от F до J и фаза 3: от K до О). Крыс случайным образом распределяют по группам лечения за день перед дозированием на основе фоновых значений перед дозированием для исследований тепловой гиперальгезии (см. ниже). Фаза 1: Внутривенный носитель, цитратный буфер, используют для фаз 1 и 2, и пероральный носитель, 1% мас./об. CMC, используют для фазы 3. Животные, распределенные в группы лечения с внутривенным введением, дозируются в хвостовую вену с использованием объема дозы 5 мл/кг и полипропиленового шприца с иглой Becton Dickinson 25G (0,516 мм). Общий объем внутривенного введения в 5 мл/кг доставляют со скоростью, настолько постоянной, насколько это возможно, в течение интервала времени 2 мин 10 с. Время начала и окончания для медленного внутривенного введения болюса регистрируют. Животные, распределенные в группы перорального лечения, дозируются с помощью перорального зонда, с использованием объема дозы 10 мл/кг. Время дозирования регистрируют в качестве исходных данных. Организация лечения вслепую Дозируемые растворы кодируются (фаза 1: от А до Е, фаза 2: от F до J и фаза 3: от K до О), так что наблюдатели не знают идентификации групп лечения. Поскольку сравнительное вещество в фазе 2 исследования вводится иным способом дозирования, эта группа не исследуется вслепую для лица, осуществляющего дозирование, и кодируется Н. Также, контроль с введением морфина в фазе 3 вводится внутривенно, и это представляет собой способ, отличный от групп с введением носителя и сравнительного вещества (пероральное дозирование), группа с введением морфина не исследуется вслепую, и по этой причине кодируется как О. Массы тел Животных взвешивают перед операцией, в день 1 после операции (РО) и в каждый день дозирования перед введением веществ, и массы тел регистрируют. Ежедневные наблюдения Общие наблюдения осуществляют для всех животных ежедневно, начиная с дня О РО, при этом особенное внимание уделяется состоянию левой и правой задних лап животного. Процедура 1. Акклиматизация. Перед поведенческим исследованием животных подвергают рутинным манипуляциям и акклиматизации для окружающей среды поведенческого исследования. 2. Фоновое поведенческое исследование. Крыс перемещают в комнату процедур за 1 день перед экспериментом. Затем крыс содержат, дозируют и наблюдают в комнате для процедур. Поведенческие исследования (см. ниже) осуществляют на всех крысах для 2 отдельных случаев перед операцией, для установления фоновых значений. Фоновые значения перед операцией берутся как данные от конечного (второго) дня исследований (данные от первого дня исследований классифицируются как часть акклиматизации). Последовательность исследований представляет собой механическую аллодинию, после которой следует тепловая гиперальгезия, с минимальным допустимым периодом времени между исследованиями 5 мин. Механическая аллодиния (тест фон Фрея). Каждое животное помещают в клетку из проволочной сетки и ряд нитей фон Фрея прикладывают к плантарной поверхности задней лапы, снизу. Нити прикладывают в восходящем порядке (начиная с самого слабого усилия) и оценивают порог отодвигания как для левой, так и для правой задней лапы. Каждая нить прикладывается на средней плантарной поверхности лапы в точке, где она как раз начинает изгибаться; это повторяют приблизительно 8-10 раз для каждой нити с частотой приблизительно 1 Гц. Порог отодвигания определяют как представляющее собой самое низкое усилие из двух или более последовательных нитей фон Фрея, необходимых для того, чтобы вызвать рефлективную реакцию отодвигания (то есть кратковременное отдергивание лапы). Тепловая гиперальгезия (плантарный тест Гаргревса). Каждую крысу помещают в прозрачную пластиковую камеру со стеклянным полом и позволяют в течение короткого периода акклиматизироваться в ее окружающей среде перед исследованием (приблизительно 1 мин). Затем животные провоцируются с помощью радиантного инфракрасного (ИК) источника тепла, направленного на плантарную поверхность их задней лапы снизу, и вычисляют латентность отодвигания как для левой, так и для правой задней лапы. Интенсивность инфракрасного излучения устанавливают при IR50 (установка, предназначенная для доставки теплового потока, соответствующего 250 мВт/см 3), и максимальная продолжительность экспонирования для источника ИК излучения составляет 18 с. Следовательно, нереагирующие животные соответствуют латентности отодвигания 18 с. 3. Хирургическая процедура. Животных подготавливают хирургически в течение 3 дней. Каждую крысу анастезируют по потребности изофлуораном в 1-3% кислорода. Каждую крысу помещают в лежачем положении и поверхность вокруг места надреза бреют и стерилизуют хирургическим спиртом. При асептических условиях левые параспинальные мышцы отделяют от остистых отростков на уровнях S2 L4. Затем поперечный отросток L6 осторожно удаляют с помощью малых костных кусачек и идентифицируют спинальные нервы L4 L6. Левые спинальные нервы L5 и L6 изолируют и плотно лигируют с использованием шелковой нити 6-0 (как видно при увеличении 40). Лежащие сверху мышцы и кожу закрывают слоями с использованием соответствующего шовного материала, и после завершения анестезию прекращают. При восстановлении после анестезии крыс опять содержат в их клетках сначала на мягкой подстилке в течение ночи, для уменьшения риска инфекции, а затем на подстилке из опилок после полного восстановления. Животным позволяют восстанавливаться в течение минимум 4 дней перед началом поведенческого исследования. 4. Исследование развития. После операции дважды осуществляют поведенческое исследование перед днем дозирования для отслеживания развития аллодинии/гиперальгезии. Включают также дополнительные произвольные дни исследования, чтобы обеспечить достаточное количество животных, имеющих развитую аллодинию/гиперальгезию перед каждой фазой дозирования. 5. Распределение по группам и критерии исключения. Животных случайным образом распределяют в группы лечения за день перед дозированием на основе фоновых значений перед дозированием для исследования тепловой гиперальгезии. Только животные как с развитой механической аллодинией, так и с развитой тепловой гиперальгезией включаются в исследования. Животные считаются имеющими развитую механическую аллодинию, если порог отодвигания их левой лапы для нитей фон Фрея составляет 5 г силы (что соответствует номеру мононити 4,56 или меньше). Животные считаются имеющими развитую тепловую гиперальгезию, если латентность отодвигания их левой лапы для теплового плантарного устройства перед дозированием показывает отличие 30% от значения для левой лапы перед операцией. 6. Дозирование и поведенческое исследование. Животных не кормят в течение этого исследования. Каждый день дозирования, каждое из распределенных животных получает однократную внутривенную дозу исследуемого вещества, эталонного вещества или носителя или пероральную дозу сравнительного вещества или носителя. Имеется 3 фазы исследования. Дозирование каждой фазы разделено на 2 дня, и каждый день дозирования дозируются животные минимум из 3 групп лечения. После завершения каждой фазы, животным предоставляется минимальный период отдыха в 1 неделю перед началом следующей фазы исследования. В фазах 1 и 2 исследования после дозирования (приблизительно через 5 мин от начала дозирования) и приблизительно через 25, 50 и 120 мин после дозирования левую и правую задние лапы каждой крысы оценивают на механическую аллодинию с использованием теста фон Фрея. Приблизительно через 15, 35,60 и 130 мин после дозирования левую и правую задние лапы каждой крысы оценивают на тепловую гиперальгезию с использованием плантарного теста Гаргревса для исследования воздействия лечения. Все временные точки приводятся по отношению к началу дозирования. В фазе 3 исследования приблизительно через 60, 120, 180 и 240 мин после дозирования левую и правую задние конечности каждой крысы оценивают на механическую аллодинию с использованием теста фон Фрея. Приблизительно через 70, 130, 190 и 250 мин после дозирования левую и правую задние конечности каждой крысы оценивают на тепловую гиперальгезию с использованием плантарного теста Гаргревса для исследования воздействия лечения. 7. Окончание исследований. Всех исследуемых животных умерщвляли посредством смещения шейных позвонков после получения выводов от конечного периода исследования. Статистический анализ Осуществляют статистическое сравнение между группами лечения с использованием параметрических (например, одностороннего анализа разброса, t-критерия Даннета, t-критерия Стьюдента) или непараметрических (например, статистики Крускала-Валлиса, критерия Данна, U-критерия Манна-Уитни) статистических процедур. Выбор параметрического или непараметрического критерия основывается на том, удовлетворяют ли группы, которые должны сравниваться, гомогенности критерия разброса (оцениваемой с помощью критерия Левена для среднего значения или F-критерия). Данные фон Фрея логарифмически преобразуются (log10 (сила в граммах 10000 перед анализом. В фазе 2 исследований, поскольку сравнительное вещество прегабалин вводится с помощью иного способа дозирования, данные для прегабалина сравниваются со значениями перед дозированием с использованием парного t-критерия Стьюдента. В фазе 3 исследования, поскольку эталонное вещество, морфин, вводится с помощью способа дозирования, иного, чем для носителя и исследуемого вещества, данные для морфина сравнивают со значениями перед дозированием с использованием парного t-критерия Стьюдента. Для всех критериев статистическая значимость определяется как Р 0,05. Статистическая значимость для теста фон Фрея,- 28022210 хотя она оценивается на логарифмически преобразованных данных, выражается по отношению к граммам силы в секции результатов для целей иллюстрации. Все детали анализа приводятся в исходных данных. Результаты Осредненные данные для групп, среднее значениестандартная ошибка, для порогов отодвигания и латентности отодвигания приводятся в табл. 17-22. Развитие состояний нейропатический боли Два различных компонента нейропатический боли исследуют с использованием установленных поведенческих исследований, а именно нитей фон Фрея для исследования присутствия механической аллодинии и плантарного теста Гаргревса для исследования для присутствия тепловой гиперальгезии. Большинство животных, которые подвергаются лигированию спинального нерва, демонстрируют заметное увеличение чувствительности левой задней лапы для двух поведенческих исследований в дни после повреждения, показывая развитие периферической мононейропатии. Правая задняя лапа не показывает увеличение чувствительности после операции. В каждой фазе исследования все дозируемые животные,как считается, имеют невропатию в левой задней лапе, как оценивается с использованием установленных поведенческих исследований за день перед дозированием. Воздействие R-DHE на реакции при поведенческих исследованиях (фаза 1) Механическая аллодиния: в фазе 1 внутривенное введение R-DHE при 0,1 и 0,3 мкг/кг не производит никаких значимых изменений в порогах отодвигания левой или правой лапы для нитей фон Фрея. Однако внутривенное введение R-DHE при 0,5 мкг/кг вызывает значимое увеличение порога отодвигания в левой лапе приблизительно через 5 мин после дозирования (21,972,30 г; Р 0,01; критерии Крускала-Валлиса и Данна), по сравнению со значениями группы, дозируемой носителем, 5,432,58 г, а также приблизительно через 25 мин после дозирования (13,123,41 г; Р 0,05; ANOVA и t-критерий Даннета),по сравнению со значениями группы, дозируемой носителем, 2,250,75 г (табл. 17, фиг. 18). Тепловая гиперальгезия: внутривенное введение R-DHE не дает значимого воздействия на латентность отодвигания левой лапы по сравнению с носителем. Внутривенное введение R-DHE при дозе 0,3 мкг/кг вызывает значимое увеличение латентности отодвигания правой лапы приблизительно через 35 минут после дозирования (14,50,7 с; Р 0,05; ANOVA и t-критерий Даннета), по сравнению со значениями группы, дозируемой носителем (10,30,9 с); однако это является физиологически иррелевантным,поскольку порог отодвигания для правой лапы является сходным со значениями перед дозированием для правой лапы (14,30,6 с) (табл. 18, фиг. 19). Воздействие S-DHE на реакции при поведенческих исследованиях (фаза 2) Механическая аллодиния. В фазе 2 внутривенное введение S-DHE при 3 и 10 мкг/кг не дает никаких значимых изменений для порогов отодвигания левой или правой лапы для нитей фон Фрея. Однако внутривенное введение при 30 мкг/кг вызывает значимое увеличение порога отодвигания левой лапы приблизительно через 5 мин после дозирования (24,560,33 г; Р 0,001; критерии Крускала-Валлиса и Данна), по сравнению со значениями для группы, дозируемой носителем, 6,112,39 г, а также приблизительно через 25 мин после дозирования (21,92+1,70 г; Р 0,001; критерии Крускала-Валлиса и Данна), по сравнению со значениями для группы, дозируемой носителем, 1,660,47 г (табл. 19, фиг. 20). Тепловая гиперальгезия: внутривенное введение S-DHE не дает значимого воздействия на латентности отодвигания левой и правой лап при дозах 3 и 10 мкг/кг, по сравнению со значениями для группы,дозируемой носителем. Внутривенное введение S-DHE при дозе 30 мкг/кг, однако, дает значимое увеличение латентностей отодвигания лапы приблизительно через 15 мин после дозирования как для левой(17,60,4 с; Р 0,01; критерии Крускала-Валлиса и Данна), так и правой (17,50,4 с; Р 0,01; критерии Крускала-Валлиса и Данна) задней лапы, по сравнению со значениями для группы, дозируемой носителем, 10,30,8 с и 13,4+0,8 с, соответственно. Увеличение латентности правой лапы может показывать воздействие дигидроэтофина (S-изомера) на центральную нервную систему при уровне дозы 30 мкг/кг(таблица 20, фиг. 21). Воздействие морфина на реакцию при поведенческих исследованиях (фазы 1 и 3) В фазе 1 морфиновый эталон сравнивают с носителем, поскольку их оба вводят перорально. В фазе 3, морфиновый эталон сравнивают с состоянием перед дозированием, поскольку он не является релевантным для сравнения его с носителем, дозируемом перорально. Механическая аллодиния: после внутривенного введения морфина при 5 мг/кг (фаза 1), порог отодвигания левой задней лапы значимо увеличивается приблизительно через 25 мин после дозирования(19,232,73 г; Р 0,001; непарный 2-сторонний t-критерий Стьюдента) и приблизительно через 50 мин после дозирования (21,552,40 г; Р 0,001; непарный 2-сторонний t-критерий Стьюдента), по сравнению со значениями для группы, дозируемой носителем, 2,250,75 и 2,110,82 г. Имеется значимое уменьшение, наблюдаемое в данных для правой лапы перед дозированием (16,372,20 г; Р 0,05; непарный 2 сторонний t-критерий Стьюдента), по сравнению со значениями для группы, дозируемой носителем(22,261,52 г). Это является неизбежным, поскольку распределение по группам лечения основывается на значениях перед дозированием от исследования тепловой гиперальгезии (табл. 17, фиг. 18). Никаких
МПК / Метки
МПК: A61P 29/00, C07D 489/12, A61K 31/4353
Метки: получение, дигидроэторфины
Код ссылки
<a href="https://eas.patents.su/30-22210-digidroetorfiny-i-ih-poluchenie.html" rel="bookmark" title="База патентов Евразийского Союза">Дигидроэторфины и их получение</a>
Предыдущий патент: Биоадгезивная эндопаразитицидная гелевая композиция для лошадей и ее применение
Следующий патент: Вибрационное устройство для лечения заболеваний верхних дыхательных путей
Случайный патент: Водовакуумная и водовоздушная установка автоматического пожаротушения












