Фторированные производные 3-гидроксипиридин-4-онов и способы их использования
Номер патента: 20976
Опубликовано: 31.03.2015
Авторы: Премыслова Марина, Тэм Тим Фэт, Ван Иншэн, Шах Биренкумар, Чжао Яньцин, Леунг-Тоунг Реджис, Н'земба Блэйз, Синь Тао, Водзинска Йоланта Мария
Формула / Реферат
1. Соединение формулы I
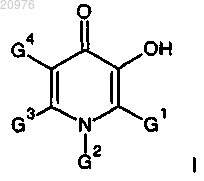 где G1 обозначает Н, С1-С4 алкил, СН2ОН, CH2NR1R2, CH(R4)CF3, CH(R7)CF2H, NR1R2 или
где G1 обозначает Н, С1-С4 алкил, СН2ОН, CH2NR1R2, CH(R4)CF3, CH(R7)CF2H, NR1R2 или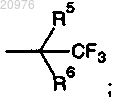
G2 обозначает H, С1-С4 алкил, циклопропил или (CH2)nCF2R3;
G3 обозначает Н, С1-С4 алкил, СН2ОН, CH2NR1R2, CH(R6)CF3, СН2-А-ОН, CH2-A-NHR9, или  и
и
G4 обозначает Н, С1-С4 алкил, атом галогена или CH(R8)CF3, где атом галогена выбран из хлора, брома и йода;
n равно 1, 2 или 3;
R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу;
если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, С1-С4 алкил, С3-С6 циклоалкил, аллил и пропаргил;
если R1 и R2 вместе образуют единую циклическую группу, то она выбрана из группы, включающей пиперазинил, N-(С1-С4алкил)-замещенный пиперазинил, морфолинил и пиперидинил;
R3 обозначает Н или F;
R4 и R7 независимо выбраны из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R4 или R7 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, точкой присоединения R4 или R7 к фрагменту СН от G1 является атом N от R4 или R7;
R5 обозначает С1-С4 алкил;
R6 обозначает Н или ОН;
R8 выбран из группы, включающей NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R8 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-С1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, то точкой присоединения R8 к фрагменту СН от G4 является атом N от R8;
R9 и R10 независимо обозначают атом Н или С1-С4 алкил;
А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток;
m равно 1, 2 или 3; и
при условии, что
(1) по меньшей мере один из G1, G2, G3 и G4 содержит по меньшей мере один фторсодержащий фрагмент, где этот фторсодержащий фрагмент выбран из CH(R4)CF3, CH(R7)CF2H или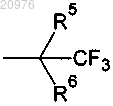 в определении G1; (CH2)nCF2R3 в определении G2; CH(R6)CF3 и
в определении G1; (CH2)nCF2R3 в определении G2; CH(R6)CF3 и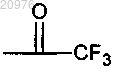 в определении G3; и CH(R8)CF3 в определении G4;
в определении G3; и CH(R8)CF3 в определении G4;
(2) если G1 обозначает CH(R4)CF3 и R4 обозначает Н или ОН, то либо (i) G3 обозначает CH2NR1R2, CH2-A-OH, CH2-A-NHR9, либо (ii) G4 обозначает атом галогена или CH(NR1R2)CF3; и
(3) если G3 обозначает CH(R6)CF3, то G1 обозначает CH2NR1R2, CH(R4)CF3, CH(R7)CF2H, NR1R2 и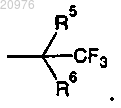
2. Соединение по п.1, в котором если G1 обозначает СН(NR1R2) CF3, то G3 и G4 независимо обозначают Н или С1-С4 алкил и G2 обозначает Н, С1-С4 алкил или циклопропил.
3. Соединение по п.1 или 2, в котором если G2 обозначает (CH2)nCF2R3, то G1 и G3 независимо обозначают Н, С1-С4 алкил, СН2ОН или CH2NR1R2.
4. Соединение по любому из пп.1-3, в котором если G2 обозначает Н, то G4 обозначает Н или С1-С4 алкил.
5. Соединение по любому из пп.1-4, в котором если G3 обозначает  то G1 и G4 независимо обозначают Н или С1-С4 алкил.
то G1 и G4 независимо обозначают Н или С1-С4 алкил.
6. Соединение по любому из пп.1-5, в котором если G3 обозначает CH(R6)CF3, где R6 означает Н, то G1 обозначает NR1R2.
7. Соединение по любому из пп.1-6, в котором если G1 обозначает CH2NR1R2, то G2 обозначает (CH2)nCF2R3.
8. Соединение по любому из пп.1-7, в котором если G1 обозначает CH(R7)CF2H, то G3 и G4 независимо обозначают Н или C1-С4 алкил, и G2 обозначает С1-С4 алкил или циклопропил.
9. Соединение по любому из пп.1-8, в котором если G1 обозначает CH(R4)CF3, то G2 обозначает С1-С4 алкил или циклопропил; при условии, что если R4 обозначает Н или ОН, то G3 обозначает CH2NR1R2, CH2-A-OH, CH2-A-NHR9.
10. Соединение по любому из пп.1-9, в котором если G1 обозначает CH(R4)CF3 и R4 обозначает Н или ОН, то G4 обозначает атом галогена.
11. Соединение по любому из пп.1-10, в котором если G1 или G3 обозначает СН2ОН, то G2 обозначает (CH2)nCF2R3.
12. Соединение по любому из пп.1-11, в котором если G1 обозначает NR1R2, то G3 обозначает CH(R6)CF3, где R6 означает Н, G4 обозначает Н или С1-С4 алкил и G2 обозначает С1-С4 алкил или циклопропил.
13. Соединение по любому из пп.1-12, в котором если G4 обозначает CH(R8)CF3, то G1 и G3 независимо обозначают Н или С1-С4 алкил, и G2 обозначает атом водорода, С1-С4 алкил или циклопропил.
14. Соединение по любому из пп.1-13, в котором если G3 обозначает СН2-А-ОН или CH2-A-NHR, то G4 обозначает Н или С1-С4 алкил, G2 обозначает С1-С4 алкил или циклопропил, и G1 обозначает CH(R4)CF3, где R4 обозначает Н или ОН.
15. Соединение по любому из пп.1-14, в котором если G3 обозначает CH2NR1R2 и G2 обозначает С1-С4 алкил или циклопропил, то G4 обозначает Н или С1-С4 алкил, и G1 обозначает CH(R4)CF3, где R4 обозначает Н или ОН.
16. Соединение по любому из пп.1-15, в котором если G1 обозначает CH(R4)CF3 и R4 обозначает Н или ОН, то либо G3 обозначает CH2NR1R2, либо G4 обозначает атом галогена.
17. Соединение по любому из пп.1-16, в котором если G3 обозначает CH(R4)CF3, то G1 обозначает CH2NR1R2 или NR1R2.
18. Соединение по п.1, в котором
G1 обозначает Н, С1-С4 алкил, -СН2ОН или -CH2NR1R2;
G2 обозначает (CH2)n-CF2R3;
G3 обозначает Н, С1-С4 алкил, -СН2ОН или -CH2NR1R2;
G4 обозначает Н, С1-С4 алкил или атом галогена;
R1 и R2 обозначают либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены;
если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, С1-С4 алкил, С3-С6 циклоалкил, аллил и пропаргил;
если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С1-С4алкил)-замещенный пиперазинил, морфолино и пиперидинил;
n равно 1, 2 или 3; и
R3 обозначает Н или F.
19. Соединение по п.18, в котором n равно 1.
20. Соединение по п.19, в котором G4 обозначает Н.
21. Соединение по п.20, в котором R3 обозначает Н.
22. Соединение по п.20, в котором R3 обозначает F.
23. Соединение по п.22, в котором G1 обозначает атом водорода и G3 обозначает метил.
24. Соединение по п.22, в котором G1 обозначает метил и G3 обозначает Н.
25. Соединение по п.22, в котором G1 обозначает этил и G3 обозначает Н.
26. Соединение по п.22, в котором G1 обозначает Н и G3 обозначает Н.
27. Соединение по п.22, в котором G1 обозначает -СН2ОН и G3 обозначает Н.
28. Соединение по п.22, в котором G1 обозначает -CH2NMe2 и G3 обозначает метил.
29. Соединение по п.22, в котором G1 обозначает -CH2NMe2 и G3 обозначает Н.
30. Соединение по п.22, в котором G1 обозначает -СН2ОН и G3 обозначает метил.
31. Соединение по п.22, в котором G1 обозначает
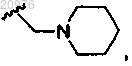
и G3 обозначает метил.
32. Соединение по п.21, в котором G1 обозначает метил и G3 обозначает Н.
33. Соединение по п.21, в котором G1 обозначает Н и G3 обозначает метил.
34. Соединение по п.21, в котором G1 обозначает -CH2NMe2 и G3 обозначает метил.
35. Соединение по п.1, в котором G1 обозначает -CH(R4)CF3;
G2 обозначает Н, С1-С4 алкил или циклопропил;
G3 обозначает Н, С1-С4 алкил, СН2-А-ОН, CH2-A-NHR9 или CH2NR1R2;
G4 обозначает Н, С1-С4 алкил или атом галогена;
R4 выбран из группы, включающей
(a) Н или ОН, когда G3 означает CH2NR1R2, CH2-A-OH или СН2-NHR9;
(b) Н или ОН, когда G4 означает галоген или СН (NR1R2) CF3; или в другом случае:
(c) NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R4 обозначает NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, то точкой присоединения R4 к фрагменту СН от G1 является атом N или R4.
36. Соединение по п.35, в котором G2 обозначает С1-С4 алкил или циклопропил; G3 обозначает Н или С1-С4 алкил; и R4 выбран из группы, включающей NR1R2, имидазол, 1,2,4-триазол, пиперазин, N-С1-С4 алкилпиперазин, N-бензилпиперазин, N-фенилпиперазин, 2-пиридилпиперазин и -A-NH-R10.
37. Соединение по п.36, в котором G2 обозначает метил.
38. Соединение по п.37, в котором G3 обозначает Н и G4 обозначает Н.
39. Соединение по п.38, в котором R4 обозначает NR1R2.
40. Соединение по п.38, в котором R4 обозначает A-NHR10; А обозначает D-аланил и R10 обозначает метил.
41. Соединение по п.39, в котором R1 обозначает метил и R2 обозначает метил.
42. Соединение по п.39, в котором R1 обозначает метил и R2 обозначает пропаргил.
43. Соединение по п.39, в котором R1 обозначает Н и R2 обозначает циклопропил.
44. Соединение по п.39, в котором R1 обозначает Н и R2 обозначает аллил.
45. Соединение по п.39, в котором NR1R2 представляет собой пиперидинил.
46. Соединение по п.39, в котором NR1R2 представляет собой N-метилпиперазинил.
47. Соединение по п.35, в котором G3 обозначает СН2-А-ОН, CH2-A-NHR9 или CH2NR1R2; G4 обозначает Н или С1-С4 алкил и R4 обозначает Н или ОН.
48. Соединение по п.47, в котором G2 обозначает метил.
49. Соединение по п.48, в котором G4 обозначает Н.
50. Соединение по п.49, в котором G3 обозначает CH2NR1R2; R1 обозначает метил; R2 обозначает метил и R4 обозначает Н.
51. Соединение по п.49, в котором G3 обозначает CH2NR1R2; R1 обозначает метил; R2 обозначает метил и R4 обозначает ОН.
52. Соединение по п.49, в котором G3 обозначает СН2-А-ОН; А обозначает L-аланил и R4 обозначает ОН.
53. Соединение по п.49, в котором G3 обозначает CH2-A-NHR9; А обозначает L-аланил; R9 обозначает метил и R4 обозначает ОН.
54. Соединение по п.1, в котором G1 обозначает -CH(R4)CF3; G2 обозначает Н, С1-С4 алкил или циклопропил; G3 обозначает Н или С1-С4 алкил и G4 обозначает атом галогена.
55. Соединение по п.54, в котором G2 обозначает метил.
56. Соединение по п.55, в котором G4 обозначает атом хлора.
57. Соединение по п.56, в котором G3 обозначает метил и R4 обозначает ОН.
58. Соединение по п.56, в котором G3 обозначает метил и R4 обозначает Н.
59. Соединение по п.56, в котором G3 обозначает метил; R4 обозначает NR1R2; R1 обозначает метил и R2 обозначает метил.
60. Соединение по п.56, в котором G3 обозначает Н; R4 обозначает NR1R2; R1 обозначает метил и R2 обозначает метил.
61. Соединение по п.56, в котором G3 обозначает Н; R4 обозначает NR1R2 и NR1R2 представляет собой пиперидинил.
62. Соединение по п.56, в котором G3 обозначает Н и R4 обозначает Н.
63. Соединение по п.1, в котором G1 обозначает Н или С1-С4 алкил;
G2 обозначает Н, С1-С4 алкил или циклопропил;
G3 обозначает Н или С1-С4 алкил;
G4 обозначает -СН(CF3)(R8);
R8 выбран из группы, включающей NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С1-С4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; точкой присоединения R8 к фрагменту СН от G1 является атом N от R8;
R1 и R2 обозначают либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены;
если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, С1-С4 алкил, С3-С6 циклоалкил, аллил и пропаргил;
если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С1-С4алкил)-замещенный пиперазинил, морфолино и пиперидинил;
А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток;
m равно 1, 2 или 3; и
R10 обозначает Н или С1-С4 алкил.
64. Соединение по п.63, в котором G3 обозначает Н.
65. Соединение по п.64, в котором G1 обозначает метил.
66. Соединение по п.65, в котором G2 обозначает Н; R8 обозначает -A-NH-R10; А обозначает L-аланил и R10 обозначает метил.
67. Соединение по п.65, в котором G2 обозначает метил; R8 обозначает NR1R2; R1 обозначает метил и R2 обозначает метил.
68. Соединение по п.65, в котором G2 обозначает метил; R8 обозначает NR1R2; R1 обозначает Н; и R2 обозначает метил.
69. Соединение по п.65, в котором G2 обозначает метил; R8 обозначает NR1R2 и NR1R2 представляет собой пиперидинил.
70. Соединение по п.65, в котором G2 обозначает метил; R8 обозначает NR1R2 и NR1R2 представляет собой имидазолил.
71. Соединение по п.65, в котором G2 обозначает метил; R8 обозначает NR1R2 и NR1R2 представляет собой N-метилпиперазинил.
72. Соединение по п.1, в котором G1 обозначает CH2NR1R2 или NR1R2;
G2 обозначает С1-С4 алкил или циклопропил;
G3 обозначает -СН(CF3)(R6);
G4 обозначает Н или С1-С4 алкил;
R6 обозначает Н или ОН; и
R1 и R2 обозначают либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены;
если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, С1-С4 алкил, С3-С6 циклоалкил, аллил и пропаргил;
если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С1-С4алкил)-замещенный пиперазинил, морфолино и пиперидинил.
73. Соединение по п.72, в котором G4 обозначает Н.
74. Соединение по п.73, в котором G2 обозначает метил.
75. Соединение по п.74, в котором G1 обозначает NR1R2; R1 обозначает метил; R2 обозначает метил и R6 обозначает Н.
76. Соединение по п.74, в котором G1 обозначает CH2NR1R2; R1 обозначает метил; R2 обозначает метил и R6 обозначает ОН.
77. Соединение по п.1, в котором G1 обозначает -СН (CF2H)(R7);
G2 обозначает Н, С1-С4 алкил или циклопропил;
G3 обозначает Н или С1-С4 алкил;
G4 обозначает Н или С1-С4 алкил;
R7 выбран из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С1-С4алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -CH2-A-NH-R10; и если R7 обозначает NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С1-С4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -CH2-A-NH-R10, то точкой присоединения R7 к фрагменту СН от G1 является атом N от R7;
R1 и R2 обозначают либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены;
если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, С1-С4 алкил, С3-С6 циклоалкил, аллил и пропаргил;
если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С1-С4алкил)-замещенный пиперазинил, морфолино и пиперидинил;
А обозначает -NH-(CH2)mCO- или альфа-аминокислотный остаток;
m равно 1, 2 или 3; и
R10 обозначает Н, С1-С4 алкил.
78. Соединение по п.77, в котором G2 обозначает метил, G3 обозначает Н, G4 обозначает Н и R7 обозначает ОН.
79. Соединение по п.77, в котором G2 обозначает метил, G3 обозначает Н, G4 обозначает Н и R7 обозначает Н.
80. Соединение по п.1, в котором G1 обозначает C(R5)(R6)(CF3); G2 обозначает Н, С1-С4 алкил или циклопропил; G3 обозначает Н или С1-С4 алкил и G4 обозначает Н или С1-С4 алкил.
81. Соединение по п.80, в котором G2 обозначает метил; G3 обозначает Н; G4 обозначает Н; R5 обозначает метил и R6 обозначает Н или ОН.
82. Соединение по п.81, в котором R6 обозначает ОН.
83. Применение соединения по любому из пп.1-82 для лечения медицинского состояния, связанного с токсической концентрацией железа.
84. Применение соединения по любому из пп.1-82 для получения лекарственного средства для лечения медицинского состояния, связанного с токсической концентрацией железа.
85. Применение по п.83 или 84, где медицинское состояние, связанное с токсической концентрацией железа, выбирают из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фридрейха.
86. Способ лечения, включающий введение терапевтически эффективного количества соединения по любому из пп.1-82 субъекту, имеющему (или с подозрением на наличие) медицинское состояние, связанное с токсической концентрацией железа.
87. Способ по п.86, где медицинское состояние, связанное с токсической концентрацией железа, выбрано из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фридрейха.
Текст
Получены соединения формулы I, которые представляют собой производные 3 гидроксипиридин-4-она. Соединения можно применять для лечения медицинского состояния,связанного с токсической концентрацией железа. Соединения можно применять с целью получения лекарственного средства для лечения медицинского состояния, связанного с токсической концентрацией железа. Медицинское состояние, связанное с токсической концентрацией железа,может быть выбрано из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фридрейха. Предпосылки Проявление in vivo токсичности железа в организме человека можно классифицировать как состояния с перегрузкой железом и без перегрузки железом. Состояния с перегрузкой железом являются обычными для пациентов с талассемией вследствие постоянного переливания крови и для пациентов с наследственным гематохроматозом. Состояния без перегрузки железом включают антрациклинопосредованную кардиотоксичность, вирусные инфекции, нейродегенеративные заболевания, фотоиндуцированное поражение и пролиферативные состояния. Возможное применение агентов хелатирования железа для лечения различных заболеваний рассматривается в работах Tam et al., Current MedicinalChemistry, 2003, 10, 983-995 и Hider et al., BioMetals, 2007, 20, 639-654. В настоящее время имеется несколько лекарственных средств-агентов хелатирования железа, которые представлены на рынке. Их примеры включают деферипрон (Ferriprox), ICL670 (ExJade), дексразоксан гидрохлорид (Zinecard) и десферриоксамин мезилат (Desferal). Однако только два из этих соединений, а именно деферипрон и ICL670, активны при пероральном приеме с целью удаления железа при заболеваниях, связанных с перегрузкой железом. Сущность изобретения При разработке 3-гидроксипиридин-4-она, который приводит к улучшению воздействия на головной мозг, один подход - это повышение липофильности хелатирующего агента посредством введения трифторэтильной группы по положению С 2, или С 5, или С 6 3-гидроксипиридин-4-она (US 20080242706). Это изобретение частично базируется на соединениях с трифторэтильной группой в положении N1 или 2-дифторэтильной группой в положении С 2 3-гидроксипиридин-4-онового каркаса. При разработке новых бидентатных 3-гидроксипиридин-4-оновых лигандов (L) предполагается также использование заместителей с низкой молекулярной массой. При комплексообразовании с металлом (М) образуется комплекс MLn, например, FeL3. Известно, что амины взаимодействуют благоприятным образом преимущественно с отрицательно заряженными фосфолипидными исходными группами на ГЭБ (гематоэнцефалическом барьере). Вообще,основания лучше проникают в ЦНС (центральную нервную систему) (глава 10, Blood Brain Barrier inPress, Elsevier 2008). Ряд аминопроизводных с трифторэтилом в положении С 2, или N1, или С 5, или С 6 3 гидроксипиридин-4-оновой основной цепи был разработан и синтезирован авторами изобретения. Выборочными примерами этих соединений являются 2-[1-(диметиламино)-2,2,2-трифторэтил]-3-гидрокси-1 метилпиридин-4(1 Н)-он (Аро 7041), 5-[1-(диметиламино)-2,2,2-трифторэтил]-3-гидрокси-1,2-диметилпиридин-4(1 Н)-он (Аро 7053) и 6-[(диметиламино)метил]-3-гидрокси-1-метил-2-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (Аро 7021) и 2-[(диметиламино)метил]-3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(1 Н)он (Аро 7067). Это изобретение частично базируется на интуитивном открытии, что аминопроизводные, такие как 2-[1-(диметиламино)-2,2,2-трифторэтил]-3-гидрокси-1-метилпиридин-4(1 Н)-он (Аро 7041), менее предпочтительны, чем деферипрон, для проницания ГЭБ в ГЭБ-исследованиях на крысах с использованием кассетного дозатора. Физико-химические исследования подтверждают, что Аро 7041 (pKa 3,51) является менее основным, чем нормальные алифатические амины. Некоторые отобранные аминопроизводные по данному изобретению являются слабыми основаниями и имеют pKa в диапазоне от 3,5 до 6,0. Слабые основания по данному изобретению являются липофильными и могут также обладать способностью накапливаться в кислотных отделах биологических систем. Кроме того, металл-хелаты соединений по данному изобретению могут иметь отличительное свойство - стабильность при значительно меньших рН, чем металл-хелат деферипрона. Соединения по данному изобретению могут быть полезны в биологических условиях, например, для лечения рака, воспалительных болезней легких и болезни почек, когда для лечения требуется аккумуляция слабого основания в кислотном отделе и изоляция свободного железа в слабокислых условиях с образованием стабильного хелата трехвалентного железа, в результате чего железо удаляется. С другой стороны, фторированные производные 3-гидроксипиридин-4-она с основным амином сpKa6,0 имеют свойства, отличные от свойств слабоосновных аминов, таких как Аро 7041. Примером такого соединения является 2-[(диметиламино)метил]-3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(Н)-он(Аро 7067, pKa 6,1). Аро 7067 является более липофильным, чем деферипрон, и легко проникает через ГЭБ в ГЭБ-исследованиях на крысах с использованием кассетного дозатора. Неаминные фторированные производные 3-гидроксипиридин-4-онов по данному изобретению обычно являются более липофильными, чем деферипрон, и могут аккумулироваться в области головного мозга. Примерами таких соединений являются 3-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)он (Аро 6995), 3-гидрокси-2-(гидроксиметил)-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (Аро 7064), 2-(2,2 дифторэтил)-3-гидрокси-1-метилпиридин-4(1 Н)-он (Аро 7080) и 2-(2,2-дифтор-1-гидроксиэтил)-3 гидрокси-1-метилпиридин-4(1 Н)-он (Аро 7078). Такие соединения как Аро 6995 могут быть пригодны в качестве агентов хелатирования железа с низкой молекулярной массой для аккумуляции в головном мозге. Одним возможным применением является лечение атаксии Фридрейха, когда место удаления или пе-1 020976 рераспределения железа находится в головном мозге. В иллюстративных вариантах настоящего изобретения получают соединение формулы IG4 обозначает Н, C1-C4 алкил, атом галогена или CH(R8)CF3, где атом галогена выбран из фтора,хлора и йода;R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, то она выбрана из группы, включающей пиперазинил, N-(C1-C4 алкил)-замещенный пиперазинил, морфолинил и пиперидинил;R4 и R7 независимо выбраны из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил,пиперазинил, N-C1-С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R4 или R7 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-C1 С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NHR10, точкой присоединения R4 или R7 к фрагменту СН от G1 является атом N от R4 или R7;R8 выбран из группы, включающей NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R8 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, Nбензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, то точкой присоединения R8 к фрагменту СН от G4 является атом N от R8;R9 и R10 независимо обозначают атом Н или C1-C4 алкил; А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток;(1) по меньшей мере один из G1, G2, G3 и G4 содержит по меньшей мере один фторсодержащий фрагмент, где этот фторсодержащий фрагмент выбран из CH(R4)CF3, CH(R7)CF2H или(2) если G1 обозначает CH(R4)CF3 и R4 обозначает Н или ОН, то либо (i) G3 обозначает CH2NR1R2,CH2-A-OH, CH2-A-NHR9, либо (ii) G4 обозначает атом галогена или СН(NR1R2) CF3; и Иллюстративные варианты настоящего изобретения касаются применения описанного здесь соединения для лечения медицинского состояния, связанного с токсической концентрацией железа. Применение может осуществляться с целью получения лекарственного средства. Медицинское состояние, связанное с токсической концентрацией железа, может быть выбрано из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фридрейха. Иллюстративные варианты настоящего изобретения касаются способа медицинского лечения,включающего введение терапевтически эффективного количества описанного здесь соединения субъекту, имеющему (или с подозрением на наличие) медицинское состояние, связанное с токсической концентрацией железа. Медицинское состояние, связанное с токсической концентрацией железа, может быть выбрано из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фри-2 020976 дрейха. Другие аспекты и отличительные признаки настоящего изобретения будут ясны специалисту в данной области после просмотра следующего описания конкретных примеров изобретения совместно с прилагаемыми фигурами. Краткое описание фигур На фиг. 1 представлена диаграмма зоны E1/2 общепризнанных лекарственных средств, таких как деферипрон и десферроксамин В. Если хелат трехвалентного железа имеет значение E1/2, которое опускается ниже -320 мВ (мВ относительно НВЭ, нормального водородного электрода), то хелат не является редокс-активным, и его свойства попадают в зону Е 1/2 общепризнанных лекарственных средств, таких как деферипрон и десферроксамин В, и имеющегося в организме белка, такого как трансферрин. Соединения формулы I имеют значения E1/2, которые попадают в зону между ферриоксамином В (хелат железа и десферриоксамина В) и Fe(деферипроном)3. Оба соединения, деферипрон и Аро 7041, представляют собой производные 3-гидроксипиридин-4-она. Деферипрон представляет собой 3-гидрокси-1,2 диметилпиридин-4(1 Н)-он, и Аро 7041 представляет собой 2-[1-(диметиламино)-2,2,2-трифторэтил]-3 гидрокси-1-метилпиридин-4(1 Н)-он. На фиг. 2 представлена диаграмма циклической вольтаметрии (CV) Fe-хелатов трех типичных соединений формулы I, Аро 7041 (G2=Me, G1=CH(NMe2) CF3, G4=H, G3=H), Apo7053 (G2=Me, G1=Me,G4=CH(NMe2)CF3, G3=H), Apo7069 (G2=CH2CHF2, G1=Me, G4=H, G3=H). На фиг. 3 А представлена диаграмма Джобса для Аро 7053, соединения формулы I 5-[1(диметиламино)-2,2,2-трифторэтил]-3-гидрокси-1,2-диметилпиридин-4(1 Н)-она. На фиг. 3 В представлена диаграмма Джобса для системы Fe-Аро 7041 с [Fe]общ+[Аро 7041]общ=810-4 М в 0,1 М MOPS при рН 7,4. На фиг. 4 представлена диаграмма видообразования Fe для системы Fe:деферипрон при соотношении 1:10 и концентрациях [Fe] =110-6 М и [деферипрон] =110-5 М. На фиг. 5 представлена диаграмма видообразования Fe для системы Fe:Apo7041 при соотношении 1:10 и концентрациях [Fe] =110-6 М и [Аро 7041] =110-5 М. На фиг. 6 представлена схема протонирования хелата Аро 7041. Fe-хелат слабого основания является приемником протонов. FeL3 тип, протонированный посредством протонирования аминофрагментовFeL3 до FeL2 присутствует в кислой среде. Преобразование FeL3 в FeL2 происходит только при очень низком кислотном рН. На фиг. 7 представлена схема деградации FeL3 до FeL2 для нейтральных 3-гидроксипиридин-4-онов. На фиг. 8 представлено схематическое изображение лиганда Аро 7041. Стерический объем в положении С 2 предполагает блокирование фазы II метаболизма, включающей глюкуронидирование С 3-атома кислорода. На фиг. 9 представлена диаграмма, демонстрирующая, что соединение формулы I и деферипрон подавляют образование гидроксибензойной кислоты, когда бензойную кислоту обрабатывают пероксидом водорода и солями железа. Ось у соответствует общей концентрации образовавшихся 2 оксибензойной, 3-оксибензойной и 4-оксибензойной кислот (единицы: мкМ). На фиг. 10 представлена диаграмма нейрозащитного действия деферипрона на (МРР+)обработанные клетки SV-NRA. Обработка посредством МРР+ снижает жизнеспособность клеток по сравнению с необработанными (контрольный носитель). Обработка деферипроном, лекарственным средством, хелатирующим железо, дает в результате примерно 20% повышение жизнеспособности клеток(р 0,05). На фиг. 11 представлена диаграмма, демонстрирующая нейрозащитное действие соединения формулы I Аро 7021 на (МРР+)-обработанные клетки SV-NRA. На фиг. 12 представлена диаграмма, демонстрирующая нейрозащитное действие соединения формулы I Аро 7060 на (МРР+)-обработанные клетки SV-NRA. На фиг. 13 представлена диаграмма, демонстрирующая нейрозащитное действие соединения формулы I Аро 6995 на (МРР+)-обработанные клетки SV-NRA. Подробное описание Соединения по настоящему изобретению включают соединения, имеющие структуру, соответствующую формуле IG4 обозначает Н, C1-C4 алкил, атом галогена или CH(R8)CF3, где атом галогена выбран из фтора,хлора и йода;R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, то она выбрана из группы, включающей пиперазинил, N-(С 1-С 4 алкил)-замещенный пиперазинил, морфолинил и пиперидинил;R4 и R7 независимо выбраны из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил,пиперазинил, N-C1-С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R4 или R7 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-C1 С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NHR10, точкой присоединения R4 или R7 к фрагменту СН от G1 является атом N от R4 или R7;R8 выбран из группы, включающей NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R8 обозначает имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, Nбензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, то точкой присоединения R8 к фрагменту СН от G4 является атом N от R8;R9 и R10 независимо обозначают атом Н или C1-C4 алкил; А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток;(1) по меньшей мере один из G1, G2, G3 и G4 содержит по меньшей мере один фторсодержащий фрагмент, где этот фторсодержащий фрагмент выбран из CH(R4)CF3, CH(R7)CF2H или(2) если G1 обозначает CH(R4)CF3 и R4 обозначает Н или ОН, то либо (i) G3 обозначает CH2NR1R2,CH2-A-OH, CH2-A-NHR9, либо (ii) G4 обозначает атом галогена или СН (NR1R2) CF3; и Как используется всюду в этом документе, А может и представлять собой -NH-(CH2)m-CO-, где m равно 1, 2 или 3, или альфа-аминокислотный остаток, пока по контексту не будет ясно иное. А имеет точку присоединения к соединению через атом азота (атом N). Точка присоединения может находиться,например, на N-терминале аминокислотного остатка. Если аминокислота представляет собой лизин или орнитин, то точкой присоединения может быть альфа-N или эпсилон-N лизина или альфа-N или дельтаN орнитина. Во фрагментах A-NHR9 или A-NHR10 карбокислотная группа аминокислотного остатка образует амид с атомом азота от NHR9 или NHR10. Во фрагментах А-ОН С-терминал аминокислотного остатка представляет собой карбоновую кислоту. Используемое здесь выражение "аминокислотный остаток" включает, но не ограничено этим, любые встречающиеся в природе альфа-, бета- и гамма-аминокарбоновые кислоты, в том числе их D и L оптические изомеры и N-низший алкил- и N-(фенил низший алкил)-производные этих аминокислот. Аминокислотный остаток связан через атом азота аминокислоты. Встречающиеся в природе аминокислоты, которые могут быть включены в настоящее изобретение, включают, но не ограничены этим, аланин (ala), аргинин (arg), аспарагин (asn), аспарагиновую кислоту (asp), цистеин (cys), цистин, глутаминовую кислоту (glu), глутамин (gln), глицин (gly), гистидин (his), изолейцин (iso), лейцин (leu), лизин (lys),метионин (met), орнитин (orn), фенилаланин (phe), пролин (pro), серин (ser), треонин (thr), тироксин,триптофан (trp), тирозин (tyr), валин (val), бета-аланин (-ala) и гамма-аминомасляную кислоту (gaba). Предпочтительные аминокислотные остатки включают пролин, лейцин, фенилаланин, изолейцин, аланин, гамма-аминомасляную кислоту, валин, глицин и фенилглицин. Все альфа-аминокислоты за исключением глицина содержат по меньшей мере один асимметриче-4 020976 ский атом углерода. В результате чего они являются оптически активными, существуя в виде D- или Lформы как рацемическая смесь. Соответственно, некоторые из соединений по настоящему изобретению можно получить в виде оптически активной формы или в виде рацемических смесей заявленных здесь соединений. Например, элемент А-ОН, где А обозначает D-аланил, имеет следующую структуру: Используемый здесь термин "алкил", сам по себе или как часть другого заместителя, обозначает,пока не указано иное, линейный или разветвленный углеводородный радикал и может включать ди- и многовалентные радикалы, имеющие указанное количество атомов углерода (т.е. "C1-C10 или 1-10 членный" обозначает от одного до десяти атомов углерода). Если точно не указано, то можно считать,что количество атомов углерода в алкильной группе составляет C1-C10 и любые другие диапазоны и/или их конкретные количества. Примеры углеводородных радикалов включают (но не ограничены этим) такие группы как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, гомологи и изомеры, например, н-пентила, н-гексила, н-гептила, н-октила и подобные. Не подразумевается, что термин "алкил" включает такие алкильные производные как "гетероалкил", пока не указано иное. Термин "циклоалкил", сам по себе или в комбинации с другими терминами, представляет циклические варианты "алкила", пока не указано иное. Примеры циклоалкила включают, но не ограничены этим,циклопентил, циклогексил, циклогептил и подобные. Термин "галоген", сам по себе или как часть другого заместителя, обозначает атом фтора, хлора,брома или йода, пока не указано иное. Кроме того, подразумевается, что такие термины как "галогеналкил" включают моногалогеналкил и полигалогеналкил. Например, предполагается, что термин "галоген(C1-C4)алкил" включает, но не ограничен этим, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3 бромпропил и подобные. Используемый здесь термин "замещенный" касается замещения атома водорода в соединении замещающей группой. Заместитель может представлять собой неводородный атом или множество атомов,среди которых по меньшей мере один атом является неводородным атомом, и один или более атомов могут быть или не быть атомами водорода. Например, без ограничения, замещенные соединения могут содержать один или более заместителей, выбранных из группы, включающей R", OR", NR"R'", SR", галоген, SiR"R'"R, OC(O)R", C(O)R", CO2R", CONR"R'", NR'"C(O)2R", S(O)R", S(O)2R", CN и NO2. Как здесь используется, каждый R", R'" и R может быть независимо выбран из группы, включающей атом водорода, атом галогена, атом кислорода, замещенный или незамещенный гетероалкил, замещенный или незамещенный арил, замещенный или незамещенный алкил, алкокси или тиоалкокси группы и арилалкильные группы. Термин "фрагмент" обозначает радикал молекулы, который присоединен к другому фрагменту. В частности, термин "фторсодержащий фрагмент" обозначает радикал молекулы, которая имеет по меньшей мере один фторсодержащий радикал и/или атом фтора. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначаетCH(NR1R2)CF3, то G3 и G4 независимо представляют собой Н или C1-C4 алкил, и G2 обозначает Н, C1-C4 алкил или циклопропил. Некоторые варианты формулы I касаются соединений, в которых, если G2 обозначает (CH2)nCF2R3,1 то G и G3 независимо представляют собой Н, C1-C4 алкил, СН 2 ОН или CH2NR1R2. Некоторые варианты формулы I касаются соединений, в которых, если G2 обозначает Н, то G4 обозначает Н или C1-C4 алкил. Некоторые варианты формулы I касаются соединений, в которых, если G3 обозначает тоG и G4 независимо представляют собой Н или C1-C4 алкил. Некоторые варианты формулы I касаются соединений, в которых, если G3 обозначает CH2CF3, то G1 обозначает NR1R2. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH2NR1R2, то 2G обозначает (CH2)nCF2R3. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH(R7)CF2H,3 то G и G4 независимо представляют собой Н или C1-C4 алкил, и G2 обозначает C1-C4 алкил или циклопропил. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH(R4)CF3, то 2G обозначает C1-C4 алкил или циклопропил; при условии, что если R4 обозначает Н или ОН, то G3 обозначает CH2NR1R2, CH2-A-OH, CH2-A-NHR9. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH(R4)CF3 и 4R обозначает Н или ОН, то G4 обозначает атом галогена. Некоторые варианты формулы I касаются соединений, в которых, если G1 или G3 обозначает СН 2 ОН, то G2 обозначает (CH2)nCF2R3. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает NR1R2, то G3 обозначает CH2CF3, G4 обозначает Н или C1-C4 алкил и G2 обозначает C1-C4 алкил или циклопропил. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH(R8)CF3, то 1G и G3 независимо представляют собой Н или C1-C4 алкил, и G2 обозначает атом водорода, C1-C4 алкил или циклопропил. Некоторые варианты формулы I касаются соединений, в которых, если G3 обозначает СН 2-А-ОН или CH2-A-NHR, то G4 обозначает Н или C1-C4 алкил, G2 обозначает C1-C4 алкил или циклопропил и G1 обозначает CH(R4)CF3, где R4 обозначает Н или OH. Некоторые варианты формулы I касаются соединений, в которых, если G3 обозначает CH2NR1R2 и 2CH(R4)CF3, где R4 обозначает Н или ОН. Некоторые варианты формулы I касаются соединений, в которых, если G1 обозначает CH(R4)CF3 и 4R обозначает Н или ОН, то либо G3 обозначает CH2NR1R2, либо G4 обозначает атом галогена. Некоторые варианты формулы I касаются соединений, в которых, если G3 обозначает CH(R4)CF3, то 1G обозначает CH2NR1R2 или NR1R2. Некоторые варианты формулы I касаются соединений, имеющих структуру формулы II 1G4 обозначает Н, C1-C4 алкил или атом галогена;R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С 1-С 4 алкил)-замещенный пиперазинил, морфолино и пиперидинил;R3 обозначает Н или F. Некоторые варианты формулы II касаются соединений, в которых n равно 1. Некоторые варианты формулы II касаются соединений, в которых G4 обозначает Н. Некоторые варианты формулы II касаются соединений, в которых R3 обозначает Н. Некоторые варианты формулы II касаются соединений, в которых R3 обозначает F. Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает метил, R3 обозначает F, G2 обозначает трифторэтил и G1 бозначает Н. Этому соединению можно дать название 5-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он,Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает Н, R3 обозначает F, G2 обозначает трифторэтил и G1 обозначает метил. Этому соединению можно дать название 3-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает Н, R3 обозначает F, G2 обозначает трифторэтил и G1 обозначает этил. Этому соединению можно дать название 2-этил-3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает Н, R3 обозначает F, G2 обозначает трифторэтил и G1 обозначает Н. Этому соединению можно дать название 3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает Н, R3 обозначает F, G2 обозначает трифторэтил и G1 обозначает СН 2 ОН. Этому соединению можно дать название 3-гидрокси-2-(гидроксиметил)-1-(2,2,2-трифторэтил)пиридин 4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомCH2NR1R2, где R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 2[(диметиламино)метил]-3-гидрокси-6-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомCH2NR1R2, где R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 2[(диметиламино)метил]-3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает метил, R3 обозначает F, G2 обозначает трифторэтил и G1 обозначает СН 2 ОН. Этому соединению можно дать название 3-гидрокси-2-(гидроксиметил)-6-метил-1-(2,2,2 трифторэтил)пиридин-4(1 Н)-он,Примером специфического иллюстративного варианта формулы II является соединение, в которомCH2NR1R2, где NR1R2 обозначает пиперидинил. Этому соединению можно дать название 3-гидрокси-6 метил-2-(пиперидин-1-илметил)-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает Н, R3 обозначает Н, G2 обозначает дифторэтил и G1 обозначает метил. Этому соединению можно дать название 1-(2,2-дифторэтил)-3-гидрокси-2-метилпиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомG4 обозначает Н; G3 обозначает метил, R3 обозначает Н, G2 обозначает дифторэтил и G1 обозначает Н. Этому соединению можно дать название 1-(2,2-дифторэтил)-5-гидрокси-2-метилпиридин-4(1 Н)-он, Примером специфического иллюстративного варианта формулы II является соединение, в которомCH2NR1R2, где R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 1(2,2-дифторэтил)-5-гидрокси-2-метилпиридин-4(1 Н)-он, Некоторые варианты формулы I касаются соединений, имеющих структуру формулы IIIG4 обозначает Н, C1-C4 алкил или атом галогена;R4 выбран из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С 1 С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10; и если R4 обозначает NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-С 1-С 4 алкилпиперазинил, Nбензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -A-NH-R10, то точкой присоединения R4 к фрагменту -СН от G1 является атом N от R4;R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N- (С 1-С 4 алкил)-замещенный пиперазинил, морфолино и пиперидинил; А обозначает -NH-(CH2)mCO- или альфа-аминокислотный остаток;R9 и R10 независимо представляют собой Н или C1-C4 алкил. Соединения формулы III включают соединения формулы I, где G1 обозначает CH(R4)CF3. Соединения формулы III можно дополнительно разделить на три основных подкатегории, соответствующие формуле IIIA, формуле IIIB и формуле IIIC. Соединения формулы IIIA представляют собой соединения формулы III, где G2 обозначает C1-C4-8 020976 алкил или циклопропил, G3 обозначает Н или C1-C4 алкил; и R4 выбран из группы, включающей NR1R2,имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-С 4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -A-NH-R10. Некоторые варианты формулы IIIA представляют соединения, в которых G2 обозначает метил. Некоторые варианты формулы IIIA представляют соединения, в которых G3 обозначает Н и G4 обозначает Н. Некоторые варианты формулы IIIA представляют соединения, в которых R4 обозначает NR1R2. Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н, G3 обозначает Н, G2 обозначает метил, R4 обозначает A-NHR10, А обозначает Dаланил и R10 обозначает метил. Этому соединению можно дать название N-метил-N2-[2,2,2-трифтор-1-(3 гидрокси-1-метил-4-оксо-1,4-дигидропиридин-2-ил)этил]-D-аланинамид, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает метил иR2 обозначает метил. Этому соединению можно дать название 2-[1-(диметиламино)-2,2,2-трифторэтил]3-гидрокси-1-метилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает метил иR2 обозначает пропаргил. Этому соединению можно дать название 3-гидрокси-1-метил-2-2,2,2-трифтор 1-[метил(проп-2-ин-1-ил)амино]этилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает Н, R2 обозначает циклопропил. Этому соединению можно дать название 2-[1-(циклопропиламино)-2,2,2 трифторэтил]-3-гидрокси-1-метилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает Н, R2 обозначает аллил. Этому соединению можно дать название 3-гидрокси-1-метил-2-[2,2,2-трифтор-1(проп-2-ен-1-иламино)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в котором G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, NR1R2 обозначает пиперидинил. Этому соединению можно дать название 3-гидрокси-1-метил-2-[2,2,2-трифтор-1-(пиперидин 1-ил)этил]пиридин-4 (1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIA является соединение, в кото-9 020976 ром G4 обозначает Н; G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, NR1R2 представляет собой N-метилпиперазинил. Этому соединению можно дать название 3-гидрокси-1-метил-2-[2,2,2 трифтор-1-(4-метилпиперазин-1-ил)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Соединения формулы IIIB представляют собой соединения формулы III, где G3 обозначает СН 2-АОН, CH2-A-NHR9 или CH2NR1R2; G4 обозначает Н или C1-C4 алкил; и R4 обозначает Н или ОН. Некоторые варианты формулы IIIB представляют собой соединения, в которых G2 обозначает метил. Некоторые варианты формулы IIIB представляют собой соединения, в которых G4 обозначает Н. Примером специфического иллюстративного варианта формулы IIIB является соединение, в котором G4 обозначает Н; G3 обозначает CH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил и R4 обозначает Н. Этому соединению можно дать название 6-[(диметиламино)метил]-3-гидрокси 1-метил-2-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы является соединение, в котором G4 обозначает Н; G3 обозначает CH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил и R4 обозначает ОН. Этому соединению можно дать название 6-[(диметиламино)метил]-3-гидрокси-1 метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIB является соединение, в котором G4 обозначает Н; G3 обозначает СН 2-А-ОН, А обозначает L-аланил, G2 обозначает метил и R4 обозначает ОН. Этому соединению можно дать название N-[5-гидрокси-1-метил-4-оксо-6-(2,2,2-трифтор-1 гидроксиэтил)-1,4-дигидропиридин-2-ил]метил-L-аланин, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIB является соединение, в котором G4 обозначает Н; G3 обозначает CH2-A-NHR9, А обозначает L-аланил, R9 обозначает метил, G2 обозначает метил и R4 обозначает ОН. Этому соединению можно дать название N2-[5-гидрокси-1-метил-4 оксо-6-(2,2,2-трифтор-1-гидроксиэтил)-1,4-дигидропиридин-2-ил]метил-N-метил-L-аланинамид, и оно имеет следующую структуру: Соединения формулы IIIC представляют собой соединения формулы III, где G3 обозначает Н илиC1-C4 алкил; и G4 обозначает атом галогена. Некоторые варианты формулы IIIC представляют собой соединения, в которых G2 обозначает метил. Некоторые варианты формулы IIIC представляют собой соединения, в которых G4 обозначает атом хлора. Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает метил, G2 обозначает метил и R4 обозначает ОН. Этому соединению можно дать название 3-хлор-5-гидрокси-1,2-диметил-6-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает метил, G2 обозначает метил и R4 обозначает Н. Этому соединению можно дать название 3-хлор-5-гидрокси-1,2-диметил-6-(2,2,2-трифторэтил)пиридин-4(1 Н)-он,и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает метил, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 3-хлор-6-[1(диметиламино)-2,2,2-трифторэтил]-5-гидрокси-1,2-диметилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает Н, G2 обозначает метил, R4 обозначает NR1R2, R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 5-хлор-2-[1-(диметиламино)-2,2,2 трифторэтил]-3-гидрокси-1-метилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает Н, G2 обозначает метил, R4 обозначает NF1R2 и NR1R2 представляет собой пиперидинил. Этому соединению можно дать название 5-хлор-3-гидрокси-1-метил-2[2,2,2-трифтор-1-(пиперидин-1-ил)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IIIC является соединение, в котором G4 обозначает атом хлора, G3 обозначает Н, G2 обозначает метил, R4 обозначает Н. Этому соединению можно дать название 5-хлор-3-гидрокси-1-метил-2-(2,2,2-трифторэтил)пиридин-4(1 Н)-он, и оно имеет следующую структуру: Некоторые варианты формулы I касаются соединений, имеющих структуру формулы IVR1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены;- 11020976 если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(C1-C4 алкил)-замещенный пиперазинил, морфолино и пиперидинил; А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток;R10 обозначает Н или C1-C4 алкил. Некоторые варианты формулы IV представляют собой соединения, в которых G3 обозначает Н. Некоторые варианты формулы IV представляют собой соединения, в которых G1 обозначает метил. Примером специфического иллюстративного варианта формулы IV является соединение, в которомG3 обозначает Н; G1 обозначает метил, G2 обозначает Н, R8 обозначает A-NHR10, А обозначает L-аланил и R10 обозначает метил. Этому соединению можно дать название N-метил-N2-[2,2,2-трифтор-1-(5 гидрокси-6-метил-4-оксо-1,4-дигидропиридин-3-ил)этил]-L-аланинамид, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IV является соединение, в которомR2 обозначает метил. Этому соединению можно дать название 5-[1-(диметиламино)-2,2,2-трифторэтил]3-гидрокси-1,2-диметилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IV является соединение, в которомG3 обозначает Н; G1 обозначает метил, G2 обозначает метил, R8 обозначает NR1R2; R1 обозначает Н и R2 обозначает метил. Этому соединению можно дать название 3-гидрокси-1,2-диметил-5-[2,2,2-трифтор-1(метиламино)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IV является соединение, в которомG3 обозначает Н; G1 обозначает метил, G2 обозначает метил, R8 обозначает NR1R2; NR1R2 представляет собой пиперидинил. Этому соединению можно дать название 3-гидрокси-1,2-диметил-5-[2,2,2-трифтор 1-(пиперидин-1-ил)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IV является соединение, в которомG3 обозначает Н; G1 обозначает метил, G2 обозначает метил, R8 обозначает NR1R2; NR1R2 представляет собой имидазолил. Этому соединению можно дать название 3-гидрокси-1,2-диметил-5-[2,2,2-трифтор-1(1 Н-имидазол-1-ил)этил]пиридин-4(1 Н)-он, и оно имеет следующую структуру: Примером специфического иллюстративного варианта формулы IV является соединение, в которомG3 обозначает Н; G1 обозначает метил, G2 обозначает метил, R8 обозначает NR1R2; и NR1R2 представляет собой N-метилпиперазинил. Этому соединению можно дать название 3-гидрокси-1,2-диметил-5-[2,2,2 трифтор-1-(4-метилпиперазин-1-ил)этил]пиридин-4(1 Н)-он гидрохлорид, и оно имеет следующую структуру: Некоторые варианты формулы I касаются соединений, имеющих структуру формулы VR1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(C1-C4 алкил)-замещенный пиперазинил, морфолино и пиперидинил. Некоторые варианты формулы V представляют собой соединения, в которых G4 обозначает Н. Некоторые варианты формулы V представляют собой соединения, в которых G2 обозначает метил. Примером специфического иллюстративного варианта формулы V является соединение, в которомG4 обозначает Н; R6 обозначает Н, G2 обозначает метил, G1 обозначает NR1R2, R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 2-(диметиламино)-3-гидрокси-1-метил-6(2,2,2-трифторэтил)пиридин-4(1 Н)-он. Примером специфического иллюстративного варианта формулы V является соединение, в которомG4 обозначает Н; R6 обозначает OH, G2 обозначает метил, G1 обозначает CH2NR1R2, R1 обозначает метил и R2 обозначает метил. Этому соединению можно дать название 2-[(диметиламино)метил]-3-гидрокси-1 метил-6-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он, Некоторые варианты формулы I касаются соединений, имеющих структуру формулы VIR7 выбран из группы, включающей Н, ОН, NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1C4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил и -CH2-ANH-R10; и если R7 обозначает NR1R2, имидазолил, 1,2,4-триазолил, пиперазинил, N-C1-C4 алкилпиперазинил, N-бензилпиперазинил, N-фенилпиперазинил, 2-пиридилпиперазинил или -CH2-A-NH-R10, то точкой присоединения R7 к фрагменту СН от G1 является атом N от R7;R1 и R2 представляют собой либо (а) две независимые группы, либо (b) вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены; если R1 и R2 являются независимыми группами, то они независимо выбраны из группы, включающей Н, C1-C4 алкил, С 3-С 6 циклоалкил, аллил и пропаргил; если R1 и R2 вместе образуют единую циклическую группу, содержащую атом N, к которому они присоединены, то она выбрана из группы, включающей пиперазинил, N-(С 1-С 4 алкил)-замещенный пиперазинил, морфолино и пиперидинил; А обозначает -NH-(CH2)m-CO- или альфа-аминокислотный остаток; Примером специфического иллюстративного варианта формулы VI является соединение, в которомG3 обозначает Н, G4 обозначает Н, G2 обозначает метил, G1 обозначает CH(R7)CF2H и R7 обозначает гидроксил. Этому соединению можно дать название 2-(2,2-дифтор-1-гидроксиэтил)-3-гидрокси-1 метилпиридин-4(1 Н)-он, и оно имеет следующую структуру: Другим примером специфического иллюстративного варианта формулы VI является соединение, в котором G3 обозначает Н, G4 обозначает Н, G2 обозначает метил, G1 обозначает CH(R7)CF2H и R7 обозначает Н. Этому соединению можно дать название 2-(2,2-дифторэтил)-3-гидрокси-1-метилпиридин-4(1 Н)он, и оно имеет следующую структуру: Некоторые варианты формулы I касаются соединений, имеющих структуру формулы VIIG4 обозначает Н или C1-C4 алкил. Специфические иллюстративные варианты формулы VII включают соединения, в которых G2 обозначает метил, G3 обозначает Н, G4 обозначает Н, R5 обозначает метил и R6 обозначает Н или ОН. Примером специфического иллюстративного варианта формулы VII является соединение, в котором G2 обозначает метил, G3 обозначает Н, G4 обозначает Н, R5 обозначает метил и R6 обозначает ОН. Этому соединению можно дать название 3-гидрокси-1-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-4(1 Н)-он, и оно имеет следующую структуру: На следующих схемах 1-9 представлены примеры способов, которые можно применять для получения соединений формул I, II, III, IV, V, VI и VII. Все исходные материалы получают по методикам, описанным на этих схемах, методикам, хорошо известным рядовому специалисту в области органической химии, или их можно получить коммерчески. Все конечные соединения по настоящему изобретению можно получить по методикам, описанным на этих схемах, или по аналогичным им методикам. Схема 1 Соединения формулы I, где G2 = -(CH2)nCF2R3, можно получить способом, который показан на схеме 1, или способами, приведенными в примерах, или аналогичными способами. Как показано на схеме 1,соединение (1 а), где G1 обозначает Н или C1-C4 алкил, G3 обозначает Н или C1-C4 алкил, G4 обозначает Н или C1-C4 алкил, можно обработать гидроксидом натрия и бензилбромидом или бензилхлоридом, получая соединение (1b). Введение амина в соединение (lb) можно провести, используя гидрохлорид трифторэтиламина и органическое основание, такое как пиридин, в инертном растворителе, получая соединение(1 с), где n равно 1 и R3 обозначает F, с которого можно удалить защиту либо посредством гидролиза в растворе соляной кислоты, либо каталитическим гидрированием на 10% Pd/C, получая соединение формулы II. Соединение формулы II представляет собой соединение формулы I, где R3 обозначает F и n равно 1. В качестве иллюстративного примера можно получить соединения формулы I, где G1 обозначает Н,3G обозначает Н, G4 обозначает Н, n равно 1, R3 обозначает F, способом, показанным на схеме 2. Можно провести взаимодействие соединения (2 а) с CF2R3CH2NH2 в воде, получая соединение (2b),которое после нагревания в инертном органическом растворителе, таком как диметилформамид, дает соединение (2 с), с которого можно удалить защиту посредством каталитического гидрирования с применением водорода, каталитического палладия-на-угле, получая соединение (2d), которое представляет собой соединение формулы II, где n равно 1, G1 обозначает Н, G3 обозначает Н, G4 обозначает Н. Соединение (2d) также представляет собой соединение формулы I, где G1 обозначает Н, G3 обозначает Н, G4 обозначает Н, n равно 1, G2 обозначает -CH2CF2R3. Соединения формулы I, где n равно 1, G2 обозначает CH2CF2R3, G1 обозначает CH2NR1R2, СН 2 ОН,или соединение формулы II, где G1 обозначает СН 2 ОН или CH2NR1R2, получают способом, который показан на схеме 3. Схема 3 Можно провести взаимодействие соединения (3 а) с формальдегидом и гидроксидом натрия, получая соединение (3b). Взаимодействие соединения (3b) с тионилхлоридом в инертном растворителе, таком как ацетонитрил, дает хлорсодержащее соединение (3 с), которое можно погасить амином R1R2NH с получением соединения формулы (3d), которое представляет собой соединение формулы I, если G1 обозначает CH2NR1R2. Это соединение можно выделить общеизвестными способами. По-другому, если n=1,можно провести взаимодействие соединения (3 а) непосредственно с бис-(диметиламино)метаном, получая соединение (3d), которое представляет собой соединение формулы I, где G1 обозначает CH2N(CH3)2. Соединения формулы I, где G1 обозначает CH(R4)CF3, R4 обозначает NR1R2, ОН, Н, или соединения формулы III, где R4 обозначает NR1R2, ОН, Н; G2 обозначает Н, C1-C4 алкил; G3 обозначает Н, C1-C4 алкил; G4 обозначает Н, C1-C4 алкил, атом галогена, можно получить способом, который показан на схеме 4. С целью иллюстрации на схеме показан синтез соединения формулы I, или IIIA, или IIIC, где G3 обозначает Н. Схема 4 Можно провести взаимодействие соединения (4 а) с гипохлоритом натрия в 2N NaOH, получая хлорсодержащее производное (4b), которое затем можно использовать для взаимодействия с карбонатом калия и метилйодидом в диметилформамиде, получая N-метильное соединение (4 с). ТЕМРО-окисление в инертном растворителе, таком как ацетон, дает карбоновую кислоту (4d). Удаление защиты посредством кислоты и декарбоксилирование с применением 6N соляной кислоты дает исходное вещество (4 е). Можно провести взаимодействие соединения (4 е) с CF3CH(OCH3)OH, получая диол (4f). Обработка тионилхлоридом и пиридином дает хлорид (4g). При взаимодействии соединения (4g) с боргидридом натрия можно получить соединение (4h). Соединение (4i) получают в результате гашения хлорида (4g) посредством R1R2NH. Соединение (4i) представляет собой соединение формулы I, где G1 обозначает CH(R4)CF3, R4 обозначает NR1R2, где R1, R2 обозначают метил, G2 обозначает метил, G3 обозначает Н и G4 обозначает атом хлора. Оно также представляет собой соединение формулы III, в котором R4 обозначает NR1R2, где R1, R2 обозначают метил, G2 обозначает метил, G3 обозначает Н и G4 обозначает атом хлора. Соединение (4h) представляет собой соединение формулы I, где G1 обозначает CH(R4)CF3, R4 обозначает Н, G2 обозначает метил, G3 обозначает Н, G4 обозначает атом хлора. Оно также представляет собой соединение формулы III, где R4 обозначает Н, G2 обозначает метил, G3 обозначает Н, G4 обозначает атом хлора. Соединение (4f) представляет собой соединение формулы I, где G1 обозначает CH(R4)CF3, R4 обозначает ОН, G2 обозначает метил, G3 обозначает Н, G4 обозначает атом хлора. Оно также представляет собой соединение формулы III, где R4 обозначает ОН, G2 обозначает метил, G3 обозначает Н, G4 обозначает атом хлора. Соединение формулы I, где G4 обозначает CH(R8)CF3, R8 обозначает NR1R2 , G3 обозначает Н, G1 обозначает C1-C4 алкил, G2 обозначает C1-C4 алкил, или соединение формулы IV, где R8 обозначаетNR1R2, G3 обозначает Н, G1 обозначает метил, G2 обозначает метил, можно получить по типичным методикам, как описано ниже на схеме 5: Схема 5 Соединение (5 с) можно получить согласно методике, описанной в WO20080242706. Взаимодействие соединения (5 с) с тионилхлоридом дает (5d), который можно загасить амином R1R2NH, получая соединение (5 е). Соединение (5 е) представляет собой соединение формулы I, где G4=CH(R8)CF3, R8 обозначает NR1R2, G3 обозначает H, G1 обозначает метил, G2 обозначает метил. Оно также представляет собой соединение формулы IV, где R8 обозначает NR1R2, G3 обозначает Н, G1 обозначает метил, G2=метил. Если R1 обозначает метил, R2 обозначает метил, то соединение (5 е) имеет химическое название 5-[1(диметиламино)-2,2,2-трифторэтил]-3-гидрокси-1,2-диметилпиридин-4(1 Н)-он. Соединение формулы I, где G1 обозначает CH(R4)CF3, R4 обозначает Н или ОН, G2 обозначает C1-C4 алкил, G3 обозначает CH2NR1R2, G4 обозначает Н, или соединение формулы IIIB, где R4 обозначает Н или ОН, G2 обозначает метил, G3 обозначает CH2NMe2, G4 обозначает Н, можно получить по типичным методикам, как описано ниже на схеме 6. Схема 6 Спирт (ба) можно преобразовать в хлорсодержащее соединение (6b) посредством тионилхлорида. При гашении диметиламином образуется соединение (6 с), с которого можно удалить защиту каталитическим гидрированием с использованием палладия-на-угле, получая соединение (6d). Взаимодействие соединения (6d) с CF3CH(OH)ОСН 3 и карбонатом калия дает диол (6 е), который взаимодействует с тионилхлоридом, давая соединение (6f). Восстановление хлорсодержащего соединения посредством каталитического гидрирования дает соединение (6g). Соединение (6 е) представляет собой соединение формулы I,где G4 обозначает Н, G3 обозначает CH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил, G1 обозначает CH(R4)CF3, R4 обозначает ОН. Оно также представляет собой соединение формулыIIIB, где G4 обозначает Н, G3 обозначает CH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил, R4 обозначает ОН. Соединение (6 е) имеет химическое название 6-[(диметиламино)метил]3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он. Соединение (6g) представляет собой соединение формулы I, где G4 обозначает Н, G3 обозначаетCH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил, G1 обозначает CH(R4)CF3, R4 обозначает Н. Оно также представляет собой соединение формулы IIIB, где G4=H, G3=CH2NR1R2, R1 обозначает метил, R2 обозначает метил, G2 обозначает метил, G1 обозначает Н. Соединение (6 е) имеет химическое название 6-[(диметиламино)метил]-3-гидрокси-1-метил-2-(2,2,2-трифторэтил)пиридин-4(1 Н)-он. Соединение формулы I, где G3 обозначает Н или C1-C4 алкил; G4 обозначает Н или C1-C4 алкил; G1 обозначает CH(R7)CF2H, или соединение формулы VI, где G3 обозначает Н или C1-C4 алкил; G4 обозначает Н или C1-C4 алкил; R7 обозначает Н, ОН, NR1R2, можно получить по типичным методикам, как описано ниже на схеме 7. Схема 7 Можно провести взаимодействие соединения (7 а) с этилполуацеталем дифторацетальдегида и карбонатом калия, получая соединение формулы (7b). Этот промежуточный продукт можно преобразовать в соединения (7 е) и (7d) аналогично тому, как описано для преобразования соединения (4f) в (4h) и (4i)(схема 4). (7b) представляет собой соединение формулы I, где G1 обозначает CH(R7)CF2H, R7 обозначает ОН, или соединение формулы VI, где R7 обозначает ОН. (7 е) представляет собой соединение формулы I,где R7 обозначает Н, или соединение формулы VI, где R7 обозначает Н, и (7d) представляет собой соединение формулы I, где G1 представляет собой CH(R7)CF2H, R7 обозначает NR1R2, или соединение формулы VI, где R7 обозначает NR1R2. Например, если G2 обозначает метил, G3 обозначает Н, G4 обозначает Н на схеме 1, то соединение (7 е) представляет собой 2-(2,2-дифторэтил)-3-гидрокси-1-метилпиридин 4(1 Н)-он и соединение (7b) представляет собой 2-(2,2-дифтор-1-гидроксиэтил)-3-гидрокси-1 метилпиридин-4(1 Н)-он. Соединение формулы I, где G3 обозначает CH(R6)CF3, R6 обозначает Н, G1 обозначает NR1R2, или соединение формулы V, где R6 обозначает Н, G3 обозначает CH2CF3, G1 обозначает NR1R2, можно получить по типичным методикам, как описано ниже на схеме 8: Схема 8 Сначала можно провести взаимодействие соединения (8 а), где G2 обозначает C1-C4 алкил, G4 обозначает Н, с тионилхлоридом в инертном растворителе. Гашение реакционной смеси амином R1R2NH дает соединение (8b). Структуру (8b) можно подтвердить методами ЯМР и МС спектроскопии. Соединение формулы (8 Ь) представляет собой соединение формулы I, где G2 обозначает C1-C4 алкил, G4 обозначает Н или C1-C4 алкил, R6 обозначает Н; или соединение формулы V, где R6 обозначает Н, G2 обозначаетC1-C4 алкил, G1 обозначает NR1R2, G4 обозначает Н. Например, соединение 5-гидрокси-1-метил-2-(2,2,2 трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он представляет собой соединение (8 а), где G4 обозначает Н, G2 обозначает метил. Соединение (8 а) можно преобразовать в 2-(диметиламино)-3-гидрокси-1-метил-6- 17020976(2,2,2-трифторэтил)пиридин-4(1 Н)-он, соединение (8b), где R1 обозначает метил, R2 обозначает метил, G2 обозначает метил, G4 обозначает атом водорода, посредством диметиламина согласно способу, описанному на схеме 8. Соединение формулы I, где G1 обозначает C(R5) (R6)CF3, R5 обозначает C1-C4 алкил, R6 обозначает ОН, или соединение формулы VII, где R5 обозначает C1-C4 алкил, R6 обозначает ОН, можно получить по типичным методикам, как показано ниже на схеме 9. Схема 9 Сначала можно провести взаимодействие соединения (9 а) с окислителем Десс-Мартина, получая соединение 9b, которое можно пустить во взаимодействие с реагентом Гриньяра R5-MgCl или R5-MgBr,получая соединение 9 с. Каталитическое гидрирование I3 с использованием палладия-на-угле дает соединение 9d, которое представляет собой соединение формулы I, если R5 обозначает C1-С 4 алкил, R6 обозначает ОН. Например, если G2 обозначает метил, G3 обозначает Н, G4 обозначает Н, R5 обозначает метил на схеме 9, то продукт (9d) представляет собой соединение 3-гидрокси-1-метил-2-(1,1,1-трифтор-2 гидроксипропан-2-ил)пиридин-4(1 Н)-он. Многие соединения по данному изобретению или для применения по данному изобретению могут образовывать соли. В таких случаях фармацевтические композиции по данному изобретению могут содержать соль такого соединения, предпочтительно физиологически приемлемую соль, которая известна в данной области. Фармацевтические препараты обычно содержат один или более носителей, подходящих для способа введения препарата, будь то инъекция, ингаляция, наружное применение, лаваж или другие способы, подходящие для выбранного лечения. Подходящими являются носители, известные в данной области как носители для применения в таких способах введения. Подходящие фармацевтические композиции можно приготовить известными в данной области способами, и специалист, практикующий в данной области, может определить способ их введения и дозировку. Для парентерального введения соединение можно растворить в стерильной воде, или физиологическом растворе, или фармацевтически приемлемом носителе, используемом для введения нерастворимых в воде соединений, таком как носитель, используемый для витамина K. Для энтерального введения соединение можно применять в виде таблетки, капсулы или в виде раствора в жидкости. Таблетка или капсула может иметь энтеросолюбильное покрытие или представлять собой препарат с длительным высвобождением активного компонента. Известны многие подходящие препараты, в том числе полимерные или белковые микрочастицы, включающие подлежащее высвобождению соединение, мази, пасты, гели,гидрогели или растворы, которые можно применять для наружного или локального введения соединения. Можно применять пластырь или имплант с длительным высвобождением для обеспечения высвобождения активного компонента в течение продолжительного периода времени. Многие методики, известные специалисту в данной области, описаны в работе Remington: the SciencePractice of Pharmacy,Alfonso Gennaro, 20th ed., Lippencott WilliamsWilkins, (2000). Препараты для парентерального введения могут содержать, например, наполнители, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительной природы или гидрированные нафталины. Для регулирования высвобождения соединений можно использовать биосовместимый, биоразрушаемый лактидный полимер, сополимер лактид/гликолид или полиоксиэтилен-полиоксипропиленовые сополимеры. Другие системы, потенциально пригодные для парентеральной доставки модулирующих соединений, включают частицы этиленвинилацетатного сополимера, осмотические насосы, имплантируемые системы для инфузии и липосомы. Препараты для ингаляции могут содержать наполнители, например лактозу, или могут представлять собой водные растворы, содержащие, например, полиоксиэтилен-9-лауриловый эфир, гликохолат и деоксихолат, или могут представлять собой масляные растворы для введения в виде назальных капель или в виде геля. Соединения или фармацевтические композиции по данному изобретению или для применения по данному изобретению можно вводить при помощи медицинского устройства или приспособления, такого как имплант, трансплантат, протез, стент и др. Также можно разработать импланты, которые предназначены для содержания и высвобождения таких соединений или композиций. Примером может быть имплант, изготовленный из полимерного материала, адаптированного для высвобождения соединения в течение некоторого периода времени."Эффективное количество" фармацевтической композиции по изобретению включает терапевтиче- 18020976 ски эффективное количество или профилактически эффективное количество. Выражение "терапевтически эффективное количество" касается количества, эффективного при дозах и в течение периодов, необходимых для достижения желательного терапевтического результата, например, улучшения распределения железа или снижения уровней токсического железа. Терапевтически эффективное количество соединения может варьироваться в соответствии с такими факторами как болезненное состояние, возраст, пол и масса субъекта и способность соединения вызвать у субъекта желательную реакцию. Схемы дозировки можно регулировать для обеспечения оптимальной терапевтической реакции. Терапевтически эффективным количеством является также количество, при котором терапевтически благоприятные эффекты превосходят любые токсические или вредные эффекты соединения. Выражение "профилактически эффективное количество" касается количества, эффективного при дозах и в течение периодов, необходимых для достижения желательного профилактического результата, например улучшения распределения железа или снижения уровней токсического железа. Обычно профилактическую дозу вводят субъектам до заболевания или на ранней стадии заболевания, так что профилактически эффективное количество может быть меньше, чем терапевтически эффективное количество. Следует отметить, что величины можно варьировать в зависимости от тяжести подлежащего облегчению состояния. Для конкретного субъекта специфические схемы дозирования можно регулировать со временем в соответствии с индивидуальной потребностью и профессиональным заключением специалиста, производящим введение или наблюдение за введением композиции. Указанные здесь диапазоны доз являются только иллюстративными и не ограничивают диапазоны доз, которые могут выбрать лечащие врачи. Количество активного соединения(й) в композиции можно менять в соответствии с такими факторами, как болезненное состояние, возраст, пол и масса субъекта. Схемы дозировки можно регулировать для обеспечения оптимальной терапевтической реакции. Например, можно вводить один болюс, можно вводить несколько поделенных доз во времени или можно пропорционально снизить или увеличить дозу при острой необходимости, как показывает терапевтическая ситуация. Может быть предпочтительным приготовление парентеральных композиций в виде стандартных дозированных форм для простоты введения и единообразия дозировки. Вообще, соединения по изобретению следует применять так, чтобы не вызывать существенной токсичности. Токсичность соединений по изобретению можно определять, применяя стандартные методики,например исследуя клеточные культуры или экспериментальных животных и определяя терапевтический индекс, т.е. соотношение между LD50 (летальная доза популяции до 50%) и LD100 (летальная доза популяции до 100%). Однако при некоторых обстоятельствах, таких как тяжелые болезненные состояния,может потребоваться введение существенных избытков композиций. Используемый здесь термин "субъект" может обозначать человека, примата, отличного от человека,крысу, мышь, корову, лошадь, свинью, овцу, козу, собаку, кошку и др. Можно предположить, что субъект имеет или находится под риском медицинского состояния, связанного с токсической концентрацией железа. Медицинское состояние, связанное с токсической концентрацией железа, может быть выбрано из группы, включающей рак, болезнь легких, прогрессирующую болезнь почек и атаксию Фридрейха. Методы диагностики различных медицинских состояний, связанных с токсической концентрацией железа, и клинического выявления различных медицинских состояний, связанных с токсической концентрацией железа, и их диагнозы известны рядовым специалистам в данной области. Важным свойством железа является его способность легко отдавать и принимать электрон, переходя из одного вида в другой, между двухвалентным железом (Fe2+) и трехвалентным железом (Fe3+). Это может являться той склонностью, из-за которой железо может играть критическую роль в обеих реакциях, Фентона и Хабер-Вайса, при катализе производства гидроксильных радикалов. Таким образом, в условиях, когда облегчено восстановление Fe(III) до Fe(II), образование этого активного вида кислорода(гидроксильного радикала) может вызывать значительное поражение биомолекул в живых системах, которые включают клеточные мембраны, белки и ДНК.H2O2+O2-О 2+ОН-+ОН (цикл Хабер-Вайса). Агенты хелатирования железа могут либо ингибировать, либо способствовать участию железа в реакциях Фентона и Хабер-Вайса, которые продуцируют токсические кислородные радикалы. Так как некоторые агенты хелатирования железа могут потенциально промотировать восстановление Fe3+, важными являются ранние оценки, может ли хелатирующий агент промотировать, предотвращать или не оказывать влияния на восстановление Fe3+. Имеется несколько наиболее типичных способов и химических моделей, которые используются для изучения способности хелатирующих агентов ограничивать участие железа в реакциях по генерации радикалов через непрямое наблюдение образования радикалов (Dean RTNicholson P (1994) Free RadicalRes 20: 83-101 и Gutteridge J.M. (1990) Free Radical Res Commun 9: 119-125). Применение циклической вольтаметрии и исследования гидроксилирования бензойной кислоты для скрининга соединений формулы I проиллюстрировано в примерах 30 и 31, соответственно. Нейрозащитный эффект соединений формулы I продемонстрирован в исследовании апоптоза, индуцированного пероксидом водорода в клетках нейробластомы SH-SY5Y, в примере 32 А. Защитный эффект соединений формулы I относительно эндогенно продуцируемой А токсичности показан в примере 32 В. Цитотоксичность также индуцировали посредством допаминергического нейротоксина МРР+ на клетках SV-NRA. Нейрозащитное действие отобранных соединений формулы I дополнительно продемонстрировано на (MPP+)-обработанных клетках SV-NRA в приведенном ниже примере 33.In vivo исследования фармакокинетического (РК) и гематоэнцефалического барьера (ГЭБ) проводили на самцах крыс Sprague-Dawley, применяя кассетное дозирование посредством перорального введения. Тема кассетного дозирования рассмотрена в работе Manitpisitkul, Р. и White, R.E. (August 2004),Drug Discovery, Vol. 9. No. 15, pp. 652-658. Результаты суммированы в приведенной ниже таблице: Список соединений формулы I, тестированных в ГЭБ-исследовании с кассетным дозированием Обычно принимается, что 1,2-диметил-3-гидроксипирид-4-он и его алкильные производные представляют собой бидентатные лиганды (L) и взаимодействуют с Fe(III), образуя нейтральные хелаты 1:3. На диаграмме видообразования, которая показана на фиг. 4, процент вида FeL3 близок к 100 при рН 7,4,если в качестве лиганда используют деферипрон. Результирующий Fe-хелат (FeL3) не является редоксактивным, о чем свидетельствует анализ методом циклической вольтаметрии. Однако если рН снижают до 6,0, то тогда в растворе присутствует смесь видов FeL2+ и FeL3. Деферипрон (1,2-диметил-3 гидроксипирид-4-он) эффективен для удаления Fe(III) при рН 7,2 в физиологических условиях, но при меньшем рН деферипрон и его алкильные производные значительно менее эффективны.Hider et al. (J. Pharm. Pharmacol. 2000, 52, 263-273; European Journal of Medicinal Chemistry 2008, 42,1035-1047) сообщают об использовании алкиламинопроизводных 3-гидроксипиридин-4-онов. Две диаграммы видообразования проиллюстрированы двумя различными концентрациями 2-этил-3-гидрокси-1[2-(пиперидин-1-ил)этил]пиридин-4(1 Н)-она [L]: 110-5 М и 710-4 М, соответственно - при сохранении концентрации [Fe], фиксированной при 110-6 M. Хелат FeL3 имеет более широкий профиль стабильности только при рН 5 и выше, и если [L] составляет 710-4 М (фиг. 9 из работы J. Pharm. Pharmacol. 2000,52, 271). Однако при концентрации [L]=110-5 М профиль стабильности FeL3 очень похож на профиль комплекса Fe-деферипрон. Отобранные аминосоединения по данному изобретению, такие как Аро 7041, имеют стабильность хелата FeL3, простирающуюся от рН 5 и выше. Анализ фотоспектроскопических данных Fe-хелата показывает, что фторированный 3-гидроксипиридин-4-он со слабоосновной аминогруппой является более сильным акцептором протонов, чем атом кислорода в связи Fe-О хелата. В диапазоне рН от 5 до 7,2Fe(III) заблокирован в виде хелата трехвалентного железа FeL3 и FeL3H. Диаграмма видообразования Аро 7041 На фиг. 5 показывает, что FeL2 не присутствует при рН выше 5,0. Кроме того, концентрация лиганда [L] не влияет на результат диаграммы видообразования в этом химическом исследовании. Количество слабоосновных аминов, доступных в качестве акцепторов протонов в хелате трехвалентного железа, равно трем. Перед расщеплением связи Fe-О хелата 1:3 все три аминогруппы должны быть протонированы. Характеристика этого соединения, действующего в качестве внутреннего приемника протонов, дает в результате повышение стабильности хелата при низком рН, что дает чистое преимущество над нейтральными 3-гидроксипиридин-4-онами, такими как деферипрон. На фиг. 6 и 7 пред- 20020976 ставлено сравнение хелатов нейтральных и основных аминов. При снижении рН примерно до 5,0 значительное количество FeL3 разлагается, давая FeL2 через расщепление связи Fe-O, если L представляет собой нейтральный лиганд. Однако хелаты основных аминопроизводных формулы I по этому изобретению являются стабильными при меньших рН. Деферипрон претерпевает фазу II метаболизма, в результате чего происходит обширное глюкуронидирование по С 3-атому кислорода 3-гидроксипиридин-4-онового каркаса. Таким образом, для достижения терапевтического эффекта требуется высокая пероральная доза деферипрона. Отобранные соединения по данному изобретению предназначены специально для блокирования С 3-атома кислорода от глюкуронидирования посредством введения объемного С 3- или С 5-трифторэтильного фрагмента, замещенного аминопроизводным. В моделирующих исследованиях простая трифторэтильная группа имеет такой же стерический объем как изопропильная группа. Например, стерический объем 1-диметиламино 2-трифторэтильного заместителя может предотвратить О-глюкуронидирование по С 3, не влияя на образование хелата трехвалентного железа FeL3. 3D моделирование соединения Fe(Apo7041)3 показано на фиг. 8. Эксперименты по циклической вольтаметрии показывают, что образуется стабильный Fe(Apo7041)3 с E1/2 = -731 мВ (фиг. 2). Данные показывают, что Fe(Apo7041)3 не является редокс-активным и представляет собой стабильный химический объект. Величина кумулятивного log 130 для Аро 7041 и Fe(III) составляет 38,8 (табл. 29 В в примере 29 В), что является относительно более высоким значением, чем значение для деферипрона 37,24 (табл. 1). В отличие от других аминопроизводных 3-гидроксипиридин-4 она, как сообщает Hider et al., pKa С 2-аминофрагмента от Аро 7041 составляет 3,5 в 0,1 М водном NaCl. Таким образом, при рН 3,5 существуют протонированная форма и непротонированная форма амина с соотношением 1:1. При постепенном повышении рН в среде будет значительно больше свободного основания. Отобранные аминопроизводные по данному изобретению имеют большую селективность относительно металла по сравнению с деферипроном. В табл. 1 сравниваются металл-связывающие свойства Аро 7041 со свойствами деферипрона. Например, кумулятивный log 120 для Zn(II) и Cu(II) составляет,соответственно, 13,2 и 17,3 для Аро 7041, что на 2-3 порядка величины меньше по сравнению с величинами для деферипрона, 15,0 и 20,5, соответственно, в смеси 0,1 М водный NaCl/MeOH, 1/1 об./об. Таким образом, аминопроизводные по данному изобретению селективны к Fe(III). Порядок расположения металлов в соответствии со связывающим сродством следующий Fe(III)Cu(II)Zn(II). Таблица 1. Сравнение металлсвязывающих свойств аминосоединения Аро 7041 и деферипрона а,b- 21020976 Кроме Fe3+, значения pKa и logопределяли в смеси 0,1 М водный NaCl/MeOH, 1/1 об./об. Для Fe3+ значения рКа и logопределяли в 0,1 М водном NaCl. Подробности см. в примере 29 В. Соединения по данному изобретению могут быть полезны для лечения пациентов с болезнью почек, при которой детектируют присутствие железа в моче. В патенте США 6906052 описано определение содержания белка и свободного железа в моче как возможный способ мониторинга болезни почек. Одной биологической функцией почки является удерживание белка. Термин "протеинурия" обозначает наличие в моче избытка белков сыворотки и может быть признаком почечного поражения (болезни почек). Повреждение клубочка, или канальца, или поджелудочной железы может неблагоприятно влиять на способность почки удерживать белок. У животных с нефротическим синдромом рН мочи может варьироваться от 5,2 до 7,8. Эксперименты на животных показали, что железо связывается с трансферрином при рН 6,05. Если рН уменьшается ниже 6,0, то происходит заметное повышение количества несвязанного железа. Железо, диссоциированное от трансферрина, способно вызывать потенциально серьезное поражение почек свободными радикалами. Для хелатирования свободного железа использовали в качестве возможного лечебного средства небольшой низкомолекулярный хелатирующий агент, такой как деферипрон.Cooper et al. сообщают о видообразовании железа в моче (American Journal of Kidney Diseases, 25,1995, 314-319) при нефротическом синдроме, где железо присутствует в жидкости канальцев в нереактивном виде в ассоциации с трансферрином, в результате протечки клубочкового белка. У крыс с нефротическим синдромом железо остается связанным с трансферрином повсюду в нефроне и выводится как таковое с мочой при щелочном рН. Когда рН мочи становится ниже 6, железо начинает диссоциировать от трансферрина. Как упоминалось ранее, свободное железо является редокс-активным и может вызывать дальнейшее програссирование почечных заболеваний. Слабоосновное соединение может аккумулироваться в кислотном отсеке для оказания своего биологического действия. Нейтральные соединения и сильные основания не аккумулируются таким образом. Например, антисекреторный агент омепразол представляет собой слабое основание, которое концентрируется в кислотном отсеке париетальной клетки, проявляя свои фармакологические свойства. Аминопроизводные 3-гидроксипиридин-4-она по данному изобретению благоприятствуют накоплению в местах, где имеется слегка кислотный отсек. Одним таким примером может быть нефрон у пациентов с болезнью почек. Аминопроизводные 3-гидроксипиридин-4-она по данному изобретению обладают по меньшей мере одним из ряда свойств: (а) они представляют собой слабые амины, которые могут аккумулироваться в кислотном отсеке биологической системы; (b) хелаты FeL3 1:3 стабильны при более низких рН, от 5 до 7,2 по сравнению с хелатами нейтральных алкильных производных 3-гидроксипиридин-4-она, таких как деферипрон; (с) они не являются редокс-активными, что подтверждено исследованием методом циклической вольтаметрии; (d) они несут объемный заместитель по положению С 2 или С 5, который может блокировать глюкуронидирование С 3-ОН и, таким образом, может требоваться меньшая терапевтическая доза лекарства; (е) более высокая скорость метаболического очищения, чем для деферипрона, в фармакокинетических исследованиях с кассетным дозированием. Таким образом, соединения по данному изобретению могут иметь склонность претерпевать выведение с мочой, и понятно, что существенным местом для свободного железа у пациентов с болезнью почек является почка. Другим возможным полезным применением аминосоединений по данному изобретению является применение для лечения рака и воспалительных заболеваний легких. Buss et al. рассматривают роль хелатообразования железа для терапии рака (Current Medicinal Chemistry, 2003, 12, 1021-1034). Повреждение ДНК вследствие окислительного стресса включает переходный металл, такой как железо. Липосомы содержат сравнительно высокую концентрацию редокс-активного железа, которое генерируется, главным образом, при деградации железосодержащих белков. Кислотный отсек липосомы дополнительно способствует катализируемым железом окислительным реакциям (Kurz et al., Biochem. J. (2004) 378,1039-1045). Сообщается, что агент хелатирования железа DFO ингибирует синтез ДНК и пролиферацию клеток. DFO представляет собой слабое основание со свободным аминотерминалом и может аккумулироваться в липосоме, приводя в действие свой механизм хелатообразования. К сожалению DFO является большим пептидным гексадентатным хелатирующим агентом и не будет легко проникать в клетку. Аминные соединения по данному изобретению представляют собой соединения с низкой молекулярной массой. Слабоосновная природа этого соединения и его липофильный характер позволяют соединению аккумулироваться в кислотном отсеке липосом.Richardson et al. сообщают, что наиболее важный клеточный пул редокс-активного железа может существовать в липосомах, делая органеллы восприимчивыми к окислительному стрессу (экспертное заключение по лекарственным препаратам, проходящим исследование, август 2005, т. 14,8, стр. 9971008). В результате окислительного стресса происходит поражение ткани. Вследствие этого, терапия с хелатированием железа, нацеленная на липосомы, может представлять возможную стратегию лечения воспалительных легочных заболеваний. Слабоосновные проникающие через клеточные мембраны агенты хелатирования железа с низкой молекулярной массой могут аккумулироваться в кислотном отсеке липосом и, следовательно, могут быть более эффективными цитозащитными агентами, чем десферриоксамин. Таким образом, другим возможным полезным применением слабых оснований по данному изобретению является применение таких соединений для лечения воспалительных легочных заболеваний. Большинство неаминных N1-трифторэтильных или С 2-дифторэтильных производных 3 гидроксипиридин-4-она по данному изобретению являются промежуточными продуктами для синтеза аминопроизводных. Кроме того, соединения формулы I, где G1 обозначает C1-C6 алкил и G2 обозначает трифторэтил или G1 обозначает дифторэтил и G2 обозначает C1-C6 алкил, представляют примеры производных 3-гидроксипиридин-4-онов без аминосодержащей боковой цепи. Некоторые из этих нейтральных производных 3-гидроксипиридин-4-она по данному изобретению являются значительно более липофильными, чем деферипрон. В ГЭБ-исследованиях с кассетным дозированием они демонстрируют более высокое соотношение концентраций в головном мозге/плазме, делая их более подходящими для аккумуляции в головном мозге. Эти соединения могут быть нацелены на аккумуляцию в головном мозге и использоваться для лечения таких заболеваний как атаксия Фридрейха, при которой хелатирующий агент применяют для снижения атаксии и мозжечкового железа в головном мозге. Все соединения по данному изобретению обладают специфичностью относительно комплексообразования Fe(III) с подходящими pKa фенольных С 3-ОН и pFe(III)19, образованием однородного 1:3 хелата трехвалентного железа, о чем свидетельствует диаграмма Джобса, и значением D7,40,1. Кроме того,исследования селективности к металлам показывают, что данное соединение не хелатирует в существенной степени такие металлы, как кальций, магний и цинк. Хотя здесь раскрыты различные варианты изобретения, можно выполнить множество адаптации и модификаций в пределах области изобретения в соответствии с обычными общими знаниями специалистов в данной области. Такие модификации включают замену известных эквивалентов любого аспекта изобретения с целью достижения аналогичного результата по существу аналогичным образом. Числовые диапазоны являются включительными для количеств, определяющих диапазон. Слово "включая" используется здесь как открытый термин, по существу, эквивалентный выражению "включая, но не ограничиваясь", и слово "содержит" имеет соответствующее значение. Используемые здесь формы единственного числа "a", "an" и "the" включают множественное число, пока в контексте ясно не указано иное. Таким образом, например, ссылка на "предмет" включает более одного такого предмета. Цитирование здесь ссылок не является допущением, что такие ссылки представляют собой прототипы настоящего изобретения. Любой приоритетный документ(ы) включен здесь в виде ссылки, как если бы для каждого индивидуального приоритетного документа было специально и индивидуально указано, что он включен здесь в виде ссылки и во всей своей полноте. Изобретение включает, по существу, все варианты и вариации, которые описаны здесь ранее, и со ссылкой на примеры и рисунки. Здесь описаны различные альтернативные варианты и примеры изобретения. Эти варианты и примеры являются иллюстративными и не предназначены для ограничения области изобретения. Пример 1. Получение 3-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она(a) Получение 3-(бензилокси)-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она. 3-(Бензилокси)-2-метил-4 Н-пиран-4-он (1,00 г, 4,6 ммоль) смешивают с гидрохлоридом трифторэтиламина (1,35 г, 10,0 ммоль) в пиридине (10 мл). Реакционную смесь нагревают в закупоренной колбе при 75 С в течение 5 ч. Смесь концентрируют и остаток очищают методом колоночной хроматографии на силикагеле с 5% метанолом в этилацетате в качестве элюента, получая 3-(бензилокси)-2-метил-1(2,2,2-трифторэтил)пиридин-4(1 Н)-он (0,82 мг) в виде бежевого твердого вещества. Выход = 60%; 1 Н ЯМР (CDCl3, 90 МГц)(м.д.): 7,02-7,58 (м, 6 Н), 6,42 (д, J=7,5 Гц, 1 Н), 5,20 (с, 2 Н), 4,30 (кв, J=8,3 Гц, 2 Н) и 2,10 (с, 3 Н).(b) Получение 3-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она. 3-(Бензилокси)-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (820 мг, 2,8 ммоль) смешивают с 10% палладием-на-угле (влажный, 84 мг) в метаноле (20 мл). Смесь перемешивают при комнатной температуре в атмосфере водорода при 30 фунт/кв.дюйм (2,04 атм.) в аппарате Парра в течение 35 мин. Смесь фильтруют через Celite и фильтрат концентрируют. Остаток растирают в эфире, получая 3 гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (511 мг) в виде не совсем белого твердого вещества. Выход = 89%; 1H ЯМР (ДМСО-D6, 90 МГц)(м.д.): 7,60 (д, J=7,4 Гц, 1 Н), 6,20 (д, J=7,4 Гц, 1 Н),4,99 (кв, J=8,8 Гц, 2 Н) и 2,29 (с, 3 Н). Пример 2. Получение 3-гидрокси-2-этил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она(b) Аналогично тому, как описано в примере 1(b), получают 2-этил-3-гидрокси-1-(2,2,2 трифторэтил)пиридин-4(1 Н)-он (0,30 г) из 3-(бензилокси)-2-этил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)она (0,90 г, 2,9 ммоль) с использованием 10% палладия-на-угле (влажный, 90 мг) в метаноле (5 мл) и этаноле (35 мл) в атмосфере водорода при 15 фунт/кв.дюйм (1,02 атм.) в течение 1,5 ч. Выход = 47%; 1H ЯМР (ДМСО-D6, 400 МГц)(м.д.): 7,58 (д, J=7,3 Гц, 1 Н), 6,41 (д, J=7,3 Гц, 1 Н), 4,92 (кв, J=8,1 Гц, 2 Н),2,72 (т, J=7,5 Гц, 2 Н) и 1,20 (т, J=7,5 Гц, 3 Н); МС m/z 222 [М+1]+. Пример 3. Получение 1-(2,2-дифторэтил)-3-гидрокси-2-метилпиридин-4(1 Н)-она(655 мг, 8,0 ммоль) и гидрохлоридом триэтиламина (1,10 г, 8,0 ммоль) в пиридине (6 мл) в закупоренной пробирке. Реакционную смесь нагревают при 110 С в течение ночи. Твердое вещество отфильтровывают и промывают этилацетатом. Фильтрат концентрируют при пониженном давлении и смешивают остаток с водой, а затем экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли. Продукт очищают методом колоночной хроматографии на силикагеле 5% метанолом в этилацетате в качестве элюента, получая 3-(бензилокси)-1-(2,2-дифторэтил)-2-метилпиридин-4(1 Н)-он (337 мг) в виде светло-желтого твердого вещества. Выход = 60%; 1 Н ЯМР (MeOD-D4, 90 МГц)(м.д.): 7,66 (д,J=7,1 Гц, 1 Н), 7,16-7,55 (м, 5 Н), 6,46 (д, J=7,l Гц, 1 Н), 5,55 (т, J=55,0 Гц, 1 Н), 4,45 (т, J=14,8 Гц, 1 Н) и 2,20(b) Аналогичным образом, как в примере 1(b), получают 1-(2,2-дифторэтил)-3-гидрокси-2-метилпиридин-4(1 Н)-он (160 мг) из 3-(бензилокси)-1-(2,2-дифторэтил)-2-метилпиридин-4(1 Н)-она (337 мг, 1,2 ммоль) с 10% Pd/C (влажный, 90 мг) в метаноле при давлении водорода 1 атм., используя баллон в течение 5 мин. Выход = 70%; 1H ЯМР (MeOD-D4, 90 МГц)(м.д.): 7,60 (д, J=7,3 Гц, 1 Н), 6,39 (д, J=7,3 Гц,1 Н), 6,23 (тт, J=54,0, 2,9 Гц, 1 Н), 4,51 (тд, J=14,8, 2,9 Гц, 2 Н) и 2,43 (с, 3 Н); МС m/z 190 [М+1]+. Пример 4. Получение 5-гидрокси-2-метил-1-(2,2,2-трифторэтил) пиридин-4(1 Н)-она(а) Получение 5-(бензилокси)-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она. 5-(Бензилокси)-2-метил-4 Н-пиран-4-он (4,32 г, 20,0 ммоль) смешивают с трифторэтиламином (6,92 г, 70,0 ммоль) в 6N HCl (11,7 мл) и этаноле (5,8 мл). Реакционную смесь нагревают в закупоренной колбе при 100 С в течение 20 ч. Затем смесь концентрируют в вакууме и остаток разбавляют водой. Твердое вещество фильтруют, промывают водой и эфиром, получая 5-(бензилокси)-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (5,01 г) в виде белого твердого вещества. Выход = 84%; 1 Н ЯМР (MeOD-D4, 90 МГц)(м.д.): 7,99 (с, 1 Н), 7,14-7,65 (м, 5 Н), 6,80 (с, 1 Н), 4,91-5,25 (м, 4 Н), 2,53 (с, 3 Н).(b) 5-(Бензилокси)-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (45,8 г, 164 ммоль) смешивают с 6N HCl (100 мл) и изопропанолом (20 мл). Смесь нагревают на 110 С масляной бане в течение 8 ч и затем концентрируют на роторном испарителе. Остаток растирают в ацетоне и эфире, получая гидрохлорид 5-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она (24,5 г). Выход = 65%; 1H ЯМР (MeODD4, 90 МГц)(м.д.): 8,18 (с, 1 Н), 7,21 (с, 1 Н), 5,31 (кв, J=8,2 Гц, 2 Н) и 2,67 (с, 3 Н). Пример 5. Получение 1-(2,2-дифторэтил)-5-гидрокси-2-метилпиридин-4(1 Н)-она метилпиридин-4(1 Н)-он (230 мг) из 5-(бензилокси)-1-(2,2-дифторэтил)-2-метилпиридин-4(1 Н)-она (500 мг, 1,80 ммоль) с 10% Pd/C (влажный, 50 мг) в метаноле (40 мл) в атмосфере водорода при давлении 15 фунт/кв.дюйм (1,02 атм.) в аппарате Парра в течение 27 мин. Выход = 99%; 1 Н ЯМР (MeOD-D4, 90 МГц)(м.д.): 7,46 (с, 1 Н), 6,37 (с, 1 Н), 5,62-6,83 (тт, J=54,9, 3,6 Гц, 1 Н), 4,26-4,60 (тд, J=15,3, 2,4 Гц, 2 Н) и 2,38(a) 5-(Бензилокси)-4-оксо-4 Н-пиран-2-карбоновую кислоту (10,5 г, 42,7 ммоль) растворяют в растворе гидроксида натрия (1,71 г, 42,7 ммоль в 77 мл деионизированной воды). Добавляют гидрохлорид 2,2,2-трифторэтиламина (23,1 г, 171 ммоль) и результирующую суспензию перемешивают при 70 С(температура масляной бани) в закупоренной колбе в течение 17 ч. Затем реакционную смесь фильтруют и не совсем белое твердое вещество промывают деионизированной водой (20 мл 5), получая 5(бензилокси)-4-оксо-1-(2,2,2-трифторэтил)-1,4-дигидропиридин-2-карбоновую кислоту (6,00 г). Выход = 43%; 1 Н ЯМР (MeOD-D4, 90 МГц)7,30 (с, 1 Н), 6,76-7,09 (м, 5 Н), 6,71 (с, 1 Н), 4,93 (д, J=8,4 Гц, 2 Н) и 4,65 (с, 2 Н); МС m/z 328 [М+1].(b) 5-(Бензилокси)-4-оксо-1-(2,2,2-трифторэтил)-1,4-дигидропиридин-2-карбоновую кислоту (4,70 г,14,4 ммоль) смешивают с ДМФА (25 мл) и нагревают при 130 С (температура бани) в течение 3 ч. Смесь концентрируют при пониженном давлении, используя роторный испаритель, и остаток смешивают с этилацетатом (50 мл). Затем его перемешивают в течение 2 ч при комнатной температуре и фильтруют. Фильтрат концентрируют, получая 3-(бензилокси)-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (3,58 г). Выход = 69%; 1H ЯМР (ДМСО-D6, 400 МГц)(м.д.) 7,57-7,84 (м, 2 Н), 7,22-7,57 (м, 5 Н), 6,25 (ушир.с, 1 Н) и 4,69-5,28 (м, 4 Н); МС m/z 284 [М+1]+.(с) 3-(Бензилокси)-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (1,2 г, 4,2 ммоль) смешивают с 10% палладием-на-угле (влажный, 0,12 г) в этаноле (70 мл). Результирующую смесь гидрируют при давлении водорода 15 фунт/кв.дюйм (1,02 атм.) в течение 1,5 ч. Палладий удаляют фильтрованием через слойCelite и промывают слой Celite метанолом (5 мл 3). Фильтрат выпаривают, получая 3-гидрокси-1(2,2,2-трифторэтил)пиридин-4(1 Н)-он (0,78 г) в виде белого твердого вещества. Выход = 95%; 1 Н ЯМР Гидрохлорид 5-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она (4,87 г, 20,0 ммоль) смешивают с 37% формальдегидом (30 мл) и 6N гидроксидом натрия (7 мл, 42,0 ммоль). Реакционную смесь перемешивают при 39-42 С в течение 11 ч и затем добавляют дополнительное количество 37% формальдегида (30 мл). Реакционную смесь перемешивают при 37 С в течение 12 ч и далее оставляют при комнатной температуре еще на 12 ч. Твердое вещество отфильтровывают и фильтрат подкисляют до рН примерно от 5 до 6. Раствор концентрируют на силикагеле и очищают продукт методом колоночной хроматографии с градиентным элюированием, используя в качестве элюента смесь 5-10% метанола в этилацетате и получая указанное в заголовке соединение 3-гидрокси-2-(гидроксиметил)-6-метил-1-(2,2,2 трифторэтил)пиридин-4(1 Н)-он (3,02 г) в виде светло-персикового твердого вещества. Выход 63,5%; 1H ЯМР (ДМСО-D6+D2O, 90 МГц)(м.д.): 6,20 (с, 1 Н), 5,15 (кв, J=8,8 Гц, 2 Н), 4,33-4,92 (м, 2 Н) и 2,37 (с,3 Н); МС m/z 238 [М+1]+. Пример 8. А. Получение 2-[(диметиламино)метил]-3-гидрокси-6-метил-1-(2,2,2-трифторэтил) пиридин-4(1 Н)-она Гидрохлорид 5-гидрокси-2-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она (415 мг, 1,7 ммоль) смешивают с N,N,N',N'-тетраметилметандиамином (4 мл) в этаноле (10 мл) и нагревают при 80 С в течение 21 ч. Реакционную смесь концентрируют на роторном испарителе и остаток растирают с водой, получая 2-[(диметиламино)метил]-3-гидрокси-6-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (315 мг) в виде белого твердого вещества. Выход = 70%; 1H ЯМР (ДMCO-D6+D2O, 90 МГц)(м.д.): 6,20 (с, 1 Н),5,15 (кв, J=8,8 Гц, 2 Н), 4,69 (ушир.с, 2 Н) и 2,37 (с, 3 Н); МС m/z 265 [М+1]+. В. Получение 2-[(диметиламино)метил]-3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4 (1H)-она Аналогичным образом получают 2-[(диметиламино)метил]-3-гидрокси-1-(2,2,2-трифторэтил) пиридин-4(1 Н)-он (0,21 г) из 3-гидрокси-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она (0,60 г, 3,1 ммоль) посредством взаимодействия с N,N,N',N'-тетраметилдиаминометаном (8,50 мл, 62,2 ммоль) в этаноле (10 мл) при 75 С в течение 20 ч. Выход = 27%; 1H ЯМР (MeOD-D4, 90 МГц)(м.д.): 7,81 (д, J=7,5 Гц, 1 Н), 6,52 Аналогичным образом получают 1-(2,2-дифторэтил)-2-[(диметиламино)метил]-3-гидрокси-6 метилпиридин-4(1 Н)-он (0,41 г) из 1-(2,2-дифторэтил)-5-гидрокси-2-метилпиридин-4(1 Н)-она (0,40 г, 2,1 ммоль) и N,N,N',N'-тетраметилдиаминометана (4,3 мл, 31,7 ммоль) в этаноле (10 мл) при 75 С в течение 19 ч. Выход = 78%; 1 Н ЯМР (ДМСО-D6, 90 МГц)ppm: 6,45 (тт, J=55,1 и 3,5 Гц, 1 Н), 6,24 (с, 1 Н), 4,74 3-Гидрокси-2-(гидроксиметил)-6-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (375 мг, 1,6 ммоль) смешивают с ацетонитрилом при 80 С и добавляют тионилхлорид (753 мг, 6,3 ммоль). Реакционную смесь перемешивают в течение 5 мин и затем концентрируют на роторном испарителе, получая гидрохлорид 2-(хлорметил)-3-гидрокси-6-метил-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-она. Этот хлорид добавляют к раствору пиперидина (672 мг, 7,9 ммоль) в изопропаноле (5 мл) при комнатной температуре. Через пять минут реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой дважды промывают водой и насыщенным раствором соли, сушат и концентрируют. Остаток растирают в смеси эфир/гексаны, получая 3-гидрокси-6-метил-2-(пиперидин-1-илметил)-1-(2,2,2-трифторэтил)пиридин-4(1 Н)-он (165 мг) в виде светло-оранжевого твердого вещества. Выход = 34%; 1H ЯМР (MeOD-D4, 90 МГц)(м.д.): 6,37 (с, 1 Н), 3,72 (ушир.с, 2 Н), 2,45 (ушир.м, 7 Н) и 1,51 (ушир.м, 6 Н); MC m/z 305 [М+1]+. Пример 10. Получение N-метил-N2-[2,2,2-трифтор-1-(3-гидрокси-1-метил-4-оксо-1,4-дигидропиридин-2-ил)этил]-D-аланинамида и N-метил-N2-[2,2,2-трифтор-1-(3-гидрокси-1-метил-4-оксо-1,4-дигидропиридин-2-ил)этил]-L-аланинамида (Аро 6998 и Аро 6999) К раствору гидрохлорида 3-гидрокси-1-метилпиридин-4(1 Н)-она (100,0 г, 0,62 моль), растворенного в 6N растворе NaOH (206,9 мл), на бане с водой и льдом добавляют метилполуацеталь трифторацетальдегида (131,9 мл, 1,24 ммоль). Результирующий раствор нагревают при 95 С в течение ночи. Затем реакционную смесь охлаждают и доводят рН смеси примерно до 5, используя 6N раствор HCl, на бане с водой и льдом. Выпавшее в осадок твердое вещество собирают фильтрованием и тщательно промывают деионизированной водой (100 мл 2), а затем сушат в вакууме при 43 С в течение ночи, получая 3 гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он (94,8 г) в виде белого твердого вещества. Выход 68%; 1 Н ЯМР (90 МГц, MeOD-D4)(м.д.): 7,60 (д, J=7,1 Гц, 1 Н), 6,40 (д, J=7,2 Гц, 1 Н),5,92 (кв, J=8,2 Гц, 1 Н), 3,98 (с, 3 Н); МС m/z 224 [М+1]+, 158 (100%). К охлаждаемой на льду суспензии 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин 4(1 Н)-она (1,60 г, 7,2 ммоль) в 50 мл ацетонитрила добавляют по капле SOCl2 (0,80 мл, 10,8 ммоль), а затем пиридин (0,6 мл, 7,2 ммоль). Результирующую суспензию перемешивают в течение 0,5 ч и далее кипятят с обратным холодильником в течение 2 ч. Реакционную смесь выпаривают досуха. К суспензии остатка в 10 мл ацетонитрила добавляют суспензию L-H-Ala-NHMe.HCl (1,19 г, 8,6 ммоль) и Et3N (4,0 мл, 28,7 ммоль) в 20 мл ацетонитрила. Результирующую смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выпаривают досуха и остаток очищают методом флэшхроматографии на силикагеле (10% конц. NH4OH в IPA в качестве элюента), получая 2,20 г двух диастереоизомеров Аро 6988 и Аро 6999. Образец каждого диастереоизомера получают дополнительной очисткой методом Biotage, применяя картридж С 18 с обращенной фазой. Более полярный изомер по данным ВЭЖХ (Rt=3,43 мин) (110 мг). 1H ЯМР (400 МГц, MeOD-D4)(м.д.): 7,68 (д, J=7,1 Гц, 1 Н), 6,41 (д, J=7,1 Гц, 1 Н), 4,68-4,80 (м, 1 Н), 3,83 (с, 3 Н), 3,41-3,56 (м, 1 Н), 2,57 (с,3 Н), 1,30 (д, J=6,1 Гц, 3 Н); МС m/z 330 [M+Na+], 308 [M+1]+, 126 (100%). Менее полярный изомер по данным ВЭЖХ (Rt=3,68 мин) (100 мг). 1H ЯМР (400 МГц, MeOD-D4) К суспензии 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-она (5,00 г, 22,4 ммоль) в 40 мл ацетонитрила на бане с водой и льдом добавляют частями реагент Вильсмейера (4,30 г,33,6 ммоль). Результирующую смесь перемешивают в течение 2 ч перед добавлением к суспензии гидрохлорида диметиламина (6,00 г, 73,6 ммоль) и Et3N (15,0 мл, 107,6 ммоль) в 30 мл ацетонитрила. Результирующую суспензию перемешивают при комнатной температуре в течение ночи. Твердое вещество отфильтровывают и фильтрат концентрируют досуха. Остаток очищают методом флэш-хроматографии на силикагеле (10% МеОН в EtOAc в качестве элюента), получая указанное в заголовке соединение Аро 7041 (1,8 г). Выход = 32%; 1H ЯМР (90 МГц, CD3OD-D4)(м.д.): 7,63 (д, J=7,3 Гц, 1 Н), 6,41 (д, J=7,3 Гц, 1 Н), 4,78 (кв, J=8,l Гц, 1 Н), 3,99 (с, 3 Н), 2,41 (с, 6 Н); МС m/z 273 [M+Na+], 251 [M+1]+, 206 (100%). Пример 12. А. Получение 3-гидрокси-1-метил-2-2,2,2-трифтор-1-[метил(проп-2-ин-1 ил)амино]этилпиридин-4(1 Н)-она (Аро 7057) К 20 мл ацетонитрила, охлажденного на бане с водой и льдом, добавляют ДМФА (0,42 мл, 5,4 ммоль), а затем по капле оксалилхлорид (0,47 мл, 5,4 ммоль). К этой результирующей суспензии добавляют одной порцией 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил)пиридин-4(1 Н)-он (1,0 г, 4,5 ммоль). Затем смесь перемешивают в течение 2 ч. Далее к этой реакционной смеси добавляют Et3N (2,50 мл, 17,9 ммоль), а затем N-метилпропаргиламин (0,75 мл, 9,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Твердое вещество отфильтровывают и фильтрат концентрируют досуха. Остаток очищают методом флэш-хроматографии на силикагеле (5% МеОН в CH2Cl2 в качестве элюента), получая указанное в заголовке соединение Аро 7057 (570 мг) в виде оранжевого порошка. Выход = 46,4%; 1 Н ЯМР (400 МГц, ДМСО + несколько капель D2O)(м.д.): 7,6 (ушир.с, 1 Н), 6,25 (д,J=7,1 Гц, 1 Н), 5,15 (ушир.с, 1 Н), 3,87 (с, 3 Н), 3,37-3,67 (м, 2 Н), 3,23 (ушир.с, 1 Н), 2,32 (ушир.с, 3 Н); МС Аналогичным образом получают Аро 7058 из 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил) пиридин-4(1 Н)-она (1,0 г, 4,5 ммоль) и пиперидина (0,88 мл, 8,9 ммоль). Указанное в заголовке соединение Аро 7058 (700 мг) получают в виде белого твердого вещества после очистки методом флэшхроматографии (4% МеОН в CH2Cl2 в качестве элюента). Выход = 54%; 1H ЯМР (400 МГц, ДМСО-D6,75 С)(м.д.): 7,59 (д, J=6,8 Гц, 1 Н), 6,19 (д, J=6,8 Гц, 1 Н), 4,82 (кв, J=9,0 Гц, 1 Н), 3,88 (с, 3 Н), 2,46-2,84 Аналогичным образом получают Аро 7073 из 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил) пиридин-4(1 Н)-она (1,0 г, 4,5 ммоль) и 1-метилпиперазина (1,0 мл, 9,0 ммоль). Указанное в заголовке соединение Аро 7073 (401 мг) получают после очистки на колонке с обращенной фазой С 18 Biotage. Выход = 29%; 1 Н ЯМР (400 МГц, ДМСО-d6, 75 С)(м.д.): 7,63 (д, J=6,8 Гц, 1 Н), 6,21 (д, J=7,4 Гц, 1 Н), 4,94 Аналогичным образом получают Аро 7074 из 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил) пиридин-4(1 Н)-она (1,0 г, 4,5 ммоль) и циклопропиламина (0,62 мл, 9,0 ммоль). Указанное в заголовке соединение Аро 7074 (470 мг) получают после очистки методом флэш-хроматографии (5% МеОН в Аналогичным образом получают Аро 7075 из 3-гидрокси-1-метил-2-(2,2,2-трифтор-1-гидроксиэтил) пиридин-4(1 Н)-она (1,0 г, 4,5 ммоль) и аллиламина (0,67 мл, 9,0 ммоль). Указанное в заголовке соединение Аро 7075 (497 мг) получают после очистки методом флэш-хроматографии (5% МеОН в CH2Cl2 в качестве элюента). Выход = 42%; 1 Н ЯМР (400 МГц, ДМСО+несколько капель D2O)(м.д.): 7,65 (д, J=7,1 Гц, 1 Н), 6,24 (д, J=7,4 Гц, 1 Н), 5,70-5,80 (м, 1 Н), 5,14 (д, J=17,4 Гц, 1 Н), 5,06 (д, J=10,1 Гц, 1 Н), 4,63 (кв.,J=8,2 Гц, 1 Н), 3,67 (с, 3 Н), 3,15-3,19 (м, 2 Н); МС m/z 263 [М+1]+, 206 (100%). Пример 13. A. Получение 5-(бензилокси)-3-хлор-2-метилпиридин-4(1 Н)-она. К раствору 5-(бензилокси)-2-метилпиридин-4(1 Н)-она (9,00 г, 41,8 ммоль) в 2 М гидроксиде натрия(62,5 мл, 125 ммоль) на бане с водой и льдом медленно добавляют раствор 10-14% гипохлорита натрия(62,5 мл) в течение 20 мин. Реакционную смесь перемешивают при комнатной температуре еще один час. Реакционную смесь осторожно нейтрализуют 6N HCl до рН примерно 7 при внешнем охлаждении, поддерживая внутреннюю температуру ниже 25 С. Твердое вещество отфильтровывают и промывают водой(3), затем сушат в вакуумной печи в течение ночи. Таким образом, получают 5-(бензилокси)-3-хлор-2 метилпиридин-4(1 Н)-он (9,03 г) в виде белого твердого вещества. Выход = 86%; 1 Н ЯМР (ДМСО-D6, 90 МГц)(м.д.): 11,74 (ушир.с, 1 Н), 7,14-7,68 (м, 6 Н), 5,02 (с, 2 Н) и 2,33 (с, 3 Н). Аналогичным образом получают 5-(бензилокси)-3-хлор-2-(гидроксиметил)пиридин-4(1 Н)-он (10,50 г) из 5-(бензилокси)-2-(гидроксиметил)пиридин-4(1 Н)-она (11,56 г, 50 ммоль) и раствора 10-14% гипохлорита натрия (75 мл) в 2 М растворе гидроксида натрия (75 мл). Выход = 81%; 1 Н ЯМР (ДМСО-D6, 90 МГц)(м.д.): 11,35 (ушир.с, 1 Н), 7,05-7,66 (м, 6 Н), 5,79-6,32 (м, 1 Н), 5,03 (с, 2 Н) и 4,54 (с, 2 Н). С. Получение 5-(бензилокси)-3-хлор-1,2-диметилпиридин-4(1 Н)-она 5-(Бензилокси)-3-хлор-2-метилпиридин-4(1 Н)-он (3,00 г, 12,0 ммоль) суспендируют в 25 мл ДМФА. Добавляют карбонат калия (3,30 г, 24,0 ммоль) с последующим добавлением йодметана (1,53 мл, 24,0 ммоль). Протекание взаимодействия контролируют методом ТСХ (30% этилацетат в гексане). По завершении взаимодействия реакционную смесь оставляют перемешиваться при комнатной температуре. Добавляют воду, и образуется белый осадок. Твердое вещество собирают фильтрованием с отсосом, оставляют сушиться на воздухе и затем дополнительно сушат в вакууме. Таким образом, получают 5(бензилокси)-3-хлор-1,2-диметилпиридин-4(1 Н)-он (2,00 г). Выход = 63%; 1 Н ЯМР (MeOD-D4, 90 МГц,)(м.д.): 7,61 (с, 1 Н), 7,27-7,46 (м, 5 Н), 5,21 (с, 2 Н), 3,75 (с, 3 Н) и 2,54 (с, 3 Н). Аналогичным образом получают 5-(бензилокси)-3-хлор-2-(гидроксиметил)-1-метилпиридин-4(1 Н)он (7,52 г) из 5-(бензилокси)-3-хлор-2-(гидроксиметил)пиридин-4(1 Н)-она (10,0 г, 37,6 ммоль), йодметана (10,7 г, 75,2 ммоль) и карбоната калия (10,3 г, 75,2 ммоль) в ДМФА (50 мл). Выход = 72%; 1H ЯМР К смеси 5-(бензилокси)-3-хлор-2-(гидроксиметил)-1-метилпиридин-4(1 Н)-она (4,90 г, 17,5 ммоль),TEMPO (120 мг, 0,77 ммоль) и бромида калия (120 мг, 1,00 ммоль) в ацетоне (50 мл) и насыщенного бикарбоната натрия (40 мл) при температуре ниже 7 С добавляют по капле 10-14% раствор гипохлорита натрия (50 мл) в течение 30 мин. После перемешивания в течение 2 ч реакционную смесь разбавляют водой и доводят рН примерно до 1,5 при помощи 6N HCl. Твердое вещество отфильтровывают и промывают водой, получая 5-(бензилокси)-3-хлор-1-метил-4-оксо-1,4-дигидропиридин-2-карбоновую кислоту(2,89 г) в виде белого твердого вещества. Выход = 56%; 1H ЯМР (ДМСО-D6, 90 МГц)(м.д.): 7,79 (с,1 Н), 7,16-7,62 (м, 5 Н), 5,03 (с, 2 Н) и 3,67 (с, 3 Н); МС m/z 294 [М+1]+. 5-(Бензилокси)-3-хлор-1-метил-4-оксо-1,4-дигидропиридин-2-карбоновую кислоту (3,50 г, 11,9 ммоль) нагревают в ДМФА (10 мл) в течение одного часа. Реакционную смесь концентрируют на роторном испарителе и остаток растирают в смеси этилацетат/эфир, получая 3-(бензилокси)-5-хлор-1 метилпиридин-4(1 Н)-он (2,80 г) в виде светло-коричневого твердого вещества. Выход = 94%; 1H ЯМР 3-(Бензилокси)-5-хлор-1-метилпиридин-4(1 Н)-он (2,70 г, 10,8 ммоль) перемешивают в 6N HCl (15 мл) и этаноле (10 мл). После кипячения с обратным холодильником в течение 2 ч реакционную смесь концентрируют на роторном испарителе. Остаток смешивают с водой (5 мл) и подщелачивают до рН 8-9 концентрированным раствором аммиака. Образуется не совсем белый осадок, и смесь снова концентрируют в вакууме для удаления летучих веществ. Не совсем белое твердое вещество собирают фильтрованием с отсосом и сушат, получая 3-хлор-5-гидрокси-1,2-диметилпиридин-4(1 Н)-он (1,32 г). Выход = 76,6%; 1H ЯМР (ДМСО-D6, 90 МГц)(м.д.): 7,98 (с, 1 Н), 7,47 (с, 1 Н) и 3,67 (с, 3 Н).
МПК / Метки
МПК: A61P 13/12, C07D 213/69, A61P 11/00, A61K 31/4422, A61P 25/28, A61P 35/00
Метки: производные, способы, использования, фторированные, 3-гидроксипиридин-4-онов
Код ссылки
<a href="https://eas.patents.su/30-20976-ftorirovannye-proizvodnye-3-gidroksipiridin-4-onov-i-sposoby-ih-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фторированные производные 3-гидроксипиридин-4-онов и способы их использования</a>
Предыдущий патент: Система и способ для изготовления самоохлаждающегося контейнера
Следующий патент: Подъемное устройство для подъема ротора ветроэнергетической установки
Случайный патент: Поворотно-выдвижная лестница грузового вагона