Производные инсулина длительного действия и способы их использования
Номер патента: 8433
Опубликовано: 29.06.2007
Авторы: Кастэнь Жан-Поль, Хуанг Ксикай, Бридон Доминик П., Робитэлль Мартин, Леже Роже
Формула / Реферат
1. Производное инсулина, включающее молекулу инсулина и реактивную группу для ковалентного связывания компонента крови, выбранную из группы, включающей a, b ненасыщенную карбонильную молекулу, сукцинимидилсодержащую группу и малеимидосодержащую группу.
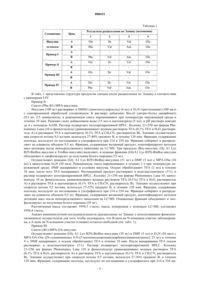
2. Производное инсулина по п.1, где молекула инсулина имеет формулу I
а реактивная группа присоединена к аминокислоте молекулы инсулина в любом из следующих положений: Gly A1, Phe B1 и Lys B29.
3. Производное инсулина по п.1 или 2, где реактивная группа представляет собой малеимидо-содержащую группу.
4. Производное инсулина по п.1 или 2, где реактивная группа представляет собой 3-малеимидопропионовую кислоту (MPА).
5. Производное инсулина по любому из пп.1-4, где реактивная группа соединена с аминокислотой молекулы инсулина посредством линкера.
6. Производное инсулина по п.5, где указанный линкер выбран из группы, включающей (2-амино)этоксиуксусную кислоту (АЕА), этилендиамин (EDA), аминоэтоксиэтоксисукциниминовую кислоту (AEES), 2-[2-(2-амино)этокси]этоксиуксусную кислоту (АЕЕА), АЕЕА-АЕЕА, -NH2-(CH2)n-COOH, где n представляет собой целое число от 1 до 20, а также мотив алкильных цепей (C1-C10) и их комбинации.
7. Производное инсулина по п.6, где мотив алкильных цепей (C1-C10) представляет собой одну или более алкильных цепей (C1-C10), насыщенных или ненасыщенных, в которые могут быть включены атомы кислорода, азота или серы.
8. Производное инсулина по п.7, где указанная алкильная цепь выбрана из группы, включающей глицин, 3-аминопропионовую кислоту (АРА), 8-аминокаприловую кислоту (АОА) и 4-аминобензойную кислоту (APhA).
9. Производное инсулина по п.6, где указанная комбинация выбрана из группы, включающей в себя AEEA-EDA, АЕЕА-АЕЕА и АЕА-АЕЕА.
10. Производное инсулина по п.6, где указанный линкер представляет собой -NH2-(СН2)7-СООН.
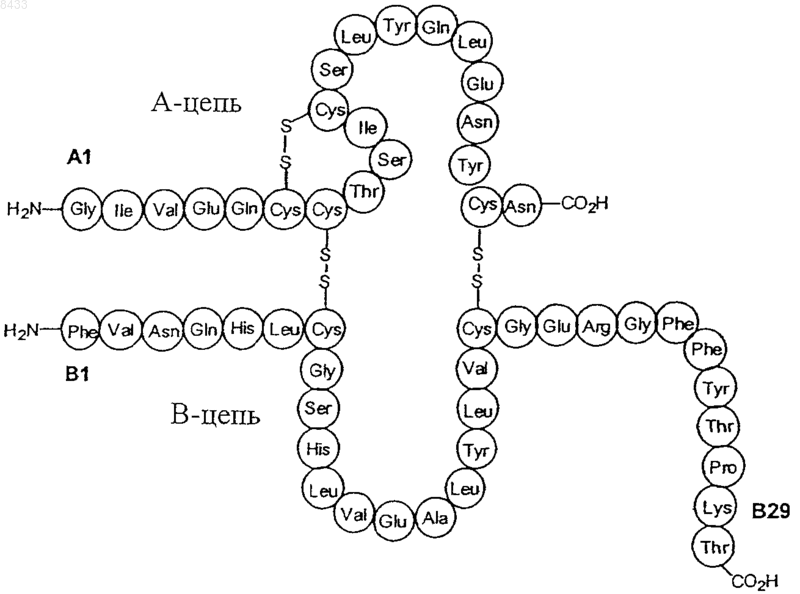
11. Производное инсулина по п.1, имеющее формулу
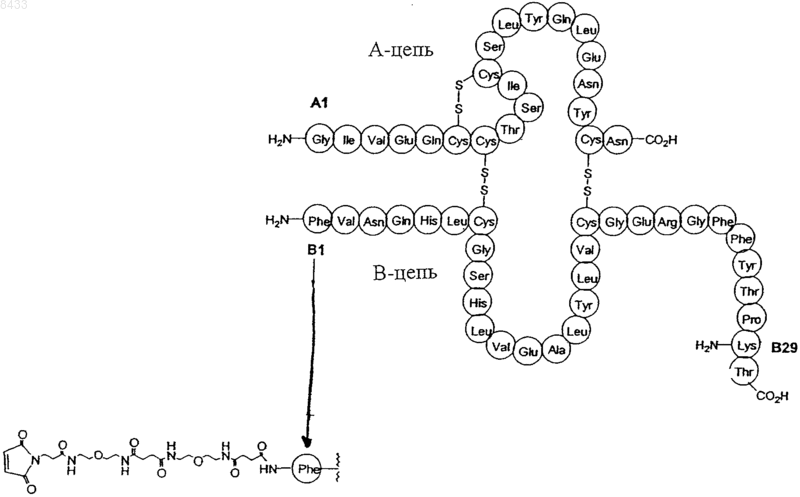
12. Производное инсулина по п.1, имеющее формулу
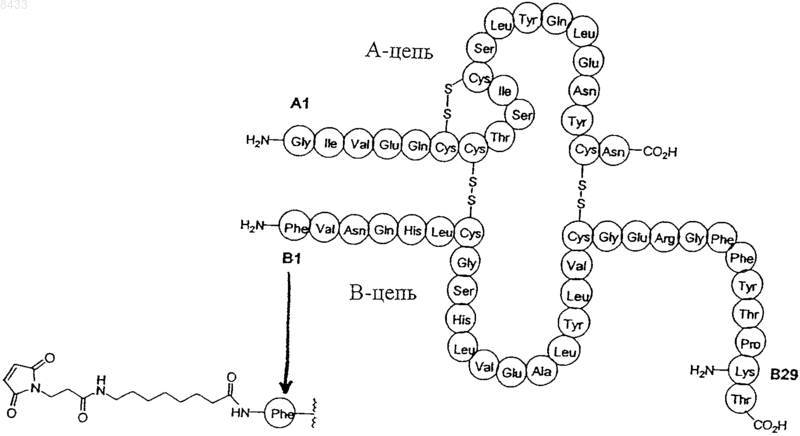
13. Производное инсулина по п.1, имеющее формулу

14. Производное инсулина по п.1, где указанный компонент крови представляет собой белок крови.
15. Производное инсулина по п.14, где указанный белок крови представляет собой сывороточный альбумин.
16. Конъюгат инсулина, включающий производное инсулина по любому из пп.1-15 и компонент крови, где реактивная группа и компонент крови соединены посредством ковалентной связи, сформированной между указанной реактивной группой и указанным компонентом крови.
17. Конъюгат инсулина по п.16, где компонент крови представляет собой белок крови.
18. Конъюгат инсулина по п.17, где белок крови представляет собой сывороточный альбумин.
19. Конъюгат инсулина по п.16, который сформирован ex vivo.
20. Конъюгат инсулина по п.19, где компонент крови представляет собой рекомбинантный альбумин.
21. Фармацевтическая композиция, включающая производное инсулина по любому из пп.1-15, и фармацевтически приемлемый носитель.
22. Фармацевтическая композиция, включающая конъюгат инсулина по любому из пп.16-20, и фармацевтически приемлемый носитель.
23. Способ лечения заболеваний или патологических состояний, связанных с изменением уровня глюкозы в крови у субъекта, страдающего от указанного заболевания, или патологического состояния, заключающийся во введении указанному субъекту производного инсулина по любому из пп.1-15.
24. Способ по п.23, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит.
25. Способ по п.24, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа.
26. Способ лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови, заключающийся во введении конъюгата инсулина по любому из пп.16-20.
27. Способ по п.26, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит.
28. Способ по п.27, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа.
29. Способ лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови, заключающийся во введении фармацевтической композиции по любому из пп.21 и 22.
30. Способ по п.29, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит.
31. Способ по п.30, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа.
32. Применение производного инсулина по любому из пп.1-15 для получения лекарственного средства, предназначенного для лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови.
33. Применение по п.32, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит.
34. Применение по п.33, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа.
35. Применение конъюгата по любому из пп.16-20 для получения лекарственного средства, предназначенного для лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови.
36. Применение по п.35, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит.
37. Применение по п.36, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа.
Текст
008433 Область техники Настоящее изобретение относится к производному инсулина длительного действия. Более детально,производное инсулина представляет собой молекулу инсулина и реактивную группу, соединенную с последней; реактивная группа предназначена для ковалентного связывания компонента крови, таким образом, происходит образование производного инсулина длительного действия. Предшествующий уровень техники Инсулин представляет собой эндокринный гормон, который связывается с рецептором на поверхности клеток, запуская каскад реакций, конечным результатом которого является абсорбция глюкозы из крови. Снижение уровня инсулина приводит к развитию тяжелых заболеваний, таких как диабет 1- и 2-го типа. Диабет 1-го типа является угрожающим жизни заболеванием, при котором пациент вынужден ежедневно вводить себе множественные дозы инсулина для того, чтобы выжить. Диабет 2-го типа также представляет собой тяжелое заболевание, при котором уровень эндогенного инсулина не позволяет длительно поддерживать нормальную гликемию, поскольку у пациента развивается толерантность к эндогенному инсулину. Для того, чтобы отсрочить появление отдаленных последствий, а также в тех случаях,когда изменение образа жизни и прием традиционных лекарственных средств для контроля гликемии оказываются неэффективными, лечение препаратами инсулина является необходимым. Успех контроля за гликемией в значительной степени определяется комлаэнтностью пациента и его согласием с предложенным лечением, поэтому уменьшение числа необходимых инъекций является желательным. Для того, чтобы этого достичь, желательно применять новое производное инсулина длительного действия. Краткое описание изобретения Настоящее изобретение относится к производному инсулина, представляющему собой молекулу инсулина и реактивную группу для ковалентного связывания с компонентом крови. Согласно предпочтительному варианту осуществления настоящего изобретения, молекула инсулина имеет формулу I а реактивная группа соединена с аминокислотой молекулы инсулина в любом из следующих положений:Gly A1, Phe B1 и Lys B29. В предпочтительном варианте осуществления настоящего изобретения реактивная группа выбрана из группы, включающей акцепторы Михаэля (,ненасыщенные карбонильные молекулы), сукцинимидилсодержащие группы и малеимидосодержащие группы, более предпочтительно, MPA (3 малеимидопропионовая кислота). Согласно предпочтительному варианту осуществления настоящего изобретения реактивная группа соединена с молекулой инсулина с помощью линкера, такого как (без ограничений указанными) (2 амино)этоксиуксусная кислота [АЕА, от англ. (2-amino)ethoxy acetic acid], этилендиамин (EDA, от англ.ethoxy acetic acid), AEEA-AEEA, -NH2-(CH2)n-COOH, где n представляет собой целое число от 1 до 20, а также мотив алкильных цепей (C1-C10) насыщенных или ненасыщенных, в состав которых могут быть включены соединения с атомом кислорода, азота или серы, такие как глицин, 3-аминопропионовая кислота (АРА, от англ. 3-aminopropionic acid), 8-аминокаприловая кислота (ОА, от англ. 8-aminooctanoicacid) и 4-аминобензойная кислота (APhA) и их комбинации. Согласно предпочтительному варианту осуществления настоящего изобретения компонентом крови-1 008433 является белок крови, более предпочтительно сывороточный альбумин. Настоящее изобретение также относится к конъюгату инсулина, включающему производное инсулина, заявленное в соответствии с настоящим изобретением, и компонент крови, при этом реактивная группа и компонент крови соединены посредством ковалентной связи, сформированной между указанной реактивной группой и указанным компонентом крови. Конъюгат формируется как in vivo, так иex vivo. Кроме того, настоящее изобретение относится к фармацевтической композиции, в состав которой входит производное инсулина, заявленное в соответствии с настоящим изобретением, соединенное с фармацевтически приемлемым носителем. Настоящее изобретение также относится к фармацевтической композиции, в состав которой входит конъюгат инсулина, заявленный в соответствии с настоящим изобретением, соединенный с фармацевтически приемлемым носителем. Настоящее изобретение относится к способу лечения заболеваний и патологических состояний,связанных с изменением уровня глюкозы крови, у субъекта, страдающего от указанного заболевания или патологического состояния, заключающийся во введении по крайней мере одного из производных инсулина, заявленных в соответствии с настоящим изобретением, конъюгата, заявленного в соответствии с настоящим изобретением и фармацевтической композиции, заявленной согласно настоящему изобретению. Все источники информации приведены здесь в качестве ссылок. Краткое описание чертежей Фиг. 1 иллюстрирует примеры I-VIII; на нем представлены производные нативного инсулина человека. Фиг. 2 иллюстрирует конкурентное связывание инсулина, производных инсулина и конъюгата производных инсулина на мембране клеток печени крыс линии Вистар. Фиг. 3 иллюстрирует конкурентное связывание инсулина, производных инсулина и конъюгата производных инсулина на мембране клеток печени крыс линии Вистар. На фиг. 4 А-4 С, 5 А, 5 В, 6 А, 6 В представлены различные фазы дифференцировки адипоцитов 3T3-L1. Фиг. 7 иллюстрирует транспорт глюкозы в адипоцитах 3T3-L1, регулируемый инсулином, производными инсулина, полученными как описано в примерах III и IV, и их соответствующим конъюгатом. Фиг. 8 иллюстрирует транспорт глюкозы из адипоцитов крыс линии Вистар в эпидидимальные жировые клетки, регулируемый инсулином, его производными, полученными, как описано в примерах III иIV, и их соответствующим конъюгатом. Фиг. 9 иллюстрирует изменение гликемии как функцию времени у животных, получавших инсулин в дозе 3,6 мг/кг. Фиг. 10 иллюстрирует изменение гликемии как функцию времени у животных, получавших производные инсулина, полученные как описано в примерах I, II и III, в дозе 3,6 мг/кг. Фиг. 11 иллюстрирует изменение гликемии как функцию времени у животных, получавших производные инсулина, полученные как описано в примерах I, II и III, в дозе 17,9 мг/кг. Фиг. 12 иллюстрирует изменение гликемии как функцию времени у животных, получавших инсулин и производное инсулина, полученное как описано в примере I, в дозе 3,6 мг/кг и производное инсулина, полученное как описано в примере I в дозе 17,9 мг/кг. Фиг. 13 иллюстрирует изменение гликемии как функцию времени у животных, получавших инсулин и производное инсулина, полученное как описано в примере II, в дозе 3,6 мг/кг и производное инсулина, полученное как описано в примере II, в дозе 17,9 мг/кг. Фиг. 14 иллюстрирует изменение гликемии как функцию времени у животных, получавших инсулин и производное инсулина, полученное как описано в примере III, в дозе 3,6 мг/кг и производное инсулина, полученное как описано в примере III, в дозе 17,9 мг/кг. На фиг. 15 представлен фармакокинетический профиль нативного инсулина, введенного подкожно и внутривенно. На фиг. 16 представлен фармакокинетический профиль конъюгата, полученного как описано в примере III, введенного подкожно и внутривенно. На фиг. 17 представлен фармакокинетический профиль производного инсулина, полученного как описано в примере III, введенного подкожно и внутривенно. На фиг. 18 сравнивается фармакокинетические профили инсулина, производного инсулина, полученного как описано в примере III, и конъюгата согласно примеру III, введенных подкожно. На фиг. 19 сравнивается фармакокинетические профили инсулина, производного инсулина, полученного как описано в примере III, и конъюгата согласно примеру III, введенных внутривенно. На фиг. 20 сравниваются фармакокинетические профили после подкожного введения инсулина, его производных, полученных, как описано в примерах I-IV, и контроля (носителя) крысам с диабетом, индуцированным стрептозоцином. На фиг. 21 сравниваются фармакокинетические профили после подкожного введения инсулина,-2 008433 конъюгата, полученного как описано в примерах I-IV, и контроля крысам с диабетом, индуцированным стрептозоцином. На фиг. 22 сравниваются фармакокинетические профили после повторных подкожных инъекций производного инсулина, полученного, как описано в примере III (день 1 против дня 6 против дня 12 против контроля). На фиг. 23 сравниваются фармакокинетические профили после повторных подкожных инъекций конъюгата, полученного как описано в примере III (день 1 против дня 6 против дня 12 против контроля). Детальное описание изобретения Настоящее изобретение относится к производным инсулина длительного действия. Более детально,к производным инсулина относятся молекула инсулина и реактивная группа, связанная с последней; реактивная группа предназначена для ковалентного связывания компонента крови. В соответствии с настоящим изобретением подразумевается, что ковалентное связывание, приводящее к формированию конъюгата инсулин-реактивная группа-компонент крови, может происходить in vivo после введения производного инсулина, заявленного согласно настоящему изобретению. Также предусматривается, что ковалентное связывание может происходить ex vivo в результате взаимодействия производного инсулина, заявленного в соответствии с настоящим изобретением, с источником альбумина, которым может быть рекомбинантный альбумин, или альбумин, выделенный из плазмы субъекта, или альбумин, полученный из любого другого подходящего источника, при этом такой источник хорошо известен специалистам в данной области. Молекула инсулина может представлять собой нативный инсулин человека (см. последовательность нативного инсулина человека, представленную в формуле 1) или же его аналог, такой как молекула инсулина с аминокислотными заменами, аминокислотными делециями или аминокислотными вставками. Далее перечисляются примеры аналогов инсулина, которые могут использоваться в соответствии с настоящим изобретением (без ограничений указанными): инсулин гларгин, выпускаемый под коммерческим названием Lantus компанией Aventus Pharmaceuticals Inc., в котором в положении А 21 замещен глицин, а на С-конце В цепи добавлены два остатка аргинина; инсулин детемир, выпускаемый под коммерческим названием Levemir компанией Novo Nordisk A/S, который представляет собой нативный инсулин человека, в котором удален треонин в положении В 30 и к латеральной цепи лизина В 29 добавлен тетрадеканоил; инсулин лизпро, выпускаемый под коммерческим названием Humalog компаниейEli Lilly, который представляет собой Lys B28, Pro B29 инсулин человека; инсулин аспарт, выпускаемый под коммерческим названием NovoLog компанией Novo Nordisk A/S, который представляет собой AspB28 инсулин человека; и инсулин глулизин, выпускаемый под коммерческим названием Adipra компанией Aventus, который представляет собой Lys B3, Glu B29 инсулин человека. Реактивная группа может быть присоединена к различным функциональным участкам молекулы инсулина или ее аналога. Предпочтительно, реактивная группа присоединена к доступной аминокислотной группе молекулы инсулина, такой, как -аминогруппы N-концевых аминокислот цепей А и В, или аминогруппа Lys B29. В соответствии с настоящим изобретением аналог инсулина, имеющий в своем составе замещенную и/или добавленную аминокислоту(ы), может также включать дополнительную аминогруппу для связывания реактивной группы; или другой функциональный участок, также предназначенный для связывания реактивной группы. Предпочтительными реактивными группами, обладающими способностью ковалентно связывать компонент крови in vivo или ex vivo, являются акцепторы Михаэля(,незамещенные карбонильные молекулы), сукцинимидинсодержащие группы и малеимидосодержащие группы. Наиболее предпочтительной реактивной группой является малеимидосодержащая группа, и в частности МРА (3-малеимидопропионовая кислота).-3 008433 Реактивная группа может быть при желании присоединена к молекуле инсулина посредством линкера. Линкер, предпочтительно, выбирается из группы, включающей соединения гидроксиэтила, такие как (2-амино)этоксиуксусная кислота (АЕА), этилендиамин (EDA), аминоэтоксиэтоксисукциниминовая кислота (AEES), 2-[2-(2-амино)этокси]этоксиуксусная кислота (АЕЕА), АЕЕА-АЕЕА, -NH2-(CH2)nCOOH, где n представляет собой целое число от 1 до 20; мотив алкильных цепей (C1-C10), насыщенных или ненасыщенных, в состав которых могут быть включены соединения с атомом кислорода, азота или серы, такие как глицин, 3-аминопропионовая кислота (АРА), 8-аминокаприловая кислота (ОА), 4 аминобензойная кислота (APhA). К комбинациям линкеров относятся (без ограничений указанными):AEEA-EDA, АЕЕА-АЕЕА, АЕА-АЕЕА, AEES-AEES и им подобные. Предпочтительно использовать такой линкер, как 8-аминокаприловая кислота (АОА), или не использовать линкер вообще с реактивной группой МРА. Любой специалист в данной области знает, какой тип линкера является наиболее подходящим для целей настоящего изобретения. Настоящее изобретение также относится к конъюгату инсулина. Конъюгат включает производное инсулина, при этом реактивная группа реагирует с компонентом крови in vivo или ex vivo с формированием ковалентной связи. Таким образом, конъюгат может быть сформирован in vivo при введении производного инсулина, или ex vivo, при взаимодействии производного инсулина с раствором крови или очищенными компонентами крови ex vivo в условиях, способствующих формированию ковалентной связи. Очищенные компоненты крови могут быть получены путем экстракции или очищения образца крови или с помощью рекомбинантных технологий. Предпочтительным компонентом крови является белок крови и более предпочтительным альбумин сыворотки. Настоящее изобретение также относится к способу лечения заболеваний и патологических состояний, связанных с изменением уровня глюкозы в крови, заключающемуся во введении производных инсулина или конъюгатов инсулина. К заболеваниям или патологическим состояниям, связанным с изменением уровня глюкозы в крови, относятся диабет 1- и 2-го типа, а также гестационный диабет. Также производные инсулина и конъюгаты инсулина, заявленные в соответствии с настоящим изобретением,могут использоваться для лечения муковисцидоза, синдрома поликистозных яичников, панкреатита и других заболеваний, связанные с нарушением функции поджелудочной железы. Также известно, что инсулин является фактором роста, следовательно, производные инсулина или конъюгаты инсулина, заявленные в соответствии с настоящим изобретением, могут быть полезны при местном применении для заживления ран и других подобных ситуациях. Представленные ниже примеры иллюстрируют настоящее изобретение и никоим образом не ограничивают его объема. Примеры На фиг. 1 показана молекула инсулина, а также сайты Gly A1, Phe B1 и Lys В 29, о которых упоминается в приведенных ниже примерах. Пример I. Синтез (Gly А 1)-МРА-инсулина. Инсулин (100 мг) растворяют в DMF (диметилформамид) (2 мл) и TFA (100 мкл). К полученному раствору добавляют NMM (4-метилморфолин, 200 мкл) и MPA-Osu (N-сукцинимидил 3 малеимидопропаноат, 9,2 мг 2,5 эквивалента), и реакционную смесь перемешивают в течение 2 ч. Реакцию гасят добавлением воды и доводят рН до 4 с помощью АсОН (уксусная кислота). Для растворения преципитата добавляют ацетонитрил, общий объем смеси вода/ацетонитрил (3:1) составляет 20 мл. Раствор подвергают полупрепаративной HPLC. Колонку 21250 мм фирмы Phenomenex Luna (10 м фенилгексила), уравновешивают водным раствором TFA (0,1% TFA в ацетонитриле, растворитель В). Элюцию осуществляют при скорости потока 9,5 мл/мин, используя 27-31% градиент В, в течение 120 мин. Фракции, содержащие пептиды, исследуют по поглощению в ультрафиолете при 214 и 254 нм. Фракции собирают и распределяют на аликвоты объемом 9,5 мл. Фракции, содержащие желаемый продукт, идентифицируют методом масс-детекции после непосредственного нанесения на LC/MS. Очищенные фракции собирают при комнатной температуре в течение 36-46 мин, объединяют и лиофилизируют до получения белого порошка (40 мг) и 23 мг восстановленного инсулина. Рассчитанная масса составляет 5958,5 г/моль; масса, измеренная с помощью LC-MS, составляет 5958,0 г/моль. В табл. 1 представлены результаты анализа аминокислотной последовательности (расщепление по Эдману с использованием фенилизотиоцианата), который осуществляли для того, чтобы подтвердить,что А-цепь на N-концевом участке заблокирована, а В-цепь на N-концевом участке (фенилаланин) остается свободной. В табл. 1 представлена структура продуктов элюции после расщепления по Эдману в соответствии с примерами I-IV Пример II. Синтез (Phe В 1)-МРА-инсулина. Инсулин (100 мг) растворяют в DMSO (диметилсульфоксид) (4 мл) и Et3N (триэтиламин) (100 мкл) с одновременной обработкой ультразвуком. К раствору добавляют Boc2O (дитрет-бутил дикарбонат)(9,3 мг, 2,5 эквивалента), и реакционную смесь перемешивают при температуре окружающей среды в течение 30 мин. Реакцию гасят добавлением воды (15 мл) и ацетонитрила (5 мл), и рН раствора доводят до 4 с помощью АсОН. Раствор подвергают полупрепаративной HPLC. Колонку 21250 мм фирмы Phenomenex Luna (10 м фенилгексила) уравновешивают водным раствором TFA (0,1% TFA в H2O, растворитель А) и раствором TFA в ацетонитриле (0,1% TFA в CH3CN, растворитель В). Элюцию осуществляют при скорости потока 9,5 мл/мин, используя 27-40% градиент В, в течение 120 мин. Фракции, содержащие пептиды, исследуют по поглощению в ультрафиолете при 214 и 254 нм. Фракции собирают и распределяют на аликвоты объемом 9,5 мл. Фракции, содержащие желаемый продукт, идентифицируют методом масс-детекции после непосредственного нанесения на LC/MS. Три продукта (Вос-инсулин, Gly A1 Lys В 29-ВicBoc-инсулин и TrisBoc-инсулин) выделяют, и нужные фракции (GlyA1 Lys В 29)-BisBoc-инсулин объединяют и лиофилизируют до получения белого порошка (72 мг). Осуществляют реакцию (Gly A1 Lys В 29)-BisBoc-инсулина (51 мг) в DMF (3 мл) с MPA-OSu (36 мг) в присутствии Et3N (30 мкл). Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды. DMF выпаривают в условиях вакуума. Осадок обрабатывают TFA (2 мл) в течение 10 мин, после чего TFA выпаривают. Неочищенный продукт растворяют в воде/ацетонитриле (3:1), и раствор подвергают полупрепаративной HPLC. Колонку 21250 мм фирмы Phenomenex Luna 10, наполненную 10 мг фенилгексила, уравновешивают водным раствором TFA (0,1%о TFA в Н 2O, растворитель А) и раствором TFA в ацетонитриле (0,1% TFA в CH3CN, растворитель В). Элюцию осуществляют при скорости потока 9,5 мл/мин, используя 27-32% градиент В, в течение 120 мин. Фракции, содержащие пептиды, исследуют по поглощению в ультрафиолете при 214 и 254 нм. Фракции собирают и распределяют на аликвоты объемом 9,5 мл. Фракции, содержащие желаемый продукт, идентифицируют методом детекции масс после непосредственного нанесения на LC/MS. Очищенные фракции объединяют и лиофилизируют до получения белого порошка (29 мг). Рассчитанная масса составляет 5958,5 г/моль; масса, измеренная с помощью LC-MS, составляет 5958,4 г/моль. Анализ аминокислотной последовательности (расщепление по Эдману с использованием фенилизотиоцианата) осуществляли для того, чтобы подтвердить, что В-цепь на N-концевом участке заблокирована, а А-цепь на N-концевом участке (глицин) остается свободной (см. табл. 1). Пример III. Синтез (B1)-МРА-ОА-инсулин. Осуществляют реакцию (Gly A1 Lys В 29)-BisBoc-инсулина (39 мг) в DMF (3 мл) и Et3N (30 мкл) сMPA-OA-Osu ([N-сукцинимидил 8-N-(3-малеимидопропанилкарбонил)аминооктаноат] 25 мг) в течение 4 ч. DMF выпаривают, и осадок обрабатывают TFA в течение 10 мин. После выпаривания TFA осадок растворяют в воде/ацетонитриле (3:1). Раствор подвергают полупрепаративной HPLC. Колонку 21250 мм фирмы Phenomenex Luna (10 м фенилгексила) уравновешивают водным раствором TFA(0,1% TFA в H2O, растворитель А) и раствором TFA в ацетонитриле (0,1% TFA в CH3CN, растворитель В). Элюцию осуществляют при скорости потока 9,5 мл/мин, используя 27-36% градиент В, в течение 120 мин. Фракции, содержащие пептиды, исследуют по поглощению в ультрафиолете при 214 и 254 нм.-5 008433 Фракции собирают и распределяют на аликвоты объемом 9,5 мл. Фракции, содержащие желаемый продукт, идентифицируют методом масс-детекции после непосредственного нанесения на LC/MS. Очищенные фракции объединяют и лиофилизируют до получения белого порошка (21 мг). Рассчитанная масса составляет 6099,5 г/моль, масса, измеренная с помощью LC-MS, составляет 6099,6 г/моль. Пример IV. Синтез (Lys В 29)-МРА-инсулина. Инсулин (74 мг) растворяют в DMSO (2 мл) и АсОН (46 мкл). К раствору добавляют Boc2O (6,9 мг,2,5 эквивалента) и реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Затем к раствору добавляют воду (15 мл) и ацетонитрил (5 мл), и раствор подвергают полупрепаративной HPLC на колонке (С 18 фенилгексил) со скоростью потока 9,5 мл/мин и с градиентом 27-40% в течение 120 мин. Фракции собирают в течение 43 мин, объединяют и лиофилизируют до получения (Gly A1 Phe В 1)-Вос 2 инсулина (30 мг). Осуществляют реакцию (Gly A1 Phe В 1)-Вос 2-инсулина (30 мг) в DMF (2 мл) и NMM (4 метилморфолин, 100 мкл) с MPA-OSu (10 мг) в течение 60 мин. DMF выпаривают, и осадок обрабатывают TFA в течение 10 мин. Осадок растворяют в воде/ацетонитриле (3:1), и раствор подвергают полупрепаративной HPLC. Колонку 21250 мм фирмы Phenomenex Luna 10, наполненную 10 мг фенилгексила,уравновешивают водным раствором TFA (0,1% TFA в H2O, растворитель А) и раствором TFA в ацетонитриле (0,1% TFA в H2O, растворитель В). Элюцию осуществляют при скорости потока 9,5 мл/мин, используя 27-32% градиент В, в течение 120 мин. Фракции, содержащие пептиды, исследуют по поглощению в ультрафиолете при 214 и 254 нм. Фракции собирают и распределяют на аликвоты объемом 9,5 мл. Фракции, содержащие желаемый продукт, идентифицируют методом детекции масс после непосредственного нанесения на LC/MS. Очищенные фракции объединяют и лиофилизируют до получения белого порошка (22 мг). Рассчитанная масса составляет 5958,5 г/моль, масса, измеренная с помощью LC-MS, составляет 5958,0 г/моль. Анализ аминокислотной последовательности (расщепление по Эдману с использованием фенилизотиоцианата) осуществляют для того, чтобы подтвердить, что В-цепь (фенилаланин) и А-цепь (глицин) наN-концевых участках остаются свободными (см. табл. 1). Пример V. Синтез MPA-(AEES)2-COOH линкера. Хроматографию на колонке для отгона легких фракций осуществляют с использованием модульной системы "40i flash-chromatography" фирмы Biotage. Очистку с помощью полупрепаративной HPLC проводят с помощью системы Waters "Breeze" серии 1500 с использованием колонки Phenomex Luna(RP-18, 10 m фенилгексил, 25021,2 мм) со скоростью потока мобильной фазы 9,5 мл/мин. Систему Gilson 690 используют для препаративной ступенчатой очистки с помощью колонки Phenomex Luna (RP-18,10 m фенилгексил, 25050 мм) со скоростью потока мобильной фазы 50 мл/мин. Градиент ацетонитрила(CH3CN) (0,1% TFA) в воде (0,1% TFA) используют, как указано ниже применительно к процедуре синтеза каждого соединения. LC-MS проводят при использовании одиночного квадрипольного массспектрофотометра Agilent 1100 серии LC-MSD с источником электроизлучения ES1.-6 008433 Пример VI. Синтез (Phe В 1)-МРА-(АЕЕS)2-инсулина. Осуществляют реакцию 2-(2-аминоэтокси)этанола (50,0 г) в метаноле (150 мл) с Boc2O (93,4 г) в течение 30 мин. Метанол выпаривают в условиях вакуума, и осадок поглощают этилацетатом, отмывают водой, солевым раствором и высушивают с помощью сульфата натрия. После выпаривания растворителя неочищенный продукт используют для следующего этапа синтеза. MS m/z 205. Защищенный спирт растворяют в N,N-диметилформамиде (500 мл) в присутствии Et3N (66 мл). По каплям добавляют MsCl (мезилата хлорид) (33,4 мл) при температуре 0 С в течение 30 мин, и затем реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. К реакционной смеси сначала добавляют NaN3 (127,6 г), после чего добавляют NMM (N-метилморфолин, 215 мл), и реакционную смесь перемешивают при 40-50 С в течение 16 ч. Реакционную смесь вливают в этилацетат (2 л) и отмывают водой. Водный слой экстрагируют этиацетатом (2 л) и комбинированные слои этилацетата отмывают водой, солевым раствором и высушивают. После выпаривания растворителя неочищенный продукт используют для следующего этапа синтеза (101,4 г содержат некоторое количество DMF). MSPd(OAc)2 (3,0 г) и муравьиную кислоту (96% 62 г). После завершения реакции частицы Pd удаляют путем фильтрации через целит. Метанол удаляют в условиях вакуума и реакционную смесь высушивают также в условиях вакуума. Неочищенный продукт используют для следующего этапа синтеза. Неочищенный продукт растворяют в дихлорметане и нейтрализуют Et3N до тех пор, пока реакция не станет щелочной. Добавляют одну порцию янтарного ангидрида (32,2 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Растворитель удаляют в условиях вакуума и осадок окисляют с помощью 1N HCl до рН 3. Продукт экстрагируют этилацетатом. Слой этилацетата пропускают через пробку силикагеля (1 кг). Затем силикагель отмывают 2-4% метанолом в этилацетате. Очищенные фракции (что подтверждают с помощью тонкослойной хроматографии) объединяют, и растворитель удаляют в условиях вакуума для получения Boc-AEES в виде масляного осадка (36 г, 44%).Boc-AEES (5,5 г) обрабатывают N-гидроксисукцинимидом (NHS, 4,57 г) и этил(диметиламинопропил)карбодимидгидрохлоридом (EDC, 7,62 г) в дихлометане (30 мл) в течение 2 ч. Эфир NHS вливают в этилацетат (500 мл), отмывают 0,1 N HCl и высушивают с помощью сульфата натрия. Растворитель удаляют в условиях вакуума, и осадок используют для следующего этапа синтеза.Boc-AEES (6,05 г) обрабатывают трифторуксусной кислотой (TFA, 10 мл) в течение 10 мин. TFA удаляют в условиях вакуума и высушивают над вакуумом. Аминокислоту (AEES) растворяют в N,Nдиметилформамиде (20 мл) и повышают основность смеси избыточным количеством NMM. Затем добавляют неочищенный продукт, полученный как описано в примере V, и реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Растворитель выпаривают под отрицательным давлением и осадок подвергают препаративной HPLC с использованием градиента 5-40% в течение 60 мин. Растворитель удаляют, и осадок высушивают в условиях вакуума для получения Boc-(AEES)2COOH в форме масла (5,64 г, 84%). MS m/z 478.Boc-(AEES)2-COOH (3,60 г) обрабатывают трифторуксусной кислотой (TFA, 10 мл) в течение 10 мин. TFA удаляют в условиях вакуума и высушивают также над вакуумом. Аминокислоту (AEES)2 растворяют в N,N-диметилформамиде и повышают основность смеси с помощью NMM. ДобавляютMPA-OSu (2,94 г), и смесь перемешивают в течение 30 мин. N,N-диметилформамид удаляют над вакуумом. Осадок растворяют в воде и подвергают препаративной HPLC с использованием градиента 4-50% в течение 60 мин. Очищенные фракции объединяют, и растворитель удаляют для получения MPA(AEES)2-COOH в форме твердого вещества серовато-белого цвета (3,8 г, 95%). MS m/z 542,2.(1,13 мл) и обрабатывают n-нитрофенилхлорформиатом (1,13 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч. N,N-диметилформамид удаляют над вакуумом. Осадок удаляют с помощью хроматографии на колонке для отгона легких фракций с использованием системыBiotage. Колонку промывают сначала этилацетатом (500 мл), а затем 10% метанолом в этилацетате(1 л). Очищенные фракции объединяют, и растворитель удаляют для получения MPA-(AEES)2-CO2PNP в форме твердого вещества (1,39 г, 37%). MS m/z 663.Gly A1, Lys B29-BisBoc-инсулин (200 мг) в N,N-диметилформамиде (10 мл) объединяют с MPA(AEES)2-CO2PNP, полученным как описано в примере VIII (200 мг), в присутствии NMM (200 мкл) при температуре окружающей среды в течение 16 ч. N,N-диметилформамид удаляют над вакуумом, и осадок обрабатывают TFA в течение 10 мин. TFA удаляют в условиях вакуума, осадок растворяют в воде и подвергают HPLC с использованием градиента 27-32% в течение 120 мин. Очищенные фракции объединяют и растворитель лиофилизируют для получения (Phe B1)-MPA-(AEES)2-инсулина в форме белого порошка (95,0 мг, 43,7%). MS m/z 6630,4. Пример VII. Синтез (В 29)-МРА(АЕЕS)2-инсулина.Gly A1 Phe B1 BisBoc-инсулин (200 мг) в N,N-диметилформамиде (10 мл) объединяют с MPA(AEES)2-CO2PNP, полученным как описано в примере VI (200 мг), в присутствии NMM (200 мкл) при температуре окружающей среды в течение 16 ч. N,N-диметилформамид удаляют над вакуумом, и осадок обрабатывают TFA в течение 10 мин. TFA удаляют в условиях вакуума, осадок растворяют в воде и подвергают HPLC с использованием градиента 27-32% в течение 120 мин. Очищенные фракции объединяют, и растворитель лиофилизируют для получения (Lys B29)-MPA-(AEES)2-инсулина в форме белого порошка (56,3 мг, 25,9%). MS m/z 6328,8. Пример VIII. Синтез (В 29)-МРА(ОА)-инсулина.Gly A1 Phe В 1-BisBoc-инсулин (205 мг) в N,N-диметилформамиде (10 мл) объединяют с MPA-OACO2Su (139 мг) в присутствии NMM (20 мкл) при температуре окружающей среды в течение 16 ч. Растворитель удаляют над вакуумом, и осадок обрабатывают TFA в течение 10 мин. TFA удаляют в условиях вакуума, осадок растворяют в воде и подвергают HPLC с использованием градиента 27-36% в течение 120 мин. Очищенные фракции объединяют, и растворитель лиофилизируют для получения (Lys В 29)МРА(ОА)-инсулина в форме белого порошка (64,2 мг, 31%). MS m/z 6098.8. Пример IX. Анализ связывания in vitro. Мембраны клеток печени крыс линии Вистар инкубируют с [125I] с возрастающими концентрациями инсулина, DAC: инсулином, а также их соответствующими конъюгатами как показано на фиг. 1 в течение 16 ч при 4 С. Мембраны фильтруют и отмывают 3 раза, а фильтры считают для определения На фиг. 2 и 3 представлено связывание инсулина в мембранах клеток печени крыс линии Вистар,выраженное в процентах ингибирования функции в зависимости от концентрации производного инсулина, заявленного в соответствии с настоящим изобретением. Пример X. Биоактивность in vitro. Оценку активности in vitro проводят на основании захвата глюкозы адипоцитами. Осуществляют дифференцировку клеток 3T3-L1 (линия клеток фибробластов мыши) в адипоциты для проведения биологического исследования. Клетки 3T3-L1 высевают на чашки Петри и выращивают до состояния монослоя в DMEM и 10% FBS с последующей инкубацией в течение двух дней. Дифференцировку клеток индуцируют добавлением дексаметазона и инсулина (D0). К 7-му дню более 90% клеток демонстрируют фенотип адипоцитов, т.е. обладают способностью аккумулировать капельки жира. На фиг. 4 А-4 С представлены преадипоциты, клетки через 3 дня инкубирования и адипоциты на 7-й день. На фиг. 5 А и 5 В показаны окрашенные масляным красным адипоциты на 4- и 7-й день инкубирования. На фиг. 6 А и 6 В-8 008433 показаны окрашенные масляным красным и метиленовым синим клетки на 4- и 7-й день инкубирования. Адипоциты 3T3-L1 выращивают в течение ночи в DMEM, содержащем 5 мМ глюкозы и 0,5% FBS. Клетки отмывают в буфере Кребса-Рингера (ХЕПЕС), содержащем 1% BSA, и инкубируют с возрастающими концетрациями инсулина, DAC: инсулина и их соответствующего конъюгата в течение 20 мин при 37 С и с [14 С]-2-деокси-D глюкозой (1 мкКи/на лунку) еще 20 мин. Клетки солюбилизируют и измеряют радиоактивность. Захват глюкозы (%) рассчитывают по отношению к контролю инсулина и рассчитывают ЕС 50 с помощью программы GraphPad Prism. В табл. 3 представлены результаты расчета ЕС 50 для тестируемых соединений, а фиг. 7 иллюстрирует захват глюкозы, выраженный в процентах по отношению к контролю, в зависимости от концентрации (М) соединений. Таблица 3 Пример XI. Дополнительно оценку активности in vitro проводят на основании захвата глюкозы адипоцитами,полученными из другого источника. Используют эпидидимальные жировые клетки, выделенные из мужских особей крыс линии Вистар весом 17525 г. Ткань (0,03 г/мл) разрушают коллагеназой в модифицированном растворе HEPES при рН 7,4 и температуре 37 С. Тестируемое соединение и/или контроль распределяют на аликвоты объемом 500 мкл и инкубируют в модифицированном буфере HEPES рН 7,4,после чего добавляют D-[3-3 Н]глюкозу (2,5 мкКи/мл) и инкубируют еще 2 ч. Усиление захвата глюкозы тестируемым соединением на 50% или более (50%) по отношению к контрольному инсулиновому ответу 2 нМ свидетельствует о возможной активности инсулиновых рецепторов-агонистов. Ингибирование тестируемым соединением индуцированного инсулином захвата глюкозы более чем на 50% свидетельствует об активности инсулиновых рецепторов-антагонистов. Соединения исследуют в количестве 10; 1; 0,1; 0,01 и 0,001 мкМ. В табл. 4 представлены значения ЕС 50 тестируемых соединений. Фиг. 8 иллюстрирует захват глюкозы, выраженный в процентах контроля функции в зависимости от концентрации (М) соединений. Таблица 4 Пример XII. Исследования in vivo. Сравнивают эффект заявленных в соответствии с настоящим изобретением рекомбинантного инсулина человека и производных инсулина, введенных подкожно, на снижение уровня глюкозы в крови у женских особей мышей db/db, страдающих диабетом. Тестируемые соединения вводят однократно подкожно женским особям мышей db/db, страдающих диабетом, весом 24,3-33,3 г, возраст которых составляет 5-6 недель. Средний объем вводимого одной мыши раствора составляет 0,35 мл (12,5 мл/кг). Рекомбинантный (Е. coli) инсулин человека (далее в настоящем описании обозначается как "rH инсулин") предоставлен компанией ICNTM в концентрации 28 МЕ/мг. Исходные растворы производных инсулина получают в концентрации 14,29 мг/мл (400 МЕ/мл) путем восстановления синтезированных производных инсулина подкисленной водой (рН 2). Исходные растворы последовательно разводят 0,9% NaCl и 0,22 мкм фильтруют (Millex GV) для получения дозовых растворов с различной концентрацией, которые представлены в табл. 5. Группа 1 получала 0,9% Группы и режимы введения представлены в табл. 6. Таблица 6 Исходя из активности rH инсулина в концентрации 28 МЕ/мг, как определено поставщиком. Уровни глюкозы и конечный ответ измеряют в образце крови (одна капля) с помощью ручного глюкометра (модель: One Touch Ultra, Lifescan Canada). Уровни глюкозы в крови измеряют у всех животных одн ократно перед введением (пре-доза) тестируемых соединений и через 1, 2, 3, 4, 6, 24, 30, 48 и 72 ч после их введения (пост-доза). Результаты in vivo. Все животные перед введением тестируемых соединений выглядели нормально. Приблизительно через 1 ч после введения у животных из группы 2, которым подкожно ввели 100 МЕ/кг рекомбинантного инсулина человека (rH инсулин), отмечалось уменьшение активности и нескоординированная ходьба. У других животных в ходе эксперимента никаких отклонений не отмечалось. Незначительное снижение потребления пищи наблюдалось у животных, которым ввели соединение, полученное как описано в примере III, в дозе 17,9 мг/кг. В табл. 7 представлены данные о потреблении пищи (общий вес животных в одной клетке, г) после однократного введения rH инсулина и производных инсулина. В табл. 8 представлены данные о потреблении пищи по отношению к контролю (общий вес животных в одной клетке, г) после однократного введения rH инсулина и производных инсулина. Таблица 8% потребления пищи по отношению к контрольной группе Изменения гликемии рассчитывают для каждого животного как отношение уровней глюкозы крови после введения тестируемых соединений (пост-доза) к уровням глюкозы крови перед их введением (предоза); данные представлены на фиг. 9-14. В целом производные инсулина (примеры I-III) обладают способностью снижать концентрацию глюкозы в крови с дозозависимым эффектом, а рекомбинантный инсулин, тестируемый только в одной дозе (100 МЕ/кг), сохраняет активность в течение 2 ч. Соединение,полученное, как описано в примере II, вводимое в дозе 3,6 мг/кг, в течение первых 2 ч проявляет такую же активность, как и инсулин, в отличие от незначительного эффекта соединений примера I и примераIII. Эффект rH инсулина является более продолжительным, если последний вводить в дозе 17,9 мг/кг;- 11008433 эффект сохраняется на протяжении 24 ч. Несмотря на то, что в целом все производные инсулина, предположительно, сохраняют свою активность в течение 24 ч (по сравнению с контрольной группой), необходимо отметить, что уровень глюкозы понижается через 1-2 ч после введения, повышается через 3-4 ч и снова снижается через 6 ч. Такой скачкообразный ответ свидетельствует о том, что пищевое поведение и метаболизм мышей являются важными параметрами, которые могут повлиять на эффективность лекарственного средства. Также необходимо отметить, что у db/db мышей с возрастом развивается резистентность к инсулину, что объясняет необходимость применения более высоких доз инсулина для снижения уровня глюкозы крови. Пример XIII. Фармакокинетический профиль у нормальных крыс. 7-8-недельным самцам мышам линии CD вводят rH инсулин, производное инсулина примера III и конъюгат инсулина примера III в дозе 36 нмоль/кг подкожно и в дозе 12 нмоль/кг внутривенно. Образцы крови отбирают в течение 72 ч (в течение 3 ч у животных, которым вводили rH инсулин). Уровень лекарственных средств определяют с помощью набора для ELISA, предназначенного для инсулина человека(Linco). Фармакокинетические параметры рассчитывают с помощью некомпартментного анализа с использованием программы WinNonlin, N=4 крысы на одно соединение/путь. На фиг. 15 представлен фармакокинетический профиль инсулина у нормальных CD крыс после его подкожного введения в дозе 36 нмоль/кг и внутривенного введения в дозе 12 нмоль/кг. На фиг. 17 представлен фармакокинетический профиль производного инсулина примера III у нормальных CD крыс после его подкожного введения в дозе 36 нмоль/кг и внутривенного введения в дозе 12 нмоль/кг. На фиг. 18 представлен фармакокинетический профиль инсулина, производного инсулина примера III и конъюгата инсулина примера III после их подкожного введения. На фиг. 19 представлен фармакокинетический профиль инсулина, производного инсулина примера III и конъюгата инсулина примера III после их внутривенного введения. Пример XIV. Фармакодинамика единичной дозы у крыс, страдающих диабетом. Индуцируют развитие диабета у мужских особей крыс CD путем однократного внутривенного введения стрептозоцина (60 мг/кг). Два дня спустя крысы получают подкожную инъекцию производных инсулина DAC однократно в дозе 120 нмоль/кг, заявленных конъюгатов в дозе 300 нмоль/кг, rH инсулина в дозе 20 МЕ/кг (120 нмоль/кг) или контроля. Уровень глюкозы в крови измеряют с помощью ручного глюкометра непосредственно перед инъекцией и спустя 1, 2, 3, 4, 6, 8, 10, 11, 24, 30 и 48 ч после инъекции у 5 крыс из группы, за исключением контрольной группы, где тестировали только 3 крысы из группы. Гликемия у нормальных крыс составляет от 5,2 до 7,6 ммоль/л. На фиг. 20 представлен уровень глюкозы у крыс после введения соединений примеров I-IV в дозе 120 нмоль/кг. На фиг. 21 представлен уровень глюкозы крови у крыс после введения соответствующего конъюгата примеров I-IV, заявленного в соответствии с настоящим изобретением, в дозе 300 нмоль/кг. Пример XV. Оценка эффектов производных инсулина: DAC и их соответствующих конъюгатов после повторного подкожного введения. Для того чтобы оценить эффективность производного инсулина примера III и его конъюгатов по сравнению со свободным рекомбинантным инсулином человека, осуществляют исследование, которое заключается в подкожном введении этих соединений взрослым мужским особям крыс CD. Индуцируют диабет 1-го типа у мужских особей крыс CD на день 1 исследования путем однократного внутривенного введения стрептозоцина (60 мг/кг, рН 4.5). Гипергликемию в образцах крови измеряют с помощью мониторинга уровня глюкозы крови. Тестируемое соединение вводят подкожно один раз в день с 3- по 14-й дни исследования в дозе 1 мл/ кг веса тела. Уровни глюкозы в крови измеряют непосредственно перед введением соединения ежедневно через 2, 8 и 18 ч после введения тестируемого соединения. Потребление пищи и воды оценивают ежедневно. Массу тела измеряют на 1-, 2-, 6-, 9-,12-, 15- и 17-й день исследования. На фиг. 22 представлен дневной профиль глюкозы на 1-, 6- и 12-й день при введении производного инсулина примера III, а на фиг. 23 - дневной профиль глюкозы на 1-, 6- и 12-й день при введении конъюгата производного инсулина примера III. Хотя настоящее изобретение было раскрыто в соответствии со специфическими вариантами его осуществления, очевидно, что возможны дополнительные модификации настоящего изобретения и данный патент охватывает любые варианты и способы использования изобретения, согласно его основным принципам, которые следуют из настоящего описания и известны из существующей практики. Все варианты и модификации изобретения входят в объем представленной ниже формулы изобретения.- 12008433 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное инсулина, включающее молекулу инсулина и реактивную группу для ковалентного связывания компонента крови, выбранную из группы, включающей ,ненасыщенную карбонильную молекулу, сукцинимидилсодержащую группу и малеимидосодержащую группу. 2. Производное инсулина по п.1, где молекула инсулина имеет формулу I а реактивная группа присоединена к аминокислоте молекулы инсулина в любом из следующих положений: Gly A1, Phe B1 и Lys B29. 3. Производное инсулина по п.1 или 2, где реактивная группа представляет собой малеимидосодержащую группу. 4. Производное инсулина по п.1 или 2, где реактивная группа представляет собой 3 малеимидопропионовую кислоту (MPА). 5. Производное инсулина по любому из пп.1-4, где реактивная группа соединена с аминокислотой молекулы инсулина посредством линкера. 6. Производное инсулина по п.5, где указанный линкер выбран из группы, включающей (2 амино)этоксиуксусную кислоту (АЕА), этилендиамин (EDA), аминоэтоксиэтоксисукциниминовую кислоту (AEES), 2-[2-(2-амино)этокси]этоксиуксусную кислоту (АЕЕА), АЕЕА-АЕЕА, -NH2-(CH2)n-COOH,где n представляет собой целое число от 1 до 20, а также мотив алкильных цепей (C1-C10) и их комбинации. 7. Производное инсулина по п.6, где мотив алкильных цепей (C1-C10) представляет собой одну или более алкильных цепей (C1-C10), насыщенных или ненасыщенных, в которые могут быть включены атомы кислорода, азота или серы. 8. Производное инсулина по п.7, где указанная алкильная цепь выбрана из группы, включающей глицин, 3-аминопропионовую кислоту (АРА), 8-аминокаприловую кислоту (АОА) и 4-аминобензойную кислоту (APhA). 9. Производное инсулина по п.6, где указанная комбинация выбрана из группы, включающей в себяAEEA-EDA, АЕЕА-АЕЕА и АЕА-АЕЕА. 10. Производное инсулина по п.6, где указанный линкер представляет собой -NH2-(СН 2)7-СООН. 11. Производное инсулина по п.1, имеющее формулу- 13008433 12. Производное инсулина по п.1, имеющее формулу 13. Производное инсулина по п.1, имеющее формулу 14. Производное инсулина по п.1, где указанный компонент крови представляет собой белок крови. 15. Производное инсулина по п.14, где указанный белок крови представляет собой сывороточный альбумин. 16. Конъюгат инсулина, включающий производное инсулина по любому из пп.1-15 и компонент крови, где реактивная группа и компонент крови соединены посредством ковалентной связи, сформированной между указанной реактивной группой и указанным компонентом крови. 17. Конъюгат инсулина по п.16, где компонент крови представляет собой белок крови. 18. Конъюгат инсулина по п.17, где белок крови представляет собой сывороточный альбумин. 19. Конъюгат инсулина по п.16, который сформирован ex vivo. 20. Конъюгат инсулина по п.19, где компонент крови представляет собой рекомбинантный альбумин. 21. Фармацевтическая композиция, включающая производное инсулина по любому из пп.1-15, и фармацевтически приемлемый носитель. 22. Фармацевтическая композиция, включающая конъюгат инсулина по любому из пп.16-20, и фармацевтически приемлемый носитель. 23. Способ лечения заболеваний или патологических состояний, связанных с изменением уровня глюкозы в крови у субъекта, страдающего от указанного заболевания, или патологического состояния,заключающийся во введении указанному субъекту производного инсулина по любому из пп.1-15. 24. Способ по п.23, где указанное заболевание, связанное с изменением уровня глюкозы в крови,представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит. 25. Способ по п.24, где указанное заболевание, связанное с изменением уровня глюкозы в крови,- 14008433 представляет собой диабет 1-го типа и диабет 2-го типа. 26. Способ лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови, заключающийся во введении конъюгата инсулина по любому из пп.16-20. 27. Способ по п.26, где указанное заболевание, связанное с изменением уровня глюкозы в крови,представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит. 28. Способ по п.27, где указанное заболевание, связанное с изменением уровня глюкозы в крови,представляет собой диабет 1-го типа и диабет 2-го типа. 29. Способ лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови, заключающийся во введении фармацевтической композиции по любому из пп.21 и 22. 30. Способ по п.29, где указанное заболевание, связанное с изменением уровня глюкозы в крови,представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит. 31. Способ по п.30, где указанное заболевание, связанное с изменением уровня глюкозы в крови,представляет собой диабет 1-го типа и диабет 2-го типа. 32. Применение производного инсулина по любому из пп.1-15 для получения лекарственного средства, предназначенного для лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови. 33. Применение по п.32, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит. 34. Применение по п.33, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа. 35. Применение конъюгата по любому из пп.16-20 для получения лекарственного средства, предназначенного для лечения заболевания или патологического состояния, связанного с изменением уровня глюкозы в крови. 36. Применение по п.35, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа, диабет 2-го типа, гестационный диабет, муковисцидоз, синдром поликистозных яичников и панкреатит. 37. Применение по п.36, где указанное заболевание, связанное с изменением уровня глюкозы в крови, представляет собой диабет 1-го типа и диабет 2-го типа. Фиг. 14 Данные по исследованию инсулина, нМ- 22008433 Данные по исследованию конъюгатов примера III, нм
МПК / Метки
МПК: A61K 38/28, A61P 3/10, C07K 1/113, C07K 14/765, A61P 5/50, C07K 14/62
Метки: производные, использования, способы, инсулина, действия, длительного
Код ссылки
<a href="https://eas.patents.su/26-8433-proizvodnye-insulina-dlitelnogo-dejjstviya-i-sposoby-ih-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные инсулина длительного действия и способы их использования</a>
Предыдущий патент: Способ превращения вязкого жидкого остатка в топливо, пригодное к применению
Следующий патент: Установка гидрокавитационного расснаряжения боеприпасов
Случайный патент: Способ получения катализатора десульфуризации