Замещенные азолы, противовирусный активный компонент, фармацевтическая композиция, способ получения и применения
Номер патента: 20949
Опубликовано: 27.02.2015
Авторы: Бычко Вадим Васильевич, Иващенко Александр Васильевич, Митькин Олег Дмитриевич
Формула / Реферат
1. Замещенные азолы общей формулы 1 и их фармацевтически приемлемые соли
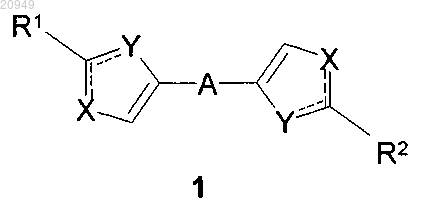 где сплошные линии с сопровождающими их пунктирными линиями
где сплошные линии с сопровождающими их пунктирными линиями X и Y необязательно принимают разные значения и представляют собой атом азота, кислорода, серы или группу NH;
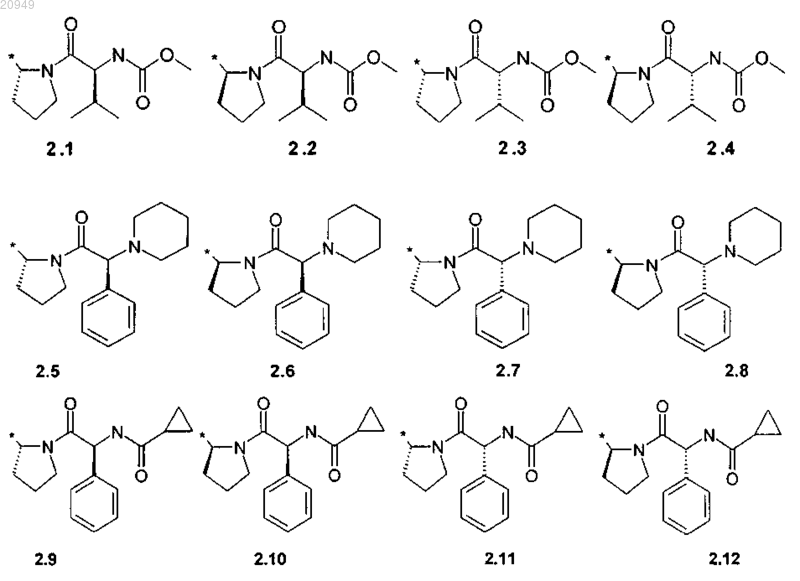
R1 и R2 представляют собой необязательно одинаковые радикалы 2.1-2.20, в которых звездочкой (*) указано место присоединения к азольным фрагментам

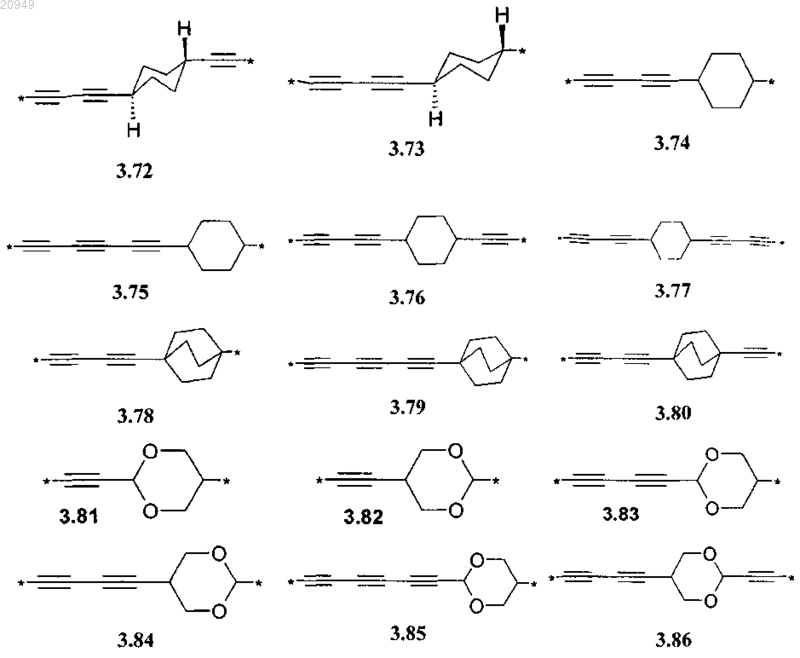
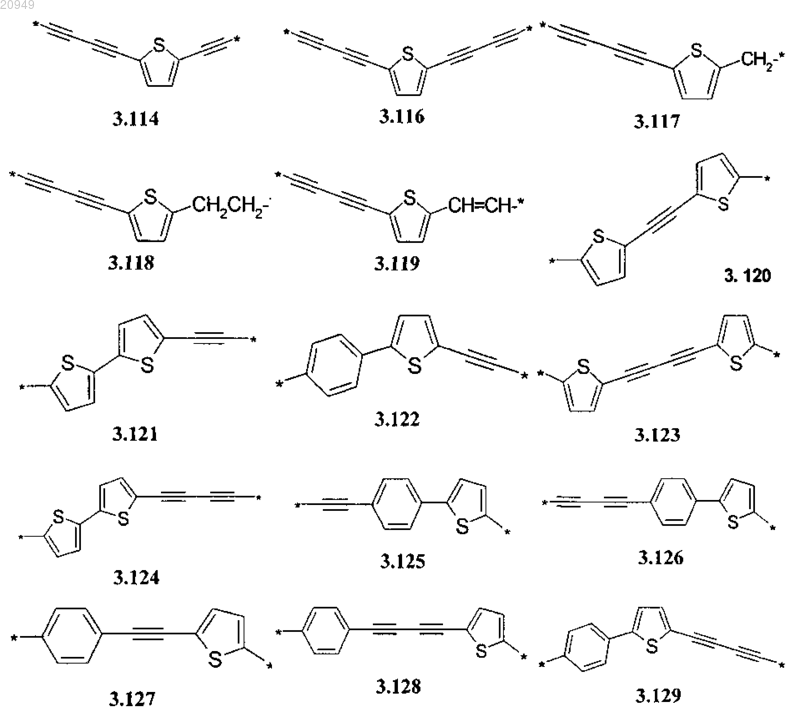
А представляет собой алкинилциклоалкильный, алкинилдиоксановый, алкиниларильный, алкилтиофеновый, алкенилтиофеновый и алкинилтиофеновый бирадикал, выбранный из бирадикалов формул 3.72-3.129, в которых звездочкой (*) указаны места присоединения азольных фрагментов

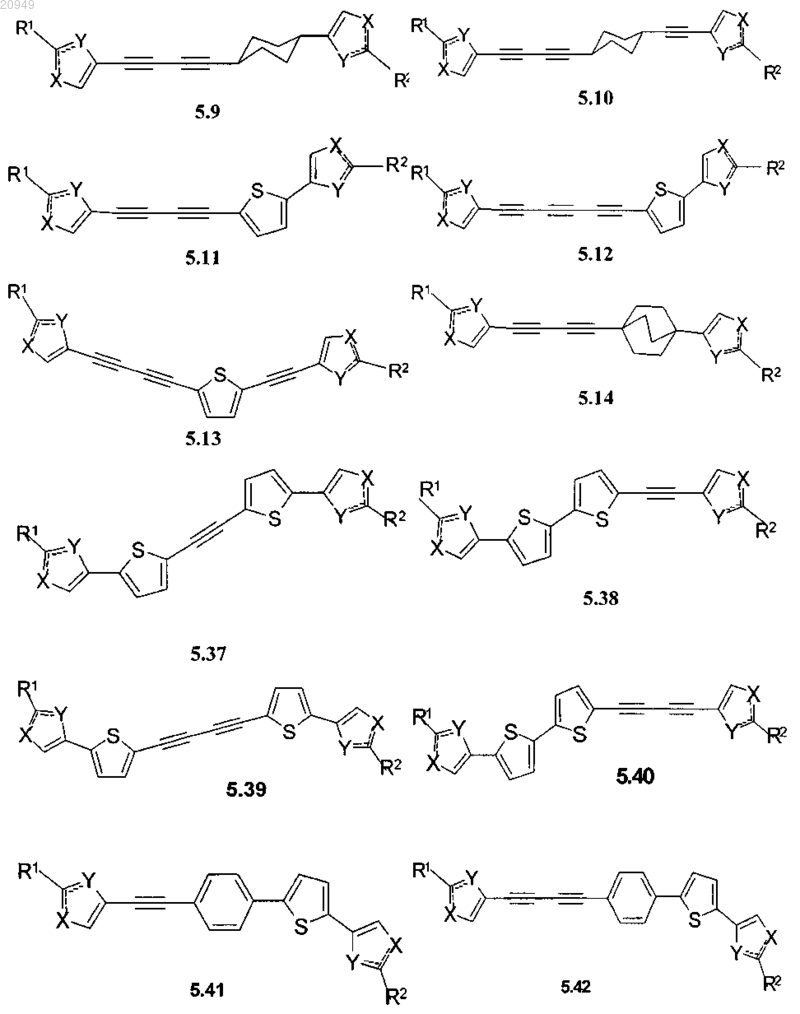
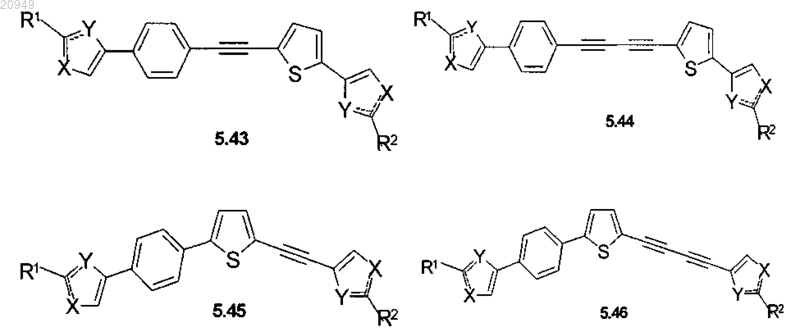
 2. Соединения по п.1, представляющие собой замещенные азолы общей формулы 5.1-5.70, в которых X, Y, R1, R2 и сплошные линии с сопровождающими их пунктирными линиями
2. Соединения по п.1, представляющие собой замещенные азолы общей формулы 5.1-5.70, в которых X, Y, R1, R2 и сплошные линии с сопровождающими их пунктирными линиями 
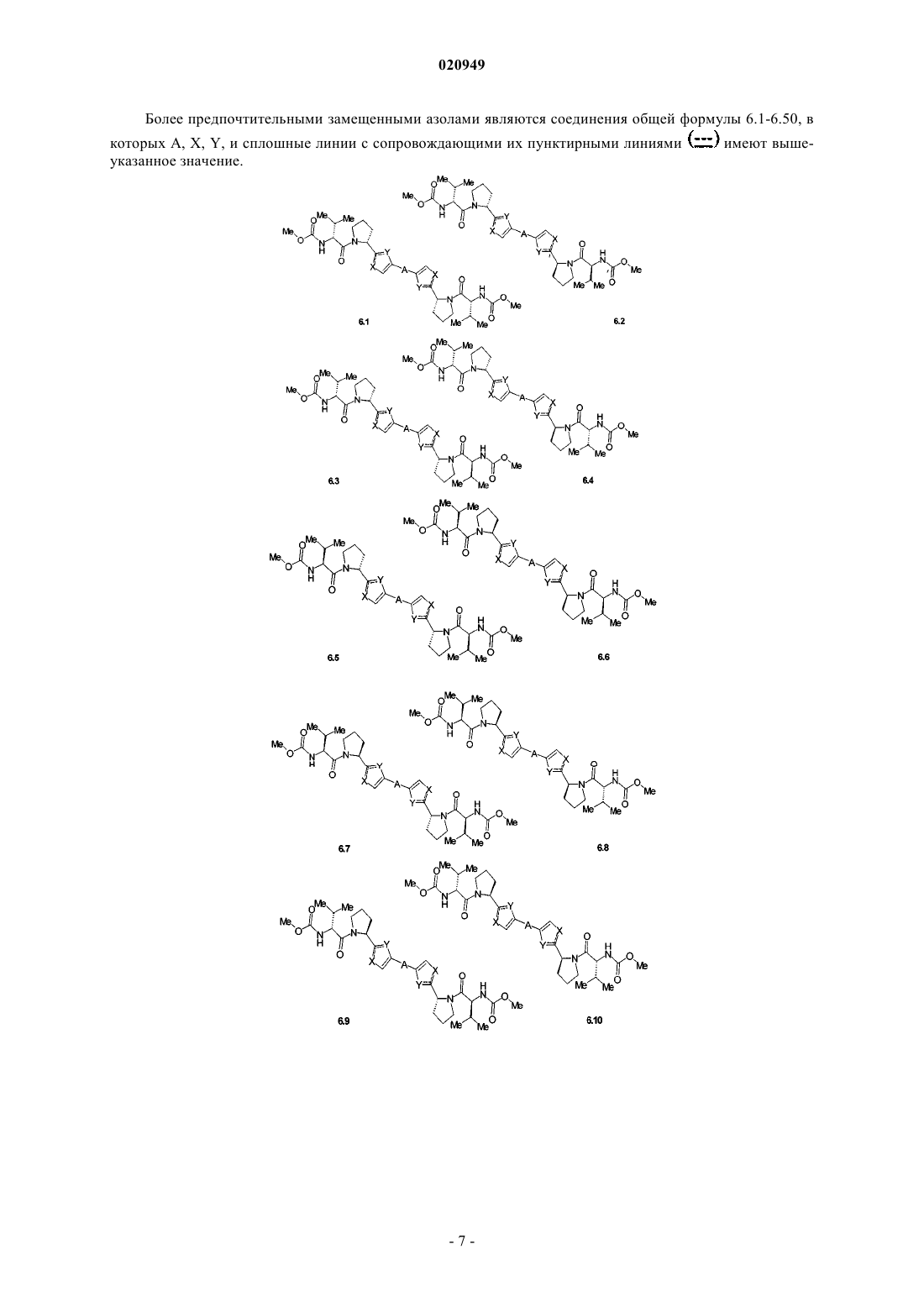
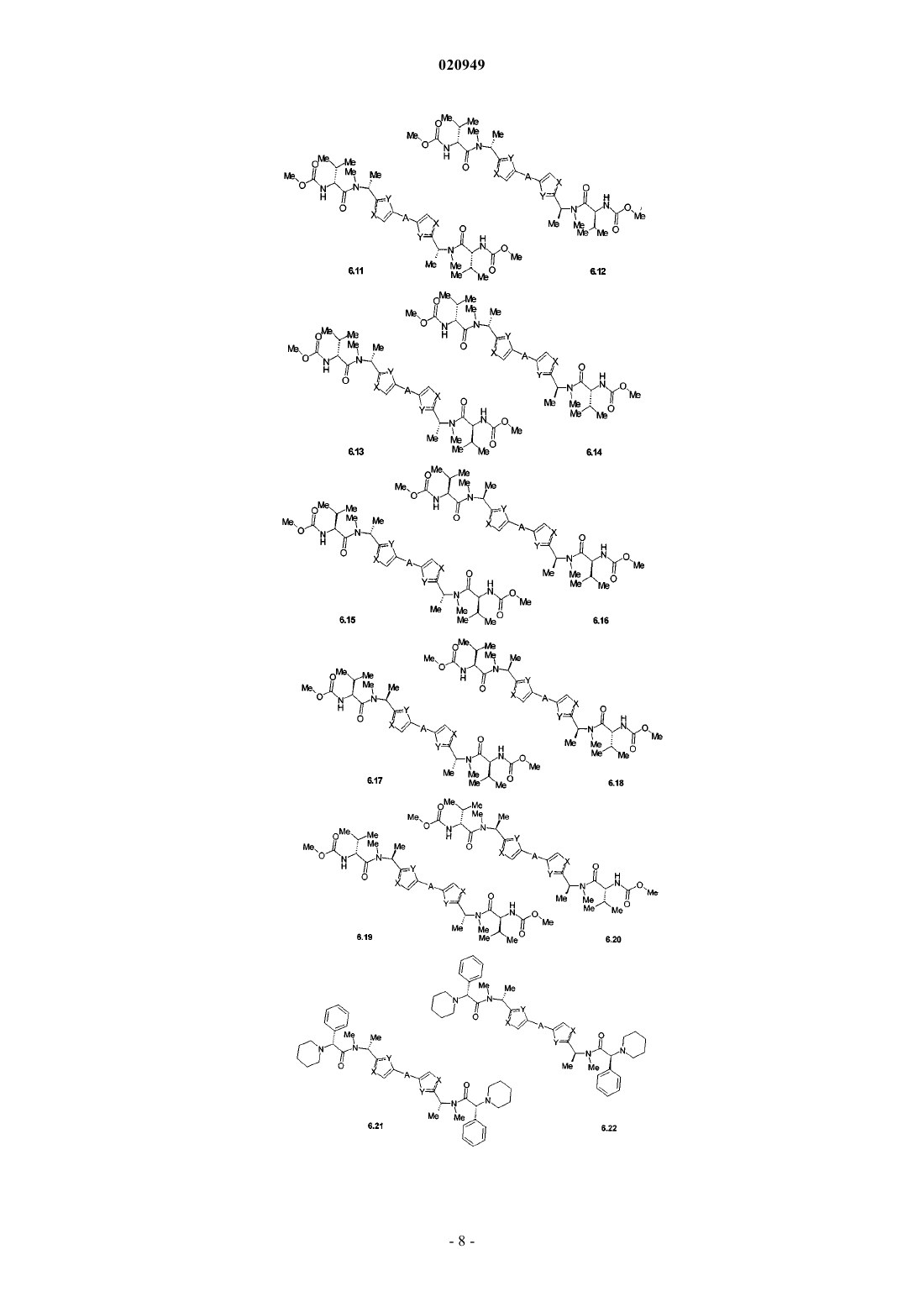
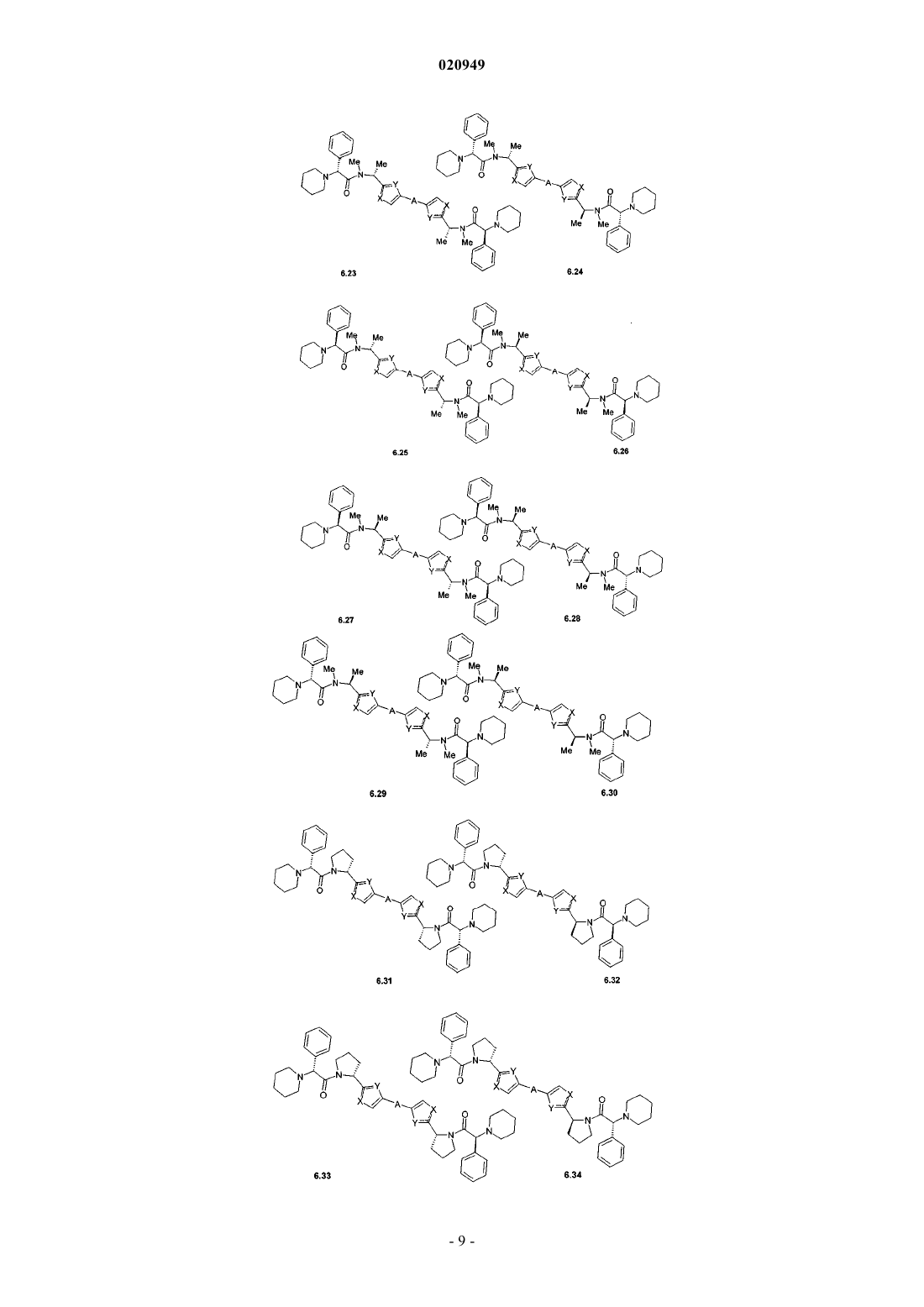
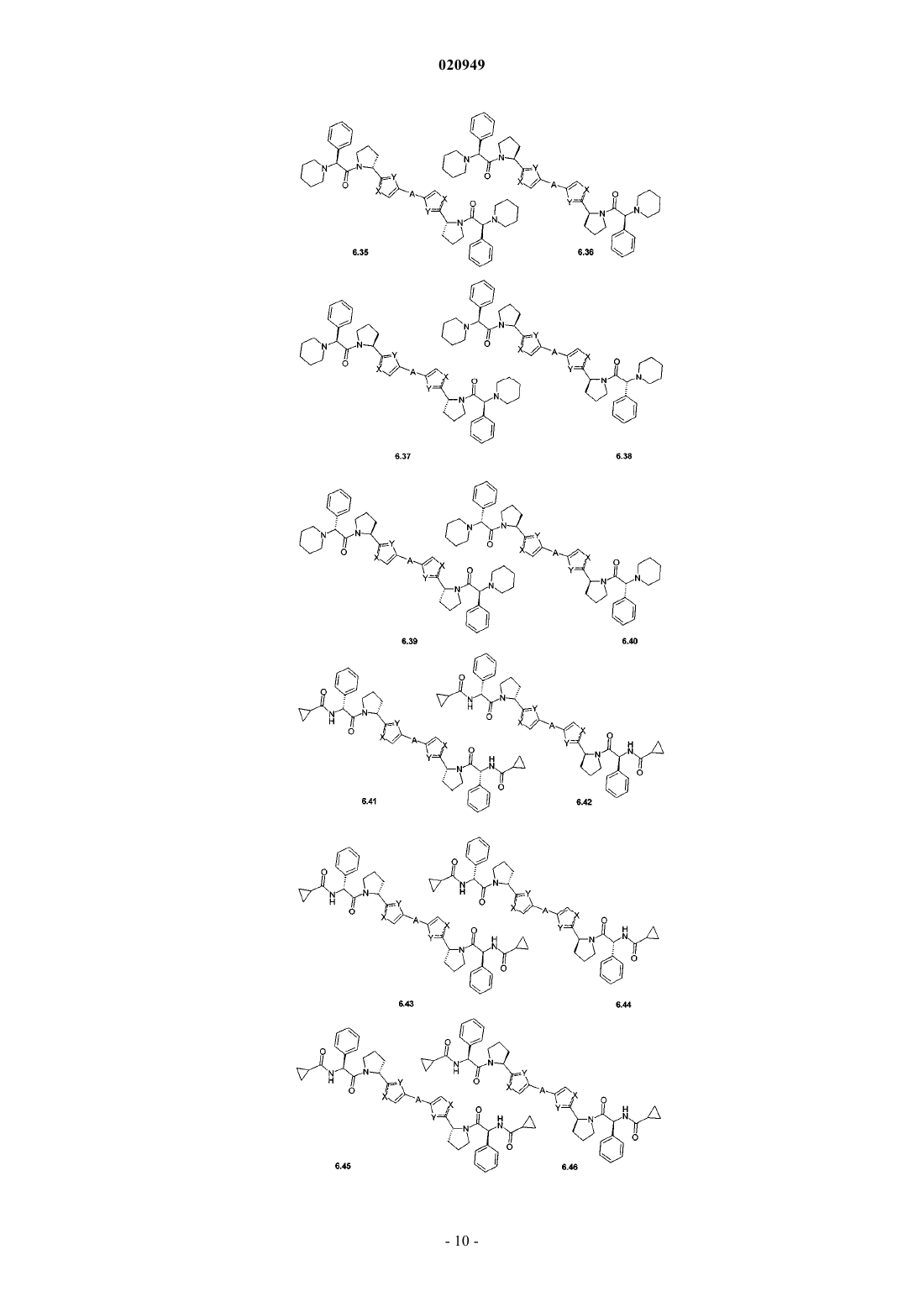
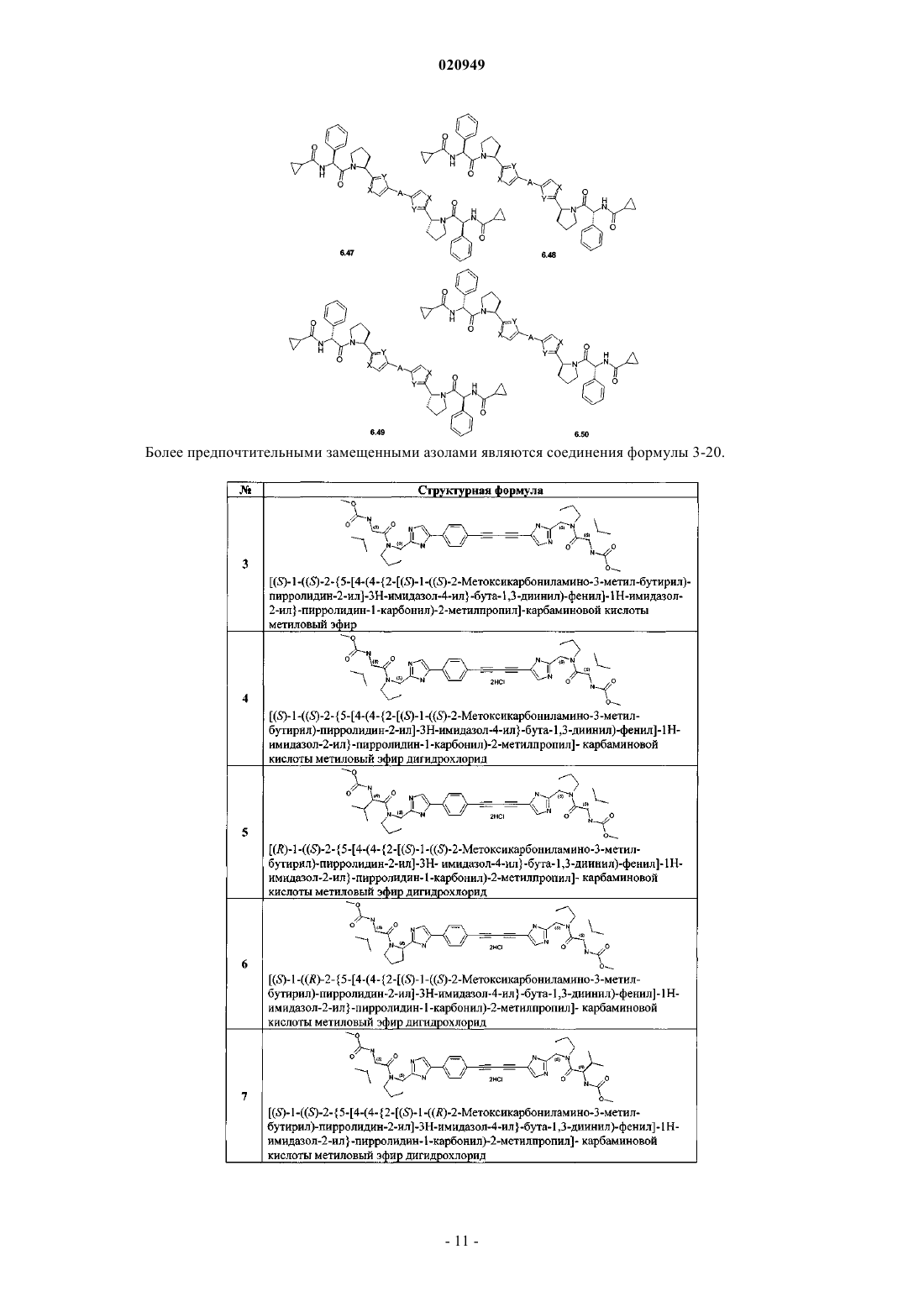
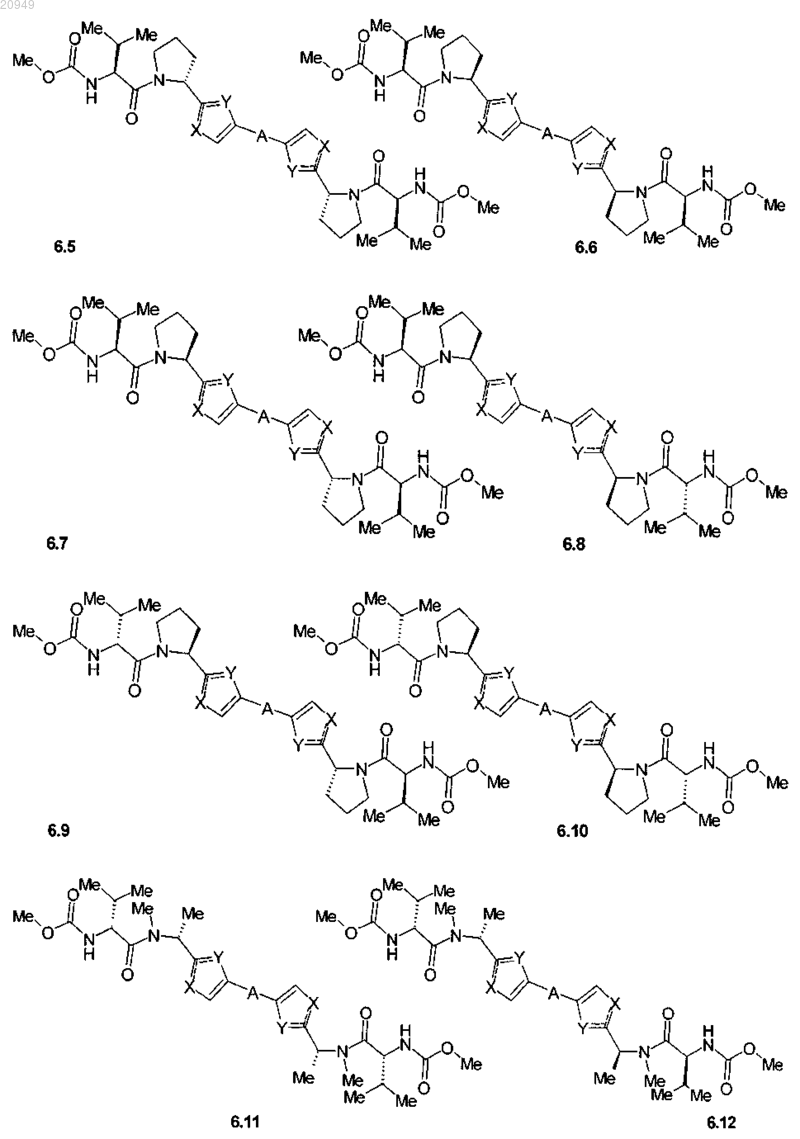
 3. Соединения по п.1, представляющие собой замещенные азолы общей формулы 6.1-6.70, в которых А, X, Y и сплошные линии с сопровождающими их пунктирными линиями
3. Соединения по п.1, представляющие собой замещенные азолы общей формулы 6.1-6.70, в которых А, X, Y и сплошные линии с сопровождающими их пунктирными линиями 
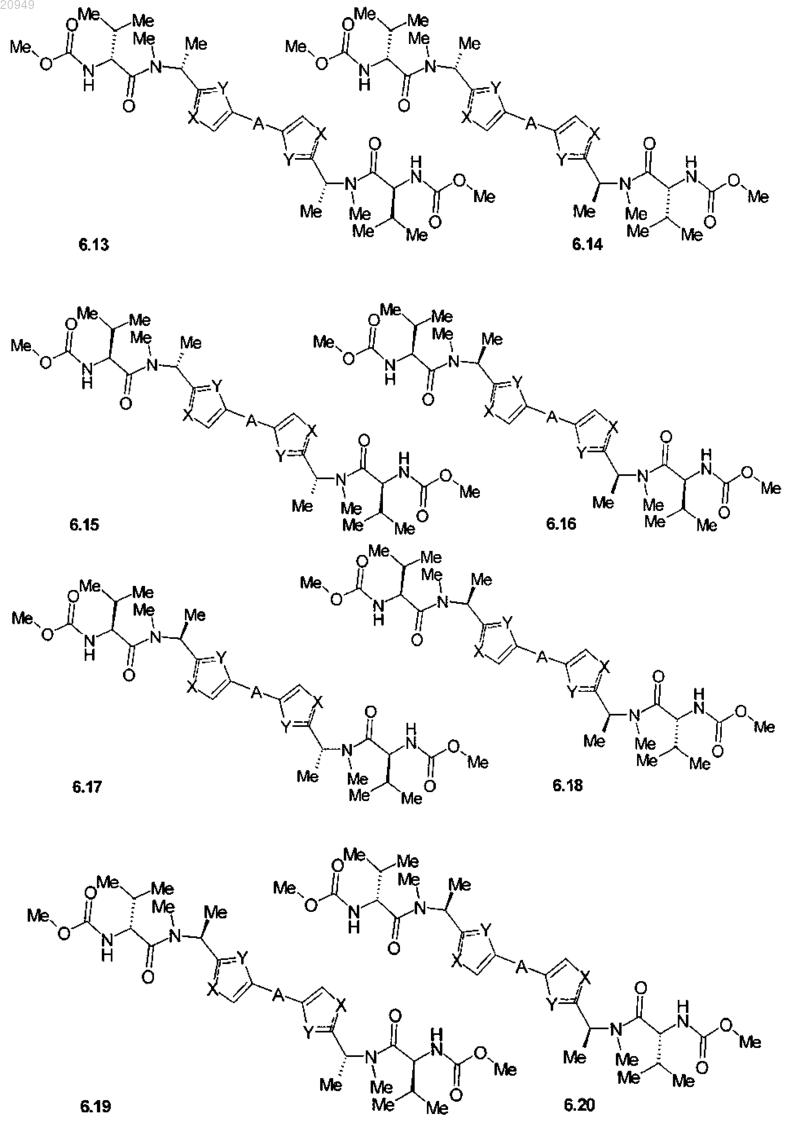
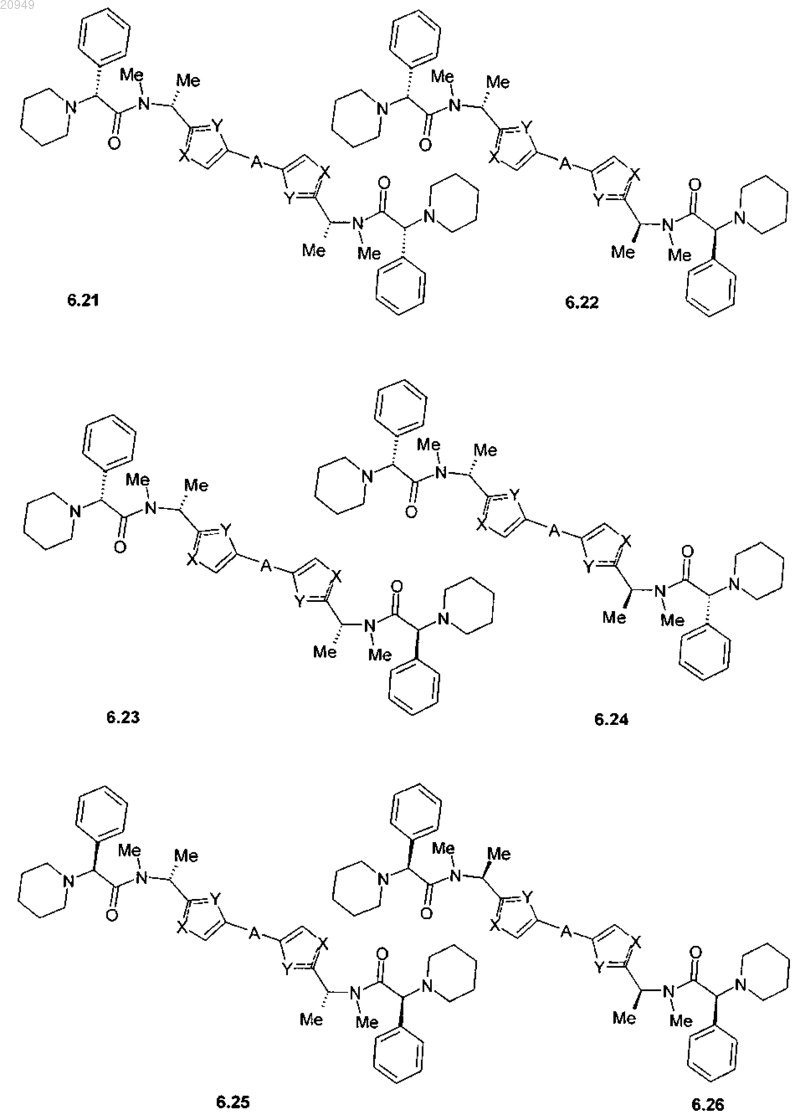

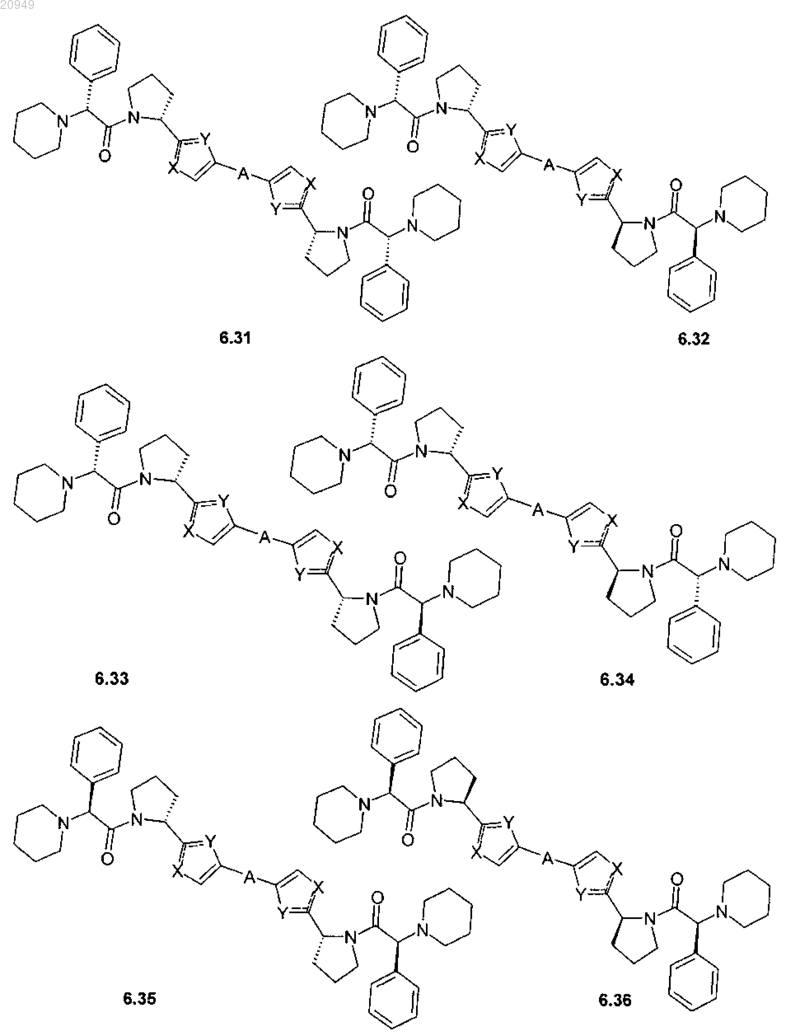

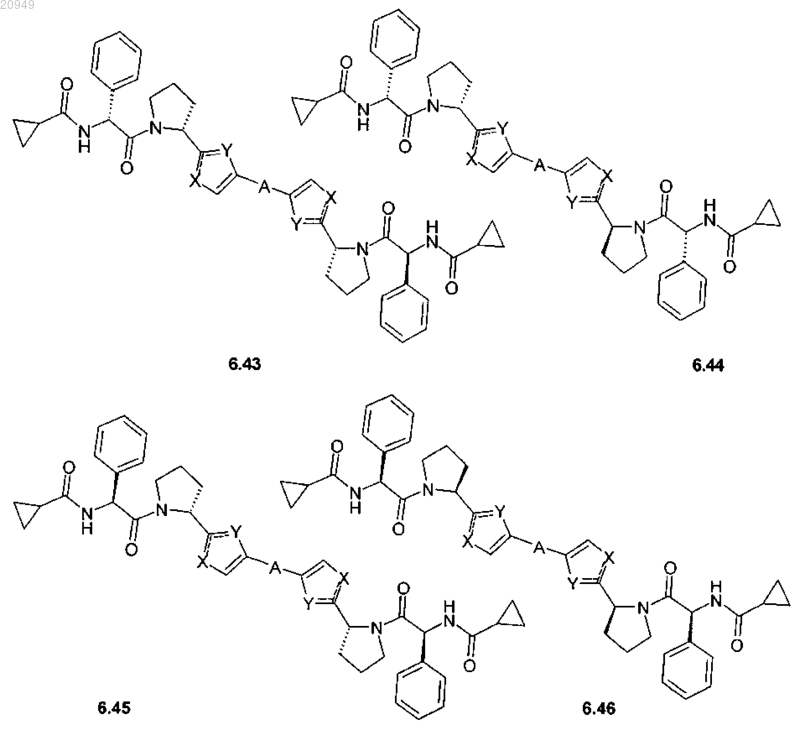
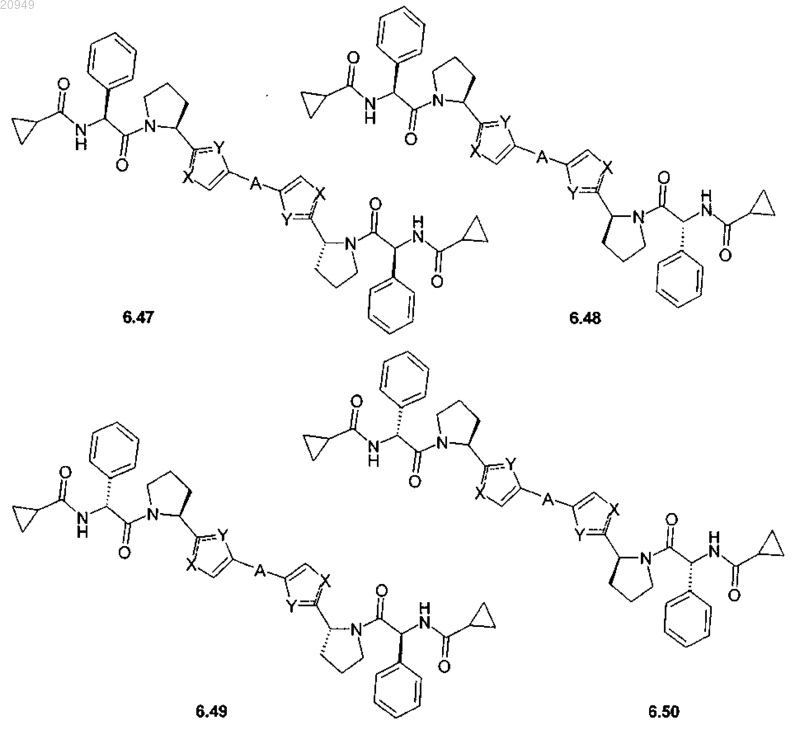
4. Соединение общей формулы 1 по пп.1, представляющие собой замещенные азолы формулы 3-20
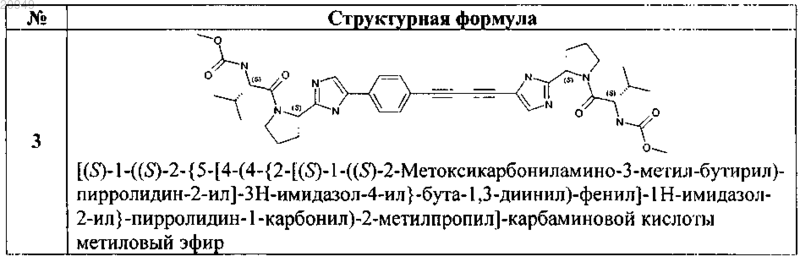
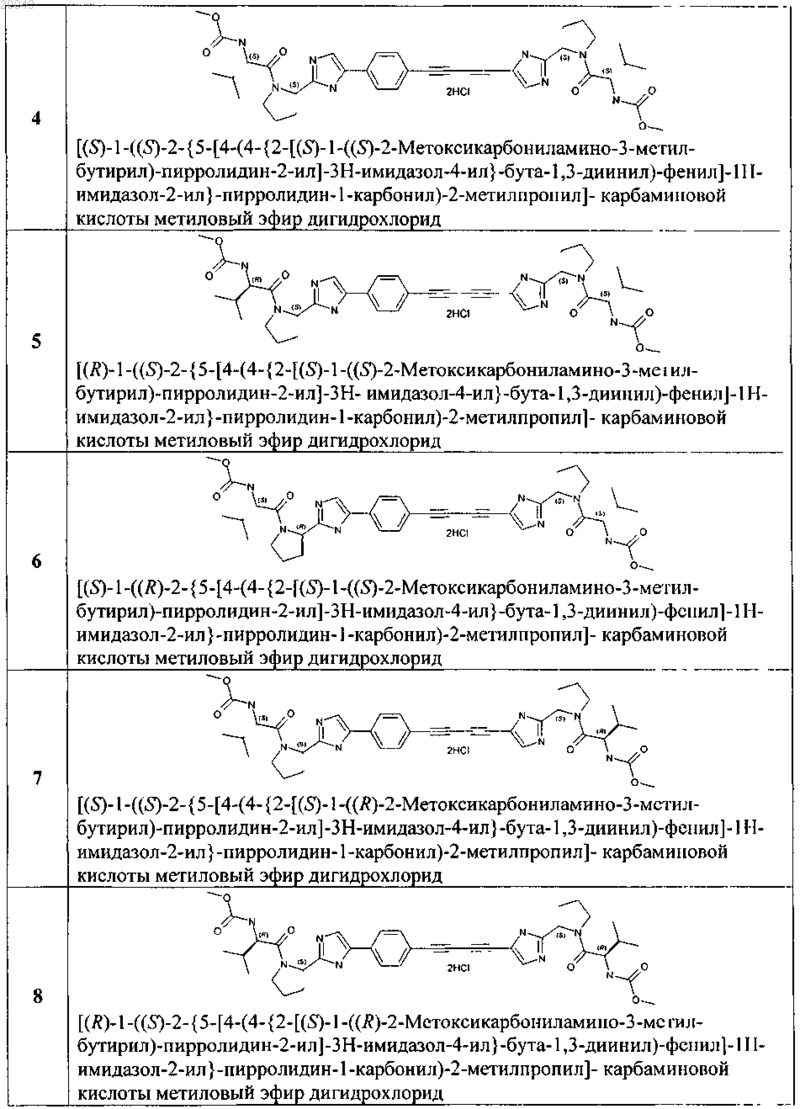
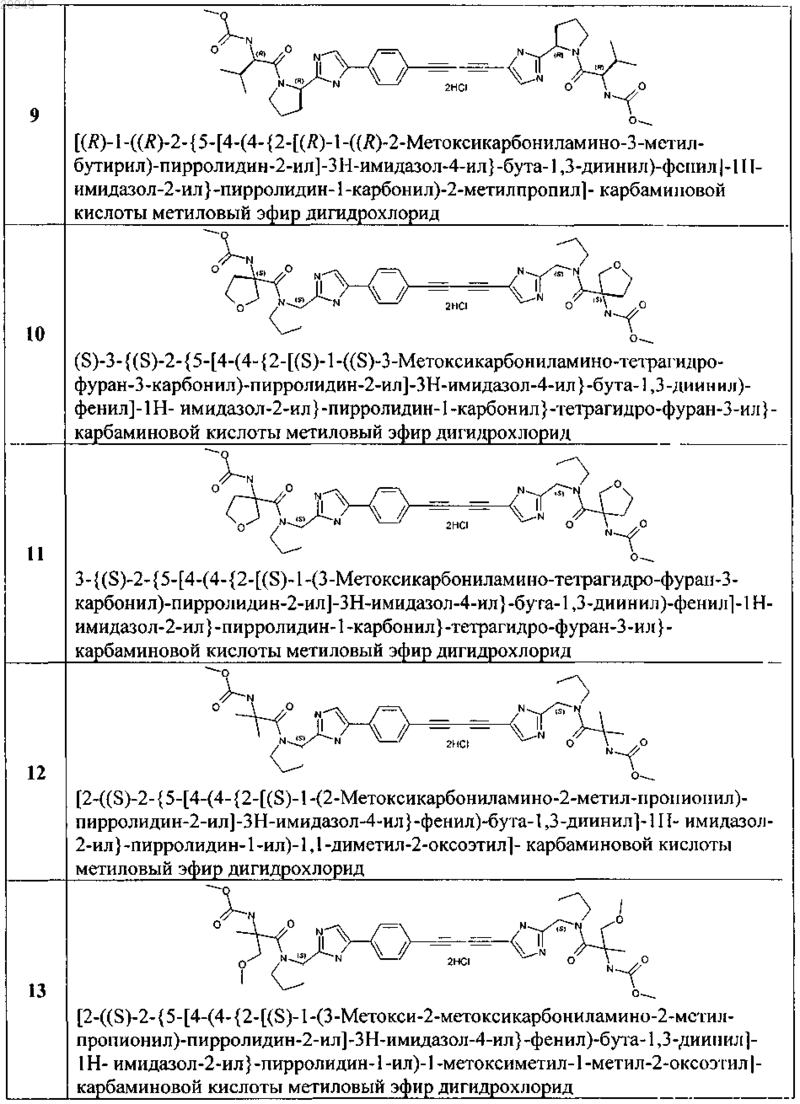
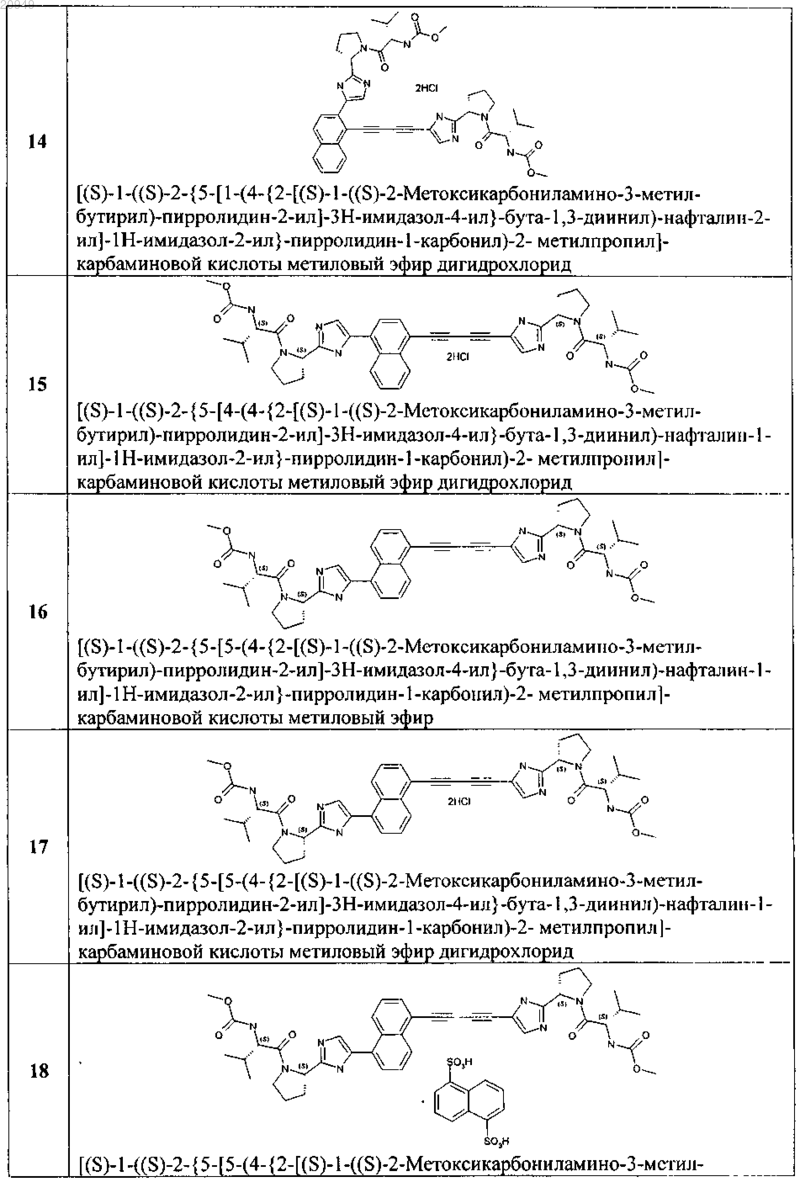
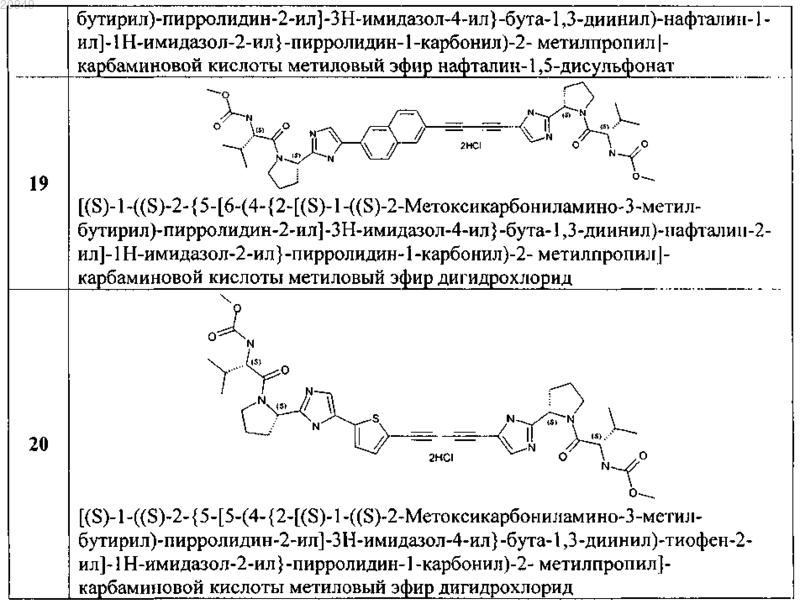
5. Применение соединения общей формулы 1 по любому из пп.1-4 и их фармацевтически приемлемых солей в качестве активного компонента в составе фармацевтических композиций и лекарственных средств, предназначенных для лечения и предупреждения флавивирусных заболеваний, обусловленных вирусом гепатита С, GBV-C, вирусом желтой лихорадки, вирусом West Nile, вирусом Денги (Dengue).
6. Фармацевтическая композиция для лечения и предупреждения заболеваний, обусловленных вирусом гепатита С, вирусом гепатита GBV-C, вирусом желтой лихорадки, вирусом West Nile, вирусом Денги (Dengue), содержащая активный компонент по п.5 в фармацевтически эффективном количестве.
7. Фармацевтическая композиция по п.6 в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
8. Способ получения фармацевтической композиции смешиванием по крайней мере одного активного компонента общей формулы 1 или его фармацевтически приемлемой соли с инертным наполнителем и/или растворителем.
9. Способ лечения флавивирусных заболеваний, обусловленных вирусом гепатита С, вирусом гепатита GBV-C, вирусом желтой лихорадки, вирусом West Nile, вирусом Денги (Dengue), путем введения терапевтически эффективного количества соединения по пп.1-4 или фармацевтической композиции по п.6.
10. Лекарственное средство, содержащее соединение общей формулы 1 и его фармацевтически приемлемую соль по пп.1-4 или фармацевтическую композицию по п.6, проявляющее биологическую активность в отношении вирусного белка NS5A.
Текст
Изобретение относится к новым азолам, к новым противовирусным активным компонентам общей формулы 1, фармацевтической композиции, противовирусному лекарственному средству, способу профилактики и лечения вирусных заболеваний, особенно вызываемых вирусами гепатита С(RU), Бычко Вадим Васильевич (US),Митькин Олег Дмитриевич (RU) где сплошные линии с сопровождающими их пунктирными линиями представляют собой одинарную или двойную связь, X и Y принимают разные значения, один из них - азот, а другой - кислород, сера или группа NH; R1 и R2 - необязательно одинаковые радикалы, выбранные из 2-(R)- и (S) замещенных N-ацил производных пирролидинов; N-метил-N-[2-(R) и (S)-замещенных 2,2-дизамещенных ацетамидов; метил[2(R) и (S)-замещенныхметил)амино)-(1-оксобутан-2-ил)-2-(R)-] и (S)-изопропил)карбаматов. А представляет собой алкинилциклоалкильный, алкинилдиоксановый, алкиниларильный,алкилтиофеновый, алкенилтиофеновый и алкинилтиофеновый бирадика.(71)(73) Заявитель и патентовладелец: ИВАЩЕНКО АЛЕКСАНДР ВАСИЛЬЕВИЧ (RU) Изобретение относится к новым азолам, к новому противовирусному активному компоненту, фармацевтической композиции, противовирусному лекарственному средству, способу профилактики и лечения вирусных заболеваний, особенно вызываемых вирусами гепатита С (HCV). Вирусные инфекции могут вызывать множество заболеваний, что создает серьезную угрозу для здоровья и жизни человечества. За последние 20 лет обнаружено не менее 30 совершенно новых возбудителей инфекционных болезней: СПИДа, вирусных гепатитов, острых и хронических диарей, геморрагических лихорадок (Эбола, венесуэльской, бразильской, долины Рифт) [a) Lednicky J.A., Rayner J.O. Uncommon respiratory pathogens. Curr. Opin. Pulm. Med. 2006, 12(3), 235-239. b) Hayden F.G. Respiratory viralthreats. Curr. Opin. Infect. Dis. 2006, 19(2), 169-178]. В частности, особую тревогу вызывает возможность заболевания человека так называемым "птичьим гриппом" [a) Liu J.P. Avian influenzaa pandemic waitingCytotoxic therapy for severe avian influenza A (H5N1) infection. Lancet. 2006 367(9513), 870-873. Review]. Согласно статистическим данным, 60-65% эпидемических инфекций имеют вирусную этиологию. Из-за сложности взаимодействия в триаде "вирус - организм хозяина - лекарство", большинство современных противовирусных препаратов в процессе терапии проявляют побочные эффекты и формируют резистентные вирусные штаммы [Jain R., Clark N.M., Diaz-Linares M., Grim S.A. Limitations of current antiretroviral agents and opportunities for development. Curr. Pharm. Des. 2006, 12(9), 1065-1074.]. В настоящее время количество противовирусных лекарственных препаратов, которые могут быть использованы в клинической практике, чрезвычайно ограничено - всего 43 низкомолекулярных вещества[http://integrity.prous.com/integrity], что далеко не удовлетворяет потребностям профилактики и лечения вирусных заболеваний. Кроме того, существует значительное число вирусных инфекций, вызывающих заболевания, для лечения которых в настоящее время не существует химиотерапевтических средств. Это относится, например, к заболеваниям, вызываемым вирусами папилломы, аденовирусам, герпеса-6, оспы, синдрома SARS, геморрагических лихорадок, лихорадки Западного Нила, птичьего гриппа и т.д. [DeClercq E. Recent highlights in the development of new antiviral drugs. Curr Opin Microbiol. 2005, 8(5), 552560]. Вирус гепатита С относится к флавивирусам (genus Flaviviridae), наряду с другими важными патогенами человека, такими как вирус желтой лихорадки, вирус West Nile, вирус Денги (Dengue) и вирус гепатита GBV-C). Флавивирусы обладают сходной организацией генома, в том числе наличием гена, кодирующего неструктурный белок NS5A. NS5A играет важную роль в репликации вирусного РНКгенома, являясь структурным компонентом вирусного репликационного комплекса. Поскольку данный белок в настоящее время валидирован в клинических испытаниях как мишень для разработки лекарственных средств против хронического гепатита С, NS5A представляется перспективной мишенью и для других клинически важных флавивирусов, перечисленных выше. Таким образом, большое значение имеет изыскание новых противофлавовирусных препаратов, в особенности, обладающих высокой активностью и низкой токсичностью. В патентной литературе имеются публикации, посвященные различным производным 2 пирролидин-2-ил-1 Н-имидазолов, которые являются лигандами неструктурного белка NS5A, и подавляют вирус гепатита С (HCV) [WO 2008021927 А 2, WO 2009020825A1, WO 2009020828A1, WO 2010065668A1, WO 2010065681A1, WO 2010096302A1, WO 2010096462A1, WO 2010096777A1, WO 2010111534A1, WO 2010111673Al,WO 2010117635Al, WO 2010117977Al]. Однако поиск новых высокоэффективных противофлавивирусных лекарственных препаратов в настоящее время по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения широкого и разнообразного круга вирусных инфекций, в том числе HCV. В этой связи актуальным является синтез новых соединений и использование их в качестве противовирусных активных компонентов для фармацевтических композиций и лекарственных средств, в том числе HCV. Ниже приведены определения терминов, которые использованы в описании этого изобретения."Алифатический" радикал означает радикал, полученный удалением атома водорода от не ароматической С-Н связи. Алифатический радикл может дополнительно содержать заместители - алифатические или ароматические радикалы, определенные в данном разделе. Представители алифатических радикалов включают алкил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероциклил, гетероцикленил, аралкенил, аралкилоксиалкил, аралкилоксикарбонилалкил, аралкил, аралкинил, аралкилоксиалкенил, гетероаралкенил, гетероаралкил, гетероаралкилоксиалкенил, гетероаралкилоксиалкил, гетероаралкенил, анелированные арилциклоалкил, анелированные гетероарилциклоалкил, анелированные арилциклоалкенил,анелированные гетероарилциклоалкенил, анелированные арилгетероциклил, анелированные гетероарилгетеоциклил, анелированные арилгетероцикленил, анелированные гетероарилгетероцикленил."Алифатический" бирадикал означает бирадикал, полученный удалением атома водорода от С-Н связи алифатического радикала, определение которого дано выше."Алкенил" означает алифатическую линейную или разветвленную углеводородную группу, содержащую от 2 до 7 атомов углерода и включающую по крайней мере одну углерод-углеродную двойную связь. Разветвленная означает, что к линейной алкенильной цепи присоединены один или несколько низших алкильных групп, таких как метил, этил или пропил. Алкильная группа может иметь один или несколько заместителей, например, таких как галоген, алкенилокси, циклоалкил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероаралкилокси, гетероциклил, гетероциклилалкилокси, алкоксикарбонил, аралкоксикарбонил, гетроаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой "заместители аминогруппы", значение которых определено в данном разделе, например, атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетеоцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбнилметил, бензилоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными алкенильными группами являются этенил, пропенил, н-бутенил, изо-бутенил, 3 метилбут-2-енил, н-пентенил, и циклогексилбутенил."Алкенилокси" означает алкенил-О-группу, в которой алкенил определен в данном разделе. Предпочтительным алкенилоксигруппами являются аллилокси и 3-бутенилокси."Алкил" означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько "низших алкильных" заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей ("алкильных заместителей") включая галоген, алкенилокси, циклоалкил, арил, гетероарил,гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси,аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-,RkaRk+1aNC(=O)-, RkaRk+1aNC(=S)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой "заместители амино группы", значение которых определено в данном разделе, например, атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетеоцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными "алкильными заместителями" являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси,алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил."Алкинил" означает алифатическую линейную или разветвленную углеводородную группу, содержащую от 2 до 12 атомов углерода и включающую по крайней мере одну углерод-углеродную тройную связь. Разветвленная означает, что к линейной алкинильной цепи присоединены один или несколько низших алкильных групп, таких как метил, этил или пропил. Алкильная группа может иметь один или несколько заместителей, например, таких как галоген, алкенилокси, циклоалкил, циано, гидрокси, алкокси,алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероаралкилокси, гетероциклил, гетероциклилалкилокси, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-,RkaRk+1aNC(=O)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой "заместители амино группы", значение которых определено в данном разделе, например, атом водорода, алкил,арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил,этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, бензилоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными алкенильными группами являются этенил, пропенил, н-бутенил, изо-бутенил, 3-метилбут-2-енил, нпентенил, бута-1,3-диин и гекса-1,3,5-триин."Алкокси" означает алкил-О- группу, в которой алкил определен в данном разделе. Предпочтительным алкилокси группами являются метокси, этокси, н-пропокси, изопропокси и н-бутокси."Алкилоксиалкил" означает алкил-О-алкил группу, в которой алкильные группы независимы друг от друга и определены в данном разделе."Алкилоксиалкиленоксиалкил" означает алкил-O-(CHR)n-O-алкил группу, в которой R представляет собой атом водорода или алкил, а n2, предпочтительно 2, 3 или 4."Алкилтиа" означает алкил-S группу, в которой алкил группа определена в данном разделе."Алкилтиаалкил" означает алкил-S-алкил группу, в которой алкильные группы независимы друг от друга и определены в данном разделе."Арил" означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимуществено от 6 до 10 атомов углерода. Арил может содержать один или более "заместителей циклической системы", которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть анелирован с неароматической циклической системой или гетероциклом."Арилокси" означает арил-О-группу, в которой значение арил определено в данном разделе. Представителями арилокси групп являются фенокси и 2-нафтилокси. "Арилтио" означает арил-S-группу, в которой значение арил определено в данном разделе. Представителями арилтиогрупп являются фенилтио и 2-нафтилтио."Бирадикал" означает радикал, полученный удалением двух атомов водорода из двух С-Н связей молекулы."Активный компонент" (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства)."Лекарственное средство (препарат)" - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего."Низший алкил" означает линейный или разветвленный алкил с 1-4 атомами углерода."Терапевтический коктейль" представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания."Фармацевтическая композиция" обозначает композицию, включающую в себя соединение формулы 1 и по крайней мере один из компонентов, выбранных из группы, состоящей из фармацевтически приемлимых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей,вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты,загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза,метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол,полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения."Фармацевтически приемлемая соль" означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты,нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты,пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин,трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как, холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин,орнитин и аргинин. Предметом данного изобретения являются новые замещенные азолы общей формулы 1 и их фармацевтически приемлемые соли, где сплошные линии с сопровождающими их пунктирными линиями представляют собой одинарную или двойную связь, причем если одна из них одинарная связь, то другая двойная связь;X и Y необязательно принимают разные значения и представляют собой атом азота, кислорода, серы или группу NH;R1 и R2 представляют собой необязательно одинаковые радикалы 2.1-2.20, в которых звездочкойуказано место присоединения к азольным фрагментам; А представляет собой алкинилциклоалкильный, алкинилдиоксановый, алкиниларильный, алкилтиофеновый, алкенилтиофеновый и алкинилтиофеновый бирадикал, выбранный из бирадикалов формул 3.72-3.129, в которых звездочкойуказаны места присоединения азольных фрагментов; Более предпочтительными замещенными азолами являются соединения общей формулы 5.1 - 5.46,в которых X, Y, R1, R2 и сплошные линии с сопровождающими их пунктирными линиями имеют вышеуказанное значение. Более предпочтительными замещенными азолами являются соединения общей формулы 6.1-6.50, в которых А, X, Y, и сплошные линии с сопровождающими их пунктирными линиями указанное значение. Более предпочтительными замещенными азолами являются соединения формулы 3-20. Замещенные азолы общей формулы 1 по данному изобретению были получены с использованием известных химических реакций и коммерческих реагентов. Строение полученных соединений подтверждено данными LCMS и ЯМР спектроскопии. Соединения названы с использованием Chem Draw(Chembridge Soft Inc.) программы. В схемах использованы следующие сокращения: DIPEA - диизопропилэтиламин, EDAC - N-(3 диметиламинопропил)-N'-этилкарбодиимид гидрохлорид, HOBt - 1-гидроксибензотриазол, N-Boc-L-ProOH - N-(трет-бутоксикарбонил)-L-пролин, N-Moc-L-Val-OH = N-(метоксикарбонил)-L-валин, RP HPLC Обращенно-фазная высокоэффективная жидкостная хроматография, ВЭЖХ - Высокоэффективная жидкостная хроматография, ДСМ = DCM - дихлорметан, DMF - N,N-диметилформамид, PdC12dppf - [1,1'Бис(дифенилфосфино)ферроцен]дихлорпалладий(II),TBTUO-(Бензотриазол-1-ил)-N,N,N',N'тетраметилуроний тетрафторборат, DBU - 1,8-Диазабицикло[5.4.0]ундец-7-ен, ВГС - вирус гепатита С,ДМЕМ (DMEM) - Dulbecco's Modified Eagle Medium - Питательная среда ДМЕМ. Так, метиловый эфир [(lS)-l-(2S)-2-[5-[4-[4-[2-[(2S)-l-[(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]-2-пирролидинил]-1H-имидазол-5-ил]-1,3-бутадиинил]фенил]-1H-имидазол-2-ил]-1 пирролидинил]карбонил]-2-метилпропил]карбаминовой кислоты 4 получают по нижеследующей схеме: Метиловый эфир [(S)-1-S)-2-5-[5-(4-2-[(S)-1-S)-2-метоксикарбониламино-3-метилбутирол) пирролидин-2-ил]-3 Н-имидазол-4-илфенилэтинил)тиофен-2-ил]-1 Н-имидазол-2-ил-пирролидин-1 карбонил)-2-метилпропил]карбаминовой кислоты 25 получен по нижеследующей схеме: Биологическая активность азолов общей формулы 1. Противовирусную активность замещенных азолов общей формулы 1 определяли в клеточной линии гепатомы человека Huh7, содержащей субгеномный РНК-репликон ВГС (генотип 1b, клон Conl). В качестве экспериментальной методики был использован вариант иммунного теста ИФА на вирусный белокNS5A в 96-луночном формате. Цитотоксичность соединений оценивали в параллельном режиме. Клетки Huh7 высевались в 96-луночные планшеты (7.5103 клеток на лунку в 100 мкл питательной среды). Растворы тестируемых соединений в среде ДМЕМ DMEM) 1X; Источник: Cellgro; Каталог: 10013-CV готовились непосредственно перед использованием. Всего готовилось одиннадцать серийных трехкратных разведений с концентрацией от 20 нМ до 0,2 пМ. Через 4 ч после высевания клеток, серийные разведения препаратов добавлялись к клеткам (100 мкл на лунку). Конечная концентрация тестируемых соединений составляла от 10 нМ до 0,1 пМ, а ДМСО - 0,5%. При необходимости исследовались более высокие концентрации заявляемых азолов. Каждое разведение препарата тестировалось на двух идентичных лунках. Далее клетки инкубировали в течение трех дней при 37 С/5% СО 2. Клетки фиксировали добавлением 250 мкл/лунку смеси ацетон/метанол (1:1). Через 1 мин клетки трижды промывали раствором PBS (Phosphate Buffered Saline). После этого клетки блокировали добавлением 150 мкл/лунку 10% фетальной телячьей сыворотки в растворе PBS на 1 ч при комнатной температуре. Далее, клетки инкубировали с мышиными моноклональными антителами к кор-антигену ВГС, клон С 7-50 (Источник:Affinity BioReagents; Каталог: MA1-080) (100 мкл/лунку, рабочее разведение - 1:500 в 10% фетальной телячьей сыворотке в растворе PBS) в течение двух часов при 37 С. Клетки промывали 6 раз растворомPBS/0.05% Твин 20, после чего инкубировали в течение 1 часа с антителами козы к иммуноглобулинам мыши (конъюгированными с пероксидазой хрена, 100 мкл/лунку, рабочее разведение - 1:2500 в 10% фетальной телячьей сыворотке в растворе PBS). Клетки промывали 6 раз раствором PBS/0.05% Твин 20,один раз раствором PBS, после чего добавляли 100 мкл/лунку субстрата (1 таблетка ОПД + 12 мл цитрат/фосфатного буфера + 5 мкл 30% Н 2 О 2). Планшеты выдерживали 30 мин в темноте при комнатной температуре. Реакцию останавливали добавлением 100 мкл/лунку 2N H2SO2, и измеряли оптическую плотность (длина волны 490 нм) при помощи многоканального спектрофотометра Victor3 V 1420 (PerkinElmer). Значения ИК 50 (концентрация азола, понижающая уровень вирусного РНК-репликона на 50% ) для каждого тестируемого азола рассчитывали при помощи программы XLfit 4. Цитотоксичность тестируемых азолов изучалась в опытах на культуре линии клеток гепатомы человека Huh7. Количество живых клеток определяли при помощи набора ATPLite (Perkin Elmer, Бостон,США) в соответствии с инструкциями производителя. Цитотоксическое действие оценивали, высеивая клетки в черной микроплате с прозрачным дном (96 ячеек, 104 клеток на лунку). Для каждого бис-азола использовали три независимых повтора. Тестируемые бис-азолы добавляли через 18 часов, после чего клетки инкубировали с веществами в течение 96 ч. Промывали дважды каждую лунку фосфатносолевым буфером (0,2 мл/лун) и затем лизировали клетки добавлением клеточного буфера (50 мкл/лун)(все указанные реактивы входят в комплект набора ATPLite). Микроплату инкубировали в течение 5 минут на вращающейся платформе при 600 об/мин, после чего добавляли в каждую лунку 50 мкл раствора субстрата (часть набора ATPLite). Инкубировали еще 5 минут на вращающейся платформе при 600 об/мин, выдерживали 10 мин в темноте и затем измеряли люминесценцию на приборе TopCount NXT(Packard, Perkin Elmer). В качестве количественного параметра для оценки цитотоксичности использовали величину ИК 50,которая соответствует концентрации бис-азола, при которой погибает 50% клеток. Расчет параметра ИК 50: для расчета эффективности ингибирования (% Инг) использовали формулу: где ЛП 03 - положительный контроль, люминесценция в ячейках с клетками без вещества; Лотр отрицательный контроль, люминесценция в ячейках со средой без клеток; Лэкс - люминесценция в ячейках с веществом в определенной концентрации. Значения ЦК 50 затем расчитывали при помощи программы XLfit 4. Результаты испытаний новых азолов общей формулы 1 свидетельствуют об их высокой (наномолярной) или очень высокой (пикомолярной) активности. Ингибирующая активность по отношению к генотипу gT1b, gTla и gT2a HCV новых азолов общей формулы 1 представлена в представленной ниже таблице и обозначена, как:1000 нМ,от 999 нМ до 10 нМ,от 9.9 нМ до 1 нМ и 1 нМ. Предметом данного изобретения является активный компонент для фармацевтических композиций и лекарственных средств, предназначенный для лечения и предупреждения флававирусных (genus Flaviviridae) заболеваний, обусловленных вирусом гепатита С, вирусом гепатита GBV-C, вирусом желтой лихорадки, вирусом West Nile, вирусом Денги (Dengue), представляющий собой замещенные азолы общей формулы 1 и их фармацевтически приемлемые соли. Предметом данного изобретения является фармацевтическая композиция, содержащая в качестве активного компонента фармацевтически эффективное количество замещенного азола общей формулы 1 и их фармацевтически приемлемые соли. Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с активным компонентом общей формулы 1 по настоящему изобретению может включать и другие активные ингредиенты, при условии, что они не вызывают нежелательных эффектов, например, аллергических реакций. При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие как, таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как, растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как, мази или растворы). Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты,дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы,стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты. Предметом настоящего изобретения является также способ получения фармацевтической композиции, который заключается в смешении, по крайней мере, одного активного компонента общей формулы 1 или его фармацевтически приемлемой соли с инертным наполнителем и/или растворителем. Предметом данного изобретения является также фармацевтическая композиция в форме таблеток,капсул или инъекций, помещенных в фармацевтически приемлемую упаковку. Предметом настоящего изобретения также является способ лечения флававирусных заболеваний,обусловленных вирусом гепатита С, вирусом гепатита GBV-C, вирусом желтой лихорадки, вирусом WestNile, вирусом Денги (Dengue), путем введения фармакологически эффективного количества замещенного азола общей формулы 1 или его фармацевтически приемлемой соли, или новой фармацевтической композиции. Клиническая дозировка фармацевтической композиции, содержащей в качестве активного компонента азол общей формулы 1, у пациентов может корректироваться в зависимости от: терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10500 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10500 мг азола общей формулы 1. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно от одного до шести раз). Для комбинированной терапии любые классы агентов, которые могут оказаться полезными, будучи объединены с замещенными азолами настоящего изобретения, могут подразумевать, например, нуклеозидные и не-нуклеозидные ингибиторы HCV полимеразы, ингибиторы протеазы, ингибиторы геликазы,NS4B ингибиторы и медицинские агенты, которые функционально ингибируют внутренний рибосомный сайт вхождения (IRES) и другие медикаменты, которые ингибируют прикрепление или вхождение вируса в клетки, транскрибирование HCV RNA, реплакацию, созревание или ослабление вируса. Специфические соединения в этих классах и полезные в этом изобретении включают, но не ограничивают макроциклические, гетероциклические и линейные ингибиторы протеазы HCV, такие как telaprevir (VX-950),boceprevir (SCH-503034), narlaprevir (SCH-900518), ITMN-191 (R-7227), TMC-435350 (a.k.a. TMC-435),MK-7009, BI-201335, BI-2061 (ciluprevir), BMS-650032, ACH-1625, ACH-1095 (HCV NS4A ингибитор сопутствующего фактора протеазы) VX-500, VX-813, PHX-1766, PHX2054, IDX-136, IDX-316, ABT-450.EP-013420 (и родственные) и VBY-376; ингибиторы нуклеозидной HCV полимеразы (репликазы), полезные в данном изобретении, включают, но не ограничены следующим: R7128, PSI-7851, IDX-184, IDX102, R1479, UNX-08189, PSI-6130, PSI-938 и PSI-879 и различные другие нуклеозиды и нуклеотидные аналоги и HCV ингибиторы, включающие (но не ограничивающие) происходящие от 2'-С-метил модифицированные нуклеозиды и нуклеотиды; и 7'-деаза модифицированные нуклеозиды и нуклеотиды. Ин- 16020949 гибиторы не-нуклеозидной HCV полимеразы (репликазы), полезные в данном изобретении, включают,но не ограничены: HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК-3281, АВТ-333,АВТ-072, PF-00868554, BI-207127, GS-9190, A-837093, JKT-109, GL-59728 и GL-60667. Кроме того, ингибиторы NS5A настоящего изобретения могут быть использованы в комбинации с антагонистами циклофиллина и имунофиллина (например, без ограничений DEBIO соединения, NM-811,а также циклоспорин и его производные), ингибиторами киназ, ингибиторами протеинов теплового шока(напр. HSP90, HSP70), другими иммуномодуляторными агентами, которые могут включать без ограничения интерфероны (альфа-, бета-, омега-, гамма-, lambda или синтетические), такие как Intron A, Roferon- А, Canferon-А 300 Advaferon, Infergen, Humoferon, Sumiferon MP, Alfaferon, IFN-,Feron, и подобные, интерфероновые соединения, дериватизированные полиэтиленгликолем (pegylated),такие как: PEG interferon2a (Pegasys), PEG interferon2b (PEGIntron, pegylated IFN- -con 1 и подобные; пролонгированные формулы и производные интерфероновых соединений, такие как альбумин-конденсированный интерферон, Albuferon, Locteron и подобные; интерфероны с различными типами контролируемой доставки (напр, ITCA-638, омега-интерферон, доставляемый DUROS подкожной системой доставки); соединения, которые стимулируют синтез интерферона в клетках, такие какresiquimod и подобные; интерлейкины; соединения, которые улучшают развитие отклика клетки type 1(action), isotorabine, ANA773 и подобные; thymosin -1, ANA-245 и ANA-246, гистамин дигидрохлорид,propagermanium; tetrachlorodecaoxide; ampligen; IMP-321; KRN-7000; антитела, такие как: civacir, XTL6865 и подобные и профилактические и терапевтические вакцины такие как: Inno Vac, HCV E1E2/MF59 и подобные. В добавление, любой из вышеописанных методов, включающий введение NS5A ингибитора, агонист рецептора интерферона типа I (напр. IFN-) и агонист рецептора интерферона типа II (напр.IFN- ) может быть усилен введением эффективного количества TNF-антагониста. Типичные неограничивающие TNF- антагонисты, которые подходят для использования в такой комбинированной терапии - ENBRELи HUMIRA . В дополнение, NS5A ингибиторы настоящего изобретения могут быть использованы в комбинации с антипротозоанами, а другие антивирусы считаются эффективными при лечении HCV инфекции такие как: пролекарство nitazoxanide. Nitazoxanide может быть использован как агент в комбинации с соединениями, раскрытыми в этом изобретении, а также в комбинации с другими агентами, полезными при лечении HCV инфекции, такими как: peginterferon alfa-2a и ribavarin (напр. Rossignol, JF и Keeffe, ЕВ, Future Microbiol. 3:539-545, 2008).NS5A ингибиторы настоящего изобретения могут быть также использованы с альтернативными формами интерферонов и пегилированных интерферонов, ribavirin или его аналогами (напр. Tarabavarin,levovirion), microRNA, мало вредными RNA соединениями (напр. SIRPLEX-140-N и подобные), аналогами нуклеотидов или нуклеозидов, иммуноглобулинами, гепатопротекторами, противовоспалительными агентами и другими ингибиторами NS5A. Ингибиторы других мишеней в жизненном цикле HCV включают ингибиторы NS3 геликазы; ингибиторы NS4A ко-фактора, ингибиторы антисмысловых олигонуклеотидов такие как: ISIS-14803, AVI-4065 и подобные; вектор-зашифрованную короткую "шпильку"RNA (shRNA); HCV специфические рибозимы такие как: heptazyme, RPI, 139199 и подобные; ингибиторы вхождения такие как: НереХ-С, HuMax-НерС и подобные; ингибиторы альфа-глюкозидазы такие как:celgosivir, UT-231B и подобные; КРЕ-02003002 и BIVN 401 и IMPDH ингибиторы. Другие показательные соединения - ингибиторы HCV включают ингибиторы, раскрытые в известных научных и патентных публикациях. Дополнительно, комбинации, например, рибавирина и интерферона могут быть введены как комбинированная терапия с, по крайней мере, одним азолом настоящего изобретения. Настоящее изобретение не ограничивается вышеуказанными классами или соединениями и рассматривает известные и новые соединения и комбинации биологически активных агентов. Имеется в виду, что комбинированные терапии настоящего изобретения включают любые химически совместимые комбинации бис-азолов этой патентоспособной группы с другими соединениями патентоспособной группы или другими соединениями вне патентоспособной группы, а также комбинация не исключает антивирусную активность соединения этой патентоспособной группы или антивирусную активность самой фармацевтической композиции. Комбинированная терапия может быть последовательной, т.е. лечение сначала одним агентом, а затем другим (например, когда каждый этап лечения подразумевает другое соединение настоящего изобретения или когда один этап лечения включает соединение настоящего изобретения, а другой подразумевает один или более биологически активных агентов) или может быть лечение с обоими агентами одновременно. Последовательная терапия может подразумевать существенное время после завершения первой стадии терапии до начала второй стадии. Лечение обоими агентами в одно и то же время может осуществляться в одной ежедневной дозе или в разных дозах. Комбинированная терапия не нуждается в ограничении двумя агентами и может включать три или более агентов. Дозы для одновременной и последовательной комбинированной терапии будут зависеть от всасывания, распределения, скоростей обмена веществ и выведения компонентов комбинированной терапии, а также других факторов, хорошо известных специалисту. Размер дозы будет также изменяться в зависимости от тяжести состояния, которое нужно облегчить. Для каждого особого пациента специфическая схема приема доз и расписание могут быть отрегулированы по времени в соответствии с потребностью индивидуума и профессиональным суждением лица, которое лечит или наблюдает за лечением методом комбинированной терапии. Несмотря на то, что вышеприведенное изобретение было описано в некоторых деталях с помощью иллюстраций и примеров с целью облегчить понимание, для специалиста в этой области совершенно очевидно, что с учетом этого изобретения возможны некоторые изменения и модификации, не отклоняясь от духа и объема изобретения, как определено в приложенной формуле изобретения. Представленные ниже примеры иллюстрируют, но не ограничивают изобретение. Пример 1. Метиловый эфир [(1S)-1-(2S)-2-[5-[4-[4-[2-[(2S)-1-[(2S)-2-[(метоксикарбонил)амино]-3 метил-1-оксобутил]-2-пирролидинил]-1H-имидазол-5-ил]-1,3-бутадиинил]фенил]-1H-имидазол-2-ил]-1 пирролидинил]карбонил]-2-метилпропил]-карбаминовой кислоты 4. К раствору 8,15 г (42 ммоль) 1,4-бис-(триметилсилил)-1,3-бутадиина в 50 мл сухого эфира под аргоном добавляют 31 мл (46,5 ммоль) 1,5 М раствора MeLiLiBr в эфире. Смесь перемешивают 6 ч при комнатной температуре. К смеси медленно добавляют 50 мл насыщенного раствора NH4Cl, экстрагируют пентаном, сушат над Na2SO4 и удаляют растворители в слабом вакууме. Жидкий остаток растворяют в 70 мл ТГФ, добавляют 20 мл триэтиламина, 8,8 г (20 ммоль) соединения 14.1, 458 мг (0,5 ммоль) Pd2(dba)3,524 мг (2 ммоль) трифенилфосфина, 190 мг (1 ммоль) Cul и смесь перемешивают под аргоном 12 ч при 40 С. Смесь фильтруют через целит, наносят на силикагель и выделяют соединение 2 флэшхроматографией (элюент CHCl3 : EtOAc = 10:1). Выход 7,56 г (87 %). LCMS (М+Н)+ 434. К раствору 7,36 г (17 ммоль) соединения 14.2 в 120 мл ТГФ и 120 мл метанола добавляют 7,04 г (51 ммоль) поташа и смесь перемешивают 2 ч. Растворители удаляют в вакууме, остаток обрабатывают 150 мл ТГФ и фильтруют. К полученному раствору соединения 14.3 добавляют 5,56 г (15,3 ммоль) соединения 13-1 (5-иод-2-[(2S)-1-вос-пирролидин-2-ил]-1 Н-имидазол), 366 мг (0,4 ммоль) Pd2(dba)3, 630 мг (2,4 ммоль) трифенилфосфина, 152 мг (0,8 ммоль) Cul и смесь перемешивают под аргоном 12 ч при 40 С. Смесь фильтруют через целит, наносят на силикагель и отделяют соединение 14.4 от основной части примесей флэш-хроматографией (элюент CHCl3 : МеОН = 80:1). После упаривания растворителя остаток обрабатывают 60 мл ацетонитрила, выдерживают в УЗИ-бане до начала кристаллизации и оставляют на 3 часа. Выпавший осадок отфильтровывают, промывают ацетонитрилом, эфиром и высушивают в вакууме. Выход 5,47 г (54 %). LCMS (М+Н)+ 597. К соединению 14.4 (0.695 г) добавляют 15 мл 3 М раствора НСl в диоксане и перемешивают 12 ч. Смесь упаривают в вакууме, получают соединение 14.5 с выходом 55%.LCMS (ESI): LCMS (М+Н)+ 397. 1 Н ЯМР (ДМСО-d6, 400 МГц)2.02 (уш.с, 8 Н), 2.99 (м, 4 Н), 3.40 (уш.с,2 Н), 6.22 (м, 4 Н), 6.75 (с, 1 Н), 7.22 (с, 1 Н), 7.77 (м, 2 Н), 7.83 (д,2 Н). Смесь 50 мг (0.283 ммоль, 2.4 экв.) Nметоксикарбонил-1-валина, 40 мг (0.295 ммоль, 2.5 экв.) 1-гидроксибензотриазола и 53 мг (0.277 ммоль,2.35 экв.) N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида в 1 мл ацетонитрила перемешивают 1 ч, добавляют 64 мг (0.118 ммоль, 1 экв.) соединения 14.5 и 82 мкл (61 мг, 0.472 ммоль, 4 экв.) диизопропилэтиламина. Реакционную массу перемешивают 12 ч при комнатной температуре. Полноту протекания реакции контролируют методом LCMS. После завершения реакции растворитель полностью отгоняют на роторном испарителе, остаток растворяют в дихлорметане. Экстракт промывают 10% раствором карбоната натрия, сушат над Na2SO4 и упаривают на роторном испарителе. Дальнейшую очистку проводят методом ВЭЖХ. Дигидрохлорид 42HCl получают добавлением избытка 3 М раствора HCl в диоксане к раствору основания 4 в CH2Cl2 и высаживанием эфиром. Получают 56 мг (67 %) соединения 42HCl. LCMS (М+1)+ 711. 1 Н ЯМР (ДМСО-d6, 400 МГц)0.87 (т, J1 = 6.50, J2 = 0.93, 6 Н), 0.97 (т, J1 = 6.50, J2 = 0.93, 6 Н), 1.64 (м, 2 Н), 1.84 (м, 2 Н), 1.99 (м, 4 Н), 2.06 (м, 2 Н), 3.56 (м, 2 Н), 3.63 (м, 8 Н), 4.02 (д, J К смеси 348 мг (1 ммоль) соединения 24.3, 295 мг (0.87 ммоль) соединения 25.1 и 17 мг (0.09 ммоль) Cul в 3 мл ДМФА добавляют 0.15 мл (0.87 ммоль) диизопропилэтиламина и 31 мг (0.09 ммоль)Pd(PPh3)Cl2 под аргоном и смесь перемешивают при 80 С в течение 12 ч. По окончании реакции смесь разбавляют хлороформом, промывают водой, сушат над Na2SO4 и упаривают в вакууме. Выделяют продукт 25.2 метотом ВЭЖХ. Выход 173 мг (30%). LCMS (ESI): m/z 655.3 (М+Н)+. Продукт 25.2 дебокируют 3 М раствором HCl в диоксане с количественным выходом с получением соединения 25.3 (LC-MS (ESI):m/z 455.6 (М+Н)+), которое превращают в соединение 25 с выходом 41% по аналогии с превращением соединения 14.5 в соединение 4. LCMS (ESI): m/z 769.7 (М+Н)+. Дигидрохлорид 25 получают добавлением избытка 3 М раствора HCl в диоксане к раствору основания 25 в CH2Cl2 и высаживанием эфиром. 1 Н ЯМР (ДМСО-d6, 400 МГц)15.11 (уш. с, 0.95 Н), 14.69 (уш. с, 1.25 Н), 8.15 (с, 1 Н), 7.93 (д, J = 8.0 Гц, 2 Н),7.87 (уш. с, 1H), 7.71 (д, J = 8.0 Гц, 2 Н), 7.58 (уш. с, 1 Н), 7.45 (д, J = 2.8 Гц, 1 Н), 7.27 (м, 2 Н), 5.16 (т, J= 6.8 Гц, 1 Н), 5.10 (т, J= 6.6 Гц, 1 Н), 4.11 (м, 2 Н), 3.92 (м, 2 Н), 3.83 (м, 2 Н), 3.56 (с, 0.1 Н), 3.54 (с, 5.9 Н), 2.34(м, 2 Н), 2.16 (м, 4 Н), 2.03 (м, 4 Н), 0.90 (м, 1.2 Н), 0.84 (т, J= 7.2 Гц, 5.4 Н), 0.77 (т, J= 7.2 Гц, 5.4 Н). Аналогичным образом, используя соответствующие исходные соединения и подходящие хиральные билдинг-блоки, были получены следующие соединения: Метиловый эфир оксобутил]метиламино]этил]-1H-имидазол-5-ил]-транс-циклогексил]-2-тиенил]-1H-имидазол-2-ил]этил] метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 747. Метиловый эфир [(1S)-1-(1R)-1-[5-[5-[4-[2-[(1R)-1-(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]бицикло[2.2.2]окт-1-ил]-2-тиенил]-1H-имидазол-2-ил] этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 753. Метиловый эфир [(1S)-1-(1R)-1-[5-[4-[2-[2-[(1R)-1-(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,3-диоксан-5-ил]фенил]-1H-имидазол-2-ил]этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 725. Метиловый эфир [(1R)-1-(1S)-1-[5-[6-[5-[2-[(1S)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,3-диоксан-2-ил]-2-нафталенил]-1H-имидазол-2-ил] этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 775. Метиловый эфир [(1R)-1-(1S)-1-[5-[6-[2-[2-[(1S)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,3-диоксан-5-ил]-2-нафталенил]-1H-имидазол-2-ил] этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 775. Метиловый эфир [(1R)-1-(1S)-1-[5-[6-[5-[2-[(1S)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,4-диоксан-2-ил]-2-нафталенил]-1H-имидазол-2 ил]этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 775. Метиловый эфир [(1R)-1-(1S)-1-[5-[2-[4'-[2-[(1S)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил][1,1'-дифенил]-4-ил]-1,3-диоксан-5-ил]-1H-имидазол-2 ил]этил]метиламино]карбонил]-2-метилпропил]-карбаминовой кислоты, LCMS (M+1) 801. Метиловый эфир [(1R)-1-(1R)-1-[5-[5-[4'-[2-[(1R)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил 1-оксобутил]метиламино]этил]-1H-имидазол-5-ил][1,1'-дифенил]-4-ил]-1,3-диоксан-2-ил]-1H-имидазол 2-ил]этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (М+1) 801. Метиловый эфир [(1R)-1-(1R)-1-[5-[5-[4'-[2-[(1R)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил 1-оксобутил]метиламино]этил]-1H-имидазол-5-ил][1,1'-дифенил]-4-ил]-1,4-диоксан-2-ил]-1H-имидазол 2-ил]этил]метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 801. Метиловый эфир [(1R)-1-(1R)-1-[5-[5-[5-[2-[(1R)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,3-диоксан-2-ил]-2-тиенил]-1H-имидазол-2-ил]этил] метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 731. Метиловый эфир [(1R)-1-(1R)-1-[5-[5-[2-[2-[(1R)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,3-диоксан-5-ил]-2-тиенил]-1H-имидазол-2-ил]этил] метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 731. Метиловый эфир [(1R)-1-(1R)-1-[5-[5-[5-[2-[(1R)-1-(2R)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]метиламино]этил]-1H-имидазол-5-ил]-1,4-диоксан-2-ил]-2-тиенил]-1H-имидазол-2-ил]этил] метиламино]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 731. Метиловый эфир [(1S)-1-(2S)-2-[5-[2-[5'-[2-[(2S)-1-[(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]-2-пирролидинил]-1H-имидазол-5-ил][2,2'-дитиофен]-5-ил]-1,3-диоксан-5-ил]-1H-имидазол-2 ил]-1-пирролидинил]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 838. Метиловый эфир [(1S)-1-(2S)-2-[5-[5-[5'-[2-[(2S)-1-[(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]-2-пирролидинил]-1H-имидазол-5-ил] [2,2'-дитиофен]-5-ил]-1,3-диоксан-2-ил]-1H-имидазол-2 ил]-1-пирролидинил]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 838. Метиловый эфир [(1S)-1-(2S)-2-[5-[5-[5'-[2-[(2S)-l-[(2S)-2-[(метоксикарбонил)амино]-3-метил-1 оксобутил]-2-пирролидинил]-1H-имидазол-5-ил] [2,2'-дитиофен]-5-ил]-1,4-диоксан-2-ил]-1H-имидазол-2 ил]-1-пирролидинил]карбонил]-2-метилпропил]карбаминовой кислоты, LCMS (M+1) 838. Пример 3. Получение фармацевтической композиции в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг бис-азола 4. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая. Пример 4. Получение фармацевтической композиции в форме капсул. Тщательно смешивают бисазол 4 с порошком лактозы в соотношении 2 : 1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера. Пример 5. Получение фармацевтической композиции в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг бис-азола 4 с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают. Промышленная применимость Изобретение может быть использовано в медицине, ветеринарии, биохимии. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенные азолы общей формулы 1 и их фармацевтически приемлемые соли где сплошные линии с сопровождающими их пунктирными линиями представляют собой одинарную или двойную связь, причем если одна из них одинарная связь, то другая двойная связь;X и Y необязательно принимают разные значения и представляют собой атом азота, кислорода, серы или группу NH;R1 и R2 представляют собой необязательно одинаковые радикалы 2.1-2.20, в которых звездочкойуказано место присоединения к азольным фрагментам; А представляет собой алкинилциклоалкильный, алкинилдиоксановый, алкиниларильный, алкилтиофеновый, алкенилтиофеновый и алкинилтиофеновый бирадикал, выбранный из бирадикалов формул 3.72-3.129, в которых звездочкойуказаны места присоединения азольных фрагментов 2. Соединения по п.1, представляющие собой замещенные азолы общей формулы 5.1-5.70, в которых X, Y, R1, R2 и сплошные линии с сопровождающими их пунктирными линиями имеют вышеуказанное значение.
МПК / Метки
МПК: C07D 403/04, C07D 413/14, A61K 31/427, A61K 31/12, A61K 31/4178, C07D 403/14, C07D 405/14, C07D 409/10, A61K 31/422, C07D 405/10, C07D 409/14
Метки: азолы, активный, компонент, противовирусный, способ, получения, композиция, замещенные, применения, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/30-20949-zameshhennye-azoly-protivovirusnyjj-aktivnyjj-komponent-farmacevticheskaya-kompoziciya-sposob-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные азолы, противовирусный активный компонент, фармацевтическая композиция, способ получения и применения</a>
Предыдущий патент: Фармацевтическая композиция, обладающая противогипоксической, нейропротекторной и антиамнестической активностью и повышающая физическую работоспособность
Следующий патент: Способ усовершенствования восстановления золота из двойных тугоплавких золотосодержащих руд
Случайный патент: Способы и устройство для измерения количества сернистого водорода и тиолов в текучих средах