Ингибиторы 11β-гидроксистероидной дегидрогеназы типа 1
Номер патента: 20794
Опубликовано: 30.01.2015
Авторы: Монльео Мас Эстер, Антолин Эрнандес Альберт, Катена Руис Хуан Лоренсо, Рей Пуиггрос Оскар, Серра Комас Карме
Формула / Реферат
1. Соединение формулы (I)
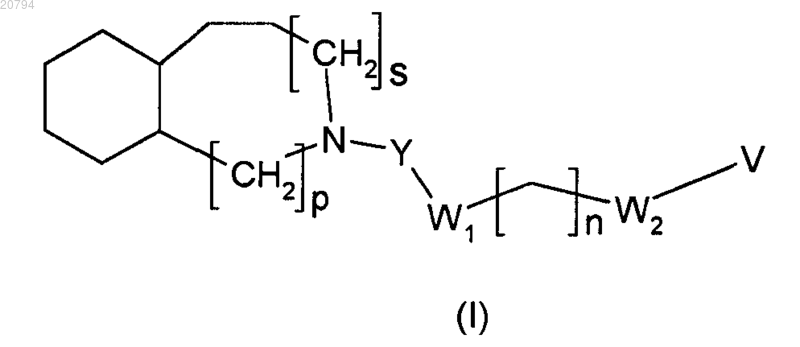
и его фармацевтически приемлемые соли, где
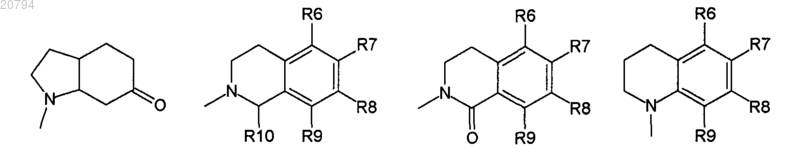
s и р равны целым числам, выбранным в обратном порядке между 0 и 1 так, что когда s равно 1, р равно 0 (с получением пергидрохинолина), и когда s равно 0, р равно 1 (с получением пергидроизохинолина);
Y является бирадикалом, выбранным из СО и SO2;
W1 и W2 независимо выбирают из связи или бирадикала, выбранного из S и NR1, где R1 является Н;
n равно целому числу, выбранному из 0, 1, 2, 3 и 4;
V является радикалом, выбранным из -СО-Т, -CS-T и -SO2-T, или радикалом, выбранным из
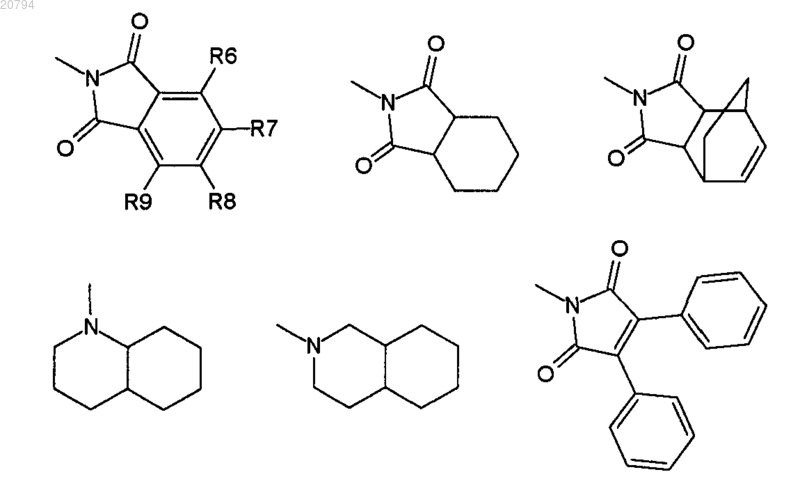
Т является группой, выбранной из NR2R3, R2, OR2 и SR2; или группой, выбранной из
где R2 и R3 независимо выбирают из Н, COR4, SO2R4, C1-4 алкила, фенила, нафтила, бензила, фенэтила, С2-4 алкенила, С3-10 циклоалкила и гетероциклила, где указанный гетероциклил выбирают из 2-фуранила, 2-тиофенила, 2-(1-метилиндолила), хинолинила, изохинолинила, 2-бензофуранила;
где R2 или R3 необязательно замещен одним или двумя заместителями, независимо выбранными из F, OR4, NR4R5, COOR4, CONR4R5, фенила, С3-10 циклоалкила, гексенила, нафтила и гетероциклила, где указанный гетероциклил выбирают из пиридила, 3-(1-метилиндолила), 3-тиофенила и 2-фуранила;
причем когда R2 или R3 является С3-10 циклоалкилом, он может быть необязательно замещен одним или двумя конденсированными бензольными кольцами, бензол может быть необязательно замещен одним заместителем, выбранным из C1-4 алкила,
где R4 и R5 независимо выбирают из С1-4 алкила, бензила, фенэтила и фенила;
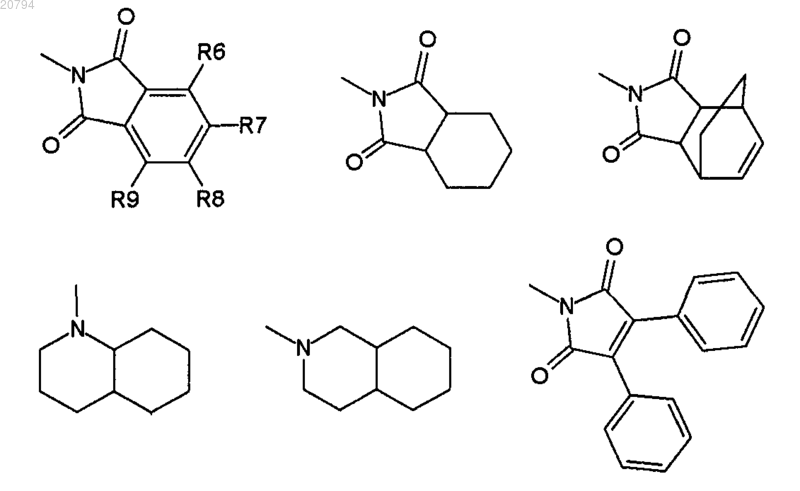
где R6, R7, R8 и R9 независимо выбирают из Н, OR4, F и Cl;
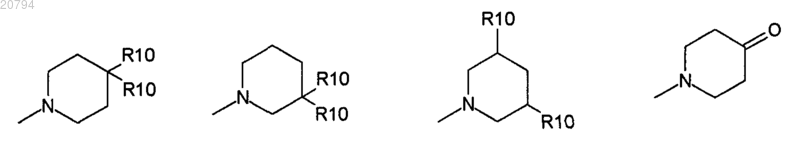
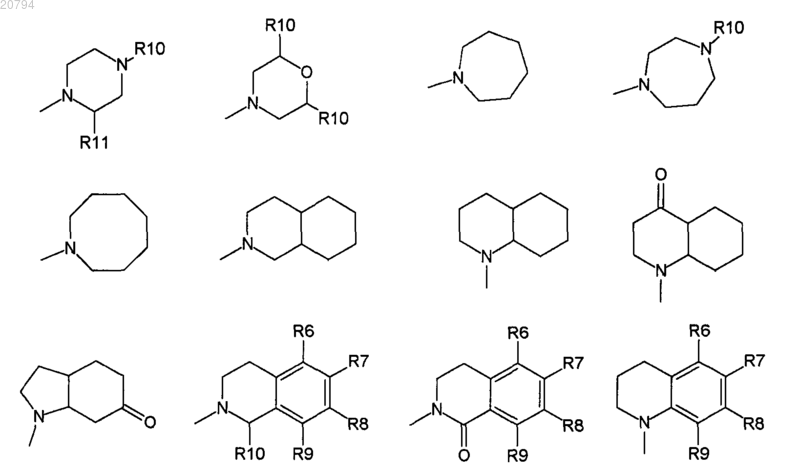
где R10 независимо выбирают из Н, ОН, F, C1-4 алкила, COOR11, COR11, фенила, бензила и бензгидрила, и где алкил, фенил, бензил или бензгидрил могут быть необязательно замещены одним заместителем, выбранным из NH2, F, Cl, NO2, COOH, COOR4, OR4, CF3, SH, SR4, CONR4R5, SO2NR4R5, COR4, NR1COR4, OCOR4, SOR4, SO2R4 и С1-4 алкила;
и R11 выбирают из Н и С3-10 циклоалкила.
2. Соединение по п.1, где V выбирают из -СО-Т, -CS-T и -SO2-T.
3. Соединение по п.1, где V выбирают из
4. Соединение по п.1, где Т выбирают из NR2R3, R2, OR2 и SR2.
5. Соединение по п.1, где Т выбирают из NR2R3, OR2 и SR2.
6. Соединение по п.1, где R2 или R3 независимо выбирают из C1-4 алкила или С2-4 алкенила.
7. Соединение по п.1, где R2 и R3 независимо выбирают из фенила, бензила, фенэтила или С3-10 циклоалкила.
8. Соединение по п.7, где R2 или R3 могут быть необязательно замещены одним или двумя заместителями, независимо выбранными из F, Cl и OR4.
9. Соединение по п.1, где Т выбирают из

10. Соединение по п.1, где R10 выбирают из фенила, бензила и бензгидрила.
11. Соединение по п.10, где R10 необязательно замещен одним заместителем, выбранным из F, OR4, CF3, COR4 и С1-4 алкила.
12. Соединение по любому из пп.1-11, где s равно 0 и р равно 1.
13. Соединение по любому из пп.1-11, где s равно 1 и р равно 0.
14. Соединение по п.1, которое представляет собой

15. Применение соединения по любому из пп.1-14 в качестве активного фармацевтического ингредиента.
16. Применение соединения по любому из пп.1-14 для профилактики или лечения заболеваний, связанных с 11β-гидроксистероидной дегидрогеназой типа 1 (11β-ГСД1).
17. Применение по п.16, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома, повышенное глазное давление, нарушения обмена веществ, ожирение, метаболический синдром, дислипидемия, артериальная гипертензия, сахарный диабет, атеросклероз, синдром Кушинга, псориаз, ревматоидный артрит, нарушения познавательной способности, болезнь Альцгеймера или нейродегенерация.
18. Применение по п.16, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома или метаболический синдром.
19. Применение соединения по любому из пп.1-14 для получения лекарственного средства, предназначенного для профилактики или лечения заболеваний, вызванных расстройствами, связанными с 11β-ГСД1.
20. Применение по п.19, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома, повышенное глазное давление, нарушения обмена веществ, ожирение, метаболический синдром, дислипидемия, артериальная гипертензия, сахарный диабет, атеросклероз, синдром Кушинга, псориаз, ревматоидный артрит, нарушения познавательной способности, болезнь Альцгеймера или нейродегенерация.
21. Применение по п.19, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома или метаболический синдром.
22. Способ профилактики или лечения индивидуума, который страдает или предположительно страдает заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, который включает введение указанному индивидууму терапевтически эффективного количества соединения по любому из пп.1-12 вместе с достаточными количествами одного или более фармацевтически приемлемых наполнителей.
23. Способ по п.22, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома, повышенное глазное давление, нарушения обмена веществ, ожирение, метаболический синдром, дислипидемия, артериальная гипертензия, сахарный диабет, атеросклероз, синдром Кушинга, псориаз, ревматоидный артрит, нарушения познавательной способности, болезнь Альцгеймера или нейродегенерация.
24. Способ по п.22, где заболеванием, вызванным расстройствами, связанными с 11β-ГСД1, является глаукома или метаболический синдром.
Текст
Соединения формулы (I) получают из пергидрохинолина и пергидроизохинолина и применяют в качестве активных фармацевтических ингредиентов для профилактики или лечения заболеваний,вызванных расстройствами, связанными с ферментом 11-гидроксистероидной дегидрогеназой типа 1 (11-ГСД 1), таких как глаукома, повышенное глазное давление, нарушения обмена веществ,ожирение, метаболический синдром, дислипидемия, артериальная гипертензия, сахарный диабет,атеросклероз, синдром Кушинга, псориаз, ревматоидный артрит, нарушения познавательной способности, болезнь Альцгеймера или нейродегенерация. Катена Руис Хуан Лоренсо, Серра Комас Карме, Рей Пуиггрос Оскар,Антолин Эрнандес Альберт, Монльео Мас Эстер (ES) Медведев В.Н. (RU) Настоящее изобретение относится к производным пергидрохинолина и пергидроизохинолина и способам лечения определенных заболеваний с применением таких соединений. Область техники, к которой относится изобретение Глюкокортикоиды (кортизол у людей, кортикостерон у мышей и крыс) являются важной группой адренокортикостероидов, которые регулируют многие метаболические и гомеостатические процессы и являются ключевым элементом реакции на стресс. Глюкокортикоиды действуют через внутриклеточные глюкокортикоидные рецепторы и в некоторых тканях через минералокортикоидные рецепторы, которые являются нуклеарными факторами транскрипции. Действие глюкокортикоидов в целевых тканях зависит не только от концентраций циркулирующего стероида и клеточной экспрессии рецепторов, но и от внутриклеточных ферментов, которые критически определяют степень, до которой глюкокортикоиды имеют активный доступ к рецепторам. 11-гидроксистероидные дегидрогеназы (11-ГСД) катализируют взаимопревращение между основным активным 11-гидроксиглюкокортикоидом (кортизол у человека) и его неактивными 11-кетометаболитами (кортизон у человека). Фермент 11-гидроксистероидная дегидрогеназа типа 1 (11-ГСД 1) обратно превращает неактивные глюкокортикоиды в активные, следовательно, играет важную роль в модулировании концентрации клеточного агониста и поэтому в активации кортикостероидных рецепторов в целевых тканях. Было описано, что чрезмерная экспрессия 11-ГСД 1 в адипоцитах мышей приводит к висцеральному ожирению и фенотипу, подобному метаболическому синдрому. Вместе эти данные в значительной степени подтверждают роль 11-ГСД 1 в ожирении и дисбалансе гомеостаза глюкозы и липидных параметров. Таким образом, селективное ингибирование этого фермента может уменьшать уровень глюкозы в крови у пациентов с сахарным диабетом 2 типа, нормализовать повышенные липидные параметры и/или уменьшить вес у пациентов с ожирением. Первый фармакологический показатель того, что ингибирование 11-ГСД 1 у человека может иметь положительный эффект, был достигнут при использовании карбеноксолона, противоязвенного лекарственного средства, которое ингибирует и 11-ГСД 1, и подобный 11-ГСД 2 фермент. Лечение карбеноксолоном повышало чувствительность к инсулину, показывая, что ингибирование 11-ГСД 1 может снизить уровни кортизола в клетках и, таким образом, свести к минимуму некоторые из его вредных эффектов. Исследования, проводимые с неспецифическим ингибитором карбеноксолона, четко показали важность развития специфических к 11-ГСД 1 ингибиторов. Ингибирование фермента 11-ГСД 2 плохо переносится и вызывает повышение кровяного давления. Наоборот, ингибирование 11-ГСД 1 хорошо переносится, поскольку было отмечено, что 11-ГСД 1 нокаутные мыши здоровы и резистентны к гипергликемии, вызванной ожирением или стрессом (см. Kotelevtsev et al., Proc. Natl. Acad. Sci. USA, 1997, vol. 94, pp. 14924-14929). Другие исследования показывают, что ингибиторы 11-ГСД 1 также могут быть полезными для снижения высокого кровяного давления (см. Masuzaki et al., J. Clin. Invest. 2003, vol. 112,pp. 83-90), для уменьшения внутриглазного давления (см. Rauz et al., Q J Med 2003, vol. 96, pp. 481-490),для улучшения познавательных способностей (см. Sandeep et al., Proc. Natl. Acad. Sci. USA, 2004, vol. 101, pp. 6734-6739) или для улучшения недостаточности, связанной с болезнью Альцгеймера. В общем,ингибирование 11-ГСД 1 может быть безопасной и эффективной стратегией лечения симптомов глаукомы, диабета, ожирения и других заболеваний. Глюкокортикоиды повышают риск развития глаукомы за счет повышения внутриглазного давления при их экзогенном введении при определенных условиях их увеличенного вырабатывания, таких как синдром Кушинга. Повышение внутриглазного давления, вызванное кортикостероидами, происходит изза повышенной резистентности к водному оттоку из-за изменений, вызванных глюкокортикоидами. 11-ГСД 1 экспрессируется в базальных клетках эпителия роговицы и непигментированных эпителиальных клетках. мРНК глюкокортикоидного рецептора была обнаружена в трабекулярной сети, в то время как мРНК для глюкокортикоидного рецептора, минералокортикоидного рецептора и 11-ГСД 1 присутствует в непигментированных эпителиальных клетках. Введение карбеноксолона пациентам дает значительное снижение внутриглазного давления (см. Rauz et al., Invest. Ophtalmol. Vis. Sci. 2001, vol. 42,pp. 2037-2042), что свидетельствует о роли ингибиторов ГСД 1 в лечении глаукомы. Была описана экспрессия изоферментов 11-ГСД в глазу человека и грызунов (см. Stokes et al., Invest. Ophthalmol. Vis. Sci. 2000, vol. 41, pp. 1629-1638), в частности 11-ГСД 1 в клетках ресничного эпителия, что позволяет предположить возможность участия в вырабатывании внутриглазной жидкости и в регулировании внутриглазного давления. Во внутриглазной жидкости концентрации кортизола приблизительно в 14 раз больше, чем кортизона. Это в значительной степени доказывает преобладание активности 11-редуктазы ГСД 1. В двойном слепом контролируемом исследовании у пациентов с глаукомой было отмечено, что лечение карбеноксолоном значительно снижает внутриглазное давление, поэтому ингибиторы 11-ГСД 1 могут представлять терапевтическую стратегию, подходящую для лечения глаукомы. В документе WO 2007026920 описаны соединения N-ариламида и родственные соединения в каче-1 020794 стве ингибиторов Rho-киназы (ROCK), а также фармацевтические композиции и их применение в лечении заболеваний, связанных с ROCK В документ WO 2003045367 описаны соединения, полученные из пиридилалкилмочевины, некоторые из которых являются структурно подобными настоящему изобретению, но имеют различное применение Тем не менее, желательно разработать новые соединения-ингибиторы 11-ГСД 1. Описание изобретения В настоящем изобретении представлены новые соединения, полученные из пергидрохинолина и пергидроизохинолина формулы (I), которые эффективны в качестве ингибиторов 11-ГСД 1 и обладают селективностью к 11-ГСД 1 по сравнению с 11-ГСД 2. Таким образом, первый аспект изобретения относится к соединениям формулы (I) и его фармацевтически приемлемым солям,где s и р равны целым числам, выбранным в обратном порядке между 0 и 1 так, что когда s равно 1,р равно 0 (с получением пергидрохинолина), и когда s равно 0, р равно 1 (с получением пергидроизохинолина);Y является бирадикалом, выбранным из СО и SO2;W1 и W2 независимо выбирают из связи или бирадикала, выбранного из S и NR1, где R1 является Н; где R2 и R3 независимо выбирают из Н, COR4, SO2R4, С 1-4 алкила, фенила, нафтила, бензила, фенэтила, С 2-4 алкенила, С 3-10 циклоалкила и гетероциклила, где указанный гетероциклил выбирают из 2 фуранила, 2-тиофенила, 2-(1-метилиндолила), хинолинила, изохинолинила, 2-бензофуранила; где R2 или R3 необязательно замещен одним или двумя заместителями, независимо выбранными изF, OR4, NR4R5, COOR4, CONR4R5, фенила, С 3-10 циклоалкила, гексенила, нафтила и гетероциклила, где указанный гетероциклил выбирают из пиридила, 3-(1-метилиндолила), 3-тиофенила и 2-фуранила; причем когда R2 или R3 является С 3-10 циклоалкилом, он может быть необязательно замещен одним или двумя конденсированными бензольными кольцами, бензол может быть, необязательно, замещен одним заместителем, выбранным из C1-4 алкила,где R4 и R5 независимо выбирают из C1-4 алкила, бензила, фенэтила и фенила; где R6, R7, R8 и R9 независимо выбирают из Н, OR4, F и Cl; где R10 независимо выбирают из Н, ОН, F, C1-4 алкила, COOR11, COR11, фенила, бензила и бензгидрила, и где алкил, фенил, бензил или бензгидрил могут быть необязательно замещены одним заместителем, выбранным из NH2, F, Cl, NO2, COOH, COOR4, OR4, CF3, SH, SR4, CONR4R5, SO2NR4R5, COR4,NR1COR4, OCOR4, SOR4, SO2R4 и C1-4 алкила; и R11 выбирают из Н и C3-10 циклоалкила. В частном варианте осуществления изобретения s равно 0 и р равно 1. В другом частном варианте осуществления изобретения s равно 1 и р равно 0. В другом частном варианте осуществления изобретения Y выбирают из СО и SO2. В другом частном варианте осуществления изобретения W1 и W2 независимо выбирают из связи, S и NR1. В другом частном варианте осуществления изобретения R1 является Н. В другом частном варианте осуществления изобретения V выбирают из -СО-Т, -CS-T и -SO2-T. В другом частном варианте осуществления изобретения V выбирают из В другом частном варианте осуществления изобретения R2 и R3 независимо выбирают из Н, COR4,SO2R4, С 1-4 алкила, фенила, нафтила, бензила, фенэтила, С 2-4 алкенила, С 3-10 циклоалкила и гетероцикла,в частности 2-фуранила, 2-тиофенила, 2-(1-метилиндола), хинолинила, изохинолинила, 2-бензофуранила. В другом частном варианте осуществления изобретения R4 и R5 независимо выбирают из C1-4 алкила, бензила, фенэтила, фенила. В другом частном варианте осуществления изобретения R6, R7, R8 и R9 независимо выбирают из Н, OR4, F и Cl. В другом частном варианте осуществления изобретения R10 выбирают из Н, ОН, F, C1-4 алкила,COOR11, COR11, фенила, бензила и бензгидрила. В другом частном варианте осуществления изобретения R10 выбирают из фенила, бензила и бензгидрила, все из которых необязательно замещены одним заместителем, независимо выбранным из F,OR4, CF3, COR4 и C1-4 алкила. В другом частном варианте осуществления изобретения R11 выбирают из Н и С 3-10 циклоалкила. В другом частном варианте осуществления Т выбирают из NR2R3, R2, OR2 и SR2. В другом частном варианте осуществления Т выбирают из NR2R3, OR2 и SR2. В другом частном варианте осуществления Т выбирают из В другом частном варианте осуществления соединение формулы (I) представляет собой Второй аспект настоящего изобретения относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в качестве активного фармацевтического ингредиента, особенно для профилактики или лечения заболеваний, вызванных расстройствами, связанными с 11-ГСД 1, особенно глаукомы, повышенного глазного давления, нарушений обмена веществ, ожирения, метаболического синдрома, дислипидемии, артериальной гипертензии, сахарного диабета, особенно сахарного диабета II типа, атеросклероза, синдрома Кушинга, псориаза, ревматоидного артрита, нарушений познавательной способности, болезни Альцгеймера или нейродегенерации, предпочтительно для профилактики или лечения глаукомы или метаболического синдрома. Другой аспект настоящего изобретения относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для профилактики или лечения заболеваний, вызванных расстройствами, связанными с 11-ГСД 1, в частности одно из расстройств,упомянутых выше. Другой аспект настоящего изобретения относится к способу профилактики или лечения индивидуума, который или страдает, или предположительно страдает заболеванием, вызванным расстройствами, связанными с 11-ГСД 1, в частности одним из вышеупомянутых расстройств, который включает введение указанному индивидууму терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли вместе с одним или более фармацевтически приемлемыми наполнителями. Предпочтительными являются соединения формулы (I) и фармацевтически приемлемые соли, особенно соединения формулы (I), описанные в качестве примеров или в качестве промежуточных соединений. Термин "C1-4 алкил", отдельно или в сочетании, означает линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Термин "С 2-4 алкенил" и "С 2-4 алкинил", отдельно или в сочетании, означает линейный или разветвленный радикал, содержащий от 2 до 4 атомовуглерода, и содержащий одну или несколько ненасыщенных связей. Термин "С 3-10 циклоалкил", отдельно или в сочетании, относится к стабильному моноциклическому,бициклическому или трициклическому радикалу, содержащему от 3 до 10 членов, который является насыщенным или частично насыщенным, и состоит только из атомов углерода и водорода. Примеры С 3-10 циклоалкила включают циклопропил, циклопентил, циклогексил, 1-циклогексенил, циклогептил, циклооктил, 1-трицикло[3.3.1.13,7]деканил, 2-трицикло[3.3.1.13,7]деканил и 2-бицикло[2.2.1]гептанил. Если не указано иначе в описании, термин "циклоалкил" относится к циклоалкильным радикалам, которые необязательно замещены одним или несколькими заместителями, такими как алкил, галоген, гидроксил,амино, циано, нитро, алкоксил, карбоксил, алкоксикарбонил, фенил и т.д. Термин "арил", отдельно или в сочетании, относится к радикалам с одним кольцом и множеством колец, включая радикалы с множеством колец, содержащие разделенные и/или конденсированные арильные группы. Типовые арильные группы содержат от 1 до 3 разделенных или конденсированных колец и от 6 до 18 атомов углерода в кольце и включают фенильный или нафтильный радикалы, предпочтительно фенильную группу, необязательно имеющую один или несколько заместителей, предпочтительно от одного до трех, где каждый независимо выбран из галогена, трифторметила, трифторметокси,амино, алкила, алкокси, алкилкарбонила, циано, карбамоила, алкоксикарбамоила, метилендиокси, карбокси, алкоксикарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, гидрокси,нитро, алкил-SO2-, амино-SO2-, циклоалкила и подобных. Предпочтительны фенил или нафтил, особенно, фенил, необязательно замещенный от одного до трех раз, предпочтительно от одного до двух раз,заместителями, независимо выбранными из алкила, галогена, алкокси, трифторметокси, нитро и трифторметила. Особенно предпочтительным является фенил. Термины "бензил" и "фенэтил" могут необязательно иметь один или несколько заместителей, независимо выбранных из галогена, трифторметила, трифторметокси, амино, алкила, алкокси, алкилкарбонила, циано, карбамоила, алкоксикарбамоила, метилендиокси, карбокси, алкоксикарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, гидрокси, нитро, алкил-SO2-, амино-SO2-, циклоалкила и подобных. Термин "гетероцикл", отдельно или в сочетании, означает насыщенный, частично ненасыщенный или ароматический 5-10-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода и серы. Для целей настоящего изобретения гетероциклом может быть моноциклическая, бициклическая или трициклическая кольцевая система, которая может включать конденсированные кольцевые системы. Гетероцикл может быть замещен на одном или нескольких атомах углерода,например, галогеном, алкилом, фенилом, алкокси, оксо и т.д., и/или на вторичном атоме азота (т.е. -NH-) алкилом, циклоалкилом, аралкоксикарбонилом, алканоилом, фенилом или фенилалкилом, или на третичном атоме азота (т.е. =N-) оксидами, где особенно предпочтительны галоген, алкил, циклоалкил и алкокси. Примеры гетероциклических групп включают пирролидинил, пиперидинил, пиперазинил, азепин, морфолинил, тиоморфолинил, имидазолил (например, имидазол-4-ил и 1-бензилоксикарбонилимидазол-4-ил), пиразолил, пиридил, пиразинил, пиримидинил, гексагидропиримидинил, фурил, тиенил,тиазолил, оксазолил, индолил (например, 2-индолил), хинолил (например, 2-хинолил, 3-хинолил и 1 оксид-2-хинолил), изохинолил (например, 1-изохинолил и 3-изохинолил), тетрагидрохинолил (например,1,2,3,4-тетрагидро-2-хинолил), 1,2,3,4-тетрагидроизохинолил (например, 1,2,3,4-тетрагидро-1-оксоизохинолил), бензимидазолил, бензотиазолил и хиноксалинил. Предпочтительные примеры включают тиофенил, хинолил, пиперидил, морфолил, тиоморфолил, оксазолил, пиридинил, пиримидинил, пиразолил,имидазолил и тиазолил. Термин "фармацевтически приемлемые соли" означает такие соли, которые сохраняют эффектив-5 020794 ность и биологические свойства свободных оснований или свободных кислот и которые не являются неподходящими в биологическом смысле или в любом другом смысле. В соответствии с настоящим изобретением соединения формулы I и их фармацевтически приемлемые соли применяют для профилактики или лечения заболеваний, вызванных расстройствами, связанными с ферментом 11-ГСД 1. Если не определено иначе, все технические и научные термины, используемые здесь, имеют то же значение, как обычно понимается специалистами в данной области техники. Способы и материалы, подобные или эквивалентные тем, которые описаны здесь, могут применяться в практике настоящего изобретения. В описании и формуле изобретения слово "включает" и его варианты не предназначены для исключения других технических характеристик, добавок, компонентов, стадий или стереоизомеров описываемых соединений. Для специалистов в данной области техники другие объекты, преимущества и характеристики изобретения станут очевидны частично из описания и частично из практики изобретения. Соединения формулы (I) могут быть получены представленными ниже различными способами, известными любому специалисту в области органического синтеза, особенно общими способами, показанными на представленных ниже схемах. Исходные материалы для способов получения коммерчески доступны или могут быть получены известными из литературы способами. Все они начинаются с пергидрохинолина, но аналогичны и для пергидроизохинолина. Схема 1 Согласно этому способу сложный эфир кислоты (IIa) обрабатывают декагидрохинолином в присутствии подходящего сочетающего агента, такого как, например, сочетание 1-(3-диметиламинопропил)-3 этилкарбодиимида (EDC) и 1-гидроксибензотриазола (НОВТ), или через превращение кислоты в соответствующий ацилгалогенид со множеством реагентов, таких как тионилхлорид, сульфурилхлорид, оксалилхлорид и т.д. В присутствии третичного основания, такого как Et3N (Elmore, Amino Acids Pep. Proteins 2001, vol. 32, pp. 107-162), получают промежуточный сложный эфир амида (IIIa). Диамид (Ia) получают сначала омылением соединения (IIIa) в водной среде с основаниями типа LiOH, NaOH и т.д., затем образованием диамида любым из способов, описанных выше для промежуточного соединения (IIIa). Схема 2 На схеме 2 показано взаимодействие декагидрохинолина с дифосгеном или трифосгеном и последующее добавление производных сложного аминоэфира, гидроксиэфира или меркаптоэфира соответственно, с получением промежуточных соединений сложного эфира мочевины, карбамата или тиокарбамата. Затем проводят снятие защиты и сочетание, такое как описано на схеме 1, с получением производных На схеме 3 показан способ получения соединений амидо-сукцинимида (Ic и Ik), амидо-амида (Id),амидо-сульфонамида (It) и амидо-мочевины или амидо-тиомочевины (Ie) в соответствии с настоящим изобретением. Промежуточный амин (Vc) может быть получен двумя альтернативными способами: с одной стороны, синтезом Габриэля с фталимидом калия из промежуточного соединения (IIIc) с получением соединения (Ic) и последующей обработкой этого соединения гидразином в кипящем с обратным холодильником EtOH с получением указанного амина (Vc), необязательно, промежуточное соединение(IIIc) подвергают взаимодействию с азидом натрия с получением алкилазида (IVc), который при восстановлении дает амин (Vc). Промежуточный амин (Vc) может быть превращен в амид (Id) и сульфамид (It) любым из способов,описанных выше, или в мочевину, или тиомочевину (Ie) реакцией с изоцианатом или тиоизоцианатом соответственно. Соединение формулы (Ik) может быть легко получено конденсацией ангидрида 1,2 дикарбоновой кислоты общей формулы (IIc) и промежуточного амина (Vc), описанного ранее. Схема 4 На схеме 4 показан способ получения соединений в соответствии с настоящим изобретением с применением сочетания способов, описанных ранее на описанных выше схемах, с получением мочевин и тиомочевин из декагидрохинолина с различными концевыми функциональными группами, уже описанными выше на схеме 3. На схеме 5 показан способ получения соединений в соответствии с настоящим изобретением типа амидо-карбамата и амидо-О-тиокарбамата. Восстановление промежуточного сложного эфира (IIIa) в спирт (IVj) через омыление сложного эфира, образование смешанного ангидрида и последующего восстановления с боргидридом натрия. Взаимодействие спирта (IVj) с изоцианатом, тиоцианатом, карбамоилхлоридом или тиокарбамоилхлоридом дает карбамат или О-тиокарбамат (Ij). Схема 6 На схеме 6 показан способ получения соединений в соответствии с настоящим изобретением типа амидо-S-тиокарбамата и амидо-дитиокарбамата. После образования промежуточного амида (IVp) описанными выше способами и последующего взаимодействия с изоцианатом, тиоцианатом, карбамоилхлоридом или тиокарбамоилхлоридом получают S-тиокарбамат или дитиокарбамат (Ip). Схема 7 На схеме 7 показан способ получения сульфонамида (Im), в котором декагидрохинолин подвергают взаимодействию с хлоридом сложного эфира сульфонила (IIm). Снятие защиты и сочетание, описанное выше на схеме 1, дают сульфонамиды (Im). Примеры Представленные ниже примеры служат для лучшей иллюстрации изобретения и не должны быть истолкованы как ограничивающие настоящее изобретение. Номенклатура, применяемая в данном документе, основана на компьютерной программе института Байльштайн, известной как AUTONOM (Automatic Nomenclature), в которой применяется систематическая номенклатура IUPAC. Общие данные Продукты анализируют с применением аппарата Agilent HPLC-UV-MS, оборудованного УФдетектором с переменной длиной волны и масс-спектрометром модели 1100 VL. Длина волны, применяемая для УФ-обнаружения, составляет 210 нм, детектор МС работает в режиме положительной ионизации электрораспылением, и сканирование проводят в интервале от 100 до 700 m/z. При хроматографическом разделении применяют колонку Kromasil 100 С 18, 404,0 мм, 3,5 мкм с впрыском 2-5 мкл. Элюирование проводят с применением описанных ниже градиентов двух растворителей. Способ А: 5-90% В, 0-8 мин, 90% В, 8-11 мин, 5% В, 9-11 мин. Скорость потока подвижной фазы 0,7 мл/мин. Способ В: 5-90% В, 0-4,5 мин, 90% В, 4,5-6 мин, 5% В, 6-7 мин. Скорость потока подвижной фазы 1,4 мл/мин. В обоих случаях растворитель состоит из 0,2% муравьиной кислоты в воде, В состоит из 0,2% муравьиной кислоты в ацетонитриле. Альтернативно, анализ проводят с применением аппарата Waters HPLC-UV-MS, оснащенного детектором, содержащим ряд диодов, и масс-спектрометром модели EMD1000. Длина волны, применяемая для УФ-обнаружения, составляет 210 нм, детектор МС работает в режиме положительной ионизации электрораспылением, и сканирование проводят в интервале от 100 до 700 m/z. При хроматографическом разделении применяют колонку Kromasil C18 2,150 мм, 3,5 мкм и с впрыском 2 мкл. Элюирование проводят с применением следующего градиента: скорость потока подвижной фазы 0,5 мл/мин. Промежуточное соединение IIIa.1. Этил 3-(октагидрохинолин-1-ил)-3-оксопропионат 3,38 мл Et3N и 1,44 мл (11 ммоль) этил 3-хлор-3-оксопропионата добавляют к раствору 1,5 мл (10 ммоль) декагидрохинолина в 100 мл AcOEt. Полученный раствор перемешивают при кипении с обратным холодильником в течение 10 ч. Затем добавляют воду и органическую водную фазу отделяют, водную фазу снова экстрагируют AcOEt. Органические фазы объединяют и сначала промывают 5% раствором NaHCO3, а затем насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 2,0 г желтого масла. Его идентифицируют как промежуточное соединение Ша.1. Способ А. Время удерживания: 6,76 мин, m/z: 268. Промежуточное соединение оксогексановой кислоты 6-(октагидроизохинолин-2-ил)-6 80 мл AcOEt и затем 3 мл (22 ммоль) Et3N добавляют к смеси, полученной из 1,1 мл (8,32 ммоль) декагидроизохинолина, 1,5 мл (10 ммоль) монометилового адипата, 2 г (15 ммоль) НОВТ и 2,9 г (15 ммоль) EDC. Полученный раствор перемешиваютв течение 18 ч. Затем его обрабатывают водой иAcOEt, органическую фазу отделяют и водную фазу снова экстрагируют AcOEt. Органические фазы объединяют и промывают последовательно насыщенным NaHCO3, 1 н. HCl и насыщенным раствором соли. Затем сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 1,5 г масла, идентифицированного как промежуточное соединение IIIa.2. Способ В. Время удерживания: 3,66/3,78 мин, m/z: 282/282. Следующие промежуточные соединения получают по методике для промежуточных соединений 2,5 г (18 ммоль) декагидрохинолина растворяют в 150 мл ДХМ и к полученному раствору медленно добавляют 2,7 г (9 ммоль) трифосгена, поддерживая температуру не выше 25 С. Полученную смесь затем кипятят с обратным холодильником в течение 18 ч. Затем смесь выпаривают досуха и полученный остаток очищают фильтрацией на силикагеле с применением AcOEt в качестве элюента, с получением 2 г желтоватого масла, идентифицированного как 1-хлоркарбонилоктагидрохинолин. ИК: 1729. Стадия 2. 0,5 г (3,5 ммоль) гидрохлорида метилового эфира 3-аминопропионовой кислоты растворяют в 5 мл безводного ТГФ и 0,9 мл Et3N. После растворения медленно добавляют 650 мг 1-хлоркарбонилоктагидрохинолина и кипятят с обратным холодильником в течение 18 ч. Затем добавляют AcOEt и полученный раствор последовательно промывают водой, 1 н. HCl и насыщенным раствором соли. Органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении с получением 580 мг промежуточного соединения IIIb.1. Способ В. Время удерживания: 3,17 мин, m/z: 269. Следующие промежуточные соединения получают по методике для промежуточного соединения 2-Хлоркарбонилоктагидроизохинолин получают по методике, описанной на стадии 1 для промежуточного соединения IIIb.1. ИК: 1737. Стадия 2. 1 г (5 ммоль) 2-хлоркарбонилоктагидроизохинолина добавляют к 0 С раствору 0,55 мл (5 ммоль) метилового эфира 3-меркаптопропионовой кислоты в 10 мл пиридина. После добавления раствор перемешивают при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляют AcOEt и последовательно промывают 5% раствором NaHCO3, 1 н. HCl и насыщенным раствором соли. Органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении, очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь (1:1) гексан:AcOEt, с получением 1,17 г остатка, идентифицированного как промежуточное соединение IIIb.5,и 210 мг твердого вещества, идентифицированного как бис-(октагидроизохинолин-2-ил)метанон (Vb.1) Способ В. Для IIIb.5 время удерживания: 4,35 мин, m/z: 286, для Vb.1 время удерживания: 5,34 мин,m/z: 305. Следующие промежуточные соединения получают по методике для промежуточного соединения Стадия 1. 4,48 мл (55,9 ммоль) хлорида сульфурила по каплям добавляют к смеси, полученной из 2,47 мл(22,4 ммоль) метил 3-меркаптопропионата и 5,64 г (55,9 ммоль) нитрата калия, охлажденной до 0 С. После добавления смесь нагревают до комнатной температуры при перемешивании в течение 10 ч. Добавляют насыщенный раствор NaHCO3 и органическую фазу отделяют, затем промывают снова с NaHCO3 и насыщенным раствором соли. Органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении с получением 2,6 г масла, идентифицированного как метиловый эфир 3-хлорсульфонилпропионовой кислоты. Способ В. Время удерживания: 2,05 мин; m/z: неионизируемое. Стадия 2. 2,1 мл Et3N (15,3 ммоль) и затем по каплям 1,3 г (7 ммоль) метилового эфира 3 хлорсульфонилпропионовой кислоты добавляют к раствору, полученному из 1,1 мл (7,6 ммоль) декагидрохинолина в 70 мл AcOEt. Смесь нагревают при 70 С и выдерживают при этой температуре в течение 12 ч. Затем охлаждают и добавляют воду, органическую фазу отделяют и последовательно промывают 5% раствором бикарбоната натрия, 2 н. HCl и насыщенным раствором соли. Органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении с получением 1,32 г красноватого масла, идентифицированного как промежуточное соединение IIIm.1. Способ В. Время удерживания: 3,36 мин, m/z: 290. Следующие промежуточные соединения получают по методике для промежуточного соединения 1,2 г (4,21 ммоль) промежуточного соединения IIIb.4 растворяют в смеси, полученной из 37,5 мл ТГФ и 12,5 мл МеОН, и к полученному раствору добавляют 5,1 мл 1 М раствора LiOH в воде. Полученную смесь перемешивают при комнатной температуре в течение 18 ч. Затем ее разбавляют в AcOEt и промывают водой, водную фазу подкисляют 1 н. раствором HCl до рН 3 и экстрагируют AcOEt. Наконец,- 12020794 органические фазы объединяют, сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 570 мг белого твердого вещества. Способ В. Время удерживания: 2,85 мин/2,96 мин, m/z: 269/269. Следующие промежуточные соединения получают по методике для промежуточного соединения 1,37 мл (9,9 ммоль) Et3N и 0,5 мл (4,5 ммоль) хлорида 5-бромвалериановой кислоты добавляют к раствору 1 мл (4,0 ммоль) декагидрохинолина в AcOEt. Полученный раствор перемешивают в течение 18 ч при комнатной температуре. Затем раствор промывают водой и водную фазу дважды реэкстрагируютAcOEt. Объединенные органические фазы последовательно промывают 5% раствором NaHCO3, 1 н. HCl и насыщенным раствором хлорида аммония. Наконец, органическую фазу сушат над безводным Na2SO4,фильтруют и растворитель выпаривают при пониженном давлении. Получают 1,2 г желтого масла, которое применяют без последующей очистки. Следующие промежуточные соединения получают по методике для промежуточного соединения 2,5 г (21 ммоль) 3-хлорпропилизоцианата растворяют в 150 мл безводного ТГФ и 6,4 мл (46 ммоль)Et3N. После растворения медленно добавляют 3,4 мл (23 ммоль) декагидрохинолина и кипятят с обратным холодильником в течение 18 ч. Затем добавляют AcOEt и полученный раствор последовательно промывают водой, 1 н. HCl и насыщенным раствором соли. Органическую фазу сушат над безводнымNa2SO4, фильтруют и растворитель выпаривают при пониженном давлении с получением 4,6 г промежуточного соединения IIIf.1. Способ В. Время удерживания: 3,58 мин, m/z: 259. Промежуточное соединение IIIf.2. 3-(Хлорпропил)амид октагидроизохинолин-2-карбоновой кислоты Получают по методике, описанной для промежуточного соединения IIIf.1. Способ В. Время удерживания: 3,57/3,68 мин, m/z: 259, 259. Промежуточное соединение IVc.1. 4-Азидо-1-(октагидрохинолин-1-ил)бутан-1-он 710 мг (10,8 ммоль) азида натрия добавляют к раствору 1,1 г (3,6 ммоль) промежуточного соединения IIIc.1 в 35 мл безводного ДМФА. Полученный раствор перемешивают в течение 18 ч при температуре 90 С. Затем раствор охлаждают и добавляют воду, экстрагируют три раза AcOEt. Объединенные органические фазы промывают насыщенным раствором соли. Наконец, органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 830 мг желтого масла, которое применяют без дальнейшей очистки. Способ А. Время удерживания: 7,07 мин, m/z: 251. Следующие промежуточные соединения получают по методике для промежуточного соединения 200 мг (1,1 ммоль) фталимида калия добавляют к раствору 307 мг (1,1 ммоль) промежуточного соединения IIIc.1 в 10 мл безводного ДМФА. Полученный раствор перемешивают в течение 18 ч при температуре 90 С. Затем раствор охлаждают и добавляют воду, экстрагируют AcOEt. Объединенные органические фазы промывают насыщенным раствором соли. Наконец, органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 360 мг пасты, которую очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь(1:1) гексан:AcOEt, с получением 180 мг масла, идентифицированного как промежуточное соединениеIc.1. Способ А. Время удерживания: 7,17 мин, m/z: 355. Следующие промежуточные соединения получают по методике для промежуточного соединения Вариант А. 0,1 мл гидразина (2,5 ммоль) добавляют к раствору, состоящему из 172 мг (0,48 ммоль) промежуточного соединения Ic.1 в 5 мл EtOH, и нагревают до кипения с обратным холодильником в течение 2 ч. Раствор затем охлаждают и добавляют концентрированную HCl до достижения кислотного рН, перемешивают в течение 2 ч или более. Полученную суспензию фильтруют и воду подщелачивают 1 н. NaOH, экстрагируют ДХМ. Объединенные органические фазы промывают насыщенным раствором соли и сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем с применением в качестве элюента смеси (10:1) ДХМ:МеОН, с получением 90 мг масла, идентифицированного как промежуточное соединение Vc.1. Вариант В. Суспензию, полученную из 830 мг (3,32 ммоль) промежуточного соединения IVc.1 и 83 мг 5% Pd/C в 35 мл МеОН, перемешивают в атмосфере водорода до исчезновения исходного продукта,отслеживая реакцию с помощью ТСХ. Смесь фильтруют через целит и выпаривают досуха с получением 700 мг масла, идентифицированного как промежуточное соединение Vc.1. Способ А. Время удерживания: 3,94 мин, m/z: 225. Следующие промежуточные соединения получают по методике для промежуточного соединения 0,63 мл (4,93 ммоль) изобутилхлорформиата добавляют по каплям к раствору 1,25 г (4,93 ммоль) промежуточного соединения IVa.8 и 0,6 мл N-метилморфолина (5,4 ммоль) в 50 мл безводного ТГФ и охлаждают до 0 С. Полученный раствор перемешивают в течение 30 мин при этой температуре, затем добавляют 370 мг (9,86 ммоль) боргидрида натрия. После добавления смесь оставляют до достижения комнатной температуры и перемешивают в течение 2 ч. Затем ее разделяют между AcOEt и водой. Водную фазу экстрагируют дважды AcOEt, органические фазы объединяют, сушат над безводным Na2SO4,фильтруют и выпаривают досуха с получением 1 г желтого масла, которое применяют без дальнейшей очистки. Способ В. Время удерживания: 2,94/3,06 мин, m/z 240/240. Промежуточное соединение IVj.2. 5-Гидроксил-1-(октагидрохинолин-1-ил)пентан-1-он Получают по методике, описанной для промежуточного соединения IVj.1. Способ В. Время удерживания: 2,94 мин, m/z: 240. Промежуточное соединение IVp.1. 3-Меркапто-1-(октагидрохинолин-1-ил)пропан-1-он(28,2 ммоль) 3-меркаптопропионовой кислоты в 45 мл ДМФА, и охлаждают до 0 С и выстаивают в течение 15 мин при перемешивании при этой температуре. Затем добавляют 4,2 г (28,3 ммоль) декагидрохинолина и смесь перемешивают при комнатной температуре в течение 18 ч. Затем смесь обрабатывают водой и AcOEt, органическую фазу отделяют и водную фазу экстрагируют еще раз AcOEt. Органические фазы объединяют и последовательно промывают насыщенным раствором NaHCO3, 1 н. HCl и насыщенным раствором соли. Затем смесь сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем с использованием в качестве элюента смеси (50:1) ДХМ:МеОН, с получением 600 мг тиольного промежуточного соединения IVp.1. Промежуточное соединение IVp.2. 3-Меркапто-1-(октагидроизохинолин-2-ил)пропан-1-он Получают по методике, описанной для промежуточного соединения IVp.1. Способ В. Время удерживания: 3,59/3,72 мин, m/z: 228/228. Промежуточное соединение IVp.3. 4-Меркапто-1-(октагидрохинолин-1-ил)бутан-1-он 1,5 мл декагидрохинолина (10 ммоль) и 10 мг камфорсульфоновой кислоты добавляют к раствору,полученному из 0,9 мл (10 ммоль) -тиолактона в 80 мл толуола. Полученную смесь перемешивают при 100 С в течение 6 ч. Затем растворитель выпаривают при пониженном давлении и полученный остаток очищают с применением хроматографии на колонке с силикагелем, с применением в качестве элюента смеси (50:1) ДХМ:МеОН, с получением 1,5 г тиольного промежуточного соединения IVp.3. Способ В. Время удерживания: 3,75 мин, m/z: 242. Промежуточное соединение IVp.4. 4-Меркапто-1-(октагидроизохинолин-2-ил)бутан-1-он Получают по методике, описанной для промежуточного соединения IVp.3. Способ В. Время удерживания: 3,75/3,87 мин, m/z: 242/242. Пример Ia.1. N-бицикло[2.2.1]гепт-2-ил-3-(октагидроизохинолин-2-ил)-3-оксопропионамид 43 мкл (0,31 ммоль) Et3N, 29 мг (0,21 ммоль) НОВТ, 41 мг (0,21 ммоль) EDC и 18,6 мкл (0,16 ммоль) 2-аминонорборнана добавляют к раствору 32 мг (0,14 ммоль) кислого промежуточного соединения IVa.6 в 2 мл AcOEt. Полученный раствор перемешивают в течение 18 ч. Затем раствор обрабатывают водой и добавляют еще AcOEt, органическую фазу отделяют и водную фазу экстрагируют еще раз большим количеством AcOEt. Органические фазы объединяют и последовательно промывают насыщенным NaHCO3,1 н. HCl и насыщенным раствором соли. Затем сушат над безводным Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Получают 27 мг соединения, идентифицированного как примерIa.1. Способ А. Время удерживания: 6,76/6,84 мин, m/z: 319/319. Следующие примеры получают по методике примера Ia.1:
МПК / Метки
МПК: A61K 31/472, C07D 295/104, A61K 31/4709
Метки: ингибиторы, типа, 11β-гидроксистероидной, дегидрогеназы
Код ссылки
<a href="https://eas.patents.su/30-20794-ingibitory-11beta-gidroksisteroidnojj-degidrogenazy-tipa-1.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 11β-гидроксистероидной дегидрогеназы типа 1</a>
Предыдущий патент: Способ электрохимического отделения водорода из реакционной смеси
Следующий патент: Генетические маркеры, ассоциированные с ответом на интерферон-альфа
Случайный патент: Уплотнительное устройство












