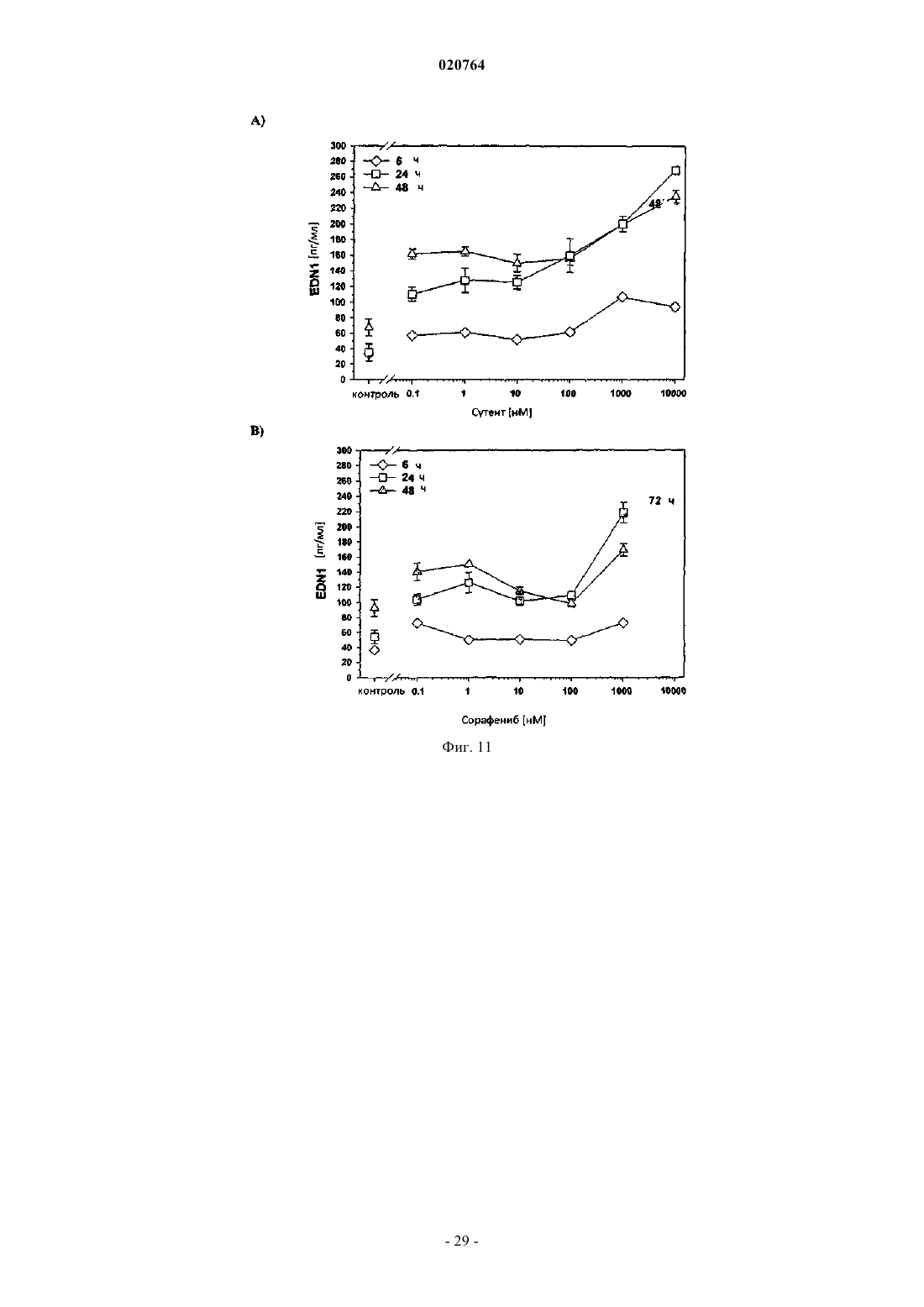
Биомаркеры для ингибиторов с антиангиогенной активностью
Формула / Реферат
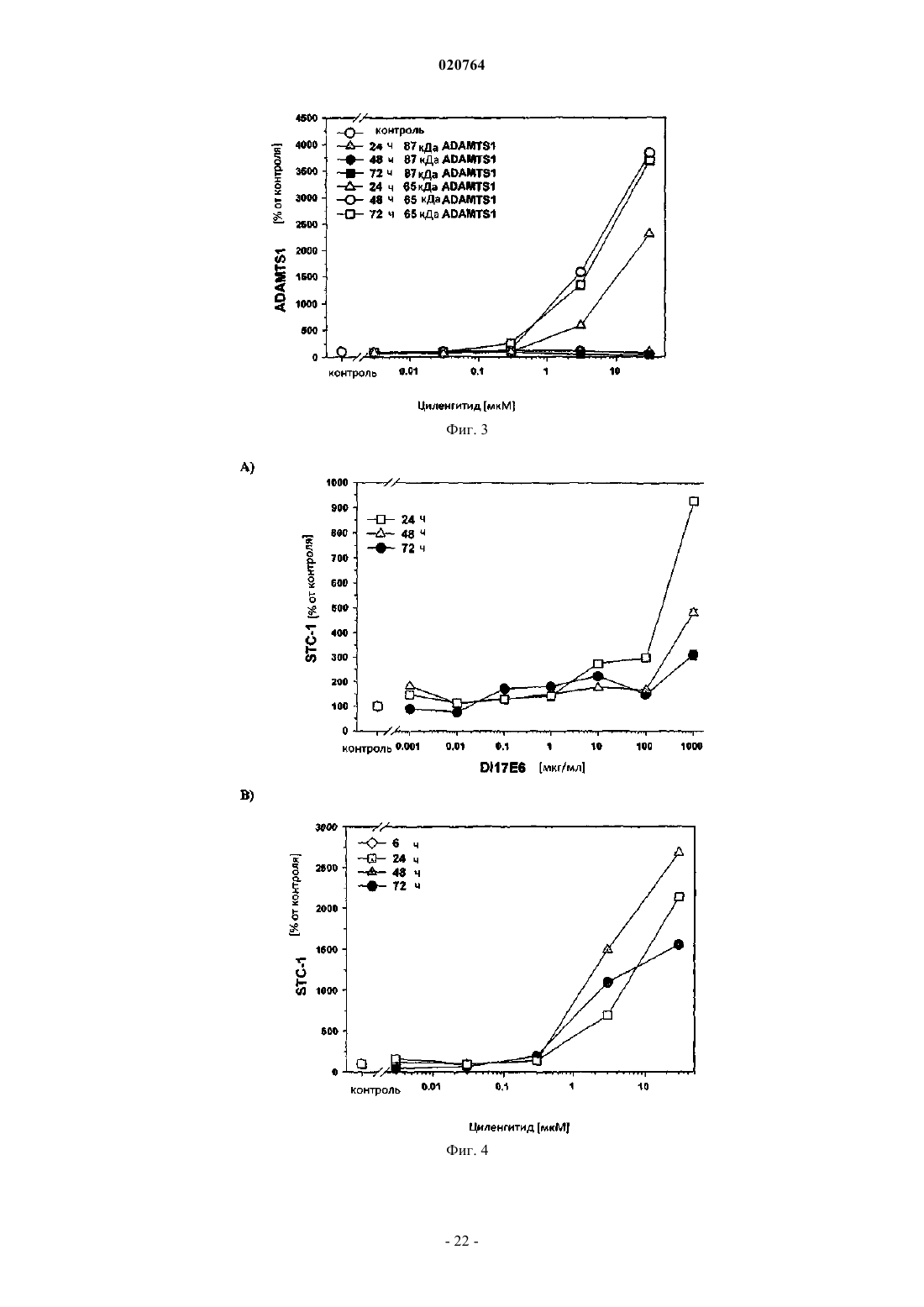
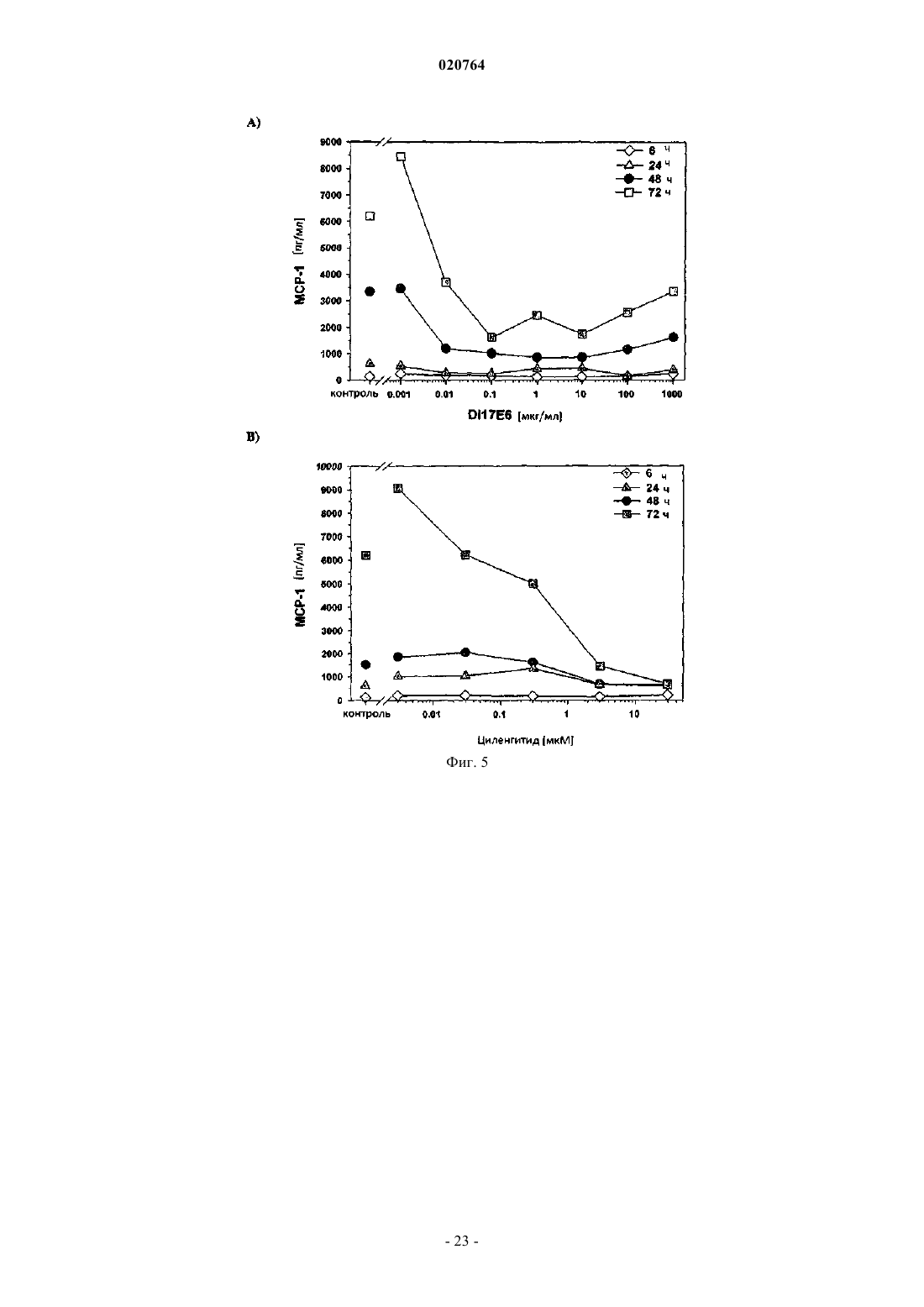
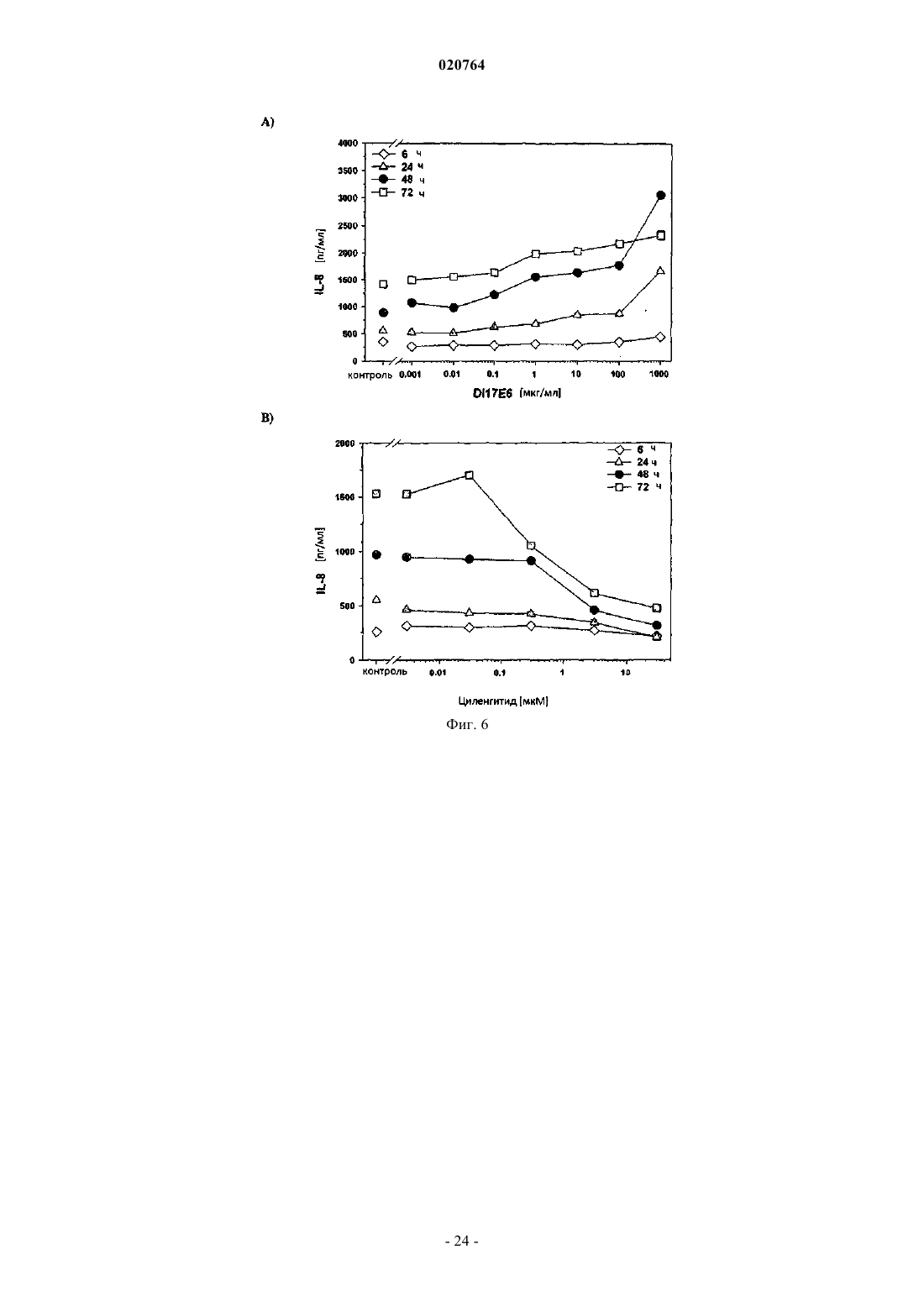
1. Ex vivo способ измерения влияния ингибитора альфа(v)-интегрина на ангиогенез и/или терапевтическую эффективность такого ингибитора против заболевания, ассоциированного с ангиогенезом, где ингибитор представляет собой mAb DI-17E6 или RGD пептид циленгитид с помощью по крайней мере одного гена селективного биомаркера или его генного продукта, выбранных из группы, которая состоит из ADAMTS1, STC1, EDN1, МСР1, IL-8, PDGF-BB, CRP, CD40 лиганда и IL-6, при котором
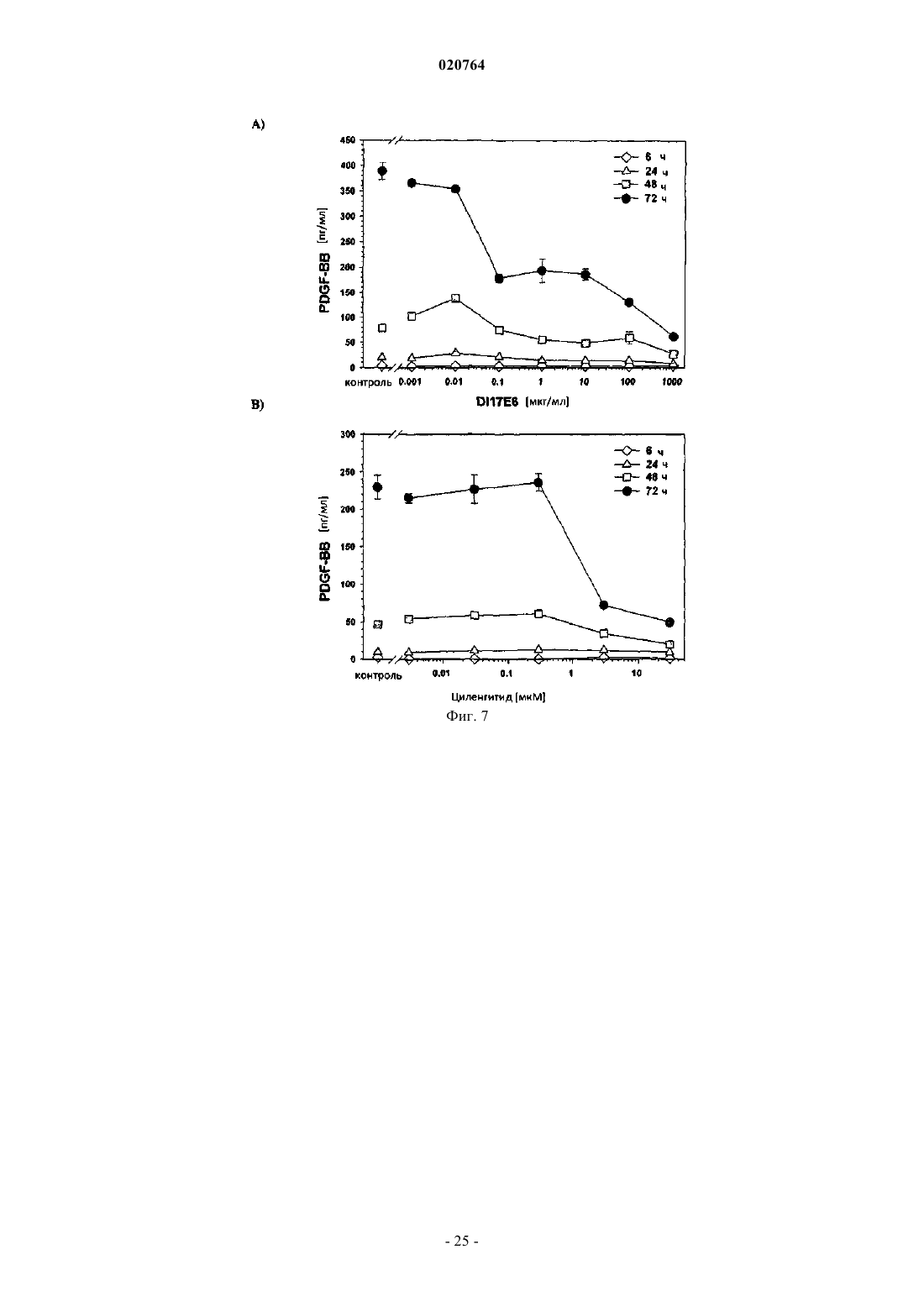
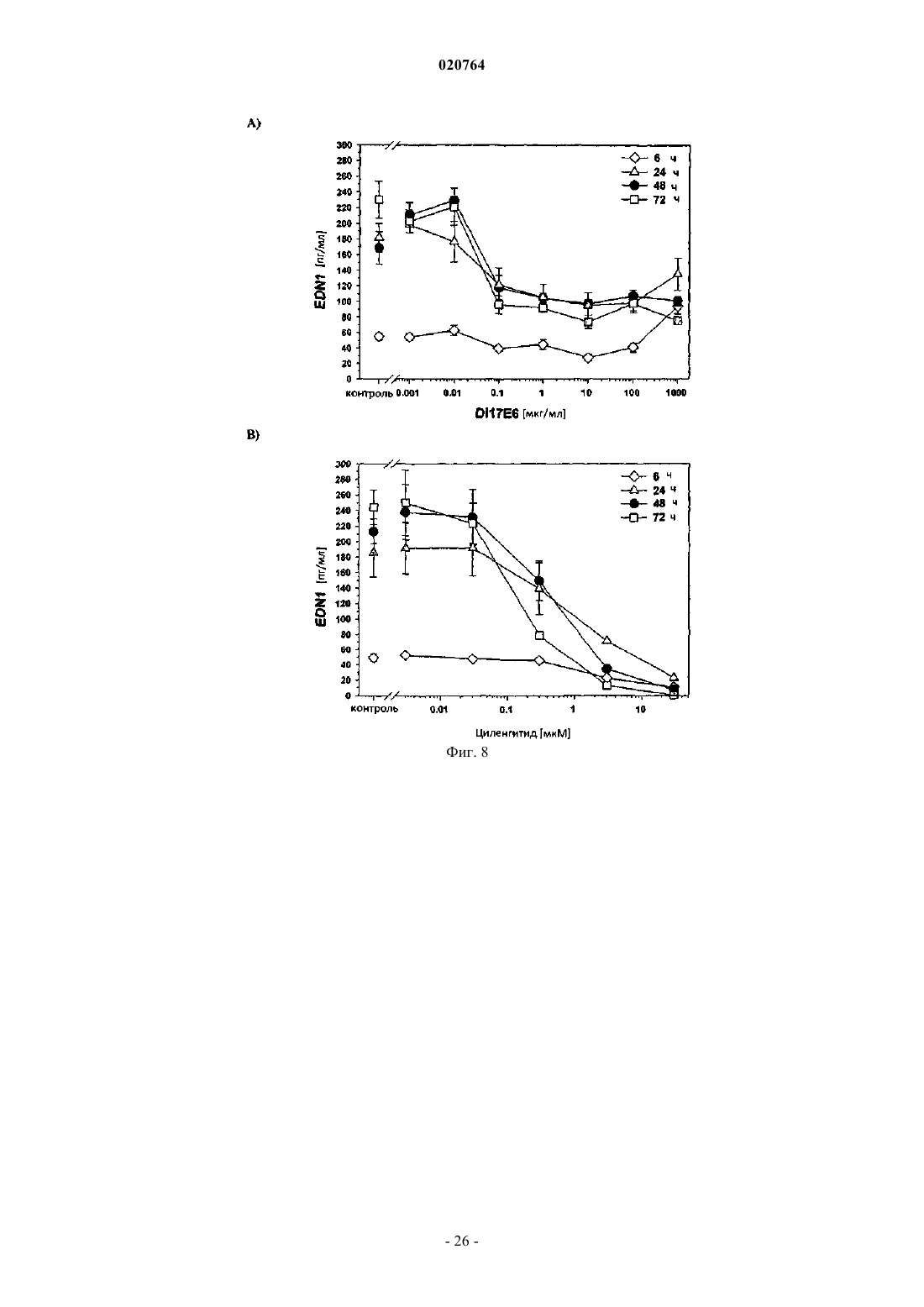
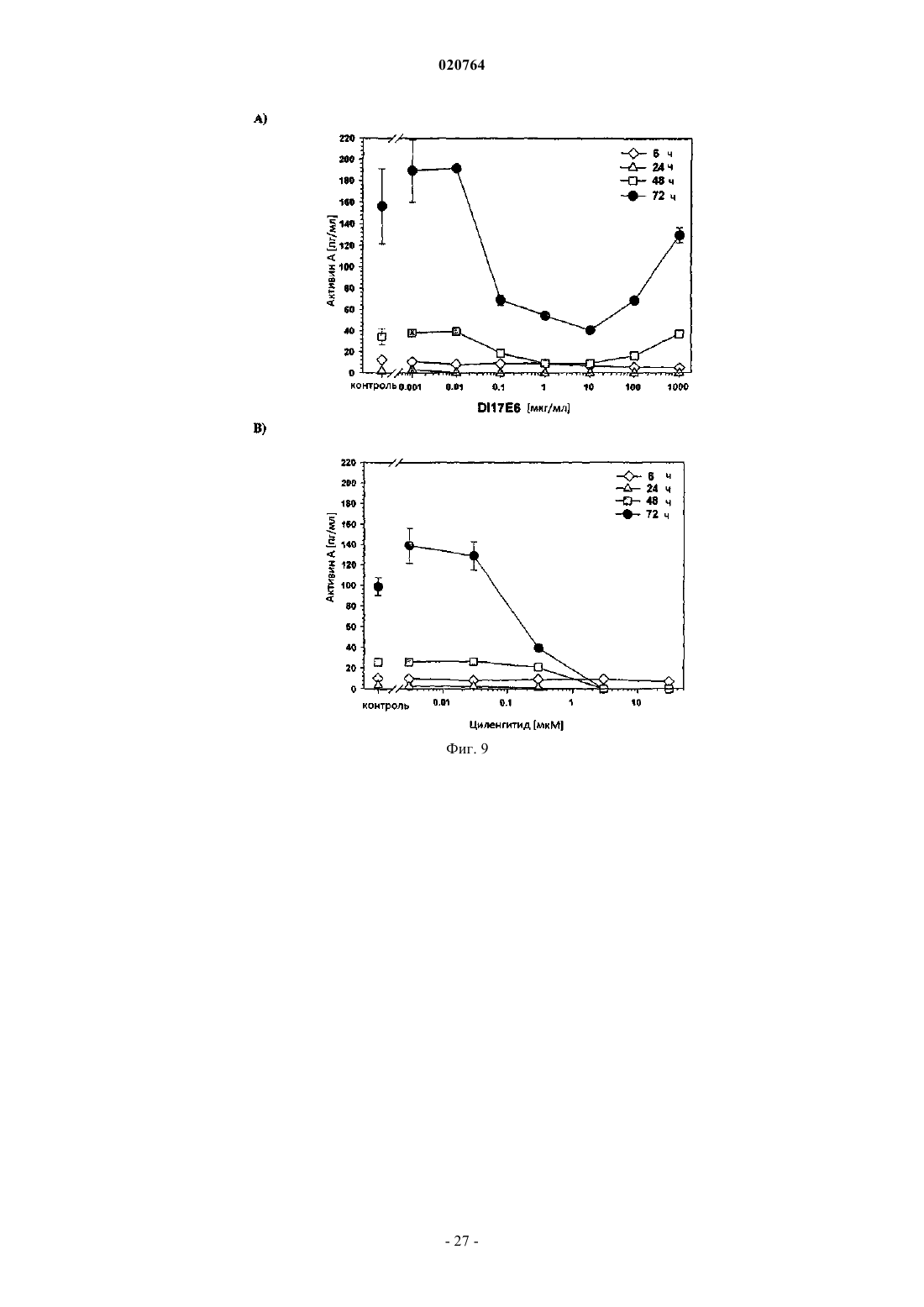
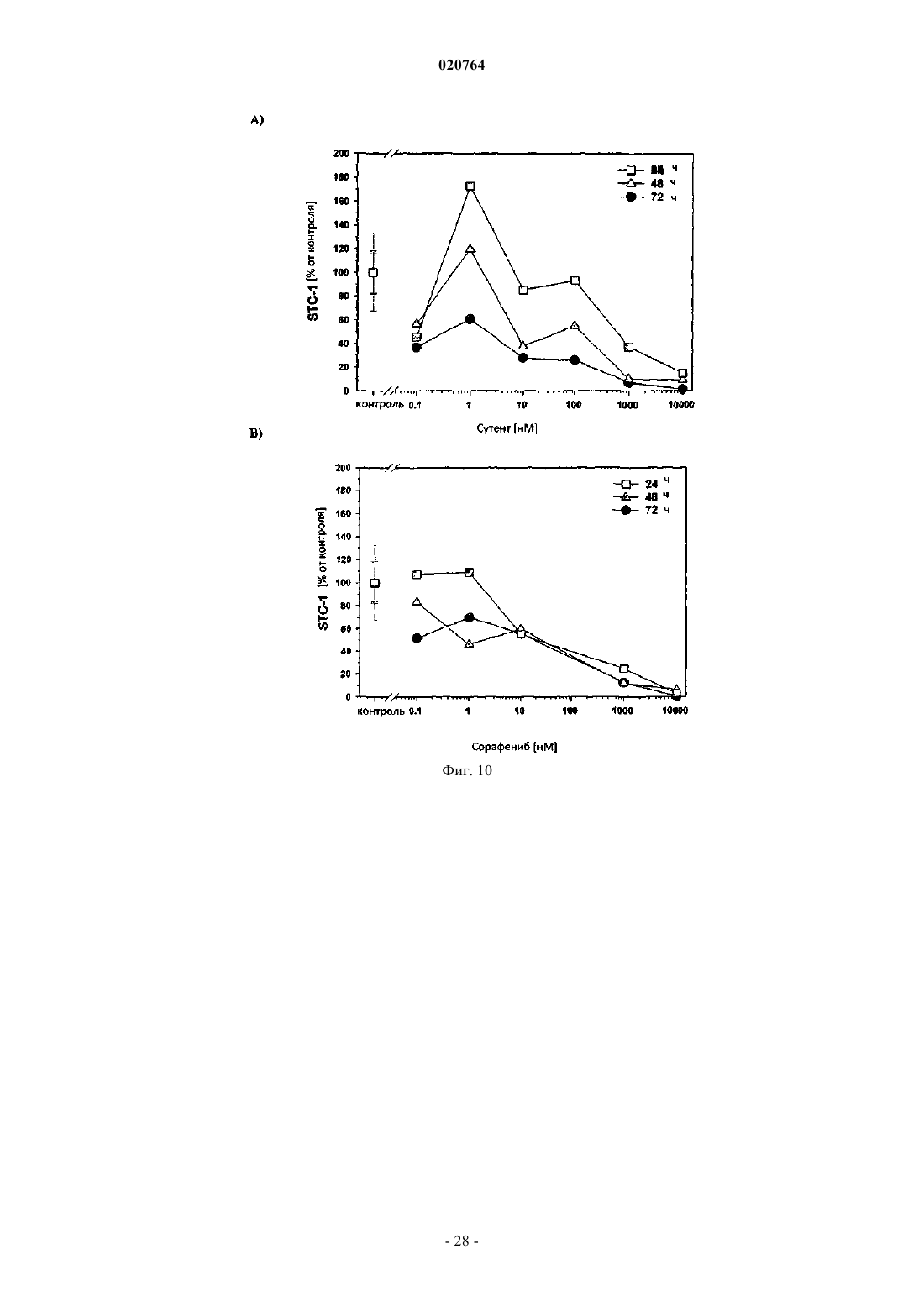
(i) в результате введения соответствующего ингибитора интегрина ADAMTS1 и STC1 подвергаются повышающей регуляции, а МСР1, INHBA, EDN1 и PDGF-BB подвергаются понижающей регуляции;
(ii) в результате введения циленгитида IL-6 подвергается понижающей регуляции и
(iii) в результате введения DI-17Е6 IL-6, IL-8 и CRP подвергаются повышающей регуляции, a CD40 лиганд подвергается понижающей регуляции,
причем способ включает следующие этапы:
(a) измерение с помощью технических средств и/или устройств базовой линии концентрации и/или статуса модификации по крайней мере одного выбранного биомаркера в образце жидкости или ткани организма, в соответствии с чем образец получают от индивидуума, который не подвергался обработке с помощью указанного ингибитора;
(b) измерение с помощью технических средств и/или устройств концентрации и/или статуса модификации указанных выбранных биомаркеров в образце (а), полученном от индивидуума, который подвергался обработке с помощью указанного ингибитора, или в образце (а), который на последующем этапе подвергался обработке с помощью указанного ингибитора;
(c) измерение с помощью технических средств и/или устройств различий между концентрациями и/или статусами модификации выбранных биомаркеров, полученных с использованием этапов (а) и (b);
(d) определение из указанных различий, полученных на этапе (с), одного или более из следующих свойств или параметров ингибиторов:
фармакодинамическое влияние на молекулярную мишень и на соответствующие пути передачи сигнала, связанные с молекулярной мишенью;
влияние на ангиогенез;
эффективность лечения и клинического выхода у пациента с заболеванием, ассоциированным с ангиогенезом,
и, необязательно,
(е) повторение этапов (а)-(d) до тех пор, пока не будут получены желаемые свойства/параметры, что, таким образом, позволяет осуществлять оценку клинических мероприятий и активностей в отношении влияния на ангиогенез или терапевтическую эффективность, безопасность, прогноз или дозировку указанного ингибитора или на связанное с ангиогенезом заболевание у индивидуума.
2. Ex vivo способ по п.1, где взятый образец жидкости организма представляет собой кровь, плазму, сыворотку, лимфу, мочу, слезы, синовиальную жидкость, раневую жидкость и/или цереброспинальную жидкость.
3. Способ по п.1, где образец ткани включает больную или здоровую ткань.
4. Способ по п.1, где образец ткани является выбранным из группы, состоящей из раковой ткани, кожной ткани и/или синовиальной ткани.
5. Ex vivo способ по п.1, где из взятого образца ткани получают эндотелиальные клетки.
6. Способ по п.5, где эндотелиальные клетки культивируют при лабораторных условиях после того, как они были получены от индивидуума и приготовлены из образца ткани, где по крайней мере один биомаркер определяют из среды для культивирования клеток или экстракта указанных клеток.
7. Способ по любому из пп.1-6, где образец эндотелиальных клеток и/или жидкостей организма имеет происхождение от здорового и/или больного индивидуума, страдающего от опухолевого расстройства и/или другого заболевания, ассоциированного с ангиогенезом.
8. Способ по любому из пп.1-7, где заболевание, ассоциированное с ангиогенезом, представляет собой рак или связанное с раком заболевание.
9. Применение гена биомаркера или его генного продукта, выбранных из группы, состоящей из ADAMTS1, STC1, EDN1, МСР1, IL-8, PDGF-BB, CRP, CD40 лиганда и IL-6, для оценки и прогнозирования влияния ингибитора альфа(v)-интегрина mAb DI-17E6 или RGD пептида циленгитида на ангиогенез в анализе на основе клеток или эффективности и/или дозирования ингибитора ex vivo, при котором:
(i) в результате введения соответствующего ингибитора интегрина ADAMTS1 и STC1 подвергаются повышающей регуляции, а МСР1, INHBA, EDN1 и PDGF-BB подвергаются понижающей регуляции;
(ii) в результате введения циленгитида IL-6 подвергается понижающей регуляции и
(iii) в результате введения DI-17E6 IL-6, IL-8 и CRP подвергаются повышающей регуляции, а CD40 лиганд подвергается понижающей регуляции.
10. Применение ингибитора интегрина DI-17E6 для получения лекарственного средства для лечения ракового заболевания или другого заболевания, ассоциированного с ангиогенезом у пациента, при котором лечение является терапевтически эффективным, а пациент восприимчивым, где в образце жидкости или ткани тела пациента экспрессия по меньшей мере одного гена селективного биомаркера или его генного продукта, выбранного из группы, состоящей из ADAMTS1, STC1, IL-8, IL-6, EDN1, МСР1, PDGF-BB, CRP и CD40 лиганда, подвергается понижающей или повышающей регуляции и гены биомаркера или генного продукта ADAMTS1, STC1, IL-8, IL-6 и CRP подвергаются повышающей регуляции, а гены биомаркера или генного продукта МСР1, EDN1, PDGF-BB и CD40 лиганда - понижающей регуляции после введения ингибитора.
11. Применение ингибитора интегрина и RGD пептида циленгитида для получения лекарственного средства для лечения ракового заболевания или другого заболевания, ассоциированного с ангиогенезом у пациента, при котором лечение является терапевтически эффективным, а пациент восприимчивым, где в образце жидкости или ткани тела пациента экспрессия по меньшей мере одного гена селективного биомаркера или его генного продукта, выбранного из группы, состоящей из ADAMTS1, STC1, IL-8, IL-6, EDN1, MCP1, PDGF-BB, CRP и CD40 лиганда, подвергается понижающей или повышающей регуляции и гены селективного биомаркера или генного продукта ADAMTS1 и STC1 подвергаются повышающей регуляции, а гены селективного биомаркера или генного продукта МСР1, EDN1, PDGF-BB и IL-8 - понижающей регуляции после введения ингибитора.

Текст
БИОМАРКЕРЫ ДЛЯ ИНГИБИТОРОВ С АНТИАНГИОГЕННОЙ АКТИВНОСТЬЮ Изобретение относится к способу для оценки эффекта ингибиторов интегрина и малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, на ангиогенез путем применения некоторых идентифицированных биомаркеров. Данный способ является весьма выгодным для определения эффективности ингибиторов интегрина и малой молекулы ингибитора мультикиназы,направленной на сайт АТФ, которые в основном используются для лечения заболевания,ассоциированного с ангиогенезом, такого как рак. В частности, изобретение относится к биомаркерам, связанным с ангиогенезом, которые являются предпочтительно доступными в жидкостях организма и, таким образом, позволяют осуществлять анализ целевой модуляции неинвазивным путем. Также раскрывается применение указанных биомаркеров для скрининга соединений с активностью ингибирования интегрина.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область, к которой относится изобретение Изобретение относится к способу для оценки влияния ингибиторов интегрина и малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, на ангиогенез путем применения определенных идентифицированных биомаркеров. Этот способ является особенно предпочтительным для определения эффективности ингибиторов интегрина и малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, которые в основном используются для лечения ассоциированных с ангиогенезом заболеваний,таких как рак. В частности, изобретение относится к биомаркерам, связанным с ангиогенезом, которые преимущественно являются доступными в жидкостях организма и, таким образом, позволяют осуществлять анализ целевой модуляции неинвазивным путем. Раскрывается также применение указанных биомаркеров для скрининга соединений с активностью ингибирования интегрина. Предпосылки создания изобретения Термин ангиогенез обычно применяется к образованию новых кровеносных сосудов из ранее существующей сосудистой системы. Пролиферация эндотелиальных клеток, подвергающихся синтезу ДНК,представляет собой общий признак ангиогенного микроваскулярного сосудистого спраутинга, в то время как обширное образование ответвлений в основном требует миграции эндотелиальных клеток. Ангиогенез представляет собой фундаментальный процесс, который контролируется спектром антиогенных факторов и ингибиторов. Активаторы пролиферации и миграции эндотелиальных клеток, главным образом,представляют собой лиганды рецептора тирозинкиназы, такие как фактор роста эндотелия сосудов(VEGF), факторы роста фибробластов (FGF), фактор роста тромбоцитов (PDGF) и эпидермальный фактор роста (EGF), но также могут иметь весьма различное происхождение, такое как происхождение от лизофосфатидов (LPA) (Bergers et al. (2003), Nature Reviews. 3, p. 401-410). EGF оказывает стимулирующее воздействие на VEGF, FGF и интерлейкин-8 (IL-8), в то время как LPA оказывает стимулирующее воздействие на уровни VEGF. Первый описанный ангиогенный ингибитор представлял собой тромбоспондин-1, который модулирует пролиферацию и подвижность эндотелиальных клеток. Примечательно,что многие ингибиторные молекулы, такие как статины, имеют происхождение от больших белков, которые не оказывают влияния на ангиогенез, например ангиостатин, фрагмент плазминогена, который связывается с АТФ синтазой и аннексином III, а также эндостатин, тумстатин и канстатин (фрагменты коллагенов, которые связываются с интегринами). В общем случае уровни активаторов и ингибиторов диктуют, будет ли эндотелиальная клетка находиться в покоящемся или ангиогенном состоянии. Предполагается, что изменения в ангиогенном балансе служат промежуточным звеном в ангиогенном переключении. Физиологическая роль ангиогенеза заключается в развитии, воспроизведении и репарации клеток,тканей и органов. Патологический ангиогенез является необходимым для опухолей и их метастазов для роста свыше микроскопических размеров, и он может вызывать кровотечение, повреждение сосудов и разрушение тканей. Последствия патологического ангиогенеза могут отвечать, непосредственно или опосредованно, за симптомы, инвалидизацию или смерть, ассоциированные с широким спектром ассоциированных с ангиогенезом заболеваний. Примеры таких заболеваний включают опухолевые заболевания, аутоиммунные заболевания, дегенерацию желтого пятна и атеросклероз, среди прочих. Кроме развития опухолей, ангиогенное переключение может возникать при различных стадиях пути развития опухоли, в зависимости от типа опухоли и окружающей среды. Однако неоваскуляризация обычно представляет собой необходимое условие развития опухоли. Несколько путей передачи сигнала являются вовлеченными в процесс ангиогенеза. VEGF играет центральную роль в васкулогенезе и ангиогенезе; среди всех ангиогенных факторов VEGF наиболее часто ассоциируется с развитием опухоли и метастазами. Предварительные данные дают возможность предположить, что сверхэкспрессия различных изоформ может оказывать дифференциальные воздействия на опухоль. Ключевые этапы ассоциированного с опухолью ангиогенеза включают секрецию VEGF опухолевыми клетками, который связывается с их рецепторами VEGFR2 и с нейропилином на эндотелиальных клетках (Folkman 2007, Nature Reviews, 6, p. 273-286). Наиболее обычными являются по крайней мере шесть других проангиогенных факторов из опухолей. Матриксные металлопротеиназы (ММ) высвобождаются из опухолевых клеток, а также из VEGF-стимулированных клеток. ММР мобилизует проангиогенные белки из стромы, а также выщепляет ангиогенный ингибитор эндостатин из коллагена 18 из стенки сосудов и участвует в расщеплении ангиогенного ингибитора ангиостатина из циркулирующего плазминогена. Опухолевые клетки секретируют ангиопоэтин 2 (ANGPT2), который конкурирует сANGPT1 за связывание с эндотелиальным TIE2 рецептором. Ангиопоэтин 1 (ANGPT1) экспрессируется множеством клеток, связывается с эндотелиальным TIE2 (который является также известным как TEK) рецептором и помогает поддерживать нормализованное состояние в кровеносных сосудах. ANGPT2 усиливает деградацию базальной мембраны сосудов и миграцию эндотелиальных клеток, способствуя, таким образом, спраутингу. PDGF, который секретируется многими опухолями, может оказывать повышающую регуляцию на свой собственный рецептор (PDGFR) на эндотелиальных клетках. Основной фактор роста фибробластов (bFGF) секретируется другими опухолями. В ответ на ростовые регуляторы,такие как VEGF и bFGF, эндотелиальные клетки оказывают повышающую регуляцию на интегрины. Ин-1 020764 тегрины представляют собой адгезивные молекулы клеточной поверхности, которые способствуют связыванию эндотелия с внеклеточным окружением, что является необходимым для поддержания жизнеспособности клеток и их чувствительности на ростовые регуляторные белки. Эндотелиальные клетки представляют собой наиболее зависимые от прикрепления клетки. Интегрины предполагаются как такие,которые поддерживают жизнеспособность эндотелиальных клеток во время периодических отделений,которые являются необходимыми для миграции к опухоли и для повышения их чувствительности к регуляторам роста, таким, как VEGF и bFGF. Интегрины играют ключевую роль в опухолевом ангиогенезе и метастазах, а также некоторых других зависимых от ангиогенеза заболеваний человека, подобных псориазу и ревматоидному артриту(Mousa S.A., Drugs of the Future, 1998; 23(1): 51-60). Они представляют собой адгезивные молекулы поверхности клеток, которые соединяют внеклеточную окружающую среду с цитоскелетом (Geiger В. et al.,Nat. Rev. Mol. Cell Biol. 2001; 2: 793-805). В дополнение к их структурным функциям, они представляют собой рецепторы для передачи сигналов, которые являются важными для клеточной адгезии, миграции,пролиферации и выживания. Сигнальный каскад, индуцированный интегринами, является множественным и зависимым от окружения клетки. Связывание лиганда с внеклеточным доменом интегрина индуцирует конформационные изменения и скопление интегрина, приводящие к активации сигнального каскада и пополнению очаговой адгезии мультипротеиновыми комплексами (Geiger В. et al., Nat. Rev. Mol. Cell Biol. 2001; 2: 793-805). Информация передается через разнообразные внутриклеточные протеинкиназы и молекулы адапторов,включая Ras, MAP киназу (MAPK), очаговую адгезивную киназу (FAK), Src, Rac/Rho/cdc42 GTP-азы,PKC и PI3K. С помощью этих молекул интегриновая передача сигнала тесно и кооперативно взаимодействует с рецепторами тирозинкиназы, передающими сигнал для регуляции выживания, пролиферации,адгезии и миграции (Giancotti F.G. et al., Science. 1999; 285(5430): 1028-32). Интегрины образуют гетеродимеры, состоящие из двух субъединиц, альфа и бета (Hynes R.O.Trends Cell Biol. 1999; 12: 33-37). Они дифференциально экспрессируются на различных типах клеток и узнают многочисленные лиганды белков внеклеточного матрикса, подобные коллагену, витронектину,фибронектину и ламинину. Поднабор интегринов, включая альфа(v)бета(3) и альфа(v)бета(5), узнает общий фрагмент в их лигандах, RGD последовательность, которая является присутствующей в лигандах,таких как витронектин, фибронектин, фибриноген (Ruoslahti E. Ann. Rev. Cell Dev. Biol. 1996. 12:697715).v5 интегрин специфически связывается с витронектином, в то время как v3 также связывается с другими макромолекулы промежуточного ECM. v3 связывает, например, лиганды, включая фибрин,фибриноген, ламинин, тромбоспондин, витронектин, фактор фон Виллебранда, остеоспонтин и костный сеалопротеин I. Специфическая роль клеточной адгезии этих интегринов, которую они играют в большом количестве клеточных взаимодействий в тканях, все еще подвергается исследованию, но является понятным, что существуют различные интегрины с различными биологическими функциями.v3 экспрессируется на высоком уровне на активированных эндотелиальных клетках, таких как опухолевые эндотелиальные клетки, но не на покоящихся эндотелиальных клетках и большинстве нормальных систем органов, что делает его приемлемой мишенью для антиангиогенной терапии (BrooksP.C. et al., Science 1994; 264: 569-71). v3 был впервые отмечен при раке как маркер, зависимый от развития, на клетках злокачественной меланомы. Он усиливал рост меланомы in vivo и выживание in vitro.v33 блокаторы реверсируют эти эффекты. В дальнейшем v3 был обнаружен в других опухолях,включая глиобластому, ренальную карциному, карциному яичника и др. v3 также широко сверхэкспрессируется в ЕС при разнообразных злокачественных образованиях. In vitro ангиогенные модели, активированные факторами роста, имеющими происхождение от опухолей, подвергаются сверхэкспрессии и требуют наличия v3 на разрастающейся сосудистой системе, в то время как блокада v3 и v5 может супрессировать ангиогенный фенотип. v5 был также продемонстрирован как такой, который поддерживает образование сосудистой системы, индуцированной некоторыми факторами роста, имеющими происхождение от опухолей. Ингибирование v5 может запускать апоптоз опухолевых клеток. Ингибиторы интегрина были предложены как фармацевтически активные начала у людей и ветеринарной медицине, в частности, для профилактики и лечения в основном заболеваний, ассоциированных с ангиогенезом. Они могут использоваться для лечения и профилактики заболеваний системы кровообращения, тромбоза, инфаркта миокарда, артериосклероза, воспалений, кровоизлияния в мозг, грудной жабы, опухолевых заболеваний, остеолитических заболеваний, в частности остеопороза, ангиогенеза, и заболеваний, имеющих происхождение от ангиогенеза, например диабетической ретинопатии глаз, макулярной дегенерации, миопии, окулярного гистоплазмоза, ревматоидного артрита, остеоартрита, рубеотической глаукомы, а также язвенного колита, болезни Крона, рассеянного склероза, псориаза и рестеноза после ангиопластики. Существует несколько ингибиторов интегрина в стадии клинической разработки для лечения рака,артрита и псориаза, такие как циленгитид, абегрин (витаксин, MEDI-522), CNTO95, DI-17E6 и волоциксимаб (Nemeth J.A. et al., Cancer Invest. 2007; 25(7): 632-646). Они антагонизируют взаимодействие ин-2 020764 тегрина с внеклеточным матриксом (ECM) и нарушают функцию эндотелиальных и опухолевых клеток. Указанные ингибиторы интегрина характеризуются различными специфичностями и механизмами действия. Абегрин, волоциксимаб, DI-17E6 и CNTO95 представляют собой антагонисты на основе моноклональных антител. Циленгитид представляет собой антагонистический циклический пептид(цикло-(Arg-Gly-Asp-DPhe-NMeVal, маскирующий RGD-фрагмент (ЕР 0770622). Циленгитид является нацеленным на v-интегрины, в частности на v3 и v5.US 6521593 раскрывает способы для ингибирования опухолевого роста в мозге при использовании циленгитида в качестве ингибитора v3/v5 интегрина. Изобретение включает такие указанные ингибиторы интегрина, демонстрирующие противоопухолевой эффект, которые зависят от антиангиогенеза. Дополнительно, указанный интегриновый антагонизм может индуцировать непосредственную гибель опухолевой клетки, которая является независимой от антиангиогенеза. WO 02/41910 относится к применению циленгитида в качестве ингибитора v3/v5 интегрина для лечения заболеваний глаз у пациента, возникших в результате ангиогенеза. Моноклональное мышиное антитело 17 Е 6 специфически ингибирует субъединицу v-интегрина клеток человека, которые несут интегриновый рецептор. Мышиное IgG1 антитело является описанным,например, Mitjans et al. (1995; J. Cell Sci. 108, 2825) и в патентах США 5985278 и ЕР 719 59. Мышиное 17 Е 6 получали от мышей, иммунизированных с помощью очищенного и иммобилизованного на сефарозе человеческого v3. Лимфоциты селезенки от иммунизированных мышей сливали с клетками мышиной миеломы, и один из полученных гибридомных клонов вырабатывал моноклональное антитело 17 Е 6. DI-17E6 (CAS No: 1105038-73-0) представляет собой антитело, обладающее биологическими характеристиками моноклонального мышиного антитела 17 Е 6, но улучшенными свойствами, прежде всего,в отношении иммуногенности у людей. Полная аминокислотная последовательность вариабельного и константного участка этого модифицированного антитела является представленной на фиг. 1 и вWO 2009/010290. Ингибиторы тирозинкиназы, например, против VEGF и VEGFR были усовершенствованы в рамках применения их в способах антиангиогенной терапии. Ингибиторы тирозинкиназы VEGFR имеют низкий молекулярный вес, АТФ-маскирующие белки, которые связываются с каталитическим сайтом связывания АТФ домена тирозинкиназы VEGFR, что приводит к блокированию внутриклеточной передачи сигнала (Morabito et al. 2006 The Oncologist. 11: 753-764). Некоторые из этих агентов в настоящее время находятся на различных фазах клинической разработки. Большие рандомизированные исследования фазыII продемонстрировали эффективность сунитиниба и сорафениба в лечении пациентов, страдающих от гастроинтестинальных стромальных опухолей (GIST) и ренального рака, устойчивых к стандартным способам терапии, соответственно. Сунитиниб (SU011248) представляет собой пероральный ингибитор тирозинкиназы с небольшим молекулярным весом, который демонстрирует мощную антиангиогенную и противоопухолевую активность (O'Farrell A.M. et al., 2003. Blood. 101: 3597-3605). Он представляет собой небольшую молекулу конкурентного ингибитора, направленного на сайт АТФ. Ингибиторы тирозинкиназы, такие как SU6668 и 8115416(семаксиниб), демонстрируют слабые фармакологические свойства и ограниченную эффективность; таким образом, сунитиниб был рационально смоделирован и выбран в соответствии с его высокой биодоступностью и его эффективностью в наномолярном интервале против антиангиогенного рецептора тирозинкиназы (RTK) - рецептора фактора роста сосудистого эндотелия (VEGFR) и рецептора фактора роста тромбоцитов (PDGFR). Сунитиниб ингибирует другие тирозинкиназы, включая KIT, FLT3, колониестимулирующий фактор 1 (CSF-1), и RET, который является вовлеченным в ряд злокачественных перерождений, включая мелкоклеточный рак легких, стромальные опухоли желудочно-кишечного тракта(GIST), рак молочных желез, острую миелогенную лейкемию, множественные эндокринные неоплазии типов 2 А и 2 В и наследственный медуллярный рак щитовидной железы. Сунитиниб продемонстрировал стабильную противоопухолевую активность в предклинических исследованиях, которая приводит не только к ингибированию опухолевого роста, но и к регрессии развития опухоли в моделях рака толстого кишечника, немелкоклеточного рака легких, меланомы, ренальной карциномы и карциномы чешуйчатых клеток, что является ассоциированным с ингибированием VEGFR и PDGFR фосфорилирования. Клиническая активность была продемонстрирована в нейроэндокринных железах, толстом кишечнике и при раке молочной железы в фазе II исследований, в то время как определенная эффективность была продемонстрирована в случае запущенной карциномы ренальных клеток и в случае устойчивых к иматинибуGIST, что привело к одобрению сунитиниба со стороны Управления по продовольствию и лекарствам США для лечения этих двух заболеваний. Исследования, изучающие сунитиниб, взятый отдельно и в комбинации с другими химиотерапиями, в различных типах опухолей продолжаются. Клинический сопоставительный анализ этих ингибиторов, которые представляют собой небольшие молекулы членов семейства RTK домена, расщепляемого киназой, будет приводить к дополнительным знаниям, относящимся к биологии, потенциальным биомаркерам и клиническому применению агентов, которые являются нацеленными на многочисленные пути передачи сигнала в опухолевых, стромальных и эндотелиаль-3 020764 ных компартментах. Сорафениб представляет собой новую биарильную мочевину, он изначально разрабатывался в качестве специфического ингибитора пути передачи сигнала Raf киназы (Morabito et al. 2006, The Oncologist, 11: 753-764). Последующими исследованиями было показано, что это соединение также ингибирует некоторые другие тирозинкиназы, вовлеченные в развитие опухоли, включая VEGFR. Ксенографтные модели рака толстого кишечника, молочных желез и немелкоклеточного рака легких (NSCLC), которые подвергались лечению с помощью сорафениба, продемонстрировали значительное ингибирование опухолевого ангиогенеза, как измеряется с помощью анти-CD31 иммуноокрашивания. Большое рандомизированное исследование фазы II у пациентов с различными типами опухолей осуществляли при использовании сорафениба. Результаты были представлены для 202 пациентов с запущенной карциномой ренальных клеток. Последующее рандомизированное, плацебо-контролируемое исследование фазы III подтвердило эффективность сорафениба у пациентов с устойчивой к цитокину запущенной ренальной карциномой. Сорафениб хорошо переносился, характеризовался поддающимися коррекции побочными эффектами: сыпь (34%), диарея (33%), реакции на коже рук и ног (27%), утомляемость (26%) и гипертензия(11%). На основе этих результатов в декабре 2005 г. FDA объявило об одобрении сорафениба для пациентов с запущенными формами ренального рака. Кроме того, Европейская комиссия недавно предоставила сорафенибу статус лекарственного средства, способного обладать значительным эффектом при редких угрожающих жизни или инвалидизирующих заболеваниях, для лечения карциномы печеночных клеток. В фазе II исследования 43% пациентов, которые подвергались лечению с помощью сорафениба, испытывали стабильное заболевание в течение по крайней мере 4 месяцев, и дополнительно 9% пациентов испытывали уменьшение массы опухоли. В настоящее время клинические исследования фазы III оценивают эффективность сорафениба при карциноме печеночных клеток, метастатической меланоме иNSCLC; кроме того, осуществляются некоторые другие исследования фазы I/II при использовании сорафениба в сочетании с несколькими химиотерапевтическими агентами (иринотекан, дакарбазин) или молекулярно нацеленными агентами (гефитиниб) при запущенных формах опухоли, для максимизации терапевтического потенциала лекарственного средства. Антиангиогенная терапия, прежде всего, является нацеленной на активированные эндотелиальные клетки сосудов, например в опухоли. Это может быть достигнуто непосредственно путем предотвращения реакции эндотелиальных клеток на окружающую среду с помощью ингибирования интегринов так,как описано выше. Антиангиогенные способы терапии могут также воздействовать путем нейтрализации ангиогенных факторов, как это осуществляется с помощью бевацизумаба (см. ниже). Генетические вариации, например, ангиогенных факторов имеют последствия для клинического лечения заболеваний, ассоциированных с ангиогенезом. Например, индивидуумы с синдромом Дауна имеют в 1,6 более высокий уровень эндостатина, чем нормальные индивидуумы, по причине избыточного количества копий гена предшественника эндостатина. Они могут оказаться наиболее защищенными из всех людей от рака. Таким образом, отличия в ангиогенезе по причине генетической вариации должны учитываться в антиангиогенных способах терапии. Антиангиогенная терапия может оптимально требовать, чтобы эндотелиальные клетки подвергались воздействию стабильного состояния уровней ингибиторов в крови. Таким образом, часто дозирование может быть оптимальным для циклопептидных ингибиторов, таких как циленгитид. Однако моноклональные антитела, такие как D7E16, могут вводиться с большими интервалами по причине того, антитела имеют более длительный период персистенции. Опухоли могут становиться нечувствительными к антиангиогенной терапии, особенно если моноантиангиогенная терапия является нацеленной только на один ангиогенный белок (например, VEGF). При использовании анти-VEGF-терапии (такой как антитело к VEGF (бевацизумаб сосудистая система ранних опухолей уменьшается и опухолевый рост ограничивается. Однако в ретроспективных анализах продолжительное антиангиогенное лечение метастатических опухолей с помощью бевацизумаба не приводило к преимуществам. Несмотря на то что VEGF экспрессируется в 60% опухолей человека, большинство опухолей могут также экспрессировать от пяти до восьми других ангиогенных белков. Когда экспрессия супрессируется в течение длительного периода времени, то может возникать экспрессия другого ангиогенного белка (Dorrell et al. (2007), Proc. Natl. Acad. Sci, doi:10.1073/pnas.0607542104). Таким образом, по описанным выше причинам панель чувствительных и специфических биомаркеров, поясняющая связанные пути передачи сигнала, может оказать помощь в выборе антиангиогенных способов терапии. Кроме того, они могут поддержать диагноз микроскопической рецидивирующей опухоли даже до того момента, когда она может быть анатомически обнаружена. Кроме этого, слабоваскуляризированные опухоли будут ингибироваться с помощью значительно более низкой дозы ингибитора ангиогенеза, чем это требуется для высоковаскуляризированной опухоли Такие опухоли могут экспрессировать свои собственные ингибиторы ангиогенеза и могут быть чувствительными к более низкой дозе ингибитора ангиогенеза. Генетические вариации и многотипные ангиогенные процессы, например, в широком интервале типов опухолей и их развития требуют, среди прочих, широкой панели информативных биомаркеров для оптимизации и для индивидуализации антиангиогенной терапии. Также может быть возможным применять биомаркеры ангиогенеза для мониторинга прогрессии или регрессии определенного зависимого от ангиогенеза заболевания, которое является отличным от неопластического. Такие включают, например, атеросклероз, эндометриоз, болезнь Крона и ревматоидный артрит среди прочих. Краткое изложение сущности изобретения Настоящее изобретение основывается на различных опытах, которые подтверждают, что антиангиогенные терапевтические агенты требуют информативных молекулярных биомаркеров (Bertolini F. etal. Drug Discov Today. 2007; 12(19-20): 806-12). Указанные биомаркеры могут предпочтительно использоваться, например, для:(1) измерения статуса молекулярной мишени и фармакодинамических (PD) критических точек влияния лекарственного средства на мишень;(3) обнаружения наиболее приемлемых антиангиогенных лекарственных средств для индивидуальных пациентов;(4) обеспечения доказательства принципа целевой модуляции;(6) обеспечения рационального выбора дозы и режима проведения антиангиогенной терапии;(7) объяснения или прогнозирования клинических выходов. Несмотря на множество успехов в области молекулярных противораковых терапевтических средств, таких как трастузумаб и иматиниб, только некоторые онкологические лекарственные средства,которые поступили в клиники, доходят до маркетингового санкционирования. Применение молекулярных биомаркеров должно снижать их высокий уровень отсева, уменьшая, таким образом, затраты на разработку лекарственного средства и повышая вероятность получения инновационных и активных лекарственных средств для раковых пациентов. Такие молекулярные биомаркеры могли бы дополнить информацию, которая обеспечивается клеточными биомаркерами. Клеточные биомаркеры представляют собой, например, различные популяции эндотелиальных клеток, такие как циркулирующие эндотелиальные клетки и циркулирующие эндотелиальные предшественники, которые используются в качестве маркеров для ангиогенеза. Молекулярный биомаркер мог бы компенсировать недостатки клеточных биомаркеров, такие как субъективный подсчет популяций эндотелиальных клеток. Применение указанных клеточных биомаркеров требует намного больше работы при характеристике связанного с раком эндотелия (Bertolini et al. (2007), Drug discoverytoday 12, 806-812). Кроме того, методики получения изображений, такие как динамическое контрастное магнитно-резонансное исследование (DCE-MRI) как подход для измерения ангиогенеза, имеют некоторые существенные пределы для обычного применения. Эти методики являются дорогими и ограниченными центрами с соответствующим оборудованием. Настоящее изобретение касается способов оценки эффекта, эффективности, безопасности, прогноза и/или дозирования терапевтических агентов или лекарственных средств, которые представляют собой ингибиторы ангиогенеза, предпочтительно ингибиторы интегрина или малую молекулу ингибитора мультикиназы, направленной на сайт АТФ, для лечения пациентов, страдающих от заболеваний, связанных с ангиогенезом, предпочтительно рака. Настоящее изобретение дополнительно относится к способам оценки эффекта ингибиторов ангиогенеза, предпочтительно ингибиторов интегрина или малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, на ангиогенез как таковой. Настоящее изобретение также касается способов для скрининга соединений, модулирующих интегрин в моделях на основе клеток. В первом аспекте изобретение является направленным на способ для оценки влияния ингибитора ангиогенеза, предпочтительно интегрина или малой молекулы ингибитора мультикиназ, направленной на сайт АТФ, на ангиогенез с помощью специфических информативных молекулярных биомаркеров. Таким образом, изобретение, в частности, основывается на необходимости оценки эффективности ингибиторов ангиогенеза, которые будут применяться к индивидуумам, предпочтительно в контексте антиангиогенной терапии. Указанная антиангиогенная терапия будет применяться для того, чтобы лечить заболевание, ассоциированное с ангиогенезом, что описывается в разделе "Уровень техники". В другом аспекте изобретение является направленным на применение указанных информативных молекулярных биомаркеров для определения и прогнозирования эффективности такого ингибитора в диагностике и терапии пациента, страдающего от ангиогенеза, предпочтительно заболевания, связанного с интегрином. Существуют различные указания, которые должны учитываться при разработке информативных молекулярных биомаркеров, которые будут оценивать эффективность ингибиторов ангиогенеза, вводимых индивидууму в рамках антиангиогенной терапии. Например, поскольку антиангиогенные терапии могут назначаться индивидуумам, страдающим от различных видов ассоциированных с ангиогенезом заболеваний, и различные виды тканей и/или органов затрагиваются заболеванием, то является сложным и даже невозможным по медицинским причинам получить достаточное количество биопсии для анализа молекулярных биомаркеров. Кроме того, если ин-5 020764 гибиторы ангиогенеза используются, например, для нацеливания на метастазирующую опухоль у индивидуума, то, для того чтобы проанализировать эффект указанных ингибиторов, будут необходимыми биопсии различных целевых тканей. Таким образом, оценка зависимого от ангиогенеза развития опухоли благодаря лечению с помощью ингибиторов ангиогенеза будет требовать несколько иных образцов ткани. Кроме того, поскольку ангиогенез основывается на образовании новых кровеносных сосудов и большое количество этапов ангиогенеза вовлекает белки в системе циркуляции, успех антиангиогенной терапии не может быть оценен с помощью анализа появления или исчезновения молекулярных биомаркеров в определенной ткани. Таким образом, применение циркулирующих белков в качестве биомаркеров может давать информацию об успехе антиангиогенной терапии. Указанные циркулирующие белки могут определяться в жидкостях тела, и, таким образом, они будут предпочтительными для преодоления обсужденных выше недостатков. Выбранные ангиогенные факторы роста, такие как VEGF, bFGF и PLGF, были проанализированы в плазме крови после введения определенных антиангиогенных терапий (Jubb et al. 2006, NatureReviews, 6, 626-635). Однако показательная оценка ангиогенных факторов роста в плазме крови ограничивается по причине активного поглощения многих ростовых факторов из тромбоцитов и других клеток. Кроме того, опухолевые клетки экспрессируют различные уровни указанных ангиогенных факторов роста. Кроме того, благодаря сложности процесса ангиогенеза и сложности белковой циркуляции оценка нескольких единичных биомаркеров в образце не является эффективной для определения антиангиогенных терапий. Таким образом, панель определенных молекулярных биомаркеров, которые предпочтительно принадлежат к различным семействам белков и которые различным образом являются вовлеченными в ангиогенез или ассоциированные пути передачи сигнала, может восполнять отсутствие достаточных средств для мониторинга антиангиогенных лекарственных средств. Изобретение относится к некоторым молекулярным биомаркерам, которые предпочтительно секретируются из клеток ткани в окружающую их среду благодаря введению ингибиторов ангиогенеза индивидуумам и благодаря их связыванию с селективной мишенью. Предпочтительно, когда эти молекулярные биомаркеры могут секретироваться из клеток ткани в окружающую их среду и, как следствие, они могут определяться в жидкостях организма. Таким образом, жидкости организма, подвергнутого обработке указанными ингибиторами ангиогенеза, предпочтительно используются для анализа молекулярных биомаркеров. Биомаркеры, которые в соответствии с настоящим изобретением обнаружены как чувствительные к рецепторам, связанным с ангиогенезом, предпочтительно интегринам и мультикиназам, направленным на сайт АТФ, и ингибиторы этих рецепторов представляют собой следующие: Биомаркеры, которые являются предпочтительными в соответствии с изобретением в отношении их чувствительности к лечению с помощью некоторых специфических ингибиторов ангиогенеза, представляют собой ADAMTS1, STC1, EDN1, MCP1, IL-8, PDGF-BB, CRP, CD 40 лиганд и IL-6. Наиболее предпочтительные биомаркеры в соответствии с настоящим изобретением представляют собой ADAMTS1, STC1, EDN1 и IL-8 или их комбинацию. В предпочтительном воплощении молекулярные биомаркеры могут определяться в жидкостях организма, таких как кровь или плазма крови, лимфа, ликвор и/или моча. В особенно предпочтительном воплощении молекулярный биомаркер может определяться в крови и/или моче. В этом случае биомаркеры могут исследоваться легко, поскольку кровь и моча могут быть взяты неинвазивным путем. В предпочтительном воплощении данного изобретения ингибитор ангиогенеза является выбранным из ингибиторов интегрина. В более предпочтительном воплощении указанный ингибитор интегрина выбирают из ингибиторов альфа(v)-интегрина. В особенно предпочтительном воплощении указанный ингибитор интегрина является выбранным из DI-17E6 или его производной и/или циленгитида (цикло-(Arg-Gly-Asp-DPhe-NMeVal. При этом мо-6 020764 лекулярные биомаркеры будут анализироваться в жидкостях организма, полученных от индивидуумов,подвергнутых лечению с помощью предположительно терапевтически эффективного количестваDI-17E6 или его производной и/или циленгитида. В другом предпочтительном воплощении указанные ингибиторы интегрина специфически связываются с интегринами на эндотелиальных клетках. Предпочтительно, когда молекулярные биомаркеры будут подвергаться повышающей регуляции в указанных эндотелиальных клетках и секретироваться в высоком количестве в среду, окружающую эндотелиальные клетки. В другом случае секреция указанных биомаркеров начинается благодаря обработке с помощью указанных ингибиторов. Окружающая эндотелиальные клетки среда включает просвет кровеносного сосуда и соседние ткани. В особенно предпочтительном воплощении молекулярные биомаркеры достигают потока крови после секреции из эндотелиальных клеток. В другом предпочтительном воплощении изобретения благодаря специфическому связыванию указанных ингибиторов интегрина с эндотелиальными клетками молекулярные биомаркеры будут подвергаться понижающей регуляции в указанных эндотелиальных клетках и секретироваться в низком количестве в окружающую эндотелиальные клетки среду. В другом случае секреция указанных биомаркеров прекращается благодаря обработке с помощью указанных ингибиторов. В одном воплощении данного изобретения указанные молекулярные биомаркеры, которые могут определяться в некоторых жидкостях организма благодаря лечению с помощью ингибиторов интегрина,представляют собой белки. Предпочтительно, когда указанные белки представляют собой растворимые белки сыворотки крови или белки, содержащиеся в плазме крови. В одном воплощении данного изобретения указанные белки могут определяться, главным образом,с помощью иммунологических методик, таких как вестерн-блоттинг, ELISA, Luminex, и родственных методик. Для целей настоящего изобретения содержание указанных биомаркеров, предпочтительно белков,количественно либо повышается, либо понижается в предпочтительной жидкости организма в ответ на лечение с помощью ингибиторов интегрина. В предпочтительном воплощении повышение или снижение количества указанного биомаркера благодаря лечению ингибиторами интегрина, охарактеризованные в многочисленных опытах, определяются значением р, не превышающим 0,01. В другом аспекте настоящего изобретения указанные биомаркеры, предпочтительно белки, модифицируются в ответ на лечение с помощью ингибиторов интегрина. Такие изменения могут включать изменение молекулярного размера белка, модификации, такие как гликозилирование в белке, и взаимодействия с отличными или теми же белковыми субъединицами. В другом аспекте данного изобретения измененная генная экспрессия указанных биомаркеров может определяться на уровне РНК. Таким образом, РНК будет экстрагироваться из образцов клеток ткани,полученной от индивидуума в ответ на лечение с помощью ингибиторов интегрина. Экспрессированные РНК транскрипты определенных биомаркеров будут подвергаться анализу с помощью известных профилирующих методик генной экспрессии, таких как технология определения генетической информации. Предпочтительно, когда образцы клеток ткани, которые взяты для экстракции РНК, имеют происхождение от эндотелиальных клеток. Предпочтительно, когда способ для оценки эффективности ингибиторов интегрина в антиангиогенных терапиях включает первое введение предположительно терапевтически эффективного количества ингибитора интегрина индивидууму. Предположение и определение терапевтически эффективного количества основываются, например, на предварительных предклинических и клинических исследованиях. Во-вторых, эффективность предположительно эффективного количества указанных ингибитора интегрина оценивается с помощью способов указанного изобретения. Определение указанной оценки приводится к ангиогенной терапии для дополнительных циклов при измененных условиях. В соответствии с одним воплощением настоящего изобретения биомаркеры являются предпочтительными кандидатами, которые являются ассоциированными с ангиогенезом и могут быть втянуты в пути передачи сигнала, связанные с интегриновыми рецепторами. Более предпочтительно, когда биомаркеры могут быть вовлечены в блокирование ангиогенеза после введения ингибиторов интегрина. Другой аспект изобретения касается разнообразия групп биомаркеров настоящего изобретения. Предпочтительным является, когда они не могут быть сгруппированы на основании высокой гомологии последовательности в одно семейство белков и не могут быть сгруппированы на основании физиологического соответствия в функциональную группу, как, например, ангиогенные факторы VEGF, EGF и PLGF и т.д. В другом аспекте данного изобретения для того, чтобы оценить антиангиогенный эффект лекарственного средства, биомаркеры могут использоваться отдельно, в комбинации с различными биомаркерами настоящего изоберетения или с другими биомаркерами ангиогенеза, которые определены за пределами настоящего изобретения. Дополнительно, результаты оценки молекулярных биомаркеров, полученные путем определения уровней белка в образцах, таких как жидкости организма, могут осуществляться при использовании результатов генной экспрессии, полученных путем определения уровней РНК в образцах, таких как эндо-7 020764 телиальные клетки. Указанное сравнение может быть полезным, поскольку молекулярный биомаркер в форме белкового транскрипта может, например, быть нестабильным в крови или моче по причине определенных физиологических обстоятельств. Во втором аспекте настоящего изобретения оно относится к способу для оценки эффекта ингибитора ангиогенеза с помощью молекулярных биомаркеров, в соответствии с чем способ включает следующие этапы. Образец ткани получали от индивидуума перед введением ингибиторов ангиогенеза, где из взятого образца ткани получают клетки, предпочтительно эндотелиальные клетки. Указанные клетки культивируют при определенных лабораторных условиях in vitro и позже обрабатывают с помощью ингибиторов ангиогенеза. Благодаря обработке с помощью ингибиторов ангиогенеза экспрессия и секреция биомаркеров может изменяться. Указанная измененная секреция может продолжаться в среде для культивирования клеток. Более подробно, эти молекулярные биомаркеры секретируются из указанных клеток в окружающую их среду, т.е. культуральную среду, благодаря обработке с помощью ингибиторов ангиогенеза. В результате этого они могут определяться в среде для культуры клеток. В этом случае молекулярные биомаркеры могут быть легко исследованы и подвергаться анализу, поскольку культуральную среду для культивирования клеток можно легко получить и подвергать обработке. В предпочтительном воплощении молекулярные биомаркеры будут подвергаться повышающей регуляции в эндотелиальных клетках и секретироваться до высокого количества в культуральную среду эндотелиальных клеток. В другом случае секреция указанных биомаркеров начинается благодаря обработке с помощью указанных ингибиторов. В другом предпочтительном воплощении изобретения молекулярные биомаркеры будут подвергаться понижающей регуляции в эндотелиальных клетках и секретироваться в более низком количестве в культуральную среду эндотелиальных клеток. В другом случае секреция указанных биомаркеров останавливается благодаря обработке с помощью указанных ингибиторов. Способ, который характеризуется указанными этапами, включает ингибитор ангиогенеза, который является предпочтительно выбранным из ингибиторов интегрина. В более предпочтительном воплощении указанный ингибитор интегрина является выбранным из альфа(v) ингибиторов интегрина. В особенно предпочтительном воплощении указанный ингибитор интегрина является выбранным из DI-17E6 или его производной и/или циленгитида. При этом молекулярные биомаркеры будут подвергаться анализу в культуральной среде для клеток, полученной в результате выращивания эндотелиальных клеток, обработанных с помощью предположительно эффективного количества DI-17E6 или его производной и/или циленгитида. В одном воплощении данного изобретения указанные биомаркеры, которые могут определяться в супернатантах благодаря обработке с помощью ингибиторов интегрина, представляют собой белки, как описано в предыдущих разделах. Для целей настоящего изобретения количество указанных биомаркеров, предпочтительно белков,либо повышается, либо понижается в супернатанте образца эндотелиальных клеток в ответ на обработку с помощью ингибиторов интегрина. В предпочтительном воплощении повышение или снижение определенного биомаркера благодаря обработке ингибиторами интегрина, охарактеризованного в определенных опытах, определяется с помощью значения р, не превышающего 0,01. В другом аспекте настоящего изобретения указанные молекулярные биомаркеры, предпочтительно белки, которые определяются в среде для культуры клеток, модифицируются так, как описано в предыдущих разделах. В другом аспекте данного изобретения изменение генной экспрессии указанных биомаркеров может определяться на уровне РНК путем экстракции РНК из эндотелиальных клеток благодаря обработке с помощью ингибиторов интегрина. Экспрессированные РНК транскрипты определенных биомаркеров могут, таким образом, подвергаться анализу с помощью известных профилирующих методик генной экспрессии, таких как технология определения генетической информации. Способ для оценки влияния ингибиторов интегрина на ангиогенез в указанной системе культуры клеток, который описывается в приведенном выше разделе, включает первое введение предположительно эффективного количества ингибитора интегрина в эндотелиальные клетки. Определение предположительно эффективного количества основывается, например, на предварительных предклинических и клинических исследованиях. Дополнительно, влияние введения предположительно эффективного количества указанного ингибитора интегрина анализируется с помощью молекулярного биомаркера, описанного в указанном изобретении. Определение указанной оценки осуществляется для определения или повторения антиангиогенной терапии. В другом аспекте способ для оценки влияния ингибиторов интегрина на ангиогенез в указанной системе культуры клеток, который описывается в приведенном выше разделе, включает первое введение диагностического количества ингибитора интегрина в эндотелиальные клетки. Определение диагностического количества основывается, например, на предварительных предклинических и клинических исследованиях. Дополнительно, влияние введения диагностического количества указанного ингибитора интегрина анализируется с помощью молекулярного биомаркера, описанного в указанном изобретении. Оценка указанного анализа приводится для дополнительных предклинических или клинических исследований. В соответствии с одним воплощением настоящего изобретения молекулярные биомаркеры, которые определяются в среде для культивирования клеток, являются предпочтительными кандидатами, которые описываются в следующем разделе. В другом аспекте данного изобретения для того, чтобы оценить антиангиогенный эффект лекарственного средства, биомаркеры могут использоваться отдельно, в комбинации с различными биомаркерами указанного изобретения или с другими биомаркерами ангиогенеза, которые определяются за пределами данного изобретения. Дополнительно, результаты оценки молекулярных биомаркеров, полученные путем определения уровня белка в среде для культуры клеток, могут осуществляться при использовании результатов генной экспрессии, полученных путем определения уровня РНК клеток в образцах клеток культуры. Кроме того, оценка эффектов ингибитора ангиогенеза с помощью молекулярных биомаркеров может осуществляться с помощью сочетанного анализа образцов ткани, или преимущественно жидкостей организма, полученных от индивидуумов, подвергнутых лечению с помощью ингибиторов интегрина, и описанного выше образца культуры клеток, обработанной ингибиторами интегрина, или преимущественно среды культивирования таких клеток. В дополнительном аспекте способы для оценки антиангиогенного эффекта ингибиторов интегрина и эффективности влияния указанных ингибиторов на заболевание, ассоциированное с ангиогенезом, как описывается в данном документе, также могут применяться для оценки антиангиогенного эффекта малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, и эффективности влияния указанных ингибиторов на ассоциированное с ангиогенезом заболевание. В предпочтительном воплощении малая молекула ингибитора мультикиназы, направленной на сайт АТФ, связывает и имитирует сайт связывания АТФ целевой киназы, где сайт связывания АТФ локализуется в каталитически активном сайте целевой киназы. Целевая киназа указанных ингибиторов мультикиназы предпочтительно включает различные рецепторные тирозинкиназы, такие как VEGFR, PDGFR, KIT, FLT3, CSF-1 и RET, а также серин/треонин внутриклеточные киназы RAF. В особенно предпочтительном воплощении молекула ингибитора мультикиназы, направленной на сайт АТФ, представляет собой сунитиниб и/или сорафениб. Кроме того, все способы указанного изобретения для оценки эффектов ингибитора ангиогенеза с помощью молекулярных биомаркеров и их применение могут быть предпочтительными для профилактики и лечения заболеваний, ассоциированных с ангиогенезом, которые являются описанными в разделе"Предпосылки создания изобретения". В дополнительном аспекте изобретение относится к способу оценки эффекта широкого спектра антиангиогенных лекарственных средств путем применения молекулярных биомаркеров в соответствии с указанным изобретением. Указанные биомаркеры могут использоваться для оценки влияния других антиангиогенных лекарственных средств на ангиогенез, которые не являются включенными или не связанными с антиангиогенными лекарственными средствами указанного изобретения. В другом аспекте помимо применения указанных биомаркеров для оценки ангиогенных лекарственных средств в контексте ангиогенной терапии, они могут также представлять интерес в раннем обнаружении. Способ, как указано в данном описании, может обеспечивать информацию об успехе антиангиогенной терапии следующим образом. Указанный способ может использоваться для определения и оптимизации эффективной дозы и/или эффективного режима антиангиогенного лекарственного средства, которое вводится пациенту, страдающему от заболевания, ассоциированного с ангиогенезом. Более подробно, эффективность антиангиогенной терапии, включающей, например, лечение пациента, страдающего от ассоциированного с ангиогенезом заболевания, с помощью антиангиогенного лекарственного средства, например, ингибитора интегрина в начальной дозировке, которая предполагается как эффективная,может быть оценена с помощью способа в соответствии с указанным изобретением. Если эффективность указанной антиангиогенной терапии оказывается, например, сниженной, то к указанному пациенту могут применяться измененные условиях, такие как вариация дозы и/или режима введения и/или выбора антиангиогенного лекарственного средства. Способ указанного изобретения может быть повторен для последующих циклов при измененных условиях антиангиогенной терапии до обнаружения оптимальной индивидуальной терапии для указанного пациента. В другом предпочтительном аспекте, если начальная дозировка антиангиогенного лекарственного средства, которая вводится пациенту, страдающему от антиангиогенного заболевания, оценивается как эффективная с помощью способа в соответствии с данным изобретением, то измененные условия могут включать снижение дозы или корректировку режима. Преимущества снижения дозы соединений, композиций, агентов и терапий, которые вводятся индивидууму, включают снижение частоты возникновения вредных побочных эффектов, ассоциированных с высокими дозировками. Вследствие этого способ терапии, как заявлено и описывается более подробно в примерах, может изменять используемое лекарствен-9 020764 ное средство и заменять его другим лекарственным средством, которое будет вызывать отличную модель биомаркера. Указанные биомаркеры могут также использоваться для исследования гомеостаза эндотелиальных клеток или ангиогенеза в общем. Оценка указанных биомаркеров может дать информацию в экспериментах, которые могут обеспечить получение лучшего представления об указанных физиологических процессах. В соответствии с другим аспектом настоящего изобретения данное изобретение обеспечивает способ скрининга соединения с возможной активностью модуляции активности интегрина. Указанный способ включает следующее:(a) определение базовой линии концентрации и/или статуса модификации по крайней мере одного выбранного биомаркера в образце жидкости и/или ткани организма, в соответствии с чем образец получают от индивидуума, который не подвергался обработке с помощью указанного ингибитора;(b) определение концентрации и/или статуса модификации указанных выбранных биомаркеров в образце (а), который подвергался обработке с помощью указанного ингибитора;(c) подсчет различий между концентрациями и/или статусом модификации выбранных биомаркеров, полученных с использованием этапов (а) и (b);(d) оценка или прогноз, полученные из указанных различий, являются показательными для молекулы, модулирующей интегрин с влиянием на ангиогенез и/или антиангиогенную эффективность в отношении заболевания, ассоциированного с ангиогенезом. В предпочтительном воплощении введение соединения, представляющего интерес, осуществляют при различных дозах, которые оценивают как находящиеся в интервале возможной интегринмодулирующей активности в отношении клеток, предпочтительно эндотелиальных клеток, для того, чтобы получить обработанные клетки. В предпочтительном воплощении среду для культивирования указанных обработанных клеток берут для анализа так, как описано в предыдущих разделах. В предпочтительном воплощении указанные биомаркеры, которые подвергают анализу и мониторингу в среде для культуры клеток в ответ на обработку с помощью указанных соединений для скрининга, представляют собой белки, как описано в предыдущих разделах. В предпочтительном воплощении повышение или снижение определенного биомаркера благодаря обработке с помощью соединений для скрининга, охарактеризованное в определенных опытах, определяют с использованием значения р, не превышающего 0,01. В другом аспекте настоящего изобретения указанные биомаркеры, предпочтительно белки, модифицируются в ответ на обработку с помощью указанных соединений для скрининга, как описано в предыдущих разделах. В другом аспекте данного изобретения изменение генной экспрессии указанных биомаркеров может определяться на уровне РНК путем экстракции РНК из клеток, обработанных с помощью соединений для скрининга. Экспрессированные РНК транскрипты определенных биомаркеров могут, таким образом, подвергаться анализу с помощью известных профилирующих методик генной экспрессии, таких как технология определения генетической информации. Таким образом, резюмируя вышесказанное, более подробно изобретение относится к следующему.Ex vivo способ для оценки влияния ингибитора ангиогенеза на ангиогенез и/или эффективности указанного ингибитора в отношении заболевания, ассоциированного с ангиогенезом, с помощью по крайней мере одного селективного биомаркера, где биомаркеры являются выбранными из генных продуктов, выбранных из группы, которая состоит из при этом способ включает следующие этапы:(a) определение базовой линии концентрации и/или статуса модификации по крайней мере одного выбранного биомаркера в образце жидкости или ткани организма, в результате чего образец получают от индивидуума, который не подвергался обработке с помощью указанного ингибитора;(b) определение концентрации и/или статуса модификации указанных выбранных биомаркеров в образце (а), полученном от индивидуума, который подвергался обработке с помощью указанного ингибитора, или в образце (а), который обрабатывают на последующем этапе с помощью указанного ингибитора;(c) подсчет различий между концентрациями и/или статусом модификации выбранных биомаркеров, полученных с использованием этапов (а) и (b);(d) оценка или прогноз, полученный из указанных различий, одного или более из следующих свойств ингибиторов: фармакодинамические влияния на молекулярную мишень и на соответствующие пути передачи сигнала, связанные с молекулярной мишенью,влияние на ангиогенез,эффективность обработки и клинический выход у пациента с заболеванием, ассоциированным с ангиогенезом. Соответствующий ex vivo способ, где взятый образец жидкости организма представляет собой кровь, плазму, сыворотку крови, лимфу, мочу, слезы, синовиальную жидкость, раневую жидкость и/или цереброспинальную жидкость. Соответствующий способ, где образец ткани включает больную или здоровую ткань. Соответствующий способ, где образец ткани является выбранным из группы, состоящей из раковой ткани, ткани кожи и/или синовиальной ткани. Соответствующий ex vivo способ, в котором из взятой ткани получают эндотелиальные клетки. Соответствующий способ, в котором эндотелиальные клетки культивируют при лабораторных условиях после того, как они были получены от индивидуума и приготовлены из образца ткани, где по крайней мере один биомаркер определяют из среды для культивирования клеток или экстракта указанных клеток. Соответствующий способ, в котором ингибитор ангиогенеза представляет собой ингибитор интегрина. Соответствующий способ, в котором ингибитор ангиогенеза представляет собой малую молекулу ингибитора мультикиназы, направленной на сайт АТФ. Соответствующий способ, в котором ингибитор интегрина представляет собой ингибитор интегрина альфа(v). Соответствующий способ, в котором ингибитор интегрина альфа(v) представляет собой антитело или его производную малую химическую молекулу RGD пептида. Соответствующий способ, в котором ингибитор интегрина альфа(v) представляет собой DI-17E6 или циленгитид. Соответствующий способ, в котором малая молекула ингибитора мультикиназы, направленной на сайт АТФ, представляет собой сунитиниб и/или сорафениб. Соответствующий способ, в котором образец эндотелиальных клеток и/или жидкостей организма имеет происхождение от здорового или больного индивидуума, страдающего от опухолевого заболевания и/или другого заболевания, ассоциированного с ангиогенезом. Соответствующий способ, в котором заболевание, ассоциированное с ангиогенезом, представляет собой опухоль или соответствующее заболевание или расстройство ангиогенеза. Соответствующий способ, в котором биомаркеры подвергаются понижающей регуляции или повышающей регуляции своего уровня и/или статуса модификации благодаря введению ингибиторов ангиогенеза. Соответствующий способ, в котором биомаркеры являются выбранными из группы, которая состоит из ADAMTS1, STC1, МСР-1, IL-8, EDN1, PDGF-BB, INHBA, IL-6, CRP, CD40 лиганда и/или ММР 9. Соответствующий способ, в котором биомаркер ADAMTS1 и/или STC1 подвергается повышающей регуляции благодаря введению по крайней мере одного ингибитора интегрина, как указано в данном описании. Соответствующий способ, в котором биомаркер MCP1, INHBA, EDN1 и/или PDGF-BB подвергается понижающей регуляции благодаря введению одного ингибитора интегрина, как указано в данном описании. Соответствующий способ, в котором биомаркер IL-8 подвергается понижающей регуляции благодаря введению циленгитида или сорафениба и подвергается повышающей регуляции благодаря введению DI-17E6 или сунитиниба. Соответствующий способ, в котором биомаркер IL-6 и/или CRP подвергается повышающей регуляции благодаря введению DI-17E6. Соответствующий способ, в котором биомаркер CD40 лиганд подвергается понижающей регуляции благодаря введению DI-17E6. Соответствующий способ, в котором биомаркер STC1 подвергается понижающей регуляции благодаря введению малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, как указано в данном описании. Соответствующий способ, в котором биомаркер EDNI подвергается повышающей регуляции благодаря введению малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, как указано в данном описании.Ex vivo способ для скрининга соединений, модулирующих интегрин в модели на основе клеток, при использовании по крайней мере одного селективного биомаркера, где биомаркеры являются выбранными из генных продуктов, выбранных из группы, которая состоит из при этом способ включает следующие этапы:(а) определение базовой линии концентрации и/или статуса модификации по крайней мере одного выбранного биомаркера в образце жидкости и/или ткани организма, который не подвергался обработке с помощью указанного ингибитора;(b) определение концентрации и/или статуса модификации указанных выбранных биомаркеров в образце (а), который подвергался обработке с помощью указанного ингибитора,(c) подсчет различий между концентрациями и/или статусом модификации выбранных биомаркеров, полученных с использованием этапа (а) и (b);(d) оценка или прогноз, полученный из указанных отличий, свойств, которые являются показательными для молекулы, модулирующей интегрин с влиянием на ангиогенез и/или антиангиогенную эффективность в отношении заболевания, ассоциированного с ангиогенезом. Диагностический набор, включающий систему определения по крайней мере для одного биомаркера, выбранного из и ингибитор ангиогенеза, как указано в данном описании, который позволяет применять способ. Применение гена биомаркера или его генного продукта, выбранных из предпочтительной группы,которая состоит из ADAMTS1, STC1, EDN1, MCP1, IL-8, PDGF-BB, CRP, CD40 лиганда и IL-6, для оценки и прогноза влияния ингибитора интегрина или малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, на ангиогенез в анализе на основе клеток, или эффективность и/или дозирование такого ингибитора ex vivo.Применение гена биомаркера или его генного продукта, выбранных из предпочтительной группы, которая состоит из ADAMTS1, STC1, EDN1, MCP1, IL-8, PDGF-BB, CRP,CD40 лиганда и IL-6, для производства ингибитора интегрина или малой молекулы ингибитора мультикиназы, направленной на сайт АТФ, для лечения рака у пациентов, которые являются чувствительными по крайней мере к одному из этих биомаркеров. Подробное описание изобретения Термин "заболевание, ассоциированное с ангиогенезом" включает многочисленные заболевания или расстройства, которые непосредственно являются результатом нарушения ангиогенеза или подвергаются опосредованному воздействию со стороны нарушенного ангиогенеза. Такие многочисленные заболевания включают опухолевые заболевания, сердечно-сосудистые заболевания, воспаления, аутоиммунные заболевания, дегенеративные заболевания, глазные заболевания. Нарушенный ангиогенез может индуцироваться с помощью вредного патологического стимула. Термин "антиангиогенный эффект" означает, что ангиогенез блокируется или, по крайней мере, ингибируется. В контексте данного изобретения антиангиогенные лекарственные средства или вещества предпочтительно используются для антагонизации ассоциированного с ангиогенезом заболевания путем ограничения патологического образования новых кровеносных сосудов (ангиогенеза), а симптомы заболевания, опосредованные ангиогенезом, улучшаются благодаря введению антиангиогенных лекарственных средств. Термин "биомаркер" относится к веществу, которое используется в качестве индикатора биологического состояния. Такое состояние представляет собой характеристику, которая объективно измеряется и оценивается в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. В этом изобретении термин "биомаркер" предпочтительно используется в качестве молекулярного биомаркера, включая генные транскрипты, такие как РНК и белки. Указанный биомаркер может подвергаться количественным, а также качественным изменениям. Предпочтительно, когда в данном изобретении молекулярные биомаркеры подвергаются количественному изменению, т.е. их уровень снижается или повышается, в соответствии с чем значение р, характеризующее достоверность биомаркера, исследованного в определенных опытах при тех же условиях, не превышает 0,01. Термин "жидкости организма" включает жидкости, которые обнаруживаются у индивидуумов. Они включают жидкости, которые экскретируются или секретируются из организма, а также жидкости, которые в норме не выделяются. Такие соответствующие жидкости включают водянистую влагу, кровь, сыворотку, тканевую жидкость, лимфу, слизь, плевральную жидкость, слюну, плазму, мочу, слезы, синовиальную жидкость, раневую жидкость и/или цереброспинальную жидкость. Предпочтительно в этом изобретении используют кровь, включая сыворотку крови и плазму крови, и мочу. Термины "рак" и "опухоль/опухолевое расстройство" относятся или описывают физиологическое состояние у млекопитающих, которое типично характеризуется нарушением роста клеток. С помощью фармацевтических композиций в соответствии с настоящим изобретением опухоли могут подвергаться лечению, при этом опухоли представляют собой опухоли молочной железы, сердца, легких, тонкого кишечника, толстого кишечника, селезенки, почки, мочевого пузыря, головы и шеи, яичника, предстательной железы, мозга, поджелудочной железы, кожи, костей, костного мозга, крови, тимуса, матки, яичек и печени. Термин "модель/анализ на основе клеток" относится в данном описании к клеткам, которые имеют происхождение от ткани и/или органов животных или человека и которые наиболее предпочтительно культивируются при лабораторных условиях перед применением для скрининга соединений, модулирующих ангиогенез. Модель на основе клеток также включает линию клеток. Термин "производная" антитела представляет собой полученную форму антитела. Термин "диагностический набор" включает предпочтительно систему для определения с различными упаковками диагностического антитела и/или наборами генных чипов и/или реагентов, которые являются необходимыми для количественной и/или качественной оценки биомаркера данного изобретения,и, как правило, инструкции для использования реагентов, диагностических антител или генных наборов. Антитела, а также реагент могут обеспечиваться как жидкость, порошок, таблетка, суспензия. Антитела,т.е. генные наборы и реагенты, могут обеспечиваться в отдельных упаковках, приемлемых для отдельного применения в соответствии с настоящим способом. Набор данного изобретения также содержит "инструкции для применения" материалов, которые содержатся в упаковке. Термин "состояние модификации" относится к изменению модификаций в генных продуктах, таким как изменения в молекулярном размере или в гликозилировании белков. Кроме того, он относится к изменению взаимодействий с различными белками или субъединицами того же белка. Термин "индивидуум" включает людей и животных, которые страдают от заболевания/расстройства и/или которые являются здоровыми, в качестве контрольных пробандов. Кроме того, также включаются лабораторные животные. Термин "рецептор" или "рецепторная молекула" представляют собой растворимый или связанный/ассоциированный с мембраной белок или гликопротеин, включающий один или более доменов, с которыми связывается лиганд с образованием комплекса рецептор-лиганд. Путем связывания лиганда,- 13020764 который может быть агонистом или антагонистом, рецептор активируется или инактивируется и может инициировать или блокировать путь передачи сигнала. Термин "образец ткани" означает биопсию, которая была удалена из индивидуума для того, чтобы использовать этот материал, предпочтительно клетки, для анализа и оценки биомаркеров. В этом изобретении образец ткани может использоваться непосредственно после биопсии для анализа биомаркеров. В другом аспекте данного изобретения клетки, экстрагированные из материала биопсии, могут культивироваться при определенных лабораторных условиях и подвергаться анализу на их биомаркеры в последующее время. В этом изобретении предпочтительно используются эндотелиальные клетки. Термин "терапевтически эффективная доза=TED" относится к количеству лекарственного средства,например терапевтического антитела, эффективного для лечения заболевания или расстройства у млекопитающего. В случае рака терапевтически эффективное количество лекарственного средства может снижать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и, предпочтительно, останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) опухолевые метастазы; ингибировать до некоторой степени рост опухоли и/или ослаблять до некоторой степени один или более симптомов, ассоциированных с раком. До некоторой степени лекарственное средство может предотвращать рост и/или убивать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для противоопухолевой терапии эффективность может, например, измеряться путем оценки времени до развития заболевания (ТТР) и/или определения скорости ответа (RR). Термин "ответ" или "чувствительность" относится к состоянию, которое может оцениваться при использовании какого-либо показателя критической точки, выгодного для пациента, включая, без ограничения, ингибирование в некоторой степени развития заболевания, включая торможение до полной остановки; снижение количества эпизодов и/или симптомов заболевания; снижение аутоиммунных ответов против используемого ингибиторного лекарственного средства; повышение длительности свободного от заболевания периода после лечения; и сниженную смертность в данной точке времени после лечения. Термин относится к способному к измерению ответу, включая полный ответ (CR) и частичный ответ(PR). Мышиные, химерные или гуманизированные варианты антитела в контексте данного изобретения включают эквивалентные антитела или производные, в которых части антитела являются замещенными в соответствии с определением мышиного антитела, химерного антитела или гуманизированного антитела. В этом исследовании идентифицируют биомаркеры, связанные с антиангиогенной активностью ингибиторов интегрина и малой молекулы ингибиторов мультикиназы, направленной на сайт АТФ, которые могут быть доступными в жидкостях организма, и таким образом, могут позволить осуществлять анализ целевой модуляции неинвазивным путем. С этой целью применяются две различные стратегии. Во-первых, могут анализироваться полногеномные изменения в профилях генной экспрессии эндотелиальных клеток в ответ на обработку лекарственным средством. Во-вторых, осуществляют кандидатнопротеомически направляемый подход при использовании in vivo модели ангиогенеза для идентификации биомаркеров плазмы крови, регулируемых лекарственным средством. 1. Идентификация биомаркеров при использовании профилей генной экспрессии. Для идентификации биомаркеров, ассоциированных с лечением, HUVEC подвергали обработке с помощью циленгитида или DI-17E6. Вестерн-блоттинг анализ выявил, что после лечения фосфорилирование FAK и MAPK ингибировалось для циленгитида и для DI-17E6 соответственно. Получали профили генной экспрессии из экспериментов с каждым состоянием, которое анализировали в трехкратной повторности. С этой целью РНК экстрагировали из обработанных и контрольных клеток и гибридизировали с полногеномными Affymetrix олигонуклеотидными микрочипами для получения профилей генной экспрессии. После процессирования при использовании GCRMA алгоритма (Wu Z., Journal AmericanStatistical Association, 2004; 99: 909-917) данные Affymetrix GeneChip фильтровали для исключения наборов зондом с низкой вариабельностью, слабым сигналом или со слабым аннотированием. Гены специфически фильтровали для получения секретируемых кандидатов, которые могут определяться в жидкостях организма у людей и могут подвергаться мониторингу неинвазивным путем у пациентов. Идентифицировали дифференциально экспрессируемые гены обработанных с помощью лекарственного средства клеток и необработанных или обработанных при использовании контроля с помощью анализа линейной системы данных экспрессии каждого набора зондов, после чего осуществляли анализ при использовании умеренных коэффициентов Стьюдента (Smyth GK, Statistical Applications in Genetics and Molecular Biology 2004; 3: статья 3). Гены, которые подвергаются повышающей регуляции в ответ на DI-17E6, включают Гены, которые подвергаются повышающей регуляции в ответ на циленгитид, включают Гены, которые подвергаются понижающей регуляции в ответ на DI-17E6, включают Гены, которые подвергаются понижающей регуляции в ответ на циленгитид, включают Гены, которые демонстрируют при данных условиях необычный ответ/изменение ответа/чувствительность, являются подчеркнутыми. Гены и продукты указанных выше генов включают в соответствии с определением настоящего изобретения также гомологичные последовательности, выявляющие такую же функциональную активность; в частности, включаются последовательности, которые имеют гомологию с указанными оригинальными последовательностями, составляющую более чем 80%, предпочтительно более чем 90% и, в частности,более чем 95%. Таким образом, последовательности, обладающие следующими гомологиями, представляют собой объект настоящего изобретения: 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96,97, 98 и 99%. Гены, которые были чрезвычайно высоко регулированными на уровне РНК либо ингибитора интегрина, подвергали анализу на уровень белка. Поскольку секретируемые биомаркеры являются релевантными, анализировали индивидуальных кандидатов в супернатантах клеток, обработанных ингибитором интегрина. HUVEC обрабатывали либо с помощью DI-17E6, либо с помощью циленгитида. Через различные промежутки времени собирали культуры супернатантов и подвергали анализу на различных кандидатов биомаркеров с помощью вестерн-блоттинга, ELISA или Luminex. Регуляцию биомаркера, индуцируемого с помощью лекарственного средства, оценивали по сравнению с контрольными клетками. Среди различных кандидатов ADAMTS1, STC-1, МСР-1, IL-8, эндотелин-1, активин А и PDGF-BB были обнаружены такие, которые подвергаются регуляции в ответ на ингибиторы интегрина. Вестерн-блоттинг анализы выявили, что ADAM металлопептидаза с фрагментом тромбоспондина типа 1 (ADAMTS1) и станниокальцин-1 (STC-1) подвергались повышающей регуляции в ответ на обработку с помощью DI-17E6 или циленгитида (фиг. 2-4). ADAMTS1 представляет собой металлопротеазу,локализующуюся во внеклеточном пространстве. При использовании различных биологических систем было продемонстрировано, что ADAMTS1 ингибирует ангиогенез (Vazquez F. et al., J. Biol. Chem. 1999; 274(33): 23349-57). STC-1 представляет собой секретируемый гликопротеин, который исходно был описан как гормон, вовлеченный в гомеостаз кальция и фосфата у костных рыб. Он играет роль во многих физиологических процессах, включая ангиогенез, про- и антиангиогенные активности, которые были описаны для STC-1 (Filvaroff E.H. et al., Endocrinology. 2002; 143: 3681-90; Zlot С. et al., J. Biol. Chem. 2003; 278(48): 47654-9). Хемоаттрактантный белок-1 моноцитов (MCP-1/CCL2) и интерлейкин-8 (IL-8/CXCL8) анализировали с помощью Luminex. МСР-1 подвергался понижающей регуляции в ответ на DI-17E6 и циленгитид(фиг. 5). В противовес этому, IL-8 дифференциально подвергался регуляции с помощью ингибиторов интегрина. В ответ на DI-17E6 IL-8 подвергался повышающей регуляции, в то время как циленгитид индуцировал понижающую регуляцию этого хемокина (фиг. 6). МСР-1 играет важную роль в рекрутинге и активации макрофагов. Он представляет собой один из ключевых агонистов для привлечения проангиогенных макрофагов к опухолям. Ингибирование МСР-1 снижает ангиогенез и опухолевый рост у мышей рактеризован в соответствии со своей лейкоцитарно хемотактической активностью, является известным,что он обладает онкогенными и проангиогенными свойствами (Xie K. et al., Cytokine Growth Factor Rev. 2001; 12(4): 375-91). Активин А, эндотелин-1 (EDN1) и фактор роста тромбоцитов ВВ (PDGF-ВВ) подвергали анализу с помощью ELISA. Все три белка подвергались понижающей регуляции в ответ на DI-17E6 и циленгитид(фиг. 7-9). EDN1 опосредует множественные активности, способствующие развитию опухоли, включая ангиогенез. Он регулирует связанные с интегрином киназы (ILK), a также мультидоменный очаговый адгезивный белок, который передает внутриклеточный сигнал, вызываемый интегринами (Rosan L. etal., Mol Cancer Ther. 2006; 5(4): 833-42). Активин А, гомодимер из двух субединиц А ингибина, представляет собой члена семейства активина/ингибина, который принадлежит к суперсемейству фактора трансформации(TGF-). Он вызывает широкий спектр биологических эффектов, включая процессы развития и размножения, воспаления, рака и ангиогенеза. Роль активина А в регуляции ангиогенеза предполагается, поскольку его как про, так и антиангиогенные функции были описаны (Panopoulou E. etal., Cancer Res. 2005; 65(5): 1877-86; Poulaki V. et al., Am. J. Pathol. 2004; 164(4): 1293-302). PDGF-BB представляет собой один из четырех PDGF лигандов, PDGF-A, PDGF-B, PDGF-C и PDGF-D (FredrikssonL. et al., Cytokine Growth Factor Rev. 2004; 15: 197-204). Он принадлежит к суперсемейству VEGF/PDGF лигандов и рецепторов, сгруппированных вместе на основе их высокой гомологии последовательности и эволюционной взаимосвязи. PDGF-BB часто экспрессируется на высоких уровнях в различных опухолевых тканях (Nguyen М. et al., J. Natl. Cancer Inst. 1994; 86: 356-361). Он представляет собой митогенный и хемотактический фактор для перицитов и играет важную роль в регуляции васкулярных клеток во время образования стенки кровеносных сосудов (Lindahl P. et al., Science 1997; 277: 242-245). Анализировали регуляцию идентифицированных биомаркеров в ответ на другие различные ингибиторы ангиогенеза, сунитиниб и сорафениб, для обнаружения, коррелируют ли идентифицированные биомаркеры в общем случае с ингибированием ангиогенеза. Оба ингибитора представляют собой малые молекулы ингибитора мультикиназы, которые оказывают воздействие путем неродственного механизма действия с помощью связывания со связывающим АТФ каталитическим сайтом киназ (Morabito А. et al.,Current status and Future Oncologist. 2006; 11: 753 - 764). Уровень кандидатного биомаркера подвергали анализу в супернатантах эндотелиальных клеток после обработки с помощью сунитиниба и сорафениба. Как наблюдали для ингибиторов интегрина, несколько биомаркеров подвергались регуляции в ответ на эти ингибиторы киназы. Например, STC-1 подвергался понижающей регуляции в ответ на любое лекарственное средство (фиг. 10), в то время как EDN1 подвергался повышающей регуляции (фиг. 11). Интересно отметить, что обратную регуляцию наблюдали для ингибиторов интегрина. IL-8 подвергался дифференциальной регуляции с помощью любого из ингибиторов киназы. Сутент вызывал повышающую регуляцию этого хемокина, в то время как сорафениб снижал уровни белка после обработки(фиг. 12). В случае ингибиторов интегрина наблюдали также дифференциальную регуляцию. Взятые вместе эти данные показывают, что биомаркеры могут использоваться для мониторинга ингибиторов интегрина, а также ингибиторов киназ. Однако отличное воздействие на гомеостаз эндотелиальных клеток может быть ожидаемым, поскольку соответствующие белки подвергаются регуляции различными путями и могут приводить к различным биологическим ответам. Поскольку все лекарственные средства воздействуют посредством различных механизмов действия, пути, втянутые в регуляцию различных биомаркеров, вероятно, отличаются между различными ингибиторами. Таким образом, биомаркеры, специфические для лекарственного средства, коррелирующие с фармакодинамическим влиянием ингибиторов интегрина, были идентифицированы в профилях генной экспрессии в культурах эндотелиальных клеток. Некоторые из идентифицированных кандидатов были подтверждены как белки, регулирующие лекарственные средства в клеточных супернатантах, что свидетельствовало о том, что они могут определяться в жидкостях организма. Некоторые из этих кандидатов также подвергались регуляции с помощью неродственных ингибиторов мультикиназы, что дает возможность предположить, что эти биомаркеры могут широко применяться для мониторинга воздействий на гомеостаз эндотелиальных клеток и ангиогенез. 2. Идентификация биомаркеров плазмы крови, регулируемых лекарственным средством, с помощью in vivo модели ангиогенеза. В этой модели ангиогенез индуцировали во вставках Matrigel с помощью ангиогенного фактора роста bFGF. Заполняющий материал Matrigel, содержащий bFGF, имплантировали подкожно в брюшную часть здоровых обезьян циномолгус и вводили животным DI-17E6 внутривенно при различных дозах непосредственно после этого. Оценку ангиогенеза осуществляли после имплантации Matrigel с помощью количественной оценки содержания гемоглобина во вставках Matrigel. Каждое состояние анализировали у различных животных, которым имплантировали вставки с Matrigel. Было обнаружено, что лечение обезьян с помощью DI-17E6 блокировало образование новых кровеносных сосудов при всех дозах (фиг. 13). Для идентификации биомаркеров, коррелирующих с PD эффектами DI-17 Е 6, собирали образцы плазмы крови перед обработкой и после обработки. Абсолютные концентрации различных белков изме- 16020764 ряли с помощью Luminex путем сравнения с соответствующими стандартами. Необработанные данные подвергали предварительной обработке путем log-трансформации, и эффект DI-17E6 исследовали при использовании критерия Стьюдента путем сравнения групп, обработанных DI-17E6, с обработанными плацебо животными в каждый момент времени Белки, которые в значительной степени подвергаются регуляции, включают С-реактивный белок(CRP) и IL-6, CD40 лиганд и ММР 9. CRP и IL-6 подвергались повышающей регуляции в ответ на обработку с помощью DI-17E6 (фиг. 14). В противовес этому, CD40 лиганд и ММР 9 подвергались специфической регуляции в контрольной группы. Через 144 ч CD40 лиганд подвергался понижающей регуляции,а ММР 9 подвергался повышающей регуляции у животных, обработанных плацебо (фиг. 15). CRP представляет собой маркер воспаления и ключевой медиатор ответа острой фазы (Pepys M.B. et al., Adv.Immunol. 1983; 34: 141-212). Он узнает поврежденные клетки, инициирует их устранение путем взаимодействия с иммунной системой и может, таким образом, быть вовлеченным в удаляющиеся клетки, которые повреждаются в ответ на обработку DI-17E6. IL-6 представляет собой плейотропный цитокин, ассоциированный с ангиогенезом и опухолевым ростом (Keller E.T. et al., Front. Biosci. 1996. 1: 340-357 иDI-17E6 оказывается в конфликте с его фармакологической активностью, но может отражать регуляторную обратную связь, как это наблюдали для других ингибиторов ангиогенеза. CD40 лиганд представляет собой трансмембранный белок, который является структурно близким с фактором- некроза опухоли. Он представляет собой провоспалительный и прокоагулянтный фактор, который осуществляет свой вклад в воспаление, образование тромбов и неоангиогенез (Ferroni Р. et al., Curr. Med. Chem. 2007; 14(20):2170-80). И наконец, ММР 9 принадлежит к семейству матриксных металлопротеиназ, которые играют роль посредников в гомеостазе внеклеточного окружения. Были описаны как про-, так и антитуморогенная активности (Egeblad M et al., Nature Rev. Cancer 2002; 2:161-174). Он модулирует ремоделирование вновь образовавшихся сосудов и способствует опухолевому росту (Seandel M et al., CancerCell 2008; 13(3): 181-3). Вкратце, фармакодинамические биомаркеры, специфические для лекарственного средства, были определены как такие, которые могут определяться в жидкостях организма у людей и могут использоваться для обеспечения подтверждения концепции целевой модуляции; для выбора приемлемой дозы и режима и для потенциального объяснения или прогнозирования клинических выходов. Среди идентифицированных биомаркеров CRP и ММР 9 могут механистически вовлекаться в блокирование ангиогенеза после лечения с помощью DI-17E6 3. Резюме В этих двух исследованиях были идентифицированы несколько PD биомаркеров для ингибиторов интегрина и ингибиторов мультикиназы, которые могут определяться в жидкостях организма у людей и могут использоваться для обеспечения подтверждения концепции целевой модуляции; обеспечивать рациональный выбор дозы и режима и потенциального объяснять или прогнозировать клинические выходы. Интересно отметить, что большинство кандидатов были ассоциированными с ангиогенезом и могли,таким образом, механистически вовлекаться в блокирование ангиогенеза после лечения с помощью лекарственного средства. Интересно отметить, что некоторые биомаркеры подвергались регуляции с помощью неродственных лекарственных средств с различными механизмами действия, предполагая, таким образом, что они могут использоваться для мониторинга влияний на гомеостаз эндотелиальных клеток и ангиогенез в общем, и, таким образом, являться приемлемыми для применения для различных классов лекарственных средств, включая ингибиторы интегрина (такие как циленгитид, DI-17E6), ингибиторыVEGF (такие как авастин), ингибиторы мультикиназ (такие как сунитиниб, сорафениб). Краткое описание фигур Фиг. 1 показывает полные последовательности легкой (А) и тяжелой (В) цепей для DI-17E6. Вариабельные участки являются подчеркнутыми, при этом CDR выделены жирным шрифтом. Выделенные жирным шрифтом последовательности в константном участке указывают IgG1 шарнир и мутацию в положениях 296 и 297. Фиг. 2 показывает, что DI-17E6 индуцирует уровни белка ADAMTS1 в HUVEC супернатантах. Фиг. 3 показывает, что циленгитид индуцирует уровни белка ADAMTS1 в HUVEC супернатантах. Фиг. 4 показывает, что DI-17E6 и циленгитид индуцируют уровни белка STC-1 в HUVEC супернатантах. Фиг. 5 представляет регуляцию МСР-1 в HUVEC в ответ на DI-17E6 и циленгитид. Фиг. 6 отражает регуляцию IL-8 в HUVEC в ответ на DI-17E6 и циленгитид. Фиг. 7 отражает регуляцию PDGF-BB в HUVEC в ответ на DI-17E6 и циленгитид. Фиг. 8 представляет регуляцию EDN1 в HUVEC в ответ на DI-17E6 и циленгитид. Фиг. 9 представляет регуляцию активина А в HUVEC в ответ на DI-17E6 и циленгитид. Фиг. 10 представляет регуляцию STC-1 в HUVEC в ответ на сутент и сорафениб. Фиг. 11 представляет регуляцию EDN1 в HUVEC в ответ на сутент и сорафениб. Фиг. 12 представляет регуляцию IL-8 в HUVEC в ответ на сутент и сорафениб. Фиг. 13 показывает DI-17E6 ингибирование ангиогенеза во вставках Matrigel у обезьян. Фиг. 14 представляет регуляцию CRP и IL- 6 в плазме крови в ответ на лечение с помощьюDI-17E6. Фиг. 15 представляет регуляцию CD40 лиганда и ММР 9 в плазме крови в ответ на лечение с помощью DI-17E6. Фиг. 16 представляет ингибирование сигнальных путей, специфических для интегрина. Примеры Пример 1.DI-17E6 индуцирует уровни белка ADAMTS1 в HUVEC супернатантах.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на ADAMTS1 с помощью вестерн-блоттинга. А) Опосредованная DI-17E6 регуляция ADAMTS1 (65 и 85 кДа) (фиг. 2). Пример 2. Циленгитид индуцирует уровни белка ADAMTS1 в HUVEC супернатантах.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на ADAMTS1 с помощью вестерн-блоттинга. А) Опосредованная циленгитидом регуляция ADAMTS1 (65 и 85 кДа) (фиг. 3). Пример 3.DI-17E6 и циленгитид индуцируют уровни белка STC-1 в HUVEC супернатантах.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 и циленгитида в течение от 24 до 72 ч. Супернатанты культур собирали и подвергали анализу на STC-1 с помощью вестерн-блоттинга. А) Регуляция STC-1 в ответ на DI-17E6. В) Регуляция STC-1 в ответ на циленгитид (фиг. 4). Пример 4. Регуляция МСР-1 в HUVEC в ответ на DI-17E6 и циленгитид.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 и циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на МСР-1 с помощью Luminex. А) Регуляция МСР-1 в ответ на DI-17E6. В) Регуляция МСР-1 в ответ на циленгитид (фиг. 5). Пример 5. Регуляция IL-8 в HUVEC в ответ на DI-17E6 и циленгитид.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 и циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на IL-8 с помощью Luminex. А) Регуляция IL-8 в ответ на DI-17E6. В) Регуляция IL-8 1 в ответ на циленгитид (фиг. 6). Пример 6. Регуляция PDGF-BB в HUVEC в ответ на DI-17E6 и циленгитид.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 или циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на PDGF-BB с помощью ELISA. А) Регуляция PDGF-BB в ответ на DI-17 Е 6. В) Регуляция PDGF-BB в ответ на циленгитид (фиг. 7). Пример 7. Регуляция EDN1 в HUVEC в ответ на DI-17E6 и циленгитид.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 или циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на EDN1 с помощью ELISA. А) Регуляция EDN1 в ответ на DI-17E6. В) Регуляция EDN1 в ответ на циленгитид (фиг. 8). Пример 8. Регуляция активина А в HUVEC в ответ на DI-17E6 и циленгитид.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями DI-17E6 или циленгитида в течение от 6 до 72 ч. Супернатанты культур собирали и подвергали анализу на активин А с помощью ELISA. А) Регуляция активина А в ответ на DI-17 Е 6. В) Регуляция активина А в ответ на циленгитид (фиг. 9). Пример 9. Регуляция STC-1 в HUVEC в ответ на сутент и сорафениб.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями сутента или сорафениба в течение от 6 до 48 ч. Супернатанты культур собирали и подвергали анализу на STC-1 с помощью вестерн-блоттинга. А) Регуляция STC-1 в ответ на сутент. В) Регуляция STC-1 в ответ на сорафениб (фиг. 10). Пример 10. Регуляция EDN1 в HUVEC в ответ на сутент и сорафениб.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями сутента или сорафениба в течение от 6 до 48 ч. Супернатанты культур собирали и подвергали анализу на EDN1 с помощью ELISA. А) Регуляция EDN1 в ответ на сутент. В) Регуляция EDN1 в ответ на сорафениб (фиг. 11). Пример 11. Регуляция IL-8 в HUVEC в ответ на сутент и сорафениб.HUVEC культивировали в течение ночи на покрытых витронектином чашках Петри и инкубировали с различными концентрациями сутента или сорафениба в течение от 6 до 48 ч. Супернатанты культур собирали и подвергали анализу на IL-8 с помощью Luminex. А) Регуляция IL-8 в ответ на сутент. В) Регуляция IL-8 в ответ на сорафениб (фиг. 12). Пример 12.DI-17E6 ингибирует ангиогенез во вставках Matrigel у обезьян. Ингибирование ангиогенеза во вставках Matrigel у обезьян проводили с помощью DI-17E6. Ангиогенез индуцировали в подкожных имплантатах Matrigel, содержащих 5 мкг/мл bFGF, у обезьян циномолгус DI-17E6 вводили в виде единственной инфузии при дозе 100, 30, 10 или 3 мг/кг. Через 6 дней ангиогенез количественно оценивали путем измерения содержания гемоглобина в Matrigel имплантатах.означает р 0,05 иозначает р 0,01 (фиг. 13). Пример 13. Регуляция CRP и IL-6 в плазме крови в ответ на лечение с помощью DI-17E6. Обезьянам циномолгус имплантировали вставки Matrigel, содержащие bFGF и различные концентрации DI-17E6, на период 6 дней. Собирали плазму и подвергали ее анализу на CRP и IL-6 с помощьюLuminex. А) Регуляция CRP. В) Регуляция IL-6 (фиг. 14). Пример 14. Регуляция CD40 лиганда и ММР 9 в плазме крови в ответ на лечение с помощью DI-17E6. А) Обезьянам циномолгус имплантировали вставки Matrigel, содержащие bFGF и различные концентрации DI-17E6, на период 6 дней. Собирали и подвергали анализу плазму крови на CD40 лиганд и ММР 9 с помощью Luminex. А) Регуляция CD40 лиганда. В) Регуляция ММР 9 (фиг. 15). Пример 15. Ингибирование специфических для интегрина путей передачи сигнала. Кроме стимуляции фактора роста, опосредованная интегрином адгезия к внеклеточному матриксу является важной для индукции клеточной пролиферации, выживания и миграции. При лигировании интегрина индуцируется широкий спектр внутриклеточных сигнальных событий, включая активацию Ras,MAPK, FAK, Src, Rac/Rho/cdc42 GTP. Для поддержания выживания эндотелиальных клеток во время ангиогенеза интегрины альфа(v)бета(3)/(5) вместе с FAK требуются для продолжительной активацииMAPK каскада (т.е. ERK1/2). В этом исследовании было проанализировано влияние двух ингибиторов интегрина, DI-17E6 и циленгитида, на опосредованные интегрином пути передачи сигнала в эндотелиальных клетках. С этой целью эндотелиальные клетки пупочной вены человека (HUVEC) высаживали на витронектин для активации альфа(v)бета(3)-интегрина, а потом обрабатывали с помощью культуральной среды или различных концентраций DI-17E6 или циленгитида. Через 24 ч после обработки готовили клеточные лизаты и подвергали их анализу с помощью вестерн-блоттинга. Влияние на пути передачи сигнала оценивали путем сравнения соотношения уровня фосфорилированной соответствующей сигнальной молекулы к ее общему уровню для того, чтобы подсчитать потенциальные эффекты, возникающие в результате отделения клеток. Как можно увидеть, DI-17E6 при концентрациях, которые колеблются от 0,01 до 10 мкг/мл, и циленгитид при концентрациях, которые колеблются от 0,01 до 10 мкМ, блокировали активацию FAK и ERK1/2 зависимым от дозы образом (фиг. 16). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ex vivo способ измерения влияния ингибитора альфа(v)-интегрина на ангиогенез и/или терапевтическую эффективность такого ингибитора против заболевания, ассоциированного с ангиогенезом, где ингибитор представляет собой mAb DI-17E6 или RGD пептид циленгитид с помощью по крайней мере одного гена селективного биомаркера или его генного продукта, выбранных из группы, которая состоит из ADAMTS1, STC1, EDN1, МСР 1, IL-8, PDGF-BB, CRP, CD40 лиганда и IL-6, при котором(i) в результате введения соответствующего ингибитора интегрина ADAMTS1 и STC1 подвергаются повышающей регуляции, а МСР 1, INHBA, EDN1 и PDGF-BB подвергаются понижающей регуляции;(ii) в результате введения циленгитида IL-6 подвергается понижающей регуляции и(iii) в результате введения DI-17 Е 6 IL-6, IL-8 и CRP подвергаются повышающей регуляции, a CD40 лиганд подвергается понижающей регуляции,причем способ включает следующие этапы:(a) измерение с помощью технических средств и/или устройств базовой линии концентрации и/или статуса модификации по крайней мере одного выбранного биомаркера в образце жидкости или ткани организма, в соответствии с чем образец получают от индивидуума, который не подвергался обработке с помощью указанного ингибитора;(b) измерение с помощью технических средств и/или устройств концентрации и/или статуса модификации указанных выбранных биомаркеров в образце (а), полученном от индивидуума, который подвергался обработке с помощью указанного ингибитора, или в образце (а), который на последующем этапе подвергался обработке с помощью указанного ингибитора;(c) измерение с помощью технических средств и/или устройств различий между концентрациями и/или статусами модификации выбранных биомаркеров, полученных с использованием этапов (а) и (b);(d) определение из указанных различий, полученных на этапе (с), одного или более из следующих свойств или параметров ингибиторов: фармакодинамическое влияние на молекулярную мишень и на соответствующие пути передачи сигнала, связанные с молекулярной мишенью; влияние на ангиогенез; эффективность лечения и клинического выхода у пациента с заболеванием, ассоциированным с ангиогенезом,и, необязательно,(е) повторение этапов (а)-(d) до тех пор, пока не будут получены желаемые свойства/параметры,что, таким образом, позволяет осуществлять оценку клинических мероприятий и активностей в отношении влияния на ангиогенез или терапевтическую эффективность, безопасность, прогноз или дозировку указанного ингибитора или на связанное с ангиогенезом заболевание у индивидуума. 2. Ex vivo способ по п.1, где взятый образец жидкости организма представляет собой кровь, плазму,сыворотку, лимфу, мочу, слезы, синовиальную жидкость, раневую жидкость и/или цереброспинальную жидкость. 3. Способ по п.1, где образец ткани включает больную или здоровую ткань. 4. Способ по п.1, где образец ткани является выбранным из группы, состоящей из раковой ткани,кожной ткани и/или синовиальной ткани. 5. Ex vivo способ по п.1, где из взятого образца ткани получают эндотелиальные клетки. 6. Способ по п.5, где эндотелиальные клетки культивируют при лабораторных условиях после того,как они были получены от индивидуума и приготовлены из образца ткани, где по крайней мере один биомаркер определяют из среды для культивирования клеток или экстракта указанных клеток. 7. Способ по любому из пп.1-6, где образец эндотелиальных клеток и/или жидкостей организма имеет происхождение от здорового и/или больного индивидуума, страдающего от опухолевого расстройства и/или другого заболевания, ассоциированного с ангиогенезом. 8. Способ по любому из пп.1-7, где заболевание, ассоциированное с ангиогенезом, представляет собой рак или связанное с раком заболевание. 9. Применение гена биомаркера или его генного продукта, выбранных из группы, состоящей изADAMTS1, STC1, EDN1, МСР 1, IL-8, PDGF-BB, CRP, CD40 лиганда и IL-6, для оценки и прогнозирования влияния ингибитора альфа(v)-интегрина mAb DI-17E6 или RGD пептида циленгитида на ангиогенез в анализе на основе клеток или эффективности и/или дозирования ингибитора ex vivo, при котором:(i) в результате введения соответствующего ингибитора интегрина ADAMTS1 и STC1 подвергаются повышающей регуляции, а МСР 1, INHBA, EDN1 и PDGF-BB подвергаются понижающей регуляции;(ii) в результате введения циленгитида IL-6 подвергается понижающей регуляции и(iii) в результате введения DI-17E6 IL-6, IL-8 и CRP подвергаются повышающей регуляции, а CD40 лиганд подвергается понижающей регуляции. 10. Применение ингибитора интегрина DI-17E6 для получения лекарственного средства для лечения ракового заболевания или другого заболевания, ассоциированного с ангиогенезом у пациента, при котором лечение является терапевтически эффективным, а пациент восприимчивым, где в образце жид- 20020764 кости или ткани тела пациента экспрессия по меньшей мере одного гена селективного биомаркера или его генного продукта, выбранного из группы, состоящей из ADAMTS1, STC1, IL-8, IL-6, EDN1, МСР 1,PDGF-BB, CRP и CD40 лиганда, подвергается понижающей или повышающей регуляции и гены биомаркера или генного продукта ADAMTS1, STC1, IL-8, IL-6 и CRP подвергаются повышающей регуляции, а гены биомаркера или генного продукта МСР 1, EDN1, PDGF-BB и CD40 лиганда - понижающей регуляции после введения ингибитора. 11. Применение ингибитора интегрина и RGD пептида циленгитида для получения лекарственного средства для лечения ракового заболевания или другого заболевания, ассоциированного с ангиогенезом у пациента, при котором лечение является терапевтически эффективным, а пациент восприимчивым, где в образце жидкости или ткани тела пациента экспрессия по меньшей мере одного гена селективного биомаркера или его генного продукта, выбранного из группы, состоящей из ADAMTS1, STC1, IL-8, IL-6,EDN1, MCP1, PDGF-BB, CRP и CD40 лиганда, подвергается понижающей или повышающей регуляции и гены селективного биомаркера или генного продукта ADAMTS1 и STC1 подвергаются повышающей регуляции, а гены селективного биомаркера или генного продукта МСР 1, EDN1, PDGF-BB и IL-8 - понижающей регуляции после введения ингибитора.
МПК / Метки
МПК: G01N 33/574
Метки: антиангиогенной, ингибиторов, биомаркеры, активностью
Код ссылки
<a href="https://eas.patents.su/30-20764-biomarkery-dlya-ingibitorov-s-antiangiogennojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Биомаркеры для ингибиторов с антиангиогенной активностью</a>
Предыдущий патент: Источник плазмы и способы нанесения тонкопленочных покрытий с использованием плазменно-химического осаждения из газовой фазы
Следующий патент: Способ получения халькогенонов
Случайный патент: Способ и устройство для подготовки пробы для анализа