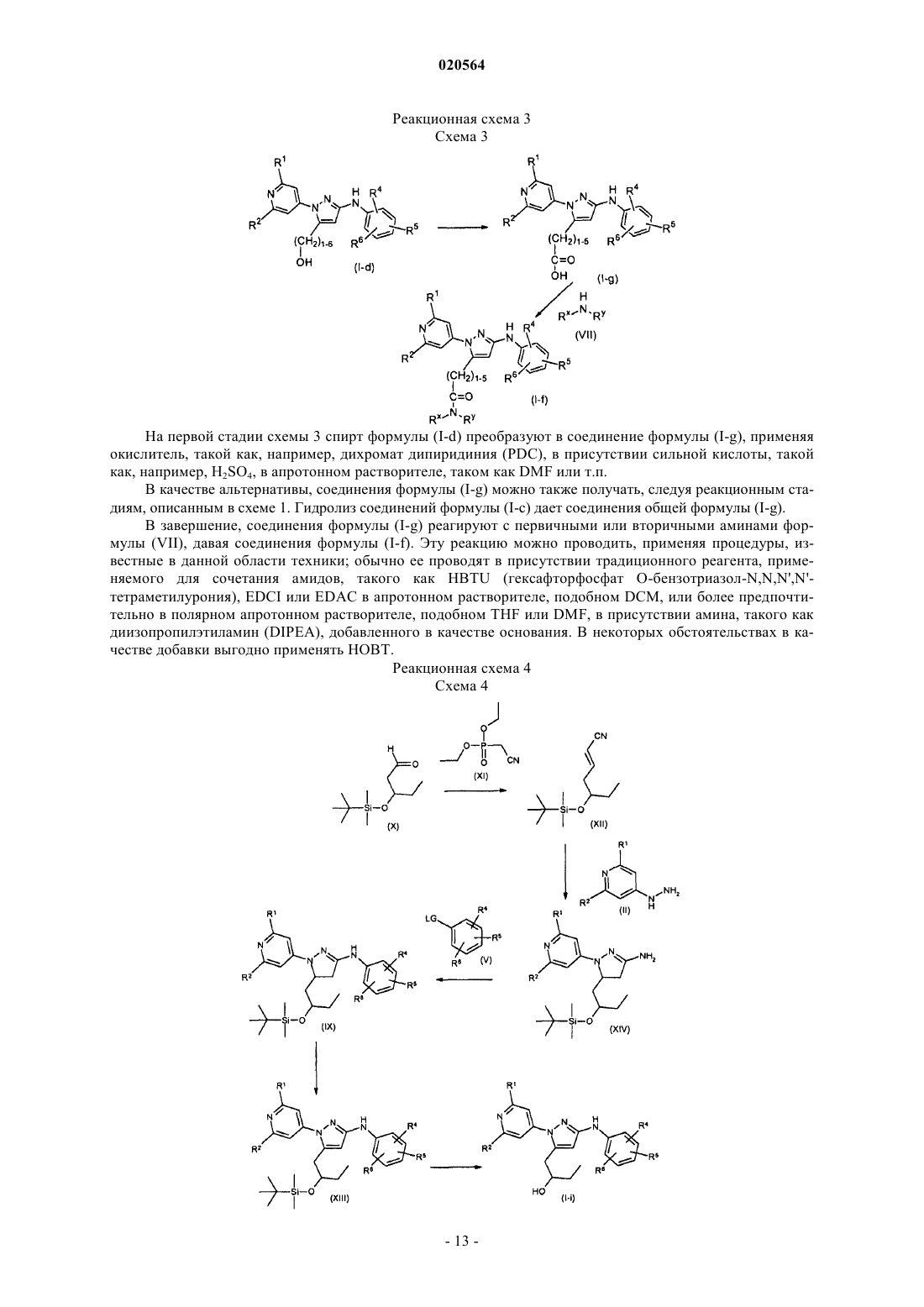
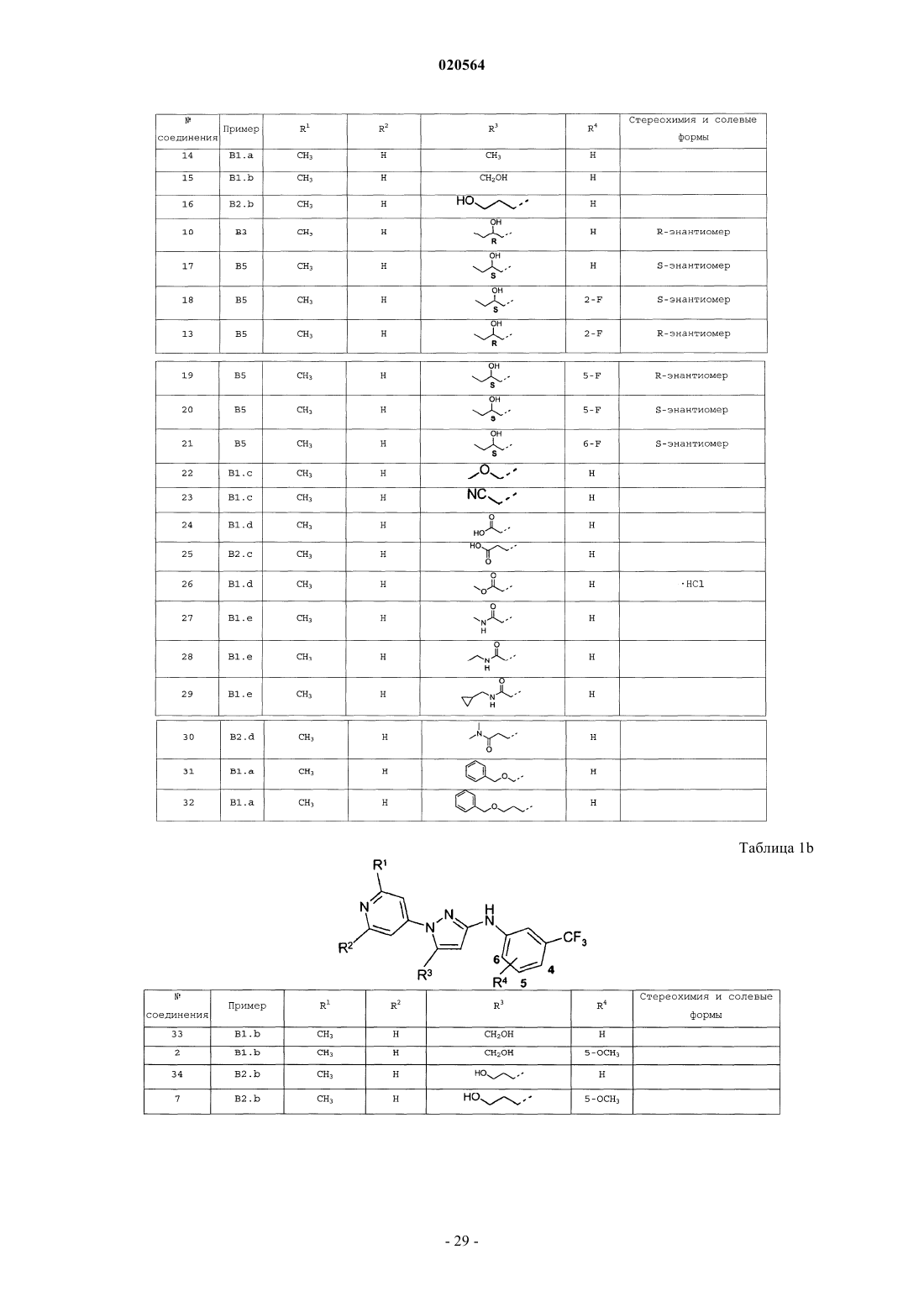
Замещенные n-фенил-1-(4-пиридинил)-1н-пиразол-3-амины
Номер патента: 20564
Опубликовано: 30.12.2014
Авторы: Макдональд Грегор Джеймс, Тюринг Йоханнес Вильхельмус Йохн Ф., Ван Дер Кейбюс Франс Альфонс Мария, Ван Росбрук Ив Эмиль Мария
Формула / Реферат
1. Соединение формулы (I)
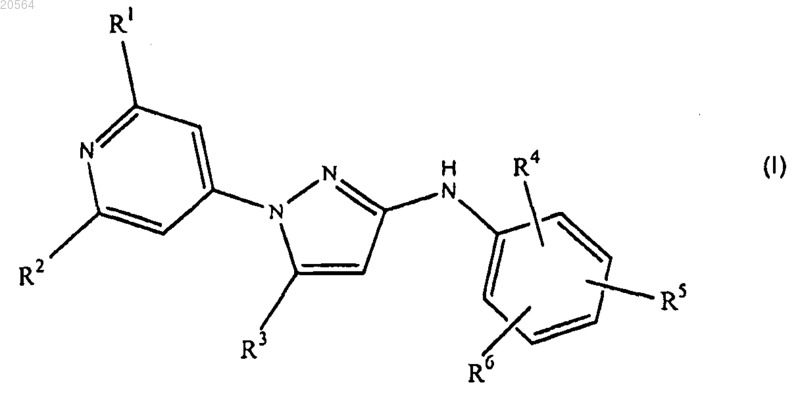
или его стереохимически изомерные формы, где
каждый из R1 и R2 независимо представляет собой водород или C1-4-алкил;
R3 представляет собой С1-6-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, С1-6-алкилоксигруппы, бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-;
каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С3-6-алкил или (цикло-С3-6-алкил)-C1-4-алкил;
Rz представляет собой водород или С1-3-алкил;
каждый из R4, R5 и R6 независимо представляет собой водород, галоген, С1-6-алкил, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; или
R4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; или
его фармацевтически приемлемая аддитивная соль.
2. Соединение по п.1 или его стереоизомерная форма, где
каждый из R1 и R2 независимо представляет собой водород или метил;
R3 представляет собой С1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы, бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-;
каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С3-6-алкил или (цикло-С3-6-алкил)-C1-4-алкил;
Rz представляет собой водород или C1-3-алкил;
каждый из R4, R5 и R6 независимо представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; или
R4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; или
его фармацевтически приемлемая аддитивная соль.
3. Соединение по п.1 или 2, где
каждый из R4, R5 и R6 независимо представляет собой галоген, С1-6-алкил, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; или
R4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-.
4. Соединение по п.1 или его стереоизомерная форма, где
каждый из R1 и R2 независимо представляет собой водород или метил;
R3 представляет собой метил; гидроксиметил; гидроксипропил; (2R)-2-гидроксибутил; (2S)-2-гидроксибутил; метоксиметил; цианометил; карбоксиметил; карбоксиэтил; 2-метокси-2-оксоэтил; 3-метокси-3-оксопропил; 2-метиламино-2-оксоэтил; 2-этиламино-2-оксоэтил; 2-[(циклопропилметил)амино]-2-оксоэтил; 2-(циклопропиламино)-2-оксоэтил; 2-(циклобутиламино)-2-оксоэтил; 3-(диметиламино)-3-оксопропил; бензилоксиметил; бензилоксипропил или 2-[(1-метилэтил)амино]-2-оксоэтил;
каждый из R4, R5 и R6 независимо представляет собой водород, хлор, фтор, бром, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; или
R4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; или
его фармацевтически приемлемая аддитивная соль.
5. Соединение по п.1 или его стереоизомерная форма, где по меньшей мере один из R4, R5 или R6 является отличным от водорода.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-5.
7. Способ получения композиции п.6, отличающийся тем, что фармацевтически приемлемый носитель тщательно перемешивают с терапевтически эффективным количеством соединения по любому из пп.1-5.
8. Комбинация, содержащая
(a) соединение формулы (I) по п.1 и
(b) агонист никотинового рецептора типа α7, выбранный из моногидрохлорида 4-бромфенилового сложного эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR180711A); (-)-спиро[1-азабицикло[2.2.2]октан-3,5'-оксазолидин]-2'-она; (+)-N-(1-азабицикло[2.2.2]окт-3-ил)бензо[b]фуран-2-карбоксамида; дигидрохлорида 3-[(2,4-диметокси)бензилиден]анабазеина (GTS-21); [гидрохлорида N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида] PNU-282987; никотина; варениклина; А-582941; AR-R17779; ТС-1698; РНА-709829; трописетрона; WAY-317538; MEM3454; EVP-6124; ТС-5619; МЕМ-63908 и AZD-0328, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при предупреждении или лечении психотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний.
9. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
10. Применение соединения по любому из пп.1-5 при лечении или профилактике психотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний.
11. Применение по п.10, где указанное соединение предназначено для лечения или предупреждения болезни Альцгеймера или деменции.
12. Способ лечения психотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний у субъекта, включающий введение указанному субъекту терапевтически эффективного количества фармацевтической композиции, содержащей соединение по любому из пп.1-5 и фармацевтически приемлемый носитель.
Текст
Настоящее изобретение относится к производным N-фенил-1-(4-пиридинил)-1 Н-пиразол-3-амина,соответствующим формуле (I) Макдональд Грегор Джеймс, Тюринг Йоханнес Вильхельмус Йохн Ф., Ван Дер Кейбюс Франс Альфонс Мария,Ван Росбрук Ив Эмиль Мария (BE) где R1, R2, R3, R4, R5, R6 имеют значения, определенные в пунктах формулы изобретения, и к их фармацевтически приемлемым солям, способам их получения, фармацевтическим композициям,содержащим их, и их применению в терапии. Конкретно, настоящее изобретение относится к положительным аллостерическим модуляторам никотиновых рецепторов ацетилхолина,причем такой положительный аллостерический регулятор обладает способностью увеличивать эффективность агонистов никотинового рецептора.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Настоящее изобретение относится к производным N-фенил-1-(4-пиридинил)-1 Н-пиразол-3-амина и их фармацевтически приемлемым солям, способам их получения, фармацевтическим композициям, содержащим их, и их применению в терапии. Конкретно, настоящее изобретение относится к положительным аллостерическим модуляторам никотиновых рецепторов ацетилхолина, причем такие положительные аллостерические модуляторы обладают способностью увеличивать эффективность агонистов никотиновых рецепторов. Уровень техники прототипаWO 2007/118903 раскрывает 1-алкил-3-анилин-5-арил-1,2,4-триазолы в качестве положительных модуляторов никотиновых рецепторов ацетилхолина, полезных для лечения неврологических, дегенеративных и психиатрических расстройств.WO 2005/051917 раскрывает производные пиразолила в форме лекарственных средств для лечения острых или хронических нейрональных регрессий.WO 2009/135944 раскрывает производные 1-алкил-3-анилин-5-арилпиразола в качестве положительных аллостерических модуляторов никотиновых рецепторов ацетилхолина. ЕР 0248523 раскрывает N-[4-метоксифенил)-1-метил-5-фенил-1 Н-пиразол-3-амин, который можно применять в качестве противовоспалительного средства широкого спектра. Предпосылки создания изобретения В нормальном состоянии холинергические рецепторы связывают эндогенный нейротрансмиттер ацетилхолин (ACh), тем самым индуцируя открытие ионных каналов. Рецепторы ACh в центральной нервной системе млекопитающих можно подразделить на мускариновый (mAChR) и никотиновый(nAChR) подтипы, основываясь на агонистических активностях мускарина и никотина соответственно. Никотиновые рецепторы ацетилхолина представляют собой управляемые лигандами ионные каналы,содержащие пять субъединиц. Членов семейства генов субъединицы nAChR подразделяют на две группы, основываясь на их аминокислотных последовательностях; одна группа содержит так называемую субъединицу, а вторая группа содержит -субъединицу. Было показано, что функциональные рецепторы образованы тремя видам субъединиц (7, 8 и 9), экспрессированными одиночно, которые, как предполагают, таким образом образуют гомоолигомерные пентамерные рецепторы. Была разработана модель аллостерического переходного состояния nAChR, включающая, по меньшей мере, состояние покоя, активированное состояние и "десенсибилизированное" состояние закрытых каналов, при котором рецепторы становятся нечувствительными к агонисту. Разные лиганды nAChR могут стабилизировать то конформационное состояние рецептора, с которым они предпочтительно связываются. Например, агонисты ACh и (-)-никотина, соответственно, стабилизируют активное и десенсибилизированное состояния. Изменения активности никотиновых рецепторов наблюдали в ряде заболеваний. Некоторые из них,например астенический бульбарный паралич (миастения гравис) и аутосомно-доминантная ночная лобнодолевая эпилепсия (ADNFLE) связаны с уменьшениями активности никотиновой нейротрансмиссии либо вследствие уменьшения числа рецепторов, либо по причине увеличенной десенсибилизации. Согласно некоторым гипотезам, снижение эффектов, обусловленных никотиновыми рецепторами,опосредует те виды когнитивного дефицита, которые наблюдаются в таких заболеваниях, как болезнь Альцгеймера и шизофрения. Эффекты табачного никотина также опосредуются никотиновыми рецепторами, и поскольку эффект никотина должен стабилизировать рецепторы в десенсибилизированном состоянии, повышенная активность никотиновых рецепторов может ослабить влечение к курению. Соединения, которые связывают nAChR, были предложены для лечения ряда расстройств, имеющих отношение к пониженной холинергической функции, таких как пониженная способность к обучению, когнитивный дефицит, дефицит внимания и потеря памяти. Как ожидается, модулирование активности никотинового рецептора типа 7 может оказаться полезным при ряде заболеваний, включая болезнь Альцгеймера, деменцию с тельцами Леви, расстройство с дефицитом внимания и гиперактивностью, тревожность, шизофрению, манию, биполярное расстройство, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травму головного мозга и другие неврологические, дегенеративные и психиатрические расстройства, при которых имеет место потеря холинергических синапсов, включая расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновую зависимость и боль. Однако лечение агонистами никотиновых рецепторов, которые действуют на тот же центр, что иAch, является проблематичным, поскольку ACh не только активирует, но и блокирует активность рецепторов посредством процессов, которые включают десенсибилизирование и бесконкурентную блокаду. Кроме того, длительная активация, по-видимому, индуцирует долгосрочную инактивацию. Поэтому можно ожидать, что агонисты ACh будут как понижать активность, так и повышать ее. У никотиновых рецепторов вообще и у никотинового рецептора типа 7 в частности десенсибилизация ограничивает продолжительность действия применяемого агониста. Описание изобретения Авторы настоящего изобретения обнаружили, что новые производные пиразола могут увеличивать эффективность агонистов никотиновых ацетилхолиновых рецепторов (nAChR). Соединения, имеющие этот тип действия (далее в настоящем документе для них используется название "положительные аллостерические модуляторы"), по-видимому, можно применять для лечения состояний, связанных с уменьшением никотиновой трансмиссии. В терапевтическом плане такие соединения могли бы восстанавливать нормальные межнейронные взаимодействия без неблагоприятного изменения профиля активации во времени. Кроме того, от положительных аллостерических модуляторов можно не ожидать долгосрочной инактивации рецепторов, возможной при длительном применении агонистов. Положительные модуляторы nAChR согласно настоящему изобретению можно применять для лечения и профилактики психотических расстройств, расстройств и заболеваний с нарушением интеллекта,воспалительных заболеваний и состояний, при которых полезно модулирование никотинового рецептора типа 7. Настоящее изобретение относится к производным N-фенил-1-(4-пиридинил)-1 Н-пиразол-3-амина,имеющим свойства положительных аллостерических модуляторов (конкретно, соединений, повышающих эффективность агонистов никотинового рецептора типа 7). Принимая во внимание вышеуказанные фармакологические характеристики указанных производных, можно заключить, что они подходят для применения в качестве лекарственного средства. Кроме того, настоящее изобретение относится к способам их получения и к фармацевтическим композициям, их содержащим. Настоящее изобретение также относится к применению этих производных для изготовления лекарственного средства для лечения и профилактики психотических расстройств, расстройств и заболеваний с нарушением интеллекта, воспалительных заболеваний и состояний, при которых полезно модулирование никотинового рецептора типа 7. Настоящее изобретение также относится к применению этих производных для лечения и предупреждения психотических расстройств, расстройств и заболеваний с нарушением интеллекта, воспалительных заболеваний и состояний, при которых полезно модулирование никотинового рецептора типа 7. Имеется настоятельная потребность в новых положительных аллостерических модуляторах, способных повышать эффективность агонистов никотинового рецептора, которые тем самым откроют новые перспективы для лечения психотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний. Целью настоящего изобретения является преодоление или ослабление по меньшей мере одного из недостатков прежнего уровня техники или представление полезной альтернативы. В соответствии с этим, целью настоящего изобретения является предоставление таких новых соединений. Соединения согласно настоящему изобретению структурно отличаются от прототипных соединений. Настоящее изобретение относится к новым соединениям, соответствующим формуле (I) и их стереоизомерным формам, где каждый из R1 и R2 независимо представляет собой водород или C1-4-алкил;R3 представляет собой C1-6-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, C1-6-алкилоксигруппы, бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-; каждый из Rx и Ry независимо представляет собой водород, С 1-4-алкил, цикло-С 3-6-алкил или (цикло-С 3-6-алкил)-С 1-4-алкил;Rz представляет собой водород или С 1-3-алкил; каждый из R4, R5 и R6 независимо представляет собой водород, галоген, С 1-6-алкил, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Следует понимать, что некоторые из соединений, соответствующих формуле (I), и их аддитивные соли, гидраты и сольваты могут содержать один или несколько центров хиральности и существовать в виде стереоизомерных форм. В текущем разделе настоящего документа будет дано дальнейшее описание настоящего изобретения. В нижеследующем изложении подробно определены различные аспекты настоящего изобретения. Каждый аспект, определенный таким образом, может представлять собой комбинацию с любым другим аспектом или любыми другими аспектами, если не дано ясного противоположного указания. В частности, любая особенность, указанная как предпочтительная или выгодная, может представлять собой комбинацию с любой другой особенностью или любыми другими особенностями, указанными как предпочтительные или выгодные. Подробное описание Термины, используемые при описании соединений согласно настоящему изобретению, следует понимать в соответствии с нижеследующими определениями, если контекст не требует иного толкования. Везде, где в настоящем изобретении использован термин "замещенный", он означает указание на то, что один или несколько водородов на атоме, указанном в том выражении, где использован термин"замещенный", заменен атомом или фрагментом, отобранными из указанной группы, при условии, что не превышена нормальная валентность указанного атома и что результатом замещения является химически устойчивое соединение, т.е. соединение, которое является достаточно прочным для того, чтобы выдержать процедуру выделения из реакционной смеси до необходимой степени чистоты и придания ему формы терапевтического средства. Термин "галоген", относящийся к группе или части группы, является общим названием для фтора,хлора, брома, йода, если не указано иначе или если иное не является ясным из контекста. Термин "С 1-6-алкил", относящийся к группе или части группы, относится к гидрокарбильному радикалу, соответствующему формуле CnH2n+1, где n представляет собой число в диапазоне от 1 до 6. C1-6 алкильные группы содержат от 1 до 6 атомов углерода (конкретно от 1 до 4 атомов углерода, более конкретно от 1 до 3 атомов углерода и еще более конкретно от 1 до 2 атомов углерода). Алкильные группы могут быть линейными или разветвленными и могут быть замещенными, как указано в настоящем документе. Там, где в настоящем документе после атома углерода используется подстрочный индекс, этот подстрочный индекс относится к числу атомов углерода, которое может содержать названная группа. Так, например, С 1-6-алкил включает все линейные или разветвленные алкильные группы с числом атомов углерода от 1 до 6 и, таким образом, включает такие группы, как, например, метил, этил, н-пропил, изопропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил), пентил и его изомеры, гексил и его изомеры и т.п. Термин "C1-4-алкил", относящийся к группе или части группы, относится к гидрокарбильному радикалу, соответствующему формуле CnH2n+1, где n представляет собой число в диапазоне от 1 до 4. C1-4 алкильные группы содержат от 1 до 4 атомов углерода (конкретно от 1 до 3 атомов углерода, более конкретно от 1 до 2 атомов углерода). C1-4-алкил включает все линейные или разветвленные алкильные группы с числом атомов углерода от 1 до 4 и, таким образом, включает такие группы, как, например,метил, этил, н-пропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил) и т.п. Термин "C1-3-алкил", относящийся к группе или части группы, относится к гидрокарбильному радикалу, соответствующему формуле CnH2n+1, где n представляет собой число в диапазоне от 1 до 3. C1-3 алкильные группы содержат от 1 до 3 атомов углерода (предпочтительно от 1 до 2 атомов углерода). C1-3 алкил включает все линейные или разветвленные алкильные группы с числом атомов углерода от 1 до 3 и, таким образом, включает такие группы, как, например, метил, этил, н-пропил, изопропил, 2-метилэтил и его изомеры и т.п. Термин "С 1-6-алкилоксигруппа", относящийся к группе или части группы, относится к радикалу,имеющему формулы ORa, где Ra представляет собой С 1-6-алкил. Неограничивающие примеры подходящих алкилоксигрупп включают метилоксигруппу, этилоксигруппу, пропилоксигруппу, изопропилоксигруппу, бутилоксигруппу, изобутилоксигруппу, втор-бутилоксигруппу, трет-бутилоксигруппу, пентилоксигруппу и гексилоксигруппу. Термин "цикло-С 3-6-алкил" отдельно или в комбинации относится к кольцевому насыщенному углеводородному радикалу, имеющему 3-6 атомов углерода. Неограничивающие примеры подходящего цикло-С 3-6-алкила включают циклопропил, циклобутил, циклопентил и циклогексил. Химические названия соединений согласно настоящему изобретению образованы по правилам номенклатуры, согласованной с Chemical Abstracts Service, с использованием номенклатурного программного обеспечения от Advanced Chemical Development, Inc. (ACD/Name product version 10.01; Build 15494,1 Dec. 2006). Некоторые из соединений, соответствующих формуле (I), могут также существовать в их таутомерной форме. Хотя такие формы не указаны явным образом в вышеуказанной формуле, они предполагаются включенными в объем настоящего изобретения. Когда какая бы то ни было величина появляется в какой бы то ни было составной части более одного раза, тогда каждое определение является независимым. Следует понимать, что некоторые из соединений формулы (I) и их фармацевтически приемлемые аддитивные соли и стереоизомерные формы могут содержать один или несколько центров хиральности и существовать в виде стереоизомерных форм. Термин "стереоизомерные формы", используемый в настоящем документе выше или ниже по тек-3 020564 сту, определяет все возможные стереоизомерные формы, которыми могут обладать соединения, соответствующие формуле (I), и их аддитивные соли. Если не оговорено или не указано иначе, химическое обозначение соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую из индивидуальных изомерных форм, соответствующих формуле (I), и их соли, сольваты, существенно свободные, т.е. содержащие менее 10% других изомеров (предпочтительно менее 5%, конкретно менее 2% и наиболее предпочтительно менее 1%). Соли соединений, соответствующих формуле (I), предназначенных для терапевтического применения, представляют собой такие соли, в которых противоион является фармацевтически приемлемым. Однако и соли кислот и оснований, не являющихся фармацевтически приемлемыми, могут найти применение, например, в препаративной работе или при очистке фармацевтически приемлемого соединения. Все соли, независимо от их фармацевтической приемлемости или неприемлемости, включены в объем настоящего изобретения. Фармацевтически приемлемые кислотно- и основно-аддититвные соли, как указано выше или ниже в настоящем документе, считаются содержащими терапевтически активные нетоксичные кислотно- или основно-аддитивные солевые формы, которые способны образовывать соединения, соответствующие формуле (I). Фармацевтически приемлемые кислотно-аддитивные соли удобно образовывать, обрабатывая основную форму соединения такой подходящей кислотой. К подходящим кислотам относятся, например, неорганические кислоты, такие как галогенводородные кислоты (например, хлористоводородная или бромисто-водородная кислота), серная, азотная, фосфорная и им подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая,фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, птолуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памовая и им подобные кислоты. Наоборот, обрабатывая соответствующим основанием, можно преобразовывать указанные солевые формы в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, можно преобразовывать в их нетоксичные формы аддитивных солей с металлами или аминами, обрабатывая соответствующими органическими или неорганическими основаниями. К подходящим основным солевым формам относятся, например,соли аммония, соли щелочных и щелочно-земельных металлов (например, соли лития, натрия, калия,магния, кальция и т.п.), соли с органическими основаниями (например, первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин,изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин,диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин,трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; соли бензатина, N-метил-D-глюкамина,гидрабамина) и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Наоборот, обрабатывая соответствующей кислотой, можно солевую форму преобразовывать в форму свободной кислоты. Соединения формулы (I), полученные в процессах, описанных ниже, могут быть синтезированными в форме рацемических смесей энантиомеров, которые можно отделять друг от друга, следуя процедурам разделения, известным в данной области техники. В способах разделения энантиомерных форм соединения формулы (I) применяют жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также производить из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, при условии, что реакции происходят с сохранением стереохимической целостности. Если желательным является конкретный стереоизомер, было бы предпочтительно указанное соединение синтезировать стереоспецифическими препаративными способами. В этих способах будут преимущественно использоваться энантиомерно чистые исходные материалы. В рамках настоящей заявки соединение согласно настоящему изобретению является по своей природе предназначенным для того, чтобы включать все комбинации изотопов тех химических элементов,из которых оно состоит. В рамках настоящей заявки, химический элемент (конкретно, в тех случаях, когда его упоминают в связи с соединением, соответствующим формуле (I включает все изотопы и смеси изотопов этого элемента. Например, когда называют водород, это понимают как ссылку на 1 Н, 2 Н, 3 Н и их смеси. Поэтому соединение согласно настоящему изобретению по своей природе содержит соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивно меченое соединение, где один или несколько нерадиоактивных атомов заменены одним из его радиоактивных изотопов. Под термином "радиоактивно меченое соединение" понимают любое соединение, соответствующее формуле (I), или его фармацевтически приемлемую соль, которое содержит не менее одного радиоактивного атома. Например, соединение может быть меченным радиоактивными изотопами,излучающими позитроны или гамма-лучи. В методиках присоединения радиоактивных лигандов, атомами выбора для замены являются атом 3 Н или атом 125I. Радиоактивными изотопами, излучающими позитроны (PET) и наиболее часто применяемыми для визуализации, являются 11C, 18F, 15O и 13N, все из кото-4 020564 рых получают в ускорителе и которые имеют периоды полураспада, составляющие 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада этих радиоактивных изотопов являются такими короткими, их можно применять только в учреждениях, которые имеют собственные ускорители для их получения. Наиболее широко применяемыми из них являются 18F, 99mTc, 201Tl и 123I. Способы обращения с этими радиоактивными изотопами, их производство, выделение и способы их включения в молекулы известны квалифицированному специалисту в данной области. Конкретный радиоактивный атом выбирают из группы, включающей водород, углерод, азот, серу,кислород и галоген. Конкретный радиоактивный изотоп выбирают из группы, состоящей из 3 Н, 11 С, 18F,122 123 125 131 75I, I, I, I, Br, 76Br, 77Br и 82Br. Термины, описанные выше, и другие термины, используемые в настоящей спецификации, хорошо понятны специалистам в данной области техники. Далее изложены предпочтительные особенности соединений согласно настоящему изобретению. Настоящее изобретение относится к новым соединениям формулы (I) и их стереоизомерным формам, где каждый из R1 и R2 независимо представляет собой водород или C1-4-алкил;R3 представляет собой С 1-6-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, С 1-6-алкилоксигруппы, бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-; каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С 3-6-алкил или (цикло-С 3-6-алкил)-C1-4-алкил;Rz представляет собой водород или С 1-3-алкил; каждый из R4, R5 и R6 независимо представляет собой водород, галоген, С 1-6-алкил, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. В варианте осуществления настоящее изобретение относится к тем соединениям формулы (I) и их стереоизомерным формам, в которых каждый из R1 и R2 независимо представляет собой водород или C1-4-алкил;R3 представляет собой С 1-6-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, C1-6-алкилоксигруппы, бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-; каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С 3-6-алкил или (цикло-С 3-6-алкил)-C1-4-алкил;Rz представляет собой водород или C1-3-алкил; каждый из R4, R5 и R6 независимо представляет собой галоген, С 1-6-алкил, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) и их стереоизомерным формам, в которых действуют одно или несколько из следующих ограничений (предпочтительно все такие ограничения):(i) каждый из R1 и R2 независимо представляет собой водород или метил;(ii) R3 представляет собой C1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы,бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-;(iii) каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С 3-6-алкил или(iv) Rz представляет собой водород или C1-3-алкил;(v) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; в частности галоген, цианогруппу, трифторметил,трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) и их стереоизомерным формам, в которых(i) каждый из R1 и R2 независимо представляет собой водород или метил;(ii) R3 представляет собой С 1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы,бензилоксигруппы и RxRyN-C(=O)-;(iii) каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С 3-6-алкил или(iv) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; в частности галоген, цианогруппу, трифторметил,трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Другой вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения, где действуют одно или несколько из следующих ограничений (предпочтительно все такие ограничения):(i) каждый из R1 и R2 независимо представляет собой водород или метил;(ii) R3 представляет собой С 1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы,бензилоксигруппы, RxRyN-C(=O)- и RzO-C(=O)-;(iv) Ry представляет собой водород или метил;(v) Rz представляет собой водород или метил;(vi) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу; в частности галоген, цианогруппу, трифторметил,трифторметоксигруппу или метоксигруппу; илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Другой вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения, где действуют одно или несколько из следующих ограничений (предпочтительно все такие ограничения):(i) каждый из R1 и R2 независимо представляет собой водород или метил;(iii) каждый из R4, R5 и R6 независимо представляет собой водород, хлор, фтор, бром, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, хлор, фтор, бром, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу); илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Другой вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения, где действуют следующие ограничения:R3 представляет собой метил; гидроксиметил; гидроксипропил; (2R)-2-гидроксибутил; (2S)-2 гидроксибутил; (2R)-2-гидроксипропил; (2S)-2-гидроксипропил; метоксиметил; цианометил; карбоксиметил; карбоксиэтил; 2-метокси-2-оксоэтил; 3-метокси-3-оксопропил; 2-метиламино-2-оксоэтил; 2 этиламино-2-оксоэтил; 2-[(циклопропилметил)амино]-2-оксоэтил; 2-(циклопропиламино)-2-оксоэтил; 2(циклобутиламино)-2-оксоэтил; 3-(диметиламино)-3-оксопропил; бензилоксиметил; бензилоксипропил; или 2-[(1-метилэтил)амино]-2-оксоэтил; и к их фармацевтически приемлемым аддитивным солям. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где действуют одно или несколько из следующих ограничений:(i) R3 представляет собой С 1-6-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы,бензилоксигруппы и RxRyN-C(=O)-;(ii) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, С 1-6-алкил, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, C1-6-алкил, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу). Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где действуют одно или несколько из следующих ограничений:(i) R3 представляет собой C1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила, цианогруппы, метоксигруппы,бензилоксигруппы и RxRyN-C(=O)-;(ii) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, цианогруппу, трифторметил,трифторметоксигруппу или метоксигруппу). Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где действуют следующие ограничения:R6 представляет собой водород, галоген, цианогруппу, трифторметил, С 1-6-алкил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, цианогруппу, трифторметил, С 1-6-алкил, трифторметоксигруппу или метоксигруппу) иR4 и R5 присоединены к двум соседним атомам углерода и совместно образуют двухвалентный радикал формулы -O-CF2-O-. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где действуют следующие ограничения:R6 представляет собой водород, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, цианогруппу, трифторметил, трифторметоксигруппу или метоксигруппу); иR4 и R5 присоединены к двум соседним атомам углерода и совместно образуют двухвалентный радикал формулы -O-CF2-O-. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где действуют одно или несколько из следующих ограничений:(i) R3 представляет собой С 1-6-алкил, в частности C1-4-алкил, необязательно, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из гидроксила и RxRyNС(=O)-;(ii) каждый из Rx и Ry независимо представляет собой водород, C1-4-алкил, цикло-С 3-6-алкил или(iii) каждый из R4, R5 и R6 независимо представляет собой водород, галоген, трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, трифторметил, трифторметоксигруппу или метоксигруппу); илиR4 и R5, когда они присоединены к двум соседним атомам углерода, совместно образуют двухвалентный радикал формулы -O-CF2-O-; и к их фармацевтически приемлемым аддитивным солям. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где по меньшей мере один из R4, R5 или R6 является отличным от водорода. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где каждый из R4, R5 и R6 независимо представляет собой водород, галоген, С 1-6-алкил, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу (конкретно, галоген, C1-6-алкил, цианогруппу,трифторметил, трифторметоксигруппу или метоксигруппу). Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или к любой их подгруппе, как указано в любом из других вариантов осуществления настоящего изобретения,где R4 и R5 присоединены к двум соседним атомам углерода и совместно образуют двухвалентный радикал формулы -O-CF2-O- и R6 представляет собой водород. В варианте осуществления настоящего изобретения соединение формулы (I) является выбранным из группы, содержащейN-(3,4-дифторфенил)-1-(2-метил-4-пиридинил)-5-[(фенилметокси)метил]-1 Н-пиразол-3-амин,3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-метанол,(R)-3-[(3,4-дифторфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,(R)этил-1-(2-метил-4-пиридинил)-3-3-(трифторметил)фенил]амино]-1 Н-пиразол-5-этанол,N-(3,4-дифторфенил)-5-(метоксиметил)-1-(2-метил-4-пиридинил)-1 Н-пиразол-3-амин,3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетонитрил,(S)этил-1-(2-метил-4-пиридинил)-3-3-(трифторметил)фенил]амино]-1 Н-пиразол-5-этанол,гидрохлорид метилового сложного эфира 3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)1 Н-пиразол-5-уксусной кислоты,3-[(3,4-дифторфенил)амино]-N-метил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетамид,3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-уксусную кислоту,(S)-3-[(3,4-дифторфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,3-[(3,4-дифторфенил)амино]-N-этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетамид,N-(циклопропилметил)-3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 ацетамид,N-(3,4-дифторфенил)-1-(2-метил-4-пиридинил)-5-[3-(фенилметокси)пропил]-1 Н-пиразол-3-амин,(S)-3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 этанол,(S)этил-3-3-метокси-5-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 этанол,(S)этил-1-(2-метил-4-пиридинил)-3-[(2,3,4-трифторфенил)амино]-1 Н-пиразол-5-этанол,(S)этил-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-этанол,(S)этил-3-4-метокси-3-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 этанол,(S)-3-[(3-хлорфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,(S)-3-[(3-хлор-5-метоксифенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,5-бром-2-5-[(2S)-2-гидроксибутил]-1-(2-метил-4-пиридинил)-1 Н-пиразол-3-ил]амино]бензонитрил,(S)этил-1-(2-метил-4-пиридинил)-3-[(2,4,5-трифторфенил)амино]-1 Н-пиразол-5-этанол,(S)-3-[(3-хлор-2-фторфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,N-(2,2-дифтор-1,3-бензодиоксол-5-ил)-1-(2-метил-4-пиридинил)-5-[3-(фенилметокси)пропил]-1 Нпиразол-3-амин,3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанол,3-[(3,4-дифторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропановую кислоту,N-(3-хлор-2-фторфенил)-1-(2-метил-4-пиридинил)-5-[(фенилметокси)метил]-1 Н-пиразол-3-амин,3-[(3-хлор-2-фторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-метанол,3-[(3-хлор-2-фторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетонитрил,3-[(3,4-дифторфенил)амино]-N,N-диметил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанамид,N,N-диметил-1-(2-метил-4-пиридинил)-3-3-(трифторметил)фенил]амино]-1 Н-пиразол-5 пропанамид,3-3-метокси-5-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанол,метиловый сложный эфир 3-[(3-хлор-2-фторфенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 уксусной кислоты,1-(2-метил-4-пиридинил)-5-[3-(фенилметокси)пропил]-N-[3-(трифторметил)фенил]-1 Н-пиразол-3 амин,N-[3-метокси-5-(трифторметил)фенил]-1-(2-метил-4-пиридинил)-5-[3-(фенилметокси)пропил]-1 Нпиразол-3-амин,3-[(3-хлор-2-фторфенил)амино]-N-метил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетамид,3-[(3-хлор-2-фторфенил)амино]-N-этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-ацетамид,3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанол,3-[(3-хлор-2-фторфенил)амино]-N-(циклопропилметил)-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 ацетамид,N-(2,2-дифтор-1,3-бензодиоксол-5-ил)-1-(2-метил-4-пиридинил)-5-[(фенилметокси)метил]-1 Нпиразол-3-амин,1-(2-метил-4-пиридинил)-3-3-(трифторметил)фенил]амино]-1 Н-пиразол-5-ацетонитрил,1-(2-метил-4-пиридинил)-5-[(фенилметокси)метил]-N-[3-(трифторметил)фенил]-1 Н-пиразол-3 амин,1-(2-метил-4-пиридинил)-3-3-(трифторметил)фенил]амино]-1 Н-пиразол-5-метанол,3-3-метокси-5-(трифторметил)фенил]амино]-N,N-диметил-1-(2-метил-4-пиридинил)-1 Н-пиразол 5-пропанамид,3-[(3-хлор-2-фторфенил)амино]-N,N-диметил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанамид,-8 020564N-(3-хлор-5-метоксифенил)-1-(2-метил-4-пиридинил)-5-[3-(фенилметокси)пропил]-1 Н-пиразол-3 амин,3-[(3-хлор-5-метоксифенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропанол,3-[(3-хлор-5-метоксифенил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-пропановую кислоту,N-циклопропил-3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2-метил-4-пиридинил)-1 Нпиразол-5-ацетамид,N-циклобутил-3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол 5-ацетамид,3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-N-метил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 ацетамид,1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-ацетонитрил,метиловый сложный эфир 1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Нпиразол-5-уксусной кислоты,1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-метанол,N-метил-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-ацетамид,N-(циклопропилметил)-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол 5-ацетамид,N-циклопропил-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,N-этил-3-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-ацетамид,N-циклобутил-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,N-(3-хлор-2-фторфенил)-1-(2,6-диметил-4-пиридинил)-5-[(фенилметокси)метил]-1 Н-пиразол-3 амин,3-[(3-хлор-2-фторфенил)амино]-1-(2,6-диметил-4-пиридинил)-1 Н-пиразол-5-метанол,3-[(3-хлор-2-фторфенил)амино]-1-(2,6-диметил-4-пиридинил)-1 Н-пиразол-5-ацетонитрил,метиловый сложный эфир 3-[(3-хлор-2-фторфенил)амино]-1-(2,6-диметил-4-пиридинил)-1 Нпиразол-5-уксусной кислоты,3-[(3-хлор-2-фторфенил)амино]-N-(циклопропилметил)-1-(2,6-диметил-4-пиридинил)-1 Н-пиразол 5-ацетамид,3-[(3-хлор-2-фторфенил)амино]-1-(2,6-диметил-4-пиридинил)-N-этил-1 Н-пиразол-5-ацетамид,3-[(3-хлор-2-фторфенил)амино]-N-циклопропил-1-(2,6-диметил-4-пиридинил)-1 Н-пиразол-5 ацетамид,N-(1-метилэтил)-1-(2-метил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,1-(2,6-диметил-4-пиридинил)-5-[(фенилметокси)метил]-N-[3-(трифторметокси)фенил]-1 Н-пиразол 3-амин,1-(2,6-диметил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-ацетонитрил,метиловый сложный эфир 1-(2,6-диметил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Нпиразол-5-уксусной кислоты,1-(2,6-диметил-4-пиридинил)-N-метил-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,1-(2,6-диметил-4-пиридинил)-N-этил-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5-ацетамид,N-(циклопропилметил)-1-(2,6-диметил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Нпиразол-5-ацетамид,N-циклопропил-1-(2,6-диметил-4-пиридинил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,1-(2,6-диметил-4-пиридинил)-N-(1-метилэтил)-3-3-(трифторметокси)фенил]амино]-1 Н-пиразол-5 ацетамид,(S)этил-1-(2-метил-4-пиридинил)-3-[(3,4,5-трифторфенил)амино]-1 Н-пиразол-5-этанол,(R)этил-1-(2-метил-4-пиридинил)-3-[(3,4,5-трифторфенил)амино]-1 Н-пиразол-5-этанол,(R)-3-[(3-хлор-2-фторфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,(R)этил-1-(2-метил-4-пиридинил)-3-[(2,3,4-трифторфенил)амино]-1 Н-пиразол-5-этанол,(R)этил-3-3-метокси-5-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1 Н-пиразол-5 этанол,(R)-3-[(3-хлор-5-метоксифенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,(R)-3-[(3-хлор-5-фторфенил)амино]этил-1-(2-метил-4-пиридинил)-1 Н-пиразол-5-этанол,включая их любые стереохимически изомерные формы и их фармацевтически приемлемые аддитивные соли. Получение соединений Соединение согласно настоящему изобретению обычно может быть получено посредством последовательности стадий, каждая из которых известна квалифицированному специалисту. В частности, соединения согласно настоящей заявке на патент могут быть получены одним или несколькими из следующих препаративных способов. В нижеследующих схемах, если не указано иначе, все переменные величины использованы так, как определено в формуле (I). Реакционная схема 1 Схема 1 Соединения согласно настоящему изобретению, соответствующие формулам (I-a), (I-b), (I-c), (I-d) и(I-е), можно получать посредством любой из нескольких стандартных процедур синтеза, обычно применяемых квалифицированными специалистами в области органической химии. На первой стадии промежуточные соединения формулы (IV) обычно получают посредством реакции замыкания кольца между промежуточным соединением формулы (II) и промежуточным соединением формулы (III) в условиях, известных в данной области техники. Это преобразование обычно проводят в протонном растворителе, в частности в спирте, таком как, например, этанол (EtOH), в присутствии сильного основания, такого как, например, этоксид натрия или металлический натрий. Перемешивание и повышенные температуры могут увеличить скорость реакции. Промежуточные соединения формулы (II) и (III) являются коммерчески доступными или легко могут быть получены квалифицированными специалистами в данной области техники. На второй стадии промежуточные соединения формулы (VI) могут быть получены в реакции сочетания между аминопроизводным формулы (IV) и промежуточным соединением формулы (V) с использованием катализа переходным металлом. LG определено как уходящая группа, такая как, например, Cl, Br,I, тозилат, мезилат или трифлат (конкретно, F, Cl, Br или I, более конкретно, Cl, Br или I, еще более конкретно, Br). Обычно в реакции этого типа применяют палладиевый катализатор (например, Pd2(dba)3). Реакцию сочетания, катализируемую палладием, обычно проводят в присутствии бидентатного фосфинового лиганда (такого как, например, [1,1'-бинафталин]-2,2'-диил-бис-[дифенилфосфин] (BINAP) или т.п.) и в присутствии сильного неорганического основания (такого как, например, трет-бутоксид калия или натрия (NaOtBu. Этот тип реакции можно успешно проводить в апротонном растворителе (таком как, например, тетрагидрофуран (THF) или т.п.) при повышенных температурах (конкретно, от 100 до 130 С). Промежуточные соединения формулы (V) являются коммерчески доступными или легко могут быть получены квалифицированными специалистами в данной области техники. Соединение формулы (I-е) может быть синтезировано посредством реакции промежуточного соединения формулы (VI) в присутствии окислителя (такого как, например, MnO2) в присутствии подходящего растворителя (такого как, например, дихлорметан (DCM. Соединения формулы (I-е) могут быть преобразованы в соединение формулы (I-d) посредством реакции с подходящим деалкилирующим средством (таким как, например, BBr3) в присутствии подходящего растворителя (такого как, например, DCM или дихлорэтан (DCE. В качестве альтернативы, соединения формулы (I-d) могут быть получены посредством каталитической гидрогенизации соединения формулы (I-е). В качестве катализатора можно применять Pd/C. Реакцию проводят в присутствии источника водорода (такого как Н 2 или гидразин) и в присутствии растворителя, такого как спирт (обычно МеОН или EtOH). Перемешивание и повышенные температуры могут увеличить скорость реакции. Затем могут быть получены соединения формулы (I-c) посредством обработки соединения формулы (I-d) на первой стадии галогенидом сульфоновой кислоты (таким как, например, мезилхлорид или тозилхлорид) в присутствии аминного основания (такого как, например, триэтиламин). Эту реакцию можно проводить в подходящем растворителе (обычно, таком как THF). На второй стадии реакции добавляют источник цианида, такой как цианид щелочного металла (обычно NaCN), совместно с органическим растворителем, таким как диметилсульфоксид (DMSO). На следующей стадии реакции соединения общей формулы (I-c) сначала гидролизуют, а затем этерифицируют по Фишеру, получая соединение формулы (I-b). Обычно этот тип реакции проводят в водной кислоте (такой как, например, водный раствор HCl) при повышенной температуре (такой как 70 С или температура кипячения с обратным холодильником). Затем карбоновокислотное производное, образованное в этой реакции, претерпевает конденсацию, катализируемую кислотой, с желательным спиртом(метанолом (МеОН), этанолом (EtOH) или т.п.) в присутствии кислоты (обычно, такой как HCl). В завершение, соединения формулы (I-b) могут реагировать далее с аминами формулы (VII), давая соединение формулы (I-а). Растворитель, подходящий для этой реакции, можно применять в зависимости от выбора амина. Предпочтительным растворителем является протонный растворитель, такой как низший алкиловый спирт (например, МеОН или т.п.). Эту реакцию можно проводить, используя реакционные условия, хорошо известные квалифицированным специалистам в данной области техники, в зависимости от выбора амина. Реакционная схема 2 Схема 2 В качестве альтернативы соединения формулы (I-е) могут быть получены из промежуточных соединений формулы (VIII) согласно реакционному протоколу, описанному в схеме 2. Промежуточное соединение формулы (VIII) может быть синтезировано посредством реакции промежуточного соединения формулы (IV) в присутствии окислителя, такого как, например, MnO2 в присутствии подходящего растворителя, такого как, например, дихлорметан (DCM). Затем соединение формулы (I-е) может быть получено в реакции сочетания между аминопроизводным формулы (VIII) и промежуточным соединением формулы (V) с использованием катализа переходным металлом. LG определено как уходящая группа, такая как, например, Cl, Br, I, тозилат, мезилат или трифлат (конкретно, F, Cl, Br или I, более конкретно, Cl, Br или I, еще более конкретно, Br). Обычно в реакции этого типа применяют палладиевый катализатор (например, Pd2(dba)3). Реакцию сочетания, катализируемую палладием, обычно проводят в присутствии бидентатного фосфинового лиганда, такого как, например, [1,1'-бинафталин]-2,2'-диил-бис-[дифенилфосфин] (BINAP) или т.п., и в присутствии сильного неорганического основания, такого как, например, трет-бутоксид калия или натрия (NaOtBu). Этот тип реакции можно успешно проводить в апротонном растворителе, таком как, например, тетрагидрофуран (THF) или т.п., при повышенных температурах (в частности, от 100 до 130 С). На первой стадии схемы 3 спирт формулы (I-d) преобразуют в соединение формулы (I-g), применяя окислитель, такой как, например, дихромат дипиридиния (PDC), в присутствии сильной кислоты, такой как, например, H2SO4, в апротонном растворителе, таком как DMF или т.п. В качестве альтернативы, соединения формулы (I-g) можно также получать, следуя реакционным стадиям, описанным в схеме 1. Гидролиз соединений формулы (I-c) дает соединения общей формулы (I-g). В завершение, соединения формулы (I-g) реагируют с первичными или вторичными аминами формулы (VII), давая соединения формулы (I-f). Эту реакцию можно проводить, применяя процедуры, известные в данной области техники; обычно ее проводят в присутствии традиционного реагента, применяемого для сочетания амидов, такого как HBTU (гексафторфосфат O-бензотриазол-N,N,N',N'тетраметилурония), EDCI или EDAC в апротонном растворителе, подобном DCM, или более предпочтительно в полярном апротонном растворителе, подобном THF или DMF, в присутствии амина, такого как диизопропилэтиламин (DIPEA), добавленного в качестве основания. В некоторых обстоятельствах в качестве добавки выгодно применять НОВТ. Реакционная схема 4 Схема 4 Промежуточное соединение формулы (XII) синтезировали посредством реакции промежуточного соединения формулы (X) (3-(1,1-диметилэтил)диметилсилил]окси]пентаналь) с цианопроизводным формулы (XI) (диэтиловый сложный эфир цианометанфосфоновой кислоты) в присутствии сильного неорганического основания (такого как NaH или т.п.) и растворителя (такого как, например, THF). Промежуточное соединение формулы (X) и промежуточное соединение формулы (XI) легко могут быть получены квалифицированными специалистами в данной области техники. Затем могут быть получены промежуточные соединения общей формулы (XIV) посредством реакции замыкания кольца между промежуточным соединением формулы (XII) и промежуточным соединением формулы (II) в условиях, известных в данной области техники. Это преобразование обычно проводят в протонном растворителе (конкретно, в спирте, таком как, например, EtOH) в присутствии сильного основания (такого как, например, этоксид натрия или металлический натрий). Перемешивание и повышенные температуры могут увеличить скорость реакции. Промежуточные соединения формулы (II) являются коммерчески доступными или легко могут быть получены квалифицированными специалистами в данной области техники. На следующей стадии промежуточные соединения формулы (IX) могут быть получены в реакции сочетания между аминопроизводным формулы (XIV) и промежуточным соединением формулы (V) с использованием катализа переходным металлом.LG определено как уходящая группа, такая как, например, Cl, Br, I, тозилат, мезилат или трифлат (конкретно, F, Cl, Br или I, более конкретно, Cl, Br или I, еще более конкретно, Br). Обычно в реакции этого типа применяют палладиевый катализатор (например,Pd2(dba)3). Реакцию сочетания, катализируемую палладием, обычно проводят в присутствии бидентатного фосфинового лиганда, такого как, например, [1,1'-бинафталин]-2,2'-диил-бис-[дифенилфосфин] (BINAP) или т.п., и в присутствии сильного неорганического основания, такого как, например, трет-бутоксид калия или натрия (NaOtBu). Этот тип реакции можно успешно проводить в апротонном растворителе (таком как, например, тетрагидрофуран (THF) или т.п.) при повышенных температурах (конкретно, от 100 до 130 С). Промежуточное соединение формулы (XIII) может быть синтезировано посредством реакции промежуточного соединения формулы (IX) в присутствии окислителя (такого как, например, MnO2) в присутствии подходящего растворителя (такого как, например, дихлорметан (DCM. Квалифицированный специалист отметит, что можно поменять очередность предшествующих двух стадий и что результатом этого также будет промежуточное соединение формулы (XIII). И, наконец, завершая последовательность, показанную на схеме 4, можно в присутствии десилилирующего средства, такого как четвертичный фторид аммония (предпочтительно фторид тетрабутиламмония (TBAF, удалить силильную защитную группу, применяя условия, известные в данной области техники. Обычно этот тип реакции проводят в подходящем растворителе (таком как, например, THF). Применяя варианты промежуточных соединений формулы (X), которые также являются коммерчески доступными или легко могут быть получены квалифицированными специалистами в данной области техники, можно получать аналоги соединений формулы (I-i), в которых гидроксильная группа помещена в другом положении на алкильной цепи и/или в которых алкильная цепь (R3) представляет собой С 1-3 алкил. Фармакология Было найдено, что соединения согласно настоящему изобретению представляют собой положительные аллостерические модуляторы никотинового рецептора типа 7. Никотиновый рецептор типа 7(7 nAChR) относится к суперсемейству цис-петельных ионотропных лиганд-управляемых ионных каналов, которое включает семейства рецепторов 5-НТ 3, GABAA и глицина. Он активируется ацетилхолином и холином (продуктом распада ацетилхолина); главной особенностью 7 nAChR является его быстрая десенсибилизация, наблюдаемая при продолжительном присутствии агониста. Он является вторым по численности подтипом никотиновых рецепторов в головном мозге и важным регулятором высвобождения многих нейротрансмиттеров. Он дискретно распределен в некоторых структурах мозга, важных для процессов, определяющих внимание и познавательные способности, таких как гиппокамп и префронтальная кора; он имеет отношение к разнообразным психиатрическим и неврологическим расстройствам у человека. Он также имеет отношение к холинергическому воспалительному пути. Генетические свидетельства о его связи с шизофренией представлены в форме сильной корреляции между характерным признаком шизофрении (дефицитом сенсорного управления) и 7-локусом на 15q13-14 и полиморфизмами в коровом промоторном регионе гена 7. Медико-патологические исследования свидетельствуют о потере иммунореактивности 7 и о связывании -Btx в гиппокампе, лобной и поясной коре головного мозга при шизофрении, болезни Паркинсона и болезни Альцгеймера и в паравентрикулярном ядре и в соединяющем ядре при аутизме. Фармакологические данные, такие как повышенная по сравнению с нормальными индивидами склонность к курению у шизофреников, были интерпретированы как попытки пациентов самолечением компенсировать дефицит 7-никотинергической трансмиссии. Временная нормализация дефектов сенсорного управления (преимпульсное ингибирование, PPI), наблюдаемая как в моделях на животных, так и у человека после введения никотина, и временное восстановление нормального сенсорного управления у шизофреников в периоды низкой холинергической активности в переднем мозге (например, во время второй фазы сна) были интерпретированы как результат временной активации 7-никотинового рецептора с последующей десенсибилизацией. Таким образом, имеются веские основания для предположения, что активирование 7 nAChR будет иметь благоприятные терапевтически эффекты при ряде психиатрических и неврологических расстройств центральной нервной системы. Как уже было указано, 7 nAChR быстро претерпевает десенсибилизацию при длительном присутствии естественного трансмиттера ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенсибилизированном состоянии рецептор остается связанным с лигандом, но функционально неактивным. Это не создает значительных осложнений для естественных трансмиттеров, таких как ацетилхолин и холин, поскольку они являются субстратами для механизмов очень эффективного разложения(ацетилхолинэстеразой) и клиренса (переносчиком холина). Эти механизмы разложения и клиренса трансмиттера, по-видимому, должны поддерживать баланс между активируемыми и десенсибилизированными 7 nAChR в физиологически полезном диапазоне. Однако синтетические агонисты, которые не являются субстратами для естественных механизмов разложения и клиренса, считают потенциально способными как к избыточной стимуляции, так и к сдвигу популяционного равновесия 7 nAChR в сторону устойчиво десенсибилизированного состояния, что нежелательно при расстройствах, при которых некоторую роль играет недостаточная экспрессия или функциональная эффективность 7 nAChR. По своей природе агонисты должны быть нацеленными на Ach-связывающую область ("карман"), которая является высококонсервативной у никотиновых рецепторов разных подтипов, что ведет к возможным неблагоприятным побочным реакциям, обусловленным неспецифической активацией никотиновых рецепторов,принадлежащих к другим подтипам. Поэтому, чтобы избежать реализации этих возможностей, альтернативная терапевтическая стратегия в отношении к агонизму 7 должна с помощью положительного аллостерического модулятора (РАМ) повысить интенсивность реакции рецептора на естественные агонисты. РАМ определен как вещество, которое связывается с сайтом, отличным от сайта связывания агониста, и поэтому он не должен обладать свойствами агониста или десенсибилизатора, но он должен повышать интенсивность реакции 7 nAChR на естественный трансмиттер. Ценность этой стратегии состоит в том,что для данного количества трансмиттера интенсивность реакции 7 nAChR в присутствии РАМ является более высокой, чем уровень трансмиссии, возможный в его отсутствие. Поэтому для расстройств, в которых имеет место дефицит белка 7 nAChR, РАМ-индуцированное увеличение 7 никотинергической трансмиссии может быть благоприятным. Поскольку эффект РАМ зависит от присутствия естественного трансмиттера, возможность гиперстимуляции является ограниченной механизмами разрушения и клиренса естественного трансмиттера. Соединения согласно настоящему изобретению классифицируют по типам от нулевого до четвертого, основываясь на качественных кинетических свойствах, определенных регистрацией фиксации напряжения в целых клетках. Эта классификация основана на эффекте соединения 7-РАМ, как описано выше в настоящем документе, на сигнал, возбуждаемый агонистом. Конкретно, указанный агонист является холином, присутствующим в концентрации 1 мМ. В предпочтительной экспериментальной системе указанным соединением 7-РАМ и холином одновременно воздействуют на клетку, как описано ниже в настоящем документе. Десенсибилизация определена как закрытие рецептора после его активации внесенным агонистом в электрофизиологических измерениях фиксации напряжения, проводимых на цельных клетках, которое регистрируют как уменьшение выходящего тока после начальной активации, вызванной агонистом. Определение РАМ типов 0-4. Соединения типа 0 минимально увеличивают эффективную величину тока, вызываемого холином в концентрации 1 мМ. Соединения типа 1 увеличивают эффективную величину тока, вызываемого холином в концентрации 1 мМ, но минимально изменяют кинетику рецептора. В частности, не меняется скорость и степень десенсибилизации, вызванной агонистом. Поэтому реакция на холин в концентрации 1 мМ, модулированная соединением, близка к прямо пропорциональному изменению реакции на холин в концентрации 1 мМ, наблюдаемой в отсутствие соединения 7-РАМ. Соединения типа 2 увеличивают эффективную величину тока, вызываемого холином в концентрации 1 мМ, снижая скорость и/или степень десенсибилизации. Соединения типа 3 увеличивают эффективную величину тока, вызываемого холином в концентрации 1 мМ. Когда их испытывают при высоких концентрациях (до 10 мкМ), они полностью ингибируют десенсибилизацию (в частности, холином в концентрации 1 мМ в течение 250 мс). Соединения типа 4 дают возможность проявляться первоначальной десенсибилизации рецептора, за которой следует повторное открытие рецептора при продолжающемся воздействии агониста. При слабо действующих концентрациях соединения 7-РАМ активация, индуцированная агонистом, за которой следует десенсибилизация, еще может быть отделенной от повторного открытия, индуцированного со- 15020564 единением, в виде максимума начального входящего тока. При более эффективных концентрациях соединения 7-РАМ повторное открытие происходит быстрее, чем закрытие, обусловленное десенсибилизацией, вследствие чего исчезает начальный максимум тока. Соединение признают обладающим РАМ-подобной активностью, представляющей определенный интерес, когда усиление пикового тока составляет не менее 200% по сравнению с контрольной реакцией на холин (=100%). В экспериментальной части такие соединения классифицированы как принадлежащие к конкретному типу РАМ. Соединения, не отвечающие указанным условиям, не классифицируют как принадлежащие к конкретному типу РАМ. В соответствии с этим целью настоящего изобретения является предоставление таких способов лечения, которые включают либо введение положительного аллостерического модулятора как единственного активного соединения, модулирующее тем самым активность эндогенных агонистов никотинового рецептора (таких как ацетилхолин или холин), либо введение положительного аллостерического модулятора вместе с агонистом никотинового рецептора. В конкретной форме этого аспекта настоящего изобретения указанный способ лечения включает лечение положительным аллостерическим модулятором никотинового рецептора типа 7, как описано в настоящем документе, и агонистом или частичным агонистом никотинового рецептора типа 7. Примеры подходящих соединений с активностью агонистов никотинового рецептора типа 7 включают моногидрохлорид 4-бромфенилового сложного эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR180711A);EVP-6124 и ТС-5619. Конкретно, примеры подходящих соединений с активностью агонистов никотинового рецептора типа 7 включают моногидрохлорид 4-бромфенилового сложного эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR180711A);AZD-0328; МЕМ 63908. Положительные модуляторы nAChR согласно настоящему изобретению можно применять для лечения или профилактики психотических расстройств, расстройств или заболеваний с нарушением интеллекта или состояний, при которых полезно модулирование активности никотинового рецептора типа 7. Конкретный аспект способа согласно настоящему изобретению представляет собой способ лечения пониженной способности к обучению, когнитивного дефицита, дефицита внимания или потери памяти,психотических расстройств, воспалительных заболеваний; как ожидают, модулирование активности никотинового рецептора типа 7 является полезным для лечения ряда заболеваний, включая болезнь Альцгеймера, деменцию с тельцами Леви, расстройство с дефицитом внимания и гиперактивностью, тревожность, шизофрению, манию, маниакальную депрессию, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травму головного мозга или другие неврологические, дегенеративные или психиатрические расстройства, при которых имеет место потеря холинергических синапсов, включая расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновую зависимость и боль; более конкретный аспект способа согласно настоящему изобретению представляет собой способ лечения пси- 16020564 хотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний. Настоящее изобретение также относится к способу лечения у субъекта заболеваний или расстройств, указанных выше или ниже, включающему введение указанному субъекту терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I) и фармацевтически приемлемый носитель. Указанные соединения могут также найти терапевтическое применение в качестве противовоспалительных лекарственных средств, поскольку 7-субъединица никотинового рецептора ацетилхолина является важной для ингибирования синтеза цитокинов посредством холинергического воспалительного пути. Примерами состояний, при которых показано лечение указанными соединениями, являются эндотоксемия, эндотоксический шок, сепсис, ревматоидный артрит, астма, рассеянный склероз, псориаз, крапивница, воспалительная болезнь кишечника, воспалительное заболевание желчного пузыря, болезнь Крона, язвенный колит, послеоперационная непроходимость кишечника, панкреатит, сердечная недостаточность, острое повреждение легких и отторжение аллотрансплантата. Соединения согласно настоящему изобретению находят терапевтическое применение при таких показаниях, как когнитивные нарушения при шизофрении, когнитивные нарушения при болезни Альцгеймера, умеренные когнитивные нарушения, болезнь Паркинсона, расстройство с дефицитом внимания и гиперактивностью, язвенный колит, панкреатит, артрит, сепсис, послеоперационная непроходимость кишечника и острое повреждение легких. Принимая во внимание вышеописанные фармакологические свойства, можно утверждать, что соединения, соответствующие формуле (I), или любую их подгруппу, их фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы можно применять в качестве лекарственного средства. В частности, соединения согласно настоящему изобретению можно применять для изготовления лекарственного средства для лечения или профилактики психотических расстройств, расстройств или заболеваний с нарушением интеллекта или состояний, при которых полезно модулирование активности никотинового рецептора типа 7. Принимая во внимание вышеописанные фармакологические свойства, можно утверждать, что соединения, соответствующие формуле (I), или любую их подгруппу, их фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы можно применять для лечения или предупреждения психотических расстройств, расстройств или заболеваний с нарушением интеллекта или состояний, при которых полезно модулирование активности никотинового рецептора типа 7. В варианте осуществления настоящее изобретение относится к соединениям, соответствующим формуле (I) и предназначенным для лечения или предупреждения психотических расстройств, расстройств или заболеваний с нарушением интеллекта или состояний, при которых полезно модулирование активности никотинового рецептора типа 7. В варианте осуществления настоящее изобретение относится к соединениям, соответствующим формуле (I) и предназначенным для лечения или профилактики (конкретно, для лечения) болезни Альцгеймера, деменции с тельцами Леви, расстройства с дефицитом внимания и гиперактивностью, тревожности, шизофрении, мании, маниакальной депрессии, болезни Паркинсона, болезни Гентингтона, синдрома Туретта, травмы головного мозга или других неврологических, дегенеративных или психиатрических расстройств, при которых имеет место потеря холинергических синапсов, включая расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновую зависимость, боль, эндотоксемию, эндотоксический шок, сепсис, ревматоидный артрит, астму, рассеянный склероз, псориаз,крапивницу, воспалительное заболевание кишечника, воспалительное заболевание желчного пузыря,болезнь Крона, язвенный колит, послеоперационную непроходимость кишечника, панкреатит, сердечную недостаточность, острое повреждение легких, отторжение аллотрансплантата, когнитивные нарушения при шизофрении, когнитивные нарушения при болезни Альцгеймера, умеренные когнитивные нарушения, болезнь Паркинсона, расстройство с дефицитом внимания и гиперактивностью, язвенный колит, панкреатит, артрит, сепсис, послеоперационную непроходимость кишечника и острое повреждение легких. В варианте осуществления настоящее изобретение относится к соединениям, соответствующим формуле (I) и предназначенным для лечения или профилактики (конкретно, для лечения) психотических расстройств, расстройств или заболеваний с нарушением интеллекта или состояний при которых полезно модулирование никотинового рецептора типа 7. В варианте осуществления настоящее изобретение относится к соединениям, соответствующим формуле (I) и предназначенным для лечения или профилактики (конкретно, для лечения) психотических расстройств, расстройств с нарушением интеллекта или воспалительных заболеваний. В варианте осуществления настоящее изобретение относится к соединениям, соответствующим формуле (I) и предназначенным для лечения или предупреждения (конкретно, для лечения) указанных заболеваний и состояний. С учетом полезности соединений, соответствующих формуле (I), предоставлен способ лечения теплокровных животных, включая людей, страдающих от заболеваний, при которых полезно модулирова- 17020564 ние никотинового рецептора 7, таких как шизофрения, мания и маниакальная депрессия, тревожность,болезнь Альцгеймера, недостаточная способность к обучению, когнитивный дефицит, дефицит внимания, потеря памяти, деменция с тельцами Леви, расстройство с дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травма головного мозга, расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновая зависимость и боль,или способ предупреждения заболевания теплокровных животных, включая людей, с указанными расстройствами. Указанные способы включают введение (т.е. системное или местное введение, предпочтительно пероральное введение) теплокровным животным, включая людей, эффективного количества соединения, соответствующего формуле (I), включая все его стереохимически изомерные формы, его фармацевтически приемлемую аддитивную соль или четвертичный амин. Квалифицированный специалист в данной области техники признает, что терапевтически эффективным количеством РАМ согласно настоящему изобретению является количество, достаточное для модулирования активности никотинового рецептора типа 7, и что это количество может быть различным в зависимости от типа заболевания, концентрации соединения в терапевтической рецептуре и состояния пациента и других факторов. Как правило, количество РАМ, которое следует вводить в качестве терапевтического средства для лечения заболеваний, при которых полезно модулирование никотинового рецептора типа 7, таких как шизофрения, мания и маниакальная депрессия, тревожность, болезнь Альцгеймера, недостаточная способность к обучению, когнитивный дефицит, дефицит внимания, потеря памяти,деменция с тельцами Леви, расстройство с дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травма головного мозга, расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновая зависимость и боль, будет определять лечащий врач отдельно для каждого случая. Как правило, подходящей дозой является такая доза, в результате которой концентрация РАМ в месте воздействия находится в диапазоне от 0,5 нМ до 200 мкМ и более обычно от 5 нМ до 50 мкМ. Для получения таких терапевтических концентраций пациенту, нуждающемуся в лечении, будут, вероятно,вводить от 0,01 до 2,50 мг/кг массы тела (в частности, от 0,1 до 0,50 мг/кг массы тела). Количество соединения согласно настоящему изобретению, также называемого в настоящем документе активным ингредиентом, которое требуется для достижения терапевтического эффекта, будет, конечно, разным для каждого конкретного случая, разным для каждого конкретного соединения, пути введения, возраста и состояния реципиента и конкретного расстройства или заболевания, требующего лечения. Способ лечения может также включать введение активного ингредиента в режиме от одного до четырех приемов в день. В этих способах лечения соединения согласно настоящему изобретению предпочтительно составляют по рецептуре перед приемом. Как описано ниже в настоящем документе, подходящие фармацевтические рецептуры готовят по известным процедурам, применяя хорошо известные и легкодоступные ингредиенты. Настоящее изобретение также предоставляет композиции, предназначенные для предупреждения или лечения заболеваний, при которых полезна модуляция никотинового рецептора типа 7, таких как шизофрения, мания и маниакальная депрессия, тревожность, болезнь Альцгеймера, недостаточная способность к обучению, когнитивный дефицит, дефицит внимания, потеря памяти, деменция с тельцами Леви, расстройство с дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травма головного мозга, расстройство биоритмов в связи с перелетом через несколько часовых поясов, никотиновая зависимость и боль. Указанные композиции содержат терапевтически эффективное количество соединения, соответствующего формуле (I), и фармацевтически приемлемый носитель или разбавитель. Хотя можно вводить один активный ингредиент, предпочтительным является его присутствие в виде фармацевтической композиции. Соответственно, настоящее изобретение дополнительно предоставляет фармацевтическую композицию, содержащую соединение согласно настоящему изобретению, совместно с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должны быть "приемлемыми" в смысле совместимости с другими ингредиентами композиции и безопасности для их реципиента. Фармацевтические композиции согласно настоящему изобретению могут быть получены посредством любых способов, хорошо известных в области фармации, например, с применением таких способов,как описанные в публикации Gennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack PublishingCompany, 1990, см. особо Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения (в форме основания или в форме аддитивной соли) как активного ингредиента комбинируют в тонко перемешанной смеси с фармацевтически приемлемым носителем, который может принимать множество форм, в зависимости от формы препарата, желательного для введения. Желательно, чтобы эти фармацевтические композиции были в форме единичных доз, подходящих предпочтительно для системного введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения, например, с применением ингаляции, интраназального аэрозоля, глазных капель или крема, геля, шампуня или т.п. Например, при изготовлении композиций в пероральной дозированной форме можно применять любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердых носителей, таких как крахмалы, сахара, каолин,смазывающие вещества, связующие, разрыхлители и т.п., в случае порошков, пилюль и таблеток. Благодаря легкости их введения, таблетки и капсулы представляют собой наиболее удобные единичные дозированные пероральные формы, в случае которых, очевидно, применяют твердые фармацевтические носители. Носитель для парентеральных композиций обычно содержит стерильную воду (по меньшей мере,в значительной своей части), хотя могут быть включены и другие ингредиенты (например, повышающие растворимость). Например, можно готовить растворы для инъекций, в которых носитель содержит физиологический раствор соли, раствор глюкозы или смешанный раствор соли и глюкозы. Можно также готовить инъецируемые суспензии, в случае которых можно применять подходящие жидкие носители,суспендирующие средства и т.п. В композициях для чрескожного введения носитель, необязательно, содержит средство, повышающее проницаемость, и/или подходящий увлажнитель, необязательно, в малых пропорциях комбинированный с подходящими добавками любой природы, причем указанные добавки не оказывают никакого существенно неблагоприятного воздействия на кожу. Указанные добавки могут облегчить введение через кожу и/или приготовление желаемых композиций. Эти композиции можно вводить различными путями, например в виде чрескожного пластыря, точечным нанесением или в виде мази. Особенно выгодно составлять вышеуказанные фармацевтические композиции в единичной дозированной форме, удобной для легкого введения и равномерного дозирования. Термин "единичная дозированная форма", используемый в настоящей спецификации и в пунктах формулы настоящего изобретения,относится к физически дискретным единицам, пригодным для единичных доз, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное на создание желаемого терапевтического эффекта, в сочетании с требующимся фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечками или покрытые оболочкой),капсулы, пилюли, пакетированные порошки, облатки, растворы или суспензии для инъекций, препараты,отмеряемые чайными или столовыми ложками, и т.п. и их разделяемые кратные множества. Поскольку соединения согласно настоящему изобретению являются соединениями, эффективными при пероральном введении, фармацевтические композиции для перорального введения, содержащие указанные соединения, являются особенно выгодными. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях может быть полезным применение -, - или -циклодекстринов или их производных (в частности, циклодекстринов, замещенных гидроксиалкильными группами, например 2-гидроксипропил-циклодекстрин или сульфобутилциклодекстрин). Кроме того, совместные растворители, такие как спирты, могут улучшать растворимость и/или стабильность соединений согласно настоящему изобретению в фармакологических композициях. Точная доза и частота введения зависят от конкретного применяемого соединения формулы (I),конкретного состояния, лечение которого проводят, тяжести состояния, лечение которого проводят, возраста, массы тела, пола, степени расстройства и общего физического состояния конкретного пациента, а также от других медицинских воздействий, которые может принимать индивид, как хорошо известно квалифицированным специалистам в данной области. Кроме того, очевидно, что указанное эффективное дневное количество может быть уменьшено или увеличено в зависимости от реакции субъекта, лечение которого проводят, и/или в зависимости от оценки врача, назначающего соединение согласно настоящему изобретению. В зависимости от способа введения фармацевтическая композиция будет содержать от 0,05 до 99 мас.% активного ингредиента (предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.%) и от 1 до 99,95 мас.% фармацевтически приемлемого носителя (предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99, 9 мас.%), причем все процентные доли даны в расчете на общую массу композиции. Соединения согласно настоящему изобретению можно применять для системного введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения, такого как при применении ингаляции, интраназального аэрозоля, глазных капель или крема, геля, шампуня или т.п. Предпочтительно указанные соединения вводят перорально. Точная доза и частота введения зависят от конкретного применяемого соединения формулы (I), конкретного состояния, лечение которого проводят,тяжести состояния, лечение которого проводят, возраста, массы тела, пола, степени расстройства и общего физического состояния конкретного пациента, а также от других медицинских средств, которые может принимать индивид, как хорошо известно квалифицированным специалистам в данной области. Кроме того, очевидно, что указанное эффективное дневное количество может быть уменьшено или увеличено в зависимости от реакции субъекта, лечение которого проводят, и/или в зависимости от оценки врача, назначающего соединение согласно настоящему изобретению. Соединения, соответствующие формуле (I), можно также применять в комбинации с другими традиционными агонистами или частичными агонистами никотинового рецептора типа 7, такими как, на- 19020564(+)-N-(1-азабицикло[2.2.2]окт-3-ил)бензо[b]фуран-2-карбоксамид; А-582941; AR-R17779; ТС-1698; РНА 709829; трописетрон; WAY-317538; EVP-6124 и ТС-5619. Соединения, соответствующие формуле (I), можно также применять в комбинации с традиционными агонистами никотинового рецептора типа 7, такими как, например, моногидрохлорид 4 бромфенилового сложного эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR180711A);(-)-спиро[1-азабицикло[2.2.2]октан-3,5'-оксазолидин]-2'-он; дигидрохлорид 3-[(2,4-диметокси)бензилиден]анабазеина (GTS-21); [гидрохлорид N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида] PNU282987; никотин; варениклин; МЕМ 3454; AZD-0328 и МЕМ 63908. Таким образом, настоящее изобретение также относится к комбинации соединения, соответствующего формуле (I), и агониста никотинового рецептора типа 7. Указанную комбинацию можно применять в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему (а) соединение, соответствующее формуле (I), и (b) агонист никотинового рецептора типа 7 в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении заболеваний, при которых полезна модуляция никотинового рецептора типа 7, таких как,например, психотические расстройства, расстройства с нарушениями интеллекта или воспалительные заболевания. Разные лекарственные средства можно комбинировать в едином препарате с фармацевтически приемлемыми носителями. Примеры Ниже в настоящем документе термин "DCM" означает дихлорметан; "МеОН" означает метанол;"THF" означает тетрагидрофуран; "ВЭЖХ" означает высокоэффективную жидкостную хроматографию;"r.t." означает комнатную температуру; "НОВТ" означает 1-гидрокси-1 Н-бензотриазол; "DMSO" означает диметилсульфоксид; "EDCI" означает моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3 пропандиамина; "RP" означает обращенную фазу; "DMAP" означает 4-(диметиламино)пиридин; "мин" означает минуту(минуты); "ТРАР" означает перрутенат тетрапропиламмония; "ч" означает час(ы); "q.s." означает quantum sufficit (достаточное количество); "I.D." означает внутренний диаметр; "Et2O" означает диэтиловый простой эфир; "EtOAc" означает этилацетат; "Et3N" означает триэтиламин; "TBAF" означает фторид тетрабутиламмония; "DIPEA" означает диизопропилэтиламин; "EtOH" означает этанол; "экв." означает эквивалент; "r.m." означает реакционную смесь (реакционные смеси); "DIPE" означает диизопропиловый простой эфир и "DMF" означает N,N-диметилформамид. А. Получение промежуточных соединений. Пример А 1. а) Получение промежуточного соединения 1NaH (60%) (8 г, 200 ммоль) перемешивали в THF (250 мл) в атмосфере N2 при 0-5 С. При 0-5 С добавляли по каплям раствор диэтилового сложного эфира цианометанфосфоновой кислоты (35,386 г, 200 ммоль) в THF (250 мл) и смесь, полученную в результате этого, перемешивали в течение 15 мин при 05 С. Затем при 0-5 С добавляли по каплям раствор 2-(фенилметокси)ацетальдегида (30 г, 200 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и затем выливали в H2O. Водную смесь экстрагировали DIPE. Отделенный органический слой сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Неочищенный продукт очищали на силикагеле (элюент:DCM). Собирали чистые фракции и выпаривали растворитель. Выход: 23 г промежуточного соединения 1 (выход 66%).b) Получение промежуточного соединения 2iPrOH (30 мл) реагировала в течение 1 ч в атмосфере N2 при 150 С. Затем реакционную смесь разбавлялиDIPE (30 мл) и охлаждали до -15 С. Осадок отфильтровывали и сушили при 40 С. Выход: 10,7 г промежуточного соединения 2, использованного в таком виде на следующей реакционной стадии. с) Получение промежуточного соединения 3 Натрий (4,48 г, 194,8 ммоль, 2,2 экв.) перемешивали в EtOH (200 мл) при 50 С в атмосфере N2. При комнатной температуре добавляли промежуточное соединение 2 (14,13 г, 88,53 моль, 1 экв.) и смесь кипятили с обратным холодильником в течение 30 мин. Затем при комнатной температуре добавляли промежуточное соединение 1 (23 г, 132,8 ммоль, 1,5 экв.) и реакционную смесь перемешивали в течение ночи при 50 С. Затем растворитель выпаривали, к остатку добавляли H2O и водную смесь экстрагировали EtOAc. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт кристаллизовали из достаточного количества Et2O. Кристаллы отфильтровывали и сушили. Выход: 18,6 г промежуточного соединения 3 (выход 71%).d) Получение промежуточного соединения 4 3-Метокси-5-(трифторметил)бензоламин (20 г, 104,6 ммоль) добавляли порциями к охлажденному раствору NaNO2 (7,392 г, 107,1 ммоль) в H2SO4 (74 мл) и СН 3 СООН (88 мл). Эту смесь добавляли по каплям к интенсивно перемешиваемому раствору CuBr (18 г, 62,8 ммоль) в 48%-ной HBr (200 мл) при 0 С. Реакционную смесь перемешивали в течение 45 мин при комнатной температуре и затем выливали в воду со льдом. Эту водную смесь экстрагировали DCM. Отделенный органический слой сушили (MgSO4),фильтровали и растворитель выпаривали при низкой температуре. Остаток перемешивали в раствореNaHCO3 и экстрагировали DIPE. Отделенные органические слои сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 12,7 г промежуточного соединения 4 (выход 48%). е) Получение промежуточного соединения 5 Промежуточное соединение 3 (5 г, 16,87 ммоль) перемешивали в THF (100 мл). К этой смеси добавляли промежуточное соединение 4 (6,607 г, 25,9 ммоль), Pd2(dba)3 (1,4 г), BINAP (1,9 г) и NaOtBu (4 г). Реакционную смесь перемешивали в течение 2 ч в микроволновой печи при 110 С. Затем добавляли(MgSO4), фильтровали и растворитель выпаривали. Остаток кристаллизовали из CH3CN. Продукт отфильтровывали и сушили, получая 5,7 г промежуточного соединения 5. При желании, дополнительное количество продукта может быть получено посредством выпаривания фильтрата и очистки полученного остатка (например, посредством обращенно-фазовой ВЭЖХ). Пример А 2. а) Получение промежуточного соединения 6NaH (60%) (7 г, 181,8 ммоль) промывали смесью гептанов (достаточным количеством) и в атмосфере N2 при 0-5 С перемешивали в THF (150 мл). Диэтиловый сложный эфир цианометанфосфоновой кислоты (32,202 г, 181,8 ммоль) растворяли в THF (150 мл) и этот раствор добавляли по каплям при 0-5 С. Смесь перемешивали в течение 15 мин. Затем в THF (100 мл) растворяли 4-(фенилметокси)бутаналь(32,4 г, 181,8 ммоль) и этот раствор добавляли по каплям при 0-5 С. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и затем выливали в H2O. Водную смесь экстрагировали DIPE. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством ВЭЖХ, получая 18,6 г промежуточного соединения 6 (выход 51%).b) Получение промежуточного соединения 7 21%-ный раствор NaOEt в EtOH (35 мл) перемешивали в EtOH (110 мл) в атмосфере N2. При комнатной температуре порциями добавляли промежуточное соединение 2 (10,4 г, 53,04 ммоль) и смесь перемешивали в течение 1 ч при 70 С. Затем смесь охлаждали и по каплям добавляли промежуточное соединение 6 (13,563 г, 67,39 ммоль). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем еще в течение 2 дней при 45 С. Затем реакционную смесь фильтровали и фильтрат концентрировали посредством выпаривания. Остаток растворяли в EtOAc (800 мл) и этот раствор промывали раствором соли (200 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH от 98/2 до 85/15). Собирали желаемые фракции и выпаривали растворитель. Выход: 2,6 г неочищенного промежуточного соединения 7, использованного в полученном виде на следующих реакционных стадиях. Большее количество продукта может быть получено дальнейшей очисткой менее чистых фракций посредством обращенно-фазовой ВЭЖХ (RP Shandon Hyperprep C18 BDS-8 мкм, 250 г,внутренний диаметр 5 см; подвижная фаза: 0,25%-ный раствор NH4HCO3 в воде; MeOH+CH3CN). Желаемые фракции собирали и подвергали завершающей обработке, получая 5 г промежуточного соединения 7. с) Получение промежуточного соединения 15 Смесь промежуточного соединения 7 (8,2 г, 25,275 ммоль) и MnO2 (21,974 г, 252,754 ммоль) в DCM перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь фильтровали через диатомовую землю и растворитель выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (DCM/MeOH от 98/2 до 85/15). Собирали желаемые фракции и выпаривали растворитель. Остаток дополнительно очищали посредством обращенно-фазовой ВЭЖХ (RP Shandon HyperprepMeOH+CH3CN). Желаемые фракции собирали и подвергали завершающей обработке. Выход: 980 мг промежуточного соединения 15 (выход 12%). Пример A3. а) Получение промежуточного соединения 8 Смесь метилового сложного эфира (3R)-3-гидроксипентановой кислоты (20 г, 151,33 ммоль), 1 Нимидазола (22,66 г, 332,93 ммоль), DMAP (1,85 г, 15,13 ммоль) и DMF (800 мл) перемешивали при 0 С. Добавляли хлор-(1,1-диметилэтил)диметилсилан (27,37 г, 181,60 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали и к остатку добавляли H2O. Водную смесь экстрагировали DIPE. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 24 г промежуточного соединения 8 (выход 64%; R-энантиомер).b) Получение промежуточного соединения 9LiBH4 (2,14 г, 97,40 ммоль) перемешивали в THF (70 мл) при комнатной температуре. В течение 5 мин добавляли промежуточное соединение 8 (24 г, 97,39 ммоль) в THF (70 мл) и реакционную смесь нагревали до температуры кипячения с обратным холодильником и кипятили с обратным холодильником в течение 2 ч. Затем при 0 С добавляли Et2O (200 мл) и насыщенный раствор NH4Cl. Реакционную смесь перемешивали в течение 30 мин при 0 С. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток растворяли в DCM и этот раствор промывали H2O. Органический слой сушили (MgSO4), фильтровали и выпаривали растворитель. Выход: 15 г промежуточного соединения 9 (выход 71%; R-энантиомер). с) Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (14,5 г, 66,40 ммоль), N-метилморфолин-N-оксида (12,5 г,103,82 ммоль), порошка молекулярного сита (33,4 г) и DCM (700 мл) перемешивали в атмосфере N2 в течение 30 мин при комнатной температуре. Добавляли ТРАР (1,25 г) и смесь перемешивали в течение 1 ч. Смесь фильтровали через стеклянный фильтр, содержавший слой силикагеля и верхний слой диатомовой земли. Фильтр промывали DCM. Фильтрат выпаривали. Выход: 10,5 г промежуточного соединения 10 (выход 73%; R-энантиомер).d) Получение промежуточного соединения 11 Отношение E/Z не определено. 60%-ный NaH (2,03 г, 50,83 ммоль) промывали смесью гептанов и затем перемешивали в THF (100 мл) при 0-5 С в атмосфере N2. По каплям при 0-5 С добавляли раствор диэтилового сложного эфира цианометанфосфоновой кислоты (9,005 г, 50,83 ммоль) в THF (100 мл) и смесь перемешивали в течение 15 мин. Затем по каплям при 0-5 С добавляли раствор промежуточного соединения 10 (11 г, 50,83 ммоль) вTHF (100 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли H2O и продукт экстрагировали DIPE. Отделенный органический слой сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток очищали на силикагеле (элюент: DCM). Собирали желаемые фракции и выпаривали растворитель. Выход: 9,4 г промежуточного соединения 11 (выход 77%; R-энантиомер). е) Получение промежуточного соединения 12 В атмосфере N2 при 50 С в EtOH (50 мл) растворяли Na (1,35 г, 58,5 ммоль). При комнатной температуре порциями добавляли промежуточное соединение 2 (3,735 г, 23,4 ммоль). Смесь перемешивали и кипятили с обратным холодильником в течение 30 мин и затем охлаждали до комнатной температуры. По каплям добавляли промежуточное соединение 11 (8,4 г, 35,08 ммоль) и реакционную смесь перемешивали в течение ночи при 50 С. Затем растворитель выпаривали и к остатку добавляли H2O и EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали посредством обращенно-фазовой ВЭЖХ (Shandon Hyperprep C18 BDS 8 мкм, 250 г, внутренний диаметр 5 см; подвижная фаза: 90% 0,5%-ного раствора NH4OAc в воде + 10% CH3CN; CH3CN). Собирали желаемые фракции и выпаривали растворитель. Добавляли DCM и раствор промывали растворомNaHCO3. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 1,5 гf) Получение промежуточного соединения 13 Смесь промежуточного соединения 12 (700 мг, 1,93 ммоль), 4-бром-1,2-дифторбензола (558,87 мг,2,90 ммоль), Pd2(dba)3 (196 мг), BINAP (266 мг) и NaOtBu (560 мг) в THF (5 мл) перемешивали в течение 2 ч при 110 С под микроволновым излучением. Смесь выпаривали, промывали H2O и экстрагировалиDCM. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт очищали на силикагеле (элюент: DCM/MeOH(NH3) от 90/10 до 80/20). Собирали желаемые фракции и выпаривали растворитель. Выход: 1 г промежуточного соединения 13 (количественный выход). г) Получение промежуточного соединения 14 Промежуточное соединение 13 (1 г, 2,107 ммоль) перемешивали в DCM (400 мл) при комнатной температуре. Добавляли MnO2 (2,5 г) и смесь перемешивали в течение 2 ч. Затем смесь фильтровали через диатомовую землю и фильтрат выпаривали. Продукт очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH(NH3) от 99/1 до 98/2). Собирали чистые фракции и выпаривали растворитель. Выход: 440 мг промежуточного соединения 14 (выход 44%). Пример А 4. Получение промежуточного соединения 16 Промежуточное соединение 12 (8 г, 22,063 ммоль) перемешивали в необходимом количестве DCM. Порциями добавляли MnO2 (20 г) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь фильтровали через диатомовую землю и фильтрат концентрировали посредством выпаривания. Остаток очищали посредством обращенно-фазовой препаративной ВЭЖХ(Shandon Hyperprep C18 BDS 8 мкм, 250 г, внутренний диаметр 5 см; подвижная фаза: 0,25%-ный раствор NH4HCO3 в H2O, MeOH+CH3CN). Собирали желаемые фракции и выпаривали растворитель, получая 3 г промежуточного соединения 16 (выход 38%). В. Получение соединений. Пример В 1. а) Получение соединения 1 Промежуточное соединение 5 (5,7 г, 12,12 ммоль) перемешивали в DCM (1 л). Добавляли MnO2 (17 г) и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем смесь фильтро- 24020564 вали через диатомовую землю и фильтрат концентрировали посредством выпаривания. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH 98/2). Собирали желаемые фракции и выпаривали растворитель. Выход: 4,1 г соединения 1 (выход 72%). Соединение 1 (4 г, 8,54 ммоль) перемешивали в DCM (250 мл) при -10 С в атмосфере N2. По каплям добавляли 1 М раствор BBr3 в DCM (11 мл) и реакционную смесь перемешивали в течение 30 мин. Затем добавляли дополнительное количество 1 М раствора BBr3 в DCM (3 мл) и реакционную смесь перемешивали в течение 30 мин. Добавляли насыщенный раствор NaHCO3 (100 мл) и смесь перемешивали. Органический слой отделяли и очищали посредством колоночной хроматографии на силикагеле (элюент:DCM/MeOH от 100/0 до 90/10). Собирали желаемые фракции и выпаривали растворитель. Выход: 3,2 г соединения 2. с) Получение соединения 3 Соединение 2 (3,2 г, 8,46 ммоль) и Et3N (3 г) перемешивали в THF (400 мл). По каплям добавляли мезилхлорид (1,453 г, 12,69 ммоль). Эту смесь перемешивали в течение 1 ч при комнатной температуре. Затем добавляли дополнительное количество Et3N (1 г) и мезилхлорида (1 г) и смесь перемешивали в течение 1 ч при комнатной температуре. В завершение добавляли еще одну порцию Et3N (1 г) и мезилхлорида (1 г) и смесь опять перемешивали в течение 1 ч при комнатной температуре. Затем добавлялиDMSO (200 мл) и NaCN (4 г) и реакционную смесь перемешивали при температуре кипячения с обратным холодильником в течение 1 ч под потоком N2. Затем, выпаривая при 70 С, удаляли THF и концентрировали смесь. Остаток перемешивали в EtOAc и эту смесь промывали H2O. Органический слой сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством колоночной хроматографии (элюент: DCM/MeOH 95/5). Собирали желаемые фракции и выпаривали растворитель, получая 2,7 г неочищенного продукта. Этот неочищенный продукт кристаллизовали из эфира и продукт отфильтровали. Выход: 2,0 г соединения 3. Соединение 3 (1,3 г, 3,35 ммоль) и 37%-ную HCl (200 мл) перемешивали в течение 3 ч при 70 С. Затем смесь концентрировали посредством выпаривания. Остаток перемешивали в DIPE и осадок отфильтровывали. Осадок перемешивали в МеОН (200 мл) и HCl (5 мл). Реакционную смесь на охлаждающей бане нейтрализовывали необходимым количеством DIPEA. Затем смесь концентрировали посредством выпаривания и остаток растворяли в DCM. Этот раствор промывали необходимым количеством H2O,сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH 95/5). Собирали желаемые фракции и выпаривали растворитель. Выход: 1 г соединения 4 (выход 71%). е) Получение соединения 5 Соединение 4 (0,2 г, 0,476 ммоль) перемешивали в циклопропанметанамине в течение 6 ч при комнатной температуре. Затем смесь концентрировали посредством выпаривания и остаток растворяли вDCM. Этот органический раствор промывали H2O, сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством обращенно-фазовой ВЭЖХ (RP Shandon Hyperprep C18 BDS-8 мкм, 250 г, внутренний диаметр 5 см; подвижная фаза: 0,25%-ный раствор NH4HCO3 вH2O; MeOH+CH3CN). Желаемые фракции собирали и подвергали завершающей обработке. Выход: 0,109 г соединения 5 (выход 50%). Пример В 2. а) Получение соединения 6 Промежуточное соединение 15 (0,98 г, 3,04 ммоль) перемешивали в THF (20 мл). Добавляли промежуточное соединение 4 (1,163 г, 4,56 ммоль), Pd2(dba)3 (360 мг) , BINAP (480 мг) и NaOtBu (960 мг) и реакционную смесь перемешивали в течение 2 ч при 110 С под микроволновым излучением. Затем к реакционной смеси добавляли EtOAc (200 мл) и раствор соли (40 мл) и смесь перемешивали. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH от 100/0 до 90/10). Собирали желаемые фракции и выпаривали растворитель. Выход: 2,2 г соединения 6 (количественный выход). В атмосфере N2 добавляли МеОН (150 мл) к Pd/C 10% (1 г). Добавляли соединение 6 (2,2 г, 4,43 ммоль) и смесь перемешивали в атмосфере Н 2 при 50 С до поглощения 1 экв. водорода. Затем смесь фильтровали через диатомовую землю. Продукт очищали посредством колоночной хроматографии на силикагеле (DCM/MeOH от 100/0 до 90/10). Собирали желаемые фракции и выпаривали растворитель. Выход: 105 мг соединения 7 (выход 6%). с) Получение соединения 8 Соединение 7 (105 мг, 0,26 ммоль) растворяли в DMF (10 мл). Этот раствор охлаждали при 0 С и добавляли PDC (116,64 мг, 0,31 ммоль) и 98% H2SO4 (0,05 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем смесь выливали в H2O и экстрагировали EtOAc. Отделенный органический слой сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Соединение 8 (230 мг, 0,55 ммоль) растворяли в DMF (10 мл). К раствору добавляли гидрохлорид диметиламина (178,46 мг, 2,19 ммоль), НОВТ (221,78 мг, 1,64 ммоль), EDCI (254,80 мг, 1,64 ммоль) иDIPEA (282,85 мг, 2,19 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем выливали в H2O и экстрагировали DCM (220 мл). Объединенные органические слои промывали раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали посредством обращенно-фазовой ВЭЖХ (RP Shandon Hyperprep C18 BDS-8 мкм, 250 г, внутренний диаметр 5 см; подвижная фаза: 0,25%-ный раствор NH4HCO3 в H2O; MeOH+CH3CN). Желаемые фракции собирали и подвергали завершающей обработке. Выход: 31,8 мг соединения 9 (выход 13%). Пример В 3. Получение соединения 10 Смесь промежуточного соединения 14 (410 мг, 0,867 ммоль) и 1 М раствора TBAF в THF перемешивали в течение 2 ч при комнатной температуре. Добавляли насыщенный раствор NH4Cl и смесь экстрагировали EtOAc. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH 96/4). Собирали желаемые фракции и выпаривали растворитель. Остаток растворяли в 1 н. растворе HCl и этот раствор промывали DCM. Водный слой подщелачивали и экстрагировали DCM. Органический слой сушили (Extrelute), фильтровали и растворитель выпаривали. Выход: 116 мг соединения 10 (выход 37%). Пример В 4. а) Получение соединения 11 Смесь соединения 32 (приготовленную по аналогии с протоколом, описанным в примере В 2.b) (80 мг, 0,213 ммоль) растворяли в DMF (10 мл). Раствор охлаждали до 0 С и добавляли PDC (95,956 мг,0,255 ммоль) и 98% H2SO4 (0,05 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч (хромато-масс-спектрометрический анализ показал, что образовано неочищенное соединение 12). Смесь выпаривали и остаток очищали посредством колоночной хроматографии на силикагеле (элюент: DCM/MeOH от 98/2 до 85/15). Собирали желаемые фракции и выпаривали растворитель. Продукт преобразовывали в метиловый сложный эфир. Выход: 119 мг соединения 11. Смесь соединения 11 (119 мг, 0,294 ммоль) растворяли в МеОН (10 мл) и H2O (10 мл). К раствору добавляли LiOH (30 мг, 0,214 ммоль) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Смесь подвергали завершающей обработке, получая 159 мг соединения 12. Пример В 5. Получение соединения 13 Смесь промежуточного соединения 16 (320 мг, 0,887 ммоль), 1-бром-2,3,4-трифторбензола (280,86 мг, 1,331 ммоль), Pd2(dba)3 (90 мг), BINAP (120 мг) и NaOtBu (257 мг) в THF (15 мл) перемешивали в течение 1 ч при 110 С под микроволновым излучением. Эту смесь затем выливали в насыщенный растворNH4Cl, добавляли EtOAc и реакционную смесь перемешивали при комнатной температуре. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали посредством выпаривания. Остаток растворяли в THF (50 мл) и добавляли 1 М раствор TBAF в THF (10 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем добавляли насыщенный раствор NH4Cl (75 мл). Смесь перемешивали и экстрагировали EtOAc. Отделенный органический слой сушили (MgSO4),фильтровали и концентрировали посредством выпаривания. Остаток растворяли в EtOAc и этот раствор промывали H2O (3), сушили (MgSO4) и опять концентрировали посредством выпаривания. Остаток дополнительно очищали посредством обращенно-фазовой препаративной ВЭЖХ (RP Vydac Denali C18-10 мкм, 250 г, внутренний диаметр 5 см; подвижная фаза: 0,25%-ный раствор NH4HCO3 в H2O;MeOH+CH3CN). Желаемые фракции собирали и подвергали завершающей обработке. Выход: 102 мг соединения 13 (выход 31%; R-энантиомер). Соединения 1-124, перечисленные в табл. 1a, 1b, 1c, 1d, 1 е и 1f, представляют собой соединения,которые получали по аналогии с одним из вышеописанных примеров. В том случае, когда не указана никакая солевая форма, соединение было получено в виде свободного основания. Обозначение Pr. относится к номеру примера, по протоколу которого указанное соединение было синтезировано. Co. No. означает номер соединения. Для получения солевых форм с HCl применяли некоторые процедуры, известные квалифицированным специалистам в данной области техники. Таблица 1a
МПК / Метки
МПК: A61P 25/00, C07D 401/04, A61K 31/4155
Метки: n-фенил-1-(4-пиридинил)-1н-пиразол-3-амины, замещенные
Код ссылки
<a href="https://eas.patents.su/30-20564-zameshhennye-n-fenil-1-4-piridinil-1n-pirazol-3-aminy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные n-фенил-1-(4-пиридинил)-1н-пиразол-3-амины</a>
Предыдущий патент: Получение полиовируса с высокими титрами для получения вакцины
Следующий патент: Пуриновые соединения
Случайный патент: Применение биоусиливающих агентов при перекрестном сшивании роговицы