Комбинированная терапия соединением, проявляющим активность ингибитора рецептора адф на тромбоцитах
Формула / Реферат
1. Способ лечения у млекопитающего состояния, характеризующегося тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества следующих терапевтических агентов:
(1) [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины формулы
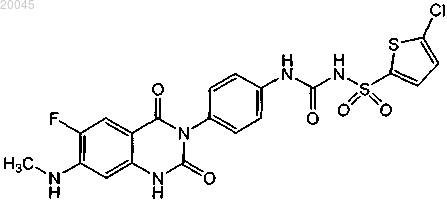
или ее фармацевтически приемлемой соли;
(2) второго терапевтического агента, выбранного из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу
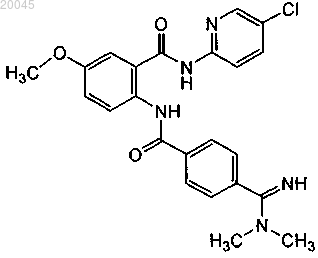
2. Способ по п.1, где второй терапевтический агент представляет собой антитело против фактора XI.
3. Способ по п.1, где второй терапевтический агент представляет собой ифетробан.
4. Способ по п.1, где второй терапевтический агент представляет собой бетриксабан формулы
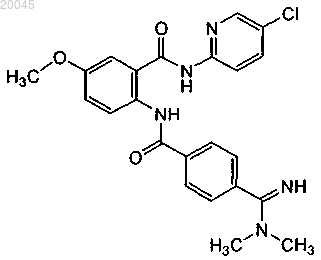
или его фармацевтически приемлемую соль.
5. Способ по п.4, где фармацевтически приемлемой солью бетриксабана является малеат.
6. Способ по любому из пп.1-5, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе.
7. Способ по любому из пп.1-5, где оба терапевтических агента вводят в субтерапевтических дозах.
8. Способ по любому из пп.1-5, где два терапевтических агента вводят одновременно.
9. Способ по любому из пп.1-5, где два терапевтических агента вводят последовательно.
10. Способ по любому из пп.1-5, дополнительно включающий введение указанному млекопитающему терапевтически эффективного количества антитромботического агента.
11. Способ по п.10, где антитромботический агент представляет собой ингибитор циклооксигеназы.
12. Способ по п.11, где антитромботический агент представляет собой ацетилсалициловую кислоту.
13. Способ по любому из пп.1-12, где фармацевтически приемлемой солью [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
14. Способ лечения у млекопитающего состояния, характеризующегося тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества следующих трех терапевтических агентов:
(1) [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины формулы

или ее фармацевтически приемлемой соли;
(2) ацетилсалициловой кислоты и
(3) соединения С921-78 (BnSO(2)-D-Arg-Gly-Arg-кетотиазол).
15. Способ по п.14, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе.
16. Способ по п.14, где все терапевтические агенты вводят в субтерапевтических дозах.
17. Способ по п.14, где три терапевтических агента вводят одновременно.
18. Способ по п.14, где три терапевтических агента вводят последовательно.
19. Способ по любому из пп.14-18, где фармацевтически приемлемой солью [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
20. Способ по любому из пп.1-19, где указанные состояния, связанные с тромбозом, выбраны из группы, включающей острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящую ишемическую атаку, инсульт, заболевание периферических сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, закупорку кровеносного сосуда, рассеянную внутрисосудистую коагуляцию и тромбоцитопеническую пурпуру, тромботические и рестенозные осложнения, которые развиваются в результате таких инвазивных процедур, как ангиопластика, каротидная эндартерэктомия, хирургическая операция аортокоронарного шунтирования (АКШ), хирургические операции на сосудах и пересадка сосудов, установка стентов и введение эндоваскулярных устройств и протезов.
21. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие терапевтические агенты:
(1) [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы
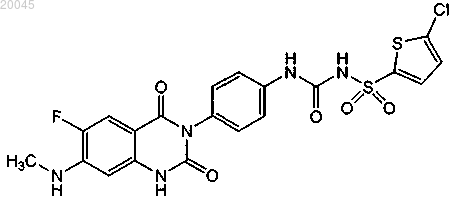
или ее фармацевтически приемлемую соль и
(2) второй терапевтический агент, выбранный из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу

22. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой антитело против фактора XI.
23. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой ифетробан.
24. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой бетриксабан формулы
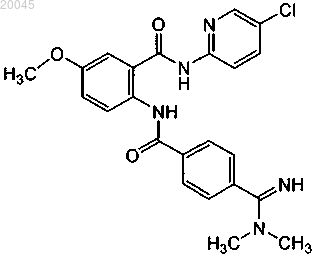
или его фармацевтически приемлемую соль.
25. Фармацевтическая композиция по п.24, где фармацевтически приемлемой солью бетриксабана является малеат.
26. Фармацевтическая композиция по любому из пп.21-25, где по крайней мере один из двух терапевтических агентов вводят в субтерапевтической дозе.
27. Фармацевтическая композиция по любому из пп.21-25, где оба из двух терапевтических агентов вводят в субтерапевтических дозах.
28. Фармацевтическая композиция по любому из пп.21-25, дополнительно включающая антитромботический агент.
29. Фармацевтическая композиция по п.28, где антитромботический агент представляет собой ингибитор циклооксигеназы.
30. Фармацевтическая композиция по п.28, где антитромботический агент представляет собой ацетилсалициловую кислоту.
31. Фармацевтическая композиция по любому из пп.21-30, где фармацевтически приемлемой солью [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
32. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие три терапевтических агента:
(1) [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы
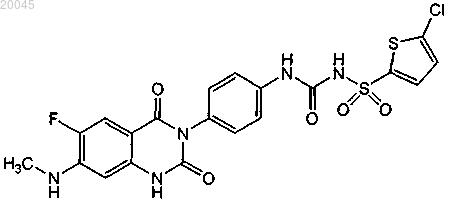
или ее фармацевтически приемлемую соль;
(2) ацетилсалициловую кислоту и
(3) соединение С921-78 (BnSO(2)-D-Arg-Gly-Arg-кетотиазол).
33. Фармацевтическая композиция по п.32, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе.
34. Фармацевтическая композиция по п.32, где все терапевтические агенты вводят в субтерапевтических дозах.
35. Фармацевтическая композиция по любому из пп.32-34, где фармацевтически приемлемой солью [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
36. Набор, включающий:
(1) первый контейнер, где указанный первый контейнер содержит [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы
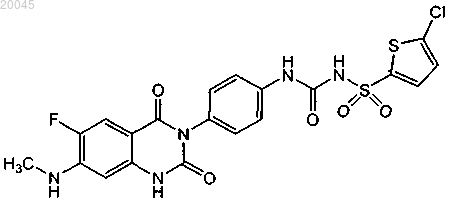
или ее фармацевтически приемлемую соль; и
(2) второй контейнер, где указанный второй контейнер содержит второй терапевтический агент, выбранный из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу
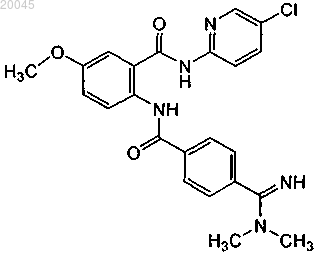
37. Набор по п.36, где второй терапевтический агент представляет собой антитело против фактора XI.
38. Набор по п.36, где второй терапевтический агент представляет собой ифетробан.
39. Набор по п.36, где второй терапевтический агент представляет собой бетриксабан формулы
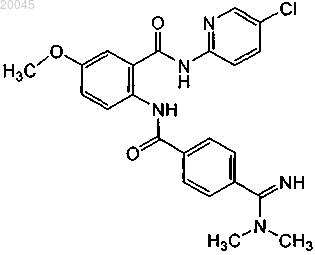
или его фармацевтически приемлемую соль.
40. Набор по п.39, где фармацевтически приемлемой солью бетриксабана является малеат.
41. Набор по п.36, дополнительно включающий третий контейнер, где указанный третий контейнер содержит антитромботический агент.
42. Набор по п.41, где антитромботический агент представляет собой ингибитор циклооксигеназы.
43. Набор по п.41, где антитромботический агент представляет собой ацетилсалициловую кислоту.
44. Набор, включающий:
(1) первый контейнер, где указанный первый контейнер содержит [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы
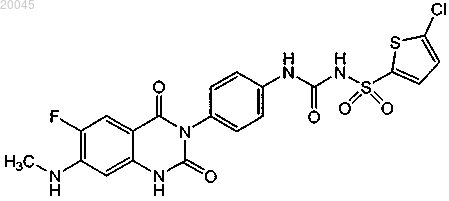
или ее фармацевтически приемлемую соль; и
(2) второй контейнер, где указанный второй контейнер содержит ацетилсалициловую кислоту; и
(3) третий контейнер, где указанный третий контейнер содержит соединение С921-78 (BnSO(2)-D-Arg-Gly-Arg-кетотиазол).
45. Набор по любому из пп.36-44, где фармацевтически приемлемой солью [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
Текст
КОМБИНИРОВАННАЯ ТЕРАПИЯ СОЕДИНЕНИЕМ, ПРОЯВЛЯЮЩИМ АКТИВНОСТЬ ИНГИБИТОРА РЕЦЕПТОРА АДФ НА ТРОМБОЦИТАХ Изобретение относится к фармацевтическим композициям и способам комбинированной терапии,включающей применение [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины или ее фармацевтически приемлемой соли и второго терапевтического агента, выбранного из антикоагулянта, такого как антитело против фактора XI и бетриксабан или его фармацевтически приемлемая соль, антитромботического агента,такого как ифетробан, или их комбинации для лечения тромбозных заболеваний. Перекрстные ссылки, относящиеся к заявке на данное изобретение В заявке на данное изобретение испрашивается приоритет на основании 119(е) 35 U.S.С. в связи с временными заявками US60/915649 (подана 2 мая 2007 г.),60/915911 (подана 3 мая 2007 г.), 60/947921 (подана 3 июля 2007 г.) и 60/978700 (подана 9 октября 2007 г.), которые включены в настоящее описание в качестве ссылок в полном объеме. Область изобретения Настоящее изобретение относится к новым композициям и способам применения комбинации ингибитора рецептора АДФ на тромбоцитах - [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины (соединение A) и антикоагулянта или другого антитромботического агента для лечения тромботических заболеваний. Настоящее изобретение также относится к новым композициям и способам применения комбинации соединения A с антикоагулянтом и с другим антитромботическим агентом для лечения тромботических заболеваний. Предпосылки создания настоящего изобретения Тромботические осложнения являются основной причиной смертельных исходов в современном индустриальном мире. Примеры указанных осложнений включают острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящую ишемическую атаку, инсульт, заболевание периферических сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, закупорку кровеносного сосуда, рассеянную внутрисосудистую коагуляцию и тромбоцитопеническую пурпуру. Тромботические и рестенозные осложнения также развиваются в результате следующих инвазивных процедур, например, после ангиопластики, каротидной эндартерэктомии, хирургической операции аортокоронарного шунтирования (АКШ), хирургических операций на сосудах и пересадки сосудов, установки стентов и введения эндоваскулярных устройств и протезов. Известно, что агрегация тромбоцитов играет важную роль в развитии указанных осложнений. Тромбоциты крови, которые в норме свободно циркулируют в сосудистой системе, активируются и агрегируют с образованием тромбов, если в сосуде нарушен поток крови из-за отрывающихся атеросклеротических бляшек или в результате инвазивной процедуры, такой как ангиопластика, что приводит к закупорке сосуда. Основным медиатором активации и агрегации тромбоцитов является АДФ (аденозин-5'-дифосфат),который высвобождается в сосудистой системе из тромбоцитов крови после активации различными агентами, такими как коллаген и тромбин, а также из поврежденных клеток крови, из эндотелия или тканей. Активация АДФ приводит к накоплению тромбоцитов и стабилизации существующих агрегатов тромбоцитов. Высвобождающиеся после активирующего сигнала аденозиннуклеотиды воздействуют на мембрану тромбоцита через пуринергические рецепторы P2, расположенные на мембране тромбоцитов(2006. Рецепторы P2 разделяют на управляемые лигандами ионные каналы (P2 Х) или сопряженные сG-белком рецепторы (GPCR), так называемые рецепторы P2Y (Abbrachio M.P., Burnstock G., Pharmacol.Ther. 64:445-475 (1994. Хотя ранее предполагали, что аденозиннуклеотиды опосредуют свое действие через один рецептор (так называемый P2Y АДФ (Fredholm В.В. et al., TIPS. 18:79-82 (1997, недавно было установлено, что АДФ воздействует на тромбоциты через два рецептора GPCR: Gq-сопряженный рецептор P2Y1 и G1-сопряженный рецептор P2Y12. Рецептор P2Y12 идентифицировали при клонировании и экспрессии гена (Hollopter G. et al., Nature, 409:202-207 (2001, кроме того, было установлено, что он играет важную роль в стабилизации тромбов (Andre Р. et al., J. Clin. Inves., 112:398-406 (2003 и является мишенью воздействия тиенопиридиновых лекарственных средств: тиклопина и клопитогрела. С другой стороны, АТФ действует через управляемый лигандами канал P2 Х 1 на поверхности тромбоцитов (Gachet С., Annu. Rev. Pharmacol. Toxicol. 46:277-300 (2006. В патенте US2007/0123547 "[4-(6-Галоген-7-замещенные-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, а также их формы и способы их получения", поданном 3 ноября 2006 г., содержание которого включено в настоящее описание в качестве ссылки в полном объеме, описано соединение - ингибитор рецептора АДФ на тромбоцитах, [4-(6-фтор-7-метиламино 2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевина (соединение которое проявляет специфическую активность антагониста P2Y12. Так как лечение заболеваний, таких как острый коронарный синдром, требует совместного введения антитромботического средства и антикоагулянта, что позволяет повысить эффективность и улучшить профиль безопасности, в настоящее время существует потребность в комбинированной терапии,при которой совместно вводят антитромботический агент и антикоагулянт, которые повышают эффективность лечения. Существует также потребность в комбинированной терапии, при которой можно снизить дозы (т.е. до субтерапевтических) каждого индивидуального агента, который используется в комбинации, что обеспечивает улучшенный профиль безопасности. Существует также потребность в комбинации двух различных антитромботических лекарственных средств, которые действуют по различным механизмам (например, антагонист P2Y12 (соединение A) и ингибитор циклооксигеназы-1 (аспирин в комбинации с антикоагулянтом, так как такая тройная комбинация (клопитогрел, аспирин и гепарин) в настоящее время используется в медицинской практике (в виде отдельных препаратов) при проведении ангиопластики и было установлено, что такая комбинация проявляет более высокую эффективность по сравнению с применением указанных лекарственных средств каждого в отдельности или в комбинации любых двух указанных агентов. Краткое изложение сущности настоящего изобретения Настоящее изобретение относится к способам и фармацевтическим композициям для комбинированной терапии, включающим антагонист P2Y12 следующей структуры: химическое название [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевина, в данном контексте "соединение A". На основе экспериментальных данных было установлено, что комбинация соединения A с антикоагулянтом, таким как ингибитор фактора Xa, и/или с другим антитромботическим средством, таким как ингибитор циклооксигеназы, обеспечивает улучшенную антитромботическую эффективность по сравнению с любым одним из указанных агентов в отдельности. Таким образом, настоящее изобретение относится к новым способам лечения состояния у млекопитающих, характеризующегося тромбозом, которые заключаются во введении указанному млекопитающему терапевтически эффективного количества соединения A - [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины или ее фармацевтически приемлемой соли, и терапевтически эффективного количества другого терапевтического агента. Другой терапевтически эффективный агент выбирают из антикоагулянта, антитромботического агента или их комбинации. В одном объекте настоящего изобретения предлагается новый способ профилактики или лечения тромбоза и связанных с тромбозом состояний у млекопитающих, который заключается во введении млекопитающему терапевтически эффективного количества [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины (соединение A) или ее фармацевтически приемлемой соли, и антикоагулянта, которым является антитело против фактора XI или специфический ингибитор фактора Xa - [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид (бетриксабан, см. ниже) или его фармацевтически приемлемая соль. В другом объекте настоящего изобретения предлагается новый способ профилактики или лечения тромбоза и/или связанного с тромбозом состояния у млекопитающего, который заключается во введении указанному млекопитающему терапевтически эффективного количества [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины (соединение A) или ее фармацевтически приемлемой соли, и другого антитромботического средства, которым является ифетробан. В еще одном объекте настоящего изобретения предлагается новый способ профилактики или лечения тромбоза и/или связанного с тромбозом состояния у млекопитающего, который заключается во вве-2 020045 дении млекопитающему терапевтически эффективного количества соединения A или его фармацевтически приемлемой соли, антикоагулянта и другого антитромботического агента. Настоящее изобретение также относится к новой фармацевтической композиции, включающей фармацевтически приемлемый носитель, соединение A - [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль, и терапевтически эффективное количество другого терапевтического агента. Другой терапевтически эффективный агент выбирают из антикоагулянта, антитромботического агента или их комбинации. В другом объекте настоящего изобретения предлагается новая фармацевтическая композиция,включающая фармацевтически приемлемый носитель, соединение A или его фармацевтически приемлемую соль и антикоагулянт, которым является антитело против фактора XI или бетриксабан или его фармацевтически приемлемая соль. В еще одном объекте настоящего изобретения предлагается новая фармацевтическая композиция,включающая фармацевтически приемлемый носитель, соединение A или его фармацевтически приемлемую соль и другой антитромботический агент, которым является ифетробан. В другом объекте предлагается новая композиция, включающая фармацевтически приемлемый носитель, соединение A или его фармацевтически приемлемую соль, антикоагулянт и другой антитромботический агент. Настоящее изобретение также относится к новому набору, включающему первый контейнер для соединения A или его фармацевтически приемлемой соли и второй контейнер для другого терапевтического агента, который выбирают из группы, включающей антикоагулянт, антитромботический агент или их комбинацию. Указанные и другие варианты настоящего изобретения описаны ниже. Было установлено, что композиции по настоящему изобретению обеспечивают синергетическую эффективность в одном или более из следующих направлений: улучшение терапевтических результатов,повышение безопасности, снижение количества одного или более лекарственных средств в составе комбинации, которое обеспечивает эквивалентную эффективность каждого из указанных лекарственных агентов в отдельности в терапевтически эффективной дозе. Краткое описание фигур На фиг. 1 показано подавление образования тромбов (в процентах) при введении комбинации соединения A (1,1 мкМ) и ингибитора фактора коагуляции Xa, бетриксабана по данным анализа тромбоза в перфузионной ячейке, при этом концентрацию бетриксабана изменяли от 100 нМ до 1,1 мкМ. На фиг. 2 показано дозозависимое подавление тромбоза при введении комбинации соединения A в фиксированной концентрации с бетриксабаном в увеличивающейся концентрации при перфузии цельной крови человека через капилляр, покрытый коллагеном, при этом концентрацию бетриксабана изменяли от 3 нМ до 1,1 мкМ. На фиг. 3 показано дозозависимое подавление тромбоза при введении комбинации соединения A в увеличивающейся концентрации с бетриксабаном в фиксированной концентрации при перфузии цельной крови человека через капилляр, покрытый коллагеном. На фиг. 4 показан комбинированный ингибирующий эффект на опосредованное тромбином накопление тромбоцитов при введении комбинации за счет ингибирования рецептора P2Y12 тромбоцитов (соединением А) и за счет подавления коагуляции ингибитором фактора коагуляции Xa (бетриксабаном). На фиг. 5 показан комбинированный ингибирующий эффект ингибитора фактора коагуляции XI(антитела против фактора XI) и соединения A на образование тромбов в условиях, когда при введении одного агента ингибирование не наблюдается. На фиг. 6 показан комбинированный ингибирующий эффект соединения A и ингибитора фактора коагуляции XI (антитела против фактора XI) на образование тромбов из тромбоцитов на поверхности капилляра, покрытого коллагеном и тканевым фактором, при этом соединение A в отдельности или комбинация соединения A с бетриксабаном не оказывают ингибирующего действия. На фиг. 7 показан комбинированный ингибирующий эффект соединения A в увеличивающейся концентрации и прямого ингибитора тромбина, бивалирудина (12 мкг/мл) на образование тромбов в условиях градиента артериального сдвига. На фиг. 8 показан комбинированный эффект соединения A и аспирина в присутствии ингибитора фактора Xa (С 921-78 - BnSO(2)-D-Arg-Gly-Arg-кетотиазол, 5 мкМ (см. статью Betz A., Wong P.W., SinhaU., Inhibition of factor Xa by a peptidyl-alpha-ketothiazole involves 2 steps: evidence for a stabilizing conformational change, Biochemistry, 38: p. 14582-14591 (1999), включенную в настоящее описание в качестве ссылки) на подавление тромботических процессов в цельной крови по данным анализа в перфузионной ячейке. На фиг. 9 показан комбинированный эффект воздействия ингибирования рецептора P2Y12 соединением А и ингибирования рецепторов ТР ифетробаном в присутствии ингибитора фактора Xa (С 921-78,5 мкМ) на подавление тромботических процессов в цельной крови по данным анализа через перфузионную ячейку. На фиг. 10-13 показан эффект соединения A на модели витальной микроскопии. На фиг. 10 показано, что соединение A замедляет время образования первого тромба в модели витальной микроскопии. На фиг. 11 показана фармакокинетическая и фармакодинамическая (ФК/ФД) корреляция действия соединения A на замедление времени образования первого тромба. На фиг. 12 показано, что соединение A подавляет закупорку сосуда. На фиг. 13 показана ФК/ФД корреляция действия соединения A на подавление закупорки сосуда. На фиг. 14-17 показана эффективность комбинации соединения A и бетриксабана на одной и той же модели витальной микроскопии. На фиг. 14 и 15 показано, что при введении комбинации неэффективных доз соединения A и бетриксабана наблюдается значительное замедление времени образования первого тромба. На фиг. 16 и 17 показано, что при введении комбинации неэффективных доз соединения A и бетриксабана наблюдается значительное подавление тромбоза. Подробное описание изобретения Настоящее изобретение относится к способу и композициям, предназначенным для профилактики или лечения тромбоза и связанных с тромбозом состояний у млекопитающего, с использованием комбинации соединения A и совместно вводимого агента. В настоящем описании использованы следующие термины.I. Определения. В настоящем описании и в формуле изобретения форма единственного числа включает и форму множественного числа, если из контекста не следует иное. Таким образом, например, ссылка на термин"фармацевтически приемлемый носитель" в составе композиции относится к двум или более фармацевтически приемлемым носителям и т.д. Кроме того, следует понимать, что классификация определенных терапевтических агентов, основанная на их назначении или механизмах действия, используется в соответствии с общими принципами,известными в данной области науки. Описанные в данном контексте механизмы действия терапевтических агентов не ограничивают терапевтические агенты, если в данном контексте не указано иное. Некоторые терапевтические агенты могут действовать по двум или более механизмам или их можно использовать для лечения двух или более состояний. Следует также отметить, что действие некоторых агентов,описанных в любом классе лекарственных средств, представлены только в качестве примеров и не ограничивают объем настоящего изобретения. Термин "включающий" обозначает, что указанные композиции и способы включают перечисленные компоненты, но не исключают включение других компонентов. Термин "в основном содержащий",использованный для определения композиций и способов, обозначает исключение других компонентов,которые имеют существенное значение для композиции. Таким образом, не исключено, что в композиции, в основном включающей компоненты, как определено в данном контексте, могут содержаться следовые количества примесей, которые остаются в продукте в результате выделения и очистки, и фармацевтически приемлемые носители, такие как фосфатно-солевой буферный раствор, консерванты и т.п. Термин "содержащий" обозначает исключение элементов следовых компонентов других ингредиентов, а также основных стадий способа введения композиции по настоящему изобретению. Варианты, определенные для каждого из этих терминов, включены в объем настоящего изобретения. Термин "лечение" обозначает любое лечение заболевания или состояния у субъекта, такого как млекопитающее, включающее 1) профилактику или защиту от заболевания или состояния, что означает предотвращение развития клинических симптомов; 2) подавление развития заболевания или состояния,что означает приостановку или подавление развития клинических симптомов; и/или 3) снижение интенсивности симптомов заболевания или состояния, что означает регрессию клинических симптомов. Использованный в настоящем описании термин "профилактика" обозначает профилактическое лечение пациента, нуждающегося в таком лечении. Профилактическое лечение осуществляют при введении соответствующей дозы терапевтического агента субъекту с риском развития заболевания, таким образом, в значительной степени можно предотвратить развитие заболевания. Для специалистов в данной области медицины представляется очевидным, что не всегда можно различить термины "профилактика" и "подавление", так как первичная причина или причины могут быть неизвестными, скрытыми или пациент не ощущает отрицательного действия этих симптомов. Таким образом, использованный в настоящем описании термин "профилактика" рассматривается как часть "лечения" и включает оба термина "профилактика" и "подавление", как определено в настоящем описании. Использованный в настоящем описании термин "защита" включает термин "профилактика". Термин "млекопитающее" включает, без ограничения перечисленным, человека, обезьян, кроликов,мышей, домашних животных, таких как собаки и кошки, сельскохозяйственных животных, таких как крупный рогатый скот, лошади или свиньи и лабораторные животные. Термин "состояние" обозначает патологическое состояние, для лечения которого можно использовать способы и композиции по настоящему изобретению. Используемый в настоящем описании термин "тромбоз и связанные с тромбозом состояния" включает следующие заболевания, не ограничиваясь только ими: любой тромбоз, прежде всего тромботиче-4 020045 ские состояния, включающие, не ограничиваясь только ими, острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящую ишемическую атаку, инсульт, болезнь периферических сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, закупорку кровеносного сосуда, рассеянную внутрисосудистую коагуляцию и тромбоцитопеническую пурпуру, тромботические и рестенозные осложнения, вызванные инвазивными процедурами, например, после ангиопластики,каротидной эндартерэктомии, хирургической операции аортокоронарного шунтирования (АКШ), хирургических операций на сосудах и пересадки сосудов, установки стентов и введения эндоваскулярных устройств и протезов и состояния гиперкоагуляции, связанные с генетической предрасположенностью или раком."Терапевтически эффективное количество" обозначает количество соединения A или совместно вводимого агента по настоящему изобретению, которое проявляет эффективность при лечении заболевания или состояния, предназначенного для лечения, при введении в комбинации. Терапевтически эффективное количество зависит от состава комбинации, от субъекта и состояния, предназначенного для лечения, от массы тела и возраста субъекта, тяжести состояния, от назначенного курса лечения, времени введения, способа введения и т.п., которые определяет специалист в данной области медицины. В некоторых вариантах терапевтически эффективное количество соединения A или совместно вводимого агента в комбинации может означать меньшее количество по сравнению с соответствующим эффективным количеством каждого агента в отдельности. В данном случае терапевтически эффективное количество означает "субтерапевтическую дозу." Таким образом, термин "субтерапевтическая доза" обозначает дозу ниже оптимальной дозы для терапевтического агента, которая требуется при его введении в отдельности, но при его введении в комбинациях, описанных в данном контексте, достигается терапевтический результат. Термины "антикоагулирующие агенты" или "антикоагулянты" обозначают агенты, предотвращающие образование кровяных сгустков. Примеры антикоагулирующих агентов включают (не ограничиваясь только ими) специфические ингибиторы тромбина, фактора IXa, фактора Xa, фактора XI, фактораXIa, фактора XIIa или фактора VIIa, гепарин и их производные, антагонисты витамина K и антитела против антитканевого фактора, а также ингибиторы Р-селектина и PSGL-1. Примеры специфических ингибиторов тромбина включают гирудин, бивалирудин (Ангиомакс), аргатробан, ксимелагатран (Exanta,см. структуру ниже), дабигатран (см. структуру ниже), AZD0837 (проходит стадию клинических испытаний: рандомизированные испытания с параллельным контролем в нескольких медицинских центрах при пероральном введении прямого ингибитора тромбина), AZD0837 в виде препарата для реанимации с целью профилактики инсульта и систолических эмболических явлений у пациентов с мерцательной аритмией, которые соответствуют критериям лечения антагонистами витамина K (отсутствие возможности/отказ от лечения), государственный идентификационный номер испытаний: NCT00623779), RB2006Using RNA Aptamer Technology, Circulation, 114, p. 2490-2497 (2006, и лепирудин (Refludan). Примеры гепарина и его производных включают нефракционированный гепарин (UFH), низкомолекулярный гепарин (LMWH), такой как эноксапарин (Lovenox), далтепарин (Fragmin) и данапароид (Orgaran) и синтетические пентасахариды, такие как фондапаринукс (Arixtra), идрапаринукс и биотинилированный идрапаринукс. Примеры антагонистов витамина K включают варфарин (Coumadin), фенокумарол, аценокумарол Термин "ингибиторы фактора Xa" обозначает соединения, способные подавлять коагуляционную активность фактора Xa, т.е. каталитическое превращение протромбина в тромбин in vitro и/или in vivo. Фактор Xa является ферментом, принимающим участие в процессе коагуляции, и активным компонентом комплекса протромбиназы, который катализирует превращение протромбина в тромбин. Тромбин участвует в превращении фибриногена в фибрин и приводит к образованию сгустков крови. Таким образом, подавление фактора Xa является эффективным способом лечения и предотвращения тромботического заболевания(ий). Предпочтительный ингибитор фактора Xa ингибирует образование тромбина какin vitro, так и in vivo. Более предпочтительный ингибитор фактора Xa обладает антикоагуляционной эффективностью in vivo. Термин "специфический ингибитор фактора Xa" относится к ингибиторам фактораXa, обладающим значительно более высокой активностью в отношении фактора Xa, по сравнению с другими ферментами или рецепторами одного и того же млекопитающего. Предпочтительно специфический ингибитор фактора Xa не проявляет заметной ингибирующей активности в отношении других ферментов или рецепторов одного и того же млекопитающего в терапевтически эффективных концентрациях. Примеры известных ингибиторов фактора Xa включают (не ограничиваясь только ими) фондапаринукс, идрапаринукс, биотинилированный идрапаринукс, эноксапарин, фрагмин, NAP-5, rNAPc2, ингибитор пути тканевого фактора, LY517717 (выпускаемый фирмой Eli LillyCo., Индианаполис, штат Индиана, США, химическое название N-(1R)-2-[4-(1-метил-4-пиперидинил)-1-пиперазинил]-2-оксо-1 фенилэтил-1 Н-индол-6-карбоксамид, как описано, например, в статье Agnelli G. et al., A Phase II StudyReplacement, J. Thromb. Haemost., 5(4), p. 746-753 (2007), который находится на стадии клинических испытаний, например на стадии сравнения антикоагулянта LY517717 в виде дифумарата для перорального введения с эноксапарином для подкожного введения для профилактики венозной тромбоэмболии (VTE) после тотального эндопротезирования тазобедренного сустава (THR) и полной замены коленного сустава(TKR), государственный идентификационный номер клинических испытаний: NCT00074828),YM-150 (как описано, например, в статье Eriksson B.I. et al., J. Thromb. Haemost., 5, p. 1660-1665(2007) находится на стадии клинических испытаний, например, прямой ингибитор YM150 фактора Xa для профилактики венозной тромбоэмболии у пациентов, которым рекомендуется тотальное эндопротезирование тазобедренного сустава. Испытания двойным слепым методом с параллельным контролем и с изменением дозы по сравнению с клиническими испытаниями эноксапарина с открытой этикеткой, государственный идентификационный номер: NCT00353678), Daiichi DU-176b (как описано, например, в статье Е. Hylek, DU-176b, An Oral, Direct Factor Xa Antagonist, Current Opinion in Investigational Drugs. 8,p. 778-783 (2007), который находится на стадии клинических испытаний, например фаза IIb, рандомизированные испытания в параллельных группах двойным слепым методом в нескольких медицинских центрах в нескольких странах с изменением дозы, испытания DU-176b по сравнению с далтепарином, с участием пациентов, которым рекомендовано тотальное эндопротезирование тазобедренного сустава, государственный идентификационный номер: NCT00398216), бетриксабан и соединения, приведенные в табл. 1, и их производные, как описано ниже. Термин "[2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил)карбоксамид", относится к соединению со следующей структурой или к его таутомеру, которые в настоящем контексте также относятся к бетриксабану: Бетриксабан описан в заявке US2007/0112039, в которой испрашивается приоритет в связи с временной заявкой US60/735224, поданной 8 ноября 2005 г., содержание которой в полном объеме включено в настоящее описание в качестве ссылки. Бетриксабан известен как специфический ингибитор фактора Xa. Термин "ингибиторы фактора XI" обозначает соединения, которые подавляют коагуляционный фактор XI. При протеолитической активации фактор XI превращается в активный фермент, фактор XIa,который расщепляет фактор IX с образованием фактора IXa. Фактор IXa затем гидролизует фактор X с образованием фактора Xa, который индуцирует реакции коагуляции, приводящие к образованию сгустков крови, как описано выше. Антитела против антифактора XI обозначают белок, который продуцируется при иммунной ответной реакции и который специфически связывается с фактором XI и, таким образом, подавляет его активность. Некоторые антитела против антифактора XI являются коммерческими продуктами, например, выпускаются фирмой Haematologic Technologies, Essex Junction, штат Вермонт,США. Термин "антикоагулянты для инъекции" обозначает антикоагулянты, которые вводят млекопитающему инъекцией. Примеры антикоагулянтов для инъекций включают нефракционированный гепарин,низкомолекулярные гепарины и синтетические пентасахариды. Термины "антитромботические агенты" или "ингибиторы тромбоцитов" означают агенты, которые блокируют образование сгустков крови за счет предотвращения агрегации тромбоцитов. Существует несколько классов антитромботических агентов, которые определяются по их активности и включают антагонисты GP IIb/IIIa, такие как абциксимаб (ReoPro), эптифибатид (Integrilin) и тирофибан(Aggrastat), антагонисты рецептора P2Y12, такие как клопидогрел (Plavix), тиклопидин (Ticlid), кангрелор, тикагрелор и прасугрел, ингибиторы фосфодиэстеразы III (PDE III), такие как цилостазол(Pletal), дипиридамол (Persantine) и аспирин/дипиридамол пролонгированного действия (Aggrenox),ингибиторы тромбоксансинтазы, такие как фурегрелат, озагрел, ридогрел и исбогрел, антагонисты тромбоксанового рецептора А 2 (антагонист ТР), такие как ифетробан, раматробан, тербогрел,(3-6-[(4-хлорфенилсульфонил)амино]-2-метил-5,6,7,8-тетрагидронафт-1-илпропионовая кислота (также известная под названием Servier S 18886, выпускаемая фирмой de Recherches Internationales Servier,Courbevoie, Франция), антагонисты рецептора тромбина, такие как SCH530348 (химическое название этиловый эфир (1R,3aR,4aR,6R,8aR,9S,9aS)-9-Е)-2-(5-(3-фторфенил)пиридин-2-ил)винил)-1-метил-3 оксододекагидронафто[2,3-С]фуран-6-илкарбаминовой кислоты, Schering Plough Corp., New Jersey,США, описанный в заявках US 20040192753 A1 и US 2004/0176418 A1 и который находится на стадии клинических испытаний, таких как рандомизированные испытания с плацебо-контролем двойным слепым методом в нескольких медицинских центрах для оценки безопасности SCH 530348 у субъектов, которым провели чрескожную коронарную ангиопластику, в неаварийной ситуации, государственый идентификационный номер: NCT00132912), ингибиторы Р-селектина, такие как 2-(4-хлорбензил)-3-гидрокси 7,8,9,10-тетрагидробензо[Н]хинолин-4-карбоновая кислота (торговое название PSI-697, Wyeth, NewJersey, США) и нестероидные противовоспалительные лекарственные средства (НСПВС), такие как ацетилсалициловая кислота (аспирин), резвератрол, ибупрофен (адвил, мотрин), напроксен (алеве,напросин), сулиндак (клинорил), индометацин (индоцин), мефенамат, дроксикам, диклофенак (катафлам, вольтарен), сульфинпиразон (антуран) и пироксикам (фельден). Предпочтительными НСПВС являются ацетилсалициловая кислота, резвератрол и пироксикам. Некоторые НСПВС ингибируют как циклооксигеназу-1 (сох-1), так и циклооксигеназу-2 (сох-2), например аспирин и ибупрофен. Некоторые селективно ингибируют только сох-1, например резвератрол, который является обратным ингибитором сох-1 и лишь незначительно ингибирует сох-2. Бета-блокаторы и блокаторы кальциевых каналов, описанные ниже, также ингибируют тромбоциты. Термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с использованием относительно нетоксичных кислот или оснований, в зависимости от выбранных конкретных заместителей в составе определенных терапевтических агентов, описанных в настоящем описании. Если терапевтические агенты, описанные в настоящем изобретении, содержат относительно кислотные функциональные группы, то образуются основно-аддитивные соли при взаимодействии нейтральной формы указанных соединений с достаточным количеством требуемого основания как в среде,не содержащей растворитель, так и в среде пригодного инертного растворителя. Примеры солей фармацевтически приемлемых неорганических оснований включают соли алюминия, аммония, кальция, меди,железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия, цинка и т.п. Соли фармацевтически приемлемых органических оснований включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и т.п., такие как аргинин,бетаин,кофеин,холин,N,N'-дибензилэтилендиамин,диэтиламин,2-диэтиламиноэтанол,2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин,трометамин и т.п. Если терапевтические агенты, описанные в настоящем изобретении, содержат относительно основные функциональные группы, то образуются кислотно-аддитивные соли при взаимодействии нейтральной формы указанных соединений с достаточным количеством требуемой кислоты как в среде, не содержащей растворитель, так и в среде пригодного инертного растворителя. Примеры фармацевтически приемлемых основно-аддитивных солей включают соли неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, магния, алюминия и т.п Прежде всего, предпочтительными являются соли калия и натрия. Соли фармацевтически приемлемых органических нетоксичных оснований включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая замещенные амины природного происхождения, циклические амины и основные ионообменные смолы, например изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметарнин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и т.п. Прежде всего,предпочтительные органические нетоксичные основания включают изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин. Если соединения по настоящему изобретению содержат относительно основные функциональные группы, можно получать кислотно-аддитивные соли при взаимодействии нейтральной формы указанных соединений с достаточным количеством требуемой кислоты, неразбавленной или в пригодном инертном растворителе. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают соли неорганических кислот, таких как хлористоводородная, бромисто-водородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодисто-водородная или фосфорные кислоты и т.п., а также соли относительно нетоксичных органических кислот, таких как уксусная, пропионовая,изомасляная, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая, паратолуолсульфоновая, лимонная, винная, метансульфоновая кислоты и т.п. Также используют соли аминокислот, таких как аргинин и т.п., и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и т.п. (см., например, Berge S.M. et al., "Pharmaceutical Salts", JournalPublishers, Амстердам) (1985. Некоторые специфические соединения по настоящему изобретению содержат как основную, так и кислотную группы, что позволяет получать как кислотно-аддитивные, так и основно-аддитивные соли. Некоторые предпочтительные солевые формы соединения формулы I описаны в заявкеUS 2007/0123547, "[4-(6-Галоген-7-замещенный-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевины, формы и способы их получения", поданной 3 ноября 2006 г., в которой испрашивается приоритет по отношению к предварительной заявке 60/733650, поданной 3 ноября 2005 г., которые в полном объеме включены в настоящее описание в качестве ссылок. Предпочтительно соединение образует калиевую соль (формула I) или натриевую соль (формула II) Некоторые кристаллические твердые или аморфные формы калиевой соли формулы I и натриевой соли формулы II также описаны в заявке US 2007/0123547. Некоторые предпочтительные кристаллические твердые формы калиевой соли формулы I характеризуются по крайней мере одной из следующих характеристик: (1) ИК-спектр содержит пики приблизительно при 3389 и приблизительно 1698 см-1, (2) рентгеновская порошковая дифрактограмма, пики 2 приблизительно при 9,5 и 25,5 и (3) эндотермический максимум на кривой ДСК наблюдается приблизительно при 246C. Некоторые указанные формы характеризуются следующими ИК-спектрами: пики приблизительно при 3559, 3389, 3324, 1698, 1623,1563, 1510, 1448, 1431, 1403, 1383, 1308, 1269, 1206, 1174, 1123, 1091, 1072, 1030, 987, 939, 909, 871, 842,787, 780, 769, 747, 718, 701, 690 и 667 см-1. Другие предпочтительные кристаллические твердые формы калиевой соли формулы I характеризуются по крайней мере одной из следующих характеристик:(1) ИК-спектр, пики приблизительно при 3327 и приблизительно 1630 см-1, (2) рентгеновская порошковая дифрактограмма, пики 2 приблизительно при 20,3 и 25,1 и (3) эндотермический максимум на кривой ДСК наблюдается приблизительно при 293C. Некоторые указанные формы характеризуются следующими ИК-спектрами: пики приблизительно при 3584, 3327, 3189, 2935, 2257, 2067, 1979, 1903, 1703,1654, 1630, 1590, 1557, 1512, 1444, 1429, 1406, 1375, 1317, 1346, 1317, 1288, 1276, 1243, 1217, 1182, 1133,1182, 1133, 1093, 1072, 1033, 987, 943, 907, 883, 845, 831, 805, 776, 727, 694 и 674 см-1. Некоторые предпочтительные аморфные формы натриевой соли формулы II характеризуются по крайней мере одной из следующих характеристик: (1) ИК-спектр, пики приблизительно при 3360, 1711, 1632, 1512, 1227, 1133 и 770 см-1 и (2) рентгеновская порошковая дифрактограмма, уширенный пик 2 от приблизительно 15 до приблизительно 30. Некоторые указанные формы характеризуются следующими ИК-спектрами, пики приблизительно при 3360, 1711, 1632, 1556, 1512, 1445, 1407, 1375, 1309, 1280, 1227, 1133, 1092, 1032,987, 905, 781, 770 и 691 см-1. Некоторые предпочтительные солевые формы бетриксабана описаны в заявке US2007/0112039. Прежде всего, в указанной заявке описано, что бетриксабан образует кислотно-аддитивную соль. Указанную кислоту предпочтительно выбирают из группы, включающей соляную, молочную, малеиновую,феноксиуксусную, пропионовую, янтарную, адипиновую, аскорбиновую, камфарную, глюконовую, фосфорную, винную, лимонную, метансульфоновую, фумаровую, гликолевую, нафталин-1,5 дисульфоновую, гентизиновую и бензолсульфоновую кислоты. Предпочтительно указанную кислоту выбирают из группы, включающей соляную, молочную, малеиновую, феноксиуксусную, пропионовую и янтарную кислоты. Более предпочтительной кислотой является малеиновая кислота и ее соль: малеат бетриксабана. Один вариант малеата бетриксабана представлен ниже (формула III) Кроме того, соль формулы III может существовать в виде кристаллических полиморфных форм, как описано в заявке US2007/0112039. По данным рентгеновской порошковой дифрактометрии одна кристаллическая полиморфная форма формулы III характеризуется по крайней мере четырьмя, а предпочтительно восемью пиками при углах 2: 4,9, 9,7, 13,8, 14,1, 15,2, 17,6, 18,5, 20,8, 21,6, 22,7, 24,1, 26,3, 26,8. Более предпочтительная кристаллическая полиморфная форма характеризуется пиками при углах 2 : 4,9, 9,7, 11,8, 13,8, 14,1, 15,2, 17,6, 18,5, 19,9, 20,8, 21,6, 22,7, 24,1, 25,0, 26,3, 26,8. Нейтральные формы терапевтических агентов получают при взаимодействии соли с основанием или кислотой с последующим выделением исходного терапевтического агента стандартными способами. Исходная форма терапевтического агента отличается от различных солевых форм по определенным фи- 10020045 зическим свойствам, таким как растворимость в полярных растворителях, но соли по настоящему изобретению эквивалентны исходной форме соединения по настоящему изобретению. Кроме солевых форм, некоторые терапевтические агенты существуют в форме пролекарства. К пролекарствам терапевтических агентов относятся такие соединения, которые подвергаются химическим превращениям в физиологических условиях, при этом образуется соединение, обладающее терапевтической активностью. Кроме того, пролекарства можно превратить в активное соединение химическими или биохимическими методами в условиях ех vivo. Например, пролекарство может медленно превращаться в активное соединение, описанное в настоящем изобретении, если находится в резервуаре трансдермального пластыря, содержащем пригодный фермент или химический реагент. Некоторые терапевтические агенты, описанные в настоящем изобретении, находятся в несольватированных формах, а также в сольватированных формах, включая гидратные формы. В основном сольватированные формы эквивалентны несольватированным формам, и все они включены в объем настоящего изобретения. Некоторые терапевтические агенты существуют в нескольких кристаллических или аморфных формах. В основном в настоящем изобретении все физические формы эквивалентны и включены в полном объеме в настоящее изобретение. Термин "фармацевтически приемлемые носители" обозначает любые разбавители, эксципиенты или носители, которые используют в композициях по настоящему изобретению. Фармацевтически приемлемые носители включают ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, дигидрофосфат натрия, дигидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, производные целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин. Пригодные фармацевтические носители описаны в справочнике Remington's PharmaceuticalSciences, Mack Publishing Company. Указанные носители предпочтительно выбирают в зависимости от предполагаемой формы введения, а именно пероральные таблетки, капсулы, эликсиры, сиропы и т.п. в соответствии со стандартной фармацевтической практикой.II. Подробное описание вариантов настоящего изобретения. а. Способы лечения. Настоящее изобретение относится к новым способам лечения состояния у млекопитающего, характеризующегося тромбозом, которые заключаются во введении указанному млекопитающему терапевтически эффективного количества следующих терапевтических агентов:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль и(2) второй терапевтический агент выбирают из группы, включающей антикоагулянт, антитромботический агент или их комбинации. В одном объекте настоящего изобретения предлагается новый способ профилактики или лечения тромбоза и/или связанного с тромбозом состояния у млекопитающего, который заключается во введении указанному млекопитающему терапевтически эффективного количества следующих двух терапевтических агентов:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль и(2) антикоагулянт, выбранный из антитела против фактора XI и бетриксабана или его фармацевтически приемлемой соли. В одном варианте фармацевтически приемлемой солью бетриксабана является малеат. В другом варианте антикоагулянт выбирают из антитела против фактора XI. В другом объекте настоящего изобретения предлагается способ лечения состояния у млекопитающего, характеризующегося тромбозом, заключающийся во введении указанному млекопитающему терапевтически эффективного количества следующих двух терапевтических агентов:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль и(2) другой антитромботический агент, которым является антагонист рецептора ТР - ифетробан. В некоторых вариантах по крайней мере один из указанных терапевтических агентов вводят в субтерапевтической дозе. В других вариантах оба из указанных терапевтических агентов вводят в субтерапевтических дозах. В некоторых вариантах два терапевтических агента вводят одновременно. В других вариантах два терапевтических агента вводят последовательно. В еще одном объекте настоящего изобретения предлагается способ профилактики или лечения тромбоза и/или связанного с тромбозом состояния у млекопитающего, который заключается во введении указанному млекопитающему терапевтически эффективного количества следующих трех терапевтических агентов:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль;(2) другой антитромботический агент и(3) антикоагулянт. В некоторых вариантах антитромботическим агентом является ингибитор циклооксигеназы. В другом варианте антитромботическим агентом является ацетилсалициловая кислота. В еще одном варианте антитромботическим агентом является антагонист рецептора ТР. В некоторых вариантах антагонистом рецептора ТР является ифетробан. В другом варианте антикоагулянтом является ингибитор фактора Xa. В некоторых вариантах ингибитором фактора Xa является бетриксабан. В другом варианте антикоагулянтом является соединение С 921-78. В других вариантах по крайней мере один из указанных терапевтических агентов вводят в субтерапевтической дозе. В некоторых вариантах все указанные терапевтические агенты вводят в субтерапевтических дозах. В других вариантах три терапевтических агента вводят одновременно. В некоторых вариантах три терапевтических агента вводят последовательно. В других вариантах фармацевтически приемлемая соль [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевой солью. В некоторых вариантах фармацевтически приемлемая соль [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является натриевой солью. В других вариантах связанные с тромбозом состояния выбирают из группы, включающей острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящую ишемическую атаку, инсульт, заболевания периферических сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, закупорку кровеносного сосуда, рассеянную внутрисосудистую коагуляцию и тромбоцитопеническую пурпуру, тромботические и рестенозные осложнения, которые развиваются в результате инвазивных процедур, например, после ангиопластики, каротидной эндартерэктомии, аортокоронарного шунтирования, хирургических операций на сосудах и пересадки сосудов, установки стентов и введения эндоваскулярных устройств и протезов. б. Фармацевтические композиции. В настоящем изобретении также предлагаются фармацевтические композиции, включающие фармацевтически приемлемый носитель, [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль и, по крайней мере, другой терапевтический агент, который выбирают из группы, включающей антикоагулянт,антитромботический агент и их комбинации. В одном объекте настоящего изобретения предлагается фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие два терапевтических агента:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль и(2) антикоагулянт, выбранный из антитела против фактора XI и бетриксабана или его фармацевтически приемлемой соли. В одном варианте фармацевтически приемлемой солью бетриксабана является малеат. В другом варианте антикоагулянт выбирают из антитела против фактора XI. В другом объекте настоящего изобретения предлагается фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие два терапевтических агента:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевина или ее фармацевтически приемлемая соль и(2) другой антитромботический агент. В некоторых вариантах антитромботическим агентом является антагонист рецептора ТР - ифетробан. В некоторых вариантах антитромботическим агентом является ингибитор циклооксигеназы. В другом варианте ингибитором циклооксигеназы является ацетилсалициловая кислота. В еще одном объекте настоящего изобретения предлагается фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие три терапевтических агента:[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилочевина или ее фармацевтически приемлемая соль;(2) другой антитромботический агент и(3) антикоагулянт. В некоторых вариантах антитромботическим агентом является ингибитор циклооксигеназы. В другом варианте антитромботическим агентом является ацетилсалициловая кислота. В некоторых вариантах антитромботическим агентом является антагонист рецептора ТР - ифетробан. В другом варианте антикоагулянтом является ингибитор фактора Xa. В некоторых вариантах ингибитором фактора Xa является бетриксабан. В другом варианте антикоагулянтом является соединение С 921-78. В некоторых вариантах по крайней мере один из указанных терапевтических агентов вводят в субтерапевтической дозе. В других вариантах все указанные терапевтические агенты вводят в субтерапевтических дозах. В некоторых вариантах фармацевтически приемлемая соль [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевой солью. В других вариантах фармацевтически приемлемая соль [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является натриевой солью. в. Набор. В настоящем изобретении предлагаются также новые наборы, включающие:(1) первый контейнер, содержащий [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль; и(2) второй контейнер, содержащий второй терапевтический агент, который выбирают из группы,включающей антикоагулянт, антитромботический агент и их комбинацию. В одном объекте настоящего изобретения предлагается набор, включающий:(1) первый контейнер, содержащий [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль; и(2) второй контейнер, содержащий антикоагулянт. В другом объекте настоящего изобретения предлагается набор, включающий:(1) первый контейнер, содержащий [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль; и(2) второй контейнер, содержащий другой антитромботический агент. В некоторых вариантах по крайней мере один из указанных терапевтических агентов вводят в субтерапевтической дозе. В других вариантах оба указанных терапевтических агента вводят в субтерапевтических дозах. Кроме того, в некоторых вариантах набор содержит вкладыш-инструкцию по совместному введению двух терапевтических агентов. В еще одном объекте настоящего изобретения предлагается набор, включающий:(1) первый контейнер, содержащий [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину или ее фармацевтически приемлемую соль;(3) третий контейнер, содержащий другой антитромботический агент. В некоторых вариантах первый контейнер содержит калиевую соль [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. В других вариантах первый контейнер содержит натриевую соль [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. В некоторых вариантах второй контейнер содержит бетриксабан или его фармацевтически приемлемую соль. Еще в одном варианте второй контейнер содержит малеат бетриксабана.III. Комбинированная терапия. Было установлено, что комбинация соединения A и ингибитора фактора Xa, такого как бетриксабан, проявляет дополнительное антитромботическое действие, превышающее по эффективности действие двух указанных агентов, каждого в отдельности. В примере 3, по данным анализа в перфизуонной камере при добавлении различных концентраций бетриксабана к соединению А (1,1 мкМ), наблюдается дополнительный дозозависимый ингибирующий эффект в отношении тромбоза. Аналогичным образом,в примере 4 было установлено, что при добавлении различных количеств соединения A к фиксированному количеству бетриксабана также наблюдается дополнительный ингибирующий эффект в отношении тромбоза. Аналогичный дополнительный эффект наблюдается при анализе накопления тромбина, индуцированного тромбоцитами, как описано в примере 5: комбинация соединения A и бетриксабана обеспечивает подавление в большей степени по сравнению с действием каждого соединения в отдельности. Ингибиторы других ферментов коагуляции, такие как ингибиторы фактора XI или прямые ингибиторы тромбина, также можно комбинировать с соединением А и наблюдать улучшенную антитромботическую эффективность. В примере 6 было установлено, что комбинация антител против фактора XI и соединения A подавляет образование тромбов в условиях, при которых ни соединение A, ни антитела против фактора XI, каждое в отдельности, не оказывает детектируемого подавления образования тромбов. В примере 7 было установлено, что при введении комбинации соединения A и антител против фактора XI наблюдается подавление образования тромбов в большей степени по сравнению с действием соединения A в отдельности или при введении комбинации соединения A и бетриксабана (по данным анализа в перфузионной ячейке). В примере 8 установлено, что при введении комбинации соединения A и прямого ингибитора тромбина, такого как бивалирудин (Angiomax), наблюдается комбинированный антитромботический эффект. Было также установлено, что аддитивный антитромботический эффект обеспечивается не только при введении комбинации соединения A и антикоагулянта, но и при введении комбинации соединения A(антитромботического соединения, которое действует по механизму анатагонизма P2Y12) с другими классами антитромботических агентов. Как было установлено в примерах 9 и 10, аддитивный антитромботический эффект наблюдается при комбинировании соединения A как с ингибитором циклооксигеназы, таким как ацетилсалициловая кислота (пример 9), так и с антагонистом ТР, таким как ифетробан(пример 10), в присутствии ингибитора фактора Xa. Установлено, что при использовании способа лечения комбинацией соединения A и совместно вводимого агента не наблюдается нежелательное взаимодействие лекарственных средств друг с другом или другие дополнительные побочные эффекты по сравнению с побочным действием указанных агентов в отдельности. Предпочтительно комбинация проявляет улучшенную эффективность и/или безопасность по сравнению с введением агентов в отдельности, прежде всего за счет снижения требуемой дозы и обеспечения требуемого уровня терапевтического действия. В указанном случае терапевтически эффективное количество агентов для комбинированной терапии можно снизить по сравнению с необходимым эффективным или оптимальным количеством агентов при их введении в отдельности. Предполагается,что более низкие дозы позволяют свести к минимуму возможные побочные эффекты агента, что обеспечивает улучшенный профиль безопасности. Таким образом, в комбинации предпочтительно можно использовать один из указанных терапевтических агентов в субтерапевтической дозе. Еще более предпочтительно в комбинации можно использовать оба терапевтических агента в субтерапевтической дозе. Аналогичным образом, предполагается, что при использовании способа лечения комбинацией соединения A, антикоагулянта и другого антитромботического агента не наблюдается нежелательное взаимодействие лекарственных средств друг с другом или другие дополнительные побочные эффекты по сравнению с побочными действиями при введении указанных агентов в отдельности. Предпочтительно комбинация трех агентов проявляет повышенную эффективность или безопасность по сравнению с введением любых агентов в отдельности. Более предпочтительно в комбинации можно использовать один из терапевтических агентов в более низких дозах по сравнению с дозами терапевтического агента в отдельности, т.е. в субтерапевтических дозах. Еще более предпочтительно в комбинации можно использовать все терапевтические агенты в субтерапевтических дозах. Соединение А и совместно вводимый агент можно перерабатывать в две отдельные фармацевтические композиции. Их можно вводить одновременно или последовательно в любом порядке. Предпочтительно при введении последовательно два агента вводят через достаточно короткие периоды времени, и таким образом обеспечивается требуемая терапевтическая эффективность. Соединение А и совместно вводимый агент можно перерабатывать в единую фармацевтическую композицию. Соединение А, антикоагулянт и другой антитромботический агент можно также вводить одновременно или последовательно в любом порядке. Предпочтительно при введении последовательно три агента вводят через достаточно короткие периоды времени, и таким образом обеспечивается требуемая терапевтическая эффективность. Их также можно перерабатывать в единую фармацевтическую композицию или любые два агента можно перерабатывать в единую фармацевтическую композицию. Можно использовать любые из вышеуказанных лекарственных форм, содержащих эффективные количества, согласно обычной медицинской практике и они в полном объеме включены в настоящее изобретение. Терапевтически эффективная доза существенно зависит от способа введения и лекарственной формы. Предпочтительно комбинация по настоящему изобретению обозначает состав, который характеризуется высоким терапевтическим индексом. Терапевтический индекс обозначает соотношение дозы, оказывающей токсическое воздействие, и дозы, оказывающей терапевтическую эффективность. Терапевтический индекс рассчитывают по отношению LD50 к ED50. LD50 обозначает летальную дозу для 50% популяции, а ED50 обозначает терапевтически эффективную дозу для 50% популяции. LD50 и ED50 определяют по стандартной фармацевтической методике с использованием культур животных клеток или экспериментальных животных. Комбинированную терапию по настоящему изобретению проводят один или несколько раз в сутки, а также можно использовать другие курсы лечения. Предпочтительно комбинированную терапию по настоящему изобретению проводят один раз в сутки или указанную комбинацию вводят два, три или четыре раза в сутки. Более предпочтительно комбинированную терапию по настоящему изобретению проводят один или два раза в сутки. Обычно соединение A (приблизительно от 0,5 до 500 мг) или соль или смесь солей соединения A смешивают с физиологически приемлемым наполнителем, носителем, эксципиентом, связующим веществом, консервантом, стабилизатором, красителем, ароматизатором и т.п., согласно фармацевтической практике. В одном объекте соединение A перерабатывают в состав, пригодный для внутривенного введения. В некоторых вариантах стандартная лекарственная форма для внутривенного введения содержит от 1 до 50 мг соединения A или его фармацевтически приемлемой соли. В других вариантах стандартная лекарственная форма содержит от 5 до 40 мг, от 10 до 30 мг, от 15 до 25 мг, от 25 до 45 мг или приблизи- 14020045 тельно 20, 30, 40 или 50 мг соединения A или его соли. В другом варианте соединение A перерабатывают в состав, пригодный для перорального введения. В некоторых вариантах композицию перерабатывают в стандартную лекарственную форму, содержащую от 1 до 800 мг, от 20 до 200 мг, от 50 до 150 мг, от 10 до 50 мг или от 20 до 40 мг соединения A или его соли. В других вариантах композиция представляет собой стандартную лекарственную форму, содержащую приблизительно 30, 50, 75, 100, 125, 150, 175 или 200 мг соединения A или его соли. Если соединение A и совместный агент перерабатывают в стандартную фармацевтическую композицию, то в указанную композицию можно добавлять приблизительно от 0,5 до 500 мг совместного агента. Предпочтительно, если соединение A и другой агент представляют собой состав для внутривенного введения, то содержание соединения A или его соли составляет от 1 до 50 мг, от 5 до 40 мг,от 10 до 30 мг, от 15 до 25 мг, от 25 до 45 мг или приблизительно 20, 30, 40 или 50 мг. Если соединение A и другой агент перерабатывают в состав для перорального введения, то содержание соединения A или его соли составляет от 1 до 800 мг, от 20 до 200 мг, от 50 до 150 мг, от 10 до 50 мг или от 20 до 40 мг или приблизительно 30, 50, 75, 100, 125, 150, 175 или 200 мг. При получении комбинаций, содержащих соединение A и бетриксабан в виде любых вышеуказанных стандартных лекарственных форм, соединениеA или его соли или смеси солей соединения A с бетриксабаном (приблизительно от 0,5 до 500 мг) или с его солью или со смесью солей бетриксабана смешивают с физиологически приемлемым наполнителем,носителем, эксципиентом, связующим веществом, консервантом, стабилизатором, красителем, ароматизатором и т.п., согласно фармацевтической практике. Количество активного ингредиента(ов) в указанных композициях должно соответствовать пригодной дозе в зависимости от назначения. Установлено, что стандартная доза соединения A, предназначенная для комбинированной терапии,составляет от приблизительно 0,001 до приблизительно 100 мг/кг, предпочтительно от приблизительно 0,01 до приблизительно 11,4 мг/кг, более предпочтительно от приблизительно 0,01 до приблизительно 2,85 мг/кг, еще более предпочтительно от приблизительно 0,01 до приблизительно 1,43 мг/кг. Установлено, что при комбинированном лечении соединением А и бетриксабаном стандартная доза бетриксабана составляет от приблизительно 0,001 до приблизительно 1000 мг/кг, предпочтительно от приблизительно 0,01 до приблизительно 2,0 мг/кг, более предпочтительно от приблизительно 0,1 до приблизительно 1,5 мг/кг или от приблизительно 0,4 до приблизительно 1,2 мг/кг, еще более предпочтительно от приблизительно 0,5 до приблизительно 1,0 мг/кг. Наиболее предпочтительно доза бетриксабана в комбинациях составляет менее 0,5 мг/кг. Стандартные дозы других совместных агентов, описанных в данном контексте, при использовании в качестве индивидуального агента известны специалисту в данной области. Установлено, что дозы указанных агентов при использовании в комбинации с соединением А не превышают максимальных доз индивидуальных агентов. Предпочтительно при комбинированной терапии соединение вводят в дозе,меньше максимальной дозы, более предпочтительно в субтерапевтической дозе. Специалист в данной области медицины может определить дозы, обеспечивающие улучшенное действие комбинированной терапии, как описано в данном контексте.IV. Композиция. Кроме того, в настоящем изобретении предлагается новая композиция, включающая соединение A или его фармацевтически приемлемую соль, антикоагулянт или другой антитромботический агент и фармацевтически приемлемый носитель. Фармацевтические композиции по настоящему изобретению получают по известным методикам,таким как грануляция, перемешивание, растворение, инкапсулирование, лиофилизация или эмульгирование и т.п. Композиции получают в различных формах, таких как гранулы, осадок или твердые частицы, порошки, включая лиофилизированные, высушенные в роторном испарителе или высушенные в сушках с распылением аморфные порошки, таблетки, капсулы, сироп, суппозитории, растворы для инъекций, эмульсии, эликсиры, суспензии или растворы. Составы не обязательно содержат стабилизаторы,модификаторы рН, поверхностно-активные вещества (ПАВ), модификаторы биодоступности и их комбинации. Фармацевтические составы получают в виде жидких суспензий или растворов с использованием стерильных жидкостей, таких как масло, вода, спирт и их комбинации. Фармацевтически пригодные ПАВ, суспендирующие агенты или эмульгирующие агенты добавляют в составы для перорального или парентерального введения. Суспензии включают масла, такие как арахисовое масло, кунжутное масло,хлопковое масло, кукурузное масло и оливковое масло. Суспензии также могут содержать эфиры жирных кислот, такие как этилолеат, изопропилмиристат, глицериды жирных кислот и ацетилированные глицериды жирной кислоты. Суспензионные составы включают спирты, такие как этанол, изопропиловый спирт, гексадециловый спирт, глицерин и полипропиленгликоль. В состав суспензии также могут входить эфиры, такие как полиэтиленгликоль, нефтяные углеводороды, такие как минеральное масло и вазелин, а также вода. Композиции по настоящему изобретению перерабатывают в составы для фармацевтического введения млекопитающему, предпочтительно человеку. Указанные фармацевтические композиции по настоящему изобретению вводят перорально, парентерально, ингаляцией, местным способом, ректально, на- 15020045 зально, трансбуккальным, вагинальным способом или с использованием имплантированного резервуара. Термин "парентеральный", используемый в данном контексте, включает подкожное введение, внутривенное введение, внутримышечное введение, внутрисуставное введение, внутрисиновиальное введение,интрастернальное введение, интратекальное введение, внутрипеченочное введение, введение внутрь поражнных тканей или внутричерепное введение или вливание. Предпочтительно композиции вводят перорально или внутривенно. Согласно настоящему изобретению получают составы быстрого действия, с быстрым высвобождением, пролонгированного действия, с замедленным высвобождением. Кроме того,соединения можно вводить местным способом, а не системным способом, например, в виде состава с замедленным высвобождением. Стерильные формы для инъекций композиций по настоящему изобретению представляют собой водные или масляные суспензии. Указанные суспензии получают по стандартным методикам с использованием пригодных диспергирующих или увлажняющих агентов, а также суспендирующих агентов. Стерильным препаратом для инъекций является также стерильный раствор или суспензия для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. К приемлемым наполнителям и растворителям относятся вода, физиологический раствор и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды можно использовать стерильные жирные масла. С этой целью можно использовать любые жирные масла, включая синтетические моно- или диглицериды. Для получения препарата для инъекций используют жирные кислоты, такие как олеиновая кислота и ее глицериды, а также природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, прежде всего в их полиоксиэтилированных формах. Указанные масляные растворы или суспензии могут также содержать спиртовые разбавители или диспергирующие средства с длинной цепью, такие как карбоксиметилцеллюлоза или аналогичные диспергирующие агенты, которые обычно используют в составах фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Для получения составов также используют другие стандартные ПАВ, такие как твин, спан и другие эмульгирующие агенты или усилители биодоступности, которые обычно применяют для получения фармацевтически приемлемых твердых, жидких,или других лекарственных форм. Соединения можно перерабатывать в формы для введения, такого как струйное введение или непрерывное введение. Стандартную лекарственную форму для инъекций упаковывают в ампулы или в контейнеры для многократного приема. Фармацевтическими композициями по настоящему изобретению являются любые пероральные лекарственные формы, включая капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального введения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Можно также использовать замасливатели, такие как стеарат магния. Для капсул пригодные разбавители включают лактозу и сухой кукурузный крахмал. Если необходимы пероральные водные суспензии, то активный ингредиент смешивают с эмульгирующими и суспендирующими агентами. При необходимости также добавляют определенные подсластители, ароматизаторы или красители. В другом варианте фармацевтические композиции по настоящему изобретению представляют собой суппозиторий для ректального введения. Указанные формы получают при смешивании агента с пригодным, не вызывающим раздражения эксципиентом, который при комнатной температуре находится в твердом состоянии, а при ректальной температуре - в жидком состоянии и, таким образом, плавится в прямой кишке с высвобождением лекарственного средства. Указанные материалы включают масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции по настоящему изобретению также представляют собой формы для местного введения, прежде всего, если мишенью доставки лекарственного средства являются участки кожи или органы, доступные для местного введения, включая заболевания глаз, кожи или нижний отдел кишечного тракта. Пригодные формы для местного введения получают в виде специальных форм для указанных участков или органов. Для нижнего отдела кишечного тракта можно использовать местное введение в форме ректального суппозитория (см. выше) или в форме пригодной клизмы. Можно также использовать трансдермальные пластыри для местного введения. Фармацевтические композиции для местного введения получают в форме пригодных мазей, содержащих активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений по настоящему изобретению включают, не ограничиваясь только ими, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгированный воск и воду. В другом варианте фармацевтические композиции получают в форме пригодного лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Пригодные носители включают минеральное масло, сорбитмоностеарат, полисорбат-60, цетиловые эфиры, воск, цетиловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции для введения в глаза получают в форме микронизированной суспензии в изотоническом, с определенным значением рН, стерильном солевом растворе или предпочтительно в форме изотонических, с определенным значением рН, стерильных солевых растворов в присутствии или отсутствие консерванта, такого как хлорид бензалкония. В другом варианте фармацевтические композиции для введения в глаза получают в форме мази на основе вазелина. Фармацевтические композиции по настоящему изобретению также вводят назально в аэрозольной форме или в форме для ингаляций. Указанные композиции получают по известным методикам для фармацевтических составов в виде солевых растворов, с добавлением бензилового спирта или других пригодных консервантов, ускорителей абсорбции для усиления биодоступности, фторированных углеводородов и/или других стандартных агентов для солюбилизации или диспергирования. Кроме указанных выше лекарственных форм, в объем настоящего изобретения включены другие известные фармацевтически приемлемые эксципиенты, носители и лекарственные формы. Следует понимать, что точная доза и конкретный курс лечения для любого конкретного пациента зависят от множества факторов, включая активность используемого специфического соединения, возраста, массы тела,общего состояния здоровья, пола и диеты, состояния почечной и печеночной функции пациента, а также времени введения, скорости выведения, комбинации лекарственных средств, от конкретного заболевания или его тяжести. Количество активных ингредиентов также зависит от терапевтического агента в составе комбинации с соединением А.V. Набор компонентов. Кроме того, в настоящем изобретении предлагается новый набор или упаковка. В некоторых вариантах набор по настоящему изобретению включает (а) первый контейнер, содержащий соединение A или формы его фармацевтически приемлемой соли, и (б) второй контейнер, содержащий антикоагулянт или другой антитромботический агент. В других вариантах набор содержит (а) первый контейнер, содержащий соединение A или формы его фармацевтически приемлемой соли, (б) второй контейнер, содержащий антикоагулянт, и (в) третий контейнер, содержащий другой антитромботический агент. Кроме того,в некоторых вариантах набор содержит вкладыш-инструкцию по совместному введению двух фармацевтических агентов для лечения состояния, характеризующегося нежелательным тромбозом. Первый, второй или третий контейнеры представляют собой бутыль, банку, флакон, сосуд, шприц,пробирку, пакет или любой другой контейнер, который можно использовать для получения, хранения или транспортировки фармацевтического продукта. Относящийся к фармацевтической композиции в составе набора вкладыш-инструкцию можно наносить на этикетку, ярлык, упаковку или т.п. Указанная информация обычно утверждается фармакологическим комитетом министерства здравоохранения, таким как Управление по контролю за продуктами питания и лекарственными средствами в США. Предпочтительно в инструкции указаны показания к применению для указанной фармацевтической композиции. Вкладыш можно изготовить из любого материала, пригодного для печати. Предпочтительно вкладыш изготавливают из материала, такого как бумага, приклеенная этикетка, фольга или пластик и т.п., на которых напечатана требуемая информация.VI. Примеры. Если не указано иное, сокращения, используемые в описании изобретения, имеют следующие значения: АФИ - активный фармацевтический ингредиент,Boc - трет-бутоксилкарбонил,ДХМ - дихлорметан,ДМСО - диметилсульфоксид,экв. - эквивалент,ЖХВР - жидкостная хроматография высокого разрешения,ПО - предел обнаружения,Me - метил,МеО - метокси,МеОН - метанол,ЯМР - ядерный магнитный резонанс,ТГФ - тетрагидрофуран,ТСХ - тонкослойная хроматография,Z-Gly-Gly-Arg-AMC - карбобензилокси - Gly-Gly-Arg-4-аминометилкумарин. Пример 1. Получение соединения A и его калиевой соли формулы I. Стадия 1. Метиловый эфир 2-амино-4,5-дифторбензойной кислоты 1 (38 кг, 1,0 экв.) и дихлорметан (560 кг,8 Х, стандарт ACS99,5%) загружали в реактор GL объемом 2000 л. Реакционную смесь перемешивали в течение 5 мин. 4-Нитрофенилхлорформиат (49,1 кг, 1,2 экв.) загружали в реактор объемом 200 л, затем добавляли дихлорметан (185 кг) и содержимое перемешивали в течение 5 мин. После продувки реактора объемом 200 л раствор 4-нитрофенилхлорформиата переносили в реактор объемом 2000 л, содержащий раствор соединения 1 в дихлорметане. Реакционную смесь нагревали при 405C (при кипении растворителя) при продувке азотом в течение 3 ч. По данным анализа ТСХ наблюдалось полное завершение реакции (анализ ТСХ в ходе реакции, отсутствие соединения 1, хроматографическая системаCHCl3/МеОН, 99:1). Раствор охлаждали до 30C и отгоняли дихлорметан (460 кг) в вакууме. В реактор объемом 2000 л загружали гексан (520 кг) и содержимое реактора охлаждали до 05C, перемешивали в течение 4 ч. Полученное твердое вещество фильтровали через нутч-фильтр GF, содержащий слой фильтра Т-515 LF Typar и слой фильтровальной бумаги Mel-Tuf 1149-12. Осадок на фильтре промывали гексаном (20 кг) и сушили в вакууме при 35C до постоянной массы. Сухой продукт выгружали из реактора(70,15 кг, выход 98%). Структуру продукта 2 подтверждали методами 1 Н ЯМР и ТСХ. Стадия 2. В реактор GL объемом 2000 л загружали соединение 2 (64,4 кг, 1,0 экв.), безводный тетрагидрофуран (557 кг) и триэтиламин (2,2 кг, 0,1 экв.). Соединительную линию реактора GL объемом 2000 л промывали тетрагидрофураном (10 кг). Содержимое реактора перемешивали в течение 25 мин, при этом наблюдалось полное растворение исходных веществ. В реактор объемом 200 л загружали N-Boc-парафенилендиамин (38 кг, 1,0 экв.), тетрагидрофуран (89 кг) и смесь перемешивали в течение 30 мин до полного растворения реагента. Содержимое реактора объемом 200 л переносили в реактор объемом 2000 л, содержащий соединение 2, и затем нагревали при 655C в течение 2 ч. По данным анализа ЖХВР в смеси отсутствовало исходное соединение 2 (т.е. реакция завершалась, согласно установленной норме содержание исходного вещества должно составлять 1%). Содержимое реактора GL объемом 2000 л охлаждали до 205C и затем в реактор загружали метоксид натрия (25% раствор в метаноле, 41,5 кг, 1,05 экв.) в течение 20 мин, температуру в реакторе поддерживали ниже 30C. Соединительные линии реактора промывали тетрагидрофураном (10 кг), содержимое реактора перемешивали при 255C в течение 4 ч. По данным анализа ЖХВР реакция полностью завершалась, т.е. содержание соединения 3a в реакционной смеси составляло 1%. В указанную реакционную смесь добавляли фильтрованную отработанную воду (500 кг) и содержимое реактора GL объемом 2000 л отгоняли в вакууме в чистый сборник GL объемом 200 л для удаления растворителя (300 кг). Полученное твердое вещество фильтровали через нутч-фильтр GL и фильтр промывали отработанной водой до тех пор, пока цвет твердого соединения 3b становился серо-белым. В реактор GL объемом 2000 л загружали соединение 3b (в виде влажного осадка после фильтрования), диоксан (340 кг) и смесь перемешивали в течение 1 ч. Полученное твердое вещество фильтровали через нутч-фильтр GL, содержащий слой фильтровальной бумаги Т-515 LF Typar. Твердый осадок на фильтре сушили в потоке воздуха в течение 2 ч и затем загружали вместе с диоксаном (200 кг) в реакторGL объемом 2000 л. Содержимое перемешивали в течение 10 мин, затем в реактор добавляли 4 н. HCl в диоксане (914 кг) в течение 3 ч и температуру в смеси поддерживали ниже 30C. Соединительную линию реактора промывали дополнительным количеством диоксана (10 кг) и содержимое перемешивали в течение 6 ч при 255C. По данным анализа ЖХВР реакция завершалась (содержание соединения 3b в реакционной смеси составляло 1%), т.е. соединение 3b превращалось в соединение 3. Содержимое реактора охлаждали до 55C в течение 2 ч, полученное твердое вещество фильтровали через нутч-фильтр GL и промывали диоксаном (50 кг). Осадок на фильтре сушили в потоке азота при давлении 87 фунтов/кв.дюйм в течение 30 мин и степень очистки определяли методом ЖХВР. Отфильтрованное твердое вещество сушили в вакуум-сушильном шкафу до постоянной массы при 45C в течение 48 ч. Соединение 3 (65,8 кг, реальный выход 110,6%) выгружали из реактора и анализировали методами 1 Н ЯМР и ЖХВР. 1 Н ЯМР (ДМСО):11,75 (s, 1H), 7,88 (dd, 1H), 7,32 (m, 4H), 7,21 (dd, 1H). Стадия 3. В реактор HP объемом 200 л загружали соединение 3 (18 кг, 1,0 экв.) и при давлении 1005 фунтов/кв.дюйм продували азотом. Азот из реактора выпускали через выпускную линию в атмосферу через вентиль на теплообменнике и в реактор загружали диметилсульфоксид (99,7%, 105 кг) в атмосфере аргона. Содержимое реактора перемешивали при 22C (19-25C) в течение 15 мин, затем в реакторе HP объемом 200 л закрывали все остальные вентили и создавали максимально возможный вакуум. В реакторHP объемом 200 л загружали метиламин (33% в абсолютном этаноле, 37,2 кг) с использованием вакуума,поддерживая температуру в реакционной смеси на уровне 255C и продувая смесь азотом. После промывки соединительной линии реактора диметилсульфоксидом (5 кг) вентиль теплообменника реактораHP закрывали и содержимое реактора нагревали при 1105C, перемешивали в течение 5 ч при 1105C. По данным анализа ЖХВР через 5 ч 40 мин в ходе реакции в смеси присутствовало соединение 3 в количестве 0,09% (т.е. реакция завершалась, согласно установленной норме содержание исходного соединения 3 составляло 1%). Содержимое реактора HP объемом 200 л охлаждали до 255C. В процессе охлаждения в реакторе GL объемом 2000 л закрывали все вентили и в реактор загружали отфильтрованную воду (550 кг). Содержимое реактора HP объемом 200 л переносили в реактор GL объемом 2000 л и через 15 мин соединительную линию промывали отработанной отфильтрованной водой (50 кг). Содержимое реактора GL объемом 2000 л перемешивали в течение 2 ч при 55C. Полученное твердое вещество фильтровали в вакууме через нутч-фильтр, содержащий слой фильтровальной бумаги Mel-Tuf 1149-12. Влажный осадок на фильтре извлекали и переносили в поддоны для сушки в вакууме, покрытые фторуглеродной пленкой Dupont (тип 100 А). Поддоны, содержащие влажное соединение 4, закрывали специальной бумагой для сушильных шкафов KAVON 992 и устанавливали в поддон в вакуумной сушке. Температуру в сушке устанавливали на 55C и соединение 4 сушили до постоянной массы в течение 12 ч, затем соединение 4 извлекали (12,70 кг, выход 76,5%, 85-95% от теории). По данным анализа ЖХВР чистота соединения 4 составляла 98,96%, а анализ 1 Н ЯМР подтверждал структуру соединения 4. 1 Н ЯМР (ДМСО):11,10 (s, 1H), 7,36 (d, 1H), 6,78 (d, 2H), 6,75 (m, 1H), 6,56 (d, 2H), 6,20 (d, 1H),5,18 (d, 2H), 2,76 (d, 3H). Стадия 4. В реактор HP объемом 200 л загружали соединение 4 (20,7 кг, 1,0 экв.), этиловый эфир 5-хлортиофен-2-илсульфонилкарбаминовой кислоты (37,5 кг, 2,0 экв., 95%), диметилсульфоксид(99%, 75 кг) и перемешивали в течение 15 мин. После установления максимальной величины вакуума реактор HP объемом 200 л нагревали при 655C в течение 15 ч. Из реакционной смеси отбирали образец для анализа ЖХВР, по данным анализа в смеси присутствовало соединение 4 в количестве 0,9% (согласно установленному критерию завершения реакции в норме содержание исходного соединения 4 должно составлять 1%). В реактор объемом 800 л загружали отфильтрованную отработанную воду(650 кг) и затем содержимое реактора HP объемом 200 л переносили в реактор объемом 800 л, поддерживая температуру в реакторе ниже 25C. Реактор HP объемом 200 л промывали диметилсульфоксидом(15 кг) и промывную фракцию переносили в реактор объемом 800 л, смесь перемешивали в течение 2 ч при 55C. Образовавшееся твердое вещество фильтровали через фильтр в сборник GL объемом 200 л в вакууме и осадок на фильтре промывали отфильтрованной отработанной водой (60 кг). Образец влажного осадка анализировали методом ЖХВР и, если чистота соединения A составляла 95%, его растирали в дихлорметане. В реактор GL объемом 800 л загружали влажное соединение A, дихлорметан (315 кг) и содержимое перемешивали в течение 3 ч. Твердое вещество фильтровали в вакууме через нутч-фильтрGL, содержащий один слой фильтровальной бумаги Т 515 LF TYPAR. Осадок на фильтре промывали дихлорметаном (50 кг) и сушили в потоке азота при давлении 87 фунтов/кв.дюйм в течение 15 мин. Осадок на фильтре переносили на поддон с фторуглеродной пленкой Dupont (тип 100 А) и затем сушили в вакуум-сушильном шкафу при 60C в течение 12 ч, затем сухое соединение A извлекали (33,6 кг, выход 93%), по данным анализа ЖХВР чистота составляла 93,5% и содержание сульфонамида составляло 4,3%. Данные 1 Н ЯМР подтверждали структуру соединения A. 1 Н ЯМР (ДМСО):11,20 (s, 1H), 9,15 (s, 1H), 7,68 (d, 1H), 7,42 (d, 2H), 7,36 (d, 1H), 7,26 (m, 1 Н),7,16 (d, 2 Н), 6,78 (m, 1 Н), 6,24 (d, 1H), 2,78 (d, 3H). Стадия 5. В реактор GL объемом 800 л загружали ацетонитрил (134 кг), воду квалификации WFI (156 кг) и содержимое перемешивали в течение 5 мин, в смесь загружали соединение A (33,6 кг, 1,0 экв.), на этой стадии реакционная смесь представляла собой суспензию. В суспензию добавляли водный раствор (водаWFI, 35 кг) гидроксида калия (4,14 кг, 1,15 экв., 85%), поддерживая температуру смеси ниже 30C, соединительную линию промывали водой WFI (2 кг), затем реактор GL объемом 800 л нагревали при 505C в течение 1 ч. Содержимое фильтровали через горячий мешотчатый фильтр, затем использовали семь картриджей для конечного фильтрования (0,2 мкм) для очистки барабанов из полиэтилена высокой плотности. Горячее фильтрование проводили при строгом контроле на утечку материала. Перед промывкой реактор GL объемом 800 л охлаждали до 255C. Реактор GL объемом 800 л промывали предварительно смешанным раствором ацетонитрила (8,5 кг) и воды WFI (10 кг) и пропущенным через фильтрационную систему в барабаны с этикеткой "горячее фильтрование соединения A". С использованием емкости под давлением реактор GL объемом 800 л промывали водой WFI (20 кг), ацетоном (20 кг), затем продували потоком азота (32 фунтов/кв.дюйм). Вентиль в нижней части реактора GL объемом 800 закрывали и создавали вакуум при 2010 дюймов рт. ст. Вакуумный насос отключали и в реактор загружали содержимое барабанов горячего фильтрования с этикеткой "горячее фильтрование соединения A". Содержимое реактора GL объемом 800 л охлаждали до 205C и через систему для конечного фильтрования в реактор загружали метанол (373 кг, 99%), поддерживая температуру смеси ниже 30C. Содержимое реактора GL объемом 800 л охлаждали до 155C и перемешивали в течение 12 ч при КТ. В ходе этого периода твердое вещество фильтровали через чистую фильтрационную систему в чистый сборникGL объемом 200 л, затем реактор герметизировали. В системе фильтр/сборник создавали вакуум 2010 дюймов рт. ст. и содержимое фильтровали. Осадок на фильтре промывали метанолом (30 кг) и продували в потоке азота при давлении 87 фунтов/кв.дюйм в течение 10 мин. Температуру в поддоне вакуумной сушки устанавливали на 80C, затем в поддон загружали влажный осадок соли формулы I. Осадок переносили в поддон, покрытый фторуглеродной пленкой Dupont (тип 100 А) и осадок 7 а покрывали специальной бумагой (Kavon Mel Tuf). Поддон устанавливали в вакуумную сушку. Влажное соединение 7 а сушили при 80C до постоянной массы (постоянную массу определяли при взвешивании поддона по крайней мере через 1 ч до тех пор, пока измеренные массы не отличаются на величину более 50 г). Образец полученного соединения анализировали на содержание остаточного растворителя (содержание остаточного растворителя согласно норме, установленной для активных фармакологических ингредиентов (АФИ. Конечный АФИ уравновешивали с водой (5-6%) в течение 12 ч в присутствии поддона с водой WFI, тщательно переворачивали и выдерживали в течение еще 12 ч, затем определяли содержание воды методом К. Фишера (содержание воды 5,5%), при этом получали соль формулы I(21,80 кг, выход 60,6%), которую переносили в двойные сверхпрочные полиэтиленовые пакеты и хранили во втором отделении. По данным ЖХВР чистота соединения составляет 99,7%, данные 1 Н ЯМР подтверждают структуру соединения A. 1 Н ЯМР (ДМСО):11,14 (s, 1H), 8,60 (s, 1H), 7,48 (m, 2H), 7,35 (d, 1H), 7,22 (d, 1H), 6,95 (m, 3H),6,75 (m, 1H), 6,22 (d, 1H), 2,78 (d, 3H). Дополнительные способы получения и анализа соединения A и его солевых форм описаны в заявкеUS 2007/0123547 (поданной 3 ноября 2006 г.), содержание которой включено в данное описание в виде ссылки. Стадия 1. 5-Метокси-2-нитробензойную кислоту (5) (25,0 кг, 1,0 экв.), 2-амино-5-хлорпиридин (6) (16,3 кг,1,0 экв.) и ацетонитрил (87,5 кг, 3,5 части) загружали в реактор GLMS объемом 380 л. Температуру реакционной смеси поддерживали при 22C (от 19 до 25C) и в смесь загружали безводный пиридин (30,0 кг,3,0 экв.). Насос и соединительную линию промывали ацетонитрилом (22,5 кг, 0,9 части), а температуру содержимого реактора поддерживали в интервале от 19 до 22C. Затем в реактор добавляли оксихлорид фосфора (23,3 кг, 1,20 экв.) через насос-дозатор, а температуру смеси поддерживали на уровне 25C(22-28C). Насос-дозатор и соединительную линию промывали ацетонитрилом (12,5 кг, 0,5 части), а температуру в смеси поддерживали на уровне 25C (22-28C). Обычно после добавления приблизительно 1/3POCl3 суспензия в реакторе превращалась в прозрачный раствор, который после завершения добавления реагента опалесцировал. Затем смесь перемешивали приблизительно при 25C (22-28C) в течение приблизительно 1 ч, при этом по данным анализа ЖХВР реакция завершалась. Раствор охлаждали до 15C(12-18C) и в него медленно загружали питьевую воду (156,3 кг, 6,25 части), поддерживая температуру смеси от 12 до 30C. Затем температуру реакционной смеси поддерживали на уровне 22C (от 19 до 25C) и смесь перемешивали в течение приблизительно 5 ч до завершения экзотермической реакции. При этом получали суспензию, образование которой подтверждали визуально, и содержимое реактора фильтровали через нутч-фильтр, содержащий фильтровальную ткань, под давлением. Реактор, насос и соединительные линии промывали через нутч-фильтр под давлением двумя порциями питьевой воды (по 62,5 кг, 2,5 части каждая). Величина рН фильтрата составляла 7. Продукт (41,8 кг) высушивали в вакууме при максимальной температуре водяной бани (для нагревания кожуха сушки) 50C. По данным анализа в ходе высушивания содержание растворителя составляло 0,72%. Сухой продукт 7 выгружали (34,4 кг),выход составлял 88,2%, чистота по данным ЖХВР составляла 99,1%. Стадия 2. В реактор Hastelloy объемом 780 л загружали соединение 7 (33 кг, 1,0 экв.), 5% платину на угле(сульфированную, 0,33 кг, 0,010 части) и дихлорметан (578 кг, 17,5 части). Включали перемешивание и температуру содержимого реактора поддерживали на уровне 22C (от 19 до 25C). В реактор подавали водород при давлении приблизительно 30 фунт/кв.дюйм и реакционную смесь медленно нагревали до 28C (25-31C), затем проводили гидрирование содержимого реактора приблизительно при 30 фунт/кв.дюйм и 28C (от 25 до 31C, максимум 31C) до завершения реакции по данным ЖХВР, т.е. через 16,5 ч в смеси практически отсутствовал исходный материал (0,472%). Содержимое реактора про- 21020045 пускали через слой предварительно обработанного целита в режиме рециркуляции. 0,2-0,5 кг целита промывали 20-55 кг дихлорметана, при этом перед нанесением на слой целита содержимое реактора фильтровали через специальный фильтр (8") для удаления платинового катализатора. Реактор и слой целита промывали двумя порциями дихлорметана (по 83 кг, 2,5 части каждая). Фильтрат переносили в реактор GLMS объемом 570 л и концентрировали при атмосферном давлении до приблизительно 132 л (т.е. до 1/4 объема). Затем в реактор загружали этанол (69 кг, 2,1 части) и концентрирование продолжали при атмосферном давлении до приблизительно 99 л (до 1/3 объема). По данным анализа содержание дихлорметана составляло 39%, в реактор снова загружали этанол (69 кг, 2,1 части) и продолжали концентрирование до приблизительно 99 л (1/3 объема). По данным ЯМР содержание дихлорметана составляло 5%. Реакционную смесь охлаждали до 3C (от 0 до 6C), перемешивали в течение приблизительно 1 ч и полученную суспензию фильтровали под давлением через нутч-фильтр с рубашкой, содержащий фильтровальную ткань. Реактор, насос и соединительную линию промывали холодным (3C (0-6C этанолом(26 кг, 0,8 части). Влажный осадок на фильтре (36,6 кг) высушивали в вакууме при 40-50C при максимальной температуре водяной бани (для нагревания кожуха сушки) 50C. По данным анализа через 12,5 ч содержание растворителя составляло 0,1%. Высушенный продукт 8 извлекали (26,4 кг), выход составлял 89,5%, чистота по данным ЖХВР составляла 98,4%, содержание дехлорированной примеси составляло 0,083%. Стадия 3. В реактор Hastelloy объемом 780 л загружали 4-цианобензоилхлорид (9) (17,2 кг, 1,1 экв.) и ТГФ(92 кг, 3,5 части). Содержимое реактора перемешивали при 22C (от 19 до 25C) до полного растворения твердого вещества. Полученный раствор переносили в нижний сборник и реактор промывали ТГФ(26 кг, 1 часть). Соединение 8 (26,4 кг, 1 экв.), ТГФ (396 кг, 15 частей) и пиридин (2,90 кг, 0,4 экв.) загружали в чистый реактор. Насос и соединительные линии промывали ТГФ (34 кг, 1,3 части). С помощью насоса-дозатора раствор 4-цианобензоилхлорид/ТГФ загружали в реактор, поддерживая температуру 30C, насос и соединительные линии промывали ТГФ (приблизительно 10 кг). Полученную суспензию желтого цвета перемешивали при 22C (от 19 до 25C) в течение приблизительно 2 ч. По данным анализа ЖХВР через 2 ч содержание соединения 8 составляло 0%, что свидетельствовало о завершении реакции. Суспензию фильтровали через нутч-фильтр, содержащий фильтровальную ткань. Реактор, насос, соединительные линии и влажный осадок на фильтре промывали тремя порциями этанола (приблизительно по 15 кг каждая). Влажный осадок на фильтре извлекали (65,4 кг) и возвращали в реактор для суспендирования в этаноле (317 кг, 12 части) при 22C (от 19 до 25C) в течение приблизительно 1 ч. Суспензию фильтровали через нутч-фильтр, реактор, насос, соединительные линии и влажный осадок на фильтре промывали двумя порциями этанола (приблизительно по 15 кг каждая) и двумя порциями ТГФ(приблизительно по 15 кг каждая). Влажный осадок на фильтре высушивали в вакууме при максимальной температуре бани с теплым гликолем (для нагревания рубашки реактора) 40C в течение 14,5 ч, при этом остаточное содержание растворителя составляло 0,75%. Высушенный материал измельчали (сито 0,125") и получали 31,8 кг соединения 10, которое высушивали в вакууме в течение еще 10,5 ч. Остаточное содержание растворителя составляло 1,8%, продукт выгружали (31,5 кг), выход 74,8% (выход в теории 60-90%), чистота по данным ЖХВР 100%. Стадия 4. Готовили суспензию соединения 10 (455 кг, 1,0 экв.) в ТГФ (4,67 кг, 10,3 части) и охлаждали до 10C. Готовили раствор диметиламида лития: гексиллитий (2,3 н./гексан, 2,45 л, 5,5 экв.) добавляли в раствор диметиламина (2 н./ТГФ, 2,8 л, 5,5 экв.), поддерживая температуру раствора 10C. Раствор диметиламида лития загружали в суспензию, содержащую соединение 10, поддерживая температуру в реакторе 10C. Ход реакции контролировали методом ЖХВР, по данным анализа содержание соединения 10 составляло 1,0%. Готовили буферный раствор, содержащий NaHCO3 (490 г, 1,1 части, 5,7 экв.) иNa2CO3 (490 г, 1,1 части, 4,5 экв.) в деионизированной воде (6,6 кг, 14,51 части), полученную выше реакционную смесь переносили в этот водный раствор, поддерживая температуру 5C. Продукт осаждали,полученную суспензию нагревали до 20C и при указанной температуре смесь выдерживали в течение 12 ч. Твердое вещество отделяли фильтрованием и полученный осадок на фильтре промывали 3,5 кг(7,7 части) деионизированной воды. Твердое вещество отделяли фильтрованием через стеклянный лабораторный фильтр с большим размером пор и промывали холодным (0-5C) абсолютным этанолом(628 кг, 1,4 части). Полученный бетриксабан высушивали при 30-35C, получали 458 кг продукта, выход 73%. Пример 3. Испытания комбинации соединения A и бетриксабана методом анализа тромбоза в перфузионной ячейке (I). В данном методе анализа в перфузионной ячейке в реальное время комбинировали свойства модели тромбоза у животных, в которой используют витальную микроскопию, и метод анализа в перфузионной ячейке, что позволяет регистрировать активность лекарственного средства в ходе клинических испытаний. Для анализа цельную кровь пропускали через капилляры по градиенту сдвига артерии, при этом кровь контактировала с коллагеном тромбогенового типа III. В тромбоциты до перфузии вводили флуоресцентную метку (родамин 6 G), которая позволяет регистрировать перемещение тромба по интенсивности флуоресценции внутри перфузионной ячейки. Количественный анализ проводили по высоте тромба (интенсивность флуоресценции (число пикселей)/общая площадь, мкм 2). Согласно данному анализу соединение A исследовали при концентрации, при которой наблюдается уровень подавления АДФ-индуцированной агрегации тромбоцитов в обогащенной тромбоцитами плазме человека, эквивалентный действию клопидогрела, который является распространенным антитромботическим агентом, антитромботическая активность которого опосредуется ингибированием рецептора P2Y12 тромбоцитов. Как показано на фиг. 1, обработка крови соединением А при концентрации 1,1 мкМ хотя и приводит к значительному подавлению агрегации тромбоцитов, но оказывает лишь частичное ингибирующее действие на тромбоз (2314%, р 0,05, n=4). При введении бетриксабана в кровь, уже обработанную соединением А, наблюдается значительное подавление тромбоза (уровень ингибирования составляет 683%, 5914% и 5711% при 1 мкМ, 300 и 100 нМ бетриксабана соответственно, р 0,01, n=4). На фиг. 2 показано дозозависимое подавление тромбоза при концентрации бетриксабана от 1 мкМ до 3 нМ. Пример 4. Испытание комбинации соединения A и бетриксабана методом анализа тромбоза в реальное время(II). Кровь отбирали из вены у здоровых добровольцев в 5 мкМ раствор бетриксабана, затем добавляли соединение A в возрастающей концентрации (in vitro). Смесь инкубировали в течение 20 мин, затем пропускали через покрытые коллагеном капилляры (коллаген типа III, 1600 с-1). Как показано на фиг. 3, при возрастании концентрации соединения A наблюдается дозозависимое подаление тромбоза, при этом при концентрации 10 мкМ соединения A наблюдается образование одного монослоя тромбоцитов. Пример 5. Испытание комбинации соединения A и бетриксабана по накоплению тромбина. Цельную кровь отбирали из вены у здоровых добровольцев в раствор 3,2% тринатриевой соли лимонной кислоты (Vacutainer, Becton Dickinson), которую использовали в качестве антикоагулянта. Обогащенную тромбоцитами плазму получали при центрифугировании, при этом получали препарат тромбоцитов, содержащий 150000 клеток/мкл, который добавляли в лунки 96-луночного планшета и тромбоциты активировали при добавлении конвулксина (200 нг/мл), смесь инкубировали при 37C в течение 3 мин. Затем активировали накопление тромбина при добавлении 23 пМ тканевого фактора (Innovin,Dade Behring) и 15 мМ кальция. Активность тромбина определяли по расщеплению специфического флуорогенного субстрата (Z-gly-gly-arg-AMC, Bachem) на флуоресцентном ридере для планшетов. При концентрации соединения A 4,75,1 мкМ (n=19) в тромбоцитах, выделенных из здоровых доноров, наблюдается подавление индуцированной АДФ агрегации тромбоцитов, которое составляет 50% от максимальной ингибирующей активности. Для ингибитора фактора Xa, бетриксабана, при концентрации 31,25 нМ наблюдается эквивалентное ингибирование накопления тромбина, которое индуцируется терапевтическим антикоагулянтом (пентасахаридом, фондапаринуксом). Как показано на фиг. 4, даже если соединение A использовать в концентрации, обеспечивающей максимальное подавление агрегации тромбоцитов (10 мкМ), то при этом в такой системе ех vivo наблюдается значительный уровень накопления тромбина. Аналогичные результаты по накоплению тромбина наблюдаются при использовании ингибитора фактора Xa, бетриксабана, в терапевтической концентрации. Однако комбинация двух агентов обеспечивает значительно более высокое подавление продуцирования тромбина. Так как активность тромбина опосредует тромботические состояния, комбинация двух агентов является более эффективной по сравнению с каждым агентом в отдельности. Пример 6. Комбинация соединения A и антител к фактору XI (I). В этом примере не содержащую антикоагулянтов цельную кровь отбирали у здоровых добровольцев, и перед пропусканием через покрытый коллагеном капилляр (коллаген типа I) по градиенту артериального сдвига (1000 с-1), в кровь добавляли родамин 6G (для включения флуоресцентной метки в тромбоциты), антитела к фактору XI (Hemetech) и соединение A. После перфузии размер тромба, образованного из тромбоцитов, оценивали по интенсивности флуоресценции. Как показано на фиг. 5, по данным анализа антитела к фактору XI в отдельности не уменьшают размера тромба при концентрации до 10 мкг/мл. Соединение А в отдельности также не оказывает значительного действия на размер тромба тромбоцитов при концентрации 10 мкМ. Однако при повышении концентрации антител к фактору XI в комбинации с 10 мкМ концентрацией соединения A наблюдается дозозависимое снижение размера тромба, при этом наблюдается подавление на 50% от максимального ингибирующего действия при концентрации 10 мкг/мл. Пример 7. Комбинация соединения A и антител к фактору XI (II). Капилляры покрывали комбинацией коллагена типа I и тканевого фактора (в соотношении коллаген/Innovin, 1:100 (Dade-Behring). Перед пропусканием через капилляр кровь, не содержащую антикоагулянтов, смешивали с родамином 6G, соединением А при концентрации 10 мкМ и добавляли бетриксабан или антитела к фактору XI. Как показано на фиг. 6, комбинация соединения A и антител к фактору XI проявляет значительно большую эффективность в отношении подавления образования тромба, по сравнению с соединением А в отдельности или в комбинации с бетриксабаном. Пример 8. Комбинация соединения A и бивалирудина, прямого ингибитора тромбина. Для иллюстрации аддитивного антитромботического действия комбинацию соединения A с прямым ингибитором тромбина, таким как бивалирудин, испытывали следующим образом: кровь отбирали из вены в раствор 12 мкг/мл бивалирудина (стандартная терапевтическая концентрация) и инкубировали при различных концентрациях соединения A (0,1, 1 или 10 мкМ) в течение 20 мин в присутствии родамина 6G (который использовали для включения флуоресцентной метки в тромбоциты), затем кровь пропускали через стеклянный капилляр, покрытый коллагеном (тип III), по фиксированному градиенту сдвига (1600 с-1). В этих условиях бивалирудин в отдельности не оказывает значительного ингибирования на тромботический процесс, однако при возрастании концентрации соединения A в комбинации с бивалирудином наблюдается дозозависимое подавление тромбоза. На фиг. 7 показано, что комбинация соединения A и бивалирудина оказывает антитромботическое действие. Пример 9. Комбинация антагониста P2Y12, соединения A, аспирина (ингибитора циклооксигеназы) и ингибитора фактора Xa. Для оценки аддитивного антитромботического действия соединения A на кровь леченых аспирином доноров, использовали перфузионную ячейку для анализа тромботического профиля у здоровых доноров. В ходе указанных испытаний у доноров, которым вводили аспирин (81 или 325 мг один раз в сутки в течение 3 дней), отбирали кровь из вены. Стеклянный капилляр покрывали коллагеном типа I, цельную кровь (которую инкубировали в течение 20 мин с родамином 6G, который использовали для включения флуоресцентной метки в тромбоциты) отбирали в ингибитор фактора Xa, С 921-78 (см. статью Betz A.,Wong P.W, Sinha U., Inhibition of factor Xa by a peptidyl-alpha-ketothiazole involves 2 steps: evidence for astabilizing conformational change. Biochemistry. 38: 14582-14591 (1999), включенную в данное описание в качестве ссылки), пропускали через капилляр при фиксированном градиенте сдвига (1600 с-1). При пропускании уровень тромбоза определяли по среднему значению интенсивности флуоресценции, деленной на площадь (мкм 2), которая является мерой отложения тромбоцитов на поверхности коллагена. Как показано на фиг. 8, при добавлении соединения A в возрастающей концентрации в цельную кровь in vitro (перед пропусканием через капилляр кровь инкубировали в течение 15 мин) наблюдается дозозависимое подавление тромботического процесса. При концентрации соединения A 0,37 мкМ наблюдается статистически значимое аддитивное антитромботическое действие в присутствии аспирина и ингибитора фактора Xa, при этом при указанной концентрации антагониста P2Y12, применяемого в отдельности, значительное антитромботическое действие в отсутствие аспирина не наблюдается. Пример 10. Комбинация соединения A и ифетробана, антагониста TP и ингибитора фактора Xa. Аналогично тому, как описано выше в примерах, комбинация соединения A и антагониста TP (например, ифетробана) и ингибитора фактора Xa проявляет аддитивное антитромботическое действие. В данных испытаниях кровь отбирали из вены у здоровых добровольцев в ингибитор фактора Xa С 921-78 (см. выше). Соединение A добавляли в образцы крови при концентрации 1,1 мкМ, указанное соединение в этих условиях имитирует ингибирующиее действие клопидогела. Как показано на фиг. 9,при добавлении возрастающих концентраций ифетробана в цельную кровь после предварительной инкубации с соединением A (1,1 мкМ) в течение 30 мин перед пропусканием крови через покрытый коллагеном капилляр (коллаген типа I, 1600 с-1) наблюдается дозозависимое подавление тромбоза, при этом комбинация 1,1 мкМ соединения A и 30 нМ ифетробана в присутствии ингибитора фактора Xa оказывает аналогичное ингибирующее действие по сравнению с комбинацией клопидогела и аспирина или соединения A и аспирина. Пример 11. Испытание комбинации соединения A и ингибитора фактора Xa методом оценки тромбоза в реальное время. Кровь отбирали из вены у здоровых добровольцев в растворы при различной концентрации(5-20 мкМ) ингибитора фактора Xa, как описано в данном контексте. Затем в образцы добавляли соединение A при возрастающей концентрации (in vitro). Смесь инкубировали в течение 20 мин и пропускали через покрытый коллагеном капилляр (коллаген типа III, 1600 с-1), как описано в примере 4. Предполагается, что при возрастающей концентрации соединения A в комбинации с фиксированной концентрацией ингибитора фактора Xa (например, выбранного из ривароксабана, апиксабана) будет наблюдаться дозо- 24020045 зависимое ингибирование тромбоза. Пример 12. Испытание комбинации соединения A и ингибитора фактора Xa методом анализа накопления тромбина. Цельную кровь отбирали из вены у здоровых добровольцев в 3,2% трехнатриевую соль лимонной кислоты (III) (Vacutainer, Becton Dickinson) для предотвращения свертывания. Обогащенную тромбоцитами плазму получали при центрифугировании и добавляли в лунки 96-луночного планшета до конечной концентрации тромбоцитов 150000/мкл, тромбоциты активировали при добавлении конвулксина(100 нг/мл) и инкубировали при 37C в течение 3 мин. После активации тромбоцитов инициировали накопление тромбина при добавлении 23 пМ тканевого фактора (Innovin, Dade Behring) и 15 мМ кальция. Активность тромбина определяли по расщеплению специфического флуоресцентного субстрата(Z-gly-gly-arg-AMC, Bachem) на флуоресцентном ридере для планшетов, как описано в статье Sinha U. etImplications for identification of therapeutically active inhibitors. Arterioscler Thromb. Vasc. Biol., 23: p. 10981104 (2003). Предполагается, что аналогично тому, как описано в примере 5, соединение A в комбинации с ингибитором фактора Xa (например, ривароксабан, апиксабан или другие ингибиторы фактора Xa) подавляет продуцирование тромбина с большей эффективностью, по сравнению с каждым соединением при равной концентрации в отдельности. Пример 13. Испытания комбинации соединения A и ингибитора фактора Xa методом анализа подавления тромбоза на модели брыжеечной артерии мыши. Тромбоз брыжеечной артерии мыши (в градиенте сдвига 1000-1300 с-1) индуцировали и регистрировали, как описано ранее, с небольшой модификацией методики, описанной в статье Andre P. et al.,Anticoagulants (thrombin inhibitors) and aspirin synergize with P2Y12 receptor antagonism in thrombosis.Circulation, 108 (21): p. 2697-2703 (2003). В тромбоциты включали метку in situ при введении родамина 6G (0,2 мг/мл) в хвостовую вену за 10 мин до визуализации артерии. Повреждения стенок сосудов индуцировали с помощью кусочка фильтровальной бумаги 11 мм, пропитанной 5% раствором FeCl3. Через 5 мин фильтровальную бумагу удаляли и брыжеечные артерии промывали теплым физиологическим раствором (37C). Взаимодействие тромбоцитов со стенкой сосуда регистрировали в течение еще 40 мин или до полной закупорки или сохранения закупорки в течение более 40 с. Мышам C57Bl6J вводили перорально через желудочный зонд носитель в качестве контроля, соединение A (7,5, 20, 60 мг/кг) или бетриксабан (2, 4, 400 мг/кг) за 2 ч до повреждения сосудов. Тромбоз регистрировали в реальное время с использованием программного обеспечения Simple PCI, как описано в статье Andre P. et al., P2Y12Invest., 112 (3): p. 398-406 (2003). Интенсивность флуоресценции регистрировали при частоте 2 Гц в течение 40 мин и строили графики зависимости от времени. Регистрировали время закупорки сосудов(прерывание кровотока). При введении соединения A в дозе 20 и 60 мг/кг наблюдается предотвращение закупорки сосуда в течение 40 мин регистрации. При введении в дозе 7,5 мг/кг наблюдалось замедление времени закупорки сосуда. При введении в дозах, обеспечивающих уровень соединения A в плазме более 1 мкг/мл, наблюдается предотвращение закупорки сосудов, а при введении в дозах, обеспечивающих уровень соединенияA в плазме менее 1 мкг/мл, предотвращения закупорки не происходит. Дозы менее 200 нг/мл являются неэффективными. При введении бетриксабана в дозах, обеспечивающих уровень в плазме более 1 мкг/мл, наблюдается предотвращение закупорки сосудов. Дозы менее 100 нг/мл являются неэффективными. Можно предположить, что при комбинировании неэффективных доз соединения A и бетриксабана можно наблюдать значительный синергетический антитромботический эффект. Аналогичным образом следует ожидать, что другие ингибиторы фактора Xa (например, ривароксабан, апиксабан) будут проявлять значительную антитромботическую активность при испытаниях методом витальной микроскопии тромбоза на модели мышей. Можно предположить, что при введении неэффективных доз ривароксабана или других ингибиторов фактора Xa, описанных выше, в комбинации с неэффективными дозами соединения A можно наблюдать значительный синергетический антитромботический эффект. Пример 14. Испытания комбинации соединения A и бетриксабана методом анализа подавления тромбоза на модели брыжеечной артерии мыши. Тромбоз брыжеечной артерии мыши (в градиенте сдвига 1000-1300 с-1) индуцировали и регистрировали, как описано ранее, с небольшой модификацией методики, описанной в статье Andre P. et al., Anticoagulants (thrombin inhibitors) and aspirin synergize with P2Y12 receptor antagonism in thrombosis. Circulation, 108(21): p. 2697-2703 (2003). В тромбоциты включали метку in situ при введении родамина 6G(0,2 мг/мл) в хвостовую вену за 10 мин до визуализации артерии. Повреждения стенок сосудов индуцировали с помощью кусочка фильтровальной бумаги 11 мм, пропитанной 5% раствором FeCl3. Через 5 мин фильтровальную бумагу удаляли и брыжеечные артерии промывали теплым физиологическим раствором (37C). Взаимодействие тромбоцитов со стенкой сосуда регистрировали в течение еще 40 мин или до полной закупорки или ее сохранения в течение более чем 40 с. Мышам C57Bl6J вводили перорально через желудочный зонд носитель в качестве контроля, соединение A (0,83, 2,5, 7,5, 20, 60 мг/кг) или бетриксабан (2, 4, 10 мг/кг) за 2 ч до повреждения сосудов. Тромбоз регистрировали в реальное время с использованием программного обеспечения Simple PCI, как описано в статье Andre P. et al., P2Y12Invest., 112 (3): p. 398-406 (2003). Интенсивность флуоресценции регистрировали при частоте 2 Гц в течение 40 мин и строили графики зависимости от времени. Регистрировали время закупорки сосудов(прерывание кровотока). Было установлено, что соединение A в дозе 0,83 и 2,5 мг/кг не проявляет эффективность в данной модели. При введении соединения A в дозе 7,5, 20 и 60 мг/кг наблюдается замедление времени образования первого тромба (фиг. 10-13) и закупорки сосуда. При введении соединения A в дозе 20 и 60 мг/кг наблюдалось предотвращение закупорки сосуда в ответ на повреждение в течение 40 мин регистрации. При введении в дозах, обеспечивающих уровень соединения A в плазме более 1 мкг/мл, наблюдается предотвращение закупорки сосудов, а при введении в дозах, обеспечивающих уровень соединения A в плазме менее 1 мкг/мл, предотвращения закупорки не происходит (фиг. 13). Дозы, обеспечивающие уровень в плазме менее 200 нг/мл, являются неэффективными в данной модели (фиг. 13). Введение бетриксабана в дозе 2 и 4 мг/кг являются неэффективным в данной модели, а введение бетриксабана в дозе 10 мг/кг значительно замедляет время формирования первого тромба и время закупорки (фиг. 14-17). При совместном введении неэффективных доз соединения A (2,5 мг/кг) и бетриксабана (2 и 4 мг/кг) наблюдается значительный синергетический антитромботический эффект (фиг. 14-17). Содержание соединения A и бетриксабана в плазме крови определяли через 2 мин после закупорки или 42 мин после повреждения сосуда. Следует понимать, что, хотя изобретение описано на примере вариантов осуществления изобретения, эти варианты приведены только для иллюстрации изобретения и не ограничивают его объем. Другие объекты, преимущества и модификации изобретения в пределах его объема представляются очевидными специалистам в данной области техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения у млекопитающего состояния, характеризующегося тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества следующих терапевтических агентов: или ее фармацевтически приемлемой соли;(2) второго терапевтического агента, выбранного из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу 2. Способ по п.1, где второй терапевтический агент представляет собой антитело против фактораXI. 3. Способ по п.1, где второй терапевтический агент представляет собой ифетробан. 4. Способ по п.1, где второй терапевтический агент представляет собой бетриксабан формулы или его фармацевтически приемлемую соль. 5. Способ по п.4, где фармацевтически приемлемой солью бетриксабана является малеат. 6. Способ по любому из пп.1-5, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе. 7. Способ по любому из пп.1-5, где оба терапевтических агента вводят в субтерапевтических дозах. 8. Способ по любому из пп.1-5, где два терапевтических агента вводят одновременно. 9. Способ по любому из пп.1-5, где два терапевтических агента вводят последовательно. 10. Способ по любому из пп.1-5, дополнительно включающий введение указанному млекопитающему терапевтически эффективного количества антитромботического агента. 11. Способ по п.10, где антитромботический агент представляет собой ингибитор циклооксигеназы. 12. Способ по п.11, где антитромботический агент представляет собой ацетилсалициловую кислоту. 13. Способ по любому из пп.1-12, где фармацевтически приемлемой солью [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль. 14. Способ лечения у млекопитающего состояния, характеризующегося тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества следующих трех терапевтических агентов: или ее фармацевтически приемлемой соли;(3) соединения С 921-78 (BnSO(2)-D-Arg-Gly-Arg-кетотиазол). 15. Способ по п.14, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе. 16. Способ по п.14, где все терапевтические агенты вводят в субтерапевтических дозах. 17. Способ по п.14, где три терапевтических агента вводят одновременно. 18. Способ по п.14, где три терапевтических агента вводят последовательно. 19. Способ по любому из пп.14-18, где фармацевтически приемлемой солью [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль. 20. Способ по любому из пп.1-19, где указанные состояния, связанные с тромбозом, выбраны из группы, включающей острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящую ишемическую атаку, инсульт, заболевание периферических сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, закупорку кровеносного сосуда, рассеянную внутрисосудистую коагуляцию и тромбоцитопеническую пурпуру, тромботические и рестенозные осложнения, которые развиваются в результате таких инвазивных процедур, как ангиопластика, каротидная эндартерэктомия, хирургическая операция аортокоронарного шунтирования (АКШ), хирургические операции на сосудах и пересадка сосудов, установка стентов и введение эндоваскулярных устройств и протезов. 21. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие терапевтические агенты: или ее фармацевтически приемлемую соль и(2) второй терапевтический агент, выбранный из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу 22. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой антитело против фактора XI. 23. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой ифетробан. 24. Фармацевтическая композиция по п.21, где второй терапевтический агент представляет собой бетриксабан формулы или его фармацевтически приемлемую соль. 25. Фармацевтическая композиция по п.24, где фармацевтически приемлемой солью бетриксабана является малеат. 26. Фармацевтическая композиция по любому из пп.21-25, где по крайней мере один из двух терапевтических агентов вводят в субтерапевтической дозе. 27. Фармацевтическая композиция по любому из пп.21-25, где оба из двух терапевтических агентов вводят в субтерапевтических дозах. 28. Фармацевтическая композиция по любому из пп.21-25, дополнительно включающая антитромботический агент. 29. Фармацевтическая композиция по п.28, где антитромботический агент представляет собой ингибитор циклооксигеназы. 30. Фармацевтическая композиция по п.28, где антитромботический агент представляет собой ацетилсалициловую кислоту. 31. Фармацевтическая композиция по любому из пп.21-30, где фармацевтически приемлемой солью[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевины является калиевая или натриевая соль. 32. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и следующие три терапевтических агента: или ее фармацевтически приемлемую соль; 33. Фармацевтическая композиция по п.32, где по крайней мере один из терапевтических агентов вводят в субтерапевтической дозе. 34. Фармацевтическая композиция по п.32, где все терапевтические агенты вводят в субтерапевтических дозах. 35. Фармацевтическая композиция по любому из пп.32-34, где фармацевтически приемлемой солью[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевины является калиевая или натриевая соль. 36. Набор, включающий:(1) первый контейнер, где указанный первый контейнер содержит [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы или ее фармацевтически приемлемую соль; и(2) второй контейнер, где указанный второй контейнер содержит второй терапевтический агент,выбранный из группы, включающей ифетробан, антитело против фактора XI и бетриксабан или его фармацевтически приемлемую соль или их комбинации, где бетриксабан имеет формулу 37. Набор по п.36, где второй терапевтический агент представляет собой антитело против фактораXI. 38. Набор по п.36, где второй терапевтический агент представляет собой ифетробан. 39. Набор по п.36, где второй терапевтический агент представляет собой бетриксабан формулы или его фармацевтически приемлемую соль. 40. Набор по п.39, где фармацевтически приемлемой солью бетриксабана является малеат. 41. Набор по п.36, дополнительно включающий третий контейнер, где указанный третий контейнер содержит антитромботический агент. 42. Набор по п.41, где антитромботический агент представляет собой ингибитор циклооксигеназы. 43. Набор по п.41, где антитромботический агент представляет собой ацетилсалициловую кислоту. 44. Набор, включающий:(1) первый контейнер, где указанный первый контейнер содержит [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевину формулы или ее фармацевтически приемлемую соль; и(2) второй контейнер, где указанный второй контейнер содержит ацетилсалициловую кислоту; и(3) третий контейнер, где указанный третий контейнер содержит соединение С 921-78 (BnSO(2)-DArg-Gly-Arg-кетотиазол). 45. Набор по любому из пп.36-44, где фармацевтически приемлемой солью [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины является калиевая или натриевая соль.
МПК / Метки
МПК: A61K 31/235, A61P 7/02, A61P 7/00, A61P 9/00, A61K 31/517, A61K 45/06, A61K 31/422, A61K 31/435
Метки: терапия, активность, соединением, комбинированная, адф, ингибитора, тромбоцитах, рецептора, проявляющим
Код ссылки
<a href="https://eas.patents.su/30-20045-kombinirovannaya-terapiya-soedineniem-proyavlyayushhim-aktivnost-ingibitora-receptora-adf-na-trombocitah.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированная терапия соединением, проявляющим активность ингибитора рецептора адф на тромбоцитах</a>
Предыдущий патент: Лыжный тренажер
Следующий патент: Фармацевтическая комбинация
Случайный патент: Экстракция поликарбоновой кислоты












