Производные атропоизомеров 2-пуринил-3-толилхиназолинона и способы применения
Формула / Реферат
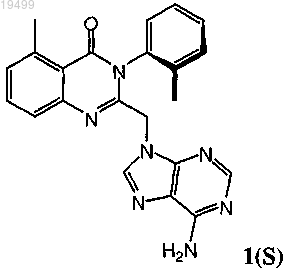
1. Оптически активная смесь, содержащая атропоизомер формулы 1(S)
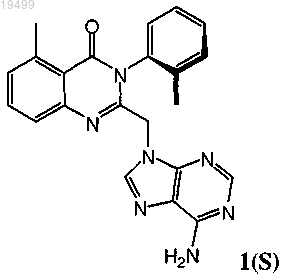
или его фармацевтически приемлемую соль;
где атропоизомер формулы 1(S) или его фармацевтически приемлемая соль присутствует в избытке относительно его соответствующего энантиомера или его фармацевтически приемлемой соли.
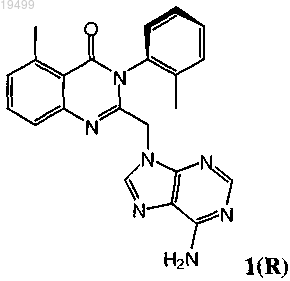
2. Оптически активная смесь, содержащая атропоизомер формулы 1(R)
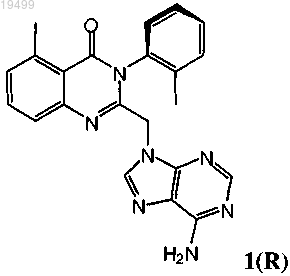
или его фармацевтически приемлемую соль;
где атропоизомер формулы 1(R) или его фармацевтически приемлемая соль присутствует в избытке относительно его соответствующего энантиомера или его фармацевтически приемлемой соли.
3. Фармацевтическая композиция, содержащая соединение формулы 1(S)

или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция, содержащая соединение формулы 1(R)
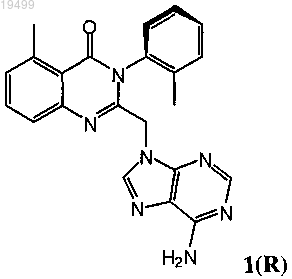
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
5. Способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза (MS), ревматоидного артрита (RA) и диабета, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции по п.3.
6. Способ лечения состояния у человека, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза (MS), ревматоидного артрита (RA) и диабета, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы 1(S)
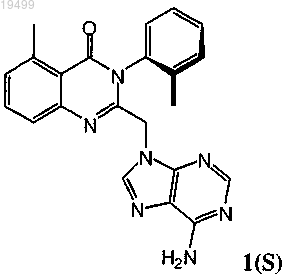
или его фармацевтически приемлемой соли.
7. Способ лечения ракового заболевания у млекопитающего, где раковое заболевание представляет собой лейкемию, лимфому или множественную миелому, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции по п.3.
8. Способ лечения ракового заболевания у человека, где раковое заболевание представляет собой лейкемию, лимфому или множественную миелому, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы 1(S)
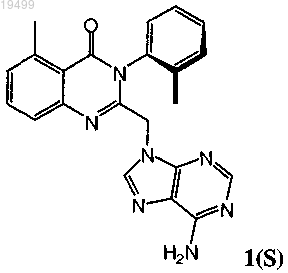
или его фармацевтически приемлемой соли.
9. Оптически активный атропоизомер формулы 1
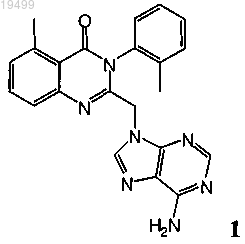
или его фармацевтически приемлемая соль;
где оптически активный атропоизомер или его фармацевтически приемлемая соль характеризуется более коротким временем удерживания на хиральной колонке с нормальной фазой при сравнении с его энантиомером или его фармацевтически приемлемой солью.
10. Оптически активный атропоизомер по п.9 или его фармацевтически приемлемая соль, где оптически активный атропоизомер или его фармацевтически приемлемая соль большей частью состоит из соединения формулы 1(S)

или его фармацевтически приемлемой соли и, по существу, свободен от его энантиомера или его фармацевтически приемлемой соли.
11. Оптически активный атропоизомер по п.9 или его фармацевтически приемлемая соль, где оптически активный атропоизомер или его фармацевтически приемлемая соль большей частью состоит из соединения формулы 1(R)
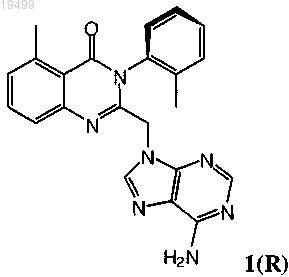
или его фармацевтически приемлемой соли и, по существу, свободен от его энантиомера или его фармацевтически приемлемой соли.
12. Оптически активный атропоизомер формулы 1
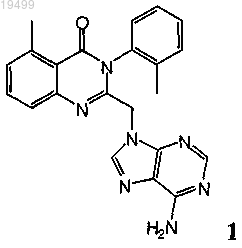
или его фармацевтически приемлемая соль;
где оптически активный атропоизомер или его фармацевтически приемлемая соль характеризуется более длительным временем удерживания на хиральной колонке с нормальной фазой при сравнении с его энантиомером.
13. Оптически активный атропоизомер по п.12 или его фармацевтически приемлемая соль, где оптически активный атропоизомер или его фармацевтически приемлемая соль большей частью состоит из соединения формулы 1(S)
или его фармацевтически приемлемой соли и, по существу, свободен от его энантиомера или его фармацевтически приемлемой соли.
14. Оптически активный атропоизомер по п.12 или его фармацевтически приемлемая соль, где оптически активный атропоизомер или его фармацевтически приемлемая соль большей частью состоит из соединения формулы 1(R)
или его фармацевтически приемлемой соли и, по существу, свободен от его энантиомера или его фармацевтически приемлемой соли.
Текст
Изобретение раскрывает соединения, композиции и способы лечения некоторых воспалительных состояний и/или онкологических заболеваний путем введения соединения, которое ингибируетPD-K-изоформы, в особенности дельта-изоформу. Оно дополнительно обеспечивает конкретные стереоизомеры соединения, полезные для реализации этих способов. В частности, соединение представляет собой оптически активный атропоизомер 2-6-амино-9 Н-пурин-9-ил)метил)-5 метил-3-о-толилхиназолин-4(3H)-она.(71)(73) Заявитель и патентовладелец: ГИЛИЭД КАЛИСТОГА ЭлЭлСи (US) Родственные заявки Заявка на данный патент заявляет приоритет предварительной заявки США US61/162980, поданной 24 марта 2009 г., и 61/231550, поданной 5 августа 2009 г. Содержимое этих документов включено в этот патент путем ссылки. Область техники, к которой относится изобретение Изобретение лежит в области терапевтических средств и медицинской химии для лечения воспалительных состояний и/или онкологических нарушений с использованием соединений, которые ингибируют ферменты на основе фосфатидилинозитол-3,4,5-трифосфат-киназы(PI3K) in vivo. В особенности,изобретение касается соединений, композиций и способов лечения воспалительных состояний и/или онкологических нарушений с помощью обогащенного энантиомерно 2-6-амино-9 Н-пурин-9-ил)метил)-5 метил-3-о-толилхиназолин-4(3H)-она. Клеточная сигнализация через 3'-фосфорилированные фосфоинозитиды была вовлечена в разнообразные клеточные процессы, например в злокачественную трансформацию, сигнализацию фактора роста,воспаление и иммунитет. Фермент, отвечающий за вырабатывание этих фосфорилированных продуктов сигнализации, фосфатидилинозитол-3-киназа (PI 3-киназа; PI3K), первоначально был идентифицирован как обладающее активностью вещество, связанное с вирусными онкобелками и с рецепторными тирозинкиназами фактора роста, которое фосфорилирует фосфатидилинозитол (PI) и его фосфорилированные производные по 3'-гидроксилу инозитольного кольца. Кроме того, активация PI3K, как полагают, является вовлеченной в разнообразные клеточные реакции, включающие рост клетки, дифференцировку и апоптоз. Идентификация р 110-изоформы фосфатидилинозитол-3-киназ (PI 3-киназы; PI3K) описана в публикации Chantry, et al., J. Biol. Chem. (1997), 272:19236-19241. Было сделано наблюдение, что р 110 изоформа человека экспрессируется в тканях ограниченно. Она экспрессируется на высоких уровнях в лимфоцитах и в лимфоидных тканях, что позволяет предположить, что белок мог бы играть роль PI-3 киназа-опосредованной сигнализации в иммунной системе. Кроме того, конкретные изоформы PI3K также могут играть роль PI3K-опосредованной сигнализации в некоторых раковых заболеваниях. Воспалительные реакции в значительной мере связаны с инфлюксом лейкоцитов и/или с хемотаксисом лейкоцитов. Воспалительные реакции могут быть результатом инфекции, вызванной патогенными организмами и вирусами, неинфекционным средством, таким как травма или реперфузия после инфаркта миокарда или инсульта, иммунных реакций на чужеродные антигены и аутоиммунных заболеваний. Лейкоциты обеспечивают первую линию иммунной защиты от многих часто встречающихся микроорганизмов.Lee, et al., FASEB J. (2006), 20:455-465 описывает доказательство того, что ингибирование PI3K ослабляет аллергическое воспаление дыхательных путей и гиперчувствительность в моделях мышиной астмы, тем самым демонстрирует то, что селективные ингибиторы PI3K являются полезными в лечении астмы и аллергических реакций, а также иммунных нарушений. Что касается ракового заболевания, то соединения, которые экспрессируют относительно высокие уровни р 110-изоформы, могут быть полезными в лечении главным образом раковых заболеваний кроветворной системы. р 110-Изоформа PI3K-фермента также может играть роль PI3K-опосредованной сигнализации в некоторых раковых заболеваниях, таких как солидные опухоли. Существует необходимость в лечении PI3K-опосредованных нарушений, имеющих отношение к раковым заболеваниям и воспалительным состояниям. Настоящее изобретение обеспечивает конкретный изомер одного хиназолинового соединения, который является особенно полезным в лечении воспалительных состояний и ракового заболевания. Раскрытие изобретения Изобретение относится к селективным ингибиторам PI3K и к способам лечения воспалительных состояний и раковых заболеваний посредством соединений, которые являются селективными ингибиторами PI3K. В частности, соединения изобретения существуют в виде разделяемых атропоизомеров, и изобретение обеспечивает разделенные атропоизомеры, имеющие неожиданные преимущества над смесями атропоизомеров при применении в лечении воспаления. Соединения, композиции и способы изобретения являются терапевтически благотворными в лечении воспалительных состояний. В одном аспекте изобретение обеспечивает оптически активное соединение, содержащее атропоизомер формулы 1(S) или его фармацевтически приемлемую соль или сольват; где атропоизомер формулы 1(S) присутствует в избытке относительно его соответственного энантиомера формулы 1(R) В другом аспекте изобретение обеспечивает оптически активное соединение, содержащее атропоизомер формулы 1(R) или его фармацевтически приемлемую соль или сольват; где атропоизомер формулы 1(R) присутствует в избытке относительно его соответственного энантиомера формулы 1(S) В еще одном аспекте изобретение обеспечивает композицию, содержащую оптически активное соединение, описанное в этом документе, и фармацевтически приемлемый носитель. В другом аспекте изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние характеризуется воспалением. В некоторых вариантах осуществления состояние выбирают из группы, состоящей из хронических воспалительных заболеваний, состояний, связанных с отторжением трансплантированных тканей или органов, реакции "трансплантат против хозяина" (GVHD), из синдромов, связанных с полиорганными поражениями, острого гломерулонефрита, реактивного артрита, врожденной эмфиземы, хронического обструктивного заболевания легких (COPD), кистозного фиброза, респираторного дистресссиндрома взрослых (ARDS), ишемического реперфузионного повреждения, инсульта, ревматоидного артрита (RA), остеоартрита (ОА), астмы, аллергического ринита, волчаночного нефрита, болезни Крона,неспецифического язвенного колита, некротизирующего энтероколита, панкреатита, пневмоцистной пневмонии (РСР), воспалительного заболевания кишечника (IBD), синдрома атипичной пневмонии(SARS), сепсиса, внебольничной пневмонии (САР), множественного склероза (MS), инфаркта миокарда,инфекции, связанной с респираторным синцитиальным вирусом (RSV), дерматита, острого гнойного менингита, термического повреждения, синдромов, связанных с трансфузией гранулоцитов, вызванной цитокинами токсичности и повреждения спинного мозга; где способ лечения такого состояния включает введение упомянутому млекопитающему терапевтически эффективного количества оптически активного атропоизомера, описанного в этом документе. В некоторых вариантах осуществления оптически активное соединение представлено формулой 1(S). В других вариантах осуществления оптически активное соединение представлено формулой 1(R). В еще одном аспекте изобретение обеспечивает оптически активный атропоизомер, полученный хиральным хроматографическим разделением рацемической смеси, соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где рацемическую смесь соединений формулы 1 разделяют с использованием хиральной колонки с нормальной фазой, и два пика (максимума), А и В, разделены, где максимум А и максимум В представляют атропоизомеры 1(S) и 1(R) соответственно, где полученный оптически активный атропоизомер в основном состоит из первого изомера, который элюируют из колонки. В некоторых вариантах осуществления полученный оптически активный атропоизомер состоит из соединения формулы 1(S) и, по существу, свободен от соединения формулы 1(R). В другом варианте осуществления полученный оптически активный атропоизомер состоит из соединения формулы 1(R) и, по существу, свободен от соединения формулы 1(S). В еще одном дополнительном аспекте изобретение обеспечивает оптически активный атропоизомер, получаемый хиральным хроматографическим разделением рацемической смеси соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где рацемическую смесь соединений формулы 1 разделяют с использованием хиральной колонки с нормальной фазой, и два пика (максимума), А и В, разделены, где максимум А и максимум В представляют атропоизомеры 1(S) и 1(R) соответственно, где полученный оптически активный атропоизомер в основном состоит из второго изомера, который элюируют из колонки. В другом аспекте изобретение обеспечивает фармацевтические композиции, содержащие любое из оптически активных соединений, описанных в этом документе, и по меньшей мере один фармацевтически приемлемый эксципиент. Краткое описание чертежей Фиг. 1 показывает схему синтеза при получении рацемического соединения 1. Фиг. 2 показывает кривые, полученные с помощью жидкостной хроматографии высокого давления(HPLC), для введенного соединения 1, содержащие разделенные атропоизомеры, на хиральных колонках с нормальной фазой (фиг. 2 А) или с обращенной фазой (фиг. 2 В). Фиг. 3 показывает кривые, полученные с помощью жидкостной хроматографии высокого давления(HPLC), для разделенного введенного соединения 1 до препаративного хроматографического разделения(фиг. 3 А), пик 1 (фиг. 3B), 1(S), и пик 2 (фиг. 3 С), 1(R), для выделенных атропоизомеров после разделения с использованием способа разделения на колонках с нормальной фазой. Фиг. 4 показывает данные по растворимости соединения 1 и разделенных атропоизомеров 1(S) и 1(R) в ряду водных растворителей. Фиг. 5 показывает различия p110-активности различных изоформ, оцениваемые для рацемического соединения 1 и атропоизомеров 1(S) и 1(R), в биохимическом (фиг. 5 А) и клеточном анализах (фиг. 5 В). Фиг. 6 показывает концентрацию атропоизомеров 1(S) и 1(R) в плазме у крыс после перорального введения дозы рацемического соединения 1. Фиг. 7 показывает концентрацию атропоизомеров 1(S) и 1(R) в плазме у собак после перорального введения дозы рацемического соединения 1. Фиг. 8 показывает концентрацию атропоизомеров 1(S) и 1(R) в плазме у обследуемого человека после перорального введения дозы рацемического соединения 1. Фиг. 9 показывает сравнение концентрации атропоизомеров 1(S) и 1(R) в плазме у обследуемых крыс после внутривенного (фиг. 9 А) или после перорального (фиг. 9 В) введения доз соединений 1(S) или 1(R). Фиг. 10 показывает сравнение концентрации атропоизомеров 1(S) и 1(R) в плазме у обследуемых людей после однократного перорального введения дозы в 100 мг (фиг. 10 А, 10 В) или 10 мг (фиг. 10 С,10D) соединения 1(S) или 1(R). Фиг. 11 показывает сравнение концентрации меченных радиоактивными 14 С-изотопами атропоизомеров 1(S) и 1(R) в плазме у обследуемых людей в течение 120 ч при ежедневном введении суточной дозы 25 мг рацемического соединения 1. Фиг. 12 показывает аналитические кривые, полученные с помощью жидкостной хроматографии в сочетании с масс-спектрометрией (LC-MS), для метаболитов в моче крыс после введения атропоизомера 1(S) (фиг. 12 А) или атропоизомера 1(R) (фиг. 12 В). Фиг. 13 показывает аналитические кривые метаболитов в плазме человека после введения атропоизомера 1(S) или атропоизомера 1(R), что испытано через 1 ч (фиг. 13 А, 13 В) или через 72 ч (фиг. 13 С,13D) после перорального введения. Фиг. 14 показывает график зависимости индексов активности артрита от количества дней после введения дозы соединения, атропоизомера 1(S) в экспериментальных моделях коллагениндуцированного артрита у крыс. Фиг. 15 показывает диаграмму уровней антиколлагеновых антител у крыс после введения субъектам дозы носителя, атропоизомера 1(S) или метотрексата. Фиг. 16 показывает диаграмму интенсивностей рентгеновского излучения в произвольных единицах, полученных в ходе радиографического обследования крыс, обработанных либо носителем, либо атропоизомером 1(S), либо метотрексатом. Фиг. 17A-D показывают изображения, полученные в ходе гистопатологических исследований субъектов, обработанных носителем, либо атропоизомером 1(S), либо метотрексатом. Подробное описание Многие органические соединения существуют в оптически активных формах, т.е. они имеют способность вращать плоскополяризованный свет. Префиксы d и l или (+) и (-) применяют для обозначения знака вращения плоскополяризованного света соединением, где (-) или l означает то, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Что касается данной химической структуры, то эти соединения, называемые стереоизомерами, являются идентичными за исключением того, что они являются зеркальными отображениями друг друга. Стереоизомеры, которые являются зеркальными отображениями друг друга, также могут называться энантиомерами, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров (50:50) называют рацемической смесью или рацематом. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных видов молекул, которые лишены оптической активности. Термин "хиральный" относится к молекулам, которые имеют свойство неналагаемости партнера при зеркальном отображении, тогда как термин "ахиральный" относится к молекулам, которые являются налагаемыми на их партнера зеркального отображения. Термин "стереоизомеры" относится к соединениям, которые имеют идентичную химическую структуру, но отличаются в отношении расположения атомов или групп в пространстве. Термин "энантиомеры", как он используется в этом документе, относится к двум стереоизомерам соединения. Термин "атропоизомеры" относится к конформационным стереоизомерам, которые имеют место в том случае, когда вращение вокруг одинарной связи в молекуле предотвращено или сильно замедлено в результате пространственных взаимодействий с другими частями молекулы, и заместители на обоих концах одинарной связи являются асимметрическими, т.е. для нихне требуется стереоцентр. В том случае, когда вращательный барьер вокруг одинарной связи является достаточно высоким и взаимопревращение между конформациями является достаточно медленным, то разделение и выделение изомерных видов молекул допустимо. Атропоизомеры представляют собой энантиомеры, не содержащие ни одного асимметрического атома. Энергетический барьер к термической рацемизации атропоизомеров может быть определен посредством пространственного затруднения свободного вращения одной или более связей, образующих хиральную ось. Некоторые биарилсодержащие соединения проявляют атропоизомерию в том случае, когда вращение вокруг внутрикольцевой связи, не имеющей С 2-симметрии, является ограниченным. Свободная энергия изомеризации (энантиомеризация) служит мерой стабильности внутрикольцевой связи в отношении вращения. Оптическое и термическое возбуждение могут способствовать рацемизации таких изомеров, зависящих от электронных и пространственных факторов. Ортозамещенные бифенилсодержащие соединения могут проявлять такой тип конформационной,вращательной изомерии. Такие бифенилсодержащие соединения являются энантиомерными, хиральными атропоизомерами, где связь углерод-углерод (sp2-sp2), внутрикольцевая связь между фенильными кольцами имеет достаточно высокий энергетический барьер, чтобы предотвращать свободное вращение,и где заместители XY и UV делают молекулу асимметрической. Пространственное взаимодействие между X:U, X:V и/или Y:V, Y:U является достаточно сильным,чтобы сделать энергетический максимум для плоской конформации. Два неплоских, аксиально хиральных энантиомера тогда существуют как атропоизомеры в том случае, когда их взаимопревращение является достаточно медленным для того, чтобы они могли быть выделены независимо друг от друга. В одном определении атропоизомерия, как определяют, имеет место там, где изомеры имеют период полураспада t1/2, равный по меньшей мере 1000 с, где свободная энергия барьера составляет 22,3 ккалмоль-1(1983), 14:1). Сплошные жирные линии и прерывистые линии на фигурах, показанных выше, указывают на те фрагменты или части молекулы, которые являются пространственно ограниченными (стесненными) вследствие вращательного энергетического барьера. Выделенные жирным шрифтом фрагменты находятся ортогонально над плоскостью страницы и пунктирные фрагменты находятся ортогонально ниже плоскости страницы. "Плоская" часть молекулы (левое кольцо в каждом из двух отраженных бифенилов) находится в плоскости страницы. Соединения с аксиальной хиральностью, такие как хиральные бифенильные кольца, могут быть описаны с использованием конфигурационной номенклатуры. Например, 2,2'; 6,6'-тетразамещенным бифенилам присваивают конфигурационные дескрипторы как другим аксиально хиральным молекулам. Молекулы могут быть рассмотрены с любого конца хиральной оси и это приведет к одному и тому же конфигурационному дескриптору (R или S). В том случае, когда, например, молекулу 2 рассматривают слева вдоль 1-1'-связи, то приходят к проекции 2.1, тогда как проекцию 2.2 получают в том случае, когда ту же самую молекулу теперь рассматривают справа вдоль 1'-1-связи. Эти проекции соответствуют конфигурации (S). Обозначение S присваивают путем последовательного применения правил наименования соединений с аксиальной хиральностью. Эти правила применяют, в первую очередь, к орто-заместителям бифенильного кольца. Два связанных кольца могут быть представлены горизонтальной и вертикальной линиями. Линии представляют собой два ортогональных кольца; и концы линий представляют собой заместители в четырех орто-положениях двух связанных колец. Эти линии, таким образом, соединяют каждую пару орто-заместителей. Две группы на ближайшем кольце ("передняя" линия) при рассмотрении имеют преимущество над двумя дальними группами. В пределах пары заместителям отдают преимущества с использованием тех же самых правил назначения приоритета, использованных для описания R- иS-энантиомеров хирального центра. Например, в проекции "сверху" формулы 2.1 вид позволяет рассматривать молекулу слева, идя вниз по оси от 1 к 1'. Близлежащее кольцо представлено сплошной жирной вертикальной линией, соединяющей -ОСН 3 и Н, которые пронумерованы соответственно 1 и 2, поскольку-ОСН 3 имеет более высокий приоритет над Н. Горизонтальная линия представляет собой кольцо, содержащее NO2 и СО 2 Н, которые пронумерованы соответственно 3 и 4, исходя из их приоритета. Таким образом, последовательность 123 показывает конфигурационный дескриптор, который в этом примере представляет собой S, так как следование в порядке числовой последовательности требует идти против часовой стрелки вокруг центра диаграммы. Так же как это делают для энантиомеров, пронумерованные заместители тогда берут подряд по ходу движения либо по часовой стрелке, либо против часовой стрелки вокруг точки, где пересекаются две линии. Если бы путь вокруг центральной точки проходил по часовой стрелке, то атропоизомер был бы обозначен как R, точно так же, как это имеет место в отношении энантиомеров стереоцентра. Такую же конфигурацию S получают при рассмотрении молекулы с противоположного конца оси 1-1', что показано на фиг. 3.2. Исходя из этого вида, кольцо, содержащее орто-NO2 и орто-CO2H, находится ближе к наблюдателю и является представленным сплошной жирной горизонтальной линией. Кольцо, содержащее орто-ОСН 3 и орто-Н, находится дальше от наблюдателя и представлено вертикальной линией. В этом примере бифенила, с целью продемонстрировать назначения в соответствии с номенклатурой, выбраны только четыре орто-заместителя. В том случае, где два орто-заместителя в кольце являются идентичными, приоритет отдают при рассмотрении мета-заместителей в том же самом кольце. Такой тип номенклатурного присваивания будет применен к атропоизомерам, описанным в этом документе. Например, соединению 3, которое является репрезентативным для части некоторых из описанных в этом документе соединений, таких как соединение 1(S), присваивают абсолютную конфигурацию S, что показано ниже. Для целей изобретения атропоизомеры предпочтительно являются достаточно стабильными при хранении и используются без существенного термического взаимопревращения. Обычно атропоизомеры имеют полураспад, составляющий более 1 недели в том случае, когда они находятся в твердой форме при комнатной температуре. В одном варианте осуществления соединение формулы 1, 2-6-амино-9 Н-пурин-9-ил)метил)-5-6 019499 метил-3-о-толилхиназолин-4(3H)-он, имеет два атропоизомера, представленных формулами 1(S) и 1(R). Формула 1 представляет собой смесь эквивалентных количеств двух атропоизомеров 1(S) и 1(R). Формула 1(R) представляет собой соответствующий энантиомер формулы 1(S), и наоборот. Как используется в этом документе, атропоизомер, "по существу, свободный от" его соответственного энантиомера, означает то, что композиция содержит по меньшей мере 90% по массе одного атропоизомера и 10% по массе или менее его стереоизомерного атропоизомера. В некоторых вариантах осуществления композиция содержит по меньшей мере 95% по массе одного атропоизомера и 5% по массе или менее его стереоизомера. В некоторых вариантах осуществления композиция содержит по меньшей мере 98% по массе одного атропоизомера и 2% по массе или менее его стереоизомера. Альтернативно,относительные количества преобладающего изомера и любого минорного энантиомера составляют по меньшей мере 9:1, или по меньшей мере 19:1, или по меньшей мере 98:2. В некоторых вариантах осуществления композиция содержит по меньшей мере 99% по массе одного атропоизомера и 1% по массе или менее его стереоизомера. В некоторых вариантах осуществления композиция содержит по меньшей мере 99,5% по массе одного атропоизомера и 0,5% по массе или менее его стереоизомера. Атропоизомерные соединения изобретения обычно представляют собой твердые вещества и их необязательно очищают до получения степени чистоты, составляющей более чем приблизительно 90%,даже если они существуют в виде смеси атропоизомеров. В некоторых вариантах осуществления атропоизомерное соединение изобретения, по существу, не включает белковоподобные вещества, или любые вещества, имеющие молекулярную массу выше приблизительно 1000 а.е.м. (атомные единицы массы). Обычно, они имеют, по меньшей мере, степень чистоты 90% (химически чистые, независимо от оптической чистоты), и предпочтительно они являются химически чистыми по меньшей мере на 95%. В некоторых вариантах осуществления в композициях и способах изобретения используют оптически активную форму описанных соединений, в каждом случае имеют в виду, что соединение является оптически активным и содержит преимущественно S-стереоизомер, такой как 1(S), хотя он может содержать R-стереоизомер, такой как 1(R), в качестве минорного компонента. В других вариантах осуществлениясоединение является оптически активным и содержит преимущественно R-стереоизомер, такой как 1(R), хотя он может содержать S-стереоизомер, такой как 1(S), в качестве минорного компонента. Для ясности, в том случае, когда в этом документе описывают дозировку соединения, дозировка относится к массе соединения, включающей каждый стереоизомер, который присутствует. Так, дозировка,составляющая 100 мг соединения 1(S), которая используется в этом документе, например, относится к массе смеси стереоизомеров, а не к массе конкретно S-стереоизомера. Ее можно было бы отнести, например, к 100 мг смеси S- и R-стереоизомеров с соотношением 9:1, которая могла бы содержать приблизительно 90 мг S-стереоизомера, или к 100 мг смеси S- и R-стереоизомеров с соотношением 19:1, которая могла бы содержать приблизительно 95 мг S-стереоизомера. В некоторых вариантах осуществления соединение предпочтительно представляет собой нерацемическую смесь, где S-изомер является главным компонентом смеси. Обычно такая смесь будет содержать не более чем приблизительно 10% R-изомера, что означает, что соотношение S- к R-изомерам составляет по меньшей мере приблизительно 9:1, и предпочтительно менее чем 5% R-изомера, что означает, что соотношение S- к R-энантиомерам составляет по меньшей мере приблизительно 19:1. В некоторых вариантах осуществления соединение имеет менее 2% R-энантиомера, что означает, что оно имеет энантиомерный избыток, составляющий по меньшей мере приблизительно 96%. В некоторых вариантах осуществления соединение имеет энантиомерный избыток, составляющий по меньшей мере 98%. В некоторых вариантах осуществления соединение имеет энантиомерный избыток, составляющий по меньшей мере 99%. В некоторых вариантах осуществления соединение предпочтительно представляет собой нерацемическую смесь, где R-изомер является главным компонентом смеси. Обычно такая смесь будет содержать не более чем приблизительно 10% S-изомера, что означает, что соотношение R- к S-изомерам составляет по меньшей мере приблизительно 9:1, и предпочтительно менее чем 5% S-изомера, что означает, что соотношение R- к S-энантиомерам составляет по меньшей мере приблизительно 19:1. В некоторых вариантах осуществления соединение имеет менее 2% S-энантиомера, что означает, что оно имеет энантиомерный избыток, составляющий по меньшей мере приблизительно 96%. В некоторых вариантах осуществления соединение имеет энантиомерный избыток, составляющий по меньшей мере 98%. В некоторых вариантах осуществления соединение имеет энантиомерный избыток, составляющий по меньшей мере 99%. Атропоизомер, который присутствует "в избытке" относительно его соответственного энантиомера или в виде "энантиообогащенной смеси", означает, что атропоизомер присутствует в количестве, превышающем количество его энантиомера, что делает смесь атропоизомеров оптически активной. Обычно это означает, что соединение, присутствующее "в избытке", преобладает над своим энантиомером по меньшей мере с соотношением 60/40. Изобретение относится к селективным ингибиторам PI3K и к способам лечения воспалительных состояний и/или онкологических нарушений посредством соединений, которые являются селективными ингибиторами PI3K. В частности, соединения изобретения существуют в виде разделяемых атропоизомеров и изобретение обеспечивает разделенные атропоизомеры, имеющие удивительные преимущества над смесями атропоизомеров для применения в лечении воспаления. Соединения, композиции и способы изобретения являются терапевтически благотворными в лечении воспалительных состояний. В одном аспекте изобретение обеспечивает оптически активное соединение, содержащее атропоизомер формулы 1(S) или его фармацевтически приемлемую соль или сольват; где атропоизомер формулы 1(S) присутствует в избытке относительно его соответственного энантиомера формулы 1(R) В одном варианте осуществления атропоизомер формулы 1(S), по существу, свободен от его соответственного атропоизомера формулы 1(R). В еще одном аспекте изобретение обеспечивает оптически активное соединение, содержащее атропоизомер формулы 1(R) или его фармацевтически приемлемую соль или сольват; где атропоизомер формулы 1(R) присутствует в избытке относительно его соответственного энантиомера формулы 1(S) В некоторых вариантах осуществления атропоизомер формулы 1(R), по существу, свободен от его соответственного атропоизомера формулы 1(S). В другом аспекте изобретение обеспечивает фармацевтическую композицию, содержащую любое из оптически активных соединений, описанных в этом документе, и по меньшей мере один фармацевтически приемлемый эксципиент. В конкретных вариантах осуществления оптически активное соединение представляет собой 1(S) или 1(R). В других вариантах осуществления оптически активное соединение представляет собой 1(S). В дополнительных других вариантах осуществления оптически активное соединение представляет собой 1(R). В одном варианте осуществления композиция содержит терапевтически эффективное количество оптически активного атропоизомера для лечения состояния, где состояние характеризуется воспалением. В некоторых вариантах осуществления состояние выбирают из группы, состоящей из хронических воспалительных заболеваний, состояний, связанных с отторжением трансплантированных тканей или органов, реакции "трансплантат против хозяина" (GVHD), из синдромов, связанных с полиорганными поражениями, острого гломерулонефрита, реактивного артрита, врожденной эмфиземы, хронического обструктивного заболевания легких (COPD), кистозного фиброза, респираторного дистресс-синдрома взрослых (ARDS), ишемического реперфузионного повреждения, инсульта, ревматоидного артрита (RA),остеоартрита (ОА), астмы, аллергического ринита, диабета, волчаночного нефрита, болезни Крона, неспецифического язвенного колита, некротизирующего энтероколита, панкреатита, пневмоцистной пневмонии (РСР), воспалительного заболевания кишечника (IBD), синдрома атипичной пневмонии (SARS),сепсиса, внебольничной пневмонии (САР), множественного склероза (MS), инфаркта миокарда, инфекции, связанной с респираторным синцитиальным вирусом (RSV), дерматита, острого гнойного менингита, термического повреждения, синдромов, связанных с трансфузией гранулоцитов, вызванной цитокинами токсичности, и повреждения спинного мозга. В некоторых вариантах осуществления оптически активное соединение представлено формулой 1(S). В других вариантах осуществления оптически активное соединение представлено формулой 1(R). В еще одном аспекте изобретение обеспечивает способ лечения состояния у млекопитающих, где состояние характеризуется воспалением. В некоторых вариантах осуществления состояние выбирают из группы, состоящей из хронических воспалительных заболеваний, состояний, связанных с отторжением трансплантированных тканей или органов, реакции "трансплантат против хозяина" (GVHD), из синдромов, связанных с полиорганными поражениями, острого гломерулонефрита, реактивного артрита, врожденной эмфиземы, хронического обструктивного заболевания легких (COPD), кистозного фиброза, респираторного дистресс-синдрома взрослых (ARDS), ишемического реперфузионного повреждения, инсульта, ревматоидного артрита (RA), остеоартрита (ОА), астмы, аллергического ринита, диабета, волчаночного нефрита, болезни Крона, неспецифического язвенного колита, некротизирующего энтероколита,панкреатита, пневмоцистной пневмонии (РСР), воспалительного заболевания кишечника (IBD), синдрома атипичной пневмонии (SARS), сепсиса, внебольничной пневмонии (САР), множественного склероза(MS), инфаркта миокарда, инфекции, связанной с респираторным синцитиальным вирусом (RSV), дерматита, острого гнойного менингита, термического повреждения, синдромов, связанных с трансфузией гранулоцитов, токсичности, вызванной цитокинами, и повреждения спинного мозга; где способ лечения такого состояния включает введение упомянутому млекопитающему терапевтически эффективного количества оптически активного атропоизомера, описанного в этом документе. В некоторых вариантах осуществления оптически активное соединение представлено формулой 1(S). В других вариантах осуществления оптически активное соединение представлено формулой 1(R). В некоторых вариантах осуществления млекопитающее представляет собой субъект, определяемый как нуждающийся в лечении нарушения. В некоторых вариантах осуществления млекопитающее представляет собой субъект, находящийся в группе риска, предрасположенной к такому состоянию, и соединение или композицию вводят для снижения или предупреждения возникновения воспаления. Способ настоящего изобретения может быть применен для терапевтического или профилактического лечения субъектов, которые имеют воспалительное состояние или могут быть подвержены воспалительному состоянию. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза(MS), ревматоидного артрита (RA) и диабета, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества атропоизомера 1(S) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза(MS), ревматоидного артрита (RA) и диабета, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза(MS), ревматоидного артрита (RA) и диабета, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера и имеет энантиомерный избыток, составляющий по меньшей мере 90%. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза(MS), ревматоидного артрита (RA) и диабета, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера и имеет энантиомерный избыток, составляющий по меньшей мере 98%. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза(MS), ревматоидного артрита (RA) и диабета, который включает введение млекопитающему, нуждающемуся в лечении такого состояния, терапевтически эффективного количества атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера и имеет энантиомерный избыток, составляющий по меньшей мере 99%. В некоторых вариантах осуществления изобретение обеспечивает способ лечения аллергического ринита у человека, который включает введение человеку, нуждающемуся в лечении такого состояния,терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения астмы у человека,который включает введение человеку, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения хронического обструктивного заболевания легких (COPD) у человека, который включает введение человеку, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения множественного склероза у человека, который включает введение человеку, нуждающемуся в лечении такого состояния,терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения ревматоидного артрита у человека, который включает введение человеку, нуждающемуся в лечении такого состояния,терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения диабета у человека, который включает введение человеку, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли, где атропоизомер, по существу, свободен от его соответствующего энантиомера. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у человека, где состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD), множественного склероза (MS),ревматоидного артрита (RA) и диабета, который включает введение человеку, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера, имеющего формулу 1(S) или его фармацевтически приемлемой соли. Примеры воспалительных состояний включают, но ими не ограничиваются, артритические заболевания, такие как ревматоидный артрит (RA), остеоартрит (ОА), подагрический артрит, спондилит, реактивный артрит; синдром Бехчета; сепсис; септический шок; эндотоксический шок; грамнегативный сепсис; грампозитивный сепсис; синдром токсического шока; синдром полиорганной недостаточности, вторичный септицемии, травма или кровотечение; офтальмические расстройства, включающие, но не ограниченные, аллергический конъюнктивит, весенний конъюнктивит, увеит и офтальмопатию, связанную с нарушением функции щитовидной железы; эозинофильную гранулему; легочные или респираторные состояния, включающие, но не ограниченные, астму, хронический бронхит, аллергический ринит, респираторный дистресс-синдром взрослых (ARDS), синдром атипичной пневмонии (SARS), хронические воспалительные заболевания легких (например, хроническое обструктивное заболевание легких), силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, пневмонию, бронхоэктаз, врожденную эмфизему, легочное отравление кислородом; ишемическое реперфузионное повреждение, например, миокарда,мозга или конечностей; фиброз, включающий, но не ограниченный, кистозный фиброз; келоидное образование или образование рубцовой ткани; атеросклероз; аутоиммунные заболевания, включающие, но не ограниченные, системный волчаночный эритематоз (SLE), волчаночный нефрит, аутоиммунный тироидит, множественный склероз, некоторые формы диабета и синдром Рейно; нарушения, связанные с отторжением трансплантированных тканей или органов, включающие, но не ограниченные, реакцию"трансплантат против хозяина" (GVHD) и отторжение аллотрансплантата; хронический или острый гломерулонефрит; воспалительные заболевания кишечника, включающие, но не ограниченные, болезнь Крона, неспецифический язвенный колит и некротизирующий энтероколит; воспалительный дерматит,включающий, но не ограниченный, контактный дерматит, атопический дерматит, псориаз и уртикарию; лихорадочное состояние и миалгии вследствие инфекции; воспалительные состояния центральной или периферической нервной системы, включающие, но не ограниченные, менингит (например, острый гнойный менингит), энцефалит и повреждение головного или спинного мозга, вследствие незначительной травмы; синдром Шегрена; заболевания, включающие диапедез лейкоцитов; алкогольный гепатит; бактериальную пневмонию; внебольничную пневмонию (САР); пневмоцистную пневмонию (РСР); заболевания, опосредованные образованием и активацией комплексов антиген-антитело; гиповолемический шок; инсулинозависимый сахарный диабет; острую и замедленную аллергическую реакцию; болезненные состояния вследствие дискразии и метастазирования лейкоцитов; термическое повреждение; синдромы, связанные с трансфузией гранулоцитов; токсичность, вызванную цитокинами; инсульт; панкреатит; инфаркт миокарда, инфекцию, вызванную респираторным синцитиальным вирусом (RSV); и повреждение спинного мозга. В некоторых вариантах осуществления состояние выбирают из группы, состоящей из аллергического ринита, астмы, атопического дерматита, хронического обструктивного заболевания легких (COPD),множественного склероза (MS), ревматоидного артрита (RA) и диабета. В конкретных вариантах осуществления диабет представляет собой инсулинозависимый сахарный диабет или инсулинонезависимый сахарный диабет. В еще одном аспекте изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние представляет собой рак, который включает введение млекопитающему, который нуждается в лечении такого состояния, терапевтически эффективного количества соединения, описанного в этом документе. В некоторых вариантах осуществления рак представляет собой гемобластозу. В конкретном варианте осуществления гемобластоза представляет собой лейкемию, лимфому или множественную миелому. В других вариантах осуществления рак представляет собой солидную опухоль. В некоторых вариантах осуществления лимфома представляет собой неоплазию зрелых В-клеток. В конкретных вариантах осуществления неоплазию зрелых В-клеток выбирают из группы, состоящей из Вклеточного хронического лимфоцитарного лейкоза/мелкоклеточной лимфоцитарной лимфомы; Вклеточного пролимфоцитарного лейкоза; лимфоплазмоцитарной лимфомы; лимфомы из клеток маргинальной зоны, такой как селезеночная В-клеточная лимфома из клеток маргинальной зоны (+/- ворсинчатые лейкоциты), узловая лимфома из клеток маргинальной зоны (+/- моноцитоидные В-клетки), и экстранодальная В-клеточная лимфома из клеток маргинальной зоны типа лимфоидной ткани слизистых оболочек (MALT); волосатоклеточного лейкоза; миеломной болезни (болезнь Бенс-Джонса)/плазмацитомы; фолликулярной лимфомы, лимфомы из клеток фолликулярного центра; лимфомы из клеток мантийной зоны; диффузной крупноклеточной В-клеточной лимфомы (включая медиастинальную крупноклеточную В-клеточную лимфому, интраваскулярную крупноклеточную В-клеточную лимфому, первичную выпотную лимфому) и лимфомы Беркитта/лейкоза Беркитта. В некоторых вариантах осуществления лимфому выбирают из группы, состоящей из множественной миеломы (ММ) и не-ходжкинской лимфомы (NHL), лимфомы из клеток мантийной зоны (MCL),фолликулярной лимфомы, макроглобулинемии Вальденстрема (WM) или В-клеточной лимфомы и диффузной крупноклеточной В-клеточной лимфомы (DLBCL). В дополнительном конкретном варианте осуществления лейкемию выбирают из группы, состоящей из острого лимфоцитарного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL) и мелкоклеточной лимфоцитарной лимфомы (SLL). Острый лимфоцитарный лейкоз также известен как острый лимфобластный лейкоз и может использоваться в этом документе взаимозаменяемо. Оба термина описывают тип рака, который начинается с белых кровяных клеток, лимфоцитов, в костном мозге. В конкретных вариантах осуществления гемобластозу выбирают из группы, состоящей из острого лимфоцитарного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL), множественной миеломы (ММ) и не-ходжкинской лимфомы (NHL). В некоторых вариантах осуществления не-ходжкинскую лимфому выбирают из группы, состоящей из диффузной крупноклеточной В-клеточной лимфомы (LDBCL), лимфомы из клеток мантийной зоны (MCL), макроглобулинемии Вальденстрема (WM) и лимфоплазмоцитарной лимфомы. В некоторых вариантах осуществления изобретение обеспечивает способ лечения гемобластозы у млекопитающего, который включает введение млекопитающему, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли. В дополнительных предпочтительных вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где состояние выбирают из группы, состоящей из острого лимфоцитарного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза(CLL), множественной миеломы (ММ) и не-ходжкинской лимфомы (NHL), который включает введение млекопитающему, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления изобретение обеспечивает способ лечения ракового заболевания у человека, где рак представляет собой лейкемию, лимфому или множественную миелому, который включает введение человеку, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера, имеющего формулу или его фармацевтически приемлемой соли. В некоторых вариантах осуществления изобретение обеспечивает способ лечения состояния у млекопитающего, где раковое заболевание представляет собой солидную опухоль, который включает введение млекопитающему, нуждающемуся в лечении такого состояния, терапевтически эффективного количества оптически активного атропоизомера 1(S) или его фармацевтически приемлемой соли. В конкретных вариантах осуществления раковое заболевание представляет собой рак молочной же- 12019499 лезы, рак легких, рак толстой кишки или рак предстательной железы. В некоторых вариантах осуществления изобретение обеспечивает способы лечения солидной опухоли, которая связана с аномальной или нежелательной PI3K-опосредованной активностью в отношении клеточной сигнализации. В некоторых вариантах осуществления солидную опухоль выбирают из группы, состоящей из рака поджелудочной железы; рака мочевого пузыря; колоректального рака; рака молочной железы, включающего метастатический рак молочной железы; рака предстательной железы, включающего андрогенозависимый и андрогенонезависимый рак предстательной железы; рака почки, включающего, например, метастатическую почечно-клеточную карциному; гепатоцеллюлярного рака; рака легких, включающего, например, немелкоклеточный рак легких (NSCLC), бронхоальвеолярную карциному (ВАС), и аденокарциному легких; рака яичников, включающего, например, эпителиальный или первичный перитонеальный рак; рака шейки матки; рака желудка; рака пищевода; ракового образования головы и шеи, включающего, например,плоскоклеточную карциному головы и шеи; меланомы; нейроэндокринного рака, включающего метастатические нейроэндокринные опухоли; опухолей мозга, включающих, например, глиому, анапластическую олигодендроглиому, мультиформную глиобластому взрослых, и анапластическую астроцитому взрослых; рака кости и саркомы мягких тканей. В конкретных вариантах осуществления рак представляет собой рак молочной железы, рак яичников, рак легких, рак толстой кишки или рак предстательной железы. В предпочтительных вариантах осуществления млекопитающее представляет собой человека. В еще одном аспекте изобретение обеспечивает оптически активный атропоизомер, полученный хиральным хроматографическим разделением рацемической смеси соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где смесь соединений формулы 1 разделяют с использованием хиральной колонки с нормальной фазой, и два пика (максимума), А и В, являются разделенными, где максимум А и максимум В представляют атропоизомеры 1(S) и 1(R) соответственно где преобладающий изомер в полученном оптически активном атропоизомере представляет собой первый изомер, который элюируют из колонки. В некоторых вариантах осуществления полученный оптически активный атропоизомер преимущественно состоит из соединения формулы 1(S) и, по существу, свободен от соединения формулы 1(R). В другом варианте осуществления полученный оптически активный атропоизомер преимущественно состоит из соединения формулы 1(R) и, по существу, свободен от соединения формулы 1(S). В еще одном дополнительном аспекте изобретение обеспечивает оптически активный атропоизомер, получаемый хиральным хроматографическим разделением рацемической смеси соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где рацемическую смесь соединений формулы 1 разделяют с использованием хиральной колонки с нормальной фазой, и два пика (максимума), А и В, являются разделенными, где максимум А и максимум В представляют атропоизомеры 1(S) и 1(R) соответственно где полученный оптически активный атропоизомер в основном состоит из второго изомера, который элюируют из колонки. В конкретных вариантах осуществления полученный оптически активный атропоизомер преимущественно состоит из соединения формулы 1(S) и, по существу, свободен отсоединения формулы 1(R). В некоторых вариантах осуществления полученный преобладающий оптически активный атропоизомер в основном состоит из соединения формулы 1(R) и, по существу, свободен от соединения формулы 1(S). В другом аспекте изобретение обеспечивает оптически активный атропоизомер, получаемый разделением рацемической смеси соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где оптически активный атропоизомер характеризуется более коротким временем удерживания на хиральной колонке с нормальной фазой при сравнении с его энантиомером. В некоторых вариантах осуществления полученный оптически активный атропоизомер преимущественно состоит из соединения формулы 1(S) и, по существу, свободен от соединения формулы 1(R). В других вариантах осуществления полученный оптически активный атропоизомер является более медленно элюирующимся изомером (более продолжительное время удерживания), большей частью состоит из соединения формулы 1(R) и, по существу, свободен от соединения формулы 1(S). В еще одном аспекте изобретение обеспечивает оптически активный атропоизомер, получаемый разделением рацемической смеси соединений формулы 1 или его фармацевтически приемлемую соль или сольват; где оптически активный атропоизомер характеризуется более продолжительным временем удерживания на хиральной колонке с нормальной фазой при сравнении с его энантиомером. В некоторых вариантах осуществления полученный преобладающий оптически активный атропоизомер представляет собой соединения формулы 1(S) и, по существу, свободен от соединения формулы 1(R). В других вариантах осуществления полученный оптически активный атропоизомер является более быстро элюирующимся изомером (более короткое время удерживания), большей частью состоит из соединения формулы 1(R) и, по существу, свободен от соединения формулы 1(S). В одном варианте осуществления соединение изобретения разделяют с использованием хиральной хроматографической колонки. В некоторых вариантах осуществления хиральная колонка имеет нормальную фазу. В альтернативных вариантах осуществления хиральная колонка имеет обращенную фазу. Атропоизомеры формулы 1 разделяли способами жидкостной хроматографии высокого давления(HPLC) с нормальной фазой, что дало в результате два разделенных пика (максимума). См. пример 2 и фиг. 2 А для получения информации по характеристикам колонки и растворителей. Максимум, получаемый сначала при элюировании на 7,4 минутах, был отмечен как 1(S), и второй максимум, который получают при элюировании на 12,3 минутах, был помечен как 1(R). Абсолютная конфигурация каждого выделенного соединения была прояснена с помощью данных по рентгенографической кристаллографии. Первый максимум, получаемый при элюировании, был отнесен S-конфигурации, которая показана в виде соединения 1(S), и второй максимум, получаемый при элюировании, был отнесен R-конфигурации, которая показана в виде соединения 1(R). Порядок получения максимумов при элюировании изменяется на обратный при использовании колонки с обращенной фазой, что описано в примере 2. Активность соединения 1 и атропоизомеров 1(S) и 1(R) in vitro имеют сходные профили в ингибировании различных изоформ p110, что показано на фиг. 5 А и 5 В. Все три соединения проявляют селективное ингибирование р 1105 и в биохимическом анализе (фиг. 5 А), и в клеточном анализе (фиг. 5 В). Хотя оказывается, что эффективность (действенность) соединений 1(S) и 1(R) in vitro является схожей, однако существуют неожиданные различия in vivo, наблюдаемые для 1(S) и 1(R), которые обнаружены в фармакокинетических исследованиях, в основном относящиеся к увеличенному времени воздействия 1(S) и к сниженному времени воздействия 1(R) на субъект. Для того чтобы выполнить фармакокинетические исследования, соединение 1 метят радиоактивным изотопом с использованием метки 14 С на ортометильной группе фенила в положении 3 хиназолинового кольца. Соединение 1, меченное радиоактивным изотопом Меченые рацемическую смесь или разделенные атропоизомеры вводили обследуемым крысам, собакам и людям с использованием пероральных и внутривенных (i.v.) путей. Соединения растворяли в полиэтиленгликоле 100 (PEG) с тем, чтобы любое различие в скоростях растворения не могло бы играть роль в фармакокинетическом профиле соединений. Незначительные различия растворимости между 1(S) и 1(R) наблюдали в разнообразных водных растворах, что сведено вместе на фиг. 4. После введения соединения у субъектов брали пробы плазмы крови во времени и оценивали методами аналитической жидкостной хроматографии высокого давления (HPLC), разработанными для идентифицирования соединения 1(S) или 1(R) и для измерения концентрации соединения 1(S) или 1(R), присутствующего в пробе. Получили, что наиболее представленным изомером, обнаруженным в плазме, является соединение 1(S),которое обусловливает 70-80% воздействия на субъект. Фиг. 6 показывает концентрацию 1(S) и 1(R) в плазме крови в течение 24 ч после того, как крысамсамкам перорально ввели однократную дозу рацемического соединения 1, составляющую 50 мг/кг. Через 4 ч после введения дозы концентрация 1(S) постоянно увеличивается в крови и через 8 ч после введения дозы средняя концентрация 1(R) составляет приблизительно одну четверть концентрации 1(R). Это демонстрирует различие воздействия соединений 1(S) и 1(R) in vivo при пероральном введении крысам, где этот субъект имеет увеличенное воздействие 1(S) по сравнению с 1(R). Фиг. 7 показывает концентрацию 1(S) и 1(R) в плазме крови в течение 24 ч после того, как собакамсамкам перорально ввели однократную дозу рацемического соединения 1, составляющую 50 мг/кг. Приблизительно через 1 ч после введения дозы достигают максимального значения концентрации 1(S) и 1(R). На тот момент концентрация 1(R) составляет менее половины концентрации 1(S). Это демонстрирует различие воздействия соединений 1(S) и 1(R) in vivo при пероральном введении собакам, где этот субъект имеет увеличенное воздействие 1(S) по сравнению с 1(R). Такие большие различия в фармакокинетическом поведении не были предсказуемыми. Фиг. 8 показывает концентрацию 1(S) и 1(R) в плазме крови в течение 72 ч после того, как обследуемым людям перорально ввели однократную дозу рацемического соединения 1, составляющую 100 мг. Через 2 ч после введения дозы достигают максимального значения концентрации 1(S) и 1(R). На момент достижения максимального значения концентрации концентрация 1(R) составляет менее половины концентрации 1(S), которая, в свою очередь, обусловливает приблизительно 70% воздействия на животного. Хотя концентрации обоих соединений после того момента постоянно снижаются, через 72 ч после введения дозы концентрация соединения 1(S) превышает намного более чем в 10 раз концентрацию 1(R). Это демонстрирует неожиданное различие воздействия соединений 1(S) и 1(R) in vivo при пероральном введении людям, где субъект имеет увеличенное воздействие соединения 1(S) по сравнению с 1(R). Кроме того, оказывается, что период полураспада для 1(S) составляет величину, выходящую за точку момента времени 72 ч. Период полураспада для соединения 1(S), составляющий несколько дней у людей, превышает период полураспада у собак. Продолжительный период полураспада для соединения 1(S) у людей предусматривает более низкую дозировку введения. Сниженные вводимые дозировки также могут снижать нежелательные побочные эффекты соединения у субъекта, при наличии таковых, и обеспечивают преимущество по сравнению с введением рацемической смеси или по сравнению с введением 1(R). Фиг. 9 показывает концентрацию соединений 1(S) и 1(R) в плазме крови в течение периода времени 24 ч после введения крысам-самкам однократной дозы 1(S) или 1(R) (1,5 мг/кг) либо с использованием однократной болюсной внутривенной (i.v.) дозы (фиг. 9 А), либо пероральной дозы (фиг. 9 В). В исследовании с внутривенным введением в момент времени 4 ч уровень воздействия 1(R) составляет приблизительно одну пятую часть концентрации 1(S). В момент времени 24 ч концентрация обоих соединений является очень низкой и находится в пределах экспериментальной ошибки. Концентрация 1(S) в плазме крови крыс, которым соединения были введены перорально, как было показано, сильно превышала концентрацию 1(R) в момент времени 12 ч. Это демонстрирует различие воздействия соединений 1(S) и 1(R)in vivo при внутривенном, либо при пероральном введении крысам, где субъект имеет увеличенное воздействие 1(S) по сравнению с 1(R). Табл. 1 сводит вместе основные фармакокинетические параметры для соединений 1(S) и 1(R) после однократного болюсного внутривенного (i.v.) введения дозы крысам-самкам Sprague Dawley (SD). Наиболее примечательным является величина периода полураспада (Т 1/2) для соединения 1(R), которая превышает приблизительно в 2,8 раз величину периода полураспада либо для атропоизомера 1(S), либо для рацемической смеси 1. Соединение 1(R) имеет значение объема распределения в терминальной фазе (Vz) выведения, равное 14833 мл/кг, которое превышает приблизительно в 2,6 раза значение Vz и для 1(S), и для рацемической смеси. Таблица 1AUCall - площадь под кривой для всех значений Различия соединений 1(S) и 1(R) in vivo изучают на обследуемых людях. Фиг. 10 А и 10 В показывают графики зависимости концентрации соединений 1(S) и 1(R) в плазме крови, нанесенные относительно периода времени 72 ч после введения однократной, пероральной дозы атропоизомеров, равной 100 мг. Максимальная концентрация 1(S) в 2 раза превышает максимальную концентрацию для 1(R). Хотя концентрация соединений в плазме крови снижается в течение периода времени 72 ч, разница концентраций двух соединений сохранялась, если дополнительно не увеличивалась. Эта разница концентрации соединения в крови, как оказывается, увеличивается, так как концентрация соединения 1(S) снижается более постепенно во времени, тогда как соединение 1(R), как оказывается, должно быть удалено из крови сравнительно более быстро. При дозе 10 мг максимальная концентрация соединения 1(S) в плазме крови по-прежнему приблизительно в два раза превышает максимальную концентрацию соединения 1(R), см. фиг. 10 С и 10D. Фиг. 11 отражает концентрацию меченного радиоактивным изотопом 14 С соединения 1(S) и 1(R) в плазме цельной крови. Субъектам вводили дозу рацемической смеси 1(S) и 1(R), равную 25 мг, каждый день в течение 7 дней. На 4 день к дозе добавляют 40 нКи меченого соединения 1(S) или меченого соединения 1(R) (общая дозировка по-прежнему составляла 25 мг рацемической смеси, поскольку количество меченого вещества было менее 0,1 мг, то оно не оказывало существенного влияния на дозировку). Фиг. 11 показывает фармакокинетический профиль для всего меченного радиоактивным изотопом вещества, начиная с того момента, когда вещество с добавлением известного количества аналита было введено на 4 день, и продолжая в течение нескольких дней после этого. Оба соединения в этом испытании быстро достигали значений их максимальных концентраций и начинали неуклонное снижение концентрации в кровотоке. После 1 дня количество соединения 1(R),равное приблизительно 500 нэкв./мл, составляет приблизительно одну четвертую часть концентрации соединения 1(S), которая, в свою очередь, составляет приблизительно 2000 нэкв./мл. Более быстрое снижение концентрации соединения 1(R) в крови по сравнению с соединением 1(S) становится еще более выраженным в момент времени через 50 ч после введения дозы, где концентрация соединения 1(S) в плазме крови находится между 500 и 1000 нэкв./мл в сравнении с концентрацией соединения 1(R), которая составляет приблизительно 10-50 нэкв./мл. Концентрация соединения 1(R) снижается более быстро,чем концентрация соединения 1(S), что отражено посредством более резкого наклона кривой для соединения 1(R) по сравнению с плавным и пологим наклоном для соединения 1(S) на фиг. 11. В табл. 2 сведены вместе значения периода полураспада, Cmax, и AUC (площадь под кривой), полученные в группе обследуемых людей, для соединений 1(S) и 1(R), исходя из данных, представленных на фиг. 11. В момент времени 64 ч соединение 1(S) имеет период полураспада в 6 раз более продолжительный, чем период полураспада для соединения 1(R), которое имеет значение периода полураспада менее 11 ч. Значение Cmax для 1(S) в два раза больше, чем значение Cmax для 1(R), и значение AUC для 1(S) превосходит значение AUC для 1(R) более чем в 4 раза. Эти результаты демонстрируют, что соединение 1(S) имеет неожиданный и очень отличающийся фармакокинетический профиль в сравнении с соединением 1(R) в группе людей после перорального введения дозы. Соединение 1(S) имеет значительно более длительный период полураспада, а также увеличенные значения Cmax и AUC; таким образом, соединение 1(S) производит большее воздействие на людей по сравнению с соединением 1(R). Соединение 1(S), следовательно, дает неожиданные преимущества и над соединением 1(R), и над рацемической смесью, и лечение человека посредством соединения 1(S) может обеспечить более высокий, более стабильный уровень активного лекарственного средства в плазме, чем лечение посредством соединения 1(R) или рацемата, и одновременно снижает воздействие на субъект других веществ или метаболитов 1(R). Таблица 2 Не будучи связанными с теорией, пониженное воздействие соединения 1(R) по сравнению с 1(S) позволяет предположить различие в поглощении организмом и выведении из организма для двух соединений. Согласно измерениям с использованием жидкостной хроматографии в сочетании с массспектрометрией (LC-MS), соединение 1(R) преимущественно выводится с мочой. Также, 1(R), как было показано, имеет больший объем распределения, Vz, и имеет более высокую скорость выделения и более низкую скорость поглощения по сравнению с 1(S). Соединение 1(R) также может быстрее метаболизироваться, чем 1(S). Независимо от причин соединение 1(R) является намного менее доступным в плазме(кровотоке), чем 1(S) при пероральном введении, и соединение 1(S) обеспечивает намного более стабильное воздействие лекарственного средства и более слабое воздействие метаболитов. Еще одним возможным объяснением различия воздействия является то, что соединения 1(R) и 1(S) взаимопревращаются во времени. После введения соединения 1(R), оказывается, что приблизительно 14% соединения 1(R) превращается в 1(S) в плазме крови за 4 ч, тогда как введение 1(S) привело к менее чем 1%-ному превращению 1(S) в 1(R) за 4 ч. Однако такая небольшая величина превращения могла бы объяснить лишь долю различия степеней воздействия in vivo, и другие факторы, такие как селективное выведение соединения 1(R), вероятно, играют основную роль в пониженной степени воздействия 1(R). Различия соединений 1(S) и 1(R) in vivo распространяются на метаболические продукты. Например,после перорального введения однократной дозы либо атропоизомера 1(S), либо 1(R), составляющей 50 мг/кг, брали пробы мочи у крыс и анализировали на предмет метаболитов. Фиг. 12 А и 12 В показывают результаты анализа обнаруженных в моче метаболитов, проведенного посредством жидкостной хроматографии в сочетании с масс-спектрометрией (LC-MS). Крысы, которых подвергали воздействию соединения 1(S), давали, главным образом, одно соединение, представленное максимумом на 13,4 минуте,и другое соединение, представленное намного меньшим максимумом на 14,5 минуте. С другой стороны,аналитические кривые для мочи крыс, которым вводили соединение 1(R), характеризуются тремя основными максимумами на 13,5, 14,4 и на 15,6 минутах и небольшим максимумом на 12,1 минуте. Это демонстрирует то, что соединение 1(R) метаболизируется in vivo с вырабатыванием большего количества метаболических продуктов по сравнению с соединением 1(S) и позволяет предположить, что два атропоизомера не метаболизируются в организме точно одинаковым образом. Фиг. 13A-13D дополнительно иллюстрируют неожиданную стабильность соединения 1(S) in vivo по сравнению с 1(R). Для этих испытаний субъекту-человеку перорально вводят либо меченное радиоактивным изотопом соединение 1(S), либо меченное радиоактивным изотопом соединение 1(R). Пробы плазмы брали у субъекта через 1 ч и через 72 ч после введения и анализировали на предмет содержания меченных радиоактивным изотопом соединений. При проведении анализа использовали HPLC-условия,которые известны для разделения соединения 1(S) (элюирование на приблизительно 21-22 минутах) от 1(R), поэтому за любыми взаимопревращениями этих видов молекул можно было наблюдать. Это также позволяет различить эти два вещества и основные метаболиты, образованные из них in vivo. Меченные радиоактивными изотопами соединения выделяли из плазмы крови человека и анализировали посредством HPLC через 1 ч и через 72 ч после введения любого из двух меченных радиоактивным изотопом соединений, что показано на фиг. 13 А-13D. Для подтверждения идентичности максимумов в качестве стандарта времени удерживания на каждом спектре дается УФ-кривая, но важными данными, которые получают в ходе наблюдения, являются сигналы радиоактивной метки С-14, которые показаны небольшими квадратами, в момент времени удерживания для соединений 1(S), 1(R), и для известных метаболитов этих соединений. На фиг. 13 А имеются два максимума, наблюдаемые как сигнал радиоактивной метки, соответствующие соединению 1(S) (большой пик на приблизительно 22 минуте) и метаболиту (небольшой пик на приблизительно 14 минуте). На фиг. 13 В имеются две доминирующие точки в данных сигналов радиоактивной метки С-14, соответствующие соединению 1(R) на 22 минуте, и метаболиту на 14 минуте. В этом случае уровень метаболита является почти таким же большим, как и уровень соединения 1(R), даже через 1 ч после введения соединения 1(R). Таким образом, соединение 1(S) приводит к образованию меньшего количества метаболитов, чем соединение 1(R), в плазме человека, и остается большей частью неизмененным через 1 ч. В момент времени 72 ч количество метаболитов,образованных из 1(S), по-прежнему меньше, чем количество исходного соединения 1(S), фиг. 13 С. Оказывается, что небольшое количество 1(R) присутствует в этот момент времени, так как можно предположить, что некоторое взаимопревращение 1(S) в 1(R) может протекать in vivo. Для 1(R) в момент времени 72 ч в основном обнаруживают метаболиты и видят очень немного 1(R); фактически, оказывается, что 1(S) может присутствовать в большем количестве, чем 1(R), опять же, если предполагать, что может происходить небольшое взаимопревращение: см. фиг. 13D. Следовательно, относительное содержание метаболита после введения дозы меченного радиоактивным изотопом соединения 1(R) позволяет предположить, что соединение 1(R) метаболизируется в организме человека сравнительно быстро. Значительно более низкие уровни метаболита в пробах плазмы, содержащих соединение 1(S), предполагает более низкие уровни метаболизма, и более высокая концентрация соединения 1(S) через 72 ч после введения показывает, что этот изомер обеспечивает более длительное воздействие однократной дозы. Соединение 1(S) дает преимущества, связанные с более длительным периодом полураспада in vivo,со сниженным количеством вводимой дозы и с увеличенным временем воздействия in vivo. Однако фармакокинетические характеристики для соединения 1(R) также обеспечивают некоторые преимущества при его применении в некоторых ситуациях и для некоторых субъектов. Другой фармакокинетический профиль для соединения 1(R) обеспечивает более медленную доставку соединения 1(S), которое имеет более длительный период полураспада. Например, превращение 1(R) в 1(S), что рассматривалось ранее,может обеспечивать путь доставки с замедленным/отсроченным воздействием соединения 1(S), с укороченным периодом воздействия высокой концентрации активного лекарственного средства в плазме вследствие короткого периода полураспада соединения 1(R). Таким образом, более медленно изменяющийся профиль в начальный момент для соединения 1(R) может быть преимущественным в том случае,когда желательным является лекарственное средство, которое имеет профиль с большей площадью под кривой (AUC), а не лекарственное средство с большим значением Cmax, или в том случае, когда жела- 18019499 тельным является сравнительно быстрое выведение из организма (короткий период полураспада). В связи с вышеизложенным, в некоторых вариантах осуществления соединения, композиции и способы изобретения включают 1(R). В предпочтительных вариантах осуществления особенно для лечения воспалительных состояний или гематологических раковых заболеваний, соединения, композиции и способы изобретения включают 1(S). Хиральное разделение энантиомеров может быть выполнено методами жидкостной хроматографии высокого давления (HPLC), кристаллизации или применения ферментов. В этом документе описывают методы хирального разделения, в которых применяют HPLC для обеспечения соединений изобретения. Например, смеси атропоизомеров формулы 1 могут быть разделены на соединения с формулами 1(S) и 1(R). С целью рассмотрения, разделенные атропоизомеры соединения 1, которые извлекают посредством хроматографического разделения с нормальной фазой и элюируют за время 8,7 и 13,0 мин, что описано в примере 3, будут называться как атропоизомеры соответственно 1(S) и 1(R). Среднему специалисту в данной области будет понятно, что для разделения на индивидуальные атропоизомеры могут быть использованы многие типы приборов, колонок и элюентов. Подходящие приборы для HPLC укомплектовывают и настраивают в соответствии со способами, хорошо известными средним специалистам в данной области. Такой комплект в любом случае включает насос, порт ввода пробы и детектор. Хроматографические колонки могут быть охарактеризованы как колонки с "нормальной фазой" или как колонки с "обращенной фазой". Как правило, колонки с нормальной фазой имеют полярную неподвижную фазу, а колонки с обращенной фазой имеют неполярную неподвижную фазу. Подходящие хиральные колонки могут быть закуплены предварительно заполненными насадкой или могут быть заполнены средним специалистом в данной области. Подходящие хиральные колонки включают хиральные колонки CHIRALPAKIA, IB, AD-H, AS, AD-RH, AS-RH и IC, а также CHIRALCELOD-H, OB-H, OF,OG, OJ-RH и OJ, которые могут быть закуплены в компании Chiral Technologies Inc., 730 SpringdaleDrive, PO Box 564, Exton, Pa. 19341. Композиция для заполнения колонок CHIRALPAKIA представляет собой трис-(3,5-диметилфенилкарбамат)амилозы, иммобилизованный на силикагеле размером 5 мкМ. Среднему специалисту в данной области будет ясно, что многие другие хиральные колонки, закупленные у других поставщиков, могут быть пригодны для разделения изомеров изобретения. Материал для заполнения также может быть закуплен с различным размером бусин. Подходящие размеры бусин для препаративного разделения составляют приблизительно 20 мкм в диаметре или менее. Подходящие размеры бусин для аналитического разделения составляют приблизительно 10 мкм в диаметре или менее. Среднему специалисту в данной области будет понятно, что соответственная подвижная фаза, используемая в методе HPLC, может быть выбрана из различных комбинаций и соотношений растворителей. Подходящую подвижную фазу определяют в соответствии со способами, хорошо известными средним специалистам в данной области. Подвижная фаза может включать органические растворители, такие как алканы, спирты, простые эфиры, хлорированные растворители, такие как вода, и забуференная вода. Неограничивающие примеры органических растворителей включают гексаны, н-гексан, метанол, этанол,бутанол, изобутанол, пропанол, изопропанол (IPA), ацетонитрил, N,N-диметилформамид (DMF), тетрагидрофуран (THF), метил-трет-бутиловый эфир, трихлорметан, дихлорметан, хлороформ, 1,4-диоксан,толуол, ацетон, метилацетат и этилацетат. Для основных или кислотных образцов для оптимизирования хирального разделения в подвижную фазу может быть внедрена добавка. В качестве оснований могут быть использованы первичные амины, такие как диэтиламин (DEA), диизопропиламин, бутиламин и триэтиламин (TEA). Неограничивающие примеры кислот включают серную кислоту, трифторуксусную кислоту, хлористо-водородную кислоту, уксусную кислоту и муравьиную кислоту. Также могут быть использованы другие неорганические добавки в подвижную фазу, такие как KPF6, NaClO4, NaBF4,NaH2PO4. Неограничивающие примеры смесей для подвижной фазы включают смесь метанол/этанол/DEA с соотношением 50:50:0,2; смесь гексаны/этанол/DEA с соотношением 70:30:0,1; смесь гексаны/изопропанол/DEA с соотношением 70:30:0,1; смесь гексаны/изопропанол/DEA с соотношением 40:60:0,06 и смесь вода/ацетонитрил с соотношением 50:50, 60:40 или 70:30. Неограничивающие примеры подвижных фаз, используемых для скрининга основных соединений в обращенно-фазовом варианте, включают смесь борат/ацетонитрил с соотношением 30:70 (рН 9) и смесь 100 мМ водный раствор KPF6/ацетонитрил с соотношением 30:70. Описание аналитических или препаративных хроматографических способов можно увидеть в примерах 2 и 3 соответственно. Относительные эффективности соединений в качестве ингибиторов ферментной активности (или другой биологической активности) могут быть установлены путем определения концентраций, при которых соединение ингибирует активность до заранее заданной степени, затем путем сравнения результатов. Обычно предпочтительно определяют концентрацию, которая ингибирует 50% активности в биохимическом анализе, т.е. 50%-ингибирующая концентрация или "IC50". Определения IC50 могут быть выполнены с использованием обычно применяемых методов, известных в данной области. Как правило,значение IC50 может быть определено путем измерения активности данного фермента в присутствии изу- 19019499 чаемого ингибитора, который берут в различных концентрациях. Экспериментально полученные значения ферментной активности затем наносят на график относительно используемых концентраций ингибитора. Концентрацию ингибитора, которая показывает 50% ферментную активность (в сравнении с активностью в отсутствие какого-либо ингибитора), принимают за значение IC50. Аналогично, другие ингибирующие концентрации могут быть определены с помощью соответственных определений активность. Например, в некоторых заданиях может быть желательно установление 90% ингибирующей концентрации, т.е. IC90."Лечение", как используют в этом документе, относится к предупреждению возникновения нарушения у животного, которое может быть предрасположено к этому нарушению, но у которого еще не выявили наличие такого нарушения; к ингибированию нарушения, например, к замедлению или купированию (прекращению) его развития; к смягчению действия симптомов нарушения, например, к вызыванию его обратного развития или ликвидации; или к улучшению состояния, т.е. к снижению тяжести симптомов, сопутствующих этому нарушению. "Нарушение", как подразумевают, охватывает внутренние нарушения, заболевания, медицинские показания, синдромы и т.п., без ограничения. Способы изобретения охватывают различные методы лечения субъекта-животного, предпочтительно млекопитающего, более предпочтительно примата и еще более предпочтительно человека. В число млекопитающих, которые могут быть подвергнуты лечению, входят, например, люди, домашние животные (комнатные животные-питомцы), в том числе собаки и кошки; сельскохозяйственные животные, в том числе рогатый скот, лошади, овцы, свиньи и козы; лабораторные животные, в том числе крысы, мыши, кролики, морские свинки и нечеловекообразные приматы; и виды животных, обитающих в зоопарке. Немлекопитающие включают, например, виды птиц, виды рыб, виды рептилий и земноводных. Как правило, любой субъект, которому могло бы быть лучше от приема соединений и композиций изобретения,подходит для назначения способа изобретения. Методы для составления и введения фармацевтических композиций могут быть обнаружены в Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co, Easton, PA, 1990. Фармацевтические композиции настоящего изобретения могут быть изготовлены с использованием любого обычно применяемого способа, например с использованием смешения, растворения, гранулирования, изготовления драже, отмучивания, эмульгирования, инкапсулирования, захватывания, формования волокна из расплава, сушки с распылением или процессов лиофилизации. Оптимальный фармацевтический состав может быть определен специалистом в данной области в зависимости от пути введения и желательной дозировки. Такие составы могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и на скорость клиренса введенного средства. В зависимости от состояния, которое подлежит вылечиванию, эти фармацевтические композиции могут быть составлены и введены системно или локально. Фармацевтические композиции составляют так, чтобы они содержали подходящие фармацевтически приемлемые носители и необязательно могли включать в себя эксципиенты и вспомогательные вещества, которые облегчают технологическую переработку активных соединений в препараты, которые могут быть использованы фармацевтически. Способ введения, как правило, будет определять природу носителя. Например, составы для парентерального введения могут содержать водные растворы активных соединений в водорастворимой форме. Носители, подходящие для парентерального введения, могут быть выбраны из физиологического раствора, забуференного физиологического раствора, декстрозы,воды и других физиологически совместимых растворов. Предпочтительные носители для парентерального введения представляют собой физиологически совместимые буферные растворы, такие как раствор Хэнка, раствор Рингера или физиологически совместимый забуференный физиологический раствор. Для введения в ткань или в клетку в составе используют проникающие вещества (пенетранты), подходящие для проникновения в конкретный барьер. Такие проникающие вещества, как правило, известны в данной области. Для препаратов, содержащих белки, состав может включать стабилизирующие вещества, такие как полиолы (например, сахарозу), и/или поверхностно-активные вещества (например, неионогенные поверхностно-активные вещества) и т.п. Альтернативно, составы для парентерального применения могут содержать дисперсии или суспензии активных соединений, приготовленные в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как сезамовое масло, и синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно, суспензия также может содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений, что позволяет приготовить высококонцентрированные растворы. Водные полимеры, которые обеспечивают рН-чувствительную солюбилизацию и/или замедленное высвобождение активного вещества, также могут быть использованы в покрытиях или в матричных структурах, например метакриловые полимеры, такие как серии EUDRAGIT, доступные в компании Rohm America Inc. (Piscataway, NJ). Также могут быть использованы эмульсии, например дисперсии типа "масло-в-воде" и типа "вода-вмасле", необязательно стабилизированные эмульгирующим агентом или дисперсантом (поверхностноактивные вещества; сурфактанты). Суспензии могут содержать суспендирующие вещества, такие как этоксилированные изостеариловые спирты, полиоксиэтиленовые сложные эфиры сорбита и сорбитана,микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, трагакантовая камедь и их смеси. Липосомы, содержащие активное вещество, также могут быть применены для парентерального введения. Липосомы, как правило, получают из фосфолипидов или других липидных веществ. Композиции в липосомной форме также могут содержать другие ингредиенты, такие как стабилизаторы, консерванты, эксципиенты и т.п. Предпочтительные липиды включают фосфолипиды и фосфатидил-холины (лецитины), и те и другие природные и синтетические. Способы образования липосом известны в данной области. См., например, публикацию Prescott (Ed.), Methods in Cell Biology, Vol. XIV, p. 33, AcademicPress, New York (1976). Фармацевтические композиции, содержащие вещество в дозировках, приемлемых для перорального введения, могут быть составлены с использованием фармацевтически приемлемых носителей, хорошо известных в данной области. Препараты, составленные для перорального введения, могут находиться в форме таблеток, пилюль, капсул, кашет, драже, крахмальных облаток, драже, лекарственных леденцов,жидкостей, гелей, сиропов, шлама/кашицы, эликсиров, суспензий или порошков. Для иллюстрации фармацевтические препараты для перорального применения могут быть получены путем соединения активных соединений с твердым эксципиентом, необязательно путем размалывания/растирания получающейся в результате смеси, и путем переработки смеси в гранулы, после добавления подходящих вспомогательных веществ, если желательно, с получением таблеток или сердцевин драже. Пероральные составы могут применять жидкие носители, сходные по типу с жидкими носителями, описанными для парентерального применения, например забуференные водные растворы, суспензии и т.п. Предпочтительные пероральные составы включают таблетки, драже и желатиновые капсулы. Эти препараты могут содержать один или более эксципиентов, которые включают, без ограничения:b) связующие вещества, такие как алюмосиликат магния, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал и т.д.;c) целлюлозные вещества, такие как метилцеллюлоза, гидроксипропилметилцеллюлоза и карбоксиметилцеллюлоза натрия, поливинилпирролидон, камеди, такие как аравийская камедь и трагакантовая камедь, и белки, такие как желатин и коллаген;d) распадающиеся или солюбилизирующие вещества, такие как сшитый поливинилпирролидон,крахмалы, агар, альгиновая кислота или ее соль, например альгинат натрия, или шипучие композиции;e) лубриканты, такие как диоксид кремния, тальк, стеариновая кислота или ее магниевая или кальциевая соль, и полиэтиленгликоль;g) окрашивающие вещества или пигменты, например, для идентифицирования продукта или для охарактеризовывания количества (дозировки) активного соединения; иh) другие ингредиенты, такие как консерванты, стабилизаторы, вещества, способствующие набуханию, эмульгирующие вещества, вещества, способствующие растворению, соли для регулирования осмотического давления, и буферные растворы. Желатиновые капсулы включают капсулы "push-fit", изготовленные из желатина, а также мягкие,закрытые капсулы, изготовленные из желатина и покрытия, такого как глицерин или сорбит. Капсулы"push-fit" могут содержать активный(ые) ингредиент(ы), смешанный(е) с наполнителями, связующими веществами, лубрикантами и/или стабилизаторами и т.д. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин, или жидкий полиэтиленгликоль со стабилизаторами или без таковых. Сердцевины драже могут быть снабжены подходящими покрытиями, такими как концентрированные растворы сахара, которые также могут содержать гуммиарабик, тальк, поливинилпирролидон, гель-карбопол, полиэтиленгликоль,и/или диоксид титана, растворы для получения глазури, и подходящие органические растворители или смеси растворителей. Фармацевтическая композиция может быть обеспечена в форме фармацевтически приемлемой соли соединения изобретения. Соли часто являются более растворимыми в водных или других протонных растворителях, чем соответствующие формы свободных кислот или оснований. Фармацевтически приемлемые соли хорошо известны в данной области. Соединения, которые содержат кислотные фрагменты,могут образовывать фармацевтически приемлемые соли с подходящими катионами. Подходящие фармацевтически приемлемые катионы включают, например, катионы щелочных металлов (например, натрий или калий) и катионы щелочно-земельных металлов (например, кальций или магний). Соединения изобретения, которые содержат основные фрагменты, могут образовывать фармацевтически приемлемые соли присоединения кислот посредством подходящих кислот. Например, Berge, etal., J. Pharm. Sci. (1977), 66:1, подробно описывают фармацевтически приемлемые соли. Соли могут быть получены in situ во время конечного выделения и очистки соединений изобретения или отдельно посредством реакционного взаимодействия функциональной группы свободного основания с подходящей кислотой. Репрезентативные соли присоединения кислот включают, но ими не ограничиваются, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорно-кислая соль,камфоросульфонат, циннамат, диглюконат, формиат, глицерофосфат, гемисульфат, гептаноат, гексаноат,фумарат, гиппурат, гидроксиацетат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат(изотионат), лактат, малеат, малонат, манделат, метансульфонат или сульфат, никотинат, 2 нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, пируват, сукцинат, тартрат, тиоцианат, фосфат или гидрофосфат, глутамат, бикарбонат, салицилат, пара-толуолсульфонат и ундеканоат. Примеры неорганических кислот включают хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту, но не ограничиваются этим. Соли присоединения оснований могут быть получены in situ во время конечного выделения и очистки соединений изобретения или отдельно путем реакционного взаимодействия фрагмента, содержащего карбоновую кислоту, с подходящим основанием, таким как гидроксид, карбонат, или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком или с органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли присоединения основания включают катионы на основе щелочных металлов или щелочно-земельных металлов, такие как литий, натрий,калий, кальций, магний, алюминий и т.п., и нетоксичные четвертичные аммониевые и амино-катионы,включающие аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, этиламмоний, диэтиламмоний, триэтиламмоний и т.п., но не ограничиваются этим. Другие репрезентативные органические амины, полезные в получении солей присоединения основания,включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и т.п. Основные азотсодержащие группы могут быть кватернизированы посредством таких веществ, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутил-хлориды, бромиды и йодиды; диалкилсульфаты, подобные диметил-, диэтил-, дибутил- и диамил-сульфатам, длинноцепочечные алкилгалогениды, такие как децил-, лаурил-, миристил- и стеарил-хлориды, бромиды и йодиды; арилалкилгалогениды, такие как бензил- и фенетил-бромиды; и другие. Посредством этого получают продукты, имеющие модифицированную растворимость и диспергируемость. Сольваты для целей изобретения относятся к тем формам соединений изобретения, которые в твердом или в жидком состоянии образуют комплекс посредством координации с молекулами растворителя. Неограничивающие примеры растворителя представляют собой воду, ацетон, метанол, этанол и уксусную кислоту. Соединения изобретения могут быть получены в форме пролекарств, т.е. в защищенных формах,которые высвобождают соединения изобретения после введения субъекту. Обычно, защитные группы гидролизуются в жидкостях организма, например в кровотоке, с высвобождением в результате этого активного соединения, или окисляются или восстанавливаются in vivo с высвобождением активного соединения. Рассмотрение пролекарств можно найти в публикации Smith and Williams Introduction to thePrinciples of Drug Design, Smith, H.J.; Wright, 2nd ed., London (1988). Выбранные состав и путь введения будут адаптированы к индивидуальному субъекту, к природе состояния, которое подлежит вылечиванию у субъекта, и, как правило, к заключению лечащего врача. В некоторых вариантах осуществления соединения изобретения вводят посредством инъекции,наиболее предпочтительно посредством внутривенной инъекции, но также посредством подкожной или интраперитонеальной инъекции и т.п. Дополнительные парентеральные пути введения включают внутримышечную и внутрисуставную инъекцию. Для внутривенного или парентерального введения соединения составляют в подходящей жидкой форме с эксципиентами, при необходимости. Композиции могут содержать липосомы или другие подходящие носители. Для внутривенной инъекции раствор делают изотоническим с использованием стандартных препаратов, таких как раствор Хэнка. Кроме инъекции, также могут быть использованы другие пути введения. Соединения могут быть введены в состав с получением таблеток, капсул, сиропов, порошков или других подходящих форм для перорального введения. Посредством использования подходящих эксципиентов эти соединения также могут быть введены через слизистую оболочку с использованием суппозиториев или интраназальных спреев. Трансдермальное введение также может быть выполнено путем использования подходящих проникающих веществ и путем контролирования скорости высвобождения. Соединения могут быть введены в виде однократной дозы, в виде дозы, вводимой в течение длительного периода времени, в виде дозы для внутривенного (i.v.) или трансдермального введения, или в виде дозы, вводимой в несколько приемов. Дозировки могут быть выше в том случае, когда соединения вводят перорально или трансдермально в сравнении, например, с внутривенным (i.v.) введением. Подходящие диапазоны дозировок для соединений изобретения варьируются в соответствии с этими предположениями, но, как правило, соединения вводят в диапазоне приблизительно 0,1 мкг/кг-5 мг/кг массы тела; предпочтительно диапазон составляет приблизительно 1-300 мкг/кг массы тела; более предпочтительно приблизительно 10-100 мкг/кг массы тела. Для обычного 70-килограммового человека, таким образом, диапазон дозировок составляет приблизительно 0,7 мкг-350 мг; предпочтительно приблизительно 700 мкг-21 мг; наиболее предпочтительно приблизительно 700 мкг-10 мг. В некоторых вариан- 22019499 тах осуществления соединение вводят в диапазоне 5-15 мг/кг массы тела. В некоторых вариантах осуществления соединение вводят в дозе, составляющей менее чем 11 мг/кг массы тела. В некоторых вариантах осуществления соединение вводят в дозе, составляющей 10 мг/кг массы тела. В некоторых вариантах осуществления подходящая дозировка составляет количество между 1-500 мг. В некоторых вариантах осуществления подходящая дозировка составляет количество между 1-250 мг. В некоторых вариантах осуществления подходящая дозировка составляет количество между 1-100 мг. В некоторых вариантах осуществления подходящая дозировка составляет количество между 1-50 мг. В некоторых вариантах осуществления подходящая дозировка составляет количество между 1-25 мг. В некоторых вариантах осуществления подходящая дозировка составляет количество, выбранное из группы, состоящей из 10, 17,50, 75, 100, 125, 200, 250 и 400 мг, где следует учитывать, что небольшие отклонения (+/- 10%), как правило, являются допустимыми. В некоторых вариантах осуществления подходящую дозировку вводят перорально. Композиции, содержащие соединение изобретения, составленные с фармацевтически приемлемым носителем, могут быть приготовлены, помещены в соответствующую упаковку и этикетированы на предмет лечения указанного состояния. В связи с вышеизложенным также предусмотрено изделие, такое как упаковка, содержащая лекарственную форму соединения изобретения, и этикетка, содержащая инструкции для применения соединения. Наборы также предусмотрены. Например, набор может включать лекарственную форму фармацевтической композиции и листок-вкладыш в упаковке, содержащий инструкции для применения композиции в лечении медицинского показания. В любом случае показания, указанные на этикетке, могут включать лечение воспалительного состояния. Если не определено иначе, все термины, используемые в данной области, обозначения и другие научные термины или терминология, используемые в данном документе, как подразумевают, имеют значения, обычно предполагаемые специалистами данной области, к которым это изобретение имеет отношение. В некоторых случаях термины с обычно понимаемыми значениями определяют в этом документе для ясности и/или для справочного материала, и включение таких определений в этот документ не следует обязательно истолковывать как представление существенного отличия от того, что обычно понимают в данной области. Многие методы и методики, описанные или упоминаемые в этом документе,хорошо понятны и общеприменимы при использовании специалистами данной области традиционной методологии. При необходимости, методики, включающие применение коммерчески доступных наборов и реагентов, как правило, выполняют в соответствии с определяемыми производителем протоколами и/или параметрами, если не отмечено иное. Рассмотрение общих способов, данных в этом документе, предназначено лишь с иллюстративными целями. Другие альтернативные способы и варианты осуществления будут очевидны специалистам данной области после прочтения этого раскрытия. Группу признаков, связанных союзом "или", не следует прочитывать как требование общей исключительности в той группе, и скорее следует также прочитывать как "и/или", если не установлено в явно выраженной форме иное. Хотя признаки, элементы или компоненты изобретения могут быть описаны или заявлены в форме единственного числа, форма множественного числа, как предусматривается, попадает в объем изобретения, если не установлено однозначно и явным образом ограничение формой единственного числа. Следующие примеры приведены для иллюстрации изобретения, а не для его ограничения. Пример 1. Получение 2-6-амино-9 Н-пурин-9-ил)метил)-5-метил-3-о-толилхиназолин-4(3H)-она. Схема синтеза для получения 2-6-амино-9 Н-пурин-9-ил)метил)-5-метил-3-о-толилхиназолин 4(3H)-она, 1, показана на фиг. 1. 2-Амино-6-метилбензойную кислоту, 1", подвергают реакции с 2 хлорацетилхлоридом с получением 2-(-2-хлорацетамидо)-6-метилбензойной кислоты, 2". Реакция с отолуидином и фосфорил-трихлоридом дает циклизованное промежуточное соединение, 3". Дальнейшая реакция с аденином, в который введены ди-трет-бутоксикарбонилзащитные группы, дает продукт с третбутоксикарбонил-защитными группами, 4", с которого удаляют защитные группы, что приводит к 2-6 амино-9 Н-пурин-9-ил)метил)-5-метил-3-о-толилхиназолин-4 (3H)-ону, 1. Атропоизомеры соединения 1 могут быть разделены с помощью жидкостной хроматографии высокого давления (HPLC). Промежуточные соединения 3" и 4" также содержат атропоизомеры и разделение обоих из этих промежуточных соединений с помощью HPLC также может быть выполнено до последующих стадий соответственно c и d. Пример 2. Разработка метода аналитической жидкостной хроматографии высокого давления (HPLC) для разделения атропоизомеров. Этот пример описывает разработку аналитических методов HPLC для разделения энантиомеров формулы 1, 2-6-амино-9 Н-пурин-9-ил)метил)-5-метил-3-о-толилхиназолин-4(3H)-она, 1. Для того чтобы разработать и оптимизировать разделение различных атропоизомеров, средний специалист в данной области может экспериментировать, меняя хроматографические параметры, такие как выбор колонки,подвижной фазы и скорости потока. Описаны методы разделения для колонок с нормальной фазой и об- 23019499 ращенной фазой. Нормальная фаза. В этом примере энантиомерную смесь соединения 1 первоначально пропускают через колонки CHIRALPAKIA, IB, AD-H, AS и IC, а также через колонки CHIRALCELOD-H и OJ, с использованием в качестве подвижных фаз на основе полярных органических растворителей смеси метанол/этанол/DEA с соотношением 50:50:0,1 и смеси ацетонитрил/DEA с соотношением 99,9:0,1. Частичное разделение атропоизомеров наблюдают на колонке CHIRALPAKAD-H при использовании подвижной фазы метанол/этанол/DEA с соотношением 50:50:0,1. Для того чтобы определить, могло бы это частичное разделение быть улучшено, колонку элюируют смесью этанол/DEA. Полное разделение получают с использованием этих условий, где альфа составляет 1,66, и время анализа (время записи хроматограммы) составляет приблизительно 20 мин. Подбор также выполняют с пропусканием энантиомерной смеси 1 через тот же набор колонок, а также через колонки CHIRALCELOB-H, OF и OG, с использованием в качестве подвижных фаз смеси гексаны/этанол/DEA с соотношением 70:30:0,1 и смеси гексаны/изопропанол/DEA с соотношением 70:30:0,1. Положительный результат по разделению получается на колонке IA с подвижной фазой гексаны/изопропанол/DEA с соотношением 70:30:0,1; однако время анализа, равное 28 минутам, является немного долгим. Время анализа снижают до 15 мин с использованием подвижной фазы гексаны/изопропанол/DEA с соотношением 40:60:0,06. Такое разделение оказывается лучше разделения, достигаемого на колонке AD-H, с использованием подвижной фазы этанол/DEA. Хроматограмма атропоизомеров соединения 1 на колонке IA проиллюстрирована на фиг. 2 а. Таким образом, конечные условия для разделения энантиомерной смеси соединения 1 включают использование колонки CHIRALPAKIA с размерами 250 мм (длина)4,6 мм (внутренний диаметр). Образец растворяют в этаноле и используют подвижную фазу смесь гексаны/изопропанол/диэтиламин с соотношением 40:60:0,06. Параметры потока представляют собой следующее: скорость потока 1,0 мл/мин, температура 25 С, и мониторинг продукта с помощью УФ-детектора осуществляют на длине волны 215 нм. Время анализа составляет приблизительно 15 мин. Два основных пика на 7,4 минутах и на 12,3 минутах представляют первый и второй атропоизомеры соединения 1, 1(S) и 1(R) соответственно. Обращенная фаза. Образец энантиомерной смеси 2-6-амино-9 Н-пурин-9-ил)метил)-5-метил-3-отолилхиназолин-4(3H)-она, 1, объединяют в ацетонитриле и используют для подбора. Образец пропускают через колонки CHIRALPAKAD-RH, AS-RH, IB, IC и CHIRALCELOJ-RH, элюируют подвижными фазами: смесью борат/ацетонитрил с соотношением 30:70 (рН 9) и смесью 100 мМ водный раствор KPF6/ацетонитрил с соотношением 30:70. Частичное разделение наблюдают для колонки IC с обеими подвижными фазами и полное разделение до нулевой линии наблюдают для обеих подвижных фаз с использованием колонки OJ-RH. Предпринимают усилия для улучшения разделения, что продемонстрировано на колонке OJ-RH. Колонку элюируют смесью вода/ацетонитрил с соотношениями 50:50, 60:40 и 70:30. В этих экспериментах, для того чтобы определить, действительно ли необходим такой буферный раствор, в подвижную фазу не добавляют никакой буферный раствор. Исходя из результатов, очевидно то, что никакой буферный раствор не нужен для этого разделения, поскольку все три подвижные фазы на основе смеси вода/ацетонитрил производят хорошие разделения на колонке OJ-RH. Из этих условий рекомендуют разделение на колонке OJ-RH со смесью вода/ацетонитрил с соотношением 60:40, хотя разделение смесью вода/ацетонитрил с соотношением 50:50 является вполне хорошим, при условии, что отсутствуют пики интерференции при элюировании близко к фронту растворителя. Хроматограмма разделения атропоизомеров на колонке OJ-RH с использованием смеси вода/ацетонитрил с соотношением 60:40 проиллюстрирована на фиг. 2b. Два основных пика на 4,7 минутах и на 7,1 минутах представляют два атропоизомера соединения 1. Энантиомерную смесь полностью разделяют методами с использованием колонок с нормальной фазой и с обращенной фазой (нормальная фаза: CHIRALPAKIA, 250 мм (длина)4,6 мм (внутренний диаметр), смесь гексаны/IPA/DEA с соотношением 40:60:0,06, скорость потока 1,0 мл/мин, 25 С, 215 нм; Обращенная фаза: CHIRALCELOJ-RH, 150 мм (длина)4,6 мм (внутренний диаметр), смесь вода/ацетонитрил с соотношением 61:40, скорость потока 0,8 мл/мин, 25 С, 230 нм). Наблюдают то, что два пика, разделенные методом с нормальной фазой, элюируются в обратном порядке в методе с обращенной фазой. Это определяют после того, как соединение первого пика, элюированное на 7,4 минутах, на нормальной фазе, выделяют и подвергают анализу методом с обращенной фазой. Это выделенное вещество элюируется за время, соответствующее второму пику, за 7,1 минут, в методе с обращенной фазой,фиг. 2b. Пример 3. Разделение с помощью препаративной жидкостной хроматографии высокого давления (HPLC) и абсолютная стереохимическая конфигурация. Этот пример демонстрирует разделение двух атропоизомеров соединения 1 с использованиемHPLC. Разрабатывают аналитический метод и небольшое количество образца энантиомерной смеси растворяют в изопропаноле в концентрации 1,45 мг/мл, и 5 мкл вводят в колонку с нормальной фазой с ис- 24019499(длина), смесь гексаны/IPA/DEA с соотношением 40/60/0,1, скорость потока 0,8 мл/мин, температура 30 С. Два пика имеют разрешение на 8,7 минутах и на 13,0 минутах (фиг. 3 А). Для идентификации композиций разделенных продуктов используют эти аналитические условия и HPLC-кривую. 2,80 г соединения 1 разделяют на препаративной колонке CHIRALPAKIA с использованием подвижной фазы гексаны/IPA/DEA с соотношением 40/60/0,1 при комнатной температуре и с использованием при детектировании длины волны 275 нм. Выделяют энантиомеры, 1(S) и 1(R), которые соответствуют первому и второму пикам элюирования из колонки соответственно. 1,24 г первого элюированного энантиомера, атропоизомера 1(S), выделяют и анализируют с помощью аналитического метода, описанного выше (0,96 мг в 0,8 мл IPA). HPLC-кривая, показанная на фиг. 3 В, имеет основной пик на 8,7 минутах и указывает на 99,0% энантиомерный избыток (е.е.). 1,38 г второго элюированного энантиомера, атропоизомера 1(R), выделяют и анализируют с помощью того же самого аналитического метода (1,72 мг в 1,0 мл IPA), описанного выше. HPLC-кривая, показанная на фиг. 3 С, имеет основной пик на 13,0 минутах и указывает на 98,8% энантиомерный избыток(е.е.). Для целей обсуждения, разделенные атропоизомеры соединения 1, которые выделяют посредством хроматографического разделения с нормальной фазой и элюируют за время 8,7 и 13,0 минут, что описано в этом примере, будут называться как атропоизомеры 1(S) и 1(R) соответственно. Абсолютная конфигурация каждого выделенного соединения была выяснена из данных по рентгеноструктурной кристаллографии. Первый пик, который получают при элюировании и который был отнесен S-конфигурации, показан как соединение 1(S), и второй пик, который получают при элюировании и который был отнесен R-конфигурации, показан как соединение 1(R). Пример 4. Активность соединения 1, 1(S) и 1(R) in vitro. Этот пример демонстрирует активность соединения 1, 1(S) и 1(R) in vitro в отношении р 110 альфа-,р 110 бета-, р 110 гамма- и р 110 дельта-изоформ. Активность соединения 1 и атропоизомеров, 1(S) и 1(R), in vitro имеет аналогичные профили в ингибировании различных изоформ p110, что показано на фиг. 5 А и 5 В. Все три соединения проявляют селективное ингибирование р 110 как в биохимическом (фиг. 5 А), так и в клеточном анализах (фиг. 5 В). Хотя их эффективность (действенность) in vitro, как оказывается, является аналогичной, однако существуют неожиданные различия in vivo, наблюдаемые для 1(S) и 1(R), которые обнаружены в фармакокинетических исследованиях, в основном относящиеся к увеличенному воздействию 1(S) и к сниженному воздействию 1(R), производимому на субъект. Пример 5. Концентрация 1(S) и 1(R) в плазме крови крыс, собак и людей. В этом примере отслеживают концентрацию соединения 1(S) и соединения 1(R) в плазме крови обследуемых крыс, собак и людей во времени. Для выполнения фармакокинетических исследований, в соединение 1 вводят радиоактивный изотоп с использованием 14 С в ортометильную группу фенила в положении 3 хиназолинового кольца. Меченное радиоактивным изотопом соединение 1 Меченые рацемическую смесь или разделенные атропоизомеры вводят обследуемым крысам, собакам и людям посредством пероральных и внутривенных (i.v.) путей. Соединения растворяют в PEG 100(полиэтиленгликоль) с тем, чтобы никакое различие в скоростях растворения не могло бы повлиять на фармакокинетический профиль соединений. Незначительные различия в растворимостях для соединений 1(S) и 1(R) наблюдают в разнообразных водных растворах, что суммировано на фиг. 4. После введения соединения у субъектов отбирают плазму крови с течением времени и оценивают аналитическими методами HPLC, разработанными для идентифицирования соединения 1(S) или соединения 1(R), присутствующего в пробе, и для измерения концентраций таковых. Наблюдают, что изомер с наибольшим относительным содержанием, измеренный в плазме, представляет собой соединение 1(S), которое обусловливает 70-80% воздействия на субъект. Фиг. 6 показывает концентрацию 1(S) и 1(R) в плазме крови в течение 24 ч после перорального введения крысам-самкам однократной дозы рацемического соединения 1, составляющей 50 мг/кг. По истечении 4 ч после введения дозы концентрация 1(S) постоянно увеличивается в крови, и по истечении 8 ч после введения дозы средняя концентрация 1(R) приблизительно составляет одну четверть концентрации 1(S). Это демонстрирует различие воздействия 1(S) и 1(R) in vivo при пероральном введении крысам, где субъект имеет увеличенное воздействие 1(S) по сравнению с 1(R). Фиг. 7 показывает концентрацию 1(S) и 1(R) в плазме крови в течение 24 ч после перорального введения собакам-самкам однократной дозы рацемического соединения 1, составляющей 50 мг/кг. Приблизительно через 1 ч после введения дозы достигается максимальная концентрация соединений 1(S) и 1(R). В тот момент времени концентрация 1(R) составляет менее половины концентрации соединения 1(S). Это демонстрирует различие воздействия соединений 1(S) и 1(R) in vivo при пероральном введении собакам, где субъект имеет увеличенное воздействие соединения 1(S) по сравнению с соединением 1(R). Эти большие различия в фармакокинетическом поведении не являются предсказуемыми. Фиг. 8 показывает концентрацию соединений 1(S) и 1(R) в плазме крови в течение 72 ч после перорального введения обследуемым людям однократной дозы рацемического соединения 1, составляющей 100 мг. Через 2 ч после введения дозы достигается максимальная концентрация соединений 1(S) и 1(R). В момент времени достижения максимальных концентраций концентрация соединения 1(R) составляет менее половины концентрации соединения 1(S), которая обусловливает приблизительно 70% воздействия на животное. Хотя концентрации обоих соединений постоянно уменьшаются после того момента,через 72 ч после введения дозы концентрация соединения 1(S) более чем в 10 раз превышает концентрацию соединения 1(R). Это демонстрирует неожиданное различие воздействия соединений 1(S) и 1(R) invivo при пероральном введении людям, где субъект имеет увеличенное воздействие соединения 1(S) по сравнению с соединением 1(R). Кроме того, оказывается, что период полураспада соединения 1(S) выходит за пределы момента времени 72 ч. Период полураспада соединения 1(S), составляющий несколько дней, у людей превышает период полураспада у собак. Для сравнения, период полураспада соединения 1(R) составляет около 9 ч. Длительный период полураспада соединения 1(S) у людей предусматривает более низкую дозировку введения. Введение сниженных дозировок также может снижать, при наличии таковых, нежелательные побочные эффекты соединения на субъект и обеспечивает преимущество над введением рацемической смеси, или над введением соединения 1(R). Пример 6. Пероральное введение 1(S) и 1(R) крысам в сравнении с внутривенным введением. В этом примере проводят сравнение перорального и внутривенного введения соединений 1(S) и 1(R) крысам. Однократную дозу соединений 1(S) или 1(R) (1,5 мг/кг) вводят либо в виде однократной болюсной внутривенной дозы (фиг. 9 А), либо в виде пероральной дозы (фиг. 9 В) крысам-самкам. Концентрацию как соединения 1(S), так и соединения 1(R) в плазме крови измеряют в различные моменты времени в течение периода времени 24 ч после введения. Фиг. 9 показывает концентрацию соединений 1(S) и 1(R) в плазме крови в течение периода времени 24 ч после введения однократной дозы соединения 1(S) или соединения 1(R) (1,5 мг/кг) либо в виде однократной болюсной внутривенной дозы 1(S) (фиг. 9 А), либо в виде пероральной дозы (фиг. 9 В) крысамсамкам. В исследовании с внутривенным введением в момент времени 4 ч уровень содержания соединения 1(R) составляет приблизительно одну пятую часть концентрации соединения 1(S). В момент времени 24 ч концентрация обоих соединений является очень низкой и находится в пределах экспериментальной ошибки. Концентрация соединения 1(S) в плазме крови крыс, которым соединения были введены перорально, как показано, сильно превышает концентрацию 1(R) в момент времени 12 ч. Это демонстрирует различие воздействия соединения 1(S) и соединения 1(R) in vivo как при внутривенном введении, так и при пероральном введении крысам, где субъект имеет увеличенное воздействие соединения 1(S) в сравнении с соединением 1(R). Пример 7. Фармакокинетические параметры для соединений 1(S) и 1(R) у крыс после введения однократной внутривенной дозы. В этом примере проводят сравнение фармакокинетических параметров для соединений 1(S) и 1(R) у крыс-самок Sprague Dawley (SD) после введения им однократной внутривенной дозы. Крысам SD вводят однократную болюсную внутривенную дозу соединения 1(S) (1,5 мг/кг), соединения 1(R) (1,5 мг/кг) или соединения 1 (3 мг/кг), и в течение времени измеряют содержание соединений, присутствующее в субъекте. Основываясь на этих данных, вычисляют фармакокинетические параметры, которые сведены вместе в табл. 3. Наиболее примечательно то, что период полураспада соединения 1(R) у крыс приблизительно в 2,8 раза превышает период полураспада как атропоизомера 1(S), так и рацемической смеси 1. Соединение 1(R) имеет значение объема распределения в терминальной фазе выведения (Vz), составляющее 14833 мл/кг, которое приблизительно в 2,6 раза превышает значение Vz как для соединения 1(S), так и для рацемической смеси. Таблица 3 Пример 8. Фармакокинетические параметры для соединений 1(S) и 1(R) у людей после введения однократной пероральной дозы. В этом примере проводят сравнение фармакокинетических параметров для соединений 1(S) и 1(R) у людей после введения им однократной пероральной дозы рацемической смеси. Выполняют исследования с введением двух доз. Людям перорально вводят однократную, пероральную дозу рацемической смеси 1(100 мг) и в течение периода времени 72 ч измеряют уровни концентраций каждого из атропоизомерных соединений в плазме крови. В другом исследовании людям перорально вводят однократную, пероральную дозу рацемической смеси 1 (10 мг) и в течение периода времени 120 ч измеряют уровни концентраций каждого из атропоизомерных соединений в плазме крови. Фиг. 10 А и 10 В показывают кривые концентрации соединений 1(S) и 1(R) в плазме крови, нанесенные в зависимости от периода времени, равного 72 ч, после введения однократной, пероральной дозы индивидуальных атропоизомеров, составляющей 100 мг. Максимальная концентрация соединения 1(S) в 2 раза превышает максимальную концентрацию для соединения 1(R). Хотя концентрация соединений в плазме крови снижается в течение периода времени 72 ч, различие в концентрации двух соединений сохраняется, если дополнительно не увеличивается. Оказывается, что такое различие по концентрации соединений в плазме крови увеличивается, так как концентрация соединения 1(S) снижается более постепенно во времени, тогда как соединение 1(R), оказывается, должно быть удалено из крови относительно более быстро. При введении дозы 10 мг максимальная концентрация соединения 1(S) в плазме крови по-прежнему приблизительно в два раза больше максимальной концентрации соединения 1(R), см. фиг. 10C и 10D. Пример 9. Меченные радиоактивными изотопами соединения 1(S) и 1(R) в плазме крови человека. В этом примере проводят сравнение концентрации меченных радиоактивными изотопами соединений 1(S) и 1(R) в плазме людей в середине режима введения суточной дозы. Обследуемым людям вводят дозу 25 мг рацемической смеси соединений 1(S) и 1(R) каждый день в течение 7 дней. На 4 день в дозу добавляют 40 нКи меченного радиоактивным изотопом соединения 1(S) или меченного радиоактивным изотопом соединения 1(R) (общая дозировка по-прежнему составляет 25 мг рацемической смеси, поскольку количество меченого вещества составляет менее чем 0,1 мг, поэтому оно не влияет существенно на дозировку). С этого момента времени отбирают пробы плазмы крови у субъекта во времени и затем определяют и количественно оценивают меченное радиоактивным изотопом соединение. Фиг. 11 отражает концентрацию меченных 14 С-изотопом соединений 1(S) и 1(R) в плазме цельной крови. Фиг. 11 показывает фармакокинетический профиль для всего меченного радиоактивным изотопом вещества, начиная с того момента, когда на 4 день вводят вещество с добавлением известной концентрации аналита, и продолжая в течение нескольких дней после того момента. Оба соединения в этом испытании быстро достигают значений их максимальных концентраций и начинают устойчивое снижение концентраций в кровотоке. По истечении 1 дня количество соединения 1(R), приблизительно 500 нэкв./мл, резко падает до приблизительно одной четверти концентрации соединения 1(S), которая составляет приблизительно 2000 нэкв./мл. Более быстрое снижение концентрации соединения 1(R) в крови по сравнению с соединением 1(S) далее проявляется в момент времени 50 ч после введения дозы, где концентрация соединения 1(S) в плазме крови находится между 500 и 1000 нэкв./мл в сравнении с концентрацией соединения 1(R), которая составляет приблизительно 10-50 нэкв./мл. Концентрация соединения 1(R) снижается более быстро, чем концентрация соединенияl(S), что показано более резким наклоном кривой для 1(R) в сравнении с более постепенным и плавным наклоном кривой для 1(S) на фиг. 11. В табл. 4 сведены вместе значения периода полураспада, Cmax и значения AUC у людей для соединений 1(S) и 1(R), исходя из данных, приведенных на фиг. 11. В момент времени 64 ч соединение 1(S) имеет период полураспада в 6 раз более долгий, чем период полураспада соединения 1(R), которое имеет период полураспада менее 11 ч. Значение Cmax для соединения 1(S) в два раза больше значения Cmax для соединения 1(R), и значение AUC для соединения 1(S) превышает в 4 раза значение AUC для соединения 1(R). Эти результаты демонстрируют то, что соединение 1(S) имеет неожиданный и очень отличающийся фармакокинетический профиль в сравнении с соединением 1(R) у людей после перорального введения дозы. Соединение 1(S) имеет значительное более длительный период полураспада, а также увеличенные значения Cmax и AUC; таким образом, соединение 1(S) производит большее воздействие на человека в сравнении с соединением 1(R). Следовательно, соединение 1(S) дает неожиданные преимущества как над соединением 1(S), так и над рацемической смесью, и лечение человека соединением 1(S) может обеспечить более высокий, более стабильный уровень активного лекарственного средства в плазме по сравнению с лечением соединением 1(R) или рацематом и одновременно с тем снизить воздействие на субъект других веществ или метаболитов соединения 1(R). Пример 10. Метаболические продукты, образованные из соединений 1(S) и 1(R) в крысах. В этом примере проводят сравнение образования метаболических продуктов в крысах после введения соединений 1(S) и 1(R). Субъектам-крысам вводят однократную пероральную дозу либо атропоизомера 1(S), либо 1(R), составляющую 50 мг/кг. Впоследствии берут пробы мочи у крыс и анализируют с использованием прибора для проведения жидкостной хроматографии в сочетании с масс-спектрометрией (LC-MS). Фиг. 12 А и 12 В показывают результаты исследования методом LC-MS метаболитов, обнаруженных в моче. Крысы, которых подвергают воздействию соединения 1(S), в основном вырабатывают одно соединение, представленное максимумом на 13,4 минутах, и второе соединение, представленное много меньшим максимумом на 14,5 минутах, фиг. 12 А. С другой стороны, аналитические кривые мочи крыс,которым вводят соединение 1(R), характеризуются тремя основными максимумами на 13,5, 14,4 и 15,6 минутах, и небольшим максимумом на 12,1 минуте, фиг. 12 В. Это демонстрирует то, что соединение 1(R) метаболизируется in vivo с вырабатыванием большего количества метаболических продуктов в сравнении с соединением 1(S) и позволяет предположить, что два атропоизомера не метаболизируются в организме в точности одинаковым образом. Пример 11. Метаболические продукты, образованные из соединений 1(S) и 1(R) в человеческих субъектах. В этом примере проводят сравнение образования метаболических продуктов в обследуемых людях после введения соединений 1(S) и 1(R). Для этих испытаний обследуемому человеку перорально вводят либо меченный радиоактивным изотопом атропоизомер 1(S), либо меченный радиоактивным изотопом атропоизомер 1(R). Пробы плазмы, взятые у субъекта, испытывают через 1 ч и через 72 ч после введения и анализируют на содержание в них меченных радиоактивным изотопом соединений. В анализе используют HPLC-условия, которые,как известно, позволяют отделить соединение 1(S) (элюирование на приблизительно 21-22 минутах) от соединения 1(R), с тем, чтобы можно было бы пронаблюдать за любым взаимопревращением между этими видами соединений. Этот метод также позволяет отделить эти два вещества от основных метаболитов, образованных из них in vivo. Фиг. 13A-13D, кроме того, иллюстрируют неожиданную стабильность соединения 1(S) in vivo относительно соединения 1(R). На каждом спектре обеспечивают УФ-кривую в качестве стандарта времени удерживания для подтверждения идентичности максимумов, но важными по значению данными, которые следует отслеживать, являются сигналы радиоактивной метки С-14, которые отображены небольшими квадратами в момент времени удерживания для соединений 1(S), 1(R) и для известных метаболитов этих соединений. На фиг. 13 А наблюдают два соответствующие сигналам радиоактивной метки максимума, для соединения 1(S) (большой пик на приблизительно 22 минутах) и для метаболита (небольшой пик на приблизительно 14 минутах). На фиг. 13 В имеются две доминантные точки, соответствующие сигналу метки С-14, для 1(R) при 22 минутах и для метаболитов при 14 минутах. В этом случае уровень метаболита является почти таким же большим, как уровень соединения 1(R), даже лишь через 1 ч после введения соединения 1(R). Таким образом, соединение 1(S) приводит к образованию меньшего количества метаболита, чем соединение 1(R) в плазме человека, и остается большей частью неизмененным по истечении 1 ч. В момент времени 72 ч количество метаболитов, образованных из соединения 1(S), попрежнему меньше, чем количество исходного соединения 1(S), фиг. 13 С; таким образом, большая часть детектируемой радиоактивной метки 14 С соответствует активному лекарственному средству. Оказывается, что небольшое количество соединения 1(R) присутствует в этот момент времени, что позволяет предположить, что некоторое взаимопревращение соединения 1(S) в 1(R) может протекать in vivo. Для соединения 1(R) в момент времени 72 часа в основном обнаруживают метаболиты и видят очень небольшое количество соединения 1(R); фактически, оказывается, что может присутствовать большее количество соединения 1(S), чем 1(R), что опять позволяет предположить, что может протекать в небольшой степени взаимопревращение: см. фиг. 13D. Следовательно, относительное содержание метаболита после введения дозы с меченным радиоактивным изотопом соединением 1(R) позволяет предположить, что соединение 1(R) метаболизируется в
МПК / Метки
МПК: C07D 473/34, A61P 35/00, A61K 31/52
Метки: применения, атропоизомеров, производные, способы, 2-пуринил-3-толилхиназолинона
Код ссылки
<a href="https://eas.patents.su/30-19499-proizvodnye-atropoizomerov-2-purinil-3-tolilhinazolinona-i-sposoby-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные атропоизомеров 2-пуринил-3-толилхиназолинона и способы применения</a>
Предыдущий патент: Аналоги нейропептида y, содержащие по меньшей мере одну замену на синтетическую аминокислоту
Следующий патент: Фотоэлектрический элемент
Случайный патент: Состав со стабилизированными окислительно-восстановительными свойствами и способ стабилизации окислительно-восстановительных свойств












