Фармацевтические соединения
Номер патента: 1913
Опубликовано: 22.10.2001
Авторы: Норман Брайан Х., Готтумуккала Саббараджу В., Мохер Эрик Д., Мартинелли Майкл Дж., Мур Ричард Э., Пейтел Винод Ф., Аль-Авар Рима С., Сих Чуан, Манро Джон Э., Рэй Джеймс Э, Элхардт Вилльям Дж., Тот Джон Э., Васудеван Венкатрагхаван
Формула / Реферат
1. Соединение I
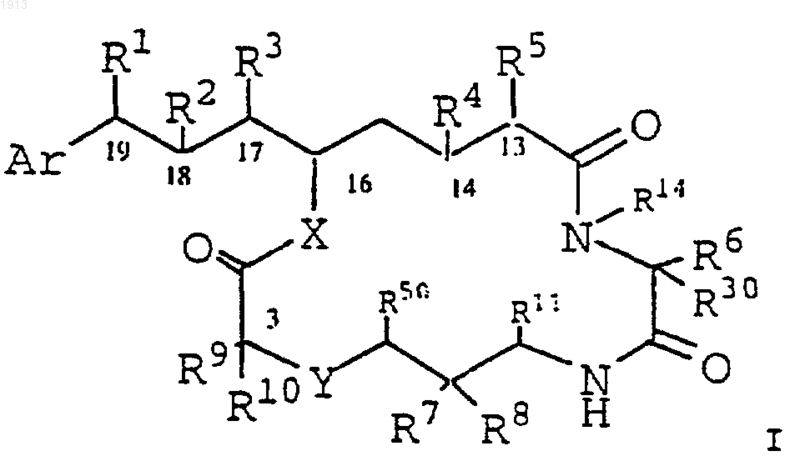
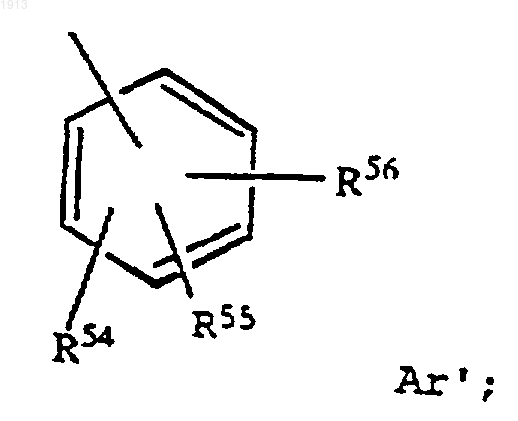
где Аr выбирают из группы, состоящей из фенила, любой простой незамещенной ароматической, простой замещенной ароматической, замещенной гетероароматической группы, незамещенной гетероароматической группы, гетероцикла, (C1-C12)-алкила, (C2-C12)-алкенила, (С2-С12)-алкинила, NR51R52, COR52, OR53 и Аr' формулы
R51 выбирают из группы, состоящей из водорода и (C1-С3)-алкила;
R52 выбирают из группы, состоящей из водорода и (C1-С3)-алкила;
R53 выбирают из группы, состоящей из (C1-C12)-алкила;
R54 выбирают из группы, состоящей из водорода, (C1-C6)-алкила, (C1-С6)-алкил-(R57'R57''R57'''), простой незамещенной ароматической, простой замещенной ароматической, гетероциклической группы, фенила, галогена, 4-(трет-бутилдиметилсилокси)бензилтрифенилфосфония, COOR57, РО3Н, SО3Н, SO2R58, N(R59)R60, NHOR61, NHCHR61', CN, NO2, галогена, OR62, CH2(O)Rб2', -СН2ОС(О)R95, CH2N(R96)R96', COR100, ((С1-С6)-алкил)OR100,
 и SR63;
и SR63;
R95 выбирают из группы, состоящей из -R98NН3;
каждый из R96 и R96' выбирают независимо из группы, состоящей из водорода, (С1-С6)-алкила, -R97NН3 и -R99NR99'R99'';
R97 выбирают из группы, состоящей из (С1-С6)-алкила;
R98 выбирают из группы, состоящей из (С1-С6)-алкила;
R99 представляет (С1-С6)-алкил;
каждый из R99' и R99" выбирают независимо из группы, состоящей из водорода и (С1-С6)-алкила;
R100 выбирают из группы, состоящей из водорода и Si(R101R102R103);
R101 представляет (С1-С6)-алкил;
R102 представляет (С1-С6)-алкил;
R103 представляет (С1-С6)-алкил;
R104 выбирают из группы, состоящей из С(О)(С1-С6)-алкил-N(R106)(R59)R60, С(О)(С1-С6)-алкил-N', конденсированного бицикла и NHR105N(R106)(R59)R60;
R105 выбирают из группы, состоящей из С(О)(С1-С6)-алкила, (С1-С6)-алкила;
R106 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, С(О)OR107;
R107 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, CR108R109R110;
R108 выбирают из группы, состоящей из водорода, (С1-С6)-алкила;
R109 выбирают из группы, состоящей из водорода, (С1-С6)-алкила;
R110 выбирают из группы, состоящей из водорода, (С1-С6)-алкила;
R111 выбирают из группы, состоящей из водорода, (С1-С6)-алкила и С(О)OR107;
R55 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, С(R57'R57"R57'''), простой незамещенной ароматической, простой замещенной ароматической группы, фенила, COOR57, РО3Н, SО3Н, SO2R58, NR59R60, NHOR61, NHCHR61', CN, NO2, галогена, OR62 и SR63;
R56 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, С(R57'R57"R57'''), простой незамещенной ароматической, простой замещенной ароматической группы, фенила, COOR57, РО3Н, SО3Н, SO2R58, NR59R60, NHOR61, NHCHR61', (С1-С6)-алкил-NR59R60, CN, NO2, галогена, OR104, CR104, OR62 и SR63;
R57 выбирают из группы, состоящей из водорода, (С1-С12)-алкила;
R57' выбирают из группы, состоящей из водорода, галогена и (С1-С12)-алкила;
R57" выбирают из группы, состоящей из водорода, галогена и (С1-С12)-алкила;
R57''' выбирают из группы, состоящей из водорода, галогена и (С1-С12)-алкила;
R58 выбирают из группы, состоящей из водорода, (С1-С12)-алкила;
R59 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, трет-бутоксикарбонила, карбо-трет-бутокси (t-Boc) и фторметоксикарбонила (FMOC);
R60 выбирают из группы, состоящей из водорода, (С1-С6)-алкила;
R61 выбирают из группы, состоящей из водорода, OR64, CH2NHR65, NHR65' и фторметоксикарбонила (FMOC);
R61' выбирают из группы, состоящей из водорода, OR64, CH2NHR65, NHR65' и фторметоксикарбонила (FMOC);
R62 выбирают среди водорода и (С1-С6)-алкила;
R62' выбирают среди водорода, ОН, OR62 и (С1-С6)-алкила;
R63 выбирают среди водорода и (С1-С6)-алкила;
R64 выбирают из группы, состоящей из водорода, (С1-С6)-алкила и CH2NR66R67;
R65 выбирают из группы, состоящей из водорода, (С1-С6)-алкила, NH2 и фторметоксикарбонила (FMOC);
R65' выбирают из группы, состоящей из водорода, (С1-С6)-алкила, NН2 и фторметоксикарбонила (FMOC);
R66 выбирают из группы, состоящей из водорода, (С1-С6)-алкила и фторметоксикарбонила (FMOC);
R67 выбирают из группы, состоящей из водорода и (С1-С6)-алкила;
каждый из R1 и R2 выбирают независимо из группы, состоящей из галогена, моноалкиламино, диалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной группы, фосфатной группы, OR31, SR31, NR31, ОН, SH, NR92, R93, NR94 и NH2;
каждый из R92, R93 и R94 выбирают независимо из группы, состоящей из (С1-С6)-алкила;
при условии, что один из группы, состоящей из R1 и R2, выбирают из группы, состоящей из OR31; SR31, NR31, OH и SH; или
R1 и R2 можно взять вместе с С-18 и С-19 с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца, циклопропильного кольца или моно-(С1-С6)-алкилфосфатного кольца; или
R1 и R2 можно взять вместе с образованием второй связи между С-18 и С-19;
R3 представляет C1-6 алкильную группу;
R4 представляет Н или ОН;
R5 представляет Н или ОН;
R4 и R5 можно взять вместе с образованием второй связи между C13 и С14;
R6 представляет заместитель, выбранный из группы, состоящей из бензила, гидроксибензила, алкоксибензила, галогенгидроксибензила, дигалогенгидроксибензила, галогеналкоксибензила, или дигалогеналкоксибензильную группу, В-кольцевую гетероароматическую группу, замещенную гетероароматическую группу, В-кольцевой (С1-С6)-алкил, (С3-С8)-циклоалкил, замещенный (С3-С8)-циклоалкил, замещенный (С1-С6)-алкил, группу формулы III'
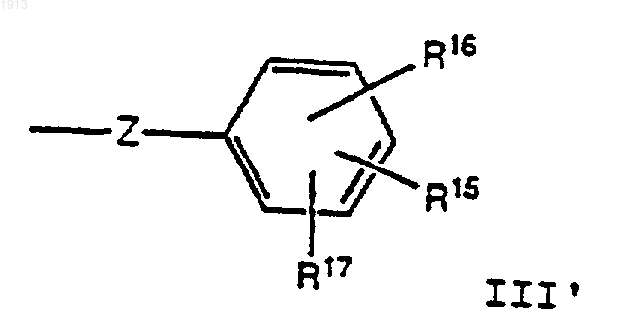
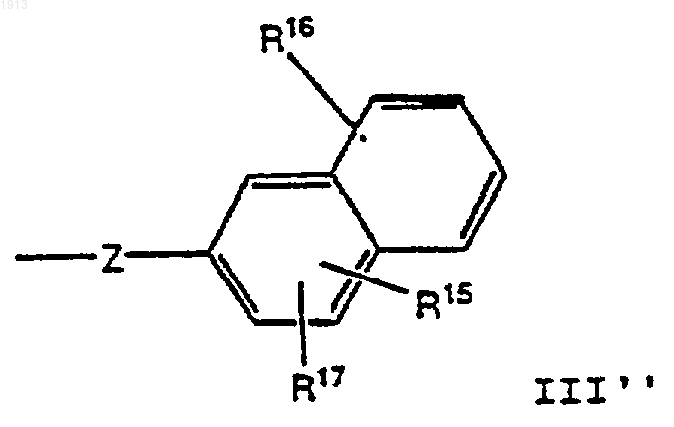
и группу формулы III"
R7 выбирают из группы, состоящей из NR51R52, R53NR51R52, OR53, Н и С1-6 алкильной группы;
R51 и R52 выбирают, независимо, из группы, состоящей из (С1-С3)-алкила;
R53 представляет (С1-С3)-алкил;
R8 представляет Н или С1-6алкильную группу;
или R7 и R8 могут образовывать циклопропильное кольцо;
R9 выбирают из группы, состоящей из Н, С1-6 алкильной группы, ненасыщенного C1-6 алкила, C1-6-алкил-(С3-С5)-циклоалкила и бензила;
R10 представляет Н или С1-6 алкильную группу;
R11 выбирают из группы, состоящей из водорода, ОН, С1-6 алкильной группы, замещенного фенила, бензила, замещенного бензила и фенила;
R14 выбирают из группы, состоящей из водорода и С1-6 алкильной группы;
каждый из R15, R16 и R17 выбирают независимо из группы, состоящей из водорода, OR18, галогена, NR18'R19', NО2, ОРО3Н2, ОR19-фенила, SСН2-фенила, CONH2, CO2H, РО3Н2, SO2R23 и ZZ;
R18 выбирают из группы, состоящей из водорода, арила, (С1-С6)-алкила, C(O)R90 и фторметоксикарбонила (FMОС);
R18' выбирают из группы, состоящей из водорода, (С1-С6)-алкила и C(O)R90';
R19 представляет (С1-С6)-алкил, C(O)R90" и фторметоксикарбонил (FMOC);
R19' выбирают из группы, состоящей из водорода, (С1-С6)-алкила и C(O)R90''';
каждый из R90, R90', R90'' и R90''' выбирают независимо из группы, состоящей из водорода, (С1-С6)-алкила, OR91 и арила;
R91' выбирают из группы, состоящей из (С1-С6)-алкила, арила и водорода;
R23 выбирают из группы, состоящей из водорода и (С1-С3)-алкила;
R30 представляет водород или (С1-С6)-алкил; или
R30 можно взять вместе с N при С-11 с образованием (трех-) - (семичленного) цикла;
R31 выбирают из группы, состоящей из (С1-С12)-алкила, R32;
R32 выбирают из группы, состоящей из аминокислоты, углевода, аминосахара, (caxapидa)q, C(O)R33 и
R33 выбирают из группы, состоящей из R37R38, R38, R37N, (R20')R38, R37N(R20')(С1-С6)-алкил-С(O)R38, R37N(R20')С(О)R38, R37O-(С1-С6)-алкил-О-(С1-С6)-алкил-O-(С1-С6)-алкил-O-(С1-С6)-алкила и R37(NR18'R20')R38;
R20' выбирают из группы, состоящей из водорода, (С1-С6)-алкила и -CO2R21';
R21' выбирают из группы, состоящей из водорода и (С1-С6)-алкила;
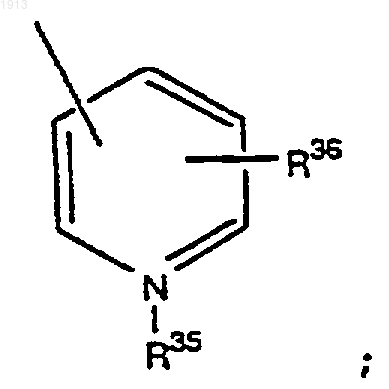
R34 представляет (С1-С4)-алкил;
R35 представляет водород или (С1-С3)-алкил;
R36 представляет водород, ОН, галоген, (С1-С3)-алкил, OR34, NO2, NH2 и гетероароматическую группу;
R37 представляет (С1-С6)-алкил;
R38 представляет COOR39, 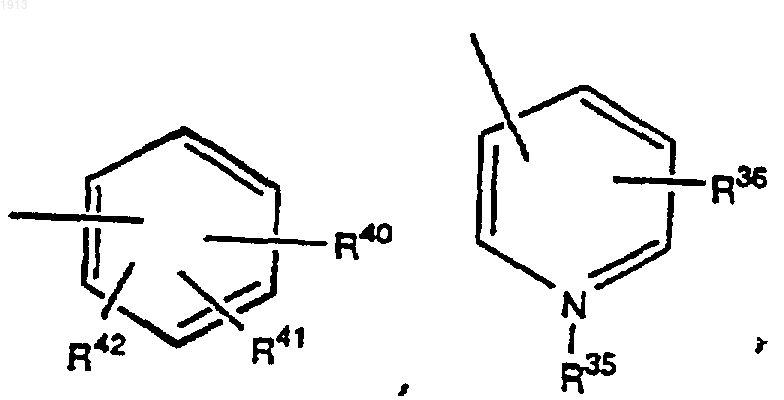 NH2, (NR18'R20'), гетероциклическую группу, гетероароматическую группу, ОН, (С1-С6)-алкил и аминокислоту;
NH2, (NR18'R20'), гетероциклическую группу, гетероароматическую группу, ОН, (С1-С6)-алкил и аминокислоту;
R39 представляет Н или (С1-С6)-алкил;
каждый из R40, R41 и R42 выбирают независимо из группы, состоящей из водорода, OR43, галогена, NH2, NO2, OPO(OR46)2, -ОR44-фенила и R45;
R43 представляет (С1-С6)-алкил;
R44 представляет (С1-С6)-алкил;
R45 выбирают из группы, состоящей из незамещенной простой ароматической группы и замещенной простой ароматической группы;
R46 выбирают из группы, состоящей из Н, Na, (С1-С6)-алкила и -С(СН3)3;
R50 представляет водород или
n равно 0, 1 или 2;
m равно 0, 1 или 2;
р равно 0, 1 или 2;
q равно 2, 3 или 4;
X выбирают из группы, состоящей из О, С, S, NH и алкиламино;
Y выбирают из группы, состоящей из С, О, NH, S, SO, SO2 и алкиламино;
Z выбирают из группы, состоящей из -(СН2)n-, -(СН2)р-O-(СН2)m-и (С3-С5)-циклоалкила;
ZZ выбирают из группы, состоящей из простой незамещенной ароматической группы и простой замещенной ароматической группы;
или его фармацевтически приемлемая соль или сольват;
при условии, что если R1 выбирают из группы, состоящей из галогена, ОН, OR31, SH, амино, моноалкиламино, диалкиламино, триалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной и фосфатной группы, а R2 выбирают из группы, состоящей из ОН, NH2, NR31 и SH, или R1 и R2 вместе образуют эпоксидное кольцо, азиридиновое кольцо, эписульфидное кольцо, сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь; R3 представляет С1-6 алкил; R4 и R5 представляют Н или R4 и R5, взятые вместе, образуют двойную связь между С13 и С14; R6 представляет бензил, гидроксибензил, алкоксибензил, галогенгидроксибензил, дигалогенгидроксибензил, галогеналкоксибензил или дигалогеналкоксибензил; каждый из R7, R8, R9 и R10 представляет независимо Н или С1-6алкильную группу; и каждый из Х и Y представляет независимо О, NH или алкиламино, и R50 представляет 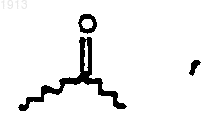 a R11 представляет водород; тогда Аr не выбирают из группы, состоящхщ из (С1-С12)-алкила, (С2-С12)-алкинила, фенила, простой незамещенной ароматической, замещенной ароматической, незамещенной гетероароматической и замещенной гетероароматической группы; или
a R11 представляет водород; тогда Аr не выбирают из группы, состоящхщ из (С1-С12)-алкила, (С2-С12)-алкинила, фенила, простой незамещенной ароматической, замещенной ароматической, незамещенной гетероароматической и замещенной гетероароматической группы; или
если Аr выбирают из группы, состоящей из (С1-С12)-алкила, (С2-С12)-алкинила, фенила, простой незамещенной ароматической, замещенной ароматической, незамещенной гетероароматической и замещенной гетероароматической группы; и R50 представляет  ,
,
а R11 представляет водород; тогда
R2 выбирают из группы, состоящей из галогена, амино, моноалкиламино, диалкиламино, триалкиламмония, алкилтио, диалкилсульфония сульфатной и фосфатной группы, OR31 и SR31; или
если R1 выбирают из группы, состоящей из галогена, ОН, OR31, SH, амино, моноалкиламино, диалкиламино, триалкиламино, триалкиламмония, алкилтио, диалкилсульфония., сульфатной и фосфатной группы, и R2 выбирают из группы, состоящей из ОН, NH2, NR31 и SH, или R1 и R2 вместе образуют эпоксидное кольцо, азиридиновое кольцо, эписульфидное кольцо, сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь, и R3 представляет С1-6 алкил, а R4 представляет Н, и R5 представляет Н, и R50 представляет водород, и R11 представляет водород; тогда Аr не выбирают из группы, состоящей из (С1-С12)-алкила, (С2-С12)-алкинила, фенила, простой незамещенной ароматической, замещенной ароматической и гетероароматической группы; или
если R1 выбирают из группы, состоящей из галогена, ОН, OR31, SH, амино, моноалкиламино, диалкиламино, триалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной и фосфатной группы, и R2 выбирают из группы, состоящей из ОН, NH2, NR31 и SH, или R1 и R2 вместе образуют эпоксидное кольцо, азиридиновое кольцо, эписульфидное кольцо, сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь и R3 представляет C1-6 алкил, а R4 представляет Н, и R5 представляет Н, и R50 представляет водород, и R11 представляет водород; или R50 выбирают из группы, состоящей из 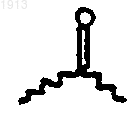 и водорода;
и водорода;
и R11 выбирают из группы, состоящей из ОН, C1-6 алкильной группы, замещенного фенила, бензила, замещенного бензила и фенила;
тогда Аr не выбирают из группы, состоящей из (С1-С12)-алкила, (С2-С12)-алкинила, фенила, простой незамещенной ароматической, замещенной ароматической, замещенной гетероароматической и незамещенной гетероароматической группы; или
если R3 представляет С1-6 алкил; R4 и R5 представляют Н или R4 и R5, взятые вместе, образуют двойную связь между C13 и C14; R6 представляет бензил, гидроксибензил, алкоксибензил, галогенгидроксибензил, дигалогенгидроксибензил, галогеналкоксибензил или дигалогеналкоксибензил; каждый из R7, R8, R9 и R10 представляет независимо Н или C1-6алкильную группу; и каждый из Х и Y представляет независимо О, NH или алкиламино; и Аr представляет группу формулы Аr', и один из R54, R55, R56 выбирают из группы, состоящей из алкила или галогена; и R1 и R2 могут быть взяты вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца, циклопропильного кольца или моноалкилфосфатного кольца; или R1 и R2 могут быть взяты вместе с образованием второй связи между C18 и C19; или R2 выбирают из группы, состоящей из ОН и SH;
тогда, по меньшей мере, два из R54, R55 и R56 должны быть выбраны из группы, состоящей из (С1-С6)-алкила, простой ароматической группы, фенила, COOR57, РО3Н, SО3Н, SO2R58, NR59R60, NHOR61, NHCHR61', CN, NO2, галогена, OR62 и SR63; или
если R3 представляет C1-6алкил; R4 и R5 представляют Н, или R4 и R5, взятые вместе, образуют двойную связь между C13 и C14; R6 представляет В-кольцевую гетероароматическую, замещенную гетероароматическую группу, В-кольцевой (С1-С6)-алкил, (С3-С8)-циклоалкил, замещенный (С3-С8)-циклоалкил, замещенный (C1-С6)-алкил, группу формулы III'
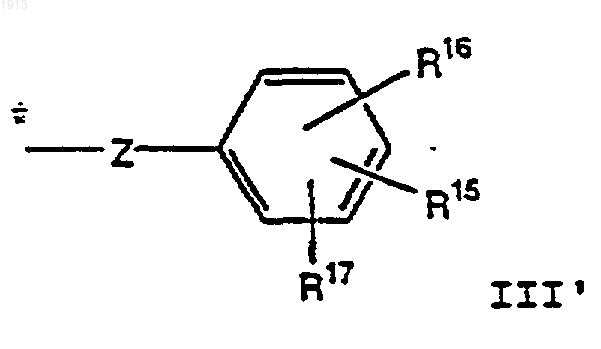
и группу формулы III"

и каждый из Х и Y представляет независимо О, NH или алкиламино; тогда
Аr не выбирают из группы, состоящей из фенила или любой простой незамещенной или замещенной ароматической или гетероароматической группы, (С1-С12)-алкила и (С2-С12)-алкинила.
2. Соединение по п.1, в котором Y представляет О.
3. Соединение по п.2, в котором Х представляет О.
4. Соединение по п.3, в котором R6 выбирают из группы, состоящей из бензила, гидроксибензила, галогенгидроксибензила, дигалогенгидроксибензила, галогеналкоксибензила или дигалогеналкоксибензила.
5. Соединение по п.4, в котором R9 представляет изобутил и R10 представляет водород.
6. Соединение по п.5, в котором каждый из R8 и R7 независимо представляет водород или С1-6алкил.
7. Соединение по п.3, в котором R11 представляет водород.
8. Соединение по п.7, в котором R50 представляет

9. Способ разрушения связывания микротрубочек у млекопитающего, включающий введение эффективного количества соединения по п.1.
10. Способ разрушения связывания микротрубочек in vitro, включающий введение эффективного количества соединения по п.1.
11. Способ лечения неоплазмы (опухоли) у млекопитающего, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1.
12. Композиция, содержащая соединение по п.1 и один или несколько фармацевтически приемлемых разбавителей или носителей для него.
13. Способ лечения животного, зараженного или восприимчивого к заражению грибками, включающий введение противогрибкового эффективного количества соединения по п.1.
14. Способ по п.13, когда указанное животное является млекопитающим.
15. Способ по п.13, отличающийся тем, что животное инфицировано грибками.
16. Соединение по п.1, в котором Y представляет NH.
17. Соединение по п.16, в котором R50 представляет
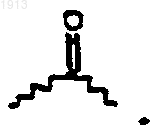
18. Соединение по п.17, в котором Х представляет О.
19. Соединение по п.18, в котором R6 выбирают, из группы, состоящей из бензила, гидроксибензила, галогенгидроксибензила, дигалогенгидроксибензила, галогеналкоксибензила и дигалогеналкоксибензила.
20. Соединение по п.19, в котором R9 представляет изобутил и R10 представляет водород.
21. Соединение по п.20, в котором каждый из R8 и R7 независимо представляет водород или С1-6алкил.
22. Соединение по п.18, в котором R11 представляет водород.
23. Соединение по п.1, которое выбирают из группы, состоящей из ацетата криптофицина 55, сукцината криптофицина 55, (2'-ди-трет-бутилфосфатил)фенилацетата криптофицина 55, (2'-фосфатил)фенилацетата криптофицина 55, никотиноата криптофицина 55, N-метилпиридинийкриптофицина 55, N-трет-Вос-3-(3-хлор-4-метоксифенил)-(D)-аланината криптофицина 55, 3-(3-хлор-4-метоксифенил)-(D)-аланината криптофицина 55, N-трет-Вос-глицината криптофицина 55, N-трет-Вос-b-аланината криптофицина 55, N-трет-Вос-g-аминобутирата криптофицина 55, N-трет-Вос-(L)-аланината криптофицина 55, N-трет-Вос-(D)-аланината криптофицина 55, (D)-аланината криптофицина 55 и Na-Ne -ди-трет-Вос-(L)-лизината криптофицина 55, или их фармацевтически приемлемых солей.
24. Соединение по п.1, которое выбирают из группы, состоящей из криптофицина 129, криптофицина 138, криптофицина 139, криптофицина 145, криптофицина 140 и криптофицина 141, или их фармацевтически приемлемых солей.
25. Соединение по п.1, которое выбирают из группы, состоящей из криптофицина 152, криптофицина 160, криптофицина 255, криптофицина 153, криптофицина 154, криптофицина 161, криптофицина 234, криптофицина 236, криптофицина 247, криптофицина 251 и криптофицина 238, или их фармацевтически приемлемых солей.
26. Соединение по п.1, которое выбирают из группы, в которую входят трет-бутилсукцинат криптофицина 55, (2'-ди-трет-бутилфосфатил)фенилацетат криптофицина 55, (2'-ди-трет-бутилфосфатил)-фенилуксусная кислота, (2'-фосфатил)фенилацетат криптофицина 55, никотиноат криптофицина 55, N-метилпиридинийкриптофицин 55, N-трет-Вос-3-(3-хлор-4-метоксифенил-(D)-аланинат криптофицина 55, N-трет-Вос-(L)-фенилаланинат криптофицина 55, (L)-фенилаланинат криптофицина 55, (L)-гистидинат криптофицина 55, N-трет-Вос-(L)-пролинат криптофицина 55, (L)-пролинат криптофицина 55, N-трет-Вос-глицинат криптофицина 55, глицинат криптофицина 55, N-трет-Вос-b-аланинат криптофицина 55, b-аланинат криптофицина 55, N-трет-Вос-g-аминобутират криптофицина 55, g-аминобутират криптофицина 55, N-трет-Вос-(L)-аланинат криптофицина 55, (L)-аланинат криптофицина 55, N-трет-Вос-(D)-аланинат криптофицина 55, (D)-аланинат криптофицина 55, Na-Ne-ди-трет-Вос-(L)-лизинат криптофицина 55, (L)-лизинат криптофицина 55, Na-Ne-ди-трет-Вос-(D)-лизинат криптофицина 55, (D)-лизинат криптофицина 55, N-тpeт-Boc-g-трет-бутил-(L)-глутамат криптофицина 55, (L)-a-глутамат криптофицина 55, N-трет-Вос-b-трет-бутил-аспартат криптофицина 55, (D)-аспартат криптофицина 55, N-трет-Вос-a-трет-бутил-(L)-глутамат криптофицина 55, (L)-g-глутамат криптофицина 55, N,N'-ди-трет-Вос-(S)-2,3-диаминопропионат криптофицина 55, (S)-2,3-диаминопропионат криптофицина 55, N-трет-Вос-(L)-серинат криптофицина 55, (L)-серинат криптофицина 55 и сукцинат криптофицина 55;
или их фармацевтически приемлемые соли.
Текст
1 Данное изобретение относится к области фармацевтической и органической химии и к новым криптофицинам, полезным в качестве средств против микротрубочек. Неопластические болезни, характеризующиеся пролиферацией клеток, не подчиняющейся нормальному регулированию роста клеток, являются одной из основных причин смертности среди людей и млекопитающих. Клинический опыт в области противораковой терапии показывает, что для лечения этих болезней нужны новые и более эффективные лекарственные средства. Система микротрубочек эукариотных клеток является основным компонентом цитоскелета и представляет динамичное скопление и разобщение; т.е. гетеродимеры тубулина полимеризуются и образуют микротрубочку. Микротрубочки играют ключевую роль в регуляции строения, метаболизма и деления клеток. Динамичное состояние микротрубочек критично для их нормальной функции. Что касается деления клеток, то тубулин полимеризуется в микротрубочки, которые образуют митотическое веретено. Микротрубочки впоследствии деполимеризуются, когда завершено использование митотического веретена. Соответственно средства,которые нарушают полимеризацию или деполимеризацию микротрубочек и посредством этого ингибируют митоз, относятся к числу наиболее эффективных противораковых химиотерапевтических средств при клиническом применении. Кроме того, заявляемые здесь соединения обладают также фунгицидными свойствами. Кроме того, такие средства со способностью разрушать систему микротрубочек могут быть полезны для исследовательских целей. Некоторые криптофицины известны из литературы; однако, для большинства фармацевтических применений нужны криптофицины с более высокой растворимостью и устойчивостью. Кроме того, расширенный ассортимент криптофицинов может обеспечить дополнительную возможность выбора для пациента,страдающего от рака. Заявители описывают новые соединения, которые обладают большей растворимостью в воде, а также обладающие способностью разрушать систему микротрубочек. Соединения данного изобретения могут быть полезны для лечения новообразований. Такие соединения можно получить с использованием общих способов синтеза, и, следовательно, они хорошо подходят для разработки в качестве фармацевтически полезных средств. Данное изобретение относится к новым криптофицинам формулы I где Аr выбирают из группы, состоящей из фенила, любой простой незамещенной ароматической, простой замещенной ароматической, замещенной гетероароматической группы, незамещенной гетероароматической группы, гетероцикла, (C1-C12)-алкила, (С 2-C12)-алкенила, (C2C12)-алкинила, NR51R52, COR52, OR53, и Аr' формулыR51 выбирают из группы, состоящей из водорода и (C1-C3)-алкила;R52 выбирают из группы, состоящей из водорода и (C1-C3)-алкила;-R98NH3; каждый из R96 и R96' выбирают независимо из группы, состоящей из водорода и (C1-C6)алкила, -R97NН 3 и -R99NR99'R99;R99 представляет (C1-C6)-алкил; каждый из R99' и R99 выбирают независимо из группы, состоящей из водорода и (C1-C6)алкила;R100 выбирают из группы, состоящей из водорода и Si(R101R102R103);R108 выбирают из группы, состоящей из водорода и (C1-C6)-алкила;R109 выбирают из группы, состоящей из водорода и (C1-C6)-алкила;R110 выбирают из группы, состоящей из водорода и (C1-C6)-алкила;R55 выбирают из группы, состоящей из водорода, (C1-C6)-алкила, С(R57'R57"R57'"), простой незамещенной ароматической, простой замещенной ароматической группы, фенила,COOR57, РО 3 Н, SО 3 Н, SO2R58, NR59R60, NHOR61,NHCHR61', CN, NO2, галогена, OR62 и SR63;R56 выбирают из группы, состоящей из водорода, (C1-C6)-алкила, С(R57'R57"R57'"), простой незамещенной ароматической, простой замещенной ароматической группы, фенила,COOR57, РО 3 Н, SО 3 Н, SO2R58, NR59R60, NHOR61,NHCHR61', (C1-C6)-алкил-NR59R60, CN, NO2, галогена, OR104, CR104, OR62 и SR63;R58 выбирают из группы, состоящей из водорода и (C1-C12)-алкила;R60 выбирают из группы, состоящей из водорода и (C1-C6)-алкила;R62 выбирают среди водорода и (C1-C6)алкила;R63 выбирают среди водорода и (C1-C6)алкила;R67 выбирают из группы, состоящей из водорода и (C1-C6)-алкила; каждый из R1 и R2 выбирают независимо из группы, состоящей из галогена, моноалкиламино, диалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной группы,фосфатной группы, OR31, SR31, NR31, ОН, SH,NR92, R93, NR94 и NH2; каждый из R92, R93 и R94 выбирают независимо из группы, состоящей из (C1-C6)-алкила; при условии, что одного из группы, состоящей из R1 и R2, выбирают из группы, состоящей из OR31, SR31, NR31, ОН и SH; илиR1 и R2 можно взять вместе с С-18 и С-19 с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца, циклопропильного кольца или моно(C1-C6)-алкилфосфатного кольца; илиR1 и R2 можно взять вместе с образованием второй связи между С-18 и С-19;R3 представляет низшую алкильную группу;R4 и R5 можно взять вместе с образованием второй связи между C13 и С 14;R8 представляет Н или низшую алкильную группу; или R7 и R8 могут образовывать циклопропильное кольцо;R10 представляет Н или низшую алкильную группу;R14 выбирают из группы, состоящей из водорода и низшей алкильной группы; каждый из R15, R16 и R17 выбирают, независимо, из группы, состоящей из водорода, OR18,галогена, NR18'R19', NО 2, ОРО 3 Н 2, OR19-фенила,SСН 2-фенила, CONH2, СО 2 Н, РО 3 Н 2, SO2R23 иR23 выбирают из группы, состоящей из водорода и (C1-C3)-алкила;R30 представляет водород или (C1-C6)алкил; илиR30 можно взять вместе с N в положении С-11 с образованием трех-семичленного цикла;R21' выбирают из группы, состоящей из водорода и (C1-C6)-алкила;R35 представляет водород или (C1-C3)алкил;R45 выбирают из группы, состоящей из незамещенной простой ароматической группы и замещенной простой ароматической группы;ZZ выбирают из группы, состоящей из простой незамещенной ароматической группы и простой замещенной ароматической группы; или их фармацевтически приемлемым солям или сольватам; при условии, что если R1 выбирают из группы, состоящей из галогена, ОН, OR31, SH,амино, моноалкиламино, диалкиламино, триалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной и фосфатной группы, а R2 выбирают из группы, состоящей из ОН,NH2, NR31 и SH, или R1 и R2 вместе образуют эпоксидное кольцо, азиридиновое кольцо, эписульфидное кольцо, сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь; R3 представляет низший алкил; R4 и R5 представляют Н, или R4 и R5, взятые вместе,образуют двойную связь между C13 и C14; R6 представляет бензил, гидроксибензил, алкоксибензил, галогенгидроксибензил, дигалогенгидроксибензил, гелогеналкоксибензил или дигалогеналкоксибензил; каждый из R7, R8, R9 и R10 представляет, независимо, Н или низшую алкильную группу; и каждый из Х и Y представляет, независимо, О, NH или алкиламино, и R50 представляетa R11 представляет водород; тогда Аr не выбирают из группы, состоящей изR1 и R2 вместе образуют эпоксидное кольцо,азиридиновое кольцо, эписульфидное кольцо,сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь, и R3 представляет низший алкил, а R4 представляет Н, и R5 представляет Н, и R50 представляет водород, иR11 представляет водород; тогда Аr не выбирают из группы, состоящей изR1 и R2 вместе образуют эпоксидное кольцо,азиридиновое кольцо, эписульфидное кольцо,сульфатное кольцо, циклопропильное кольцо или моноалкилфосфатное кольцо, или R1 и R2 вместе образуют вторую связь, и R3 представляет низший алкил, а R4 представляет Н, и R5 представляет Н, и R50 представляет водород, иR11 представляет водород; или R50 выбирают из и водорода; и R11 группы, состоящей из выбирают из группы, состоящей из ОН, низшей алкильной группы, замещенного фенила, бензила, замещенного бензила и фенила; тогда Аr не выбирают из группы, состоящей изR представляют Н, или R4 и R5, взятые вместе,образуют двойную связь между С 13 и C14; R6 представляет бензил, гидроксибензил, алкокси 001913 8 бензил, галогеногидроксибензил, дигалогеногидроксибензил, галогеноалкоксибензил или дигалогеноалкоксибензил; каждый из R7, R8, R9 и R10 представляет независимо Н или низшую алкильную группу; и каждый из Х и Y представляет, независимо, О, NH или алкиламино; и Аr представляет группу формулы Аr', и один из R54, R55, R56 выбирают из группы,состоящей из алкила или галогена; иR1 и R2 могут быть взяты вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца, циклопропильного кольца или моноалкилфосфатного кольца; или R1 и R2 могут быть взяты вместе с образованием второй связи между C18 и C19; или R2 выбирают из группы, состоящей из ОН и SH; тогда, по меньшей мере, два из R54, R55 и 56R должны быть выбраны из группы, состоящей из (C1-C6)-алкила, простой ароматической группы, фенила, COOR57, РО 3 Н, SО 3 Н, SO2R58,NR59R60, NHOR61, NHCHR61', CN, NO2, галогена,OR62 и SR63; или если R3 представляет низший алкил; R4 и 5R представляют Н, или R4 и R5, взятые вместе,образуют двойную связь между C13 и C14; R6 представляет В-кольцевую гетероароматическую, замещенную гетероароматическую группу,В-кольцевой и каждый из Х и Y представляет, независимо, О,NH или алкиламино; тогда Аr не выбирают из группы, состоящей из фенила или любой простой незамещенной или замещенной ароматической или гетероароматической группы, (C1-C12)-алкила и (C2-C12)алкинила. Настоящее изобретение относится к фармацевтическим композициям, способу разрушения системы микротрубочек с использованием эффективного количества соединения формулыI, способу ингибирования пролиферации клеток млекопитающего, включающему введение эффективного количества соединения формулы I,и способу лечения неоплазии у млекопитающего, включающему введение эффективного количества соединения формулы I. Кроме того, изобретение относится к способу борьбы с микозом, включающему введение животному, зараженному или чувствительному к микозу, противогрибковго эффективного количества соединения формулы I. 9 Используемый здесь термин простой алкил будет относиться к (C1-C7)-алкилу, при этом алкил может быть насыщенным, ненасыщенным, разветвленным или линейным. Примерами, но никоим образом не ограничением, являются метил, этил, н-пропил, изопропил, нбутил, пропенил, этенил, втор-бутил, н-пентил,изобутил, трет-бутил, втор-бутил, метилированные бутильные группы, пентил, трет-пентил,втор-пентил,метилированные пентильные группы и подобные группы. Термин алкенил относится к алкильной группе, определенной выше, с одной-тремя двойными связями. Термин алкинил относится к алкильной группе,определение которой дается выше, по меньшей мере, с одной тройной связью. Особенно предпочтительно, когда алкинил имеет только одну тройную связь. Термин (C1-Cn')-алкил, где n' является целым числом от 2 до 12 обозначает алкильную группу, имеющую от одного до указанного числа атомов углерода. (C1-Cn')-алкил может быть линейным или разветвленным. Используемый здесь термин В-кольцевой(C1-C6)-алкил относится к насыщенному, ненасыщенному, разветвленному и линейному алкилу, при этом В-кольцевая (C1-C6)-алкильная группа может включать до трех (3) неуглеродных заместителей. Такие неуглеродные заместители выбираются, наиболее предпочтительно,из группы, состоящей из ОН, SСН 2-фенила,NН 2, СО, CONH2, СО 2 Н, РО 3 Н 2, SO2R21, где R21 выбирают среди водорода и (C1-C3)-алкила. Используемый здесь термин аминокислота обозначает органическую кислоту, содержащую аминогруппу. Термин включает как встречающиеся в природе, так и синтетические аминокислоты, поэтому аминогруппа может, но не обязательно, присоединяться к атому углерода, следующему за кислотной группой. Аминокислотный заместитель присоединяется к исходной молекуле через функциональную группу органической кислоты. Используемый здесь термин углевод относится к классу заместителей, состоящих из углерода, водорода и кислорода, при этом водород и кислород находятся в тех же пропорциях,что в воде, или почти в тех же пропорциях, что в воде. Термин углевод также относится к альдегиду или кетоспирту, или к соединению,которое при гидролизе образует альдегид или кетон. Термин углевод таков, как он обычно понимается специалистами в этой области техники. Например, термин относится, но никоим образом этим не ограничивается, к С 12 Н 22O11 и С 6 Н 10 О 5. Используемый здесь термин аминосахар относится к углеводной группе, содержащей от одного до трех аминозаместителей в молекуле углевода в любом доступном положении. Используемый здесь термин сахарид относится к углеводным подгруппам, образующим дисахариды или полисахариды. Этот термин, 001913 10 например, обозначает, но никоим образом этим не ограничивается, лактозу, мальтозу, сахарозу,фруктозу, крахмал и т.п. Используемый здесь термин замещенный фенил будет относиться к фенильной группе с одним-тремя отличными от водорода заместителями, которые можно выбрать, независимо, из группы, состоящей из простого алкила, Cl, Br, F и I. Используемый здесь термин замещенный бензил будет относиться к бензильной группе с одним-тремя отличными от водорода заместителями, которые можно выбрать, независимо, из группы, состоящей из простого алкила, Сl, Вr, F и I, при этом такие заместители могут присоединяться к любому доступному атому углерода. Некоторые предпочтительные замещенные бензилы также описаны. Используемый здесь термин алкоксибензил относится к бензильной группе с алкоксизаместителем в любом доступном положении бензильного кольца. Наиболее предпочтительной алкокси-группой является-О(C1-C3)-алкил. Особенно предпочтительна метокси. Соответственно, термин галогеналкоксибензил относится к бензильной группе,имеющей кроме алкоксизаместителя галогенозаместитель. Каждая галогено- или алкоксигруппа замещается у любого доступного атома углерода. Подобным образом, термин галогеногидроксибензил относится к гидроксизамещенной бензильной группе, которая содержит также галогенозаместитель у любого доступного атома углерода в бензильном кольце. Наконец, термин дигалогеналкоксибензил относится к алкоксизамещенному бензилу, который,кроме того, содержит два галогенозаместителя,каждый из которых является независимым заместителем у любого доступного атома углерода на бензильном кольце. Используемый здесь термин В-кольцевая гетероароматическая группа относится к ароматическим кольцам, содержащим один или несколько неуглеродных заместителей, выбранных из группы, состоящей из атомов кислорода,азота и серы. Особенно предпочтительные Вкольцевые гетероциклические группы выбирают, но не ограничиваются, из группы, состоящей изR20 выбирают среди водорода и (C1-C6)алкила. Особенно предпочтительно, когда Вкольцевая гетероароматическая группа отно 11 сится к заместителю, выбранному из группы,состоящей из Определение замещенная ароматическая относится к группе, замещенной одним-тремя заместителями, выбранными из группы, состоящей из простого алкила и галогена. Используемый здесь термин циклоалкил относится к насыщенной (C3-C8)-циклоалкильной группе, при этом такая группа может включать от нуля до трех заместителей, выбранных из группы, состоящей из (C1-C3)-алкила, галогена и OR22, где OR22 выбирают среди водорода и(C1-C3)-алкила. Такие заместители могут присоединяться к любому доступному атому углерода. Особенно предпочтительно, когда циклоалкил представляет замещенный или незамещенный циклогексил. Используемый здесь термин низшая алкоксильная группа обозначает алкильную группу с одним-пятью атомами углерода, связанную с атомом кислорода. Используемый здесь термин низшая алкильная группа обозначает алкильную группу с одним-шестью атомами углерода и включает линейные и нелинейные углеводородные цепи, в том числе, например, но не в качестве ограничения, метил,этил, пропил, изопропил, бутил, изобутил, третбутил, втор-бутил, метилированные бутильные группы, пентил, трет-пентил, втор-пентил и метилированные пентильные группы. Используемые здесь термины ненасыщенная низшая алкильная группа и насыщенная низшая алкильная группа будут означать то, что обычно у специалиста ассоциируется с терминами ненасыщенный и насыщенный. Термин низший алкил будет относиться как к насыщенным, так и к ненасыщенным низшим алкильным группам. (Например, насыщенная группа не содержит двойных или тройных связей). Используемый здесь термин алкилзамещенный алкен обозначает любой алкен с двумя-семью атомами углерода, который содержит алкильный заместитель. Используемый здесь термин эпоксидное кольцо обозначает трехчленное кольцо, состоящее из двух атомов углерода и атома кислорода. Используемый здесь термин азиридиновое кольцо обозначает трехчленное кольцо,состоящее из двух атомов углерода и атома азота. Используемый здесь термин сульфидное 12 кольцо обозначает трехчленное кольцо, состоящее из двух атомов углерода и атома серы. Используемый здесь термин эписульфидное кольцо обозначает трехчленное кольцо, состоящее из двух атомов углерода и атома серы. Используемый здесь термин сульфатное кольцо обозначает пятичленное кольцо, состоящее из цепи углерод-углерод-кислород-серакислород с двумя дополнительными атомами кислорода, присоединенными к атому серы. Используемый здесь термин моноалкилфосфатное кольцо обозначает пятичленное кольцо,состоящее из цепи углерод-углерод-кислородфосфор-кислород с двумя дополнительными атомами кислорода, один из которых несет низшую алкильную группу, присоединенными к атому фосфора. Используемый здесь термин простая незамещенная ароматическая группа относится к обычным ароматическим кольцам с 4n+2 электронами в моноциклической или в бициклической сопряженной системе, например, но не в порядке ограничения, к фурилу, пирролилу,тиенилу, пиридилу и т.п., или к бициклической сопряженной системе, например, но не в порядке ограничения, к индолилу или нафтилу. Используемый здесь термин простая замещенная ароматическая группа относится к простому ароматическому кольцу, замещенному одной группой, выбранной из группы, состоящей из галогена и низшей алкильной группы. Используемое здесь определение гетероароматический относится к ароматическим кольцам, содержащим один или несколько неуглеродных атомов, выбранных из группы, состоящей из атомов кислорода, азота и серы. Наиболее предпочтительные гетероароматические циклы содержат в кольце от трех до восьми атомов. Особенно предпочтительная группа гетероароматических колец имеет три-шесть атомов. Особенно предпочтительно, когда гетероароматическая группа будет содержать в кольце один-три неуглеродных атома. Одной из предпочтительных гетероароматических групп является пятичленное кольцо, содержащее один атом кислорода; однако, указанный термин никоим образом не ограничивается этой группой. Используемое здесь определение гетероциклический относится к циклам, содержащим один или несколько неуглеродных атомов, выбранных из группы, состоящей из атомов кислорода, азота и серы. Гетероциклические группы могут быть насыщенными или ненасыщенными. Кроме того, гетероциклические группы могут конденсироваться друг с другом с образованием бициклической или трициклической системы, например, но не в порядке ограничения, пятичленного кольца с двумя двойными связями или пятичленного кольца с одной двойной связью. Гетероциклические группы могут быть незамещенными или могут содержать от одного до трех заместителей, выбранных из 13 группы, состоящей из (C1-C6)-алкила, карбонила, галогена и OR62. Наиболее предпочтительные гетероциклические группы содержат тривосемь атомов в кольце. Особенно предпочтительная группа гетероциклических групп содержит три-шесть членов. Особенно предпочтительно, если гетероциклическая группа будет содержать от одного до трех неуглеродных атомов. Одной из предпочтительных гетероциклических групп является пятичленное кольцо с одним атомом азота, одним атомом серы, одним метильным заместителем и двумя двойными связями. Предпочтительная гетероциклическая группа представляет, но не ограничивается этой группой, Определение замещенная гетероароматическая относится к группе, замещенной однимтремя заместителями, выбранными из группы,состоящей из простого алкила и галогена. Используемый здесь термин галоген,или гало, относится к членам группы периодической таблицы, исторически известным как галогены. Способы галогенирования включают, но ограничиваются перечисленным, присоединение галогенводородов, замещение при высокой температуре, галогенирование на свету, и т.п., и эти способы известны специалистам в этой области техники. Особенно предпочтительными галогенами являются, но не в порядке ограничения, хлор, фтор и бром. Используемый здесь термин арил имеет значения, обычно ассоциирующиеся с этим термином у специалистов. Так, этот термин обозначает органический радикал, образовавшийся от ароматического углеводорода посредством удаления одного атома водорода. Примерами,но не ограничением, являются фенил, толил,салицил и подобные радикалы. Используемый здесь термин млекопитающее относится к классу млекопитающих высших позвоночных. Термин животное будет включать, но не ограничиваться, млекопитающих, рептилий, амфибий и рыб. Термин млекопитающее включает, но не ограничивается этим, человека. Термин лечение, используемый здесь, включает профилактику названного состояния или уменьшение симптомов, или ликвидацию состояния, как только оно установлено. Заявляемые здесь криптофицины могут быть полезны для целей оздоровления в ветеринарии, а также для лечения человека. Когда нужный заместитель R6 в соединении содержит амин, тогда аминозаместитель группы R6 необходимо защитить с использованием аминозащищающей группы. Специалист может легко выбрать подходящую защитную для аминогруппы группу, руководствуясь из 001913Press (London and New York, 1973); Greene,T.W., "Protective Groups in Organic Synthesis",Wiley (New York, 1981). Используемый здесь термин дериватизация относится к стандартным химическим превращениям, известным специалистам в этой области техники, которые позволяют получить соединения данного изобретения. Заявляемый здесь способ относится, в общем, к способу получения синтетических криптофицинов. Удобно, что коммерчески доступные аминокислоты можно циклизовать до молекулы криптофицина. Многие из известных криптофицинов обладают противоопухолевым действием; однако,плохая растворимость в воде может представлять проблему при внутривенном введении лекарственного средства. Такие проблемы связаны с использованием солюбилизирующих поверхностно-активных веществ, таких как кремофор,которые могут обладать присущей им токсичностью. Задачей настоящего изобретения является создание криптофицинов, обладающих противоопухолевой активностью, а также более высокой растворимостью в воде. Такие соединения имеют нужные характеристики по растворимости, а также приемлемую эффективность. Способы получения соединений данного изобретения наиболее предпочтительно осуществлять в присутствии растворителя. Специалист в этой области техники может выбрать подходящие растворители с использованием стандартных подходов. Подходящими инертными органическими растворителями являются растворители, известные специалистам, например, но не как ограничение, тетра-гидрофуран(ТГФ) и диметилформамид (ДМФА). Особенно предпочтителен ДМФА. Для некоторых из используемых здесь способов могут быть подходящими растворители на водной основе. Можно отрегулировать рН такого водного растворителя до нужного значения для облегчения процесса. В таблице приводятся некоторые типичные соединения данного изобретения; однако,такие названные соединения не предназначены для какого-либо ограничения объема данного изобретения. Таблица 1 16 Также представляющими интерес соединениями являются соединения, приведенные в таблице 1, в которых, однако, группа NH заменяет О в положении Y молекулы. Например,одним из соединений этого ряда является Дополнительными предпочтительными соединениями являются, например, но не ограничиваются ими, соединения, названные выше в таблице 1, в которых меняются положения соседних OR и Cl-групп, например, с теми же названными выше заместителями R, в которых основной структурой является Другими представляющими интерес соединениями являются соединения, приведенные в таблице 1, в которых, однако, Аr вместо фенила представляет Аr', и R54 в пара-положении Аr' представляет ОСН 3, в то время как каждый из Также предпочтительными соединениями являются, например, но не ограничиваются перечисленным, соединения, приведенные выше в таблице 1, а также соединения, в которых меняются местами соседние Сl и OR; при этом каждое из названных соединений содержит одну метильную группу вместо двух диметильных групп в положении 6 криптофицинового кольца. См., например, 23, ниже. Особенно предпочтительные соединения данного изобретения содержат диметильную группу в положении 6 криптофицинового кольца. Предпочтительным соединением данного изобретения является представленное в таблице 1 соединение, в котором Аr представляет Аr'; только один из R54, R55 и R56 представляет ОСН 3; каждый из R9 и R10 представляет метил. В способах получения соединений данного изобретения используют общеизвестные силилирующие агенты. См., например, Calvin, E.W.,"Silicon Reagents in Organic Synthesis", AcademicPress (London, 1988). Особенно полезными силилирующими агентами являются агенты, содержащие три-(низший алкил)-силил - термин, охватывающий триизопропилсилил, триметилсилил и триэтилсилил, триметилсилилгалогениды, силилированные мочевины, такие как бис(триметилсилил) мочевина (BSU), и силилированные амиды, такие как N,О-бис(триметилсилил)ацетамид (BSA). Предпочтительным среди них является BSA. Некоторые предпочтительные признаки данного изобретения указываются ниже в таблице, при этом можно выбрать независимо признаки, обеспечивающие предпочтительные варианты воплощения данного изобретения. Изобретение никоим образом не ограничивается описанными ниже особенностями.(нумерация приводится выше в формуле I); И) Аr' представляет фенил с заместителем,выбранным из группы, состоящей из HR59R60,NHOR61 и NHCHR61'; Й) соединение, в котором Y выбирают из группы, состоящей из алкиламино, NH и О; К) соединение, в котором Y представляет О, каждый из R7 и R10 представляет водород; R9 представляет низший алкил; и R1 представляет галоген; Л) каждый из R7 и R8 представляет метил; М) R7 представляет водород; Н) R2 представляет глицинат; О) R2 представляет ацилат; П) R1 и R2 образуют эпоксидное кольцо; Р) R6 выбирают из группы, состоящей из бензила, гидроксибензила, алкоксибензила, галогенгидроксибензила,дигалогенгидроксибензила, галогеналкоксибензила и дигалогеналкоксибензила; С) R4 и R5 образуют двойную связь; Т) n равен 0; R6 представляет замещенный бензил, где одним заместителем является галоген, а другой представляет группу OR12, где R12 представляет низший алкил; У) соединение формулы I применяют для разрушения системы микротрубочек; Ф) соединение формулы I применяют в качестве противоопухолевого средства;X) соединение формулы I применяют для лечения рака у млекопитающего; Ц) соединение формулы I применяют в качестве противогрибкового средства; Ч) R6 имеет формулу III' и является гидроксизaмещенным в пара-положении. Ш) R6 выбирают из группы, состоящей изSO2R21; где R21 выбирают среди водорода и (C1C3)-алкила; ГГ) Аr представляет фенил; ДД) Аr представляет фенил, замещенный одним или двумя заместителями из группы, состоящей из ОН, ОСН 3, галогена и метила; ЕЕ) R2 выбирают из группы, состоящей из галогена, амино, моноалкиламино, диалкиламино, триалкиламмония, алкилтио, диалкилсульфония, сульфатной группы, фосфатной группы,OR31R32 и SR31R32; ЖЖ) R6 содержит Z, где первый атом углерода Z-группы является по отношению к точке присоединения к молекуле криптофицина; ЗЗ) соединение формулы I применяют для лечения микоза; ИИ) R50 представляет ЙЙ) R11 представляет водород; КК) каждый из R4 и R5 представляет водород; ЛЛ) Аr является фенилом, этилзaмещенным в пара-положении; ММ) Аr является фенилом, метилзамещенным в пара-положении; НН) Y представляет NH; Настоящее изобретение относится к способу облегчения патологического состояния,вызванного гиперпролиферирацией клеток млекопитающего, включающему введение субъекту эффективного количества фармацевтической или ветеринарной композиции, описанной здесь, для ингибирования пролиферации клеток. В предпочтительном варианте воплощения дан 19 ного изобретения способ включает также назначение субъекту, по меньшей мере, одного дополнительного лечения, направленного на облегчение патологического состояния. В предпочтительном варианте воплощения данного изобретения патологическое состояние характеризуется образованием неоплазм. В другом предпочтительном варианте воплощения настоящего изобретения неоплазмы выбирают из группы, состоящей из опухолей молочной железы, мелкоклеточных опухолей легкого, немелкоклеточных опухолей легкого, колоректальной опухоли, лейкоза, меланомы, аденокарциномы поджелудочной железы, опухолей в центральной нервной системе (ЦНС), опухолей яичника,предстательной железы, саркомы мягкой ткани или кости, опухолей головы и шеи, опухолей желудочно-кишечного тракта, к которым относятся опухоли поджелудочной железы, пищевода и желудка, миеломы, опухолей мочевого пузыря, почек, опухолей нейроэндокринной системы, к которым относятся опухоли щитовидной железы и опухоли, не относящиеся и относящиеся к болезни Ходжкина. Используемое здесь определение неопластическое относится к новообразованию с аномальным ростом, причем такой рост происходит из-за пролиферации клеток, не подчиняющейся обычным ограничениям роста. Используемый здесь термин противоопухолевое средство включает любое соединение, композицию, добавку, совместную композицию или смесь, которая ингибирует, устраняет, замедляет или реверсирует неопластический фенотип клетки. Антимитотические средства на основании молекулярного механизма их действия можно подразделить на три группы. Первая группа состоит из средств, включающих колхицин и колцемид, которые ингибируют образование микротрубочек путем изоляции тубулина. Вторая группа состоит из средств, включающих винбластин и винкристин, индуцирующих образование паракристаллических скоплений тубулина. Винбластин и винкристин являются хорошо известными противораковыми лекарственными средствами; их воздействие, разрушающее микротрубочки митотического веретена, ингибирует преимущественно гиперпролиферирующие клетки. Третья группа состоит из средств,включающих таксол, которые промотируют полимеризацию тубулина и таким образом стабилизируют микротрубочки. Проявление фенотипа устойчивости к лекарственным средствам и множественной лекарственной устойчивости клетками многих опухолей и клинически доказанный способ действия антимикротрубочных средств против опухолевых клеток требуют разработки средств против микротрубочек, цитотоксичных для опухолевых клеток, неустойчивых к лекарственным средствам, а также цитотоксичных для опухоле 001913 20 вых клеток с фенотипом устойчивости к лекарственным средствам. В настоящее время при лечении рака применяют химиотерапию, операции, лучевую терапию, терапию с биомодуляторами и иммунотерапию. Каждый вид терапии имеет специфические показания, известные специалистам в этой области техники, и один из них или все могут использоваться при попытке добиться общего разрушения опухолевых клеток. Кроме того, комбинированная химиотерапия - химиотерапия с использованием соединений формулыI в сочетании с другими противоопухолевыми средствами также составляет предмет изобретения, так как комбинированная терапия обычно более эффективна, чем применение одного противоопухолевого средства. Таким образом, другой задачей настоящего изобретения является создание композиции, содержащей терапевтически эффективное количество, по меньшей мере, одного соединения формулы I, в том числе его нетоксичные соли присоединения, служащих для обеспечения перечисленных выше преимуществ. Такие композиции также могут дополняться физиологически переносимой жидкостью, гелем или твердыми носителями, разбавителями, адъювантами и эксципиентами. Такие носители, адъюванты и эксципиенты можно найти в U.S. Pharmacopoeia, Vol.XXII, и в National Formulary, Vol.XVII, U.S. PharmacopoeiaConvention, Inc., Rockville, MD (1989). Дополнительные виды лечения приводятся в AHFS DrugFormulary Service, cc.522-660. Каждое из этих упомянутых изданий хорошо известно и доступно для специалистов. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения неопластической болезни, содержащей, по меньшей мере, одно соединение формулы I и, по меньшей мере, одно дополнительное противоопухолевое средство. Противоопухолевыми средствами, которые можно использовать в сочетании с соединениями формулы I, являются средства, указанные в Merck Index 11, pp. 16-17, MerckCo., Inc. (1989). MerckIndex широко известен и доступен для специалистов. В другом варианте воплощения данного изобретения противоопухолевые средства могут представлять антиметаболиты, к которым относятся, но никоим образом ими не ограничиваются, антиметаболиты, выбранные из группы,состоящей из метотрексата, 5-фторурацила, 6 меркаптопурина, цитозина, арабинозида, гидроксимочевины и 2-хлордезоксиаденозина. В другом варианте воплощения настоящего изобретения рассматриваемые противоопухолевые средства могут представлять алкилирующие агенты,которые могут включать, но никоим образом ими не ограничиваются, средства, выбранные из группы, состоящей из циклофосфамида, мефа 21 лана, бусульфана, параплатина, хлорамбуцила и азотистого иприта. Еще в одном варианте воплощения изобретения противоопухолевые средства представляют растительные алкалоиды, к которым можно отнести, но не ограничить перечисленным, средства, выбранные из группы, состоящей из винкристина, винбластина,таксола и этопозида. В другом варианте рассматриваемые противоопухолевые средства представляют антибиотики, к которым можно отнести, но никоим образом этим не ограничиваться, средства, выбранные из группы, состоящей из доксорубицина, даунорубицина, митомицина С и блеомицина. Еще в одном варианте воплощения изобретения рассматриваемые противоопухолевые средства представляют гормоны, к которым можно отнести, но никоим образом ими не ограничиваться, средства, выбранные из группы, состоящей из калустерона, диомоставолона, пропионата, эпитиостанола, мепитиостана, тестолактона, тамоксифена, полиэстрадиолфосфата, мегестеролацетата, флутамида,нилутамида и трилотана. В другом варианте воплощения изобретения рассматриваемые противоопухолевые средства включают ферменты, к которым можно отнести, но не ограничиваться ими, средства,выбранные из группы, состоящей из L-аспарагиназы и производных аминоакридина, таких как, но не только, амсакрин. Дополнительные противоопухолевые средства включают средства, указанные в работе Skeel, Roland Т., "Antineoplastic Drugs and Biologic Response Modifier:(3rd ed.). Little BrownCo. (1991). Эти соединения и композиции можно вводить млекопитающим при применении в ветеринарии. Например, домашних животных можно лечить теми же способами, что и больных людей. Обычно, дозировка, необходимая для лечебного действия, будет меняться в соответствии с видом применения, способом введения,а также конкретными требованиями отдельных хозяев. Обычно дозировка составляет интервал примерно от 0,001 до 1000 мг/кг, а чаще - 0,0110 мг на кг массы тела хозяина. С другой стороны, дозировки в пределах этих интервалов можно вводить путем непрерывного вливания на протяжении длительного периода времени,обычно превышающем 24 ч, до получения желательного лечебного действия. Действительно,дозировку лекарственного средства, так же, как и способ введения, необходимо выбирать с учетом относительной эффективности, относительной токсичности, особенностей роста опухоли и действия соединения формулы I на клеточный цикл, фармакокинетики лекарственного средства, возраста, пола, физического состояния пациента и предшествующего лечения, что может установить специалист. 22 Соединение формулы I, с дополнительными противоопухолевыми средствами или без них, можно вводить в состав терапевтических композиций в виде естественной формы или формы соли. Фармацевтически приемлемые нетоксичные соли включают соли присоединения оснований, которые могут образовывать неорганические основания, такие как, например,гидроксиды натрия, калия, аммония, кальция или железа (3), и такие органические основания как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и подобные. Такие соли могут также образовываться в виде солей присоединения кислот с любыми свободными катионными группами, и обычно будут образовываться с неорганическими кислотами,такими как, например, хлористоводородная или фосфорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, винная,миндальная и подобные. Дополнительные эксципиенты, также предлагаемые по изобретению специалисту, см., например, в Фармакопеи США. Пригодность определенных носителей для включения их в данные терапевтические композиции зависит от предпочтительного способа введения. Например, можно составить противоопухолевые композиции для перорального введения. Такие композиции обычно готовят в виде жидких растворов или суспензий или в твердой форме. Пероральная композиция обычно содержит такие добавки, как связующие, наполнители, носители, консерванты, стабилизаторы,эмульгаторы, буферы, маннит, лактозу, крахмал,стеарат магния, натрийсахарин, целлюлозу, карбонат магния и подобные. Эти композиции могут принимать форму растворов, суспензий,таблеток, пилюль, капсул, составов с отсроченным высвобождением или порошков и обычно содержат 1%-95% активного ингредиента. Предпочтительнее, такая композиция содержит примерно от 2% до, примерно, 70% активного ингредиента. Композиции настоящего изобретения можно получить в виде составов для инъекций или в виде жидких растворов, или суспензий,или эмульсий; или твердых форм, пригодных для приготовления раствора или суспензии в жидкости перед инъекцией. Такие составы для инъекций можно вводить подкожно, внутривенно, интраперитонеально, внутримышечно, внутриоболочечно или интраплеврально. Активный ингредиент или ингредиенты часто смешивают с разбавителями, носителями или эксципиентами, которые физиологически переносимы и совмещаются с активным ингредиентом (ингредиентами). Подходящими разбавителями и эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин или подобные вещества и их комбинации. Кроме того,если желательно, композиции могут содержать небольшое количество вспомогательных ве 23 ществ, таких как смачиватели или эмульгаторы,стабилизаторы или буферирующие вещества. Изобретение также относится к использованию соединений формулы I для ингибирования пролиферации клеток млекопитающего посредством приведения в контакт этих клеток с соединением формулы I в количестве, достаточном для ингибирования пролиферации клетки млекопитающего. Предпочтительным вариантом является способ ингибирования пролиферации гиперпролиферирующих клеток млекопитающего. Для данного изобретения гиперпролиферирующие клетки млекопитающего являются клетками, не поддающимися характерным ограничениям роста (например, запрограммированной гибели клеток). Другим предпочтительным вариантом является случай, когда клетка млекопитающего является человеческой клеткой. Изобретение также относитсяк контактированию клетки млекопитающего, по меньшей мере, с одним соединением формулы I и, по меньшей мере, с одним противоопухолевым средством. Типы рассматриваемых противоопухолевых средств описываются выше. Изобретение также относится к использованию соединения формулы I для ингибирования пролиферации гиперпролиферирующих клеток с фенотипами лекарственной устойчивости, включая клетки с фенотипами множественной лекарственной устойчивости, посредством контакта указанной клетки с соединением формулы I в количестве, достаточном для ингибирования пролиферации гиперпролиферирующей клетки млекопитающего. Предпочтительным вариантом является случай, когда клетка млекопитающего является человеческой клеткой. Изобретение также относится к контактированию соединения формулы I и, по меньшей мере,одного дополнительного противоопухолевого средства из описанных выше. Изобретение относится к способу облегчения патологических состояний, вызванных гиперпролиферирующими клетками млекопитающего, например, неоплазии, посредством введения субъекту эффективного количества фармацевтической композиции, содержащей соединение формулы I, для ингибирования пролиферации гиперпролиферирующих клеток. Используемый здесь термин патологическое состояние относится к любой патологии, появляющейся из-за пролиферации клеток млекопитающего, которая не поддается нормальным ограничениям роста. Такая пролиферация клеток может происходить в связи с описанными выше новообразованиями. В другом предпочтительном варианте воплощения изобретения опухолевые клетки являются человеческими клетками. Настоящее изобретение относится к способам облегчения таких патологических состояний с использованием соединения формулы I в сочетании с дру 001913 24 гими видами лечения, а также другими противоопухолевыми средствами. Эффективность заявляемого соединения можно оценить с использованием стандартных способов, известных специалисту в этой области техники. Примерами таких способов являются способы, описанные ниже. Обнаружено, что соединения данного изобретения полезны против патогенных грибов. Например, полезность для лечения от Cryptococcus neoformans можно проиллюстрировать результатами испытаний против Cryptococcusneoformans с использованием среды основного декстрозного агара с азотом дрожжей. При осуществлении анализа соединение данного изобретения растворяют в диметилсульфоксиде с добавлением твина 20. Осуществляют двойное разведение стерильной дистиллированной водой с 10% ДМСО для получения конечной концентрации лекарственного средства на агаровых пластинках с разведением в интервале от 0,008 мкг/мл до 16,0 мкг/мл при анализе против расширенного набора из 84 штаммов Cryptococcusneoformans. Чтобы проиллюстрировать нужную противогрибковую активность, определяют минимальную ингибирующую концентрацию против набора из 84 изоляторов Cryptococcus neoformans. Соединения отбирают по минимальной ингибирующей концентрации против KB - клеточной линии носоглоточной карциномы человека,и LoVo - клеточной линии колоректальной аденокарциномы человека, используя анализ по Корбетту, см. Corbett, Т.Н., et al., Cytotoxic Anticancer Drugs: Models and Concepts for Drug Discovery and Development, pp. 35-87, Kluwer Academic Publishers, Norwell, 1992. См. также Valeriote et al., Discovery and Development of Anticancer Agents; Kluwer Academic Publisher, Norwell, 1993, что также используют для оценки соединений. Наиболее активные соединения также оценивают, с использованием анализа по Корбетту,на цитотоксичность в отношении 4 различных типов клеток, например, лейкоза мыши, твердой опухоли мыши, твердой опухоли человека и слабозлокачественного фибробласта. Соединения также оценивают на действие против широкого спектра опухолей мыши и человека, имплантированных мышам, в том числе, опухолей, устойчивых к лекарственным средствам. Также в качестве оценки используют опухолевый груз (Т/С) (отношение опухолевого груза у обработанных животных к опухолевому грузу у необработанных животных). Величины Т/С менее 42% считаются активными по стандартам Национального института рака; величины Т/С менее 10% по стандарту Национального института рака считаются присущими отличной(ТРИТЦ),сульфородамин В (SRB) и антитела против тубулина и виментина коммерчески доступны от известных продавцов. Минимальная среда Игла, содержащая соли Эрла (ВМЕ), и фетальная бычья сыворотка (FBS) также доступны коммерчески. Клеточные линии Линию Т-клеточного лейкоза Юрката и аортные гладкомышечные клетки крысы А-10 получают от Американской коллекции типовых культур и культивируют, в ВМЕ, содержащей 10% FBS и 50 мкг/мл сульфата гентамицина. Клетки овариальной карциномы человека(SKOV3) и сублинии, отобранной на устойчивость к винбластину (SKVLB1), любезно предоставлены Dr. Victor Ling из Института рака,Онтарио. Обе клеточные линии сохраняются в ВМЕ, содержащей 10% FBS и 50 мкг/мл сульфата гентамицина. Винбластин добавляют к клеткам SKVLB1 до конечной концентрации 1 мкг/мл через 24 ч после пересева для поддержания селекционного давления на клетки, сверхэкспрессирующие Р-гликопротеин. Анализы клеточной пролиферации и задержки цикла Анализы клеточной пролиферации осуществляют так, как описывают Skehan с сотр. В случае клеток Юрката культуры обрабатывают указанными лекарственными средствами так,как описывает Skehan, и определяют общее число клеток путем подсчета клеток в гемоцитометре. Процент митотических клеток определяют путем окрашивания 0,4% Giemsa в ЗФР с последующим быстрым промыванием в ЗФР. По меньшей мере 1000 клеток на обработку оценивают на наличие картины митоза, и вычисляют митотический показатель как отношение клеток с картиной митоза к общему числу подсчитанных клеток. Иммунофлуоресцентные анализы Клетки А-10 выращивают почти до слияния на покровных стеклах в ВМЕ с 10% FBS. Соединения в ЗФР добавляют до указанной конечной концентрации, и клетки инкубируют еще в течение 24 ч. В случае окрашивания микротрубочек и промежуточных филаментов клетки фиксируют холодным метанолом и инкубируют с ЗФР, содержащим 10% телячьей сыворотки, для блокировки сайтов неспецифического связывания. Затем клетки инкубируют при 37 С в течение 60 мин либо с моноклональным антитубулином, либо с моноклональным антивиментином при разведениях, рекомендованных изготовителем. Связанные первичные антитела затем визуализируют посредством 45 001913 26 минутной инкубации с конъюгированным с флуоресцеином козьим антимышиным IgG. Покровные стекла помещают на предметные стекла микроскопа, и проверяют и фотографируют картины флуоресценции с использованием фотомикроскопа I11, Zeiss, снабженного эпифлуоресцентной для флуоресцеина оптикой. В случае окрашивания микрофиламентов клетки фиксируют 3% параформальдегидом, пропитывают 0,2% тритоном Х-100 и химически восстанавливают борогидридом натрия (1 мг/мл). Затем добавляют ЗФР, содержащий 100 нМ ТРИТЦфаллоидина, и смесь инкубируют в течение 45 мин при 37 С. Клетки быстро промывают ЗФР перед установкой покровных стекол на предметные стекла и сразу фотографируют, как описано выше. Действие криптофицинов и винбластина на пролиферацию клеток Юрката и клеточный цикл Строят кривые зависимости доза-ответ влияния криптофицинов и винбластина на пролиферацию клеток, и определяют процент клеток в состоянии митоза. Действие цитохалазина В, винбластина и криптофицинов на цитоскелет Аортные гладкомышечные клетки (А-10) выращивают на покровных стеклах и обрабатывают ЗФР, 2 мкМ цитохалазина В, 100 нМ винбластина или 10 нМ криптофицинов. Через 24 ч визуализуют микротрубочки и промежуточные виментиновые филаменты с помощью непрямой иммунофлуоресценции, и окрашивают микрофиламенты с использованием ТРИТЦ-фаллоидина. Определяют морфологическое действие каждого лекарственного средства. Необработанные клетки демонстрируют обширные сетки из микротрубочек, полные перинуклеарных образующих микротрубочки центров. Виментиновые промежуточные филаменты также равномерно разрушаются в цитоплазме, в то время как пучки микрофиламентов концентрируются вдоль основной оси клетки. Цитохалазин В вызывает полную деполимеризацию микрофиламентов одновременно с накоплением паракристаллических остатков. Это соединение не влияет на разрушение микротрубочек или промежуточных филаментов. В случае обработанных криптофицином микротрубочек и виментиновых промежуточных образований наблюдают очищение от микротрубочек и свертывание виментиновых промежуточных филаментов. Действие криптофицинов и винбластина на стабилизированные таксолом микротрубочки Клетки А-10 обрабатывают в течение 3 ч 0 или 10 мкМ таксола перед добавлением ЗФР,100 нМ винбластина или 10 нМ криптофицина. Через 24 ч проверяют образование микротрубочек с помощью иммунофлуоресценции, как описано выше. По сравнению с микротрубочками в контрольных клетках микротрубочки в клетках, обработанных таксолом, группируются 27 повсеместно, в особенности в полярных участках клеток. Как и прежде, винбластин вызывает полную деполимеризацию микротрубочек предварительно необработанных клеток. Однако предварительная обработка таксолом предотвращает деполимеризацию микротрубочек в ответ на винбластин. Подобным образом микротрубочки, предварительно обработанные таксолом, наблюдаются при обработке криптофицином. Реверсивность деполимеризации микротрубочек под действием винбластина и криптофицина Клетки А-10 обрабатывают или 100 нМ винбластина, или 10 нМ криптофицина в течение 24 ч, что приводит, в результате, к полной деполимеризации микротрубочек. Затем клетки промывают и инкубируют в среде без лекарственного средства в течение 1 ч или 24 ч. Микротрубочки снова быстро полимеризуются после удаления винбластина, причем высокое содержание микротрубочек демонстрируется через 1 ч, а полное восстановление морфологии - через 24 ч. Клетки визуализуют на состояние микротрубочек после обработки криптофицином данного изобретения или через 1 ч, или через 24 ч после удаления криптофицинов. Действие сочетаний винбластина и криптофицинов на клеточную пролиферацию Клетки SKOV3 обрабатывают комбинациями из криптофицинов и винбластина в течение 48 ч. Затем определяют процент выживающих клеток, и вычисляют IC50 для каждой комбинации. Токсичность криптофицинов, винбластина и таксола в отношении клеток SKOV3 и SKVLB1 Клетки SKVLB1 устойчивы к противораковым средствам из натуральных продуктов изза их сверхэкспрессии Р-гликопротеина. Наблюдают способность таксола, винбластина и криптофицинов ингибировать рост клетокSKOV3 и SKVLB1. Таксол вызывает зависящее от дозы ингибирование пролиферации обеих клеточных линий при значениях IС 50 дляSKOV3 и SKVLB1 1 и 8000 нМ, соответственно. Винбластин также ингибирует рост обеих клеточных линий при значениях IC50 для SKOV3 иSKVLB1 0,35 и 4200 нМ, соответственно. Криптофицины данного изобретения демонстрируют активность при значениях IС 50 примерно от 1 до, примерно, 1000 нМ для клеток SKOV3 иSKVLB1. Таким образом, можно показать, что настоящее изобретение относится к новым криптофицинам, являющимся сильными ингибиторами клеточной пролиферации, действующими посредством разрушения микротрубочной сети и подавления митоза. Эти исследования могут проиллюстрировать, что криптофицины разрушают структуру микротрубочек и, таким образом, нормальные клеточные функции, в том числе функции митоза. 28 Классические средства против микротрубочек, такие как колхицин и алкалоиды Vinca,останавливают деление клеток в митозе. Представляется подходящим сравнить действие этих средств на клеточную пролиферацию с действием криптофицинов. Для этой цели в качестве представителя классических средств против микротрубочек выбирают алкалоид Vinca винбластин. Соответственно, сравнивают действие криптофицинов и винбластина на пролиферацию и развитие клеточного цикла клеточной линии лейкоза Т-клеток Юрката. Так как антимитотическое действие обычно передается через разрушение микротрубочек в митотических веретенах, действие криптофицинов на цитоскелетные структуры характеризуют с помощью флуресцентной микроскопии. Иммунофлуоресцентное окрашивание клеток, обработанных или криптофицином, или винбластином, показывает, что оба соединения вызывают полное исчезновение микротрубочек. Подобные исследования с клетками SKOV3 могут показать, что действие криптофицинов против микротрубочек не является уникальным лишь для гладкомышечной клеточной линии. Исследование GC3 карциномы ободочной кишки человека В выбранные лунки 96-луночного микропланшета высевают клетки GC3 карциномы ободочной кишки человека (1 х 10 клеток в 100 мкл среды для анализа на лунку). В другие выбранные лунки 96-луночного микропланшета добавляют среду для анализа без клеток. К среде для анализа (используют среду RPM1-1640; однако, приемлемой будет любая среда, в которой будут выживать клетки) добавляют 10% диализованной фетальной бычьей сыворотки и 25 мМ буфера HEPES. Испытываемое соединение до испытаний хранят в янтарном флаконе. Свежий исходный раствор в диметилсульфоксиде (200 мкг/мл) готовят непосредственно перед получением разведений испытываемого образца в забуференном фосфатом физиологическом растворе(ЗФР). Получают разведение раствора в диметилсульфоксиде в ЗФР 1:20, так что конечная концентрация составляет 10 мкг/мл. Получают серийные разведения 1:3 с использованием ЗФР(0,5 мл предыдущего раствора с 1 мл ЗФР). Для анализа используют пробирки Фалькона 2054. Образец в 10 мкл каждого разведения испытываемого соединения добавляют, при трехкратном повторении, в лунки микропланшетов сGC3. Микропланшеты инкубируют в течение 72 ч при 37 С. В каждую лунку добавляют 10-мкл образец исходного раствора соли - бромида 3[4,5-диметил-2-ил]-2,5-дифенилтетразолия(МТТ, 5 мг/мл, в ЗФР). Планшеты инкубируют примерно в течение часа при 37 С. Планшеты центрифугируют, среды из лунок декантируют, и в каждую лунку добавляют 100 мкл кислого изопропанола (0,04 N HCl в изопро 29 паноле). Планшет прочитывают в пределах одного часа с использованием длины волны при измерениях 570 нм (аппарат для чтения планшетов SpectraMax). Оценка соединений формулы I приводит к выводу, что соединения могут быть полезны при заявляемых здесь способах лечения. Кроме того, соединения будут полезны для разрушения системы микротрубочек. Получение соединений данного изобретения можно осуществить с использованием ряда схем с участием активированного сложного эфира с последующей хроматографией и, при необходимости, с индуцированным кислотой деблокированием. Например, обработка 1 (здесь выделенные жирным шрифтом цифры относятся к номерам соединений, указанным в разделе примеров) уксусным ангидридом в присутствии триэтиламина и 4-диметиламинопиридина дает 3 с выходом 89% после флэш-хроматографии. Подобным образом получают 4 из 1 при действии янтарного ангидрида с последующей очисткой ВЭЖХ с обращенной фазой. Действие раствора 1 в пиридине на коммерчески доступный гидрохлорид никотиноилхлорида в присутствии триэтиламина и 4-диметиламинопиридина с последующей хроматографией и обработкой хлористым водородом дает 7 с высоким выходом. Пиридиниевую соль 8 получают с выходом 48% по способу, описанному в Nicolaou, Angew. Chem.Int. Ed. Engl., 1994, 33, в соответствии с которым 1 обрабатывают коммерчески доступным п-толуолсульфонатом 2-фтор-1-метилпиридиния с последующей очисткой ВЭЖХ с обращенной фазой с сопутствующим анионным обменом (п-толуолсульфанат на ацетат) и лиофилизацией. Сложные эфиры 5, 9, 11, 13, 15, 17, 19 и 21 - все получают с выходом от среднего до высокого из 1 и коммерчески доступных (за исключением случаев 5 и 9) N-t-boc-защищенных аминокислот с активацией при действии 1,3 дициклогексилкарбодиимида в присутствии 4 диметиламинопиридина. Хлористоводородные соли 10, 12, 14, 16, 18, 20 и 22 получают с высоким выходом из 9, 11, 13, 15, 17, 19 и 21, соответственно, после обработки 4,0 М раствором хлористого водорода в диоксане и удаления растворителя в вакууме. Динатриевую соль 6 получают из 5 после вызванного хлористоводородной кислотой расщепления трет-бутилового эфира и обработки гидроксидом натрия. Требуемую для получения 5 кислоту 24 синтезиру 001913 30 ют с выходом 63% 5-стадийным способом,представляющим способ Джонса (Synthesis,1988, 142) для введения фосфатной функциональной группы. Некоторые из новых конъюгатов проанализированы на цитотоксичность in vitro на модели опухолевых клеток GC3. Из результатов,приведенных в табл. 2, ясно, что для этого ряда соединений присуща активность от хорошей до отличной относительно активности криптофицина 55 (1). Получение любого сложного эфира типа 2(R1 или R2 образуются от карбоновой кислоты) включает ряд технологий с использованием хлорангидридов кислот, ангидридов и обычных активирующих реагентов (например, карбодиимидов)2. Можно использовать любой растворитель, иной чем участвующие в реакции спирты. В помощь этерификации можно использовать любые слабые основания и/или катализаторы(амины, карбонаты). Конверсию карбаматов 9, 11, 13, 15, 17, 19 и 21 в соответствующие соли можно осуществить с помощью любой сильной кислоты, а именно с помощью минеральных кислот, к которым относятся галогениды водорода, серная кислота, фосфорная кислота, азотная кислота,хлорная кислота, или сильных органических кислот, таких как трифторуксусная, п-толуолсульфоновая и метансульфоновая кислоты. Те же кислоты можно использовать для получения солей типа 7 из соответствующего свободного основания. Ряд контрионов (катионов) может входить в соли типа 6, включая любые щелочные и щелочно-земельные металлы. Ряд контрионов (анионов) может входить в соли типа 8,а именно, любое сопряженное с кислотой основание (с органической или минеральной). Таблица 2. Данные по цитотоксичности in vitro для производных криптофицинов, полученные с использованием описанных выше анализов Соединение Приводятся дополнительные соединения данного изобретения и результаты анализов с 32 Испытаны другие соединения данного изобретения при анализе с GC3, и из значенияIC50 находятся в интервале величин от менее единицы примерно до 700 нМ; однако, наиболее типичными значениями являются величины менее 100 нМ. В табл. 3 приводятся результаты сравнительных предварительных определений растворимости 21, 1 и 12. Эти результаты показывают повышенную растворимость 12. Таблица 3. Сравнительная растворимость криптофицинов 1, 12 и 27 27 1 12 Эксципиент, объем доведен(НПКО - ниже предела количественного определения,приблизительно 0,001 мг/мл) Проводят сравнение характеристик устойчивости 1 и 12 в водной среде с рН 4-8 в течение 6 ч при комнатной температуре. Результаты этих исследований ясно показывают, что отличные показатели растворимости в воде и устойчивости у 12. Например, при рН 8 криптофицин 55 имеет значение растворимости 10 мг/мл при комнатной температуре против растворимости 30 мг/мл для 12, по существу, при тех же условиях. При рН 4 показатель растворимости криптофицина 55 в воде 50 мг/мл; однако, растворимость криптофицина 55 в воде снижается, когда рН становится щелочным, в то время как растворимость в воде 12 остается по существу постоянной, во всем исследованном интервале рН. На основании результатов по растворимости и устойчивости выбирают подходящие парентеральные носители для определения абсолютных характеристик растворимости, устойчивости для 12. Табл. 4 иллюстрирует параметры растворимости 12 в этих носителях. Предварительные результаты показывают приемлемую устойчивость 12 в композиции 6 в течение времени до 3 недель. Таблица 4. Растворимость криптофицинглицината 12 в различных парентеральных носителях Эксципиент 1. Этанол Пропиленгликоль 0,05 М цитратн. буфер рН 4,0 2. Этанол Пропиленгликоль 0,05 М ацетатн. буфер рН 4,0 3. Этанол 0,05 М ацетатн. буфер рН 4,0 4. Пропиленгликоль 0,05 М ацетатн. буфер рН 4,0 5. Полисорбат 80 0,05 М ацетатн. буфер рН 4,0 6. Этанол Пропиленгликоль 0,05 М ацетатн. буфер рН 4,0 Таким образом можно достичь высоких концентраций соединения данного изобретения в носителе, не содержащем поверхностноактивного вещества или эмульгатора, что, в свою очередь, должно облегчить токсикологические и клинические оценки этих соединений. Эфир глицинат (12) также позволяет иметь лучшую устойчивость в водной окружающей среде в физиологическом интервале рН на протяжении более длительных периодов времени,что указывает на повышенную устойчивость при хранении при нормальных условиях. В то время как для хранения 1 и 27 необходимо получать концентраты, и затем разводить их перед введением, существует возможность получения готовых к применению растворов соединений данного изобретения. Соединения формулы I можно получать с использованием соединения формулы II где Аr, R1, R2, R3, R4, R5, R7, R8, R9, R10 имеют значения, установленные выше для формулы I,R13 выбирают из группы, состоящей из трет-бутилкарбамата (ВОС); где R-группы и различные заместители имеют значения, установленные выше и по ходу описания, можно, получить посредством приведения в контакт соединения формулы IV 34 где R25 представляет удаляемую группу, значения которой определены с кислотой формулы для R27; где R27 выбирают из группы, состоящей из Н, (C1-C12)-алкила и арила; и силилирующим агентом. Особенно предпочтительным силилирующим агентом является бис-N,O-триметилсилилацетамид (БСА). Используемое здесь выражение активный сложно эфирный заместитель относится к заместителю, который превращает указанный заместитель в удобную отщепляющуюся группу. Подходящие заместители можно выбрать, обратившись к стандартным руководствам, например, к "Protective Groups in Organic Chemistry",Plenum Press (London and New York, 1973);Greene, T.W., "Protective Groups in Organic Synthesis", Willey (New York, 1981). См., в особенности, cc. со 180 по 184 в труде Greene. Особенно предпочтительной активной сложноэфирной замещающей группой является N-гидроксисукцинимидная (NHC). Другими предпочтительными группами являются, но не ограничиваются перечисленным,(O-N-гидроксисукцинимид), O-N-гидроксисульфосукцинимид и их соли, O-2-нитрофенил, O-4-нитрофенил иO-2,4-дихлорфенил, где О относится к кислородной группе, необходимой для образования сложноэфирной функциональной группы. Используемый здесь термин амид относится к амидной функциональной группе, которую можно отщепить с использованием щелочи. Например, термин относится, но никоим образом не ограничивается этим, к -NMe2. В качестве дополнительного руководства см., например,Greene, T.W., "Protective Groups in Organic Synthesis", Willey (New York, 1981). Используемое здесь выражение активный сложноэфирный заместитель относится к заместителю, который превращает заместительOR24 в удобную отщепляющуюся группу. Подходящие заместители можно выбрать, обратившись к стандартным руководствам, например, кPress (London and New York, 1973); Greene,T.W., "Protective Groups in Organic Synthesis",Willey (New York, 1981). Особенно предпочтительной активной группой R25 является Nгидроксисукцинимидная (NГC). Описанные здесь способы наиболее предпочтительно осуществлять в присутствии растворителя. Специалист может выбрать подходящий растворитель для описанного выше процесса. Особенно предпочтительны инертные органические растворители; однако, при определенных условиях подходящим может быть водный растворитель. Например, если R27 пред 35 ставляет водород, а R13 представляет ВОС, в качестве растворителя эффективным будет растворитель на водной основе. Когда нужный заместитель R6 в соединении формулы I содержит амин, тогда аминозаместитель в группе R6 должен быть защищен с использованием аминозащищающей группы. Специалист может легко выбрать подходящую аминозащищающую группу, руководствуясь известными трудами, например, "ProtectiveR27 должен представлять группу, допускающую удаление заместителя -CO2R27 с использованием кислой, нейтральной или слабощелочной среды. Предпочтительными группамиR27 являются, но не ограничиваются перечисленным, водород, (C1-C6)-алкил, трихлорметил,трихлорэтил и метилтиометил. Особенно предпочтительно, когда R27 представляет водород. Также для руководства для специалиста приводятся нижеследующие схемы процессов. Соединение формулы I можно получить с использованием соединения формулы II где Аr, R1, R2, R3, R4, R5, R7, R8, R9, R10 имеют значения, установленные выше для формулы I.R24 выбирают из группы, состоящей из активного сложноэфирного заместителя, амидного заместителя, O-2-нитрофенила, O-4-нитрофенила и O-2,4-дихлорфенила; Х представляет О, NH или алкиламино; где R-группы и различные заместители имеют значения, установленные выше и по ходу описания, можно получить посредством приведения в контакт соединения формулы IV где R25 представляет удаляемую группу, значения которой определены с кислотой формудля R27,где R27 выбирают из группы, состоящей из Н, (C1-C12)-алкила и арила; и силилирующим агентом. Особенно предпочтительным силилирующим агентом является бис-N,О-триметилсилилацетамид (БСА). Используемое здесь в отношении R25 выражение активный сложно эфирный заместитель относится к заместителю, который превращает заместитель OR24 в удобную отщепляющуюся группу. Подходящие заместители можно выбрать, обратившись к стандартным руководствам, например, к "Protective Groups inGroups in Organic Synthesis", Willey (New York,1981). Особенно предпочтительной активной группой R25 является N-гидроксисукцинимидная(NГС). Описанные здесь способы наиболее предпочтительно осуществлять в присутствии растворителя. Специалист может выбрать подходящий растворитель для описанного выше процесса. Особенно предпочтительны инертные органические растворители; однако, при определенных условиях подходящим может быть водный растворитель. Например, если R27 представляет водород, а R13 представляет ВОС, в качестве растворителя эффективным будет растворитель на водной основе. Когда нужный заместитель R6 в соединении формулы I содержит амин, тогда аминозаместитель в группе R6 должен быть защищен с использованием аминозащищающей группы. Специалист может легко выбрать подходящую аминозащищающую группу, руководствуясь известными трудами, например, "ProtectiveR27 должен представлять группу, допускающую удаление заместителя -CO2R27 с использованием кислой, нейтральной или слабощелочной среды. Предпочтительными группамиR27 являются, но не ограничиваются перечисленным, водород, (C1-C6)-алкил, трихлорметил,трихлорэтил и метилтиометил. Особенно предпочтительно, когда R27 представляет водород. Также для руководства для специалиста приводятся нижеследующие схемы процессов. лы 38 В общих чертах способы данного изобретения поясняются ниже. На схеме I' и далее в описании R1' представляет галоген, SH, амино, моноалкиламино,диалкиламино, триалкиламмоний, алкилтио,диалкилсульфоний, сульфатную группу, фосфатную группу или защищенную ОН- или защищенную SH-группу;R2 представляет ОН или SH; R26 представляет спиртозащищающую группу, вводимую во время стадии процесса синтеза для защиты спиртовой группы, которая в противном случае может реагировать по ходу химических превращений, и затем удаляемую на более поздней стадии синтеза. Многие реакции для образования и удаления таких защитных групп описаны в известных работах, в том числе, например, вPress (London and New York, 1973); Greene,T.W., "Protective Groups in Organic Synthesis",Willey (New York, 1981). Специалист может легко выбрать подходящую группу, защищающую спиртовую группу, в частности, обратившись к указанным работам. Одной из особенно полезных групп, защитных для спиртовых групп, является трет-бутилдиметилсилильная группа (ТБС). Можно, с использованием стандартных способов, дериватизировать продукты,полученные по указанным схемам, и получить другие криптофицины.R6 и R11' имеют значения, определенные в описании. Можно, с использованием стандартных способов, получить другие производные продукта, полученного по приведенной схеме, и получить другие криптофицины. Руководствуясь описанными ранее схемами и следующими далее примерами, специалист может использовать соответствующие исходные вещества и реагенты, и получить нужные соединения. Исходный сложный эфир можно получить,например, по следующей схеме.(стандартный реагент для восстановления ненасыщенного сложного эфира до аллилового спирта);SAE - нерезкое асимметричное эпоксидирование (установленная реакция для энантиоселективного эпоксидирования аллиловых спиртов);EDCI - 1-этил-3-(3-диметиламинопропил) карбодиимид. Схема получения сложного эфира поясняется в дальнейшем с помощью раздела препаративных примеров, где показываются конкретное применение схемы для удобства специалиста. Схема IR6 имеет значения, установленные выше. Далее приводятся схемы, составляющие дополнительное руководство. На схемах, в препаративных примерах и примерах используются некоторые аббревиатуры, общеизвестные в технике. К числу таких аббревиатур относятся аббревиатуры, приведенные, для удобства, ниже.- реакция Хорнера-ЭммонсаУодсворса (стандартная реакция олефинирования альдегида с использованием фосфоната и основания); Схематическое пояснение не предназначается для ограничения схемы синтеза только до показанного фенильного кольца. Напротив, специалист может широко применять этот способ для получения нужных исходных веществ для заявляемых здесь соединений. Требуемое для реакции время зависит от исходных веществ и рабочей температуры. Оптимальное время реакции для данного способа,как всегда, представляет компромисс, устанавливаемый путем рассмотрения конкурирующих задач производства, для которого благоприятны краткие времена реакций, и максимального выхода, для которого благоприятны длительные по времени реакции. Некоторые соединения данного изобретения можно получить с использованием биосинтетического способа. Например, раствор криптофицина 3 (примерно 0,24 ммоль) в смеси ДМЭ и воды (2:1, 15,0 мл) примерно при 0 С обрабатывают бромсукцинимидом (примерно 65 мг), и нагревают до комнатной температуры. Примерно через 24 ч растворитель удаляют, а остаток растворяют в таком растворителе, как СН 3 СN, и подвергают ВЭЖХ с обращенной фазой (предпочтительно, СН 3 СN/Н 2 О, 65:35, 6 мл/мин), и получают смесь криптофицинов. Смесь повторно хроматографируют ВЭЖХ с нормальной фазой (предпочтительно, гексан с этилацетатом, 1:1, 3 мл/мин), и получают нужные криптофицины.N-хлорсукцинимид (NCS) (0,075 ммоль), и нагреют примерно при 60-70 С в течение примерно 24 ч. Добавляют еще NCS (8 мг), и продолжают нагревание примерно еще в течение 24 ч. Удаляют растворитель, а остаток подвергают ВЭЖХ (35% Н 2 О в СН 3 СN, 6 мл/мин), и получают нужные криптофицины. Получающуюся в результате смесь затем очищают ВЭЖХ с использованием метанола с водой (примерно 4:1),и получают нужные очищенные криптофицины. Для дальнейшего пояснения изобретения приводятся нижеследующие примеры. Объем изобретения никоим образом не следует считать ограниченным этими примерами. Препаративный пример 1 Стадия 1. Метил-5-фенилпент-2(Е)-еноат. Раствор триметилфосфоноацетата (376 г,417 мл, 2,07 моль) в ТГФ (750 мл) перемешивают при 0 С в 3-л 3-горловой круглодонной колбе, снабженной механической мешалкой и трубкой для подачи N2. К охлажденному раствору из капельной воронки по каплям добавляют чистый тетраметилгуанидин (239 г, 260 мл, 2,07 моль). Охлажденный прозрачный бледно-желтый раствор перемешивают в течение 25 мин при 0 С. К реакционному раствору постепенно, по каплям, добавляют раствор гидрокоричного альдегида (90%, 253 г, 248 мл, 1,9 моль) в ТГФ (125 мл). После завершения добавления реакционную смесь перемешивают в течение 10 ч при повышении температуры до комнатной. ГХ показывает отношение продукта к исходному веществу 95:5. К реакционной смеси добавляют 500 мл воды, и реакционную смесь перемешивают в течение ночи, разделяя ее на два слоя. Органический слой отделяют, а водный слой экстрагируют трет-ВuОМе. Органические слои объединяют и сушат над МgSO4, затем концентрируют в вакууме, и получают оранжевое масло. Сырой продукт перегоняют при 129 С и 0,3 мм рт.ст., и получают 360,5 г, с выходом 91,7%, прозрачного светло-желтого масла. М.-с., ионизация электронным ударом (EI),m/е, 190(13; М+), 159(410), 158(39), 131(90),130(62), 117(22), 104(12), 95(57), 91(100), 77(21),65(59); м.-с. высокого разрешения, EI (HREI),m/е, 190,0998 (C12H14O,-0,4 молек.-мас.ед-ц,м.-м.е (mmu; УФ, mах (е) 210 (8400), 260 43 Стадия 2. 5-Фенилпент-2-ен-1-ол. В 12-л 4-горловую круглодонную колбу,снабженную термопарой, механической мешалкой и трубкой для подачи N2, загружают раствор еноата (310,5 г, 1,5 моль) в ТГФ (1,5 л) и охлаждают до -71 С на бане изо-РrОН с СО 2. В реактор добавляют по каплям DIBAL (2,5 л,1,5 М в толуоле, 3,75 моль) со скоростью, при которой температура реакции поддерживается на уровне-50 С. По завершении добавления реакционную смесь перемешивают в течение ночи при температуре реакции-50 С. ТСХ(гексан с EtOAc, 3:1, SiO2) показывает отсутствие исходного вещества через 16 ч. Температуру реакции поднимают до -15 С. Постепенно гасят реакцию с помощью 1N НСl (150 мл). В этот момент реакционная смесь становится гелеобразным твердым веществом. Используют шпатель, чтобы разрушить это полутвердое вещество, и добавляют 1N НСl (200 мл), чтобы сделать смесь более жидкой. Загружают концентрированную НСl (625 мл) с образованием двухфазной системы. Слои разделяют, и экстрагируют продукт трет-ВuОМе. Органический слой сушат над MgSO4 и концентрируют в вакууме, и получают 247,8 г прозрачного бледно-желтого масла. Сырой продукт перегоняют при 145 С и 0,25 мм рт.ст., и получают 209,7 г, выход 86,2%. М.-с., El, m/e 162(1:М+), 144(16), 129 (7),117(9), 108(6), 92(17), 91(100), 75(5), 65(12); M.c., HREI, m/e 162, 1049 (С 11H14 О,- 0,4 м.-м.е); УФ, mах (е) 206(9900), 260(360); ИК max 3356, 2924, 1603, 1496, 1454, 970, 746, 700 см-1; 1(Ph-4') , 63,3(1), 35,4/33,8 (4/5) . Стадия 3. (2S,3S)-2,3-Эпокси-5-фенил-1 пентанол. В 1-л 3-горловую круглодонную колбу,снабженную механической мешалкой, термопарой и трубкой для подачи азота, загружаютCH2Cl2 (350 мл) высушенные молекулярные сита, 4 (30 г), и L-(+)-диэтилтартрат (7,62 г,0,037 моль). Получающуюся в результате смесь охлаждают до -20 С и обрабатывают Ti(O-i-Pr)4(9,2 мл, 0,031 моль), а затем добавляют третбутилгидропероксид (4,0 М в СН 2 Сl2, 182 мл,0,78 моль) со скоростью, при которой поддерживается температура 2 -20 С. По завершении добавления реакционную смесь перемешивают еще в течение 30 мин, а затем обрабатывают раствором аллилового спирта (50 г, 0,31 мoль) вCH2Cl2 (30 мл) со скоростью, при которой поддерживается температура 2 -20 С. Реакционную смесь перемешивают при этой температуре в течение 5 ч, затем фильтруют в раствор гептагидрата сульфата железа (2) (132 г) и винной кислоты (40 г) в воде (400 мл) при 0 С. Смесь 44 перемешивают в течение 20 мин, затем переносят в разделительную воронку и экстрагируют трет-ВuОМе (2 х 200 мл). Объединенную органическую фазу перемешивают с 30% растворомNaOH, содержащим NaCl, в течение 1 ч при 0 С. Слои снова разделяют, и водную фазу экстрагируют трет-ВuОМе. Объединенную органическую фазу промывают рассолом, сушат над МgSO4 и концентрируют, и получают 52,8 г масла янтарного цвета. Стадия 4. (2R,3R)-2-Гидрокси-3-метил-5 фенилпентан-1-ол. В 5-л 3-горловую круглодонную колбу,снабженную механической мешалкой, термопарой и трубкой для подачи азота, загружают гексан (1 л) и охлаждают до 0 С. Добавляют 2,0 М раствор Ме 3 Аl в гексане (800 мл, 1,6 моль), а затем раствор эпоксида (120 г, 0,677 моль) в гексане (250 мл) и СН 2 Сl2 (50 мл), поддерживая температуру на уровне ниже 20 С. По завершении добавления мутную реакционную смесь перемешивают при 5 С в течение 35 мин, после чего добавляют по каплям раствор 10% НСl(300 мл), а затем конц. НСl (350 мл). Слои разделяют, и органическую фазу промывают рассолом и сушат над MgSO4. После удаления летучих веществ в вакууме получают 122,1 г масла. Стадия 5. (2R,3R)-2-Гидрокси-3-метил-5 фенилпент-1-илтозилат. В 2-л 3-горловую круглодонную колбу,снабженную механической мешалкой и трубкой для подачи азота, загружают диол (58 г, 0,30 моль), оксид дибутилолова (1,5 г, 0,006 моль, 2 мол.%), толуолсульфонилхлорид (57,5 г, 0,30 моль), CH2Cl2 (580 мл) и триэтиламин (42,0 мл,0,30 моль). Получающуюся в результате смесь перемешивают при комнатной температуре в течение 2 ч (хотя реакция завершается за время в пределах 1 ч), фильтруют, промывают водой и сушат над MgSO4. После удаления летучих веществ в вакууме получают 104,1 г масла светлоянтарного цвета. Стадия 6. (2R,3R)-2-[(трет-Бутилдиметилсилил)окси]-3-метил-5-фенилпент-1-илтозилат. Раствор тозилата (100 г, 0,29 моль) и триэтиламина (81,0 мл, 0,58 моль) в СН 2 Сl2 (1200 мл) обрабатывают чистым TBS-OTf (99 мл, 0,43 моль), добавляя его по каплям при непрерывном перемешивании еще в течение 20 мин. Реакционную смесь дважды промывают рассолом, сушат над MgSO4 и концентрируют до сухого состояния. Масло растворяют в минимальном количестве гексана и фильтруют через слой диоксида кремния, элюируют гексаном с EtOAC(9:1), и получают 134 г масла светло-янтарного цвета. Стадия 7. (2R,3R,5RS)-2-[(трет-Бутилдиметилсилил)окси]-3-метил-5-бром-6-фенилпент 1-илтозилат. В 5-л 3-горловую круглодонную колбу,снабженную механической мешалкой, обрат 45 ным холодильником и трубкой для подачи азота, загружают ССl4 (1680 мл), TBS-Ts (140 г,0,30 моль), NBS (65 г, 0,365 моль) и AIBN (16,5 г, 0,10 моль). Смесь обезгаживают посредством откачивания в достижимом вакууме при перемешивании и снова заполняют азотом (3 х). Затем реакционную смесь нагревают с обратным холодильником, после чего смесь становится темно-коричневой. После 15-мин энергичного кипячения с обратным холодильником реакционная смесь становится светло-желтой, и хроматографический анализ показывает, что реакция завершилась. После охлаждения до комнатной температуры реакционную смесь фильтруют, и фильтрат концентрируют досуха. Остаток снова растворяют в гексане и снова фильтруют и концентрируют досуха, и получают 170,3 г вещества в виде янтарного масла. Стадия 8. (2R,3R)-2-[(трет-Бутилдиметилсилил)окси]-3-метил-5-фенилпент-4(Е)-ен-1 илтозилат. В 2-л 3-горловую круглодонную колбу,снабженную механической мешалкой, обратным холодильником и трубкой для подачи азота, загружают раствор бромида (100 г, 0,186 моль) в ацетонитриле (700 мл). Добавляют DBU(83,6 мл, 0,557 моль), и получающийся в результате темно-коричневый раствор перемешивают при кипячении с обратным холодильником в течение 15 мин. После охлаждения до комнатной температуры растворитель удаляют в вакууме, а остаток размешивают CH2Cl2 (200 мл) и фильтруют через слой диоксида кремния. Летучие снова испаряют, а остаток растворяют вMgSO4 и концентрируют досуха. Препаративная ГЖХ среднего давления (преп 500) дает нужное ненасыщенное соединение (50,3 г, выход после 4 стадий 60%). Стадия 9. (3S,4R)-3-[(трет-Бутилдиметилсилил)окси]-4-метил-6-фенилгекс-5(Е)-ен-1 нитрил. Тозилат (50 г, 0,11 моль) растворяют в ДМСО (1 л) и обрабатывают KCN (14,2 г, 0,22 моль) и водой (25 мл), и получающуюся в результате смесь перемешивают при 60 С в атмосфере азота в течение 18 ч. После охлаждения до комнатной температуры реакционную смесь обрабатывают EtOАc (1 л) и водой (1 л). Водную фазу экстрагируют EtOAc (500 мл), и объединенную органическую фазу промывают рассолом и сушат над Na2SО 4. Посредством флэшхроматографии на диоксиде кремния с СН 2 Сl2 получают нужный нитрил с выходом 92%. Стадия 10. Метил-(5S,6R)-5-[(трет-бутилдиметилсилил)окси]-6-метил-8-фенилокта-2(Е),7(Е)-диеноат. Нитрил (14,67 г, 46,5 ммоль) растворяют в толуоле (200 мл) и охлаждают до -78 С в атмосфере азота. Добавляют по каплям при энергичном перемешивании 1,5 М раствор DIBAL в толуоле (37,2 мл, 55,8 ммоль). По завершении до 001913 46 бавления охлаждающую баню убирают, и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь осторожно выливают в 1N HCl, и смесь перемешивают при комнатной температуре в течение 30 мин. Слои разделяют, и органическую фазу промывают насыщенным водным раствором виннокислого калий-натрия (2 х), рассолом и сушат над Na2SО 4. Летучие вещества удаляют в вакууме, а неочищенное бледно-желтое масло используют непосредственно при последующей конденсации. Неочищенный альдегид, полученный выше, растворяют в ТГФ (90 мл) и обрабатывают триметилфосфоноацетатом (9,03 мл, 55,8 ммоль) и тетраметилгуанидином (7,0 мл, 55,8 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивают в течение 16 ч, и затем обрабатывают EtOAc (200 мл) и водой (100 мл). Водную фазу снова экстрагируют EtOAc (100 мл), и объединенную органическую фазу промывают водой, рассолом и сушат над Na2SО 4. Летучие вещества удаляют в вакууме, а сырое желтое масло (17,0 г) хроматографируют на силикагеле с элюированиемCH2Cl2 с циклогексаном (1:1-2:1), и получают 13,67 г нужного сложного эфира (78,5%). Препаративный пример 2 Сложный метиловый эфир (2,673 ммоль) растворяют в ацетоне, и затем при комнатной температуре добавляют 1N водный растворLiOH (26 мл). Затем мутную смесь разбавляют ацетоном (20 мл), и получающуюся в результате смесь желтого цвета перемешивают при комнатной температуре в течение 23,5 ч. Реакционную смесь разбавляют диэтиловым эфиром (400 мл), и органическую фазу промывают 1N НСl(120 мл), рассолом (200 мл) и Н 2 О (160 мл). Органическую фазу сушат и концентрируют в вакууме, и остается желток масло, которое очищают колоночной хроматографией (с градиентом - 5% АсОН + 20%-40% EtOFc в гексане), и получают карбоновую кислоту в виде желтого масла (960 мг, 100%). 1 Н ЯМР (CDCl3)7,38-7,19 (м, PhH5), 7,09 К раствору карбоновой кислоты (2 ммоль) в сухом диметилформамиде (5,50 мл) при перемешивании при комнатной температуре добавляют 1-этил-3-(3-диметиламинопропил) карбодиимид (2,4 ммоль) и N-гидроксисукцинимид(2,6 ммоль). Смесь перемешивают в течение 28 ч, а затем разбавляют EtOAc (100 мл) и промывают 1N соляной кислотой (2 х 50 мл), Н 2 О (75 мл), сушат и концентрируют в вакууме, остается масло. Сырой продукт очищают колоночной хроматографией (с градиентом 5-30% EtOAc в гексане), и получают активный эфир в виде бледно-желтого масла (724 мг, 80%). 1 К раствору силилового эфира (2,50 г, 5,47 ммоль) в СН 3 СN (130 мл) при перемешивании при 0 С добавляют 48% водный раствор HF (15 мл). Раствор перемешивают при 0 С в течение 0,75 ч, а затем при комнатной температуре в течение 4 ч. Реакционную смесь разбавляют диэтиловым эфиром (300 мл) и промывают Н 2 О до тех пор, пока рН промывной воды не станет 7. Органический слой сушат (MgSO4) и концентрируют в вакууме, и получают желтый остаток, который перекристаллизовывают из Et2O,и получают спирт в виде белых кристаллов (1,46 г, 78%). 1 Пример 1. Получение ацетата криптофицина 55 (3). К раствору 1 (93 мг, 0,13 ммоль) в 659 мл метиленхлорида при 0 С добавляют триэтиламин (55 мл, 0,40 ммоль), 4-диметиламинопиридин (1,6 мг, 0,013 ммоль) и уксусный ангидрид (19 мл, 0,20 ммоль). После перемешивания при 0 С в течение 1 ч реакцию гасят 19 мл метанола, реакционную смесь концентрируют до половины объема и непосредственно вносят в колонку для флэш-хроматографии (19 г силикагеля для флэш-хроматографии - флэш-силикагеля). Элюирование этилацетатом с гексаном (3:1) дает 88 мг (89%) названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (CDCl3)7,38-7,31 (м,5 Н), 7,24 (д, 1 Н, J=2,1 Гц), 7,22-7,18 (м, 1H), 7,10(д, 3 Н, J=6,6 Гц). Пример 2. Получение сукцината криптофицина 55 (4). К раствору 1 (27 мг, 0,038 ммоль) и янтарного ангидрида (5,7 мг, 0,057 ммоль) в 383 мл метиленхлорида при комнатной температуре добавляют триэтиламин (16 мл, 0,115 ммоль) и 4-диметиламинопиридин (4,7 мг, 0,038 ммоль). После перемешивания в течение 19 ч добавляют еще 5,7 мг (0,057 ммоль) янтарного ангидрида и 4,7 мг (0,038 ммоль) 4-диметиламинопиридина,и перемешивание продолжают еще в течение 29 ч. Реакционную смесь обрабатывают 0,5 мл 1N соляной кислоты и промывают метиленхлоридом (3 х 0,5 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют в вакууме до белой пены. Очистка методом ВЭЖХ с обращенной фазой 7 дает 10 мг(ушс, 1 Н), 6, 87 (д, 1 Н, J=8,4, Гц), 6,61 (м,1 Н),5,94-5,87 (м, 2 Н), 5,51 (д,1 Н, J-9, 8 Гц), 4,95 (дд,1 Н, J=10, 2,8 Гц), 4,87-4,76 (м, 3 Н), 3,90 (с, 3 Н), 49 3,39 (дд, 1 Н, J=16, 5,6 Гц), 3,28 (дд, 1 Н, J=16, 8,2 Гц), 3,17 (дд, 1H, J=16, 5,6 Гц), 3,05 (дд, 1 Н,J=16, 8,2 Гц), 2,68-2,62 (м, 1H), 2,60-2,46 (м, 2 Н),2,45-2,28 (м, 3 Н), 2,01-1,93 (м, 2 Н), 1, 88-1,70 (м,2 Н), 1,26 (с, 3 Н), 1,18 (с, 3 Н), 1,12 (д, 3 Н, J=7,0 Гц), 1,04(д, 3 Н, J=6, 6 Гц), 1,00 (д, 3 Н, J=6,5 Гц). Пример 3. Получение (2'-ди-трет-бутилфосфатил)фенилацетата криптофицина 55 (5). К раствору 1 (0,102 ммоль), 24 (46 мг,0,134 ммоль) и 4-диметиламинопиридина (12 мг, 0,102 ммоль) в 250 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3-дициклогексилкарбодиимида (27 мг,0,134 ммоль) в 50 мл метиленхлорида. После перемешивания при комнатной температуре в течение 6 ч реакционную смесь разбавляют 1 мл смеси этилацетата и гексана (3:1), и фильтруют через слой целита, промывая смесью этилацетата и гексана (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до фиолетовой пены. Хроматография (15 г флэш-силикагеля) с элюированием смесью этилацетата и гексана(6). К раствору 5 (84 мг, 0,081 ммоль) в 400 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (81 мл, 0,33 ммоль). Слабожелтый раствор перемешивают при комнатной температуре в течение 2 ч. После концентрирования в вакууме до не совсем белой пены сырой дигидрофосфат растворяют в 614 мл тетрагидрофурана и обрабатывают 5,00 N водным раствором гидроксида натрия (33 мл, 0,163 ммоль). После перемешивания в течение 10 мин смесь концентрируют в вакууме до желтовато-коричневой пены. Сырую соль растворяют в 1 мл горячего ацетонитрила и 0,1 мл горячей воды. Нерастворившиеся вещества отфильтровывают, а фильтрат концентрируют в вакууме, и получают 69 мг(87%) названного в заголовке соединения в виде белого твердого вещества.(м, 1 Н), 2,31-2,22 (м, 1H), 1,96-1,88 (м, 1H), 1,851,77 (м, 2 Н), 1,22 (с, 3 Н), 1,20 (с, 3 Н), 1,03 (д,3 Н, J=6,2 Гц), 0,98 (д, 3 Н, J=6,1 Гц), 0,93 (д, 3 Н,J=7,1 Гц). Пример 5. Получение гидрохлорида никотиноата криптофицина 55 (7). К раствору 1 (50 мг, 0,071 ммоль) в 354 мл пиридина при комнатной температуре добавляют гидрохлорид никотиноилхлорида (15 мг,0,085 ммоль), а затем триэтиламин (23 мл, 0,170 ммоль). После перемешивания в течение 1,5 ч добавляют 4-диметиламинопиридин (8,6 мг,0,071 ммоль). После перемешивания в течение 5 ч добавляют еще триэтиламин (23 мл, 0,170 ммоль), 4-диметиламинопиридин (8,6 мг, 0,071 ммоль) и гидрохлорид никотиноилхлорида (15 мг, 0,085 ммоль) вместе с ополаскиванием 50 мл пиридина. После перемешивания в течение 18 ч реакционную смесь обрабатывают 0,5 мл насыщенного водного раствора бикарбоната натрия и промывают метиленхлоридом (4 х 1 мл). Объединенные органические экстракты сушат(Na2SO4), фильтруют и концентрируют в вакууме до светло-коричневого масла. Хроматография (14 г флэш-силикателя) с элюированием смесью этилацетата с гексаном (10:1) дает 49 мг(85%) свободного основания в виде белой пены. Никотиноат растворяют в 1 мл метиленхлорида и обрабатывают 1,0 М раствором хлористого водорода в диэтиловом эфире (90 мл, 0,090 ммоль). Прозрачный бесцветный раствор оставляют при комнатной температуре на 5 мин. Удаляют растворитель в вакууме, и получают 51 мг названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (CDCl3)8,94 (с, 1 Н),8,78 (ушс, 1 Н), 8,29 (д, 1 Н, J=7,0 Гц), 7,57 (ушс,1 Н), 7,38 (д, 2 Н, J=7,1 Гц), 7,30-7,16 (м, 5 Н), 7,10 51 Пример 6. Получение N-метилпиридинийацетата криптофицина 55 (8). К раствору 1 (53 мг, 0,075 ммоль) в 751 мл метиленхлорида при 0 С добавляют триэтиламин (13 мл, 0,090 ммоль), а затем 2-фтор-1 метилпиридиний-п-толуолсульфонат (23 мг,0,083 ммоль). Неоднородную реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3,5 ч, после чего добавляют еще 11 мг (0,039 ммоль) 2-фтор-1 метилпиридиний-л-толуолсульфоната. После перемешивания еще в течение 14,5 ч добавляют еще 11 мг (0,039 ммоль) 2-фтор-1-метилпиридиний-п-толуолсульфоната, затем через 2,5 ч еще добавляют 11 мг (0,039 ммоль) 2-фтор-1 метилпиридиний-п-толуолсульфоната и 13 мл(0,090 ммоль) триэтиламина. После перемешивания еще в течение 1 ч реакционную смесь концентрируют в вакууме до оранжевой пены. Очистка методом ВЭЖХ с обращенной фазой 8 с сопутствующим анионным обменом(птолуолсульфонат на ацетат) с последующей лиофилизацией позволяет получить 30 мг (47%) названного в заголовке соединения в виде белого твердого вещества. 500 МГц, 1 Н ЯМР (ДМСО-d6)8,65-8,58(16 мг, 0,049 ммоль) и 4-диметиламинопиридина (несколько кристаллов) в 143 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3-дициклогексилкарбодиимида (10 мг, 0,049 ммоль) в 20 мл метиленхлорида. После перемешивания в течение 2 ч мутную белую реакционную смесь разбавляют этилацетатом с гексаном (2:1, 1 мл), перемешивают в течение 10 мин, и фильтруют через слой целита, промывая этилацетатом с гексаном(2:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (14 г флэш-силикагеля, этилацетат с гексаном, 2:1) дает 29 мг (88%) названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (СDCl3)7,42-7,27 (м,5 Н), 7,24 (д, 1 Н, J=2,0 Гц), 7,25-7,18 (м, 1 Н), 7,09(с, 3 Н), 1,09-1,04 (м, 6 Н), 1,01 (д, 3 Н, J=6,3 Гц). Пример 8. Получение гидрохлорида 3-(3 хлор-4-метоксифенил)-(D)-аланината криптофицина 55 (10). К раствору 9 (27 мг, 0,027 ммоль) в 265 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (33 мл, 0,133 ммоль). После перемешивания в течение 3 ч прозрачную бесцветную реакционную смесь концентрируют в вакууме, и получают 26 мг (96%, исправлено на 5 мас.% диоксана) названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (MeOH-d4)7,79 (д, 1 Н,J=7,3 Гц), 7,49-7,45 (м, 2 Н), 7,43-7,48 (м, 3 Н),7,31 (д, 1 Н, J=2,0 Гц), 7,20 (дд, 1 Н, J=8,4, 2,1 Гц), 7,13 (д, 1 Н, J=2,2 Гц), 7,07-6,95 (м, 3 Н), 6,71(д, 3 Н, J=7,1 Гц), 1,10 (д, 3 Н, J=6,1 Гц), 1,06(д,3 Н, J=6, 0 Гц). Пример 9. Получение N-трет-Вос-глицината криптофицина 55 (11). К раствору 1 (118 мг, 0,167 ммоль), N-третВос-глицина (44 мг, 0,251 ммоль) и 4 диметиламинопиридина (2,0 мг, 0,0167 ммоль) в 490 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3 дициклогексилкарбодиимида (52 мг, 0,251 ммоль) в 67 мл метиленхлорида. После перемешивания в течение 50 мин мутную белую реакционную смесь разбавляют этилацетатом с гексаном (3:1, 1 мл), перемешивают в течение 10 мин, и фильтруют через слой целита, промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (19 г флэшсиликагеля, этилацетат с гексаном, 3:1) дает 138 мг (96%) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (СDСl3)7,34 (с, 5 Н),7,24 (д, 1H, J=2,0 Гц), 7,23-7,19 (м, 1 Н), 7,10 (дд,1 Н, J=8,4, 2,0 Гц), 6,88 (д, 1 Н, J=8,4 Гц), 6,796,70 (м, 1 Н), 5,77 (д, 1 Н, J=13 Гц), 5,50 (д, 1 Н, 53(д, 3 Н, J=7,0 Гц), 1,03 (д, 3 Н, J=6,7 Гц), 0,98 (д,3 Н, J=6,5 Гц). Пример 9. Получение гидрохлорида глицината криптофицина 55 (12). К раствору 11 (122 мг, 0,141 ммоль) в 471 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (178 мл, 0,707 ммоль). После перемешивания в течение 1 ч 20 мин прозрачную бесцветную реакционную смесь концентрируют в вакууме, и получают 120 мг (99%, исправлено на 7 мас.% диоксана) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (MeOH-d4)7,81 (дд,1H, J=8,5, 2,2 Гц), 7,46-7,41 (м,2 Н), 7,40-7,36 (м,3 Н), 7,31 (д, 1 Н, J=2,1 Гц), 7,20 (дд, 1H, J=8,4,2,1 Гц), 7,01 (д, 1H, J=8,4 Гц), 6,70 (ддд, 1 Н,J=15, 13, 3,7 Гц), 5,97 (дд, 1H, J=15, 1,7 Гц), 5,55(д, 1H, J=9,9 Гц), 5,18 (д, 1H, J=9,9 Гц), 5,14 (дд,1 Н, J=10, 2,8 Гц), 4,84 (т, 1 Н, J=10 Гц), 4,52 (дд,1 Н, J=11, 3,7 Гц), 3,87 (с, 3 Н), 3,78 (д, 1 Н, J=18 Гц), 3,50 (дд, 1 Н, J=13, 9,8 Гц), 3,23 (д, 1 Н, J=18 Гц), 3,20 (дд, 1H, J=14, 3,6 Гц), 3,13 (дд, 1 Н,J=13, 2,4 Гц), 2,80-2,69 (м, 3 Н), 2,41-2,32 (м, 1 Н),1,99-1,92 (м, 1 Н), 1,91-1,81 (м, 2 Н), 1,25 (с, 3 Н),1,20 (с, 3 Н), 1,12 (д, 3 Н, J=7,0 Гц), 1,06 (д, 3 Н,J=6,2 Гц), 1,04 (д, 3 Н, J=6,2 Гц). Пример 10. Получение N-трет-Вос-аланината криптофицина 55 (13). К раствору 1 (102 мг, 0,145 ммоль), N-третВосаланина (41 мг, 0,217 ммоль) и 4 диметиламинопиридина (18 мг, 0,145 ммоль) в 400 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3 дициклогексилкарбодиимида (45 мг, 0,217 ммоль) в 82 мл метиленхлорида. После перемешивания в течение 3,5 ч мутную белую реакционную смесь разбавляют этилацетатом с гексаном (3:1, 1 мл), перемешивают в течение 10 мин, и фильтруют через слой целита, промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (21 г флэшсиликагеля, этилацетат с гексаном, 2:1, затем 4:1) дает 121 мг (95%) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (СDСl3)7,44-7,39 (м,2 Н), 7,37-7,31 (м, 3 Н), 7,32 (д, 1 Н, J=2,1 Гц), 7,20(м, 1 Н), 3,20 (дд, 1 Н, J=14, 3,6 Гц), 3,13 (ушд,1 Н, J=14 Гц), 3,05-2,92 (м, 2 Н), 2,79-2,63 (м, 3 Н),2,45-2,37 (м, 1H), 2,24 (дт, 1 Н, J=16, 7,0 Гц),2,08-1,99 (м, 1H), 1,96-1,79 (м, 3 Н), 1,43 (с, 9 Н),1,25 (с, 3 Н), 1,21 (с, 3 Н), 1,12 (д, 3 Н, J=7,0 Гц),1,06 (д, 3 Н, J=6,2 Гц), 1,02 (д, 3 Н, J=6,1 Гц). Пример 11. Получение гидрохлорида аланината криптофицина 55 (14). К раствору 13 (119 мг, 0,136 ммоль) в 452 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (170 мл, 0,679 ммоль). После перемешивания в течение 2 ч 15 мин мутную белую реакционную смесь концентрируют в вакууме, и получают 110 мг (96%, исправлено на 4 мас.% диоксана) названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (MeOH-d4)7,80 (дд,1H, J=9,7, 2,3 Гц), 7,45-7,40 (м, 2 Н), 7, 39-7,32(с, 3 Н), 1,13 (д, 3 Н, J=7,1 Гц), 1,08 (д, 3 Н, J=6,3 Гц), 1,04 (д, 3 Н, J=6,2 Гц). Пример 12. Получение N-трет-Вос-аминобутирата криптофицина 55 (15). К раствору 1 (48 мг, 0,068 ммоль), N-третВос-4-аминомасляной кислоты (18 мг, 0,088 ммоль) и 4-диметиламинопиридина (8 мг, 0,068 ммоль) в 150 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3-дициклогексилкарбодиимида (18 мг, 0,088 ммоль) в 50 мл метиленхлорида. После перемешивания в течение 45 мин мутную белую реакционную смесь разбавляют этилацетатом с гексаном (3:1, 0,5 мл), перемешивают в течение 5 мин, и фильтруют через слой целлита, промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (15 г флэшсиликагеля, этилацетат с гексаном, 3:1) дает 55 мг (90%) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (СDСl3)7,38-7,32 (м,5 Н), 7,24 (д, 1 Н, J=1,9 Гц), 7,22-7,19 (м, 1 Н), 7,10(д, 3 Н, J=6, 6 Гц). Пример 13 Получение гидрохлорида аминобутирата криптофицина 55 (16). К раствору 15 (53 мг, 0,059 ммоль) в 297 мл метиленхлорида при комнатной температуре добавляют 1,0 М раствор хлористого водорода в диэтиловом эфире (297 мл, 0,297 ммоль). Исходное вещество осаждается в виде белой пасты, которую снова растворяют путем добавления 150 мл метиленхлорида. После перемешивания в течение 4 ч добавляют еще 59 мл (0,059 ммоль) раствора хлористого водорода. Перемешивание продолжают еще в течение 14 ч и реакционную смесь концентрируют в вакууме, и получают 49 мг (100%) названного в заголовке соединения в виде белой пены. 500 МГц, 1 Н ЯМР (ДМСО-d6)8,49 (д, 1 Н,J=8,0 Гц), 7,72 (ушс, 3 Н), 7,44-7,33 (м, 5 Н), 7,32(м, 1 Н), 3,07-3,01 (м, 2 Н), 2,72 (дд, 1 Н, J=14, 12 Гц), 2,65-2,47 (м, 4 Н), 2,38-2,28 (м, 1H), 2,21 (дт,1 Н, J=17, 7,5 Гц), 1,97 (дт, 1 Н, J=17, 7,5 Гц),1,80-1,70 (м, 3 Н), 1,54-1,46 (м, 2 Н), 1,17 (с, 3 Н),1,03 (с, 3 Н), 1,01 (д, 3 Н, J=7,0 Гц), 0,99 (д, 3 Н,J=5,8 Гц), 0,95 (д, 3 Н, J=5,8 Гц). Пример 14. Получение N-трет-Boс-(L)аланината криптофицина 55 (17). К раствору 1 (103 мг, 0,146 ммоль), N-третВос-(L)-аланина (41 мг, 0,219 ммоль) и 4 диметиламинопиридина (18 мг, 0,146 ммоль) в 400 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3 дициклогексилкарбодиимида (45 мг, 219 ммоль) в 87 мл метиленхлорида. После перемешивания в течение 5 ч 50 мин мутную белую реакционную смесь обрабатывают еще 5,5 мг (0,029 ммоль) N-трет-Воc-(L)-аланина, 6,0 мг (0,029 ммоль) 1,3-дициклогексилкарбодиимида и несколькими кристаллами 4-диметиламинопиридина. После перемешивания еще в течение 1 ч реакционную смесь разбавляют этилацетатом с гексаном (3:1, 1 мл), перемешивают в течение 10 мин и фильтруют через слой целита, промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (22 г флэш-силикагеля, этилацетат с гексаном, 1,5:1,затем 2:1 затем 4:1) дает 96 мг (75%) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (CDCl3)7, 35-7, 30 (м,5 Н), 1, 26-7,21 (м, 2 Н), 7,10 (дд, 1 Н, J=8,4, 1,9 Гц), 6,88 (д, 1 Н, J=8,4 Гц), 6,76 (ддд, 1 Н, J=15, 001913(м, 9 Н), 0,99 (д, 3 Н, J=6,3 Гц). Пример 15. Получение гидрохлорида (L)аланината криптофицина 55 (18). К раствору 17 (95 мг, 0,108 ммоль) в 361 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (135 мл, 0,542 ммоль). После перемешивания в течение 2,5 ч мутную белую реакционную смесь концентрируют в вакууме и получают 90 мг (96%, исправлено на 6 мас.% диоксана) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (MeOH-d4)8,54 (д, 1 Н,J=7, 6 Гц), 7,81 (ушд, 1H, J=9,7 Гц), 7,46-7,44 (м,2 Н), 7,39-7,37 (м, 3 Н), 7,32 (д, 1 Н, J=2,0 Гц), 7,20(м, 3 Н), 2,41-2,34 (м, 1 Н), 1,98-1,93 (м, 1 Н), 1,881,82 (м, 2 Н), 1,41 (д, 3 Н, J=7,3 Гц), 1,25 (с, 3 Н),1,20 (с, 3 Н), 1,13 (д, 3 Н, J=7,0 Гц), 1,06 (д, 3 Н,J=6,2 Гц), 1,04 (д, 3 Н, J=6,0 Гц). Пример 16. Получение N-трет-Boc-(D)аланината криптофицина 55 (19). К раствору 1 (25 мг, 0,035 ммоль), N-третВос-(D)-аланина (10 мг, 0,053 ммоль) и 4 диметиламинопиридина (0,4 мг, 0,0035 ммоль) в 130 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3 дициклогексилкарбодиимида (11 мг, 0,053 ммоль) в 47 мл метиленхлорида. После перемешивания в течение 5,5 ч мутную белую реакционную смесь разбавляют этилацетатом с гексаном (3:1, 0,5 мл), перемешивают в течение 10 мин и фильтруют через слой целита, промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до бесцветного масла. Хроматография (15 г флэшсиликагеля, этилацетат с гексаном, 2:1) дает 26 мг (83%) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (CDCl3)7,49-7,29 (м,5 Н), 7,24 (д, 1 Н, J= 2,0 Гц), 7,22-7,18 (м, 1 Н),7,09 (дд, 1 Н, J=8,4 2,0 Гц), 6,87 (д, 1 Н, J=8,4 Гц),6,76 (ддд, 1 Н, J=15, 13, 4,4 Гц), 5,77 (д, 1 Н, J=15 Гц), 5,56 (д,1 Н, J=9,9 Гц), 5,48 (д, 1H, J=7,7 Гц),5,01 (дд, 1 Н, J=10, 2,6 Гц), 4,91 (т,1 Н, J=9,4 Гц),4,84 (д, 1 Н, J=9,9 Гц), 4,81-4,7 (м, 2 Н), 3,99-3,93(д, 3 Н, J=7,1 Гц), 1,04 (д, 3 Н, J=6,4 Гц), 0,99 (д,3 Н, J=6,3 Гц), 0,65 (д, 3 Н, J=6,8 Гц). Пример 17. Получение гидрохлорида (D)аланмната криптофицина 55 (20). К раствору 18 (24 мг, 0,027 ммоль) в 274 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (34 мл, 0,137 ммоль). После перемешивания в течение 3,5 ч прозрачную бесцветную реакционную смесь концентрируют в вакууме и получают 24 мг (100%, исправлено на 8 маc.% диоксана) названного в заголовке соединения в виде белой пены. 500 МГц, 1H ЯМР (МеОН-d4)7,79 (д, 1 Н,J=9, 5 Гц), 7,47-7,40 (м, 2 Н), 7,40-7,36 (м, 3 Н),7,31 (д, 1 Н, J=2,0 Гц), 7,20 (дд, 1 Н, J=8,4, 2,0 Гц), 7,01 (д, 1 Н, J=8,4 Гц), 6,71 (ддд, 1 Н, J=15,13, 3,7 Гц), 5,98 (дд, 1 Н, J=15, 1,6 Гц), 5,65 (д,1 Н, J=10 Гц), 5,20 (д, 1 Н, J=10 Гц), 5,17 (дд, 1 Н,J=11, 2,5 Гц), 4,88-4,78 (м, 1 Н), 4,53 (дд, 1 Н,J=11, 3,7 Гц), 3,95 (к, 1 Н, J=7,2 Гц), 3,87 (с, 3 Н),3,51 (дд, 1 Н, J=13, 9,8 Гц), 3,20 (дд, 1 Н, J=14, 3,6 Гц), 3,14 (дд, 1 Н, J=13, 2,3 Гц), 2,81-2,74 (м, 3 Н),2,41-2,34 (м, 1 Н), 2,07-1,99 (м, 1 Н), 1,96-1,84(м,2 Н), 1,26 (с, 3 Н), 1,21 (с, 3 Н), 1,15 (д, 3 Н, J= 7,1 Гц), 1,09 (д, 3 Н, J=6,0 Гц), 1,05 (д, 3 Н, J=6,0 Гц), 0,80 (д, 3 Н, J=7,4 Гц). Пример 18. Получение N-N-ди-трет-Boc(L)-лизината криптофицина 55 (21). К раствору 1 (105 мг, 0,149 ммоль), N-Nди-трет-Вос-(L)-лизина (67 мг, 0,193 ммоль) и 4 диметиламинопиридина (18 мг, 0,149 ммоль) в 400 мл безводного метиленхлорида при комнатной температуре добавляют раствор 1,3 дициклогексилкарбодиимида (40 мг, 0,193 ммоль) в 96 мл метиленхлорида. После перемешивания в течение 4 ч мутную белую реакционную смесь обрабатывают еще 10 мг (0,030 ммоль) N-N-ди-трет-Вос-(L)-лизина и 6,1 мг(0,030 ммоль) 1,3-дициклогексилкарбодиимида в виде раствора в 100 мл метиленхлорида. После перемешивания еще в течение 1 ч мутную белую реакционную смесь разбавляют этилацетатом с гексаном (3:1, 1 мл), перемешивают в течение 10 мин, и фильтруют через слой целита,промывая этилацетатом с гексаном (3:1). Фильтрат и промывную жидкость концентрируют в вакууме до белой пены, которую снова обрабатывают в описанных выше условиях с использованием 34 мг (0,097 ммоль) N-N-дитрет-Вос-(L)-лизина, 20 мг (0,097 ммоль) 1,3 дициклогексилкарбодиимида и 9,1 мг (0,075 ммоль) 4-диметиламинопиридина. После перемешивания в течение 1,5 ч реакционную смесь обрабатывают, как описано выше, и получают сырой продукт в виде белой пены. Хроматогра 001913(L)-лизината криптофицина 55 (22). К раствору 21 (107 мг, 0,103 ммоль) в 345 мл метиленхлорида при комнатной температуре добавляют 4,0 М раствор хлористого водорода в 1,4-диоксане (155 мл, 0,621 ммоль). После перемешивания в течение 4 ч мутную белую реакционную смесь фильтруют. Собранное белое твердое вещество промывают метиленхлоридом (2 х 1 мл) и сушат в вакууме при комнатной температуре и получают 87 мг (93%) названного в заголовке соединения. 500 МГц, 1 Н ЯМР (МеОН-d4)8,61 (д, 1 Н,J=7,7 Гц), 7,81 (д, 1 Н, J=7,7 Гц), 7,47-7,44 (м,2 Н), 7,40-7,38 (м, 3 Н), 7,31 (д, 1 Н, J=2,2 Гц), 7,20(д, 3 Н, J=8,2 Гц), 1,17 (с, 3 Н), 1,08 (д, 3 Н, J=6,2 Гц), 1,05 (д, 3 Н, J=6,1 Гц),Пример 20. Получение 2'-(ди-трет-бутилфосфатил)фенилуксусной кислоты (24). К раствору 2'-гидроксифенетилового спирта (1,05 г, 7,60 ммоль) в 15,2 мл N,N-диметилформамида при 0 С добавляют имидазол (621 мг, 9,11 ммоль) и трет-бутилдиметилсилилхлорид (1,26 мг, 8,34 ммол). После перемешивания при 0 С в течение 40 мин и в течение 45 мин при комнатной температуре добавляют еще 155 г (2,28 ммоль) имидазола и 229 мг (1,52 ммоль) трет-бутилдиметилсилилхлорида. Реакционную смесь перемешивают еще в течение 15 мин, после чего добавляют еще 150 мл третбутилметилового эфира. Смесь промывают холодной 1 N соляной кислотой (1 х 15 мл), а затем водой (1 х 15 мл). Органический слой сушат(Na2SО 4), фильтруют и концентрируют в вакууме до желтого масла. Хроматография (70 г 59 флэш-силикагеля) с элюированием гексаном с этилацетатом (5:1) дает 1,81 мг (94%) 1 силилового эфира в виде бледного, не совсем белого масла. К раствору силилэфира (506 мг, 2,00 ммоль) и ди-трет-бутилдиэтилфосфорамидита(600 мл, 93%, 2,00 ммоль) в 2 мл тетрагидрофурана при комнатной температуре добавляют 1 Н-тетразол (421 мг, 6,01 ммоль). После перемешивания в течение 45 мин реакционную смесь охлаждают до -10 С и быстро обрабатывают раствором м-хлорпербензойной кислоты (450 мг, 99%, 2,61 ммоль) в 3,6 мл метиленхлорида. Мутную белую реакционную смесь нагревают до комнатной температуры и перемешивают в течение 15 мин. Реакцию гасят 4 мл 10% водного раствора бисульфита натрия, энергично перемешивают смесь в течение 10 мин, разбавляют 15 мл трет-бутилметилового эфира и промывают 10% водным раствором бисульфита натрия(2 х 10 мл), а затем 0,5 N водным раствором гидроксида натрия (2 х 10 мл). Органический слой сушат (Na2SO4),фильтруют и концентрируют в вакууме до бесцветного масла (941 мг), которое используют непосредственно на последующей стадии. Неочищенный фосфат растворяют в 10 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 1 М раствором тетра-н-бутиламмонийфторида в тетра-гидрофуране (2,4 мл, 2,4 ммоль). После перемешивания при 0 С в течение 20 мин и при комнатной температуре в течение 1,5 ч реакционную смесь разбавляют 60 мл третбутилметилового эфира и промывают водой(1 х 10 мл) и затем рассолом (1 х 10 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют в вакууме до желтого масла. Хроматография (50 г флэш-силикагеля) с элюированием этилацетатом с гексаном (3:1) дает 525 мг(79%) 1 спирта в виде не совсем белого масла. К раствору спирта (123 мг, 0,372 ммоль) в смеси ацетонитрила с четыреххлористым углеродом(1:1, 1,49 мл) при комнатной температуре добавляют воду (1,1 мл), а затем периодат натрия(III) (1,8 мг, 0,0082 ммоль). Коричневую смесь энергично перемешивают при комнатной температуре в течение 55 мин. После концентрирования в вакууме и хроматографии (8 г флэшсиликагеля, элюирование 10% метанола в этилацетате) получают 109 мг (85%) названного в заголовке соединения в виде фиолетового масла. 500 МГц, 1 Н ЯМР (CDCl3)7,49 (д, 1 Н,J=7,53 Гц), 7,30-7,15 (м, 3 Н), 3,77 (с, 2 Н), 1,51 (с,18 Н). Пример 21. Соединение примеров 21-26 получают с использованием способов, по существу таких же, какие описаны выше. Спектральные характеристики криптофицина-129. М.-с., EI m/е (относ.интенс.) 654/656
МПК / Метки
МПК: A61P 35/00, C07D 291/02, A61K 31/395
Метки: фармацевтические, соединения
Код ссылки
<a href="https://eas.patents.su/30-1913-farmacevticheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические соединения</a>
Предыдущий патент: Замещенные 1,2,3,4 -тетрагидро-2-дибензофуранамины
Следующий патент: Способ получения бензотиофенов.
Случайный патент: Способ получения фармацевтического препарата для фотодинамической терапии онкологических заболеваний


































