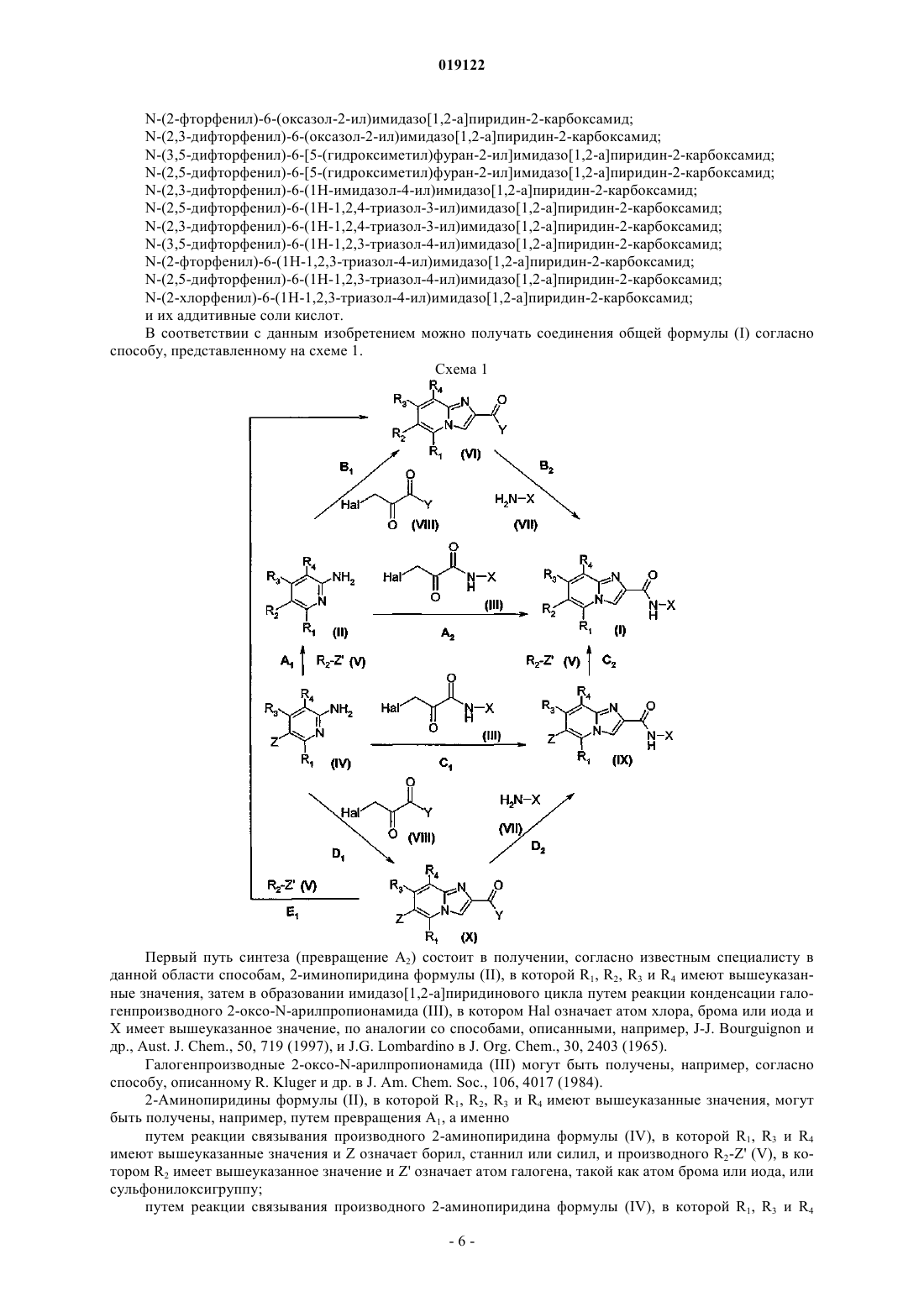
Производные 6-гетероциклоимидазо[1,2-а]пиридин-2-карбоксамидов, их получение и их применение в терапии
Формула / Реферат
1. Соединения формулы (I)
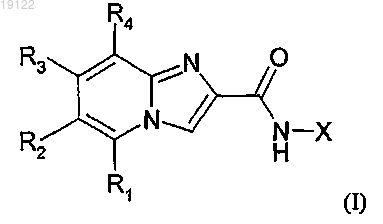
в которой X означает фенильную группу, необязательно замещенную одной или несколькими группами, выбираемыми независимо друг от друга среди следующих атомов или групп: галоген, (C1-C6)-алкокси, (C1-C6)-алкил, NRaRb, цианогруппа, (C1-C6)-алкоксикарбонил, причем (C1-C6)-алкильные и (C1-C6)-алкоксильные группы необязательно замещены одним или несколькими атомами галогена;
R1 означает атом водорода, галоген, (C1-C6)-алкокси, (С1-С6)-алкил, группу NRaRb, причем алкильные и алкоксильные группы, в случае необходимости, могут быть замещены одним(ной) или несколькими атомами галогена, гидроксильными группами, аминогруппами или (C1-C6)-алкоксилом;
R2 означает диоксолан, имидазолин, индол, пиррол, фуран, тиофен, пиразол, имидазол, триазол, тетразол, оксазол, изоксазол, оксадиазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин, пиразин, пиридазин или триазин, необязательно замещенные одной или несколькими группами, выбираемыми независимо друг от друга среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, галоген, цианогруппа, NRaRb,
-CO-R5, -CO-NR6R7, -CO-O-R8, -NR9-CO-R10, (C3-C7)-циклоалкил-(C1-C6)-алкил, (С3-С7)-циклоалкил-(C1-C6)-алкоксил, (C1-C6)-алкил, необязательно замещенный одной или несколькими гидроксильными группами или NRaRb, оксидогруппа;
R3 означает атом водорода, (C1-C6)-алкил, (C1-C6)-алкоксил или атом галогена;
R4 означает атом водорода, (C1-C4)-алкил, (C1-C4)-алкоксил или атом фтора;
R5 означает атом водорода, фенил или (C1-C6)-алкил;
R6 и R7, одинаковые или разные, означают атом водорода или (C1-C6)-алкил или с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбираемый среди N, О и S;
R8 означает (C1-C6)-алкил;
R9 и R10, одинаковые или разные, означают атом водорода или (C1-C6)-алкил;
Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил или с атомом азота, который их несет, образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбираемый среди N, О и S;
причем гетероциклическая группа представляет ненасыщенную, частично насыщенную или полностью насыщенную моноциклическую ароматическую группу, включающую 5-10 атомов, включая 1-4 гетероатома, выбранных из N, О или S;
за исключением N-(4-бромфенил)-6-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-2-карбоксамида;
в виде основания или аддитивной соли кислоты.
2. Соединения формулы (I) по п.1, отличающиеся тем, что
X означает фенильную группу, необязательно замещенную одним или несколькими атомами галогена или цианогруппами;
в виде основания или аддитивной соли кислоты.
3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что
R2 означает пиррольную, фурановую, тиофеновую, пиразольную, имидазольную, триазольную, тетразольную, оксазольную, изоксазольную, оксадиазольную, тиазольную, изотиазольную, тиадиазольную, пиридиновую, пиримидиновую, пиразиновую, пиридазиновую, триазиновую группу, необязательно замещенную одной или несколькими группами, выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген, -NRaRb, (C1-C6)-алкил, сам необязательно замещенный гидроксильной группой;
Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил;
в виде основания или аддитивной соли кислоты.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что
R2 означает диоксолановую, пиридиновую, имидазольную, пиразольную, триазольную, пиррольную, фурановую, оксазольную, индольную, имидазолиновую, тиофеновую, пиразиновую, пиримидиновую, тиазольную группу, необязательно замещенную одной или несколькими группами, выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген, -NRaRb, (C1-C6)-алкил, сам необязательно замещенный гидроксильной группой;
Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил;
в виде основания или аддитивной соли кислоты.
5. Соединения формулы (I) по любому из предыдущих пунктов, отличающиеся тем, что R1 означает атом водорода или (C1-C6)-алкил;
в виде основания или аддитивной соли кислоты.
6. Соединения формулы (I) по любому из предыдущих пунктов, отличающиеся тем, что R3 и R4 означают атом водорода;
в виде основания или аддитивной соли кислоты.
7. Соединения формулы (I) по любому из предыдущих пунктов, отличающиеся тем, что
X означает фенил, необязательно замещенный одним или несколькими атомами фтора, хлора или цианогруппой;
R2 означает диоксолановую, пиридиновую, имидазольную, пиразольную, триазольную, пиррольную, фурановую, оксазольную, индольную, имидазолиновую, тиофеновую, пиразиновую, пиримидиновую, тиазольную группу, необязательно замещенную одной или несколькими гидроксильными, метильными, гидроксиметильными группами, метоксигруппами, атомами галогена, NH2-группами, (C1-C6)-алкильными группами, оксидогруппами;
R1 означает атом водорода или метил;
R3 и R4 означают атом водорода;
в виде основания или аддитивной соли кислоты.
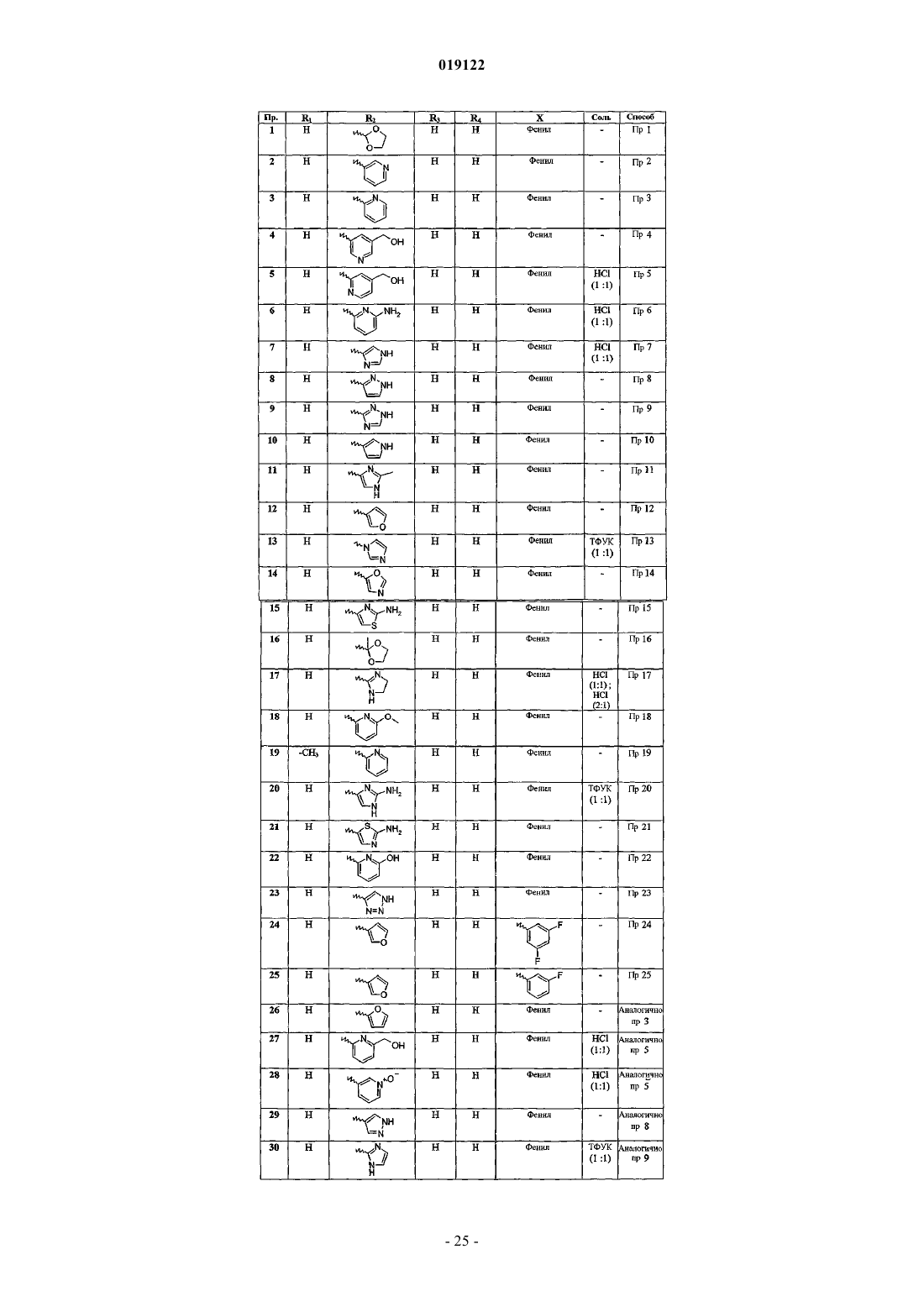
8. Соединения формулы (I) по любому из предыдущих пунктов, отличающиеся тем, что их выбирают среди
6-(1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(пиридин-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-[5-(гидроксиметил)пиридин-3-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-[4-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
6-(6-аминопиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
6-(1Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
N-фенил-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-метил-1Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(3-фурил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(1Н-имидазол-1-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его трифторацетата (1:1);
6-(оксазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-аминотиазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-метил-1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(4,5-дигидро-1H-имидазол-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
6-(6-метоксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
5-метил-N-фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-амино-1Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его трифторацетата (1:1);
6-(2-аминотиазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(6-гидроксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
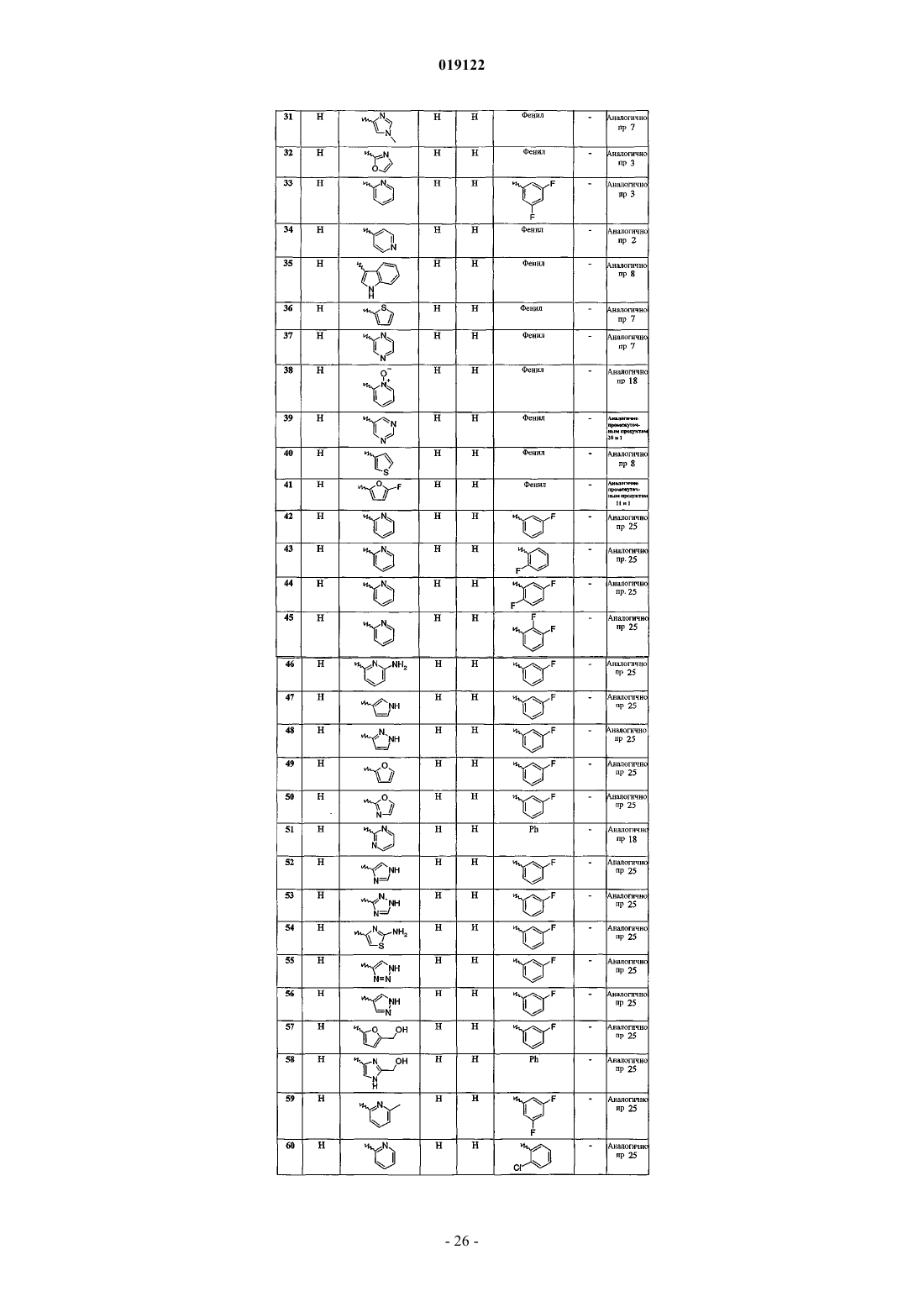
N-(3,5-дифторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-фурил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-[6-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
6-(1-оксидопиридин-3-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида и его гидрохлорида (1:1);
N-фенил-6-(1Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(1H-имидазол-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида, гидрохлорида (1:1);
6-(1-метил-1H-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(оксазол-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(пиридин-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(1Н-индол-3-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(тиофен-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(пиразин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(1-оксидопиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(пиримидин-5-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(тиен-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(5-фтор-2-фурил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(6-аминопиридин-2-ил)-N-(3-фторфенил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
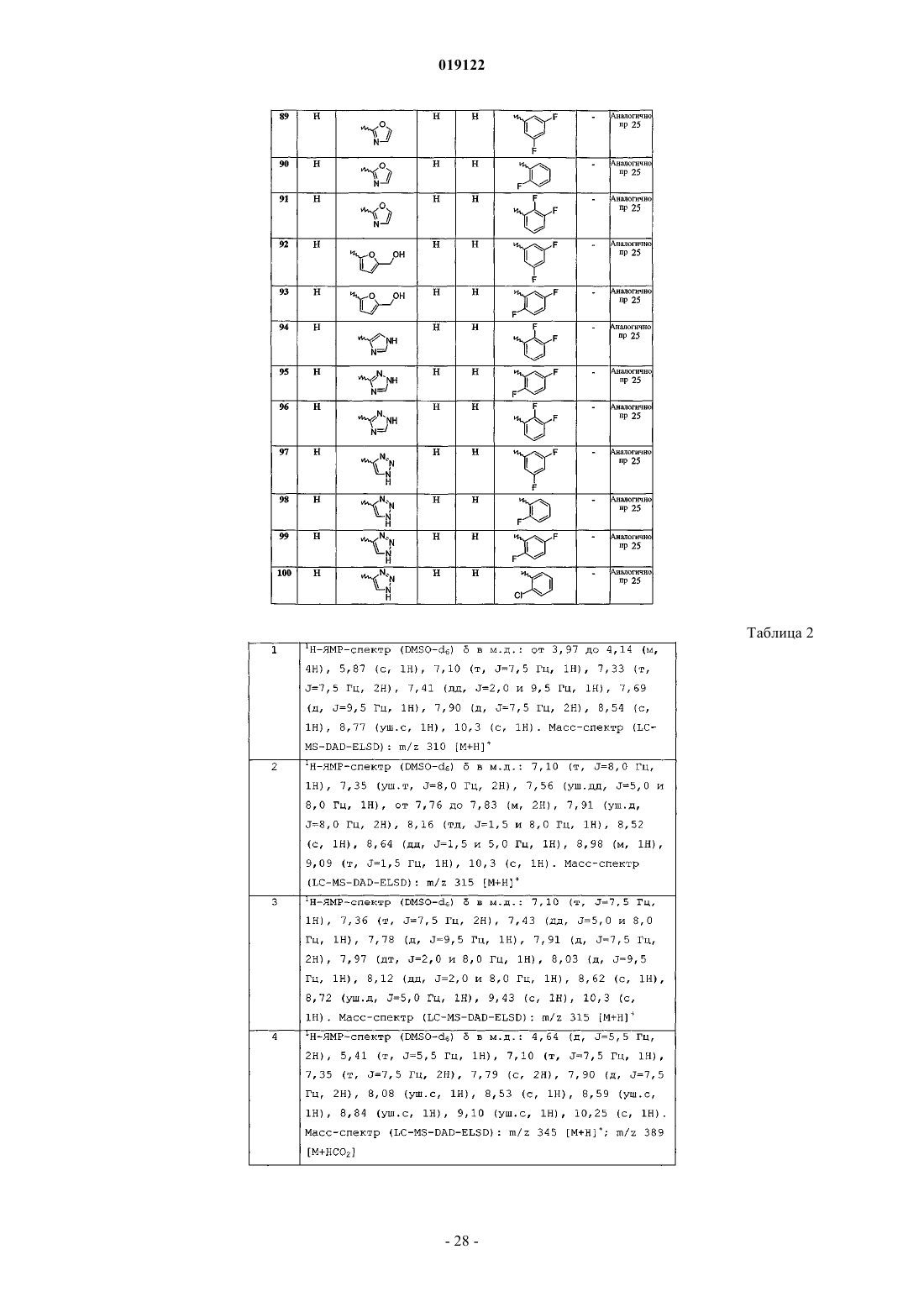
N-фенил-6-(пиримидин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-аминотиазол-4-ил)-N-(3-фторфенил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-(1Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3-фторфенил)-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксамида;
6-[2-(гидроксиметил)-1Н-имидазол-4-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(6-метилпиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
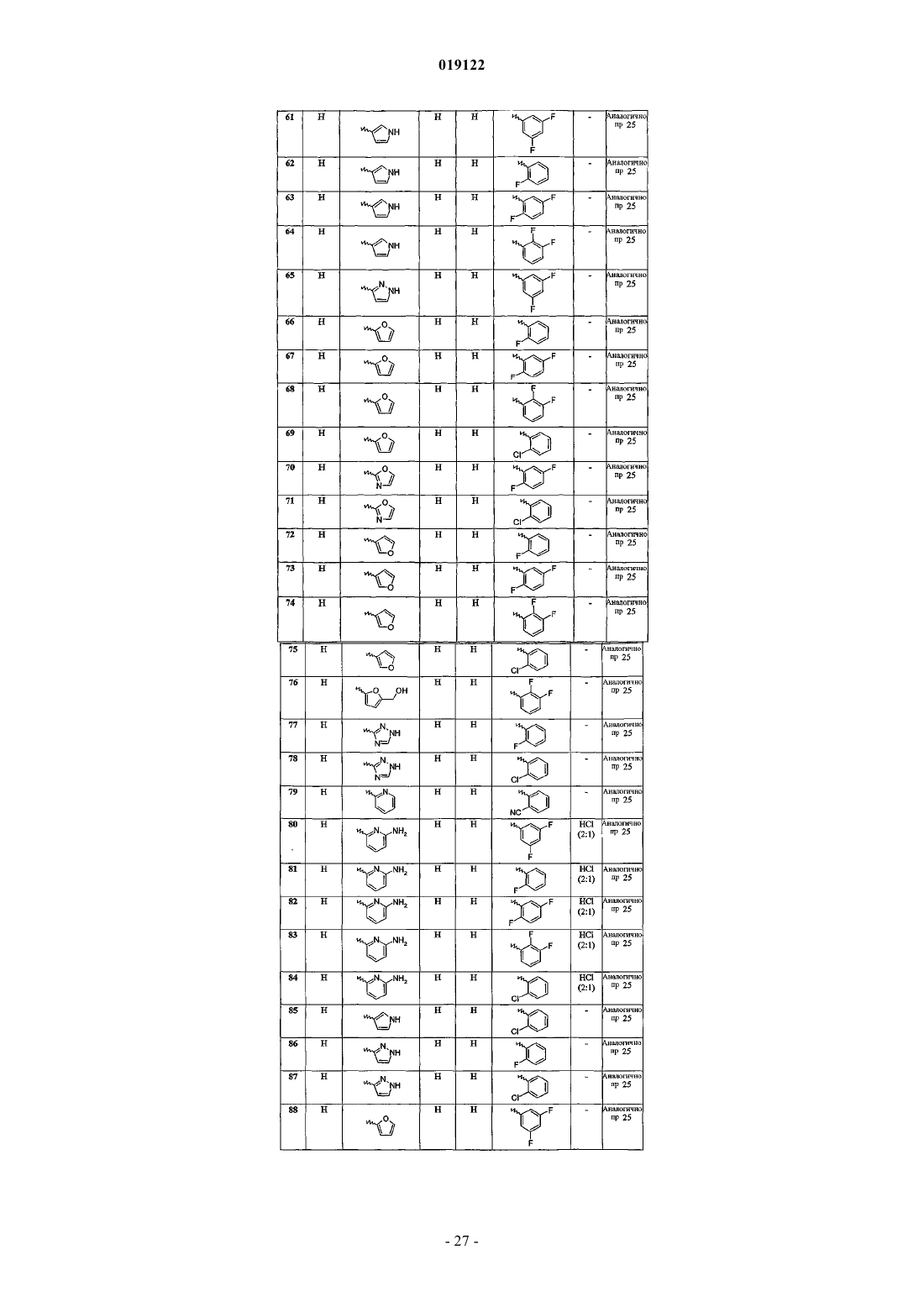
N-(3,5-дифторфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-цианофенил)-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
6-(6-аминопиридин-2-ил)-N-(3,5-дифторфенил)имидазо[1,2-а]пиридин-2-карбоксамида и его дигидрохлорида;
6-(6-аминопиридин-2-ил)-N-(2-фторфенил)имидазо[1,2-а]пиридин-2-карбоксамида и его дигидрохлорида;
6-(6-аминопиридин-2-ил)-N-(2,5-дифторфенил)имидазо[1,2-а]пиридин-2-карбоксамида и его дигидрохлорида;
6-(6-аминопиридин-2-ил)-N-(2,3-дифторфенил)имидазо[1,2-а]пиридин-2-карбоксамида и его дигидрохлорида;
6-(6-аминопиридин-2-ил)-N-(2-хлорфенил)имидазо[1,2-а]пиридин-2-карбоксамида и его дигидрохлорида;
N-(2-хлорфенил)-6-(1Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(1Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,3-дифторфенил)-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-фторфенил)-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2,5-дифторфенил)-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида;
N-(2-хлорфенил)-6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида
и их аддитивных солей кислот.
9. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-8 или аддитивную соль фармацевтически приемлемой кислоты этого соединения.
10. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-8 или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
11. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения нейродегенеративных заболеваний.
12. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения церебральных травм и эпилепсии.
13. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения психиатрических заболеваний.
14. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения воспалительных заболеваний.
15. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения остеопороза.
16. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения раковых заболеваний.
17. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения болезни Паркинсона, болезни Альцгеймера, таутопатий, рассеянного склероза.
18. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и предотвращения шизофрении, депрессии, зависимости от вещества, нарушений в отношении дефицита внимания и гиперактивности.
19. Соединения, выбранные из
6-бром-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-цианоимидазо[1,2-а]пиридин-2-карбоксамида;
6-триметилстаннил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида и его гидробромида (1:1);
гидрохлорида (1:1) 2-фенилкарбамоилимидазо[1,2-а]пиридин-6-бороновой кислоты;
N-фенил-6-винилимидазо[1,2-а]пиридин-2-карбоксамида;
6-формил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(2-бромацетил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
6-(1-этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида;
N-(3,5-дифторфенил)-6-иодимидазо[1,2-а]пиридин-2-карбоксамида;
6-(6-{[(1,1-диметилэтокси)карбонил]амино}пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(6-аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
этил-6-(6-{[(1,1-диметилэтокси)карбонил]амино}пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
этил-6-(6-{бис[(1,1-диметилэтокси)карбонил]амино}пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-(6-пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1-трифенилметил-1Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(1-трифенилметил-1Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(2-{[(1,1-диметилэтокси)карбонил]амино}тиазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(2-{[(1,1-диметилэтокси)карбонил]амино}тиазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1H-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты и ее гидрохлорида (1:1);
этил-6-[1-(триизопропилсилил)-1Н-пиррол-3-ил]имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(1Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(1Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(5-формилфуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
этил-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксилата;
6-(тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-[этокси(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилата;
этил-6-[гидразино(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилата;
этил-6-(1Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
этил-6-(1H-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
6-(1Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты;
гидробромида (1:1) этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата;
2-этоксикарбонилимидазо[1,2-а]пиридин-6-бороновой кислоты.
20. Применение соединений по п.19 для получения соединений общей формулы (I), как указано в любом из пп.1-8.
Текст
Изобретение относится к соединениям формулы (I), в которой X означает возможно замещенную фенильную группу; R1 означает атом водорода, галоген, (C1-C6)-алкоксил, (C1-C6)-алкил, группуNRaRb; R2 означает возможно замещенную гетероциклическую группу; R3 означает атом водорода,(C1-C6)-алкил, (C1-C6)-алкоксил или атом галогена; R4 означает атом водорода, (C1-C4)-алкил, (C1C6)-алкоксил или атом фтора; в виде основания или аддитивной соли кислоты. Применение в терапии. Настоящее изобретение относится к производным имидазо[1,2-а]пиридин-2-карбоксамидов, их получению и их применению в терапии в случае лечения или предотвращения заболеваний, в которых принимают активное участие ядерные рецепторы Nurr-1, также называемые NR4A2, NOT, TINUR, RNR-1 иHZF3. Предшествующий уровень техники В данной области техники известны производные бензоил-2-имидазо[1,2-а]пиридина, использующиеся в качестве лекарственного средства (см. FR 2638161). Кроме того, WO 2004/050659 раскрывает производные имидазо[1,2-а]пиридинила, предназначенные для лечения рака. ЕР 0436831 раскрывает далее производные имидазо[1,2-а]пиридинилалкила, используемые в лечении нейродегенеративных заболеваний. Объектом настоящего изобретения являются соединения формулы (I)X означает фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми независимо друг от друга среди следующих атомов или групп: галоген, (C1-C6)-алкоксил, (C1-С 6)алкил, NRaRb, цианогруппа, (C1-C6)-алкоксикарбонил, причем (C1-C6)-алкильные и (C1-C6)-алкоксильные группы возможно замещены одним или несколькими атомами галогена;R1 означает атом водорода, галоген, (C1-C6)-алкоксил, (С 1-С 6)-алкил, группу NRaRb, причем алкильные и алкоксильные группы, в случае необходимости, могут быть замещены одним(ной) или несколькими атомами галогена, гидроксильными группами, аминогруппами, или (C1-C6)-алкоксилом;R2 означает ароматическую, ненасыщенную, частично насыщенную или полностью насыщенную гетероциклическую группу, возможно замещенную одной или несколькими группами, выбираемыми независимо друг от друга среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, галоген,цианогруппа, NRaRb, -CO-R5, -CO-NR6R7, -CO-O-R8, -NR9-CO-R10, (C1-C6)-алкил, сам возможно замещенный одной или несколькими гидроксильными группами или NRaRb, оксидогруппа;R6 и R7, одинаковые или разные, означают атом водорода или (C1-C6)-алкил или с атомом азота образуют 4-7-членный цикл, возможно включающий другой гетероатом, выбираемый среди N, О и S;R9 и R10, одинаковые или разные, означают атом водорода или (C1-C6)-алкил;Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил или с атомом азота, который их несет, образуют 4-7-членный цикл, возможно включающий другой гетероатом, выбираемый среди N, О и S; за исключением N-(4-бромфенил)-6-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-2-карбоксамида; в виде основания или аддитивной соли кислоты. Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть данного изобретения. Соединения формулы (I) могут существовать в виде оснований или аддитивных солей кислот. Такие аддитивные соли составляют часть данного изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, однако, соли других кислот, пригодные, например, для очистки или выделения соединений формулы (I), также составляют часть данного изобретения. Соединения формулы (I) также могут находиться в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть данного изобретения.N-(4-Бромфенил)-6-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-2-карбоксамид, конкретно исключенный из формулы (I) согласно изобретению, указан в химических печатных изданиях под номеромRN = 797785-86-5. В рамках настоящего изобретения под атомом галогена понимают фтор, хлор, бром или иод; под алкилом понимают линейную, разветвленную или циклическую насыщенную алифатическую группу, возможно замещенную линейным, разветвленным или циклическим насыщенным алкилом. В качестве примеров можно назвать метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил, циклогексил, метилциклопропил и т.д.; под алкенилом понимают линейную или разветвленную, моно- или полиненасыщенную алифатическую группу, включающую, например, одну или две этиленовые ненасыщенности; под алкоксилом понимают радикал -О-алкил, где алкил представляет собой такой, как указанный выше; под гетероциклической группой понимают моно- или бициклическую, ароматическую, ненасыщенную, частично насыщенную или полностью насыщенную группу, включающую 5-10 атомов, 1-4 гетероатома которой выбирают среди N, О и S. В качестве примеров гетероциклических групп можно назвать пиррольную, фурановую, тиофеновую, пиразольную, имидазольную, триазольную, тетразольную, оксазольную, изоксазольную, оксадиазольную, тиазольную, изотиазольную, тиадиазольную, пиридиновую,пиразиновую, пиридазиновую, триазиновую, пирролопиррольную, пирролоимидазольную, пирролопиразольную, пирролотриазольную, имидазоимидазольную, имидазопиразольную, имидазотриазольную, индольную, изоиндольную, бензимидазольную, индазольную, индолизиновую, бензофурановую, изобензофурановую, бензотиофеновую, бензо[с]тиофеновую, пирролопиридиновую, имидазопиридиновую, пиразолопиридиновую, триазолопиридиновую, тетразолопиридиновую, пирролопиримидиновую, имидазопиримидиновую, пиразолопиримидиновую, триазолопиримидиновую, тетразолопиримидиновую, пирролопиразиновую, имидазопиразиновую пиразолопиразиновую, триазолопиразиновую, тетразолопиразиновую, пирролопиридазиновую, имидазопиридазиновую, пиразолопиридазиновую, триазолопиридазиновую, тетразолопиридазиновую, пирролотриазиновую, имидазотриазиновую, пиразолотриазиновую, триазолотриазиновую, тетразолотриазиновую, фуропиридиновую, фуропиримидиновую, фуропиразиновую,фуропиридазиновую, фуротриазиновую, оксазолопиридиновую, оксазолопиримидиновую, оксазолопиразиновую, оксазолопиридазиновую, оксазолотриазиновую, изоксазолопиридиновую, изоксазолопиримидиновую, изоксазолопиразиновую, изоксазолопиридазиновую, изоксазолотриазиновую, оксадиазолопиридиновую, оксадиазолопиримидиновую, оксадиазолопиразиновую, оксодиазолопиридазиновую, оксадиазолотриазиновую, бензоксазольную, бензизоксазольную, бензоксадиазольную, тиенопиридиновую,тиенопиримидиновую, тиенопиразиновую, тиенопиридазиновую, тиенотриазиновую, тиазолопиридиновую, тиазолопиримидиновую, тиазолопиразиновую, тиазолопиридазиновую, тиазолотриазиновую, изотиазолопиридиновую, изотиазолопиримидиновую, изотиазолопиразиновую, изотиазолопиридазиновую,изотиазолотриазиновую, тиадиазолопиридиновую, тиадиазолопиримидиновую, тиадиазолопиразиновую,тиадиазолопиридазиновую, тиадиазолотриазиновую, бензотиазольную, бензоизотиазольную, бензотиадиазольную, хинолиновую, изохинолиновую, циннолиновую, фталазиновую, хиноксалиновую, хиназолиновую, нафтиридиновую, бензотриазиновую, пиридопиримидиновую, пиридопиразиновую, пиридопиридазиновую, пиридотриазиновую, пиримидопиримидиновую, пиримидопиразиновую, пиримидопиридазиновую, пиримидотриазиновую, пиразинопиразиновую, пиразинопиридазиновую, пиразинотриазиновую, пиридазинопиридазиновую, пиридазинотриазиновую группу; причем эти группы могут быть частично ненасыщенными или насыщенными. В качестве примеров гетероциклических групп также можно назвать диоксолановую группу, индазолиновую группу. Эта гетероциклическая группа в значении R2 не связана с имидазо[1,2-а]пиридином через азот, если она является азотсодержащей насыщенной моноциклической гетероциклической группой. Несколько подмножеств соединений приводятся ниже, составляя также часть данного изобретения. Среди соединений, объектов данного изобретения, первая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой X означает фенил, возможно замещенный одним или несколькими атомами галогена или цианогруппами; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, вторая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой X означает фенил, возможно замещенный одним или несколькими атомами фтора, хлора или цианогруппами; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, третья группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой R2 означает моно- или бициклическую, ароматическую, ненасыщенную, частично насыщенную или полностью насыщенную гетероциклическую группу, включающую 5-10 атомов, 1-4 гетероатома которой выбирают среди N, О и S, за исключением пиперидиновой группы, причем вышеуказанный гетероцикл возможно замещен одной или несколькими группами, выбираемыми, независимо друг от друга, среди следующих атомов или групп: гидроксил, (C1C6)-алкоксил, галоген, цианогруппа, NRaRb, -CO-R5, -CO-NR6R7, -CO-O-R8, -NR9-CO-R10, оксидогруппа,(C1-C6)-алкил, который сам возможно замещен одной или несколькими гидроксильными группами или группами NRaRb,причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, четвертая группа соединений образована соеди-2 019122 нениями формулы (I), такой как приведенная выше, в которойR2 означает пиррольную, фурановую, тиофеновую, пиразольную, имидазольную, триазольную, тетразольную, оксазольную, изоксазольную, оксадиазольную, тиазольную, изотиазольную, тиадиазольную,пиридиновую, пиримидиновую, пиразиновую, пиридазиновую, триазиновую группу, возможно замещенную одной или несколькими группами, выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген, -NRaRb, (C1-C6)-алкил, сам возможно замещенный гидроксильной группой;Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил. Среди соединений, объектов данного изобретения, пятая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которойR2 означает диоксолановую, пиридиновую, имидазольную, пиразольную, триазольную, пиррольную, фурановую, оксазольную, имидазолиновую, тиофеновую, пиразиновую, пиримидиновую, тиазольную группу, возможно замещенную одной или несколькими группами, выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген, -NRaRb, (C1-С 6)-алкил, сам возможно замещенный гидроксильной группой;Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, шестая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которойR2 означает индольную, изоиндольную, бензимидазольную, индазольную, индолизиновую, бензофурановую, изобензофурановую, бензотиофеновую, бензо[с]тиофеновую, пирролопиридиновую, имидазопиридиновую, пиразолопиридиновую, триазолопиридиновую, тетразолопиридиновую, пирролопиримидиновую, имидазопиримидиновую, пиразолопиримидиновую, триазолопиримидиновую, тетразолопиримидиновую, пирролопиразиновую, имидазопиразиновую, пиразолопиразиновую, триазолопиразиновую, тетразолопиразиновую, пирролопиридазиновую, имидазопиридазиновую, пиразолопиридазиновую,триазолопиридазиновую, тетразолопиридазиновую, пирролотриазиновую, имидазотриазиновую, пиразолотриазиновую, триазолотриазиновую, тетразолотриазиновую, фуропиридиновую, фуропиримидиновую,фуропиразиновую, фуропиридазиновую, фуротриазиновую, оксазолопиридиновую, оксазолопиримидиновую, оксазолопиразиновую, оксазолопиридазиновую, оксазолотриазиновую, изоксазолопиридиновую,изоксазолопиримидиновую, изоксазолопиразиновую, изоксазолопиридазиновую, изоксазолотриазиновую, оксадиазолопиридиновую, оксадиазолопиримидиновую, оксадиазолопиразиновую, оксадиазолопиридазиновую, оксадиазолотриазиновую, бензоксазольную, бензизоксазольную, бензоксадиазольную,тиенопиридиновую, тиенопиримидиновую, тиенопиразиновую, тиенопиридазиновую, тиенотриазиновую, тиазолопиридиновую, тиазолопиримидиновую, тиазолопиразиновую, тиазолопиридазиновую, тиазолотриазиновую, изотиазолопиридиновую, изотиазолопиримидиновую, изотиазолопиразиновую, изотиазолопиридазиновую, изотиазолотриазиновую, тиадиазолопиридиновую, тиадиазолопиримидиновую,тиадиазолопиразиновую, тиадиазолопиридазиновую, тиадиазолотриазиновую, бензотиазольную, бензоизотиазольную, бензотиадиазольную группу, возможно замещенную одной или несколькими группами,выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген,-NRaRb, (C1-C6)-алкил, сам возможно замещенный гидроксильной группой;Ra и Rb независимо друг от друга означают атом водорода, (C1-C6)-алкил; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, седьмая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которойR2 означает индольную группу, возможно замещенную одной или несколькими группами, выбираемыми среди следующих атомов или групп: гидроксил, (C1-C6)-алкоксил, оксидогруппа, галоген,-NRaRb, (C1-C6)-алкил, сам возможно замещенный гидроксильной группой;Ra и Rb независимо друг от друга означают атом водорода, (C1-С 6)-алкил; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, восьмая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой R2 означает диоксолановую, пиридиновую,имидазольную, пиразольную, триазольную, пиррольную, фурановую, оксазольную, индольную, имидазолиновую, тиофеновую, пиразиновую, пиримидиновую, тиазольную группу, возможно замещенную одной или несколькими гидроксильными, метильными, гидроксиметильными, метокси-, оксидогруппами, атомами галогена, NH2-группами; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, девятая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой R1 означает атом водорода или (C1-C6)алкил; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, десятая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой R1 означает атом водорода или метил; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, одиннадцатая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которой R1 и R4 означают атом водорода; причем другие группы имеют вышеуказанные значения. Среди соединений, объектов данного изобретения, двенадцатая группа соединений образована соединениями формулы (I), такой как приведенная выше, в которойX означает фенил, возможно замещенный одним или несколькими атомами фтора, хлора или цианогруппой;R2 означает диоксолановую, пиридиновую, имидазольную, пиразольную, триазольную, пиррольную, фурановую, оксазольную, индольную, имидазолиновую, тиофеновую, пиразиновую, пиримидиновую, тиазольную группу, возможно замещенную одной или несколькими гидроксильными, метильными,гидроксиметильными группами, метоксигруппами, оксидогруппами, атомами галогена, NH2-группами;R1 означает атом водорода или метил;R3 и R4 означают атом водорода; в виде основания или аддитивной соли кислоты. Среди соединений формулы (I), объектов данного изобретения, тринадцатая группа соединений образована соединениями, в которыхX означает фенил, возможно замещенный одним или несколькими атомами фтора;R2 означает пиридиновую, фурановую, диоксолановую, имидазольную, пиразольную, триазольную,пиррольную, тиазольную, оксазольную, пиразиновую, пиримидиновую, тиофеновую, индольную, имидазолиновую группу, причем эти группы возможно замещены гидроксиметилом, NH2-группой, метилом,метоксигруппой, гидроксилом, оксидогруппой или атомом фтора;R1 означает атом водорода или метил;R3 и R4 означают атом водорода; в виде основания или аддитивной соли кислоты. Из соединений формулы (I), объектов данного изобретения, можно назвать следующие соединения: 6-(1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид;N-(2-хлорфенил)-6-(1 Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамид; и их аддитивные соли кислот. В соответствии с данным изобретением можно получать соединения общей формулы (I) согласно способу, представленному на схеме 1. Схема 1 Первый путь синтеза (превращение А 2) состоит в получении, согласно известным специалисту в данной области способам, 2-иминопиридина формулы (II), в которой R1, R2, R3 и R4 имеют вышеуказанные значения, затем в образовании имидазо[1,2-а]пиридинового цикла путем реакции конденсации галогенпроизводного 2-оксо-N-арилпропионамида (III), в котором Hal означает атом хлора, брома или иода иX имеет вышеуказанное значение, по аналогии со способами, описанными, например, J-J. Bourguignon и др., Aust. J. Chem., 50, 719 (1997), и J.G. Lombardino в J. Org. Chem., 30, 2403 (1965). Галогенпроизводные 2-оксо-N-арилпропионамида (III) могут быть получены, например, согласно способу, описанному R. Kluger и др. в J. Am. Chem. Soc., 106, 4017 (1984). 2-Аминопиридины формулы (II), в которой R1, R2, R3 и R4 имеют вышеуказанные значения, могут быть получены, например, путем превращения А 1, а именно путем реакции связывания производного 2-аминопиридина формулы (IV), в которой R1, R3 и R4 имеют вышеуказанные значения и Z означает борил, станнил или силил, и производного R2-Z' (V), в котором R2 имеет вышеуказанное значение и Z' означает атом галогена, такой как атом брома или иода, или сульфонилоксигруппу; путем реакции связывания производного 2-аминопиридина формулы (IV), в которой R1, R3 и R4 имеют вышеуказанные значения и Z означает атом галогена, такой как атом брома или иода, с производным R2-Z' (V), в котором R2 имеет вышеуказанное значение и Z' означает реакционноспособную группу,такую как борил, станнил или силил, или атом водорода,или другим способом, известным специалисту в данной области. Второй путь синтеза (превращение В 2) состоит в связывании имидазопиридин-2-карбоновой кислоты или одного из ее производных формулы (VI), в которой R1, R2, R3 и R4 имеют вышеуказанные значения, Y означает гидроксил, атом галогена или (C1-C6)-алкоксил, с ариламином X-NH2 формулы (VII), в которой X имеет вышеуказанное значение, согласно способам, известным специалисту в данной области. Таким образом, кислота может быть предварительно превращена в одно из ее реакционноспособных производных, такое как галогенангидрид, ангидрид, смешанный ангидрид или активированный эфир,затем введена во взаимодействие с амином (VII) в присутствии основания, такого как диизопропилэтиламин, триэтиламин или пиридин, в инертном растворителе, таком как тетрагидрофуран (ТГФ), диметилформамид (ДМФА) или дихлорметан. Реакция связывания также может быть осуществлена в присутствии связующего вещества, такого как CDI, EDCI, HATU или HBTU, в одних и тех же условиях, без выделения реакционноспособного промежуточного продукта. Альтернативно, амин (VII) можно вводить во взаимодействие с эфиром кислоты формулы (VI) в присутствии катализатора, такого как триметилалюминий, согласно способу Weireb S. и др. (Tet. Lett., 18, 4171 (1977 или трет-бутилат циркония. Производные имидазопиридин-2-карбоновых кислот формулы (VI), в которой R1, R2, R3 и R4 имеют вышеуказанные значения и Y означает (C1-C6)-алкоксил, гидроксил или галоген, получают путем реакции конденсации 2-аминопиридина формулы (II), в которой R1, R2, R3 и R4 имеют вышеуказанные значения, с эфиром 3-галоген-2-оксопропионовой кислоты формулы (VIII), в которой Hal означает галоген и Y означает (C1-C6)-алкоксил, при условиях, подобных таковым, используемым при осуществлении реакции конденсации производного формулы (II) с производным формулы (III), затем, в случае необходимости,путем превращения сложного эфира в кислоту, потом в хлорангидрид кислоты или другое реакционноспособное производное (превращение B1). Третий путь синтеза (превращение С 2) состоит в связывании производного общей формулы (IX), в которой R1, R3, R4 и X имеют вышеуказанные значения и Z означает атом галогена, такой как атом брома или иода, сульфонилоксигруппу или реакционноспособную группу, такую как борил, станнил или силил,с производным формулы R2-Z' (V), в которой R2 имеет вышеуказанное значение и Z' означает реакционноспособную группу, такую как борил, станнил или силил, или атом водорода, когда Z означает атом галогена или сульфонилоксигруппу, или Z' означает атом галогена, такой как атом брома или иода, когдаZ означает реакционноспособную группу, такую как борил, станнил или силил, или атом водорода. Производные общей формулы (IX), в которой R1, R3, R4, X и Z имеют вышеуказанные значения, могут быть получены путем реакции конденсации 2-аминопиридина формулы (IV), в которой R1, R3, R4 и Z имеют вышеуказанные значения, с производным 2-оксо-N-арилпропионамида (III), в котором Hal означает атом хлора, брома или иода и X имеет вышеуказанное значение (превращение C1), согласно способам, указанным для превращения соединения формулы (II) в соединение формулы (I), или путем реакции амидирования имидазопиридин-2-карбоновой кислоты или одного из ее производных формулы (X), в которой R1, R2, R3 и R4 имеют вышеуказанные значения, Y означает гидроксил, атом галогена или (C1-C6)-алкоксил, с помощью ариламина X-NH2 формулы (VII), в которой X имеет вышеуказанное значение (превращение D2), согласно способам, указанным для превращения соединения формулы (VI) в соединение формулы (I). Имидазопиридин-2-карбоновые кислоты или их производные формулы (X), в которой R1, R3 и R4 имеют вышеуказанные значения, Y означает (C1-C6)-алкоксил, гидроксил или галоген и Z означает борил, станнил или силил или атом галогена, могут быть получены (превращение D1) путем реакции конденсации 2-аминопиридина формулы (IV), в которой R1, R3 и R4 имеют вышеуказанные значения и Z означает борил, станнил или силил или атом галогена, с эфиром 3-галоген-2-оксопропионовой кислоты формулы (VIII), в которой Hal означает галоген и Y означает (C1-C6)-алкоксил, при условиях, подобных таковым, указанным выше для реакции конденсации 2-аминопиридинов формулы (II) с производным формулы (VIII) для получения имидазопиридин-2-карбоновых кислот или их производных формулы(VI), согласно превращению B1, затем, в случае необходимости, путем превращения сложного эфира в кислоту, потом в хлорангидрид кислоты или другое реакционноспособное производное. Имидазопиридин-2-карбоновые кислоты или их производные формулы (VI), в которой R1, R2, R3 иR4 имеют вышеуказанные значения и Y означает (C1-C6)-алкоксил, гидроксил или галоген, также могут быть получены (превращение E1) путем реакции связывания производного общей формулы (X), в которой R1, R3 и R4 имеют вышеуказанные значения, Y означает (C1-C6)-алкоксил и Z означает атом галогена,такой как атом брома или иода, сульфонилоксигруппу или реакционноспособную группу, такую как борил, станнил или силил, с производным формулы R2-Z' (V), в которой R2 имеет вышеуказанное значение и Z' означает реакционноспособную группу, такую как борил, станнил или силил, или атом водорода,когда Z означает атом галогена или сульфонилоксигруппу, или Z' означает атом галогена, такой как атом брома или иода, когда Z означает реакционноспособную группу, такую как борил, станнил или силил,-7 019122 или атом водорода, затем, в случае необходимости, путем превращения сложного эфира в кислоту, потом в хлорангидрид кислоты или другое реакционноспособное производное. Реакции связывания производных формулы (IV), (IX) или (X) с продуктами формулы (V) могут быть осуществлены любым способом, известным специалисту в данной области, в частности работая в присутствии катализаторов на основе меди или палладия, лигандов, таких как фосфины, согласно или по аналогии со способами, описанными, например, в следующих и цитированных ссылках: для реакций типа Suzuki: N. Miyaura, A. Suzaki, Chem. Rev., 95, 2457 (1995),для реакций типа Stille: V. Farina и др., Org. React., 50, 1 (1997),для реакций типа Hiyama: T. Hiyama и др., Top. Curr. Chem., 219), 61 (2002),для реакций типа Negishi: E. Negishi и др., Chem. Rev., 103, 1979 (2003),для реакций типа Bellina: M. Miura и др., Chem. Lett., 200 (2007). В случае осуществления реакции связывания также можно промежуточно получать, но без их выделения, металлоорганические производные, такие как цинковые производные. Согласно данному изобретению соединения общей формулы (I), (VI) и (II) также можно получать согласно способам, представленным на схеме 2. Схема 2 Этот путь синтеза состоит в превращении соединения общих формул (XI), (XII) или (XIII), в которых R1, R3, R4, X и Y имеют вышеуказанные значения и W означает группу-предшественника, позволяющую образовывать гетероцикл формулы R2 согласно способам, известным специалисту в данной области. В качестве примера группы W можно назвать 2-галогенацил, такой как бромацетил, или 1-галоген-2-оксоалкил, такой как 1-бром-2-оксоэтил, который может быть превращен, например, в тиазолил, имидазолил, оксазолил путем обработки производными тиомочевины, тиоамида, гуанидина, мочевины или амида,алкинил, такой как этинил, который может быть превращен в 1,2,3-триазол-4-ил,ацил, такой как формил, который может быть превращен, например, в 1,3-диоксолан-2-ил или оксазолил,цианогруппу, которая может быть превращена, например, в дигидроимидазол-2-ил или 1,3,4 триазол-2-ил. Соединения общей формулы (XI) могут быть получены из соединений формулы (XII) при условиях,описанных для получения соединений формулы (I), исходя из производных имидазопиридин-2 карбоновых кислот формулы (VI), путем превращений В 2. Производные имидазопиридин-2-карбоновых кислот общей формулы (XII) могут быть получены из аминопиридинов формулы (XIII) при условиях, описанных для превращения аминопиридинов формулы(II) в соединения общей формулы (I), путем превращения А 2. Продукты формулы (I) и их предшественники формул (II), (IV), (VI), (IX) или (X) могут быть использованы, если желательно и если необходимо, для получения продуктов формулы (I) или могут быть превращены в другие продукты формулы (I) при осуществлении одной или нескольких реакций следующих превращений, в любом порядке:a) реакция этерификации или амидирования кислотной группы,-8 019122b) реакция аминирования аминогруппы,c) реакция гидролиза сложноэфирной группы до кислотной группы,d) реакция превращения гидроксильной группы в алкоксигруппу,e) реакция окисления спиртовой группы до альдегидной группы или кетогруппы,f) реакция превращения альдегидной группы или кетогруппы в спиртовую группу путем восстановления или воздействия металлоорганического соединения, такого, как магнийорганическое соединение,g) реакция превращения нитрильного радикала в альдегидную группу,h) реакция превращения нитрильного радикала в кетогруппу,i) реакция окисления алкенильной группы до альдегидной группы или кетогруппы,j) реакция каталитического связывания металлоорганического производного, такого как производное бора, олова или кремния, с галогенированным производным для введения алкильного, алкенильного,алкинильного, арильного или гетероарильного заместителя,k) реакция превращения первичной или вторичной аминогруппы во вторичную или третичную аминогруппу путем восстановительного аминирования или алкилирования,l) реакция превращения галогенированного производного в производное со вторичной или третичной аминогруппой путем возможно каталитического замещения первичным или вторичным амином,m) реакция защиты реакционноспособных функциональных групп,n) реакция элиминирования защитных групп, которые могут иметь защищенные реакционноспособные функциональные группы,о) реакция солеобразования с неорганической или органической кислотой или основанием для получения соответствующей соли,р) реакция разделения рацемических форм до энантиомеров,причем таким образом полученные вышеуказанные продукты формулы (I), в случае необходимости, находятся в любых возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных. Согласно схемам 1 и 2 исходные соединения и реагенты, когда способ их получения не описывается, являются коммерчески доступными или описанными в литературе или же могут быть получены способами, которые там описаны или которые известны специалисту в данной области. В нижеприводимых примерах описывается получение некоторых соединений согласно данному изобретению. Эти примеры не являются ограничивающими объем охраны изобретения и даны только для пояснения настоящего изобретения. Номера приводимых в примерах соединений соответствуют таковым, указанным в нижеприводимой таблице, в которой представлены химические структуры и физические свойства некоторых соединений согласно изобретению. Пример 1. 6-(1,3-Диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 137 мг 6-формил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 8) в 5 мл толуола добавляют 45 мкл этиленгликоля, 169 мг п-толуолсульфокислоты и молекулярное сито. Смесь кипятят с обратным холодильником в течение 24 ч в колбе, снабженной насадкой Дина-Старка, затем охлаждают, фильтруют и разбавляют с помощью 100 мл дихлорметана и промывают 2 н. раствором гидроксида натрия и водой. Органические фазы сушат и концентрируют досуха, получая смесь исходного продукта и ожидаемого продукта, которую снова растворяют в 5 мл метанола, содержащего 410 мкл этиленгликоля, 130 мг п-толуолсульфокислоты и молекулярное сито. Смесь кипятят с обратным холодильником в течение 6 ч, затем охлаждают, фильтруют и концентрируют досуха. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью дихлорметана и этилацетата в соотношении 70/30, получая 53 г 6-(1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. Пример 2. N-Фенил-6-(пиридин-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 150 мг 6-бром-N-фенилимидазо[1,2-а]пиридин 2-карбоксамида (промежуточный продукт 1), 0,237 г пиридин-3-бороновой кислоты, 45 мг тетракис(трифенилфосфин)палладия, 2 мл 2 М водного раствора карбоната натрия, 4 мл ацетонитрила и 4 мл толуола. Смесь нагревают в течение 20 мин в аппарате для микроволнового облучения, установленном на температуру 150 С, затем охлаждают и фильтруют, промывая нерастворимую часть смесью метанола и дихлорметана. Объединенные фильтраты концентрируют досуха при пониженном давлении. Остаток уплотняют водным метанолом, получая 73 мг N-фенил-6-(пиридин-3-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества сурового цвета. Пример 3. N-Фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 230 мг 6-иод-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида (промежуточный продукт 2), 690 мг 2-трибутилстаннилпиридина, 120 мг тетракис(трифенилфосфин)палладия и 4 мл N,N-диметилформамида. Реакционную смесь нагревают в течение 5 мин в аппарате для микроволнового облучения, установленном на температуру 100 С, затем в течение 5 мин при температуре 150 С и концентрируют досуха. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью дихлорметана и этилацетата. Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 56 мг N-9 019122 фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 4. 6-[5-(Гидроксиметил)пиридин-3-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 163 мг 6-триметилстаннил-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида (промежуточный продукт 4), 310 мг (5-бромпиридин-3-ил)метанола, 66 мг тетракис(трифенилфосфин)палладия и 4 мл N,N-диметилформамида. Реакционную смесь нагревают в течение 20 мин в аппарате для микроволнового облучения, установленном на температуру 150 С, и концентрируют досуха. Остаток хроматографируют при использовании картуша с диоксидом кремния,элюируя дихлорметаном. Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 61 мг 6-[5-(гидроксиметил)пиридин-3-ил]-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 5. Гидрохлорид (1:1) 6-[4-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин 2-карбоксамида. 5.1. 6-[4-(Гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Этот продукт получают по методике, подобной таковой примера 4, заменяя (5-бромпиридин-3 ил)метанол на (2-бромпиридин-4-ил)метанол. 5.2. Гидрохлорид (1:1) 6-[4-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида. Суспензию 117 мг 6-[4-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 2 мл метанола обрабатывают с помощью 0,68 мл 0,5 н. водного раствора соляной кислоты. Смесь перемешивают в течение 16 ч при комнатной температуре, затем выпаривают досуха при пониженном давлении. Полученный остаток порошкуют в метаноле, отфильтровывают и высушивают, получая 91 мг гидрохлорида (1:1) 6-[4-(гидроксиметил)пиридин-2-ил]-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида. Пример 6. Гидрохлорид (1:1) 6-(6-аминопиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида. В пробирку для микроволнового облучения вводят 236 мг 6-триметилстаннил-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида (промежуточный продукт 4), 413 мг 6-бромпиридин-2-иламина, 95 мг тетракис(трифенилфосфин)палладия и 4 мл N,N-диметилформамида. Реакционную смесь нагревают в течение 45 мин в аппарате для микроволнового облучения, установленном на температуру 150 С, и концентрируют досуха. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью дихлорметана и этилацетата. Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 147 мг 6-(6-аминопиридин-2-ил)-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида в виде твердого вещества желтого цвета, которое обрабатывают смесью диоксана и метанола и затем обрабатывают с помощью 112 мкл 4 М раствора хлороводорода в диоксане. После перемешивания в течение 1 ч при комнатной температуре, осадок отфильтровывают под вакуумом, промывают диоксаном и высушивают, получая 156 мг гидрохлорида (1:1) 6-(6-аминопиридин-2 ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бледно-желтого цвета. Пример 7. Гидрохлорид(1:1) 6-(1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]-пиридин-2 карбоксамида. 7.1. 6-(1-Трифенилметил-1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 540 мг N-фенил-6-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 5), 13 мл диоксана, 6,8 мл 2 М раствора карбоната натрия, 843 мг 4-иод-1-трифенилметилимидазола и 86 мг тетракис(трифенилфосфин)палладия. Смесь нагревают в течение 10 мин в аппарате для микроволнового облучения, установленном на температуру 120 С, затем охлаждают и концентрируют при пониженном давлении. Остаток обрабатывают с помощью 100 мл дихлорметана. После промывки водой, органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя градиентом циклогексана и этилацетата (от 100/0 до 60/40). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении. Твердое вещество кристаллизуют из ацетонитрила. Кристаллы промывают ацетонитрилом, затем диэтиловым эфиром, после чего высушивают в вакууме, получая 342 мг 6-(1-трифенилметил-1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 7,09 (т, J=7,5 Гц, 1 Н), 7,19 (д, J=8,0 Гц, 6 Н), 7,33 (т, J=7,5 Гц,2 Н), от 7,38 до 7,49 (м, 9 Н), 7,53 (д, J=1,5 Гц, 1 Н), 7,57 (д, J=1,5 Гц, 1 Н), 7,59 (д, J=9,5 Гц, 1 Н), 7,79 (дд,J=1,5 и 9,5 Гц, 1 Н), 7,89 (д, J=7,5 Гц, 2 Н), 8,50 (с, 1 Н), 9,03 (уш.с, 1 Н), 10,2 (с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 546 [М+Н]+. 7.2. Гидрохлорид (1:1) 6-(1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида. Суспензию 270 мг 6-(1-трифенилметил-1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида в 4 мл 2 н. соляной кислоты нагревают при температуре 70 С в течение 30 мин, затем разбавляют с помощью 2 мл метанола и кипятят с обратным холодильником в течение 45 мин, разбавляют еще путем добавления 2 мл дихлорметана и кипятят с обратным холодильником еще в течение 2 ч. Реакционную смесь перемешивают в течение 60 ч при комнатной температуре. Осадок отфильтровывают под вакуумом, промывают метанолом, водой, затем пентаном и высушивают при пониженном давлении, получая 96 мг гидрохлорида (1:1) 6-(1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 8. N-Фенил-6-(1 Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 300 мг 6-иод-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида (промежуточный продукт 2), 4 мл диоксана, 4 мл воды, 185 мг 1 Н-пиразол-3-бороновой кислоты, 45 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия и 1,077 г карбоната цезия. Смесь нагревают в течение 20 мин в аппарате для микроволнового облучения, установленном на температуру 160 С, затем охлаждают, разбавляют с помощью 20 мл воды и экстрагируют два раза по 20 мл дихлорметана. Объединенные органические фазы сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя градиентом дихлорметана и метанола (от 0 до 10%). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 40 мг N-фенил 6-(1 Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 9. N-Фенил-6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 250 мг 6-иод-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида (промежуточный продукт 2), 8 мл N,N-диметилформамида, 7,7 мг ацетата палладия, 197 мг иодида меди(I) и 71,3 мг 1,2,4-триазола. Реакционную смесь нагревают в течение 2,5 ч в аппарате для микроволнового облучения, установленном на температуру 200 С. Охлажденную реакционную смесь фильтруют, нерастворимую часть промывают N,N-диметилформамидом, дихлорметаном и метанолом и объединенные фильтраты концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью дихлорметана и метанола в соотношении 90/1. Фракции, содержащие чистый ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 40 мг N-фенил-6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. Пример 10. N-Фенил-6-(1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. 10.1. N-Фенил-6-(1-триизопропилсилил-1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. Этот продукт получают по методике, подобной таковой примера 8, заменяя 1 Н-пиразол-3 бороновую кислоту на 1-триизопропилсилил-1 Н-пиррол-3-бороновую кислоту. 1(дд, J=1,5 и 9,5 Гц, 1 Н), 7,89 (д, J=7,5 Гц, 2 Н), 8,39 (с, 1 Н), 8,82 (ушир.с, 1 Н), 10,15 (с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 459 [М+Н]+. 10.2. N-Фенил-6-(1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. Раствор 120 мг N-фенил-6-(1-триизопропилсилил-1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2 карбоксамида в 5 мл тетрагидрофурана обрабатывают с помощью 262 мкл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране и перемешивают в течение 10 мин при комнатной температуре. Затем разбавляют с помощью 15 мл дихлорметана и 20 мл воды. Органическую фазу сушат и концентрируют досуха при пониженном давлении. Остаток обрабатывают с помощью 2 мл дихлорметана, отфильтрованное твердое вещество промывают два раза по 1 мл дихлорметана, затем два раза по 1 мл диизопропилового эфира, порошкуют 2 раза при использовании 2 мл воды, отфильтровывают под вакуумом и снова промывают 2 мл дихлорметана и 2 мл диизопропилового эфира, после чего высушивают, получая 40 мгN-фенил-6-(1H-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 11. 6-(2-Метил-1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 400 мг 6-триметилстаннил-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида (промежуточный продукт 4), 229 мг 2-метил-4-иод-1 Н-имидазола, 8 мл тетрагидрофурана, 9,1 мг бис(дибензилиденацетон)палладия и 4,6 мг трис(2-фурилфосфина). Реакционную смесь нагревают в течение 50 мин в аппарате для микроволнового облучения, установленном на температуру 130 С, затем концентрируют досуха. Остаток обрабатывают 3,5 мл N,N-диметилформамида и снова добавляют 150 мг 2-метил-4-иод-1 Н-имидазола, 10 мг бис(дибензилиденацетон)палладия и 5 мг трис(2-фурилфосфина), снова нагревая в течение 40 мин в аппарате для микроволнового облучения, установленном на температуру 120 С. Реакционную смесь фильтруют, нерастворимую часть промывают метанолом и дихлорметаном и объединенные фильтраты концентрируют при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя дихлорметаном,затем смесью дихлорметана и метанола в соотношении 90/10. Фракции, содержащие чистый ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 28 мг 6-(2-метил-1 Нимидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. Пример 12. 6-(3-Фурил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 200 мг 6-бром-N-фенилимидазо[1,2-а]пиридин 2-карбоксамида (промежуточный продукт 1), 10 мл диоксана, 400 мкл 3-(триэтоксисилил)фурана, 42 мг ацетата палладия, 42 мг 1,4-диазабицикло[2,2,2]октана (DABCO), 1,5 мл 1 М раствора тетрабутиламмо- 11019122 нийфторида в тетрагидрофуране. Реакционную смесь нагревают в течение 3 ч в аппарате для микроволнового облучения, установленном на температуру 120 С, затем добавляют 200 мкл 3(триэтоксисилил)фурана, 20 мг ацетата палладия и 20 мг DABCO и нагревают еще в течение 1,5 ч в аппарате для микроволнового облучения, установленном на температуру 150 С, после чего охлаждают и фильтруют. Фильтрат концентрируют досуха при пониженном давлении и остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя дихлорметаном. Фракции, содержащие ожидаемый чистый продукт, объединяют и выпаривают досуха при пониженном давлении. Твердое вещество растворяют при нагревании в смеси дихлорметана и метанола. Горячий раствор фильтруют и обрабатывают диизопропиловым эфиром. Выпавший осадок отфильтровывают под вакуумом и высушивают,получая 25 мг 6-(3-фурил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества желтого цвета. Пример 13. Трифторацетат (1:1) 6-(1 Н-имидазол-1-ил)-N-фенилимидазо[1,2-а]-пиридин-2 карбоксамида. Смесь 0,6 г 6-иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 2), 20 мл N,N-диметилформамида, 1,08 г карбоната цезия, 113 мг имидазола, 60 мг 1,10-фенантролина и 31,5 мг иодида меди(I) нагревают в течение 21 ч при температуре 130 С и после добавления 70 мг имидазола нагревают еще в течение 3 ч при той же самой температуре и выдерживают в течение 64 ч при комнатной температуре. Реакционную смесь фильтруют, нерастворимую часть промывают дихлорметаном и объединенные фильтраты концентрируют при пониженном давлении. Остаток очищают путем препаративной ВЭЖХ при использовании колонки Waters Sunfire 30100, 5 мкм, элюируя градиентом ацетонитрила, который содержит от 0 до 60% воды и 0,07% трифторуксусной кислоты, в течение 15 мин и с объемным расходом 30 мл/мин. Фракции, содержащие чистый ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении. Твердое вещество дробят в 2 мл метанола, отфильтровывают и промывают 1 мл метанола и высушивают, получая 110 мг трифторацетата (1:1) 6-(1 Н-имидазол-1-ил)-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. Пример 14. 6-(Оксазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К суспензии 200 мг 6-формил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 8) в 10 мл метанола добавляют 104 мг карбоната калия и 147 мг п-толуолсульфонилметилизонитрила (TOSMIC). Реакционную смесь кипятят с обратным холодильником в течение 2 ч, затем выпаривают досуха при пониженном давлении, обрабатывают с помощью 300 мл дихлорметана и промывают водой. Органическую фазу сушат и концентрируют досуха на диоксиде кремния для хроматографирования при использовании картуша с диоксидом кремния, элюируя градиентом от 0 до 20% метанола в дихлорметане. Фракции, содержащие ожидаемый продукт, концентрируют досуха и полученное твердое вещество порошкуют с помощью небольшого количества дихлорметана, отфильтровывают и высушивают, получая 80 мг 6-(оксазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 15. 6-(2-Аминотиазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К суспензии 60 мг сырого 6-(2-бромацетил)-N-фенилимидазо-[1,2-а]пиридин-2-карбоксамида в 10 мл метанола добавляют 14 мг тиомочевины. Реакционную смесь кипятят с обратным холодильником в течение 45 мин, затем концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью дихлорметана и метанола (градиент от 100/0 до 90/10). Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 20 мг 6-(2-аминотиазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. Пример 16. 6-(2-Метил-1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Смесь 80 мг 6-(1-этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида, 2,5 мл толуола, 280 мкл этиленгликоля, 170 мг п-толуолсульфокислоты кипятят с обратным холодильником в течение 2 ч,затем охлаждают, фильтруют и разбавляют с помощью 20 мл дихлорметана и 20 мл воды и нейтрализуют 1 н. раствором гидроксида натрия. Водную фазу промывают дихлорметаном и объединенные органические фазы сушат и концентрируют досуха. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя градиентом дихлорметана и этилацетата от 0/30 до 70/30, получая 17 мг 6(2-метил-1,3-диоксолан-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 17. Гидрохлориды (1:1) и (2:1) 6-(4,5-дигидро-1 Н-имидазол-2-ил)-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида. 17.1. Гидрохлорид (1:1) этил-2-фенилкарбамоилимидазо[1,2-а]пиридин-6-карбоксимидата. Суспензию 300 мг N-фенил-6-цианоимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 2) в 25 мл этанола с добавленными 0,5 мл диметилформамида охлаждают до температуры 0 С, затем обрабатывают в течение 1 ч 40 мин газообразным хлороводородом. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, затем концентрируют при пониженном давлении до небольшого объема. Осадок отфильтровывают под вакуумом и промывают этанолом и диэтиловым эфиром, получая 296 мг гидрохлорида (1:1) этил-2-фенилкарбамоилимидазо[1,2-а]пиридин-6- 12019122 карбоксимидата в виде твердого вещества белого цвета, которое используют таким, какое есть, для продолжения синтеза. 17.2. Гидрохлориды (1:1) и (2:1) 6-(4,5-дигидро-1 Н-имидазол-2-ил)-N-фенилимидазо[1,2-а]пиридин 2-карбоксамида. Суспензию 296 мг гидрохлорида (1:1) этил-2-фенилкарбамоилимидазо[1,2-а]пиридин-6 карбоксимидата в 10 мл этанола охлаждают до температуры 0 С перед добавлением 144 мкл этилендиамина. Реакционную смесь кипятят с обратным холодильником в течение 16 ч, затем перемешивают при комнатной температуре в течение 60 ч. Осадок отфильтровывают под вакуумом и промывают этанолом,после чего перекристаллизуют из метанола, получая 64 мг гидрохлорида (2:1) 6-(4,5-дигидро-1 Нимидазол-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Фильтрат концентрируют досуха и обрабатывают водой. Нерастворимую часть отфильтровывают под вакуумом и промывают метанолом, затем высушивают, получая 99 мг гидрохлорида (1:1) 6-(4,5-дигидро 1 Н-имидазол-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 18. 6-(6-Метоксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 624 мг карбоната цезия, 90 мг 2-бром-6-метоксипиридина, 17,5 мг [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия в 10 мл диоксана и 4 мл воды добавляют 160 мг 2 фенилкарбамоилимидазо[1,2-а]пиридин-6-бороновой кислоты. Смесь кипятят с обратным холодильником в течение 1 ч, затем охлаждают и концентрируют досуха при пониженном давлении. Остаток обрабатывают с помощью 150 мл дихлорметана и промывают 100 мл воды. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении на диоксиде кремния для осуществления хроматографии при использовании картуша с диоксидом кремния, элюируя градиентом 0-35% этилацетата в циклогексане. Фракции, содержащие чистый ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 36 мг 6-(6-метоксипиридин-2-ил)-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества не совсем белого цвета. Пример 19. 5-Метил-N-фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамид. 19.1. Этил-6-иод-5-метил(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. К суспензии 2 г 5-иод-6-метилпиридин-2-амина в 15 мл диметоксиэтана добавляют 1,3 мл этилбромпирувата. Реакционную смесь перемешивают при температуре 20 С в течение 16 ч, затем концентрируют досуха, обрабатывают 15 мл этанола, кипятят с обратным холодильником в течение 2,5 ч и, наконец, концентрируют при пониженном давлении. Остаток обрабатывают смесью дихлорметана и насыщенного раствора гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении, получая 2,77 г этил-6-иод-5-метил(пиридин-2 ил)имидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества бежевого цвета. 1(д, J=9,3 Гц, 1 Н), 7,66 (д, J=9,3 Гц, 1 Н), 8,48 (с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 331 [М+Н]+. 19.2. 6-Иод-5-метил-N-фенил(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамид. К раствору 852 мкл анилина в 104 мл толуола, охлажденному до температуры 0 С, добавляют по каплям 6,2 мл 2 М раствора триметилалюминия в толуоле, затем при температуре 20 С 1,5 г этил-6-иод-5 метил(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата. Реакционную смесь перемешивают в течение 2 ч при температуре 20 С. Охлаждают до температуры 4 С, затем добавляют 120 мл насыщенного раствора хлорида аммония. После концентрирования при пониженном давлении остаток обрабатывают этилацетатом, органическую фазу промывают водой, сушат над сульфатом магния, фильтруют через целит, выпаривают досуха при пониженном давлении. Остаток порошкуют в метаноле, отфильтровывают и высушивают,получая 1,15 г 6-иод-5-метил-N-фенил(пиридин-2-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества желтого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 2,89 (с, 3 Н), 7,10 (тт, J=1,5 и 7,5 Гц, 1 Н), 7,33 (т, J=7,5 Гц, 2 Н),7,39 (д, J=9,5 Гц, 1 Н), 7,70 (д, J=9,5 Гц, 1 Н), 7,90 (д, J=7,5 Гц, 2 Н), 8,49 (с, 1 Н), 10,3 (с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 378 [М+Н]+. 19.3. 5-Метил-N-фенил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксамид. Этот продукт получают аналогичным получению продукта примера 3 образом, заменяя 6-иод-Nфенилимидазо[1,2-а]пиридин-2-карбоксамид на 6-иод-5-метил-N-фенил(пиридин-2-ил)имидазо[1,2 а]пиридин-2-карбоксамид. Пример 20. Трифторацетат (1:1) 6-(2-амино-1 Н-имидазол-4-ил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида. К раствору 135 мг 6-(2-бромацетил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 9) в 10 мл N,N-диметилформамида добавляют 190 мг 1-трет-бутилоксикарбонилгуанидина. Реакционную смесь перемешивают в течение 16 ч при температуре 20 С, затем концентрируют досуха при температуре 60 С при пониженном давлении. Остаток обрабатывают с помощью 5 мл дихлорметана и 3 мл метанола и раствор выпаривают на диоксиде кремния для осуществления хроматографии при ис- 13019122 пользовании картуша с диоксидом кремния, элюируя смесью дихлорметана и метанола (градиент от 100/0 до 90/10). Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 50 мг смеси 6-(2-трет-бутилоксикарбониламинотиазол-4-ил)-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида и 6-(2-амино-1-трет-бутилоксикарбонилтиазол-4-ил)-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. Этот продукт растворяют в 5 мл диоксана и обрабатывают с помощью 320 мкл 4 н. раствора хлороводорода в диоксане. Смесь нагревают при температуре 60 С в течение 4 ч, затем добавляют 200 мкл 4 н. раствора хлороводорода в диоксане, после чего концентрируют досуха при пониженном давлении. Остаток очищают путем препаративной ВЭЖХ, получая 18 мг трифторацетата (1:1) 6-(2-амино-1 Н-имидазол-4-ил)-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. Пример 21. 6-(2-Аминотиазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. 21.1. 6-(2-Этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Этот продукт получают при условиях, подобных таковым, описанным в случае первой стадии получения промежуточного продукта 9, заменяя трибутил(1-этоксивинил)олово на трибутил(2 этоксивинил)олово. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 1,33 (т, J=7,2 Гц, 3 Н), 4,06 (кв, J=7,2 Гц, 2 Н), 5,26 (д, J=6,8 Гц,1 Н), 6,52 (д, J=6,8 Гц, 1 Н), 7,08 (т, J=7,8 Гц, 1 Н), 7,34 (т, J=7,8 Гц, 2 Н), 7,54-7,66 (м, 2 Н), 7,88 (д, J=7,8 Гц,2 Н), 8,51 (с, 1 Н), 8,75 (с, 1 Н), 10,16 (с, 1 Н). 21.2. 6-(2-Аминотиазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 168 мг 6-(2-этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 5,1 мл тетрагидрофурана добавляют 1,4 мл воды, затем после охлаждения до температуры 0 С раствор 97 мг Nбромсукцинимида в 0,7 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Образовавшийся 6-(1-бром-2-оксоэтил)-N-фенилимидазо[1,2-а]пиридин-2 карбоксамид не выделяют из реакционной смеси, которую обрабатывают с помощью 42 мг тиомочевины и перемешивают еще в течение 16 ч после повышения температуры до 20 С. Полученное твердое вещество отфильтровывают под вакуумом, затем промывают водой, потом метанолом и высушивают, получая 51 мг 6-(2-аминотиазол-5-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Пример 22. 6-(6-Гидроксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. 22.1. 6-(6-Бензилоксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 250 мг 2-бензилокси-6-бромпиридина в 12 мл диоксана добавляют раствор 1,234 г карбоната цезия в 3 мл воды, 34,6 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия, затем 546 мг гидробромида (1:1) N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2 карбоксамида. Смесь нагревают при температуре 110 С в течение 2 ч 45 мин, затем охлаждают и фильтруют. Твердое вещество промывают небольшим количеством метанола, затем дихлорметана, потом обрабатывают с помощью 250 мл кипящего метанола с добавленными 5 мл трифторуксусной кислоты. Нерастворимую часть отфильтровывают и промывают метанолом, затем дихлорметаном и фильтрат концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя градиентом 0-5% метанола в дихлорметане. Фракции, содержащие чистый ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 0,3 г 6-(6-бензилоксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 5,54 (с, 2 Н), 6,91 (д, J=8,3 Гц, 1 Н), 7,11 (уш.т, J=7,7 Гц, 1 Н),7,31-7,45 (м, 5 Н), 7,54 (м, 2 Н), 7,63 (д, J=7,8 Гц, 1 Н), 7,77 (д, J=9,7 Гц, 1 Н), 7,85-7,93 (м, 3 Н), 8,12 (дд,J=9,7, 2,0 Гц, 1 Н), 8,64 (с, 1 Н), 9,44 (уш.с, 1 Н), 10,30 (уш.с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 421 [М+Н]+. 22.2. 6-(6-Гидроксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Раствор 300 мг 6-(6-бензилоксипиридин-2-ил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 3 мл трифторуксусной кислоты перемешивают при температуре 25 С в течение 48 ч, затем выпаривают досуха при пониженном давлении при температуре 45 С. Остаток порошкуют в диэтиловом эфире, отфильтровывают и высушивают, затем снова порошкуют при использовании 2 мл насыщенного раствора гидрокарбоната натрия, промывают 2 раза по 2 мл воды и 2 раза по 2 мл диэтилового эфира и высушивают при пониженном давлении, получая 168 мг 6-(6-гидроксипиридин-2-ил)-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. Пример 23. N-Фенил-6-(1 Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамид. 23.1. 6-Этинил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения емкостью 20 мл вводят 0,2 г 6-иод-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 2), 156 мкл триметилсилилацетилена, 20 мг дихлорбис(трифенилфосфин)палладия и 2 мл пиперидина. Смесь нагревают в течение 15 мин в аппарате для микроволнового облучения, установленном на температуру 130 С. После охлаждения смесь выливают в 50 мл водного насыщенного раствора хлорида аммония. Экстрагируют 2 раза по 70 мл диэтилового эфира. Объединенные органические фазы декантируют, сушат и концентрируют при пониженном давлении. Остаток обрабатывают с помощью 4 мл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране и перемешивают в течение 16 ч при температуре 25 С. После выпаривания досуха реакционной среды, остаток хроматографируют на диоксиде кремния, элюируя смесью циклогексана и этилацетата (градиент 0-35%), получая 30 мг 6-этинил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 4,37 (с, 1 Н), 7,09 (т, J=8,0 Гц, 1 Н), 7,34 (уш.т, J=8,0 Гц, 2 Н), 7,39[M-NHPh]+. 23.2. N-Фенил-6-(1 Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 123 мг 6-этинил-N-фенилимидазо[1,2 а]пиридин-2-карбоксамида, 46 мг азида натрия, 38 мг хлорида аммония и 5 мл N,N-диметилформамида. Реакционную смесь нагревают в течение 20 мин в аппарате для микроволнового облучения, установленном на температуру 170 С, затем снова в течение 30 мин при тех же самых условиях после добавления 46 мг азида натрия и 38 мг хлорида аммония и, наконец, концентрируют при температуре 50 С при пониженном давлении. Остаток обрабатывают с помощью 20 мл этилацетата и 20 мл воды. Водную фазу экстрагируют 2 раза по 20 мл этилацетата и объединенные органические фазы промывают с помощью 30 мл насыщенного солевого раствора, после чего сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя градиентом дихлорметана и метанола (от 100/0 до 90/10). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 36 мг N-фенил 6-(1 Н-1,2,3-триазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества не совсем белого цвета. Пример 24. N-(3,5-Дифторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. В пробирку для микроволнового облучения вводят 83 мг карбоната калия и 4 мл 1,2 диметоксиэтана, затем после дегазации с помощью аргона 120 мл N-(3,5-дифторфенил)-6 иодимидазо[1,2-а]пиридин-2-карбоксамида (промежуточный продукт 10), 40 мг 3-фуранбороновой кислоты и 21 мг дихлорбис(трифенилфосфин)палладия(II). Реакционную смесь нагревают в течение 20 мин в аппарате для микроволнового облучения, установленном на температуру 120 С, затем выливают в смесь 15 мл этилацетата и 15 мл воды. Водную фазу экстрагируют 2 раза по 15 мл этилацетата и объединенные органические фазы промывают с помощью 15 мл насыщенного солевого раствора, после чего сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Остаток порошкуют 2 раза при использовании 10 мл смеси метанол-диэтиловый эфир (1:1), затем промывают изопропанолом и пентаном и высушивают, получая 22 мг N-(3,5-дифторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. Пример 25. N-(3-Фторфенил)-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксамид. К суспензии 65 мг 6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты (промежуточный продукт 19) и 104 мг 1-(3-диметиламинопропил-3-этилкарбодиимидгидрохлорида в 2 мл безводного пиридина в атмосфере аргона добавляют 68 мг 3-фторанилина. Реакционную смесь перемешивают в течение 16 ч при температуре 80 С, затем концентрируют досуха при пониженном давлении. Остаток обрабатывают дихлорметаном и промывают водой. Органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении, получая 46 мг N-(3-фторфенил)-6-(фуран-3 ил)имидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. Нижеописанные промежуточные продукты пригодны для получения соединений согласно настоящему изобретению. Промежуточный продукт 1. 6-Бром-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 3 г анилина в 366 мл толуола, охлажденному до температуры 0 С, по каплям добавляют 22,5 мл 2 М раствора триметилалюминия в толуоле, затем при температуре 20 С 5,6 г этил-6 бромимидазо[1,2-а]пиридин-2-карбоксилата. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Охлаждают до температуры 4 С, затем добавляют 150 мл насыщенного раствора хлорида аммония. Реакционную смесь концентрируют досуха, затем обрабатывают с помощью 400 мл воды и 400 мл дихлорметана. Органическую фазу сушат над сульфатом магния, фильтруют через целит,выпаривают досуха при пониженном давлении, получая 4,6 г 6-бром-N-фенилимидазо[1,2-а]пиридин-2 карбоксамида в виде порошка сурового цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 7,09 (т, J=7,5 Гц, 1 Н), 7,34 (т, J=7,5 Гц, 2 Н), 7,51 (д, J=9,5 Гц,1 Н), 7,57 (дд, J=1,5 и 9,5 Гц, 1 Н), 7,88 (д, J=8,0 Гц, 2 Н), 8,42 (с, 1 Н), 9,02 (уш.с, 1 Н), 10,25 (с, 1 Н). Масс-спектр (IE): m/z=363 [M]+, m/z=271 [M-C6H6N]+, m/z=144 (m/z=271 - I]+. Промежуточный продукт 2. 6-Иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Следуя той же самой методике, как в случае получения промежуточного продукта 1, заменяя этил- 15019122 6-бромимидазо[1,2-а]пиридин-2-карбоксилат на этил-6-иодимидазо[1,2-а]пиридин-2-карбоксилат, получают 6-иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид в виде твердого вещества бежевого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 7,09 (т, J=7,5 Гц, 1 Н), 7.34 (т, J=7,5 Гц, 2 Н), 7,51 (д, J=9,5 Гц,1 Н), 7,57 (дд, J=1,5 и 9,5 Гц, 1 Н), 7,88 (д, J=8,0 Гц, 2 Н), 8,42 (с, 1 Н), 9,02 (уш.с, 1 Н), 10,25 (с, 1 Н). Масс-спектр (IE): m/z=363 [M]+, m/z=271 [M-C6H6N]+, m/z=144 (m/z=271 - I]+. Промежуточный продукт 3. N-Фенил-6-цианоимидазо[1,2-а]пиридин-2-карбоксамид. Следуя той же самой методике, как в случае получения промежуточного продукта 1, заменяя этил 6-бромимидазо[1,2-а]пиридин-2-карбоксилат на этил-6-цианоимидазо[1,2-а]пиридин-2-карбоксилат (J.Med. Chem., 41(22), 4317 (1998, получают N-фенил-6-цианоимидазо[1,2-а]пиридин-2-карбоксамид в виде твердого вещества желтого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 7,11 (т, J=7,5 Гц, 1 Н), 7,35 (т, J=7,5 Гц, 2 Н), 7,65 (дд, J=2,0 и 9,5 Гц, 1 Н), 7,81 (д, J=9,5 Гц, 1 Н), 7,89 (д, J=8,0 Гц, 2 Н), 8,58 (с, 1 Н), 9,41 (уш.с, 1 Н), 10,4 (уш.с, 1 Н). ИК-спектр (KBr): 3364; 2234; 1671; 1599; 1560; 1527; 1504; 1433; 748 см-1. Масс-спектр (IE): m/z=262 [M]+ (пик молекулярного иона), m/z=170 [M-C6H6N]+, m/z=143 (m/z=170 HCN]+. Промежуточный продукт 4. 6-Триметилстаннил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К суспензии 160 мг 6-бром-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 10 мл толуола добавляют 260 мкл гексаметилдистаннана и 30 мг тетракис(трифенилфосфин)палладия(0). Реакционную смесь кипятят с обратным холодильником в течение 2 ч, затем перемешивают в течение 16 ч при комнатной температуре и фильтруют через слой целита. Фильтрат концентрируют при пониженном давлении и остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя дихлорметаном. Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 163 мг 6-триметилстаннил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества желтого цвета. 1(уш.д, J=9,5 Гц, 1 Н), 7,61 (уш.д, J=9,5 Гц, 1 Н), 7,89 (д, J=7,5 Гц, 2 Н), 8,43 (с, 1 Н), 8,53 (м, 1 Н), 10,2 (с,1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 402 [М+Н]+. Промежуточный продукт 5. N-Фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2 а]пиридин-2-карбоксамид и его гидробромид (1:1). К раствору 1 г 3-бром-2-оксо-N-фенилпропионамида в 50 мл 1,2-диметоксиэтана добавляют 1,09 г 2-амино-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Реакционную смесь перемешивают в течение 40 ч при комнатной температуре, затем концентрируют досуха при пониженном давлении. Остаток обрабатывают с помощью 30 мл этанола и кипятят с обратным холодильником в течение 90 мин. После концентрирования досуха при пониженном давлении, твердое вещество порошкуют в небольшом количестве этанола, отфильтровывают и промывают этанолом, затем диэтиловым эфиром, получая 0,6 г гидробромида (1:1) N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. Этот гидробромид обрабатывают с помощью 200 мл этилацетата и промывают насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат и концентрируют досуха при пониженном давлении, получая 0,53 г N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2 а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. 1(дд, J=1,5 и 9,5 Гц, 1 Н), 7,63 (д, J=9,5 Гц, 1 Н), 7,89 (д, J=7,5 Гц, 2 Н), 8,58 (с, 1 Н), 8,96 (уш.с, 1 Н), 10,25 (с,1 Н). Масс-спектр (IE): m/z=363 [M]+, m/z=271 [M-NHPh]+, m/z=171 (271 - C6H12O]-. Промежуточный продукт 6. Гидрохлорид (1:1) 2-фенилкарбамоилимидазо[1,2-а]пиридин-6 бороновой кислоты. 1) К раствору 0,8 г 3-бром-2-оксо-N-фенилпропионамида в 30 мл 1,2-диметоксиэтана добавляют 0,87 г 2-амино-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре, затем концентрируют досуха при пониженном давлении. Остаток обрабатывают с помощью 15 мл этанола и кипятят с обратным холодильником в течение 2 ч. После концентрирования досуха при пониженном давлении остаток кристаллизуют из этанола, отфильтровывают под вакуумом и промывают этанолом, затем диэтиловым эфиром, получая 0,75 г гидробромидаN-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2 карбоксамида в виде твердого вещества белого цвета. 1 ил)имидазо[1,2-а]пиридин-2-карбоксамида в 9 мл ацетонитрила обрабатывают с помощью 0,5 мл соляной кислоты и 1 г бензолбороновой кислоты, нанесенной на полимер (Alfa-Aesar L19459, примерно 3 ммоль/г). Реакционную смесь перемешивают в течение 16 ч при температуре 25 С, затем кипятят с обратным холодильником в течение 1 ч. Смолу отфильтровывают, промывают ацетонитрилом, затем метанолом и объединенные фильтраты выпаривают досуха при пониженном давлении, получая 160 мг гидрохлорида (1:1) 2-фенилкарбамоилимидазо[1,2-а]пиридин-6-бороновой кислоты в виде твердого вещества оранжевого цвета. 1(уш.м, 1 Н). Промежуточный продукт 7. N-Фенил-6-винилимидазо[1,2-а]пиридин-2-карбоксамид. Смесь 0,73 г 6-иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида, 209 мг тетракис(трифенилфосфин)палладия(0), 587 мкл трибутилвинилолова и 17 мл диметилформамида нагревают в течение 10 мин при температуре 130 С в аппарате для микроволнового облучения, затем концентрируют досуха. Остаток обрабатывают с помощью 100 мл воды и экстрагируют два раза 70 мл этилацетата. Объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Твердое вещество порошкуют в этилацетате, отфильтровывают под вакуумом и промывают этилацетатом, затем диизопропиловым эфиром, обрабатывают смесью метанола и дихлорметана. Нерастворимую часть отфильтровывают и промывают метанолом, Фильтрат концентрируют досуха при пониженном давлении, получая 0,29 г N-фенил-6 винилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 5,39 (д, J=11,0 Гц, 1H), 5,92 (д, J=17,5 15 Гц, 1 Н), 6,77 (дд,J=11,0 и 17,5 Гц, 1H), 7,09 (уш.т, J=7,5 Гц, 1 Н), 7,34 (уш.т, J=7,5 Гц, 2 Н), 7,64 (д, J=9,5 Гц, 1 Н), 7,70 (дд,J=2,0 и 9,5 Гц, 1 Н), 7,89 (уш.д, J=8,0 Гц, 2 Н), 8,47 (с, 1 Н), 8,66 (уш.с, 1 Н), 10,2 (с, 1 Н). Масс-спектр (IE): m/z=263 [M+]. Промежуточный продукт 8. 6-Формил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. Суспензию 150 мг N-фенил-6-винилимидазо[1,2-а]пиридин-2-карбоксамида, 232 мкл тетраоксида осмия и 167 мг периодата натрия в смеси 6 мл тетрагидрофурана, 3 мл трет-бутанола и 3 мл воды перемешивают в течение 20 ч при температуре 20 С, затем еще в течение 48 ч, добавляя в четырех повторениях 100 мкл тетроксида осмия и 80 мг периодата натрия. Реакционную смесь выливают в 50 мл воды и экстрагируют два раза по 50 мл этилацетата. Объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, декантируют, сушат и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью циклогексана и этилацетата(градиент от 0 до 50%), получая 100 мг 6-формил-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 7,11 (т, J=8,0 Гц, 1 Н), 7,36 (уш.т, J=8,0 Гц, 2 Н), 7,71 (дд, J=1,5 и 9,5 Гц, 1 Н), 7,77 (уш.д, J=9,5 Гц, 1 Н), 7,90 (уш.д, J=8,0 Гц, 2 Н), 8,73 (с, 1 Н), 9,39 (уш.с, 1 Н), 10,0 (с, 1 Н),10,35 (уш.с, 1 Н). Масс-спектр (LC/MS): m/z=266 [M+H+]. Промежуточный продукт 9. 6-(2-Бромацетил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. 9.1. 6-(1-Этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К суспензии 1 г 6-иод-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 50 мл толуола добавляют 159 мг тетракис(трифенилфосфин)палладия и 1,09 г трибутил(1-этоксивинил)олова. Реакционную смесь нагревают в течение 9 ч при температуре 150 С, затем в течение 16 ч при температуре 130 С и концентрируют досуха. Остаток обрабатывают дихлорметаном и промывают водным 10%-ным раствором фторида калия. Органическую фазу сушат и концентрируют досуха и остаток хроматографируют при использовании картуша с диоксидом кремния, элюируя смесью циклогексана и этилацетата. Фракции, содержащие ожидаемый продукт, объединяют и выпаривают досуха при пониженном давлении, получая 0,52 г 6-(1-этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 1,40 (т, J=7,0 Гц, 3 Н), 3,97 (кв, J=7,0 Гц, 2 Н), 4,46 (д, J=3,0 Гц,1 Н), 4,90 (д, J=3,0 Гц, 1 Н), 7,09 (т, J=8,0 Гц, 1 Н), 7,34 (уш.т, J=8,0 Гц, 2 Н), 7,61 (д, J=9,5 Гц, 1 Н), 7,66 (дд,J=2,0 и 9,5 Гц, 1 Н), 7,89 (уш.д, J=8,0 Гц, 2 Н), 8,57 (с, 1 Н), 8,83 (уш.с, 1 Н), 10,2 (с, 1 Н). 9.2. 6-(2-Бромацетил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 123 мг 6-(1-этоксивинил)-N-фенилимидазо[1,2-а]пиридин-2-карбоксамида в 4 мл тетрагидрофурана добавляют 1 мл воды, затем после охлаждения до температуры 0 С 71 мг Nбромсукцинимида. Реакционную смесь перемешивают в течение 2,5 ч при комнатной температуре, затем разбавляют с помощью 80 мл дихлорметана. Органическую фазу промывают водой, затем сушат и концентрируют досуха при пониженном давлении, получая 60 мг сырого 6-(2-бромацетил-Nфенилимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества белого цвета (содержащий небольшие количества 6-ацетильного производного и дибромпроизводного), используемого без другойH-ЯМР-спектр (DMSO-d6)в м.д.: 4,92 (с, 2 Н), 7,11 (т, J=7,5 Гц, 1 Н), 7,36 (т, J=7,5 Гц, 2 Н), 7,75 (д,J=9,5 Гц, 1 Н), 7,82 (дд, J=l,5 и 9,5 Гц, 1 Н), 7,90 (д, J=7,5 Гц, 2 Н), 8,61 (с, 1 Н), 9,57 (уш.с, 1 Н), 10,35 (с,1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 358 [М+Н]+, m/z 356 [М-Н]-. Промежуточный продукт 10. N-(3,5-Дифторфенил)-6-иодоимидазо[1,2-а]пиридин-2-карбоксамид. К раствору 980 мг анилина в 100 мл толуола, охлажденному до температуры 0 С, по каплям добавляют 5 мл 2 М раствора триметилалюминия в толуоле, затем при температуре 20 С 1,5 г этил-6 иодимидазо[1,2-а]пиридин-2-карбоксилата. Реакционную смесь перемешивают в течение 2 ч при температуре 20 С. Охлаждают до температуры 4 С, затем добавляют 100 мл насыщенного раствора хлорида аммония. После концентрирования при пониженном давлении остаток обрабатывают этилацетатом, органическую фазу промывают водой, сушат над сульфатом магния, фильтруют через целит, выпаривают досуха при пониженном давлении. Остаток порошкуют в диэтиловом эфире, отфильтровывают и высушивают, получая 258 мг N-(3,5-дифторфенил)-6-иодоимидазо[1,2-а]пиридин-2-карбоксамида в виде твердого вещества желтого цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 6,92 (тт, J=2,0 и 9,0 Гц, 1 Н), 7,51 (д, J=9,5 Гц, 1 Н), 7,59 (дд,J=1,5 и 9,5 Гц, 1 Н), 7,72 (м, 2 Н), 8,47 (с, 1 Н), 9,02 (уш.с, 1 Н), 10,75 (с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z 398 [М+Н]-; m/z 400 [М-Н]+. Промежуточный продукт 11. 6-(6-[(1,1-Диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 11.1. Этил-6-(6-аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. 350 мг 2-амино-6-бромпиридина, 750 мг 2-этоксикарбонилимидазо[1,2-а]пиридин-6-бороновой кислоты и 57 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия дегазируют с помощью вакуума,затем суспендируют в атмосфере аргона, в 20 мл дегазированного диоксана. После добавления 2 мл 2 н. водного раствора карбоната натрия смесь дегазируют с помощью вакуума, затем помещают в атмосферу аргона и нагревают в течение 5 ч при температуре 90 С, потом охлаждают, разбавляют и перемешивают со смесью из 50 мл насыщенного раствора гидрокарбоната натрия и 50 мл дихлорметана. Органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью этилацетата и гексана. Фракции,содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 446 мг этил-6-(6-аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата. 1(кв, J=7,1, 2H), 1,33 (т, J=7,1, 3H). Масс-спектр (APCI (химическая ионизация при атмосферном давлении: m/z=283 [M+H]+. 11.2. Этил-6-(6-[(1,1-диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2 карбоксилат и этил-6-(6-бис[(1,1-диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. К суспензии 700 мг этил-6-(6-аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата и 25 мг 4 диметиламинопиридина в 5 мл ацетонитрила добавляют 1,14 мл ди-трет-бутилдикарбоната. Смесь перемешивают в течение 16 ч при температуре 25 С, затем концентрируют. Остаток хроматографируют на силикагеле, элюируя градиентом этилацетата и гексана (от 50/50 до 100/0), получая 370 мг этил-6-(6 бис[(1,1-диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата; 1H-ЯМР-спектр (DMSO-d6)в м.д.: 9,28 (с, 1 Н), 8,50 (с, 1 Н), 8,04-8,00 (м, 2 Н), 7,95 (д, J=7,8, 1H),7,70 (д, J=9,6, 1 Н), 7,38 (д, J=7,9, 1 Н), 4,31 (кв, J=7,0, 2 Н), 1,39 (с, 9 Н), 1,33 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=383 [M+H]+. 11.3. 6-(6-[(1,1-Диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 0,9 мл 2 М водного раствора гидроксида лития добавляют к раствору 292 мг этил-6-(6-бис[(1,1 диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата в 4,73 мл смеси 50:1 тетрагидрофурана и метанола. Реакционную смесь перемешивают в течение 7 ч при температуре 25 С, затем обрабатывают, добавляя по каплям, при температуре 0 С, 2 н. соляную кислоту (HCl) вплоть до достижения значения рН 3. Выпавший спустя 20 мин осадок отфильтровывают под вакуумом и промывают водой (20 мл) и диэтиловым эфиром (20 мл), затем высушивают при пониженном давлении, получая 195 мг 6-(6-[(1,1-диметилэтокси)карбонил]аминопиридин-2-ил)имидазо[1,2-а]пиридин-2 карбоновой кислоты в виде твердого вещества бежевого цвета.(дд, J=1,5, 9,6 1 Н), 7,88 (приблизительно т, J=8,0, 7,8, 1 Н), 7,77 (д, J=8,2, 1H), 7,73 (д, J=9,6, 1 Н), 7,62 (д,J=7,5, 1 Н), 1,50 (с, 9 Н). Промежуточный продукт 12. 6-(Пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 12.1. Этил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Смесь 3,18 г карбоната цезия, 25 мл диоксана, 9,3 мл воды, 500 мг 2-иодпиридина, 89 мг [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия и 848 мг гидробромида (1:1) этил-6-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата нагревают в течение 2 ч при температуре 110 С, затем частично концентрируют и разбавляют дихлорметаном и отфильтровывают. Органическую фазу промывают водой и сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Остаток хроматографируют при использовании картуша с диоксидом кремния,элюируя смесью дихлорметана и циклогексана (80/20). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 317 мг этил-6-(пиридин-2 ил)имидазо[1,2-а]пиридин-2-карбоксилата в виде масла коричневого цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 1,34 (т, J=7,0 Гц, 3 Н), 4,33 (кв, J=7,0 Гц, 2 Н), 7,42 (ддд, J=7,5,5,5, 2,0 Гц, 1H), 7,73 (д, J=9,3 Гц, 1 Н), 7,85-8,02 (м, 2 Н), 8,07 (дд, J=9,3, 2,0 Гц, 1 Н), 8,64 (с, 1 Н), 8,70(уш.д, J=5,5 Гц, 1 Н), 9,36 (уш.с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z=268 [M+H]+. 12.2. 6-(Пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 317 мг этил-6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 280 мг 6-(пиридин-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества густорозового цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 7,47 (м, 1 Н), 7,83 (д, J=9,8 Гц, 1 Н), 7,99 (дт, J=8,5, 2,0 Гц, 1 Н),8,06 (д, J=8,5 Гц, 1 Н), 8,31 (уш.д, J=9,8 Гц, 1 Н), 8,73 (м, 2 Н), 9,52 (уш.с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z=240 [M+H]+. Промежуточный продукт 13. 6-(1-Трифенилметил-1 Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2 карбоновая кислота. 13.1. Этил-6-(1-трифенилметил-1 Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилат. 873 мг 4-Иод-1-трифенилметилимидазола, 750 мг 2-этоксикарбонилимидазо[1,2-а]пиридин-6 бороновой кислоты, 23 мг ацетата палладия и 70 мг (2-бифенил)дициклогексилфосфина дегазируют с помощью вакуума, затем суспендируют в атмосфере аргона в дегазированной смеси 15 мл толуола, 5 мл воды и 5 мл N-метилпирролидона. После добавления 950 мг фосфата калия смесь дегазируют с помощью вакуума, затем помещают в атмосферу аргона и нагревают в течение 15 мин при температуре 100 С при микроволновом облучении, после этого охлаждают, разбавляют и перемешивают со смесью из 50 мл насыщенного раствора гидрокарбоната натрия и 50 мл дихлорметана. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью этилацетата и гексана. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 508 мг этил-6-(1 трифенилметил-1 Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,97 (с, 1 Н), 8,54 (с, 1 Н), 7,76-7,72 (м, 1H), 7,56-7,52 (м, 3 Н),7,47-7,37 (м, 9 Н), 7,20-7,17 (м, 6 Н), 4,31-4,27 (м, 2 Н), 1,34-1,20 (м, 3 Н). Масс-спектр (APCI): m/z=499 [M+H]+. 13.2. 6-(1-Трифенилметил-1 Н-имидазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 500 мг Этил-6-(1-трифенилметил-1 Н-имидазол-4-ил)имидазо-[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11H-ЯМР-спектр (DMSO-d6)в м.д.: 9,01 (с, 1 Н), 8,51 (с, 1 Н), 7,83 (д, J=9,5, 1 Н), 7,59-7,56 (м, 3 Н),7,47-7,37 (м, 9 Н), 7,20-7,17 (м, 6 Н). Обменного протона не наблюдают. Масс-спектр (APCI): m/z=471 [M+H]+. Промежуточный продукт 14. 6-(2-[(1,1-Диметилэтокси)карбонил]аминотиазол-4-ил)имидазо[1,2 а]пиридин-2-карбоновая кислота. 14.1. Этил-6-(2-[(1,1-диметилэтокси)карбонил]аминотиазол-4-ил)имидазо[1,2-а]пиридин-2 карбоксилат. 465 мг трет-Бутил-4-иодтиазол-2-илкарбамата, 434 мг 2-этоксикарбонилимидазо[1,2-а]пиридин-6 бороновой кислоты и 104 мг [1,1'-бис(дифенилфосфин)ферроцен]дихлорпалладия дегазируют с помощью вакуума. После добавления 10 мл дегазированного тетрагидрофурана и 0,66 мл 2 н. водного раствора карбоната натрия реакционную смесь нагревают в течение 2 ч при температуре 100 С, затем охлаждают, разбавляют дихлорметаном и промывают водным полунасыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметан:метанол (от 99:1 до 99:2). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении. Полученное твердое вещество промывают 5 мл диэтилового эфира,получая 125 мг этил-6-(2-[(1,1-диметилэтокси)карбонил]аминотиазол-4-ил)имидазо[1,2-а]пиридин-2 карбоксилата в виде твердого вещества не совсем белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 11,65 (с, 1 Н), 8,84 (с, 1 Н), 8,47 (с, 1 Н), 7,84 (с, 1 Н), 7,68-7,71 (м,2 Н), 4,32 (кв, J=7,1, 2 Н), 1,51 (с, 9 Н), 1,33 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=389 [M+H]+. 14.2. 6-(2-[(1,1-Диметилэтокси)карбонил]аминотиазол-4-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 125 мг Этил-6-(2-[(1,1-диметилэтокси)карбонил]аминотиазол-4-ил)имидазо[1,2-а]пиридин-2 карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 90 мг 6-(2-[(1,1-диметилэтокси)карбонил]аминотиазол-4 ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества коричневого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 11,66 (с, 1 Н), 8,86 (с, 1 Н), 8,42 (с, 1 Н), 7,84 (с, 1 Н), 7,67-7,69 (м,2 Н), 1,51 (с, 9 Н). Масс-спектр (APCI): m/z=361 [M+H]+. Промежуточный продукт 15. 6-(1 Н-Пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 15.1. Этил-6-[1-(триизопропилсилил)-1 Н-пиррол-3-ил]имидазо[1,2-а]пиридин-2-карбоксилат. 100 мг Этил-6-иодимидазо[1,2-а]пиридин-2-карбоксилата, 135 мг 1-(триизопропилсилил)пиррол-3 бороновой кислоты и 18 мг тетракис(трифенилфосфин)палладия(0) дегазируют с помощью вакуума, затем суспендируют в атмосфере аргона в дегазированной смеси 1,5 мл 1,2-диметоксиэтана, 1,5 мл этанола и 316 мкл 2 н. водного раствора карбоната натрия. Реакционную смесь кипятят с обратным холодильником в течение 4 ч, затем охлаждают, разбавляют и перемешивают со смесью 5 мл водного полунасыщенного раствора гидрокарбоната натрия и 5 мл дихлорметана. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью этилацетата и гексана (50/50). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 121 мг этил-6-[1(триизопропилсилил)-1 Н-пиррол-3-ил]имидазо[1,2-а]пиридин-2-карбоксилата. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,76 (с, 1 Н), 8,42 (с, 1 Н), 7,70 (дд, J=1,9, 9,7 1 Н), 7,59 (д, J=9,7 1H), 7,37 (уш.с, 1 Н), 6,94 (м, 1 Н), 6,63 (м, 1 Н), 4,33 (кв, J=6,9, 2 Н), 1,61-1,50 (м, 3 Н), 1,33 (т, J=6,9, 3 Н),1,10-1,03 (м, 18 Н). Масс-спектр (APCI): m/z=412 [M+H]+. 15.2. Гидрохлорид (1:1) 6-(1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 292 мг Этил-6-[1-(триизопропилсилил)-1 Н-пиррол-3-ил]имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 140 мг гидрохлорида (1:1) 6-(1 Н-пиррол-3-ил)имидазо[1,2-а]пиридин-2 карбоновой кислоты в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 11,07 (уш.с, 1 Н), 8,73 (с, 1 Н), 8,39 (с, 1 Н), 7,69 (дд, J=1,3, 9,5,1 Н), 7,59 (д, J=9,5, 1 Н), 7,31 (с, 1 Н), 6,86 (с, 1 Н), 6,46 (с, 1 Н). Масс-спектр (APCI): m/z=228 [M+H]+. Промежуточный продукт 16. 6-(1 Н-Пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 16.1. Этил-6-(1 Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Этот продукт получают при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 15 (стадия 15.1), заменяя 1-(триизопропилсилил)пиррол-3-бороновую кислоту на пиразол-3-бороновую кислоту. 1H-ЯМР-спектр (MeOD-d4)в м.д.: 8,89 (т, J=1,2, 2,4, 1 Н), 8,45 (д, J=0,6, 1 Н), 7,89 (д, J=9,0, 1 Н),7,76 (уш.с, 1 Н), 7,67 (д, J=9,5, 1H), 6,77 (д, J=2,4, 1H), 4,42 (кв, J=7,l, 2H), 1,43 (т, J=7,1, 3 Н). Масс-спектр (APCI): m/z=257 [M+H]+. 16.2. 6-(1 Н-Пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 128 мг Этил-6-(1 Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях,аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 113 мг 6-(1 Н-пиразол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 13,50-12,50 (уш.с, 1 Н), 9,03 (с, 1 Н), 8,40 (с, 1 Н), 7,83-7,80 (м,2 Н), 7,63 (д, J=9,4, 1H), 6,74 (с, 1 Н). Промежуточный продукт 17. 6-(1 Н-Пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 17.1. Этил-6-(1 Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Этот продукт получают при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 15 (стадия 15.1), заменяя 1-(триизопропилсилил)пиррол-3-бороновую кислоту на пиразол-4-бороновую кислоту и нагревая при температуре 90 С при микроволновом облучении в тече- 20019122(уш.с, 1 Н), 7,69-7,61 (м, 2 Н), 4,31 (кв, J=7,1, 2H), 1,32 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=257 [M+H]+. 17.2. 6-(1 Н-Пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 128 мг Этил-6-(1 Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях,аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 60 мг 6-(1 Н-пиразол-4-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 1(с, 2 Н). Промежуточный продукт 18. 6-(Фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 18.1. Этил-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Этот продукт получают при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 15 (стадия 15.1), заменяя 1-(триизопропилсилил)пиррол-3-бороновую кислоту на фуран-2-бороновую кислоту. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,78 (с, 1 Н), 8,44 (с, 1 Н), 7,72 (дд, J=1,8, 9,6, 1 Н), 7,63-7,60 (м,2 Н), 6,89 (д, J=3,4, 1 Н), 6,57 (дд, J=1,8, 3,4, 1 Н), 4,42 (кв, J=7,1, 2H), 1,42 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=257 M+H]+. 18.2. 6-(Фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 384 мг Этил-6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 256 мг 6-(фуран-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 8,86 (с, 1 Н), 8,38 (с, 1 Н), 7,80 (дд, J=1,7, 9,5, 1 Н), 7,67-7,64 (м,2 Н), 6,90 (д, J=3,4, 1 Н), 6,60 (дд, J=1,8, 3,4, 1 Н). Промежуточный продукт 19. 6-(Фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 19.1. Этил-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Этот продукт получают при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 15 (стадия 15.1), заменяя 1-(триизопропилсилил)пиррол-3-бороновую кислоту на фуран-3-бороновую кислоту. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,86 (с, 1 Н), 8,45 (с, 1 Н), 8,28 (с, 1 Н), 7,82 (с, 1 Н), 7,66 (с, 2 Н),6,95 (с, 1 Н), 4,31 (кв, J=7,1, 2H), 1,33 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=257 [M+H]+. 19.2. 6-(Фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 384 мг Этил-6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 287 мг 6-(фуран-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,86 (с, 1 Н), 8,38 (с, 1 Н), 8,27 (с, 1 Н), 7,81 (с, 1 Н), 7,64 (с, 2 Н),6,95 (с, 1 Н). Масс-спектр (APCI): m/z=229 [M+H]+. Промежуточный продукт 20. 6-[5-(Гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоновая кислота. 20.1. Этил-6-(5-формилфуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. 2 г Этил-6-иодимидазо[1,2-а]пиридин-2-карбоксилата, 42 г 5-формилфуран-2-бороновой кислоты и 231 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия дегазируют с помощью вакуума, затем суспендируют в атмосфере аргона в дегазированной смеси 30 мл диоксана и 9,4 мл 2 н. водного раствора карбоната натрия. Реакционную смесь нагревают в течение 5 ч при температуре 90 С, затем перемешивают в течение 16 ч при температуре 20 С и концентрируют досуха. Остаток хроматографируют на диоксиде кремния, элюируя смесью этилацетата и гексана (90/10), этилацетатом, затем смесью (99/1) этилацетата и метанола. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 884 мг этил-6-(5-формилфуран-2-ил)имидазо[1,2-а]пиридин-2 карбоксилата. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 9,64 (с, 1 Н), 9,20 (с, 1 Н), 8,66 (с, 1 Н), 7,86-7,74 (м, 2 Н), 7,72 (д,J=3,8, 1H), 7,37 (д, J=3,8, 1H), 4,33 (кв, J=7,0, 2H), 1,33 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=285 [M+H]+. 20.2. Этил-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксилат. К суспензии 770 мг этил-6-(5-формилфуран-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата в 15 мл этанола добавляют 123 мг боргидрида натрия. Реакционную смесь перемешивают при температуре 25 С в течение 90 мин, затем разбавляют и перемешивают с 10 мл дихлорметана и 3 мл водного полунасыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют, сушат над сульфатом магния,фильтруют и концентрируют при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и метанола (98/2). Фракции, содержащие ожидаемый продукт, объе- 21019122 диняют и концентрируют досуха при пониженном давлении. Полученное твердое вещество порошкуют в 5 мл дихлорметана, отфильтровывают и высушивают, получая 403 мг этил-6-[5-(гидроксиметил)фуран-2 ил]имидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,89 (с, 1 Н), 8,60 (с, 1 Н), 7,70 (м, 2 Н), 6,98 (д, J=3,3, 1H), 6,45 (д,J=3,3, 1H), 5,30 (т, J=5,3, 1H), 4,47 (д, J=5,6, 2H), 4,32 (кв; J=7,1, 2H), 1,32 (т, J=7,1, 3H). Масс-спектр (APCI): m/z=287 [M+H]+. 20.3. 6-[5-(Гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоновая кислота. 400 мг Этил-6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 346 мг 6-[5-(гидроксиметил)фуран-2-ил]имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 9,06 (с, 1 Н), 8,73 (с, 1 Н), 8,03 (д, J=9,5, 1H), 7,82 (д, J=9,5, 1H),7,09 (д, J=3,3, 1 Н), 6,49 (д, J=3,2, 1 Н), 4,49 (с, 2 Н). Масс-спектр (APCI): m/z=259 [M+H]+. Промежуточный продукт 21. 6-(Тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 21.1. Этил-6-(тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Этот продукт получают при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 15 (стадия 15.1), заменяя 1-(триизопропилсилил)пиррол-3-бороновую кислоту на тиофен-3-бороновую кислоту (катализатор: дихлорбис(трифенилфосфин)палладий). 1H-ЯМР-спектр (DMSO-d6)в м.д.: 1,34 (д, J=7,1 Гц, 3 Н), 4,32 (кв, J=7,1 Гц, 2 Н), 7,56 (дд, J=5,0, 1,4 Гц, 1 Н), 7,68 (д, J=9,8 Гц, 1 Н), 7,73 (дд, J=5,0, 3,0 Гц, 1 Н), 7,78 (дд, J=9,8, 1,8 Гц, 1 Н), 7,97 (дд, J=3,0, 1,4 Гц, 1 Н), 8,48 (с, 1 Н), 8,98 (уш.с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z=273 M+H]+. 21.2. 6-(Тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 310 мг Этил-6-(тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 250 мг 6-(тиофен-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 7,57 (д, J=5,4 Гц, 1 Н), 7,66 (д, J=9,8 Гц, 1 Н), 7,73 (дд, J=5,4, 2,8 Гц, 1 Н), 7,76 (дд, J=9,8, 2,0 Гц, 1 Н), 7,97 (уш.д, J=2,0 Гц, 1 Н), 8,41 (с, 1 Н), 8,99 (уш.с, 1 Н). Масс-спектр (LC-MS-DAD-ELSD): m/z=245 [M+H]+. Промежуточный продукт 22. 6-(Оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 22.1. Этил-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксилат. 1 г Этил-6-иодимидазо[1,2-а]пиридин-2-карбоксилата, 250 мг тетракис(трифенилфосфин)палладия(0) и 360 мг хлорида лития дегазируют с помощью вакуума, затем суспендируют в атмосфере аргона в 15 мл дегазированного диоксана. После добавления 5 г 2-(три-н-бутилстаннил)оксазола реакционную смесь нагревают при температуре 90 С в течение 3,5 ч, затем охлаждают, разбавляют и перемешивают со смесью 100 мл 1 М водного раствора фторида калия и 200 мл этилацетата. Водную фазу экстрагируют с помощью 200 мл этилацетата и объединенные органические фазы промывают насыщенным солевым раствором и сушат над сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя градиентом этилацетата и гексана (от 80/20 до 100/0). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 530 мг этил-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата в виде порошка желтого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 9,30 (д, J=0,8, 1H), 8,68 (с, 1 Н), 8,30 (с, 1 Н), 7,85 (дд, J=1,7, 9,5,1 Н), 7,79 (д, J=9,5, 1H), 7,44 (д, J=0,6, 1H), 4,33 (кв, J=7,0, 2H), 1,33 (T, J=7,1, 3H). Масс-спектр (APCI): m/z=258 [M+H]+. 22.2. 6-(Оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 512 мг Этил-6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3), получая 365 мг 6-(оксазол-2-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 9,41 (с, 1 Н), 8,73 (с, 1 Н), 8,34 (с, 1 Н), 8,05 (дд, J=1,5, 9,5, 1 Н),7,86 (д, J=9,5, 1H), 7,48 (с, 1 Н). Промежуточный продукт 23. 6-(1 Н-1,2,4-Триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 23.1. Этил-6-[этокси(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилат. 470 мг Этантиолята натрия добавляют к раствору 1 г этил-6-цианоимидазо[1,2-а]пиридин-2 карбоксилата (J. Med. Chem., 41(22), 4317 (1998 в смеси 15 мл этанола и 10 мл дихлорметана, охлажденному до температуры 0 С. Реакционную смесь перемешивают в течение 5 ч при температуре 25 С,отфильтровывают и фильтрат выпаривают досуха. Остаток хроматографируют на диоксиде кремния,элюируя смесью дихлорметана и метанола (98/2), получая 625 мг этил-6-[этокси(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества бледно-желтого цвета. 1 4,33 (кв, J=7,1, 4 Н), 1,34 (т, J=7,2, 6 Н). Масс-спектр (APCI): m/z=262 [M+H]+. 23.2. Этил-6-[гидразино(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилат. К раствору 625 мг этил-6-[этокси(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилата в 12 мл этанола по каплям добавляют при температуре 0-5 С 0,2 мл гидразингидрата. Реакционную смесь перемешивают в течение 2 ч, затем добавляют 73 мкл гидразингидрата и перемешивают еще в течение 2 ч при повышении температуры до 25 С. Реакционную смесь концентрируют досуха при пониженном давлении и остаток высушивают, получая 600 мг этил-6-[гидразино(имино)метил]имидазо[1,2-а]пиридин-2 карбоксилата, который используют без другой очистки в продолжении синтеза. 1(с, 2 Н), 5,15 (уш.с, 2 Н), 4,33 (кв, J=7,1, 2H), 1,32 (т, J=7,1, 3 Н). Масс-спектр (APCI): m/z=248 [M+H]+. 23.3. Этил-6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилат. Суспензию 580 мг этил-6-[гидразино(имино)метил]имидазо[1,2-а]пиридин-2-карбоксилата в 6 мл муравьиной кислоты нагревают в течение 20 ч при температуре 85 С. Реакционную смесь концентрируют до менее 20% ее первоначального объема и разбавляют с помощью 20 мл воды. При температуре 05 С добавляют твердый карбонат натрия вплоть до достижения значения рН 8-9. Осадок отфильтровывают под вакуумом, затем очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и метанола (98/2), получая 320 мг этил-6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2 карбоксилата. 1 Н-ЯМР-спектр (DMSO-d6)в м.д.: 14,5-14,0 (уш.с, 1 Н), 9,25 (с, 1 Н), 8,69 (с, 1 Н), 8,63 (уш.с, 1 Н),7,94 (дд, J=9,5, 1,5, 1 Н), 7,73 (д, J=9,5, 1H), 4,33 (кв, J=7,0, 2H), 1,33 (т, J=7,0, 3 Н). Масс-спектр (APCI): m/z=258 [M+H]+. 23.4. 6-(1 Н-1,2,4-Триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 320 мг этил-6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3),получая 238 мг 6-(1 Н-1,2,4-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества не совсем белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 14,5-14,2 (уш.с, 1 Н), 9,26 (с, 1 Н), 8,66-8,62 (м, 2 Н), 7,91 (д,J=9,1,1H), 7,73 (д, J=9,6, 1 Н). Промежуточный продукт 24. 6-(1 Н-1,2,3-Триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 24.1. Этил-6-[(триметилсилил)этинил]имидазо[1,2-а]пиридин-2-карбоксилат. Смесь 4 г этил-6-иодимидазо[1,2-а]пиридин-2-карбоксилата, 2,63 мл этинилтриметилсилана, 888 мг дихлорбис(трифенилфосфин)палладия дегазируют с помощью вакуума. Добавляют 240 мг дегазированного N,N-диметилформамида, 3,52 мл триэтиламина. Реакционную смесь дегазируют с помощью аргона,затем перемешивают при температуре 50 С в течение 50 ч, после чего охлаждают, разбавляют с помощью 20 мл воды. Осадок отфильтровывают под вакуумом и промывают с помощью 5 мл воды, затем хроматографируют на диоксиде кремния, элюируя смесями этилацетата и гексана (от 50/50 до 90/10). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 3,6 г этил-6-[(триметилсилил)этинил]имидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества не совсем белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,61 (с, 1 Н), 8,22 (с, 1 Н), 7,36 (д, J=9,5, 1 Н), 7,07 (дд, J=9,5, 1,7,1 Н), 4,07 (кв, J=7,1, 2 Н), 1,08 (т, J=7,1, 3 Н), 0,01 (с, 9 Н). Масс-спектр (APCI): m/z=287 [М+Н]+. 24.2. Этил-6-этинилимидазо[1,2-а]пиридин-2-карбоксилат. К раствору 500 мг этил-6-[(триметилсилил)этинил]имидазо[1,2-а]пиридин-2-карбоксилата в 10 мл безводного тетрагидрофурана, охлажденному до температуры 0 С, по каплям добавляют 1,58 мл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране. Реакционную смесь перемешивают в течение 30 мин, затем добавляют 5 мл воды и экстрагируют 3 раза по 20 мл дихлорметана. Продукт очищают хроматографией на диоксиде кремния, элюируя смесями этилацетата и гексана (от 1/3 до 1/1). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 280 мг этил-6-этинилимидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества желтого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,86 (д, J=1,0, 1H), 8,50 (д, J=0,6, 1 Н), 7,63 (д, J=9,4, 1 Н), 7,37 (д,J=1,7, 9,4, 1 Н), 4,32 (м, 3 Н), 1,32 (т, J=7,1 Гц, 3 Н). Масс-спектр (APCI): m/z=215 [M+H]+. 24.3. Этил-6-(1 Н-1,2,3-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилат. К раствору 220 мг этил-6-этинилимидазо[1,2-а]пиридин-2-карбоксилата и 0,21 мл азидотриметилсилана в 4 мл смеси (9:1) N,N-диметилформамида и метанола добавляют 9,8 мг иодида меди(I). Реакционную смесь перемешивают в течение 2 ч при температуре 100 С, затем охлаждают и разбавляют с помощью 4 мл дихлорметана, после чего фильтруют через оксид алюминия и концентрируют досуха. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и этанола (97/3). Фракции,- 23019122 содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 125 мг этил-6-(1 Н-1,2,3-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата в виде твердого вещества не совсем белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 15,5-15,0 (уш.с, 1 Н), 9,14 (дд, J=l,1, 1,5, 1 Н), 8,60 (д, J=0,5, 1H),8,40 (уш.с, 1 Н), 7,82 (дд, J=1,7, 9,5, 1 Н), 7,75 (д, J=9,5, 1H), 4,33 (кв, J=7,1, 2H), 1,33 (т, J=7,1, 3 Н). Масс-спектр (APCI): m/z=258 [M+H]+. 24.4. 6-(1 Н-1,2,3-Триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновая кислота. 125 мг Этил-6-(1 Н-1,2,3-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоксилата омыляют при условиях, аналогичных таковым, описанным в случае получения промежуточного продукта 11 (стадия 11.3),получая 72 мг 6-(1 Н-1,2,3-триазол-3-ил)имидазо[1,2-а]пиридин-2-карбоновой кислоты в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 16,0-15,0 (уш.с, 1 Н), 9,23 (с, 1 Н), 8,62 (с, 1 Н), 8,46 (уш.с, 1 Н),7,96 (дд, J=1,4, 9,5, 1 Н), 7,80 (д, J=9,5, 1H). Промежуточный продукт 25. Гидробромид (1:1) этил-6-(4,4,5,5-тетраметил-1,3,2-оксаборолан-2 ил)имидазо[1,2-а]пиридин-2-карбоксилата. К раствору 4 г 2-амино-5-(4,4,5,5-тетраметил-1,3,2-оксаборолан-2-ил)пиридина в 40 мл 1,2 диметоксиэтана добавляют 4,26 г этил-3-бром-2-оксопропионата. Реакционную смесь перемешивают в течение 40 ч при температуре 20 С. Осадок отфильтровывают под вакуумом, промывают 1,2 диметоксиэтаном и пентаном, затем обрабатывают с помощью 50 мл этанола и кипятят с обратным холодильником в течение 1 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученное масло растворяют в диэтиловом эфире и раствор концентрируют при пониженном давлении. Твердое вещество отфильтровывают под вакуумом и промывают небольшим количеством диэтилового эфира, получая 3,78 г гидробромида (1:1) этил-6-(4,4,5,5-тетраметил-1,3,2-оксаборолан-2-ил)имидазо[1,2 а]пиридин-2-карбоксилата в виде твердого вещества белого цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 1,27-1,38 (м, 15 Н), 4,36 (кв, J=7,3 Гц, 2 Н), 7,59 (д, J=9,3 Гц, 1 Н),7,67 (д, J=9,3 Гц, 1 Н), 8,68 (с, 1H), 8,97 (с, 1 Н). Масс-спектр (IE): m/z=316 [M]+, 244 [M-CO2Et+H]+. Промежуточный продукт 26. 2-Этоксикарбонилимидазо[1,2-а]пиридин-6-бороновая кислота. К раствору 2,5 г 2-амино-5-(4,4,5,5-тетраметил-1,3,2-оксаборолан-2-ил)пиридина в 50 мл 1,2 диметоксиэтана добавляют 2,14 мл этил-3-бром-2-оксопропионата. Реакционную смесь перемешивают в течение 3,5 ч при температуре 25 С, затем добавляют 50 мл этанола и кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают и концентрируют досуха. Остаток суспендируют в 100 мл воды при температуре 0 С и обрабатывают при интенсивном перемешивании твердым карбонатом натрия вплоть до достижения значения рН 8-9. Осадок отфильтровывают под вакуумом и промывают с помощью 100 мл воды при температуре 0 С, затем растворяют в 150 мл метанола. Раствор сушат над сульфатом магния, отфильтровывают, концентрируют и высушивают в вакууме, получая 2,36 г 2 этоксикарбонилимидазо[1,2-а]пиридин-6-бороновой кислоты в виде твердого вещества кремового цвета. 1H-ЯМР-спектр (DMSO-d6)в м.д.: 8,82 (д, J=0,9, 1H), 8,58 (с, 1 Н), 8,35 (с, 2 Н), 7,61 (м, 2 Н), 4,33 (м,2 Н), 1,32 (м, 3 Н). Масс-спектр (APCI): m/z=235 [M+H]+. В нижеприводимых таблицах представлены химические структуры (табл. 1), спектроскопические характеристики и способы синтеза (табл. 2) некоторых примеров соединений согласно данному изобретению. В этой таблице указанное в скобках соотношение означает соотношение (кислота:основание); HCl означает соединение в форме гидрохлорида; TFA (ТФУК) означает соединение в форме трифторацетата и соотношение, указанное в скобках, означает соотношение (кислота:основание); знак - указывает, что соединение находится в форме основания; СН 3 означает метил. Таблица 1
МПК / Метки
МПК: A61K 31/437, A61P 9/00, A61P 35/00, C07D 471/04, A61P 29/00, C07F 5/04, C07F 7/08, A61P 19/10
Метки: применение, 6-гетероциклоимидазо[1,2-а]пиридин-2-карбоксамидов, терапии, получение, производные
Код ссылки
<a href="https://eas.patents.su/30-19122-proizvodnye-6-geterocikloimidazo12-apiridin-2-karboksamidov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-гетероциклоимидазо[1,2-а]пиридин-2-карбоксамидов, их получение и их применение в терапии</a>
Предыдущий патент: Защитная метка и способ изготовления таких меток
Следующий патент: Устройство и способ обработки отходов
Случайный патент: Способ производства измельченной и порошковой резины и устройство для его осуществления