Соединения пиридо[2,3-d]пиримидин-7-она в качестве ингибиторов pi3k-альфа для лечения рака
Формула / Реферат
1. Соединение формулы I
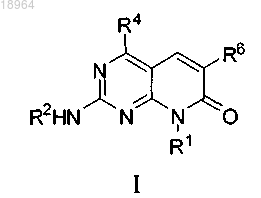
или его фармацевтически приемлемая соль, сольват или гидрат, где
R1 представляет собой 5- или 6-членный гетероциклоалкил, где гетероциклоалкил содержит один гетероатом, представляющий собой -О-;
R2 представляет собой водород;
R4 представляет собой (C1-С6)алкил;
R6 представляет собой 5- или 6-членный гетероарил, где гетероарил содержит 1-2 гетероатома, и эти гетероатомы выбраны из N, О и S, возможно замещенный одной, двумя, тремя или четырьмя группами R9;
каждая группа R9 (при наличии) независимо представляет собой (C1-С6)алкокси(С1-С6)алкил, (С1-С6)алкокси, амино, (С1-С6)алкиламино или ди(С1-С6)алкиламино.
2. Соединение по п.1, где R6 представляет собой 5-членный гетероарил, возможно замещенный одной, двумя или тремя группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
3. Соединение по п.1 или 2, где R6 - пиразолил, имидазолил, тиенил, фуранил, пирролил или тиазолил, каждый из которых возможно замещен одной, двумя или тремя группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
4. Соединение по п.1 или 2, где R6 представляет собой пиразолил, имидазолил или тиазолил, каждый из которых возможно замещен одной, двумя или тремя группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
5. Соединение по п.1 или 2, где R6 представляет собой 6-членный гетероарил, необязательно замещенный 1, 2 или 3 группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
6. Соединение по пп.1-5, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
7. Соединение по п.1, соотвествующее соединению формулы I(а)
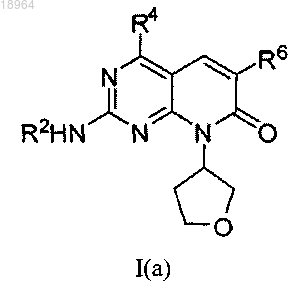
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
8. Соединение по п.7, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
9. Соединение по п.1, соотвествующее соединению формулы I(b)
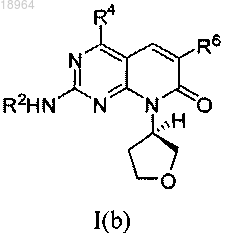
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
10. Соединение по п.9, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
11. Соединение по п.1, соотвествующее соединению формулы I(с)
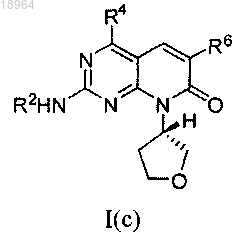
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
12. Соединение по п.11, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
13. Соединение по п.1, соотвествующее соединению формулы I(d)
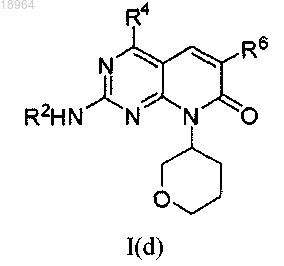
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
14. Соединение по п.13, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
15. Соединение по п.1, соотвествующее соединению формулы I(е)
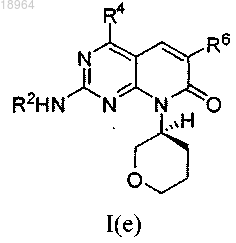
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
16. Соединение по п.15, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
17. Соединение по п.1, соотвествующее соединению формулы I(f)
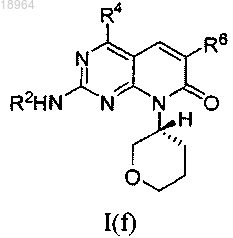
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
18. Соединение по п.17, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
19. Соединение по п.1, соотвествующее соединению формулы I(g)
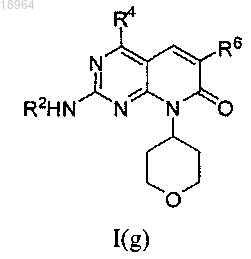
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
20. Соединение по п.19, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
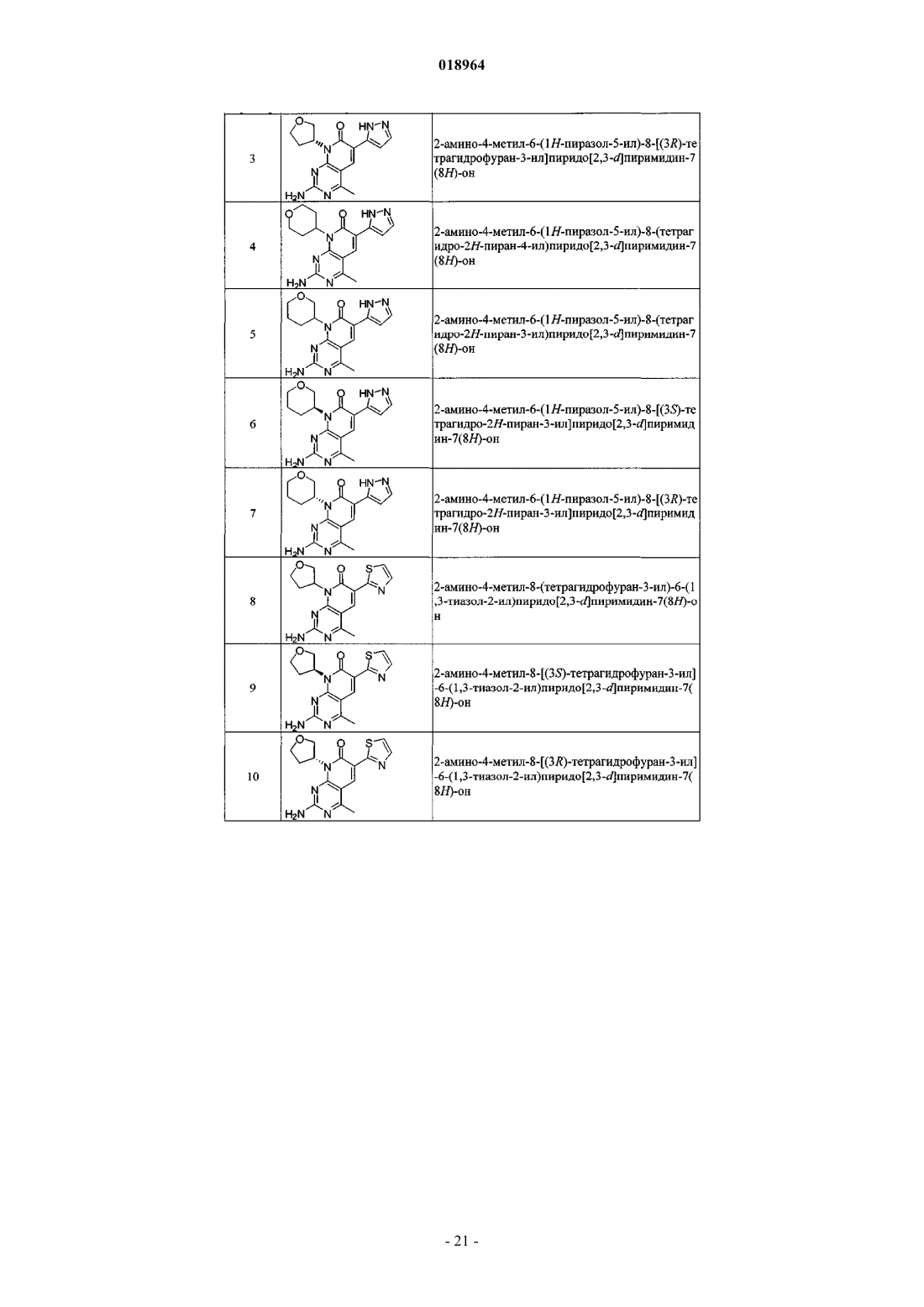
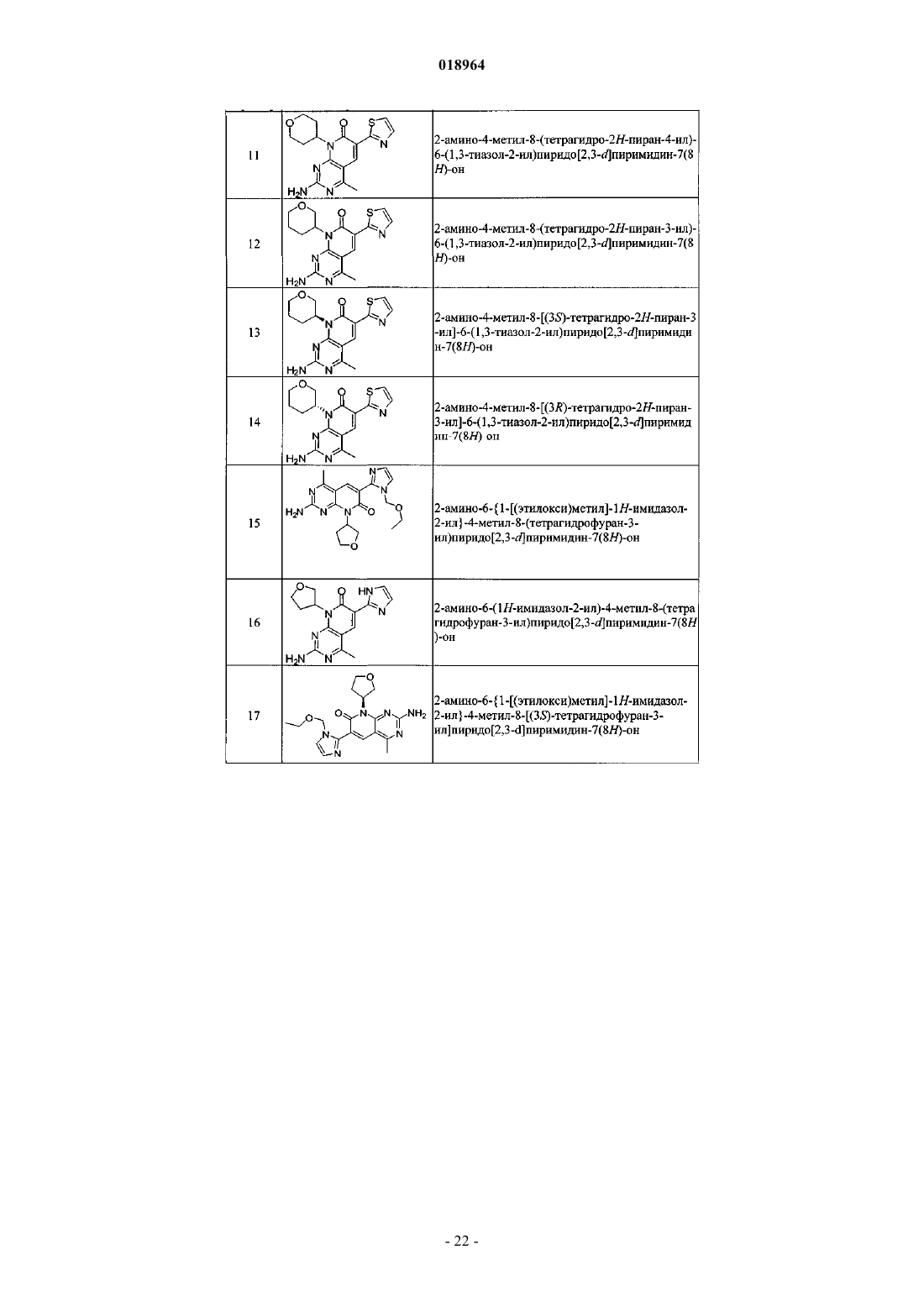
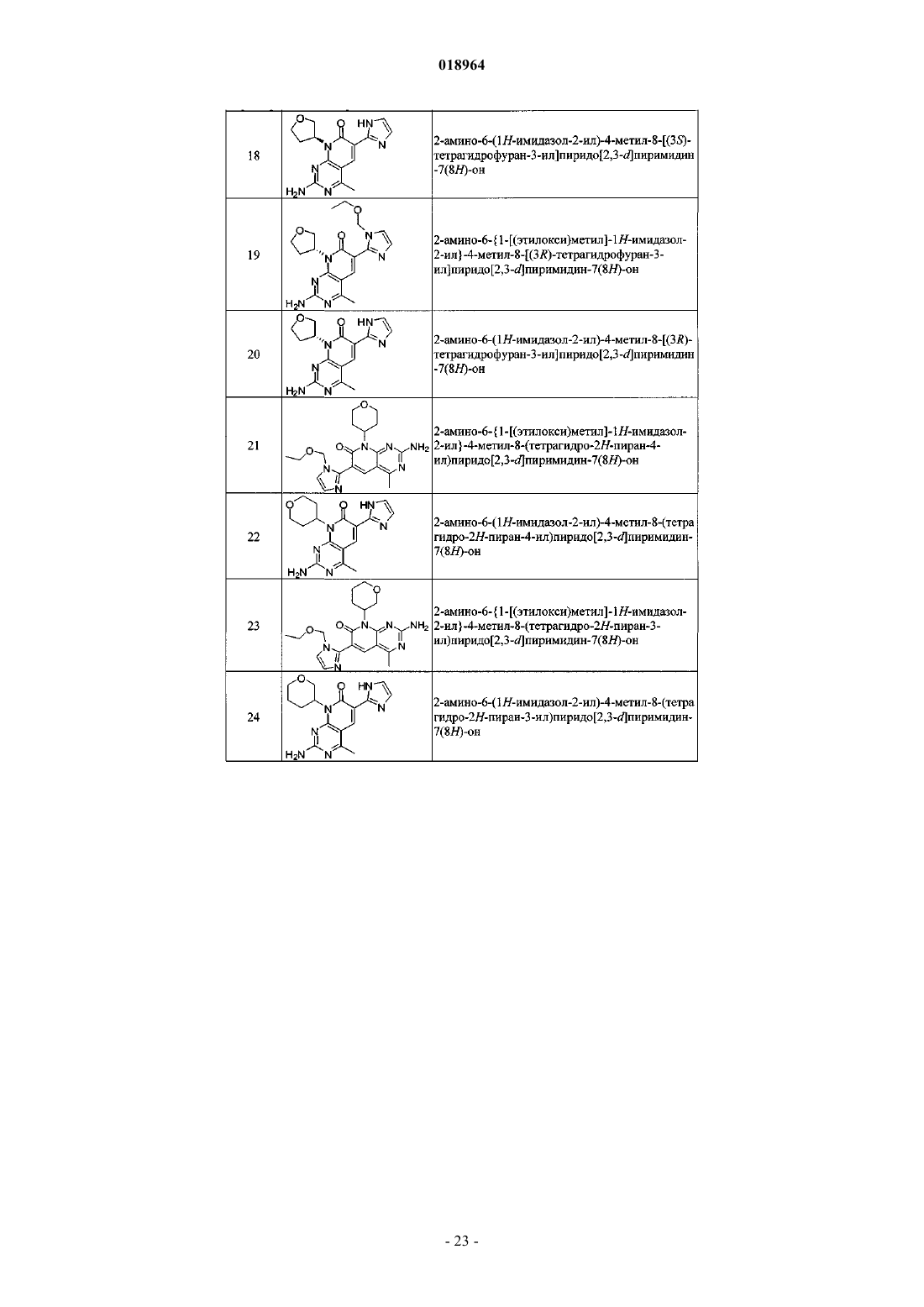
21. Соединение по п.1, выбранное из


где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
22. Соединение по п.1, выбранное из


где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
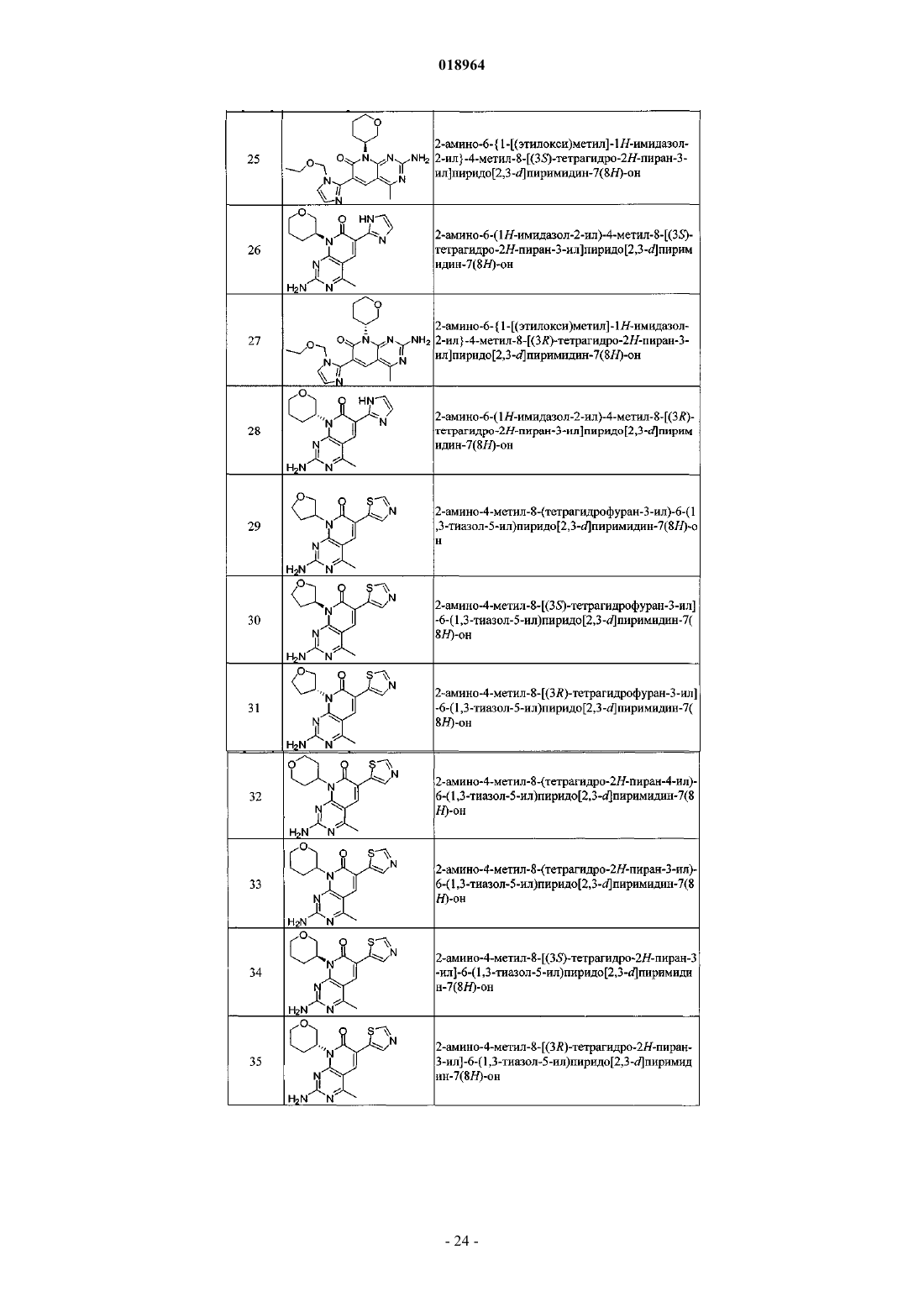
23. Соединение по п.1, выбранное из следующих соединений:
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-(тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
2-амино-6-{1-[(этилокси)метил]-1Н-имидазол-2-ил}-4-метил-8-[(3R)-тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8Н)-он;
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-[(3S)-тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
2-амино-6-{1-[(этилокси)метил]-1Н-имидазол-2-ил}-4-метил-8-(тетрагидро-2H-пиран-4-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-(тетрагидро-2H-пиран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
2-амино-6-{1-[(этилокси)метил]-1Н-имидазол-2-ил}-4-метил-8-[(3S)-тетрагидро-2H-пиран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он и
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-[(3R)-тетрагидро-2H-пиран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он,
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
24. Соединение по п.1, выбранное из следующих соединений:
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-(тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-[(3R)-тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он и
2-амино-6-{1-[(этилокси)метил]-1H-имидазол-2-ил}-4-метил-8-[(3S)-тетрагидрофуран-3-ил)пиридо[2,3-d]пиримидин-7(8H)-он;
где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
25. Фармацевтическая композиция, содержащая соединение по пп.1-24 и фармацевтически приемлемый носитель, наполнитель или растворитель; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
26. Способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения по пп.1-24, где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат.
27. Способ по п.26, где рак представляет собой рак молочной железы, рак толстой кишки, рак прямой кишки, рак эндометрия, карциному желудка, глиобластому, печеночно-клеточную карциному, мелкоклеточный рак легкого, немелкоклеточный рак легкого, меланому, рак яичников, рак шейки матки, рак поджелудочной железы, рак предстательной железы, острый миелобластный лейкоз (AML), хронический миелолейкоз (CML), неходжкинскую лимфому или карциному щитовидной железы.
28. Способ по п.26, где рак представляет собой рак яичников, рак шейки матки, рак молочной железы, рак толстой кишки, рак прямой кишки или глиобластому.
29. Способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения по пп.1-24, где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов, одного или нескольких видов гормонотерапии, одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения.
30. Способ лечения рака, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, содержащей соединение по пп.1-24.
31. Способ лечения рака, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, содержащей соединение по пп.1-24, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов, одного или нескольких видов гормонотерапии, одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения.
32. Способ получения соединения по п.1, включающий реакцию интермедиата формулы 1
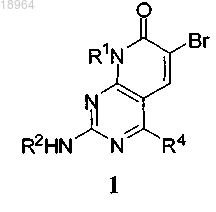
где R1, R2 и R4 являются такими, как определено по п.1,
с интермедиатом формулы
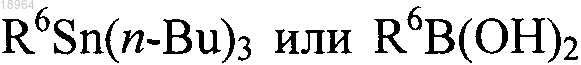
где R6 является таким, как определено по п.1,
с получением соединения по п.1.
Текст
и их фармацевтически приемлемым солям или сольватам, а также к способам получения и использования соединений. Область техники Изобретение относится к протеинкиназам и их ингибиторам. В частности, данное изобретение относится к ингибиторам сигнальных путей фосфатидилинозит-3-киназы (PI3K) и способам их применения. Уровень техники Фосфатидилинозит 3-киназа (PI3K), липидкиназа двойной специфичности, состоит из регуляторной субъединицы (85 кДа) и каталитической субъединицы (110 кДа). Белок, кодированный этим геном,представляет собой каталитическую субъединицу, которая использует АТФ для фосфорилированияPtdIns, PtdIns4P и PtdIns (4,5) Р 2. Опухолевый супрессор PTEN, ингибирующий рост клетки в результате сложных механизмов действия, может дефосфорилировать PIP3, основной продукт PIK3CA. PIP3, в свою очередь, необходим для транслокации протеинкиназы В (AKT1, PKB) в мембрану клетки, где она фосфорилируется и активируется вышележащими киназами. Влияние PTEN на гибель клетки обусловлено механизмом PIK3CA/AKT1 каскада.PI3K вовлечена в механизмы контролирования реорганизации цитоскелета, апоптоза, везикулярной миграции, процессы пролиферации и дифференцировки. Увеличенное число копий и усиленная экспрессия PIK3CA или активирующие мутации в каталитической субъединице p110a PI3KCA связаны с рядом злокачественных опухолей, таких как рак яичников (Campbell et al., Cancer Res 2004, 64, 76787681; Levine et al., Clin Cancer Res 2005, 11, 2875-2878; Wang et al., Hum Mutat 2005, 25, 322; Lee et al.,Gynecol Oncol 2005, 97, 26-34), рак шейки матки, рак молочной железы (Bachman et al. Cancer Biol Ther 2004, 3, 112-115; Levine et al., supra; Li et al., Breast Cancer Res Treat 2006, 96, 91-95; Saal et al., Cancer Res 2005, 65, 2554-2559; Samuels and Velculescu, Cell Cycle 2004, 3, 1221-1224), рак ободочной и прямой кишки (Samuels et al. Science 2004, 304, 554; Velho et al. Eur J. Cancer 2005, 41, 1649-1654), рак эндометрияal., id.), мелкоклеточный и немелкоклеточный рак легкого (Tang et al., Lung Cancer 2006, 51, 181-191;Massion et al., Am J. Respir Crit Care Med 2004, 170, 1088-1094), рак щитовидной железы (Wu et al., J. ClinEndocrinol Metab 2005, 90, 4688-4693), острый миелобластный лейкоз (AML) (Sujobert et al., Blood 1997,106, 1063-1066), хронический миелолейкоз (CML) (Hickey and Cotter J. Biol Chem 2006, 281, 2441-2450) и глиобластома (Hartmann et al. Acta Neuropathol (Berl) 2005, 109, 639-642; Samuels et al., supra). Учитывая важную роль PI3K в биологических процессах и болезненных состояниях, разработка и исследование ингибиторов этой протеинкиназы являются актуальной задачей. Сущность изобретения Нижеследующее описание обобщает определенные аспекты изобретения, но по сути не является ограничивающим. Эти и другие аспекты и варианты реализации более подробно описаны ниже. Все источники, указанные в данном изобретении, полностью включены в настоящее описание посредством ссылки. В случае выявления несоответствия между содержанием представленного описания и источниками, включенными посредством ссылки, содержание представленного описания необходимо проверить. В настоящем изобретении предложены соединения, которые ингибируют, регулируют и/или модулируют PI3K и способствуют лечению гиперпролиферативных заболеваний, таких как рак, у людей. Также в настоящем изобретении предложены способы получения соединений, способы применения этих соединений в лечении гиперпролиферативных заболеваний у людей и фармацевтические композиции,содержащие эти соединения. В соответствии с первым аспектом настоящего изобретения предложено соединение формулы I или его фармацевтически приемлемая соль, сольват или гидрат, гдеR1 представляет собой 5- или 6-членный гетероциклоалкил, где гетероциклоалкил содержит один гетероатом, представляющий собой -О-;R6 представляет собой 5- или 6-членный гетероарил, где гетероарил содержит 1-2 гетероатома, и эти гетероатомы выбраны из N, О и S, возможно замещенный одной, двумя, тремя или четырьмя группами R9; каждая группа R9 (при наличии) независимо представляет собой (C1-С 6)алкокси(С 1-С 6)алкил, (C1 С 6)алкокси, амино, (C1-С 6)алкиламино или ди(С 1-С 6)алкиламино. Согласно второму аспекту настоящее изобретение относится к фармацевтической композиции, в состав которой входит соединение формулы I, возможно в виде его фармацевтически приемлемой соли,-1 018964 сольвата и/или гидрата, и фармацевтически приемлемый носитель, наполнитель или растворитель. Согласно третьему аспекту настоящее изобретение относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества соединения формулы I, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата. Согласно четвертому аспекту настоящее изобретение относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества фармацевтической композиции,содержащей соединение формулы I. В соответствии с пятым аспектом настоящее изобретение относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества соединения формулы I, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов, одного или нескольких видов гормонотерапии, применения одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения. Согласно шестому аспекту настоящее изобретение относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества фармацевтической композиции,содержащей соединение формулы I, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов,одного или нескольких видов гормонотерапии, применения одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения. Согласно седьмому аспекту настоящее изобретение относится к способу получения соединения формулы I, включающему реакцию интермедиата формулы 1 где R1, R2 и R4 являются такими, как определено выше для соединения формулы I,с интермедиатом формулы где R6 является таким, как определено выше для соединения формулы I,с получением соединения формулы I. Подробное описание изобретения Сокращения и определения. В описании настоящего изобретения применяют следующие сокращения и термины, имеющие указанные значения. Символ "-" обозначает простую связь,обозначает двойную связь,обозначает тройную связь,обозначает простую или двойную связь. Символ обозначает группу на двойной связи, занимающую любое положение на конце двойной связи, к которой прикреплен этот символ, т.е. характер Е- или Z-геометрической изомерии относительно двойной связи неясен. Когда группу изображают несвязанной с исходной формулой, символ будет использован на конце теоретически разорванной связи, чтобы отделить эту группу от исходной структурной формулы. Когда изображают или описывают химические структуры, если не указано иное, считают, что все атомы углерода насыщены водородом и являются четырехвалентными. Например, структура, расположенная слева на нижеприведенной схеме, подразумевает наличие девяти атомов водорода. Структурное расположение этих девяти атомов водорода изображено справа на той же схеме. Иногда отдельный атом в структуре описан в текстовой формуле как содержащий атом или атомы водорода в качестве замещения (четко обозначенный водород), например -СН СН-. Любому специалисту в данной области техники известно, что вышеуказанные способы изображения часто встречаются в химии, так как придают лаконичность и простоту изображению сложных структур. то, если не указано иное, заместитель "R" может быть присоединен к любому атому циклической системы, при этом предполагают замещение изображенного, подразумеваемого или четко обозначенного водорода одного из атомов кольца, обусловливающее образование устойчивой структуры. Если группу "R" изображают "плавающей" в конденсированной циклической системе, как, например, в формуле то, если не указано иное, заместитель "R" может принадлежать любому атому конденсированной циклической системы, при этом предполагают замещение изображенного водорода (например, -NH- в вышеприведенной формуле), подразумеваемого водорода (например, в вышеуказанной формуле, где атомы водорода не показаны, но их подразумевают) или четко обозначенного водорода (например, где в вышеуказанной формуле "Z" соответствует =СН-) одного из атомов кольца, обусловливающее образование устойчивой структуры. На изображенном примере группа "R" может принадлежать как 5-членному,так и 6-членному кольцу конденсированной циклической системы. Когда в вышеуказанной формуле "у" равен, например, 2, то две группы "R" могут принадлежать любым двум атомам циклической системы,при этом также предполагают, что каждая группа замещает изображенный, подразумеваемый или четко обозначенный атом водорода в кольце. Когда группу "R" изображают находящейся в циклической системе, состоящей из насыщенных атомов углерода, как, например, в формуле где в данном примере "у" может быть больше единицы, предполагают, что каждая группа замещает непосредственно изображенный, подразумеваемый или четко обозначенный атом водорода кольца, и,если не указано иное, в том случае, когда образующаяся структура является устойчивой, две группы "R" могут принадлежать одному атому углерода. Простым примером является вариант, когда R представляет собой метильную группу; в этом случае имеет место образование геминального диметила при атоме углерода изображенного кольца ("кольцевой" атом углерода). Термин "ацил", как определено в настоящем описании, означает радикал -C(O)R, где R представляет собой возможно замещенный алкил, возможно замещенный алкенил, циклоалкил, циклоалкилалкил,арил, аралкил, гетероарил, гетероаралкил, гетероциклоалкил или гетероциклоалкилалкил, например ацетил, трифторметилкарбонил или 2-метоксиэтилкарбонил и т.п. Термин "ациламино", используемый в настоящем описании, означает радикал -NRR', где R представляет собой водород, гидрокси, алкил или алкокси, R' представляет собой ацил. Термин "ацилокси", используемый в настоящем описании, означает радикал -OR, где R представляет собой ацил, например цианометилкарбонилокси и т.п. Термин "введение" и его варианты (например,"введение" соединения) в отношении соединения согласно настоящему изобретению означает введение этого соединения или пролекарства соединения в организм животного, нуждающегося в таком лечении. Когда соединение согласно настоящему изобретению или его пролекарство предлагается вводить в сочетании с одним или несколькими другими активными агентами (например, хирургическое вмешательство,облучение, химиотерапия и т.д.), подразумевают, что термин "введение" и его варианты включает совместное и последовательное введение соединения или его пролекарства и других агентов. Термин "алкенил" означает линейный моновалентный углеводородный радикал с 2-6 атомами углерода или разветвленный моновалентный углеводородный радикал с 3-6 атомами углерода, содержащий по меньшей мере одну двойную связь, например этенил, пропенил, 1-бут-3-енил и 1-пент-3-енил и т.п. Термин "алкокси", используемый в настоящем описании, означает группу -OR, где R представляет собой алкильную группу. Примеры включают метокси, этокси, пропокси, изопропокси и т.п. Термин "алкоксиалкил", используемый в настоящем описании, означает алкильную группу, замещенную по меньшей мере одной, в частности, одной, двумя или тремя алкоксильными группами. В качестве примера можно назвать метоксиметил и т.п. Термин "алкоксикарбонил", используемый в настоящем описании, означает группу -C(O)R, где R представляет собой алкокси. Термин "алкил" означает линейный насыщенный моновалентный углеводородный радикал с 1-6 атомами углерода или разветвленный насыщенный моновалентный углеводородный радикал с 3-6 атомами углерода, например метил, этил, пропил, 2-пропил, бутил (включая все изомерные формы) или пентил (включая все изомерные формы) и т.п. Термин "алкиламино", используемый в настоящем описании, означает группу -NHR, где R представляет собой алкил. Термин "алкиламиноалкил", используемый в настоящем описании, означает алкильную группу, замещенную одной или двумя алкиламиногруппами. Термин "алкиламиноалкилокси", используемый в настоящем описании, означает группу -OR, где R представляет собой алкиламиноалкил. Термин "алкилкарбонил", используемый в настоящем описании, означает группу -C(O)R, где R представляет собой алкил. Термин "алкинил" означает линейный моновалентный углеводородный радикал с 2-6 атомами углерода или разветвленный моновалентный углеводородный радикал с 3-6 атомами углерода, содержащий по меньшей мере одну тройную связь, например этинил, пропинил, бутинил, пентин-2-ил и т.п. Термин "амино" означает -NH2. Термин "аминоалкил" означает алкильную группу, замещенную по меньшей мере одной, в частности, одной, двумя или тремя аминогруппами. Термин "аминоалкилокси", используемый в настоящем описании, означает группу -OR, где R представляет собой аминоалкил. Термин "арил" означает моновалентный 6-14-членный, моно- или бикарбоциклический цикл, где моноциклическое кольцо является ароматическим и по меньшей мере одно из колец в бициклическом цикле является ароматическим. Если не указано иное, свободная валентность группы может быть локализована на любом атоме любого кольца в соответствии с основными правилами определения валентности. Типичными примерами являются фенил, нафтил, инданил и т.п. Термин "арилалкил", используемый в настоящем описании, означает алкильный радикал, замещенный, как определено в настоящем описании, одной или двумя арильными группами, например бензил,фенэтил и т.п. Термин "арилокси", используемый в настоящем описании, означает группу -OR, где R представляет собой арил. Термин "карбоксиалкил", используемый в настоящем описании, означает алкильную группу, замещенную по меньшей мере одной, в частности, одной или двумя группами -С(О)ОН. Термин "циклоалкил" означает моноциклический или конденсированный бициклический, насыщенный или частично ненасыщенный (но не ароматический), моновалентный углеводородный радикал с 3-10 атомами углерода в цикле. Конденсированный бициклический углеводородный радикал включает мостиковые кольцевые системы. Если не указано иное, свободная валентность группы может быть локализована на любом атоме любого кольца в соответствии с основными правилами определения валентности. Один или два кольцевых углеродных атома могут быть заменены группами -С(О)-, -C(S)- или-C(=NH)-. Более конкретно, термин "циклоалкил" включает, но без ограничения, циклопропил, циклобутил, циклопентил, циклогексил или циклогекс-3-енил и т.п. Термин "циклоалкилалкил", используемый в настоящем описании, означает алкильную группу, замещенную по меньшей мере одной, в частности, одной или двумя циклоалкильными группами. Термин "диалкиламино", используемый в настоящем описании, означает радикал -NRR', где R и R' представляют собой алкил, или производное N-оксида, или его защищенное производное, например диметиламино, диэтиламино, N,N-метилпропиламино или N,N-метилэтиламино и т.п. Термин "диалкиламиноалкил", используемый в настоящем описании, означает алкильную группу,замещенную одной или двумя диалкиламиногруппами. Термин "диалкиламиноалкилокси", используемый в настоящем описании, означает группу -OR, где R представляет собой диалкиламиноалкил. Типичным примером является 2-(N,N-диэтиламино)этилокси и т.п. Термин "галоген" (или "гало") означает фтор, хлор, бром и йод. Термин "галогеналкокси", используемый в настоящем описании, означает группу -OR', где R' представляют собой галогеналкил, например трифторметокси или 2,2,2-трифторэтокси и т.п. Термин "галогеналкил" означает алкильную группу, замещенную одним или несколькими атомами галогена, в частности 1-5 атомами галогена, например трифторметил, 2-хлорэтил, 2,2-дифторэтил и т.п. Термин "гетероарил" означает моноциклический, конденсированный бициклический или конденсированный трициклический моновалентный радикал с 5-14 кольцевыми атомами, содержащий один или несколько, в частности, один, два, три или четыре кольцевых гетероатома, независимо выбранных из -О-,-S(O)n (n равно 0, 1 или 2), -N-, -N(Rx)-, а остальные кольцевые атомы представляют собой атомы углерода, в которых кольцо, содержащее моноциклический радикал, является ароматическим и по меньшей мере одно из конденсированных колец, содержащих бициклический или трициклический радикал, является ароматическим. Один или два атома углерода любых неароматических колец, содержащих бициклический или трициклический радикал, могут быть замещены группами С(О)-, -C(S)- или -C(=NH)-. Rx представляет собой водород, алкил, гидрокси, алкокси, ацил или алкилсульфонил. Конденсированный бициклический радикал включает мостиковые кольцевые системы. Если не указано иное, свободная валентность группы может быть локализована на любом атоме любого кольца гетероарильной группы в соответствии с основными правилами определения валентности. Когда свободная валентность локализована на атоме азота, Rx отсутствует. Более конкретно, термин "гетероарил" включает без ограничения 1,2,4-триазолил, 1,3,5-триазолил, фталимидил, пиридинил, пирролил, имидазолил, тиенил, фуранил, индолил, 2,3-дигидро-1H-индолил (включая, например, 2,3-дигидро-1H-индол-2-ил или 2,3-дигидро-1Hиндол-5-ил и т.п.), изоиндолил, индолинил, изоиндолинил, бензимидазолил, бензодиоксол-4-ил, бензофуранил, циннолинил, индолизинил, нафтиридин-3-ил, фталазин-3-ил, фталазин-4-ил, птеридинил, пуринил, хиназолинил, хиноксалинил, тетразоил, пиразолил, пиразинил, пиримидинил, пиридазинил, оксазолил, изооксазолил, оксадиазолил, бензоксазолил, хинолинил, изохинолинил, тетрагидроизохинолинилN-оксид или его защищенное производное. Термин "гетероарил" включает без ограничения "5- или 6 членный гетероарил"."Гетероатом" представляет собой атом О, S, N и Р. Термин "гетероциклоалкил" означает насыщенную или частично ненасыщенную (но не ароматическую) моновалентную моноциклическую группу с 3-8 кольцевыми атомами или насыщенную или частично ненасыщенную (но не ароматическую) моновалентную конденсированную бициклическую группу с 5-12 кольцевыми атомами, в которой один или несколько, в частности, один, два, три или четыре кольцевых гетероатома независимо выбраны из О, S(O)n (n равно 0, 1 или 2), N, N(Ry) (где Ry представляет собой водород, алкил, гидрокси, алкокси, ацил или алкилсульфонил), а остальные атомы кольца являются углеродными. Один или два кольцевых атома углерода могут быть замещены группами -С(О)-, -C(S)или -C(=NH)-. Конденсированный бициклический радикал включает мостиковые кольцевые системы. Если не указано иное, свободная валентность группы может быть локализована на любом атоме в соответствии с основными правилами определения валентности. Когда свободная валентность локализована на атоме азота, Ry отсутствует. Более конкретно, термин "гетероциклоалкил" включает, но без ограничения, азетидинил, пирролидинил, 2-оксопирролидинил, 2,5-дигидро-1H-пирролил, пиперидинил, 4 пиперидонил, морфолинил, пиперазинил, 2-оксопиперазинил, тетрагидропиранил, 2-оксопиперидинил,тиоморфолинил, тиаморфолинил, пергидроазепинил, пиразолидинил, имидазолинил, имидазолидинил,дигидропиридинил, тетрагидропиридинил, оксазолинил, оксазолидинил, изоксазолидинил, тиазолинил,тиазолидинил, хинуклидинил, изотиазолидинил, октагидроиндолил, октагидроизоиндолил, декагидроизохинолил, тетрагидрофурил и тетрагидропиранил и их производные, или N-оксид или его защищенное производное. Термин "гетероциклоалкил" включает, но без ограничения, "5- или 6-членный гетероциклоалкил"; однако указанный термин "5- или 6-членный гетероциклоалкил", в частности, означает 5- или 6-членное гетероциклоалкильное кольцо, которое может включать отдельные изомеры или смеси изомеров. Термин "гетероциклоалкилалкил", используемый в настоящем описании, означает алкильный радикал, замещенный, как указано в настоящем описании, одной или двумя гетероциклоалкильными группами, например морфолинилметил, N-пирролидинилэтил и 3-(N-азетидинил)пропил и т.п. Термин "возможный" или "возможно" означает, что описанный далее процесс или условие может иметь место или может отсутствовать и что данное описание включает примеры, в которых указанный процесс или условие имеет место и примеры, в которых оно отсутствует. Любой специалист в данной области техники понимает, что по отношению к любой молекуле, которую описывают как содержащую один или несколько возможных заместителей, могут быть использованы только стерически возможные соединения и/или соединения, которые могут быть получены путем синтеза. Термин "возможно замещенный алкил", как определено в настоящем описании, означает алкильный радикал, возможно замещенный одной или несколькими группами, в другом примере одной, двумя, тремя, четырьмя или пятью группами, независимо выбранными из следующих групп: алкилкарбонил, алкенилкарбонил, циклоалкилкарбонил, алкилкарбонилокси, алкенилкарбонилокси, амино, алкиламино, диалкиламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, циано, цианоалкиламинокарбонил, алкокси, алкенилокси, гидрокси, гидроксиалкокси, галогено, карбокси, алкилкарбониламино,алкилкарбонилокси, алкил-S(О)2-, алкенил-S(О)2-, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, алкилсульфонил-NRc- (где Rc представляет собой водород, алкил, возможно замещенный алкенил, гидрокси, алкокси, алкенилокси или цианоалкил), алкиламинокарбонилокси, диалкиламинокарбонилокси, алкиламиноалкилокси, диалкиламиноалкилокси, алкоксикарбонил, алкенилоксикарбонил, алкоксикарбониламино, алкиламинокарбониламино, диалкиламинокарбониламино, алкоксиалкилокси и -C(O)NRaRb (где Ra и Rb независимо представляют собой водород, алкил, возможно замещенный алкенил, гидрокси, алкокси, алкенилокси или цианоалкил). Термин "возможно замещенный алкенил", как определено в настоящем описании, означает алкенильный радикал, возможно замещенный одной или несколькими группами, в частности, одной, двумя,тремя, четырьмя или пятью группами, независимо выбранными из следующего: алкилкарбонил, алкенилкарбонил, циклоалкилкарбонил, алкилкарбонилокси, алкенилкарбонилокси, амино, алкиламино, диалкиламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, циано, цианоалкиламино-6 018964 карбонил, алкокси, алкенилокси, гидрокси, гидроксиалкокси, галогено, карбокси, алкилкарбониламино,алкилкарбонилокси, алкил-S(О)2-, алкенил-S(О)2-, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, алкилсульфонил-NRc- (где Rc представляет собой водород, алкил, возможно замещенный алкенил, гидрокси, алкокси, алкенилокси или цианоалкил), алкиламинокарбонилокси, диалкиламинокарбонилокси, алкиламиноалкилокси, диалкиламиноалкилокси, алкоксикарбонил, алкенилоксикарбонил, алкоксикарбониламино, алкиламинокарбониламино, диалкиламинокарбониламино, алкоксиалкилокси и -C(O)NRaRb (где Ra и Rb независимо представляют собой водород, алкил, возможно замещенный алкенил, гидрокси, алкокси, алкенилокси или цианоалкил). Термин "возможно замещенный 5- или 6-членный гетероциклоалкил", используемый в настоящем описании, означает гетероциклоалкильную группу, в которой кольцо содержит пять или шесть атомов,возможно замещенных одним, двумя или тремя заместителями, независимо выбранными из следующей группы: ацил, ациламино, ацилокси, возможно замещенный алкил, возможно замещенный алкенил, алкокси, алкенилокси, галогено, гидрокси, алкоксикарбонил, алкенилоксикарбонил, амино, алкиламино,диалкиламино, нитро, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, карбокси, циано,алкилтио, алкилсульфинил, алкилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, алкилсульфониламино, аминоалкокси или арил представляет собой пентафторфенил. Среди возможных заместителей "гетероциклоалкила" алкил и алкенил как отдельно, так и в составе другой группы (включая, например, алкил в алкоксикарбониле) являются независимо возможно замещенными одним, двумя, тремя, четырьмя или пятью атомами галогена. Термин "выход" для каждой представленной в настоящем описании реакции выражен в процентах от теоретического выхода. Термин "ингибитор АКТ" включает, например, LY294002, PKC 412, перифозин, соединения в табл. 2 а, соединения в табл. 2b и соединения, описанные в WO 2006/071819 и WO 05/117909. В указанных источниках также описаны методики in vitro, которые можно применять для определения ингибирующей активности AKT. Термин "алкилирующий агент" включает, например, одно или несколько следующих веществ: Хлорамбуцил (Chlorambucil), Хлорметин (Chlormethine), Циклофосфамид (Cyclophosphamide), Ифосфамид (Ifosfamide), Мелфалан (Melphalan), Кармустин (Carmustine), Стрептозоцин (Streptozocin), Фотемустин (Fotemustine), Ломустин (Lomustine), Карбоплатин (Carboplatin), Цисплатин (Cisplatin), Оксалиплатин (Oxaliplatin), BBR3464, Бусульфан (Busulfan), Дакарбазин (Dacarbazine), Мехлорэтамин (Mechlorethamine), Прокарбазин (Procarbazine), Темозоломид (Temozolomide), Тиотепа (ThioTEPA) и Урамустин (Uramustine). Термин "антитело" включает, например, одно или несколько следующих антител: антитело к IGF1R(Fludarabine), Меркаптопурин (Mercaptopurine), Тиогуанин (Thioguanine), Капецитабин (Capecitabine),Цитарабин (Cytarabine), фторурацил (fluorouracil) (введенный с/без лейковорином или фолиновой кислотой) и Гемцитабин (Gemcitabine). Термин "антитубулиновый агент" включает, например, Винкристин (Vincristine), Винбластин (Vinblastine), Винорелбин (Vinorelbine), Винфлунин (Vinflunine) и Виндезин (Vindesine). Термин "ингибитор ароматазы" включает, например, одно или несколько следующих веществ: Аминоглутетимид (Aminoglutethimide), Анастрозол (Аримидекс) (Anastrozole, Arimidex), Летрозол(Фемара) (Letrozole, Femara), Экземестан (Аромазин) (Exemestane, Aromasin) и Форместан (Лентарон) (Formestane, Lentaron). Термин "рак" относится к клеточным пролиферативным болезненным состояниям, включая, но не ограничиваясь следующими: болезненные состояния сердца: саркома (ангиосаркома, фибросаркома,рабдомиосаркома, липосаркома), миксома, рабдомиома, фиброма, липома и тератома; болезненные состояния легких: бронхогенная карцинома (плоскоклеточная, недифференцированная мелкоклеточная,недифференцированная крупноклеточная, аденокарцинома), альвеолярная (бронхиолярная) карцинома,аденома бронха, саркома, лимфома, хондроматозная гамартома, мезотелиома; болезненные состояния желудочно-кишечного тракта: пищевода (плоскоклеточная карцинома, аденокарцинома, лейомиосаркома, лимфома), желудка (карцинома, лимфома, лейомиосаркома), поджелудочной железы (протоковая аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), тонкой кишки нейрофиброма, фиброма), толстой кишки (аденокарцинома, тубулярная аденома, ворсинчатая аденома,гамартома, лейомиома); болезненные состояния мочеполового тракта: почек (аденокарцинома, опухоль Вильмса [нефробластома], лимфома, лейкоз), мочевого пузыря и уретры (плоскоклеточная карцинома,переходно-клеточная карцинома, аденокарцинома), предстательной железы (аденокарцинома, саркома),яичек (семинома, тератома, эмбриональная карцинома, тератокарцинома, хориокарцинома, саркома, интерстициально-клеточная карцинома, фиброма, фиброаденома, аденоматоидные опухоли, липома); болезненные состояния печени: гепатома (печеночно-клеточная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, печеночно-клеточная аденома, гемангиома; болезненные состояния костей: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулосаркома), множественная миелома, гигантоклеточная саркома хордома, остеохондрома (костно-хрящевые экзостозы), доброкачественная хондрома,хондробластома, хондромиксофиброма, остеоидная остеома и гигантоклеточные опухоли; болезненные состояния нервной системы: черепа (остеома, гемангиома, гранулма, ксантома, деформирующий остит),мозговых оболочек (менингиома, менингосаркома, глиоматоз), мозга (астроцитома, медуллобластома,глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома, олигодендроглиома, шваннома, ретинобластома, врожденные опухоли), спинного мозга (нейрофиброма, менингиома, глиома, саркома); гинекологические болезненные состояния: матки (карцинома эндометрия), шейки матки (карцинома шейки матки, предопухолевая дисплазия шейки матки), яичников (карцинома яичника [серозная цистаденокарцинома, муцинозная цистаденокарцинома, неклассифицированная карцинома], гранулезотекаклеточные опухоли, опухоли клеток Сертоли-Лейдига, дисгерминома, злокачественная тератома),наружных половых органов (плоскоклеточная карцинома, внутриэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (светлоклеточная карцинома, плоскоклеточная карцинома,ботриоидная саркома [эмбриональная рабдомиосаркома]), маточные трубы (карцинома); гематологические болезненные состояния: крови (миелоидная лейкемия [острая и хроническая], острый лимфобластный лейкоз, хронический лимфолейкоз, миелопролиферативные заболевания, множественная миелома,миелодиспластический синдром, болезнь Ходжкина, неходжкинская лимфома [злокачественная лимфома]); болезненные состояния кожи: злокачественная меланома, базально-клеточная карцинома, плоскоклеточная карцинома, саркома Капоши, диспластические невоидные опухоли, липома, ангиома, дерматофиброма, келоиды, псориаз; болезненные состояния надпочечников: нейробластома; и рак молочной железы. Таким образом, термин "раковая клетка", используемый в настоящем описании, включает клетку, пораженную любым одним вышеопределенным заболеванием. Термин "химиотерапевтический агент" включает, но не ограничивается следующими примерами: ингибитор АКТ, алкилирующй агент,антиметаболит, антитубулиновый агент, ингибитор ароматазы, ингибитор c-KIT, ингибитор сМЕТ, ингибитор EGFR, ингибитор ErbB2, ингибитор Flt-3, ингибитор HSP90, ингибитор IGF1R, платин (platin),ингибитор Raf, рапамицин (rapamycin), аналог Рапамицина, ингибитор рецепторной тирозинкиназы, таксан (taxane), ингибитор топоизомеразы, ингибитор SRC и/или ABL киназы и ингибитор VEGFR. Фармацевтически приемлемая соль, сольват и/или гидрат химиотерапевтического агента может быть получен специалистом в данной области техники и эта соль, сольват и/или гидраты могут быть применены для практического использования изобретения. Термин "ингибитор c-KIT" включает, например, иматиниб(imatinib), сунитиниб (sunitinib), нилотиниб (nilotinib), AMG 706, сорафениб (sorafenib), соединения,представленные табл. 3b, соединения, представленные в табл. 3 с, соединения, представленные в табл. 8,соединения, представленные в табл. 9, и соединения, описанные в документах WO 2006/108059,WO/2005/020921, WO/2006/033943 и WO 2005/030140. Термин "ингибитор сМЕТ" включает, например, соединения, представленные в табл. 3 а, соединения, представленные в табл. 3b, соединения, представленные в табл. 3 с, и соединения, описанные в документах WO 06/108059, WO 2006/014325 и WO 2005/030140. Термин "ингибитор EGFR" включает, например, одно или несколько следующих веществ: пелитиниб (pelitinib), лапатиниб (Тикерб) (lapatinib, Tykerb), гефитиниб (Иресса) (gefitinib, Iressa), эрлотиниб (Тарцева) (erlotinib, Tarceva), Зактима (Zactima) (ZD6474, вандетиниб (vandetinib, AEE788 и тиниб (canertinib), CI-1033, HKI272 и EKB-569. Термин "ингибитор Flt-3" включает, например, СЕР-701, PKC 412, MLN 518, сунитиниб (sunitinib),сорафениб (sorafenib), соединения, представленные в табл. 3 а, соединения, представленные в табл. 3b,соединения, представленные в табл. 3 с, соединения, представленные в табл. 9, и соединения, описанные в документах WO 2006/108059, WO 2006/033943, WO 2006/014325 и WO 2005/030140. Термины "гормонотерапия" и "гормональная терапия" включают, например, лечение одним или несколькими следующими веществами: стероиды (например, дексаметазон (dexamethasone, финастеридWO 2004072051 (который включен в настоящее описание посредством ссылки), в документеWO 2005028434 (который включен в настоящее описание посредством ссылки), в документеWO 2007035620 (который включен в настоящее описание посредством ссылки), в документеWO 2006091963 (который включен в настоящее описание посредством ссылки). Термин "ингибитор IGF1R" включает, например, Тирфостин (Tyrphostin) AG 1024, соединения,представленные в табл. 5 а, соединения, представленные в табл. 5b, и соединения, описанные в документеWO 06/074057. Термин "киназазависимые заболевания или состояния" означает патологические состояния, которые зависят от активности одной или нескольких липидкиназ. Киназы напрямую или опосредованно участвуют в путях сигнальной трансдукции различных механизмов жизнедеятельности клетки, включая пролиферацию, адгезию, миграцию, дифференцировку и инвазию. Заболевания, связанные с активностью киназы, включают рост опухоли, патологическую неоваскуляризацию, способствующую росту солидной опухоли, и связаны с другими заболеваниями, сопровождающимися чрезмерной локальной васкуляризацией, такими как заболевания глаз (диабетическая ретинопатия, возрастная макулярная дегенерация и т.п.) и воспалительные процессы (псориаз, ревматоидный артрит и т.п.). Не основываясь на какой-либо конкретной теории, следует отметить, что фосфатазы также могут играть роль в "киназазависимых заболеваниях или состояниях" в качестве родственных киназам соединений; т.е. киназы фосфорилируют, а фосфатазы дефосфорилируют, например, липидные субстраты. Поэтому соединения согласно настоящему изобретению кроме модуляции активности киназы, описанной в настоящем изобретении, могут также модулировать активность фосфатазы, как напрямую, так и опосредованно. Если такая дополнительная модуляция имеет место, она может вызывать (или не вызывать) синергетический эффект, связанный с активностью соединений согласно настоящему изобретению по отношению к родственной киназе или иным способом зависимой киназы или семейства киназы. В любом случае, как было установлено, соединения согласно настоящему изобретению эффективны для лечения заболеваний, которые кроме прочего характеризуются аномальными уровнями пролиферации клеток (т.е. ростом опухоли), запрограммированной гибелью клеток (апоптозом), миграцией клеток, инвазией и ангиогенезом, связанных с ростом опухоли. Термин "метаболит" относится к продуктам распада или конечным продуктам соединения или его соли, полученным в результате метаболизма или биотрансформации в организме животного или человека; например, процесс биотрансформации в более полярную молекулу (такой как окисление, восстановление или гидролиз) или в конъюгат (см. Goodman and Gilman, "The Pharmacological Basis of Therapeutics" 8.sup.th Ed., Pergamon Press, Gilman et al. (eds), 1990 для обсуждения биотрансформации). Используемый в настоящем патенте метаболит соединения согласно настоящему изобретению или его соли может представлять собой биологически активную форму соединения в организме. В одном примере пролекарство может быть использовано таким образом, чтобы биологически активная форма, метаболит,высвобождалась in vivo. В другом примере биологически активный метаболит обнаруживается с большим трудом, т.е. по сути, формирование пролекарства не происходило. Методика по определению активности метаболита соединения согласно настоящему изобретению известна специалисту в данной области техники в соответствии с данным описанием. Термин "пациент" в рамках настоящего изобретения включает людей и животных, главным образом млекопитающих, и другие организмы. Таким образом,эти методы применимы как для лечения людей, так и в ветеринарии. В предпочтительном варианте реализации пациент представляет собой млекопитающее, а в еще более предпочтительном варианте реализации пациент представляет собой человека. Термин "фармацевтически приемлемая соль соединения" означает соль, которая фармацевтически приемлема и обладает необходимой фармакологической активностью исходного соединения. Подразумевают, что фармацевтически приемлемые соли нетоксичны. Дополнительную информацию о подходящих фармацевтически приемлемых солях можно найти в источнике Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, который включен в настоящее описание посредством ссылки, или S.М. Berge et al., "Pharmaceutical Salts", J.Pharm. Sci., 1977; 66:1-19, оба включены в настоящее описание посредством ссылки. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают соли, образованные неорганическими ки-9 018964 слотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота,фосфорная кислота и т.п.; а также органическими кислотами, такими как уксусная кислота, трифторуксусная кислота, пропионовая кислота, капроновая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, 3-(4-гидроксибензоил)бензойная кислота, миндальная кислота, метансульфокислота, этансульфокислота, 1,2-этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота,4-хлорбензолсульфокислота, 2-нафталинсульфокислота, 4-толуолсульфокислота, камфорсульфокислота,глюкогептоновая кислота,4,4'-метилен-бис-(3-гидрокси-2-ен-1-карбоновая кислота),3 фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота,стеариновая кислота, муконовая кислота, п-толуолсульфокислота, салициловая кислота и т.п. Примеры фармацевтически приемлемых основно-аддитивных солей включают соли, образующиеся при замещении присутствующего в исходном соединении кислого протона на ион металла, например натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, солей алюминия и т.п. Предпочтительными солями являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают, но без ограничения,соли первичных, вторичных и третичных аминов, замещенных аминов (включая замещенные амины,встречающиеся в природе), циклических аминов и катионообменных смол. Примеры органических оснований включают изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин,2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин,прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины,пиперазин, пиперидин, N-этилпиперидин, трометамин, N-метилглюкамин, полиаминовые смолы и т.п. Типичными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин. Термины "платин" (платины) и "платинсодержащий агент (агенты)" включают, например, цисплатин (cisplatin), карбоплатин (carboplatin) и оксалиплатин (oxaliplatin). Термин "пролекарство" относится к соединениям, которые трансформируются (как правило, быстро) in vivo, например, в результате гидролиза в крови, с образованием исходного соединения вышеуказанной формулы. Общеизвестные примеры включают, но без ограничения сложноэфирные и амидные формы соединения с активной формой, содержащей остаток карбоновой кислоты. Примеры фармацевтически приемлемых сложноэфирных соединений согласно настоящему изобретению включают, но без ограничения алкилэфиры (например, содержащие приблизительно 1-6 атомов углерода), алкильная группа представляет собой линейную или разветвленную цепь. Приемлемые сложные эфиры также включают циклоалкиловые эфиры и арилалкиловые эфиры, неограничивающим примером которых является бензиловый. Примеры фармацевтически приемлемых амидов соединений согласно настоящему изобретению включают, но без ограничения первичные амиды и вторичные и третичные алкиламиды (например, содержащие приблизительно 1-6 атомами углерода). Амиды и сложные эфиры соединений согласно настоящему изобретению можно получить общеизвестными способами. Подробное обсуждение пролекарств приведено в источниках Т. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems", Vol. 14 ofthe A.C.S. Symposium Series и Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые полностью включены в настоящее описание посредством ссылки. Термин "ингибитор Raf" включает, например, сорафениб (sorafenib), RAF 265 (CHIR 265), соединения в табл. 6 и соединения, описанные в WO 2005/112932. В этих источниках также описаны методики invitro, которые могут быть использованы для определения ингибирующей активности RAF. Термин "аналог рапамицина" включает, например, CCI-779, АР 23573, RAD 001, TAFA 93 и соединения, описанные в источниках WO 2004/101583 и US 7160867, которые полностью включены в настоящее описание посредством ссылки. Термин "ингибитор рецепторной тирозинкиназы" включает, например, ингибиторы AKT, EGFR, ErbB2, IGF1R, KIT, Met, Raf и VEGFR2. Примеры ингибиторов рецепторной тирозинкиназы могут быть найдены в источниках WO 2006/108059 (US Nat'l Stage Application SerialStage Application Serial No. 10/573336), WO 2004/050681 US Nat'l Stage Application Serial No. 10/533555),WO 2005/112932 (US Nat'l Stage Application Serial No. 11/568789) и WO 2004/006846 (US Nat'l Stage Application Serial No. 10/522004), полностью включеных в настоящее описание посредством ссылки. В частности, заявки, указанные в этом абзаце, включены в качестве конкретных примеров и основных вариантов реализации (а также с целью пояснения определений, связанных с терминами, используемыми в описании вариантов реализации) в отношении соединений, обусловливающих практическое применение изобретения. В этих источниках также описаны методики in vitro, применимые для практического применения изобретения.(Гливек) (imatinib, Gleevec) и соединения, описанные в документе WO 2006/074057. Термин "таксан (таксаны)" включает, например, одно или несколько следующих веществ: Паклитаксел (Таксол) (Paclitaxel, Taxol) и Доцетаксел (Таксотер) (Docetaxel, Taxotere). Термин "терапевтически эффективное количество" обозначает количество соединения согласно настоящему изобретению, которое при введении пациенту облегчает симптом заболевания. Количество соединения согласно настоящему изобретению, которое составляет "терапевтически эффективное количество", меняется в зависимости от соединения, болезненного состояния и его тяжести, возраста пациента и т.п. Терапевтически эффективное количество может быть определено общепринятым способом специалистом в данной области техники, исходя из его знаний и с учетом настоящего описания. Термин "ингибитор топоизомеразы" включает, например, одно или несколько следующих веществ: амсакрин (amsacrine), камптотецин (camptothecin), этопозид (etoposide), этопозидфосфат (etoposide phosphate), exatecan, иринотекан (irinotecan), луртотекан (lurtotecan), тенипозид (teniposide) и топотекан (topotecan). Термин "лечение" заболевания, расстройства, или синдрома, используемый в настоящем описании,включает (i) предупреждение заболевания, расстройства или синдрома у человека, т.е. недопущение развития клинических симптомов заболевания, расстройства или синдрома у животного, которое может быть подвержено риску заболевания или предрасположено к заболеванию, расстройству или синдрому,но у которого еще не проявлены или не диагностированы симптомы заболевания, расстройства или синдрома; (ii) ингибирование заболевания, расстройства или синдрома, т.е. замедление его развития; и (iii) ослабление заболевания, расстройства или синдрома, т.е. достижение ремиссии заболевания, расстройства или синдрома. Как известно в данной области техники, может потребоваться системное регулирование лечения в зависимости от места доставки, возраста, массы тела, общего состояния здоровья, пола,диеты, продолжительности введения, взаимодействия лекарственных препаратов и тяжести состояния; которое устанавливается специалистом в данной области техники путем проведения стандартного исследования. Согласно другому варианту реализации термин "лечение" заболевания, расстройства или синдрома, используемый в настоящем описании, включает (i) ингибирование заболевания, расстройства или синдрома, т.е. замедление его развития; и (ii) ослабление заболевания, расстройства или синдрома, т.е. достижение ремиссии заболевания, расстройства или синдрома. Термин "ингибитор VEGFR" включает, например, одно или несколько следующих веществ: VEGFWO 2004/006846. В нижеследующих абзацах представлено несколько вариантов реализации соединений, которые могут быть использованы для практического применения изобретения. В каждом примере вариант реализации включает как перечисленные соединения, так и конкретные изомеры и смеси изомеров. Кроме того,в каждом примере вариант реализации включает фармацевтически приемлемые соли, гидраты и/или сольваты перечисленных соединений. Один вариант реализации изобретения относится к соединению формулы I, где R6 представляет собой 5-членный гетероарил, возможно замещенный одной, двумя или тремя группами R9; где соединение формулы I возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат, aR9 (при наличии) и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения". Другим вариантом реализации изобретения является соединение формулы I, где R6 представляет собой пиразолил, имидазолил, тиенил, фуранил, пирролил или тиазолил, каждый из которых возможно замещен одной, двумя или тремя группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I, где R6 представляет собой пиразолил, имидазолил или тиазолил, каждый из которых возможно замещен одной, двумя или тремя группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I,- 11018964 где R6 представляет собой 6-членный гетероарил, необязательно замещенный 1, 2 или 3 группами R9; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль,сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(а) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(а), или его единственный изомер, где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(b) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(b), где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(с) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(с), где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(d)- 12018964 где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(d), где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(е) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(е), где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Другим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(f) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения"; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующим вариантом реализации изобретения является соединение формулы I, соотвествующее соединению формулы I(f), где R4 представляет собой метил; где соединение возможно представляет собой его фармацевтически приемлемую соль, сольват или гидрат. Следующий вариант реализации изобретения относится к соединению формулы I(g) где R2, R4, R6 и все остальные группы являются такими, как определено для соединения формулы I в разделе "Сущность изобретения". В другом примере варианта реализации соединением формулы I(g) является соединение, где R4 представляет собой метил; а все остальные группы являются такими, как определено для соединения формулы I(g). В другом варианте реализации изобретения предложена фармацевтическая композиция, содержащая соединение формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата и фармацевтически приемлемый носитель, наполнитель или растворитель. Другой вариант реализации изобретения относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e),I(f) или I(g) или его фармацевтически приемлемой соли, сольвата и/или гидрата. Другой вариант реализации изобретения относится к способу лечения рака, который включает введение пациенту терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g). В другом примере реализации изобретения рак представляет собой рак молочной железы, рак толстой кишки, рак прямой кишки, рак эндометрия, карциному желудка, глиобластому, печеночноклеточную карциному, мелкоклеточный рак легкого, немелкоклеточный рак легкого, меланому, рак яичников, рак шейки матки, рак поджелудочной железы, рак предстательной железы, острый миелобластный лейкоз (AML), хронический миелолейкоз (CML), неходжкинскую лимфому или карциному щитовидной железы. В другом варианте реализации рак представляет собой рак яичников, рак шейки матки, рак молочной железы, рак толстой кишки, рак прямой кишки или глиобластому. В другом примере варианта реализации соединение формулы I выбирают из табл. 1. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов,одного или нескольких видов гормонотерапии, одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, содержащей соединение формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединение, выбранное из табл. 1,возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, применения одного или нескольких химиотерапевтических агентов, одного или нескольких видов гормонотерапии, одного или нескольких антител, одного или нескольких видов иммунотерапии, терапии радиоактивным йодом и облучения. Один или несколько химиотерапевтических агентов независимо выбирают из следующих веществ: рапамицин (rapamycin), аналог рапамицина, алкилирующий агент, таксан (taxane), платин(platin), ингибитор EGFR и ингибитор ErbB2. В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: рапамицин (rapamycin), темозоломид (temozolomide), паклитаксел (paclitaxel), доцетаксел (docetaxel), карбоплатин (carboplatin), цисплатин (cisplatin), оксалиплатин (oxaliplatin), гефитиниб (Иресса) (gefitinib, Iressa), эрлотиниб (Тарцева) (erlotinib, Tarceva), Зактима (ZD6474) (Zactima), HKI-272, пелитиниб (pelitinib), канертиниб (canertinib) и лапатиниб (lapatinib). В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: рапамицин (rapamycin), темозоломид (temozolomide), паклитаксел (paclitaxel), доцетаксел (docetaxel), карбоплатин (carboplatin), трастузумаб (trastuzumab), эрлотиниб(erlotinib) и лапатиниб (lapatinib). В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: рапамицин (rapamycin), паклитаксел (paclitaxel),карбоплатин (carboplatin) и эрлотиниб (erlotinib). В другом примере один или несколько химиотерапевтических агентов независимо выбирают из следующих веществ: платин (platin) и таксан (taxane). В другом варианте один или два химиотерапевтических агента независимо выбирают из следующих веществ: карбоплатин (carboplatin), цисплатин (cisplatin), оксалиплатин (oxaliplatin) и паклитаксел (paclitaxel). В другом примере один или несколько химиотерапевтических агентов являются ингибиторамиEGFR. В другом варианте реализации один или два химиотерапевтических агента являются ингибиторами EGFR. В другом варианте реализации один из химиотерапевтических агентов является ингибиторомEGFR, выбранным из следующих веществ: лапатиниб (Тикерб) (lapatinib, Tykerb), гефитиниб (Иресса) (gefitinib, Iressa), эрлотиниб (Тарцева) (erlotinib, Tarceva), Зактима (Zactima) (ZD6474),АЕЕ 778, HKI-272, EKB-569 и CI1033. В другом примере один или несколько химиотерапевтических агентов представляют собой ингибиторы ErbB2. В другом варианте реализации один из химиотерапевтических агентов представляет собой ингибитор ErbB2, выбранный из лапатиниба (lapatinib), EXB-569, HKI272, CI1033 и PKI-166. В другом примере один или несколько химиотерапевтических агентов выбирают из следующих веществ: рапамицин (rapamycin), CCI-779, AP23573, RAD 001, TAFA 93, PI103 и SF1126. В другом варианте реализации одним из химиотерапевтических агентов является рапамицин (rapamycin). Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно дополнительно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с облучением. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),- 14018964I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими антителами. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с хирургическим вмешательством. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами гормонотерапии. Другой вариант реализации изобретения представляет собой способ лечения острого миелобластного лейкоза, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель; в сочетании с одним или несколькими видами лечения, выбранными из трансплантации костного мозга или стволовых клеток периферической крови, облучения, применения одного или нескольких антител и одного или нескольких химиотерапевтических агентов. В другом варианте реализации антитело выбирают из следующих веществ: Джемтузумаб озогамицин (Милотарг) (Gemtuzumab ozogamicin, Mylotarg), IGF-1R A12 MoAb, IGF-1R 19D12 MoAb, IGF-1R h7C10 MoAb, IGF-1R CP-751871 MoAb и трастузумаб (trastuzumab). В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из следующих веществ: Иматиниб (например, Гливек) (Imatinib, Gleevec), PKC412, СЕР-701, даунорубицин (daunorubicin), доксорубицин (doxorubicin), цитарабин (ara-C) (cytarabine), антрациклиновые препараты, такие как даунорубицин (daunorubicin) или идарубицин (Дауномицин, Идамицин) (idarubicin, Daunomycin, Idamycin), 6-тиогуанин и гранулоцитарный колониестимулирующий фактор, такой как Нейпоген (Neupogen) или Лейкин (Leukine). Другой вариант реализации изобретения представляет собой способ лечения хронического миелолейкоза (CML), включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из трансплантации костного мозга или стволовых клеток периферической крови, облучения, применения одного или нескольких химиотерапевтических агентов, иммунотерапии и применения одного или нескольких антител. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из следующих веществ: Иматиниб (например, Гливек) (Imatinib, Gleevec), PKC412, гидроксиурея (Гидрея)(dasatinib), AMN107, VX680 (МК 0457) и цитарабин (ara-C) (cytarabine); в другом варианте реализации один или несколько химиотерапевтических агентов выбирают из Иматиниба (например, Гливек)(Imatinib, Gleevec) и дазатиниба (dasatinib). В другом варианте реализации иммунотерапию выбирают из терапии интерфероном, таким как интерферон-. Другой вариант реализации изобретения представляет собой способ лечения рака предстательной железы, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства (включая криохирургию), облучения, применения одного или нескольких химиотерапевтических агентов, одного или нескольких антител и одного или нескольких видов гормонотерапии. В другом варианте реализации одним или несколькими антителами являются IGF-1R А 12 MoAb, IGF-1R 19D12MoAb, IGF-1R h7C10 MoAb, IGF-1R СР-751871 MoAb. В другом варианте реализации один или два химиотерапевтических агента выбирают из следующих веществ: рапамицин (rapamycin), митоксантрон(doxorubicin), этопозид (etoposide), винбластин (vinblastine), паклитаксел (paclitaxel) и карбоплатин (carboplatin). В другом варианте реализации одним или двумя видами гормонотерапии является андрогенная депривация или супрессия андрогенов. В другом варианте реализации одним или двумя видами лечения являются таксаны (taxanes). Другой вариант реализации изобретения представляет собой способ лечения меланомы, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c),I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, одного или нескольких видов иммунотерапии, одного или нескольких видов гормонотерапии и применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из алкилирующего агента, таксана (taxane), платина (platin) и ингибитора Raf. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из следующих веществ: сорафениб (sorafenib), Паклитаксел (Таксол) (Paclitaxel,Taxol), Доцетаксел (Таксотер) (Docetaxel, Taxotere), дакарбазин (dacarbazine), рапамицин (rapamycin), иматиниба мезилат (Гливек) (imatinib mesylate, Gleevec), цисплатин (cisplatin), карбоплатин (carboplatin), дакарбазин (DTIC) (dacarbazine), кармустин (BCNU) (carmustine), винбластин (vinblastine), темозоломид (Темодар) (temozolomide, Temodar), Мелфалан (Melphalan) и имиквимод (Алдара) (imiquimod(Aldara). В другом варианте реализации один или два вида иммунотерапии выбирают из ипилимумаба(ipilimumab), интерферона-альфа (interferon-alpha) и/или интерлейкина-2 (interleukin-2). В другом варианте реализации одним или двумя видами гормонотерапии является терапия тамоксифеном (tamoxifen). Другой вариант реализации изобретения представляет собой способ лечения рака толстой или прямой кишки, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, применения одного или нескольких антител и одного или нескольких химиотерапевтических агентов. В другом варианте реализации хирургический метод выбирают из местного иссечения, электрофульгурации, резекции сегмента толстой кишки, полипэктомии, локальной трансанальной резекции, низкой передней резекции, брюшно-промежностной экстирпации прямой кишки и экзентерации органов таза. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из платиносодержащего соединения (включая цисплатин (cisplatin), оксалиплатин (oxaliplatin) и карбоплатин (carboplatin, 5-фторурацила (5-ФУ) (5-fluorouracil, 5-FU), лейковорина (leucovorin), капецитабина (Ксилода) (Capecitabine, Xeloda), иринотекана (Камптосар) (irinotecan, Camptosar), ФОЛФОКСА (фолиниевая кислота, 5-ФУ, Оксалиплатин) (FOLFOX (Folinic acid, 5-FU, Oxaliplatin и лейковорина(leucovorin). В другом варианте реализации одно или несколько антител выбирают из следующих веществ: цетуксимаб (Эрбитукс) (cetuximab, Erbitux) и бевацизумаб (Авастин) (bevacizumab, Avastin). Другой вариант реализации изобретения представляет собой способ лечения рака поджелудочной железы, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения и применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два химиотерапевтических агента выбирают из платиносодержащего соединения (включая цисплатин (cisplatin), оксалиплатин (oxaliplatin) и карбоплатин (carboplatin, 5 фторурацила (5-ФУ) (5-fluorouracil, 5-FU), гемцитабина (gemcitabine), таксана (taxane) (включая паклитаксел (paclitaxel) и доцетаксел (docetaxel, топотекана (topotecan), иринотекана (irinotecan), капецитабина (capecitabine), стрептозоцина (streptozocin), эрлотиниба (Тарцева) (erlotinib, Tarceva), цетуксимаба(cetuximab), лейковорина (leucovorin) и капецитабина (Кселода) (capecitabine, Xeloda). Другой вариант реализации изобретения представляет собой способ лечения рака молочной железы, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e),- 16018964I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения,применения одного или нескольких химиотерапевтических агентов, одного или нескольких видов гормонотерапии и одного или нескольких антител. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из следующих веществ: лапатиниб (Тикерб) (lapatinib,Tykerb), паклитаксел (Таксол) (Paclitaxel, Taxol), доцетаксел (docetaxel), капецитабин (capecitabine),Циклофосфамид (Цитоксан) (Cyclophosphamide, Cytoxan), ЦМФ (циклофосфамид, фторурацил и метотрексат) CMF (cyclophosphamide, fluoruracil and methotrexate), метотрексат (methotrexate), фторурацил(fluorouracil), доксорубицин (doxorubicin), эпирубицин (epirubicin), гемцитабин (gemcitabine), карбоплатин (Параплатин) (carboplatin, Paraplatin), цисплатин (Платинол) (cisplatin, Platinol), винорелбин (Навельбин) (Vinorelbine, Navelbine), капецитабин (Кселода) (Capecitabine, Xeloda), пегилированный липосомальный доксорубицин (Доксил) (pegylated liposomal doxorubicin Doxil), альбумин-связанный паклитаксел (Абраксан) (albumin-bound paclitaxel Abraxane), АЦ (адриамицин и циклофосфамид) (AC (adriamycin(zoledronic acid) (для лечения хрупкости костей). В другом варианте реализации один или два вида гормонотерапии выбирают из следующих веществ: тамоксифен (tamoxifen), Торемифен (Фарестон) (Toremifene, Fareston), Фульвестрант (Фазлодекс) (Fulvestrant, Faslodex), Мегестрола ацетат (Мегейс)(Megestrol acetate, Megace) и один или два ингибитора ароматазы; в другом варианте реализации один или два ингибитора ароматазы выбирают из следующих веществ: летрозол (Фемара) (Letrozole, Femara),анастрозол (Аримидекс) (anastrozole, Arimidex) и эксеместан (Аромазин) (exemestane, Aromasin). В другом варианте одно или несколько антител выбирают из IGF-1R А 12 MoAb, IGF-1R 19D12 MoAb,IGF-1R h7C10 MoAb, IGF-lR CP-751871 MoAb, бевацизумаба (Авастин) (Bevacizumab, Avastin) и трастузумаба. Другой вариант реализации изобретения представляет собой способ лечения рака молочной железы, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из одного или нескольких химиотерапевтических агентов и одного или нескольких антител. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из следующих веществ: рапамицин (rapamycin),лапатиниб (lapatinib) и эрлотиниб (erlotinib). В другом варианте реализации одним из антител является трастузумаб (trastuzumab). Другим вариантом реализации изобретения является способ лечения немелкоклеточного рака легких, включающий введение пациенту терапевтически эффективного количества соединения формулы I,I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, применения одного или нескольких антител и одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: цисплатин (cisplatin), оксалиплатин (oxaliplatin), карбоплатин(carboplatin), Зактима (ZD6474) (Zactima ZD6474), Паклитаксел (Paclitaxel), Доцетаксел (Таксотер) (Docetaxel, Taxotere), Гемцитабин (Гемзар) (Gemcitabine, Gemzar), Винорелбин (Vinorelbine), Иринотекан (Irinotecan), Этопозид (Etoposide), Винбластин (Vinblastine), Эрлотиниб (Тарцева) (Erlotinib, Tarceva), гефитиниб (Иресса) (gefitinib, Iressa) и Пеметрексед (Pemetrexed). В другом варианте реализации одним из антител является Бевацизумаб (Bevacizumab). В другом варианте реализации химиотерапевтический агент выбирают из следующих веществ: цисплатин (cisplatin), оксалиплатин (oxaliplatin), карбоплатин (carboplatin), Паклитаксел (Paclitaxel), Доцетаксел (Таксотер) (Docetaxel, Taxotere) и Эрлотиниб(Тарцева) (Erlotinib, Tarceva). Другой вариант реализации изобретения представляет собой способ лечения мелкоклеточного рака легких, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмеша- 17018964 тельства, облучения, применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два химиотерапевтических агента выбирают из следующих веществ: платин(doxorubicin), винкристин (vincristine), гемцитабин (gemcitabine), топотекан (topotecan), иринотекан (irinotecan) и метотрексат (methotrexate). Другой вариант реализации изобретения представляет собой способ лечения папиллярного или анапластического рака щитовидной железы, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(а), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I,I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения,выбранными из хирургического вмешательства, облучения, терапии радиоактивным йодом, одного или нескольких видов гормонотерапии и применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или несколько химиотерапевтических агентов выбирают из препаратов тиреоидных гормонов, Доксорубицина (Doxorubicin) и платина (platin). В другом варианте реализации одним из видов гормонотерапии является абляция радиоактивным йодом. Другой вариант реализации изобретения представляет собой способ лечения рака эндометрия,включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a),I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, одного или нескольких видов гормонотерапии и применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два вида гормонотерапии выбирают из следующих веществ: мегестрола ацетат (megestrol acetate), Тамоксифен (Tamoxifen) и прогестин(progestin), включая медроксипрогестерона ацетат (Провера) (Medroxyprogesterone acetate, Provera) и мегестрола ацетат (Мегейс) (Megestrol acetate, Megace). В другом варианте реализации один или два химиотерапевтических агента выбирают из платиносодержащего соединения (включая цисплатин (cisplatin),оксалиплатин (oxaliplatin) и карбоплатин (carboplatin); в другом примере цисплатин (cisplatin, таксана(taxane) (включая паклитаксел (paclitaxel, доксорубицина (Адриамицин) (doxorubicin, Adriamycin), циклофосфамида (cyclophosphamide), фторурацила (5-ФУ) (fluorouracil, 5-FU), метотрексата (methotrexate) и винбластина (vinblastine). Другой вариант реализации изобретения представляет собой способ лечения рака яичников, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b),I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения,выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, применения одного или нескольких антител и одного или нескольких химиотерапевтических агентов. В другом варианте реализации одно из антител выбирают из бевацизумаба (bevacizumab). В другом варианте реализации один или два химиотерапевтических агента выбирают из платиносодержащего соединения (включая цисплатин (cisplatin), оксалиплатин (oxaliplatin) и карбоплатин (carboplatin, таксана (taxane) (включая паклитаксел (paclitaxel) и доцетаксел (docetaxel, топотекана (topotecan), антрациклина (включая доксорубицин (doxorubicin) и липосомальный доксорубицин (liposomal doxorubicin, гемцитабина (gemcitabine), циклофосфамида (cyclophosphamide), винорелбина (Навелбин) (Vinorelbine, Navelbine), гексаметилмеламина (hexamethylmelamine), ифосфамида (ifosfamide), этопозида (etoposide), блеомицина (bleomycin), винбластина (vinblastine), ифосфамида (ifosfamide), винкристина (vincristine) и циклофосфамида (cyclophosphamide). В другом варианте реализации один или несколько видов лечения выбирают из одного или двух химиотерапевтических агентов, независимо выбранных из платина (platin) и таксана (taxane). Другой вариант реализации изобретения представляет собой способ лечения глиобластомы, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b),I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения,выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в соче- 18018964 тании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, применения одного или нескольких химиотерапевтических агентов, одного или нескольких противосудорожных агентов и одного или нескольких агентов для уменьшения опухоли. В другом варианте реализации лучевую терапию выбирают из внешнего облучения, внутритканевой радиотерапии и стереотаксической радиохирургии. В другом варианте реализации один или два химиотерапевтических агента выбирают из следующих веществ: кармустин (carmustine BCNU), Эрлотиниб (Тарцева) (Erlotinib,Tarceva), бевацизумаб (bevacizumab), гефитиниб (Иресса) (gefitinib, Iressa), рапамицин (rapamycin), темозоломид (temozolomide), цисплатин (cisplatin), BCNU, ломустин (lomustine), прокарбазин (procarbazine) и винкристин (vincristine). В другом варианте реализации один или два противосудорожных агента выбирают из дифенилгидантоина (Дилантин) (diphenylhydantoin, Dilantin). В другом варианте реализации один или нескольких агентов для уменьшения опухоли выбирают из дексаметазона (Декадрон) (dexamethasone, Decadron). В другом варианте реализации одним из видов лечения является один или два химиотерапевтических агента; в другом варианте реализации один или два химиотерапевтических агента независимо выбирают из эрлотиниба (erlotinib) и темозоломида (temozolomide). Другой вариант реализации изобретения представляет собой способ лечения рака шейки матки,включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a),I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения и одного или нескольких химиотерапевтических агентов. В другом варианте реализации хирургический метод выбирают из криохирургии, лазерной хирургии, петлевой электрохирургической резекции, конизации, простой гистерэктомии и радикальной гистерэктомии и тазовой лимфодиссекции. В другом варианте реализации облучение выбирают из названной внешней лучевой терапии и брахитерапии. В другом варианте реализации один или два химиотерапевтических агента выбирают из платиносодержащего соединения (такого как (cisplatin), карбоплатин (carboplatin) и оксалиплатин (oxaliplatin,паклитаксела (paclitaxel), топотекана (topotecan), ифосфамида (ifosfamide), гемцитабина (gemcitabine),винорелбина (vinorelbine) и фторурацила (fluorouracil). Другой вариант реализации изобретения представляет собой способ лечения гастроинтестинальной карциноидной опухоли, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли,сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения, иммунотерапии и применения одного или нескольких химиотерапевтических агентов. В другом варианте реализации хирургический метод выбирают из резекции и электрофульгурации. В другом варианте реализации один или два химиотерапевтических агента выбирают из следующих веществ: ципрогептадин (cyproheptadine), SOM230, октреотид (octreotide) и ланреотид (lanreotide). В другом варианте реализации иммунотерапией является терапия интерфероном. Другой вариант реализации изобретения представляет собой способ лечения гастроинтестинальной стромальной опухоли, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e),I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, облучения и одного или нескольких химиотерапевтических агентов. В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: иматиниба мезилат (Гливек) (imatinib mesylate, Gleevec), сунитиниб (Сутент) (sunitinib, Sutent) и нилотиниб (AMN107) (nilotinib). Другой вариант реализации изобретения представляет собой способ лечения печеночно-клеточной карциномы, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) илиI(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из хирургического вмешательства, радиочастотной абляции, абляции этанолом, криохирургии, эмболизации печеночной артерии, химиоэмболизации, облучения и одного или нескольких химиотерапевтических агентов. В другом варианте реализации хирургический метод выбирают из резекции и трансплантации. В другом вари- 19018964 анте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: сорафениб (sorafenib), 5-фторурацил (5-fluorouracil) и цисплатин (cisplatin). Другой вариант реализации изобретения представляет собой способ лечения неходжкинской лимфомы, включающий введение пациенту терапевтически эффективного количества соединения формулыI, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с одним или несколькими видами лечения, выбранными из облучения, применения одного или нескольких химиотерапевтических агентов, терапии интерфероном, одного или нескольких антител и трансплантации костного мозга или стволовых клеток периферической крови. В другом варианте реализации один или два химиотерапевтических агента независимо выбирают из следующих веществ: CHOP (циклофосфамид, доксорубицин, винкристин и преднизон) (cyclophosphamide, doxorubicin,vincristine and prednisone), хлорамбуцил (chlorambucil), флударабин (fludarabine) и этопозид (etoposide). В другом варианте реализации антитело выбирают из следующих веществ: ритуксимаб (rituximab), ибритумомаб тиуксетан (ibritumomab tiuxetan), тозитумомаб (tositumomab) и алемтузумаб (alemtuzumab); в другом варианте реализации антителом является ритуксимаб (rituximab). Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d),I(e), I(f) или I(g) или соединения, выбранного из табл. 1, возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель, наполнитель или растворитель в сочетании с облучением и хирургическим вмешательством. Другой вариант реализации изобретения представляет собой способ лечения рака, включающий введение пациенту терапевтически эффективного количества соединения формулы I, I(a), I(b), I(c), I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1,возможно в виде его фармацевтически приемлемой соли, сольвата и/или гидрата, или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, I(a), I(b), I(c),I(d), I(e), I(f) или I(g) или соединения, выбранного из табл. 1, и фармацевтически приемлемый носитель,наполнитель или растворитель в сочетании с облучением и применением одним или двумя химиотерапевтическими агентами. Примеры соединений Примеры соединений формулы I представлены ниже. Данные соединения приведены исключительно в качестве примеров и никоим образом не ограничивают объем изобретения. Названия соединений,представленных в настоящем изобретении, даны согласно правилам систематической номенклатуры, в соответствии с правилами Международного союза теоретической и прикладной химии (IUPAC) (International Union of Pure and Applied Chemistry), Международного союза биохимии и молекулярной биологии(CAS) (Chemical Abstracts Service). Названия образовывали с использованием версии программного обеспечения для наименований ACD/Labs 8.00, версии 8.08. Каждое из перечисленных соединений в табл. 1 может быть получено в виде конкретного изомера (при необходимости), а также в виде его фармацевтически приемлемой соли, сольвата и/или гидрата. Таблица 1 Системное введение В соответствии с одним аспектом изобретения предложены фармацевтические композиции, содержащие ингибитор PI3K согласно изобретению и фармацевтически приемлемый носитель, наполнитель или растворитель. В некоторых других конкретных вариантах реализации введение осуществляют перорально. Введение соединений согласно изобретению или их фармацевтически приемлемых солей в чистом виде или в составе подходящей фармацевтической композиции можно осуществлять посредством любого из общепринятых способов введения или с помощью агентов, используемых для подобных целей. Таким образом, введение может быть, например, пероральным, назальным, парентеральным (внутривенным, внутримышечным или подкожным), местным, трансдермальным, внутривагинальным, интравезикальным, интрацистернальным или ректальным в форме твердого, полужидкого или лиофилизированного порошка или в жидких лекарственных формах, например, таких как таблетки, суппозитории,пилюли, мягкие эластичные и твердые желатиновые капсулы, порошки, растворы, суспензии, аэрозоли или другие формы, в частности, в дозированных лекарственных формах, подходящих для простого введения точных доз. Композиции будут содержать стандартный фармацевтический носитель или наполнитель и соединение согласно изобретению в качестве конкретного или одного из возможных активных веществ и,кроме того, могут содержать носители и адъюванты и т.д. Адъюванты включают консерванты, смачивающие средства, суспендирующие средства, подсластители, отдушки, ароматизирующие добавки, эмульгаторы и диспергаторы. Предотвращение развития микроорганизмов может достигаться за счет применения различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, сорбиновой кислоты и др. При необходимости возможно включение изотонических средств, например сахаров, хлорида натрия и др. Пролонгированная абсорбция инъекционной лекарственной формы может быть обеспечена применением агентов,замедляющих абсорбцию, например моностеарата алюминия и желатина. При необходимости фармацевтическая композиция изобретения также может содержать небольшие количества вспомогательных веществ, таких как смачивающие средства или эмульгаторы, буферные агенты, антиоксиданты и других, таких как, например, лимонная кислота, сорбитанмонолаурат, триэтаноламинолеат, бутилированный гидрокситолуол и т.д. Выбор состава зависит от различных факторов, таких как способ введения лекарства (например, для перорального введения - составы в форме таблеток, пилюль или капсул) и биодоступность лекарственного соединения. В последнее время фармацевтические составы совершенствуются, особенно это касается лекарств с низкой биодоступностью; в основу был положен принцип, что биодоступность можно повысить, увеличив контактирующую поверхность, т.е. уменьшив размер частиц. Например, в патенте США 4107288 описан фармацевтический состав с размером частиц от 10 до 1,000 нм, в котором активное вещество нанесено на матрицу из поперечно сшитых макромолекул. В патенте США 5145684 описано получение фармацевтического состава, когда лекарственное вещество измельчают до наночастиц (средний размер частиц составляет 400 нм) в присутствии поверхностного модификатора, а затем диспергируют в жидкой среде с образованием фармацевтического состава, обладающего заметно более высокой биодоступностью. Композиции, предназначенные для парентерального введения, могут содержать физиологически приемлемые стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для приготовления стерильных растворов для инъекций или дисперсий. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этиловый спирт, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и др.), их подходящие смеси, растительные масла (такие как оливковое масло) и органические эфиры для инъекций, такие как этилолеат. Необходимая текучесть может быть сохранена, например, путем использования специального покрытия,такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсий и с помощию поверхностно-активных веществ. Один из конкретных способов введения представляет собой пероральное введение с подходящим ежедневным режимом приема, который можно регулировать в зависимости от степени тяжести вылечиваемого заболевания. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых лекарственных формах активное вещество смешивают по меньшей мере с одним стандартным инертным наполнителем (или носителем), таким как цитрат натрия или дикальцийфосфат, или с (а) наполнителями или сухими разбавителями, такими как, например, крахмалы,лактоза, сахароза, глюкоза, маннит и кремниевая кислота; (b) связующими веществами, такими как, например, производные целлюлозы, крахмал, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская-камедь; (с) смачивателями, такими как, например, глицерин; (d) распадающимися веществами,такими как, например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, кроскармеллоза натрия, сложные силикаты и карбонат натрия; (е) ингибиторами растворения,такими как, например, парафин; (f) ускорителями абсорбции, такими как, например, соединения четвертичного аммония; (g) увлажняющими средствами, такими как, например, цетиловый спирт и моностеарат глицерина, стеарат магния и др.; (h) адсорбентами, такими как, например, каолин и бентонит; (i) скользящими веществами, такими как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферные вещества. Твердые лекарственные формы, как описано выше, могут быть получены с покрытиями и в оболочке, такой как энтеросолюбильная оболочка и другими, хорошо известными в данной области техники. Они могут содержать успокаивающие вещества и иметь такую композицию, при которой активное соединение или соединения постепенно высвобождаются в определенной части кишечного тракта. Примерами залитых композиций, которые могут быть использованы, являются полимеры и воски. Активные вещества также могут находиться в форме микрокапсул, если необходимо, в смеси с одним или несколькими вышеупомянутыми наполнителями. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Такие лекарственные формы получают, например,растворением, диспергированием и т.д. соединения (соединений) согласно настоящему изобретению или его фармацевтически приемлемой соли и возможных фармацевтических адъювантов в носителе, таком как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этиловый спирт и др.; солюбилизирующих компонентах и эмульгаторах, таких как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3 бутиленгликоль, диметилформамид; маслах, в частности хлопковом масле, арахисовом масле, кукурузном масле, оливковом масле, касторовом и кунжутном масле, глицерине, тетрагидрофурфуриловом спирте, полиэтиленгликолях и сорбитановых эфирах жирных кислот; или смесях этих и подобных им веществ с образованием раствора или суспензии. Кроме активных соединений суспензии могут содержать суспендирующие вещества, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитан-эфиры, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, или смеси этих соединений и т.п. Композиции для ректального введения представляют собой, например, суппозитории, которые могут быть получены смешением соединений согласно настоящему изобретению, например, с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозитория, которые являются твердыми при обычных температурах, но становятся жидкими при температуре тела, а следовательно, плавятся в соответствующей полости тела, и высвобождают активный компонент. Лекарственные формы для поверхностного применения соединения согласно данному изобретению включают мази, порошки, спреи и ингаляционные препараты. Активный компонент смешивают в стерильных условиях с физиологически приемлемым носителем или любыми консервантами, буферными растворами или пропеллентами при необходимости. Офтальмологические составы (глазные мази, порошки и растворы) также входят в объем настоящего изобретения. Сжатые газы могут быть применены для диспергирования соединения данного изобретения с получением аэрозоля. Подходящими инертными газами являются азот, диоксид углерода и т.д. Как правило, в зависимости от предполагаемого способа введения, фармацевтически приемлемые композиции содержат приблизительно 1-99% (от общей массы) соединения (соединений) согласно данному изобретению или его фармацевтически приемлемой соли и от 99 до 1% (от общей массы) подходящего фармацевтического наполнителя. В одном примере композиция включает приблизительно 5-75%(от общей массы) соединения (соединений) согласно настоящему изобретению или его фармацевтически приемлемой соли с остальными веществами, которые являются подходящими фармацевтическими наполнителями. Современные способы получения таких лекарственных форм известны или очевидны специалистам в данной области техники; см., например, Remington's Pharmaceutical Sciences, 18th Ed., (MackPublishing Company, Easton, Pa., 1990). Такая композиция для введения в любом случае будет содержать терапевтически эффективное количество соединения согласно изобретению или его фармацевтически приемлемую соль для лечения болезненного состояния в соответствии с основными идеями данного изобретения. Соединения согласно настоящему изобретению или их фармацевтически приемлемые соли или сольваты вводят в терапевтически эффективном количестве, которое может варьироваться в зависимости от ряда факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия соединения, возраст, массу тела, общее состояние здоровья, пол,питание, способ и продолжительность введения, скорость выведения из организма, сочетание препаратов, тяжесть конкретного болезненного состояния и восприимчивость пациента к терапии. Соединения согласно настоящему изобретению могут быть введены пациенту в дозировке на уровне от приблизительно 0,1 до приблизительно 1,000 мг в сутки. Например, для обычного взрослого человека с массой тела около 70 кг на 1 кг тела приходится доза от приблизительно 0,01 до приблизительно 100 мг в сутки. Однако конкретная используемая доза может варьироваться. Например, доза может зависеть от ряда факторов, включая потребности пациента, тяжесть вылечиваемого состояния и фармакологическую активность используемого соединения. Любой специалист в данной области техники может определить оптимальные дозы для конкретного пациента. Если определена фиксированная доза, такая комбинация продуктов содержит соединения согласно данному изобретению в пределах вышеуказанного диапазона доз и другое фармацевтически активное вещество (вещества) в пределах принятого диапазона доз. Соединения рассматриваемого изобретения в качестве альтернативы могут быть последовательно использованы с известным фармацевтически приемлемым агентом (агентами) в случае, когда комбинированный состав не приемлем. Полезность Соединения согласно данному изобретению протестированы с помощью анализа, описанного в примере 1 биологического исследования, для определения ингибирующей активности в отношении PI3K. Соединения формулы I эффективны для лечения заболеваний, в частности рака, при которых активностьPI3K способствует его развитию и/или симптоматике, включает рак молочной железы, рак толстой кишки, рак прямой кишки, рак эндометрия, карциному желудка, глиобластому, печеночно-клеточную карциному, мелкоклеточный и немелкоклеточный рак легкого, меланому, рак яичников, рак шейки матки, рак поджелудочной железы, карциному предстательной железы, острый миелобластный лейкоз (AML), хронический миелолейкоз (CML) или карциному щитовидной железы. Подходящие анализы in vitro для определения активности PI3K и ее ингибирования с помощью соединений известны в данной области техники. Более детальное описание анализа in vitro для определение активности PI3K см. ниже в разделе"Примеры биологических исследований" (пример 1). На основании примеров, описанных в настоящем изобретении, а также примеров, известных из области техники, любой специалист может определить ингибирующую активность соединения согласно данному изобретению. Исследования для определения in vitro эффективности в лечении рака известны в данной области техники. Для более детального описания клеточных анализов см. ниже раздел "Примеры биологических исследований" (примеры 1, 3 и 4). На основании примеров, описанных в настоящем изобретении, а также примеров, известных из области техники, любой специалист в данной области техники может определить клеточную активность соединения изобретения. Подходящие для рака модели in vivo известны любому специалисту в данной области техники. Для более детального описания моделей in vivo аденокарциномы предстательной железы, глиобластомы,карциномы легкого и аденокарциномы молочной железы см. ниже примеры 5-10 биологических исследований; они могут быть использованы для определения клеточной активности соединений согласно настоящему изобретению. Общая схема синтеза Соединения согласно настоящему изобретению могут быть получены с помощью способов синтеза,приведенных ниже. Исходные материалы и реагенты, используемые для получения этих соединений,либо поставляют такие коммерческие фирмы, как Aldrich Chemical Co. (Milwaukee, Wis.) или Bachem(Torrance, Calif.), либо их получают способами, известными специалистам в данной области техники,руководствуясь такими источниками, как Fieser and Fieser's Reagents for Organic Synthesis, Vol. 1-17 (JohnChemistry (John Wiley and Sons, 4th Edition) и Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1989). Приведенные схемы только иллюстрируют некоторые способы, по которым могут быть синтезированы соединения, согласно настоящему изобретению, при этом указанные схемы могут иметь различные модификации, которые могут быть разработаны в качестве возможного варианта специалистом в данной области техники, на основании данного описания. Исходные соединения и интермедиаты реакции могут быть выделены и очищены, если это необходимо, общеизвестными способами, которые включают, но не ограничиваются такими процессами, как фильтрование, перегонка, кристаллизация, хроматография и т.п. Такие соединения характеризуют обычными параметрами, включая физические константы и спектральные данные. Если не указано иное, описанные ниже реакции проводят при атмосферном давлении и при температуре в диапазоне от приблизительно -78 до приблизительно 150 С,в частности в диапазоне от приблизительно 0 до приблизительно 125 С и более конкретно, при комнатной температуре (или температуре окружающей среды), например при около 20 С. Если не указано иное(как в случае процесса гидрирования), все реакции проводят в атмосфере азота. Пролекарства могут быть получены с помощью методик, известных специалисту в данной области техники. Эти методики обычно направлены на модификацию соответствующих функциональных групп данного соединения. Такие модифицированные функциональные группы восстанавливают в исходные функциональные группы с помощью стандартных действий in vivo. Амиды и эфиры соединений согласно настоящему изобретению могут быть получены стандартными способами. Подробное обсуждение пролекарств представлено в источниках Т. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems",Vol. 14 of the A.C.S. Symposium Series и Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые полностью включены в настоящее описание посредством ссылки. Соединения изобретения или их фармацевтически приемлемые соли могут содержать в своей структуре асимметричные атомы углерода или кватернизированные атомы азота. Соединения формулы I,которые могут быть получены нижеописанными способами, могут быть представлены в виде отдельных стереоизомеров, рацематов и в виде смесей энантиомеров и диастереомеров. Эти соединения также могут быть представлены в виде геометрических изомеров. Каждый из таких конкретных стереоизомеров,рацематов и их смесей и геометрических изомеров включен в объем данного изобретения. Некоторые соединения изобретения могут быть представлены в виде таутомеров. Например, когда присутствует кетон или альдегид, молекула может быть представлена в енольной форме; когда присутствует амид,молекула может быть представлена в форме имидокислоты, а когда присутствует енамин, молекула может быть представлена в форме имина. Каждый из таких таутомеров включен в объем изобретения. В частности, имидазол-5-ил и пиразол-5-ил также могут быть представлены в соответствующих таутомерных формах: имидазол-4-ил и пиразол-5-ил. Независимо от используемой структуры или терминологии каждый таутомер включен в объем изобретения. Настоящее изобретение также включает производные N-оксида и защищенные производные соединений формулы I. Например, когда соединения формулы I содержат окисляемый атом азота, этот атом азота может быть превращен в N-оксид при помощи способов, известных в этой области техники. В случае, когда соединения формулы I содержат такие группы, как гидроксильная, карбоксильная, тиольная,или любые группы, в состав которой входит атом (атомы) азота, эти группы могут быть защищены подходящей "защищающей группой" или "защитной группой". Полный список подходящих защитных групп можно найти в источнике T.W. Greene, Protective Groups in Organic Synthesis, John WileySons, Inc. 1991, который полностью включен в настоящее описание посредством ссылки. Защищенные производные соединений формулы I могут быть получены при помощи способов, общеизвестных в области техники. Способы получения и/или разделения и выделения отдельных стереоизомеров из рацемических смесей и нерацемических смесей стереоизомеров известны в области техники. Например, оптически активные (R)- и (S)-изомеры могут быть получены при использовании хиральных синтонов или хиральных реагентов, или разделены с применением стандартных методов. Энантиомеры (R- и S-изомеры) могут быть разделены при помощи способов, известных специалисту в данной области техники, например, используя такие процессы, как образование диастереоизомерных солей или комплексов, которые могут быть разделены, например, кристаллизацией; образование диастереоизомерных производных, которые могут быть разделены, например, кристаллизацией, селективная реакция одного энантиомера с энантиомер-специфическим реагентом (например, ферментативное окисление или восстановление) с последующим разделением модифицированных и немодифицированных энантиомеров; или газо-жидкостная или жидкостная хроматография с хиральной фазой, например, на хиральном носителе, таком как кварц (silica), со связанным хиральным лигандом или в присутствии хирального растворителя. Необходимо учесть, что когда нужный энантиомер преобразуют в другое химическое соединение одним из вышеописанных способов, может потребоваться дополнительная стадия для того, чтобы выделить нужную энантиомерную форму. В качестве альтернативы конкретный энантиомер может быть получен с помощью асимметрического синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного энантиомера в другой с помощью асимметрической трансформации. Для смеси энантиомеров, в которой содержится большое количество определенного изомера, основной энантиомер может быть дополнительно обогащен (с сопутствующей потерей в выходе) посредством перекристаллизации. Кроме того, соединения согласно настоящему изобретению могут быть представлены как в несольватированной, так и в сольватированной форме с фармацевтически приемлемыми растворителями, такими как вода, этиловый спирт и т.п. В целом, сольватированные формы считают эквивалентными несольватированным формам в рамках настоящего изобретения. Химизм получения соединений изобретения известен специалисту в этой области техники. В действительности, для получения соединений согласно изобретению может существовать не один способ. В качестве конкретных примеров см. М. Barvian et al. J. Med. Chem. 2000, 43, 4606-4616; S.N. VanderWei et al. J. Med. Chem. 2005, 48, 2371-2387; P.L. Toogood et al. J. Med. Chem. 2005, 48, 2388-2406; J. Kasparec et al. TetrahedronLetters 2003, 44, 4567-4570; и указанные в этих материалах источники. См. также патентную заявку США 2004/0009993 A1 (M. Angiolini et al.), которая полностью включена в настоящее описание посредством ссылки, и указанные в ней источники. Нижеследующие примеры иллюстрируют, но не ограничивают изобретение. Все указанные в настоящем описании источники полностью включены посредством ссылки. Соединение формулы II, где R1 представляет собой 5- или 6-членный гетероциклоалкил, содержащий один гетероатом, которым является (-О-), R2 представляет собой водород, R4 представляет собой метил или этил, a R6 представляет собой 5- или 6-членный гетероарил, возможно замещенный одной,двумя, тремя, четырьмя или пятью группами R9 (как определено для соединения формулы I в разделе"Сущность изобретения"), может быть получено согласно схеме 1. Интермедиат формулы 14 получают по реакции коммерчески доступного интермедиата формулы 13 с коммерчески доступным первичным амином R1NH2 (также как и со свободным амином или его солью, такой как соль HCl) в растворителях, таких как вода и смесь вода/этиловый спирт, в присутствии основания, такого как TEA, и при нагревании указанной реакции. Затем на интермедиат 14 воздействуют монохлоридом йода или монобромидом йода в растворителе, таком как метанол, при температуре около 0 С и выдерживают реакцию при комнатной температуре приблизительно в течение ночи или меньше, в зависимости от количества времени, которое необходимо, чтобы реакция завершилась с образованием соединения 15. После завершения реакции остаток может быть растерт с ацетоном. В качестве альтернативы, после завершения реакционная смесь может быть слита с 0.2 н. тиосульфатом натрия для связывания избыточного йода. Затем интермедиат 15 реагирует в растворителе, таком как DMA или DMF, с этилакрилатом в присутствии основания, такого как триэтиламин, и в присутствии катализатора, такого какPd(OAc)2 в присутствии (+)BINAP, или такого катализатора, как (Pd(PPh34. Реакционную смесь нагревают приблизительно до 95-100 С и оставляют примерно на ночь или меньше, в зависимости от количества времени, которое необходимо, чтобы реакция завершилась с образованием соединения 16. Затем соединение 16 возможно очищают с помощью колоночной хроматографии. Соединение 17 получают по реакции соединения 16 с DBU возможно в присутствии основания, такого как DIEA, при температуре,близкой к комнатной. Затем реакционную смесь нагревают в колбе с обратным холодильником или до приблизительно 170 С и оставляют до завершения реакции примерно на 5-15 ч. После выпаривания растворителя остаток растирают с ацетоном и концентрируют фильтрованием с получением соединения 17. В качестве альтернативы реакционную смесь оставляют охлаждаться до комнатной температуры, а затем очищают непосредственно с помощью колоночной хроматографии. Соединение 18 получают по реакции соединения 17 с бромирующим реагентом, таким как Br2 в растворителе, таком как DCM, при комнатной температуре. Затем реакционную смесь перемешивают в течение приблизительно от 4 ч до ночи. Образующийся продукт фильтруют, а затем суспендируют в растворителе, таком как DCM, и проводят реакцию с основанием, таким как триэтиламин. Органические слои промывают водой и высушивают над осушителем, таким как Na2SO4, с получением соединения 18. В качестве альтернативы, после завершения, реакционную смесь частично концентрируют и добавляют ацетон с последующим концентрированием и осаждением в растворителе, таком как этилацетат, который затем может быть отделен путем фильтрования с получением соединения 18. Реакция сочетания Сузуки может быть проведена для соединения 18 с использованием бороновой кислоты (или сложного эфира) формулы R6B(OH)2 в растворителе, таком как смесь DME-Н 2 О или смесь диоксан-Н 2 О, в присутствии катализатора, такого как Pd(dpppf)2, и в присутствии основания, такого как триэтиламин. Реакционную смесь нагревают в колбе с обратным холодильником или приблизительно до 95-100 С в течение около 4 ч. После охлаждения до комнатной температуры реакционную смесь разделяют водой и этилацетатом. После разделения органический слой высушивают над осушителем, таким как Na2SO4, с получением соединения формулы II. В качестве альтернативы, реакция сочетания Стилла может быть проведена для соединения 18 (или как свободное основание или как соль, такая как соль HBr) с использованием оловосодержащего реагента формулы R6Sn(n-Bu)3, в растворителе, таком как толуол, в присутствии катализатора, такого какPd(PPh3)4, и возможно в присутствии основания, такого как триэтиламин, основания Хюнига. Реакционную смесь нагревают приблизительно до 80-110 С в течение 4 ч. После охлаждения до комнатной температуры реакционная смесь может быть очищена с помощью колоночной хроматографии с получением соединения формулы II. В качестве альтернативы, после охлаждения до комнатной температуры добавляют 40% KF на оксиде алюминия. Затем смесь фильтруют через целит для удаления оксида алюминия, а затем целит промывают растворителем, таким как этилацетат. Образующийся фильтрат затем может быть промыт 1 M водным KF и раствором соли. Органические слои высушивают над осушителем, таким как MgSO4, фильтруют и концентрируют в вакууме. Затем остаток может быть растерт с хлористым метиленом и гексаном с получением соединения формулы II.
МПК / Метки
МПК: A61P 35/00, C07D 471/04, A61K 31/519
Метки: pi3k-альфа, рака, ингибиторов, качестве, пиридо[2,3-d]пиримидин-7-она, соединения, лечения
Код ссылки
<a href="https://eas.patents.su/30-18964-soedineniya-pirido23-dpirimidin-7-ona-v-kachestve-ingibitorov-pi3k-alfa-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пиридо[2,3-d]пиримидин-7-она в качестве ингибиторов pi3k-альфа для лечения рака</a>
Предыдущий патент: Комбинации агентов для биологической борьбы и нематоцидов, входящих в покрытие семян
Следующий патент: Профильная система для раздвижной двери
Случайный патент: Устройство для манипулирования банкнотами