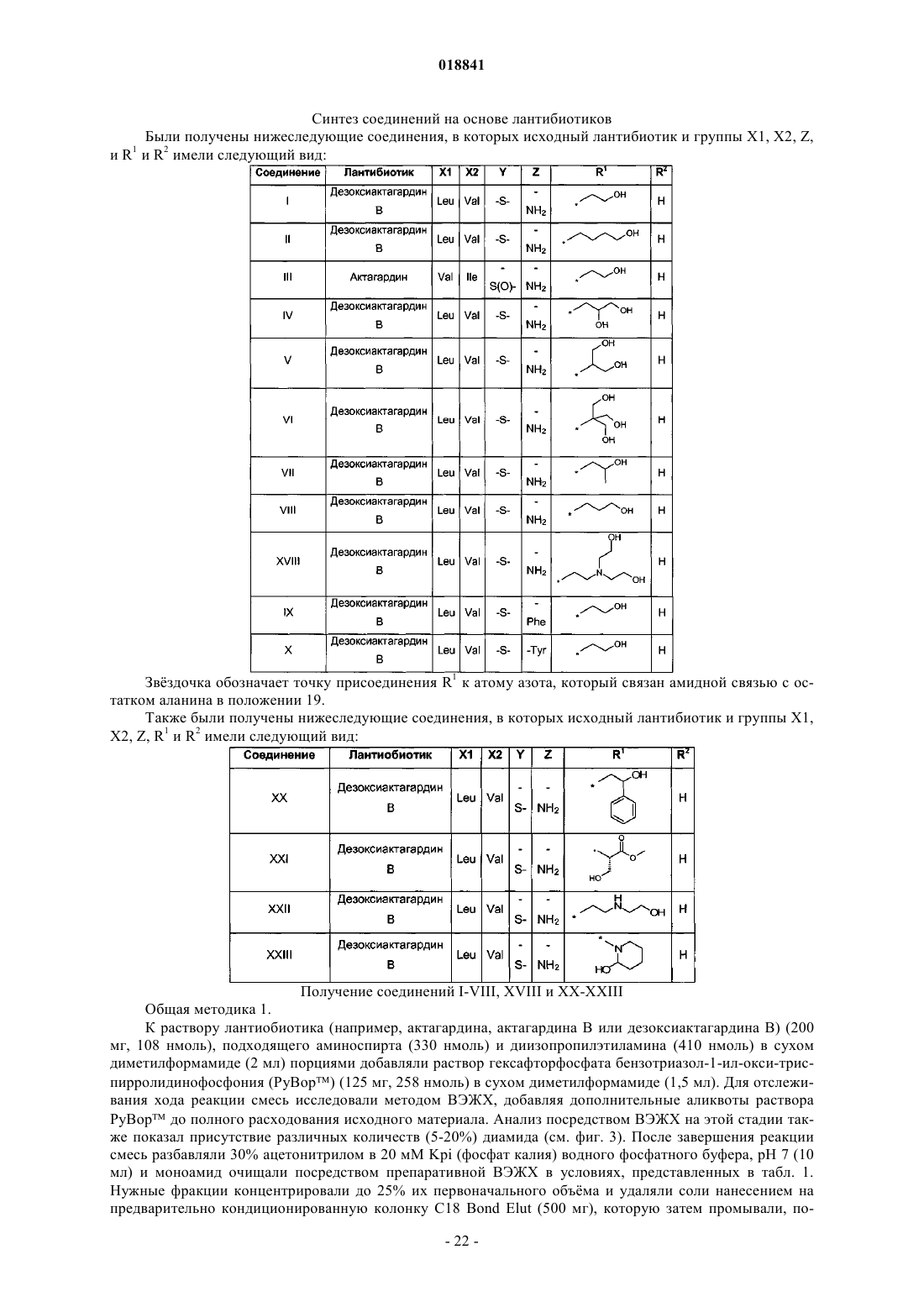
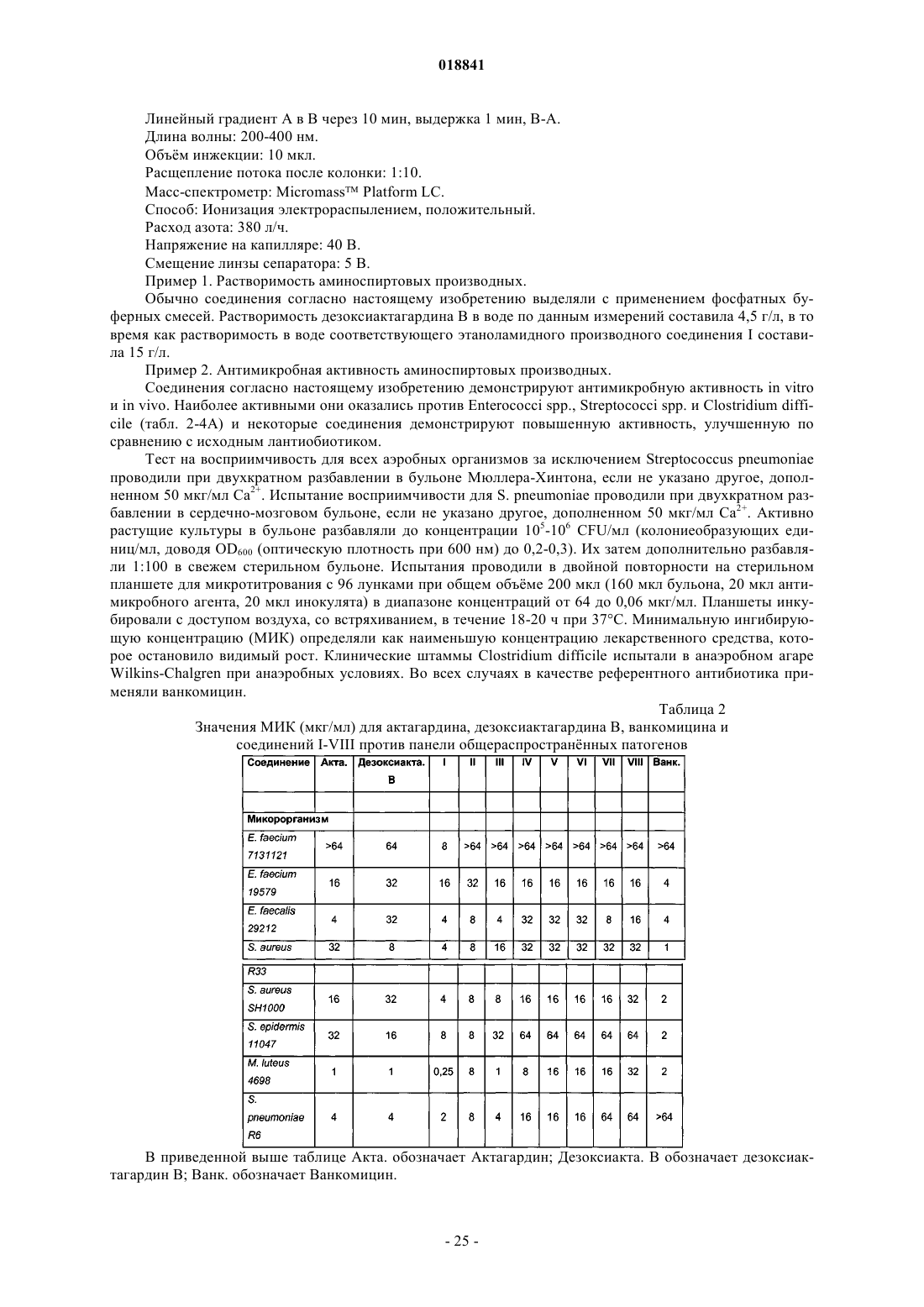
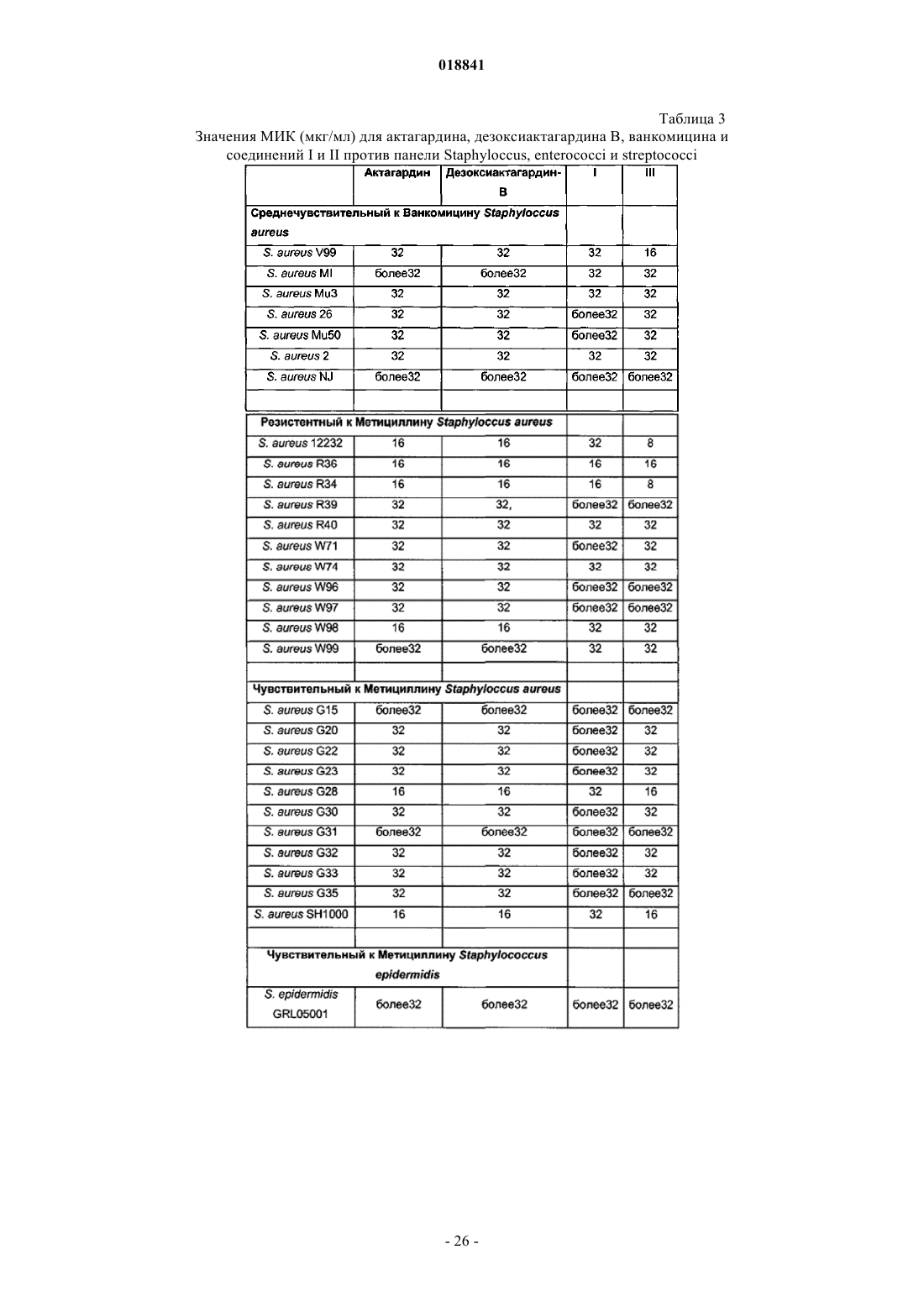
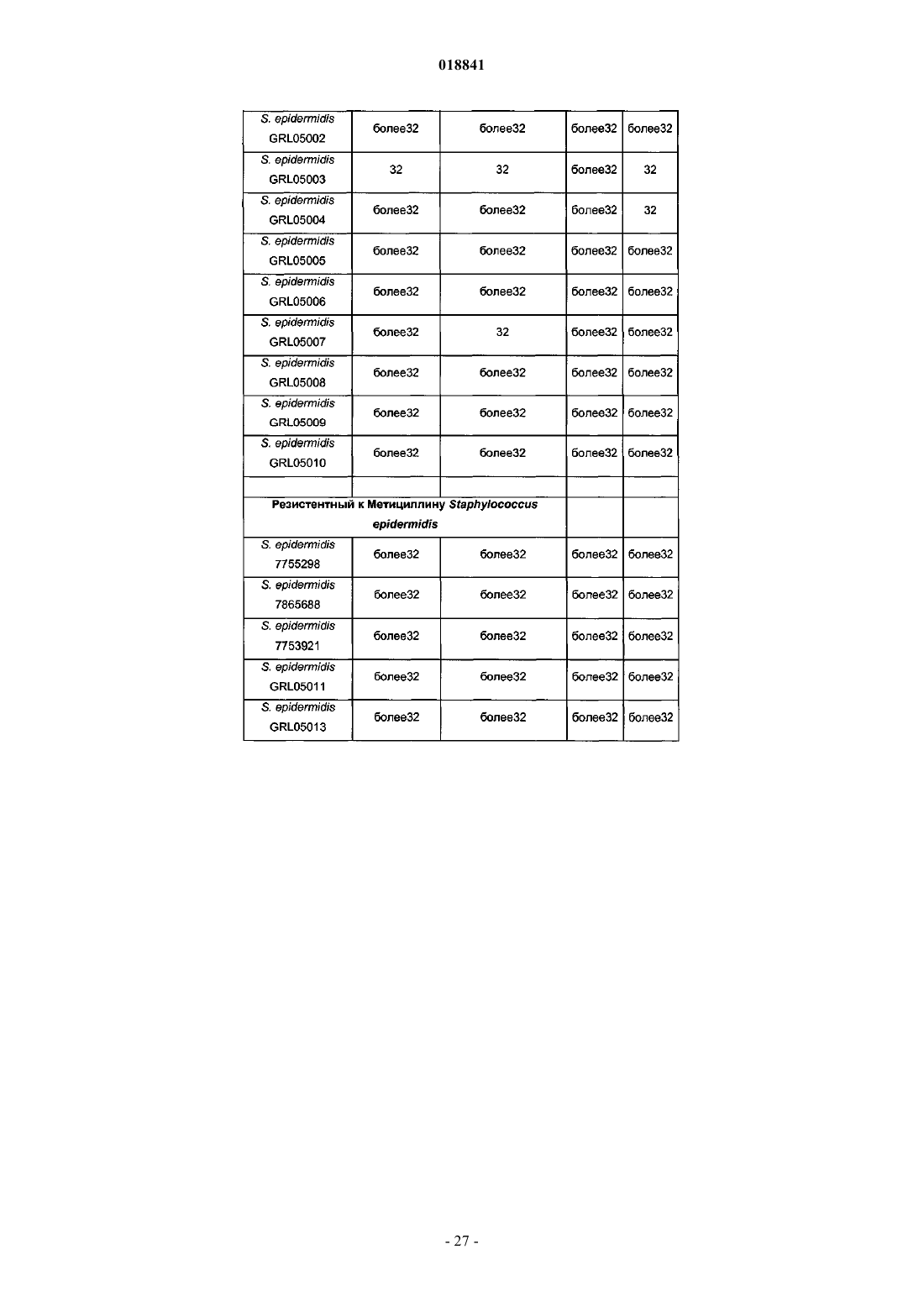
Соединения на основе лантибиотиков, обладающие противомикробной активностью
Формула / Реферат
1. Соединение формулы
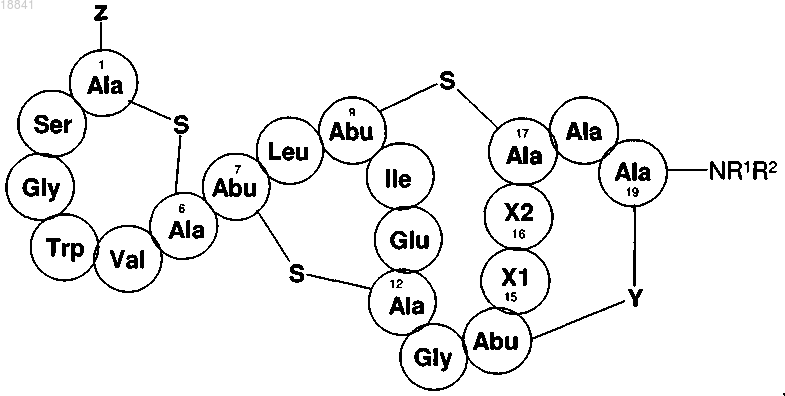
обладающее противомикробной активностью, где
Х1 обозначает остаток Leu, Val или Ile;
Х2 обозначает остаток Leu, Val или Ile;
R1 представляет собой C1-20алкильную или C1-20гетероалкильную группу, замещенную одним, двумя или тремя гидроксильными заместителями и замещенную или незамещенную группой, выбранной из карбокси, сложного эфира, ацилоксиамидо, ациламидо, С5-7арила и С5-20гетероарила;
R2 представляет собой водород или С1-20алкильную или C1-20гетероалкильную группу, замещенную или не замещенную по меньшей мере одним гидроксильным заместителем, или
R1 и R2 вместе с атомом азота образуют С5-7гетероциклическую группу, причем R1 и R2, взятые вместе, содержат один или два гидроксильных заместителя, причем указанная гетероциклическая группа дополнительно содержит или не содержит один или более гетероатомов, и указанная гетероциклическая группа дополнительно замещена или не замещена C1-20алкильной группой;
Z представляет собой аминокислотный остаток или -NH2, который представляет собой N-конец аланинового остатка в положении 1;
Y представляет собой -S- или -S(O)-;
или вариант указанного соединения, в котором 1, 2, 3 или 4 аминокислоты замещены другой аминокислотой,
или фармацевтически приемлемая соль указанного соединения или варианта.
2. Соединение по п.1, отличающееся тем, что Х1, Х2 выбраны из группы, состоящей из Leu-Leu, Leu-Val, Leu-Ile, Val-Leu, Val-Ile, Ile-Leu, Ile-Val и Ile-Ile.
3. Соединение по п.1 или его вариант, отличающееся тем, что Z представляет собой аминокислоту, выбранную из группы Ala, Ile-, Lle, Lys-, Phe-, Val-, Glu-, Asp-, His-, Leu-, Arg-, Ser- и Trp-, причем указанные аминокислоты имеют D- или L-конфигурацию.
4. Соединение по любому из пп.1-3 или его вариант, отличающееся тем, что R2 представляет собой водород.
5. Соединение по любому из пп.1-4 или его вариант, отличающееся тем, что Х1 представляет собой Leu; Х2 представляет собой Val или Ile или Х1 представляет собой Val и Х2 представляет собой Val или Ile.
6. Соединение по любому из пп.1-5 или его вариант, отличающееся тем, что R1 представляет собой C1-7алкильную группу, замещенную одним, двумя или тремя гидроксильными заместителями и, возможно, замещенную группой, выбранной из карбокси, сложного эфира, ацилоксиамидо, ациламидо.
7. Соединение по любому из пп.1-6 или его вариант, отличающееся тем, что R1 выбран из группы, состоящей из:
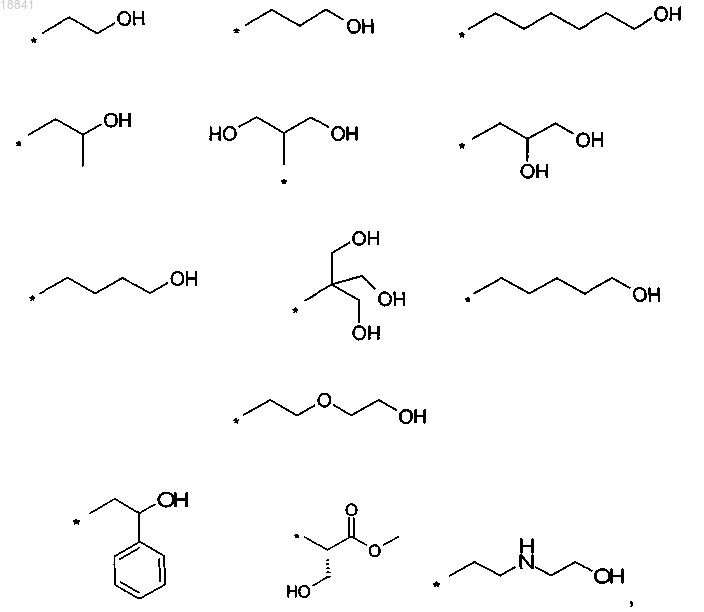
где * обозначает место присоединения к атому азота.
8. Соединение по любому из пп.1-7 или его вариант, отличающееся тем, что R1 представляет собой -СН2СН2ОН.
9. Соединение по любому из пп.1-5, отличающееся тем, что R1 выбран из группы, состоящей из:
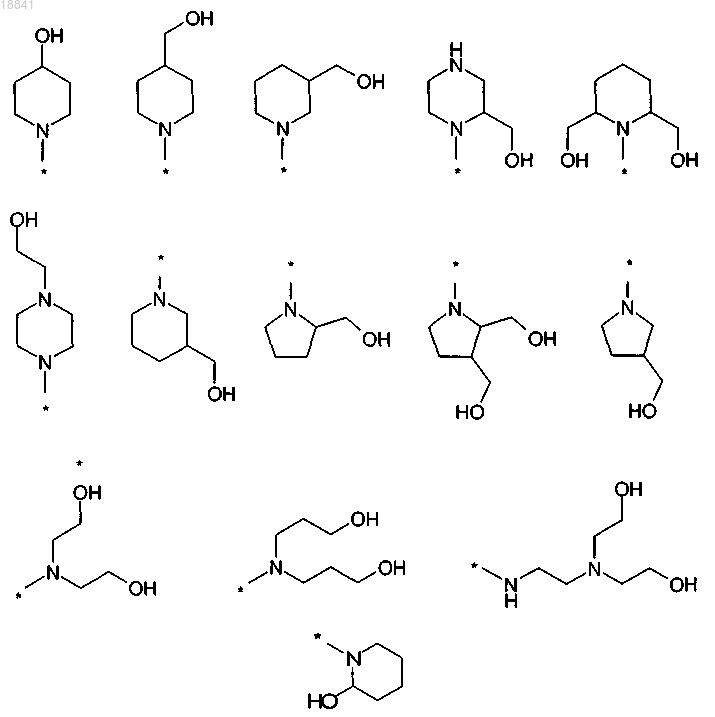
где * обозначает место присоединения к карбонильному углероду на С-конце.
10. Соединение по п.1, отличающееся тем, что соединение выбрано из группы, состоящей из следующих соединений:
соединение I: дезоксиактагардин В N-[2-этаноламин]монокарбоксамид;
соединение II: дезоксиактагардин В N-[4-бутаноламино]монокарбоксамид;
соединение III: актагардин N-[2-этаноламин]монокарбоксамид;
соединение IV: дезоксиактагардин В (3-амино-1,2-пропандиол)монокарбоксамид;
соединение V: дезоксиактагардин В (2-амино-1,3-пропанол)монокарбоксамид;
соединение VI: дезоксиактагардин В [трис-(гидроксиметил)метиламин]монокарбоксамид;
соединение VII: дезоксиактагардин В (1-амино-2-пропанол)монокарбоксамид;
соединение VIII: дезоксиактагардин В (1-амино-3-пропанол)монокарбоксамид;
соединение IX: (L)-фенилаланил-(О)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение X: (L)-триптофанил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XI: (L)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XII: (D)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XIII: (L)-изолейценил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XIV: (L)-лейцинил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XV: N-фенилацетилдезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XVI: N-ацетилдезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XVII: N-манделилдезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XVIII: дезоксиактагардин В (N,N-бис-(2-гидроксиэтил)этилендиамино)монокарбоксамид;
соединение XX: дезоксиактагардин В N-[2-гидрокси-2-фенилэтиламино]монокарбоксамид;
соединение XXI: дезоксиактагардин В (L-серин метиловый эфир)монокарбоксамид;
соединение XXII: дезоксиактагардин В (N-(2-гидроксиэтил)этилендиамин)монокарбоксамид;
соединение XXIII: дезоксиактагардин В (2-гидроксипиперазин)монокарбоксамид;
соединение XXX: (L)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XXXI: (D)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XXXII: (L)-изолейцинил-(О)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XXXIII: (L)-лейцинил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XXXIV: N-фенилацетилдезоксиактагардин В (этаноламин)монокарбоксамид;
соединение XXXV: N-ацетилдезоксиактагардин В (этаноламин)монокарбоксамид и
соединение XXXVI: N-манделилдезоксиактагардин В (этаноламин)монокарбоксамид.
11. Соединение по п.1, представляющее собой
соединение I: дезоксиактагардин В N-[2-этаноламин]монокарбоксамид.
12. Соединение или его вариант по любому из пп.1-11, причем указанный вариант отличается тем, что 1, 2, 3 или 4 аминокислоты находятся в положениях, выбранных из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18 в указанном соединении.
13. Фармацевтическая композиция, содержащая соединение или его вариант по любому из пп.1-12 и фармацевтически приемлемый носитель или разбавитель.
14. Применение соединения или его варианта по любому из пп.1-12 в терапии.
15. Применение соединения или его варианта по любому из пп.1-12 для лечения или профилактики микробной инфекции у субъекта.
16. Применение по п.15, отличающееся тем, что микробная инфекция представляет собой бактериальную инфекцию.
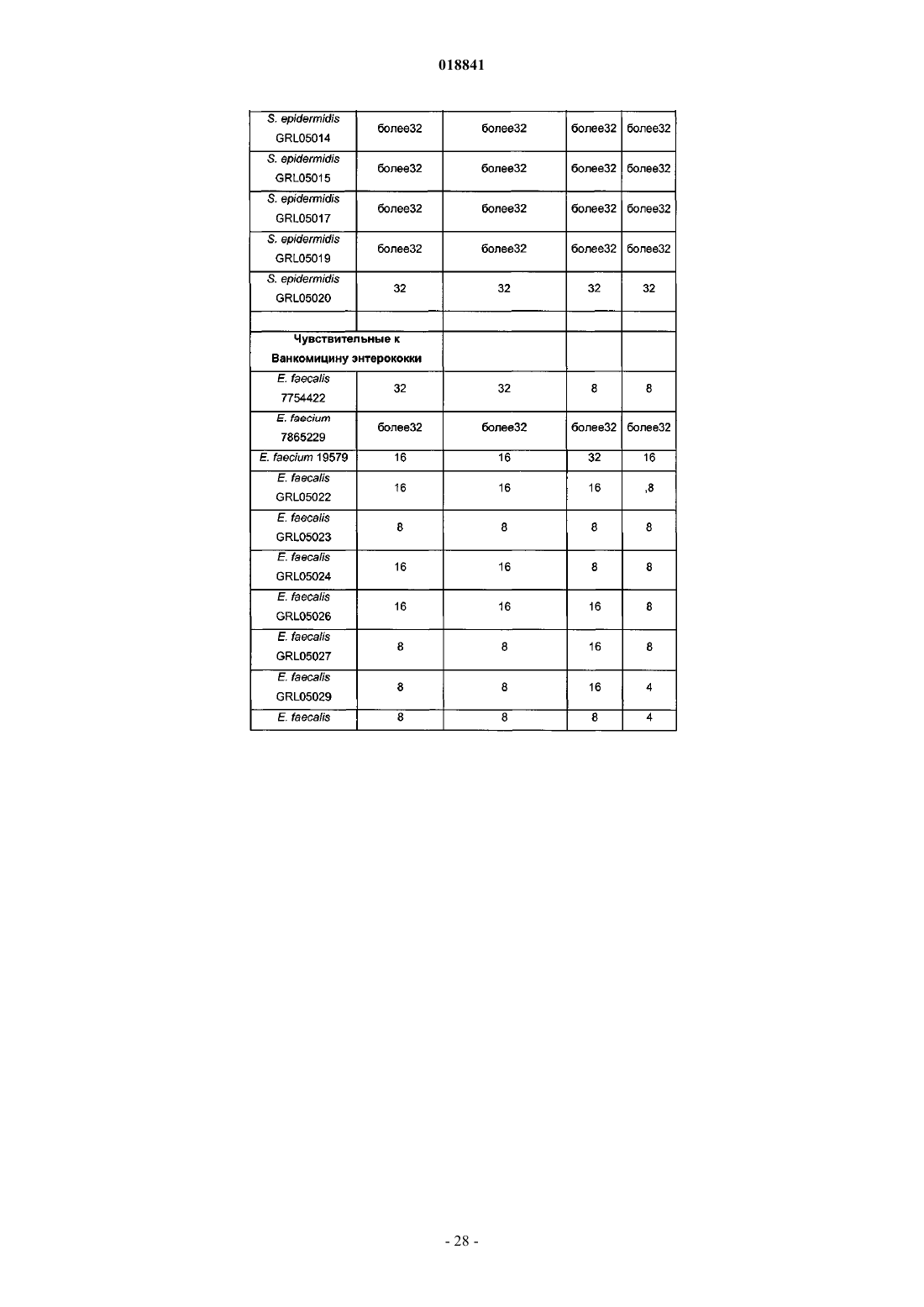
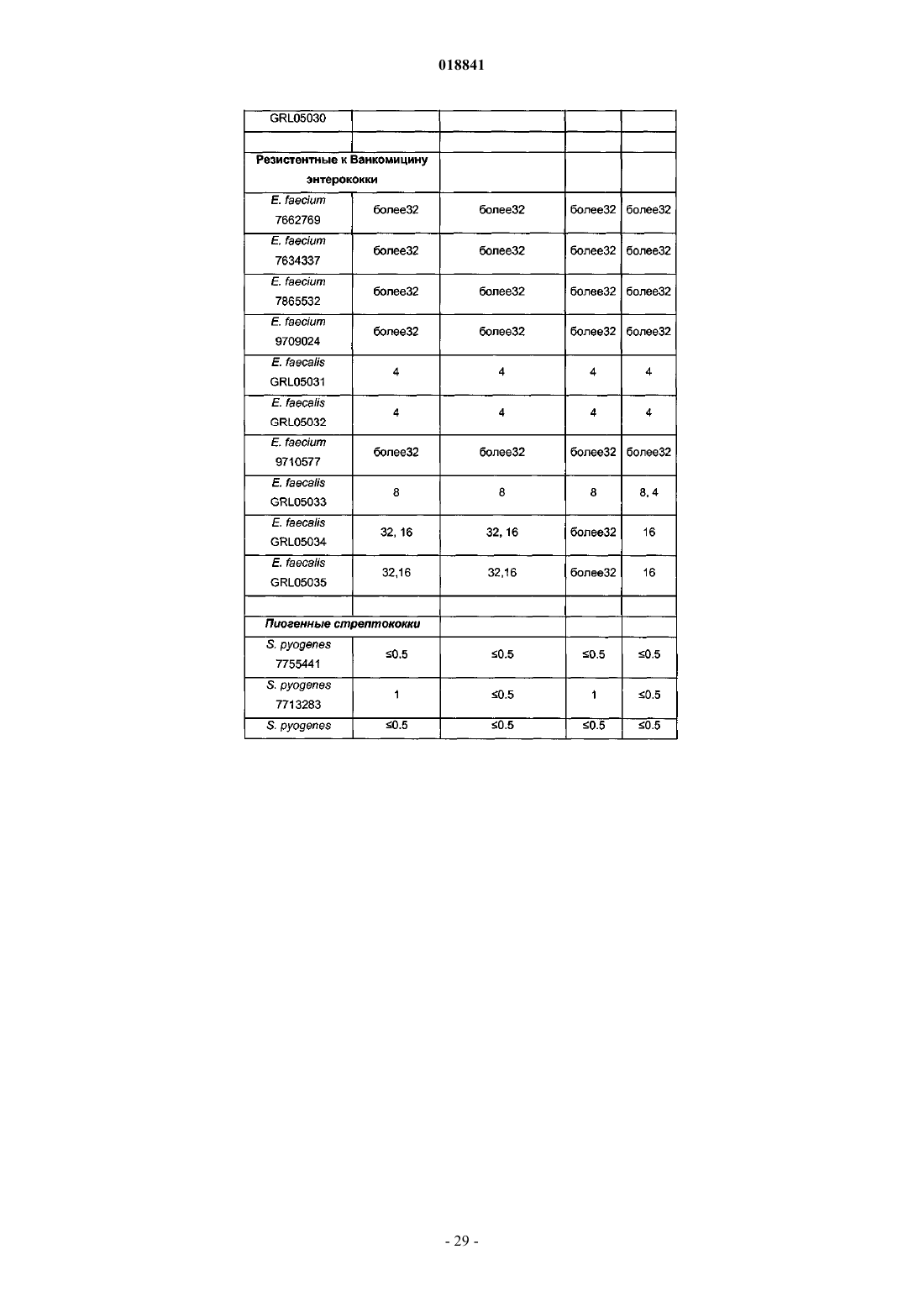
17. Применение по п.16, отличающееся тем, что бактериальная инфекция представляет собой инфекцию Enterococcus sp., Streptococcus spp., Staphylococcus spp. или Clostridium difficile.
18. Применение по п.17, отличающееся тем, что бактериальная инфекция представляет собой инфекцию Clostridium difficile.
19. Применение фармацевтической композиции по п.13 для лечения или профилактики микробной инфекции у субъекта.
20. Применение по п.19, отличающееся тем, что микробная инфекция представляет собой бактериальную инфекцию.
21. Применение по п.20, отличающееся тем, что бактериальная инфекция представляет собой инфекцию Enterococcus sp., Streptococcus spp., Staphylococcus spp. или Clostridium difficile.
22. Применение по п.21, отличающееся тем, что бактериальная инфекция представляет собой инфекцию Clostridium difficile.
23. Способ лечения или профилактики микробной инфекции у субъекта, включающий введение указанному субъекту соединения по любому из пп.1-11, варианта по п.12 или фармацевтической композиции по п.13.
24. Способ по п.23, отличающийся тем, что микробная инфекция представляет собой бактериальную инфекцию.
25. Способ по п.24, отличающийся тем, что бактериальная инфекция представляет собой инфекцию Enterococcus sp., Streptococcus spp., Staphylococcus spp. или Clostridium difficile.
26. Способ по п.25, отличающийся тем, что бактериальная инфекция представляет собой инфекцию Clostridium difficile.
Текст
СОЕДИНЕНИЯ НА ОСНОВЕ ЛАНТИБИОТИКОВ, ОБЛАДАЮЩИЕ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ Вадман Сьрд Николаас (GB) Нилова М.И. (RU)OF SOME AMIDE DERIVATIVES OF THE Согласно настоящему изобретению дезоксиактагардина В формулы где Х 1 обозначает остаток Leu, Val или Ile; Х 2 обозначает остаток Leu, Val или Ile; R1 представляет собой алкильную или гетероалкильную группу, содержащую по меньшей мере один гидроксильный заместитель;R2 представляет собой водород или алкильную или гетероалкильную группу, возможно содержащую в качестве заместителей замещнную по меньшей мере одним гидроксильным заместителем, или R1 иR2 вместе с атомом азота образуют гетероциклическую группу, содержащую по меньшей мере один гидроксильный заместитель, причем гетероциклическая группа возможно дополнительно содержит один или более гетероатомов; Z представляет собой остаток аминокислоты, -NR3R4, -NR5COR6, -NR5C(O)OR6;-NR5SOR6, -NR5SO2R6; -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, причем R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой водород или возможно содержащую заместители группу, которая выбрана из алкила, гетероалкила, арила, гетероарила, аралкила и гетероалкила, при условии, что R9 не представляет собой водород и Y представляет собой -S- или -S(O)-. Соединения находят применение в лечении микробных инфекций.(71)(73) Заявитель и патентовладелец: НОВАКТА БИОСИСТЕМС ЛИМИТЕД (GB) Родственная заявка Заявка на настоящий патент связана с заявкой на патент Великобритании GB 07140296, поданной 18 июля 2007 г.; содержание которой полностью включено в настоящее описание посредством ссылки. Область техники, к которой относится изобретение Изобретение относится к соединениям на основе лантибиотиков, обладающим противомикробной активностью, способам их получения и к их применению. Уровень техники Обладающие свойствами антибиотиков пептиды, содержащие лантионин, или "лантибиотики",представляют собой группу природных продуктов, секретируемых различными грамположительными бактериями. Отличительной особенностью структуры данного класса соединений является присутствие тиоэфирных аминокислот лантионина и метиллантионина, образующихся в определенных процессах биосинтеза, влияющих на синтезируемые рибосомами линейные пептиды-предшественники. Лантибиотики подразделяют на два класса: тип А и тип В. Лантибиотики типа А в целом представляют собой вытянутые амфифильные соединения, сохраняющие в своей структуре крупные линейные участки. Примерами лантибиотиков типа А являются низин и субтилин. Низин и родственные молекулы могут связываться с липидом II, незаменимым промежуточным продуктом в синтезе клеточной стенки бактерии. Кроме того, лантибиотики типа А способны образовывать поры в плазматических мембранах. Считается, что мощная противомикробная активность лантибиотиков типа А обусловлена сочетанием их способности к связыванию с липидом II и способности к образованию пор. Лантибиотики типа В обычно представляют собой пептиды меньшего размера, сложенные и поперечно сшитые в глобулярные структуры и не содержащие протяженных линейных пептидных участков. Примерами лантибиотиков типа В являются мерсацидин, актагардин и циннамицин. Подобно лантибиотикам типа А они обладают противомикробной активностью, которая, как считают, в основном является следствием их способности связывать липид II, так как они не способны образовывать поры в мембранах бактерии. Мерсацидин и актагардин обладают мощной противомикробной активностью в отношении ряда грамположительных организмов, включая виды Streptococcus, Enterococcus и Clostridium. Обзоры можно найти в Sahl and Bierbaum (1998), Annual Rev. Microbiol. 52:41-79; van Kraaij, de Vos,Siezen and Kuipers, Nat. Prod. Rep. 1999, 16, 575; Chatterjee, Paul, Xie and van der Donk, Chem. Rev. 2005,105, 633. Сообщалось, что актагардин и его аналоги продуцируют два вида актинопланов; A. garbadinensis иA. liguriae [Parenti, Pagani, Beretta, J. Antibiotics, 1976, 29, 501; патент США 6022851]. Актагардин образуется из препропептида, С-концевая часть которого включает полипептидную последовательностьSSGWVCTLTIECGTVICAC. Данный полипептид подвергается последующей модификации поперечными сшивками, образующими вторичную и третичную структуру: поперечная сшивка 1-6, лантионин (SerCys); поперечная сшивка 7-12, бета-метиллантионин (Thr-Cys); поперечная сшивка 9-17, бетаметиллантионин (Thr-Cys); поперечная сшивка 14-19, бета-метиллантионинсульфоксид (Thr-Cys). Также совместно образуется аналог [Zimmerman, Metzger and Jung, Eur.J. Biochem 1995, 228, 786], в котором поперечная сшивка 14 и 19 не окислена, т.е. она представляет собой бета-метиллантионин, а не бетаметиллантионинсульфоксид, и в настоящем тексте называется деоксиактагардин. Другой вариант, называемый в настоящем изобретении дезоксиактагардин В, является производным пропептида с последовательностью С-конца SSGWVCTLTIECGTLVCAC без сульфоксида на поперечной сшивке между остатками 14 и 19, также был выделен из A. liguriae (как обсуждается в заявке того же заявителя, находящейся на рассмотрении патентного ведомства PCT/GB2007/000138(WO 2007/083112), которая полностью включена в настоящее изобретение посредством ссылки). Далее показаны структуры актагардина и дезоксиактагардина В. В патенте США 6022851 описано выделение актагардина и родственных форм из изолированных штаммов A. garbadinensis и A. liguriae. Краткое описание изобретения Настоящее изобретение относится к соединениям на основе лантибиотиков, обладающим противомикробной активностью, способам их получения и к применению таких соединений. Такие соединения обладают спектром противомикробной активности, близким к спектру актагардина, и представляют собой новые и полезные альтернативы этому лантибиотику. Согласно одному аспекту настоящего изобретения предложены новые производные актагардина, актагардина В и дезоксиактагардина В. В другом аспекте соединения согласно настоящему изобретению получают путем модификации С-конца и возможно N-конца лантибиотиков, вариантов и производных лантибиотиков. Соединения согласно настоящему изобретению могут иметь улучшенную противомикробную активность по сравнению с соединениями актагардином, актагардином В и дезоксиактагардином В, являющимися их предшественниками. В настоящем изобретении также предложены фармацевтические композиции, содержащие соединение согласно настоящему изобретению и фармацевтически приемлемый носитель или разбавитель. В дополнительном аспекте настоящего изобретения предложено применение соединений и композиций согласно настоящему изобретению в терапии. В частности, настоящее изобретение обеспечивает способы лечения или профилактики у субъекта микробной инфекции, которые включают введение указанному субъекту соединения или композиции согласно настоящему изобретению. Соединение или композицию можно вводить перорально, ректально, внутривенно, вагинально, внутримышечно или локально. В наиболее предпочтительном варианте соединения и композиции согласно настоящему изобретению вводят перорально. Инфекция может представлять собой бактериальную инфекцию. В предпочтительном случае инфекция представляет собой инфекцию, вызываемую микроорганизмами рода Clostridium, предпочтительно Clostridium perfringens, Clostridium difficile, Clostridium tetani или Clostridiumbotulinum, в наиболее предпочтительном случае инфекцию С. difficile. Эти способы предлагают новые и полезные альтернативы способам лечения с применением лантибиотика типа А, ванкомицина или метронидазола. Соединения, описанные в настоящем изобретении, их производные и их варианты могут быть селективными в отношении С. difficile. Данные соединения могут иметь пониженную по сравнению с ванкомицином или метронидазолом активность против других представителей флоры кишечника, в частности Bifidobacterium spp. и Bacteroides spp. Соединения, описанные в настоящем изобретении, обладают активностью против С. difficile, близкой к ванкомицину, и обеспечивают новые и полезные альтернативы ванкомицину в способе лечения или профилактики у субъекта микробной инфекции. Соединения, описанные в настоящем изобретении, могут обладать повышенной устойчивостью к разрушению ферментами по сравнению с низином. В частности, такие соединения могут обладать повышенной по сравнению с низином устойчивостью к действию кишечного сока. Структуры лантибиоти-2 018841 ков типа В, на которых основаны настоящие соединения, являются более компактными, чем соединения типа А, и они не содержат протяженных линейных участков, характерных для соединений А-форм. Следовательно, они менее чувствительны к протеолизу и поэтому с большей вероятностью достигают очага инфекции, такого как бактериальная инфекция нижних отделов кишечника. Также предложено применение соединений и композиций согласно настоящему изобретению в качестве противомикробных агентов для использования in vivo или in vitro. Согласно дополнительному аспекту настоящего изобретения предложены способы синтеза соединений согласно настоящему изобретению из лантибиотиков или их вариантов и/или производных. Краткое описание графических материалов Фиг. 1 демонстрирует эффективность соединения III in vivo в модели тифлита у хомяков, ассоциируемой с C.difficile. Фиг. 2 демонстрирует эффективность соединения I in vivo в модели тифлита у хомяков, ассоциируемой с C.difficile. На фиг. 3 показана реакция образования соединения I по данным аналитической ВЭЖХ (высокоэффективной жидкостной хроматографии). На фиг. 3(а)-(с) показано превращение дезоксиактагардина В в моноамидное соединение I и незначительное количество диамида в ходе реакции. Фиг. 4 демонстрирует устойчивость (а) низина и мерсадицина и (b) соединений I и III в имитации желудочного сока (ИЖС). Фиг. 5 демонстрирует устойчивость (а) низина и мерсадицина и (b) соединения III в имитации кишечного сока (ИКС). Подробное описание изобретения Настоящее изобретение относится к соединениям на основе лантибиотиков, в частности, лантибиотиков типа В, таких как актагардин, актагардин В и дезоксиактагардин В. Соединения на основе лантибиотиков согласно настоящему изобретению могут обладать улучшенной растворимостью и/или другими физико-химическими свойствами и/или биологической активностью по сравнению с исходными лантибиотиками, производными которых они являются. Улучшенная растворимость обеспечивает значительные преимущества при создании композиций соединений согласно настоящему изобретению, предназначенных для перорального и внутривенного введения. Более того, повышение растворимости обеспечивает условия для получения более высоких концентраций антибиотика в месте действия, что способствует увеличению эффективности. Соединения Согласно первому аспекту настоящего изобретения предложено соединение формулы (I) в котором А представляет собой боковую цепь аминокислоты Leu, Val или Ile; В представляет собой Leu, Val или боковую цепь аминокислоты Ile;X представляет собой -NR1R2 или фармацевтически приемлемую соль такого соединения, a В качестве альтернативы, структуру соединения удобно представить следующим образом:R1 представляет собой алкильную или гетероалкильную группу, содержащую в качестве заместителя по меньшей мере один гидроксил;R2 представляет собой водород или алкильную или гетероалкильную группу, возможно содержащую в качестве заместителей один или более гидроксилов, или R1 и R2 вместе с атомом азота образуют гетероциклическую группу, содержащую меньшей мере один гидроксильный заместитель, отличающуюся тем, что гетероциклическая группа возможно дополнительно содержит один или более гетероатомов;Z представляет собой остаток аминокислоты, -NR3R4, -NR5COR6, -NR5C(O)OR6; -NR5SOR6,5-NR SO2R6; -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, где R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой водород или возможно содержащую заместители группу, которая выбрана из алкила,гетероалкила, арила, гетероарила, аралкила и гетероаралкила, при условии, что R9 не является водородом;Y представляет собой -S- или -S(O)-; или фармацевтически приемлемая соль. Согласно дополнительному аспекту изобретения предложены варианты и биологически активные производные таких соединений. Определения Указание на то, что Z представляет собой группу -NH2, обозначает, что данная группировка представляет собой N-конец остатка аланина в положении 1 указанного соединения. Указание на то, что Z представляет собой остаток аминокислоты, обозначает, что эта группировка представляет собой аминокислоту, обычно обозначаемую специалистами в данной области, как Хаа(0), связанную с аланином в положении 1 амидной связью. Если указано, что группа Z представляет собой -NR3R4, -NR5COR6,-NR5C(O)OR6, -NR5SOR6, -NR5SO2R6, -NR5C(S)NR6R7, -NR5C(NR8)NR6R7 или -N=R9, это обозначает, что данные группы представляют собой модификации N-конца аланина в положении 1. Из вышеприведнного представления формулы (I) очевидно, что остатки аминокислот обозначены соответствующим трхбуквенным кодом. Abu относится к остатку аминокислоты, производному 4 аминомасляной кислоты, что станет ясным из структурной формулы. Очевидно, обозначение -NR1R2(-X) относится к группе, связанной с остатком аланина в положении 19 амидной связью, т.е. если атом азота, к которому присоединены R1 и R2, образует часть амидной группы. Тогда понятно, что эта группа является модификацией С-конца аланина в положении 19. Также следует принять во внимание, что если указано, что Z представляет собой остаток аминокислоты, то это относится к группе -NR5COR6, где R6 представляет собой функциональные аминогруппу и группу боковой цепи аминокислоты. Например, если остаток аминокислоты представляет собой глицин,то R6 представляет собой -CH2NH2. Обычно для остатка аминокислоты R6 является C1-7 алкильной группой, содержащий аминозаместитель и возможно другие соответствующие заместители. Если Х 1 и Х 2 представляют собой Val и Ile соответственно и Y представляет собой -S(O)-, то соединение может быть обозначено как производное актагардина. Если Х 1 и Х 2 представляют собой Leu и Val соответственно и Y представляет собой -S-, то соединение может быть обозначено как производное дезоксиактагардина В. Если Х 1 и Х 2 представляют собой Leu и Val соответственно, Y представляет собой -S-, Z представляет собой -NH2, R1 представляет собой -СН 2 СН 2 ОН и R2 представляет собой водород, тогда соединение также может быть обозначено как деокси-актагардин В N-[2-этаноламин]монокарбоксамид. Алкил. Термин "алкил" в настоящем изобретении относится к одновалентной группировке, полученной удалением атома водорода от атома углерода в углеводороде, содержащем от 1 до 20 атомов углерода (если не оговорено другое), и которая может быть насыщенной или ненасыщенной (например,частично ненасыщенной, полностью ненасыщенной). Гетероалкил. Термин "гетероалкил" в настоящем изобретении относится к алкильной группе, в которой один или более атомов углерода замещены гетероатомами N, S или О. В описании алкильных групп префиксы (например, C1-4, C1-7, C1-20, С 2-7, С 3-7 и т.д.) указывают на число атомов углерода или диапазон числа атомов углерода. Например, термин "C1-4 алкил" в настоящем изобретении относится к алкильной группе, содержащей от 1 до 4 атомов углерода. Примеры алкильных групп алкилов: C1-4 алкил ("низший алкил"), С 1-7 алкил и С 1-20 алкил. Следует иметь в виду, что первый префикс может варьироваться в зависимости от некоторых ограничений; например, для ненасыщенных алкильных групп первый префикс должен быть по меньшей мере 2; для циклических алкильных групп первый префикс должен быть по меньшей мере 3 и т.д. Примеры (незамещнных) насыщенных алкильных групп включают, но не ограничиваются перечисленными, метил (C1), этил (С 2), пропил (С 3), бутил (С 4), пентил (C5), гексил (С 6), гептил (С 7), октил(C15) и эйкодецил (С 20). Примеры (незамещнных) насыщенных линейных алкильных групп включают, но не ограничиваются перечисленными, метил (C1), этил (С 2), н-пропил (С 3), н-бутил (C4), н-пентил (амил) (C5), н-гексил(С 6) и н-гептил (С 7). Примеры (незамещнных) насыщенных разветвлнных алкильных групп включают, но не ограничиваются перечисленными, изопропил (С 3), изобутил (C4), втор-бутил (С 4), трет-бутил (С 4), изопентил(C5) и нео-пентил (С 5). Циклоалкил. Термин "циклоалкил" в настоящем изобретении относится к алкильной группе, являющейся одновременно циклической группой; т.е. одновалентной группировкой, полученной удалением атома водорода от атома алициклического кольца или карбоциклического кольца карбоциклического соединения, причем указанное карбоциклическое кольцо может быть насыщенным или ненасыщенным(например, частично ненасыщенным, полностью ненасыщенным), причем указанная группировка включает от 3 до 20 атомов углерода (если специально не оговорено), включая от 3 до 20 атомов кольца. Предпочтительно каждое кольцо содержит от 3 до 7 атомов кольца. Примеры циклоалкильных групп включают С 3-20 циклоалкил, С 3-15 циклоалкил, С 3-10 циклоалкил, С 3-7 циклоалкил. Гетероциклил. Термин "гетероциклил" в настоящем изобретении относится к одновалентной группировке, полученной удалением атома водорода от атома кольца гетероциклического соединения, причем указанная группировка содержит от 3 до 20 атомов кольца (если не указано другое), из которых от 1 до 10 представляют собой гетероатомы кольца. В предпочтительном случае каждое кольцо содержит от 3 до 7 атомов кольца, из которых от 1 до 4 являются гетероатомами кольца. В настоящем описании префиксы (например, С 3-20, С 3-7, С 5-6 и т.д.) указывают на число атомов кольца или на диапазон числа атомов кольца, будь то атомы углерода или гетероатомы. Например, термин "С 5-6 гетероциклил" в настоящем изобретении относится к гетероциклилу, содержащему 5 или 6 атомов кольца. Примеры гетероциклилов включают С 3-20 гетероциклил,С 5-20 гетероциклил,С 3-15 гетероциклил, С 5-15 гетероциклил, С 3-12 гетероциклил, С 5-12 гетероциклил, С 3-10 гетероциклил,С 5-10 гетероциклил, С 3-7 гетероциклил, С 5-7 гетероциклил и С 5-6 гетероциклил. Примеры моноциклических гетероциклилов включают, но не ограничиваются перечисленными,группы, являющиеся производными:N1O1S1: оксатиазина (С 6). Примеры замещнных (неароматических) моноциклических гетероциклилов включают производные сахаридов, например фураноз (C5), таких как арабинофураноза, ликсофураноза, рибофураноза и ксилофураноза и пираноз (С 6), таких как аллопираноза, альтропираноза, глюкопираноза, маннопираноза,гулопираноза, идопираноза, галактопираноза и талопираноза.R1 и R2 вместе с атомом азота амидной связи могут образовывать гетероциклил, содержащий по меньшей мере один гидроксильный заместитель. Гетероциклил может представлять собой группу, выбранную из примеров N1, приведенных выше. Гетероциклил может содержать один или более дополнительных гетероатомов. Кроме того, гетероциклил может являться группой, выбранной из примеров N2,N1O1, N1S1, N2O1 и N1O1S1, приведенных выше. Арил. Термин "арил" в настоящем изобретении относится к одновалентной группировке, полученной удалением атома водорода из ароматического кольца ароматического соединения, причм указанное соединение может включать одно кольцо или два или более колец (например, конденсированных). Гетероарил. Термин "гетероарил" в настоящем изобретении относится к арильной группе, в которой один или более атомов углерода заменены на гетероатом N, S, О или другой. В этом случае удобно обозначать группу как "С 5-20 гетероарильная" группа, где "С 5-20" обозначает атомы кольца, будь то атомы углерода или гетероатомы. В предпочтительном случае каждое кольцо включает от 5 до 7 атомов кольца,из которых от 0 до 4 являются гетероатомами кольца. Аралкил. Термин "аралкил" в настоящем изобретении относится к алкильной группе, определнной выше, содержащей в качестве заместителя одну или более, предпочтительно одну, арильную группу,определение которой дано выше. Гетероаралкил. Термин "гетероаралкил" в настоящем изобретении относится к алкильной группе,определнной выше, содержащей в качестве заместителя одну или более, предпочтительно одну, арильную группу, определнную выше, причем один или более атомов углерода в алкильной и/или арильной группе заменен на, без ограничения, гетероатомы N, S, О. С 5-20 арил. Термин "С 5-20 арил" в настоящем изобретении относится к одновалентной группировке,полученной удалением атома водорода от атома ароматического кольца С 5-20 ароматического соединения,содержащего в кольце от 5 до 20 атомов, причем по меньшей мере одно из указанных колец представляет собой ароматическое кольцо. В предпочтительном случае каждое кольцо содержит от 5 до 7 атомов в кольце. Примеры С 5-20 арильных групп, не содержащих гетероатомов в кольце (т.е. С 5-20 карбоарильные группы) включают, но не ограничиваются перечисленными, производные бензола (т.е. фенил) (С 6), нафталина (С 10), антрацена (С 14), фенантрена (С 14) и пирена (C16). Примеры С 5-20 гетероарильных групп, содержащих конденсированные кольца, включают, но не ограничиваются перечисленными, С 9 гетероарильные группы, являющиеся производными бензофурана,изобензофурана, бензотиофена, индола, изоиндола; С 10 гетероарильные группы, являющиеся производными хинолина, изохинолина, бензодиазина, пиридопиридина; С 14 гетероарильные группы, являющиеся производными акридина и ксантена. Указанные группы, сами по себе или в качестве части другого заместителя, возможно могут содержать в качестве заместителей одну или более групп, которые выбраны из них самих и дополнительных перечисленных ниже заместителей. Галоген: -F, -Cl, -Br и -I. Гидроксил: -ОН. Эфир: -OR, где R представляет собой эфирный заместитель, например, C1-7 алкильную группу (также называемую C1-7 алкоксигруппой), С 3-20 гетероциклильную группу (также называемую С 3-20 гетероциклилоксигруппой), либо С 5-20 арильную группу (также называемую С 5-20 арилоксигруппой),предпочтительно C1-7 алкильную группу. Нитро: -NO2. Циано (нитрил, карбонитрил): -CN. Ацил (кетогруппа): -C(=O)R, где R представляет собой ацильный заместитель, например Н,C1-7 алкильную группу (также называемую C1-7 алкилацильной группой или C1-7 алканоильной группой),С 3-20 гетероциклил (также называемую С 3-20 гетероциклилацил) или С 5-20 арильную группу (также называемую С 5-20 арилацильной группой), в предпочтительном случае C1-7 алкильную группу. Примеры ацильных групп включают, но не ограничиваются перечисленными, -С(=О)СН 3 (ацетил), -С(=О)СН 2 СН 3 (пропионил), -С(=О)С(СН 3)3 (бутирил) и -C(=O)Ph (бензоил, фенон). Карбоксильная группа (карбоновая кислота): -СООН. Сложный эфир (карбоксилат, эфир карбоновой кислоты, оксикарбонил): -C(=O)OR, где R представляет собой сложноэфирный заместитель, например С 1-7 алкильную группу, С 3-20 гетероциклил или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сложноэфирных групп включают, но не ограничиваются перечисленными, -С(=О)ОСН 3, -С(=О)ОСН 2 СН 3, -С(=О)ОС(СН 3)3 иR представляют собой независимо заместители у амина, определнные для аминогрупп. Примеры амидогрупп включают, но не ограничиваются перечисленными, -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2,-C(=O)NHCH2CH3 и -C(=O)N(CH2CH3)2, а также амидогруппы, в которых R1 и R2 вместе с атомом азота,к которому они присоединены, образуют гетероциклическую структуру, такую как, например, пиперидинокарбонил, морфолинокарбонил, тиоморфолинокарбонил и пиперазинилкарбонил. Амино: -NR1R2, где R1 и R2 представляют собой независимо заместители, например водород,С 1-7 алкильную группу (также называемую C1-7 алкиламиногруппой или ди-С 1-7 алкиламиногруппой),С 3-20 гетероцикл, С 5-20 арильную группу, предпочтительно Н или С 1-7 алкильную группу, или, в случае ограничиваются перечисленными, -NH2, -NHCH3, -NHCH(CH3)2, -N(CH3)2, -N(CH2CH3)2 и -NHPh. Примеры циклических аминогрупп включают, но не ограничиваются перечисленными, азиридинил, азетидинил, пирролидинил, пиперидиновую группу, пиперазинил, пергидродиазепинил, морфолиногруппу и тиоморфолиногруппу. В частности, циклические аминогруппы могут замещаться содержать в кольце любые заместители, определнные в настоящем изобретении, например карбоксил, карбоксилат и амидо. Ациламидогруппа (ациламиногруппа): -NR1C(=O)R2, где R1 представляет собой заместитель у амида, например, водород, С 1-7 алкильную группу, С 3-20 гетероциклил или С 5-20 арильную группу, предпочтительно Н или С 1-7 алкильную группу, в наиболее предпочтительном случае Н, и R2 представляет собой заместитель у ацильной группы, например С 1-7 алкильную группу, С 3-20 гетероциклили С 5-20 арильную группу, в предпочтительном случае C1-7 алкильную группу. Примеры ациламидных групп включают, но не ограничиваются перечисленными, -NHC(=O)CH3, -NHC(=O)CH2CH3 и -NHC(=O)Ph. R1 и R2 могут вместе образовать циклическую структуру, как, например, сукцинимидил, малеимидил и фталимидил Аминокарбонилокси: -OC(=O)NR1R2, в которой R1 и R2 независимо представляют собой заместители аминогруппы, определнные для аминогрупп. Примеры аминокарбонилоксигрупп включают, но не ограничиваются перечисленными, -OC(=O)NH2, -OC(=O)NHMe, -OC(=O)NMe2 и -OC(=O)NEt2. Уреидо: -N(R1)CONR2R3, где R2 и R3 независимо представляют собой заместители у аминогрупп,определнные для аминогрупп, и R1 представляет собой заместитель у уреидогруппы, например водород,С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно водород или C1-7 алкильную группу. Примеры уреидогрупп включают, но не ограничиваются перечисленными,-NHCONH2,-NHCONHMe,-NHCONHEt,-NHCONMe2,-NHCONEt2,-NMeCONH2,-NMeCONHMe, -NMeCONHEt, -NMeCONMe2, -NMeCONEt2 и -NHCONHPh. Гуанидиногруппа: -NH-C(=NH)NH2. Тетразолил: пятичленное ароматическое кольцо, содержащее четыре атома азота и один атом углерода Иминогруппа: =NR, в которой R представляет собой заместитель у иминогруппы, например, водород, С 1-7 алкильную группу, С 3-20 гетероцикл или С 5-20 арильную группу, предпочтительно Н или С 1-7 алкильную группу. Примеры иминогрупп включают, но не ограничиваются перечисленными, =NH,=NMe и =NEt. Амидин (амидиног): -C(=NR)NR2, где каждый R представляет собой заместитель у амидина, например водород, С 1-7 алкильную группу, С 3-20 гетероциклилили С 5-20 арильную группу, предпочтительно Н или С 1-7 алкильную группу. Примерами амидиновых групп являются, без ограничения, -C(=NH)NH2,-C(=NH)NMe2 и -C(=NMe)NMe2. Нитрогруппа: -NO2. Нитрозогруппа: -NO. Азидогруппа: -N3. Цианогруппа (нитрил, карбонитрил): -CN. Изоцианогруппа: -NC. Цианат: -OCN. Изоцианат: -NCO. Тиоцианогруппа (тиоцианатогруппа): -SCN. Ацилокси (обращенный эфир): -OC(=O)R, в которой R представляет собой заместитель у ацилоксигруппы, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу,предпочтительно С 1-7 алкильную группу. Примеры ацилоксигрупп включают, но не ограничиваются перечисленными, -ОС(=О)СН 3 (ацетокси), -ОС(=О)СН 2 СН 3, -ОС(=О)С(СН 3)3, -OC(=O)Ph, -OC(=O)C6H4F и-OC(=O)CH2Ph. Изотиоцианогруппа (изотиоцианато): -NCS. Тиол: -SH. Тиоэфир (сульфид): -SR, где R представляет собой заместитель у тиоэфирной группы, например С 17 алкильную группу (также называемую С 1-7 алкилтиогруппой), С 3-20 гетероциклил или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры С 1-7 алкилтиогрупп включают, но не ограничиваются перечисленными, -SCH3 и -SCH2CH3. Дисульфид: -SS-R, где R представляет собой заместитель у дисульфидной группы, например(также в настоящем изобретении называемую С 1-7 алкилдисульфидами). ПримерыC1-7 алкилдисульфидных групп включают, но не ограничиваются перечисленными, -SSCH3 и -SSCH2CH3. Сульфин (сульфинил, сульфоксид): -S(=O)R, в которой R представляет собой заместитель сульфина, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфиновых групп включают, но не ограничиваются перечисленными, -S(=O)CH3 и -S(=O)CH2CH3. Сульфоксид (сульфинил): -S(=O)R, где R представляет собой заместитель сульфоксида, например С 1-7 алкильную группу, С 3-20 гетероциклил, или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфоксидных групп включают, но не ограничиваются перечисленными, -S(=O)CH3 и-S(=O)CH2CH3. Сульфонил (сульфон): -S(=O)2R, где R представляет собой заместитель у сульфона, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительноC1-7 алкильную группу. Примеры сульфоновых групп включают, но не ограничиваются перечисленными,-S(=O)2CH3 (метансульфонил, мезил), -S(=O)2CF3, -S(=O)2CH2CH3 и 4-метилфенилсульфонил (тозил). Тиоамидо (тиокарбамил): -C(=S)NR1R2, в которой R1 и R2 независимо представляют собой заместители аминогруппы, определнные выше для аминогрупп. Примеры амидогрупп включают, но не ограничиваются перечисленными, -C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2 и -C(=S)NHCH2CH3. Сульфонаминогруппа: -NR1S(=O)2R, в которой R1 представляет собой заместитель аминогруппы,определнный выше для аминогрупп, R представляет собой заместитель у сульфонаминогруппы, например С 1-7 алкильную группу, С 3-20 гетероциклилили С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфонаминогрупп включают, но не ограничиваются перечисленными,-NHS(=O)2CH3, -NHS(=O)2Ph и -N(CH3)S(=O)2C6H5. Сульфиновая кислота (сульфиногруппа): -S(=O)OH, -SO2H. Сульфоновая кислота (сульфогруппа): -S(=O)2OH, -SO3H. Сульфинат (сложный эфир сульфиновой кислоты): -S(=O)OR; где R представляет собой заместитель сульфината, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфинатных групп включают, но не ограничиваются перечисленными, -S(=O)OCH3 (метоксисульфинил; метиловый эфир сульфиновой кислоты) и-S(=O)OCH2CH3 (этоксисульфинил; этиловый эфир сульфиновой кислоты). Сульфонилоксигруппа: -OS(=O)2R, где R представляет собой заместитель у сульфонилоксигруппы,например С 1-7 алкильную группу, С 3-20 гетероциклил или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфонилоксигрупп включают, но не ограничиваются перечисленными, -OS(=O)2CH3 (мезилат) и -OS(=O)2CH2CH3 (эзилат). Сульфат: -OS(=O)2OR; где R представляет собой заместитель сульфата, например С 1-7 алкильную группу, С 3-20 гетероциклил или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфатных групп включают, но не ограничиваются перечисленными, -OS(=O)2OCH3 и-SO(=O)2OCH2CH3. Сульфамил (сульфамоил; амид сульфиновой кислоты; сульфинамид): -S(=O)NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определнные выше для аминогрупп. Примеры сульфамильных групп включают, но не ограничиваются перечисленными, -S(=O)NH2, -S(=O)NH(CH3),-S(=O)N(CH3)2, -S(=O)NH(CH2CH3), -S(=O)N(CH2CH3)2 и -S(=O)NHPh. Сульфонамидогруппа (сульфинамоил; амид сульфоновой кислоты; сульфонамид): -S(=O)2NR1R2, в которой R1 и R2 независимо представляют собой заместители аминогруппы, определнные выше для аминогрупп. Примеры сульфонамидогрупп включают, но не ограничиваются перечисленными,-S(=O)2NH2, -S(=O)2NH(CH3), -S(=O)2N(CH3)2, -S(=O)2NH(CH2CH3), -S(=O)2N(CH2CH3)2 и -S(=O)2NHPh. Сульфаминогруппа: -NR1S(=O)2OH, где R1 представляет собой заместитель аминогруппы, уже определенный для аминогрупп. Примеры сульфаминогрупп включают, но не ограничиваются перечисленными, -NHS(=O)2OH и -N(CH3)S(=O)2OH. Сульфонаминогруппа: -NR1S(=O)2R, в которой R1 представляет собой заместитель аминогруппы,определнный выше для аминогрупп, R представляет собой заместитель сульфонаминогруппы, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфонаминогрупп включают, но не ограничиваются перечисленными,-NHS(=O)2CH3 и -N(CH3)S(=O)2C6H5. Сульфинаминогруппа: -NR1S(=O)R, где R1 представляет собой заместитель аминогруппы, определнный выше для аминогрупп, R представляет собой заместитель сульфинаминогруппы, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу. Примеры сульфинаминогрупп включают, но не ограничиваются перечисленными,-NHS(=O)CH3 и -N(CH3)S(=O)C6H5. Фосфиногруппа (фосфин): -PR2, в которой R представляет собой заместитель фосфиногруппы, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфиногрупп включают, но не ограничиваются перечисленными, -РН 2, -Р(СН 3)2, -Р(СН 2 СН 3)2, -P(трет-Bu)2 и -P(Ph)2. Фосфогруппа: -Р(=О)2. Фосфинил (фосфиноксид): -P(=O)R2, где R представляет собой заместитель фосфинильной группы,например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфонильных групп включают, но не ограничиваются перечисленными, -Р(=О)(СН 3)2, -Р(=О)(СН 2 СН 3)2, -P(=O)(трет-Bu)2 и -P(=O)(Ph)2. Фосфоновая кислота (фосфонокислота): -Р(=О)(ОН)2. Фосфонат (сложный эфир фосфоновой кислоты): -P(=O)(OR)2 где R представляет собой заместитель фосфонатной группы, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфонатных групп включают, но не ограничиваются перечисленными, -Р(=О)(ОСН 3)2,-Р(=О)(ОСН 2 СН 3)2, -P(=O)(O-трет-Bu)2 и -P(=O)(OPh)2. Фосфорная кислота (фосфоноокси кислота): -ОР(=О)(ОН)2. Фосфат (сложный эфир фосфоноокси кислоты): -OP(=O)(OR)2, в котором R представляет собой заместитель фосфата, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклили С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфатных групп включают,но не ограничиваются перечисленными, -ОР(=О)(ОСН 3)2, -ОР(=О)(ОСН 2 СН 3)2, -OP(=O)(O-трет-Bu)2 и-OP(=O)(OPh)2. Фосфористая кислота: -ОР(ОН)2. Фосфит: -OP(OR)2, где R представляет собой заместитель у фосфита, например -Н, С 1-7 алкильную группу, С 3-20 гетероцикл или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу илиC5-20 арильную группу. Примеры фосфитных групп включают, но не ограничиваются перечисленными,-ОР(ОСН 3)2, -ОР(ОСН 2 СН 3)2, -OP(O-трет-Bu)2 и -OP(OPh)2. Фосфорамидит: -OP(OR1)-NR22, где R1 и R2 представляют собой заместители фосфорамидитной группы, например -Н, (при необходимости замещнную) С 1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфорамидитных групп включают, но не ограничиваются перечисленными, -OP(OCH2CH3)N(CH3)2, -OP(OCH2CH3)-N(изо-Pr)2 и -OP(OCH2CH2CN)-N(i-Pr)2. Фосфорамидат: -OP(=O)(OR1)-NR2, где R1 и R2 представляют собой заместители у фосфорамидатной группы, например -Н, (при необходимости замещнную) С 1-7 алкильную группу,С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или C5-20 арильную группу. Примеры фосфорамидатных групп включают, но не ограничиваются перечисленными, -OP(=O)(OCH2CH3)-N(CH3)2, -OP(=O)(OCH2CH3)-N(изо-Pr)2 и -OP(=O)(OCH2CH2CN)-N(изоPr)2. Силил: -SiR3, где R представляет собой заместитель у силила, например -Н, С 1-7 алкильную группу,С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры силильных групп включают, но не ограничиваются перечисленными, -SiH3, -SiH2(CH3), -SiH(CH3)2, -Si(CH3)3, -Si(Et)3, -Si(изо-Pr)3, -Si(трет-Bu)(CH3)2 и -Si(tBu)3. Оксисилил: -Si(OR)3, в которой R представляет собой заместитель у оксисилильной группы, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры оксисилильных групп включают, но не ограничиваются перечисленными, -Si(OH)3, -Si(OMe)3, -Si(OEt)3 и -Si(O-трет-Bu)3. Силоксигруппа (силиловый эфир): -OSiR3, где SiR3 представляет собой силильную группу, как обсуждалось выше. Оксисилоксигруппа: -OSi(OR)3, где OSi(OR)3 представляет собой оксисилильную группу, как обсуждалось выше. Во многих случаях заместители сами содержат заместители. Как упоминалось выше, группы, образующие перечисленные заместители, например алкил, гетероциклил и арил, сами могут содержать заместители. Таким образом, указанные определения охватывают заместители у замещнных групп. Предпочтительные соединения. Ниже описываются предпочтительные соединения согласно первому аспекту изобретения. В предпочтительном случае Х 1 представляет собой Leu и Х 2 представляет собой Val или Ile или Х 1 представляет собой Val и Х 2 представляет собой Val или Ile. В наиболее предпочтительном случае Х 1 представляет собой Leu и Х 2 представляет собой Val или Х 1 представляет собой Val и Х 2 представляет собой Ile.R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10, возможно, содержат соответствующие заместители, в некоторых вариантах реализации эти группы являются незамещнными или несодержащими дополнительно соответствующих заместителей. В случае, когда R1 или R2 является алкильной группой, алкильная группа может представлять собойC1-7 алкильную группу, в наиболее предпочтительном случае C1-4 алкильную группу. Алкильная группа R1 или R2 предпочтительно является полностью насыщенной.R1 или R2 могут содержать один, два, три, четыре, пять, шесть или семь атомов углерода. В случае, когда R1 и R2 вместе с атомом азота из амида образуют гетероциклическую группу, и если данная группа дополнительно содержит один или более гетероатомов, в предпочтительном случае гетероатомы не находятся в соседних положениях гетероциклического кольца. Если R1 и R2 вместе с атомом азота амидной группы образуют гетероциклическую группу и если указанная группа дополнительно содержит один или более гетероатомов, гетероциклическая группа в предпочтительном случае является С 3-20 гетероциклической группой. В предпочтительном варианте гетероциклическая группа является C5-10 гетероциклической группой. Гетероциклическая группа может содержать 5, 6 или 7 атомов в кольце. Как R1, так и R2 могут содержать один или более гидроксильных заместителей. Между собой R1 и 2R могут иметь два или более гидроксильных заместителя. В предпочтительном случае R1 имеет один,два или три гидроксильных заместителя.R1 и R2 могут быть одинаковыми. В предпочтительном варианте R1 является алкильной группой. Предпочтительно R2 представляет собой водород. Если R1 или R2 является гетероалкильной группой, содержащей гидроксильный заместитель, указанный гидроксильный заместитель является заместителем на атоме углерода гетероалкильной группы. Если R1 или R2 представляет собой алкильную или гетероалкильную группу, содержащую два или более гидроксильных заместителей, каждый атом углерода алкильной или гетероалкильной группы имеет один заместитель. В одном варианте реализации алкильная группа R1 или R2 является ациклической. В одном варианте реализации группа алкильная группа R1 или R2 является линейной. В одном варианте реализации R1 или R2 содержит заместители или соответствующие дополнительные заместители. Заместитель может представлять собой одну или более из групп, которые выбраны из группы, состоящей из карбоксильной группы, сложноэфирной группы, ацилоксигруппы, амидогруппы,ациламидогруппы, арила и гетероарила. В предпочтительном случае заместитель представляет собой одну или более группу, которые выбраны из группы, состоящей из карбоксильных, сложноэфирных, ацилокси-, арильных и гетероарильных групп. В предпочтительном варианте R1 или R2 независимо представляют собой один из заместителей,приведнных ниже, гдеобозначает точку присоединения к атому азота: Дополнительно или в качестве альтернативы R1 или R2 могут быть независимо выбраны из одного из приведнных ниже заместителей, гдеобозначает точку присоединения к атому азота: В одном варианте реализации группа R1 независимо выбрана из одного из любого из приведенных выше наборов заместителей. В этом варианте реализации R2 предпочтительно представляет собой водород. В качестве альтернативы R1 и R2 вместе с атомом азота, т.е. X, могут представлять собой заместитель, выбранный из приведнной ниже группы, гдеобозначает точку присоединения к углероду карбонила С-конца: Дополнительно или в качестве альтернативы R1 или R2 могут быть независимо выбраны из приведенных ниже заместителей, гдеобозначает точку присоединения к атому азота: предпочтительно R1 представляет собой -СН 2 СН 2 ОН. В одном из вариантов реализации Z представляет собой -NH2, аминокислоту или -NR5COR6. В предпочтительном варианте Z представляет собой -NH2 или аминокислоту. В одном варианте реализации Z представляет собой -NR5COR6, R5 представляет собой водород. В случае, если Z представляет собой остаток аминокислоты, остаток аминокислоты представляет собой предпочтительно остаток природной аминокислоты, кодируемой генетическим кодом, или остатокD-изоформы такой аминокислоты, более предпочтительно остаток аминокислоты, выбранный из группыIle-, Lys-, Phe-, Val-, Glu-, Asp-, His-, Leu, Arg-, Ser- и Trp-. Согласно одному из аспектов остаток аминокислоты может быть выбран из группы Ile-, Lys-, Phe-, Val-, Glu-, Asp-, His-, Leu-, Arg- и Ser-. Такие варианты могут быть получены путем химического присоединения остатка к соединениям, в которых Z представляет собой -NH2, по описанию к патенту США 6022851, который включен в настоящее изобретение посредством ссылки. Следует принимать во внимание, что при химическом присоединении кислоты допускается нахождение аминокислоты в L- или D-конфигурации. Это относится к D-Ala, и дополнительно к D-формам других аминокислот, таких как были упомянуты выше. Остаток аминокислоты может являться модифицированным остатком природной аминокислоты,таким как остатки, образующиеся в результате посттрансляционной модификации, например остатков серина, цистеина и треонина. Остаток в составе соединений согласно настоящему изобретению может быть выбран из дегидрированных аминокислот, из группы, показанной ниже: Вторую из этих структур можно назвать остатком дегидроаминомасляной кислоты. Дополнительно остаток аминокислоты может быть выбран из циклических остатков, показанных в нижеприведнной группе: Следует учесть, что синтез этих циклических структур обычно включает циклизацию остатков боковой цепи серина, треонина или цистеина с амидным карбонилом, типично, но не обязательно, соседнего аминокислотного остатка. Таким образом, показанные выше структуры включают часть соседних групп, таких как соседние аминокислоты. Альтернативно, соседняя группа может быть производной из группы, совместной с ос- 11018841 татками серина, треонина или цистеина, образующей амидную связь у остатка N-конца. Это доказывается ретросинтезом в нижеприведнном примере для оксазолинового аминокислотного остатка, производного из остатка серина, который связывается амидной связью с соседней группой остатка N-конца серина: Звздочкаобозначает положение атома углерода в оксазолине, полученного из углерода карбонила в соседней группе. Ретросинтез показан исключительно в иллюстративных целях, и обсуждавшиеся выше посттрансляционно модифицированные остатки аминокислот можно приготовить из альтернативных предшественников. Остаток аминокислоты может являться остатком не встречающейся в природе аминокислоты или редкой природной аминокислоты. Аминокислота может быть выбрана из группы, состоящей из селеносерина, аминомасляной кислоты, аминоизомасляной кислоты, бутилглицина, цитруллина, циклогексилаланина, диаминопропионовой кислоты, гомосерина, гидроксипролина, норлейцина, норвалина, орнитина, пеницилламинопироглутаминовой кислоты, саркозина, статина, тетрагидроизохинолин-3-карбоновой кислоты и тиенилаланина. Могут быть выбраны L- или D-формы. Аминокислота может являться -, - или -аминокислотой. Аминогруппа аминокислоты может быть моно- или диалкилированной. Если Z представляет собой остаток аминокислоты, аминогруппа аминокислоты может быть модифицирована. Так, N-конец может являться группой, выбранной из-NR3R4, -NR5COR6, -NR5C(O)OR6, -NR5SOR6, -NR5SO2R6, -NR5C(S)NR6R7 и -NR5C(NR8)NR6R7, где R3, R4,R5, R6, R7 и R8 определены выше. Если Z представляет собой остаток аминокислоты, остаток аминокислоты может также представлять собой защищенный остаток аминокислоты. Защитные группы для аминогрупп могут быть выбраны из группы, состоящей из Fmoc, Boc, Ac, Bn и Z (или Cbz). Боковая цепь также может быть защищена соответствующим образом. Защитные группы для боковых цепей могут быть выбраны из группы, состоящей из Pmc, Pbf, OtBu, Trt, Acm, mMt, tBu, Boc, ivDde, 2-CITrt, tButhio, Npys, Mts, NO2, Tos, OBzl, OcHx,Acm, pMeBzl, pMeOBz, OcHx, Bom, Dnp, 2-Cl-Z, Bzl, For и 2-Br-Z по выбору для данной боковой цепи. Стандартные и нестандартные аминокислоты и их защищенные варианты, а также способы снятия защитных групп хорошо известны. Многие из них приведены в каталоге Merck Novabiochem "Reagentsfor Peptide and High-Throughput Synthesis" (2006/7) (содержание которого полностью включено в настоящую заявку в виде ссылки). Одна из групп R3 и R4 может являться группой при возможно содержащей в качестве заместителя алкил, гетероалкил, арил, гетероарил, аралкил или гетероаралкил. Группы R3 и R4, обе, могут представлять собой водород. Если Z представляет собой -NH2, т.е. R3 и R4, обе, представляют собой водород, такая группа может находиться в защищенной форме. Защитная группа может быть выбрана из группы, состоящей из Fmoc,Boc, Ac, Bn и Z (или Cbz). Могут применяться другие защитные группы, такие как те, которые описаны ниже в части, касающейся защищннных форм. В предпочтительном случае R5 представляет собой водород. В предпочтительном случае Z представляет собой -NH2, аминокислоту или -NR5COR6. Если Z представляет собой -NR5COR6, предпочтительно R5 представляет собой водород и R6 представляет собой аралкильную группу, замещнную гидроксилом, в наиболее предпочтительном случае аралкильную группу, замещнную в алкильной части группы. R6 может являться -CH(OH)Ph (т.е. Z модифицирована остатком миндальной кислоты).R9 представляет собой предпочтительно группу, возможно содержащую заместитель, выбранный из алкила, гетероалкила, арила, гетероарила, аралкила и гетероалкила. Предпочтительными соединениями согласно первому аспекту настоящего изобретения являются перечисленные ниже соединения: соединение I: дезоксиактагардин В N-[2-этаноламино]монокарбоксамид; соединение II: дезоксиактагардин В N-[4-бутаноламино]монокарбоксамид; соединение III: актагардин N-[2-этаноламино]монокарбоксамид; соединение IV: дезоксиактагардин В (3-амино-1,2-пропандиол)монокарбоксамид; соединение V: дезоксиактагардин В (2-амино-1,3-пропанол)монокарбоксамид; соединение VI: дезоксиактагардин В [трис-(гидроксиметил)метиламино]монокарбоксамид; соединение VII: дезоксиактагардин В (1-амино-2-пропанол)монокарбоксамид; соединение VIII: дезоксиактагардин В (1-амино-3-пропанол)монокарбоксамид; соединение IX: (L)-фенилаланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение X: (L)-триптофанил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение X: (L)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение XII: (D)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид;(N,N-бис-(2-гидроксиэтил)этилендиамино)монокарбоксамид. Дополнительно или в качестве альтернативы предпочтительные соединения согласно первому аспекту настоящего изобретения могут быть выбраны из нижеперечисленных соединений: соединение XX: дезоксиактагардин В N-[2-гидрокси-2-фенилэтиламин]монокарбоксамид; соединение XXI: дезоксиактагардин В (L-серин метиловый эфир)монокарбоксамид; соединение XXII: дезоксиактагардин В (N-(2-гидроксиэтил)этилендиамин)монокарбоксамид; соединение XXIII: дезоксиактагардин В (2-гидроксипиперазин)монокарбоксамид. Дополнительно или альтернативно предпочтительные соединения согласно первому аспекту настоящего изобретения могут быть выбраны из нижеперечисленных соединений: соединение XXX: (L)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение XXXI: (D)-аланил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение XXXII: (L)-изолейцинил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение XXXIII: (L)-лейцинил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид; соединение XXXIV: N-фенилацетилдезоксиактагардин В (этаноламин)монокарбоксамид; соединение XXXV: N-ацетилдезоксиактагардин В (этаноламин)монокарбоксамид; Соединение XXXVI: N-манделилдезоксиактагардин В (этаноламин)монокарбоксамид. Наиболее предпочтительными соединениями являются: соединение I: дезоксиактагардин В N-[2-этаноламин]монокарбоксамид; соединение III: актагардин N-[2-этаноламино]монокарбоксамид. Наиболее предпочтительные соединения имеют улучшенную противомикробную активность по сравнению с соединениями актагардина и дезоксиактагардина В, из которых они получены. Настоящее изобретение также обеспечивает варианты, производные и предшественники соединений формулы (I). Их подробно обсуждают ниже. Варианты Вариант соединения формулы (I) включает соединение, в котором один или более, например от 1 до 5, например 1, 2, 3 или 4 аминокислот заменены другой аминокислотой. В предпочтительном варианте указанная аминокислота находится в положении, выбранном из положений 2, 3, 4, 5, 8, 10, 11, 13, 15, 16 или 18 соединения формулы (I). Замены могут представлять собой замену одной аминокислоты на другую аминокислоту, встречающуюся в природе, и могут быть консервативными или неконсервативными заменами. Консервативные замены включают замены, приведенные ниже в таблице, при которых аминокислоты одного и того же блока во второй колонке и предпочтительно на той же строке третьей колонки могут заменять друг друга: В качестве альтернативы аминокислота может быть заменена на одну из описанных выше модифицированных неприродных или редких природных аминокислот. Вариант соединения согласно настоящему изобретению включает соединение с одной или более поперечными сшивками, причем одна или более поперечных сшивок представляет собой мостик, не являющийся тиониновым мостиком. Альтернативные мостики включают, если это приемлемо, дисульфидные мостики и амидные и сложноэфирные мостики (так называемые макролактамные и макролактонные варианты соответственно). Производные Производные соединений согласно настоящему изобретению (включая варианты) представляют собой производные, в которых одна или более боковая цепь аминокислоты соединения согласно настоящему изобретению была модифицирована, например этерификацией, амидированием или окислением. Производные соединений согласно настоящему изобретению могут являться моноамидными производными по одной из карбоксильных функциональных группактагардина. Производное соединение может включать соединение, в которой карбоксильная функциональная группа боковой цепи внутреннего остатка, какого как Glu11, превращена из -СООН в группу -COOR10, в которой R10 представляет собой водород, (С 1-С 4)алкил или (С 1-С 4)алкокси(С 2-С 4)алкил. В качестве альтурнативы карбоксильная функциональная группа боковой цепи внутреннего остатка, например остатка Glu11, может быть превращена из -СООН в группу -CONR1R2, где R1 и R2 имеют значения, определенные выше для заместителей Сконцевого амида. Соединение (I) показано с поперечными сшивками: поперечная сшивка 1-6, лантионина (Ser-Cys); поперечная сшивка 7-12, бета-метиллантионина (Thr-Cys); и поперечная сшивка 9-17, бетаметиллантионина (Thr-Cys). В одном варианте реализации изобретения одна, две или три из этих поперечных сшивок могут являться тионинсульфоксидными поперечными сшивками. Другие формы Вышеупомянутые соединения и полипептиды-предшественники включают хорошо известные ионные формы, формы солей, сольватов и защищенные формы. Например, ссылки на карбоновую кислоту(-СООН) также включают анионную (карбоксилатную) форму (-СОО-), е соль или сольват, а также обычные защищенные формы. Аналогично, ссылка на аминогруппу включает е протонированную форму (-N+HR1R2), соль или сольват аминогруппы, например соль хлороводородной кислоты, а также обычные защищенные формы аминогруппы. Аналогично, ссылка на гидроксильную группу также включает е анионную форму (-О-), соль или сольват, а также традиционные защитные формы гидроксильной группы. Например, ссылка на карбоксилсодержащую боковую цепь глутаминовой кислоты (Glu), представляющей собой остаток в соединении согласно настоящему изобретению, включает е карбоксилатную форму. Если Z представляет собой -NH2, ссылка на эту группу включает протонированную форму данной аминогруппы. Изомеры, соли, сольваты, защищенные формы и пролекарства. Некоторые соединения могут существовать в одной или более конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, стереоизомерных, таутомерных, конформационных или аномерных форм, включая, но не ограничиваясь перечисляемыми, цис- и транс-формы; Е- и Zформы; с-, t- и r-формы; эндо- и экзо-формы; R-, S- и мезо-формы; D- и L-формы; d- и l-формы; (+)- и (-)формы; кето-, енольные и енолятные формы; син- и антиформы; синклинальные и антиклинальные формы; - и -формы; аксиальные и экваториальные формы; формы "лодки", "кресла", твист-формы, формы(или "изомерными формами"). Например, описанные в настоящем изобретении остатки аминокислот могут существовать в одной из конкретных стереоизомерных форм. Аналогично группы R1 и R2 могут существовать в одной из конкретных стереоизомерных форм, если такие формы существуют. Подобным образом группы R3 R4, R5,R6, R7, R8, R9 и R10 могут существовать в любой конкретной стереоизомерной форме, если такая форма существует. Если соединение или его полипептидный предшественник согласно настоящему изобретению включает остаток дигидроаминомасляной кислоты, данный остаток может существовать либо в цис-,либо в транс-форме. Если соединение находится в кристаллической форме, оно может существовать в разнообразных полиморфных формах. Следует отметить, что кроме обсуждаемых ниже таутомерных форм из понятия "изомеры", применяемого в настоящем изобретении, исключены структурные (или конституционные) изомеры (т.е. изомеры, которые различаются связями между атомами, а не просто расположением атомов в пространстве). Например, упоминание метоксигруппы, -ОСН 3, не следует толковать как упоминание его структурного изомера, гидроксиметильной группы, -СН 2 ОН. Аналогично, упоминание орто-хлорфенила не должно толковаться, как упоминание его структурного изомера, мета-хлорфенила. Однако ссылка на класс структур может включать структурные изомерные формы, входящие в этот класс (например, С 1-7 алкил включает н-пропил и изопропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и параметоксифенил). Вышеупомянутое исключение не относится к таутомерным формам, например кето-, енольным- и енолятным-формам, как, например, в следующих таутомерных парах: кетон/енол, имин/енамин,амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/ацинитро. Следует отметить, что в понятие "изомер" включено соединение с одним или более изотопов в качестве заместителей. Например, Н может иметь форму любого изотопа, включая 1 Н, 2 Н (D) и 3 Н (Т); С может иметь форму любого изотопа, включая 12 С, 13 С и 14 С; О может иметь форму любого изотопа,включая 16 О и 18 О и т.п. Если не указано другое, ссылка на конкретное соединение включает все такие изомерные формы,включая (полностью или частично) рацематы и другие их смеси. Способы приготовления (например,асимметрический синтез) и разделения (например, частичная кристаллизация и хроматографические средства) таких изомерных форм либо хорошо известны специалистам в данной области, либо легко могут быть получены путем адаптации способов, изложенных в настоящем изобретении, или известных способов, известным образом. Если не указано другое, ссылка на конкретное соединение также включает его ионные формы, формы солей, сольватов и защищенные формы, например, обсуждаемые ниже, а также различные полиморфные формы указанного соединения. Удобным или желательным может быть получение, очистка и/или обращение с соответствующей солью активного соединения, например фармацевтически приемлемой солью. Примеры фармацевтически приемлемых солей приводятся в Berge, et al., "Pharmaceutically Acceptable Salts ", J. Pharm. Sci., 66, 119 (1977). Например, если соединение является анионным или включает функциональную группу, которая может стать анионной (например, -СООН может быть превращена в анионную -СОО-), соль может быть образована с соответствующим катионом. Примеры приемлемых неорганических катионов включают, но не ограничиваются перечисленными, ионы щелочных металлов, такие как Na+ и K+, катионы щелочноземельных металлов, такие как Са 2+ и Mg2+, и другие катионы, такие как Al3+. Примеры приемлемых органических катионов включают, но не ограничиваются перечисленными, ион аммония (т.е. NH4+) и замещнные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами приемлемых замещнных ионов аммония являются ионы, являющиеся проиводными из: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислоты, такие как лизин и аргинин. Примером общераспространнной четвертичной соли аммония является N(CH3)4+. Если соединение является катионным или включает функциональную группу, которая может быть превращена в катионную (например, -NH2 может стать -NH3+), может быть образована соль с приемлемым анионом. Примеры приемлемых неорганических анионов включают, но не ограничиваются перечисленными, производные следующих неорганических кислот: хлористо-водородной, бромистоводородной, йодисто-водородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры приемлемых органических анионов включают, но не ограничиваются перечисленными, производные следующих органических кислот: уксусной, пропионовой, янтарной, гликолевой, стеариновой,пальмитиновой, молочной, малоновой, памоевой, винной, лимонной, глюконовой, аскорбиновой, малеиновой, гидроксималеиновой, фенилуксусной, глутаминовой, аспарагиновой, бензойной, коричной, пировиноградной, салициловой, сульфаниловой, 2-ацетоксибензойной, фумаровой, толуолсульфоновой, метансульфоновой, этансульфоновой, этандисульфоновой, щавелевой, изетионовой, валериановой и глюконовой. Примеры приемлемых полимерных анионов включают, но не ограничиваются перечисленными, производные следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы. Может оказаться удобным или желательным приготовить, очистить и/или использовать соответствующий сольват активного соединения. Термин "сольват" употребляется в настоящем изобретении в свом обычном значении и относится к комплексу растворнного вещества (например, соли активного соединения) и растворителя. Если растворителем является вода, сольват традиционно называют гидратом, например моногидратом, дигидратом, тригидратом и т.д. Может оказаться целесообразным приготовить, очистить и/или использовать активное соединение в химически защищенной форме. Понятие "химически защищенная форма" в настоящем описании имеет обычное химическое значение и относится к соединению, в котором одна или более реакционноспособных функциональных групп защищены от нежелательных химических реакций, т.е. эти группы существуют в виде защищенной или защитной группы (также известной под названием замаскированной или маскирующей группы или блокированной или блокирующей группы). Защита реакционноспособной функциональной группы позволяет проводить реакции, в которых задействованы незащищнные реакционноспособные функциональные группы, не затрагивая защищенную группу, защитная группа может быть удалена обычно на более поздней стадии, практически без влияния на остальную часть молекулы. См., например, Protective Groups in Organic Synthesis (Т. Green и Р. Wuts; 3rd Edition; John Wiley and Sons,1999). Например, аминогруппа может быть защищена, как ранее описано для Z, представляющего собой-NH2. Дополнительно аминогруппа может быть защищена в виде амида или уретана, например в виде метиламида (-NHCO-CH3); бензилоксиамида (-NHCO-OCH2C6H5, -NH-Cbz); трет-бутоксиамида (-NHCOОС(СН 3)3, -NH-Boc); 2-дифенил-2-пропоксиамида (-NHCO-OC(CH3)2C6H4C6H5, -NH-Bpoc), в виде 9 флуоренилметоксиамида (-NH-Fmoc), в виде 6-нитровератрилоксиамида (-NH-Nvoc), в виде 2 триметилсилилэтилоксиамида (-NH-Teoc), в виде 2,2,2-трихлорэтилоксиамида (-NH-Troc), в виде аллилоксиамида (-NH-Alloc), в виде 2(-фенилсульфонил)этилоксиамида (-NH-Psec) или, если это приемлемо,в виде нитроксида (N-O). Например, карбоксильная группа карбоновых кислот может быть защищена, как описано ранее для остатка аминокислоты. Например, карбоксильная группа карбоновой кислоты может быть защищена путем образования сложного эфира, например: С 1-7 алкилового эфира (например, метилового эфира; третбутилового эфира); C1-7 галогеналкилового эфира (например, С 1-7 тригалогеналкилового эфира); три-С 1-7 алкилсилил-C1-7 алкилового эфира или С 5-20 арил-С 1-7 алкилового эфира (например, бензилового эфира; нитробензилового эфира) или амида, например метиламида. Например, гидроксильная группа может быть защищена в форме эфирной (-OR) или сложноэфирной (-OC(=O)R) группы, например эфирной: трет-бутилэфирной; бензильной, бензгидрильной (дифенилметильной) или тритильной(трифенилметильной); триметилсилильной или третбутилдиметилметилсилильной или сложноэфирной ацетилированной (-ОС(=О)СН 3, -ОАс) группы. Например, альдегидная или кетонная группа может быть защищена путем превращения в ацеталь или кеталь соответственно, в которых карбонильная группа (С=О) превращена в диэфир (C(OR)2), посредством реакции, например, с первичным спиртом. Альдегидную или кетонную группу легко регенерировать гидролизом в большом избытке воды в присутствии кислоты. Может оказаться удобным или желательным приготовить, очистить и/или использовать соединение в форме пролекарства. Термин "пролекарство" в настоящем изобретении относится к соединению, которое в ходе метаболизма (например, in vivo) образует желаемое активное соединение. Обычно пролекарство является неактивным, или менее активным, чем желаемое активное соединение, но может обеспечить преимущества при обращении, введении или полезные метаболические свойства. Например, некоторые пролекарства представляют собой сложные эфиры активного соединения(например, физиологически приемлемого метаболически лабильного сложного эфира). В ходе метаболизма сложноэфирная группа (-C(=O)OR) расщепляется с образованием активного лекарственного средства. Некоторые сложные эфиры могут быть образованы посредством этерификации, например, карбоксильных групп (-СООН) исходного соединения, включающей, если это возможно, предварительную защиту любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим снятием защиты, если это необходимо. Примеры таких метаболически лабильных сложных эфиров включают, но не ограничиваются перечисленными, такие эфиры, в которых R представляет собой C1-20 алкил (например -Me, -Et); C1-7 аминоалкил (например аминоэтил; 2-(N,N-диэтиламино)этил; 2(4-морфолино)этил); и ацилокси-С 1-7 алкил (например, ацилоксиметил; ацилоксиэтил; например пивалоилоксиметил; ацетоксиметил; 1-ацетоксиэтил; 1-(1-метокси-1-метил)этилкарбонилоксиэтил; 1(бензоилокси)этил; изопропоксикарбонилоксиметил; 1-изопропоксикарбонилоксиэтил; циклогексилкарбонилоксиметил; 1-циклогексилкарбонилоксиэтил; циклогексилоксикарбонилоксиметил; 1 циклогексилоксикарбонилоксиэтил;(4-тетрагидропиранил)карбонилоксиметил и 1-(4 тетрагидропиранил)карбонилоксиэтил). Дополнительные приемлемые формы пролекарств включают фосфоновые и гликолевые соли. В частности, гидроксильные группы (-ОН), можно "встраивать" в фосфонатные пролекарства реакцией с хлордибензилфосфитом с образованием после гидрирования фосфонатной группы -О-Р(=О)(ОН)2. Эта группа при метаболизме отщепляется под действием ферментов фосфатаз с образованием активного лекарственного средства с гидроксилом. Также некоторые пролекарства под действием ферментов активируются с образованием активного соединения или соединения, которое после дополнительной химической реакции дает активное соединение. Например, пролекарство может быть производным углевода или другим конъюгатом с гликозидом или может быть сложноэфирным производным аминокислоты. Способы получения соединений согласно настоящему изобретению Авторами настоящего изобретения ранее были описаны способы получения соединений лантибиотиков, а также их производных, вариантов и предшественников. Имеется более ранняя родственная заявка тех же авторов PCT/GB2007/000138 (WO 2007/083112), находящаяся параллельно на рассмотрении, и содержание которой полностью включено в настоящее изобретение посредством ссылки. Соединения,указанные в данном документе, могут быть использованы в качестве исходных материалов для соединений, описанных в настоящем изобретении. В частности, настоящее изобретение ссылается на следующие разделы родственной заявки изобретателей, находящейся на рассмотрении: Конструкт экспрессии; Рекомбинантный вектор экспрессии; Кассеты экспрессии; Библиотеки экспрессии; Клетка-хозяин, включая "клетку-хозяина, продуцирующую лантибиотик" и "непродуцирующую клетку"; Получение соединений согласно настоящему изобретению и Примеры 1-4 и 7. Соединения, описанные в настоящем изобретении, можно применять в качестве исходных материалов для синтеза других соединений согласно настоящему изобретению. Соединения актагардина для применения согласно настоящему изобретению могут быть получены из известных аналогов актагардина. В предпочтительном случае соединения актагардина согласно настоящему изобретению получают из актагардина, актагардина В и дезоксиактагардина В. Данные лантибиотики можно рассматривать как "исходные лантибиотики" или "исходный материал для получения лантибиотиков". Соединение актагардина может быть получено путем экспрессии нуклеиновой кислоты, например в виде конструкта экспрессии, кодирующего полупептид-предшественник, введенного в рекомбинантном векторе экспрессии в клетку-хозяина, которая содержит соответствующий ген лантибиотика, такой как ген LanA, если это необходимо, вместе со связанными генами кластера, необходимыми для превращения полипептида-предшественника в аналог актагардина. Варианты соединения актагардина могут быть получены соответствующей модификацией гена LanA с применением способов, по существу известных специалистам в данной области. Ген LanO, который, как было показано, является частью актагардинового кластера генов, кодирует белок, ответственный за окисление дезоксиформы аналогов актагардина в актагардин, в котором Y представляет собой -S(O)-. Модификация этого гена может обеспечить образование производных соединений с альтернативной структурой поперечных сшивок. Модификация гена LanO также позволяет менять соотношения относительных уровней окисленной (Y=-S(O и восстановленных форм (Y=-S-), продуцируемых в клетке-хозяине. Считается, что ген LanM, который, как было показано, является частью актагардинового кластера генов, кодирует белок, необходимый для превращения полипептида-предшественника в аналог лантибиотика. Модулирование этого гена и других генов, кодирующих модифицикацию белков, может обеспечить продуцирование производных соединений с альтернативными структурами поперечных сшивок. Модулирование этих генов может также обеспечить продуцирование соединений, обладающих или сохраняющих последовательность аминокислот, присоединнных к N-концу аналога актагардина, такую как лидерная последовательность. Обычно соединения, продуцируемые культурой клеток, будут содержать на N-конце свободный амин (т.е. z представляет собой -NH2) и свободную карбоксильную группу в С-конце (т.е. X представляет собой -ОН). Эти концы можно дериватизировать, как будет подробно описано ниже. Если аналог актагардина содержит модифицированный N-конец, обычно в исходном материале N-конец будет представлять собой свободный амин. Следует принимать во внимание, что соединения, продуцируемые культурой клеток, могут содержать также модифицированный N-конец. Таким образом, соединение для использования в качестве исходного материала может представлять собой соединение, в котором Z представляет собой -NHR3, где R3 определено как для аналогов по формуле (I). В тех случаях, когда настоящее изобретение предусматривает использование соединений, полученных из актагардина, в качестве исходного материала, причем Х 1 и Х 2 представляют собой Leu и Val соответственно, в качестве клетки-хозяина может выступать A. liguriae NCIMB 41362 без какой-либо дополнительной модификации. Если клетки-хозяева продуцируют смесь аналогов исходного материала, например такие, в которыхY представляет собой -S- или -S(O)-, продукты можно выделить, применяя стандартную технологию разделения, например при посредстве ВЭЖХ (высокоэффективная жидкостная хроматография), например как описано в патенте США 6022851 для получения актагардина и Ala-актагардина. В зависимости от культуры клетки исходный материал для лантибиотика может быть выделен из клетки-хозяина немодифицированным. Выделенные и модифицированные соединения могут быть изготовлены в форме фармацевтической композиции, возможно в форме фармацевтически приемлемой соли. В качестве альтернативы, исходный материал для получения лантибиотиков или их предшественников, вариантов и производных, может быть получен посредством химического синтеза пептидов, например твердофазного синтеза пептидов (ТФСП). Эти технологии хорошо известны специалистам в данной области. Однако в предпочтительном случае исходный материал для изготовления лантибиотиков получают из культуры клеток. Соединения согласно настоящему изобретению могут быть представлены, по существу, в изолированной форме. Изолированными соединениями согласно настоящему изобретению будут считаться такие изолированные соединения, определнные выше, которые свободны или по существу свободны от связанного с ними материала, такого как полипептиды, из которых были получены данные соединения. Естественно, соединения могут быть изготовлены с разбавителями и вспомогательными веществами, но считаться изолированными практических целей. Соединение согласно настоящему изобретению также может находиться, по существу, в очищенной форме, что обычно относится к препарату, в котором более 90%, например 95, 98 или 99%, соединений представляют собой соединение согласно настоящему изобретению. Соединения согласно настоящему изобретению получают путм осуществления взаимодействия исходного материала для получения лантибиотиков, содержащих карбоксильный С-конец, 2-6-кратным молярным избытком соответствующей аминоалкильной или аминогетероалкильной группы, в приемлемом органическом растворителе, таком как диметилформамид, при температуре обычно между 0 С и комнатной температурой и в присутствии подходящего конденсирующего агента. Типичными примерами конденсирующих агентов являются производные карбодиимида, такие как дициклогексилкарбодиимид, фосфоазидаты, такие как DPPA (дифенилфосфорилазид) или сочетающие агенты на основе бензотриазола, такие как PyBop, HATU (гексафторфосфат 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3 тетраметилурония) или TBTU (тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония). Соединения согласно настоящему изобретению, в которых Z представляет собой аминокислоту или-NR5COR6, могут быть получены из материала для получения лантибиотиков, содержащего аминогруппу в N-конце, посредством реакции сочетания с соответствующей карбоновой кислотой в присутствии связывающего агента, такого как дициклогексилкарбодиимид, фосфоазидаты, такие как DPPA или сочетающие агенты на основе бензотриазола, такие как РуВор, HATU или TBTU. Для запуска реакции обычно используют органические аминооснования, такие как триэтиламин или диизопропилэтиламин. В альтернативном варианте в качестве реагентов для взаимодействия с N-концом лантабиотика можно использовать предварительно полученные активированные производные соответствующей кислоты, такие как пентафторфениловые эфиры. Для запуска реакции добавляют катализатор, такой какHOBt. Типичным растворителем является диметилформамид. Если карбоновая кислота, которую используют в реакции сочетания с лантибиотиком, дополнительно содержит функциональные группы, способные помешать реакции сочетания, могут применяться подходящие защитные группы, известные специалистам в данной области. Например, можно использовать защитные группы Fmoc или tBoc для аминокислотных производных, предназначенных для сочетания с N-концом лантибиотика. Соединения согласно настоящему изобретению, где Z представляет собой NR3R4, могут быть получены из лантибиотика, содержащего на N-конце аминогруппу, посредством реакции сочетания с альдегидом или кетоном в органическом растворителе, таком как дихлорметан, диметилсульфоксид или уксусная кислота в присутствии подходящего восстанавливающего агента, такого как боргидрид натрия или триацетоксиборгидрид натрия. Указанные восстанавливающие агенты можно применять в растворе или связанными с подходящей смолой, такой как полистирол. В зависимости от условий реакции, того,что используется: нетон или альдегид и соотношения реагентов, применяемых в реакции, можно получить как моно-, так и диалкилированный N-конец. В альтернативном варианте реакция может быть осуществлена в отсутствие восстанавливающего агента. В этом случае можно получать соединения согласно настоящему изобретению, где Z представляет собой -N=R9. Соединения согласно настоящему изобретению, где Z представляет собой -NR5C(O)OR6, -NR5SOR6,5-NR SO2R6, -NR5C(S)NR6R7 или -NR5C(NR8)NR6R7, можно получить из исходного материала для производства лантибиотиков с аминогруппой на N-конце посредством реакций сочетания, с соответствующим образом активированной группой замещаемого реагента. Так соединения, в которых Z представляет собой -NR5C(O)OR6, можно приготовить, применяя CIC(O)OR6 и т.п. Соединения, в которых Z представляет собой NR5SO2R6, могут дополнительно содержать функциональную группу, защищенную защитной группой. Защитная группа может быть удалена соответствующим образом после проведения реакции сочетания. Соединения согласно изобретению, в которых Z отличается от -NH2 (т.е. соединения, где R3 и R4 не являются водородом), могут быть получены из исходных материалов, модифицированных либо по С-,либо по N-концу. Затем может быть модифицирован другой конец с получением соединения согласно настоящему изобретению. Так последовательность замещений может или начинаться с модификации Nконца с последующей модификацией С-конца, или наоборот. Если возникают проблемы, связанные с региоселективностью, например, если заместитель на С-конце обладает свойствами, характерными для аминогруппы, может применяться подходящая стратегия защиты. Так исходный материал лантибиотика, в котором N-конец соединения представляет собой остаток аминокислоты, -NR3R4, -NR5COR6, -NR5C(O)OR6; -NR5SOR6, -NR5SO2R6, -NR5C(S)NR6R7,-NR5C(NR8)NR6R7 или -N=R9 (как было определено выше в настоящем описании по отношению к соединениям согласно настоящему изобретению), может эквивалентно сочетаться с аминоспиртами у С-конца. Авторы настоящего изобретения обнаружили, что в условиях реакции сочетания, применяемых для сочетания аминоспирта с карбоксилом С-конца исходного лантибиотика, может модифицироваться также карбоксильная группа в боковой цепи остатка аминокислоты, например глутаминовой кислоты. Соединения такого рода, в которых модификации подвергаются и С-конец, и боковая цепь, также входят в объем настоящего изобретения. Если была модифицирована боковая цепь аминокислоты, для того чтобы изменить количество полученного продукта, можно путем соответствующего изменения реакционных условий. В альтернативном варианте, для того чтобы обеспечить целостность боковой цепи, может применяться стратегия защиты и снятия защиты. Подходящие защитные группы для аминокислотных остатков боковой цепи хорошо известны и включают в себя вышеупомянутые защитные группы. Идентификацию продуктов реакции можно проводить, применяя ЖХ-МС (жидкостную хроматографию с масс-спектрометрическим детектором). За прохождением реакции можно следить посредством ВЭЖХ; см., например, фиг. 3. ВЭЖХ можно применять для отслеживания расхода исходного материала,появления продукта, а также побочных продуктов или продуктов разложения (если они появятся). Продукты и исходный материал можно анализировать методом ЯМР-спектроскопии. Соостветствующие технологии были ранее описаны авторами настоящего изобретения в PCT/GB2007/000138(WO 2007/083112). Структура соединения на основе лантибиотика может быть подтверждена с применением стандартных технологий, таких как COSY (двумерная корреляционная ЯМР), НМВС (гетероядерная корреляция многих связей), TOCSY (спектроскопия полной корреляции), HSQC (гетероядерная од- 18018841"Фармацевтически приемлемая соль" может являться солью присоединения кислоты, в которой основание сохраняет биологическую эффективность и свойства соединения и которая является фармацевтически приемлемой. Такие соли включают соли, образованные хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и т.п., и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфокислота, салициловая кислота и т.п. Соли также включают соли с основаниями, такие как соли щелочных или щелочно-земельных металлов. Дополнительно или в качестве альтернативы соли могут быть образованы с любым из соединений,такими как N-метил-D-глюкамин, L-аргинин, L-тирозин, холин и трис-(гидроксиметил)аминометан. Фармацевтические композиции Соединения согласно настоящему изобретению на основе лантибиотиков можно вводить в композиции с одним или более фармацевтически приемлемых ингредиентов, хорошо известных специалистам в данной области, включая, но не органичиваясь перичисленными, фармацевтически приемлемые носители, адъюванты, эксципиенты, разбавители, наполнители, буферные системы, консерванты, антиоксиданты, лубриканты, стабилизаторы, солюбилизаторы, сурфактанты (например, смачивающие агенты),маскирующие агенты, красители, ароматизаторы и подсластители. Композиция может дополнительно содержать другие активные агенты, например другие терапевтические или профилактические агенты. Так настоящее соединение дополнительно предлагает фармацевтические композиции, определнные выше, и способы, предусматривает получение фармацевтической композиции путм смешивания по меньшей мере одного активного соединения, определнного выше, с одним или более другими фармацевтическими приемлемыми ингредиентами, хорошо известными специалистам в данной области, например носителями, адъювантами, эксципиентами и т.д. При изготовлении в виде дискретных единиц(например, таблеток и т.д.) каждая единица содержит заранее определнное количество (дозу) активного соединения. Термин "фармацевтически приемлемый" в настоящем изобретении относится к соединениям, ингредиентам, материалам, композициям, лекарственнным формам и т.д., которые, как известно специалистам в области медицины, пригодны к применению в контакте с тканями субъекта (например, человека) и не обладают чрезмерной токсичностью, раздражающим действием, аллергической реакцией и не вызывают другие проблемы или осложнения, при сравнении разумным отношением польза/риск. Каждый носитель, адъювант, эксципиент и т.д. также должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции. Композиции могут быть изготовлены в форме, подходящей для любого приемлемого способа и средства введения. Фармацевтически приемлемые носители или разбавители включают таковые, применяющиеся в комположениях, пригодных для орального, ректального, назального, локального (включая буккальное и подъязычное), вагинального, парентерального (включая подкожное, внутримышечное, внутивенное, интрадермальное интратекальное, эпидуральное) введения. Композиции могут быть удобно представлены в дозированной лекарственной форме и могут быть получены любым способом, известным специалистам в области фармацевтики. Такие способы включают стадию приведения в контакт активного ингредиента с носителем, который содержит один или более вспомогательных ингредиентов. В целом композиции получены путем равномерного приведения в тесный контакт активного ингредиента с жидкими носителями или тонкоизмельчнными тврдыми носителями или теми и другими, и затем при необходимости формования продукта. В тврдых комположениях можно применять традиционные нетоксичные тврдые носители, например маннитол, лактозу, целлюлозу, производные целлюлозы, крахмал, стеарат магния, сахаринат натрия, тальк, глюкозу, сахарозу, карбонат магния, и т.п., все они - фармацевтического качества. Вышеуказанное активное соединение может быть изготовлено в форме суппозиториев, с применением в качестве носителя, например, полиалкиленгликоля, ацетилированных триглицеридов и т.п. Жидкие фармацевтические композиции, пригодные для введения могут быть, например, изготовлены путем растворения,диспергирования, и так далее, определнного выше активного соединения и возможно фармацевтических адъювантов в носителе, таком, например, как вода, водный раствор декстрозы, глицерин, этанол и т.п., с образованием раствора или суспензии. Если это желательно, фармацевтическая композиция, предназначенная для введения, может также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, буферные агенты для доведения рН, и т.п.,например ацетат натрия, монолаурат сорбита, натриевая соль триэтаноламиноацетата, триэтаноламиноолеат и т.д. Существующие способы приготовления таких лекарственных форм известны или станут очевидными специалистам в данной области; например, см. "Remington: The Science and Practice of Phar- 19018841macy", 20th Edition, 2000, pub. Lippincott, WilliamsWilkins. Композиция или лекарственная форма,предназначенные для введения, будут в любом случае содержать активное соединение(я) в количестве,эффективном для смягчения симптомов у субъекта, подвергаемого лечению. Могут быть получены лекарственные формы или композиции, содержащие активный ингредиент в диапазоне от 0,25 до 95%, добавляя для баланса нетоксичный носитель. Для орального введения изготавливают фармацевтически приемлемую нетоксичную композицию посредством добавления обычных наполнителей, таких, например, как маннитол, лактоза, целлюлоза,производные целлюлозы, кросскармелллоза натрия, крахмал, стеарат магния, сахаринат натрия, тальк,глюкоза, сахароза, карбонат магния и т.п. - все компоненты фармацевтического качества. Такие композиции могут иметь форму растворов, суспензий, таблеток, пилюль, капсул, порошков, форм замедленного высвобождения и т.п. Такие композиции могут содержать 1-95% активного ингредиента, более предпочтительно 2-50%, наиболее предпочтительно 5-8%. Парентеральное введение обычно осуществляют путем инъекции либо подкожной, либо внутремышечной, либо внутривенной. Инъекционные формы могут быть получены в традиционном виде, либо жидких растворов, либо суспензий, тврдых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией или в виде эмульсий. Дополнительно, если желательно вводимые фармацевтические композиции могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, агенты для доведения рН и т.п., таких как,например, ацетат натрия, монолаурат сорбита, триэтаноламиноолеат, натриевая соль триэтаноламиноацетата и т.д. Для местного применения фармацевтически приемлемые композиции могут быть изготовлены в форме подходящей мази или геля, содержащих активный компонент, суспендированный или растворнный в одном или более носителях. Носители для местного введения соединений согласно данному изобретению включают, но не ограничиваются перечисленными, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий парафин и воду. В альтернативном варианте, фармацевтически приемлемые композиции могут быть изготовлены в форме подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворнные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются перечисленными, минеральное масло, моностеарат сорбита,полисорбат 60, цетиловые эфиры парафина, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Процентное содержание активного соединения, содержащегося в такой композиции для парентерального или местного введения, в значительной степени зависит от его конкретной природы, а также от активности соединения и потребностей субъекта. Однако можно применять процентные содержания активного ингредиента от 0,1 до 10% мас./мас., причем указанные значения будут выше, если композиция представляет собой твердое вещество, которое разбавляют до указанных процентных содержаний. В предпочтительном случае в растворе будет содержаться от 0,2-2% мас./мас. активного агента в растворе. Дополнительные сведения, касающиеся подходящих носителей, адъювантов, наполнителей и т.д. можно найти в стандартных фармацевтических текстах, например, "Remington: The Science и Practice ofPharmacy", 20th Edition, 2000, pub. Lippincott, WilliamsWilkins и Handbook of Pharmaceutical Excipients,2nd edition, 1994. Введение соединений Соединения на основе лантибиотиков и композиции согласно настоящему изобретению можно вводить субъекту в рамках медицинского лечения или профилактики. Субъект может представлять собой животное или человека. Животное может быть млекопитающим или другим позвоночным. Таким образом, предлагается соединение согласно настоящему изобретению для применения у субъекта в способе его лечения или профилактики. Также предлагается применение соединения согласно настоящему изобретению для производства лекарственного средства для применения у субъекта в способе его лечения или профилактики. В частности, соединения согласно настоящему изобретению могут применяться для лечения у субъекта микробной, типично, бактериальной инфекции. Термин "микробная инфекция" относится к инвазии патогенных микробов в организм хозяинаживотного. Данный термин включает избыточный рост количества микробов, которые присутствуют в организме животного в нормальных условиях. В более общем смысле микробная инфекция может представлять собой ситуацию, в которой присутствие популяции(ий) микробов наносит вред хозяинуживотному. Таким образом, животное "страдает" от микробной инфекции, если избыточные количества популяции микробов присутствуют в организме или на теле животного, или если присутствие микробной популяции(ий) наносит вред клеткам или тканям животного. Инфекция может являться инфекцией желудочно-кишечного тракта, предпочтительно кишечника и в наиболее предпочтительном случае толстой кишки. В частности, в одном из аспектов настоящего изобретения предлагается способ лечения бактериальной инфекции. В предпочтительном случае инфекция является инфекцией Clostridium, предпочтительно инфекцией Clostridium perfringens, Clostridium difficile,- 20018841Clostridium tetani или Clostridium botulinum, в наиболее предпочтительном случае - инфекцией С. difficile. Эти способы предлагают новые и полезные альтернативы способам лечения с применением лантибиотиков типа А, ванкомицина или метронидазола. Бактериальная инфекция может являться инфекцией Enterococcus sp., Streptococcus spp., Staphylococcus spp. или Clostridium difficile. Настоящее изобретение также обеспечивает способ лечения заболевания, вызванного бактериальной инфекцией кишечника и в предпочтительном случае толстой кишки. Способ можно использовать для лечения псевдомембранозного колита или диареи, ассоциируемой с Clostridium difficile (CDAD). В предпочтительном случае инфекция является инфекцией Clostridium, предпочтительно инфекцией Clostridium perfringens, Clostridium difficile, Clostridium tetani или Clostridium botulinum, в наиболее предпочтительном случае инфекцией С. difficile. Настоящее изобретение также обеспечивает способ лечения или профилактики у субъекта, включающий стадию введения субъекту соединения или композиции согласно настоящему изобретению. В предпочтительном варианте соединение или композицию вводят орально. Настоящее изобретение также относится к лечению или профилактике инфекции Clostridium difficile, Helicobacter pylori или энтерококков, устойчивых к ванкомицину (VRE). В предпочтительном варианте изобретение относится к инфекции Clostridium difficile. Настоящее изобретение также относится к лечению инфекции, которая не была устранена путем лечения активным соединением, предпочтительно соединением, не являющимся лантибиотиком типа В. Другим активным соединением может являться ванкомицин. Если соединение согласно настоящему изобретению вводят инфицированному субъекту с инфекцией, которая не была устранена путем лечения другим активным соединением, лантибиотик типа В можно вводить через 1 сутки, 1 неделю или 1 месяц после введения другого активного соединения. Соединения и композиции также можно применять для системного лечения бактериемии (включая бактериемию, связанную с постановкой катетера), пневмонии, инфекции кожи и кожных структур(включая инфекцию в месте хирургии), эндокардита и остеомиелита. Эти и другие способы лечения могут быть направлены против болезнетворных агентов, таких как стафилококки, стрептококки, энтерококки. Соединения согласно настоящему изобретению или содержащие их композиции также можно использовать для местного лечения кожных инфекций, включая акне, т.е. Propionibacterium acnes. Соединения и содержащие их композиции также можно применять для лечения глазных инфекций, таких как конъюнктивит. Соединения также можно применять для лечения или предотвращения кожных инфекций в местах ран или ожогов. Кроме того, соединения и композиции, раскрытые в настоящем изобретении, можно применять в целях профилактики. Их можно применять у субъектов с риском инфекции (например, у пациентов, поступающих в клинику) или у здоровых медиков или другого персонала по уходу, подвергающемуся риску стать носителями таких инфекций. В наиболее предпочтительном случае соединения и композиции можно применять для лечения суперинфекции кишечника, вызываемой Clostridium difficile, включая полирезистентные С. difficile (псевдомембранозный колит). Соединение или композицию можно вводить орально. Также можно лечить инфекции кишечника, связанные с Helicobacter pylori. Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с ClostridiumDifficile, CDAD. Полное устранение симптомов CDAD к концу лечения можно принять опорожнение кишечника менее чем три раза в день (вне зависимости от того, являются ли каловые массы оформленными или неоформленными) при отсутствии сопутствующей лихорадки, повышенной концентрации лейкоцитов или боли в области живота. Способ лечения может касаться бактериальной инфекции, включая кожную инфекцию, инфекцию,относящуюся к слизистой оболочке, кишечную или системную инфекцию. Соединения согласно изобретению можно вводить энтерально (орально), парентерально (внутримышечно или внутривенно), ректально, вагинально или локально (местно). Соединения можно вводить в форме растворов, порошков (таблеток, капсул, включая микрокапсулы), мазей (кремов или гелей) или суппозиториев. Возможными вспомогательными веществами для композиций этого типа являются обычные в фармацевтической практике жидкие или тврдые наполнители и модификаторы, растворители, эмульгаторы, лубриканты, отдушки, красители и/или буферные вещества. В качестве подходящей дозы вводят 0,1-1000, предпочтительно 0,2-100 мг/кг массы тела. Введение можно осуществлять в лекарственной форме, содержащей, по меньшей мере, эффективное ежедневное количество соединений согласно изобретению, например 30-3000, предпочтительно 50-1000 мг. В предпочтительном варианте эффективное количество вводимого соединения составляет от около 100 до около 2000 мг на пациента ежедневно. Ниже со ссылками на прилагаемые графические материалы и исключительно с целью иллюстрации дополнительно подробно описана экспериментальная основа настоящего изобретения, включая наилучший способ осуществления. Синтез соединений на основе лантибиотиков Были получены нижеследующие соединения, в которых исходный лантибиотик и группы Х 1, Х 2, Z,и R1 и R2 имели следующий вид: Звздочка обозначает точку присоединения R1 к атому азота, который связан амидной связью с остатком аланина в положении 19. Также были получены нижеследующие соединения, в которых исходный лантибиотик и группы Х 1,Х 2, Z, R1 и R2 имели следующий вид: Получение соединений I-VIII, XVIII и XX-XXIII Общая методика 1. К раствору лантиобиотика (например, актагардина, актагардина В или дезоксиактагардина В) (200 мг, 108 нмоль), подходящего аминоспирта (330 нмоль) и диизопропилэтиламина (410 нмоль) в сухом диметилформамиде (2 мл) порциями добавляли раствор гексафторфосфата бензотриазол-1-ил-окси-триспирролидинофосфония (РуВор) (125 мг, 258 нмоль) в сухом диметилформамиде (1,5 мл). Для отслеживания хода реакции смесь исследовали методом ВЭЖХ, добавляя дополнительные аликвоты раствора РуВор до полного расходования исходного материала. Анализ посредством ВЭЖХ на этой стадии также показал присутствие различных количеств (5-20%) диамида (см. фиг. 3). После завершения реакции смесь разбавляли 30% ацетонитрилом в 20 мМ Kpi (фосфат калия) водного фосфатного буфера, рН 7 (10 мл) и моноамид очищали посредством препаративной ВЭЖХ в условиях, представленных в табл. 1. Нужные фракции концентрировали до 25% их первоначального объма и удаляли соли нанесением на предварительно кондиционированную колонку С 18 Bond Elut (500 мг), которую затем промывали, по- 22018841 следовательно элюируя двумя свободными объмами колонки 30, 40, 70 и 90% водного метанола. После упаривания соответствующих фракций целевые продукты были получены в виде белых тврдых веществ. Образцы проанализировали посредством ЖХ-МС в условиях, описанных ниже. Таблица 1 Условия препаративной ВЭЖХ для разделения лантиобиотика (например, актагардина,актагардина В или дезоксиактагардина В) и аминоспиртового дериватизированного продукта Соединение I: дезоксиактагардин В N-[2-этаноламин]монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и этаноламина согласно общей методике 1. Выход 18 мг, выход 85%. [М+2 Н 2+] рассчитано 979,0, найдено 980,2. Соединение II: дезоксиактагардин В N-[4-бутаноламино]. Был получен путем осуществления реакции сочетания дезоксиактагардина В и бутаноламина согласно общей методике 1. Выход 9 мг, 43%. [М+2 Н 2+] рассчитано 972,50, найдено 979,92. Соединение III: актагардин N-[2-этаноламин]монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и этаноламина согласно общей методике 1. Выход 11 мг, 53%. [М+2 Н 2+] рассчитано 966,5, найдено 966,1. Соединение IV: дезоксиактагардин В (3-амино-1,2-пропандиол)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и 3-амино-1,2 пропандиола согласно общей методике 1. Выход 18 мг, 87%. [М+2 Н 2+] рассчитано 973,5, найдено 973,9. Соединение V: дезоксиактагардин В (2-амино-1,3-пропанол)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и 2-амино-1,3 пропанола согласно общей методике 1. Выход 20 мг, 96% Выход. [М+2 Н 2+] рассчитано 973,5, найдено 973,9. Соединение VI: [трис-(гидроксиметил)метиламино]дезоксиактагардин В монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и трис(гидроксиметил)метиламина согласно общей методике 1. Выход 13 мг, 69% Выход. [М+2 Н 2+] рассчитано 988,5, найдено 988,6. Соединение VII: дезоксиактагардин В (1-амино-2-пропанол)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и 1-амино-2 пропанола согласно общей методике 1. Выход 16 мг, 78%. [М+2 Н 2+] рассчитано 965,5, найдено 965,6. Соединение VIII: дезоксиактагардин В (1-амино-3-пропанол)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и 1-амино-3 пропанола согласно общей методике 1. Выход 19 мг, 87%. [М+2 Н 2+] рассчитано 965,5, найдено 965,3. Соединение(N,N-бис-(2-гидроксиэтил)этилендиамино)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и N,N-бис-(2 гидроксиэтил)этилендиамина согласно общей методике 1. Выход 48%. [М+2 Н 2+] рассчитано 1002,0, найдено 1002,3. Соединение XX: дезоксиактагардин В N-[2-гидрокси-2-фенилэтиламино]монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и N-[2-гидрокси-2 фенилэтиламина] согласно общей методике 1. [M+2 Н 2+] рассчитано 995,5, найдено 995,8. Соединение XXI: дезоксиактагардин В (метиловый эфир L-серина)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и метилового эфира Lсерина согласно общей методике 1. [М+2 Н 2+] рассчитано 987,5, найдено 986,9. Соединение XXII: дезоксиактагардин В (N-(2-гидроксиэтил)этилендиамино)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и N-(2 гидроксиэтил)этилендиамина согласно общей методике 1. [М+2 Н 2+] рассчитано 980, найдено 979,8. Соединение XXIII: дезоксиактагардин В (2-гидроксипиперазино)монокарбоксамид. Был получен путем осуществления реакции сочетания дезоксиактагардина В и 2 гидроксипиперазина согласно общей методике 1. [М+2 Н 2+] рассчитано 978,5, найдено 977,7. Получение соединений IX и X. Общая методика 2 на примере (L)-триптофанил-(О)-дезоксиактагардин В(1 мл). Затем смесь добавляли к раствору дезоксиактагардина В (50 мг, 27 нмоль) в сухом диметилформамиде (0,5 мл). Смесь оставляли при комнатной температуре на 15 мин, по истечении этого времени весь исходный материал был израсходован. Добавляли воду (0,05 мл) и пиперидин (0,1 мл) и смесь оставляли при комнатной температуре на 1 ч. Реакционную смесь разбавляли 30% водным метанолом и полученную белую суспензию наносили на короткую колонку С 18 массой 1 г для твердофазной экстракции. Материал элюировали фракциями 40, 50, 60 и 70% водного метанола. Фракцию 60% упаривали досуха, получая тврдого вещество буроватого оттенка. Выход 35 мг (63%), [М+2 Н 2+] рассчитано 1030,0,найдено 1030,1. Соединение X: (L)-триптофанил-(O)-дезоксиактагардин В (этаноламин)монокарбоксамид. Был получен путем осуществления реакции сочетания (L)-триптофанил-(O)-дезоксиактагардина В(50 мг) и этаноламина согласно общей методике 1. Выход 23 мг, 45%. [М+2 Н 2+] рассчитано 1051,5, найдено 1051,8.(L)-Фенилаланил-(O)-дезоксиактагардин В. Был получен путем осуществления реакции сочетания дезоксиактагардина В и N-(9 флуренилметоксикарбонил)фенилаланин-О-пентафторфенилового эфира согласно общей методике 2. Выход 65%. [М+2 Н 2+] рассчитано 1010,5, найдено 1011,0. Соединение IX: (L)-фенилаланил-(O)-дезоксиактагардина В (этаноламин)монокарбоксамид. Был получен путем осуществления реакции сочетания (L)-фенилаланил-(O)-дезоксиактагардина В(50 мг) и этаноламина согласно общей методике 1. Выход 23 мг, 45%. [М+2 Н 2+] рассчитано 1032,0, найдено 1032,2. Соединения XI-XVIII и XXX-XXXVI могут быть получены аналогично вышеописанным способам. Высокоэффективная жидкостная хроматография. Анализы посредством ВЭЖХ проводили, применяя систему серии Hewlett Packard 1050 при нижеописанных параметрах: Высокоэффективная жидкостная хроматография с масс-спектрометрическим детектором (ВЭЖХМС). Анализы ВЭЖХ-МС проводили на хроматографе системы Hewlett Packard 1050 серии HPLC, связанном с Micro-mass Platform LC (управляемым программой MassLynx версия 3,5) при следующих параметрах: Колонка: Agilent Zorbax SB-C18 1504,6 мм 5 мкм Расход: 1 мл/мин. Подвижная фаза: А 10% ацетонитрила, 0,1% муравьиной кислоты 90% воды; В 90% ацетонитрила,0,1% муравьиной кислоты, 90% воды. Линейный градиент А в В через 10 мин, выдержка 1 мин, В-А. Длина волны: 200-400 нм. Объм инжекции: 10 мкл. Расщепление потока после колонки: 1:10. Масс-спектрометр: Micromass Platform LC. Способ: Ионизация электрораспылением, положительный. Расход азота: 380 л/ч. Напряжение на капилляре: 40 В. Смещение линзы сепаратора: 5 В. Пример 1. Растворимость аминоспиртовых производных. Обычно соединения согласно настоящему изобретению выделяли с применением фосфатных буферных смесей. Растворимость дезоксиактагардина В в воде по данным измерений составила 4,5 г/л, в то время как растворимость в воде соответствующего этаноламидного производного соединения I составила 15 г/л. Пример 2. Антимикробная активность аминоспиртовых производных. Соединения согласно настоящему изобретению демонстрируют антимикробную активность in vitro и in vivo. Наиболее активными они оказались против Enterococci spp., Streptococci spp. и Clostridium difficile (табл. 2-4A) и некоторые соединения демонстрируют повышенную активность, улучшенную по сравнению с исходным лантиобиотиком. Тест на восприимчивость для всех аэробных организмов за исключением Streptococcus pneumoniae проводили при двухкратном разбавлении в бульоне Мюллера-Хинтона, если не указано другое, дополненном 50 мкг/мл Са 2+. Испытание восприимчивости для S. pneumoniae проводили при двухкратном разбавлении в сердечно-мозговом бульоне, если не указано другое, дополненном 50 мкг/мл Са 2+. Активно растущие культуры в бульоне разбавляли до концентрации 105-106 CFU/мл (колониеобразующих единиц/мл, доводя OD600 (оптическую плотность при 600 нм) до 0,2-0,3). Их затем дополнительно разбавляли 1:100 в свежем стерильном бульоне. Испытания проводили в двойной повторности на стерильном планшете для микротитрования с 96 лунками при общем объме 200 мкл (160 мкл бульона, 20 мкл антимикробного агента, 20 мкл инокулята) в диапазоне концентраций от 64 до 0,06 мкг/мл. Планшеты инкубировали с доступом воздуха, со встряхиванием, в течение 18-20 ч при 37 С. Минимальную ингибирующую концентрацию (МИК) определяли как наименьшую концентрацию лекарственного средства, которое остановило видимый рост. Клинические штаммы Clostridium difficile испытали в анаэробном агареWilkins-Chalgren при анаэробных условиях. Во всех случаях в качестве референтного антибиотика применяли ванкомицин. Таблица 2 Значения МИК (мкг/мл) для актагардина, дезоксиактагардина В, ванкомицина и соединений I-VIII против панели общераспространнных патогенов В приведенной выше таблице Акта. обозначает Актагардин; Дезоксиакта. В обозначает дезоксиактагардин В; Ванк. обозначает Ванкомицин.
МПК / Метки
МПК: C07K 14/365, C07K 7/08
Метки: соединения, основе, обладающие, активностью, лантибиотиков, противомикробной
Код ссылки
<a href="https://eas.patents.su/30-18841-soedineniya-na-osnove-lantibiotikov-obladayushhie-protivomikrobnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения на основе лантибиотиков, обладающие противомикробной активностью</a>
Предыдущий патент: Рекомбинантная клетка-хозяин для получения соединения, представляющего интерес
Следующий патент: Способ байпасирования трубопровода в системе множества трубопроводов
Случайный патент: Фильтровальный узел для отбора проб