Ингибиторы активности akt
Номер патента: 18038
Опубликовано: 30.05.2013
Авторы: Роуз Миган Б., Пис Саймон, Ямасита Деннис С., Хирдинг Дирк А., Сифелд Марк Эндрю, Макналти Кеннет С.
Формула / Реферат
1. Соединение формулы (I)
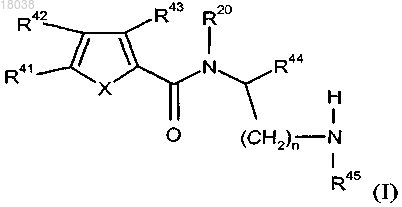
где R41 выбран из хлора, этила, метила и метокси;
R42 представляет собой
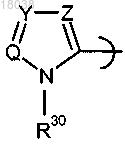
где Q представляет собой азот, Y представляет собой -СН- и Z представляет собой -C(R48)- и R30 выбран из метила и этила;
R48 выбран из водорода, метила, хлора и брома;
R43 представляет собой водород;
R44 представляет собой -СН2-фенил, где фенил замещен одним или двумя заместителями, выбранными из фтора и трифторметила;
R45 представляет собой водород;
R20 представляет собой водород;
X выбран из О и S;
n имеет значение 1;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, выбранное из следующих:
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-хлор-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-этил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(1,4-диметил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(1,4-диметил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-этил-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-этил-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-этил-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-хлор-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-хлор-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-бром-1-метил-1Н-пиразол-5-ил)-5-хлор-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-(метилокси)-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-(метилокси)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(2,5-дифторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-(метилокси)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-(метилокси)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-(метилокси)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-этил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-метил-4-(1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-4-(1,4-диметил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[2-(трифторметил)фенил]метил}этил)-5-хлор-4-(1-этил-4-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(1-этил-4-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(1-этил-4-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-((1S)-2-амино-1-{[3-(трифторметил)фенил]метил}этил)-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(4-фторфенил)метил]этил}-5-хлор-4-(1,4-диметил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-2-фуранкарбоксамид и
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-4-(4-хлор-1-этил-1Н-пиразол-5-ил)-5-метил-2-фуранкарбоксамид,
или его фармацевтически приемлемая соль.
3. Соединение по п.1, выбранное из следующих:
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид;
N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-5-метил-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид;
N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид,
или его фармацевтически приемлемая соль.
4. Соединение по п.1, представляющее собой N-{(1S)-2-амино-1-[(3-фторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-тиофенкарбоксамид, или его фармацевтически приемлемая соль.
5. Соединение по п.1, представляющее собой N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид, или его фармацевтически приемлемая соль.
6. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или облегчения тяжести заболевания или состояния, выбранного из рака и артрита.
7. Применение по п.6, где указанный рак выбран из рака головного мозга (глиомы), глиобластом, синдрома Bannayan-Zonana, болезни Коудена, болезни Lhermitte-Duclos, рака молочной железы, воспалительного рака молочной железы, опухоли Вильмса, саркомы Эвинга, рабдомиосаркомы, эпендиомы, медуллобластомы, рака толстой кишки, головы и шеи, почки, легкого, печени, меланомы, рака яичников, поджелудочной железы, предстательной железы, саркомы, остеосаркомы, гиганто-клеточной опухоли кости, рака щитовидной железы, лимфобластного Т-клеточного лейкоза, хронического миелогенного лейкоза, хронического лимфоцитарного лейкоза, волосисто-клеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого лимфобластного Т-клеточного лейкоза, плазмацитомы, иммунобластного крупно-клеточного лейкоза, мантийно-клеточного лейкоза, множественной миеломы, мегакариобластного лейкоза, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, уротелиального рака, рака вульвы, цервикального рака, рака эндометрия, рака мочеиспускательной системы, мезотелиомы, рака пищевода, рака слюной железы, гепатоцеллюлярного рака, рака желудка, назофарангеального рака, буккального рака, рака полости рта, GIST (желудочно-кишечной стромальной опухоли) и тестикулярного рака.
8. Применение по п.7, где указанный рак выбран из рака головного мозга (глиомы), глиобластом, синдрома Bannayan-Zonana, болезни Коудена, болезни Lhermitte-Duclos, рака молочной железы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, рака яичников, поджелудочной железы, предстательной железы, саркомы и рака щитовидной железы.
9. Фармацевтическая композиция, включающая соединение по любому из пп.1-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п.9, дополнительно включающая по меньшей мере одно противоопухолевое средство.
11. Фармацевтическая композиция по п.10, где по меньшей мере одно противоопухолевое средство выбрано из группы, по существу, состоящей из средств, направленных против организации микротрубочек, платиновых координационных комплексов, алкилирующих средств, антибиотиков, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и гормональных аналогов, ингибиторов путей сигнальной трансдукции; ингибиторов ангиогенеза, связанного с нерецепторными тирозиновыми киназами; иммунотерапевтических средств; проапоптических средств и ингибиторов передачи сигнала клеточного цикла.
Текст
Настоящее изобретение относится к новым гетероциклическим карбоксамидным соединениям формулы (I), фармацевтической композиции, содержащей эти соединения, применению таких соединений в качестве ингибиторов активности протеинкиназ В и для лечения рака и артрита.(71)(73) Заявитель и патентовладелец: СМИТКЛАЙН БИЧАМ КОРПОРЕЙШН (US) Область техники, к которой относится изобретение Настоящее изобретение относится к новым гетероциклическим карбоксамидным соединениям, к применению таких соединений в качестве ингибиторов активности протеинкиназы В (далее указана какPKB/Akt, PKB или Akt) и для лечения рака и артрита. Уровень техники Настоящее изобретение относится к гетероциклическим карбоксамидсодержащим соединениям, которые являются ингибиторами активности одной или нескольких изоформ сериновой/треониновой киназы, Akt (также известной как протеинкиназа В), является подходящим, когда соединения по настоящему изобретению являются ингибиторами активности всех трех изоформ сериновой/треониновой киназы,Akt. Настоящее изобретение также относится к фармацевтическим композициям, включающим такие соединения, и способам применения соединений по настоящему изоретению для лечения рака и артрита(Liu et al. Current Opin. Pharmacology 3:317-22 (2003. Апоптоз (программированная клеточная гибель) играет существенную роль в развитии эмбриона и патогенезе различных заболеваний, таких как дегенеративные нервные заболевания, сердечнососудистые заболевания и рак. Последние работы привели к идентификации различных про- и антиапоптических генных продуктов, которые участвуют в регуляции или осуществлении программированной клеточной гибели. Экспрессия антиапоптических генов, таких как Bcl2 или Bcl-xL, ингибирует апоптическую клеточную гибель, индуцируемую различными стимулами. С другой стороны, экспрессия проапоптических генов, таких как Вах или Bad, приводит к программированной клеточной гибели (Adams etal. Science, 281:1322-1326 (1998. Осуществление программированной клеточной гибели опосредовано протеиназами, родственными каспазе-1, включая каспазу-3, каспазу-7, каспазу-8, каспазу-9 и т.д. (Thornberry et al. Science, 281:1312-1316 (1998. Оказалось, что путь фосфатидилинозитол 3'-ОН киназы (PI3K)/Akt/PKB является важным для регуляции клеточного выживания/клеточной гибели (Kulik et al. Mol. Cell. Biol. 17:1595-1606 (1997); Franke et(1997); Dudek et al., Science, 275:661-665 (1997. Факторы выживания, такие как фактор роста, продуцируемый тромбоцитами (PDGF), фактор роста нервов (NGF) и инсулиноподобный фактор роста-1 (IGF-I),промотируют клеточное выживание в различных условиях, индуцируя активность PI3K (Kulik et al. 1997,Hemmings 1997). Активированная PI3K приводит к продукции фосфатидилинозитола (3,4,5)-трифосфата(Ptdlns (3,4,5)-P3), который, в свою очередь, связывается с и промотирует активацию, сериновой/треониновой киназы Akt, которая содержит плекстрин-гомологичный (РН) домен (Franke et al. Cell.,81:121-136 (1995); Hemmings Science, 277:534 (1997); Downward, Curr. Opin. Cell. Biol. 10:262-267 (1998),Alessi et al., EMBO J. 15: 6541-6551 (1996. Специфические ингибиторы PI3K или доминантные негативные Akt/PKB мутанты уничтожают промотирующую выживание активность этих факторов роста или цитокинов. Ранее было раскрыто, что ингибиторы PI3K (LY294002 или вортманнин) блокируют активацию Akt/PKB находящимися выше по направлению киназами. Кроме того, введение конститутивно активных PI3K или Akt/PKB мутантов промотирует клеточное выживание в условиях, в которых клетки обычно претерпевают апоптическую клеточную гибель (Kulik et al. 1997, Dudek et al. 1997). Анализ уровней Akt в опухолях у человека показал, что имеет место сверхэкспрессия Akt2 в значительном количестве случаев рака яичников (J.Q. Cheung et al. Proc. Natl. Acad. Sci. U.S.A. 89:9267-9271(1992 и поджелудочной железы (J.Q. Cheung et al. Proc. Natl. Acad. Sci. U.S.A. 93:3636-3641 (1996. Также было обнаружено, что сверхэкспрессия Akt3 имеет место в клеточных линиях рака молочной железы и предстательной железы (Nakatani et al. J. Biol. Chem. 274:21528-21532 (1999). Было продемонстрировано, что сверхэкспрессия Akt-2 имеет место в 12% случаев карцином яичников и что амплификация Akt особенно часто встречается в 50% недифференцированных опухолей, что говорит о том, что Akt также может быть связан с агрессивностью опухолей (Bellacosa et al., Int. J. Cancer, 64, pp. 280-285, 1995). Сообщалось о повышенной активности Akt1 киназы при раке молочной железы, яичников и предстательной железы (Sun et al. Am. J. Pathol. 159: 431-7 (2001. Супрессор опухоли PTEN, протеин- и липид-фосфатаза, который специфическим образом удаляет 3' фосфат из Ptdlns(3,4,5)-P3, является отрицательным регулятором PI3K/Akt пути (Li et al. Science 275:1943-1947 (1997), Stambolic et al. Cell. 95:29-39 (1998), Sun et al. Proc. Nati. Acad. Sci. U.S.A. 96:61996204 (1999. Мутации зародышевой линии PTEN являются ответственными за синдромы рака человека,такие как болезнь Коудена (Liaw et al. Nature Genetics 16:64-67 (1997. Делеция PTEN имеет место в большом проценте опухолей человека, и опухолевые клеточные линии без функционального PTEN демонстрируют повышенные уровни активированной Akt (Li et al. supra, Guldberg et al. Cancer Research 57:3660-3663 (1997), Risinger et al. Cancer Research 57:4736-4738 (1997. Эти наблюдения показывают, что PI3K/Akt пути играют важную роль в регуляции клеточного выживания или апоптоза в онкогенезе. Были идентифицированы три члена субсемейства Akt/PKB сериновых/треониновых протеинкиназ,регулируемых вторичным мессенджером, и названы Akt1/PKB, Akt2/PKB и Akt3/PKB соответственно. Эти изоформы являются гомологичными особенно в областях, кодирующих каталитические домены.Akt/PKBs активируются событиями фосфорилирования, происходящими в ответ на передачу сигналаPI3K. PI3K фосфорилирует мембранные инозитолфосфолипиды, образуя вторичные мессенджеры фосфатидилинозитол 3,4,5-трисфосфат и фосфатидилинозитол 3,4-бисфосфат, которые, как было показано,связываются с РН доменом в Akt/PKB. Существующая модель Akt/PKB активации предполагает рекрутмент фермента к мембране посредством 3'-фосфорилированных фосфоинозитидов, где происходит фосфорилирование регуляторных сайтов Akt/PKB под действием находящихся выше киназ (В.А. Hemmings,Science 275:628-630 (1997); В.A. Hemmings, Science 276:534 (1997); J. Downward, Science 279:673-674(1998. Фосфорилирование Akt1/PKB происходит на двух регуляторных сайтах, Thr308 в петле активации каталитического домена и по Ser473 близко от карбоксиконца (D.R. Alessi et al. EMBO J. 15:6541-6551(1996) и R. Meier et al. J. Biol. Chem. 272:30491-30497 (1997. Эквивалентные регуляторные сайты фосфорилирования присутствуют в Akt2/PKB и Akt3/PKB. Действующая по направлению выше киназа,которая фосфорилирует Akt/PKB в сайте петли активации, была клонирована и названа 3'фосфоинозитидзависимая протеинкиназа 1 (PDK1). PDK1 фосфорилирует не только Akt/PKB, но также р 70 рибосомальную S6 киназу, p90RSK, сывороточную и глюкокортикоидрегулируемую киназу (SGK) и протеинкиназу С. Фосфорилирование действующей выше по направлению киназой регуляторного сайтаAkt/PKB около карбоксиконца пока еще не было идентифицировано, но последние сообщения предполагают роль интегринсвязанной киназы (ILK-1), сериновой/треониновой протеинкиназы или автофосфорилирование. Ингибирование активации и активности Akt может быть достигнуто путем ингибирования PI3K ингибиторами, такими как LY294002 и вортманнин. Однако ингибирование PI3K потенциально может неизбирательно влиять не только на три Akt изофермента, но также на другие РН доменсодержащие сигнальные молекулы, которые являются зависимыми от Pdtlns(3,4,5)-P3, такие как Тес семейство тирозиновых киназ. Кроме того, сообщалось, что Akt может активироваться ростовыми сигналами, которые являются независимыми от PI3K. Альтернативно, активность Akt можно ингибировать блокированием активности действующей по направлению выше киназы PDK1. Соединение UCN-01, как сообщалось, является ингибитором PDK1(Biochem. J. 375(2):255 (2003. И опять ингибирование PDK1 приведет к ингибированию нескольких протеинкиназ, активность которых зависит от PDK1, таких как атипичные PKC изоформы, SGK и S6 киназы (Williams et al. Curr. Biol. 10:439-448 (2000. Малые молекулы-ингибиторы Akt являются полезными для лечения опухолей, особенно опухолей с активированной Akt (например, опухолей с отсутствием PTEN и опухолей с ras мутациями). PTEN является критическим отрицательным регулятором Akt, и его функция утрачивается во многих типах рака,включая карциномы молочной железы и предстательной железы, глиобластомы и некоторые раковые синдромы, включая синдром Bannayan-Zonana (Maehama, Т. et al. Annual Review of Biochemistry, 70: 247Current Opinion in Neurobiology, 12(5): 516 (2002. Akt3 активируется в типах рака молочной железы с дефицитом рецепторов эстрогена и клеточных линиях андрогеннезависимого рака предстательной железы, а сверхэкспрессия Akt2 имеет место в карциномах поджелудочной железы и яичников. Akt1 амплифицируется в различных типах рака желудка (Staal, Proc. Natl. Acad. Sci. USA 84: 5034-7 (1987), и его повышающая регуляция имеет место в различных типах рака молочной железы (Stal et al. Breast CancerRes. 5: R37-R44 (2003. Поэтому ожидается, что малая молекула-ингибитор Akt будет полезной для лечения этих типов рака, а также других типов рака. Ингибиторы Akt также являются полезными в сочетании с другими химиотерапевтическими и противораковыми средствами. Целью настоящего изобретение является предоставление новых соединений, которые являются ингибиторами Akt/PKB. Также целью настоящего изобретение является предоставление фармацевтических композиций, которые включают фармацевтический носитель и соединения по настоящему изобретению. Сущность изобретения Настоящее изобретение относится к новым соединениям формулы (I)R30 выбран из метила и этила,R48 выбран из водорода, метила, хлора и брома;R44 представляет собой -СН 2-фенил, где фенил замещен одним или двумя заместителями, выбранными из фтора и трифторметила;n имеет значение 1; и/или их фармацевтически приемлемым солям. Настоящее изобретение также относится к открытию, что соединения формулы (I) являются активными в качестве ингибиторов Akt/PKB. Настоящее изобретение включает фармацевтические композиции, которые включают фармацевтический носитель и соединения по настоящему изобретению. Подробное описание изобретения Настоящее изобретение относится к соединениям формулы (I), описанной выше. Соединения формулы (I) по настоящему изобретению ингибируют активность Akt/PKB. В частности, соединения, раскрываемые в настоящей заявке, ингибируют каждую из трех Akt/PKB изоформ. Включены те соединения формулы (I) по настоящему изобретению, в которыхR30 выбран из метила и этила,R48 выбран из водорода, метила, хлора и брома;R44 представляет собой -СН 2-фенил, где фенил замещен одним или двумя заместителями, выбранными из фтора и трифторметила;n имеет значение 1; и/или их фармацевтически приемлемые соли. Из соединений, полезных в настоящем изобретении, включены следующие соединения:N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-4-(4-хлор-1-этил-1 Н-пиразол-5-ил)-5-метил-2 фуранкарбоксамид и/или их фармацевтически приемлемые соли. Соединения формулы (I) включены в фармацевтические композиции по настоящему изобретению. Некоторые из соединений, описанных в настоящей заявке, могут содержать один или несколько хиральных атомов или же иным образом могут быть способными к существованию в виде двух энантиомеров. Соответственно, соединения по настоящему изобретению включают смеси энантиомеров, а также очищенные энантиомеры или энантиомерно обогащенные смеси. Также должно быть понятно, что все таутомеры и смеси таутомеров включены в объем соединений формулы (I). Некоторые соединения, описанные в настоящей заявке, могут образовывать сольват, который, как это известно, представляет собой комплекс различной стехиометрии, образованный растворенным веществом (в настоящем изобретении это соединение формулы I и его соль) и растворителем. Такие растворители в целях настоящего изобретения не оказывают влияния на биологическую активность растворенного вещества. Примеры подходящих растворителей включают, но не ограничиваются этим, воду, метанол, этанол и уксусную кислоту. Предпочтительно используемый растворитель является фармацевтиче-6 018038 ски приемлемым растворителем. Примеры подходящих фармацевтически приемлемых растворителей включают, без ограничения, воду, этанол и уксусную кислоту. Наиболее предпочтительно используемый растворитель представляет собой воду. Под термином "арил" и его производными, используется ли он отдельно или как часть более крупного фрагмента, как в "-(СН 2)mариле", как он используется в настоящей заявке, если не указано иное,подразумеваются моноциклические, бициклические и трициклические кольцевые системы, содержащие в целом от 5 до 14 кольцевых членов, где по меньшей мере одна кольцевая система является ароматической и где каждое кольцо в системе содержит от 3 до 7 членов, такие как фенил, нафталин, тетрагидронафталин и бифенил. Соответственно, под термином "арил" подразумевается моноциклическая ароматическая кольцевая система, содержащая в целом от 5 до 7 кольцевых членов. Под термином "гетероарил" и его производными, используется ли он отдельно или как часть более крупного фрагмента, как в "-(СН 2)mгетероариле", как он используется в настоящей заявке, если не указано иное, подразумевается циклическое ароматическое кольцо, содержащее от 3 до 7 атомов углерода и содержащее от 1 до 3 гетероатомов, при условии, что когда количество атомов углерода составляет 3,ароматическое кольцо содержит по меньшей мере 2 гетероатома. Примеры "гетероарильных" групп включают пиридин и индол. Под термином "циклоалкил" и его производными, используется ли он отдельно или как часть более крупного фрагмента, как в "-(СН 2)mциклоалкиле", как он используется в настоящей заявке, если не указано иное, подразумевается неароматическое циклическое углеводородное кольцо, содержащее от 3 до 7 атомов углерода. Примеры "циклоалкильных" групп включают циклопропил, циклобутил, циклопентил и циклогексил. Под термином "гетероциклоалкил" и его производными, используется ли он отдельно или как часть более крупного фрагмента, как в "-(СН 2)mгетероциклоалкиле", как он используется в настоящей заявке,если не указано иное, подразумевается неароматическое циклическое углеводородное кольцо, содержащее от 3 до 6 атомов углерода и содержащее 1 или 2 гетероатома. Примеры "циклоалкильных" групп включают пиперазин и пирролидин. Под термином "С 5-С 12 арил", используется ли он отдельно или как часть более крупного фрагмента,как в "-(СН 2)mC5-С 12 ариле", как он используется в настоящей заявке, подразумевается ароматическая группа, выбранная из фенила, нафталина, тетрагидронафталина и бифенила. Термин "замещенный", как он используется в настоящей заявке, если не указано иное, подразумевает, что химический фрагмент, о котором идет речь, содержит от 1 до 5 заместителей, соответственно от 1 до 3 заместителей, выбранных из группы, состоящей из -CO2R20, С 1-С 4 алкила, гидроксиС 1-С 4 алкила, С 1 С 4 алкилокси, амино, C1-С 4 алкиламино, аминоС 1-С 4 алкила, диС 1-С 4 алкиламино, гидрокси, нитро, тетразола,циано, оксо, галогена и трифторметила, где R20 выбран из водорода, С 1-С 4 алкила и трифторметила. Соответственно, термин "замещенный", как он используется в настоящей заявке, подразумевает,что химический фрагмент, о котором идет речь, содержит от 1 до 3 заместителей, выбранных из группы,состоящей из С 1-С 4 алкила, гидроксиС 1-С 4 алкила, С 1-С 4 алкилокси, амино, С 1-С 4 алкиламино, аминоС 1 С 4 алкила, гидрокси, тетразола, галогена и трифторметила. Соответственно, термин "замещенный", как он используется в настоящей заявке, подразумевает,что химический фрагмент, о котором идет речь, содержит от 1 до 3 заместителей, выбранных из группы,состоящей из галогена и трифторметила. Под термином "гетероатом", как он используется в настоящей заявке, подразумевается кислород,азот или сера. Под термином "галоген", как он используется в настоящей заявке, подразумевается заместитель,выбранный из бромида, иодида, хлорида и фторида. Под термином "алкил" и его производными и во всех углеродных цепях, как это используется в настоящей заявке, включая алкильные цепи, определенные под термином "-(СН 2)n", "-(СН 2)m" и т.п., подразумевается линейная или разветвленная, насыщенная или ненасыщенная углеводородная цепь, и, если не указано иное, углеродная цепь содержит от 1 до 12 атомов углерода. Примеры алкила, как он используется в настоящей заявке, включают -СН 3, -СН 2-СН 3, -СН 2-СН 2-СН 3, -СН(СН 3)2, -СН 2-СН 2-С(СН 3)3,-СС(СН 3)3, -С(СН 3)3, -(СН 2)3-СН 3, -СН 2-СН(СН 3)2, -СН(СН 3)-СН 2-СН 3, -СН=СН 2 и -С=С-СН 3. Под термином "лечение" и его производными, как это используется в настоящей заявке, подразумевается профилактическое и терапевтическое лечение. Профилактическое лечение является подходящим,например, когда считается, что субъект подвержен высокому риску развития рака, или когда субъект подвергался воздействию канцерогена. Как он используется в настоящей заявке, термин "эффективное количество" и его производные означает такое количество лекарственного или фармацевтического средства, которое вызывает биологичесий или медицинский ответ ткани, системы, животного или человека, которого добивается, например,исследователь или клиницист. Кроме того, термин "терапевтически эффективное количество" и его производные означает любое количество, которое по сравнению с соответствующим субъектом, который не получал такое количество, приводит к улучшению лечения, исцеления, профилактики или облегчения заболевания, расстройства или побочного эффекта или снижению скорости развития заболевания или расстройства. Термин также охватывает количества, эффективные для усиления нормальной физиологической функции. Соединения формулы (I) включены в фармацевтические композиции по настоящему изобретению и используются в способах по настоящему изобретению. Когда присутствует группа -СООН или -ОН,можно использовать фармацевтически приемлемые сложные эфиры, например метиловый, этиловый,пивалоилоксиметиловый и подобные для -СООН, и ацетат, малеат и подобные для -ОН, и такие сложные эфиры известны из уровня техники для модификации характеристик растворимости или гидролиза, для использования в качестве композиций замедленного высвобождения или композиций пролекарств. Фармацевтически приемлемые соли соединений по настоящему изобретению могут быть легко получены специалистами в данной области. Новые соединения формул (I), (АА), (ВВ) и (СС), в основном, получают, как показано на схемах 1-3 ниже, или аналогичными способами, при условии, что X и 'R' заместители в формулах (I), (АА), (ВВ) и(СС), соответственно, не включают какие-либо из этих заместителей, которые мешают работе способов в соответствии с любой из схем 1-3. Все исходные вещества являются коммерчески доступными или могут быть легко получены из коммерчески доступных исходных веществ специалистами в данной области. Общие схемы Схема 1 Реагенты: (а) фталимид, PPh3, DEAD, ТГФ, комнатная температура; (b) NH2NH2, МеОН, 50 С. Аминоспирт (1-1) подвергали взаимодействию в условиях реакции Мицунобу с получением дифференциально защищенного диамина (1-2). Реакции Мицунобу хорошо известны специалистам в области органического синтеза. Способы и реакционные условия для таких преобразований обсуждаются в Synthesis 1981, 1-28. Селективное удаление фталимидной защитной группы в соединении (1-2) с использованием нуклеофильного амина, такого как гидразин или метиламин, в полярном растворителе, таком как метанол, давало амин (1-3). Многие разнообразные защитные группы являются доступными для специалистов в данной области, и их можно использовать в настоящем изобретении, при условии, что они не препятствуют осуществлению способов, описанных в настоящей заявке. Способы защиты аминов описаны в стандартных справочниках, таких как Greene "Protective Groups in Organic Synthesis" (опубликован Реагенты: (a) PyBrop, (i-Pr)2NEt, 1,1-диметилэтил (2-амино-3-фенилпропил)карбамат, DCM, комнатная температура; (b) 5-(5,5-диметил-1,3,2-диоксаборинан-2-ил)-1-метил-1 Н-пиразол, K2CO3,Pd(PPh3)4, диоксан/Н 2 О; (с) TFA/DCM, комнатная температура. Карбоновую кислоту (II-1) подвергали взаимодействию с 1,1-диметилэтил (2-амино-3 фенилпропил)карбаматом с получением амида (II-2). Различные амидные связывающие реагенты, такие как EDC, PyBrop и т.д., являются коммерчески доступными. Реакции амидного связывания обычно осуществляют в растворителях, таких как DCM или ДМФА, с использованием органического основания,такого Et3N или (i-Pr)2NEt. Дибромид (II-2) подвергали региоселективной реакции сочетания с 1,1 диметилэтил (2-[(4,5-дибром-2-фуранил)карбонил]амино-3-фенилпропил)карбаматом с использованием процедуры сочетания по методу Сузуки. Реакции сочетания по методу Сузуки типично осуществляют с использованием палладиевого(0) катализатора, такого как Pd(PPh3)4, с неорганическим основанием,например K2CO3, Na2CO3 или K3PO4, в водной смеси, содержащей эфирные растворители, такие какDME, диоксан или ТГФ. Способы опосредованных палладием сочетаний описаны в стандартных справочниках, таких как Schlosser "Organometallics in Synthesis" (опубликован Wiley and Sons). Кислотная обработка соединения II-3 с использованием HCl или TFA для удаления защитной группы Boc давала амин (II-4). Множество различных зищитных групп доступно для специалистов в данной области, и их можно использовать в настоящем изобретении при условии, что они не препятствуют осуществлению способов, описанных в настоящей заявке. Способы защиты аминов описаны в стандартных справочниках, таких как Greene "Protective Groups in Organic Synthesis" (опубликован Wiley-Interscience). Схема 3 Реагенты: (а) МеОН, H2SO4, 60C; (b) AlCl3, Br2, CHCl3; (с) 5-(5,5-диметил-1,3,2-диоксаборинан-2 ил)-1-метил-1 Н-пиразол, K2CO3, Pd2(t-Bu)3, диоксан/Н 2 О, 70 С; (d) NCS, ТГФ, 70 С; (e) 6M NaOH,ТГФ/МеОН, 50 С; (f) PyBrop, (i-Pr)2NEt, 2-(2S)-2-амино-3-[2-(трифторметил)фенил]пропил-1 Низоиндол-1,3(2 Н)-дион, DCM, комнатная температура; (g) NH2NH2, ТГФ/МеОН, комнатная температура. Карбоновую кислоту (III-1) подвергали этерификации в стандартных условиях этерификации по методу Фишера и затем селективному галогенированию с использованием кислоты Льюиса с получением (III-2). Дигалогенированный сложный эфир подвергали селективному сочетанию с 5-(5,5-диметил 1,3,2-диоксаборинан-2-ил)-1-метил-1 Н-пиразолом с использованием химии сочетания по методу Сузуки с получением (III-3). Реакции сочетания по методу Сузуки типично осуществляют с использованием палладиевого(0) катализатора, такого как Pd(PPh3)4, с неорганическим основанием, например K2CO3,Na2CO3 или K3PO4, в водной смеси, содержащей эфирные растворители, такие как DME, диоксан или ТГФ. Способы опосредованных палладием сочетаний описаны в стандартных справочниках, таких какSchlosser "Organometallics in Synthesis" (опубликован Wiley and Sons). Сложный эфир (III-3) подвергали реакции хлорирования с использованием NCS и in situ омыления с использованием водного раствораNaOH. Полученную карбоновую кислоту (III-4) подвергали сочетанию с 2-(2S)-2-амино-3-[2(трифторметил)фенил]пропил-1 Н-изоиндол-1,3(2 Н)-дионом с получением амида (III-5). Различные амидные связывающие реагенты, такие как EDC, PyBrop и т.д., являются коммерчески доступными. Реакции амидного связывания обычно осуществляют в растворителях, таких как DCM или ДМФА, с использованием органического основания, такого Et3N или (i-Pr)2NEt. Амид (III-5) подвергали реакции удаления защиты с использованием гидразина с получением амина (III-6). Множество различных зищитных групп доступно для специалистов в данной области, и их можно использовать в настоящем изобретении, при условии, что они не препятствуют осуществлению способов, описанных в настоящей заявке. Способы защиты аминов описаны в стандартных справочниках, таких как Greene "Protective Groups inOrganic Synthesis" (опубликован Wiley-Interscience). Под термином "совместное введение" и его производными, как это используется в настоящей заявке, подразумевается либо одновременное введение, либо любое отдельное последовательное введение ингибирующего АКТ соединения, описанного в настоящей заявке, и дополнительного активного ингредиента или ингредиентов, известных как полезные для лечения рака, включая химиотерапию и радиационную терапию, или как полезные для лечения артрита. Термин "дополнительный активный ингредиент или ингредиенты", как он используется в настоящей заявке, включает любое соединение или терапевтическое средство, известное как демонстрирующее, или которое демонстрирует выгодные свойства при введении пациенту, нуждающемуся в лечении рака или артрита. Предпочтительно, если введение не является одновременным, соединения вводят с небольшими промежутками времени между их введениями. Кроме того, не имеет значения, вводят ли соединения в одной лекарственной форме или нет, например одно соединение можно вводить местным путем, а другое соединение можно вводить перорально. Типично, любое противоопухолевое средство, которое обладает активностью против подлежащей лечению опухоли, поддающейся такому лечению, можно использовать для совместного введения для лечения рака в настоящем изобретении. Примеры таких средств можно найти в Cancer Principles andPractice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott WilliamsWilkins Publishers. Специалист в данной области сможет определить, какие комбинации средств будут полезными, исходя из конкретных характеристик лекарственных средств и типа рака. Типичные противоопухолевые средства, полезные в настоящем изобретении, включают, но не ограничиваются этим, средства, направленные против организации микротрубочек, такие как дитерпеноиды и алкалоиды барвинка; платиновые координационные комплексы; алкилирующие средства, такие как азотный иприт,оксазафосфорины, алкилсульфонаты, соединения нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как пуриновые и пиримидиновые аналоги, и антифолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы пути сигнальной трансдукции; ингибиторами ангиогенеза, связанного с нерецепторными тирозиновыми киназами; иммунотерапевтические средства; проапоптотические средства; и ингибиторы передачи сигнала клеточного цикла. Примерами дополнительного активного ингредиента или ингредиентов (противоопухолевое средство) для использования в сочетании или для совместного введения с ингибирующими АКТ соединениями по настоящему изобретению являются химиотерапевтические средства. Средства против организации микротрубочек или антимитотические средства представляют собой фаза-специфические средства, активные против микротрубочек опухолевых клеток в фазе М или митоза клеточного цикла. Примеры средств, направленных против организации микротрубочек, включают, но не ограничиваются этим, дитерпеноиды и алкалоиды барвинка. Дитерпеноиды, которые выделяют из природных источников, представляют собой фазаспецифические противораковые средства, которые действуют в фазах G2/M клеточного цикла. Считается, что дитерпеноиды стабилизируют -тубулиновую субъединицу микротрубочек путем связывания с этим белком. Разрушение структуры белка, по-видимому, затем ингибируется с остановкой митоза и следующей за этим клеточной гибелью. Примеры дитерпеноидов включают, но не ограничиваются этим,паклитаксел и его аналог доцетаксел. Паклитаксел, 5,20-эпокси-1,2,4,7,10,13-гекса-идрокситакс-11-ен-9-он 4,10-диацетат 2-бензоат 13-эфир с (2R,3S)-N-бензоил-3-фенилизосерином, представляет собой природный дитерпеновый продукт, выделенный из тихоокеанского тисового дерева Taxus brevifolia, и является коммерчески доступным в виде раствора для инъекций TAXOL. Он является членом таксанового семейства терпенов. Он был впервые выделен в 1971 г. Wani et al. J. Am. Chem, Soc, 93:2325. 1971), которые охарактеризовали его структуру химическими методами и методами рентгеновской кристаллографии. Один механизм его активности относится к способности паклитаксела связываться с тубулином, ингибируя, таким образом,рост раковых клеток. Schiff et al., Proc. Natl, Acad, Sci. USA, 77:1561-1565 (1980); Schiff et al., Nature,277:665-667 (1979); Kumar, J. Biol., Chem., 256: 10435-10441 (1981). Обзор синтеза и противораковой активности некоторых производных паклитаксела см. в D.G.I. Kingston et al., Studies in Organic Chemistryvol. 26, озаглавленном "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne,Eds. (Elsevier, Amsterdam, 1986) pp. 219-235. Паклитаксел был одобрен для клинического использования для лечения рефракторного рака яичников в США (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann. Intern,Med., 111:273, 1989) и для лечения рака молочной железы (Holmes et al., J. Nat. Cancer Inst., 83:1797,1991). Он является потенциальным кандидатом для лечения опухолей кожи (Einzig et al., Proc. Am. Soc.Clin. Oncol., 20:46) и карцином головы и шеи (Forastire et al., Sem. Oncol., 20:56, 1990). Это соединение также продемонстрировало потенциал для лечения поликистозного почечного заболевания (Woo et al.,Nature, 368:750. 1994), рака легкого и малярии. Лечение пациентов паклитакселом приводит к супрессии костного мозга (multiple cell lineages, Ignoff, R.J. et al., Cancer Chemotherapy Pocket Guide., 1998), что связано с продолжительным введением доз выше пороговой концентрации (50 нМ) (Kearns, C.M. et al.,Seminars in Oncology, 3(6) p. 16-23, 1995). Доцетаксел, (2R,3S)-N-карбокси-3-фенилизосерин, N-трет-бутиловый эфир, 13-эфир с 5-20 эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-оном 4-ацетатом 2-бензоатом, тригидрат; является коммерчески доступным в виде раствора для инъекций как TAXOTERE. Доцетаксел показан для лечения рака молочной железы. Доцетаксел представляет собой полусинтетическое производное паклитаксела q.v., полученное с использованием природного предшественника 10-деацетил-баккатина III, который экстрагируют из хвои европейского тисового дерева. Дозоограничивающей токсичностью доцетаксела является нейтропения. Алкалоиды барвинка представляют собой фаза-специфические противоопухолевые средства, выделяемые из растения барвинка. Алкалоиды барвинка действуют на М фазу (митоз) клеточного цикла пу- 10018038 тем связывания специфическим образом с тубулином. Соответственно, связанная молекула тубулина неспособна полимеризоваться в микротрубочки. Считается, что митоз останавливается в метафазе с последующей клеточной гибелью. Примеры алкалоидов барвинка включают, но не ограничиваются этим,винбластин, винкристин и винорелбин. Винбластин, винкалейкобластин сульфат, является коммерчески доступным как VELBAN в виде раствора для инъекций. Хотя он может быть показан в качестве терапии второй очереди различных солидных опухолей, он в первую очередь показан для лечения тестикулярного рака и различных лимфом,включая болезнь Ходжкина; и лимфоцитарных и гистиоцитарных лимфом. Миелосупрессия является дозоограничивающим побочным эффектом винбластина. Винкристин, винкалейкобластин, 22-оксо-, сульфат, является коммерчески доступным как ONCOVIN в виде раствора для инъекций. Винкристин показан для лечения острых лейкозов, а также нашел применение в схемах лечения ходжкинских и неходжкинских злокачественных лимфом. Алопеция и неврологические эффекты являются наиболее распространенными побочными эффектами винкристина и в меньшей степени возникают эффекты миелосупрессии и желудочно-кишечный мукозит. Винорелбин, 3',4'-дидегидро-4'-дезокси-С'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутандиоат (1:2) (соль)], коммерчески доступный в виде раствора для инъекций винорелбина тартрата (NAVELBINE), представляет собой полусинтетический алкалоид барвинка. Винорелбин показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами, такими как цисплатин, для лечения различных солидных опухолей, в частности немелкоклеточного рака легкого, прогрессирующего рака молочной железы и гормоно-резистентного рака предстательной железы. Миелосупрессии являются наиболее распространенным дозоограничивающим побочным эффектом винорелбина. Платиновые координационные комплексы представляют собой противораковые средства, которые не являются фаза-специфическими и которые являются интерактивными с ДНК. Платиновые комплексы проникают в опухолевые клетки, подвергаются гидратации и образуют внутри- и межцепочечные поперечные связи ДНК, вызывая неблагоприятные для опухоли биологические эффекты. Примеры платиновых координационных комплексов включают, но не ограничиваются этим, цисплатин и карбоплатин. Цисплатин, цисдиамминдихлорплатина, является коммерчески доступным как PLATINOL в виде раствора для инъекций. Цисплатин, прежде всего, показан для лечения метастатического тестикулярного рака и рака яичников, а также прогрессирующего рака мочевого пузыря. Основными дозоограничивающими побочными эффектами цисплатина являются нефротоксичность, которую можно контролировать гидратацией, и диурез и ототоксичность. Карбоплатин, платина, диаммин [1,1-циклобутан-дикарбоксилат(2-)-О,О'], является коммерчески доступным как PARAPLATIN в виде раствора для инъекций. Карбоплатин, прежде всего, показан в качестве перво- и второочередного лечения прогрессирующей карциномы яичников. Супрессия костного мозга является дозоограничивающей токсичностью карбоплатина. Алкилирующие средства представляют собой противораковые средства, не являющиеся фазаспецифическими, и являются сильными электрофилами. Типично, алкилирующие средства образуют ковалентные связи путем алкилирования с ДНК через нуклеофильные группы молекулы ДНК, такие как фосфатные, амино, сульфгидрильные, гидроксильные, карбоксильные и имидазольные группы. Такое алкилирование разрывает функцию нуклеиновых кислот, приводя к клеточной гибели. Примеры алкилирующих средств включают, но не ограничиваются этим, азотный иприт, такой как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бусульфан; соединения нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин. Циклофосфамид, 2-[бис(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин 2-оксид моногидрат, является коммерчески доступным в виде раствора для инъекций или таблеток как CYTOXAN. Циклофосфамид показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения злокачественных лимфом, множественных миелом и лейкозов. Алопеция,тошнота, рвота и лейкопения являются наиболее распространенными дозоограничивающими побочными эффектами циклофосфамида. Мелфалан, 4-[бис(2-хлорэтил)амино]-L-фенилаланин, является коммерчески доступным в виде раствора для инъекций или таблеток как ALKERAN. Мелфалан показан для паллиативного лечения множественных миелом и неоперабельной эпителиальной карциномы яичника. Супрессия костного мозга является наиболее распространенным дозоограничивающим побочным эффектом мелфалана. Хлорамбуцил, 4-[бис(2-хлорэтил)амино]бензолбутановая кислота, является коммерчески доступным как LEUKERAN в виде таблеток. Хлорамбуцил показан для паллиативного лечения хронического лимфатического лейкоза и злокачественных лимфом, таких как лимфосаркома, гиганто-клеточная фолликулярная лимфома и болезнь Ходжкина. Супрессия костного мозга является наиболее распространенным дозоограничивающим побочным эффектом хлорамбуцила. Бусульфан, 1,4-бутандиол диметансульфонат, является коммерчески доступным как MYLERAN в виде таблеток. Бусульфан показан для паллиативного лечения хронического миелогенного лейкоза. Супрессия костного мозга является наиболее распространенным дозоограничивающими побочными эффек- 11018038 тами бусульфана. Кармустин, 1,3-[бис(2-хлорэтил)-1-нитрозомочевина, является коммерчески доступным в виде отдельных флаконов, содержащих лиофилизированное вещество, как BiCNU. Кармустин показан для паллиативного лечения в качестве отдельного средства или в сочетании с другими средствами для лечения опухолей головного мозга, множественных миелом, болезни Ходжкина и неходжкинских лимфом. Замедленная миелосупрессия является наиболее распространенным дозоограничивающими побочным эффектом кармустина. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, является коммерчески доступным в виде отдельных содержащих вещество флаконов как DTIC-Dome. Дакарбазин показан для лечения метастатической злокачественной меланомы и в сочетании с другими средствами для второочередного лечения болезни Ходжкина. Тошнота, рвота и анорексия являются наиболее распространенными дозоограничивающими побочными эффектами дакарбазина. Противоопухолевые средства на основе антибиотиков представляют собой средства, не являющиеся фаза-специфическими, которые связываются или интеркалируют с ДНК. Типично, такое действие приводит к стабильным комплексам ДНК или разрыву цепочки, что разрушает обычную функцию нуклеиновых кислот, приводя к клеточной гибели. Примеры антибиотических противоопухолевых средств включают, но не ограничиваются этим, актиномицины, такие как дактиномицин, антроциклины, такие как даунорубицин и доксорубицин; и блеомицины. Дактиномицин, также известный как Актиномицин D, является коммерчески доступным в форме для инъекций COSMEGEN. Дактиномицин показан для лечения опухоли Вильмса и рабдомиосаркомы. Тошнота, рвота и анорексия являются наиболее распространенными дозоограничивающими побочными эффектами дактиномицина. Даунорубицин, (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридезоксиL-ликсоэкзопиранозил)окси]7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендион гидрохлорид, является коммерчески доступным в виде липосомного препарата для инъекций DAUNOXOME или в виде препарата для инъекций CERUBIDINE. Даунорубицин показан для индукции ремиссии при лечении острого нелимфоцитарного лейкоза и прогрессирующей связанной с ВИЧ саркомой Капоши. Миелосупрессия является наиболее распространенным дозоограничивающим побочным эффектом даунорубицина. Доксорубицин, (8S,10S)-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]-8-гликолоил, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендион гидрохлорид, является коммерчески доступным в виде препарата для инъекций RUBEX или ADRIAMYCIN RDF. Доксорубицин, прежде всего, показан для лечения острого лимфобластного лейкоза и острого миелобластного лейкоза, но он также является полезным компонентом для лечения некоторых солидных опухолей и лимфом. Миелосупрессии является наиболее распространенным дозоограничивающим побочным эффектом доксорубицина. Блеомицин, смесь цитотоксических гликопептидных антибиотиков, выделенных из штамма Streptomyces verticillus, является коммерчески доступным как BLENOXANE. Блеомицин показан в качестве паллиативного лечения, как отдельное средство или в сочетании с другими средствами, сквамозноклеточной карциномы, лимфом и тестикулярных карцином. Легочная и кожная токсичность являются наиболее распространенными дозоограничивающими побочными эффектами блеомицина. Ингибиторы топоизомеразы II включают, но не ограничиваются этим, эпиподофиллотоксины. Эпиподофиллотоксины являются фаза-специфическими противоопухолевыми средствами, выделенными из растения мандрагоры. Эпиподофиллотоксины типично влияют на клетки в S и G2 фазах клеточного цикла путем образования тройного комплекса с топоизомеразой II и ДНК, вызывая разрывы цепи ДНК. Разрывы цепи аккумулируются, и затем следует клеточная гибель. Примеры эпиподофиллотоксинов включают, но не ограничиваются этим, этопозид и тенипозид. Этопозид, 4'-деметил-эпиподофиллотоксин 9[4,6-0-(R)-этилиденO-глюкопиранозид], является коммерчески доступным в виде раствора для инъекций или капсул как VePESID и является широкоизвестным как VP-16. Этопозид показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения тестикулярного рака и немелкоклеточного рака легкого. Миелосупрессия является наиболее распространенным побочным эффектом этопозида. Случаи лейкопении обычно менее тяжелые по сравнению с тромбоцитопенией. Тенипозид, 4'-деметил-эпиподофиллотоксин 9[4,6-0-(R)-тенилиденО-глюкопиранозид], является коммерчески доступным в виде раствора для инъекций VUMON и является широкоизвестным как VM26. Тенипозид показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения острого лейкоза у детей. Миелосупрессия является наиболее распространенным дозоограничивающим побочным эффектом тенипозида. Тенипозид может вызывать как лейкопению, так и тромбоцитопению. Антиметаболические противоопухолевые средства являются фаза-специфическими противоопухолевыми средствами, которые действуют на S-фазу (синтез ДНК) клеточного цикла путем ингибирования синтеза ДНК или путем ингибирования синтеза пуринового или пиримидинового основания, ограничи- 12018038 вая, таким образом, синтез ДНК. Соответственно, S-фаза не осуществляется, приводя к клеточной гибели. Примеры антиметаболических противоопухолевых средств включают, но не ограничиваются этим,фторурацил, метотрексат, цитарабин, мекаптопурин, тиогуанин и гемцитабин. 5-Фторурацил, 5-фтор-2,4-(1 Н,3H)пиримидиндион, является коммерчески доступным как фторурацил. Введение 5-фторурацила приводит к ингибированию синтеза тимидилата, а также включению как в РНК, так и в ДНК. Типичным результатом является клеточная гибель. 5-Фторурацил показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения карцином молочной железы, толстой кишки, прямой кишки, желудка и поджелудочной железы. Миелосупрессия и мукозит являются дозоограничивающими побочными эффектами 5-фторурацила. Другие фторпиримидиновые аналоги включают 5-фтордезоксиуридин (флоксиридин) и 5-фтордезоксиуридин монофосфат. Цитарабин, 4-амино-1D-арабинофуранозил-2(1 Н)-пиримидинон, является коммерчески доступным как CYTOSAR-U и является широкоизвестным как Ara-С. Считается, что цитарабин обладает специфическим действием в S-фазе клеточного цикла путем ингибирования удлинения цепи ДНК посредством включения на конце цепи цитарабина в растущую цепь ДНК. Цитарабин показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения острого лейкоза. Другие цитидиновые аналоги включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Цитарабин вызывает лейкопению, тромбоцитопению и мукозит. Меркаптопурин, 1,7-дигидро-6H-пурин-6-тион моногидрат, является коммерчески доступным какPURINETHOL. Меркаптопурин обладает специфическим действием в S-фазе клеточного цикла путем ингибирования синтеза ДНК, при этом механизм этого действия еще не определен. Меркаптопурин показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения острого лейкоза. Миелосупрессия и желудочно-кишечный мукозит являются ожидаемыми побочными эффектами меркаптопурина при высоких дозах. Полезным меркаптопуриновым аналогом является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, является коммерчески доступным какTABLOID. Тиогуанин обладает специфическим действием в S-фазе клеточного цикла путем ингибирования синтеза ДНК, при этом механизм этого действия еще не определен. Тиогуанин показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения острого лейкоза. Миелосупрессия, включая лейкопению, тромбоцитопению и анемию, является наиболее распространенным дозоограничивающим побочным эффектом введения тиогуанина. Однако имеют место желудочно-кишечные побочные эффекты, и они могут быть дозоограничивающими. Другие пуриновые аналоги включают пентостатин, эритрогидроксинониладенин, флударабин фосфат и кладрибин. Гемцитабин, 2'-дезокси-2',2'-дифторцитидин моногидрохлорид (-изомер), является коммерчески доступным как GEMZAR. Гемцитабин обладает специфическим действием в S-фазе клеточного цикла и путем блокирования продвижения клеток через G1/S границу. Гемцитабин показан в сочетании с цисплатином для лечения локально прогрессирующего немелкоклеточного рака легкого и отдельно для лечения локально прогрессирующего рака поджелудочной железы. Миелосупрессия, включая лейкопению,тромбоцитопению и анемию, является наиболее распространенным дозоограничивающим побочным эффектом введения гемцитабина. Метотрексат, N-[4(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, является коммерчески доступным как метотрексат натрий. Метотрексат обладает специфическим действием в S-фазе клеточного цикла путем ингибирования синтеза ДНК, репарации и/или репликации через ингибирование редуктазы дигидрофолиевой кислоты, которая необходима для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат показан в качестве отдельного средства или в сочетании с другими химиотерапевтическими средствами для лечения хориокарциномы, менингеального лейкоза, неходжкинской лимфомы и карцином молочной железы, головы, шеи, яичника и мочевого пузыря. Миелосупрессия (лейкопения, тромбоцитопения и анемия) и мукозит являются ожидаемыми побочными эффектами введения метотрексата. Камптотецины, включая камптотецин и производные камптотецина, являются доступными или находятся в стадии разработки в качестве ингибиторов топоизомеразы I. Считается, что цитотоксическая активность камптотецина связана с его активностью ингибирования топоизомеразы I. Примеры камптотецинов включают, но не ограничиваются этим, иринотекан, топотекан и различные оптические формы 7-(4-метилпиперазинометилен)-10,11-этилендиокси-20-камптотецина, как описано ниже. Иринотекан HCl, (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1 Нпирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-дион гидрохлорид, является коммерчески доступным как раствор для инъекций CAMPTOSAR. Иринотекан является производным камптотецина, который связывается вместе с его активным метаболитом SN-38 с комплексом топоизомераза I-ДНК. Считается, что цитотоксичность возникает в результате невосстанавливаемых двухцепочечных разрывов, вызванных взаимодействием тройного комплекса топоизомераза I:ДНК:иринотекан или SN-38 с репликационными ферментами. Иринотекан пока- 13018038 зан для лечения метастатического рака толстой кишки или прямой кишки. Дозоограничивающими побочными эффектами иринотекана HCl являются миелосупрессия, включая нейтропению и желудочнокишечные эффекты, включая диарею. Топотекан HCl, (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-дион моногидрохлорид, является коммерчески доступным как раствор для инъекций HYCAMTIN. Топотекан является производным камптотецина, который связывается с комплексом топоизомераза I-ДНК и предотвращает объединение отдельных разрывов цепи, вызванных топоизомеразой I в ответ на деформацию кручения молекулы ДНК. Топотекан показан для второй очереди лечения метастатической карциномы яичника и мелкоклеточного рака легкого. Дозоограничивающим побочным эффектом топотекана HCl является миелосупрессия, в основном нейтропения. Также представляет интерес производное камптотецина формулы А, представленной ниже, находящееся в настоящее время в стадии разработки, включая форму рацемической смеси (R,S), a также R- и известные под химическим названием "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R,S)камптотецин (рацемическая смесь)", или "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R)камптотецин"7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(S)камптотецин (S-энантиомер)". Такое соединение, а также родственные соединения описаны, включая способы их получения, в патентах США 6063923; 5342947; 5559235; 5491237 и находящейся на одновременном рассмотрении патентной заявке США 08/977217, поданной 24 ноября 1997 г. Гормоны и гормональные аналоги являются полезными соединениями для лечения раковых заболеваний, где имеет место взаимосвязь между гормоном(гормонами) и ростом и/или отсутствием роста рака. Примеры гормонов и гормональных аналогов, полезных для лечения рака, включают, но не ограничиваются этим, адренокортикостероиды, такие как преднизон и преднизолон, которые являются полезными для лечения злокачественной лимфомы и острого лейкоза у детей; аминоглутетимид и другие ингибиторы ароматазы, такие как анастрозол, летрозол, воразол и экземестан, полезные для лечения адренокортикальных карцином и гормонозависимой карциномы молочной железы, содержащей рецепторы эстрогена; прогестрины, такие как мегестрол ацетат, полезный для лечения гормонозависимого рака молочной железы и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флутамид, нилутамид, бикалутамид, ципротерон ацетат и 5-редуктазы, такие как финастерид и диастерид, полезные для лечения карциномы простаты и доброкачественной гипертрофии простаты; антиэстрогены, такие как тамоксифен, торемифен, ралоксифен, дролоксифен, иодоксифен, а также селективные модуляторы эстрогеновых рецепторов (SERMS), такие как описанные в патентах США 5681835, 5877219 и 6207716,полезные для лечения гормонозависимой карциномы молочной железы и других восприимчивых типов рака; и гонадотропинвысвобождающий гормон (GnRH) и его аналоги, которые стимулируют высвобождение лютеинизирующего гормона (LH) и/или фолликулостимулирующего гормона (FSH) для лечения карциномы простаты, например агонисты и антагонисты LHRH, такие как госерелин ацетат и лупролид. Ингибиторы пути сигнальной трансдукции являются такими ингибиторами, которые блокируют или ингибируют химический процесс, который вызывает внутриклеточное изменение. Как это используется в настоящей заявке, указанное изменение представляет собой клеточную пролиферацию или дифференциацию. Ингибиторы сигнальной трансдукции, которые являются полезными в настоящем изобретении, включают ингибиторы тирозиновых киназ рецепторов, нерецепторных тирозиновых киназ, блокаторов SH2/SH3 домена, сериновых/треониновых киназ, фосфотидилинозитол-3 киназ, передачи сигнала мио-инозитола и Ras онкогенов. Некоторые тирозиновые протеикиназы катализируют фосфорилирование специфических тирозиновых остатков в различных белках, участвующих в регуляции клеточного роста. Такие тирозиновые протеикиназы в широком смысле могут быть классифицированы как рецепторные или нерецепторные киназы. Тирозиновые киназы рецепторов представляют собой трансмембранные белки, содержащие внеклеточный лигандсвязывающий домен, трансмембранный домен и тирозинкиназный домен. Тирозиновые киназы рецепторов участвуют в регуляции клеточного роста, и их, как правило, называют рецепторами фактора роста. Несоответствующая или неконтролируемая активация многих таких киназ, т.е. аберрантная активность киназного рецептора факторов роста, например, посредством сверхэкспрессии или мута- 14018038 ции, как было показано, приводит к неконтролируемому клеточному росту. Соответственно, аберрантную активность таких киназ связывают с ростом злокачественной ткани. Соответственно, ингибиторы таких киназ могли бы обеспечить способы лечения рака. Рецепторы факторов роста включают, например, рецептор эпидермального фактора роста (EGFr), рецептор фактора роста, продуцируемого тромбоцитами (PDGFr), erbB2, erbB4, рецептор сосудистого эндотелиального фактора роста (VEGFr), области гомологии тирозинкиназы с иммуноглобулинподобным и эпидермальным фактором роста (TIE-2), рецептор инсулиноподобного фактора роста-1 (IGF1), макрофагальный колониестимулирующий фактор(cfms), ВТК, ckit, cmet, рецепторы фактора роста фибробластов (FGF), рецепторы Trk (TrkA, TrkB иTrkC), рецепторы эфрина (eph) и RET протоонкоген. Некоторые ингибиторы рецепторов факторов роста в настоящее время находятся в стадии разработки и включают антагонисты лигандов, антитела, ингибиторы тирозиновой киназы и антисмысловые олигонуклеотиды. Рецепторы факторов роста и средства,которые ингибируют функцию рецептора фактора роста, описаны, например, в Kath, John С., Exp. Opin.Kerr, David, CRC press 1994, London. Тирозиновые киназы, которые не являются киназами рецепторов факторов роста, называются нерецепторными тирозиновыми киназами. Нерецепторные тирозиновые киназы для использования в настоящем изобретении, которые являются мишенями или потенциальными мишенями противораковых лекарственных средств, включают cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (киназа фокальной адгезии), тирозиновая киназа Brutons и Bcr-Abl. Такие нерецепторные киназы и средства, которые ингибируют функцию нерецепторных тирозиновых киназ, описаны в Sinh, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem. Cell. Research 8 (5): 465-80; и Bolen, J. В., Brugge, J.S., (1997) Annual review of Immunology. 15: 371-404. Блокаторы SH2/SH3 домена представляют собой средства, которые разрушают связывание SH2 илиSH3 домена в различных ферментах или адапторных белках, включая PI3-K р 85 субъединицу, киназы семейства Src, адапторные молекулы (Shc, Crk, Nek, Grb2) и Ras-GAP. SH2/SH3 домены в качестве мишеней для противораковых лекарственных средств обсуждаются в Smithgall, Т.Е. (1995), Journal of Pharmacological and Toxicological Methods. 34(3) 125-32. Ингибиторы сериновой/треониновой киназы, включая блокаторы каскада MAP киназы, которые включают блокаторы Raf киназ (rafk), митоген или внеклеточно регулируемых киназ (MEK) и внеклеточно регулируемых киназ (ERK); и блокаторы членов семейства протеинкиназы С, включая блокаторыPKC (, , , , , ), семейства IkB киназ (IKKa, IKKb), РКВ семейства киназ, членов семейства akt киназ и TGF -рецепторных киназ. Такие сериновые/треониновые киназы и их ингибиторы описаны вal. Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; в патенте США 6268391; и Martinezlacaci, L., et al., Int. J. Cancer (2000), 88(1), 44-52. Ингибиторы членов семейства фосфотидилинозитол-3 киназ, включая блокаторы PI3-киназы, ATM,DNA-PK и Ku, также могут быть полезными в настоящем изобретении. Такие киназы обсуждаются в(7):935-8; и Zhong, H. et al., Cancer res, (2000) 60(6), 1541-1545. Также в настоящем изобретении представляют интерес ингибиторы сигнальной активности миоинозитола, такие как блокаторы фосфолипазы С и аналоги миоинозитола. Такие ингибиторы сигнала описаны в Powis, G. And Kozikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., PaulWorkman and David Kerr, CRC press 1994, London. Другая группа ингибиторов пути сигнальной трансдукции представляет собой ингибиторы Ras онкогена. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранилгеранилтрансферазы и СААХ протеаз, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапевтические средства. Было показано, что такие ингибиторы блокируют активацию ras в клетках, содержащих мутант ras дикого типа, действуя, таким образом, как антипролиферативные средства. Ингибирование Ras онкогена обсуждаются в Scharovsky, О.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology. 9 (2) 99-102; и BioChim. Biophys. Acta,(19899) 1423 (3) :19-30. Как указано выше, антитела, направленные против связывания лиганда киназного рецептора, также могут служить в качестве ингибиторов сигнальной трансдукции. Эта группа ингибиторов пути сигнальной трансдукции включает использование гуманизированных антител к внеклеточному лигандсвязывающему домену рецепторных тирозиновых киназ. Например, Imclone C225 EGFR специфическое антитело (см. Green, M.С. et al., Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat. Rev., (2000),26(4), 269-286); Herceptin erbB2 антитело (см. Tyrosme Kinase Signalling in Breast cancer:erbB Familyblocks tumor growth in mice, Cancer Res. (2000) 60, 5117-5124). Ингибиторы связанных с ангиогенезом нерецепторных киназ также могут быть полезными в настоящем изобретении. Ингибиторы связанных с ангиогенезом VEGFR и TIE2 обсуждаются выше в связи с ингибиторами сигнальной трансдукции (оба рецептора представляют собой тирозиновые киназы). Ангиогенез, как правило, связывают с передачей сигнала erbB2/EGFR, поскольку было показано, что ингибиторы erbB2 и EGFR ингибируют ангиогенез, преимущественно экспрессию VEGF. Соответственно,ингибиторы нерецепторных тирозиновых киназ можно использовать в сочетании с соединениями по настоящему изобретению. Например, анти-VEGF антитела, которые не распознают VEGFR (рецепторная тирозиновая киназа), но связываются с лигандом; малые молекулы-ингибиторы интегрина (v3), которые ингибируют ангиогенез; эндостатин и ангиостатин (не-PTK) также могут быть полезными в сочетании с соединениями, раскрытыми в настоящем изобретении (см. Bruns C.J. et al. (2000), Cancer Res., 60: 2926-2935; Schreiber A.B., Winkler M.E. and Derynck R. (1986), Science, 232: 1250-1253; Yen L. et al.(2000), Oncogene 19: 3460-3469). Средства, используемые в иммунотерапии, также могут быть полезными в сочетании с соединениями формулы (I). Существует ряд иммунологоических стратегий для генерации иммунного ответа. Эти стратегии, в основном, относятся к области противоопухолевой вакцинации. Эффективность иммунологических подходов можно существенно повысить посредством комбинированного ингибирования сигнальных путей с использованием малой молекулы-ингибитора. Обсуждение подхода на основе иммунологических методов/противоопухолевой вакцины против erbB2/EGFR можно найти в Reilly R.T. et al.(2000), Cancer Res. 60: 3569-3576; и Chen Y., Hu D., Eling D.J., Robbins J. and Kipps T.J. (1998), Cancer Res. 58: 1965-1971. Средства, используемые в проапоптических программах лечения (например, bcl-2 антисмысловые олигонуклеотиды), также можно использовать в комбинации по настоящему изобретению. Члены Bcl-2 семейства белков блокируют апоптоз. Поэтому повышающую регуляцию bcl-2 связывают с резистентностью к химическому воздействию. Исследования показали, что эпидермальный фактор роста (EGF) стимулирует антиапоптические члены bcl-2 семейства (т.е. mcl-1). Поэтому стратегии, разработанные для понижающей регуляции экспрессии bcl-2 в опухолях, продемонатрировали клиническую выгоду и в настоящее время находятся в фазе II/III испытаний, а именно антисмысловой олигонуклеотид Genta'sG3139 bcl-2. Такие проапоптические стратегии с использованием стратегии антисмысловых олигонуклеотидов для bcl-2 обсуждаются в Water J.S. et al. (2000), J. Clin. Oncol. 18: 1812-1823; и Kitada S. et al.(1994), Antisense Res. Dev. 4: 71-79. Ингибиторы передачи сигнала клеточного цикла ингибируют молекулы, участвующие в контроле клеточного цикла. Семейство протеинкиназ, которые называют циклинзависимыми киназами (CDK), и их взаимодействие с семейством белков, которые называют циклинами, контролирует продвижение через эукариотический клеточный цикл. Координированная активация и инактивация различных циклин/CDK комплексов необходима для нормального продвижения через клеточный цикл. Некоторые ингибиторы передачи сигнала клеточного цикла находятся в стадии разработки. Например, примеры циклинзависимых киназ, включая CDK2, CDK4 и CDK6, и их ингибиторы описаны, например, в Rosaniaet al., Exp. Opm. Ther. Patents (2000) 10 (2): 215-230. В одном варианте воплощения изобретения способ лечения рака в соответствии с настоящим изобретением включает совместное введение соединения формулы (I) и/или его фармацевтически приемлемой соли и по меньшей мере одного противоопухолевого средства, такого как средство, выбранное из группы, включающей средства, направленные против организации микротрубочек, платиновые координационные комплексы, алкилирующие средства, антибиотики, ингибиторы топоизомеразы II, антиметаболиты, ингибиторы топоизомеразы I, гормоны и гормональные аналоги, ингибиторы путей сигнальной трансдукции, ингибиторы ангиогенеза, связанного с нерецепторными тирозинкиназами, иммунотерапевтические средства, проапоптические средства и ингибиторы передачи сигнала клеточного цикла. Поскольку фармацевтически активные соединения по настоящему изобретению являются активными в качестве ингибиторов AKT, они демонстрируют терапевтическую пользу в лечении рака и артрита. Соответственно, настоящее изобретение относится к способу лечения или облегчения тяжести рака,выбранного из рака головного мозга (глиомы), глиобластомы, синдрома Bannayan-Zonana, болезни Коудена, болезни Lhermitte-Duclos, рака молочной железы, воспалительного рака молочной железы, опухоли Вильмса, саркомы Эвинга, рабдомиосаркомы, эпендиомы, медуллобластомы, рака толстой кишки,головы и шеи, почки, легкого, печени, меланомы, рака яичников, поджелудочной железы, предстательной железы, саркомы, остеосаркомы, гиганто-клеточной опухоли кости, рака щитовидной железы, лимфобластного Т-клеточного лейкоза, хронического миелогенного лейкоза, хронического лимфоцитарного лейкоза, волосисто-клеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза,хронического нейтрофильного лейкоза, острого лимфобластного Т-клеточного лейкоза, плазмацитомы,иммунобластного крупно-клеточного лейкоза, мантийно-клеточного лейкоза, множественной миеломы,мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиело- 16018038 цитарного лейкоза, эритролейкоза, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, уротелиального рака, рака легкого, рака вульвы, цервикального рака,рака эндометрия, рака мочеиспускательной системы, мезотелиомы, рак пищевода, рак слюной железы,гепатоцеллюлярного рака, рак желудка, назофарангеальный рак, буккального рака, рака полости рта,GIST (желудочно-кишечной стромальной опухоли) и тестикулярного рака. Соответственно, настоящее изобретение относится к способу лечения или облегчения тяжести рака,выбранного из рака головного мозга (глиомы), глиобластом, синдрома Bannayan-Zonana, болезни Коудена, болезни Lhermitte-Duclos, рака молочной железы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, рака яичников, поджелудочной железы, предстательной железы, саркомы и рака щитовидной железы. Соответственно, настоящее изобретение относится к способу лечения или облегчения тяжести рака,выбранного из рака яичников, молочной железы, поджелудочной железы и предстательной железы. Выделение и очистка His-меченного AKT1 (аминокислоты 136-480). Клетки насекомого, эксперссирующие His-меченный AKT1 (аминокислоты 136-480), лизировали в 25 мМ HEPES, 100 мМ NaCl, 20 мМ имидазола; рН 7,5, с использованием polytron (5 мл лизисного буфера/г клеток). Клеточный дебрис удаляли путем центрифугирования при 28000g в течение 30 мин. Супернатант фильтровали через 4,5-микронный фильтр, затем загружали на никель-хелатирующую колонку, предварительно уравновешенную лизисным буфером. Колонку промывали 5 колоночными объемами(CV) лизисного буфера, затем 5 CV 20% буфера В, где буфер В представлял собой 25 мМ HEPES, 100 мМ NaCl, 300 мМ имидазола; рН 7,5. His-меченный AKT1 (аминокислоты 136-480) элюировали с использованием 20-100% линейного градиента буфера В 10 CV. Полученные в результате элюирования фракции His-меченного AKT1 (136-480) объединяли и разбавляли 3-кратно буфером С, где буфер С представлял собой 25 мМ HEPES, рН 7,5. Образец затем хроматографировали через колонку Q-SepharoseHP, предварительно уравновешенную буфером С. Колонку промывали 5 CV буфера С, затем постадийно элюировали при помощи 5 CV 10% D, 5 CV 20% D, 5 CV 30% D, 5 CV 50% D и 5 CV 100% D; где буфер(аминокислоты 136-480), объединяли и концентрировали в концентраторе с молекулярно-массовой отсечкой 10 кДа. His-меченный AKT1 (аминокислоты 136-480) хроматографировали через колонку для гель-фильтрации Superdex 75, предварительно уравновешенную 25 мМ HEPES, 200 мМ NaCl, 1 мМ DTT; рН 7,5. Фракции, содержащие His-меченный AKT1 (аминокислоты 136-480), исследовали с использованием SDS-PAGE и масс-спектрометрии. Белок объединяли, концентрировали и замораживали при -8 С.His-меченный AKT2 (аминокислоты 138-481) и His-меченный AKT3 (аминокислоты 135-479) выделяли и очищали таким же образом. Ферментный анализ His-меченного AKT. Соединения по настоящему изобретению были испытаны на активность ингибирования сериновой протеинкиназы AKT 1, 2 и 3 в анализах фосфорилирования субстрата. В этих анализах исследуют способность малых молекул органических соединений ингибировать фосфорилирование серина пептидного субстрата. В анализах фосфорилирования субстрата используют каталитические домены AKT 1, 2 или 3.AKT 1, 2 и 3 также являются коммерчески доступными от Upstate USA, Inc. В данном способе измеряют способность выделенного фермента катализировать перенос -фосфата из АТФ на сериновый остаток биотинилированного синтетического пептида SEQ ID NO: 1 (биотин-ahx-ARKRERAYSFGHHA-амид). Фосфорилирование субстрата определяли с использованием следующей процедуры. Анализы осуществляли в 384-луночных U-донных белых планшетах. 10 нМ активированного AKT фермента инкубировали в течение 40 мин при комнатной температуре в анализируемом объеме 20 мкл,содержащем 50 мМ MOPS, pH 7,5, 20 мМ MgCl2, 4 мкМ АТФ, 8 мкМ пептида, 0,04 мкКи [g-33 Р] АТФ/лунка, 1 мМ CHAPS, 2 мМ DTT и 1 мкл испытываемого соединения в 100% DMSO. Реакцию останавливали добавлением 50 мкл смеси SPA шариков (PBS Дульбекко без Mg2+ и Са 2+, 0,1% Triton X-100, 5 мМ EDTA, 50 мкМ АТФ, 2,5 мг/мл покрытых стрептавидином SPA шариков). Планшет герметично закрывали, шарикам давали осадиться в течение ночи и затем планшет считывали в сцинтилляционном счетчике Packard Topcount Microplate Scintillation Counter (Packard Instrument Co., Meriden, CT). Данные для получения кривых доза-ответ наносили на график как % от контроля, рассчитанный с использованием формулы сокращения данных 100(U1-C2)/(С 1-С 2) против концентрации соединения,где U представляет собой неизвестное значение, С 1 представляет собой среднее значение контроля, полученное для DMSO, и С 2 представляет собой среднее значение контроля, полученное для 0,1 М EDTA. Данные соответствуют кривой, описанной как у=Vmaxх)/(K+х, где Vmax представляет собой верхнюю асимптоту, и K представляет собой ИК 50. Клонирование полноразмерного человеческого (FL) AKT1. Полноразмерный AKT1 ген человека амплифицировали при помощи ПЦР из плазмиды, содержащей миристилированный-AKT1-ER (подарок от Robert Т. Abraham, Duke University under MTA, описанный в Klippel et al. Molecular and Cellular Biology 1998, Vol. 18, p. 5699) с использованием 5' праймера:SEQ ID NO: 2, 5' TATATAGGATCCATGAGCGACGTGGC 3' и 3' праймера: SEQ ID NO: 3,AAATTTCTCGAGTCAGGCCGTGCTGCTGG 3'. Для целей клонирования 5' праймер включал BamHI сайт, а 3' праймер включал Xhol сайт. Полученный ПЦР продукт субклонировали в pcDNA3 в виде, кодирующей Цистеин 25, была преобразована в AKT1 последовательность дикого типа, кодирующую Аргинин 25, посредством сайтнаправленного мутагенеза с использованием набора для сайт-направленного мутагенеза QuikChangeACCTGGCGGCCACGCTACTTCCTCC и селективный праймер: SEQ ID NO: 5, 5' CTCGAGCATGCAACTAGAGGGCC (разработан для разрушения Xbal сайта в сайте множественного клонирования рсДНК 3) в соответствии с предложениями изготовителя. В целях экспрессии/очистки AKT1 выделяли в видеBamHI/Xhol фрагмента и клонировали в BamHI/Xhol сайты pFastbacHTb (Invitrogen). Экспрессия полноразмерного человеческого AKT1. Экспрессию осуществляли с использованием бакуловирусной системы экспрессии BAC-to-BAC отInvitrogen (catalog10359-016). Вкратце, 1) кДНК переносили из FastBac вектора в бакмидную ДНК, 2) бакмидную ДНК выделяли и использовали для трансфекции клеток насекомого Sf9, 3) вирус продуцировали в Sf9 клетках, 4) T.ni клетки инфицировали этим вирусом и направляли для очистки. Очистка полноразмерного человеческого AKT1. Для очистки полноразмерного AKT1 130 г клеток sf9 (партия 41646WO2) ресуспендировали в лизисном буфере (буфер А, 1 л, рН 7,5), содержащем 25 мМ HEPES, 100 мМ NaCl и 20 мМ имидазола. Лизис клеток осуществляли при помощи Avestin (2 прохода при 15-20 K ф/дюйм 2). Клеточный дебрис удаляли путем центрифугирования при 16 K об/мин в течение 1 ч и супернатант связывали с 10 мл шариковNickel Sepharose HP при 4 С в течение ночи. Шарики затем переносили в колонку и связанное вещество элюировали буфером В (25 мМ HEPES, 100 мМ NaCl, 300 мМ имидазол, рН 7,5). Полученные в результате элюирования фракции AKT объединяли и разбавляли 3-кратно с использованием буфера С (25 мМHEPES, 5 мМ DTT; рН 7,5). Образец фильтровали и хроматографировали через 10-мл Q-HP колонку,предварительно уравновешенную буфером С, при 2 мл/мин. Колонку Q-HP промывали 3 колоночными объемами (CV) буфера C, затем постадийно элюировали при помощи 5 CV 10% D, 5 CV 20% D, 5 CV 30% D, 5 CV 50% D и 5 CV 100% D; где буфер D представлял собой 25 мМ HEPES, 1000 мМ NaCl, 5 мМ DTT; pH 7,5. Собирали фракции 5 мл. AKT, содержащие фракции, объединяли и концентрировали до 5 мл. Белок затем загружали в 120-мл колонку Superdex 75 для разделения по размеру, которая была предварительно уравновешена 25 мМ HEPES, 200 мМ NaCl, 5 мМ DTT; рН 7,5. Собирали 2,5-мл фракции. Полученные в результате элюирования фракции AKT1 объединяли, разделяли на аликвоты (1 мл) и хранили при -8 С. Использовали масс-спектрометрический и SDS-PAGE анализ для подтверждения чистоты и идентичности очищенного полноразмерного AKT1. Полноразмерный AKT2 и полноразмерный AKT3 клонировали, экспрессировали и очищали таким же образом. Ферментный анализ AKT. Соединения по настоящему изобретению были испытаны на активность ингибирования сериновой протеинкиназы AKT 1, 2 и 3 в анализах фосфорилирования субстрата. В этих анализах исследуют способность малых молекул органических соединений ингибировать фосфорилирование серина пептидного субстрата. В анализах фосфорилирования субстрата используют каталитические домены AKT 1, 2 или 3.AKT 1, 2 и 3 также являются коммерчески доступными от Upstate USA, Inc. В данном способе измеряют способность выделенного фермента катализировать перенос -фосфата из АТФ на сериновый остаток биотинилированного синтетического пептида SEQ ID NO: 1 (биотин-ahx-ARKRERAYSFGHHA-амид). Фосфорилирование субстрата определяли с использованием следующей процедуры. Анализы осуществляли в 384-луночных U-донных белых планшетах. 10 нМ активированного AKT фермента инкубировали в течение 40 мин при комнатной температуре в анализируемом объеме 20 мкл,содержащем 50 мМ MOPS, pH 7,5, 20 мМ MgCl2, 4 мкМ АТФ, 8 мкМ пептида, 0,04 мкКи [g-33 Р] АТФ/лунка, 1 мМ CHAPS, 2 мМ DTT и 1 мкл испытываемого соединения в 100% DMSO. Реакцию останавливали добавлением 50 мкл смеси SPA шариков (PBS Дульбекко без Mg2+ и Са 2+, 0,1% Triton X-100, 5 мМ EDTA, 50 мкМ АТФ, 2,5 мг/мл покрытых стрептавидином SPA шариков). Планшет герметично закрывали, шарикам давали осесть в течение ночи и затем планшет считывали в сцинтилляционном счетчике Packard Topcount Microplate Scintillation Counter (Packard Instrument Co., Meriden, CT). Данные для получения кривых доза-ответ наносили на график как % от контроля, рассчитанный с использованием формулы сокращения данных 100(U1-C2)/(С 1-С 2) против концентрации соединения,где U представляет собой неизвестное значение, С 1 представляет собой среднее значение контроля, полученное для DMSO, и С 2 представляет собой среднее значение контроля, полученное для 0,1 М EDTA. Данные соответствуют кривой, описанной как у=Vmaxх)/(K+х, где Vmax представляет собой верхнюю асимптоту, и K представляет собой ИК 50. Соединения по настоящему изобретению были испытаны на активность против AKT1, AKT2 иAKT3 в одном или нескольких из описанных выше анализов. Большая часть соединений примеров были испытаны, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте они показали значение рИК 50: 5,9 против полноразмерного AKT1; 5,0 против полноразмерного AKT2 и 5,0 против полноразмерного AKT3. Соединения примеров 31, 32, 91, 95, 120, 128, 140, 161, 167, 169, 170, 190, 222, 225, 237, 249, 258 и 259 были испытаны, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте они показали значение рИК 50: 8,6 против полноразмерного AKT1 и 7,5 против полноразмерного AKT2. Большая часть соединений примеров 31, 32, 91,95, 120, 128, 140, 161, 167, 169, 170, 190, 222, 225, 237, 249, 258 и 259 были испытаны, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте они показали значение рИК 50: 7,6 против полноразмерного AKT3. Соединение примера 96 было испытано, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте оно показало значение рИК 50, равное 9,0 против полноразмерного AKT1; равное 8,0 против полноразмерного AKT2 и равное 8,8 против полноразмерного AKT3. Соединение примера 137 было испытано, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте оно показало значение рИК 50, равное 9,0 против полноразмерного AKT1; равное 7,8 против полноразмерного AKT2 и равное 8,4 против полноразмерного AKT3. Соединение примера 224 было испытано, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте оно показало значение рИК 50, равное 8,7 против полноразмерного AKT1 и равное 7,8 против полноразмерного AKT2. Соединение примера 161 было испытано, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте оно показало значение рИК 50, равное 8,8 против полноразмерного AKT1; равное 7,5 против полноразмерного AKT2 и равное 7,6 против полноразмерного AKT3. Соединение примера 222 было испытано, в основном, в соответствии с описанными выше ферментными анализами AKT, и по меньшей мере в одном осуществленном эксперименте оно показало значение рИК 50, равное 8,8 против полноразмерного AKT1 и равное 7,9 против полноразмерного AKT2 и равное 8,5 против полноразмерного AKT3. В представленных выше данных рИК 50 определяется как -log(ИК 50), где значение ИК 50 выражено в единицах молярности. Фармацевтически активные соединения, входящие в объем настоящего изобретения, являются полезными в качестве ингибиторов АКТ у млекопитающих, в частности человека, нуждающихся в этом. Настоящее изобретение поэтому обеспечивает способ лечения рака, артрита и других состояний,требующих ингибирования AKT, который включает введение эффективного соединения формулы (I) и/или его фармацевтически приемлемой соли, гидрата, сольвата или пролекарства. Соединения формулы(I) также обеспечивают способ лечения указанных выше болезненных состояний благодаря продемонстрированной ими способности действовать как ингибиторы AKT. Лекарственное средство можно вводить пациенту, нуждающемуся в этом, любым традиционным способом введения, включая, но не ограничиваясь этим, внутривенный, внутримышечный, пероральный, подкожный, внутрикожный и парентеральный. Фармацевтически активные соединения по настоящему изобретению включают в удобные лекарственные формы, такие как капсулы, таблетки или препараты для инъекций. Используют твердые или жидкие фармацевтические носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, белую глину, сахарозу, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, арахисовое масло, оливковое масло, физиологический раствор и воду. Таким же образом, носитель или разбавитель может включать любое вещество пролонгированного высвобождения, такое как глицерилмоностеарат или глицерилдистеарат, отдельно или вместе с воском. Количество твердого носителя варьирует в широких пределах, но предпочтительно оно составляет от около 25 мг до около 1 г на единицу дозирования. Когда используют жидкий носитель,препарат будет в форме сиропа, эликсира, эмульсии, мягкой желатиновой капсулы, стерильной жидкости для инъекций, например в ампуле, или водной или неводной жидкой суспензии. Фармацевтические препараты получают, следуя традиционным приемам, используемым в фармацевтической химии, включая смешивание, гранулирование и прессование, если это необходимо, для препарата в форме таблеток, или смешивание, заполнение и растворение ингредиентов, как это является подходящим, с получением желаемых продуктов для перорального или парентерального введения. Дозы фармацевтически активных соединений по настоящему изобретению в фармацевтических стандартных лекарственных формах, описанных выше, должны представлять собой эффективное нетоксичное количество, предпочтительно выбираемое в пределах 0,001-100 мг/кг активного соединения,предпочтительно 0,001-50 мг/кг. При лечении человека, нуждающегося в ингибиторе AKT, выбранную дозу предпочтительно вводят 1-6 раз в день, перорально или парентерально. Предпочтительные формы парентерального введения включают местное, ректальное, чрескожное введение, введение путем инъекции и непрерывное введение путем инфузии. Пероральные стандартные лекарственные формы для введения человеку предпочтительно содержат от 0,05 до 3500 мг активного соединения. Пероральное введение с использованием более низких доз является предпочтительным. Однако также можно использовать парентеральное введение при более высоких дозах, когда это является безопасным и удобным для пациента. Оптимальные дозы для введения легко может определить специалист в данной области, и они варьируют в зависимости от конкретного используемого ингибитора AKT, активности препарата, способа введения и стадии болезненного состояния. Дополнительные факторы, зависящие от конкретного пациента, принимающего лечение, включая возраст пациента, массу тела, режим питания и время введения,могут вызвать необходимость корректировки доз. Способ по настоящему изобретению индукции активности ингибирования AKT у млекопитающих,включая человека, включает введение субъекту, нуждающемуся в такой активности, эффективного ингибирующего Akt количества фармацевтически активного соединения по настоящему изобретению. Изобретение также обеспечивает применение соединения формулы (I) для получения лекарственного средства для использования в качестве ингибитора AKT. Изобретение также обеспечивает применение соединения формулы (I) для получения лекарственного средства для использования в терапии. Изобретение также обеспечивает применение соединения формулы (I) для получения лекарственного средства для использования в лечении рака. Изобретение также обеспечивает применение соединения формулы (I) для получения лекарственного средства для использования в лечении артрита. Изобретение также обеспечивает фармацевтическую композицию для использования в качестве ингибитора AKT, которая включает соединение формулы (I) и фармацевтически приемлемый носитель. Изобретение также обеспечивает фармацевтическую композицию для использования для лечения рака, которая включает соединение формулы (I) и фармацевтически приемлемый носитель. Изобретение также обеспечивает фармацевтическую композицию для использования в лечении артрита, которая включает соединение формулы (I) и фармацевтически приемлемый носитель. Не ожидают никаких неприемлемых токсикологических эффектов соединений по настоящему изобретению при их введении в соответствии с настоящим изобретением. Кроме того, фармацевтически активные соединения по настоящему изобретению можно совместно вводить с дополнительными активными ингредиентами, такими как другие соединения, известные для лечения рака или артрита, или соединения, известные как применяемые в сочетании с ингибитором AKT. Считается, что специалист в данной области без каких-либо дополнительных усилий, используя представленное выше описание, сможет применить настоящее изобретение в его самом широком объеме. Представленные ниже примеры поэтому следует рассматривать лишь как иллюстративные, а не ограничивающие каким-либо образом объем настоящего изобретения. Экспериментальная часть Соединения примеров 1-328 легко получают в соответствии со схемами 1-3 или аналогичными способами. Получение 1. Получение 1,1-диметилэтил (2-амино-2-фенилэтил)карбамата(8,7 г, 40,1 ммоль) одной порцией. Через 0,5 ч раствор концентрировали и остаток использовали непосредственно без дополнительной очистки: ЖХ-МС (ES) m/z=238 (М+Н)+. К раствору 1,1-диметилэтил (2-гидрокси-2-фенилэтил)карбамата (2 г, 8,44 ммоль), фталимида (1 г,7,03 ммоль) и трифенилфосфина (2,76 г, 10,5 ммоль) в ТГФ (35 мл) при 25 С добавляли DEAD (1,7 мл,10,5 ммоль) по каплям. Через 0,5 ч раствор концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 15% EtOAc в гексане) с получением указанного в заголовке соединения (2 г,80%) в виде белого пенистого вещества: ЖХ-МС (ES) m/z=367 (М+Н)+. с) 1,1-Диметилэтил (2-амино-2-фенилэтил)карбамат Раствор 1,1-диметилэтил [2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-2-фенилэтил]карбамата (2 г, 5,46 ммоль) и либо MeNH2 (40 мас.% в H2O, 10 экв.), либо NH2NH2 (10 экв.) в МеОН (0,5 М, 10 мл) нагревали до 60 С в герметично закрытой пробирке. Через 12 ч раствор концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния-сухая нагрузка, 2% МеОН в DCM (1% NH4OH с получением указанного в заголовке соединения (1,1 г, 85%) в виде белого твердого вещества: ЖХ-МС К раствору 1-амино-3-фенил-2-пропанола (7,6 г, 50 ммоль) в ТГФ (50 мл) при комнатной температуре добавляли (Вос)2 О (12,0 г, 55 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакционный раствор концентрировали в вакууме и остаток очищали на силикагеле (5% МеОН в DCM(0,5% NH4OH с получением указанного в заголовке соединения (13,1 г, 91%) в виде прозрачного желтого масла: ЖХМС (ES) m/z = 252 (М+Н)+. с) 1,1-Диметилэтил [2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-3-фенилпропил]карбамат К раствору 1,1-диметилэтил (2-гидрокси-3-фенилпропил) карбамата (10,0 г, 39,8 ммоль), PPh3 (12,5 г, 47,8 ммоль) и фталимида (6,44 г, 43,8 ммоль) в ТГФ (125 мл) при комнатной температуре добавлялиDEAD (9,4 мл, 59,7 ммоль) в течение 5 мин. По прошествии 1 ч при комнатной температуре реакционный раствор концентрировали и очищали на диоксиде кремния (гексан/EtOAc, 2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (12,6 г, 83%): ЖХМС (ES) m/z 381 (М+Н)+.d) 1,1-Диметилэтил (2-амино-3-фенилпропил)карбамат NH2NH2 (12,5 мл, 394 ммоль) добавляли к ТГФ/МеОН (50 мл/50 мл) раствору 1,1-диметилэтил (2-амино-4-фенилбутил)карбамат (7,5 г, 19,7 ммоль) и перемешивали при 50 С в герметично закрытой системе. Через 12 ч твердые вещества отфильтровывали, промывая метанолом. Фильтрат концентрировали и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 0,5% NH4OH, с получением указанного в заголовке соединения (3,75 г, 76%) в виде белого твердого вещества: ЖХ-МС (ES) m/z = 251 (М+Н)+. Получение 3. Получение 1,1-диметилэтил (3-амино-3-фенилпропил)карбамата Бензоилацетонитрил (2 г, 13,8 ммоль) в ТГФ (35 мл) добавляли по каплям через капельную воронку к 0 С раствору LAH (1,6 г, 41,3 ммоль) в ТГФ (35 мл). Полученный раствор нагревали до 25 С и затем нагревали до 60 С еще в течение 2 ч. После охлаждения до 0 С добавляли по каплям насыщенный раствор тартрата натрия-калия и раствор экстрагировали несколько раз при помощи ДХМ. Объединенные органические фракции сушили (Na2SO4), концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 5-8% МеОН в DCM (1% NH4OH с получением аминоспирта (1,4 г, 67%) в виде прозрачного масла: ЖХМС (ES) m/z = 152 (М+Н)+. 3-Амино-1-фенил-1-пропанол (1,4 г, 9,27 ммоль) растворяли в ТГФ (50 мл) и добавляли одной порцией Boc2O (2,4 г, 11,1 ммоль). Через 30 мин раствор концентрировали и остаток очищали через диоксид кремния (0,5-1% МеОН в DCM (1% NH4OH с получением указанного в заголовке соединения (1,6 г,69%) в виде беловатого твердого вещества: ЖХМС (ES) m/z = 152 (М+Н)+. с) 1,1-Диметилэтил [3-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-3-фенилпропил]карбамат К раствору 1,1-диметилэтил (3-гидрокси-3-фенилпропил) карбамата (3 г, 11,95 ммоль), PPh3 (4 г,15,5 ммоль) и фталимида (1,8 г, 11,95 ммоль) в ТГФ (60 мл) при комнатной температуре добавлялиDEAD (2,4 мл, 15,5 ммоль) в течение 5 мин. По прошествии 1 ч при комнатной температуре реакционный раствор концентрировали и очищали на диоксиде кремния (гексан/EtOAc, 4:1) с получением указанного в заголовке соединения в виде белого твердого вещества (2,2 г, 48%): ЖХМС (ES) m/z = 381 Через 12 ч твердые вещества отфильтровывали, промывая метанолом. Фильтрат концентрировали и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 1% NH4OH, с получением указанного в заголовке соединения (1,1 г, 76%) в виде белого твердого вещества: ЖХ-МС 3-Хлорбензолкарбопероксокислоту (12,1 г, 54,0 ммоль) добавляли одной порцией к раствору 3 бутен-1-илбензола (7,15 г, 54,1 ммоль) в CH2Cl2 при 0 С с последующим нагреванием до 25 С в течение ночи. Добавляли насыщенный раствор NaHCO3 и смесь разделяли и полученное прозрачное масло (8,0 г,колич.) использовали далее без дополнительной очистки: ЖХ-МС (ES) m/z = 149 (М+Н)+. 2-(2-Фенилэтил)оксиран (8,0 г, 54 ммоль) помещали в герметично закрытую пробирку с 7 н. NH3 МеОН (130 мл) и перемешивали в течение 2 ч при 70 С с последующим концентрированием до прозрачного масла (и использовали без дополнительной очистки на следующей стадии). с) 1,1-Диметилэтил (2-гидрокси-4-фенилбутил)карбамат 1-Амино-4-фенил-2-бутанол (7,4 г, 50,0 ммоль) растворяли в ТГФ (50 мл) и добавляли одной порцией Boc2O (13 г, 59,6 ммоль). Через 30 мин раствор концентрировали и остаток очищали через пробку из диоксида кремния (5% МеОН в DCM (0,5% NH4OH с получением указанного в заголовке соединения (13,1 г, 91%) в виде прозрачного желтого масла: ЖХМС (ES) m/z = 266 (М+Н)+. К раствору 1,1-диметилэтил (2-гидрокси-4-фенилбутил)карбамата (3,0 г, 11,4 ммоль), PPh3 (3,6 г,13,7 ммоль) и фталимида (1,84 г, 12,5 ммоль) в ТГФ (60 мл) при комнатной температуре добавлялиDEAD (1,8 мл, 11,4 ммоль) в течение 5 мин. По прошествии 0,5 ч при комнатной температуре реакционный раствор концентрировали и очищали на диоксиде кремния (гексан/EtOAC, 2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (3,1 г, 69%): ЖХМС (ES) m/z = 395NH2NH2 (2,5 мл, 79,6 ммоль) добавляли к ТГФ/МеОН (40 мл/40 мл), раствору 1,1-диметилэтил (2 амино-4-фенилбутил)карбамата (3,1 г, 7,83 ммоль) и перемешивали в течение ночи. Через 12 ч раствор концентрировали и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 0,5% NH4OH, с получением указанного в заголовке соединения (1,4 г, 66%) в виде белого твердого вещества: ЖХ-МС (ES) m/z = 265 (М+Н)+. Получение 5. Получение 2-[(2S)-2-амино-3-фенилпропил]-1 Н-изоиндол-1,3(2 Н)диона(3,74 г, 14,4 ммоль) и фталимида (1,93 г, 13,1 ммоль) в ТГФ (75 мл) при комнатной температуре добавляли DEAD (2,8 мл, 17,8 ммоль) в течение 5 мин. По прошествии 1,5 ч при комнатной температуре реакционный раствор концентрировали и очищали на диоксиде кремния (гексан/EtOAC, 2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (4,3 г, 95%): ЖХМС (ES) m/z = 381b) 2-[(2S)-2-Амино-3-фенилпропил]-1 Н-изоиндол-1,3(2 Н)-дион. К раствору 1,1-диметилэтил [(1S)-2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-1-(фенилметил) этил]карбамата (4,3 г, 11,3 ммоль) в МеОН (100 мл) при комнатной температуре добавляли 4 М HCl в диоксане (50 мл). После перемешивания в течение 3 ч при комнатной температуре реакционный раствор концентрировали с получением белого твердого вещества (колич.): ЖХМС (ES) m/z = 281 (М+Н)+. Получение 6. Получение 2-(2S)-2-амино-3-[2-(трифторметил)фенил]пропил-1 Н-изоиндол 1,3(2 Н)диона К раствору N-[(1,1-диметилэтил)окси]карбонил-2-(трифторметил)-L-фенилаланина (5 г, 15 ммоль) в ТГФ (75 мл) при 0 С при перемешивании добавляли ВН 3-ТГФ (45 мл, 45 ммоль - 1 М в ТГФ). Через 12 ч реакцию гасили при помощи АсОН:МеОН (1:5, 24 мл) и смесь распределяли между насыщенным водным раствором NaHCO3 и ДХМ. Водную фазу затем экстрагировали несколько раз при помощи ДХМ. Объединенные органические фракции сушили над Na2SO4 и использовали непосредственно сразу(4,2 г, 13,2 ммоль), трифенилфосфина (4,5 г, 17,1 ммоль) и фталимида (1,9 г, 13,2 ммоль) в ТГФ (66 мл) при 25 С добавляли диэтилазодикарбоксилат (2,7 мл, 17,1 ммоль). После перемешивания при комнатной температуре в течение 1 ч реакционный раствор концентрировали в вакууме и остаток очищали на силикагеле (1% МеОН в ДХМ) с получением указанного в заголовке соединения (3,2 г, 54%) в виде белого твердого вещества: ЖХМС (ES) m/z = 449 (М+Н)+. с) 2-(2S)-2-Амино-3-[2-(трифторметил)фенил]пропил-1 Н-изоиндол-1,3(2 Н)-дион. К раствору 1,1-диметилэтил 1S)-2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-1-[2-(трифторметил)фенил]метилэтил)карбамата (3,2 г, 7,1 ммоль) в МеОН (35 мл) при комнатной температуре добавляли раствор 4 М HCl в диоксане (18 мл). Через 12 ч раствор концентрировали с получением указанного в заголовке соединения (2,7 г, колич.) в виде соли HCl: ЖХМС (ES) m/z = 349 (М+Н)+. Получение 7. Получение 5-(5,5-диметил-1,3,2-диоксаборинан-2-ил)-1-метил-1 Н-пиразола К раствору 1-метилпиразола (4,1 г, 50 ммоль) в ТГФ (100 мл) при 0 С добавляли n-BuLi (2,2 М в ТГФ, 55 ммоль). Реакционный раствор перемешивали в течение 1 ч при комнатной температуре и затем охлаждали до -78 С [J. Heterocyclic Chem. 41, 931 (2004)]. К реакционному раствору добавляли 2 изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (12,3 мл, 60 ммоль). По прошествии 15 мин при-78 С реакционной смеси давали нагреться до 0 С в течение 1 ч. Реакционную смесь разбавляли насыщенным раствором NH4Cl и экстрагировали при помощи ДХМ. Органические фракции промывали при помощи H2O (2100 мл), сушили над Na2SO4 и концентрировали в вакууме с получением рыжеватокоричневого твердого вещества (8,0 г, 77%), которое использовали без дополнительной очистки. ЖХМС К раствору цианоуксусной кислоты (2 г, 23,5 ммоль) в ТГФ (100 мл) при -78 С добавляли nBuLi (10 мл, 25,9 ммоль, 2,5 М в гексане). Через 30 мин добавляли по каплям фенилацетилхлорид (1,6 мл, 11,8 ммоль). Еще через 30 мин раствор распределяли между 1 н. HCl-Et2O и водную фазу промывали несколько раз при помощи Et2O. Объединенные органические фракции сушили над Na2SO4, концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 30% EtOAc в гексане) с получением указанного в заголовке соединения (770 мг, 40%) в виде рыжевато-коричневого масла: ЖХМС (ES)b) 1,1-Диметилэтил (3-гидрокси-4-фенилбутил)карбамат. Раствор 3-оксо-4-фенилбутаннитрила (1,1 г, 6,92 ммоль) в ТГФ (10 мл) добавляли к 0 С раствору литийалюминийгидрида (787 мг, 20,8 ммоль) в ТГФ (25 мл). Через 12 ч раствор гасили при помощи Н 2 О(943 мкл), 6 н. NaOH (716 мкл) и Н 2 О (3,5 мл). Образовавшийся осадок отфильтровывали и лепешку промывали несколько раз при помощи ДХМ. Фильтрат концентрировали, затем снова растворяли в ТГФ (30 мл) и добавляли одной порцией Boc2O (1,5 г, 6,92 ммоль). Через 30 мин раствор концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 3% МеОН в ДХМ (1% NH4OH с получением указанного в заголовке соединения (1 г, 55% - 2 стадии) в виде оранжевого твердого вещества: ЖХМС (ES) m/z = 265 (М+Н)+. К раствору 1,1-диметилэтил (3-гидрокси-4-фенилбутил)карбамата (1 г, 3,77 ммоль), PPh3 (1,3 г, 4,91 ммоль) и фталимида (555 мг, 3,77 ммоль) в ТГФ (18 мл) при комнатной температуре добавляли DEAD(772 мкл, 4,91 ммоль) в течение 5 мин. По прошествии 1 ч при комнатной температуре реакционный раствор концентрировали и очищали на диоксиде кремния (гексан/EtOAc, 5:1) с получением указанного в заголовке соединения в виде белого твердого вещества (725 мг, 49%): ЖХМС (ES) m/z =395 (М+Н)+.NH2NH2 (577 мкл, 18,4 ммоль) добавляли к ТГФ/МеОН (1:1, 10 мл) раствору 1,1-диметилэтил [3(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-4-фенилбутил]карбамата (725 мг, 1,84 ммоль) и перемешивали при 50 С в герметично закрытой системе. Через 12 ч твердые вещества отфильтровывали, промывая метанолом. Фильтрат концентрировали и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 1% NH4OH, с получением указанного в заголовке соединения (483 мг, ко- 25018038 лич.) в виде белого твердого вещества: ЖХ-МС (ES) m/z = 264 (М+Н)+. Получение 9. Получение 4-бром-5-метил-2-тиофенкарбоновой кислоты Раствор брома (725 мкл, 14,1 ммоль) в АсОН (2,8 мл) добавляли по каплям к 5-метил-2 тиофенкарбоновой кислоте (2 г, 14,1 ммоль) и FeCl3 (456 мг, 2,81 ммоль) в АсОН (28 мл) при 25 С. Через 5 ч раствор выливали на лед и осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (3 г, колич.) в виде желтого порошка: ЖХМС (ES) m/z = 222 (М+Н)+. Получение 10. Получение метил 4-бром-5-метил-2-тиофенкарбоксилата Раствор 4-бром-5-метил-2-тиофенкарбоновой кислоты (3 г, 13,6 ммоль) в МеОН (67 мл) и H2SO4 (3 мл) перемешивали при 50 С. Через 12 ч раствор добавляли к смеси лед-Н 2 О и рН доводили до 11. Водную фазу экстрагировали несколько раз при помощи ДХМ и объединенные органические фракции сушили над Na2SO4, концентрировали и использовали непосредственно с получением указанного в заголовке соединения (3 г, 94%) в виде оранжевого твердого вещества: ЖХМС (ES) m/z = 236 (М+Н)+. Получение 11. Получение 4-бром-5-хлор-2-тиофенкарбоновой кислоты Раствор брома (634 мкл, 12,3 ммоль) в АсОН (2,5 мл) добавляли по каплям к 5-хлор-2 тиофенкарбоновой кислоте (2 г, 12,3 ммоль) и FeCl3 (399 мг, 2,50 ммоль) в АсОН (25 мл) при 25 С. Реакционную смесь нагревали до температуры кипения с обратным холодильником, при этом добавляли дополнительное количество брома (634 мкл, 12,3 ммоль) и FeCl3 (399 мг, 2,50 ммоль). Через 7 дней раствор выливали на лед и осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (3 г, колич.) в виде желтого порошка: ЖХМС (ES) m/z = 242 (М+Н)+. Получение 12. Получение 1,1-диметилэтил (3-амино-3-фенилпропил)метилкарбамата 3-(Метиламино)-1-фенил-1-пропанол (4,12 г, 24,9 ммоль) растворяли в ТГФ (30 мл) и добавляли одной порцией Boc2O (1 М/ТГФ, 30 мл, 30 ммоль). Через 30 мин раствор концентрировали и остаток очищали через пробку из диоксида кремния (5% МеОН в ДХМ (0,5% NH4OH с получением указанного в заголовке соединения (6,4 г, 97%) в виде прозрачного желтого масла: ЖХМС (ES) m/z = 265 (М+Н)+.(3,3 г, 12,7 ммоль) и фталимида (1,86 г, 12,6 ммоль) в ТГФ (50 мл) при комнатной температуре добавлялиDEAD (1,98 мл, 12,6 ммоль) в течение 5 мин. По прошествии 0,5 ч при комнатной температуре добавляли МеОН (10 мл) и реакционный раствор абсорбировали на диоксиде кремния и очищали при помощи хроматографии (гексан/EtOAC, 2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (2,7 г, 65%): ЖХМС (ES) m/z = 395 (М+Н)+. с) 1,1-Диметилэтил (3-амино-3-фенилпропил)метилкарбамат. шивали в течение ночи. Через 12 ч раствор абсорбировали на диоксиде кремния и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 0,5% NH4OH, с получением указанного в заголовке соединения (1,4 мг, 77%) в виде белого твердого вещества: ЖХ-МС (ES) m/z = 265Galons, H. et al. Eur. J. Med. Chem. Chim. Ther. 1979 14, 165-170] в ТГФ (390 мл) при комнатной температуре добавляли (Вос)2O (21,6 г, 99 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакционный раствор абсорбировали на диоксиде кремния и очищали при помощи хроматографии(35% EtOAc/гексан) с получением указанного в заголовке соединения (11,6 г, 56%) в виде прозрачного желтого масла: ЖХМС (ES) m/z = 266 (М+Н)+.(14,3 г, 54,5 ммоль) и фталимида (8,7 г, 59,1 ммоль) в ТГФ (220 мл) при комнатной температуре добавляли DEAD (8,5 мл, 54 ммоль) в течение 15 мин. По прошествии 0,5 ч при комнатной температуре добавляли МеОН (10 мл) и реакционный раствор абсорбировали на диоксиде кремния и очищали при помощи хроматографии (гексан/EtOAC, 2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (9,97 г, 57%): ЖХМС (ES) m/z = 395 (М+Н)+. с) 1,1-Диметилэтил (2-амино-3-фенилпропил)метилкарбамат.NH2NH2 (7 мл, 0,2 моль) добавляли к ТГФ/МеОН (100 мл/25 мл) раствору 1,1-диметилэтил [2-(1,3 диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-3-фенилпропил]метилкарбамата (2,7 г, 6,8 ммоль) и перемешивали в течение ночи. Через 12 ч раствор абсорбировали на диоксиде кремния и очищали колоночной хроматографией с использованием 5% МеОН в CHCl3, содержащем 0,5% NH4OH, с получением указанного в заголовке соединения (5,8 мг, 88%) в виде белого твердого вещества: ЖХ-МС (ES) m/z = 265 (М+Н)+. Получение 14. Получение 2-(2-амино-3-метил-3-фенилбутил)-1 Н-изоиндол-1,3(2 Н)-диона К раствору KHMDS (36 мл, 17,9 ммоль) в ТГФ (70 мл) при -78 С добавляли метил 3-метил-3 фенилбутаноат (3 г, 15,6 ммоль) в ТГФ (15 мл) по каплям. Через 1 ч добавляли по каплям трисилазид (5 г, 18,7 ммоль) в ТГФ (15 мл) в течение 10 мин. Еще через 5 мин добавляли уксусную кислоту (4,1 мл) и реакционную смесь нагревали до 25 С в течение 1 ч. Раствор затем распределяли между Н 2 О-ДХМ и водную фазу промывали несколько раз при помощи ДХМ. Объединенные органические фракции сушили над Na2SO4, концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния,20% EtOAc в гексане) с получением указанного в заголовке соединения (2,6 г, 71%), содержащего в виде примеси 33% метил 3-метил-3-фенилбутаноата, которое очищали на следующих стадиях: ЖХМС (ES) Раствор метил 2-азидо-3-метил-3-фенилбутаноата (2,6 г, 11,2 ммоль) и PPh3 (4,4 г, 16,7 ммоль) в Н 2 О (400 мкл) и ТГФ (100 мл) перемешивали при 25 С в течение 2 дней, затем при 50 С в течение 12 ч. Раствор концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 5% МеОН в ДХМ (1% NH4OH с получением указанного в заголовке соединения (1,4 г, колич.): ЖХМС К раствору метил ,-диметилфенилаланината (1,4 г, 6,76 ммоль) в ТГФ (20 мл) при 0 С добавляли по каплям раствор литийалюминийгидрида (384 мг, 10,1 ммоль) в ТГФ (10 мл). После нагревания до 25 С в течение 12 ч раствор гасили путем последовательного добавления H2O (659 мкл), 6 н. раствораNaOH (500 мкл) и H2O (2,4 мл). Образовавшийся осадок отфильтровывали и фильтровальную лепешку тщательно промывали при помощи ДХМ. Фильтрат концентрировали и очищали при помощи колоночной хроматографии (диоксид кремния, 2-5% МеОН в ДХМ (1% NH4OH с получением указанного в заголовке соединения (770 мг, 64%): ЖХМС (ES) m/e = 179 (М+Н)+.Boc2O (1 г, 4,76 ммоль) добавляли одной порцией к 2-амино-3-метил-3-фенил-1-бутанолу (770 мг,4,33 ммоль) в ТГФ (20 мл) при 25 С. Через 30 мин раствор концентрировали с получением указанного в заголовке соединения (1,2 г, колич.) в виде белого твердого вещества, которое использовали без дополнительной очистки: ЖХМС (ES) m/e = 279 (М+Н)+. е) 1,1-Диметилэтил 1-[(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)метил]-2-метил-2-фенилпропил карбамат К раствору 1,1-диметилэтил [1-(гидроксиметил)-2-метил-2-фенилпропил]карбамата (775 мг, 2,8 ммоль), трифенилфосфина (915 мг, 3,5 ммоль) и фталимида (499 мг, 3,4 ммоль) в ТГФ (15 мл) при 25 С добавляли диэтилазодикарбоксилат (0,54 мл, 3,4 ммоль). После перемешивания при комнатной температуре в течение 1 ч добавляли МеОН (5 мл) и раствор адсорбировали на диоксиде кремния и очищали при помощи колоночной хроматографии (1% МеОН в ДХМ) с получением указанного в заголовке соединения (723 мг, 64%) в виде белого твердого вещества: ЖХМС (ES) m/z = 409 (М+Н)+. К раствору 1,1-диметилэтил 1-[(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)метил]-2-метил-2 фенилпропилкарбамата (723 мг, 1,77 ммоль) в CHCl3:МеОН (10:1, 55 мл) при комнатной температуре добавляли раствор 4 М HCl в диоксане (10 мл). После перемешивания в течение 3 ч при комнатной температуре реакционный раствор концентрировали с получением белого твердого вещества (колич.): ЖХМС (ES) m/z = 309 (М+Н)+. Получение 15. Получение 5-иод-1-метил-1 Н-1,2,4-триазолаnBuLi в Et2O при -70 С. Смесь перемешивали в течение 60 мин при -70 С и давали нагреться до -30 С. Медленно добавляли раствор I2 (6,5 г, 25,6 ммоль) в ТГФ (27 мл) в течение 15 мин и смеси давали нагреться до комнатной температуры и перемешивали в течение 60 мин. Смесь распределяли при помощи насыщенного раствора Na2S2O3, фазы разделяли и органический растворитель удаляли. Неочищенный иодид использовали без дополнительной очистки: ЖХМС (ES) m/z = 210 (М+Н)+. Получение 16. Получение 1,1-диметилэтил [2-амино-2-(1-нафталенил)этил]карбамата К раствору цианид калия в простом эфире (100 мл) при 0 С добавляли по каплям смесь 1 нафталенкарбальдегида (1,56 г, 10 ммоль) и уксусной кислоты (1,41 г, 23,5 ммоль) в простом эфире (10 мл). Полученную смесь нагревали до 25 С в течение 20 ч, осадок отфильтровывали и фильтрат концентрировали с получением указанного в заголовке соединения в виде прозрачного масла (1,67 г, 9,14 ммоль, 91%): ЖХМС (ES) m/z = 184 (М+Н)+. К раствору гидрокси(1-нафталенил)ацетонитрила (1,67 г, 9,14 моль) в ТГФ (90 мл) при 0 С добавляли по каплям раствор LAH-ТГФ (1 М, 11 мл, 11 ммоль). Через 2 ч раствор гасили путем последовательного добавления Н 2 О (0,42 мл), 6 н. раствора NaOH (6M, 0,32 мл) и H2O (1,6 мл). Образовавшийся осадок отфильтровывали и фильтрат концентрировали и использовали непосредственно с получением указанного в заголовке соединения (0,897 г, 4,8 ммоль, 53%) в виде прозрачного масла: ЖХМС (ES) m/z = 188Boc ангидрид (1,155 г, 5,3 ммоль). После перемешивания при комнатной температуре в течение 12 ч реакционный раствор концентрировали и распределяли между насыщенным раствором NaHCO3/ДХМ. Водную фазу промывали несколько раз при помощи ДХМ. Объединенные органические фракции сушили над Na2SO4, концентрировали и использовали непосредственно с получением указанного в заголовке соединения в виде белого твердого вещества (1,378 г, 4,8 ммоль, колич.): ЖХМС (ES) m/z = 288 (М+Н)+.
МПК / Метки
МПК: A61K 31/12
Метки: ингибиторы, активности
Код ссылки
<a href="https://eas.patents.su/30-18038-ingibitory-aktivnosti-akt.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы активности akt</a>
Предыдущий патент: Способ повышения уровней эритроцитов
Следующий патент: Ядерный фактор перепрограммирования
Случайный патент: Способ восстановления твердых веществ, содержащих оксид железа, и установка для его осуществления












