Производные сульфонилмочевины и их применение для контроля активности интерлейкина-1
Формула / Реферат
1. Соединение формулы
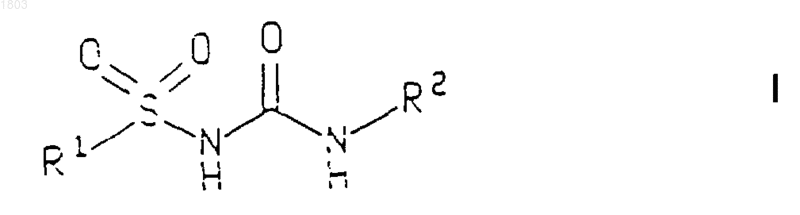
или его фармацевтически приемлемая соль,
где R1 представляет собой:
1,1-диоксо-1-тиохроманил, возможно замещенный (С1-С6)алкилом, 8-гидрокси-5,6,7,8-тетрагидронафтил; 8-оксо-5,6,7,8-тетрагидронафтил; 8-гидроксиимино-5,6,7,8-тетрагидронафтил; или фенил, тиенил, 5,6,7,8-тетрагидронафтил, фуранил, индолил, бензоимидазолил, каждый из которых возможно замещен 1-3 заместителями, выбранными из группы: (С1-С6)алкил, возможно замещенный 1-2 заместителями, выбранными из гидрокси, амино, (С1-С6)алкокси, перфторо(С1-С6)алкила, фенилокси, замещенного (С1-С6)ацилом, гидрокси(С3-С6) циклоалкил, галогено, перфторо(С1-С6)алкил, (С1-С6)алкиламиносульфонил, ((С1-С6)алкил)2аминосульфонил, (С1-С6)алкилтио, (С1-С6)алкилсульфинил, (С1-С6)алкилсульфонил, аминосульфонил, (С3-С7)циклоалкиламиносульфонил, диоксоланил, возможно замещенный (С1-С6)алкилом, (С1-С6)алкокси, амино, имидазолил, фуранил, группа формулы
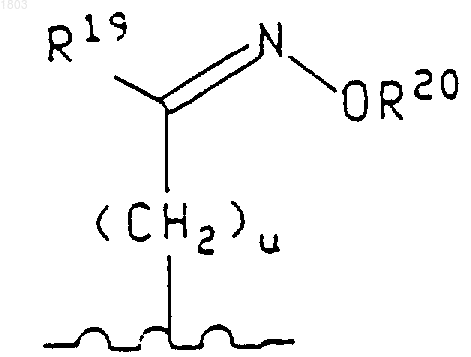
где u равно 0, 1,
R19 представляет собой водород или (С1-С6)алкил,
R20 представляет собой водород, (С1-С6)алкил, (С1-С6)карбоксиалкил или фенил(С1-С6)алкил, группа формулы
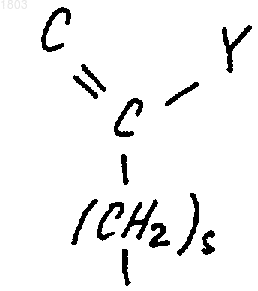
где s равно 0 или 1,
Y представляет собой водород, (С1-С6)алкил, перфтор(С1-С6)алкил, (С1-С6)алкокси(С1-С6)алкил, NR9R10, где R9 и R10, каждый независимо, выбран из водорода и (С1-С6)алкила;
R2 представляет собой фенил или 1,2,3,5,6,7-гексагидроиндаценил, каждый из которых возможно замещен 1-3 заместителями, выбранными из группы, состоящей из галогено, (С1-С6)алкила (линейного или разветвленного), циано, тиенила, фенила, группы формулы
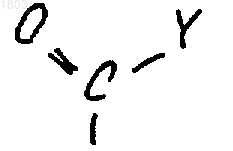
где Y представляет собой (С1-С6)алкил или амино.
2. Соединение по п.1, где R1 представляет собой 8-гидрокси-5,6,7,8-тетрагидронафтил; 8-оксо-5,6,7,8-тетрагидронафтил; 8-гидроксиимино-5,6,7,8-тетрагидронафтил; индолил; бензоимидазолил; или фенил, тиенил, фуранил, каждый из которых возможно замещен галогено, (С1-С6)алкилом, который возможно замещен 1-2 гидрокси, (С3-С7)циклоалкиламиносульфонилом, (С1-С6)алкиламиносульфонилом, диоксоланилом, который возможно замещен (C1-С6)алкилом, группой формулы
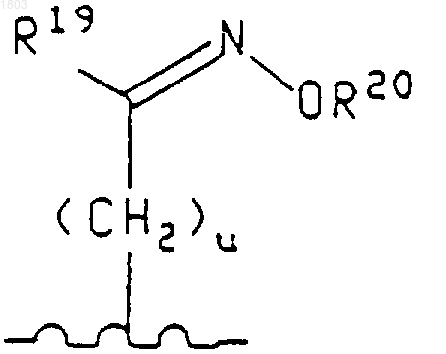
где u равно 0, 1,
R19 представляет собой (С1-С6)алкил,
R20 представляет собой водород, или
группой формулы
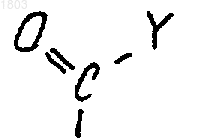
где Y представляет собой водород, (С1-С6)алкил, (С1-С6)алкокси(С1-С6)алкил.
3. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
1-(4-хлор-2,6-диизопропил-фенил)-3-[3-(1-гидрокси-1-метил-этил)-бензосульфонил]-мочевины;
1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины;
1-(1,2,3,5,6,7-гексагидро-4-аза-s-индацен-8-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины;
1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины;
1-(4-[1,3]диоксолан-2-ил-фуран-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины;
1-(2,6-диизопропил-фенил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины;
1-(2,6-диизопропил-фенил)-3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины;
1-(4-ацетил-тиофен-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины;
1-(1Н-бензимидазол-5-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины;
1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины;
1-(8-хлор-1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины;
1-(4-ацетил-фуран-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины;
1-(8-фтор-1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины;
1-(4-фтор-2,6-диизопропил-фенил)-3-[3-(1-гидрокси-1-метил-этил)-бензолсульфонил]-мочевины;
1-(6-фтор-1Н-бензимидазол-5-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины;
1-(4-хлор-2,6-диизопропил-фенил)-3-(1Н-индол-6-сульфонил)-мочевины;
1-(4-хлор-2,6-диизопропил-фенил)-3-(5-фтор-1Н-индол-6-сульфонил)-мочевины;
1-[1,2,3,5,6,7-гексагидро-s-индацен-u-ил)-3-(1Н-индол-6-сульфонил)-мочевины;
1-(5-фтор-1Н-индол-6-сульфонил)-(1,2,3,5,6,7-гексагидро-5-индацен-4-ил)-мочевины;
1-[4-хлор-2,6-диизопропил-фенил]-3-[2-фтор-5-(2-метил-(1,3)диоксолан-2-ил)-бензолсульфонил]-мочевины;
3-[3-[4-хлор-2,6-диизопропил-фенил]-уреидосульфонил]-N-метил-бензолсульфонамида;
1-[2-фтор-5-(2-метил-(1,3)диоксолан-2-ил)-бензолсульфонил]-3-(1,2,3,5,6,7-гексагидроиндацен-4-ил)-мочевины и
3-[3-(1,2,3,5,6,7-гексагидро-S-индацен-4-ил)-уреидосульфонил]-N-метил-бензолсульфонамида.
4. Фармацевтическая композиция для лечения менингита и сальпингита, септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресс-синдрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита, эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита, реперфузионного повреждения, васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-против-хозяина, аутоиммунных заболеваний, включая сахарный диабет типа I и рассеянный склероз, заболеваний периодонта, интерстициального фиброза легких, цирроза, системного склероза, келоидного образования, опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения, депрессии, атеросклероза и остеопороза у млекопитающего, в том числе человека, содержащая введение количества соединения по п.1 или его фармацевтически приемлемой соли, эффективного при таком лечении или ингибировании, и фармацевтически приемлемый носитель.
5. Способ лечения состояния, выбранного из группы, состоящей из менингита и сальпингита, септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресс-синдрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита, эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита, реперфузионного повреждения, васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-против-хозяина, аутоиммунных заболеваний, включая сахарный диабет типа I и рассеянный склероз, заболеваний периодонта, интерстициального фиброза легких, цирроза, системного склероза, келоидного образования, опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения, депрессии, атеросклероза и остеопороза у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят количество соединения по п.1 или его фармацевтически приемлемой соли, эффективное при лечении такого состояния.
6. Соединение 4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонамид.
Текст
1 Предпосылки изобретения Это изобретение относится к замещенным производным мочевины, которые полезны при лечении воспаления суставов, центральной нервной системы, желудочно-кишечного тракта,эндокардия, перикардия, легких, глаз, кожи и мочеполовой системы. Более конкретно, это изобретение относится к арил- и гетероарилзамещенным сульфонилмочевинам, которые пригодны в качестве ингибиторов процессинга и высвобождения интерлейкина-1 и интерлейкина-1. Статус интерлейкина-1 (ИЛ-1) как важного медиатора воспаления основан на многих исследованиях, демонстрирующих провоспалительную активность этого цитокина. In vivo эти эффекты проявляются в виде стимуляции резорбции хряща, индуцировании пополнения лейкоцитов и реакции острой фазы, а также продуцировании лихорадочного состояния и состояния, подобного шоку. Изменения, которые опосредованы связыванием ИЛ-1 с его рецептором, включают в себя регуляцию адгезионных молекул и хемокинов, стимуляцию синтеза металлопротеаз, усиленный синтез циклооксигеназы-2 и фосфолипазы А 2 и следовательно увеличение продукции простагландинов,индукцию синтазы оксида азота и следовательно увеличение продукции оксида азота и стимуляцию синтеза ИЛ-6, приводящую к изменениям синтеза белков острой фазы. Две индивидуальные формы ИЛ-1 (ИЛ-1 и ИЛ-1) продуцируются моноцитами и макрофагами в ответ на воспалительные стимулы. Первичным трансляционным продуктом ИЛ-1 у человека является полипептид с молекулярной массой 31 кДа, который не способен связываться с рецепторами ИЛ-1 на клеткахмишенях. Чтобы стимулировать биологическую активность ИЛ-1, про-ИЛ-1 сначала должен быть расщеплен тиоловой протеазой с образованием зрелого вида полипептида с молекулярной массой 17 кДа. Эта протеаза, конвертаза интерлейкина-1 (ICE), является членом нового семейства цитоплазматических протеаз, которые требуют остатка аспарагиновой кислоты на субсайте Р 1 их субстратов. В отличие от проИЛ-1 про-ИЛ-1 с молекулярной массой 31 кДа способен связываться с рецепторами ИЛ-1. Тем не менее, этот цитокин также процессируется протеазой до вида с молекулярной массой 17 кДА, отличающегося от ICE. Обе формы ИЛ-1 синтезируются без сигнальных последовательностей, и в результате эти цитокины накапливаются в цитоплазме активированных липополисахаридом (LPS) моноцитов и макрофагов. Таким образом, в отличие от большинства секретируемых цитокинов, которые процессируются посредством обычного секреторного аппарата клетки, включающего в себя эндоплазматический ретикулум и аппарат 2 Гольджи, ИЛ-1 должен получать доступ к внеклеточному компартменту посредством нового секреторного пути. Элементы механизма этого пути остаются неизвестными. Однако недавние исследования показали, что синтез ИЛ-1 не сочетается с его секрецией. Средства, которые служат стимулами, способствующими посттрансляционному процессингу (как протеолитическому расщеплению посредством ICE, так и высвобождению зрелого вида с молекулярной массой 17 кДа), включают в себя АТФ, цитолитические Т-клетки и ионофоры, такие как нигерицин. Важно, что in vivo LPS-активированным мышиным перитонеальным макрофагам требуется также вторичный стимул, способствующий эффективному высвобождению зрелого ИЛ-1,и было показано, что для этого служит АТФ. Таким образом, продукция ИЛ-1 и in vivo, и invitro строго регулируется благодаря тому, что требует особых стимулов, способствующих транскрипции, трансляции и посттрансляционному созреванию/высвобождению. Терапевтические подходы, которые состоят в стремлении к ингибированию ICE как к средству регулирования продукции ИЛ-1, вероятно, будут ограниченными, потому что ингибиторы ICE: 1) не блокируют высвобождение про-ИЛ-1, который может процессироваться вне клеток другими протеазами с образованием зрелого биологически активного вида цитокина,и 2) не снижают продукцию ИЛ-1 активированными моноцитами/макрофагами. Поэтому терапевтический подход, который состоит в предотвращении активации посттрансляционного процессинга и высвобождения ИЛ-1, вероятно, обеспечит более высокую эффективность,чем эффективность ингибиторов ICE, посредством блокирования выхода из клеток обоих видов цитокина. Способные продуцировать ИЛ-1 клетки млекопитающих включают в себя, но не ограничены ими, кератиноциты, эндотелиальные клетки, мезангиальные клетки, эпителиальные клетки тимуса, кожные фибробласты, хондроциты, астроциты, клетки глиомы, мононуклеарные фагоциты, гранулоциты, Т- и В-лимфоциты и NК-клетки (естественные киллерные клетки). Активности интерлейкина-1 многочисленны. Подкожное введение ИЛ-1 приводит к лихорадочному состоянию, сонливости, анорексии, генерализованной миалгии, артралгии, головной боли и при дальнейшем воздействии к гипотензии. Также наблюдаются маргинация нейтрофилов и предельная экстраваскулярная инфильтрация полиморфно-нуклеарными(PMN) лейкоцитами. Кроме того, ИЛ-1 стимулирует хондроциты к высвобождению матриксных металлопротеаз, что приводит к деградации хрящевого матрикса. Соответственно, болезненные состояния,при которых в качестве терапевтических аген 3 тов могут быть использованы ингибиторы процессинга и высвобождения ИЛ-1 формулы I,включают в себя, но не ограничены ими, инфекционные заболевания, при которых активная инфекция существует в любом месте организма,такие как менингит и сальпингит; осложнения инфекций, в том числе септический шок, диссеминированная внутрисосудистая коагуляция и/или респираторный дистресс-синдром взрослых; острые и хронические воспаления вследствие отложения антигенов, антител и/или комплемента; воспалительные состояния, включая артрит, холангит, колит, энцефалит, эндокардит,гломерулонефрит, гепатит, миокардит, панкреатит, перикардит, реперфузионное повреждение и васкулит. Заболевания иммунного генеза, которые могут реагировать на ингибиторы процессинга и высвобождения ИЛ-1 формулы I,включают в себя, но не ограничены ими, состояния с вовлечением Т-клеток и/или макрофагов, такие как острая и замедленная гиперчувствительность; отторжение трансплантата; реакция трансплантат-против-хозяина, аутоиммунные заболевания, в том числе сахарный диабет типа 1 и рассеянный склероз. Ингибиторы процессинга и высвобождения ИЛ-1 формулы I также могут быть использованы при лечении резорбции кости и хряща, а также заболеваний,приводящих к избыточному отложению внеклеточного матрикса. Такие заболевания включают в себя заболевания периодонта, интерстициальный фиброз легких, цирроз, системный склероз и келоидное образование. Ингибиторы процессинга и высвобождения ИЛ-1 формулы I также могут быть использованы при лечении некоторых опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, и для предотвращения кахексии, связанной с некоторыми опухолями. Ингибиторы процессинга и высвобождения ИЛ-1 формулы I также могут быть использованы при лечении неврологических заболеваний с воспалительной составляющей, которые включают в себя, но не ограничены ими, болезнь Альцгеймера, депрессию или перкуссионное повреждение. Ингибиторы процессинга и высвобождения ИЛ-1 также могут быть использованы при лечении сердечно-сосудистых заболеваний, где играет роль пополнение моноцитов в субэндотелиальное пространство, таких как развитие атеросклеротических бляшек. Резюме изобретения Настоящее изобретение относится к соединению формулы или его фармацевтически приемлемой соли,где R1 представляет собой (С 1-С 6)алкил, который возможно замещен (С 1-С 6)алкиламино, (С 1 С 6)алкилтио, (С 1-С 6)алкокси, трифторметилом, 001803R1 и R2, каждый независимо, представляют собой группу формулы где пунктирные линии обозначают возможные двойные связи;n равно 0, 1, 2 или 3; А, В, D, Е и G, каждый независимо, представляют собой кислород, серу, азот или CR5R6,где R5 и R6, каждый независимо, выбраны из водорода, (С 1-С 6)алкила, который возможно замещен одной или двумя группами, выбранными из (С 1-С 6)алкиламино, (С 1-С 6)алкилтио,(С 1-С 6)алкокси, гидрокси, циано, перфтор(С 1 С 6)алкила, (С 6-С 10)арила, (С 5-С 9)гетероарила,(С 6-С 10)ариламино, (С 6-С 10)арилтио, (С 6-С 10) арилокси, где арильная группа возможно замещена (С 1-С 6)алкокси, (С 1-С 6)ацилом, карбокси,гидрокси или галогено; (С 5-С 9)гетероариламино,(С 5-С 9)гетероарилтио,(С 5-С 9)гетероарилокси,(С 6-С 10)арил(С 6-С 10)арила, (С 3-С 6)циклоалкила,гидрокси, пиперазинила, (С 6-С 10) арил(С 1(С 5-С 9)гетероарил(С 1-С 6)алкокси,С 6)алкокси,(С 1-С 6)ациламино, (С 1-С 6)ацилтио, (С 1-С 6)ацилокси, (С 1-С 6)алкилсульфинила, (С 6-С 10)арилсульфинила,(С 1-С 6)алкилсульфонила,(С 6 С 10)арилсульфонила, амино, (С 1-С 6)алкиламино или С 1-С 6)алкил)2 амино; галогено, циано, амино, гидрокси, перфтор(С 1-С 6)алкила, перфтор(С 1-С 6)алкокси, (С 2-С 6)алкенила, карбокси(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 1-С 6) алкиламино, С 1-С 6)алкил)2 амино, (С 1-С 6)алкилсульфониламидо,(С 1-С 6)алкилсульфинила,аминосульфонила, (С 1-С 6)алкиламиносульфонила, С 1-С 6)алкил)2 аминосульфонила, (С 1-С 6) алкилтио, (С 1-С 6)алкокси, перфтор(С 1-С 6)алкила, (С 6-С 10)арила, (С 5-С 9)гетероарила, (С 6-С 10) ариламино, (С 6-С 10)арилтио, (С 6-С 10)арил(С 1-С 6) алкокси, (С 5-С 9)гетероариламино, (С 5-С 9)гетероарилтио, (С 5-С 9)гетероарилокси, (С 3-С 6)циклоалкила, (С 1-С 6)алкил(гидроксиметилен)а, пиперидила, пиридинила, тиенила, фуранила, (С 1-С 6) алкилпиперидила, (С 1-С 6)ациламино, (С 1-С 6) ацилтио, (С 1-С 6)ацилокси, R7(С 1-С 6)aлкилa, где где s равно числу от 0 до 6;t равно 0 или 1; Х представляет собой кислород или NR8,где R8 представляет собой водород, (С 1 С 6)алкил или (С 3-С 7)циклоалкил(С 1-С 6)алкил;Y представляет собой водород, гидрокси,(С 1-С 6)алкил, который возможно замещен галогено, гидрокси или циано; (С 1-С 6)алкокси, циано, (С 2-С 6)алкинил, (С 6-С 10)арил, где арильная группа возможно замещена галогено, гидрокси,карбокси, (С 1-С 6)алкилом, (С 1-С 6)алкокси; перфтор(С 1-С 6)алкил, (С 1-С 6)алкокси(С 1-С 6)алкил или NR9R10, где R9 и R10, каждый независимо,выбраны из группы, состоящей из водорода,(С 1-С 6)алкила, который возможно замещен (С 1 С 6)алкилпиперидилом,(С 6-С 10)арилпиперидилом, (С 5-С 9)гетероарилпиперидилом, (С 6-С 10) арилом, (С 5-С 9)гетероарилом или (С 3-С 6)циклоалкилом; пиперидил, (С 1-С 6)алкилпиперидил,(С 6-С 10)арилпиперидил,(С 5-С 9)гетероарилпиперидил, (С 1-С 6)ацилпиперидил, (С 6-С 10)арил,(С 5-С 9)гетероарил, (С 3-С 6)цикпоалкил, R11(С 2 С 6)aлкил, (С 1-С 5)aлкил(CHR11)(С 1-С 6)aлкил, где(CHR )(С 1-С 6)aлкил, где R12 представляет собой пиперидил или (С 1-С 6)алкилпиперидил; иJ и L, каждый независимо, представляют собой кислород или серу;R22 представляет собой водород, (С 1 С 6)алкил, который возможно замещен гидрокси,галогено,(С 1-С 6)алкилтио,(С 1-С 6)алкилсульфинилом или (С 1-С 6)алкилсульфонилом; или, когда n равно 1 и В и D оба представляют собой CR5, эти две группы R5, взятые вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулы где пунктирные линии обозначают возможные двойные связи;CR5R6, где R5 и R6 являются такими, как определено выше; или, когда А и В, либо когда n равно 1 и В и D, или D и Е, или Е и G оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углерода, к которым они присоединены, могут образовывать (С 5-С 9)циклоалкильную группу, которая возможно замещена гидрокси или бензогруппой; или, когда n равно 1 и D и Е оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углерода, к которым они присоединены, могут образовывать группу формулы где пунктирная линия обозначает возможную двойную связь;R представляет собой гидрокси, (С 1-С 6) алкокси или (С 6-С 10)арил(С 1-С 6)алкокси; или гидрокси; или R25SO2, где R25 определен так же, как выше R1, или представляет собой (С 3-С 7) циклоалкиламино; и при условии, что группы формул II и VI не могут иметь два кислорода, две серы или кислород и серу в соседних положениях; при условии, что R2 должен быть ароматическим; при условии, что, когда одно из а или е равно нулю, другое равно 1; при условии, что, когда b и d равны 1,сумма а, с и е не может быть равна 6 или 7; и при условии, что, когда А, В, D, Е, G, Т, U,V и W представляют собой sp2 углерод, R6 не существует. Термин "алкил", используемый в этом документе, если не указано иначе, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие нормальные, разветвленные или циклические группировки или их комбинации. Термин "алкокси", используемый в этом документе, включает в себя O-алкильные группы, где "алкил" определен выше. Термин "арил", используемый в этом документе, если не указано иначе, включает в себя органический радикал, образованный из ароматического углеводорода удалением одного водорода, такой как фенил или нафтил, возможно замещенный заместителями в количестве от 8 одного до трех, выбранными из группы, состоящей из фторо, хлоро, трифторметила, (С 1 С 6)алкокси, (С 6-С 10)арилокси, трифторметокси,дифторметокси и (С 1-С 6)алкила. Термин "гетероарил", используемый в этом документе, если не указано иначе, включает в себя органический радикал, образованный из ароматического гетероциклического соединения удалением одного водорода, такой как пиридил, фурил, пироил, тиенил, изотиазолил,имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил,изоксазолил, тиазолил, оксазолил, бензотиазолил или бензоксазолил, возможно замещенный заместителями в количестве от 1 до 2, выбранными из группы, состоящей из фторо, хлоро,трифторметила, (С 1-С 6)алкокси, (С 6-С 10) арилокси, трифторметокси, дифторметокси и (С 1 С 6)алкила. Термин "ацил", используемый в этом документе, если не указано иначе, включает в себя радикал общей формулы RCO, где R представляет собой алкил, алкокси, арил, арилалкил или арилалкилокси, а термины "алкил" или "арил" такие, как определено выше. Термин "ацилокси", используемый в этом документе, включает в себя O-ацильные группы, где "ацил" определен выше. Предпочтительные соединения формулы I включают в себя соединения, в которых R1 представляет собой группу формулы где пунктирные линии обозначают двойные связи;n равно 0 или 1; А представляет собой CR5, где R5 представляет собой водород или галогено; В и Е оба независимо представляют собойCR5, где R5 представляет собой водород, циано,галогено, (С 1-С 6)алкил, возможно замещенный одним или двумя гидрокси; (С 3-С 7) циклоалкиламиносульфонил,(С 1-С 6)алкиламиносульфонил или группу формулыJ и L, каждый независимо, представляют собой кислород или серу;R21 представляет собой водород, гидрокси или (С 1-С 6)алкил, который возможно замещен галогено; иR22 представляет собой водород или (С 1-С 6) алкил, который возможно замещен гидрокси,галогено, (С 1-С 6)алкилтио, (С 1-С 6)алкилсульфинилом или (С 1-С 6)алкилсульфонилом; или группу формулыG представляет собой CR5, где R5 представляет собой кислород, серу или CR5, где R5 представляет собой водород или галогено; или, когда n равно 1, а В и D оба представляют собой CR5, эти две группы R5, взятые вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулы где пунктирные линии обозначают двойные связи;U представляет собой СО или CR5, где R5 представляет собой водород; иW представляет собой азот или CR5, где R5 представляет собой водород; или, когда n равно 1, а D и Е оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углерода, к которым они присоединены, могут образовывать группу формулы где пунктирная линия обозначает двойную связь;R23 представляет собой водород или (С 1 С 6)алкил;R представляет собой гидрокси; или гидрокси. Другие предпочтительные соединения формулы I включает в себя соединения, в которых R2 представляет собой группу формулы где прерывистые линии обозначают возможные двойные связи;n равно 1; А представляет собой CR5, где R5 представляет собой галогено или (С 1-С 6)алкил; В представляет собой CR5, где R5 представляет собой водород или галогено;D представляет собой CR5, где R5 представляет собой водород, галогено, циано или группу формулыY представляет собой NН 2; Е представляет собой CR5, где R5 представляет собой водород или галогено; иG представляет собой CR5, где R5 представляет собой галогено или (С 1-С 6)алкил; или, когда либо А и В, либо Е и D оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углеродами, к которым они присоединены, могут образовывать(С 5-С 6)циклоалкильную группу. Другие предпочтительные соединения формулы I включают в себя соединения, в которых R1 представляет собой группу формулы где прерывистые линии обозначают двойные связи;n равно 0 или 1; А представляет собой CR5, где R5 представляет собой водород или галогено; В и Е оба независимо представляют собойCR5, где R5 представляет собой водород, циано,галогено, (С 1-С 6)алкил, который возможно замещен одним или двумя гидрокси; (С 3-С 7) циклоалкиламиносульфонил,(C1-С 6)алкиламиносульфонил или группу формулыY представляет собой водород, (С 1-С 6) алкил, который возможно замещен галогено; илиJ и L каждый независимо представляют собой кислород или серу;R21 представляет собой водород, гидрокси или (С 1-С 6)алкил, который возможно замещен галогено; иR22 представляет собой водород или (С 1-С 6) алкил, который возможно замещен гидрокси,галогено, (С 1-С 6)алкилтио, (С 1-С 6)алкилсульфинилом или (С 1-С 6)алкилсульфонилом; или группу формулыG представляет собой CR5, где R5 представляет собой кислород, серу или CR5, где R5 представляет собой водород или галогено; или, когда n равно 1 и В и D оба представляют собой CR5, эти две группы R5, взятые вме 001803 12 сте с атомами углерода, к которым они присоединены, могут образовывать группу формулы где прерывистые линии обозначают двойные связи;U представляет собой СО или CR5, где R5 представляет собой водород; иW представляет собой азот или CR5, где R5 представляет собой водород; или, когда n равно 1 и D и Е оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углерода, к которым они присоединены, могут образовывать группу формулы где пунктирная линия обозначает возможную двойную связь;R23 представляет собой водород или (С 1 С 6)алкил;R2 представляет собой группу формулы где прерывистые линии обозначают возможные двойные связи;n равно 1; А представляет собой CR5, где R5 представляет собой галогено или (С 1-С 6)алкил; В представляет собой CR5, где R5 представляет собой водород или галогено;D представляет собой CR5, где R5 представляет собой водород, галогено, циано или группу формулы 13 Е представляет собой CR5, где R5 представляет собой водород или галогено;G представляет собой CR5, где R5 представляет собой галогено или (С 1-С 6)алкил; или, когда А и В или Е и G оба представляют собой CR5, эти две группы R5, взятые вместе с соседними атомами углерода, к которым они присоединены, могут образовывать (С 5-С 6) циклоалькильную группу. Конкретные предпочтительные соединения формулы I включают в себя следующие: 1-(4-хлор-2,6-диизопропил-фенил)-3-[3-(1 гидрокси-1-метил-этил)-бензолсульфонил]мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины; 1-(1,2,3,5,6,7-гексагидро-4-аза-s-индацен 8-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины; 1-(4-[1,3]диоксолан-2-ил-фуран-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(2,6-диизопропилфенил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2-сульфонил]-мочевины; 1-(2,6-диизопропилфенил)-3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины; 1-(4-ацетилтиофен-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины; 1-(1 Н-бензимидазол-5-сульфонил)-3(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-тиофен-2-сульфонил]-мочевины; 1-(8-хлор-1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(4-ацетил-фуран-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-мочевины; 1-(8-фтор-1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-3-[4-(1-гидрокси-1-метил-этил)фуран-2-сульфонил]-мочевины; 1-(4-фтор-2,6-диизопропил-фенил)-3-[3-(1 гидрокси-1-метил-этил)-бензолсульфонил]мочевины; 1-(6-фтор-1 Н-бензимидазол-5-сульфонил)3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(4-хлор-2,6-диизопропил-фенил)-3-(1 Ниндол-6-сульфонил)-мочевины; 1-(4-хлор-2,6-диизопропил-фенил)-3-(5 фтор-1 Н-индол-6-сульфонил)-мочевины; 1-[1,2,3,5,6,7-гексагидро-s-индацен-u-ил)3-(1 Н-индол-6-сульфонил)-мочевины; 14 1-(5-фтор-1 Н-индол-6-сульфонил)(1,2,3,5,6,7-гексагидро-5-индацен-4-ил)мочевины; 1-[4-хлор-2,6-диизопропил-фенил]-3-[2 фтор-5-(2-метил-(1,3)диоксолан-2-ил)-бензолсульфонил]-мочевины; 3-[3-[4-хлор-2,6-диизопропил-фенил]уреидосульфонил]-N-метил-бензолсульфонамида; 1-[2-фтор-5-(2-метил-(1,3)диоксолан-2-ил)бензолсульфонил]-3-(1,2,3,5,6,7-гексагидроиндацен-4-ил)-мочевины и 3-[3-(1,2,3,5,6,7-гексагидро-S-индацен-4 ил)-уреидосульфонил]-N-метил-бензолсульфонамида. Настоящее изобретение относится также к фармацевтической композиции для лечения менингита и сальпингита, септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресс-синдрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита,эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита, реперфузионного повреждения, васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-противхозяина, аутоиммунных заболеваний, включая сахарный диабет типа I и рассеянный склероз,заболеваний периодонта, интерстициального фиброза легких, цирроза, системного склероза,келоидного образования, опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения, депрессии, атеросклероза (включая кардиомиопатию, миокардит и сердечную недостаточность) и остеопороза у млекопитающего, в том числе человека, содержащей введение количества соединения по п.1 или его фармацевтически приемлемой соли, эффективного при таком лечении или ингибировании,и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения состояния, выбранного из группы, состоящей из менингита и сальпингита,септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресс-синдрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита, эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита, реперфузионного повреждения, васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-против-хозяина,аутоиммунных заболеваний, включая сахарный диабет типа I и рассеянный склероз, заболеваний периодонта,интерстициального фиброза легких, цирроза,системного склероза, келоидного образования,опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения, 15 депрессии, атеросклероза (включая кардиомиопатию, миокардит и сердечную недостаточность) и остеопороза у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят количество соединения по п.1 или его фармацевтически приемлемой соли,эффективное при лечении такого состояния. Подробное описание изобретения Приведенные ниже реакционные схемы иллюстрируют получение соединений по настоящему изобретению. Если не указано иначе,n, А, В и G на реакционных схемах и в последующем обсуждении такие, как определено выше. Получение А В реакции 1 Получения А соединение формулы XII превращают в соответствующее изоцианатное соединение формулы XI взаимодействием XII с трифосгеном в присутствии основания, такого как триэтиламин, диизопро 17 пиламин или 1,8-диазабицикло[5,4,0]ундец-7-ен,и апротонного растворителя, такого как тетрагидрофуран, бензол или метиленхлорид. Эту смесь перемешивают и нагревают до температуры образования флегмы в течение времени от примерно 1 до примерно 3 ч, предпочтительно около 2 ч. В реакции 1 Получения Б соединение формулы XIV превращают в соответствующее сульфонамидное соединение формулы XIII добавлением алкиллития, такого как н-бутил-,втор-бутил- или трет-бутиллитий, к перемешиваемому раствору XIV в полярном растворителе, таком как тетрагидрофуран, при температуре между примерно -70 С и примерно -85 С, предпочтительно около -78 С. Через приблизительно 15 мин к образовавшейся таким образом реакционной смеси добавляют сжиженный диоксид серы, в течение 5 мин перемешивают при примерно -78 С, а затем нагревают до комнатной температуры в течение времени от примерно 1 до примерно 3 ч, предпочтительно около 2 ч. Эту смесь затем (а) концентрируют в вакууме и либо обрабатывают хлорирующим реагентом,таким как N-хлорсукцинимид, в полярном растворителе, таком как метиленхлорид, с последующей обработкой газообразным или водным аммиаком, либо (б) обрабатывают гидроксиламин-о-сульфоновой кислотой в воде в присутствии буфера, такого как ацетат натрия. В реакции 1 Получения В соединение формулы XVI превращают в соответствующее сульфонамидное соединение формулы XV добавлением раствора нитрата натрия в воде к перемешиваемому раствору XVI в смеси уксусной кислоты и соляной кислоты. Затем добавляют уксусную кислоту, насыщенную газообразным диоксидом серы, а затем добавляют хлорид меди. Образованную таким образом реакционную смесь перемешивают при температуре между примерно -10 С и примерно 10 С,предпочтительно около 0 С, в течение времени от примерно 1 ч до примерно 3 ч, предпочтительно около 2 ч. Затем полученный сульфонилхлорид обрабатывают газообразным или водным аммиаком, который пропускают через раствор сульфонилхлорида в апротонном растворителе, таком как метиленхлорид или эфир. В реакции 1 Получения Г соединение формулы XVIII превращают в соответствующее сульфонамидное соединение формулы XVII взаимодействием XVIII с хлорсульфоновой кислотой в полярном апротонном растворителе,таком как хлороформ, при температуре от примерно -10 С до примерно 10 С, предпочтительно около 0 С. Образовавшуюся таким образом реакционную смесь нагревают до примерно 60 С. После периода времени от примерно 1,5 ч до примерно 2,5 ч, предпочтительно около 2 ч,реакционную смесь снова охлаждают до температуры приблизительно 0 С и выливают на лед. Затем полученный сульфонилхлорид обрабаты 001803 18 вают газообразным или водным аммиаком, который пропускают через раствор сульфонилхлорида в апротонном растворителе, таком как метиленхлорид или эфир. В реакции 1 Схемы 1 изоцианатное соединение формулы Х и сульфонамидное соединение формулы IX превращают с соответствующую сульфонилмочевину формулы VII взаимодействием IX и Х в присутствии основания, такого как гидрид натрия, гидроксид натрия, триэтиламин или 1,8-диазабицикло[5,4,0]ундец-7 ен, и полярного растворителя, такого как тетрагидрофуран, ацетон или диметилформамид. Образовавшуюся таким образом реакционную смесь нагревают до температуры образования флегмы в течение времени от примерно 10 до примерно 14 ч, предпочтительно около 12 ч. Ингибирование АТФ-индуцированного высвобождения ИЛ-1 В Мононуклеарные клетки выделяют из 100 мл крови, полученной с помощью LSM (Organon Teknika). Гепаринизированную кровь (по 1,5 мл гепарина для инъекций, 1000 ед./мл, отApotheconis, добавленные в каждый из шприцов на 50 мл) разводят 20 мл Среды (RPMI 1640, 5% фетальной телячьей сыворотки, 1% пенициллина/стрептомицина, 25 мМ HEPES, рН 7,3). 30 мл разведенной крови наслаивают на 15 мл LSM(Organon Teknika) в конических полипропиленовых центрифужных пробирках на 50 мл. Эти пробирки центрифугируют при 1200 об./мин в течение 30 мин на настольной центрифугеSorvall при комнатной температуре. Мононуклеарные клетки, локализованные на границе между плазмой и LSM, выделяют, разводят Средой до конечного объема 50 мл и собирают центрифугированием, как описано выше. Супернатант отбрасывают, а клеточный осадок промывают 2 раза с использованием 50 мл среды. Перед второй промывкой отбирают 10 мкл суспендированных клеток для счета. На основании этого счета отмытые клетки разводят средой до конечной концентрации 2,0 х 106 клеток/мл. По 0,1 мл суспензии клеток вносят в каждую лунку планшетов на 96 лунок. В течение 2 ч дают прилипнуть моноцитам, после чего не прилипшие клетки удаляют отсасыванием, а прикрепленные клетки дважды промывают с использованием 100 мкл Среды. В каждую лунку добавляют по 100 мкл Среды и клетки инкубируют в течение ночи при 37 С в инкубаторе с 5% диоксида углерода. На следующий день в каждую лунку добавляют по 25 мкл LPS (50 нг/мл Среды) и клетки активируют в течение 2 ч при 37 С. Тестируемые агенты разводят диметилсульфоксидом до конечной концентрации 10 мМ. Из этого исходного раствора соединения сначала разводят в соотношении 1:50 [5 мкл 10 мМ исходного раствора + 245 мкл Среды Чейза(LPS) и 5 мл бикарбоната натрия)]. Второе разведение готовят добавлением 10 мкл 200 мкМ тестируемого агента к 90 мкл Среды Чейза с получением конечной концентрации тестируемого агента 20 мкМ, при этом концентрация диметилсульфоксида составляет 0,2%.LPS-активированные моноциты один раз промывают 100 мкл Среды Чейза, а затем в каждую лунку добавляют по 100 мкл Среды Чейза(содержащей 0,2% диметилсульфоксида). В соответствующие лунки добавляют 20 мкМ растворы тестируемых агентов в количестве 0,011 мл и моноциты инкубируют в течение 30 мин при 37 С. Сразу после этого вводят 2 мМ АТФ добавлением 12 мкл 20 мМ исходного раствора(с рН, предварительно доведенным до 7,2 гидроксидом натрия) и клетки инкубируют еще 3 ч при 37 С. 96-тилуночные планшеты центрифугируют в течение 10 мин при 2000 об/мин в настольной центрифуге Sorvall, чтобы удалить клетки и клеточные остатки. Отбирают по аликвоте объемом 90 мкл каждого супернатанта и переносят в планшет на 96 круглодонных лунок. Этот планшет центрифугируют еще раз, чтобы обеспечить удаление всех клеточных остатков. 30 мкл полученного супернатанта добавляют в лунку планшета для проведения твердофазного иммуноферментного анализа (ELISA) на ИЛ-1,которая также содержит 70 мкл забуференного фосфатом физиологического раствора и 1% фетальной телячьей сыворотки. Планшеты дляELISA инкубируют в течение ночи при 4 С.ELISA (RD Systems) выполняют в соответствии с инструкциями к наборам. Данные расчета и анализа. Количество иммунореактивности, соответствующей ИЛ-1, в образцах со средой Чейза рассчитывают как указано ниже% от контроля = (Х-В)/(ТОТ-В)х 100,где Х= OD450 (оптическая плотность при 450 нм) в лунке с тестируемым соединением,В= OD450 в лунке с контролем на реактивы ELISA ТОТ = OD450 в случае клеток, которые обрабатывали только 0,2% диметилсульфоксидом. Соединения по настоящему изобретению можно вводить в широком разнообразии различных лекарственных форм. Как правило, терапевтически эффективные соединения по этому изобретению присутствуют в таких лекарственных формах в концентрациях в диапазоне от примерно 5,0% до примерно 79 мас.%. Для перорального введения можно использовать таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальцийфосфат и глицин, наряду с различными разрыхлителями, такими как крахмал (и, пред 001803 20 почтительно кукурузный, картофельный или тапиоковый крахмал), альгиновая кислота и некоторые сложные силикаты, вместе со связывающими гранулирующими агентами, как то поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, очень полезными в целях таблетирования часто бывают смазывающие агенты, такие как стеарат магния,лаурилсульфат натрия и тальк. Твердые композиции подобного типа можно также применять в качестве наполнителей в желатиновых капсулах; предпочтительные в этой связи материалы включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда желательны водные суспензии и/или эликсиры для перорального введения, активный ингредиент можно комбинировать с различными подсластителями и корригентами, красящим веществом или красителями и, если это желательно, также эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и разные подобные их комбинации. Для парентерального введения (внутримышечного, внутрибрюшинного, подкожного и внутривенного применения) обычно готовят стерильный инъецируемый раствор активного ингредиента. Можно применять растворы терапевтического соединения по настоящему изобретению в кунжутном или арахисовом масле,либо в водном пропиленгликоле. Водные растворы при необходимости следует должным образом доводить и забуферивать, предпочтительно до рН выше 8, а жидкий разбавитель сначала делать изотоническим. Эти водные растворы подходят для внутривенных инъекций. Масляные растворы подходят для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществить с использованием стандартных фармацевтических методик, которые хорошо известны специалистам. Настоящее изобретение иллюстрируется следующими примерами, но не ограничено их деталями. ПОЛУЧЕНИЕ А. 3-Трет-бутилсульфамоилбензосульфонилхлорид. Раствор 1,46 г (20 ммоль) трет-бутиламина и 2,02 г (20 ммоль) триэтиламина в тетрагидрофуране добавляли по каплям к раствору 5,5 г (20 ммоль) 1,3-бензолдисульфонилхлорида в тетрагидрофуране. Реакционную смесь в течении 2 ч перемешивали при комнатной температуре. Растворитель выпаривали в вакууме. Остаток очищали на силикагеле, элюируя метиленхлоридом с получением 3,86 г указанного в заголовке соединения в виде масла. ПОЛУЧЕНИЕ Б. Трет-бутиламидметиламид бензол-1,3-дисульфоновой кислоты. 5 мл 33% раствора метиламина в этаноле добавляли к раствору 1,8 г (7 ммоль) 3-третбутилсульфамоилбензолсульфонилхлорида в 21 этилацетате. Эту смесь перемешивали 2 ч. Этилацетатный слой отделяли и концентрировали в вакууме. Остаток очищали на силикагеле,элюируя смесью 5% метанола в дихлорметане с получением 1,32 г указанного в заголовке соединения в виде белого твердого вещества. ПОЛУЧЕНИЕ В. Трет-бутиламиддиметиламид бензол-1,3-дисульфоновой кислоты. Газообразный диметиламин в течение 3 мин пропускали через раствор 1,8 г (7 ммоль) 3 трет-бутилсульфамоилбензолсульфонилхлорида в этилацетате. Добавляли воду и смесь перемешивали при комнатной температуре в течение 1 ч. Этилацетатный слой отделяли, сушили над сульфатом магния и концентрировали в вакууме до твердого вещества, которое растирали со смесью гексан/изопропиловый эфир с получением 1,59 г указанного в заголовке соединения,т.пл. 100-102 С. ПОЛУЧЕНИЕ Г. Трет-бутиламидамид бензол-1,3-дисульфоновой кислоты. 20 мл концентрированного гидроксида аммония добавляли к раствору 1 г (3,3 ммоль) 3 трет-бутилсульфамоилбензолсульфонилхлорида в этилацетате. Интенсивно перемешивали в течение 8 ч. Этилацетатный слой отделяли и сушили над сульфатом магния в вакууме с получением 320 мг указанного в заголовке соединения в виде белого твердого вещества, т.пл. 151154 С. ПОЛУЧЕНИЕ Д. Трет-бутиламидциклопропиламид бензол-1,3-дисульфоновой кислоты. Смесь 5 мл циклопропиламина и 10 мл воды добавляли к раствору 1 г (3,9 ммоль) 3-третбутилсульфамоилбензолсульфонилхлорида в этилацетате. Смесь перемешивали при комнатной температуре в течение 2 ч. Этилацетатный слой отделяли, сушили над сульфатом магния и концентрировали в вакууме до масла, которое кристаллизовали из изопропилового эфира с получением 839 мг указанного в заголовке соединения в виде твердого вещества. ПОЛУЧЕНИЕ Е. Трет-бутиламидциклобутиламид бензол-1,3-дисульфоновой кислоты. С использованием процедуры, подобной процедуре, которая описана в ПОЛУЧЕНИИ Д,4 мл циклобутиламина добавляли к 1 г (3,9 ммоль) 3-трет-бутилсульфамоилбензолсульфонилхлорида с получением 813 мг указанного в заголовке соединения. ПОЛУЧЕНИЕ Ж. Амидметиламид бензол 1,3-дисульфоновой кислоты. Раствор 1,3 г (4,3 ммоль) трет-бутиламидметиламида бензол-1,3-дисульфоновой кислоты в 15 мл трифторуксусной кислоты, содержащей 1 каплю анизола, 12 ч перемешивали при комнатной температуре. Трифторуксусную кислоту выпаривали в вакууме и остаток растирали с метиленхлоридом с получением 330 мг указанного в заголовке соединения, т.пл. 124126 С. 22 Указанные в заголовках Получений З-К соединения получали способом, аналогичным способу, который описан в Получении Ж, используя указанный исходный материал. ПОЛУЧЕНИЕ З. Амиддиметиламид бензол-1,3-дисульфоновой кислоты. Трет-бутиламиддиметиламид бензол-1,3 дисульфоновой кислоты, т.пл. 166-167 С. ПОЛУЧЕНИЕ И. Амидциклопропиламид бензол-1,3-дисульфоновой кислоты. Трет-бутиламидциклопропиламид бензол 1,3-дисульфоновой кислоты, т.пл. 120-121 С. ПОЛУЧЕНИЕ К. Амидциклобутиламид бензол-1,3-дисульфоновой кислоты. Трет-бутиламидциклобутиламид бензол 1,3-дисульфоновой кислоты, т.пл. 128-130 С. ПОЛУЧЕНИЕ Л. 3-Метилсульфанилбензолсульфонамид. Раствор 1,6 М н-бутиллития (12,5 мл; 20 ммоль) в гексане добавляли к раствору мбромтиоанизола (4,06 г; 20 ммоль). Образовавшийся таким образом раствор 3 ч перемешивали при -78 С. Затем через реакционную смесь пропускали диоксид серы, пока смесь не становилась кислотной. Эту реакционную смесь оставляли в течение ночи нагреваться до комнатной температуры. Добавляли раствор N-хлорсукцинимида (2,4 г; 78 ммоль) в метиленхлориде, и после перемешивания в течение 1 ч при комнатной температуре выпаривали тетрагидрофуран. Остаток суспендировали в метиленхлориде и фильтровали. Фильтрат смешивали с концентрированным гидроксидом аммония и перемешивали при комнатной температуре в течение 1 ч. Метиленхлоридный слой сушили и упаривали. Остаток растирали с метиленхлоридом с получением 1,5 г указанного в заголовке соединения, т.пл. 126-127 С. ПОЛУЧЕНИЕ М. 3-Метансульфинилбензолсульфонамид. Смесь 3-метилсульфанилбензолсульфонамида (406 мг; 2 ммоль) и N-хлорсукцинимида(268 мг; 2 ммоль) в метаноле перемешивали при комнатной температуре в течение 8 ч. Метанол выпаривали, и остаток суспендировали в метиленхлориде и фильтровали. Фильтрат упаривали с получением 250 мг указанного в заголовке соединения в виде белого твердого вещества. ПОЛУЧЕНИЕ Н. 3-Метансульфонилбензолсульфонамид. К раствору 3-метилсульфанилбензолсульфонамида (500 мг; 2,5 ммоль) в ацетоне добавляли водный раствор OXONE (3,2 г; 5 ммоль). Эту смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь упаривали в вакууме досуха. Остаток растирали с ацетоном и фильтровали. Фильтрат упаривали с получением 460 мг указанного в заголовке соединения. 23 ПОЛУЧЕНИЕ О. 1-(3-Бромфенил)-циклобутанол. К раствору 1,3-дибромбензола (2,36 г; 10 ммоль) в тетрагидрофуране при -78 С добавляли 1,6 М раствор н-бутиллития (6,3 мл; 10 ммоль) в гексане и перемешивали в течение 4 ч. Затем одной порцией добавляли циклобутанон(700 мг; 10 ммоль). После перемешивания в течение 2 ч при -78 С реакцию гасили 2 н. соляной кислотой. Реакционную смесь нагревали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Этилацетатный слой сушили и упаривали с получением 2,5 г неочищенного продукта, который очищали на силикагеле, элюируя смесью 50% метиленхлорида в гексане, с получением 1,5 г указанного в заголовке соединения. ПОЛУЧЕНИЕ П. 3-(1-Гидроксициклобутил)-бензолсульфонамид. 1,6 М раствор н-бутиллития (8 мл; 12,8 ммоль) в гексане добавляли к раствору 1-(3 бромфенил)-циклобутанола (1,44 г; 6,4 ммоль) в тетрагидрофуране при -78 С. Через 30 мин реакционной смеси давали возможность нагреться до 0 С. Через реакционную смесь пропускали диоксид серы и перемешивали ее еще 30 мин. Выпаривали тетрагидрофуран и добавляли водный раствор ацетата натрия (4,1 г; 50 ммоль) и гидроксиламинсульфоновую кислоту (1,85 г; 16 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь подкисляли 2 н. соляной кислотой и экстрагировали этилацетатом. Этилацетат сушили над сульфатом натрия и выпаривали. Остаток очищали на силикагеле с использование смеси дихлорметан/эфир с получением 70 мг указанного в заголовке соединения. ПОЛУЧЕНИЕ Р. 1-(3-Бромфенил)-циклопентанол. Используя процедуру, подобную процедуре Получения О, из 2,36 г 1,3-дибромбензола,6,3 мл 1,6 М н-бутиллития и 840 мг циклопентанона было получено 1,56 г 1-(3-бромфенил)циклопентанола в виде масла. ПОЛУЧЕНИЕ С. 3-(1-Гидроксициклопентил)-6-бензолсульфонамид. Используя процедуру, подобную процедуре Получения П, из 1,5 г 1-(3-бромфенил)циклопентанола, 7,9 мл 1,6 М н-бутиллития, 1,85 г гидроксиламин-O-сульфоновой кислоты и 4,1 г NaOAc было получено 220 мг 3-(1-гидроксициклопентил)-6-бензолсульфонамида в виде белого вещества из дихлорметана, т.пл. 146148 С. ПОЛУЧЕНИЕ Т. 1-(3-Бромфенил)-циклогексанол. Используя процедуру, подобную процедуре Получения О, из 20 г (85 ммоль) 1,3 дибромбензола, 53 мл 1,6 М н-бутиллития в гексане и 8,3 г циклогексанона было получено 4,9 г 1-(3-бромфенил)-циклогексанола в виде белого твердого вещества. 24 ПОЛУЧЕНИЕ У. 3-(1-Гидроксициклогексил)-бензолсульфонамид. 1,6 М раствор н-бутиллития (12,35 мл; 19,8 ммоль) в гексане добавляли к раствору 1-(3 бромфенил)-циклогексанола (2,4 г; 9,4 моль) в тетрагидрофуране при -78 С. Реакционную смесь перемешивали в течение 1 ч, затем через раствор пропускали диоксид серы до тех пор,пока он не становился кислотным по индикаторной бумаге. Реакционной смеси давали возможность нагреться до комнатной температуры в течение 12 ч. Добавляли N-хлорсукцинимид(1,38 г; 10,3 моль), растворенный в дихлорметане и перемешивали реакционную смесь в течение 2 ч. Тетрагидрофуран выпаривали, и остаток суспендировали в метиленхлориде и фильтровали. Фильтрат упаривали до 2,1 г 3-(1 гидроксициклогексил)-бензолсульфонилхлорида в виде коричневого масла. Его растворяли в метиленхлориде и добавляли по каплям к 20 мл жидкого аммиака. Аммиаку давали возможность испариться, а остаток очищали на силикагеле с использованием смеси дихлорметан/метанол с получением 250 мг указанного в заголовке соединения в виде белого твердого вещества. Указанные в заголовке Получении Ф-Ц соединения получали способом, аналогичным способу, который описан в Получении Л, используя указанные исходные материалы. ПОЛУЧЕНИЕ Ф. 3-(2-Метил-[1,3]диоксолан-2-ил)-бензолсульфонамид. 2-(3-Бромфенил)-2-метил-[1,3]диоксолан,т.пл.: 96-98 С. ПОЛУЧЕНИЕ Х. 3-[1,3]Диоксолан-2-илбензолсульфонамид. 2-(3-Бромфенил)-[1,3]диоксолан, т.пл.: 5558 С. ПОЛУЧЕНИЕ Ц. 2-Фтор-5-(2-метил-[1,3] диоксолан-2-ил)-бензолсульфонамид. 2-[-Бром-4-фторфенил]-2-метил-[1,3] диоксолан, т.пл.: 149-150 С. ПОЛУЧЕНИЕ Ч. [2-(4-бром-2-нитрофенил)-винил]-диметиламин. Раствор 27 г (0,125 моль) 4-Бром-1-метил 2-нитробензола и 1 мл (0,31 моль) диметилацеталя N,N-диметилформамида в 120 мл диметилформамида (ДМФ) нагревали при 80 С в течение 2 ч. После охлаждения реакционную смесь вливали в воду и экстрагировали этилацетатом. Затем сушили над сульфатом натрия и упаривали с получением 36 г указанного в заголовке соединения в виде пурпурного твердого вещества. ПОЛУЧЕНИЕ Ш. 2-(4-Бром-2-нитрофенил)-этиленгидразид уксусной кислоты. Раствор 36 г неочищенного [2-(4-бром-2 нитрофенил)-винил]-диметиламина в 75 мл диметилформамида охлаждали до 0 С. Добавляли раствор 26 г семикарбазида гидрохлорида в 200 мл воды. Затем добавляли 20 мл концентрированной соляной кислоты. Полученному раствору давали возможность нагреться до комнатной 25 температуры. Желтовато-коричневый осадок отфильтровывали, промывали водой и сушили. ПОЛУЧЕНИЕ Щ 6-Бром-1 Н-индол. Раствор 375 г гептагидрата сульфата железа (II) в 700 мл воды добавляли к суспензии 35 г неочищенного 2-(4-бром-2-нитрофенил)-этиленгидразида уксусной кислоты в 300 мл концентрированного гидроксида аммония. Механически перемешиваемую смесь нагревали до температуры образования флегмы в течение 4 ч,затем охлаждали и фильтровали. Осадок несколько раз растирали с горячим этилацетатом. Объединенные этилацетатные слои сушили и упаривали с получением 18 г указанного в заголовке соединения. ПОЛУЧЕНИЕ Ы. Амид 1 Н-индол-6 сульфоновой кислоты. К суспензии 3,5 г (0,03 моль) 35% KH в минеральном масле в эфире при 0 С по каплям добавляли раствор 6,0 г (0,03 моль) 6-бром-1 Ниндола. После перемешивания в течение 1 ч светло-желтый раствор охлаждали до -78 С. По каплям добавляли 36,5 мл (0,06 моль) 1,7 М раствора трет-бутиллития в пентане. После перемешивания в течение 1 ч при -78 С через раствор в течение 5 мин пропускали SO2. Реакционной смеси в течение ночи давали возможность нагреться до комнатной температуры. Одной порцией добавляли раствор 4,1 г (0,03 моль) N-хлорсукцинимида. После перемешивания в течение 1 ч реакционную смесь фильтровали, чтобы удалить сукцинимид, и фильтрат упаривали до желтого твердого вещества. Его растворяли в тетрагидрофуране и добавляли к 20 мл жидкого аммиака. Реакционной смеси давали возможность нагреться до комнатной температуры. Остаток растворяли в этилацетате,промывали водой, сушили и упаривали с получением 1,4 г указанного в заголовке соединения. ПОЛУЧЕНИЕ АА. 5-Фтор-2,3-дигидро 1 Н-индол. Раствор 6,8 г (0,05 моль) 5-фтор-1 Н-индола в 50 мл эфира охлаждали до 0 С под азотом. По каплям добавляли 507 мл 0,15 М раствора боргидрида цинка в эфире. Реакционной смеси давали возможность перемешиваться в течение 48 ч. Реакционную смесь гасили разбавленной соляной кислотой. Доводили рН до 8,0 разбавленным гидроксидом натрия. Эфирный слой отделяли, сушили и упаривали с получением 7 г указанного в заголовке соединения. ПОЛУЧЕНИЕ ББ. 1-(5-Фтор-2,3-дигидроиндол-1-ил)-этанон. Ацетилхлорид (3 мл) по каплям добавляли к раствору 7 г неочищенного 5-фтор-2,3 дигидро-1 Н-индола и 3 мл триэтиламина в 100 мл CH2Cl2 при 0 С. Через 2 ч реакционную смесь разбавляли водой. Метиленхлоридный слой отделяли, сушили и упаривали c получением 7,3 г неочищенного продукта, который очищали на силикагеле, элюируя смесью гек 001803 26 сан/этилацетат с получением 3,3 г указанного в заголовке соединения. ПОЛУЧЕНИЕ ВВ. Амид 1-ацетил-5-фтор 2,3-дигидро-1 Н-индол-6-сульфоновой кислоты. Хлорсульфоновую кислоту (35 мл) под азотом охлаждали до 0 С. Порциями добавляли 3 г (0,16 моль) 5-(фтор-2,3-дигидроиндолил)этанона. Реакционную смесь в течение 3 ч нагревали при 50 С, охлаждали и выливали на лед. Полученный белый осадок отфильтровывали и растворяли в метиленхлориде. Добавляли раствор концентрированного гидроксида аммония, и смесь перемешивали при комнатной температуре в течение 1 ч. Выпаривали в вакууме летучие вещества и добавляли разбавленную соляную кислоту. Осадок отфильтровывали и промывали водой с получением 3,6 г указанного в заголовке соединения. ПОЛУЧЕНИЕ ГГ. Амид 5-фтор-2,3 дигидро-1 Н-индол-6-сульфоновой кислоты. Смесь 3,6 г амида 1-ацетил-5-фтор-2,3 дигидро-1 Н-индол-6-сульфоновой кислоты и 30 мл 2 н. гидроксида натрия нагревали при 100 С в течение 3 ч. Реакционную смесь охлаждали и доводили рН до 7,0 уксусной кислотой. Полученный осадок отфильтровывали с получением 3,0 г указанного в заголовке соединения. ПОЛУЧЕНИЕ ДД. Амид 5-фтор-1 Н-индол 6-сульфоновой кислоты. Смесь 3 г диоксида магния и 3 г амида 5 фтор-2,3-дигидро-1 Н-индол-6-сульфоновой кислоты в 30 мл диоксана в течение ночи нагревали при 50 С. Эту реакционную смесь фильтровали, и фильтрат упаривали с получением неочищенного продукта, который очищали на силикагеле с использованием смеси метиленхлорид/этилацетат с получением 1,1 г указанного в заголовке соединения, т.пл.: 181-182 С. ПОЛУЧЕНИЕ ЕЕ. 2-(3-Бромфенил)пропан-2-ол. К перемешиваемому раствору метилмагнийбромида (60 мл 3,0 М раствора в диэтиловом эфире) при 0 С по каплям добавляли раствор 3 бромацетофенона (29,8 г) в 75 мл диэтилового эфира. По завершении добавления смесь перемешивали в течение получаса и вливали в воду. Водную фазу подкисляли 1 М соляной кислотой и экстрагировали тремя порциями диэтилового эфира. Объединенные эфирные слои промывали насыщенным бикарбонатом натрия и концентрировали с получением 30,4 г указанного в заголовке соединения. 1(110 мл 1,4 М раствора в диэтиловом эфире). Раствор 15 мин перемешивали при -78 С, затем 27 добавляли бутиллитий (61 мл 2,5 М раствора в гексане). Раствор перемешивали при -78 С в течение 15 мин, при этом образовывалась взвесь. К этой взвеси добавляли одной порцией сжиженный диоксид серы (примерно 5 эквивалентов). Взвесь перемешивали при -78 С в течение 5 мин, затем нагревали до комнатной температуры и перемешивали еще 2 ч. Эту смесь концентрировали в вакууме с получением желтого твердого вещества, которое переносят в воду (418 мл). К водному раствору добавляли ацетат натрия (190 г) и гидроксиламин-Oсульфоновую кислоту (47,3 г) и раствор перемешивали в течение ночи. Эту смесь экстрагировали этилацетатом, и органическую фазу промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Очистка флэш-хроматографией (2:1 этилацетат/гексан) давала 27 г указанного в заголовке соединения, т.пл. 107,2-108,2 С. ПОЛУЧЕНИЕ ЗЗ. 4-Хлор-2,6-диизопропиланилин. К перемешиваемому раствору 2,6-диизопропиланилина (47 г) в N,N-диметилформамиде(886 мл) добавляли N-хлорсукциниммид (37,3 г) и эту смесь перемешивали в течение ночи. Полученный темно-красный раствор вливали в воду (12 л) и экстрагировали диэтиловым эфиром. Объединенные эфирные экстракты промывали водой и рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученное темно-красное масло очищали фильтрацией через силикагель, элюируя смесью гексан/метиленхлорид 6:1, с получением 32 г указанного в заголовке соединения. 1 Н-ЯМР 7.02 (s, 2), 3.71 (brs, 2), 2.91 (qq,2, J=6.9 Hz), 1.27 (d, 6, J=6.9 Hz), 1.27 (d, 6, J=6.9Hz). ПОЛУЧЕНИЕ ИИ. 4-Хлор-2,6-диизопропилфенилизоцианат. К перемешиваемому раствору 4-хлор-2,6 диизопропиланилина (32 г) и триэтиламина (7,8 мл) в тетрагидрофуране (505 мл) добавляли трифосген (14,9 г). Смесь нагревали с обратным холодильником в течение 2 ч при перемешивании. Затем тетрагидрофуран удаляли в вакууме и полученное масло переносили в пентан и фильтровали через силикагель с получением 33,3 г продукта. 1 Н-ЯМР 7.18 (s, 2), 3.22 (qq, 2, J=7.1 Hz),1.25 (d, 6, J=7.1Hz). ПОЛУЧЕНИЕ KK. 2-[3-4-Хлор-2,6-диизопропилфениламино)-амино)карбонил]-амино]-сульфонил]-фенил]-пропан-2-ол. К перемешиваемому раствору 2-(3 аминосульфонилфенил)-пропан-2-ола (26,5 г) в тетрагидрофуране несколькими порциями добавляли гидрид натрия (5,2 г, 60% дисперсия в минеральном масле). Как только выделение водорода прекращалось, одной порцией добавляли 4-хлор-2,6-диизопропилизоцианат (30,8 г) и по 001803 28 лученную смесь нагревали до температуры образования флегмы в течение 12 ч. Затем эту смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученную пену растворяли в воде, подщелачивали 1 н. гидроксидом натрия и экстрагировали двумя порциями смеси эфир/гексан (1:1). Водный слой подкисляли 1 н. соляной кислотой и полученное белое твердое вещество отфильтровывали, промывали водой и сушили. Это давало 50 г белого твердого вещества, которое перекристаллизовывали из влажной смеси этилацетат/гексан с получением указанного в заголовке соединения,т.пл. 160,5-162,0 С. ПОЛУЧЕНИЕ ЛЛ. 5-Нитроизофталоилхлорид. К перемешиваемому раствору 5 нитроизофталевой кислоты (10 г) в метиленхориде (943 мл) добавляли оксалилхлорид (12,3 мл) и N,N-диметилформамид (1 капля). Эту реакционную смесь в течение ночи перемешивали при комнатной температуре. Удаление растворителя в вакууме давало 10,63 г указанного в заголовке соединения. 1H-ЯМР 9.17 (s, 2), 9.07 (s, 1). ПОЛУЧЕНИЕ MM. 3,5-Диацетилнитробензол. Магниевую стружку (2,27 г) перемешивали с этанолом (12 мл) и тетрахлоридом углерода (1 капля). Как только выделение водорода полностью завершалось, добавляли диэтиловый эфир малоновой кислоты (15,18 г) в диэтиловом эфире (30 мл) и смесь нагревали при температуре образования флегмы до тех пор, пока весь магний не израсходовался. К этой смеси добавляли 5-нитроизофталоилхлорид (10 г) в тетрагидрофуране (29 мл) и нагревание при температуре образования флегмы продолжали еще 16 ч. Смесь охлаждали в ледяной бане и подкисляли 10% серной кислотой. Водную фазу экстрагировали этилацетатом, а органическую фазу концентрировали в вакууме. Маслянистый остаток переносили в уксусную кислоту (72 мл) и добавляли воду (14 мл) и серную кислоту (4 мл). Эту смесь нагревали при интенсивном образовании флегмы в течение 12 ч, а затем охлаждали в ледяной бане. Смесь нейтрализовали 3 М гидроксидом натрия и экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия и концентрировали в вакууме с получением 7,54 г указанного в заголовке соединения. 1H-ЯМР 8.90 (s, 2), 886 (s, 1), 2.78 (s, 6). ПОЛУЧЕНИЕ НН. 3,5-Диацетиланилин. К перемешиваемому раствору дигидрата хлорида олова (II) (32,87 г) в концентрированной соляной кислоте (93 мл) при 50 С добавляли 3,5-диацетилнитробензол (7,54 г). Нагревание немедленно прекращали, и происходила экзотермическая реакция. Смесь перемешивали в течение 5 мин, охлаждали в ледяной бане и нейтрализовали насыщенным раствором карбо 29 ната калия. Водную фазу экстрагировали несколькими порциями этилацетата, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3,01 г указанного в заголовке соединения. 1(17 мл) и соляной кислоты (5,7 мл) добавляли раствор нитрита натрия (1,27 г) в 2,1 мл воды. Раствор перемешивали 20 мин, 14 мл уксусной кислоты насыщали газообразным диоксидом серы и эту смесь добавляли к реакционной смеси, после чего добавляли хлорид меди (I) (0,63 г). Происходило сильное вспенивание. Эту реакционную смесь перемешивали в течение 1 ч,разбавляли водой и экстрагировали тремя порциями этилацетата. Объединенные этилацетатные экстракты промывали водой и концентрировали. Полученное масло переносили в диэтиловый эфир и через этот раствор пропускали газообразный аммиак. Полученную взвесь фильтровали и твердое вещество переносили в ацетон и фильтровали, чтобы удалить хлорид аммония. Удаление ацетона в вакууме дало 1,48 г указанного в заголовке соединения, т.пл. 179,2-180,7 С. ПОЛУЧЕНИЕ ПП. 1-[3-(4-Хлор-2,6-диизопропилфениламино)-карбонил]-амино]-сульфонил]-5-ацетилфенил]-этан-1-он. Указанное в заголовке соединение получали как описано в способе А из 3,5 диацетилбензолсульфонамида (0,35 г), 4-хлор 2,6-диизопропилфенилизоцианата (0,37 г), гидрида натрия (0,06 г 60% дисперсия в минеральном масле) в тетрагидрофуране (4 мл). Это дало 0,28 г указанного в заголовке соединения, т.пл. 201,9-203,4 С. ПОЛУЧЕНИЕ РР. 3-Хлор-1-индан-5-илпропан-1-он. К перемешиваемому раствору индана (300 г) и 3-хлорпропионоилхлорида (323 г) в метиленхлориде (2 л) при 0 С в течение 3 ч добавляли хлорид алюминия (376 г). Как только добавление завершалось, охлаждающую баню убирали и смесь нагревали до комнатной температуры и перемешивали, пока не прекращалось выделение водорода. Реакционную смесь гасили вливанием в смесь 3,5 кг льда и 700 мл концентрированной соляной кислоты. Слои разделяли и водную фазу экстрагировали метиленхлоридом. Объединенные метиленхлоридные слои промывали водой, насыщенным раствором бикарбоната натрия и рассолом. Органическую фазу сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток перекристаллизовывали из гексана с получением 282 г желтого твердого вещества, т.пл. 63,5-65,1 С. 30 ПОЛУЧЕНИЕ СС. 3,5,6,7-Тетрагидро-2 Нs-индацен-1-он. Концентрированную серную кислоту (550 мл) в течение 2 ч по каплям при перемешивании добавляли к 137 г 3-хлор-1-индан-5-ил-пропан 1-она. Полученный густой черный раствор нагревали до 90 С, пока не прекращалось выделение водорода (обычно 1-4 ч). Затем смесь охлаждали до комнатной температуры и вливали в 5 кг льда. Полученный шлам перемешивали в течение ночи и фильтровали. Затем желтокоричневое твердое вещество сушили в вакууме и перекристаллизовывали из гексана с получением 90 г указанного в заголовке соединения,т.пл. 72,4-74,8 С. ПОЛУЧЕНИЕ ТТ. 1,2,3,5,6,7-Гексагидро-sиндацен. Смесь 3,5,6,7-тетрагидро-2 Н-s-индацен-1 она (90 г), этанола (1 л), 10% палладия на углероде (1-2 г) и концентрированной соляной кислоты (50 мл) гидрировали на шейкере Парра при комнатной температуре, пока не прекращалось поглощение водорода. Смесь фильтровали через слой целита. Этот слой промывали 1 л диэтилового эфира. Фильтрат разбавляли водой и органическую фазу отделяли. Водную фазу экстрагировали 1 л эфира и объединенные эфирные экстракты промывали водой, насыщенным раствором бикарбоната натрия и рассолом. Эфирные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученное бледно-желтое твердое вещество перекристаллизовывали из метанола с получением 61 г указанного в заголовке соединения в виде бесцветных кристаллов, т.пл. 56,6-58,5 С. ПОЛУЧЕНИЕ УУ. 1-(1,2,3,5,6,7-Гексагидро-s-индацен-4-ил)-этанон. К перемешиваемому раствору 1,2,3,5,6,7 гексагидро-s-индацена (30 г) и ацетилхлорида(14,2 мл) в 120 мл бензола при 0 С в течение 1 ч добавляли 30 г хлорида алюминия. Охлаждающую баню убирали, и раствор нагревали до комнатной температуры и перемешивали в течение 4 ч. Затем темно-красную смесь вливали в смесь 270 г льда и 50 мл концентрированной соляной кислоты. Слои разделяли, и водную фазу экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным раствором бикарбоната натрия и рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением оранжевого твердого вещества, которое перекристаллизовывали из гексана с получением 34 г указанного в заголовке соединения, т. пл. 69,1-76,1 С. ПОЛУЧЕНИЕ ФФ. 1-(1,2,3,5,6,7-Гексагидро-s-индацен-4-ил)-этаноноксим. Смесь 1-(1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-этанона (33 г), этанола (250 мл), гидрохлорида гидроксиламина (58,5 г) и пиридина (80 мл) нагревали до температуры образования флегмы в течение 12 ч. Затем эту смесь охлаж 31 дали до комнатной температуры и концентрировали в вакууме Затем остаток обрабатывали водой (500 мл) и экстрагировали смесью хлороформ-метанол. Органическую фазу сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 32 г указанного в заголовке соединения в виде смеси Е- и Zизомеров, т.пл. 178,6-182,3 С. ПОЛУЧЕНИЕ XX. N-(1,2,3,5,6,7-Гексагидро-s-индацен-4-ил)-ацетамид. Смесь 1-(1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-этаноноксима (85 г) в 270 мл трифторуксусной кислоты по каплям в течение получаса добавляли к перемешиваемому при температуре образования флегмы раствору 90 мл трифторуксусной кислоты. Полученный пурпурный раствор затем нагревали с обратным холодильником в течение 1 ч. Раствор охлаждали до комнатной температуры, и трифторуксусную кислоту удаляли в вакууме. Темное твердое вещество растирали со смесью этилацет/гексаны с получением 83 г серого твердого вещества, которое использовали без дальнейшей очистки,т.пл. 257,4-259,1 С. ПОЛУЧЕНИЕ ЦЦ. 1,2,3,5,6,7-Гексагидроs-индацен-4-иламин. ВзвесьN-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)-ацетамида (110 г) в 70 мл 25% серной кислоты обрабатывали достаточным количеством этанола, чтобы получить раствор (приблизительно 70 мл). Полученный раствор нагревали до температуры образования флегмы за период времени 2 дня. Полученный черный раствор обрабатывали активированным углем, фильтровали в горячем виде и охлаждали до 0 С. Затем раствор осторожно нейтрализовали 20% раствором гидроксида натрия. Затем полученную взвесь фильтровали и сушили в вакууме с получением 80 г указанного в заголовке соединения,т.пл. 94,5-96,6 С, которое использовали без дальнейшей очистки. При необходимости указанное в заголовке соединение можно перекристаллизовать из метанола с получением белого твердого вещества. ПОЛУЧЕНИЕ ЧЧ. 1,2,3,5,6,7-Гексагидроs-индацен. К перемешиваемому раствору 1,2,3,5,6,7 гексагидро-s-индацен-4-иламина (77 г) в тетрагидрофуране (1,5 л) и триэтиламине (68,3 мл) добавляли одной порцией трифосген (43,9 г). Эту смесь нагревали до температуры образования флегмы в течение получаса, затем охлаждали до комнатной температуры. Тетрагидрофуран удаляли при пониженном давлении и остаток пeреносили в пентан и фильтровали через слой силикагеля. Удаление пентана в вакууме дало 80 г белого твердого вещества, т.пл. 35,036,2 С. ПОЛУЧЕНИЕ ШШ. 3-(1-Гидрокси-1 метил)-этилфуран. К перемешиваемому раствору 24,97 мл бромида метилмагния (3 М раствор в диэтило 001803 32 вом эфире) при 0 С добавляли 4,82 мл этилового эфира фуран-3-карбоновой кислоты в диэтиловом эфире. Эту смесь осторожно нагревали на водяной бане в течение 30 мин, после чего смесь вливали в ледяную воду, осторожно подкисляли с использованием буферного раствора и экстрагировали диэтиловым эфиром. Эфирные экстракты объединяли, промывали небольшим количеством рассола, сушили над сульфатом натрия и концентрировали в вакууме. Третичный спирт фурана очищали, используя флэшхроматографию со смесью гесан/этилацет (6:1). Выход: 2.89 г (64%). 1(br s, 1H), 7.42 (br s, 1 Н). ПОЛУЧЕНИЕ ЩЩ. 2-Аминосульфонил-3(1-гидрокси-1-метил)-этилфуран. К перемешиваемой смеси третичного спирта фурана в тетрагидрофуране при -78 С добавляли 17,19 мл метиллития (1,4 М раствор в диэтиловом эфире) и через 5 мин 18,51 мл вторбутиллития (1,3 М раствор в циклогексанах). Эту смесь продолжали перемешивать при -78 С в течение 40 мин и добавляли 5,02 мл сжиженного SO2. Температуру -78 С поддерживали в течение 5 мин, а затем повышали до комнатной температуры, продолжая перемешивать в течение 2 ч. Затем тетрагидрофуран удаляли в вакууме и сульфинат лития растворяли в 76,4 мл воды с последующим добавлением 7,78 г гидроксиламин-о-сульфоновой кислоты и 31 г ацетата натрия. Эту смесь перемешивали при комнатной температуре в течение ночи и экстрагировали этилацетатом. Этилацетатные экстракты объединяли, промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Сульфонамид очищали, используя флэшхроматографию со смесью гекасан/этилацетат(2:1). Выход: 1,91 г (41%), т. пл. 110,1-111,6 С. ПОЛУЧЕНИЕ ЫЫ. 3-(1-Гидрокси-1 метил)-этилтиофен. К перемешиваемому раствору 3,17 мл бромида метилмагния (3 М раствор в диэтиловом эфире) при 0 С добавляли 1 г 3 ацетотиофена в диэтиловом эфире. Затем эту смесь оставляли перемешиваться в течение 30 мин, в то же время нагревая ее до комнатной температуры, после чего смесь вливали в ледяную воду, подкисляли и экстрагировали диэтиловым эфиром. Эфирные экстракты объединяли,промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Выход: 800 мг (71%). 1H-ЯМР (400 мГц, ацетон-d6)1.50 (s, 6H),4.00 (br s, 1H), 7.15 (dd, 1 Н, J=1.4, 5), 7.23 (m,1 Н), 7.33 (dd, 1H, J=3.1, 5). ПОЛУЧЕНИЕ ААА. 2-Аминосульфонил-3(1-гидрокси-1-метил)-этилтиофен. К перемешиваемой смеси 800 мг третспиртового производного тиофена в тетрагид 33 рофуране добавляли 4, 22 мл метиллития (1,4 М раствор в диэтиловом эфире), затем через 5 мин добавляли 4,55 мл втор-бутиллития (1,3 М раствор в циклогексанах). Эту смесь продолжали перемешивать при -78 С в течение 40 мин и добавляли 1,23 мл сжиженного SO2. Температуру -78 С поддерживали в течение 5 мин, а затем повышали до комнатной температуры и продолжали перемешивание в течение 2 ч. Затем тетрагидрофуран удаляли в вакууме и сульфинат лития растворяли в 19 мл воды с последующим добавлением 1,9 г гидроксиламин-осульфоновой кислоты и 7,66 г ацетата натрия. Эту смесь перемешивали при комнатной температуре в течение ночи и экстрагировали этилацетатом. Этилацетатные экстракты объединяли, промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Сульфонамид очищали,используя флэшхроматографию со смесью гексан/этилацетат(2:1). Выход: 600 мг (48%), т.пл. 114,3-115,1 С. Пример 1. 1-(4-Хлор-2,6-дизопропилфенил)-3-[3-(1-гидрокси-1-метилэтил)-бензолсульфонил]-мочевина. К перемешиваемому раствору 2-(3 аминосульфонилфенил)-пропан-2-ола (26,5 г) в тетрагидрофуране добавляли гидрид натрия (5,2 г 60% дисперсия в минеральном масле). Как только выделение водорода прекращалось, одной порцией добавляли 4-хлор-2,6 диизопропилфенилизоцианат (30,8 г) и полученную смесь нагревали до температуры образования флегмы в течение 12 ч. Затем смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученную пену растворяли в воде, делали основным 1 н. гидроксидом натрия и эстрагировали двумя порциями смеси эфир/гексан в соотношении 1:1. Водный слой подкисляли 1 н. соляной кислотой и полученное белое твердое вещество отфильтровывали, промывали водой и сушили. Это дало 50 г белого твердого вещества, которое перекристаллизовывали из влажной смеси этилацетат/гексан с получением указанного в заголовке соединения,т.пл. 160,5-162,0 С. Указанные в заголовках примеров 2-130 соединения получали способом, аналогичным способу, который описан в примере 1, используя указанные реагенты. Пример 2. 1-(4-Хлор-2,6-диизопропилфенил)-3-[3-(1-гидроксициклопентил)-бензолсульфонил]-мочевина. 3-1-Гидроксициклопентил-бензолсульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 155 С. Пример 3. 1-(4-Хлор-2,6-диизопропилфенил)-3-[3-метилсульфамоил-бензолсульфонил]мочевина. 3-Метилсульфамоил-бензолсульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 125-128 С. 45 5-(1-Гидрокси-1-метил-этил)-фуран-2 сульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 116,0-117,9 С. Пример 121. 1-(4-Хлор-2,6-диизопропилфенил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевина. 4-(1-Гидрокси-1-метил-этил)-фуран-2 сульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 127,4-129,2 С. Пример 122. 1-(4-Хлор-2,6-диизопропилфенил)-3-[4-(1-гидрокси-1-метил-этил)-тиофен 2-сульфонил]-мочевина. 4-(1-Гидрокси-1-метил-этил)-тиофен-2 сульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 131,2-133,6 С. Пример 123. 1-(4-Хлор-2,6-диизопропилфенил)-3-[5-(1-гидрокси-1-метил-этил)-тиофен 2-сульфонил]-мочевина, натриевая соль. 5-(1-Гидрокси-1-метил-этил)-тиофен-2 сульфонамид; 4-хлор-2,6-диизопропил-фенилизоцианат. Т.пл.: 270,3-271,9 С. Пример 124. 1-(4-[1,3]Диоксолан-2-илтиофен-2-сульфонил)-3-(1,2,3,5,6,7-гексагидроs-индацен-4-ил)-мочевина. 4-[1,3]Диоксолан-2-ил-тиофен-2-сульфонамид; 4-изоцианато-1,2,3,5,6,7-гексагидро-sиндацен. Т.пл.: 224,7-226,6 С. Пример 125. 1-(4-[1,3]Диоксолан-2-ил-фуран-2-сульфонил)-3-(1,2,3,5,6,7-гексагидро-sиндацен-4-ил)-мочевина. 4-[1,3]Диоксолан-2-ил-фуран-2-сульфонамид; 4-изоцианато-1,2,3,5,6,7-гексагидро-sиндацен. Т.пл.: 183,5 С (разложение). Пример 126. 1-[3-(4,5-Дигидро-1 Н-имидазол-2-ил)-бензолсульфонил]-3-(1,2,3,5,6,7 гексагидро-s-индацен-4-ил)-мочевина. 3-(4,5-Дигидро-1 Н-имидазол-2-ил)-бензолсульфонамид; 4-изоцианато-1,2,3,5,6,7-гексагидро-s-индацен. Т.пл.: 241,0C (разложение). Пример 127. 1-(1 Н-Бензимидозол-5-сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен-4 ил)-мочевина. 1 Н-Бензимидозол-5-сульфонамид; 4-изоцианато-1,2,3,5,6,7-гексагидро-s-индацен. Т.пл.: 239,0 С (разложение). Пример 128. 1-(1,2,3,5,6,7-Гексагидро-sиндацен-4-ил)-3-[3-(1-гидроксиимино-этил)бензолсульфонил]-мочевина. 3-(1-Гидроксиимино-этил)-бензолсульфонамид; 4-изоцианато-1,2,3,5,6,7-гексагидро-sиндацен. Т.пл.: 249,8 С (разложение). Пример 129. 1-(4-Хлор-2,6-диизопропилфенил)-3-[3-трет-бутилсульфамоил-бензолсульфонил]-мочевина. Амид-трет-бутиламид бензол-1,3-дисульфоновой кислоты; 5-хлор-2-изоцианато-1,3 диизопропил-бензол. Пример 130. 1-(4-Хлор-2,6-диизопропилфенил)-3-[3-сульфамоил-бензолсульфонил]мочевина. Используя процедуру, подобную процедуре Получения Ж, из 200 мг (0,38 ммоль) (4-хлор 001803 46 2,6-диизопропил-фенил)-3-[3-трет-бутилсульфамоил-бензолсульфонил]-мочевины было получено 92 мг указанного в заголовке соединения в виде белого твердого вещества. Т.пл.: 172177 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль,где R1 представляет собой: 1,1-диоксо-1-тиохроманил, возможно замещенный (С 1-С 6)алкилом, 8-гидрокси-5,6,7,8 тетрагидронафтил; 8-оксо-5,6,7,8-тетрагидронафтил; 8-гидроксиимино-5,6,7,8-тетрагидронафтил; или фенил, тиенил, 5,6,7,8-тетрагидронафтил, фуранил, индолил, бензоимидазолил, каждый из которых возможно замещен 1-3 заместителями, выбранными из группы: (С 1 С 6)алкил, возможно замещенный 1-2 заместителями, выбранными из гидрокси, амино, (С 1 С 6)алкокси, перфторо(С 1-С 6)алкила, фенилокси,замещенного (С 1-С 6)ацилом, гидрокси(С 3-С 6) циклоалкил, галогено, перфторо(С 1-С 6)алкил,(С 1-С 6)алкиламиносульфонил,С 1-С 6)алкил)2 аминосульфонил, (С 1-С 6)алкилтио, (С 1-С 6)алкилсульфинил, (С 1-С 6)алкилсульфонил, аминосульфонил, (С 3-С 7)циклоалкиламиносульфонил,диоксоланил, возможно замещенный (С 1-С 6) алкилом, (С 1-С 6)алкокси, амино, имидазолил,фуранил, группа формулы где u равно 0, 1,R19 представляет собой водород или (С 1 С 6)алкил,R20 представляет собой водород, (С 1 С 6)алкил, (С 1-С 6)карбоксиалкил или фенил(С 1 С 6)алкил, группа формулы где s равно 0 или 1,Y представляет собой водород, (С 1 С 6)алкил,перфтор(С 1-С 6)алкил,(С 1 С 6)алкокси(С 1-С 6)алкил, NR9R10, где R9 и R10,каждый независимо, выбран из водорода и (С 1 С 6)алкила;R2 представляет собой фенил или 1,2,3,5,6,7-гексагидроиндаценил, каждый из которых возможно замещен 1-3 заместителями,выбранными из группы, состоящей из галогено,(С 1-С 6)алкила (линейного или разветвленного),циано, тиенила, фенила, группы формулы где Y представляет собой (С 1-С 6)алкил или амино. 2. Соединение по п.1, где R1 представляет собой 8-гидрокси-5,6,7,8-тетрагидронафтил; 8 оксо-5,6,7,8-тетрагидронафтил; 8-гидроксиимино-5,6,7,8-тетрагидронафтил; индолил; бензоимидазолил; или фенил, тиенил, фуранил,каждый из которых возможно замещен галогено, (С 1-С 6)алкилом, который возможно замещен 1-2 гидрокси, (С 3-С 7)циклоалкиламиносульфонилом, (С 1-С 6)алкиламиносульфонилом, диоксоланилом, который возможно замещен (C1 С 6)алкилом, группой формулы где u равно 0, 1,R19 представляет собой (С 1-С 6)алкил,R20 представляет собой водород, или группой формулы где Y представляет собой водород, (С 1-С 6)алкил,(С 1-С 6)алкокси(С 1-С 6)алкил. 3. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из 1-(4-хлор-2,6-диизопропил-фенил)-3-[3-(1 гидрокси-1-метил-этил)-бензосульфонил]мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(1,2,3,5,6,7-гексагидро-4-аза-s-индацен 8-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-тиофен-2 сульфонил]-мочевины; 1-(4-[1,3]диоксолан-2-ил-фуран-2 сульфонил)-3-(1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-мочевины; 1-(2,6-диизопропил-фенил)-3-[4-(1 гидрокси-1-метил-этил)-фуран-2-сульфонил]мочевины; 1-(2,6-диизопропил-фенил)-3-[4-(1 гидрокси-1-метил-этил)-тиофен-2-сульфонил]мочевины; 1-(4-ацетил-тиофен-2-сульфонил)-3(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(1 Н-бензимидазол-5-сульфонил)-3(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)3-[4-(1-гидрокси-1-метил-этил)-тиофен-2 сульфонил]-мочевины; 1-(8-хлор-1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(4-ацетил-фуран-2-сульфонил)-3(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(8-фтор-1,2,3,5,6,7-гексагидро-s-индацен 4-ил)-3-[4-(1-гидрокси-1-метил-этил)-фуран-2 сульфонил]-мочевины; 1-(4-фтор-2,6-диизопропил-фенил)-3-[3-(1 гидрокси-1-метил-этил)-бензолсульфонил]мочевины; 1-(6-фтор-1 Н-бензимидазол-5-сульфонил)3-(1,2,3,5,6,7-гексагидро-s-индацен-4-ил)мочевины; 1-(4-хлор-2,6-диизопропил-фенил)-3-(1 Ниндол-6-сульфонил)-мочевины; 1-(4-хлор-2,6-диизопропил-фенил)-3-(5 фтор-1 Н-индол-6-сульфонил)-мочевины; 1-[1,2,3,5,6,7-гексагидро-s-индацен-u-ил)3-(1 Н-индол-6-сульфонил)-мочевины; 1-(5-фтор-1 Н-индол-6-сульфонил)(1,2,3,5,6,7-гексагидро-5-индацен-4-ил)мочевины; 1-[4-хлор-2,6-диизопропил-фенил]-3-[2 фтор-5-(2-метил-(1,3)диоксолан-2-ил)бензолсульфонил]-мочевины; 3-[3-[4-хлор-2,6-диизопропил-фенил]уреидосульфонил]-N-метил-бензолсульфонамида; 1-[2-фтор-5-(2-метил-(1,3)диоксолан-2-ил)бензолсульфонил]-3-(1,2,3,5,6,7-гексагидроиндацен-4-ил)-мочевины и 3-[3-(1,2,3,5,6,7-гексагидро-S-индацен-4 ил)-уреидосульфонил]-N-метил-бензолсульфонамида. 4. Фармацевтическая композиция для лечения менингита и сальпингита, септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресссиндрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита, эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита,реперфузионного повреждения, васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-против-хозяина, аутоиммунных заболеваний, включая сахарный диабет типа I и рассеянный склероз, заболеваний периодонта, интерстициального фиброза легких, цирроза, системного склероза, келоидного образования, опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения, депрессии,атеросклероза и остеопороза у млекопитающего, в том числе человека, содержащая введение количества соединения по п.1 или его фармацевтически приемлемой соли, эффективного при таком лечении или ингибировании, и фармацевтически приемлемый носитель. 5. Способ лечения состояния, выбранного из группы, состоящей из менингита и сальпингита, септического шока, диссеминированной внутрисосудистой коагуляции и/или респираторного дистресс-синдрома взрослых, острого или хронического воспаления, артрита, холангита, колита, энцефалита, эндокардита, гломерулонефрита, гепатита, миокардита, панкреатита, перикардита, реперфузионного повреждения,васкулита, острой и замедленной гиперчувствительности, отторжения трансплантата и реакции трансплантат-против-хозяина,аутоиммунных заболеваний, включая сахарный диабет типа I и 50 рассеянный склероз, заболеваний периодонта,интерстициального фиброза легких, цирроза,системного склероза, келоидного образования,опухолей, которые продуцируют ИЛ-1 как аутокринный фактор роста, кахексии, болезни Альцгеймера, перкуссионного повреждения,депрессии, атеросклероза и остеопороза у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят количество соединения по п.1 или его фармацевтически приемлемой соли, эффективное при лечении такого состояния. 6. Соединение 4-(1-гидрокси-1-метилэтил)-фуран-2-сульфонамид.
МПК / Метки
МПК: C07C 311/54, A61K 31/64, A61P 35/00
Метки: производные, активности, применение, сульфонилмочевины, интерлейкина-1, контроля
Код ссылки
<a href="https://eas.patents.su/26-1803-proizvodnye-sulfonilmocheviny-i-ih-primenenie-dlya-kontrolya-aktivnosti-interlejjkina-1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные сульфонилмочевины и их применение для контроля активности интерлейкина-1</a>
Предыдущий патент: Дисперсионные покрытия на основе (со)полимеров винилиденфторида, модифицированных акриловыми полимерами
Следующий патент: Продукт, подобный лярду, и сособ его получения
Случайный патент: Способ количественного определения 7-окса-6-оксобрассиностероидов и состав для его осуществления












