Ингибиторы кинезина в качестве средств для лечения рака
Номер патента: 18014
Опубликовано: 30.04.2013
Авторы: Вальтер Аннетте Ольга, Барсанти Пол, Абрамс Тиниа, Дул Дейвид, Ренхау Пол А., Форе Мишель
Формула / Реферат
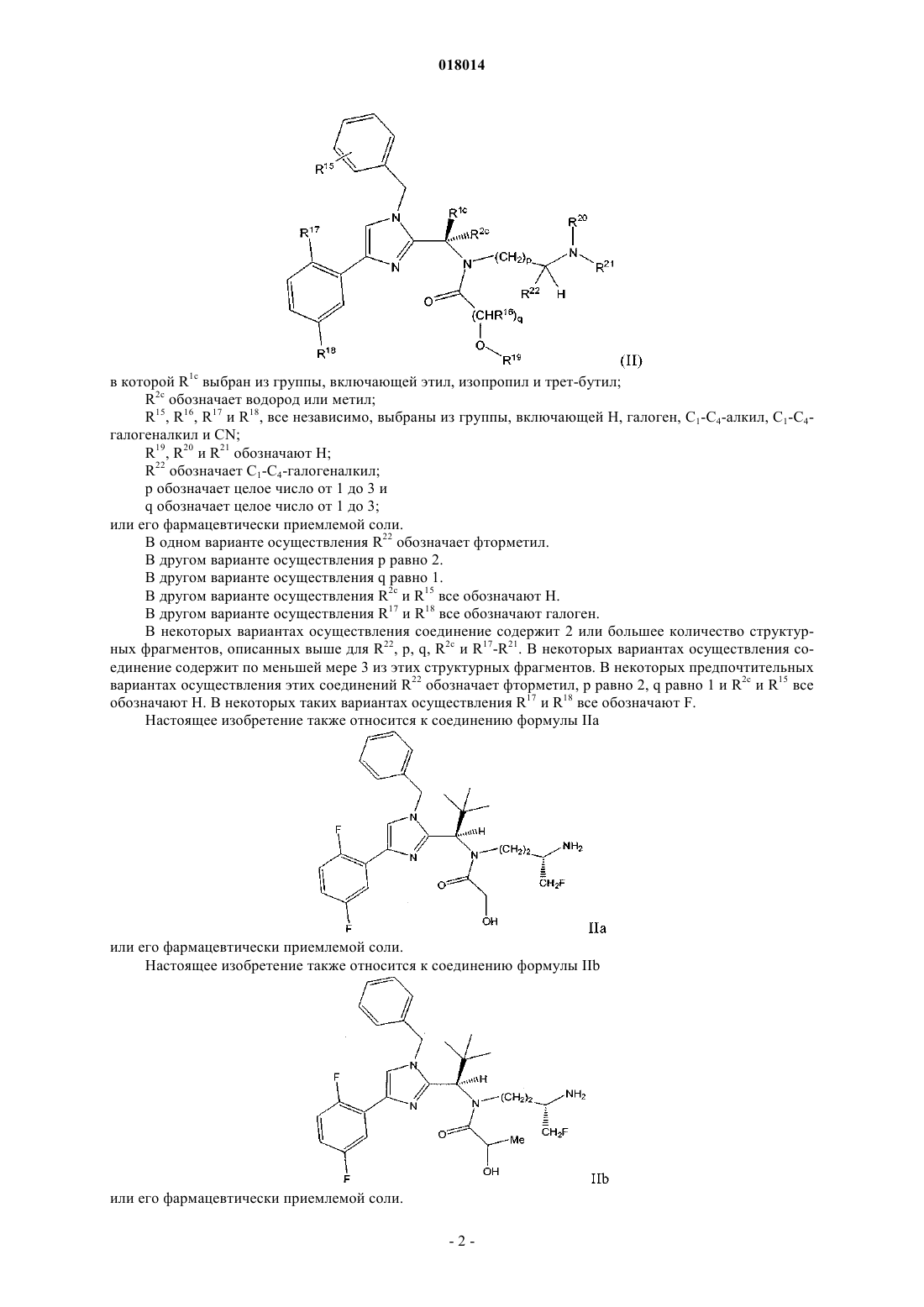
1. Соединение формулы (II)
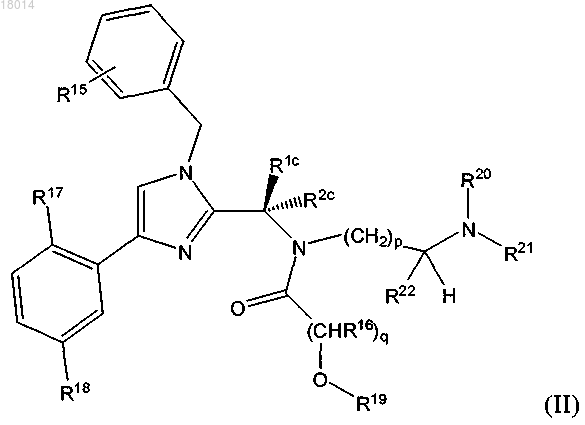
в которой R1c выбран из группы, включающей этил, изопропил и трет-бутил;
R2c обозначает водород или метил;
R15, R16, R17 и R18, все независимо, выбраны из группы, включающей Н, галоген, C1-C4-алкил, С1-С4-галогеналкил и CN;
R19, R20 и R21 обозначают Н;
R22 обозначает С1-С4-галогеналкил;
р обозначает целое число от 1 до 3 и
q обозначает целое число от 1 до 3;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R22 обозначает фторметил.
3. Соединение по п.1 или 2, в котором р равно 2.
4. Соединение по любому из пп.1-3, в котором q равно 1.
5. Соединение по любому из пп.1-4, в котором R2c и R15, каждый, обозначают Н.
6. Соединение по п.5, в котором R17 и R18, каждый, обозначают галоген.
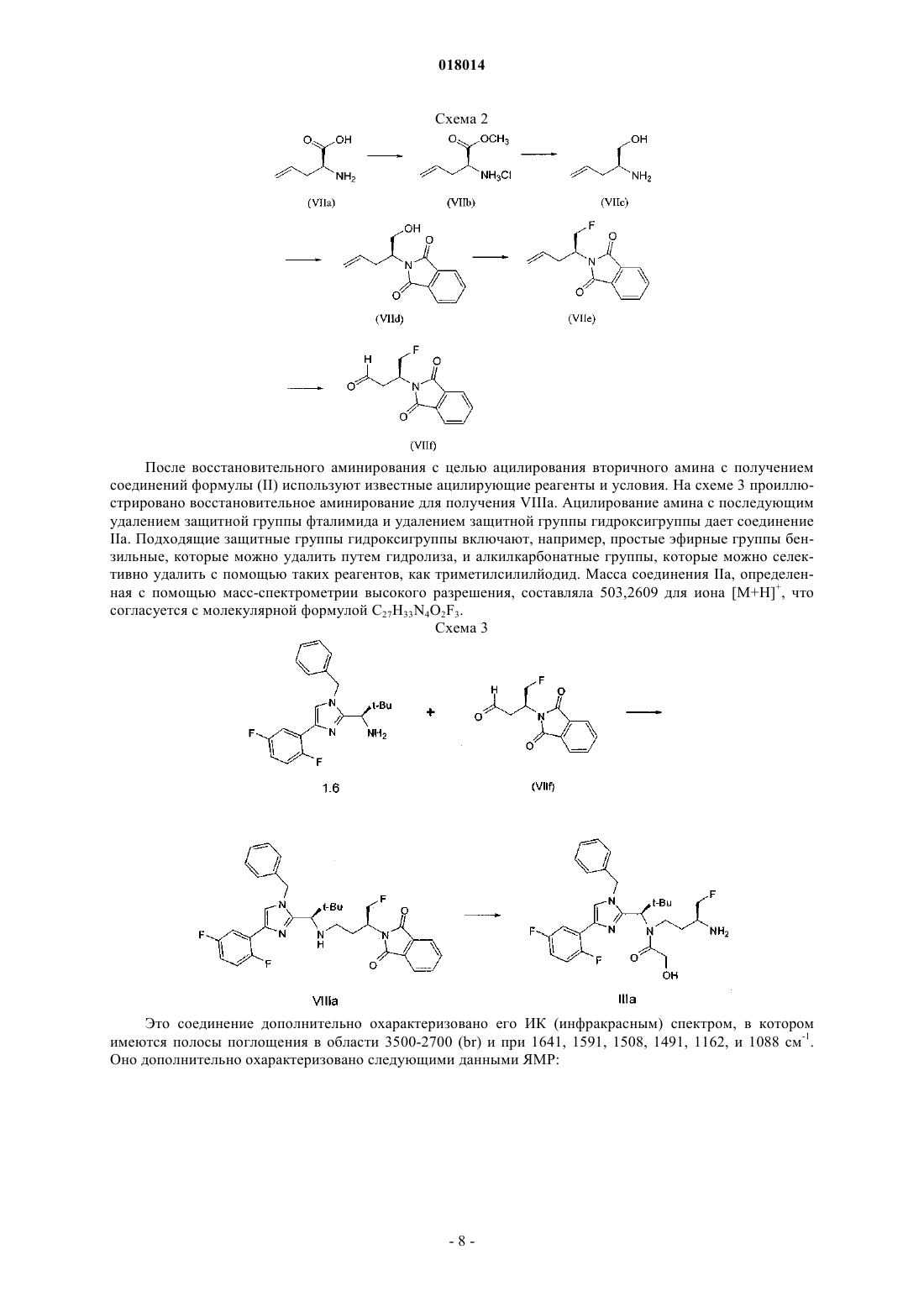
7. Соединение формулы IIb
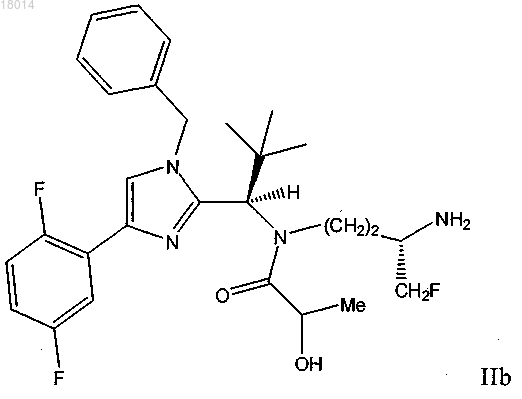
или его фармацевтически приемлемая соль.
8. Соединение формулы IIa
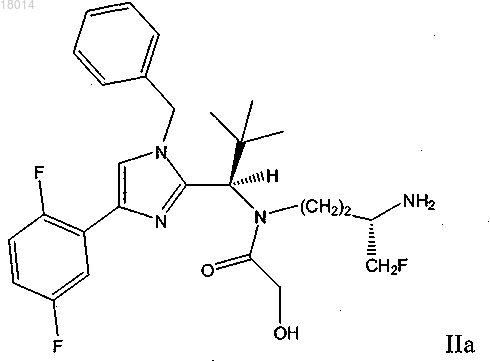
или его фармацевтически приемлемая соль.
9. Соединение формулы IIc
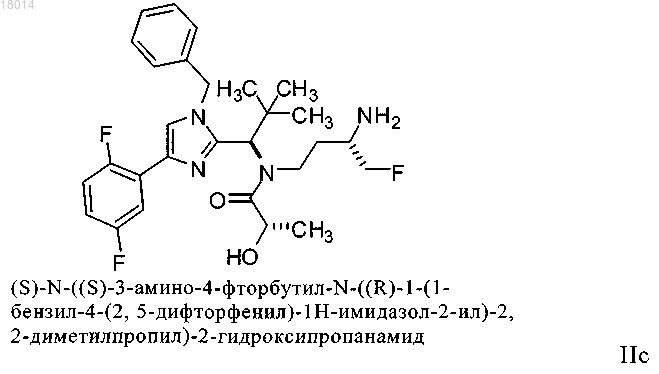
или его фармацевтически приемлемая соль.
10. Способ лечения пролиферативного заболевания, выбранного из группы, включающей солидную опухоль и рак крови, у млекопитающего, включающий введение указанному млекопитающему соединения по любому из пп.7, 8 или 9 или фармацевтически приемлемой соли любого из этих соединений в терапевтически эффективном количестве.
11. Способ по п.10, в котором указанное пролиферативное заболевание представляет собой солидную опухоль, выбранную из группы, включающей карциному легких, карциному молочной железы, карциному яичника, карциному кожи, карциному толстой кишки, карциному мочевого пузыря, карциному печени, карциному желудка, рак предстательной железы, почечно-клеточную карциному, носоглоточную карциному, плоскоклеточную карциному, папиллярную карциному щитовидной железы, карциному шейки матки, мелкоклеточную карциному легких (МККЛ), немелкоклеточную карциному легких, рак поджелудочной железы, плоскоклеточный рак головы и шеи и саркомы.
12. Способ по п.11, в котором солидная опухоль представляет собой карциному молочной железы.
13. Способ по п.12, в котором карцинома молочной железы представляет собой метастатическую карциному молочной железы.
14. Способ по п.11, в котором солидная опухоль представляет собой карциному желудка.
15. Способ по п.11, в котором солидная опухоль представляет собой рак предстательной железы.
16. Способ по любому из пп.11-15, в котором опухоль представляет собой опухоль, обладающую множественной лекарственной резистентностью.
17. Способ по п.16, в котором опухоль экспрессирует повышенный уровень Р-гликопротеина.
18. Способ по п.10, в котором указанное пролиферативное заболевание представляет собой рак крови, выбранный из группы, включающей ходжкинскую лимфому (ХЛ), неходжкинскую лимфому (НХЛ), лейкоз, миелогенный лейкоз, лимфолейкоз, острый миелогенный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), острый лимфолейкоз (ОЛЛ), хронический лимфолейкоз (ХЛЛ), миелодиспластический синдром (МДС), волосатоклеточный лейкоз и множественную миелому.
19. Способ по п.18, в котором указанный рак крови представляет собой острый миелогенный лейкоз.
20. Способ по п.18, в котором указанный рак крови представляет собой множественную миелому.
21. Фармацевтическая композиция, включающая соединение по любому из пп.1-9 и фармацевтически приемлемый наполнитель.
Текст
ИНГИБИТОРЫ КИНЕЗИНА В КАЧЕСТВЕ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ РАКА В изобретении описаны новые имидазолы формулы которые ингибируют активность кинезина - белка веретена (КБВ, также называемый Eg5). Ингибиторы КБВ могут уменьшить нежелательную пролиферацию клеток и оказать другие лечебные воздействия. В изобретении также описаны фармацевтические композиции, содержащие эти новые соединения, и способы применения новых ингибиторов КБВ и содержащих их фармацевтических композиций для лечения разных типов раковых заболеваний. Соединения,композиции и способы, предлагаемые в настоящем изобретении, являются особенно полезными для лечения некоторых классов рака, которые резистентны по отношению к воздействию обычных лекарственных средств, поскольку показано, что такие раковые заболевания остаются чувствительными к соединениям, предлагаемым в настоящем изобретении. Область техники, к которой относится изобретение Настоящее изобретение относится к способам лечения пролиферативных нарушений, таких как раковые заболевания, путем введения ингибиторов КБВ. Уровень техники Кинезины являются моторными белками, которые используют аденозинтрифосфат для связывания с микротрубочками и генерации механического усилия. Кинезины характеризуются моторным доменом,содержащим примерно 350 аминокислотных остатков. Расшифрована кристаллическая структура нескольких моторных доменов кинезина. К настоящему времени идентифицированы около тысячи родственных кинезину белков (РКБ). Кинезины участвуют во многих биологических процессах в клетках, включая транспорт органелл и везикул и поддержание эндоплазматического ретикулума. Различные РКБ взаимодействуют с микротрубочками митотического веретена или с хромосомами непосредственно и, видимо, играют главную роль на митотических стадиях клеточного цикла. Эти митотические РКБ представляют особый интерес для разработки противораковых средств. Кинезин - белок веретена (КБВ) (также известный как Eg5, HsEg5, KNSL1 или KIF11) - является одним из нескольких кинезиноподобных моторных белков, которые локализованы в митотическом веретене и для которых известно, что они необходимы для образования и/или функционирования биполярного митотического веретена. В 1995 г. показано, что уменьшение содержания КБВ с помощью антител против С-конца КБВ задерживает митоз клеток HeLa с помощью последовательностей моноастральных микротрубочек (Blangyet al., Cell 83:1159-1169, 1995). Мутации в генах bimC и cut7, которые считаются гомологами КБВ, приводят к нарушению отделения центросом в Aspergillus nidulans (Enos, A.P., and N.R. Morris, Cell 60:10191027, 1990) и Schizosaccharomyces pombe (Hagan, I., and M. Yanagida, Nature 347:563-566, 1990). Обработка клеток с помощью ATRA (полностью-транс-ретиноевая кислота), которая уменьшает экспрессирование КБВ на уровне белка, или уменьшение количества КБВ с помощью антисмысловых олигонуклеотидов показали, что происходит значительное подавление роста клеток DAN-G карциномы поджелудочной железы, и это указывает на то, что КБВ может участвовать в антипролиферативном воздействии полностью-транс-ретиноевой кислоты (Kaiser, A., et al., J. Biol. Chem. 274, 18925-18931, 1999). Интересно, что показано, что родственная Xenopus laevis Aurora протеинкиназа pEg2 связывается с XlEg5 и фосфорилирует его (Giet, R., et al., J. Biol. Chem. 274:15005-15013, 1999). Возможные субстраты родственных Aurora киназ представляют особый интерес для разработки противораковых средств. Например, у пациентов,страдающих раком толстой кишки, киназы Aurora 1 и 2 сверхэкспрессируются на уровне белка и ДНК и гены амплифицируются. Показано, что первая проникающая в клетку небольшая молекула - ингибитор КБВ, "монастрол",останавливает клеточный цикл у клеток с монополярными веретенами, но не влияет на полимеризацию микротрубочек, на которую влияют обычные химиотерапевтические средства, такие как таксаны и алкалоиды барвинка (Mayer, T.U., et al., Science 256:971-974, 1999). При исследованиях, основанных на фенотипе, установлено, что монастрол является ингибитором, и предположено, что это соединение может послужить основой для разработки противораковых лекарственных средств. Установлено, что ингибирование не является конкурентным по отношению к аденозинтрифосфату и быстро обратимо (DeBonis, S.,et al., Biochemistry, 42:338-349, 2003; Kapoor, T.M., et al., J. Cell Biol., 750:975-988, 2000). Вследствие важности улучшенных химиотерапевтических средств необходимы ингибиторы КБВ,которые in vivo являются эффективными ингибиторами КБВ и белков, родственных КБВ. Некоторые ингибиторы КБВ были описаны ранее. Например, в WO 06/002236 и PCT/US 2006/031129 раскрыты некоторые классы соединений, для которых указано, что они являются ингибиторами КБВ. Испинесиб (SB715992) является исследуемым в клинике соединением, разработанным фирмой Cytokinetics, для которого указано, что он действует, как ингибитор КБВ. Настоящее изобретение относится к новым ингибиторам КБВ, обладающим улучшенной активностью, и к новым способам применения этих ингибиторов КБВ. Кроме того, оно относится к новым ингибиторам КБВ, которые эффективны по отношению к раковым клеткам, которые резистентны по отношению к другим терапевтическим средствам, таким как паклитаксел, поскольку они экспрессируют Р-гликопротеин, который действует, как выкачивающий насос. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению формулы (II)R2c обозначает водород или метил;R22 обозначает С 1-С 4-галогеналкил; р обозначает целое число от 1 до 3 иq обозначает целое число от 1 до 3; или его фармацевтически приемлемой соли. В одном варианте осуществления R22 обозначает фторметил. В другом варианте осуществления р равно 2. В другом варианте осуществления q равно 1. В другом варианте осуществления R2c и R15 все обозначают Н. В другом варианте осуществления R17 и R18 все обозначают галоген. В некоторых вариантах осуществления соединение содержит 2 или большее количество структурных фрагментов, описанных выше для R22, р, q, R2c и R17-R21. В некоторых вариантах осуществления соединение содержит по меньшей мере 3 из этих структурных фрагментов. В некоторых предпочтительных вариантах осуществления этих соединений R22 обозначает фторметил, р равно 2, q равно 1 и R2c и R15 все обозначают Н. В некоторых таких вариантах осуществления R17 и R18 все обозначают F. Настоящее изобретение также относится к соединению формулы IIa или его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению формулы IIb или его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению формулы IIc или его фармацевтически приемлемой соли. Один вариант осуществления настоящего изобретения относится к способу лечения пролиферативного заболевания, выбранного из группы, включающей солидную опухоль и рак крови, у млекопитающего, включающий введение указанному млекопитающему соединения любой из формул II, IIa, IIb или IIc или фармацевтически приемлемой соли любого из этих соединений в терапевтически эффективном количестве. В другом варианте осуществления солидная опухоль выбрана из группы, включающей карциному легких, карциному молочной железы, карциному яичника, карциному кожи, карциному толстой кишки,карциному мочевого пузыря, карциному печени, карциному желудка, рак предстательной железы, почечно-клеточную карциному, носоглоточную карциному, плоскоклеточную карциному, папиллярную карциному щитовидной железы, карциному шейки матки, мелкоклеточную карциному легких (МККЛ),немелкоклеточную карциному легких, рак поджелудочной железы, плоскоклеточный рак головы и шеи,рак головного мозга и саркомы. В некоторых вариантах осуществления солидная опухоль представляет собой опухоль, которая резистентна по отношению к другим противораковым лекарственным средствам. Она может представлять собой рак, который экспрессирует выкачивающий насос, такой как P-gp, который стимулирует резистентность по отношению к лекарственному средству, или рак, для которого показано, что он является резистентным при лечении такими лекарственными средствами, как паклитаксел или SB-715992. Раковые заболевания, которые являются резистентным по отношению к таким лекарственными средствами, как паклитаксел, вследствие сверхэкспрессирования раковыми клетками выкачивающего насоса, в частности Р-гликопротеина (P-gp), чувствительны по отношению к соединениям формулы II, как это показано в настоящем изобретении, в то время как соединения, не содержащие гидроксигруппу, сходные с соединениями формулы II, могут не являться эффективными для борьбы с этими резистентными по отношению к лекарственному средству опухолями. Соединения формулы IIa, IIb, и IIc являются особенно подходящими для борьбы с опухолями, которые экспрессируют P-gp и обладают резистентностью по отношению к другим терапевтическим средствам. Эти соединения являются предпочтительными вследствие указанной неожиданной применимости для борьбы с резистентными по отношению к лекарственному средству опухолями. Предполагается, что их активность по отношению к резистентным по отношению к лекарственному средству опухолям связана со свободной гидроксигруппой амидного фрагмента формулы II. В другом варианте осуществления солидная опухоль представляет собой карциному молочной железы. В другом варианте осуществления карцинома молочной железы представляет собой метастатическую карциному молочной железы. В альтернативном варианте осуществления солидная опухоль представляет собой карциному желудка. В другом варианте осуществления солидная опухоль представляет собой рак предстательной железы. В каждом из этих вариантов осуществления опухоль иногда представляет собой опухоль, которая резистентна по отношению к другим лекарственным средствам. В некоторых вариантах осуществления опухоль выбрана из группы, включающей рак почки, печени, толстой кишки, головного мозга или молочной железы. В некоторых вариантах осуществления она представляет собой опухоль, которая экспрессирует повышенное количество P-gp. Такое увеличенное экспрессирование P-gp может возникнуть естественным путем или явиться следствием лечения другими лекарственными препаратами. В другом варианте осуществления настоящее изобретение относится к способу лечения пролиферативного заболевания, выбранного из группы, включающей солидную опухоль и рак крови, у млекопитающего, включающему введение указанному млекопитающему соединения любой из формул IIa, IIb или IIc или фармацевтически приемлемой соли любого из этих соединений в терапевтически эффективном количестве, в котором рак крови выбран из группы, включающей ходжкинскую лимфому (ХЛ), неходжкинскую лимфому (НХЛ), лейкоз, миелогенный лейкоз, лимфолейкоз, острый миелогенный лейкоз(ОМЛ), хронический миелогенный лейкоз (ХМЛ), острый лимфолейкоз (ОЛЛ), хронический лимфолейкоз(ХЛЛ), миелодиспластический синдром (МДС), волосатоклеточный лейкоз и множественную миелому. В другом варианте осуществления рак крови представляет собой острый миелогенный лейкоз. В другом варианте осуществления рак крови представляет собой множественную миелому. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, включающей соединение формул II, IIa, IIb или IIc и фармацевтически приемлемый наполнитель. Краткое описание чертежей Фиг. 1 - относительная чувствительность по отношению к соединению IIa для линий клеток, полученных из злокачественных новообразований в крови. Значения относительной чувствительности, основанные на данных исследования CellTiter Glo набора линий клеток злокачественных новообразований в крови, приведены в виде зависимости средних значений Log(GI50) (GI50 означает концентрацию при 50% подавлении) для всей группы клеток от значений Log(GI50) для каждой линии клеток; положительные значения (столбик диаграммы направлен направо) относятся к линиям клеток, которые являются более чувствительными, чем в среднем, и отрицательные значения (столбик диаграммы направлен налево) относятся к линиям клеток, которые являются менее чувствительными, чем в среднем; фиг. 2 - исследование с помощью FACS стадий развития клеток для линий клеток SUDHL-4 и RL,обработанных соединением IIa: первый столбец относится к необработанным клеткам, второй столбец относится к клеткам после обработки соединением IIa в течение 24 ч и третий столбец относится к клеткам после обработки соединением IIa в течение 48 ч; фиг. 3 - данные, показывающие, что соединение IIa является цитотоксичным для бластных клеток ОМЛ, взятых у пациентов, страдающих ОМЛ. На фиг. 3 А представлена зависимость выраженной в процентах выживаемости от дозы. На фиг. 3B охарактеризованы культуры клеток после выращивания в течение 2 недель. На фиг. 3C представлены доли клеток на стадиях 2N, 2N или 4N и проведено сопоставление воздействия соединения IIa и паклитаксела; фиг. 4 - эффективность соединения IIa при введении в режиме q4d3 для модели ксенотрансплантата подкожной опухоли MV4;11. Опухоли MV4;11 вводили самкам лишенных вилочковой железы мышей линии nu/nu путем подкожной инъекции 107 клеток в 0,2 мл смеси состава 1:1 HBSS и Matrigel в правый бок каждой мыши. Когда объемы опухолей достигали 250 мм 3, примерно через 24 дня после имплантации клеток, на основе объемов опухолей мышей путем рандомизации разделяли на группы для лечения (n=9). Животным внутривенно вводили разбавитель (каптисол), соединение IIa или SB-715992(испинесиб, ингибитор КБВ фирмы Cytokinetics, который проходит клинические исследования) ВВ. Всем животным введение проводили в режиме q4d3. (A) Зависимость эффективность/объемы опухолей для групп животных, подвергавшихся лечению, от количества дней, прошедших после рандомизации; (В) зависимость для выраженного в процентах изменения массы тела по сравнению с начальной массой в день рандомизации; фиг. 5 - эффективность соединения IIa при введении в режиме q4d3 для модели ксенотрансплантата опухоли КВ 8.5. Опухоли КВ 8.5 вводили самкам лишенных вилочковой железы мышей линии nu/nu(Charles River Laboratories) путем подкожной инъекции 5106 клеток в 0,2 мл смеси состава 1:1 HBSS иMatrigel в правый бок каждой мыши. Когда объемы опухолей достигали примерно 300 мм 3, примерно через 10 дней после имплантации клеток, на основе объемов опухолей мышей путем рандомизации разделяли на группы для лечения (n=9/группа). Животным ВВ вводили соединение IIa или SB-715992. Паклитаксел ВБ вводили в дозе, равной 30 мг/кг. Всем животным введение проводили в режиме q4d3. Слева - зависимость эффективность/объемы опухолей для групп животных, подвергавшихся лечению, от количества дней, прошедших после начала введения; справа - зависимость для выраженного в процентах изменения массы тела по сравнению с начальной массой в день рандомизации/начала введения. р 0,05 для сопоставления с разбавителем и SB-715992 (ANOVA/методика Данна); фиг. 6 - эффективность соединения IIc при введении в режиме q4d3 для модели ксенотрансплантата опухоли КВ 8.5. Опухоли КВ 8.5 вводили самкам лишенных вилочковой железы мышей линии nu/nu(Charles River Laboratories) путем подкожной инъекции 5106 клеток в 0,2 мл смеси состава 1:1 HBSS иMatrigel в правый бок каждой мыши. Когда средние объемы опухолей достигали 339 мм 3, на основе объемов опухолей мышей путем рандомизации разделяли на группы для лечения (n=9). Животным ВВ вводили соединение IIc или SB-715992. Паклитаксел вводили ВБ в дозе, равной 30 мг/кг. Всем животным введение проводили в режиме q4d3. Слева - зависимость эффективность/объемы опухолей для групп животных, подвергавшихся лечению, от количества дней, прошедших после начала введения; справа зависимость для выраженного в процентах изменения массы тела по сравнению с начальной массой в день рандомизации/начала введения. В день 11 данные для группы животных, которым вводили соединение IIc при дозе, равной 1,25 мг/кг, статистически значимо отличались от данных для группы животных, которым вводили разбавитель (р 0,05, ANOVA/критерий Тьюки); фиг. 7 - эффективность соединения Ia при введении в режиме q4d3 для модели ксенотрансплантата опухоли КВ 8.5. Опухоли КВ 8.5 вводили самкам лишенных вилочковой железы мышей линии nu/nu(Charles River Laboratories) путем подкожной инъекции 5106 клеток в 0,2 мл смеси состава 1:1 HBSS иMatrigel в правый бок каждой мыши. Когда средние объемы опухолей достигали 285 мм 3, на основе объемов опухолей мышей путем рандомизации разделяли на группы для лечения (n=10). Животным ВВ вводили соединение Ia или SB-715992. Паклитаксел вводили ВБ в дозе, равной 30 мг/кг. Всем животным введение проводили в режиме q4d3. Слева - зависимость эффективность/объемы опухолей для групп животных, подвергавшихся лечению, от количества дней, прошедших после начала введения; справа зависимость для выраженного в процентах изменения массы тела по сравнению с начальной массой в день рандомизации/начала введения. Данные для всех групп статистически значимо не отличались от данных для группы животных, которым вводили разбавитель (ANOVA для методики Ранкса). Варианты осуществления изобретения А. Определения и общий обзор. Следует понимать, что терминология, использующаяся в настоящем изобретении, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения. Следует отметить, что при использовании в настоящем изобретении и формуле изобретения термины в единственном числе включают и термины во множественном числе, если из контекста явно не следует иное. В настоящем описании и приведенной ниже формуле изобретения используется целый ряд терминов, которые обладают указанными ниже значениями. При использовании в настоящем изобретении "алкил" означает одновалентные насыщенные алифатические обладающие линейной цепью, разветвленные или циклические гидрокарбильные группы, содержащие от 1 до 4 атомов углерода. Примерами этого термина являются такие группы, как метил, этил,н-пропил, изопропил, н-бутил, изобутил, трет-бутил. Термин "линейный алкил" означает алкильную группу, которая не является разветвленной. Термин "галогеналкил" означает алкильную группу, в которой по меньшей мере один атом водорода заменен на атом галогена. В одном варианте осуществления термин означает фторметил, дифторметил или трифторметил и т.п."Галоген" означает фтор, хлор, бром или йод и предпочтительно означает фтор или хлор."Биологическая активность" при использовании в настоящем изобретении означает уменьшение концентрации по данным исследования с помощью по меньшей мере одной из методик, описанных в примерах 1-13. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает нетоксичные соли с кислотой или щелочно-земельным металлом соединений формул (II). Эти соли можно получить in situ во время окончательного выделения и очистки соединений формул (II) или посредством отдельной реакции основной или кислотной группы с подходящей органической или неорганической кислотой или основанием соответственно. Типичные фармацевтически приемлемые соли включают, но не ограничиваются только ими, следующие: ацетат, адипат, альгинат, цитрат, аспартат,бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат,гексаноат, фумарат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы можно кватернизировать такими реагентами, как алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинными цепями,такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, арилалкилгалогениды,такие как бензил- и фенетилбромиды и др. Таким образом получают растворимые или диспергирующиеся в воде или масле продукты. Примеры кислот, которые можно использовать для получения фармацевтически приемлемых солей присоединения с кислотами, включают такие неорганические кислоты, как хлористо-водородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как уксусная, гиппуровая, молочная, щавелевая кислота, малеиновая кислота, метансульфоновая кислота, янтарная кислота и лимонная кислота. Соли присоединения с основаниями можно получить in situ при окончательном выделении и очистке соединений формулы (II) или путем раздельных реакций кислотных групп карбоновых кислот с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком или с первичным, вторичным или третичным органическим амином. Фармацевтически приемлемые соли включают, но не ограничиваются только ими, соли, содержащие катионы щелочных и щелочно-земельных металлов, такие как соли натрия, лития, калия, кальция, магния, алюминия и т.п., а также соли аммония, четвертичного аммония и аминов, включая, но не ограничиваясь только ими соли аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина,триметиламина, триэтиламина, этиламина и т.п. Другие типичные органические амины, применяющиеся для получения солей присоединения с основаниями, включают диэтиламин, этилендиамин, этаноламин,диэтаноламин, пиперазин и т.п. При использовании в настоящем изобретении термин "фармацевтически приемлемый сложный эфир" означает сложные эфиры, которые гидролизуются in vivo, и включают такие, которые легко раз-5 018014 рушаются в организме человека с высвобождением исходного соединения или его соли. Подходящие сложноэфирные группы включают, например, образованные из фармацевтически приемлемых алифатических карбоновых кислот, предпочтительно алканкарбоновых, алкенкарбоновых, циклоалканкарбоновых и алкандикарбоновых кислот, в которых каждый алкильный или алкенильный фрагмент предпочтительно содержит не более 6 атомов углерода. Типичные примеры предпочтительных сложных эфиров включают, но не ограничиваются только ими, формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты. Термин "фармацевтически приемлемое пролекарство" при использовании в настоящем изобретении означает такие пролекарства соединений, предлагаемых в настоящем изобретении, которые с медицинской точки зрения применимы для взаимодействия с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п., характеризуются разумным соотношением польза/риск и эффективны для применения по назначению, а также, когда это возможно,цвиттерионные формы соединений, предлагаемых в настоящем изобретении. Термин "пролекарство" означает соединения, которые быстро подвергаются превращению in vivo и образуют исходные соединения указанной выше формулы, например путем гидролиза в крови. Обсуждение приведено в публикациях Т. Higuchi and V. Stella, Pro-Drugs as Njvel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, иEdward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, которые включены в настоящее изобретение в качестве ссылки. При использовании в настоящем изобретении "противораковые средства", или "средство для лечения рака", или "противораковое лекарственное средство" означают средства, которые включают только в качестве примера средства, которые вызывают апоптоз; полинуклеотиды (например, рибозимы); полипептиды (например, ферменты); лекарственные средства; биологические миметики; алкалоиды; алкилирующие средства; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные антитела; моноклональные антитела, конъюгированные с противораковыми лекарственными средствами, токсинами и/или радионуклидами; модификаторы биологического ответа (например, интерфероны и интерлейкины и т.п.); средства для адоптивной иммунотерапии; гематопоэтические факторы роста; средства, которые вызывают дифференциацию опухолевых клеток (например, полностью-транс-ретиноевая кислота и т.п.); реагенты для генной терапии; реагенты для антисмысловой терапии и нуклеотиды; противоопухолевые вакцины; ингибиторы ангиогенеза и т.п. Многочисленные другие средства хорошо известны специалисту в данной области техники. Следует понимать, что для всех замещенных групп, определенных выше, в объем настоящего изобретения не входят полимеры, получающиеся путем определения заместителей, в которые входят собственные заместители (например, замещенный арил, содержащий в качестве заместителя замещенную арильную группу, которая сама замещена замещенной арильной группой и т.п.). В таких случаях максимальное количество таких заместителей равно трем. Это означает, что каждое из приведенных выше определений обладает ограничениями, например замещенные арильные группы ограничены системой-замещенный арил-(замещенный арил)-замещенный арил. Аналогичным образом, следует понимать, что приведенные выше определения не включают неразрешенные схемы замещения (например, метил, замещенный 5 фторидными группами, или гидроксигруппу, находящуюся в -положении по отношению к двойной или тройной связи, или двухвалентную группу, такую как оксогруппа в фенильном кольце). Такие неразрешенные схемы замещения хорошо известны специалисту в данной области техники. Соединения, предлагаемые в настоящем изобретении, могут обладать стереоизомерией вследствие наличия в соединениях одного или большего количества асимметрических или хиральных центров. В объем настоящего изобретения входят все различные стереоизомеры и их смеси. Некоторые из соединений, предлагаемых в настоящем изобретении, содержат асимметрично замещенные атомы углерода. Такие асимметрично замещенные атомы углерода могут привести к соединениям, предлагаемым в настоящем изобретении, включающим смеси стереоизомеров по конкретному асимметрично замещенному атому углерода или к одному стереоизомеру. Поэтому рацемические смеси, смеси диастереоизомеров,отдельные энантиомеры, а также отдельные диастереоизомеры соединений, предлагаемых в настоящем изобретении, входят в объем настоящего изобретения. Термины "S- и R-конфигурация", при использовании в настоящем изобретении являются такими, как определено в публикации IUPAC 1974 "Recommendations for Section E, Fundamental Stereochemistry," Pure Appl. Chem. 45:13-30, 1976. Искомые энантиомеры можно получить хиральным синтезом из имеющихся в продаже хиральных исходных веществ по методикам, хорошо известным в данной области техники, или их можно получить из смеси энантиомеров путем выделения искомого энантиомера по известным методикам. В некоторых вариантах осуществления соединений формулы (II) изображен один изомер по меньшей мере для одного стереоцентра в соединениях; когда изображен один изомер для конкретного стереоцентра, представленная абсолютная относительная стереохимическая конфигурация является предпочтительным вариантом осуществления. Если конкретная стереохимическая конфигурация не указана, то стереоцентр может находиться в R- илиS-конфигурации, или соединение может представлять собой любую смесь соединений в этих двух конфигурациях, включая рацемическую смесь. Соединения, предлагаемые в настоящем изобретении, также могут обладать геометрической изомерией. Геометрические изомеры включают цис- и транс-формы соединений, предлагаемых в настоящем изобретении, содержащих двойные связи, таких как алкенильные, оксимные, иминные или алкениленильные фрагменты. В объем настоящего изобретения входят отдельные геометрические изомеры и стереоизомеры и их смеси. Соединения, предлагаемые в настоящем изобретении, можно получить по методикам, известным в данной области техники и дополнительно описанным в настоящем изобретении. Например, методики получения соединений формулы (II) описаны в опубликованных заявках PCT/US 2005/022062 (WO 06/002236) и соответствующих заявках на патенты США. Примеры дополнительных методик синтеза,применимых для получения соединений формулы (II), приведены в настоящем изобретении. Пример получения некоторых ингибиторов КБВ формулы II приведен ниже на схеме 1. Схема 1 Соединение 1.1 и 1.2 вводили в реакцию с K2CO3 в ацетоне, содержащем KI. Установлено, что использование смеси K2CO3/ацетон предпочтительнее использования смеси Cs2CO3/этанол вследствие меньшей стоимости K2CO3 и по той причине, что соединение 1.3 осаждается из раствора в ацетоне после добавления воды, что устраняет необходимость обработки водой для экстрагирования 1.3. Затем кетоэфир 1.3 кипятили с обратным холодильником с ацетатом аммония (NH4OAc) в толуоле с получением имидазола 1.4. Установлено, что использование толуола приводит к более высоким выходам имидазола по сравнению с кипячением с обратным холодильником в ксилолах с применением ловушки ДинаШтарка, поскольку последняя методика приводит к удалению ацетата аммония из реакционной смеси в ловушку. Реакция 1.4 с бензилбромидом и K2CO3 в диметилформамиде давала 1.5, который можно осадить из раствора реакционной смеси путем добавления воды. Обработка 1.5 метанолом и ацетилхлоридом давала соль 1.6 с HCl, которую затем превращали в свободное основание путем растирания с раствором NaOH/метанол. Установлено, что образование 1.6 и 1.1 и 1.2 протекает с выходом 81% при высокой чистоте (97% по данным ВЭЖХ (высокоэффективная жидкостная хроматография и высокой оптической чистоте (энантиомерный избыток 99%). Соединение 1.6 можно ввести в реакцию с альдегидом HC(O)Rb' при условиях восстановительного аминирования или с Y-Rb, где Y обозначает отщепляющуюся группу, для присоединения алкильной группы к аминнному атому азота и затем ацилировать с получением соединения формулы (II). На схеме 2 проиллюстрировано получение альдегида, который можно использовать на стадии восстановительного аминирования для получения соединений формулы (II) и в особенности соединений формулы IIa или IIb,или IIc. После восстановительного аминирования с целью ацилирования вторичного амина с получением соединений формулы (II) используют известные ацилирующие реагенты и условия. На схеме 3 проиллюстрировано восстановительное аминирование для получения VIIIa. Ацилирование амина с последующим удалением защитной группы фталимида и удалением защитной группы гидроксигруппы дает соединениеIIa. Подходящие защитные группы гидроксигруппы включают, например, простые эфирные группы бензильные, которые можно удалить путем гидролиза, и алкилкарбонатные группы, которые можно селективно удалить с помощью таких реагентов, как триметилсилилйодид. Масса соединения IIa, определенная с помощью масс-спектрометрии высокого разрешения, составляла 503,2609 для иона [М+Н]+, что согласуется с молекулярной формулой C27H33N4O2F3. Схема 3 Это соединение дополнительно охарактеризовано его ИК (инфракрасным) спектром, в котором имеются полосы поглощения в области 3500-2700 (br) и при 1641, 1591, 1508, 1491, 1162, и 1088 см-1. Оно дополнительно охарактеризовано следующими данными ЯМР: Мультиплетность: АВ (квадруплет АВ), b (широкий), d (дублет), dd (дублет дублетов),m (мультиплет), s (синглет), t (триплет). Сдвиг средней точки мультиплета присоединенного 19F. Отметим, что абсолютные стереохимические конфигурации хиральных центров этой молекулы установлены на основании хиральности известных исходных веществ или промежуточных продуктов. Данные ВЭЖХ и ЯМР свидетельствуют в пользу вывода о том, что указанный выше способ приводит к образованию соединения в виде одного изомера. По таким же методикам соединение IIc получали путем использования хирального -гидроксиацилирующего реагента. Он обладает масс-спектром, ожидающимся для указанной структуры, включая молекулярный ион М+Н со значением m/z = 517,3 и значением Rt = 3,70 мин, полученным с помощью аналитической ВЭЖХ (с обращенной фазой). Данные ЖХ/ИЭР-МС (жидкостная хроматография/ионизация электрораспылением-масс-спектроскопия) получали с помощью масс-спектрометра Waters LCT Premier с двойным источником с ионизацией электрораспылением и жидкостного хроматографаAgilent 1100. Разрешение системы МС составляло примерно 12000 (по определению FWHM). Разделение с помощью ВЭЖХ проводили при скорости потока, равной 1,0 мл/мин, в градиентном режиме от 10 до 95% за 2,5 мин. В качестве модифицирующей добавки для водной фазы использовали 10 мМ формиат аммония. В качестве стандарта использовали сульфадиметоксин (Sigma; протонированная молекула, m/z 311,0814) и его вводили через канал LockSpray при каждом третьем сканировании. Точность определения масс в системе найдена равной 5 ч./млн. Ацилирующие реагенты и кислоты, подходящие для стадии ацилирования, включают ацилгалогениды, ангидриды и кислоты, содержащие подходящую группу Rc (см. формулу I). Реагенты, подходящие для сочетания амидов, включают множество реагентов для сочетания амидов, приводящих к образованию амидной связи, такие как карбодиимиды: N-N'-дициклогексилкарбодиимид (DCC), N-N'диизопропилкарбодиимид (DIPCDI), и 1-этил-3-(3'-диметиламинопропил)карбодиимид (EDCI). Карбодиимиды можно использовать вместе с добавками, такими как диметиламинопиридин (ДМАП) или бензотриазолы, такие как 7-аза-1-гидроксибензотриазол (HOAt), 1-гидроксибензотриазол (HOBt) и 6-хлор-1 гидроксибензотриазол (Cl-HOBt); условия такого формирования амидной связи хорошо известны в данной области техники. Дополнительные реагенты для сочетания амидов также включают реагенты на основе урония и фосфония. Соли урония включают N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-Nметилуронийгексафторфосфат-N-оксид (HATU), N-[(1 Н-бензотриазол-1-ил)(диметиламино)метилен]-Nметилуронийгексафторфосфат-N-оксид (HBTU), N-[(1 Н-6-хлорбензотриазол-1-ил)(диметиламино)метилен]-N-метилуронийгексафторфосфат-N-оксид (HCTU), N-[(1 Н-бензотриазол-1-ил)(диметиламино)метилен]-N-метилуронийтетрафторборат-N-оксид (TBTU) и N-[(1H-6-хлорбензотриазол-1-ил)(диметил-9 018014 амино)метилен]-N-метилуронийтетрафторборат-N-оксид (TCTU). Соли фосфония включают бензотриазол-1-илокси-трис-(диметиламино)фосфонийгексафторфосфат (ВОР), 7-азабензотриазол-1-ил-N-окситрис(пирролидино)фосфонийгексафторфосфат (РуАОР) и бензотриазол-1-ил-N-окси-трис(пирролидино) фосфонийгексафторфосфат (РуВОР). Стадию образования амида можно провести в полярном растворителе, таком как диметилформамид(ДМФ), и в ней также можно использовать органическое основание, такое как диизопропилэтиламин(ДИЭА) или диметиламинопиридин (ДМАП). Методики выбора, введения и удаления подходящих защитных групп для гидроксигруппы при получении соединения формулы II хорошо известны в данной области техники. На основе приведенной выше схемы реакций специалист с общей подготовкой в данной области техники, который знает, как выбрать исходные вещества, подходящие для получения искомых продуктов, может легко получить соединения формулы II."Ингибитор КБВ" представляет собой соединение, которое способно ингибировать кинезин - белок веретена (КБВ) при любой его измеримой активности. Предпочтительно, если ингибитор КБВ характеризуется значением IC50, равным менее 100 мкМ, более предпочтительно менее 10 мкМ и часто менее 1 мкМ."Пролиферативное заболевание" включает любое заболевание или патологическое состояние,влияющее на позвоночное, которое характеризуется чрезмерной или нежелательной пролиферацией клеток. "Способ лечения пролиферативного заболевания" в контексте настоящего изобретения включает способ лечения (подавления) аномального роста клеток, включая трансформированные клетки, у пациента, нуждающегося в таком лечении (например, у млекопитающего, такого как человек), путем одновременного или последовательного введения ингибитора КБВ в эффективном количестве по отдельности или в комбинации с химиотерапевтическим реагентом в эфективном количестве и/или лучевой терапией. Аномальный рост клеток означает рост клеток, не зависящий от нормальных механизмов регуляции (например, прекращение контактного торможения роста), включая аномальный рост опухолевых клеток или доброкачественных и злокачественных клеток при других пролиферативных заболеваниях. Термины "рак" и "злокачественное" означает или описывает физиологическое патологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток."Опухоль" при использовании в настоящем изобретении означает все растущие и пролиферирующие опухолевые клетки, доброкачественные или злокачественные, и все предраковые и раковые клетки и ткани. Термин "солидная опухоль" означает рак или карциному тканей организма, которые не являются кровью, костным мозгом и лимфоидной системой. Примеры солидных опухолей могут включать, но не ограничиваются только ими, карциному легких, карциному молочной железы, карциному яичника, карциному кожи, карциному толстой кишки, карциному мочевого пузыря, карциному печени, карциному желудка, рак предстательной железы, рак поджелудочной железы, почечно-клеточную карциному, носоглоточную карциному, плоскоклеточную карциному, папиллярную карциному щитовидной железы, карциному шейки матки, мелкоклеточную карциному легких, немелкоклеточную карциному легких, плоскоклеточный рак головы и шеи и саркомы. При использовании в настоящем изобретении термин "рак крови" означает раковое заболевание крови и включает, в частности, лейкоз и злокачественные гиперпролиферативные нарушения. "Лейкоз" означает рак крови, при котором образуется слишком много лейкоцитов или эритроцитов, которыми вытесняются другие компоненты крови, такие как тромбоциты и нормальные эритроциты. Следует понимать, что случаи лейкоза разделяются на острые и хронические. При острых лейкозах раковые клетки блокируются на стадии созревания, хотя они продолжают размножаться. Вследствие этого происходит накопление большого количества нефункциональных зрелых клеток и одновременное уменьшение количества функциональных клеток. Хронические лейкозы прогрессируют медленнее и при этом раковые клетки полностью созревают. Кроме того, лейкоциты могут быть миелогенными или лимфоидными. Поэтому некоторые формы лейкоза могут представлять собой острый лимфоцитарный (или лимфобрастный) лейкоз (ОЛЛ), острый миелогенный лейкоз (ОМЛ), хронический лимфолейкоз (ХЛЛ) или хронический миелогенный лейкоз (ХМЛ) и миелодиспластический синдром. "Злокачественные гиперпролиферативные нарушения" могут означать лимфому, в частности, такую как ходжкинскую лимфому и неходжкинскую лимфому или множественную миелому. Некоторые опухоли, описанные в настоящем изобретении, могут быть резистентными по отношению к различным терапевтическим средствам. "Резистентный" означает, что терапевтическое средство,вводимое в обычных дозах или в дозах, которые переносятся пациентом, не оказывает значительное воздействие на рак. Основная форма резистентности по отношению к множеству противоопухолевых средств включает действие группы мембранных белковых насосов, которыми выводятся эти цитотоксичные молекулы. "Насосы множественной лекарственной резистентности могут означать суперсемейство белков ATP Binding Cassette (ABC), содержащихся в организмах в диапазоне от бактерий до людей.ABC переносящие насосы расположены в плазматической мембране клеток или в мембране различных клеточных органелл и они опосредуют перенос различных молекул через эти барьеры. В большинстве насосов ABC для осуществления такого переноса используется энергия гидролиза АТФ (активные пере- 10018014 носчики), но с помощью некоторых насосов ABC образуются специфические мембранные каналы. Многочисленные клинические исследования показали, что фенотип множественной лекарственной резистентности в опухолях связан со сверхэкспрессированием некоторых насосов ABC, называющихся белками множественной лекарственной резистентности (MDR). Первым был открыт Р-гликопротеин (называющийся P-gp, MDR1 или АВСВ 1), опосредующий множественную лекарственную резистентность(1986); Ueda, K. et al., Proc. Natl. Acad. Sci., 84, 3004-3008 (1987 и, вероятно, он участвует в механизме множественной лекарственной резистентности, чаще всего наблюдающейся в клинических условияхal., Nat. Rev. Cancer; 2, 48-58 (2002. Имеются два других насоса ABC, для которых показано, что они участвуют во множественной лекарственной резистентности опухолей: белок 1 множественной лекарственной резистентности (MRP1, ABCC1) и белок резистентности по отношению к митоксантрону(1997); Litman, L. et al., Cell. Mol. Life Sci., 58, 931-959 (2001. Кроме того, в некоторых случаях множественной лекарственной резистентности также могут участвовать другие насосы ABC человека, способные активно переносить различные соединения. К ним относятся АВСВ 4 (MDR3) и ABCB11 (сестринский P-gp или BSEP), два насоса, расположенные преимущественно в печени, участвующие в секреции фосфатидилхолина и желчных кислот соответственно (Lecureur, V. et al., Toxicol., 152, 203-219 (2000);(1997. Ранее показано, что MDR3 переносит и некоторые лекарственные средства (Smith, A.J. et al., J.Bioi. Chem., 275, 23530-23539 (2000. В дополнение к MRP1 были клонированы 5 гомологов (MRP2MRP6). С определенностью показано, что сверхэкспрессирование MRP2 (переносчик органических анионов, который также может выводить гидрофобные соединения) приводит к MDR9 рака (Kool, M. etal., Cancer Res., 57, 3537-3547 (1997. MRP3, органический конъюгат переносящего насоса, и MRP5, насос, переносящий нуклеозид, также предположительно являются белками, приводящими к некоторым формам множественной лекарственной резистентности (Borst, P. et al. ibid)."Антитела" и "иммуноглобулины" (Igs) являются гликопротеинами, обладающими одинаковыми структурными характеристиками. В то время как антитела связываются с антигеном специфически, иммуноглобулины включают и антитела, и другие молекулы типа антител, которые не обладают специфичностью по отношению к антигенам. Полипептиды последнего типа, например, продуцируются в небольших количествах лимфатической системой и в повышенных количествах миеломами. Термин "метка" при использовании в настоящем изобретении означает обнаруживаемое соединение или композицию, которая непосредственно или косвенно конъюгируется с антителом с образованием так называемого "меченого" антитела. Метка может быть обнаруживаемой самой по себе (например, радиоактивные метки или флуоресцентные метки) или в случае ферментной метки может катализировать химическое изменение соединения-субстрата или композиции, которые становятся обнаруживаемыми. Радионуклиды, которые могут выступать в качестве обнаруживаемых меток, включают, например, 1-131, 1123, 1-125, Y-90, Re-188, Re-186, At-211, Cu-67, Bi-212 и Pd-109. Метка также может быть нерадиоактивным объектом, таким как токсин, который обнаруживается по своей биологической или биохимической активности. Термин "антагонист" используется в самом широком смысле и включает любые молекулы, которые частично или полностью блокируют, ингибируют или нейтрализуют биологическую активность нативной мишени, раскрытой в настоящем изобретении, или ее транскрипцию или трансляцию."Носители" при использовании в настоящем изобретении включают фармацевтически приемлемые носители, инертные наполнители и стабилизаторы, которые при использующихся дозах и концентрациях нетоксичны по отношению к клеткам или млекопитающему, подвергающимся их воздействию. Часто физиологически приемлемым носителем является забуференный водный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный, сукцинатный и основанные на других органических кислотах; антиоксиданты, включая аскорбиновую кислоту; обладающие небольшой молекулярной массой (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или декстрины; хелатные реагенты, такие как этилендиаминтетрауксусная кислота; гидроксисахара, такие как маннит или сорбит; солеобразующие противоионы, такие как ион натрия; и/или неионогенные поверхностно-активные вещества, такие какTWEEN, полиэтиленгликоль (ПЭГ) и Pluronics. Введение "в комбинации с" одним или большим количеством других терапевтических средств включает одновременное (совместное) и последовательное введение в любом порядке. Предпочтительно, если терапевтические средства, объединенные в таких режимах,одновременно содержатся в организме подвергающегося лечению субъекта в терапевтически необходимых количествах."Клетка-хозяин" при использовании в настоящем изобретении означает микроорганизм, или эукариотную клетку, или линию клеток, выращенную в виде моноклеточного объекта, которая может использоваться или была использована в качестве реципиента для рекомбинантного вектора или других переносящих полинуклеотидов, и включает потомство исходной клетки, которая была трансфицирована. Следует понимать, что потомство одной клетки по морфологии или геномному или полному ДНК комплименту не обязательно может быть полностью таким же, как исходная родительская клетка, что обусловлено естественной, случайной или искусственной мутацией."Лечение" в настоящем изобретении определяется, как нанесение ингибитора КБВ на субъект или его введение или нанесение ингибитора КБВ на изолированную ткань или линию клеток субъекта или его введение, когда у субъекта наблюдается солидная опухоль или рак крови, симптом, связанный с солидной опухолью или раком крови, или предрасположение к развитию солидной опухоли или рака крови, при котором задачей является лечение, излечивание, облегчение протекания, уменьшение, изменение,смягчение, улучшение состояния, улучшение показателей или воздействие на солидную опухоль или рак крови, любые сопутствующие симптомы солидной опухоли или рака крови, или предрасположение к развитию солидной опухоли или рака крови. Субъектом может быть млекопитающее, и в некоторых вариантах осуществления субъектом является человек. Часто субъектом является человек, у которого диагностировано по меньшей мере одно из патологических состояний, описанных в настоящем изобретении, как пригодное для лечения соединениями и способами, предлагаемыми в настоящем изобретении. В предпочтительных вариантах осуществления у субъекта может наблюдаться рак, при котором экспрессируется выкачивающий насос, который способствует резистентности по отношению к лекарственному средству, такой как P-gp, или у субъекта может наблюдаться опухоль, которая проявляет резистентность по отношению к лекарственным средствам, таким как паклитаксел или SB-715992."Лечение" также означает нанесение фармацевтической композиции, содержащей ингибитор КБВ,на субъекта или ее введение или нанесение фармацевтической композиции, содержащей ингибитор КБВ,на изолированную ткань или линию клеток субъекта или ее введение, когда у него наблюдается солидная опухоль или рак крови, симптом, связанный с солидной опухолью или раком крови, или предрасположение к развитию солидной опухоли или рака крови, при котором задачей является лечение, излечивание,облегчение протекания, уменьшение, изменение, смягчение, улучшение состояния, улучшение показателей или воздействие на солидную опухоль или рак крови, любые сопутствующие симптомы солидной опухоли или рака крови или предрасположение к развитию солидной опухоли или рака крови."Противоопухолевая активность" означает уменьшение скорости пролиферации или накопления злокачественных клеток и тем самым уменьшение скорости роста имеющейся опухоли или опухоли, которая образуется во время лечения, и/или разрушение имеющихся неопластических (опухолевых) клеток или вновь образовавшихся опухолевых клеток и, следовательно, уменьшение полного размера опухоли при лечении. Лечение по меньшей мере одним ингибитором КБВ приводит к физиологическому ответу,который благоприятен для борьбы с солидными опухолями у людей. Лечение по меньшей мере одним ингибитором КБВ приводит к физиологическому ответу, который благоприятен для лечения опухолевых заболеваний крови у человека. Следует понимать, что способы, предлагаемые в настоящем изобретении,могут быть применимы для предупреждения дальнейшего разрастания опухоли, проявляющегося во время лечения. В соответствии со способами, предлагаемыми в настоящем изобретении, по меньшей мере один ингибитор КБВ, определенный в настоящем изобретении, применяют для стимулирования положительного терапевтического ответа в случае солидной опухоли или рака крови. "Положительный терапевтический ответ" при лечении рака означает улучшение протекания заболевания в связи с противораковой активностью этих антител или их фрагментов и/или ослабление симптомов, связанных с заболеванием. Это означает, что можно наблюдать антипролиферативный эффект, предупреждение дальнейшего разрастания опухоли, уменьшение размера опухоли, уменьшение количества раковых клеток и/или ослабление одного или большего количества симптомов, опосредуемых стимулированием раковых клеток. Так, например, улучшение протекания заболевания можно охарактеризовать, как полный ответ. "Полный ответ" означает отсутствие клинически обнаруживаемого заболевания с нормализацией любых наблюдавшихся ранее аномальных данных радиографического обследования, костного мозга и спинномозговой жидкости(CSF). Такой ответ должен сохраняться в течение не менее одного месяца после лечения способами,предлагаемыми в настоящем изобретении. Альтернативно, улучшение протекания заболевания можно охарактеризовать, как частичный ответ. "Частичный ответ" означает составляющее по меньшей мере 50% уменьшение всей измеримой массы опухоли (т.е. количества опухолевых клеток, находящихся в субъекте) при отсутствии новых поражений и сохраняющееся в течение не менее одного месяца. Такое определение ответа применимо только к измеримым опухолям. Ответ опухоли можно оценить по изменениям морфологии опухоли (т.е. полной массы опухоли,размера опухоли и т.п.) по данным просвечивающих методик, таких как магнитно-резонансная сканирующая визуализация (MRI), рентгенографическая визуализация, сканирующая компьютерная томография (СТ), биолюминесцентная визуализация, например визуализация с помощью люциферазы, сканирующая визуализация костей и отбор проб для биопсии опухоли, включая аспирацию костного мозга(АКМ). В дополнение к этим положительным терапевтическим ответам у субъекта, подвергающегося лечению ингибитором КБВ, может проявляться такой благоприятный эффект, как ослабление симптомов, связанных с заболеванием."Терапевтически эффективная доза или количество" или "эффективное количество" означает количество ингибитора КБВ, которое при введении приводит к положительному терапевтическому ответу при лечении пациента, у которого наблюдается солидная опухоль или рак крови. Следует понимать, что способ лечения может включать однократное введение терапевтически эффективной дозы или многократное введение терапевтически эффективной дозы ингибитора. Ген тирозинкиназы Bcr-Abl кодирует белок слияния и образуется путем аномального соединения генов BCR и ABL. Это слияние обнаруживается в так называемой филадельфийской хромосоме и вызвано обратной транслокацией t(9:22), которое приводит к образованию гена слияния Bcr-Abl, который вызывает нерегулируемую экспрессию тирозинкиназы ABL. Наличие филадельфийской хромосомы считают одним из факторов, вызывающих и ХМЛ, и ОЛЛ (Abraham, (2007) Community Oncology 4 (1) p. 1114). В настоящее время тирозинкиназа Bcr-Abl является мишенью для нового класса ингибирующих BcrAbl терапевтических соединений, таких как иматиниб (глеевек, Novartis), дасатиниб (сприцел, BristolMyers Squibb) и нилотиниб (AML107, Novartis). Тирозинкиназа Bcr-Abl действует в обратном направлении от белка КБВ. В некоторых предпочтительных вариантах осуществления ингибитор КБВ применяют в комбинации по меньшей мере с одним другим "активным средством", которым может быть противораковое средство, включая, но не ограничиваясь только ими, оперативное вмешательство, лучевую терапию, химиотерапию, лечение цитокином или другими моноклональными антителами, предназначенными для борьбы с рассматриваемой солидной опухолью, и дополнительное противораковое средство применяют до,во время или после лечения ингибитором КБВ, и оба терапевтических средства одновременно содержатся в субъекте в терапевтических концентрациях. Таким образом, когда объединенные методики лечения включают введение ингибитора КБВ в комбинации с введением другого терапевтического средства, такого как химиотерапевтическое средство, цитокин или другие моноклональные антитела, способы, предлагаемые в настоящем изобретении, включают совместное введение с использованием отдельных препаратов или одного фармацевтического препарата и последовательное введение, проводимое в любом порядке, и при этом предпочтительно существует период времени, за который оба (или все) активные средства одновременно проявляют свою терапевтическую активность. Когда способы, предлагаемые в настоящем изобретении, включают объединенные терапевтические режимы, эти средства можно вводить одновременно, т.е. ингибитор КБВ вводят совместно или в тот же период времени, что и другое противораковое средство (т.е. средства применяют совместно, но ингибитор КБВ вводят не точно в то же время, как другое противораковое средство). Альтернативно, ингибитор КБВ, предлагаемый в настоящем изобретении, также можно вводить до или после другого противоракового средства. Для уменьшения вероятности ремиссии или рецидива последовательное введение разных противораковых средств можно проводить независимо от реакции подвергающегося лечению субъекта на первый курс лечения. В некоторых вариантах осуществления настоящего изобретения ингибиторы КБВ, предлагаемые в настоящем изобретении, вводят в комбинации с химиотерапевтическим средством или цитокином, причем ингибитор КБВ и химиотерапевтическое средство (средства) или цитокин(ы) можно вводить последовательно в любом порядке или одновременно (т.е. совместно или в один и тот же период времени). Примеры подходящих химиотерапевтических средств включают, но не ограничиваются только ими,СРТ-11 (иринотекан), который можно применять, например, для лечения колоректального рака и немелкоклеточной карциномы легкого; гемцитабин, который можно применять, например, для лечения рака легкого, рака молочной железы и эпителиального рака яичников; и другие химиотерапевтические средства, применимые для борьбы с солидными опухолями. Рассматриваемые цитокины включают, но не ограничиваются только ими, -интерферон, -интерферон, интерлейкин-2 (IL-2), IL-12, IL-15, и IL-21,гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF) или биологически активные варианты этих цитокинов. В других вариантах осуществления настоящего изобретения ингибиторы КБВ, описанные в настоящем изобретении, вводят в комбинации с моноклональными антителами, предназначенными для борьбы с солидной опухолью. Так, например, когда у субъекта лечат рак желудка или толстой кишки,лечение может включать введение эффективных количеств ингибитора КБВ, описанного в настоящем изобретении, в комбинации с введением эффективных количеств моноклональных антител, таких как эрбутукс (также известный под названием цетуксимаб; ImClone Systems Incorporated, New York, NewYork и Bristol Meyers Squibb, Princeton, New Jersey). Аналогичным образом, когда у субъекта лечат колоректальный рак, лечение может включать введение эффективных количеств ингибитора КБВ, описанного в настоящем изобретении, в комбинации с введением эффективных количеств гуманизированных моноклональных антител авастин (также известных под названием бевацизумаб; Genentech, Inc., SanFrancisco, California), который связывается с сосудистым эндотелиальным фактором роста (VEGF), белком, который играет критически важную роль в ангиогенезе опухоли, или ингибирует его. Альтернатив- 13018014 но, когда у субъекта лечат рак молочной железы, лечение может включать введение эффективных количеств ингибитора КБВ, описанного в настоящем изобретении, в комбинации с эффективным количеством гуманизированных моноклональных антител герцептин (также известных под названием трастузумаб; Genentech In, San Francisco, California). Другие примеры моноклональных антител, предназначенных для борьбы с солидными опухолями, которые можно применять в комбинации с ингибиторами КБВ,предлагаемыми в настоящем изобретении, включают, но не ограничиваются только ими, антитела против EGFR, воздействующие на рецептор эпидермального фактора роста (например, IMC-C225 (ImCloneSolbach et al. (2002) Int. J. Cancer 101:390-394); антитела против рецептора IGF-1, воздействующие на рецепторный белок IGF-1 (см., например, Maloney et al. (2003) Cancer Res. 63:5073-5083 и Hailey et al.(2002) Mol. Cancer. Ther. 1:1349-1353; антитела против MUC1, воздействующие на связанный с опухолью антиген MUC1; против 51, против v5 и против v3, воздействующие на эти соответствующие интегрины, которые регулируют адгезию клеток и передачу сигналов, способствующую пролиферации и выживанию клеток (см., например, Laidler et al. (2000) Ada Biochimica Polonica 47(4):1159-1170 и CruetHennequart et al. (2003) Oncogene 22(11):1688-1702); антитела против Р-кадгерина, воздействующие на представителя семейства кадгеринов (см., например, одновременно находящуюся на рассмотрении заявку на патент US 20030194406); и антитела против VE-кадгерина, влияющие на связанную с ангиогенезом активность этой специфической по отношению к эндотелиальным клеткам адгезивной молекулы (см.,например, Liao et al. (2002) Cancer Res. 62:2567-2575). В предпочтительных вариантах осуществления этих комбинаций ингибитор КБВ представляет собой соединение формулы (II) и может представлять собой соединение формулы IIa, IIb или IIc. Ингибиторы КБВ, предлагаемые в настоящем изобретении, и моноклональные антитела можно вводить последовательно в любом порядке или одновременно (т.е. совместно или в один и тот же период времени). Если вводят моноклональные антитела более одного типа, то способы, предлагаемые в настоящем изобретении, могут дополнительно включать лучевую терапию и/или химиотерапию, если это оправдано для подвергающегося лечению рака и если это рекомендует лечащий врач. Примеры Пример 1. Исследование по определению активности КБВ. Очищенные микротрубочки, полученные из головного мозга крупного рогатого скота, приобретали у фирмы Cytoskeleton Inc. (Denver, Colorado, USA). Моторный домен КБВ человека (Eg 5, KNSL1) клонировали, экспрессировали и очищали до однородности, составляющей более 95%. Biomol Green приобретали у фирмы Affinity Research Products Ltd. (Matford Court, Exeter, Devon, United Kingdom). Микротрубочки и моторный белок КБВ (т.е. моторный домен КБВ) разводили в буфере для анализа (20 мМTris-HCl [Tris = трис(гидроксиметиламинометан)] (рН 7,5), 1 мМ MgCl2, 10 мМ ДТТ (дитиотреитол) и 0,25 мг/мл БСА (бычий сывороточный альбумин) до конечной концентрации, равной 35 мкг/мл микротрубочек и 45 нМ КБВ. Затем смесь микротрубочки/КБВ предварительно инкубировали при 37 С в течение 10 мин для стимулирования связывания КБВ с микротрубочками. В каждую лунку исследовательского планшета (384-луночный планшет), содержащую 1,25 мкл ингибитора или исследуемого соединения в ДМСО (диметилсульфоксид) (или только ДМСО в случае контролей), добавляли 25 мкл раствора АТФ (аденозинтрифосфат) (АТФ, разведенный в буфере для анализа до концентрации, равной 300 мкМ) и 25 мкл описанного выше раствора микротрубочки/КБВ. Планшеты инкубировали при КТ (комнатная температура) в течение 1 ч. После инкубации в каждую лунку добавляли 65 мкл Biomol Green (краситель на основе малахитового зеленого, с помощью которого можно обнаружить выделение неорганического фосфата). Планшеты инкубировали в течение еще 5-10 мин,затем с помощью устройства Victor II для считывания планшетов измеряли поглощение при 630 нм. Степень поглощения при 630 нм соответствует степени активности КБВ в образцах. Затем значения IC50 для каждого ингибитора или исследуемого соединения определяли по уменьшению поглощения при 630 нм при каждой концентрации с помощью нелинейного регрессионного анализа с использованием программного обеспечения для обработки данных XLFit для Excel или Prism, выпускающегося фирмойGraphPad Software Inc. Предпочтительные соединения, предлагаемые в настоящем изобретении, обладают биологической активностью, характеризующейся значениями IC50, равными менее примерно 1 мМ, а предпочтительные варианты осуществления соединений обладают биологической активностью, характеризующейся значениями, равными менее примерно 25 мкМ, особенно предпочтительные варианты осуществления соединений обладают биологической активностью, характеризующейся значениями, равными менее примерно 1000 нМ, и наиболее предпочтительные варианты осуществления соединений обладают биологической активностью, характеризующейся значениями, равными менее примерно 100 нМ. Соединения формулыII исследовали по этой методике и установлено, что они характеризуются значениями IC50, меньшими,чем предел обнаружения для этой методики (по оценке они равны 2-4 нМ). Пример 2. Подавление пролиферации линий опухолевых клеток, обработанных соединением IIa. Использовали следующие линии клеток: НСТ-116 (National Cancer Institute's DCTF Tumor Reposi- 14018014tory, catalog NCI 502568, Rockville, MD), HCT-15 (National Cancer Institute's DCTF Tumor Repository,catalog NCI 502711, Rockville, MD, которые можно получить из American Type Tissue Collection, catalogХЛЛ-225), KB-3-1 (которые можно получить из DSMZ, Deutsche Sammlung von Mikroorganismen undZellkulturen GmbH (German Collection of Microorganisms and Cell Cultures-catalog number ACC 158), KBV1 (которые можно получить из DSMZ-catalog number ACC 149), AGS (которые можно получить изAmerican Type Culture Collection, Manassas VA, catalog number CRL-1739), N87 (которые можно получить из American Type Culture Collection, Manassas VA, catalog number CRL-5822), Hel92.1.7 (которые можно получить из American Type Culture Collection, Manassas VA, catalog number TIB 180), K562 (которые можно получить из American Type Culture Collection, Manassas VA, catalog number CRL-243),MV4;11 (American Tissue Culture Collection, Manassas VA, catalog number CRL-9591) и U937 (которые можно получить из American Type Culture Collection, Manassas VA, catalog number CRL-1593.2). Клетки помещали в 96-луночные планшеты при плотностях, равных примерно 500 клеток/лунка 96 луночного планшета, и им давали расти в течение 24 ч. Затем клетки в течение 72 ч обрабатывали соединениями в разных концентрациях. Затем добавляли 100 мкл реагента CellTiter-Glo (Promega Corporation). CellTiter-Glo используют в однородной методике определения количества жизнеспособных клеток с использованием только реагента CellTiter-Glo для обнаружения АТФ (патенты US6602677 и 7241584) (см. Promega product catalog G7570). После добавления реагента CellTiter-Glo клетки инкубировали в темноте в течение 30 мин. Интенсивность люминесценции определяли для каждой лунки с помощью устройства Wallac Trilux для считывания планшетов, и она коррелирует с количеством клеток в лунке. Количество жизнеспособных клеток в лунках, в которых содержался только ДМСО (0,5%), считали результатом отсутствия подавления, тогда как содержимое лунок, не содержащих клеток, считали результатом 100% подавления роста клеток. Концентрацию соединения, которая приводила к равному 50% подавлению роста (GI50), определяли графически по сигмовидным зависимостям доза-ответ, построенным в координатах логарифмически преобразованная доза - количество клеток (в процентах от контроля), полученных за 72 ч непрерывного воздействия соединения. Данные приведены ниже в табл. 1. Для всех исследованных линий клеток обнаружено, что антипролиферативные воздействия находятся в широком диапазоне (значения GI50 равны 0,1-6,5 нМ). Этот широкий диапазон активности согласуется с соединением, которое является ингибитором митоза. Таблица 1 Исследование in vitro антипролиферативной активности (значения GI50 в нМ) соединения IIa Р-Гликопротеин (P-gp, также известный под названием MDR1) является выкачивающим насосом,представляющим собой переносчик ABC, который опосредует множественную лекарственную резистентность по отношению к некоторым цитотоксичным лекарственным средствам в экспрессирующих его клетках. Некоторые линии клеток, использующиеся в настоящем исследовании (НСТ-15, KBV1, и КВ 8.5), экспрессируют P-gp и, как можно видеть из табл. 1, эти линии клеток чувствительны к ингибиторам КБВ формулы II. В приведенном ниже примере 12 показано, что аналогичные соединения формулыI, в которых нет гидроксигруппы в ацильном фрагменте, неактивны in vivo по отношению к таким опухолям. Пример 3. Исследование in vitro влияния ингибиторов КБВ на характеристики клеточного цикла линий раковых клеток. Линии клеток лимфомы обрабатывали ингибиторами КБВ, предлагаемыми в настоящем изобретении, и исследовали с помощью FACS (исследование с помощью возбужденной флуоресценции). Собирали примерно 2105 клеток, таблетки клеток дважды промывали холодным ЗФФ (забуференный фосфатом физиологический раствор) и повторно суспендировали в 500 мкл холодного ЗФФ. Клетки фиксировали путем добавления 8 мл холодного 80% этанола при медленном взбалтывании. После инкубации в течение 15 мин фиксированные клетки дважды промывали с помощью ЗФФ и таблетки клеток повторно суспендировали в 1 мл окрашивающего буфера PI/RNASE (BD Pharmingen catalog 550825) и инкубирова- 15018014 ли в течение 15 мин при 37 С с защитой от воздействия света. Пропидиййодид (PI) является флуоресцентным красителем, который окрашивает и ДНК, и РНК. Поэтому РНК необходимо удалить путем разложения с помощью рибонуклеазы (РНКазы). Перед проведением анализа с помощью FACS окрашенные клетки пропускали через устройство для окрашивания клеток в пробирку для FACS с целью уменьшения количества агрегатов клеток (BD Falcon352235). Содержание ДНК в фиксированных и окрашенных клетках определяли с помощью проточного устройства для подсчета клеток BD FACSCalibur с использованием программного обеспечения CellQuest. Обработка раковых клеток ингибиторам КБВ приводила к задержке митоза, но степень задержки, ее длительность и последствия после задержки для разных линий клеток могут быть разными. После задержки митоза возможны различные варианты поведения клеток, включая прекращение задержки и нормальное деление, непосредственное протекание апоптоза или прекращение митоза без протекания цитокинеза (явление, называющееся митотическим скольжением). Если клетки испытывают митотическое скольжение, то они могут перейти на псевдостадию G1 и затем продолжается клеточный цикл, они стареют или подвергаются апоптозу. Некоторые из этих различий проявляются при обработке линий клеток лимфомы SUDHL-4 (линия клеток В-клеточной лимфомы, полученная у фирмы DSMZ, DeutscheSammlung von Mikroorganismen und Zellkulturen GmbH (German Collection of Microorganisms and Cell Cultures, catalog number ACC 495) и RL (линия клеток неходжкинской лимфомы человека, American TypeCulture Collection, Manassas VA, catalog number CRL-2261) ингибиторами КБВ. При воздействии соединения IIa у обеих линий клеток происходила задержка митоза, однако после обработки в течение 48 ч клетки SUDHL-4 подвергались апоптозу, о чем свидетельствовало увеличение количества клеток при содержании ДНК 2N, тогда как для клеток лимфомы RL происходила задержка митоза и не происходило ни индуцирования апоптоза, ни митотического скольжения. См. фиг. 2. Пример 4. Скрининговые исследования ингибитора КБВ. Выявление типов опухолей, которые наиболее чувствительны по отношению к ингибиторам КБВ,предлагаемым в настоящем изобретении, можно провести с применением несмещенной методики, в которой проводятся различные исследования с использованием клеток. Выбраны следующие методики.CellTiter-Glo. Это исследование предназначено для определения концентрации АТФ в культуре клеток и результат можно скоррелировать с количеством клеток. При кратком описании CellTiter-Glo(Promega Corporation) представляет собой однородную методику, в которой для обнаружения АТФ используют один реагент CellTiter-Glo, и в исследовании АТФ инициирует активность термически стабильной люциферазы, в результате чего вырабатывается люминесцентный сигнал, интенсивность которого можно измерить и скоррелировать с количеством жизнеспособных клеток. Вкратце, методика заключается в следующем: в случае прилипающих клеток от 1000 до 5000 клеток/лунка помещали в 96 луночные планшеты (100 мкл/лунка) и им давали прилипать в течение 24 ч и затем обрабатывали лекарственным средством. В случае неприлипающих клеток от 1000 до 10000 клеток/лунка помещали в 96 луночные планшеты (100 мкл/лунка) и сразу обрабатывали лекарственным средством. Разведения лекарственного средства готовили в ДМСО при концентрации, в 1000 раз превышающей конечную концентрацию. Затем эти разведения разводили в соотношении 1/100 в среде для выращивания и после этого добавляли к клеткам (11 мкл/лунка) для обеспечения необходимой конечной концентрации. После обработки в течение 48 ч при 37 С в инкубаторе для культур клеток планшеты обрабатывали для проведения исследования CellTiter-Glo в соответствии с инструкциями изготовителя. Методика исследования пролиферации клеток в течение 72 ч: исследование, проводимое в течение 72 ч, выполняли таким же образом, как исследование, проводимое в течение 48 ч, но со следующими изменениями. В случае прилипающих клеток от 500 до 5000 клеток/лунка помещали в 96-луночные планшеты (90 мкл/лунка среды для выращивания клеток) и им давали прилипать в течение 24 ч и затем обрабатывали лекарственным средством. В случае неприлипающих клеток от 1000 до 10000 клеток/лунка помещали в 96-луночные планшеты (90 мкл/лунка среды для выращивания клеток) и сразу обрабатывали лекарственным средством. Приводимые значения представляют собой концентрацию исследуемого соединения, необходимую для снижения роста на 50%. Высвобождение ЛДГ (лактатдегидрогеназа). В исследовании по обнаружению цитотоксичностиKitPLUS (ЛДГ) (Roche Diagnostics, Manheim, Germany) определяют количество ЛДГ, выделенного в среды гибнущими клетками; ЛДГ катализирует превращение лактата в пируват. Ферментная реакция сочетается с химической реакцией, в которой соль тетразолия используется для образования формазана, который обладает красным цветом, и его можно зарегистрировать по поглощению при 490 нм. В этом исследовании определяют количество клеток, погибших после обработки лекарственным средством. Клетки по 10000 клеток/лунка помещали в 96-луночные планшеты (100 мкл/лунка). Прилипающим клеткам давали прилипать в течение 24 ч и затем обрабатывали лекарственным средством, а неприлипающие клетки сразу обрабатывали лекарственным средством. Разведения лекарственного средства готовили в ДМСО при концентрации, в 1000 раз превышающей конечную концентрацию. Затем эти разведения разводили в соотношении 1/100 в среде для выращивания и затем добавляли к клеткам (11 мкл/лунка) для обеспечения необходимой конечной концентрации. После обработки в течение 48 ч при 37 С в инкуба- 16018014 торе для культур клеток планшеты обрабатывали для проведения исследования Cytotoxicity DetectionKitPLUS (ЛДГ) в соответствии с инструкциями изготовителя. Перед проведением анализа значения, полученные для чистых сред, вычитали из полученных значений. Приводимые значения представляют собой концентрацию исследуемого соединения, при которой образование ЛДГ составляет половину от максимального.Caspase-Glo 3/7. Исследование Caspase-Glo 3/7 (Promega Corporation) представляет собой основанную на люминесценции однородную методику, в которой определяют активность каспазы-3/7. В исследовании используют пролюминесцентный субстрат каспаза-3/7 DEVD-аминолюциферин и термически стабильную люциферазу, в реагенте, оптимизированном для обеспечения активности каспазы-3/7,активность люциферазы и лизис клеток. Добавление одного реагента Caspase-Glo 3/7 приводит к лизису клеток и последующему отщеплению каспазы субстрата. Это приводит к высвобождению свободного аминолюциферина, который используется люциферазой, в результате чего вырабатывается люминесцентный сигнал. Интенсивность сигнала пропорциональна активности каспазы-3/7. Приводимые значения представляют собой концентрацию соединения, при которой активность каспазы-3/7 равна половине максимального значения. Для того чтобы продемонстрировать прогнозирующую способность скрининговых исследований,выбраны клетки 5 линий, обладающие известными различающимися чувствительностями по отношению к ингибиторам КБВ, предлагаемым в настоящем изобретении. Этими линиями являются следующие. НСТ-116 и НТ 29. НСТ-116 - линия клеток, образованная из карциномы эпителия толстой кишки человека, и показано, что in vivo она чувствительна по отношению к ингибиторам КБВ, предлагаемым в настоящем изобретении. НТ 29 (можно получить у фирмы American Type Culture Collection, Manassas VA,catalog number HTB-38) также образована из карциномы эпителия толстой кишки человека, но она менее чувствительна по отношению к ингибиторам КБВ.MV4;11 (American Tissue Culture Collection (catalogCRL-9591, Rockville, MD) представляет собой линию клеток острого миелогенного лейкоза (ОМЛ).Colo205 (American Tissue Culture Collection (catalogHB-8307, Rockville, MD) представляет собой линию клеток колоректального рака человека.T47D (можно получить у фирмы American Tissue Culture Collection (catalogHTB-133, Rockville,MD) представляет собой линию клеток, образованную из карциномы эпителия протоков молочной железы человека, которая, видимо, содержит дефект в точке контроля веретена). Данные для соединения IIa приведены ниже в табл. 2. Результаты показывают, что в целом результаты анализов хорошо согласуются друг с другом и их можно использовать для широкого скрининга клеток разных типов для скрининга ингибиторов КБВ и скрининга чувствительных типов клеток. Таблица 2 Скрининговые исследования пролиферации/выживаемости ДН - данных нет Исследование CTG - результатами являются значения GI50, которые рассчитывают, как концентрацию соединения, приводящую к 50% выживаемости. Исследование ЛДГ - результатами являются значения ЕС 50, которые рассчитывают, как концентрацию соединения, приводящую к эффекту, составляющему половину максимального. Исследование каспазы 3/7 - результатами являются значения ЕС 50, которые рассчитывают, как концентрацию соединения, приводящую к эффекту, составляющему половину максимального. Пример 5. Активность ингибиторов КБВ по отношению к набору линий клеток NCI60. Набор NCI-60 представляет собой стандартизированный набор линий опухолевых клеток, который часто используют для изучения чувствительности опухолей разной этиологии по отношению к определенному средству (Shoemaker 2006 Nat. Rev. Cancer., 6:813-23). Исследование CellTiter-Glo, описанное выше, используют для определения чувствительности целого ряда линий клеток, полученных из опухолей, по отношению к соединениям-ингибиторам КБВ. Данные для соединения IIa приведены ниже в табл. 3 и они показывают, что многие линии клеток, полученных из опухолей, чувствительны по отно- 17018014 шению к ингибиторам КБВ, предлагаемым в настоящем изобретении. Таблица 3 Сводка данных исследования CellTiter-Glo для соединения IIa ЦНС - центральная нервная система, НМКРЛ - немелкоклеточный рак легкого,Значение GI50 представляет собой концентрацию соединения (выраженную в нМ),приводящую к 50% выживаемости. Разность: разность среднего значения Log(GI50) (0,331) и Log(GI50) для каждой линии клеток. Среднее значение: среднее геометрическое значение для GI50 и среднее арифмети ческое значение для Log(GI50). Пример 6. Активность ингибиторов КБВ по отношению к линиям клеток, полученных из злокачественных новообразований в крови. Данные, приведенные в табл. 3, показывают, что линии клеток лейкозов являлись наиболее чувствительными по отношению к ингибиторам КБВ, предлагаемым в настоящем изобретении. Кроме того,набор различных линий клеток, полученных из злокачественных новообразований в крови, изучили с помощью исследования CellTiter-Glo, описанного выше, и результаты приведены ниже в табл. 4 и на фиг. 1. Таблица 4 Значения GI50 для соединения IIa по отношению к линиям клеток, полученных из злокачественных новообразований в крови Значение GI50 представляет собой концентрацию соединения, приводящую к 50% выживаемости. Разность: разность среднего значения Log(GI50) (-0,470) и Log(GI50) для каждой линии клеток. Среднее значение: среднее геометрическое значение для GI50 и среднее арифметическое значение для Log(GI50). (KMS-11, см. Namba et al (1989) Invitro Cell Dev. Biol. 25 (8) p. 723-729). Пример 7. Чувствительность первичных бластных клеток по отношению к ингибиторам КБВ. Данные, приведенные в табл. 4, показывают, что различные типы линий клеток рака крови чувстви- 19018014 тельны по отношению к ингибиторам КБВ, предлагаемым в настоящем изобретении. Первичные бластные клетки пациентов, страдающих ОМЛ, исследовали на чувствительность по отношению к соединению IIa, как показано ниже. Замороженные бластные клетки ОМЛ периферической крови получали у фирмы AllCell LLC. (Emeryville, CA). Приобретали 3 замороженных флакона, содержащие 1107 МКПК. Мононуклеарные клетки периферической крови (МКПК) трех пациентов, у которых впервые диагностирован ОМЛ, с большим содержанием бластных клеток (06-188, 80%; 06-366, 88%; 06-503,73%) выращивали в течение нескольких недель и обрабатывали ингибиторами КБВ. Флаконы быстро оттаивали и клетки выращивали в среде Исков DMEM с добавлением 10% ФБС (фетальная бычья сыворотка) и следующих цитокинов, всех при концентрации 10 нг/мл: GM-CSF, G-CSF, SCF, IL-3, и IL-6 (все выпускающиеся фирмой RD Systems). Три исследования с использованием клеток проводили следующим образом. Исследование CellTiter-Glo бластных клеток ОМЛ. МКПК (мононуклеарные клетки периферической крови), содержащие бластные клетки ОМЛ, высевали в 96-луночные планшеты (5000/лунка) и обрабатывали соединением IIa при различных концентрациях (от 10 пМ до 10 нМ) в течение 48 ч и затем выживаемость клеток определяли так, как описано выше. Значения GI50 (нМ) рассчитывали так же, как для линий клеток. Исследование клеточного цикла с применением окрашивания пропидиййодидом. МКПК, содержащие бластные клетки ОМЛ, высевали в 6-луночные планшеты (от 0,6 до 1106 клеток/лунка) и обрабатывали одним из следующих веществ: ДМСО (разбавитель), соединением IIa при концентрации, равной 0,2 или 2 нМ, или паклитакселом при концентрации, равной 100 нМ. Собирали примерно 2105 клеток, таблетки клеток дважды промывали холодным ЗФФ и повторно суспендировали в 500 мкл холодного ЗФФ. Клетки фиксировали путем добавления 8 мл холодного 80% этанола при медленном взбалтывании. После инкубации в течение 15 мин фиксированные клетки дважды промывали с помощью ЗФФ и таблетки клеток повторно суспендировали в 1 мл окрашивающего буфера PI/RNASE (BD Biosciences 550825) и инкубировали в течение 15 мин при 37 С с защитой от воздействия света. Пропидиййодид (PI) является флуоресцентным красителем, который окрашивает и ДНК, и РНК. Поэтому РНК необходимо удалить путем разложения с помощью рибонуклеазы (РНКазы). Перед проведением анализа с помощью FACS окрашенные клетки пропускали через устройство для окрашивания клеток в пробирку для FACS с целью уменьшения количества агрегатов клеток (BD Falcon352235). Содержание ДНК в фиксированных и окрашенных клетках определяли с помощью проточного устройства для подсчета клеток BD FACSCalibur с использованием программного обеспечения CellQuest. Исследование образования колоний в среде,содержащей метилцеллюлозу. Полужидкую среду, содержащую метилцеллюлозу, приобретали у фирмыStemCell Technologies Inc. (Methocult GF+ H4435, Cat 04435). Властные клетки высевали при плотностях в диапазоне от 1103 до 1105 клеток/лунка в не предназначенные для культур тканей обработанные 6-луночные планшеты. ДМСО (разбавитель) или соединение IIa (0,1, 0,2, 0,5, 1 и 2 нМ) добавляли к средам одновременно с клетками. Количество колоний подсчитывали под микроскопом через 2 недели. Живые клетки окрашивали Р-йоднитротетразолием по 750 мкл/лунка при концентрации, равной 1 мг/мл(Sigma CatI8377); изображения получали после инкубации в течение ночи при 37 С. Результаты: хотя кажущееся время удвоения этих бластных клеток было меньше, чем для большинства линий клеток ОМЛ, 50-70 ч и 30-50 ч соответственно, значения GI50, полученные для соединения IIa(0,12, 0,28 и 0,34 нМ), согласовывались с приведенными выше для линий клеток ОМЛ. Сходные результаты получены с помощью исследования образования колоний, по данным которого для образца 06-366 количество колоний заметно уменьшалось при концентрации, равной 0,2 нМ, и колонии отсутствовали при концентрации, равной 0,5 нМ и выше. Сходные результаты получены для образцов 06-188 и 06503, во всех случаях колонии отсутствовали при концентрации, равной 0,5 нМ и выше. Характеристики клеточного цикла показали, что для образца 06-366 через 24 ч увеличивалось количество клеток, у которых задержан митоз (4N популяция), и через 48 ч увеличивалось количество погибших клеток (2N популяция). При наибольшей концентрации (2 нМ) эти изменения были более выраженными, чем при меньшей концентрации (0,2 нМ), которая близка к GI50. Для получения положительного контрольного образца устойчивой задержки митоза использовали большую дозу паклитаксела (100 нМ). Сходные результаты получены для образцов 06-188 и 06-503. Для образца 06-503 данные получали через 48 и 72 ч. Характеристики, полученные через 48 ч, сходны с наблюдавшимися для образца 06-366, и через 72 ч увеличение количества погибших клеток (2N популяция) было более заметным, в особенности при концентрации, равной 2 нМ. См. фиг. 2. Тот факт, что значения GI50 все еще является очень низким, показывает, что клетки, вступившие в клеточный цикл, очень эффективно уничтожались соединением IIa. Пример 8. Исследование in vivo эффективности ингибиторов КБВ. Линию клеток НСТ-116 широко использовали для исследования ингибиторов митоза, таких как средства, разрушающие микротрубочки, ингибиторы митотической киназы и ингибиторы КБВ. Исследование эффективности многократного введения доз проводили в режиме введения по четыре раза в день в течение 3 дней (q4d3). Эксперименты проводили с использованием аутбредных лишенных вилочковой железы мышей линии nu/nu в возрасте примерно 6-8 недель (Charles River Laboratories, Hollister, CA). Для идентификации отдельных мышей им сразу же после поступления подкожно имплантировали микрочип (AVID, Folsom, LA) в подлопаточную область. До начала каких-либо экспериментальных исследований животным давали акклиматизироваться в течение 1 недели. Мышей по 4-5 особей помещали в прозрачные изготовленные из поликарбоната изолирующие микроклетки при освещении в циклическом режиме - 12 ч освещение, 12 ч без освещения - при температуре в диапазоне 70-80F и относительной влажности 30-70%. Корм (гранулированный корм для грызунов Purina) и воду давали без ограничений. С мышами обращались в соответствии с правилами и руководствами Novartis ACUC (Animal Care and UseCommittee) и руководством по уходу за лабораторными животными и их использованию ILAR (InstituteAnimal Care), по методике, утвержденной ACUC. Соединение IIa (свободное основание) и SB-715992 (испинесиб, ингибитор КБВ фирмы Cytokinetics, который проходит клинические исследования; в виде свободного основания) готовили в 20% каптисоле во всех указанных выше дозах для объемной дозы, составляющей 8 мл/кг. Дозы устанавливали в соответствии массой тела каждого животного. Препараты готовили один раз в начале исследования и хранили при комнатной температуре. Паклитаксел, предназначенный для клинических исследований,приобретали в виде смеси с разбавителем на основе кремофора (Mayne Pharma, now Hospira, Lake Forest,IL, catalogNDC-6170334209) и разводили в стерильном физиологическом растворе с получением объемной дозы, составляющей 16 мл/кг для ВБ введения дозы, равной 30 мг/кг. Клетки НСТ 116 карциномы толстой кишки человека получали из National Cancer Institute's DCTDTumor Repository (catalogNCI 502568, Rockville, MD) и с помощью набора анализов IMPACT1 PCR(RADIL, University of Missouri, Columbia, МО) подтверждали отсутствие Mycoplasma sp. и вирусов мышей. Клетки НСТ 116 выращивали в среде RPMI 1640, содержащей 2 мМ L-глутамина (Mediatech Inc.,catalog 15-040-CV), к которой добавляли 10% фетальную бычью сыворотку (JRH Biosciences, catalog 12003-1000 М). Эти клетки выращивали в виде прилипающих культур, хранили при 37 С в увлажненной атмосфере, содержащей 5% диоксида углерода. Перед использованием клетки выращивали посредством менее 10 пассажей. Клетки собирали при слиянии, составляющем 95%, и центрифугировали при 800g в течение 5 мин при 4 С и затем повторно суспендировали в холодной среде HBSS (Mediatech Inc., catalog 21-021-CV) при концентрации, равной 50 млн клеток/мл, для подкожной имплантации (вводимый объем составлял 0,1 мл). Самкам мышей линии nu/nu (Charles River, Hollister, CA) в правый бок путем инъекции подкожно вводили 5 млн. опухолевых клеток НСТ-116, суспендированных в сбалансированном солевом растворе Хенкса (HBSS), при полном объеме, равном 0,1 мл/мышь. Для исследования эффективности мышей рандомизировали через 10 дней после имплантации. В исследование 1 включали 72 мышей и в исследование 2 включали 81 мышь, обладающих опухолями со средним объемом, равным примерно 300 мм 3. Ксенотрансплантаты опухолей измеряли в двух направлениях (L (длина) и W (ширина с помощью цифровых штангенциркулей два раза в неделю от момента начала введения в день 0. Объем опухоли рассчитывали по уравнению (LW2)/2. Массы тела измеряли два раза в неделю и результаты клинических обследований регистрировали ежедневно. Значения объемов опухолей и массы тела регистрировали и хранили с использованием программного обеспечения StudyDirector (StudyLog, South San Francisco, CA). Выраженные в процентах значения лечение/контроль (Т/С) рассчитывали по следующей формуле: в которой Т - средний объем опухоли для группы, получавшей лекарственное средство, в последний день исследования; Т - средний объем опухоли для группы, получавшей лекарственное средство, в последний день исследования - средний объем опухоли для группы, получавшей лекарственное средство, в первый день исследования; С - средний объем опухоли для контрольной группы в последний день исследования и С - средний объем опухоли для контрольной группы в последний день исследования - средний объем опухоли для контрольной группы в первый день исследования. Все данные представляли в виде средних значений с указанием СКП (среднеквадратичная погрешность). Сопоставление конечных данных измерений опухолей между группами проводили с использованием одностороннего парного дисперсионного анализа (ANOVA). Статистическую значимость определяли с помощью одностороннего ANOVA Крускала-Уоллиса для методики множественных парных сравнений Ранкса и Данна. Статистическую обработку проводили с использованием программного обеспечения SigmaStat (Systat Software Inc., San Jose, CA). Исследование эффективности многократного введения доз проводили в режиме q4d3 для сопоставления противоопухолевой активности соединения IIa с данными для SB-715992 и паклитаксела. Результаты приведены в табл. 5. В этом исследовании животные, которых лечили с применением наибольших доз, равных 5 мг/кг для соединения IIa и 15 мг/кг для SB-7115992, получали только две первые дозы из запланированного режима q4d3 вследствие значительного уменьшения массы тела мышей, которую восстанавливали. Даже после введения только двух доз сходным образом происходила значительная регрессия опухоли (73% регрессия, р 0,05 в каждом случае). Две меньшие дозы соединения IIa, равные 2,5 и 1,25 мг/кг, и дозу SB-715992, равную 7,5 мг/кг, вводимые в режиме q4d3, также сходным образом приводили к регрессии ксенотрансплантатов опухолей НСТ 116 (82%, 66%, 65% регрессия, р 0,05 соответственно). В целом паклитаксел был менее эффективным, чем соединение IIa; хотя для опухолей, сначала регрессировавших, рост возобновлялся вскоре после превращения введения. Таблица 5 Эффективность соединения IIa при введении в режиме q4d3 для модели ксенотрансплантата опухоли НСТ 116 Поскольку столь низкая доза, как равная 1,25 мг/кг, в режиме введения q4d3 приводила к регрессии ксенотрансплантатов НСТ 116, исследование эффективности проводили повторно в диапазоне доз от 2 до 0,125 мг/кг, чтобы изучить ответ на дозы и определить, насколько низкую дозу можно ввести, чтобы вызвать регрессию опухоли. Результаты, приведенные в табл. 6, показывают, что при введении регрессия опухолей наблюдалась при низкой дозе, равной лишь 1 мг/кг (46% регрессия, р 0,05, день 17), и остановка роста опухоли наблюдалась при дозе соединения IIa, равной лишь 0,25 мг/кг, однако при сопоставлении с данными для животных контрольной группы, которым вводили разбавитель, результат не становился статистически значимым. Противоопухолевый эффект соединения IIa при дозе, равной 0,125 мг/кг, статистически значимо не отличался от результата для животных контрольной группы, которым вводили разбавитель. Только равная 7,5 мг/кг доза SB-715992 приводила к регрессии опухолей. Кроме того, через 72 ч после введения последней дозы брали пробы крови для сопоставления содержания нейтрофилов в кровотоке в разных группах. Содержание нейтрофилов уменьшилось в соответствии с дозой аналогично тому, как изменилась эффективность воздействия на опухоли. Таблица 6 Эффективность низких доз соединения IIa при введении в режиме q4d3 для модели ксенотрансплантата опухоли НСТ 116. Пример 9. Эффективность ингибиторов КБВ для модели ксенотрансплантата опухоли НСТ 15. НСТ 15 представляет собой линию клеток аденокарциномы человека и также известно, что они экспрессируют насос P-gp. Таким образом, модель ксенотрансплантата опухоли с применением этой линии клеток использована для проверки результатов, полученных в примере 10. Эксперименты проводили с использованием аутбредных лишенных вилочковой железы мышей линии nu/nu в возрасте примерно 6-8 недель (Charles River Laboratories, Hollister, CA). Для идентификации отдельных мышей им сразу же после поступления подкожно имплантировали микрочип (AVID, Folsom,LA) в подлопаточную область. До начала каких-либо экспериментальных исследований животным давали акклиматизироваться в течение 1 недели. Стандартный уход за животными и жизнеобеспечение осуществляли так, как описано выше. Клетки НСТ 15 карциномы толстой кишки человека получали из National Cancer Institute's DCTD ную бычью сыворотку (JRH Biosciences, catalog 12003-1000 М). С помощью набора анализов IMPACT1PCR (RADIL, University of Missouri, Columbia, МО) подтверждали отсутствие в клетках Mycoplasma sp. и вирусов мышей. Эти клетки выращивали в виде прилипающих культур, хранили при 37 С в увлажненной атмосфере, содержащей 5% диоксида углерода. Перед использованием клетки выращивали посредством менее 10 пассажей. Клетки собирали при слиянии, составляющем 95%, и центрифугировали при 800g в течение 5 мин при 4 С и затем повторно суспендировали в смеси состава 1:1 HBSS (MediatechInc., catalog 21-021-CV) и Matrigel при концентрации, равной 50 млн клеток/мл, для подкожной имплантации (вводимый объем составлял 0,2 мл). Лечение для изучения эффективности начинали через 10 дней после имплантации опухолевых клеток, когда объемы опухолей составляли примерно 300 мм 3. Соединение IIa и SB-715992 вводили внутривенно (ВВ) через хвостовую вену в объеме, равном 8 мл/кг, в указанных дозах. Паклитаксел вводили внутрибрюшинно (ВБ) в объеме, равном 16 мл/кг, в дозе, равной 30 мг/кг. Для изучения эффективности мышей рандомизировали через 10 дней после имплантации и включали в исследование при среднем объеме опухоли, равном примерно 300 мм 3. Ксенотрансплантаты опухолей измеряли в двух направлениях (L (длина) и W (ширина с помощью цифровых штангенциркулей два раза в неделю от момента начала введения в день 0. Объем опухоли рассчитывали по уравнению(LW2)/2. Массы тела измеряли два раза в неделю и результаты клинических обследований регистрировали ежедневно. Значения объемов опухолей и массы тела регистрировали и хранили с использованием программного обеспечения StudyDirector (StudyLog, South San Francisco, CA). Данные анализировали так, как описано выше. Результаты, приведенные в табл. 7, показывают, что соединение IIa обладает большей эффективностью по отношению к опухоли НСТ 15, чем паклитаксел; при дозе, равной 4 мг/кг, выраженное в процентах значение Т/С равнялось 26% (р 0,05 при сравнении с разбавителем и аналогичное значение получено при сравнении с паклитакселом). Хотя эти данные свидетельствуют о различии результатов для животных групп, которым вводили 4 мг/кг ингибитора КБВ и 7,5 и 15 мг/кг SB-715992, результаты не являются статистически значимыми вследствие разброса значений объемов опухолей в этой модели. В день 10 обнаружено статистически значимое (р 0,05) различие результатов для животных групп, которым вводили 4 мг/кг соединения IIa и 7,5 мг/кг SB-715992. Паклитаксел, являющийся известным субстратом для P-gp, в этой модели обладал очень низкой противоопухолевой активностью. Ни для одной из подвергавшихся лечению мышей не обнаружены ни значительное уменьшение массы тела, ни внешние признаки токсического воздействия. Увеличенная противоопухолевая активность для модели НСТ 15 свидетельствует об эффективности соединения IIa для моделей ксенотрансплантатов опухолей, которые экспрессируют большие количества P-gp. Таблица 7 Эффективность соединения Па при введении в режиме q4d3 для модели ксенотрансплантата опухоли НСТ 15 Пример 10. Эффективность ингибиторов КБВ для модели ксенотрансплантата острого миелогенного лейкоза (ОМЛ). Эффективность соединения IIa для модели ксенотрансплантата опухоли MV4;11 (O'Farrell, et al.,2003) оценивали с использованием лишенных вилочковой железы мышей. Сначала эффективность исследовали для модели подкожного ксенотрансплантата опухоли MV4;11 у мышей и, поскольку микроокружение костного мозга оказывает значительное влияние на рост и выживание клеток ОМЛ, эффективность также исследовали для модели диссеминированного заболевания MV4;11-luc у мышей, в которой клетки находились и росли в костном мозге и некоторых мягких органах. Поскольку опухолевые клетки экспрессируют люциферазу, последовательный комплексный мониторинг роста лейкозных поражений проводили с помощью биолюминесцентной визуализации. Исследования эффективности по отношению к подкожным опухолям проводили с использованием аутбредных лишенных вилочковой железы мышей линии nu/nu в возрасте примерно 6-8 недель (CharlesRiver Laboratories, Hollister, CA). Исследования эффективности для модели диссеминированного заболевания проводили с использованием иммунодефицитных самок мышей линии NOD-SCID в возрасте примерно 7-8 недель (Jackson Laboratories, Bar Harbor, ME). Для идентификации отдельных мышей им сразу же после поступления подкожно имплантировали микрочип (AVID, Folsom, LA) в подлопаточную область. До начала каких-либо экспериментальных исследований животным давали акклиматизироваться в течение 1 недели. Стандартный уход за животными и жизнеобеспечение осуществляли так, как описано выше. Клетки MV4;11 острого миелогенного лейкоза человека получали из American Tissue Culture Collection (catalogCRL-9591, Rockville, MD) и с помощью набора анализов IMPACT1 PCR (RADIL, Universityof Missouri, Columbia, МО) подтверждали отсутствие Mycoplasma sp. и вирусов мышей. Для модели диссеминированного заболевания стабильный пул клеток MV4;11, экспрессирующих ген люциферазы, получали из Fangxian Sun at the Genomics Institute of the Novartis Research Foundation in San Diego, California(MV4;11-luc). Клетки MV4;11 выращивали в среде Дульбекко, модифицированной по методике Исков(Mediatech Inc., catalog 15-016-CV), к которой добавляли 10% фетальную бычью сыворотку (JRH Biosciences, catalog 12003-1000M), 4 мМ L-глутамина и 5 нг/мл рекомбинантных гранулоцитов человека MCSF (GM-CSF) (RD Systems, catalog 215-GM). MV4;11-luc выращивали таких же средах, но с добавлением 2 мкг/мл пуромицина для селекции экспрессии люциферазы. Эти клетки выращивали в виде суспензий культур, хранили при 37 С в увлажненной атмосфере, содержащей 5% диоксида углерода. Перед использованием клетки выращивали посредством менее 10 пассажей. Клетки собирали примерно по 2 млн клеток/мл и центрифугировали при 800g в течение 5 мин при 4 С и затем повторно суспендировали в холодной среде HBSS (Mediatech Inc., catalog 21-021-CV) при концентрации, равной 25 млн клеток/мл (содержащей 50% Matrigel, BD Biosciences, catalog 354234), для подкожной имплантации (вводимый объем составлял 0,2 мл) или при концентрации, равной 100 млн клеток/мл, для внутривенной(ВВ) имплантации через хвостовую вену (вводимый объем составлял 0,1 мл). Мышей облучали дозой,равной 3 Гр, в течение 3 мин за один день до ВВ имплантации клеток. Соединение IIa (свободное основание) и SB-715992 (свободное основание) готовили в 20% каптисоле для объемной дозы, составляющей 8 мл/кг. Дозы устанавливали в соответствии с массой тела каждого животного. Препараты готовили один раз в начале исследования и хранили при комнатной температуре. Паклитаксел, предназначенный для клинических исследований, приобретали в виде смеси с разбавителем на основе кремофора (Mayne Pharma, now Hospira, Lake Forest, IL, catalogNDC-6170334209) и разводили в стерильном физиологическом растворе с получением объемной дозы, составляющей 16 мл/кг для ВБ введения дозы, равной 30 мг/кг. При двух исследованиях с помощью модели подкожной опухоли 10 млн клеток, объединенных со смесью 1:1 HBSS и Matrigel, путем инъекции подкожно вводили в правый бок при полном объеме,равном 0,2 мл/мышь. Мышей рандомизировали через 17 дней после имплантации и в исследование включали мышей, обладающих опухолями со средним объемом, равным примерно 250 мм 3. Ксенотрансплантаты опухолей измеряли в двух направлениях (L (длина) и W (ширина с помощью цифровых штангенциркулей два раза в неделю от момента начала введения в день 0. Объем опухоли рассчитывали по уравнению (LW2)/2. Массы тела измеряли два раза в неделю и результаты клинических обследований регистрировали ежедневно. Значения объемов опухолей и массы тела регистрировали и хранили с использованием программного обеспечения StudyDirector (StudyLog, South San Francisco, CA). Для оценки эффективности в модели диссеминированного заболевания проводили облучение всего тела самок мышей линии NOD-SCID дозой, равной 3 Гр, за один день до введения путем инъекции в хвостовую вену 10 млн клеток в 0,1 мл среды HBSS. Сорок мышей рандомизировали и включали в исследование через 28 дней после имплантации при среднем количестве фотонов (со стороны спины + со стороны живота), определенном с помощью биолюминесцентной визуализации, равном примерно 510 фотон/с. Примерно за 10 мин до визуализации мышам с помощью ВБ инъекции вводили 150 мг/кг люциферина (Xenogen Corporation, Alameda, CA), затем их анестезировали изофлураном. Испускание фотонов измеряли с помощью камеры на приборах с зарядовой связью в системе визуализации IVIS (XenogenCorporation). Вкратце, методика заключается в следующем: получали полутоновое изображение мыши,затем накладывали карту биолюминесценции, представляющую пространственное распределение фотонов, зарегистрированных вследствие разложения люциферина в раковых клетках, экспрессирующих люциферазу. Интенсивности сигналов количественно определяли с использованием модифицированной версии программного обеспечения IGOR Pro version 4.09A (WaveMetrics, Inc., Lake Oswego, OR) под названием Living Image version 2.50.2 (Xenogen). Определяли суммарное количество всех зарегистрированных фотонов со стороны спины + со стороны живота. Биолюминесценцию раковых клеток животных исследовали путем визуализации в назначенные дни, пока у первой мыши не развивался паралич задней конечности, вызванный развитием заболевания; этот момент являлся главной конечной точкой для гуманного умерщвления мыши. Регистрировали день умерщвления каждой мыши и строили зависимость выраженного в процентах количества оставшихся мышей от времени (анализ выживания КапланаМейера). Значения Р рассчитывали с использованием логарифмического рангового критерия (программное обеспечение GraphPad Prism 4.0) для оценки различия между группой животных, подвергавшихся лечению, и контрольной группой (значение р 0,05 считали обеспечивающим статистическую значимость). Массы тела измеряли два раза в неделю и результаты клинических обследований регистрировали ежедневно. Значения массы тела регистрировали и хранили с использованием программного обеспечения StudyDirector (StudyLog, South San Francisco, CA). Анализ данных проводили так, как описано выше. Результаты, модель подкожной опухоли. Исследования эффективности для модели подкожной опухоли проводили для сопоставления активности соединения IIa в диапазоне доз при введении в режимеq4d3. В первом исследовании для мышей линии nu/nu определили наибольшие переносимые дозы: 4 мг/кг соединения IIa, 15 мг/кг SB-715992 и 30 мг/кг паклитаксела. Четырем оставшимся мышам, у которых имелись опухоли, в том же режиме вводили 0,625 мг/кг ингибитора КБВ. Результаты приведены в табл. 8. В течение введения регрессию опухолей наблюдали во всех группах, для которых проводили лечение, и у 9/9, 6/9 и 7/9 мышей наблюдалась длительная/полная регрессия опухолей (ПР) в течение более 100 дней в группах животных, которым вводили наибольшие дозы соединения IIa, SB-715992 и паклитаксела соответственно. Хотя в группах животных, которым вводили 0,625 мг/кг соединения IIa,опухоли регрессировали, они начинали повторно расти примерно через 10 дней после введения последней дозы. Дозы исследуемых средств обычно хорошо переносились, и среднее максимальное уменьшение массы составляло 10%, хотя в группах животных, которым вводили SB-715992, у двух мышей уменьшение массы тела составляло 20%. Таблица 8 Эффективность соединения IIa при подкожном введении в режиме q4d3 для модели ксенотрансплантата опухоли MV4;11 Второе исследование эффективности для модели подкожной опухоли проводили путем сопоставления активности в диапазоне низких доз соединения IIa при введении в режиме q4d3. Наибольшая использованная доза равнялась 2 мг/кг, что составляло половину наибольшей переносимой дозы для голых мышей. Активность соединения IIa сопоставляли с активностью SB-715992 при дозе, равной 7,5 мг/кг,что составляло половину наибольшей переносимой дозы. Результаты приведены в табл. 9 и на фиг. 2. При равных 0,5, 1 и 2 мг/кг дозах соединения IIa и равных 1,75, 3,5 и 7,5 мг/кг дозах SB-715992 наблюдали различные степени регрессии опухоли. Через 5 дней после введения последней дозы начинался рост опухолей в группах животных, которым вводили 0,5 мг/кг соединения IIa и 1,75 мг/кг SB-715992. Затем,через 30 дней после введения начинался рост опухолей в группах животных, которым вводили 7,5 мг/кгSB-715992. Равные 1 и 2 мг/кг дозы соединения IIa приводили к длительной регрессии и в течение более 100 дней наблюдалась полная регрессия 6 и 5 опухолей соответственно. Дозы исследуемых средств обычно хорошо переносились и среднее максимальное уменьшение массы составляло 10%. Таблица 9 Исследование 2: сводка данных по противоопухолевой эффективности и переносимости соединения IIa для подкожных ксенотрансплантатов опухолей MV4;11 ОМЛ человека Результаты, модель диссеминированного ОМЛ. Активность соединения IIa оценивали для модели диссеминированного заболевания ОМЛ MV4;11-luc, в которой опухолевые клетки имплантировали внутривенно. Введение лекарственного средства начинали через 28 дней после имплантации клеток, и в это время животные находились на стадии запущенного заболевания, о чем свидетельствовал интенсивный сигнал биолюминесценции. Результаты приведены в табл. 10. При начальной визуализации сигнал биолюминесценции наблюдался в костях (нижняя челюсть, череп, позвоночный столб и длинные кости),но он также наблюдался для всего тела, включая легкие и печень. Поэтому после этого регистрировали испускание фотонов из всего тела (со стороны спины + со стороны живота). Эти поражения в конечном счете приводили к параличу задней конечности и в некоторых случаях к значительному уменьшению массы тела вследствие увеличения массы опухоли и в это время мышей умерщвляли. Это называли "условной выживаемостью". Последовательный мониторинг испускания фотонов из опухоли MV4;11-luc у мышей проводили,пока от болезни не погибала первая мышь, что происходило после 12-го дня исследования. Равные 0,5 и 1 мг/кг дозы соединения IIa при введении в режиме q4d3 приводили к значительно меньшему сигналу биолюминесценции, который являлся мерой развития заболевания, чем для группы животных, которым вводили разбавитель (р 0,05), в то же время воздействие дозы лекарственного средства, равной 0,25 мг/кг, статистически значимо не отличалось от воздействия разбавителя. При этих дозах соединение IIa хорошо переносилось. Соединение IIa значительно задерживало развитие паралича задней конечности и при всех трех дозах приводило к лучшей выживаемости мышей, чем в когорте животных, которым вво- 28018014 дили разбавитель (р 0,05). Средняя выживаемость в группе животных, которым вводили разбавитель,составляла 15 дней, а в группах животных, которым вводили 0,25, 0,5 и 1 мг/кг соединения IIa, она составляла 27, 31 и 30 дней соответственно. Уменьшение массы опухоли в начале введения (по данным биолюминесценции), которое происходило во время введения, не согласовывалось с зависящим от дозы увеличением выживаемости. Представляется, что после прекращения воздействия соединения заболевание быстро прогрессировало во всех группах. Таблица 10 Эффективность соединения IIa при введении в режиме q4d3 для модели диссеминированного заболевания MV4;11 Пример 11. Исследование эффективности ингибиторов КБВ для ксенотрансплантатов множественной миеломы человека KMS-11-luc. Оценивали эффективность соединения IIa для ксенотрансплантатов множественной миеломы человека KMS-11-luc. Сначала эффективность исследовали для модели подкожного ксенотрансплантата опухоли у мышей этой линии и соединение IIa приводило к выраженному противоопухолевому эффекту. Поскольку микроокружение костного мозга оказывает значительное влияние на рост и выживание клеток миеломы, эффективность также исследовали для модели диссеминированного заболевания KMS-11luc у мышей, в которой клетки предпочтительно находились и росли в ортотопической части костного мозга. Экспрессирование репортерного гена люциферазы в клетках позволило провести последовательный комплексный мониторинг роста миеломных поражений в кости с помощью биолюминесцентной визуализации. Эксперименты проводили с использованием иммунодефицитных самок мышей линии SCID-Beige в возрасте примерно 7-8 недель (Charles River Laboratories, Wilmington, MA). Для идентификации отдельных мышей им сразу же после поступления подкожно имплантировали микрочип (AVID, Folsom, LA) в подлопаточную область. До начала каких-либо экспериментальных исследований животным давали акклиматизироваться в течение 1 недели. Стандартный уход за животными и жизнеобеспечение осуществляли так, как описано выше. Клетки KMS-11-luc множественной миеломы человека получали из лаборатории Suzanne Trudel atthe University of Toronto (Ontario, Canada) и с помощью набора анализов IMPACT1 PCR (RADIL, University of Missouri, Columbia, МО) подтверждали отсутствие Mycoplasma sp. и вирусов мышей. До получения нами этих клеток их с помощью генной инженерии путем ретровирусной трансфекции вектора pGCgfp/luc модифицировали, так чтобы они стабильно экспрессировали люциферазу. Клетки KMS-11-luc выращивали в среде Исков, к которой добавляли 2 ммоль/л L-глутамина (Mediatech, Inc., Herndon, VA) и 10% фетальную бычью сыворотку (JRH Biosciences, catalog 12003-1000 М). Эти клетки выращивали в виде суспензий культур, хранили при 37 С в увлажненной атмосфере, содержащей 5% диоксида углерода. Перед использованием клетки выращивали посредством менее 10 пассажей. Клетки собирали примерно по 2 млн клеток/мл и центрифугировали при 800g в течение 5 мин при 4 С и затем повторно суспендировали в смеси состава 1:1 холодного сбалансированного солевого раствора Хенкса (HBSS) иMatrigel (Mediatech Inc., catalog 21-021-CV; BD Biosciences, catalog 354234 соответственно) при концентрации, равной 50 млн клеток/мл, для подкожной имплантации (вводимый объем составлял 0,2 мл). Альтернативно, для модели диссеминированного заболевания клетки готовили только в холодном HBSS при концентрации, равной 100 млн клеток/мл, для внутривенной (ВВ) имплантации через хвостовую ве- 29
МПК / Метки
МПК: C07D 233/00, A61P 35/00, A61K 31/4164
Метки: средств, лечения, качестве, рака, кинезина, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-18014-ingibitory-kinezina-v-kachestve-sredstv-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы кинезина в качестве средств для лечения рака</a>
Предыдущий патент: Способ, устройство и рамная конструкция для очистки поверхностей труб и трубная конструкция для распределения частиц
Следующий патент: Модификатор асфальтобетонной смеси
Случайный патент: Способ увеличения количества мононуклеарных клеток у субъекта, страдающего раком, и используемая для этого фармацевтическая комбинация