Аминооксимные производные 2- и/или 4-замещенных андростанов и андростенов в качестве лекарственных средств для лечения сердечно-сосудистых нарушений
Номер патента: 17497
Опубликовано: 28.12.2012
Авторы: Марацци Джузеппе, Феррари Патриция, Черри Альберто, Торри Марко, Кабри Вальтер, Бьянки Джузеппе, Гоббини Мауро, Федрицци Джорджо
Формула / Реферат
1. Соединение общей формулы (I)
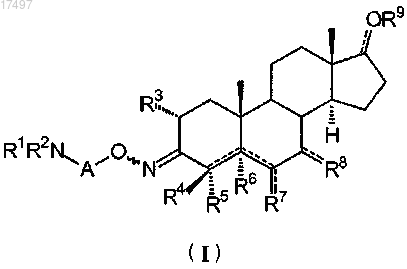
в которой А представляет прямой или разветвленный C1-C6-алкилен или C3-C6-циклоалкилен;
R1 и R2, которые могут быть одинаковыми или различными, представляют Н, C1-C6-алкил и R1 и R2 могут быть необязательно замещены одним или более заместителями, выбранными из гидрокси, метокси или этокси;
в том случае, когда R1 представляет алкил, R1 и А, взятые вместе с атомом азота, могут образовать незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6-членное кольцо;
R3 является атомом водорода, гидрокси или атомом фтора;
в том случае, когда символв положении 4 является простой связью, R4 представляет атом водорода, фтора, C1-C6-алкил или гидрокси и R5 представляет атом водорода, фтора, метил, этил или гидрокси;
R4 и R5, когда символв положении 4 является простой связью, взятые вместе с атомом углерода, с которым они связаны, могут образовать спироциклопропановое или спироциклопентановое кольцо;
в том случае, когда символв положении 4 является двойной связью, R4 представляет атом фтора, C1-C6-алкил или гидрокси и R5 отсутствует;
R6 представляет Н или OR10 или отсутствует, когда символв положении 4 или 5 является двойной связью;
R5 и R6, когда символыв положениях 4 и 5 являются простыми связями, взятые вместе, могут образовать оксирановое или циклопропановое кольцо;
в том случае, когда связьOR11 или CR12R13;
в том случае, когда связьOR11 или CR12R13;
в том случае, когда связь, соединяющая атом углерода в положении 6 андростанового скелета с R7, представляет простую связь, R7 является Н, C1-C6-алкилом, OR14, COOR15, NHCHO, спироциклопропаном, спирооксираном, где алкильная группа может быть необязательно замещена одним или более гидрокси, метокси или этокси;
R6 и R7, когда символыв положениях 4, 5 и 6 являются простыми связями, взятые вместе, могут образовать оксирановое или циклопропановое кольцо;
в том случае, когда связь, соединяющая атом углерода в положении 7 андростанового скелета с R8, представляет простую связь, R8 является Н, C1-C6-алкилом, OR14, NHCHO, спироциклопропаном, спирооксираном, где алкильная группа может быть необязательно замещена одним или более гидрокси, метокси или этокси;
R9 представляет Н, C1-C6-алкил или C2-C7-алкилкарбонил, когда связьв положении 17 представляет двойную связь, то R9 отсутствует;
R10 представляет Н, C1-C6-алкил или C2-C7-алкилкарбонил;
R11 представляет Н, C1-C6-алкил или C2-C7-алкилкарбонил;
R12 и R13, которые могут быть одинаковыми или различными, представляют Н, C1-C6-алкил или F;
R14 представляет Н, C1-C6-алкил или C2-C7-алкилкарбонил;
R15 представляет Н или C1-C6-алкил;
R10, R11, R12, R13, R14 и R15, когда находятся в одном и том же соединении в различных положениях, могут быть одинаковыми или различными;
символпредставляет Е- или Z-диастереоизомер;
символв положениях 4, 5, 6, 7 и 17 независимо представляет простую или двойную связь, в том случае, когда она является простой экзоциклической связью в положениях 6, 7 или 17, она может иметь α- или β-ориентацию;
при следующих условиях:
когда R4 представляет Н и R5 является метилом, оба R7 и R9 не образуют кетогрупп;
когда R4 представляет гидрокси, R5 не является гидрокси или атомом фтора, и наоборот;
данные R3, R4 и R5 одновременно не являются атомом водорода.
2. Соединение по п.1, которое выбрано из группы, состоящей из
(E)-3-(2-аминоэтоксиимино)-4,4-диметиландростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4,4-диметиландрост-5-ен-17-она,
(E)-3-(2-аминоэтоксиимино)-4,4-диметиландростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4,4-диметиландрост-5-ен-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4,4-диметиландростан-6,17-диона,
(E)-3-(2-аминоэтоксиимино)-4,4-диметил-5α-гидроксиандростан-6,17-диона,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопропанандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопропанандрост-5-ен-17-она,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопропанандростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопропанандрост-5-ен-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопропанандростан-6,17-диона,
(E)-3-(2-аминоэтоксиимино)-4β-этиландростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4β-этиландростан-6,17-диона,
(E)-3-(2-аминоэтоксиимино)-4β-этил-6α-гидроксиандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4β-этил-6β-гидроксиандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4β-этиландростан-6β,17β-диола,
(E)-3-(2-аминоэтоксиимино)-4α-этиландростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4α-этиландростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4α-фторандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4α-фторандростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-2α-фторандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-2α-фторандростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-2α-фтор-17β-гидроксиандростан-6-она,
3-(Е)-(2-аминоэтоксиимино)-2α-фтор-6-(Е)-гидроксииминоандростан-17β-ола,
3-(Е)-(2-аминоэтоксиимино)-2α-фтор-6-(Е)-метоксииминоандростан-17β-ола,
3-(Е)-(2-аминоэтоксиимино)-2α-фтор-6-(Е)-гидроксииминоандростан-17β-она,
3-(Е)-(2-аминоэтоксиимино)-2α-фтор-6-(Е)-метоксииминоандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопентанандростан-17-она,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопентанандростан-17β-ола,
(E)-3-(2-аминоэтоксиимино)-4-спироциклопентанандростан-6α,17β-диола
и соответствующих 3-(3-аминопропоксиимино), 3-(2-N-метиламиноэтоксиимино), 3-(3-N-метиламинопропоксиимино), 3-(1-амино-2-метил-2-пропоксиимино), 3-(3-(R)-пирролидинилоксиимино), 3-(3-(S)-пирролидинилоксиимино), 3-(3-азетидинилоксиимино), 3-(4-пиперидинилоксиимино) и (Е)-3-(2-диметиламиноэтоксиимино) производных.
3. Способ получения соединения по п.1, который включает взаимодействие соединения общей формулы (II)
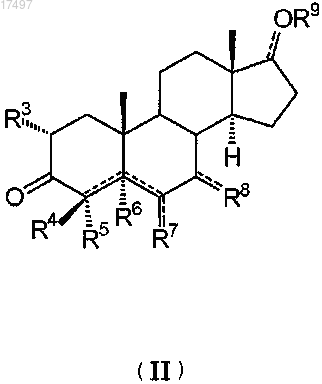 в которой символы R3, R4, R5, R6, R7, R8, R9 и
в которой символы R3, R4, R5, R6, R7, R8, R9 иимеют значения, определенные в п.1,
с соединениями формулы (III)
в которой R1, R2 и А имеют значения, определенные в п.1.
4. Способ по п.3, в котором взаимодействие проводят в полярном растворителе при температуре в пределах от 0°С до температуры кипения с обратным холодильником.
5. Применение соединения по п.1 или 2 для получения лекарственного средства.
6. Применение по п.5, в котором лекарственное средство является пригодным для лечения сердечно-сосудистого нарушения или его осложнений на органы.
7. Применение по п.6, в котором сердечно-сосудистое заболевание является сердечной недостаточностью и/или гипертензией.
8. Фармацевтическая композиция, содержащая одно или более соединений по п.1 или 2 в сочетании с наполнителями и/или фармакологически приемлемыми разбавителями.
9. Способ получения фармацевтической композиции по п.8, включающий смешивание одного или более соединений по п.1 или 2 с подходящими наполнителями.
10. Способ лечения млекопитающего, страдающего сердечно-сосудистым нарушением, включающий введение терапевтически эффективного количества одного или более соединений по п.1 или 2.
Текст
АМИНООКСИМНЫЕ ПРОИЗВОДНЫЕ 2- И/ИЛИ 4-ЗАМЕЩЕННЫХ АНДРОСТАНОВ И АНДРОСТЕНОВ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ НАРУШЕНИЙ Приведено описание новых аминооксимных производных в положении 3 2- и/или 4-замещенных андростанов и андростенов, способы их получения и фармацевтические композиции, содержащие их, для лечения сердечно-сосудистых нарушений, таких как сердечная недостаточность и гипертензия. В частности, приведено описание соединений общей формулы I, в которой радикалы имеют значения, подробно описанные в изобретении.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. 017497 Настоящее изобретение относится к новым аминооксимным производным в положении 3 2- и/или 4-замещенных андростанов и андростенов, необязательно 5-, и/или 6-, и/или 7-замещенных, а также к способам их получения и содержащим их фармацевтическим композициям, предназначенным для лечения сердечно-сосудистых нарушений, таких как сердечная недостаточность и гипертензия. Уровень техники Сердечно-сосудистые заболевания по-прежнему занимают первое место в качестве причины заболеваемости и смертности в западном мире; среди них гипертензия и сердечная недостаточность являются наиболее распространенными заболеваниями. Гипертензия представляет собой один из наиболее важных сердечно-сосудистых факторов риска, и более трети населения в возрасте старше 60 лет страдает данным недугом. Застойной сердечной недостаточностью страдает 1-2% населения и даже 10% в очень пожилом возрасте; полагают, что данный процентный показатель возрастает (Sharpe N. et al., The Lancet, 1998, 352(suppl. 1), 3-17). Кроме того, гипертензия может представлять одну из наиболее важных причин сердечной недостаточности в пожилом возрасте (Remme W.J. et al., Eur. Heart J., 2001, 22, 1527-1560). Несмотря на то что существует ряд эффективных препаратов для лечения гипертензии и сердечной недостаточности, проводятся дальнейшие исследования с целью поиска более эффективных и безопасных соединений. Несколько лекарственных средств применяют в комбинации для лечения сердечной недостаточности, и среди инотропных средств с позитивным действием дигоксин является наиболее часто назначаемым сердечным гликозидом наперстянки, который может улучшить функцию миокарда. Очень хорошо известным недостатком препаратов наперстянки является их аритмогенное побочное действие. Признаки токсичности наперстянки проявляются при концентрации в сыворотке крови, превышающей в 2-3 раза терапевтическую дозу, и они выражаются в нарушении проводимости и сердечной аритмии, которые характерны для токсичности наперстянки (Hoffman B.F. et al., Digitalis and Allied Cardiac Glycosides; ThePergamon Press, New York, 1990, 814-839). Способность природных соединений наперстянки усиливать сократимость миокарда тесно связана с их карденолидной структурой, содержащей 17-лактон в 14-гидрокси-5,14-андростановом скелете. Область техники, к которой относится изобретение 6-Гидрокси- и 6-оксоандростановые производные раскрыты в ЕР 0825197 в качестве лигандов и ингибиторов Na+, K+-АТФазы и позитивных инотропных средств. De Munari S. et al., J. Med. Chem., 2003,64, 3644 также сообщали об этих же соединениях. Данная публикация посвящена проблеме, связанной со смесью изомеров. 3-Оксимные производные получали в виде смесей Е- и Z-изомеров в соотношении примерно 1:1. Попытки получить чистые изомеры имели слабый успех, и разделение проводили только в конкретных случаях с использованием сложного и неэффективного метода. Если соединение 22i получали одностадийным способом из промежуточного соединения 1 с с выходом 85%, то соответствующие чистые изомеры 22j и 22k получали с очень низким выходом (соответственно выход 32 и 16%) двустадийным способом из соединения 22i. Следовательно, такое получение не является перспективным. В результате не представляется возможным решить проблему получения чистых и эффективных ингибиторов андростанов и андростенов. Введение метильной группы в смежное положение 3-оксима привело к решению проблемы получения чистых изомеров. Соединения 22 с и 22d получили в виде отдельных изомеров, но они показали низкую эффективность по сравнению с легко получаемыми смесями изомеров. В действительности десметильное соединение 22b является в два раза более активным по сравнению с его аналогом, соединением 22 с. Аналогично соединение 22d в 30 раз менее активно по сравнению с соединением 22b. Хорошо известно, что введение смесей изомеров может привести к возникновению проблем за счет различий в химической и физической стабильности, фармакологической активности, токсичности и силе изомеров; кроме того, изомеры могут превращаться друг в друга в условиях in vivo с различной скоростью. Также фармакокинетика изомеров может быть различной, что вносит свой вклад в усиление трудностей при разработке смеси изомеров; фактически всасывание, метаболизм и выделение могут варьировать, приводя к различному распределению изомеров. В результате государственные контролирующие органы (например, Управление по контролю за продуктами и лекарствами) заявляют, что "изомеры следует рассматривать в качестве отдельных лекарственных средств и соответственно разрабатывать. Отсутствует причина для разработки смесей геометрических изомеров или диастереоизомеров, если только они случайно не представляют разумную комбинацию с фиксированными дозами. Но даже в этом случае следует подходить критически к тому, насколько оптимальное соотношение двух изомеров представляет соотношение, полученное при синтезе". Таким образом, попытки получить чистые изомеры могут решить проблемы, связанные с исследованием и разработкой смесей изомеров.-1 017497 Сущность изобретения В настоящее время было установлено, что 3-аминооксимные производные 2- и/или 4-замещенных андростанов и андростенов, необязательно 5-, и/или 6-, и/или 7-замещенных, отвечают требованиям в отношении получения лекарственных средств с высокой изомерной чистотой и лучшим терапевтическим индексом и/или более длительным периодом действия. Некоторые из данных соединений были получены в результате модификации соединений, раскрытых в ЕР 0825197 и в J. Med. Chem., 2003, 64, 3644-3654,что привело к появлению неожиданных фармакологических свойств, а именно более высокой активности при корреляции с их структурой. Соответственно настоящее изобретение относится к соединениям общей формулы (I) в которой А представляет прямой или разветвленный C1-C6-алкилен или C3-C6-циклоалкилен;R1 и R2, которые могут быть одинаковыми или различными, представляют Н, C1-C6-алкил иR1 и R2 могут быть необязательно замещены одним или более заместителями, выбранными из гидрокси, метокси или этокси; в том случае, когда R1 представляет алкил, R1 и А, взятые вместе с атомом азота, могут образовать незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6 членное кольцо;R3 является атомом водорода, гидрокси или атомом фтора; в том случае, когда символ в положении 4 является простой связью, R4 представляет атом водорода, фтора, C1-C6-алкил или гидрокси и R5 представляет атом водорода, фтора, метил, этил или гидрокси;R4 и R5, когда символ в положении 4 является простой связью, взятые вместе с атомом углерода, с которым они связаны, могут образовать спироциклопропановое или спироциклопентановое кольцо; в том случае, когда символ в положении 4 является двойной связью, R4 представляет атом фто 5 ра, C1-C6-алкил или гидрокси и R отсутствует;R5 и R6, когда символы в положениях 4 и 5 являются простыми связями, взятые вместе, могут образовать оксирановое или циклопропановое кольцо; в том случае, когда связь, соединяющая атом углерода в положении 6 андростанового скелета с, соединяющая атом углерода в положении 7 андростанового скелета с, соединяющая атом углерода в положении 6 андростанового скелета сR7, представляет простую связь, R7 является Н, C1-C6-алкилом, OR14, COOR15, NHCHO, спироциклопропаном, спирооксираном, где алкильная группа может быть необязательно замещена одним или более гидрокси, метокси или этокси;R6 и R7, когда символы в положениях 4, 5 и 6 являются простыми связями, взятые вместе, могут образовать оксирановое или циклопропановое кольцо; в том случае, когда связь, соединяющая атом углерода в положении 7 андростанового скелета сR8, представляет простую связь, R8 является Н, C1-C6-алкилом, OR14, NHCHO, спироциклопропаном,спирооксираном, где алкильная группа может быть необязательно замещена одним или более гидрокси,метокси или этокси;R9 представляет Н, C1-C6-алкил или C2-C7-алкилкарбонил, когда связь в положении 17 андростанового скелета представляет простую связь и когда связь в положении 17 представляет двойную связь, то R9 отсутствует;R12 и R13, которые могут быть одинаковыми или различными, представляют Н, C1-C6-алкил или F;R10, R11, R12, R13, R14 и R15, когда находятся в одном и том же соединении в различных положениях,то могут быть одинаковыми или различными; символ представляет Е- или Z-диастереоизомер; символ в положениях 4, 5, 6, 7 и 17 независимо представляет простую или двойную связь и в-2 017497 том случае, когда она является простой экзоциклической связью в положениях 6, 7 или 17, то она может иметь - или -ориентацию; при следующих условиях: когда R4 представляет Н и R5 является метилом, оба R7 и R9 не образуют кетогрупп; когда R4 представляет гидрокси, R5 не является гидрокси или атомом фтора, и наоборот; данные R3, R4 и R5 одновременно не являются атомом водорода. Еще одним объектом настоящего изобретения является способ получения соединения общей формулы (I), который включает взаимодействие соединения общей формулы (II) имеют значения, определенные выше, в которой R1, R2 и А имеют значения, определенные в п.1. В предпочтительном варианте взаимодействие проводят в полярном растворителе при температуре в пределах от 0 С до температуры кипения с обратным холодильником. Другим объектом настоящего изобретения является применение соединения общей формулы (I) для получения лекарственного средства, в частности для получения лекарственного средства, которое является пригодным для лечения сердечно-сосудистого нарушения или его осложнений на органы, например для лечения сердечной недостаточности и/или гипертензии. Ещ одним другим объектом настоящего изобретения является фармацевтическая композиция, содержащая одно или более соединений общей формулы (I) в сочетании с наполнителями и/или фармакологически приемлемыми разбавителями. Другим объектом настоящего изобретения является способ получения указанной выше фармацевтической композиции, включающий смешивание одного или более соединений общей формулы (I) с подходящими наполнителями. Ещ одним другим объектом изобретения является способ лечения млекопитающего, страдающего сердечно-сосудистым нарушением, включающий введение терапевтически эффективного количества одного или более соединений общей формулы (I). Подробное описание изобретения В контексте настоящего изобретения C1-C6-алкильные группы могут представлять разветвленные или прямые цепи или циклические группы, например метил, этил, н-пропил, изопропил, н-бутил, третбутил, циклопентил или циклогексил.C1-C6-Алкиленовые группы могут представлять разветвленные или прямые цепи или циклические группы, например метилен, этилен, триметилен, пропилен, тетраметилен, диметилэтилен, циклопропилен, циклобутилен, циклопентилен или циклогексилен. В том случае когда R1 и А, взятые вместе с атомом азота, образуют незамещенное или замещенное,насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6-членное кольцо, то предпочтительно гетероциклы представляют 3-пирролидинил, 3-азетидинил, 4-пиперидинил или 3-пиперидинил.C2-C7-Алкилкарбонильные группы могут представлять разветвленные, прямые или циклические цепи и предпочтительно представляют ацетил, пропионил, бутирил, пивалоил, циклопентанкарбонил или бензоил.C4-C14-Алкоксикарбонилангидридные группы могут представлять разветвленные, прямые или циклические цепи и предпочтительно представляют уксусный ангидрид, пропионовый ангидрид, бензойный ангидрид, бензилоксикарбонильный ангидрид и т.п. Связь в положении "х" представляет простую или двойную связь, если не указано иначе, соединяющую атом углерода в положении "x" с атомом углерода в положении "x+1" андростанового скелета или с его заместителем. Последний случай относится к атомам углерода только в положениях 6, 7 и 17.-3 017497 Предпочтительными примерами конкретных соединений формулы (I) по настоящему изобретению являются:(Е)-3-(2-диметиламиноэтоксиимино) производные. Соединения общей формулы (I) получают взаимодействием соединений общей формулы (II) имеют значения, определенные выше, в которой R1, R2 и А имеют значения, определенные выше, в форме свободного основания или соли,например, такой как дигидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, пиридин, вода или их смеси, при температуре в пределах от 0 С до температуры рефлюкса. Реакцию можно проводить в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, бикарбонат натрия или калия, или кислоты, такой как соляная кислота, бромисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, динатрий или дикалий гидрофосфат, натрия или калия дигидрофосфат. Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R7, R8, R9 имеют значения, определенные выше, и по меньшей мере один символ представляет простую связь, можно получить восстановлением соответствующих соединений общей формулы (I), в которой символ пред-4 017497 ставляет двойную связь, каталитическим гидрированием, с использованием газообразного водорода или в условиях переноса водорода, в присутствии металлического катализатора, такого как Pd/C, PtO2, Pt,Pt/C, никель Ренея. В качестве реагента для переноса водорода можно использовать формиат аммония,гипофосфит натрия и циклогексадиен. Реакцию можно проводить в растворителе, например, таком как этанол, метанол, этилацетат, диоксан, тетрагидрофуран, уксусная кислота, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0 С до температуры рефлюкса, под давлением в пределах от атмосферного давления до 10 атм. В зависимости от субстрата и используемых условий гидрирование может избирательно воздействовать на одну или более двойных связей. Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, R7 не является N, соединяющая атом углерода в положении 6 с R7, может представлять простую или двойную связь, и связь, соединяющая атом углерода в положении 7 андростанового скелета с R8, представляет двойную связь, можно получить из соответствующих соединений общей формулы (I), в которой R8 представляет О, в значении кетогруппы, с использованием одного из способов, описанных в литературе, например взаимодействием соединений общей формулы H2NOR11, где R11 имеет значения, определенные выше, в реакционных условиях, описанных выше для взаимодействия соединений формулы (II) с соединениями формулы (III). Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, R7 является NOR11, когда связь, соединяющая атом углерода в положении 7 андростанового скелета с R8, может быть простой или двойной связью,можно получить из соответствующих соединений общей формулы (I), в которой R8 представляет О, в значении кетогруппы, с использованием одного из способов, описанных в литературе, например взаимодействием соединений общей формулы H2NOR11 в реакционных условиях, описанных выше для взаимодействия соединений формулы (II) с соединениями формулы (III). Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, R7 и R8 являются NOR11, можно получить из соответствующих соединений общей формулы (I), в которой R7 и R8 представляют О, в значении кетогруппы, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием соединений общей формулы H2NOR11 в реакционных условиях, описанных выше для взаимодействия соединений формулы(II) с соединениями формулы (III). Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, R7 не является CR12R13 и R8 является CR12R13, когда связь, соединяющая атом углерода в положении 6 с R7, может представлять простую или двойную связь, можно получить из соответствующих соединений общей формулы (I), в которой R8 представляет О, в значении кетогруппы,с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с соединениями общей формулы (IV) или (V) в которых R12 и R13 имеют значения, определенные выше;Hal является атомом галогена, например, таким как атом хлора, брома или йода. Взаимодействие с соединениями общей формулы (IV) или (V) можно проводить в растворителе,таком как диэтиловый эфир,диоксан,тетрагидрофуран,1,2-диметоксиэтан,толуол,N,N-диметилформамид, диметилсульфоксид, н-пентан или их смеси, при температуре в пределах от-78 С до температуры рефлюкса. Реакцию проводят в присутствии основания, например, такого как гидрид натрия или калия, метилат натрия или калия, трет-бутилат натрия или калия. Также реакцию можно провести в смеси органических растворителей, например, таких как дихлорметан, хлорбензол, толуол,гексан и вода, в присутствии гидроксида натрия или калия и соли четвертичного аммония, например,такой как хлорид, или бромид, или йодид или гидросульфат тетрабутиламмония, при температуре в пределах от 0 С до температуры рефлюкса смеси. Реакцию с соединениями общей формулы (V) также можно проводить в воде или в смеси указанных выше растворителей с водой при температуре в пределах от 0 С до температуры рефлюкса. Данные реакции можно проводить в присутствии основания, например,такого как гидроксид натрия или калия, бикарбонат натрия или калия, карбонат натрия или калия, триэтиламин, диизопропилэтиламин, необязательно в присутствии соли, такой как хлорид лития. Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, R7 является CR12R13 и R8 не является CR12R13, когда связь, соединяющая атом углерода в положении 7 андростанового скелета с R8 представляет простую или двойную связь,можно получить из соответствующих соединений общей формулы (I), в которой R7 представляет О, в значении кетогруппы, взаимодействием соединений общей формулы (IV) или (V), как описано выше, с использованием реакционных условий, описанных выше.-5 017497 имеют значеСоединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и ния, определенные выше, и R7 и R8 являются CR14R13, можно получить из соответствующих соединений общей формулы (I), в которой оба R7 и R8 представляют О, в значении кетогруппы, например взаимодействием с соединениями общей формулы (IV) или (V), как описано выше, с использованием реакционных условий, описанных выше. Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, и по меньшей мере один из R7 и R8 представляет гидроксиметил, можно получить из соответствующих соединений общей формулы (I), в которой по меньшей мере один из R7 и R8 является CR12R13, где R12 и R13 представляют атомы водорода, с использованием одного из способов,описанных в литературе для таких реакций, например взаимодействием с бораном, например, таким как диборан, или его комплексами с диметиламином или диметилсульфидом, 9-борабициклононаном,диизопинокамфенилбораном, диизоамилбораном, в эфирном растворителе, например, таком как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой щелочным раствором пероксида водорода или пербората натрия. С использованием аналогичных способов также можно получить соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, и по меньшей мере один из R7 и R8 представляет гидроксиэтил, можно получить из соответствующих соединений общей формулы (I), в которой по меньшей мере один из R7 и R8 является винилом. Соединения общей формулы (I), в которой по меньшей мере один из R7 и R8 представляет винил, можно получить взаимодействием соединений общей формулы (I), в которой по меньшей мере один из R7 и R8 представляет СНО, с хлоридом, или бромидом, или йодидом метилтрифенилфосфония, с использованием аналогичных реакционных условий, описанных выше для соединений общей формулы (IV) или (V). Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, и по меньшей мере один из R7 и R8 представляет О, в значении кетогруппы,можно получить из соответствующих соединений общей формулы (I), в которой по меньшей мере один из R7 и R8 является гидрокси, с использованием одного из реагентов, описанных в литературе для таких реакций окисления, например, таких как йодоксибензойная кислота, периодинан Десс-Мартина, оксалилхлорид и триэтиламин и ДМСО, CrO3 в пиридине или в серной кислоте и ацетоне, хлорхромат пиридиния или дихромат пиридиния. С использованием аналогичных реакций окисления, описанных выше, соединения общей формулы(I), в которой R9 отсутствует, можно получить обработкой соединений общей формулы (I), в которой R9 является атомом водорода. Соединения общей формулы (I), в которой символы A, R1, R2, R3, R4, R5, R6, R9 и имеют значения, определенные выше, и по меньшей мере один из R7 и R8 является OR14, где R14 представляет атом водорода, можно получить из соответствующих соединений общей формулы (I), в которой по меньшей мере один из R7 и R8 представляет О, в значении кетогруппы, восстановлением с использованием комплексного гидрида, например, такого как NaBH4, необязательно в присутствии кислоты Льюиса, например, такой как CeCl3, в спиртовом или эфирном растворителе, или LiAlH4 в эфирном растворителе, LiBH4 или LiAl(tBuO)3 Н или металла, например, такого как натрий, в спиртовом растворителе, при температуре в пределах от 0 С до температуры рефлюкса. С использованием аналогичных реакций восстановления, описанных выше, соединения общей формулы (I), в которой R9 представляет атом водорода, можно получить обработкой соединений общей формулы (I), в которой R9 отсутствует. Соединения общей формулы (I), в которой R9 представляет C1-C6-алкил, можно получить из соединений общей формулы (I), в которой R9 представляет атом водорода, обработкой основанием, например,таким как гидрид натрия или калия, метилат натрия или калия, трет-бутилат натрия или калия, диизопропиламид лития в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран,1,2-диметоксиэтан, толуол, диметилсульфоксид или их смеси, при температуре в пределах от -78 С до температуры рефлюкса с последующим гашением C1-C6-алкил-LG, где LG представляет уходящую группу, например, такую как хлор, бром, йод, мезилокси, п-толуолсульфонилокси, трифторметансульфонилокси, при температуре в пределах от -78 С до температуры рефлюкса. Реакцию также можно проводить в смеси органических растворителей, например, таких как дихлорметан, хлорбензол, толуол, гексан и вода, в присутствии гидроксида натрия или калия и соли четвертичного аммония, например, такой как хлорид, или бромид, или йодид, или гидросульфат тетрабутиламмония, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (I), в которой R9 представляет C2-C7-алкилкарбонил, можно получить из соединений общей формулы (I), в которой R9 представляет атом водорода, взаимодействием с соответствующим C2-C7-алкилкарбонилгалогенидом или C4-C14-алкилкарбонилангидридом в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол,N,N-диметилформамид, диметилсульфоксид, дихлорметан, пиридин или их смеси, при температуре в пределах от -78 С до температуры рефлюкса, необязательно в присутствии основания, такого как триэтиламин, пиридин, 4-диметиламинопиридин. Также аналогичную реакцию можно проводить с исполь-6 017497 зованием C2-C7-карбоновой кислоты в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, ацетон, этилацетат, дихлорметан, хлороформ, N,N-диметилформамид,диметилсульфоксид, вода или их смеси, при температуре в пределах от -30 С до температуры рефлюкса,в присутствии конденсирующего реагента, такого как N,N'-дициклогексилкарбодиимид, N-этил-N'-(3 диметиламинопропил)карбодиимид гидрохлорид. Соединения общей формулы (I), описанные выше, можно получить, начиная с известных соединений с необходимой функциональной группой в различных положениях, о которых уже сообщалось в литературе, или из промышленно доступных соединений, например, таких как тестостерон, следуя общим методам, описанным ниже. Atwater et al., J. Am. Chem. Soc., 1957, 5315 сообщали о 4-метилтестостероне и 17-гидрокси-4,4-диметиландрост-5-ен-3-оне; Rosenkranz et al., J. Org. Chem., 1957, 602 сообщали о 17-гидрокси-4,4-диметиландростан-3-оне; Youngdale сообщали о 4-(спироциклопропан)-17 гидроксиандрост-5-ен-3-оне в патенте США 3793308 (1974); Nakanishi et al., J. Am. Chem. Soc., 1959,5259 сообщали о 2-фтордигидротестостероне; Rizvi S.Q.A. et al., J. Org. Chem., 1974, 1127 сообщали о 4 спироциклопентан-17-гидроксиандрост-5-ен-3-оне; Sollman Р.В. et al., J. Org. Chem., 1961, 4180 сообщали о 6-метокси-17-гидроксиандрост-4,6-диен-3-оне и в WO 2002000681 сообщалось о 4-изопропил-17 гидроксиандрост-4-ен-3-оне. Соединения общей формулы (II), в которой символы R4, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет простую связь, и другие символы имеют значения, определенные выше, и R3 является атомом фтора, можно получить из соединений общей формулы(II), в которой R3 представляет атом водорода, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием соответствующего 2-енол-3-сложного эфира сCF3OF, 2-енол-3-простого эфира с FClO3 или 2-енол-3-силилэфира с трифлатом N-фторпиридиния при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой символы R4, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет простую связь, другие символы имеют значения, определенные выше, и R3 является атомом хлора, можно получить из соединений общей формулы(II), в которой R3 представляет атом водорода, с использованием одного из способов, описанных в литературе, например взаимодействием с t-BuOCl или ацетилхлоридом и MnO2 в уксусной кислоте при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой символы R4, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет простую связь, другие символы имеют значения, определенные выше, и R3 является атомом брома, можно получить из соединений общей формулы(II), в которой R3 представляет атом водорода, с использованием одного из способов, описанных в литературе, например взаимодействием с бромом в уксусной кислоте, бромидом пиридиния пербромом в уксусной кислоте, PhSeBr в EtOAc или из соответствующего 2-енол-3-простого эфира с NBS в третBuOH в присутствии кислоты, такой как H2SO4, при температуре в пределах от -78 до температуры рефлюкса. Соединения общей формулы (II), в которой символы R4, R5, R6, R7, R8, R9 имеют значения, определенные выше, символы в положениях 4 и 5 представляют простые связи, другие символы имеют значения, определенные выше, и R3 является гидрокси, можно получить из соединений общей формулы(II), замещенных 2- или 2-бромом, с использованием одного из способов, описанных в литературе,например взаимодействием с основанием, таким как K2CO3, Na2CO3, NaOH, KOH, в воде и органическом растворителе, или гидросульфатом тетрабутиламмония в органическом растворителе, или из соединений общей формулы (II), в которой R3 представляет атом водорода, с Pb(ОАс)4 необязательно в присутствии кислоты Льюиса, такой как BF3, или взаимодействием соединения общей формулы (II) через его соответствующий 2-енол-3-силилэфир, с м-хлорпербензойной кислотой с последующим гидролизом кислотой или фторидным ионом при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой символы R3, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет двойную связь, другие символы имеют значения, определенные выше, R4 является атомом фтора и R5 отсутствует, можно получить из соединений общей формулы (II), в которой R4 представляет Bu3Sn, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с Cs2CO3 и фтором при температуре в пределах от -78 С до температуры рефлюкса. Соединения, в которых R4 представляет н-Bu3Sn, можно получить из соответствующих соединений общей формулы (II), в которых R4 является атомом брома. Соединения общей формулы (II), в которой R3, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет двойную связь, другие символы имеют значения, определенные выше, R4 является атомом хлора и R5 отсутствует, можно получить из соединений общей формулы (II), в которой R4 представляет атом водорода, с использованием одного из способов, описанных в литературе, например взаимодействием с SOCl2 в пиридине, или из соединений общей формулы-7 017497 Соединения общей формулы (II), в которой R3, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет двойную связь, другие символы имеют значения, определенные выше, R4 является атомом брома и R5 отсутствует, можно получить из соединений общей формулы (II), в которой R4 представляет атом водорода, R5 и R6, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов, описанных в литературе, например взаимодействием с бромом и органическим основанием, таким как пиридин или s-коллидин в уксусной кислоте, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R5, R6, R7, R8, R9 имеют значения, определенные выше, символ в положении 4 представляет двойную связь, другие символы имеют значения, определенные выше, R4 является гидрокси и R5 отсутствует, можно получить из соединений общей формулы (II), в которой R4 представляет атом водорода, R5 и R6, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов, описанных в литературе, например взаимодействием с сильной кислотой, такой как HCl или H2SO4, или с основанием, таким как NaOH или KOH, затем с кислотой и в органическом растворителе, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символ в положении 5 представляет двойную связь, другие символы имеют значения, определенные выше, и R4 или R5 являются атомом фтора, можно получить из соединений общей формулы (II), в которой R4 и R5 представляют атом водорода или R4 и R5 представляют соответственно атом водорода иC1-C6, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием соответствующего 3,5-диенол-3-силилэфира с трифлатом N-фторпиридиния, 3,5-диен-3 амина с FClO3, при температуре в пределах от -78 С до температуры рефлюкса смеси; или из соединений общей формулы (II), в которой R4 и R5 представляют атом водорода, символ в положении 5 является двойной связью, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с сильным основанием, таким как LDA, KH или NaH, с последующим добавлением FClO3 или N-фтор-бис-(фенилсульфонил)амина, при температуре в пределах от -78 С до температуры рефлюкса; или из соединений общей формулы (II), в которой R4 и R5 представляют атом водорода или R4 и R5 представляют соответственно атом водорода или C1-C6-алкил, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием соответствующего 3 кетопроизводного с селектфтором в растворителе, таком как ацетонитрил, изопропанол, при температуре в пределах от 0 С до температуры рефлюкса смеси. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символы в положениях 4 и 5 представляют простые связи, другие символы имеют значения, определенные выше, один из R4 и R5 является атомом фтора, другой представляет C1-C6-алкил или Н, можно получить из соединений общей формулы (II), в которой один из R4 и R5 представляет Н, другой представляет Н или C1-C6-алкил, с использованием одного из способов, описанных в литературе для таких реакций,например взаимодействием соответствующего 3-енолсилилэфира с трифлатомN-фторпиридиния, 3-енамина с FClO3, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой символы R3, R7, R8, R9 имеют значения, определенные выше, R6 является гидрокси, символы имеют значения, определенные выше, и R4 и R5 являются атомом фтора, можно получить из соединений общей формулы (II), в которой R4 представляет атом водорода, R5 и R6, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с н-Bu4NF, KF, CsF, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символы в положениях 4 и 5 представляют простые связи, другие символы имеют значения, определенные выше, R4 или R5 являются атомом хлора или один из R4 и R5 представляет Н, другой являетсяC1-C6-алкилом, можно получить из соединений общей формулы (II), в которой R4 или R5 представляют атом водорода или один из R5 и R6 представляет Н, другой является C1-C6-алкилом, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с t-BuOCl,необязательно в присутствии HCl, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символы в положениях 4 и 5 представляют простые связи, другие символы имеют значения, определенные выше, R4 или R5 являются атомом брома или один из R4 и R5 представляет Н, другой является C1-C6-алкилом, можно получить из соединений общей формулы (II), в которой R4 или R5 представляют атом водорода или один из R5 и R6 представляет Н, другой является C1-C6-алкилом, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с бромом в уксусной кислоте, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символ в положении 5 представляет двойную связь, другие символы имеют значения, определенные выше, и R4 или R5 являются гидрокси или один из R4 и R5 представляет ОН, другой являетсяC1-C6-алкилом, можно получить из соединений общей формулы (II), в которой R4 или R5 представляют атом водорода или один из R5 и R6 представляет Н, другой является C1-C6-алкилом, с использованием-8 017497 одного из способов, описанных в литературе для таких реакций, например взаимодействием с Pb(ОАс)4 в АсОН, с последующим гидролизом промежуточного ацетата, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 имеют значения, определенные выше,символы в положениях 4 и 5 представляют простые связи, другие символы имеют значения, определенные выше, R4 является гидрокси и R5 представляет Н или C1-C6-алкил, можно получить из соответствующих соединений общей формулы (II), в которой R4 является атомом водорода илиC1-C6-алкилом, символ в положении 4 представляет двойную связь, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с бораном, таким как диборан, или его комплексами с тетрагидрофураном, диметиламином или диметилсульфидом,9-борабициклононаном, диизопинокамфенилбораном, диизоамилбораном, в эфирном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой щелочным водным раствором пероксида водорода или перборатом натрия. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 представляет C1-C6-алкил, связь в положении 4 является двойной связью, можно получить из соединений общей формулы (II), в которой R4 представляет атом водорода, связь в положении 4 представляет двойную связь, с использованием одного из реагентов, описанных в литературе для таких реакций, например обработкой основанием, например, таким как гидрид натрия или калия,метилат натрия или калия, трет-бутилат натрия или калия, диизопропиламид лития, амид натрия, амид лития, в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, N,N-диметилформамид, диметилсульфоксид, t-BuOH, жидкий аммиак или их смеси, при температуре в пределах от -78 С до температуры рефлюкса, с последующим гашением C1-C6-алкил-LG, где LG представляет уходящую группу, например, такую как хлор, бром, йод, мезилокси, трифторметансульфонилокси, п-толуолсульфонилокси, при температуре в пределах от -78 С до температуры рефлюкса. Также реакцию можно проводить в дихлорметане, хлорбензоле, толуоле, гексане и воде или их смесях, в присутствии гидроксида натрия или калия или соли четвертичного аммония, например, такой как хлорид,или бромид, или йодид, или гидросульфат тетрабутиламмония, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 и R5 являются одинаковыми и представляют C1-C6-алкил, когда связь в положении 5 представляет двойную связь, можно получить из соединений общей формулы (II), в которой R4 является атомом водорода, когда связь в положении 4 представляет двойную связь, с использованием одного из способов, описанных выше, с избытком C1-C6-LG. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 является C1-C6-алкилом и R5 представляет метил или этил, R4 и R5 являются различными алкильными группами, связь в положении 5 представляет двойную связь, можно получить из в положении 4 предсоединений общей формулы (II), в которой R4 является C1-C6-алкилом, связь ставляет двойную связь, с использованием одного из способов, описанных выше, с метил-LG или этилLG, где LG является уходящей группой, имеющей значения, определенные выше, или из соединений общей формулы (II), в которой R4 представляет метил или этил, связь в положении 4 представляет двойную связь, с использованием одного из способов, описанных выше, соответственно с этил-LG или метил-LG. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 и R5, взятые вместе, образуют спироциклопропан, связь в положении 5 представляет двойную связь, можно получить из соединений общей формулы (II), в которой R4 является атомом водорода и R5 отсутствует, связь в положении 4 представляет двойную связь, с использованием одного из способов, описанных выше, с 1,2-дибромэтаном, или 1,2-дийодэтаном, или 1,2-дихлорэтаном в качестве алкилирующих реагентов. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 и R5, взятые вместе, образуют спироциклопентан, связь в положении 5 представляет двойную связь, можно получить из соединений общей формулы (II), в которой R4 является атомом водорода, и R5 отсутствует, связь в положении 4 представляет двойную связь, с использованием одного из способов, описанных выше, с 1,4-дигалогенбутаном в качестве алкилирующего реагента, где галогены могут представлять бром, хлор или йод. Соединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы имеют значения, определенные выше, R4 и R5, взятые вместе, образуют спироциклопропан, можно получить из соответствующего, подходящим образом защищенного 3-гидроксипроизводного, 4-кетопроизводного взаимодействием с галогенидом метилтрифенилфосфония в аналогичных реакционных условиях, описанных выше для соединений общей формулы (IV) или (V), с получением соответствующего 4-метиленового производного и последующим взаимодействием последнего соединения с одним из реагентов, описанных в литературе для таких реакций, например дийодметаном или диэтилоловом или сплавом олово-медь.-9 017497 имеют значения, опреСоединения общей формулы (II), в которой R3, R6, R7, R8, R9 и символы деленные выше, один из R4 и R5 представляет гидрокси, другой является C1-C6-алкилом, можно получить из соответствующих, подходящим образом защищенных 3-гидроксипроизводных, 4-кетопроизводных взаимодействием с C1-C6-алкил-MetY, где Met представляет атом металла и Y либо отсутствует, либо является атомом галогена или атомом другого металла в зависимости от состояния окисления атома металла Met, например, такого как Li, MgCl, MgBr, MgI, ZnCl и CuLi, в эфирном растворителе, при температуре в пределах от -78 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R8, R9 и символы имеют значения, определенные выше, R5 и R6 или R6 и R7, взятые вместе, образуют оксирановое кольцо, можно получить из соединений общей формулы (II), в которой R5 и R6 или R6 и R7 являются атомами водорода, когда связь соответственно в положении 4 или в положении 5 андростанового скелета представляет двойную связь, с использованием одного из реагентов, описанных в литературе для таких реакций, например, таких как пербензойная кислота, м-хлорпербензойная кислота, перфталат магния, перфталевая кислота, перуксусная кислота или пероксид водорода и гидроксид натрия в ацетонитриле. Соединения общей формулы (II), в которой R3, R4, R8, R9 и символы имеют значения, определенные выше, R5 и R6 или R6 и R7, взятые вместе, образуют циклопропановое кольцо, можно получить из соединений общей формулы (II), в которой связь соответственно в положении 4 или 5 представляет двойную связь, с использованием одного из реагентов, описанных в литературе для таких реакций, например, таких как дийодметан или диэтилолово или сплав олово-медь, йодид триметилсульфония и сильное основание. Соединения общей формулы (II), в которой R3, R7, R8, R9 имеют значения, определенные выше,один из R4 и R5 является атомом водорода, другой представляет Н или C1-C6-алкил, символы имеют значения, определенные выше, и R6 представляет OR10, где R10 является атомом водорода, можно получить из соединений общей формулы (II), в которой R4 представляет Н или C1-C6-алкил, R5 и R6, взятые вместе, или R6 и R7, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов,описанных в литературе для таких реакций, например восстановлением LiAlH4, LiBH4, Li(С 2 Н 5)3H в эфирном растворителе, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R5, R6, R8,R9 и символы имеют значения, определенные выше, и R7 представляет OR14, где R14 является атомом водорода, где связи в положениях 4, 5, 6 и 7 представляют простые связи, можно получить из соединений общей формулы (II), в которой связь вположении 5 представляет двойную связь, и R7 является атомом водорода, с использованием одного из способов, описанных в литературе для таких реакций, например взаимодействием с бораном,таким как диборан, или его комплексами с тетрагидрофураном, диметиламином или диметилсульфидом,9-борабициклононаном, диизопинокамфенилбораном, диизоамилбораном, в эфирном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой щелочным водным раствором пероксида водорода или перборатом натрия. имеют значения, опреСоединения общей формулы (II), в которой R3, R4, R5, R8, R9 и символы деленные выше, R6 и R7 являются соответственно OR10 и OR14, где R10 и R14 представляют атом водорода,можно получить из соединений общей формулы (II), в которой связь в положении 5 представляет двойную связь, и R7 представляет атом водорода, с использованием одного из способов, описанных в литературе для таких реакций, например, с OsO4, KMnO4, H2O2 и муравьиной, уксусной или перуксусной кислотой с последующим гидролизом промежуточного соединения, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R5, R8, R9 и символы имеют значения, определенные выше, и R6 и R7 являются соответственно OR10 и OR14, где R10 и R14 представляют атом водорода, можно получить из соединений общей формулы (II), в которой R6 и R7, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов, описанных в литературе для таких реакций,например кислотным или щелочным гидролизом, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R5, R8, R9 и символы имеют значения, определенные выше, и R6 является OR10, где R10 представляет атом водорода, и R7 представляет О, в значении кетогруппы, можно получить из соединений общей формулы (II), в которой R6 и R7, взятые вместе, образуют оксирановое кольцо, с использованием одного из способов, описанных в литературе для таких реакций, например окислением CrO3 в пиридине или в присутствии кислоты, такой как H2SO4, в ацетоне или уксусной кислоте, в присутствии воды, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R5, R6, R8, R9 и символы имеют значения,определенные выше, и R7 является OR14, где R14 представляет атом водорода, когда связи в положениях 4, 5, 6 и 7 представляют простые связи, можно получить из соединений общей формулы (II), в которой R7 представляет О, имеющий значение кетона, восстановлением комплексным гидридом, например,таким как NaBH4, необязательно в присутствии кислоты Льюиса, например, CeCl3, в спиртовом или эфирном растворителе, или LiAlH4 в эфирном растворителе, LiBH4 или LiAl(tBuO)3H или металлом, та- 10017497 ким как, например, натрий, в спиртовом растворителе, при температуре в пределах от 0 С до температуры рефлюкса. имеют значения, опСоединения общей формулы (II), в которой R3, R4, R5, R6, R8, R9 и символы ределенные выше, R7 представляет О, в значении кетогруппы, можно получить из соединений общей формулы (II), в которой R7 представляет OR14, где R14 является атомом водорода, где связь, соединяющая атом углерода в положении 6 андростанового скелета с R7, представляет простую связь, с использованием одного из способов, описанных в литературе, например окислением одним из реагентов,описанных в литературе для таких реакций окисления, например йодоксибензойной кислотой, периодинаном Десс-Мартина, оксалилхлоридом и триэтиламином и диметилсульфоксидом в метиленхлориде,CrO3 в пиридине или в серной кислоте и ацетоне, хлорхроматом пиридиния, дихроматом пиридиния или хромным ангидридом в смеси серная кислота/ацетон. Соединения общей формулы (II), в которой R3, R4, R5, R6, R8, R9 и символы имеют значения, определенные выше, в которой связь в положении 5 представляет двойную связь, и R8 представляет О,в значении кетогруппы, можно получить из соединений общей формулы (II), в которой связь, соединяющая атом углерода в положении 7 андростанового скелета с R8, представляет простую связь, и R8 является атомом водорода, с использованием одного из способов, описанных в литературе для таких реакций, например окислением одним из реагентов, описанных в литературе для таких реакций окисления,например Na2Cr2O7 в уксусной кислоте в присутствии уксусного ангидрида; кислородом или воздухом иN-гидроксифталимидом, необязательно в присутствии уксусного ангидрида и пербензойного ангидрида,или ультрафиолетового света или окислителя, такого как кислород и соли трехвалентного железа, в присутствии органической соли четвертичного аммония; кислородом в присутствии индуктора радикалов,например AIBN, с последующей обработкой уксусным ангидридом и пиридином; трет-BuOOH необязательно в присутствии других окислителей, таких как CrO3, KMnO4, Mn3O(OAc)9, Mn(OAc)3, RuCl3 и необязательно катализатора фазового переноса на основе четвертичного аммония; KHSO5 в гомогенной фазе или системе фазового переноса. Соединения общей формулы (I), в которой R3, R4, R5, R6, R7, R9 и символы имеют значения, определенные выше, в которой связь в положении 5 представляет двойную связь, и R8 является OR14,где R14 является атомом водорода, можно получить из соединений общей формулы (II), в которой связь, соединяющая атом углерода в положении 7 андростанового скелета с R8, представляет простую связь и R8 является атомом водорода, с использованием одного из способов, описанных в литературе для таких реакций, например окислением, например кислородом в присутствии сенсибилизаторов, например бенгальского розового, или индуктора радикалов, например AIBN, с последующим восстановлением комплексным гидридом металла; солями двухвалентного железа; кислородом и солями трехвалентного железа в присутствии органической соли четвертичного аммония; трет-бутилпербензоатом и Cu2Br2; трет-BuOCl, Н 2 О 2 и солями трехвалентного железа; перуксусной кислотой и перхлоратом железа (III) илиNa2Cr2O7 в уксусной кислоте в присутствии уксусного ангидрида. имеют значения, опСоединения общей формулы (II), в которой R3, R4, R5, R6, R7, R9 и символы ределенные выше, в которой связь в положении 4 представляет простую связь, связь в положении 5 представляет простую или двойную связь и R8 является OR14, где R14 представляет атом водорода,можно получить из соединений общей формулы (II), в которой R8 представляет атом кислорода, в значении кетогруппы, с использованием одного из способов, описанных в литературе, например восстановлением комплексным гидридом, например, таким как NaBH4, необязательно в присутствии кислоты Льюиса, например CeCl3, в спиртовом или эфирном растворителе, или LiAlH4 в эфирном растворителе, LiBH4 или металлом, таким как, например, натрий, в спиртовом растворителе, при температуре в пределах от 0 С до температуры рефлюкса. Соединения общей формулы (II), в которой R3, R4, R5, R6, R7, R9 и символы имеют значения, определенные выше, и R8 представляет О, в значении кетогруппы, можно получить из соединений общей формулы (II), в которой связь, соединяющая атом углерода в положении 7 с R8, представляет про 8 14 стую связь и R представляет OR , где R14 является атомом водорода, с использованием одного из реагентов, описанных в литературе для таких реакций окисления, например, йодоксибензойной кислоты,периодинана Десс-Мартина, оксалилхлорида и триэтиламина и ДМСО, CrO3 в пиридине или в серной кислоте и ацетоне, хлорхромата пиридиния или дихромата пиридиния. Соединения общей формулы (II), в которой один из R7 и R8 представляет C1-C6-алкил, другой является О, имеющим значение кетогруппы, можно получить из соответствующих соединений общей формулы (II), в которой один из R7 и R8 представляет атом водорода, другой является О, имеющим значение кетогруппы, обработкой основанием, например, таким как NaH, KH, NaOMe, NaOtBu, KOtBu или LDA, в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, диметилсульфоксид или их смеси, при температуре в пределах от -78 С до температуры рефлюкса, с последующим гашением C1-C6-алкил-LG, где LG представляет уходящую группу, например хлор, бром, йод,мезилокси, п-толуолсульфонилокси, трифторметансульфонилокси, при температуре в пределах от -78 С до температуры рефлюкса. Также реакцию можно проводить в дихлорметане, хлорбензоле, толуоле, гексане, воде или их смесях, в присутствии NaOH или КОН и соли четвертичного аммония, например, такой- 11017497 как хлорид, или бромид, или йодид, или гидросульфат тетрабутиламмония, при температуре в пределах от 0 С до температуры рефлюкса. С использованием аналогичных реакций, описанных выше, соединения общей формулы (II), в которой R6 представляет OR10, где R10 является C1-C6-алкилом, можно получить обработкой соответствующих соединений общей формулы (II), в которой R6 представляет гидрокси, соединениями общей формулы C1-C6-алкил-LG, где LG имеет значения, определенные выше. С использованием аналогичных реакций, описанных выше, соединения общей формулы (II), в которой R7 и R8 независимо представляют OR14, где R14 является C1-C6-алкилом, можно получить обработкой соответствующих соединений общей формулы (II), в которой R7 и R8 представляют гидрокси, соединениями общей формулы C1-C6-алкил-LG, где LG имеет значения, определенные выше. С использованием аналогичных реакций, описанных выше, соединения общей формулы (II), в которой R9 представляет C1-C6-алкил, можно получить обработкой соединений общей формулы (II), в которой R9 представляет атом водорода, соединениями общей формулы C1-C6-алкил-LG, где LG имеет значения, определенные выше. Соединения общей формулы (II), в которой один из R7 и R8 представляет гидроксиметил, другой является атомом кислорода, имеющим значение кетогруппы, и символы в положениях 4 и 5 представляют простые связи, можно получить из соответствующих соединений общей формулы (II), в которой один из R7 и R8 представляет атом водорода, другой является О, обработкой основанием, например,таким как NaH, KH, NaOtBu, KOtBu, LDA, в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, диметилсульфоксид, толуол или их смеси, при температуре в пределах от -78 С до температуры рефлюкса, с последующим гашением параформальдегидом или триоксаном или алкилированием параформальдегидом или триоксаном в присутствии кислоты Льюиса, такой как триметилалюминий, необязательно в присутствии лиганда, такого как 2,6-дифенилфенол. Соединения общей формулы (II), в которой R6 представляет OR10, R10 являетсяC2-C7-алкилкарбонилом, можно получить обработкой соответствующих соединений общей формулы (II),в которойC2-C7-алкилкарбонилгалогенидом или C4-C14-алкилкарбонильным ангидридом в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, N,N-диметилформамид, диметилсульфоксид, дихлорметан, пиридин или их смеси, при температуре в пределах от -78 С до температуры рефлюкса, необязательно в присутствии основания, например, такого как триэтиламин, пиридин,4- диметиламинопиридин. Также аналогичную реакцию можно провести с соответствующейC2-C7-карбоновой кислотой в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран,1,2-диметоксиэтан, толуол, ацетон, этилацетат, дихлорметан, хлороформ, N,N-диметилформамид, диметилсульфоксид, вода или их смеси, при температуре в пределах от -30 С до температуры рефлюкса, в присутствии конденсирующего реагента,такого какN,N'-дициклогексилкарбодиимид,N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид, или C2-C7-карбоновую кислоту можно предварительно обработать SOCl2, POCl3 или PCl5 и затем подвергнуть взаимодействию с описанным выше соединением общей формулы (II) необязательно в присутствии основания, например, такого какNaOH, KOH, Na2CO3, K2CO3, NaHCO3, KHCO3, триэтиламин, пиридин или 4-диметиламинопиридин. С использованием аналогичных реакций, описанных выше, соединения общей формулы (II), в которой R7 и/или R8 представляют OR14, где R14 является C2-C7-алкилкарбонилом, можно получить обработкой соответствующих соединений общей формулы (II), в которой R7 и/или R8 соответственно представляют гидрокси, символы в положениях 4 и 5 представляют простые связи, соединениями общей формулы C2-C7-алкилкарбонилгалогенид или C4-C14-алкилкарбонилангидрид или C2-C7-карбоновая кислота. С использованием аналогичных реакций, описанных выше, соединения общей формулы (II), в которой R9 представляет C2-C7-алкилкарбонил, можно получить обработкой соединений общей формулы(II), в которой R9 представляет Н, соединениями общей формулы C2-C7-алкилкарбонилгалогенид илиC4-C14-алкилкарбонилангидрид или C2-C7-карбоновая кислота. Соединения общей формулы (II), в которой R7 и/или R8 представляют ONO2, можно получить обработкой соединений общей формулы (II), в которой соответственно R7 и/или R8 представляют гидрокси, в которой символ в положении 5 представляет простую связь, азотной кислотой в уксусном ангидриде или уксусной кислоте, азотной кислотой и серной кислотой в дихлорметане, нитрозилфторидом или тетрафторборатом в ацетонитриле. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют NOR11, можно 7 8 получить обработкой соединений общей формулы (II), в которой один или оба R и R представляют атом кислорода, в значении кетогруппы, соединениями общей формулы H2NOR11, где R11 имеет значения, определенные выше, в виде свободного основания или соли, например, такой как гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол,N,N-диметилформамид, пиридин, вода и их смеси, при температуре в пределах от 0 С до температуры рефлюкса. Реакцию можно проводить в присутствии основания, такого как гидроксид натрия или калия,карбонат натрия или калия, бикарбонат натрия или калия, или кислоты, такой как соляная кислота, бро- 12017497 мисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, динатрий или дикалий гидрофосфат, натрия или калия дигидрофосфат.OR11,Соединения общей формулы (II), в которой один или оба R7 и R8 представляют N 11 где R является C2-C7-алкилкарбонилом или C1-C6-алкилом, можно получить обработкой соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют NOR11,11 где R является атомом водорода, соединениями общей формулы C2-C7-алкилкарбонилгалогенид илиC4-C14-алкилкарбонилангидрид, или C2-C7-карбоновая кислота с последующим ацилированием в условиях, описанных выше, или соединениями общей формулы C1-C6-алкил-LG с последующим алкилированием в условиях, описанных выше. Соединения общей формулы (II), в которой один или оба R7 и R8 независимо представляют CR12R13,можно получить взаимодействием соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют атом кислорода, в значении кетогруппы, с соединениями общей формулы (IV) или (V), описанными выше, в аналогичных условиях, описанных для соединений общей формулы (IV) или (V). Соединения общей формулы (II), в которой один или оба R7 и R8 представляют гидроксиметил,можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют CR12R13, где R12 или R13 являются атомами водорода, с использованием одного из способов, описанных в литературе, например взаимодействием с бораном, таким как диборан, или его комплексами с диметиламином, диметилсульфидом, 9-борабициклононаном, диизопинокамфенилбораном или диизоамилбораном, в эфирном растворителе, например, таком как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой щелочным водным раствором пероксида водорода или перборатом натрия. С использованием аналогичных способов также можно получить соединения общей формулы (II), в которой один или оба R7 и R8 представляют гидроксиэтил, из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 являются винилом. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют винил, можно получить взаимодействием соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют СНО, с хлоридом, или бромидом, или йодидом метилтрифенилфосфония, с использованием аналогичных реакционных условий, описанных для соединений общей формулы (IV) или (V). Соединения общей формулы (II), в которой один или оба R7 и R8 представляют этинил, можно получить взаимодействием соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют СНО, с хлоридом, или бромидом, или йодидом метилтрифенилфосфония и н-бутиллитием при температуре в пределах от -78 С до комнатной температуры, с последующей дополнительной обработкой н-бутиллитием. Соединения общей формулы (II), в которой заместители R7 и R8 независимо представляютC1-C6-алкильные группы, можно получить из соединений общей формулы (II), в которой R7 и R8, где R7 иR8 являются одинаковыми или различными, представляют CR12R13, где R12 и R13 представляют атом водорода или C1-C5-алкильные группы, с использованием одного из способов, описанных в литературе для таких реакций, например каталитическим гидрированием, в реакционных условиях, описанных выше для аналогичных превращений соединений общей формулы (I). Соединения общей формулы (II), в которой R7 и R8 независимо представляют C1-C6-алкильные группы, в частности метил или этил, можно получить из соединений общей формулы (II), в которой R7 иR8, где R7 и R8 являются одинаковыми или различными, представляют гидроксиметил или 2-гидроксиэтил, с использованием одного из способов, описанных в литературе для таких реакций, например обработкой мезил- или тозилхлоридом, в присутствии основания, с последующим восстановлением гидридом, например, таким как боргидрид натрия или алюмогидрид лития, или деоксигенированием с использованием одного из способов, описанных в литературе для такого вида реакций, например взаимодействием с тиокарбонилдиимидазолом и три-н-бутилстаннаном, дисульфидом углерода в присутствии основания, с последующим взаимодействием с метилйодидом и последующей обработкой трин-бутилстаннаном, NaBH3CN и ZnI2, NaBH4 в уксусной кислоте. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют COOR15, где R15 является атомом водорода, можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют гидроксиметил, окислением с использованием одного из реагентов,описанных в литературе для таких реакций окисления, например, таких как йодоксибензойная кислота,периодинан Десс-Мартина, оксалилхлорид и триэтиламин и диметилсульфоксид в метиленхлориде, CrO3 в пиридине или в серной кислоте и ацетоне, хлорхромат пиридиния, дихромат пиридиния, с получением промежуточного альдегида, в котором соответственно один или оба R7 и R8 представляют СНО, с последующим дополнительным окислением в карбоновую кислоту с использованием одного из реагентов,описанных в литературе для таких реакций окисления, например, таких как перманганат калия, хромовый ангидрид в смеси серная кислота/ацетон, дихромат пиридиния в N,N-диметилформамиде.- 13017497 Соединения общей формулы (II), в которой один или оба R7 и R8 представляют COOR15, где R15 является C1-C6-алкильной группой, можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют СООН, обработкой диазометаном, триметилсилилдиазометаном или соединением общей формулы R15OH, с использованием одного из способов, описанных в литературе для таких превращений, например конденсацией в присутствии конденсирующего реагента, такого как N,N'-дициклогексилкарбодиимид или N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид, или соединения общей формулы (II) можно предварительно обработать SOCl2, POCl3, PCl5 и затем подвергнуть взаимодействию с соединением общей формулы R15OH необязательно в присутствии основания, например, такого как триэтиламин, пиридин или 4-диметиламинопиридин. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют NHCHO, можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляютOR11, где R11 является атомом водорода, с использованием одного из способов, описанных в литературе для таких реакций восстановления, например обработкой алюмогидридом лития, каталитическим гидрированием натрием, или литием, или магнием в спирте с получением соответствующего амина, в котором R7 и R8 представляют NH2, с последующим формилированием муравьиной кислотой в присутствии конденсирующего реагента, например, такого как N,N'-дициклогексилкарбодиимид илиN-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид, или необязательно в присутствии основания, например, такого как триэтиламин, пиридин или 4-диметиламинопиридин. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют спирооксиран, можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют CR12R13, где R12 и R13 являются атомами водорода, с использованием одного из реагентов, описанных в литературе для таких реакций, например пербензойной кислоты, м-хлорпербензойной кислоты,перфталата магния, перфталевой кислоты, перуксусной кислоты или пероксида водорода и гидроксида натрия в ацетонитриле. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют спирооксиран, можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют О, в значении кетогруппы, с использованием одного из реагентов, описанных в литературе для таких реакций, например йодида триметилсульфония или йодида триметилсульфоксония в присутствии основания, такого как гидрид натрия, метилат натрия или трет-бутилат калия. Соединения общей формулы (II), в которой один или оба R7 и R8 представляют спироциклопропан,можно получить из соединений общей формулы (II), в которой соответственно один или оба R7 и R8 представляют CR12R13, где R12 и R13 являются атомами водорода, с использованием одного из реагентов,описанных в литературе для таких реакций, например, таких как дийодметан или диэтилолово или сплав олово-медь. Соединения общей формулы (II), в которой символы R3, R4, R5, R6, R7, R8, R9 и имеют значения,определенные выше, и по меньшей мере один представляет простую связь, можно получить восстановлением соответствующих соединений общей формулы (II), в которой соответствующий символ представляет двойную связь, каталитическим гидрированием, с использованием газообразного водорода или в условиях переноса водорода, в присутствии металлического катализатора, такого как Pd/C, PtO2, Pt,Pt/C или никель Ренея. В качестве реагента для переноса водорода можно использовать формиат аммония, гипофосфит аммония или циклогексадиен. Реакцию можно проводить в растворителе,например, таком как этанол, метанол, этилацетат, диоксан, тетрагидрофуран, уксусная кислота,N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0 С до температуры рефлюкса, под давлением в пределах от атмосферного давления до 10 атм. В зависимости от субстрата и используемых условий гидрирование может избирательно воздействовать на одну или более двойных связей. Также восстановление можно провести натрием, литием, калием или кальцием в жидком аммиаке, метиламине или этиламине, необязательно в присутствии тетрагидрофурана или диэтилового эфира, при температуре в пределах от -30 С до температуры рефлюкса растворителя или смеси. Соединения общей формулы (III)-(V) являются промышленно доступными или их можно получить из промышленно доступных соединений с использованием стандартных методов. Во всех указанных превращениях любую интерферирующую реакционноспособную группу можно защитить и затем снять защиту согласно хорошо известным методам, описанным в органической химии(см., например, T.W. Greene and P.G.M. Wuts "Protective Groups in Organic Synthesis", J. WileySons,Inc., 3th Ed., 1999) и хорошо известным специалистам в данной области. Все указанные превращения представляют собой только примеры хорошо известных методов, описанных в органической химии (см., например, J. March "Advanced Organic Chemistry", J. WileySons,Inc., 4th Ed., 1992) и хорошо известных специалистам в данной области. Заявители установили, что производные (I) и их фармацевтически приемлемые соли, полученные по изобретению, являются пригодными средствами для лечения сердечно-сосудистых нарушений, таких как сердечная недостаточность и гипертензия.- 14017497 Фармацевтические композиции будут содержать по меньшей мере одно соединение формулы (I) в качестве активного ингредиента в количестве, достаточном для обеспечения значимого терапевтического эффекта. Композиции, входящие в объем настоящего изобретения, являются вполне традиционными, и их получают способами, которые обычно применяются в фармацевтической промышленности, например, описанными в Remington's Pharmaceutical Science Handbook, Mack Pub., N.Y. - самое последнее издание. В зависимости от выбранного пути введения композиции будут находиться в твердой или жидкой форме, подходящей для перорального, парентерального или внутривенного введения. Композиции по настоящему изобретению содержат, наряду с активным ингредиентом, по меньшей мере один фармацевтически приемлемый носитель или наполнитель. Они могут представлять особенно пригодные для формуляции соадъюванты, например солюбилизирующие агенты, диспергирующие агенты и эмульгаторы. Для любого соединения терапевтически эффективную дозу можно установить первоначально в тестах на культуре клеток или на моделях на животных, обычно мышах, крысах, морских свинках, кроликах, собаках или поросятах. Также модель на животных можно использовать для определения соответствующих пределов концентраций и пути введения. Затем данную информацию используют для установления подходящих доз и путей введения у людей. Точная эффективная доза для человека будет зависеть от тяжести заболевания, общего состояния здоровья у субъекта, возраста, массы тела и пола субъекта, рациона, времени и кратности введения, комбинации(й) лекарственных средств, чувствительности и толерантности/ответа на терапию. Данное количество можно определить обычным экспериментированием, и это может сделать клиницист. Как правило, эффективная доза будет находиться в пределах от 0,001 до 10 мг/кг, предпочтительно от 0,005 до 5 мг/кг. Композиции можно вводить пациенту самостоятельно или можно вводить в сочетании с другими средствами, препаратами или гормонами. Лекарственное средство также может содержать фармацевтически приемлемый носитель для введения лекарственного средства. Такие носители включают антитела и другие полипептиды, гены и другие лекарственные средства, такие как липосомы, при условии, что носитель сам по себе не будет индуцировать продукцию антител, оказывающих отрицательное влияние на организм субъекта, получающего композицию, и который можно вводить без проявления высокой токсичности. Подходящие носители могут представлять собой крупные, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Подробное обсуждение фармацевтически приемлемых носителей имеется в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J., 1991). Фармацевтически приемлемые носители в лекарственных композициях могут дополнительно включать жидкости, такие как вода, физиологический раствор, глицерин и этанол. В таких композициях могут находиться вспомогательные вещества, такие как смачивающие вещества или эмульгаторы, забуферирующие рН вещества и т.п. Такие носители обеспечивают формуляцию фармацевтических композиций в таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, суспензии и т.п. для приема пациентом. После формулирования композиции по изобретению можно непосредственно вводить субъекту. Субъекты, которые подвергаются лечению, могут представлять собой животных; в частности, можно лечить людей. Лекарственное средство по данному изобретению можно вводить любыми путями, включая, не ограничиваясь этим, пероральный, внутривенный, внутримышечный, интраартериальный, интрамедуллярный, интратекальный, интравентрикулярный путь, трансдермальные или чрескожные аппликации, подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, сублингвальный, внутривагинальный или ректальный путь введения. Схема лечения может представлять собой схему с одной дозой или схему со многими дозами. Дополнительным объектом настоящего изобретения является применение указанного соединения общей формулы (I) для получения лекарственного средства, пригодного для лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность и гипертензия. Во всем мире гипертензией страдает примерно 30% населения в возрасте старше 60 лет, и она является ведущей причиной преждевременной заболеваемости и смертности в результате серьезных сердечно-сосудистых событий и сердечнососудистых осложнений на органы, таких как коронарное заболевание сердца, хроническая сердечная недостаточность, удар, почечная недостаточность, негативное сосудистое ремоделирование, повреждение сетчатки и когнитивные расстройства (Ritz E., Am. J. Cardiol., 2007, Aug. 6, 100 (3 А):53J-60J;Messerli F.H. et al., Lancet, 2007, Aug. 18, 370, 9587, 591-603). Еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие одно или более соединений формулы (I), описанных ранее, в сочетании с наполнителями и/или фармакологически приемлемыми разбавителями. Данные композиции могут содержать, вместе с соединениями формулы (I), известные активные соединения.- 15017497 Еще одним вариантом осуществления настоящего изобретения является способ получения фармацевтических композиций, отличающихся смешиванием одного или более соединений формулы (I) с подходящими наполнителями, стабилизаторами и/или фармацевтически приемлемыми разбавителями. Последующие примеры иллюстрируют изобретение, не ограничивая его. Сокращенные обозначения:TMS - тетраметилсилан; ТРАР - перрутенат тетрапропиламмония. Общие примечания: 1 Н-спектры записывали при 300 МГц на приборе Bruker, если не указано иначе. Значения химических сдвигов приведены в ppm и константы сочетания в герцах. Колоночную флэшхроматографию проводили с использованием силикагеля (Merck 230-400 меш). Пример 1.(Е)-3-(2-Аминоэтоксиимино)-4-метиландрост-4-ен-17-ол гидрохлорид (I-аа). К перемешиваемому раствору 4-метилтестостерона (203 мг) в диоксане (3,7 мл) быстро по каплям добавляли раствор 2-аминоэтоксиамина дигидрохлорида (259 мг) в воде (2 мл). Через 24 ч добавляли диоксан (20 мл) и насыщенный раствор соли (10 мл) и смесь перемешивали в течение 10 мин. Фазы разделяли и водную фазу экстрагировали диоксаном (2). Объединенные органические экстракты промывали насыщенным раствором соли, высушивали над MgSO4, фильтровали и упаривали досуха. Остаток растирали с Et2O в течение 5 ч и осадок отфильтровывали. Сырой продукт растворяли в воде и высушивали вымораживанием с получением указанного в заголовке соединения (I-аа) в виде белого твердого вещества (197 мг, выход 74%). 1(Е)-3-(2-Аминоэтоксиимино)-4,4-диметиландрост-5-ен-17-ол фумарат (I-ab). К перемешиваемому раствору 17-гидрокси-4,4-диметиландрост-5-ен-3-она (342 мг) в пиридине добавляли раствор 2-аминоэтоксиамина дигидрохлорида (707 мг). Через 4 ч раствор упаривали досуха при 100 С. Сырой продукт очищали флэш-хроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH и упаривали досуха с получением указанного в заголовке соединения I-ab (386 мг, выход 73%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):8,20 (ушир. с, 4 Н), 6,43 (с, 2 Н), 5,57 (м, 1 Н), 4,45(Е)-3-(2-Диметиламиноэтоксиимино)-4,4-диметиландрост-5-ен-17-ол фумарат (I-ас). Указанное в заголовке соединение получали с выходом 63% (467 мг), как описано в примере 2, начиная с 17-гидрокси-4,4-диметиландрост-5-ен-3-она (454 мг) и 2-диметиламиноэтоксиамина дигидрохлорида (547 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):6,50 (с, 2 Н), 5,56 (м, 2 Н), 4,45 (д, 1 Н), 4,06 (т, 2 Н),3,42 (м, 1 Н), 2,76 (м, 1 Н), 2,56 (м, 2 Н), 2,30-0,80 (м, 16 Н), 2,22 (м, 6 Н), 1,24 (с, 3H), 1,17 (с, 3H), 0,74 (с,3H), 0,63 (с, 3H).(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметиландрост-5-ен-17-ол фумарат (I-ad). Указанное в заголовке соединение получали с выходом 78% (347 мг), как описано в примере 2, начиная с 17-гидрокси-4,4-диметиландрост-5-ен-3-она (274 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 452 мг). 1TBAF в ТГФ (0,4 мл). После перемешивания при комнатной температуре в течение 1 ч раствор концентрировали и очищали флэш-хроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH и упаривали досуха. Остаток растирали с Et2O и осадок отфильтровывали с получением указанного в заголовке соединения 1-ае в виде белого твердого вещества (61 мг, выход 38%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):8,10 (ушир. с, 4 Н), 6,40 (с, 2 Н), 5,61 (м, 1 Н), 4,05 (т,2 Н), 2,95 (т, 2 Н), 2,84 (м, 1 Н), 2,45-0,89 (м, 16 Н), 1,27 (с, 3H), 1,20 (с, 3H), 0,79 (с, 3H), 0,77 (с, 3H). Пример 6.(пример 3, 157 мг) в DCM (8 мл) в атмосфере N2 добавляли NMO (56 мг), ТРАР (6 мг) и молекулярные сита 4 (250 мг). Смесь перемешивали в течение 1 ч и затем добавляли SiO2. Смесь очищали флэшхроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH и упаривали досуха с получением указанного в заголовке соединения I-af (142 мг, выход 86%). 1(Е)-3-(2-Аминоэтоксиимино)-4,4-диметиландростан-17-ол фумарат (I-ag). Указанное в заголовке соединение получали с выходом 87% (484 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (361 мг) и 2-аминоэтоксиамина дигидрохлорида(Е)-3-(2-N-Метиламиноэтоксиимино)-4,4-диметиландростан-17-ол фумарат (I-ah). Указанное в заголовке соединение получали с выходом 88% (194 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (139 мг) и 2-N-метиламиноэтоксиамина дигидрохлорида (получение 13, 213 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,44 (ушир. с, 2 Н), 6,60 (с, 2 Н), 4,14 (т, 2 Н),3,39 (т, 1 Н), 3,18 (м, 2 Н), 3,02 (м, 1 Н), 2,58 (т, 3H), 2,13-0,50 (м, 19 Н), 1,05 (с, 3H), 0,98 (с, 3H), 0,92 (с,3H), 0,60 (с, 3H). Пример 9.(Е)-3-(3-Аминопропоксиимино)-4,4-диметиландростан-17-ол фумарат (I-ai). Указанное в заголовке соединение получали с выходом 87% (352 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (211 мг) и 3-аминопропоксиамина дигидрохлорида(Е)-3-(3-N-Метиламинопропоксиимино)-4,4-диметиландростан-17-ол фумарат (I-aj). Указанное в заголовке соединение получали с выходом 69% (348 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (311 мг) и 3-метиламинопропоксиамина дигидрохлорида (получение 14, 519 мг). 1(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметиландростан-17-ол фумарат (I-ak). Указанное в заголовке соединение получали с выходом 87% (510 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (311 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 592 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,90 (ушир. с, 1 Н), 8,80 (ушир. с, 1 Н), 6,60(Е)-3-[3-(S)-Пирролидинил]оксиимино-4,4-диметиландростан-17-ол фумарат (I-al). Указанное в заголовке соединение получали с выходом 83% (181 мг), как описано в примере 2, начиная с 4,4-диметил-17-гидроксиандростан-3-она (133 мг) и 3-(S)-пирролидинилоксиамина дигидрохлорида (получение 15, 219 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,89 (ушир. с, 1 Н), 8,81 (ушир. с, 1 Н), 6,60(Е)-3-(2-Аминоэтоксиимино)-4,4-диметиландростан-17-он фумарат (I-am). Указанное в заголовке соединение получали с выходом 68% (187 мг), как описано в примере 5, начиная с 3-(Е)-2-[N-(9-флуоренилметоксикарбонил)]аминоэтоксиимино-4,4-диметиландростан-17-она(Е)-3-(3-Аминопропоксиимино)-4,4-диметиландростан-17-он фумарат (I-an). Указанное в заголовке соединение получали с выходом 63% (97 мг), как описано в примере 5, начиная с 3-(Е)-3-[N-(9-флуоренилметоксикарбонил)]аминопропоксиимино-4,4-диметиландростан-17 она (получение 3, 188 мг) и 1 М раствора TBAF в ТГФ (0,40 мл). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):7,66 (ушир. с, 3H), 6,60 (с, 2 Н), 3,99 (т, 2 Н),2,95 (м, 1 Н), 2,84 (м, 2 Н), 2,44-0,55 (м, 21 Н), 1,06 (с, 3H), 0,98 (с, 3H), 0,94 (с, 3H), 0,76 (с, 3H). Пример 15.(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметиландростан-17-он фумарат (I-ao). Указанное в заголовке соединение получали с выходом 57% (57 мг), как описано в примере 5, начиная с 3-(Е)-1-[N-(9-флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4-диметиландростан-17-она (получение 4, 120 мг) и 1 М раствора TBAF в ТГФ (0,44 мл). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,92 (ушир. с, 1 Н), 8,80 (ушир. с, 1 Н), 6,60(Е)-3-(2-Аминоэтоксиимино)-4,4-диметиландростан-5,6,17-триол фумарат (I-ap). Указанное в заголовке соединение получали с выходом 93% (420 мг), как описано в примере 2, начиная с 5,6,17-тригидрокси-4,4-диметиландростан-3-она (получение 5, 300 мг) и 2-аминоэтоксиамина дигидрохлорида (510 мг). 1(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметиландростан-5,6,17-триол фумарат (I-aq). Указанное в заголовке соединение получали с выходом 90% (121 мг), как описано в примере 2, начиная с 5,6,17-тригидрокси-4,4-диметиландростан-3-она (получение 5, 100 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 200 мг).(15 мл) и насыщенный раствор соли (20 мл) и смесь перемешивали в течение 10 мин. Фазы разделяли и водную фазу экстрагировали ТГФ. Объединенные органические экстракты промывали водным раствором NaHSO3, насыщенным раствором соли, высушивали над MgSO4, фильтровали и упаривали досуха. Сырой продукт очищали флэш-хроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH и упаривали досуха. Остаток растирали с Et2O в течение 0,5 ч и осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (58 мг, выход 55%). 1(Е)-3-[3-(R)-Пирролидинил]оксиимино-5,6-дигидрокси-4,4-диметиландростан-17-он фумарат (Ias). Указанное в заголовке соединение получали с выходом 59% (50 мг), как описано в примере 18, начиная с (Е)-3-[3-(R)-пирролидинил]оксиимино-4,4-диметиландростан-5,6,17-триола гидрохлорида(Е)-3-(2-Аминоэтоксиимино)-4,4-диметиландростан-6,17-дион фумарат (I-at). Указанное в заголовке соединение получали, как описано в примере 1, начиная с 4,4 диметиландростан-3,6,17-триона (получение 6, 80 мг) и 2-аминоэтоксиамина дигидрохлорида (37 мг). Сырой продукт очищали флэш-хроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH и упаривали досуха. Остаток растирали с Et2O и осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (36 мг, выход 30%). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):7,78 (ушир. с, 3H), 6,60 (с, 2 Н), 4,09 (т, 2 Н),3,15 (м, 1 Н), 3,06 (м, 2 Н), 2,43 (с, 1 Н), 2,45-1,05 (м, 16 Н), 1,38 (с, 3H), 1,10 (с, 3H), 0,94 (с, 3H), 0,78 (с,3H). Пример 21.(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметил-5-гидроксиандростан-6,17-дион фумарат (I-au). Указанное в заголовке соединение получали с выходом 82% (33 мг), как описано в примере 5, начиная с 3-(Е)-1-[N-(9-флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4-диметил-5 гидроксиандростан-6,17-диона (получение 7, 48 мг) и 1 М раствора TBAF в ТГФ (0,11 мл). 1(97 мг). Раствор упаривали, добавляли воду и водную фазу экстрагировали ТГФ. Объединенные органические экстракты промывали насыщенным раствором соли, высушивали над Na2SO4 и упаривали досуха. Сырой продукт растирали со смесью диизопропиловый эфир/MeOH 95/5 и осадок отфильтровывали с получением указанного в заголовке соединения (47 мг, 68%). 1(I-ах). 4,4-Диметил-6-гидроксиметил-17-гидроксиандростан-3,7-дион (получение 9, 69 мг) и аминоэтоксиамин дигидрохлорид (28 мг) растворяли в пиридине (0,5 мл) и перемешивали при комнатной температуре в течение 4,5 ч. Добавляли воду и после экстракции водного слоя AcOEt и трет-BuOH объединенные органические фазы высушивали и упаривали. Сырую реакционную смесь очищали флэшхроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления смесиEtOAc/Et2O 1/1 полученный осадок отфильтровывали с получением указанного в заголовке соединения Iax (63 мг, 62%) в виде белого порошка. 1(Е)-3-(2-Аминоэтоксиимино)-4,4-диметил-6-гидроксиметиландростан-7,17-диол фумарат (I-ay). 4,4-Диметил-6-гидроксиметил-7,17-дигидроксиандростан-3-он (получение 10, 115 мг) и аминоэтоксиамин дигидрохлорид (52 мг) растворяли в пиридине (1,0 мл) и перемешивали при 60 С в течение 5 ч и при 90 С еще в течение 2 ч. После выпаривания растворителя сырую реакционную смесь очищали и выделяли, как описано в примере 24, с получением указанного в заголовке соединения I-ay (140 мг,86%) в виде белого порошка. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):7,78 (ушир. с, 3H), 6,60 (с, 2 Н), 4,07 (т, 2 Н),3,88 (м, 1 Н), 3,77 (дд, 1 Н), 3,53 (дд, 1 Н), 3,41 (т, 1 Н), 3,05 (м, 2 Н), 2,78 (м, 1 Н), 2,30-0,70 (м, 16 Н), 1,22 (с,3H), 1,09 (с, 3H), 0,77 (с, 3H), 0,58 (с, 3H). Пример 26.(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметил-6-гидроксиметиландростан-7,7-диол фумарат (I-az). Указанное в заголовке соединение получали с выходом 81%, следуя методике, описанной в примере 25, и начиная с 4,4-диметил-6-гидроксиметил-7,17-дигидроксиандростан-3-она (получение 10,115 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 60 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,93 (ушир. с, 1 Н), 8,81 (ушир. с, 1 Н), 6,60(Е)-3-(4-Пиперидилоксиимино)-4,4-диметил-6-гидроксиметиландростан-7,17-диол фумарат (Iba). 4,4-Диметил-6-гидроксиметил-7,17-дигидроксиандростан-3-он (получение 10, 40 мг) и 4-пиперидилоксиамин дигидрохлорид (получение 16, 52 мг) растворяли в пиридине (1,0 мл) и перемешивали при комнатной температуре в течение 4 суток. После выпаривания растворителя полученное твердое вещество растирали со смесью DCM/AcOEt 1/1 с получением после фильтрования указанного в заголовке соединения (40 мг, 86%). 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,50 (ушир. с, 1 Н), 8,36 (ушир. с, 1 Н), 4,20(Е)-3-(2-Аминоэтоксиимино)-4-(спироциклопропан)-5-андростен-17-ол фумарат (I-bb). Указанное в заголовке соединение получали с выходом 77% (90 мг), как описано в примере 2, начиная с 4-(спироциклопропан)-17-гидроксиандрост-5-ен-3-она (75 мг) и 2-аминоэтоксиамина дигидрохлорида (88 мг). 1(Е)-3-[3-(R)-Пирролидинил]оксиимино-4-спироциклопропанандрост-5-ен-17-ол фумарат (I-bc). Указанное в заголовке соединение получали с выходом 91% (86 мг), как описано в примере 2, начиная с 4-(спироциклопропан)-17-гидроксиандрост-5-ен-3-она (58 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 48 мг). 1Na2HPO412 Н 2 О (15 мг) в воде (0,55 мл). Через 3,5 ч раствор упаривали, добавляли воду и водную фазу экстрагировали ТГФ. Объединенные органические экстракты промывали насыщенным раствором соли,высушивали над Na2SO4 и упаривали досуха. Сырой продукт растирали с Et2O и осадок отфильтровывали с получением указанного в заголовке соединения I-bd (34%, 42%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS): 7,73 (ушир. с, 3H), 4,08 (т, 2 Н), 3,02 (м, 3H), 2,60-1,14(Е)-3-[3-(R)-Пирролидинил]оксиимино-4-этиландростан-6,17-дион гидрохлорид (I-be). Указанное в заголовке соединение получали с выходом 58% (46 мг), как описано в примере 30, начиная с 4-этиландростан-3,6,17-триона (получение 11, 58 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 30 мг). 1(Е)-3-(2-Аминоэтоксиимино)-2-фторандростан-17-ол фумарат (I-bf). 2-Фтордигидротестостерон (40 мг) и 2-аминоэтоксиамин дигидрохлорид (58 мг) растворяли в пиридине (0,5 мл) и перемешивали при 70 С в течение 5 ч. После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Осадок промывали гептаном и фильтровали с получением указанного в заголовке соединения I-bf с выходом 76%. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):7,82 (т, 3H), 6,60 (с, 2 Н), 5,20 (ддд, 1 Н),4,15 (т, 2 Н), 3,41 (т, 1 Н), 3,08 (м, 2 Н), 2,87 (м, 1 Н), 2,30-0,60 (м, 19 Н), 0,82 (с, 3H), 0,61 (с, 3H). Пример 33.(Е)-3-[3-(R)-Пирролидинил]оксиимино-2-фторандростан-17-ол фумарат (I-bg). Указанное в заголовке соединение получали с выходом 91%, следуя методике, описанной в примере 32, начиная с 2-фтордигидротестостерона (40 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида(Е)-3-[3-(R)-Пирролидинил]оксиимино-2-фторандростан-17-он гидрохлорид (I-bh). 2-Фторандростан-3,17-дион (315 мг) и 3-(R)-пирролидинилоксиамин дигидрохлорид (получение 12, 190 мг) растворяли в пиридине (5 мл) и перемешивали при комнатной температуре в течение 1 ч. После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесьCHCl3/MeOH/26% NH4OH 90/10/1). К маслу, полученному после упаривания фракций, растворенному в смеси EtOAc/Et2O 1/1 (20 мл) и охлажденному на ледяной бане, добавляли избыток 2 н. раствора HCl вEt2O. После фильтрования получали указанное в заголовке соединение I-bh в виде белого твердого вещества с выходом 91%. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):9,02 (ушир. с, 2 Н), 5,22 (ддд, 1 Н), 4,83 (м,1 Н), 3,35-2,90 (м, 5 Н), 2,45-0,75 (м, 21 Н), 0,84 (с, 3H), 0,77 (с, 3H). Пример 35.(Е)-3-[3-(R)-Пирролидинил]оксиимино)-2-фтор-17-гидроксиандростан-6-он фумарат (I-bi). Указанное в заголовке соединение получали с выходом 97%, следуя методике, описанной в примере 34, начиная с 2-фтор-17-гидроксиандростан-3,6-диона (получение 18, 98 мг) и 3-(R)пирролидинилоксиамина дигидрохлорида (получение 12, 53 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bi. 1(I-bj). Указанное в заголовке соединение получали с выходом 74%, следуя методике, описанной в примере 34, начиная с (Е)-3-[3-(R)-пирролидинил]оксиимино-2 фтор-17-гидроксиандростан-6-она фумарата(пример 35, 73 мг) и гидроксиламина гидрохлорида (11 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bj. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):9,05 (ушир. с, 4 Н), 6,40 (с, 2 Н), 5,26 (ддд,1 Н), 4,81 (м, 1 Н), 4,50 (ушир., 1 Н), 3,50-3,00 (м, 7 Н), 2,36-0,89 (м, 16 Н), 0,73 (с, 3H), 0, 61 (с, 3H). Пример 37.(Е)-3-[3-(R)-Пирролидинил]оксиимино-2-фтор-6-(Е)-метоксииминоандростан-17-ол фумарат (I-bk). Указанное в заголовке соединение получали с выходом 56%, следуя методике, описанной в примере 34, начиная с (Е)-3-[3-(R)-пирролидинил] оксиимино-2-фтор-17-гидроксиандростан-6-она фумарата(пример 35, 72 мг) и метоксиамина гидрохлорида (14 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bk. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):9,50 (ушир. с, 3H), 6,42 (с, 2 Н), 5,26 (ддд,1 Н), 4,84 (м, 1 Н), 4,50 (ушир., 1 Н), 3,72 (с, 3H), 3,50-3,00 (м, 7 Н), 2,30-0,91 (м, 18 Н), 0,75 (с, 3H), 0,61 (с,3H). Пример 38.(Е)-3-[3-(R)-Пирролидинил]оксиимино-4-фторандростан-17-он фумарат (I-bl). Указанное в заголовке соединение получали с выходом 64%, следуя методике, описанной в примере 34, начиная с 4-фторандростан-3,17-диона (получение 17, 23 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 14 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bl. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):9,50 (ушир. с, 3H), 6,42 (с, 2 Н), 5,26 (ддд,1 Н), 4,84 (м, 1 Н), 4,50 (ушир., 1 Н), 3,72 (с, 3H), 3,50-3,00 (м, 7 Н), 2,30-0,91 (м, 18 Н), 0,75 (с, 3H), 0,61 (с,3H). Пример 39.(4 мл). Смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель выпаривали досуха и сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После разведения смесью EtOAc/Et2O 1/1 полученный осадок отфильтровывали с получением указанного в заголовке соединения I-bm (97 мг, 70%) в виде белого порошка. 1 Н-ЯМР (300 МГц, ДМСО-d6/CF3COOH, ppm от TMS):8,90 (ушир. с, 4 Н), 6,40 (с, 2 Н), 4,40 (ушир. с, 1 Н), 4,10 (м, 2 Н), 3,85 (д, 1 Н), 3,10 (м, 1 Н), 3,04 (м, 2 Н), 2,45-0,58 (м, 19 Н), 0,89 (с, 3H), 0,77 (с, 3H). Пример 40.(4 мл). Смесь перемешивали при комнатной температуре в течение 5 ч. Растворитель выпаривали досуха и сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH- 22017497 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После разведения смесью EtOAc/Et2O 1/1 полученный осадок отфильтровывали с получением указанного в заголовке соединения I-bn (63 мг, 43%) в виде белого порошка. 1(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-спироциклопропан-5-андростен-17-он фумарат (I-bo). Указанное в заголовке соединение получали с выходом 78%, следуя методике, описанной в примере 5, и начиная с 3-(Е)-2-N-(9-флуоренилметоксикарбонил)-[3-(R)-пирролидинил]оксиимино-4(спироциклопропан)андрост-5-ен-17-она (получение 20, 162 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):9,00 (ушир. с, 3H), 6,42 (с, 2 Н), 5,31 (м, 1 Н), 4,68 (м,1 Н), 3,30-310 (м, 4 Н), 2,88 (м, 1 Н), 2,45-0,48 (м, 22 Н), 1,13 (с, 3H), 0,79 (с, 3H). Пример 42.(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-спироциклопентан-5-андростен-17-ол фумарат (I-bp). Указанное в заголовке соединение получали с выходом 74%, следуя методике, описанной в примере 32, и начиная с 4-спироциклопентан-17-гидрокси-5-андростен-3-она (162 мг) и 3-(R)пирролидинилоксиамина дигидрохлорида (получение 12, 165 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bp. 1(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-спироциклопентанандростан-17-ол фумарат (I-bq). Указанное в заголовке соединение получали с выходом 71%, следуя методике, описанной в примере 32, начиная с 4-спироциклопентан-17-гидроксиандростан-3-она (получение 21, 92 мг) и 3-(R)пирролидинилоксиамина дигидрохлорида (получение 12, 70 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bq. 1(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-спироциклопентан-5-андростен-17-он гидрохлорид (I-br). Указанное в заголовке соединение получали с выходом 78%, следуя методике, описанной в примере 5, начиная с 3-(Е)-2-[N-(9-флуоренилметоксикарбонил)]-[3-(R)-пирролидинил]оксиимино-4(спироциклопентан)андрост-5-ен-17-она (получение 22, 423 мг). После перемешивания при комнатной температуре в течение 2,5 ч раствор концентрировали и очищали флэш-хроматографией (SiO2, смесьDCM/MeOH/26% NH4OH 90/10/0,1) с получением белой пены, которую растворяли в DCM (3 мл) и охлаждали на ледяной бане. Добавляли избыток 0,2 н. раствора HCl в Et2O. После фильтрования получали указанное в заголовке соединение I-bh в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):9,07 (ушир. с, 2 Н), 5,96 (м, 1 Н), 4,79 (м, 1 Н), 4,50(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-спироциклопентанандростан-7,17-диол фумарат (I-bs). Указанное в заголовке соединение получали с выходом 62%, следуя методике, описанной в примере 32, начиная с 4-спироциклопентан-7,17-дигидроксиандростан-3-она (получение 23, 50 мг) и 3-(R)пирролидинилоксиамина дигидрохлорида (получение 12, 36 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bs. 1(Е)-3-(2-Аминоэтоксиимино]-4-метил-4,5-эпоксиандростан-17-ол фумарат (I-bt). Указанное в заголовке соединение получали с выходом 62%, следуя методике, описанной в примере 2, начиная с 4-метил-4,5-эпокси-17-гидроксиандростан-3-она (получение 24, 50 мг) и 2 аминоэтоксиамина дигидрохлорида (36 мг). После выпаривания растворителя сырую реакционную смесь- 23017497 очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 85/15/1,5). К концентрированнным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bt. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):8,50 (ушир. с, 4 Н), 6,42 (с, 2 Н), 4,50 (ушир., 1 Н), 4,18(Е)-3-(2-Аминоэтоксиимино)-4-метил-4,5-эпоксиандростан-17-ол фумарат (I-bu). Указанное в заголовке соединение получали с выходом 65%, следуя методике, описанной в примере 2, и начиная с 4-этил-4,5-эпокси-17-гидроксиандростан-3-она (получение 25, 50 мг) и 2 аминоэтоксиамина дигидрохлорида (50 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bu. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):9,50 (ушир. с, 4 Н), 6,42 (с, 2 Н), 4,50 (ушир., 1 Н), 4,19(Е)-3-(2-Аминоэтоксиимино)-4-изопропиландрост-4-ен-17-ол фумарат (I-bv). Указанное в заголовке соединение получали с выходом 40%, следуя методике, описанной в примере 32, начиная с 4-изопропил-17-гидроксиандрост-4-ен-3-она (155 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 246 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bv. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):9,00 (ушир. с, 3H), 6,40 (с, 2 Н), 4,78 (м, 1 Н), 4,50(Е)-3-[(3-(R)-Пирролидинил)оксиимино]-4-этиландростан-17-ол фумарат (I-bw). Указанное в заголовке соединение получали с выходом 90%, следуя методике, описанной в примере 32, начиная с 4-этил-17-гидроксиандростан-3-она (получение 26, 109 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 180 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bw. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):9,00 (ушир. с, 3H), 6,42 (с, 2 Н), 4,75 (м, 1 Н), 4,50(Е)-3-[3-(R)-Пирролидинил]оксиимино-4-этил-6-гидроксиандростан-17-он гидрохлорид (I-bx). Указанное в заголовке соединение получали с выходом 90%, следуя методике, описанной в примере 30, начиная с 4-этил-6-гидроксиандростан-3,17-диона (получение 27, 137 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 160 мг). Сырой продукт растирали с Et2O и полученный осадок отфильтровывали с получением указанного в заголовке соединения I-bx. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):8,98 (ушир. с, 2 Н), 4,76 (м, 1 Н), 4,42 (д, 1 Н), 3,70-2,91(Е)-3-[3-(R)-Пирролидинил]оксиимино-4,4-диметиландростан-5,17-диол гидрохлорид (I-by). Указанное в заголовке соединение получали с выходом 51%, следуя методике, описанной в примере 2, начиная с 4,4-диметил-5,17-дигидроксиандростан-3-она (получение 28, 33 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 69 мг). Сырой продукт растирали с Et2O и полученный осадок отфильтровывали с получением указанного в заголовке соединения I-by. 1(Е)-3-(2-Аминоэтоксиимино)-4-изопропиландрост-4-ен-17-ол фумарат (I-bz). Указанное в заголовке соединение получали с выходом 40%, следуя методике, описанной в примере 32, начиная с 4-изопропил-17-гидрокси-4-андростен-3-она (155 мг) и 3-(R)-пирролидинилоксиамина дигидрохлорида (получение 12, 246 мг). После выпаривания растворителя сырую реакционную смесь очищали флэш-хроматографией (SiO2, смесь CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. Полученный осадок промывали гептаном и отфильтровывали с получением указанного в заголовке соединения I-bz.(м, 6 Н), 2,44-0,50 (м, 22 Н), 0,92 (с, 3H), 0,76 (т, 3H), 0,75 (с, 3H). Получение 1. 3-(E)-2-[N-(9-Флуоренилметоксикарбонил)]аминоэтоксиимино-4,4-диметиландрост-5-ен-17-он. Стадия 1. К перемешиваемому раствору смеси (Е)-3-(2-аминоэтоксиимино)-4,4-диметиландрост-5 ен-17-ола (пример 2, 250 мг) и Et3N (0,14 мл) в атмосфере N2 в DCM (10 мл) при 0 С добавляли 9-флуоренилметоксикарбонилхлорид (170 мг). После перемешивания при комнатной температуре в течение 15 мин добавляли воду и смесь экстрагировали DCM. Органическую фазу промывали 5% раствором NaHCO3, высушивали над Na2SO4 и упаривали досуха с получением 3-(Е)-2-[N-(9 флуоренилметоксикарбонил)]аминоэтоксиимино-4,4-диметиландрост-5-ен-17-ола (392 мг, 99%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):7,90-7,20 (м, 9 Н), 5,54 (м, 1 Н), 4,44 (м, 1 Н), 4,25 (м,3H), 3,95 (м, 2 Н), 3,42 (м, 1 Н), 3,22 (м, 2 Н), 2,76 (м, 1 Н), 2,30-0,77 (м, 16 Н), 1,24 (с, 3H), 1,16 (с, 3H), 0,68NMO (114 мг), ТРАР (11,4 мг) и молекулярные сита 4 (325 мг). Смесь перемешивали в течение 1 ч и затем добавляли SiO2. Смесь очищали флэш-хроматографией (SiO2, смесь DCM/MeOH/26% NH4OH 90/10/1) с получением 3-(Е)-2-[N-(9-флуоренилметоксикарбонил)]аминоэтоксиимино-4,4-диметиландрост-5-ен-17-она (343 мг, 88%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):8,00-7,20 (м, 9 Н), 5,57 (м, 1 Н), 4,22 (м, 3H), 3,97 (м,2 Н), 3,22 (м, 2 Н), 2,76 (м, 1 Н), 2,45-0,60 (м, 16 Н), 1,25 (с, 3H), 1,17 (с, 3H), 0,73 (с, 3H), 0,67 (с, 3H). Получение 2. 3-(E)-2-[N-(9-Флуоренилметоксикарбонил)]аминоэтоксиимино-4,4-диметиландростан-17-он. Указанное в заголовке соединение получали (343 г, 88%), следуя методике, описанной в получении 1 (стадия 2), начиная с 3-(Е)-2-[N-(9-флуоренилметоксикарбонил)]аминоэтоксиимино-4,4 диметиландростан-17-ола (391 мг). 1H-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):7,90-7,20 (м, 9 Н), 4,38 (д, 1 Н), 4,22 (м, 3H), 3,94 (м,2 Н), 3,23 (м, 2 Н), 2,96 (м, 1 Н), 2,05-0,40 (м, 19 Н), 1,02 (с, 3H), 0,94 (с, 3H), 0,87 (с, 3H), 0,60 (с, 3H). Получение 3. 3-(E)-3-[N-(9-Флуоренилметоксикарбонил)]аминопропоксиимино-4,4-диметиландростан-17-он. Указанное в заголовке соединение получали (194 г, 82%), следуя методике, описанной в получении 1 (стадия 2), начиная с 3-(Е)-3-[N-(9-флуоренилметоксикарбонил)]аминопропоксиимино-4,4 диметиландростан-17-ола (237 мг). 1(с, 3H). Получение 4. 3-(Е)-1-[N-(9-Флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4 диметиландростан-17-он. Указанное в заголовке соединение получали (127 г, 87%), следуя методике, описанной в получении 1 (стадия 2), начиная с 3-(Е)-1-[N-(9-флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4 диметиландростан-17-ола (147 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):7,94-7,25 (м, 8 Н), 4,64 (м, 1 Н), 4,28 (м, 3H), 3,49-2,83 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):7,94-7,24 (м, 8 Н), 4,64 (м, 1 Н), 4,42 (д, 1 Н), 4,27 (м,3H), 3,50-2,80 (м, 6 Н), 2,14-0,50 (м, 21 Н), 1,05 (с, 3H), 0,97 (с, 3H), 0,90 (с, 3H), 0,59 (с, 3H). Получение 5. 5,6,17-Тригидрокси-4,4-диметиландростан-3-он. К перемешиваемому раствору 17-гидрокси-4,4-диметиландрост-5-ен-3-она (1,00 г) в ТГФ (100 мл) и пиридине (7,1 мл) добавляли 0,16 М раствор OsO4 (35 мл). После перемешивания при комнатной температуре в течение 24 ч реакционную смесь гасили добавлением 40% раствора NaHSO3 в воде (5 мл). После перемешивания в течение 4 ч добавляли насыщенный раствор соли и смесь экстрагировали EtOAc. Объединенные органические экстракты промывали насыщенным раствором соли, высушивали надNa2SO4, фильтровали и упаривали досуха. Смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/DCM/ацетон 60/20/20) с получением указанного в заголовке соединения (610 мг, 55%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):4,42 (д, 1 Н), 4,41 (д, 1 Н), 3,90 (с, 1 Н), 3,83 (м, 1 Н),3,42 (м, 1 Н), 2,84 (м, 1 Н), 2,08-0,80 (м, 16 Н), 1,23 (с, 3H), 1,15 (с, 3H), 0,70 (с, 3H), 0,58 (с, 3H). Получение 6. 4,4-Диметиландростан-3,6,17-трион. Стадия 1. К перемешиваемому раствору 17-гидрокси-4,4-диметиландрост-5-ен-3-она (408 мг) в ТГФ (12 мл) при -15 С в атмосфере N2 добавляли 1 М раствор комплекса ВН 3 ушир. ТГФ в ТГФ(6,44 мл). Затем смесь перемешивали при комнатной температуре в течение ночи. Осторожно по каплям добавляли Н 2 О (5 мл) с последующим добавлением NaBO3 ушир. 4H2O (330 мг). После перемешивания при комнатной температуре в течение ночи смесь фильтровали. Твердое вещество промывали ТГФ и затем отбрасывали. Жидкие фазы разделяли и водный слой насыщали NaCl и экстрагировали ТГФ(3200 мл). Объединенные органические экстракты высушивали над NaCl и Na2SO4, фильтровали и упаривали досуха. Сырой продукт очищали флэш-хроматографией (SiO2, смесь DCM/MeOH 97/3) с получением 4,4-диметиландростан-3,6,17-триола (137 мг, выход 32%). 1H-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):4,39 (д, 1 Н), 4,20 (д, 1 Н), 3,95 (д, 1 Н), 3,69 (м, 1 Н),3,40 (м, 1 Н), 2,91 (м, 1 Н), 1,88-0,47 (м, 18 Н), 1,19 (с, 3H), 0,84 (с, 3H), 0,79 (с, 3H), 0,60 (с, 3H). Стадия 2. Следуя методике, описанной в получении 1 (стадия 2), и начиная с 4,4-диметиландростан 3,6,17-триол (127 мг) и ТРАР (6,5 мг) получали 4,4-диметиландростан-3,6,17-трион (99 мг, выход 80%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):2,86 (м, 1 Н), 2,65 (с, 1 Н), 2,47-1,04 (м, 16 Н), 1,37 (с,3H), 1,05 (с, 3H), 0,99 (с, 3H), 0,79 (с, 3H). Получение 7. 3-(Е)-1-[N-(9-Флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4-диметил-5 гидроксиандростан-6,17-дион. Следуя методике, описанной в получении 1 (стадия 1), и начиная с 3-(Е)-[3-(R)-пирролидинил]оксиимино-4,4-диметиландростан-5,6,17-триола (пример 17, 83 мг) и 9-флуоренилметоксикарбонилхлорида (56 мг) получали 3-(Е)-1-[N-(9-флуоренилметоксикарбонил)]-3-(R)-пирролидинилоксиимино-4,4-диметиландростан-5,6,17-триол (81 мг, 64%) в виде сырого продукта. Последнее соединение окисляли без дополнительной очистки, следуя методике, описанной в получении 1 (стадия 2), с получением указанного в заголовке соединения с выходом 88% (51 мг). 1mCPBA (1,17 г) добавляли к перемешиваемому раствору 17-гидрокси-4,4-диметиландрост-5-ен-3 она (1,00 г) в DCM (30 мл). Через 8 ч при комнатной температуре добавляли 10% водный растворNa2SO3. Смесь нейтрализовали добавлением 5% водного раствора NaHCO3 и экстрагировали DCM(3100 мл). Объединенные органические экстракты промывали H2O, высушивали над Na2SO4 и упаривали досуха. Смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/EtOAc 70/30) с получением 5,6-эпокси-4,4-диметил-17-гидроксиандростан-3-она (230 мг, 23%). 1 Н-ЯМР (300 МГц, ацетон-d6, ppm от TMS):3,55 (м, 2 Н), 3,09 (д, 1 Н), 2,77-0,80 (м, 17 Н), 1,21 (с,3H), 1,03 (с, 3H), 0,80 (с, 3H), 0,70 (с, 3H). Получение 9. 4,4-Диметил-6-гидроксиметил-17-гидроксиандростан-3,7-дион. Стадия 1. К суспензии 4,4-диметил-17-гидроксиандрост-5-ен-3-она (3,34 г) в ДМФА (30 мл) добавляли имидазол (1,40 г) и трет-бутилдиметилсилилхлорид (3,15 г). После перемешивания смеси в течение ночи при комнатной температуре добавляли воду и перемешивание продолжали еще в течение 30 мин при 0 С. Образовавшееся твердое вещество отфильтровывали, после высушивания получали 4,4 диметил-17-трет-бутилдиметилсилилоксиандрост-5-ен-3-он (4,0 г, выход 93%). Н-ЯМР (300 МГц, ацетон-d6, ppm от TMS):5,60 (1 Н, м), 3,63 (1 Н, т), 2,65-1,00 (17 Н, м), 1,22 (3H,с), 1,18 (3H, с), 0,87 (9 Н, с), 0,85 (3H, с), 0,77 (3H, с), 0,02 (3H, с), 0,01 (3H, с). Стадия 2. 4,4-Диметил-17-трет-бутилдиметилсилилоксиандрост-5-ен-3-он (4,0 г) растворяли в толуоле (235 мл). Добавляли этиленгликоль (9,3 мл) и PTSA (124 мг) и смесь кипятили с обратным холодильником в течение 7,5 ч, воду удаляли с помощью насадки Дин-Старка. После охлаждения добавляли воду и смесь экстрагировали EtOAc. Органическую фазу промывали 5% раствором NaHCO3, насыщенным раствором соли, затем высушивали над Na2SO4 и упаривали досуха с получением 3,3-(этилендиокси)-4,4-диметил-17-трет-бутилдиметилсилилоксиандрост-5-ена (4,4 г, выход 100%),который использовали на следующей стадии без очистки. 1 Н-ЯМР (300 МГц, ацетон-d6, ppm от TMS):5,60 (1 Н, м), 3,95-3,90 (4 Н, м), 3,60 (1 Н, м), 2,65-1,00(17 Н, м), 1,22 (3H, с), 1,18 (3H, с), 0,87 (9 Н, с), 0,85 (3H, с), 0,77 (3H, с), 0,02 (3H, с), 0,01 (3H, с). Стадия 3. К раствору первого соединения (4,4 г) и NHS (4,2 г) в ацетоне (70 мл) добавляли порциями Na2CrO7 (3,3 г) при 45 С. После перемешивания в течение ночи смесь охлаждали, затем добавляли воду (300 мл) и лед. Полученную суспензию перемешивали в течение 1 ч. Полученный твердый осадок отфильтровывали и высушивали при 45 С с получением 3,3-(этилендиокси)-4,4-диметил-17-третбутилдиметилсилилоксиандрост-5-ен-7-она (3,9 г, выход 85%), который использовали на следующей стадии без очистки. 1 Н-ЯМР (300 МГц, ацетон-d6, ppm от TMS):5,60 (1 Н, м), 3,95-3,90 (4 Н, м), 3,60 (1 Н, м), 2,65-1,00(15 Н, м), 1,22 (3H, с), 1,18 (3H, с), 0,87 (9 Н, с), 0,85 (3H, с), 0,77 (3H, с), 0,02 (3H, с), 0,01 (3H, с). Стадия 4. К раствору 3,3-(этилендиокси)-4,4-диметил-17-трет-бутилдиметилсилилоксиандрост-5 ен-7-она (3,9 г) в диоксане (270 мл) добавляли 10% Pd/C (390 мг) и затем смесь гидрировали при комнатной температуре в течение 72 ч. Катализатор отфильтровывали, промывали EtOAc и органическую фазу упаривали при пониженном давлении. Сырую реакционную смесь очищали флэш-хроматографией (SiO2,смесь н-гексан/EtOAc/толуол 90/5/5) с получением 3,3-(этилендиокси)-4,4-диметил-17-третбутилдиметилсилилоксиандростан-7-она (2,44 г, выход 63%). 1 Н-ЯМР (300 МГц, ацетон-d6, ppm от TMS):3,95-3,90 (4 Н, м), 3,60 (1 Н, м), 2,65-1,00 (18 Н, м), 1,22(8 мл, 2 М раствор в гексане) при комнатной температуре. Через 1 ч смесь охлаждали до 0 С и добавляли раствор триоксана (460 мг) в DCM (2 мл). Через 1 ч смесь охлаждали до -78 С и по каплям добавляли к раствору энолата лития(полученного из 3,3-(этилендиокси)-4,4-диметил-17-третбутилдиметилсилилоксиандростан-7-она (2,44 г) в ТГФ (25 мл) и LDA (1,5 М раствор в циклогексане,21,2 мл) при -78 С. После перемешивания в течение ночи при -20 С реакцию гасили добавлением насыщенного раствора NaHCO3. Смесь фильтровали на подушке целлита и промывали DCM. Фильтрат промывали водой, высушивали над Na2SO4 и концентрировали. Добавляли TBAF (5,6 мл, 1 М раствор в ТГФ) и смесь перемешивали при комнатной температуре в течение 1,5 ч. Полученный раствор промывали водой, высушивали над Na2SO4 и упаривали досуха. Полученный остаток очищали флэшхроматографией (SiO2, смесь н-гексан/EtOAc 75/25) с получением 3,3-(этилендиокси)-4,4-диметил-6 гидроксиметил-17-трет-бутилдиметилсилилоксиандростан-7-она (1,26 г, выход 50%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):3,95-3,90 (4 Н, м), 3,60 (1 Н, м), 2,75 (2 Н, м), 2,65-1,00(16 Н, м), 1,22 (3H, с), 1,18 (3H, с), 0,87 (9 Н, с), 0,85 (3H, с), 0,77 (3H, с), 0,02 (3H, с), 0,01 (3H, с). Стадия 6. 3,3-(Этилендиокси)-4,4-диметил-6-гидроксиметил-17-трет-бутилдиметилсилилоксиандростан-7-он (100 мг) растворяли в диоксане (2 мл), затем добавляли 1 н. раствор HCl (2 мл) и смесь перемешивали при комнатной температуре в течение 5,5 ч. Добавляли 5% раствор NaHCO3 и растворитель выпаривали досуха. Водную фазу экстрагировали DCM, высушивали над Na2SO4 и упаривали досуха с получением 4,4-диметил-6-гидроксиметил-17-гидроксиандростан-3,7-диона с выходом 95%. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):4,33 (1 Н, т), 4,28 (1 Н, м), 3,85-3,80 (1 Н, м), 2,70 (2 Н,м), 2,20-0,80 (17 Н, м), 1,12 (3H, с), 1,01 (3H, с), 0,83 (3H, с), 0,79 (3H, с). Получение 10. 4,4-Диметил-6-гидроксиметил-7,17-дигидроксиандростан-3-он. К перемешиваемому раствору 3,3-(этилендиокси)-4,4-диметил-6-гидроксиметил-17-третбутилдиметилсилилоксиандростан-7-она (получение 9, стадия 5, 1,0 г) в MeOH (40 мл) добавляли NaBH4(140 мг) при 0 С и смесь подогревали до комнатной температуры. Через 1 ч реакцию гасили добавлением 5% NaH2PO4 и смесь экстрагировали DCM. Объединенные органические экстракты промывали насыщенным раствором соли, высушивали над Na2SO4 и упаривали досуха. Остаток растворяли в диоксане(20 мл) и добавляли 1 н. раствор HCl (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и упаривали досуха. Остаток очищали флэш-хроматографией (SiO2, смесь нгексан/AcOEt 25/75) с получением 4,4-диметил-6-гидроксиметил-7,17-дигидроксиандростан-3-она с выходом 76%. Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):4,33 (1 Н, т), 4,28 (2 Н, м), 3,85-3,80 (2 Н, м), 2,70 (2 Н,м), 2,20-0,80 (17 Н, м), 1,12 (3H, с), 1,01 (3H, с), 0,83 (3H, с), 0,79 (3H, с). Получение 11. 4-Этиландростан-3,6,17-трион. Стадия 1. Йодэтан (1,60 г) в сухом трет-бутаноле (150 мл) добавляли по каплям в атмосфере N2 в течение 6 ч к энергично перемешиваемому, нагретому до рефлюкса раствору тестостерона (3,00 г) и трет-бутилата калия (1,75 г) в сухом трет-бутаноле (100 мл). Смесь кипятили с обратным холодильником еще в течение 3 ч. После охлаждения до комнатной температуры смесь гасили добавлением насыщенного водного раствора NH4Cl (170 мл). После перемешивания в течение 10 мин трет-бутанол выпаривали и смесь экстрагировали толуолом. Объединенные органические экстракты промывали насыщенным раствором соли, высушивали над Na2SO4, фильтровали и упаривали досуха. Смесь очищали флэшхроматографией (SiO2, смесь н-гексан/EtOAc 70/30) с получением 17-гидрокси-4-этиландрост-4-ен-3 она (1,68 г, 51%). 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):4,46 (д, 1 Н), 3,41 (м, 1 Н), 2,63 (м, 1 Н), 2,45-0,13 (м,20 Н), 1,12 (с, 3H), 0,78 (т, 3H), 0,67 (с, 3H). Стадия 2. Перемешиваемый раствор последнего соединения (1,05 г) в атмосфере N2 вместе с Ас 2 О(0,87 мл), пиридином (0,22 мл) и ацетилхлоридом (1,8 мл) кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до комнатной температуры добавляли EtOAc и раствор промывали Н 2 О, 5% раствором NaHCO3 и насыщенным раствором соли. Органическую фазу высушивали над Na2SO4, фильтровали и упаривали досуха. Смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/EtOAc 90/10) с получением 3,17-диацетокси-4-этиландроста-3,5-диена (1,14 г, 86%). 1EtOH/H2O 95/5 (13,7 мл) добавляли mCPBA (1,0 г). Через 8 ч при комнатной температуре добавлялиDCM (150 мл) и смесь промывали 10% водным раствором Na2SO3, 5% водным раствором NaHCO3 и насыщенным раствором соли. Органическую фазу высушивали над Na2SO4 и упаривали досуха. Сырую смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/EtOAc 60/40) с получением смеси 6 гидрокси-17-ацетокси-4-этиландрост-4-ен-3-она и 6-гидрокси-17-ацетокси-4-этиландрост-4-ен-3-она(0,53 г, 52%). Стадия 4. К раствору 6-гидрокси-17-ацетокси-4-этиландрост-4-ен-3-она и 6-гидрокси-17 ацетокси-4-этиландрост-4-ен-3-она (510 мг) в ацетоне (34 мл), охлажденному до 0 С, добавляли по каплям реагент Джонса (1,1 мл). Через 5 мин после окончания добавления вносили DCM (140 мл) и смесь промывали 10% водным раствором Na2SO3, 5% водным раствором NaHCO3 и насыщенным раствором соли. Органическую фазу высушивали над Na2SO4 и упаривали досуха с получением 17-ацетокси-4 этиландрост-4-ен-3,6-диона (465 мг, 92%). 1H-ЯМР (300 МГц, ацетон-d6, ppm от TMS):4,61 (т, 1 Н), 2,59-1,20 (м, 19 Н), 1,99 (с, 3H), 1,13 (с,3H), 0,90 (т, 3H), 0,87 (с, 3H). Стадия 5. Li (252 мг) добавляли небольшими порциями к жидкому NH3 (80 мл) при температуре-35 С. К первому раствору добавляли по каплям 17-ацетокси-4-этиландрост-4-ен-3,6-дион (465 мг) в сухом ТГФ (12 мл). Смесь перемешивали при -35 С в течение 10 мин и осторожно добавляли NH4Cl(5,0 г). NH3 выпаривали при комнатной температуре в атмосфере N2. Добавляли воду и смесь экстрагировали EtOAc. Объединенные органические экстракты промывали насыщенным раствором соли, высушивали, фильтровали и упаривали досуха. Смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/EtOAc 30/70) с получением смеси 3,17-дигидрокси-4-этиландростан-6-она и 3,17-дигидрокси-4-этиландростан-6-она (193 мг, 48%). Стадия 6. К раствору 3,17-дигидрокси-4-этиландростан-6-она и 3,17-дигидрокси-4 этиландростан-6-она (179 мг) в DCM (6,7 мл) в атмосфере N2 добавляли NMO (190 мг), ТРАР (9,5 мг) и молекулярные сита 4 (270 мг). Смесь перемешивали в течение 15 мин и затем добавляли SiO2. Смесь очищали флэш-хроматографией (SiO2, смесь н-гексан/EtOAc 70/30) с получением указанного в заголовке соединения (140 мг, 79%). 1H-ЯМР (300 МГц, ацетон-d6, ppm от TMS):2,90-1,20 (м, 21 Н), 1,16 (с, 3H), 0,89 (с, 3H), 0,85 (т,3H). Получение 12. 3(R)-Пирролидинилоксиамин дигидрохлорид. Стадия 1. Ди-трет-бутилдикарбонат (21,5 г) добавляли к раствору 3-(S)-гидроксипирролидина гидрохлорида (15,0 г) и NEt3 (27,3 мл) в MeOH (135 мл) при 0 С. После перемешивания при комнатной температуре в течение 6 ч растворитель выпаривали. Остаток разводили DCM, промывали водой и органическую фазу упаривали досуха с получением N-трет-бутоксикарбонил-3-(S)-пирролидинола (21,4 г, выход 95%), который использовали на следующей стадии без очистки.(2 Н, м), 1,37 (9 Н, с). Стадия 2. К раствору последнего соединения (10,0 г) и NEt3 (8,2 мл) в DCM (150 мл) при 0 С добавляли метансульфонилхлорид (4,34 мл). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь выливали в ледяную воду и экстрагировали DCM. Органическую фазу промывали 5% водным раствором NaHCO3, водой и насыщенным раствором соли, высушивали и упаривали досуха с получением масла, которое затвердевало после стояния в течение ночи в холодильнике. Твердое вещество растирали с Et2O с получением N-трет-бутоксикарбонил-3-(S)-пирролидинилметансульфоната (13,0 г,выход 92%) в виде светло-желтого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):5,23 (1 Н, м), 3,60-3,10 (4 Н, м), 3,23 (3H, с), 2,11 (2 Н,м), 1,39 (9 Н, с). Стадия 3. К суспензии порошка KOH (4,86 г) в ДМСО (250 мл) при энергичном перемешивании добавляли оксим бензофенона (7,86 г). После перемешивания при комнатной температуре в течение 30 мин добавляли раствор N-трет-бутоксикарбонил-3-(S)-пирролидинилметансульфоната (10,0 г) в ДМСО(70 мл). Через 18 ч при комнатной температуре реакционную смесь выливали в ледяную воду (900 мл) и экстрагировали Et2O. Объединенные органические слои промывали водой, насыщенным раствором соли,высушивали и растворитель выпаривали. Получали О-[(R)-3-пирролидинил]оксим бензофенона (13,0 г,выход 96%) в виде белого твердого вещества и его использовали без дополнительной очистки на следующей стадии. 1(2 Н, м), 1,38 (9 Н, с). Стадия 4. Последнее соединение суспендировали в 6 н. растворе HCl (250 мл) и смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь экстрагировали Et2O. Водный слой упаривали с получением сырого коричневого твердого вещества, которое кипятили с обратным холодильником в течение 2 ч в абсолютном EtOH (255 мл) в присутствии 0,34 г активированного угля. Твердое вещество, полученное после выпаривания, кристаллизовали из 96% EtOH (40 мл) с получением 3-(R)-пирролидинилоксиамина дигидрохлорида (2,98 г, 72%) в виде не совсем белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):11,22 (3H, bb), 9,74 (1 Н, bb), 9,54 (1H, bb), 4,98 (1H,м), 3,60-3,00 (4H, м), 2,40-2,00 (2H, м). Получение 13. 2-N-Метиламиноэтоксиамин дигидрохлорид. Стадия 1. К суспензии KOH (19,7 г) в ДМСО (200 мл) при энергичном перемешивании добавляли оксим бензофенона (20,2 г). Добавляли по каплям раствор N-метил-2-хлорэтиламина гидрохлорида(5,2 г) в ДМСО (40 мл). Через 2,5 ч при комнатной температуре реакционную смесь выливали в ледяную воду (400 мл), подкисляли 37% HCl до рН 2,5 и промывали Et2O. Водный слой обрабатывали KOH порошком до рН 10 и экстрагировали три раза Et2O; объединенные органические слои промывали водой,насыщенным раствором соли, высушивали над Na2SO4 и растворитель выпаривали. Очистка флэшхроматографией (SiO2, смесь CHCl3/MeOH/АсОН от 9/1/0,1 до 7/3/0,3) давала О-(2-N-метиламиноэтил)оксим бензофенона (4,65 г, 62%) в виде вязкого масла. 1H-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):7,51-7,25 (10H, м), 4,13 (2 Н, т), 2,72 (2 Н, т), 2,26 (3H,с), 1,60 (1 Н, bb). Стадия 2. Последнее соединение суспендировали в 6 н. HCl (24 мл) и смесь кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали и экстрагировали Et2O. Водный слой упаривали досуха с получением 2-N-метиламиноэтоксиамина дигидрохлорида (1,78 г, 80%) в виде гигроскопичного белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, ppm от TMS):10,5 (5 Н, bb), 4,26 (2 Н, т), 3,22 (2 Н, т), 2,55 (3H, с). Получение 14. 3-Метиламинопропоксиамин дигидрохлорид. Стадия 1. О-(3-Метиламинопропил)оксим бензофенона получали с выходом 62% из оксима бензофенона и N-метил-3-хлорпропиламина гидрохлорида с использованием методики, описанной выше, для получения О-(2-N-метиламиноэтил)оксима бензофенона (получение 13, стадия 1). 1
МПК / Метки
МПК: A61P 9/04, A61P 9/06, A61P 9/12, A61K 31/565, C07J 41/00, A61K 31/58, C07J 43/00
Метки: лечения, сердечно-сосудистых, качестве, производные, 4-замещенных, аминооксимные, андростанов, андростенов, средств, лекарственных, нарушений
Код ссылки
<a href="https://eas.patents.su/30-17497-aminooksimnye-proizvodnye-2-i-ili-4-zameshhennyh-androstanov-i-androstenov-v-kachestve-lekarstvennyh-sredstv-dlya-lecheniya-serdechno-sosudistyh-narushenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Аминооксимные производные 2- и/или 4-замещенных андростанов и андростенов в качестве лекарственных средств для лечения сердечно-сосудистых нарушений</a>
Предыдущий патент: Композиция для регулирования метаболизма липидов
Следующий патент: Конструкция электрохимического аккумуляторного элемента
Случайный патент: Арилсульфонилпиразолинкарбоксамидиновые производные в качестве антагонистов 5-нт6












