Соагонисты глюкагоновых/glp-1-рецепторов
Номер патента: 17849
Опубликовано: 29.03.2013
Авторы: Паттерсон Джеймс, Димарчи Мария, Смайли Девид, Дэй Джонатан, Шабенн Джозеф, Димарчи Ричард Д.
Формула / Реферат
1. Ненативный глюкагоновый пептид, содержащий последовательность SEQ ID NO: 55 или аналог последовательности SEQ ID NO: 55, представляющий собой искусственный пептид, отличающийся от последовательности SEQ ID NO: 55 1-3 модификациями аминокислот, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 и 29, причем упомянутый глюкагоновый пептид проявляет повышенную активность на GLP-1-рецепторе по сравнению с нативным глюкагоном, а также содержит внутримолекулярный мостик между боковыми цепями двух аминокислот, разделенных тремя промежуточными аминокислотами, для обеспечения повышенной активности на GLP-1-рецепторе, или фармацевтически приемлемая соль такого пептида.
2. Глюкагоновый пептид по п.1, причем упомянутые две боковые цепи связаны одна с другой посредством ковалентной связи.
3. Глюкагоновый пептид по п.2, причем внутримолекулярный мостик представляет собой лактамный мостик.
4. Глюкагоновый пептид по любому из пп.1-3, содержащий лактамный мостик между двумя аминокислотами, выбранными из группы, которую составляют аминокислоты в положениях 16 и 20, аминокислоты в положениях 12 и 16, аминокислоты в положениях 20 и 24 и аминокислоты в положениях 24 и 28.
5. Глюкагоновый пептид по п.4, причем мостик находится между аминокислотами в положениях 16 и 20.
6. Глюкагоновый пептид по п.4, причем мостик находится между аминокислотами в положениях 12 и 16.
7. Глюкагоновый пептид по п.1, причем боковые цепи связаны одна с другой посредством водородных связей или ионных взаимодействий, факультативно посредством солевого мостика.
8. Глюкагоновый пептид по п.7, причем внутримолекулярный мостик представляет собой солевой мостик.
9. Глюкагоновый пептид по п.8, содержащий солевой мостик между двумя аминокислотами, выбранными из группы, которую составляют аминокислоты в положениях 16 и 20, аминокислоты в положениях 12 и 16, аминокислоты в положениях 20 и 24 и аминокислоты в положениях 24 и 28.
10. Глюкагоновый пептид по п.9, причем солевой мостик образован между аминокислотами в положениях 16 и 20.
11. Глюкагоновый пептид по п.9, причем солевой мостик образован между аминокислотами в положениях 12 и 16.
12. Глюкагоновый пептид по любому из пп.1-11, причем аминокислотой в положении 16 является глутаминовая кислота, аминокислотой в положении 20 является лизин, а С-концевая карбоксильная группа заменена амидом, факультативно с лактамным мостиком между глутаминовой кислотой в положении 16 и лизином в положении 20.
13. Глюкагоновый пептид по п.1, который содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56.
14. Глюкагоновый пептид по любому из предшествующих пунктов, который дополнительно содержит пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 26, SEQ ID NO: 29 и SEQ ID NO: 65, присоединенные к карбоксильному концу упомянутого глюкагонового пептида.
15. Глюкагоновый пептид по любому из предшествующих пунктов, причем аминокислотой в положении 28 является Asp, Asn или Lys и аминокислотой в положении 29 является Gly или Thr.
16. Глюкагоновый пептид по п.1, причем аминокислота в положении 1 или 2 модифицирована для понижения восприимчивости к расщеплению дипептидилпептидазой IV.
17. Глюкагоновый пептид по п.16, причем аминокислота в положении 2 выбрана из группы, которую составляют d-серин, аланин, D-аланин, валин, глицин, N-метилсерин, N-метилаланин и аминоизомасляная кислота.
18. Глюкагоновый пептид по п.16 или 17, причем аминокислота в положении 1 выбрана из группы, которую составляют d-гистидин, дезаминогистидин, гидроксигистидин, ацетилгистидин, гомогистидин, N-метилгистидин, α-метилгистидин, имидазолуксусная кислота и α,α-диметилимидазолуксусная кислота (DMIA).
19. Глюкагоновый пептид по любому из предшествующих пунктов, причем аминокислотой в положении 3 является глутаминовая кислота или глутамин.
20. Глюкагоновый пептид по любому из предшествующих пунктов, дополнительно содержащий гидрофильную составляющую, факультативно полиэтиленгликолевую цепь, ковалентно присоединенную в положении 17, 21 или 24 либо к С-концевой аминокислоте глюкагонового пептида.
21. Глюкагоновый пептид по любому из предшествующих пунктов, содержащий С-концевую аминокислоту с нейтральной по заряду группой, факультативно амидом, вместо карбоновой кислоты.
22. Глюкагоновый пептид по п.1, содержащий последовательность SEQ ID NO: 33.
23. Глюкагоновый пептид по п.1, содержащий последовательность аналога последовательности SEQ ID NO: 33, отличающегося от последовательности SEQ ID NO: 33 1-3 аминокислотами, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что в случае если аминокислотой в положении 16 является серин, то либо в положении 20 находится лизин, либо между аминокислотой в положении 24 и аминокислотой в положении 20 или 28 образован лактамный мостик.
24. Глюкагоновый пептид по п.23, содержащий последовательность аналога последовательности SEQ ID NO: 33, отличающегося от последовательности SEQ ID NO: 33 1-2 аминокислотами, выбранными из положений 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что в случае если аминокислотой в положении 16 является серин, то либо в положении 20 находится лизин, либо между аминокислотой в положении 24 и аминокислотой в положении 20 или 28 образован лактамный мостик.
25. Глюкагоновый пептид по п.24, причем аминокислотой в положении 16 является глутаминовая кислота, а С-концевая карбоксильная группа заменена амидом.
26. Глюкагоновый пептид по п.25, причем к боковой цепи аминокислоты в положении 17, 21 или 24 ковалентно присоединена полиэтиленгликолевая цепь.
27. Глюкагоновый пептид по п.25, причем аминокислота в положении 28 или 29 замещена кислой аминокислотой.
28. Глюкагоновый пептид по п.25, причем аминокислота в положении 1 или 2 модифицирована для понижения восприимчивости к расщеплению дипептидилпептидазой IV.
29. Глюкагоновый пептид по п.25, который содержит аналог последовательности SEQ ID NO: 33, причем аминокислота в положении 2 пептида последовательности SEQ ID NO: 33 выбрана из группы, которую составляют d-серин, аланин, глицин, N-метилсерин и аминоизомасляная кислота.
30. Глюкагоновый пептид по п.25, который содержит аналог последовательности SEQ ID NO: 33, причем аминокислота в положении 1 пептида последовательности SEQ ID NO: 33 выбрана из группы, которую составляют d-гистидин, дезаминогистидин, гидроксигистидин, ацетилгистидин и гомогистидин.
31. Глюкагоновый пептид по п.25, дополнительно содержащий гидрофильную составляющую, ковалентно присоединенную в положении 17 или 21 упомянутого глюкагонового пептида.
32. Глюкагоновый пептид по п.31, причем упомянутая гидрофильная составляющая представляет собой полиэтиленгликолевую цепь.
33. Глюкагоновый пептид по п.25, содержащий любую из аминокислотных последовательностей SEQ ID NO: 9, SEQ ID NO: 10-18, SEQ ID NO: 20-22, SEQ ID NO: 40-44 и SEQ ID NO: 53.
34. Глюкагоновый пептид по п.25, содержащий любую из аминокислотных последовательностей SEQ ID NO: 2-4 и SEQ ID NO: 23-25.
35. Глюкагоновый пептид по п.1, который содержит последовательность X1X2QGT FTSDY SKYLD ERX5AK DFVX3W LMNX4 (SEQ ID NO: 61) или X1X2QGT FTSDY SKYLD EQ X5AK EFI X3W LMNX4 (SEQ ID NO: 62), при условии, что в случае, когда Х3 - Cys-PEG, X4 не является Cys-PEG либо GGPSSGAPPPSC-PEG, и когда Х2 - серин, X1 не является гистидином, причем факультативно данный пептид дополнительно содержит лактамный мостик между аминокислотами в положениях 16 и 20.
36. Глюкагоновый пептид по п.35, в котором Х3 - Cys-PEG, причем факультативно данный глюкагоновый пептид содержит лактамный мостик между аминокислотами в положениях 16 и 20.
37. Глюкагоновый пептид, содержащий последовательность

и аналоги агониста глюкагона последовательностей SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, где R - COOH или CONH2 и боковая цепь остатка аминокислоты в положении 17, 21 или 24 либо С-концевой аминокислоты упомянутого глюкагонового пептида дополнительно содержит гидрофильную составляющую, ковалентно присоединенную к этому остатку аминокислоты; а также фармацевтически приемлемые соли данного глюкагонового пептида.
38. Глюкагоновый пептид по п.37, причем R - CONH2 и упомянутой гидрофильной составляющей является полиэтиленгликолевая цепь.
39. Глюкагоновый пептид по п.38, который содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25.
40. Глюкагоновый пептид по п.39, в котором полиэтиленгликолевая цепь имеет молекулярную массу, выбранную в диапазоне от приблизительно 1000 до приблизительно 5000 Да.
41. Глюкагоновый пептид по п.39, в котором полиэтиленгликолевая цепь имеет молекулярную массу по меньшей мере приблизительно 20000 Да.
42. Глюкагоновый пептид, содержащий последовательность, выбранную из последовательностей SEQ ID NO: 70-514, или его фармацевтически приемлемая соль.
43. Глюкагоновый пептид по п.42, содержащий аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 240-256, причем факультативно С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 20 кДа, или в альтернативном варианте С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 40 кДа.
44. Глюкагоновый пептид, содержащий аминокислотную последовательность SEQ ID NO: 251, или его фармацевтически приемлемая соль.
45. Глюкагоновый пептид по п.44, отличающийся тем, что Cys в положении 24 содержит малеимидометоксиполиэтиленгликолевую составляющую, причем полиэтиленгликоль имеет среднюю молекулярную массу приблизительно 40 кДа.
46. Глюкагоновый пептид по п.42, содержащий аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 308-324, причем факультативно С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 20 кДа, или в альтернативном варианте С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 40 кДа.
47. Глюкагоновый пептид, содержащий аминокислотную последовательность SEQ ID NO: 319, или его фармацевтически приемлемая соль.
48. Глюкагоновый пептид по п.42, содержащий аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 505-513, причем факультативно С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 20 кДа, или в альтернативном варианте С* - Cys, присоединенный к полиэтиленгликолю, имеющему среднюю массу приблизительно 40 кДа.
49. Глюкагоновый пептид, содержащий аминокислотную последовательность SEQ ID NO: 510, или его фармацевтически приемлемая соль.
50. Ненативный глюкагоновый пептид, содержащий последовательность SEQ ID NO: 55 или аналог последовательности SEQ ID NO: 55, представляющий собой искусственный пептид, отличающийся от последовательности SEQ ID NO: 55 1-3 модификациями аминокислот, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 и 29, причем упомянутый глюкагоновый пептид проявляет повышенную активность на GLP-1-рецепторе по сравнению с нативным глюкагоном, причем аминокислотой в положении 16 является глутаминовая кислота, аминокислотой в положении 20 является лизин, а С-концевая карбоксильная группа заменена амидом, факультативно с лактамным мостиком между глутаминовой кислотой в положении 16 и лизином в положении 20, или фармацевтически приемлемая соль такого пептида.
51. Аналог глюкагоновой аминокислотной последовательности SEQ ID NO: 1, содержащий внутримолекулярный мостик между боковыми цепями аминокислот в положениях 12 и 16, 16 и 20, 20 и 24 либо 24 и 28, причем данный аналог проявляет повышенную активность на GLP-1-рецепторе по сравнению с нативным глюкагоном, или фармацевтически приемлемая соль такого аналога.
52. Гомодимер, включающий в себя два глюкагоновых пептида или аналога, соединенных между собой посредством линкера, причем каждый из этих глюкагоновых пептидов или аналогов представляет собой пептид или аналог по любому из предшествующих пунктов.
53. Гомодимер по п.52, включающий в себя последовательность SEQ ID NO: 33, где аминокислотой в положении 28 является Asp, аминокислотой в положении 29 является Gly и аминокислотная последовательность SEQ ID NO: 29 ковалентно присоединена к карбоксильному концу последовательности SEQ ID NO: 33.
54. Димер, включающий в себя два глюкагоновых пептида или аналога по любому из предшествующих пунктов.
55. Конъюгат, содержащий глюкагоновый пептид или аналог по любому из предшествующих пунктов, присоединенный к гетерологичному пептиду или полипептиду, средству направленной доставки, иммуноглобулину или его части, диагностической метке, полимеру или терапевтическому либо диагностическому агенту.
56. Конъюгат по п.55, причем упомянутый глюкагоновый пептид присоединен к белку плазмы.
57. Конъюгат по п.56, причем карбоксильный конец глюкагонового пептида присоединен к аминокислотной последовательности любой из последовательностей SEQ ID NO: 26-29.
58. Фармацевтическая композиция, содержащая глюкагоновый пептид по любому из пп.1-50, или аналог по п.51, или его фармацевтически приемлемую соль, или гомодимер по п.52 или 53, или димер по п.54, или конъюгат по любому из пп.55-57, а также фармацевтически приемлемый носитель.
59. Фармацевтическая композиция по п.58, дополнительно содержащая противодиабетический препарат или лекарственное средство против ожирения, а также фармацевтически приемлемый носитель.
60. Фармацевтическая композиция по п.59, отличающаяся тем, что противодиабетический препарат выбран из группы, которую составляют инсулин, сульфонилмочевины, такие как толбутамид (Orinase), ацетогексамид (Dymelor), толазамид (Tolinase), хлорпропамид (Diabinese), глипизид (Glucotrol), глибурид (Diabeta, Micronase, Glynase), глимепирид (Amaryl) или гликлазид (Diamicron); меглитиниды, такие как репаглинид (Prandin) или натеглинид (Starlix); бигуаниды, такие как метформин (Glucophage) или фенформин; тиазолидиндионы, такие как росиглитазон (Avandia), пиоглитазон (Actos), троглитазон (Rezulin) или другие ингибиторы PPARγ (активатор пероксисомальной пролиферации); ингибиторы α-глюкозидазы, угнетающие переваривание углеводов, такие как миглитол (Glyset), акарбос (Precose/Glucobay); эксенатид (Byetta) или прамлинтид; ингибиторы дипептидилпептидазы-4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрийзависимый переносчик глюкозы 1) и ингибиторы фруктоза-1,6-бис-фосфатазы, или лекарственное средство против ожирения выбрано из группы, которую составляют средства, подавляющие аппетит, в том числе стимуляторы типа фенэтиламина, фентермин (факультативно с фенфлурамином либо дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидного рецептора; оксинтомодулин; флуоксетина гидрохлорид (Prozac); препарат Qnexa (топирамат и фентермин), препарат Excalia (бупропион и зонисамид) или препарат Contrave (бупропион и налтрексон); или ингибиторы липаз, подобные ксеникалу (Orlistat) либо препарату Cetilistat (известному также как ATL-962), и препарат GT 389-255.
61. Набор для введения глюкагонового пептида или аналога пациенту, нуждающемуся в этом, отличающийся тем, что он включает в себя фармацевтическую композицию по любому из пп.58-60 и устройство для введения упомянутой композиции пациенту.
62. Применение фармацевтической композиции по любому из пп.58-60 для лечения диабета или гипергликемии для снижения прироста массы тела либо инициирования снижения массы тела.
63. Применение глюкагонового пептида по любому из пп.1-50, или аналога по п.51, или их фармацевтически приемлемых солей при изготовлении лекарственного средства для лечения диабета или гипергликемии, или для снижения прироста массы тела, или инициирования снижения массы тела.
64. Способ снижения прироста массы тела либо инициирования снижения массы тела у пациента, включающий введение пациенту фармацевтической композиции по любому из пп.57-59 в количестве, эффективном для снижения прироста массы тела либо инициирования снижения массы тела.
65. Способ лечения диабета или гипергликемии у пациента, включающий введение пациенту фармацевтической композиции по любому из пп.57-59 в количестве, эффективном для лечения диабета или гипергликемии.
66. Способ снижения прироста массы тела либо инициирования снижения массы тела, включающий введение эффективного количества композиции, содержащей агонист глюкагона, включающий в себя глюкагоновый пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 10, SEQ ID NO: 1l, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 55, причем аминокислота 29 глюкагонового пептида посредством пептидной связи присоединена к второму пептиду, содержащему последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 65.
67. Способ снижения прироста массы тела либо инициирования снижения массы тела, включающий введение эффективного количества композиции, содержащей глюкагоновый пептид по п.1, дополнительно включающий последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 26-28 и SEQ ID NO: 65.
68. Способ по п.67, отличающийся тем, что агонист глюкагона дополнительно содержит полиэтиленгликолевую цепь, присоединенную к глюкагоновому пептиду в положении 17, 21 или 24, имеющую молекулярную массу, выбранную в диапазоне от приблизительно 5000 до приблизительно 40000 Да, при условии, что в случае если пептид содержит последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, то полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 16, 17, 21 или 24; если пептид содержит последовательность SEQ ID NO: 14 или SEQ ID NO: 15, то полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 16, 17 или 21; если пептид содержит последовательность SEQ ID NO: 55, то полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 21 или 24; и если пептид содержит последовательности SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, то полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 17 или 21.
69. Способ лечения гипергликемии с применением заранее изготовленной водной композиции, отличающийся тем, что он включает введение эффективного количества фармацевтической композиции по любому из пп.58-60.
70. Способ по п.69, отличающийся тем, что агонист глюкагона дополнительно содержит полиэтиленгликолевую цепь, присоединенную к глюкагоновому пептиду в положении 16, 17, 21 или 24, имеющую молекулярную массу, выбранную в диапазоне от приблизительно 5000 до приблизительно 40000 Да, при условии, что в случае когда пептид содержит последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 17, 21 или 24, когда пептид содержит последовательность SEQ ID NO: 14 или SEQ ID NO: 15, полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 16, 17 или 21, и когда пептид содержит последовательности SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 17 или 21.
71. Применение глюкагонового пептида или аналога по любому из предшествующих пунктов в комбинации с противодиабетическим препаратом или лекарственным средством против ожирения для лечения диабета или гипергликемии, или для снижения прироста массы тела, или инициирования снижения массы тела.
72. Применение глюкагонового пептида или аналога по любому из предшествующих пунктов в комбинации с противодиабетическим препаратом или лекарственным средством против ожирения при изготовлении лекарственного средства для лечения диабета или гипергликемии, или для снижения прироста массы тела, или инициирования снижения массы тела.
73. Применение по п.71 или 72, причем противодиабетический препарат выбран из группы, которую составляют инсулин, сульфонилмочевины, такие как толбутамид (Orinase), ацетогексамид (Dymelor), толазамид (Tolinase), хлорпропамид (Diabinese), глипизид (Glucotrol), глибурид (Diabeta, Micronase, Glynase), глимепирид (Amaryl) или гликлазид (Diamicron); меглитиниды, такие как репаглинид (Prandin) или натеглинид (Starlix); бигуаниды, такие как метформин (Glucophage) или фенформин; тиазолидиндионы, такие как росиглитазон (Avandia), пиоглитазон (Actos), троглитазон (Rezulin) или другие ингибиторы PPARγ (активатор пероксисомальной пролиферации); ингибиторы α-глюкозидазы, угнетающие переваривание углеводов, такие как миглитол (Glyset), акарбос (Precose/Glucobay); эксенатид (Byetta) или прамлинтид; ингибиторы дипептидилпептидазы-4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрийзависимый переносчик глюкозы 1) и ингибиторы фруктоза-1,6-бис-фосфатазы, или лекарственное средство против ожирения выбрано из группы, которую составляют средства, подавляющие аппетит, в том числе стимуляторы типа фенэтиламина, фентермин (факультативно с фенфлурамином либо дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидного рецептора; оксинтомодулин; флуоксетина гидрохлорид (Prozac); препарат Qnexa (топирамат и фентермин), препарат Excalia (бупропион и зонисамид) или препарат Contrave (бупропион и налтрексон); или ингибиторы липаз, подобные ксеникалу (Orlistat) либо препарату Cetilistat (известному также как ATL-962), и препарат GT 389-255.
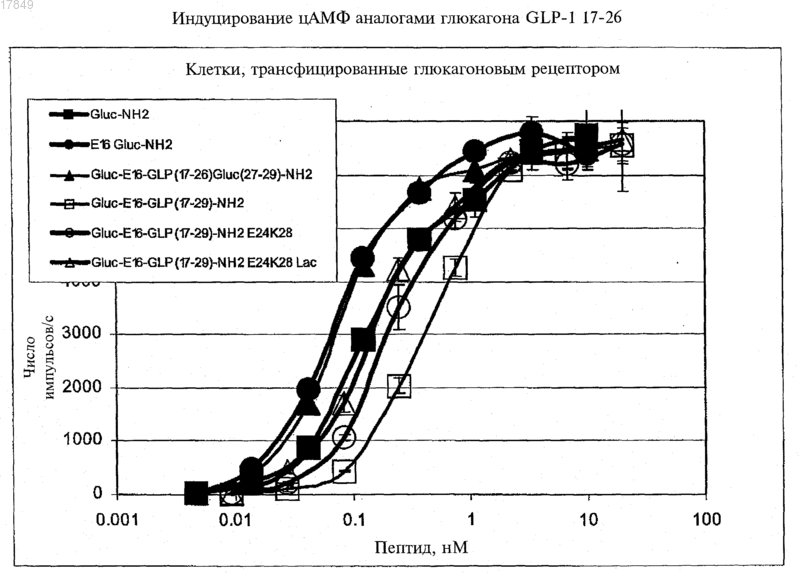
Текст
Раскрыты модифицированные глюкагоновые пептиды, обладающие повышенной активностью на глюкагоновом рецепторе в сравнении с нативным глюкагоном. Дополнительная модификация глюкагоновых пептидов посредством образования лактамных мостиков или замены концевой карбоксильной кислоты амидной группой продуцирует пептиды, проявляющие активность соагонистов на глюкагоновом/GLP-1-рецепторе. Растворимость и стабильность этих высокоактивных аналогов глюкагона может быть дополнительно улучшена модифицированием полипептидов посредством пегилирования, замены карбоксиконцевых аминокислот либо добавления карбоксиконцевого пептида, выбранного из группы, которую составляют последовательности SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) и SEQ ID NO: 28 (KRNR).(71)(73) Заявитель и патентовладелец: ИНДИАНА ЮНИВЕРСИТИ РИСЕРЧ ЭНД ТЕКНОЛОДЖИ КОРПОРЕЙШН (US) Перекрестные ссылки на родственные заявки Настоящая заявка претендует на приоритет по предварительной заявке на патент США 60/890087, поданной 15 февраля 2007 г., и по предварительной заявке на патент США 60/938565, поданной 17 мая 2007 г. Содержание упомянутых предварительных заявок полностью включено в настоящую заявку посредством ссылки. Предпосылки создания изобретения Препроглюкагон представляет собой полипептид-предшественник, состоящий из 158 аминокислот,подвергаемый процессингу в различных тканях с образованием ряда различных проглюкагоновых пептидов, в том числе глюкагона, глюкагоноподобного пептида-1 (GLP-1), глюкагоноподобного пептида-2(GLP-2) и оксинтомодулина (ОХМ), которые принимают участие в разнообразных физиологических функциях, в том числе в глюкозном гомеостазе, секреции инсулина, опорожнении желудка и в росте организма вследствие усвоения пищи в кишечнике, а также в регулировании потребления пищи. Глюкагон представляет собой пептид, состоящий из 29 аминокислот, соответствующих аминокислотам 33-61 препроглюкагона, в то время как GLP-1 продуцируется в виде пептида длиной в 37 аминокислот, соответствующих аминокислотам 72-108 препроглюкагона. Амид GLP-1(7-36) либо кислота GLP-1(7-37) являются биологически сильнодействующими формами GLP-1, проявляющими по сути эквивалентную активность на GLP-1-рецепторе. Гипогликемия наблюдается в том случае, когда уровень глюкозы в крови падает слишком низко для обеспечения достаточного количества энергии для жизнедеятельности организма. У взрослых и детей старше 10 лет гипогликемия наблюдается редко, кроме тех случаев, когда она является побочным эффектом лечения диабета, однако она может быть следствием применения других лекарственных препаратов,заболеваний, гормональной или ферментной недостаточности или опухолей. Когда уровень глюкозы в крови начинает опускаться, глюкагон, гормон, продуцируемый поджелудочной железой, подает сигнал печени для расщепления гликогена и выделения глюкозы, что приводит к повышению уровня глюкозы в крови до нормального уровня. Таким образом, общая роль глюкагона в регулировании уровня глюкозы заключается в нейтрализации воздействия инсулина и поддержании уровня глюкозы в крови. Однако у больных диабетом подобная реакция глюкагона на гипогликемию может быть ослаблена, что затрудняет возвращение уровня глюкозы в пределы нормального диапазона. Гипогликемия является состоянием, представляющим угрозу для жизни, которое требует немедленной медицинской помощи. Введение глюкагона является общепринятым способом лекарственной терапии при лечении острой гипогликемии, посредством которого можно восстановить нормальный уровень глюкозы в течение нескольких минут после введения. В случае применения глюкагона при экстренном лечении гипогликемии, кристаллическую форму глюкагона растворяют в разбавленном кислом буфере, и раствор вводят внутримышечным путем. Несмотря на эффективность упомянутого лечения, методика его проведения тягостна и опасна для лица, находящегося в полубессознательном состоянии. Следовательно, существует потребность в аналоге глюкагона, который сохраняет либо превосходит биологические характеристики исходной молекулы, однако является в достаточной степени растворимым и стабильным, в соответствующих физиологических условиях, чтобы его можно было заранее изготовлять в виде раствора, готового для инъекций. Кроме того, больным диабетом рекомендуется поддерживать уровень глюкозы в крови, близкий к норме, для отсрочки либо профилактики возникновения микрососудистых осложнений. Достижение этой цели требует, как правило, проведения интенсивной инсулинотерапии. В стремлении к достижению этой цели, врачи столкнулись со значительным повышением частоты и тяжести гипогликемии у больных диабетом. Следовательно, имеется потребность в улучшенных фармацевтических препаратах и усовершенствованных методиках лечения диабета, которые обладают меньшей вероятностью индуцирования гипогликемии, по сравнению с современными методами инсулинотерапии.GLP-1 по сравнению с глюкагоном имеет иную биологическую активность. К числу его воздействий относится стимулирование синтеза и секреции инсулина, угнетение секреции глюкагона и удерживание от потребления пищи. Было показано, что GLP-1 снижает тяжесть гипергликемии (повышенный уровень глюкозы) у больных диабетом. Эксендин-4, пептид из яда ящериц, аминокислотный состав которого почти на 50% совпадает с аминокислотным составом GLP-1, активизирует GLP-1-рецептор и так же, как было показано, снижает тяжесть гипергликемии у больных диабетом. Имеются также данные о том, что GLP-1 и эксендин-4 могут снижать потребление пищи и стимулировать снижение массы тела, т.е. оказывать эффект, являющийся благотворным не только для больных диабетом, но и для больных, страдающих ожирением. У больных, страдающих ожирением, имеется большой риск развития диабета, гипертензии, гиперлипидемии, сердечно-сосудистых заболеваний и заболеваний опорно-двигательного аппарата. Таким образом, сохраняется потребность в альтернативных и предпочтительно усовершенствованных методах лечения диабета и ожирения. Суть изобретения В соответствии с настоящим описанием предлагаются высокоэффективные аналоги агонистов глюкагона, которые проявляют также повышенную активность на глюкагоновом рецепторе и в соответствии с описанными ниже вариантами осуществления проявляют повышенную биофизическую стабильность и/или растворимость в воде. Кроме того, в соответствии с другим аспектом настоящего изобретения предлагаются аналоги агонистов глюкагона, утратившие избирательность нативного глюкагона в отношении глюкагоновых рецепторов, по сравнению с GLP-1-рецепторами, и, тем самым, представляющие собой соагонисты двух упомянутых рецепторов. Посредством определенных модификаций аминокислот аналогов глюкагона можно контролировать относительную активность упомянутого аналога на GLP-1 рецепторе, по сравнению с относительной активностью на глюкагоновом рецепторе. Таким образом, в соответствии с еще одним аспектом настоящего изобретения предлагаются аналоги соагониста глюкагона, обладающие повышенной активностью на глюкагоновом рецепторе, по сравнению с активностью наGLP-1-рецепторе, аналоги соагониста глюкагона, обладающие приблизительно эквивалентной активностью на обоих рецепторах, и аналоги соагониста глюкагона, обладающие повышенной активностью наGLP-1-рецепторе, по сравнению с активностью на глюкагоновом рецепторе. Соагонист последней упомянутой категории может быть сконструирован методами генной инженерии для проявления незначительной активности либо полного ее отсутствия на глюкагоновом рецепторе с одновременным сохранением способности активизирования GLP-1-рецептора с такой же самой либо лучшей активностью, нежели нативный GLP-1. Любой из этих аналогов может также включать модификации, наделяющие их повышенной биофизической стабильностью и/или растворимостью в воде. Аналоги глюкагона, проявляющие соагонизм на глюкагоновых и GLP-1-рецепторах, полезны для нескольких вариантов применения. Прежде всего, применение глюкагона для лечения гипогликемии может привести к гиперкомпенсации низкого уровня глюкозы в крови, следствием чего может быть избыточный уровень глюкозы в крови. При введении соагониста глюкагоновых/GLP-l-рецепторов, дополнительная стимуляция GLP-1-рецепторов может смягчать воздействие глюкагонового агониста с предотвращением избыточного уровня глюкозы в крови, являющегося следствием лечения гипогликемии. Кроме того, в соответствии с приведенным описанием аналоги соагониста глюкагона, соответствующие настоящему изобретению, могут применяться для регулирования содержания глюкозы в крови при гипергликемии, стимулирования снижения массы тела либо предотвращения прироста массы тела при введении отдельно либо в комбинации с другими противодиабетическими препаратами либо лекарственными средствами против ожирения. Другим соединением, стимулирующим снижение массы тела,является оксинтомодулин, природный пищеварительный гормон, обнаруживаемый в тонкой кишке (см.Diabetes, 2005; 54:2390-2395). Оксинтомодулин представляет собой пептид, состоящий из 37 аминокислот, включающий последовательность глюкагона из 29 аминокислот (т.е. последовательность SEQ IDNO: 1), за которой следует карбоксиконцевой удлиняющий сегмент (последовательность SEQ ID NO: 27), состоящий из 8 аминокислот (KRNRNNIA). Настоящим изобретением предусматривается, что аналоги глюкагона, раскрытые в настоящем описании, могут факультативно соединяться с упомянутым карбоксиконцевым удлиняющим сегментом (последовательность SEQ ID NO: 27), состоящим из 8 аминокислот, однако некоторые варианты осуществления настоящего изобретения также конкретно предусматривают аналоги и применение аналогов, лишенных упомянутых 8 прилегающих аминокислот карбоксильного конца последовательности SEQ ID NO: 27. Модифицированием аминокислот могут быть получены соединения, специально предназначенные для регулирования активности упомянутого пептида по отношению к GLP-1, и, следовательно, могут быть получены аналоги глюкагона, соответствующие настоящему изобретению, обладающие особыми свойствами для лечения конкретного состояния либо заболевания. В частности, настоящим изобретением предлагаются аналоги глюкагона, где каждый аналог проявляет типичный относительный уровень активности на соответствующих глюкагоновых и GLP-1-рецепторах. Например, модификациям может подвергаться каждый пептид с получением глюкагонового пептида, обладающего активностью на GLP1-рецепторе в диапазоне по меньшей мере от приблизительно 10% (включая приблизительно 20, 30, 40,50, 60, 75, 100, 125, 150, 175%) до приблизительно 200% или более высокой по сравнению с активностью нативного GLP-1 и активностью на глюкагоновом рецепторе в диапазоне по меньшей мере от приблизительно 10% (включая приблизительно 20, 30, 40, 50, 60, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400,450%) до приблизительно 500% или более высокой по сравнению с активностью нативного глюкагона. Аминокислотная последовательность нативного глюкагона представлена последовательностью SEQ IDNO: 1, аминокислотная последовательность амида GLP-l(7-36) представлена последовательностью SEQID NO: 52 и аминокислотная последовательность кислоты GLP-1(7-37) представлена последовательностью SEQ ID NO: 50. В иллюстративных вариантах осуществления глюкагоновый пептид может проявлять по меньшей мере 10% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 50% активности нативного GLP-1 на GLP-1-рецепторе, или по меньшей мере 40% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 40% активности нативного GLP-1 наGLP-1-рецепторе, или по меньшей мере 60% активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере 60% активности нативного GLP-1 на GLP-1-рецепторе. Избирательность глюкагонового пептида в отношении глюкагонового рецептора по сравнению сGLP-1-рецептором может описываться как относительный показатель активности глюкагона к активности GLP-1 (активность пептида на глюкагоновом рецепторе относительно нативного глюкагона, делен-2 017849 ная на активность пептида на GLP-1-рецепторе относительно нативного GLP-1). Например, глюкагоновый пептид, проявляющий 60% активности нативного глюкагона на глюкагоновом рецепторе и 60% активности нативного GLP-1 на GLP-1-рецепторе, имеет 1:1 отношение активности глюкагона к активности GLP-1. Примеры отношений активности глюкагона к активности GLP-1 включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 либо приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4,1:3, 1:2 или 1:1,5. В качестве примера отношение активности глюкагона к активности GLP-1 10:1 указывает на 10-кратную избирательность в отношении глюкагонового рецептора по сравнению с GLP-1 рецептором. Подобным же образом, отношение активности GLP-1 к активности глюкагона 10:1 указывает на 10-кратную избирательность в отношении GLP-1-рецептора по сравнению с глюкагоновым рецептором. В одном из вариантов осуществления предлагаются аналоги глюкагона, обладающие повышенной активностью и оптимально улучшенной растворимостью и стабильностью. В одном из вариантов осуществления повышенная активность глюкагона обеспечивается модифицированием аминокислоты в положении 16 нативного глюкагона (последовательность SEQ ID NO: 1). В качестве неограничивающего примера такая повышенная активность может обеспечиваться заменой природного серина в положении 16 глутаминовой кислотой либо другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или же в альтернативном варианте любой аминокислотой из группы, которую составляют глутамин, гомоглутаминовая кислота и гомоцистеиновая кислота, или заряженной аминокислотой,имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, О, S, Р), или боковую цепь длиной приблизительно 4 атома (или 3-5 атомов). В одном из вариантов осуществления агонист глюкагона повышенной активности содержит пептид, представленный последовательностями SEQID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, либо аналог агониста глюкагона, представленный последовательностью SEQ ID NO: 5. В одном из вариантов осуществления предлагается белок-аналог глюкагона, имеющий повышенную активность на глюкагоновом рецепторе относительно глюкагона дикого типа, где пептид содержит последовательности SEQ ID NO: 7, SEQ IDNO: 8, SEQ ID NO: 9 или SEQ ID NO: 10, и где глюкагоновый белок сохраняет свою избирательность в отношении глюкагонового рецептора по сравнению с GLP-1-рецепторами. Активность глюкагонового рецептора может быть снижена модифицированием аминокислоты в положении 3, например, посредством замены природного глутамина в положении 3 любой аминокислотой. Было показано, что замена в этом положении кислой, основной либо гидрофобной аминокислотой(глутаминовой кислотой, орнитином, норлейцином) значительно снижает либо ликвидирует активность глюкагонового рецептора. В соответствии с некоторыми вариантами осуществления аналоги обладают приблизительно 10% или менее активности нативного глюкагона на глюкагоновом рецепторе, например приблизительно 1-10%, или приблизительно 0,1-10%, или более чем приблизительно 0,1%, но менее чем приблизительно 10%, одновременно с этим проявляя по меньшей мере 20% активности GLP-1 на GLP-1 рецепторе. Например, иллюстративные аналоги, описание которых приводится в этом документе, обладают приблизительно 0,5%, приблизительно 1% либо приблизительно 7% активности нативного глюкагона, в то же время проявляя по меньшей мере 20% активности GLP-1 на GLP-1-рецепторе. В соответствии с другими вариантами осуществления предлагаются аналоги глюкагона, обладающие повышенной или сохраненной активностью на глюкагоновом рецепторе по сравнению с нативным глюкагоновым пептидом, но имеющие также значительно повышенную активность на GLP-1-рецепторе. Глюкагон, как правило, имеет приблизительно 1% активности нативного GLP-1 на GLP-1-рецепторе, в то время как GLP-1, как правило, имеет менее чем приблизительно 0,01% активности нативного глюкагона на глюкагоновом рецепторе. Повышенная активность на GLP-1-рецепторе обеспечивается посредством замены карбоксильной группы С-концевой аминокислоты нейтральной по заряду группой, такой как амид либо сложный эфир. В одном из вариантов осуществления эти аналоги глюкагона содержат последовательность SEQ ID NO: 20, где карбоксиконцевая аминокислота имеет амидную группу вместо карбоксильной группы, находящейся в нативной аминокислоте. Эти аналоги глюкагона имеют сильную активность как на глюкагоновых, так и на GLP-1-рецепторах и, таким образом, выступают на обоих рецепторах в качестве соагонистов. В одном из вариантов осуществления предлагается соагонист глюкагонового и GLP-1-рецептора, где пептид содержит последовательность SEQ ID NO: 20, в которой аминокислотой в положении 28 является Asn или Lys и аминокислотой в положении 29 является амид Thr. Повышенная активность на GLP-1-рецепторе обеспечивается также благодаря стабилизации спиральной структуры С-концевой части глюкагона (приблизительно аминокислоты 12-29) посредством образования внутримолекулярного мостика между боковыми цепями двух аминокислот, разделенных тремя промежуточными аминокислотами. В соответствии с другими вариантами осуществления мостик или линкер имеет приблизительно 8 (либо приблизительно 7-9) атомов в длину и образуется между боковыми цепями аминокислот в положениях 12 и 16, или в положениях 16 и 20, или в положениях 20 и 24,или в положениях 24 и 28. Боковые цепи этих аминокислот могут связываться между собой посредством водородных связей либо ионных взаимодействий, таких как образование солевых мостиков, или с помощью ковалентных связей. В одном из вариантов осуществления предлагается агонист глюкагона, содержащий глюкагоновый пептид с последовательностью SEQ ID NO: 20, где лактамный цикл образуется между боковыми цепями остатка лизина, находящегося в положении 12, 20 либо 28, и остатком глутаминовой кислоты, находящимся в положении 16 либо 24, где две аминокислоты глюкагонового пептида,боковые цепи которых участвуют в образовании лактамного цикла, отделены одна от другой тремя промежуточными аминокислотами. В одном из вариантов осуществления лактамсодержащий аналог глюкагона содержит аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ IDNO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. В одном из вариантов осуществления карбоксиконцевая аминокислота лактамсодержащего пептида содержит амидную группу либо сложноэфирную группу вместо концевой карбоксильной группы. В одном из вариантов осуществления глюкагоновый пептид с последовательностями SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ IDNO: 16, SEQ ID NO: 17 и SEQ ID NO: 18 дополнительно содержит дополнительную аминокислоту, ковалентно присоединенную к карбоксильному концу последовательностей SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. В соответствии с еще одним вариантом осуществления предлагается глюкагоновый пептид, который содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 66,SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, и также содержит дополнительную аминокислоту, ковалентно присоединенную к карбоксильному концу последовательностей SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69. В одном из вариантов осуществления аминокислотой в положении 28 является аспарагин либо лизин и аминокислотой в положении 29 является треонин. Повышенная активность на GLP-1-рецепторе обеспечивается также модифицированием аминокислоты в положении 20. В одном из вариантов осуществления глутамин в положении 20 заменяют другой гидрофильной аминокислотой, имеющей боковую цепь, которая заряжена или же обладает способностью к образованию водородной связи и имеет в длину по меньшей мере приблизительно 5 (или приблизительно 4-6) атомов, например лизином, цитруллином, аргинином либо орнитином. Любая из описанных выше модификаций, которая повышает или снижает активность глюкагонового рецептора и которая повышает активность GLP-1-рецептора, может осуществляться отдельно либо комбинировано. Комбинации модификаций, повышающих активность GLP-1-рецептора, как правило,обеспечивают более высокую активность GLP-1, нежели любая из таких модификаций по отдельности. Например, настоящее изобретение предлагает аналоги глюкагона, содержащие модификации в положении 16, в положении 20 и на С-концевой карбоксильной группе, факультативно с ковалентной связью между аминокислотами в положениях 16 и 20; аналоги глюкагона, содержащие модификации в положении 16 и на С-концевой карбоксильной группе; аналоги глюкагона, содержащие модификации в положениях 16 и 20, факультативно с ковалентной связью между аминокислотами в положениях 16 и 20; и аналоги глюкагона, содержащие модификации в положении 20 и на С-концевой карбоксильной группе; факультативно при условии, что аминокислотой в положении 12 не является Arg; или же факультативно при условии, что аминокислотой в положении 9 не является Glu. Другие модификации в положении 1 или положении 2, как описано в данном документе, могут повысить устойчивость пептида к расщеплению дипептидилпептидазой IV (DPP IV). Например, аминокислота в положении 2 может быть заменена D-серином, аланином, D-аланином, валином, глицином, Nметилсерином, N-метилаланином или же аминоизомасляной кислотой. В альтернативном варианте или же в дополнение к нему аминокислота в положении 1 может быть заменена D-гистидином, дезаминогистидином, гидроксилгистидином, ацетилгистидином, гомогистидином, N-метилгистидином, метилгистидином, имидазолуксусной кислотой или же ,-диметилимидазолуксусной кислотой (DMIA). Наблюдалось, что модификации в положении 2 (например, аминоизомасляная кислота (AIB) в положении 2) и в некоторых случаях модификации в положении 1 могут снижать активность глюкагона, иногда значительно; неожиданно подобное снижение активности глюкагона может быть восстановлено с помощью ковалентной связи между аминокислотами в положениях 12 и 16, 16 и 20 либо 20 и 24, например,лактамного мостика между глутаминовой кислотой в положении 16 и лизином в положении 20. В соответствии с другими вариантами осуществления любое из предшествующих соединений может быть дополнительно модифицировано для повышения стабильности модифицированием аминокислоты в положении 15 последовательности SEQ ID NO: 1 для снижения разложения пептида со временем,особенно в кислотных либо щелочных буферах. В соответствии с другим вариантом осуществления растворимость глюкагоновых пептидов, раскрытых в настоящем описании, повышается посредством ковалентного присоединения гидрофильной составляющей к пептиду. В одном из вариантов осуществления гидрофильной составляющей является полиэтиленгликолевая (PEG) цепь, факультативно присоединенная к пептиду в одном либо нескольких положениях 16, 17, 21, 24, 29 либо на С-конце. В соответствии с некоторыми вариантами осуществления нативную аминокислоту в этом положении заменяют аминокислотой, имеющей боковую цепь, пригодную для образования мостиковых связей с гидрофильными составляющими, для облегчения присоединения гидрофильной составляющей к пептиду. В соответствии с другими вариантами осуществления к пептиду на С-конце добавляют аминокислоту, модифицированную для включения гидрофильной груп-4 017849 пы. В одном из вариантов осуществления пептид-соагонист содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где боковая цепь аминокислотного остатка в одном из положений 16, 17, 21 или 24 упомянутого глюкагонового пептида дополнительно содержит полиэтиленгликолевую цепь, имеющую молекулярную массу, выбранную в диапазоне от приблизительно 500 до приблизительно 40000 Да. В одном из вариантов осуществления полиэтиленгликолевая цепь имеет молекулярную массу, выбранную в диапазоне от приблизительно 500 до приблизительно 5000 Да. В другом варианте осуществления полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 10000 до приблизительно 20000 Да. В других вариантах осуществления полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 20000 до приблизительно 40000 Да. В соответствии с другим вариантом осуществления растворимость любого из вышеупомянутых аналогов глюкагона может быть улучшена посредством аминокислотных замен и/или добавлений, которые вводят заряженную аминокислоту в С-концевую часть пептида, предпочтительно в С-концевое положение относительно положения 27 последовательности SEQ ID NO: 1. Факультативно в С-концевую часть могут быть введены одна, две или три заряженные аминокислоты предпочтительно в С-концевом направлении относительно положения 27. В одном из вариантов осуществления нативную(ые) аминокислоту(ы) в положениях 28 и/или 29 заменяют заряженными аминокислотами и/или в соответствии с другим вариантом осуществления к С-концу пептида также добавляют от одной до трех заряженных аминокислот. В дальнейших вариантах осуществления одна, две либо все заряженные аминокислоты имеют отрицательный заряд. Глюкагоновый пептид может подвергаться дополнительным модификациям, например консервативным заменам, что, тем не менее, позволяет ему сохранять активность глюкагона. В одном из вариантов осуществления предлагается пептид-аналог с последовательностью SEQ IDNO: 20, где упомянутый аналог отличается от последовательности SEQ ID NO: 20 1-2 заменами аминокислот в положениях 17-26, и в другом варианте осуществления упомянутый аналог отличается от пептида с последовательностью SEQ ID NO: 20 заменой аминокислоты в положении 20. В соответствии с одним из вариантов осуществления глюкагоновые пептиды, раскрытые в настоящем описании, модифицируются посредством добавления второго пептида к карбоксильному концу глюкагонового пептида, например последовательности SEQ ID NO: 26, SEQ ID NO: 27 либо SEQ ID NO: 28. В одном из вариантов осуществления глюкагоновый пептид, имеющий пептидную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ IDNO: 19, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, ковалентно соединяется посредством пептидной связи со вторым пептидом, где второй пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В другом варианте осуществления у глюкагоновых пептидов, содержащих С-концевой удлиняющий сегмент,треонин в положении 29 нативного глюкагонового пептида заменяется глицином. Аналог глюкагона,имеющий замену треонина глицином в положении 29 и содержащий карбоксильный концевой удлиняющий сегмент последовательности SEQ ID NO: 26, в четыре раза активнее на GLP-1-рецепторе по сравнению с нативным глюкагоном, модифицированным с включением карбоксильного концевого удлиняющего сегмента последовательности SEQ ID NO: 26. Активность на GLP-1-рецепторе может быть дополнительно повышена посредством замены нативного аргинина в положении 18 аланином. Таким образом, как описано в настоящем документе, предлагаются высокоэффективные аналоги глюкагона либо аналоги соагониста глюкагона, которые также проявляют повышенную растворимость и/или стабильность. Один из иллюстративных примеров высокоэффективного аналога глюкагона проявляет по меньшей мере приблизительно 200% активности нативного глюкагона на глюкагоновом рецепторе, факультативно растворим с концентрацией по меньшей мере 1 мг/мл при рН в пределах 6-8 (например, рН 7) и факультативно сохраняет по меньшей мере 95% исходного пептида (например, 5% или менее исходного пептида разлагается либо расщепляется) через 24 ч при температуре 25 С. Другой иллюстративный пример аналога соагониста глюкагона проявляет более чем приблизительно 40% либо более чем приблизительно 60% активности как на глюкагоновом рецепторе, так и на GLP-1-рецепторе (в соотношении в пределах приблизительно 1:3-3:1 либо в пределах приблизительно 1:2-2:1), факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН в пределах 6-8 (например, рН 7) и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Другой иллюстративный аналог соагониста глюкагона проявляет приблизительно 175% или более высокую активность нативного глюкагона на глюкагоновом рецепторе и приблизительно 20% либо более низкую активность нативного GLP-1 на GLP-1-рецепторе, факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН в пределах 6-8 (например, рН 7) и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Еще один иллюстративный аналог соагониста глюкагона проявляет приблизительно 10% или менее активности нативного глюкагона на глюкагоновом рецепторе и по меньшей мере приблизительно 20%) активности нативного GLP-1 на GLP-1-рецепторе,факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН в пределах 6-8 (например,-5 017849 рН 7) и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. Еще один иллюстративный аналог соагониста глюкагона проявляет приблизительно 10% или более низкую (но выше 0,1, 0,5 либо 1%) активность нативного глюкагона на глюкагоновом рецепторе и по меньшей мере приблизительно 50, 60, 70, 80, 90 или 100% либо более высокую активность нативногоGLP-1 на GLP-1-рецепторе, факультативно растворим при концентрации по меньшей мере 1 мг/мл при рН в пределах 6-8 (например, рН 7) и факультативно сохраняет по меньшей мере 95% исходного пептида через 24 ч при температуре 25 С. В некоторых вариантах осуществления такие аналоги глюкагона сохраняют по меньшей мере 22, 23, 24, 25, 26, 27 или 28 природных аминокислот в соответствующих положениях в нативном глюкагоне (например, имеют 1-7 модификаций, 1-5 модификаций либо 1-3 модификации по сравнению с природным глюкагоном). Любой из приведенных ниже пептидов исключается из числа соединений, соответствующих настоящему изобретению, хотя их дополнительные модификации, которые проявляют требуемую активность соагониста, фармацевтические композиции, наборы и методы лечения, в которых применяются такие соединения, могут быть включены в настоящее изобретение: пептид последовательности SEQ IDNO: 1 с [Arg12] заменой и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с [Arg12,Lys20] заменами и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с [Arg12, Lys24] заменами и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с [Arg12, Lys29] заменами и Сконцевым амидом; пептид последовательности SEQ ID NO: 1 с [Glu9] заменой; пептид последовательности SEQ ID NO: 1 с отсутствующим His1, с [Glu9, Glu16, Lys29] заменами и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с [Glu9, Glu16, Lys29] заменами и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с [Lys13, Glu17] заменами, присоединенными через лактамный мостик, и Сконцевым амидом; пептид последовательности SEQ ID NO: 1 с [Lys17, Glu21] заменами, присоединенными через лактамный мостик, и С-концевым амидом; пептид последовательности SEQ ID NO: 1 с отсутствующим His1, с [Glu20, Lys24] заменами, присоединенными через лактамный мостик. В соответствии с одним из вариантов осуществления предлагается фармацевтическая композиция,содержащая любой из новых глюкагоновых пептидов, раскрытых в настоящем описании, предпочтительно стерильный и предпочтительно имеющий уровень чистоты по меньшей мере 90, 91, 92, 93, 94, 95,96, 97, 98 или 99%, и фармацевтически приемлемый растворитель, носитель либо наполнитель. Такие композиции могут содержать глюкагоновый пептид с концентрацией по меньшей мере 0,5, 1, 2, 3, 4, 5, 6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 мг/мл или выше. В одном из вариантов осуществления фармацевтические композиции выполнены в виде водных растворов, которые стерилизуются и факультативно хранятся в различных емкостях. Соединения, соответствующие настоящему изобретению, можно применять в одном из вариантов осуществления, чтобы заранее изготовить растворы, готовые для инъекции. В других вариантах осуществления фармацевтические композиции выполнены в виде лиофилизированного порошка. Фармацевтические композиции могут дополнительно фасоваться как часть набора, который включает в себя одноразовое устройство для введения композиции больному. Емкости либо наборы могут маркироваться для хранения при комнатной либо при пониженной температуре. В соответствии с одним из вариантов осуществления предлагается способ ускоренного повышения уровня глюкозы или лечения гипогликемии с применением заранее полученной водной композиции глюкагоновых пептидов, соответствующих настоящему изобретению. Упомянутый способ включает стадию введения эффективного количества водного раствора, содержащего новый модифицированный глюкагоновый пептид, раскрытый в настоящем описании. В одном из вариантов осуществления глюкагоновый пептид пегилирован в положении 21 или 24 глюкагонового пептида, и полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 500 до приблизительно 5000 Да. В одном из вариантов осуществления раствор модифицированного глюкагона расфасовывается в устройство, применяемое для введения композиции больному, страдающему гипогликемией. В соответствии с одним из вариантов осуществления предлагается улучшенный способ регулирования уровня глюкозы в крови у инсулинзависимых больных. Упомянутый способ включает стадии введения инсулина в количестве, терапевтически эффективном для регулирования углеводного обмена веществ при диабете, и введения нового модифицированного глюкагонового пептида, раскрытого в настоящем описании, в количестве, терапевтически эффективном для предотвращения гипогликемии, где упомянутые стадии введения осуществляются раздельно в течение промежутка времени продолжительностью 12 ч. В одном из вариантов осуществления глюкагоновый пептид и инсулин вводят одновременно в виде единой композиции, причем глюкагоновый пептид пегилирован полиэтиленгликолевой цепью,имеющей молекулярную массу, выбранную в пределах от приблизительно 5000 до приблизительно 40000 Да. В другом варианте осуществления предлагается способ инициирования временного паралича кишечника. Упомянутый способ включает стадию введения больному одного либо нескольких глюкагоновых пептидов, раскрытых в настоящем описании. В еще одном варианте осуществления предлагается способ лечения гипергликемии либо способ снижения прироста массы тела или инициирования снижения массы тела, который включает введение эффективного количества водного раствора, содержащего глюкагоновый пептид, соответствующий настоящему изобретению. В одном из вариантов осуществления любой способ включает введение эффективного количества композиции, содержащей агонист глюкагона, выбранный из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ IDNO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19. В другом варианте осуществления упомянутый способ включает введение эффективного количества композиции, содержащей агонист глюкагона, где агонист глюкагона содержит глюкагоновый пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ IDNO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 66, SEQ ID NO: 67,SEQ ID NO: 68 и SEQ ID NO: 69, где аминокислота 29 глюкагонового пептида присоединена к второму пептиду через пептидную связь и упомянутый второй пептид содержит последовательности SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 28. В других вариантах осуществления предлагаются способы лечения диабета, включающие одновременное ведение традиционной дозы либо уменьшенной дозы инсулина и глюкагонового пептида, соответствующего настоящему изобретению. Предлагаются также способы лечения диабета с помощью глюкагонового пептида, соответствующего настоящему изобретению, без одновременного ведения инсулина. В еще одном аспекте настоящее изобретение предлагает новые способы лечения гипергликемии и новые способы снижения аппетита либо стимулирования снижения массы тела, которые включают введение молекулы соагониста глюкагона/GLP-1 (включая их фармацевтически приемлемые соли), которая активизирует как глюкагоновые, так и GLP-1-рецепторы. Агонизм, т.е. активизация, как глюкагоновых,так и GLP-1-рецепторов, обеспечивает при лечении гипергликемии неожиданное улучшение по сравнению только с агонизмом GLP-1. Таким образом, добавление глюкагонового агонизма обеспечивает неожиданный аддитивный или синергический эффект либо другое(ие) неожиданное(ые) благоприятное(ые) клиническое(ие) воздействие(я). В соответствии с упомянутыми способами предусматривается введение с обычной дозой инсулина, уменьшенной дозой инсулина либо без инсулина. Агонизм глюкагонового рецептора также имеет непредвиденное благотворное воздействие по сравнению только с агонизмомGLP-1 при стимулировании снижения массы тела либо предупреждении прироста массы тела. К примерам молекул соагонистов глюкагона/GLP-l относятся глюкагоновые пептиды, соответствующие настоящему изобретению, аналоги GLP-1, активизирующие как GLP-1-рецепторы, так и глюкагоновые рецепторы, гибриды глюкагона и GLP-1 или гибриды аналогов глюкагона и аналогов GLP-1 либо их химически модифицированные производные. В альтернативном варианте соединение, активизирующее глюкагоновый рецептор, может вводиться одновременно с соединением, активизирующим GLP1-рецептор (таким как аналог GLP-1, аналог эксендина-4 либо их производные). Изобретение предусматривает также одновременное ведение аналога агониста глюкагона с аналогом агониста GLP-1. Такие способы лечения гипергликемии и/или снижения аппетита либо стимулирования похудания включают введение аналога глюкагона с модификацией в положении 12 (например, Arg12), факультативно в сочетании с модификациями в положении 16 и/или 20. Способы, соответствующие настоящему изобретению, включают также введение аналогов глюкагона, имеющих внутримолекулярный мостик между боковыми цепями двух аминокислот в пределах участка аминокислот 12 и 29, которые разделяются тремя промежуточными аминокислотами, например положения 12 и 16, положения 13 и 17 (например, Lys13Glu17 либо Glu13Lys17), положения 16 и 20, положения 17 и 21 (например, Lys17Glu21 либоGlu17Lys21), положения 20 и 24 либо положения 24 и 28, при факультативном условии, что аминокислота в положении 9 не является Glu, и факультативно содержащих С-концевой амид либо сложный эфир. В соответствии с одним из вариантов осуществления из числа таких молекул соагонистов глюкагона/GLP-1 исключаются любые аналоги глюкагона либо аналоги GLP-1, которые согласно известному уровню техники пригодны для применения в таком способе. В другом варианте осуществления пептиды,описанные в патенте США 6864069, действующие как агонист GLP-1 и антагонист глюкагона при лечении диабета, также исключаются из числа молекул соагонистов глюкагона/GLP-1. В другом варианте осуществления при лечении диабета исключается применение антагонистов глюкагона, таких как антагонисты, описанные в публикациях Unson et al., J. Biol. Chem., 264:789-794 (1989), Ahn et al., J. Med.Chem., 44:3109-3116 (2001) и Sapse et al., Mol. Med., 8(5):251-262 (2002). В другом варианте осуществления оксинтомодулин или аналог глюкагона, который содержит 8 С-концевых аминокислот оксинтомодулина (последовательность SEQ ID NO: 27), также исключаются из числа молекул соагонистов глюкагона/GLP-1. Ожидается, что такие способы лечения гипергликемии будут пригодны для лечения гипергликемии различных типов, в том числе диабета, сахарного диабета типа I, сахарного диабета типа II, диабета беременных как инсулинзависимых, так и инсулиннезависимых, и сокращения количества осложнений,обусловленных диабетом, в том числе нефропатии, ретинопатии и сосудистых заболеваний. Предполагается, что такие способы снижения аппетита либо стимулирования снижения массы тела будут пригодны для уменьшения массы тела, предотвращения прироста массы тела, лечения ожирения различной этиологии, включая ожирение, инициированное лекарственными препаратами, и сокращения количества осложнений, связанных с ожирением, в том числе сосудистых заболеваний (коронарная болезнь сердца,-7 017849 инсульт, заболевания периферических сосудов, ишемическая реперфузия и т.п.), гипертензии, начальной стадии диабета типа II, гиперлипидемии, болезней костно-мышечной системы. Все терапевтические способы, фармацевтические композиции, наборы и другие подобные варианты осуществления, описание которых приведено в данном документе, предусматривают, что применение термина "аналоги глюкагона" охватывает все его фармацевтически приемлемые соли либо сложные эфиры. Краткое описание фигур Фиг. 1 - столбиковая диаграмма, представляющая стабильность глюкагона Cys21 малеимидоPEG5K,инкубированного при 37 С в течение 24, 48, 72, 96, 144 и 166 ч соответственно. Фиг. 2 - данные, полученные посредством HPLC анализа глюкагона Cys21 малеимидоPEG5K при рН 5, инкубированного при 37 С в течение 24, 72 или 144 ч соответственно. Фиг. 3 - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 3 сравнивается индуцирование глюкагонового рецептора аналогами глюкагона Е 16, K20 , Е 15, Е 16 , Е 16, K20 , Е 15, Е 16 , Е 16 и Gluc-NH2 . Фиг. 4 А и 4 В - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 4 А сравнивается индуцирование глюкагонового рецептора аналогамиGluc-NH2 с нативным глюкагоном , в то время как на фиг. 4 В сравнивается индуцирование GLP-1 рецептора аналогами глюкагона Gluc-NH2 , E16 Gluc-NH2, Orn3, E16 Glucи Nle3, E16 Gluc-NH2 с нативным GLP-1 . Фиг. 5A и 5 В - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 5 А сравнивается индуцирование глюкагонового рецептора аналогамиGluc-NH2 время как на фиг. 5 В сравнивается индуцирование GLP-1-рецептора аналогами глюкагона (Е 16, K20Gluc-NH2 , E15, E16 Gluc-NH2 и E16 Gluc-NH2 ) с GLP-1 ( ) и NH2-глюкагоном ( ). Фиг. 6 А и 6 В - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 6 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона (Gluc-NH2, K20 Е 24-NH2-лактам и Е 24K28-NH2-лактам ) с глюкагоном ( ), в то время как на фиг. 6 В сравнивается индуцирование GLP1-рецептора аналогами глюкагона (Gluc-NH2,K20 Е 24-NH2-лактам и Е 24K28-NH2-лактам ) с GLP-1 ( ). Фиг. 7 А и 7 В - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона. Конкретнее, на фиг. 7 А сравнивается индуцирование глюкагонового рецептора аналогами глюкагона (Gluc-NH2 , Е 16 Gluc-NH2, Е 16, K20 Gluc-NH2 и E16,K20 Cluc-NH2-лактам ) с глюкагоном ( ), в то время как на фиг. 7 В сравнивается индуцирование,Е 16, K20 Gluc-NH2 и Е 16, K20 Gluc-NH2-лактам ) с GLP-1 ( ). Фиг. 8A-8F - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона на глюкагоновом рецепторе (фиг. 8 А, 8 С и 8 Е) или на GLP-1-рецепторе (фиг. 8 В, 8 С и 8F), гдеhE - гомоглутаминовая кислота и hC - гомоцистеиновая кислота. Фиг. 9 А и 9 В - данные, показывающие рецептор-опосредованное индуцирование цАМФ аналогами глюкагона GLP-1 (17-26), где аминокислоты в положениях 17-26 нативного глюкагона (последовательность SEQ ID NO: 1) были заменены аминокислотами положений 17-26 нативного GLP-1 (последовательность SEQ ID NO: 50). Конкретнее, на фиг. 9 А сравнивается индуцирование глюкагонового рецептора сконструированными аналогами глюкагона GLP-1 (17-26), а на фиг. 9 В сравнивается индуцированиеGLP-1-рецептора сконструированными аналогами глюкагона GLP-1 (17-26). Фиг. 10 А-Е - диаграммы, представляющие in vivo данные, проявляющие способность глюкагоновых пептидов, соответствующих настоящему изобретению, инициировать снижение массы мышами, которым подкожным путем были введены указанные количества соответствующих соединений. Идентификаторы последовательностей для глюкагонового пептида, перечисленные на фиг. 10 А-10 Е, выглядят следующим образом: фиг. 10 А: химера 2 Aib2 C24 40K PEG (SEQ ID NO: 486), Aib2 C24 химера 2 40K лактам (SEQ ID NO: 504) и Aib2 E16 K20 Gluc-NH2 Lac 40K (SEQ ID NO: 528); фиг. 10 В: Aib2 C24 Chi 2 лактам 40K (SEQ ID NO: 504), DMIA1 C24 Chi 2 лактам 40 К (SEQ ID NO: 505), химера 2 DMIA1 C24 40K(SEQ ID NO: 519) и химера 2 Aib2 C24 40K (SEQ ID NO: 486), где цифра в конце последовательности обозначает использованную дозировку, 70 либо 350 нмоль/кг; фиг. 10 С: AIB2 без лактама С 24 40K (SEQE16 K20 без лактама/Сех С 24 40K (SEQ ID NO: 513), где цифра в конце последовательности обозначает использованную дозировку, 14 нмоль/кг/неделя либо 70 нмоль/кг/неделя; фиг. 10 Е: AIB2 без лактама С 24 40K (SEQ ID NO: 486), Chi 2 AIB2 С 24 CEX 40K (SEQ ID NO: 533), AIB2 E16 A18 K20 C24 40KC41-2 (SEQ ID NO: 532), AIB2 без лактама CEX C24 C40-2 (SEQ ID NO: 531) и AIB2 без лактама С 24 60K (SEQ ID NO: 498), где обозначение 40K или 60K представляет молекулярную массу полиэтиленгликолевой цепи, присоединенной к глюкагоновому пептиду. Подробное описание Определения В описании и формуле изобретения будет применяться следующая терминология, соответствующая определениям, приведенным ниже. Термин "фармацевтически приемлемый носитель", применяемый в настоящем описании, охватывает любой из обычных фармацевтических носителей, таких как забуференный фосфатом солевой раствор,вода, эмульсии, такие как эмульсия масла в воде либо эмульсия воды в масле, и увлажняющие средства различных типов. Упомянутый термин охватывает также любой из агентов, одобренных органом регулирования федерального правительства США или приведенных в Фармакопее США для применения на животных, включая людей. Термин "фармацевтически приемлемая соль", применяемый в настоящем описании, обозначает соли соединений, которые сохраняют биологическую активность исходного соединения и которые не являются нежелательными ни в биологическом, ни в других отношениях. Многие соединения, раскрытые в настоящем описании, способны образовывать кислые и/или основные соли вследствие присутствия аминогрупп и/или карбоксильных групп либо групп, им подобных. Фармацевтически приемлемые соли с основаниями могут быть получены из неорганических и органических оснований. К числу солей, производных неорганических оснований, относятся (только в качестве примера) соли натрия, калия, лития, аммония, кальция и магния. К числу солей, производных органических оснований, относятся (но ими не ограничиваются) соли первичных, вторичных и третичных аминов. Фармацевтически приемлемые соли с кислотами могут быть получены из неорганических и органических кислот. К числу солей, производных неорганических кислот, относятся соли хлористоводородной кислоты, бромисто-водородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. К числу солей, производных органических кислот, относятся соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, n-толуолсульфоновой кислоты, салициловой кислоты и т.п. Термин "лечение", применяемый в настоящем описании, охватывает профилактику определенного расстройства либо состояния или облегчение тяжести симптомов, связанных с определенным расстройством либо состоянием и/или предотвращение либо ликвидацию упомянутых симптомов. Например,термин "лечение диабета", применяемый в настоящем описании, будет в общем относиться к изменению уровня глюкозы в крови в направлении нормального уровня и может включать повышение или снижение уровня глюкозы в крови в зависимости от конкретной ситуации. Определение "эффективное" количество или "терапевтически эффективное количество" глюкагонового пептида, применяемое в настоящем описании, обозначает нетоксическое, но достаточное количество пептида для обеспечения достижения желаемого эффекта. Например, одним из желаемых эффектов было бы предотвращение либо лечение гипогликемии, определяемой, например, по повышению уровня глюкозы в крови. Альтернативным желаемым эффектом для аналогов соагонистов, раскрытых в настоящем описании, было бы включение лечения гипергликемии, определяемой, например, по незначительному отклонению уровня глюкозы в крови от нормального, либо инициирование снижения массы тела/предупреждение прироста массы тела, определяемое, например, по уменьшению массы тела, либо предотвращение или снижение прироста массы тела, или нормализацию распределения жирового компонента тела. Количество, являющееся "эффективным", будет изменяться от субъекта к субъекту в зависимости от возраста и общего состояния индивида, способа введения и т.п. Таким образом, не всегда возможно определить точное "эффективное количество". Однако подходящее "эффективное" количество в любом отдельном случае может быть определено средним специалистом в этой области посредством общепринятой практики экспериментирования. Термин "парентерально" обозначает не через пищеварительный тракт, а каким-либо иным путем,например подкожным, внутримышечным, интраспинальным либо внутривенным. Термин "очищенный" и подобные термины, применяемые в настоящем описании, относятся к вы-9 017849 делению молекулы или соединения в форме, являющейся по сути свободной от примесей, которые, как правило, связываются с молекулой либо соединением в нативном либо природном окружении. Термин"очищенный", применяемый в настоящем описании, не требует абсолютной чистоты; этот термин, скорее, применяется в качестве относительного определения. Словосочетание "очищенный полипептид" применяется здесь для описания полипептида, который был отделен от других соединений, в том числе(но без ограничения) от молекул нуклеиновых кислот, липидов и углеводов. Термин "выделенный" обозначает удаление эталонного материала из его естественного окружения(например, природного окружения, если он встречается в естественных условиях). Например, естественно встречающийся полинуклеотид, присутствующий в живом животном, не является выделенным, но тот же самый полинуклеотид, отделенный от некоторой части либо всех сосуществующих в природной системе материалов, является выделенным. Термин "пептид", применяемый в настоящем описании, обозначает последовательность из 3 или более аминокислот, как правило, меньше чем 50 аминокислот, где упомянутые аминокислоты являются естественными либо искусственными аминокислотами. Искусственные аминокислоты означают аминокислоты, которые не встречаются in vivo в природных условиях, но которые, тем не менее, могут быть включены в пептидные структуры, описание которых приведено в данном документе. Термины "полипептид" и "белок", применяемые в настоящем описании, представляют собой термины, применяемые взаимозаменяемо для обозначения полимера аминокислот, независимо от длины упомянутого полимера. Длина полипептидных и белковых полимеров, как правило, превосходит длину"пептидов". Словосочетание "глюкагоновый пептид", применяемое в настоящем описании, обозначает любой пептид, содержащий либо аминокислотную последовательность SEQ ID NO: 1 или любой аналог аминокислотной последовательности SEQ ID NO:1, включая замены аминокислот, добавления, делеции или посттрансляционные модификации (например, метилирование, ацилирование, убиквитирование, внутримолекулярное ковалентное связывание, такое как образование лактамных мостиков, пегилирование и т.п.) пептида, где упомянутый аналог стимулирует активность глюкагонового или GLP-1-рецептора, что определяется, например, по уровню продуцирования цАМФ с помощью анализа, описание которого приведено в примере 14. Словосочетание "агонист глюкагона" обозначает комплексное соединение, содержащее глюкагоновый пептид, который стимулирует активность глюкагонового рецептора, что определяется, например, по уровню продуцирования цАМФ с помощью анализа, описание которого приведено в примере 14. Словосочетание "аналог агониста глюкагона", применяемое в настоящем описании, обозначает глюкагоновый пептид, содержащий последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 иSEQ ID NO: 15, либо аналог такой последовательности, которая была модифицирована с включением одной или нескольких консервативных аминокислотных замен в одном или нескольких положениях 2, 5,7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29. Термин "модификация" аминокислоты, применяемый в настоящем описании, обозначает замену,добавление либо делецию аминокислоты и охватывает замену любой из 20 аминокислот либо добавление любой из 20 аминокислот, которые обычно входят в состав человеческих белков, а также атипичных либо искусственных аминокислот. Все ссылки в описании на конкретные номера положений аминокислоты (например, положение 28) относятся к аминокислоте в этом положении в нативном глюкагоне (последовательность SEQ ID NO: 1) либо к положению соответствующей аминокислоты в любом из его аналогов. Например, ссылка в описании на "положение 28" будет обозначать соответствующее положение 27 для аналога глюкагона, в котором первая аминокислота последовательности SEQ ID NO: 1 была удалена. Подобным же образом, ссылка в описании на "положение 28" будет обозначать соответствующее положение 29 для аналога глюкагона, у которого перед N-концом последовательности SEQ ID NO: 1 была добавлена одна аминокислота. К числу имеющихся на рынке источников атипичных аминокислот относятся компания Sigma-Aldrich (Milwaukee, штат Висконсин), компания ChemPep Inc. (Miami, штат Флорида) и компания Genzyme Pharmaceuticals (Cambridge, штат Массачусетс). Атипичные аминокислоты могут быть закуплены от коммерческих поставщиков, синтезированы de novo, химически модифицированы либо получены из других аминокислот. Словосочетание "соагонист глюкагона", применяемое в настоящем описании, обозначает глюкагоновый пептид, проявляющий активность на глюкагоновом рецепторе, уровень которой составляет по меньшей мере от приблизительно 10 до приблизительно 500% или более по сравнению с нативным глюкагоном, и также проявляющий активность на GLP-1-рецепторе, уровень которой составляет по меньшей мере от приблизительно 10 до приблизительно 200% или более по сравнению с нативным GLP-1. Словосочетание "молекула соагониста глюкагона/GLP-1", применяемое в настоящем описании,обозначает молекулу, проявляющую активность на глюкагоновом рецепторе, уровень которой составляет по меньшей мере приблизительно 10% по сравнению с нативным глюкагоном, и также проявляющую активность на GLP-1-рецепторе, уровень которой составляет по меньшей мере приблизительно 10% по сравнению с нативным GLP-1. Словосочетание "нативный глюкагон", применяемое в настоящем описании, обозначает пептид, содержащий последовательность SEQ ID NO: 1; словосочетание "нативный GLP-1" представляет собой обобщающий термин, обозначающий амид GLP-1(7-36) (содержащий последовательность SEQ ID NO: 52), кислоту GLP-1(l-37) (содержащую последовательность SEQ ID NO: 50) либо смесь двух этих соединений. Общая ссылка в этом описании на "глюкагон" либо "GLP-1" при отсутствии любых дополнительных определений обозначает нативный глюкагон либо нативный GLP-1 соответственно. Термин "замена" аминокислоты, применяемый в настоящем описании, обозначает замену одного остатка аминокислоты другим остатком аминокислоты. Словосочетание "консервативная замена аминокислот", применяемое в настоящем описании, определяется как замена в пределах одной из пяти приведенных ниже групп:I) небольшие алифатические, неполярные либо слегка полярные остаткиII) полярные, отрицательно заряженные остатки и их амиды и сложные эфирыPhe, Tyr, Trp, ацетилфенилаланин. Обобщающее словосочетание "полиэтиленгликолевая цепь" или "PEG-цепь", применяемое в настоящем описании, обозначает смеси конденсационных полимеров этиленоксида и воды в виде разветвленной или неразветвленной цепи, представленной общей формулой H(OCH2CH2)nOH, где n равняется по меньшей мере 9. При отсутствии любых дополнительных определений упомянутое словосочетание обозначает полимеры этиленгликоля с усредненным значением молекулярной массы, выбранным в пределах от 500 до 40000 Да. Словосочетание "полиэтиленгликолевая цепь" или "PEG-цепь" применяется в сочетании с числовым индексом для обозначения ее приблизительной средней молекулярной массы. Например, PEG-5000 означает полиэтиленгликолевую цепь, имеющую усредненное значение молекулярной массы приблизительно 5000 Да. Термин "пегилированный" и подобные термины, применяемые в настоящем описании, относятся к соединению, которое было модифицировано по сравнению с его нативным состоянием посредством присоединения к упомянутому соединению полиэтиленгликолевой цепи. "Пегилированный глюкагоновый пептид" представляет собой глюкагоновый пептид, имеющий полиэтиленгликолевую цепь, ковалентно присоединенную к упомянутому глюкагоновому пептиду. Общая ссылка на пептид, которая применяется в настоящем описании, относится к пептидам,имеющим модифицированные амино- и карбоксильные концы. Например, аминокислотная цепь, содержащая амидную группу вместо концевой карбоксильной кислоты, определяется аминокислотной последовательностью, обозначающей стандартные аминокислоты. Термин "линкер", применяемый в настоящем описании, обозначает связь, молекулу либо группу молекул, соединяющую две отдельные составляющие одна с другой. Линкеры могут определять оптимальное пространственное размещение двух составляющих или же могут дополнительно обеспечивать лабильную связь, которая предоставляет возможность взаимного разделения двух составляющих. К числу лабильных связей относятся фоторасщепляемые группы, не стойкие к воздействию кислот группы, не стойкие к воздействию оснований группы и расщепляемые ферментами группы. Термин "димер", применяемый в настоящем описании, обозначает комплексное соединение, содержащее две субъединицы, ковалентно присоединенные одна к другой посредством линкера. Термин "димер", в случае его применения без каких-либо определений, обозначает как гомодимеры, так и гетеродимеры. Гомодимер содержит две идентичные субъединицы, в то время как гетеродимер содержит две субъединицы, которые различаются, несмотря на то, что две упомянутые субъединицы являются по сути подобными одна другой. Словосочетание "заряженная аминокислота", применяемое в настоящем описании, означает аминокислоту, которая содержит боковую цепь, отрицательно заряженную (т.е. депротонированную) или положительно заряженную (т.е. протонированную), в водном растворе при физиологическом рН. Например, к числу отрицательно заряженных аминокислот относятся аспарагиновая кислота, глутаминовая кислота, цистеиновая кислота, гомоцистеиновая кислота и гомоглутаминовая кислота, в то время как к числу положительно заряженных аминокислот относятся аргинин, лизин и гистидин. К заряженным аминокислотам относятся заряженные аминокислоты из числа 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичные либо искусственные аминокислоты. Словосочетание "кислая аминокислота", применяемое в настоящем описании, означает аминокислоту, которая содержит вторую кислую составляющую, включая, например, карбоксильную либо сульфокислотную группы. Примеры осуществления Настоящее изобретение предлагает глюкагоновые пептиды с повышенной либо пониженной активностью на глюкагоновом рецепторе, GLP-1-рецепторе либо на обоих рецепторах. Настоящее изобретение предлагает также глюкагоновые пептиды с измененной избирательностью в отношении глюкагонового рецептора, по сравнению с GLP-1-рецептором. Повышенная активность на глюкагоновом рецепторе обеспечивается модификацией аминокислоты в положении 16 нативного глюкагона (последовательность SEQ ID NO: 1), как описано в данном документе. Пониженная активность на глюкагоновом рецепторе обеспечивается, например, модификацией аминокислоты в положении 3, как описано в данном документе. Повышенная активность на GLP-1-рецепторе обеспечивается посредством замены карбоксильной трупы С-концевой аминокислоты нейтральной по заряду группой, такой как амид либо сложный эфир. Повышенная активность на GLP-1-рецепторе обеспечивается посредством модификаций, предоставляющих возможность образования внутримолекулярного мостика между боковыми цепями двух аминокислот, разделенных тремя промежуточными аминокислотами, например, в положениях 12 и 16, или 16 и 20, или 20 и 24, как описано в данном документе. Повышенная активность на GLP-1-рецепторе обеспечивается модификацией аминокислоты в положении 20, как описано в данном документе. Повышенная активность на GLP-1-рецепторе предлагается у аналогов глюкагона, содержащих Сконцевой удлиняющий сегмент (последовательность SEQ ID NO: 26). Активность на GLP-1-рецепторе у таких аналогов, содержащих последовательность SEQ ID NO: 26, может дополнительно повышаться посредством модифицирования аминокислоты в положении 18, 28 или 29 либо в положении 18 и 29, как описано в данном документе. Восстановление активности на глюкагоновом рецепторе, которая была снижена модификациями аминокислот в положениях 1 и 2, обеспечивается с помощью ковалентной связи между боковыми цепями двух аминокислот, разделенных тремя промежуточными аминокислотами, например, в положениях 12 и 16, или 16 и 20, или 20 и 24, как описано в данном документе. Дополнительное незначительное повышение активности на GLP-1-рецепторе обеспечивается посредством модифицирования аминокислоты в положении 10, которой является Trp. Любая из описанных выше модификаций, которая повышает или снижает активность на глюкагоновом рецепторе и которая повышает активность на GLP-1-рецепторе, может осуществляться отдельно либо в комбинации. Любая из описанных выше модификаций может также сочетаться с другими модификациями, которые обеспечивают получение других необходимых свойств, таких как повышенная растворимость, и/или стабильность, и/или продолжительность действия. В альтернативном варианте любая из описанных выше модификаций может сочетаться с другими модификациями, которые не оказывают существенного влияния на растворимость, стабильность либо активность. К примерам модификаций относятся (но ими не ограничиваются) приведенные ниже:(A) улучшение растворимости, например, посредством введения одной, двух, трех или более заряженных аминокислот в С-концевую часть нативного глюкагона, предпочтительно в С-концевом направлении относительно положения 27. Такая заряженная аминокислота может быть введена путем замены нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29 или в альтернативном варианте путем добавления заряженной аминокислоты, например, после положения 27, 28 или 29. В иллюстративных вариантах осуществления одна, две, три либо все заряженные аминокислоты имеют отрицательный заряд. В других вариантах осуществления одна, две, три либо все заряженные аминокислоты являются положительно заряженными. Такие модификации повышают растворимость,например обеспечивают по меньшей мере 2-, 5-, 10-, 15-, 25-, 30-кратное или большее увеличение растворимости по сравнению с нативным глюкагоном при заданном рН в пределах от приблизительно 5,5 до 8, например рН 7, при определении через 24 ч при температуре 25 С;(B) повышение растворимости и увеличение продолжительности действия или периода полувыведения из плазмы посредством добавления гидрофильной составляющей, такой как полиэтиленгликолевая цепь, как описано в данном документе, например, в положении 16, 17, 20, 21, 24 или 29 либо на С-конце пептида;(C) повышение стабильности модифицированием аспарагиновой кислоты в положении 15, например, путем делеции или замены глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой либо гомоцистеиновой кислотой. Такие модификации могут уменьшить разложение или расщепление при рН в пределах от 5,5 до 8, например, с сохранением по меньшей мере 75, 80, 90, 95, 96, 97, 98% или 99% исходного пептида через 24 ч при температуре 25 С;(D) повышение стабильности модифицированием аминокислоты в положении 27, например, путем замены метионином, лейцином либо норлейцином. Такие модификации могут уменьшить окислительную деструкцию;(F) консервативные замены, добавления или делеции, которые не оказывают отрицательного воздействия на активность, например консервативные замены в одном либо нескольких положениях 2, 5, 7,10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 либо 29; или делеция аминокислоты 29, факультативно присоединенной к С-концевому амиду либо сложному эфиру вместо С-концевой карбоксильной группы;(Н) гомодимеризация или гетеродимеризация, как описано в данном документе. В иллюстративных вариантах осуществления глюкагоновый пептид может содержать суммарно 1,до 2, до 3, до 4, до 5, до 6, до 7, до 8, до 9 или до 10 модификаций аминокислот по сравнению с последовательностью нативного глюкагона. В одном из вариантов осуществления, раскрытых в настоящем описании, предложен агонист глюкагона, модифицированный по сравнению с пептидом дикого типа (His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-AspTyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr(последовательность SEQ ID NO: 1 для повышения активности пептида на глюкагоновом рецепторе. Неожиданно заявители обнаружили, что серин, занимающий положение 16 нативного глюкагона (последовательностьSEQ ID NO: 1), может быть заменен выбранной кислой аминокислотой для повышения активности глюкагона, с точки зрения его способности стимулировать синтез цАМФ в испытании in vitro модели (см. пример 14). Конкретнее, эта замена повышает активность аналога на глюкагоновом рецепторе по меньшей мере в 2, 4, 5 и до 10 раз. Эта замена также повышает активность аналога на GLP-1-рецепторе по меньшей мере в 5, 10 или 15 раз по сравнению с нативным глюкагоном, однако избирательность сохраняется в отношении глюкагонового рецептора по сравнению с GLP-1-рецептором. В соответствии с одним из вариантов осуществления остаток серина в положении 16 нативного глюкагона заменяется аминокислотой, выбранной из группы, которую составляют глутаминовая кислота,глутамин, гомоглутаминовая кислота, гомоцистеиновая кислота, треонин или глицин. В соответствии с другим вариантом осуществления остаток серина в положении 16 нативного глюкагона заменяется аминокислотой, выбранной из группы, которую составляют глутаминовая кислота, глутамин, гомоглутаминовая кислота и гомоцистеиновая кислота, и в еще одном из вариантов осуществления остаток серина заменяется глутаминовой кислотой. В одном из вариантов осуществления глюкагоновый пептид, обладающий повышенной специфичностью в отношении глюкагонового рецептора, содержит пептид последовательностей SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 либо аналог агониста глюкагона, где карбоксиконцевая аминокислота сохраняет свою нативную карбоксильную группу. В соответствии с одним из вариантов осуществления предлагается агонист глюкагона, содержащий последовательность NH2-HisSer-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-TrpLeu-Met-Asn-Thr-COOH (последовательность SEQ ID NO: 10), где пептид проявляет приблизительно в пять раз более высокую активность на глюкагоновом рецепторе по сравнению с нативным глюкагоном,как определяется in vitro анализом цАМФ примера 14. Глюкагоновые пептиды, соответствующие настоящему изобретению, могут быть дополнительно модифицированы для улучшения растворимости и стабильности пептида в водных растворах при физиологическом рН с одновременным сохранением высокой биологической активности по сравнению с нативным глюкагоном. В соответствии с одним из вариантов осуществления предполагается, что введение гидрофильных групп в положениях 17, 21 и 24 пептида последовательности SEQ ID NO: 9 либо последовательности SEQ ID NO: 10, улучшит растворимость и стабильность высокоэффективного аналога глюкагона в растворах, имеющих физиологический рН. Введение таких групп также увеличивает продолжительность действия, например, поскольку определяется более длительным периодом полувыведения из системы кровообращения. К числу подходящих гидрофильных составляющих относятся любые водорастворимые полимеры, известные в данной области, включая полиэтиленгликоль, гомо- или сополимеры полиэтиленгликоля, монометилзамещенный полимер полиэтиленгликоля (mPEG) либо полиоксиэтиленглицерол (POG). В соответствии с одним из вариантов осуществления гидрофильная группа содержит полиэтиленгликолевую (PEG) цепь. Конкретнее, в одном из вариантов осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 6 или последовательность SEQ ID NO: 7, где полиэтиленгликолевая цепь ковалентно присоединена к боковым цепям аминокислот, присутствующих в положениях 21 и 24 глюкагонового пептида, и карбоксиконцевая кислота пептида имеет карбоксильную группу. Настоящим описанием охватываются также другие конъюгаты, в которых глюкагоновые пептиды,соответствующие настоящему изобретению, присоединены факультативно посредством ковалентной связи и факультативно посредством линкера к конъюгату. Присоединение может осуществляться посредством ковалентных химических связей, физических сил, например электростатических, водородных,ионных, ван-дер-ваальсовых, гидрофобных либо гидрофильных взаимодействий. Могут применяться различные системы нековалентного связывания, в том числе биотин-авидин, лиганд/рецептор, фермент/ субстрат, нуклеиновая кислота/белок, связывающий нуклеиновую кислоту, липид/белок, связывающий липид, партнеры молекулы клеточной адгезии или же любые связывающие партнеры либо их фрагменты, которые обладают взаимным сродством. К примерам конъюгатов относятся (но ими не ограничиваются) гетерологичный пептид или поли- 13017849 пептид (включая, например, белок плазмы), средство направленной доставки, иммуноглобулин или его часть (например, вариабельный участок, гипервариабельный участок или Fc-фрагмент), диагностическая метка, такая как радиоизотоп, флуорофор либо энзиматическая метка, полимер, в том числе водорастворимые полимеры, или другие терапевтические либо диагностические агенты. В одном из вариантов осуществления предлагается конъюгат, содержащий глюкагоновый пептид, соответствующий настоящему изобретению, и белок плазмы, где белок плазмы выбран из группы, которую составляют альбумин,трансферрин, фибриноген и глобулины. В одном из вариантов осуществления белковой составляющей плазмы конъюгата является альбумин или трансферрин. В некоторых вариантах осуществления линкер содержит цепь атомов длиной от 1 до приблизительно 60 атомов, от 1 до 30 атомов или более, от 2 до 5 атомов, от 2 до 10 атомов, от 5 до 10 атомов или от 10 до 20 атомов. В некоторых вариантах осуществления все атомы цепи являются атомами углерода. В некоторых вариантах осуществления атомы цепи в каркасе линкера выбраны из группы, состоящей из С, О, N и S. Атомы цепи и линкеры могут быть выбраны в соответствии с их ожидаемой растворимостью (гидрофильностью), с целью получения более растворимого конъюгата. В некоторых вариантах осуществления линкер содержит функциональную группу, которая подвергается расщеплению ферментом, другим катализатором либо гидролитическими условиями, обнаруживаемыми в ткани-мишени, органе либо клетке. В некоторых вариантах осуществления длина линкера является достаточной для снижения потенциала стерического препятствия. Если линкер представляет собой ковалентную связь или пептидильную связь, а конъюгат является полипептидом,упомянутый конъюгат в целом может быть гибридным белком. Такие пептидильные линкеры могут иметь любую длину. Варианты линкеров имеют в длину от приблизительно 1 до 50 аминокислот, от 5 до 50 аминокислот, от 3 до 5 аминокислот, от 5 до 10 аминокислот, от 5 до 15 аминокислот или от 10 до 30 аминокислот. В альтернативном варианте такие гибридные белки могут быть получены методами рекомбинантных ДНК, известных среднему специалисту в этой области. В представленном описании раскрыты также глюкагоновые гибридные пептиды или белки, где второй пептид или полипептид был соединен с концом, например карбоксильным концом, глюкагонового пептида. Конкретнее, гибридный глюкагоновый пептид может содержать агонист глюкагона последовательностей SEQ ID NO: 55, SEQ ID NO: 9 или SEQ ID NO: 10, который дополнительно содержит аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), последовательность SEQ ID NO: 27(KRNRNNIA) или последовательность SEQ ID NO: 28 (KRNR), присоединенную к аминокислоте 29 глюкагонового пептида. В одном из вариантов осуществления аминокислотная последовательность SEQ IDID NO: 28 (KRNR) присоединяется к аминокислоте 29 глюкагонового пептида посредством пептидной связи. Заявители установили, что замена у глюкагоновых гибридных пептидов, содержащих С-концевой удлиняющий пептид эксендина-4 (например, последовательность SEQ ID NO: 26 или последовательность SEQ ID NO: 29), нативного остатка треонина в положении 29 глицином, резко усиливает активность на GLP-1-рецепторе. Эта аминокислотная замена может применяться в сочетании с другими модификациями, раскрытыми в настоящем описании, для повышения сродства аналогов глюкагона к GLP-1 рецептору. Например, замена T29G может комбинироваться с аминокислотными заменами S16E и N20K,факультативно с лактамным мостиком между аминокислотами 16 и 20 и факультативно с добавлением полиэтиленгликолевой цепи, как описано в данном документе. В одном из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, содержащий последовательность SEQ ID NO: 64. В одном из вариантов осуществления глюкагоновая пептидная часть глюкагонового гибридного пептида выбрана из группы, которую составляют последовательности SEQ ID NO: 55, SEQ ID NO: 2, SEQ IDNO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, где полиэтиленгликолевую цепь, в случае ее присутствия в положениях 17, 21, 24, или в С-концевой аминокислоте, или в обоих положениях 21 и 24, выбирают в диапазоне от 500 до 40000 Да. Конкретнее, в одном из вариантов осуществления глюкагоновый пептидный сегмент выбран из группы, которую составляют последовательности SEQ ID NO: 7, SEQ ID NO: 8 и SEQID NO: 63, где полиэтиленгликолевая цепь выбрана в диапазоне от 500 до 5000 Да. В одном из вариантов осуществления глюкагоновый пептид представляет собой гибридный пептид, содержащий последовательности SEQ ID NO: 55 и SEQ ID NO: 65, где пептид последовательности SEQ ID NO: 65 присоединен к карбоксильному концу последовательности SEQ ID NO: 55. В соответствии с одним из вариантов осуществления дополнительная химическая модификация глюкагонового пептида последовательности SEQ ID NO: 10 обеспечивает повышенную активность наGLP-1-рецепторе до такой степени, когда относительные активности на глюкагоновом рецепторе и GLP1-рецепторе оказываются фактически эквивалентными. Соответственно, в одном из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, где концевая аминокислота глюкагоновых пептидов, соответствующих настоящему изобретению, имеет амидную группу, вместо карбоксильной группы, присутствующей у нативной аминокислоты. Относительная активность аналога глюкагона на соответствующих глюкагоновых и GLP-1-рецепторах может регулироваться посредством дополнительных модификаций глюкагонового пептида с получением аналогов, проявляющих от приблизительно 40 до приблизительно 500% или более активности нативного глюкагона на глюкагоновом рецепторе и от приблизительно 20 до приблизительно 200% или более активности нативного GLP-1 на GLP-1- 14017849 рецепторе, например 50-, 100-кратное или более увеличение по сравнению с нормальной активностью глюкагона на GLP-1-рецепторе. В другом варианте осуществления предлагаются аналоги глюкагона, проявляющие активность соагониста глюкагонового/GLP-1-рецептора, где внутримолекулярный мостик образован между двумя боковыми цепями аминокислот для стабилизации объемной структуры карбоксильного конца пептида. Конкретнее, боковые цепи аминокислотных пар 12 и 16, 16 и 20, 20 и 24 или 24 и 28 присоединяются одна к другой и, тем самым, стабилизируют -спираль глюкагона. Две боковые цепи могут быть соединены одна с другой посредством водородных связей, ионных взаимодействий, таких как образование солевых мостиков, или же с помощью ковалентных связей. В некоторых вариантах осуществления величина цикла или линкера составляет приблизительно 8 атомов или приблизительно 7-9 атомов. К числу примеров составления пар аминокислот, способных к ковалентному связыванию с образованием линкерного мостика из семи атомов, относятся Orn-Glu (лактамный цикл); Lys-Asp (лактам) или гомосерин-гомоглутамин (лактон). К числу примеров составления пар аминокислот, которые могут образовывать линкер из восьми атомов, относятся Lys-Glu (лактам); гомолизин-Asp (лактам); Ornгомоглутамин (лактам); 4-амино-Phe-Asp (лактам); либо Tyr-Asp (лактон). К числу примеров составления пар аминокислот, которые могут образовывать линкер из девяти атомов, относятся гомолизин-Glu (лактам); Lys-гомоглутамин (лактам); 4-амино-Phe-Glu (лактам); либо Tyr-Glu (лактон). Любая из боковых цепей этих аминокислот может дополнительно заменяться дополнительными химическими группами до тех пор, пока не разрушается объемная структура -спирали. Средний специалист в этой области может предусмотреть альтернативное составление пар либо альтернативные аналоги аминокислот, в том числе химически модифицированные производные, которые могли бы образовать стабилизирующую структуру подобного же размера и необходимого действия. Например, дисульфидный мостик гомоцистеингомоцистеин имеет в длину 6 атомов и может подвергаться дополнительному модифицированию для получения желательного эффекта. Даже без ковалентного присоединения описанное выше составление пар аминокислот или же подобное составление пар, которое может предусматриваться средним специалистом в этой области, может также обеспечить дополнительную стабильность -спирали через нековалентные связи, например, посредством образования солевых мостиков либо взаимодействий водородных связей. Дополнительные варианты осуществления включают приведенное ниже составление пар, факультативно с лактамным мостиком: Glu в положении 12 с Lys в положении 16; нативный Lys в положении 12 сGlu в положении 16; Glu в положении 16 с Lys в положении 20; Lys в положении 16 с Glu в положении 20; Glu в положении 20 с Lys в положении 24; Lys в положении 20 с Glu в положении 24; Glu в положении 24 с Lys в положении 28; Lys в положении 24 с Glu в положении 28. В соответствии с одним из вариантов осуществления предлагается аналог глюкагона, проявляющий активность соагониста глюкагонового/GLP-1-рецептора, где упомянутый аналог содержит аминокислотную последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11,SEQ ID NO: 47, SEQ ID NO: 48 и SEQ ID NO: 49. В одном из вариантов осуществления боковые цепи ковалентно соединены между собой, а в другом варианте осуществления две аминокислоты соединены между собой с образованием лактамного цикла. Величина лактамного цикла может изменяться в зависимости от длины боковых цепей аминокислот, и в одном из вариантов осуществления лактам образуется посредством присоединения боковых цепей аминокислоты лизина к боковой цепи глутаминовой кислоты. Порядок амидной связи в лактамном цикле может изменяться на обратный (например, лактамный цикл может быть образован между боковыми цепями Lys 12 и Glu16 или в альтернативном варианте между Glu12 и Lys16). В соответствии с одним из вариантов осуществления предлагается аналог глюкагона последовательности SEQ ID NO: 45, где по меньшей мере один лактамный цикл образован между боковыми цепями аминокислотной пары, выбранной из группы, которую составляют аминокислотные пары 12 и 16, 16 и 20, 20 и 24 или 24 и 28. В одном из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, где упомянутый соагонист содержит аналог глюкагонового пептида последовательности SEQ ID NO: 20, где упомянутый пептид содержит внутримолекулярный лактамный мостик, образованный между положениями 12 и 16 аминокислот или же между положениями 16 и 20 аминокислот. В одном из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора,содержащий последовательность SEQ ID NO: 20, где внутримолекулярный лактамный мостик образован между положениями 12 и 16 аминокислот, между положениями 16 и 20 аминокислот или же между положениями 20 и 24 аминокислот и аминокислотой в положении 29 является глицин, где последовательность SEQ ID NO: 29 присоединена к С-концевой аминокислоте последовательности SEQ ID NO: 20. В другом варианте осуществления аминокислотой в положении 28 является аспарагиновая кислота. Растворимость глюкагонового пептида последовательности SEQ ID NO: 20 может быть дополнительно улучшена, например, введением одной, двух, трех или более заряженных аминокислот в Сконцевую часть глюкагонового пептида последовательности SEQ ID NO: 20, предпочтительно в Сконцевом направлении относительно положения 27. Такая заряженная аминокислота может быть введена посредством замены нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, либо в альтернативном варианте посредством добавления заряженной аминокислоты, например,после положения 27, 28 или 29. В дальнейших вариантах осуществления одна, две, три либо все заряженные аминокислоты являются отрицательно заряженными. В альтернативном варианте растворимость может также быть повышена посредством ковалентного присоединения гидрофильных составляющих,например полиэтиленгликоля, к пептиду. В соответствии с одним из вариантов осуществления предлагается аналог глюкагона, содержащий последовательность SEQ ID NO: 55, где упомянутый аналог отличается от последовательности SEQ IDNO: 55 1-3 аминокислотами, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27,28 и 29, причем упомянутый глюкагоновый пептид проявляет по меньшей мере 20% активности нативного GLP-1 на GLP-1-рецепторе. В соответствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1 рецептора, содержащий последовательность NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-TyrLeu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (последовательность SEQ IDNO: 33), в которой Хаа в положении 15 выбрана из группы аминокислот, которую составляют Asp, Glu,цистеиновая кислота, гомоглутаминовая кислота и гомоцистеиновая кислота, Хаа в положении 16 выбрана из группы аминокислот, которую составляют Ser, Glu, Gln, гомоглутаминовая кислота и гомоцистеиновая кислота, Хаа в положении 20 представляет собой Gln или Lys, Хаа в положении 24 представляет собой Gln или Glu, Хаа в положении 28 представляет собой Asn, Lys или кислую аминокислоту, Хаа в положении 29 представляет собой Thr, Gly или кислую аминокислоту, R представляет собой СООН илиLys, или в альтернативном варианте в случае, если в положении 16 находится серин, то в положении 24 находится Glu, а в положении 20 либо в положении 28 находится Lys. В одном из вариантов осуществления соагонист глюкагонового/GLP-1-рецептора содержит последовательность SEQ ID NO: 33, где аминокислотой в положении 28 является аспарагиновая кислота и аминокислотой в положении 29 является глутаминовая кислота. В другом варианте осуществления аминокислотой в положении 28 является нативный аспарагин, аминокислотой в положении 29 является глицин и аминокислотная последовательность SEQ ID NO: 29 или последовательность SEQ ID NO: 65 ковалентно присоединена к карбоксильному концу последовательности SEQ ID NO: 33. В одном из вариантов осуществления предлагается соагонист, содержащий последовательностьSEQ ID NO: 33, где к карбоксильному концу пептида добавлена дополнительная кислая аминокислота. В еще одном варианте осуществления карбоксиконцевая аминокислота аналога глюкагона имеет амид вместо карбоксильной группы природной аминокислоты. В одном из вариантов осуществления аналог глюкагона содержит последовательность, выбранную из группы, которую составляют последовательностиSEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44. В соответствии с одним из вариантов осуществления предлагается аналог глюкагонового пептида последовательности SEQ ID NO: 33, где упомянутый аналог отличается от последовательности SEQ IDNO:33 1-3 аминокислотами, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27 при условии, что в случае, если аминокислотой в положении 16 является серин, то в положении 20 находится лизин, либо между аминокислотой в положении 24 и любой аминокислотой в положении 20 либо в положении 28 образован лактамный мостик. В соответствии с одним из вариантов осуществления упомянутый аналог отличается от последовательности SEQ ID NO:33 1-3 аминокислотами, выбранными из положений 1, 2, 3, 21 и 27. В одном из вариантов осуществления аналог глюкагонового пептида последовательности SEQ ID NO: 33 отличается от этой последовательности 1-2 аминокислотами, либо в одном из вариантов осуществления одной аминокислотой, выбранной из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17,18, 19, 21 и 27 при условии, что в случае, если аминокислотой в положении 16 является серин, то в положении 20 находится лизин, либо между аминокислотой в положении 24 и любой аминокислотой в положении 20 либо в положении 28 образован лактамный мостик. В соответствии с другим вариантом осуществления предлагается относительно избирательный агонист GLP-1-рецептора, содержащий последовательность NH2-His-Ser-Xaa-Gly-Thr-Phe-Thr-Ser-Asp-TyrSer-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (последовательностьSEQ ID NO: 53), где Хаа в положении 3 выбрана из группы аминокислот, которую составляют Glu, Orn иNle, Хаа в положении 15 выбрана из группы аминокислот, которую составляют Asp, Glu, цистеиновая кислота, гомоглутаминовая кислота и гомоцистеиновая кислота, Хаа в положении 16 выбрана из группы аминокислот, которую составляют Ser, Glu, Gln, гомоглутаминовая кислота и гомоцистеиновая кислота,Хаа в положении 20 представляет собой Gln или Lys, Хаа в положении 24 представляет собой Gln илиGlu, Хаа в положении 28 представляет собой Asn, Lys или кислую аминокислоту, Хаа в положении 29 представляет собой Thr, Gly или кислую аминокислоту, R представляет собой СООН, CONH2, последовательность SEQ ID NO: 26 или последовательность SEQ ID NO: 29 при условии, что в случае, если в положении 16 находится серин, то в положении 20 находится Lys, или в альтернативном варианте в случае, если в положении 16 находится серин, то в положении 24 находится Glu, а в положении 20 либо в положении 28 находится Lys. В одном из вариантов осуществления аминокислотой в положении 3 является глутаминовая кислота. В одном из вариантов осуществления кислой аминокислотой, замененной в положении 28 и/или 29, является аспарагиновая кислота либо глутаминовая кислота. В одном из вариантов осуществления глюкагоновый пептид, в том числе пептид-соагонист, содержит последовательностьSEQ ID NO: 33, дополнительно содержащую добавочную кислую аминокислоту, добавленную к карбоксильному концу пептида. В другом варианте осуществления карбоксиконцевая аминокислота аналога глюкагона имеет амид вместо карбоксильной группы природной аминокислоты. В соответствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1 рецептора, содержащий модифицированный глюкагоновый пептид, выбранный из группы, которую составляют NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-AspPhe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (последовательность SEQ ID NO: 34), где Хаа в положении 15 выбрана из группы аминокислот, которую составляют Asp, Glu, цистеиновая кислота, гомоглутаминовая кислота и гомоцистеиновая кислота, Хаа в положении 16 выбрана из группы аминокислот, которую составляют Ser, Glu, Gln, гомоглутаминовая кислота и гомоцистеиновая кислота, Хаа в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Asp или Lys, R представляет собой СООН или CONH2, Xaa в положении 29 представляет собой Thr или Gly, R представляет собой СООН, CONH2, последовательности SEQ ID NO: 26 или SEQ ID NO: 29 при условии, что в случае, если в положении 16 находится серии, то в положении 20 находится Lys, или в альтернативном варианте в случае, если в положении 16 находится серии, то в положении 24 находится Glu, а в положении 20 либо в положении 28 находится Lys. В одном из вариантов осуществления R представляет собой CONH2, Xaa в положении 15 представляет собой Asp, Xaa в положении 16 выбрана из группы аминокислот, которую составляют Glu, Gln, гомоглутаминовая кислота и гомоцистеиновая кислота, каждая из Хаа в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp и Хаа в положении 29 представляет собой Thr. В одном из вариантов осуществления каждая из Хаа в положениях 15 и 16 представляет собой Glu, каждая из Хаа в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp, Xaa в положении 29 представляет собой Thr и R представляет собой CONH2. Сообщалось, что определенные положения нативного глюкагонового пептида могут быть модифицированы с сохранением, по меньшей мере, некоторой части активности исходного пептида. Соответственно, заявители предполагают, что одна либо несколько аминокислот, находящихся в положениях 2, 5,7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29 пептида последовательности SEQ ID NO: 11 могут быть заменены аминокислотой, отличающейся от кислоты, присутствующей в нативном глюкагоновом пептиде, с сохранением активности на глюкагоновом рецепторе. В одном из вариантов осуществления остаток метионина, присутствующий в положении 27 нативного пептида, заменен лейцином либо норлейцином для предотвращения окислительной деструкции упомянутого пептида. В другом варианте осуществления аминокислота в положении 20 заменена Lys, Arg, Orn или цитруллином и/или аминокислота в положении 21 заменена Glu, гомоглутаминовой кислотой либо гомоцистеиновой кислотой. В одном из вариантов осуществления предлагается аналог глюкагона последовательности SEQ IDNO: 20, где от 1 до 6 аминокислот, выбранных из положений 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 27, 28 или 29 аналога, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1 при условии, что в случае, если аминокислотой в положении 16 является серин, то в положении 20 находитсяLys, либо в альтернативном варианте в случае, если в положении 16 находится серин, то в положении 24 находится Glu, a в положении 20 либо в положении 28 находится Lys. В соответствии с другим вариантом осуществления предлагается аналог глюкагона последовательности SEQ ID NO: 20, где от 1 до 3 аминокислот, выбранных из положений 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20, 21, 27, 28 или 29 аналога,отличаются от соответствующей аминокислоты последовательности SEQ ID NO: l. В другом варианте осуществления предлагается аналог глюкагона последовательностей SEQ ID NO: 8, SEQ ID NO: 9 илиSEQ ID NO: 11, где от 1 до 2 аминокислот, выбранных из положений 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20 или 21 аналога, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1, и в еще одном варианте осуществления от 1 до 2 отличающихся аминокислот представляют собой консервативные аминокислотные замены по сравнению с аминокислотами, присутствующими в последовательности нативного глюкагона (последовательность SEQ ID NO: 1). В одном из вариантов осуществления предлагается глюкагоновый пептид последовательностей SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, причем упомянутый глюкагоновый пептид дополнительно содержит одну, две или три аминокислотные замены в положениях, выбранных из положений 2, 5, 7, 10, И, 13, 14, 17, 18, 19, 20,21, 27 или 29. В одном из вариантов осуществления замены в положениях 2, 5, 7, 10, 11, 13, 14, 16, 17, 18,19, 20, 21, 27 или 29 представляют собой консервативные аминокислотные замены. В соответствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1 рецептора, содержащий вариант последовательности SEQ ID NO: 33, где от 1 до 10 аминокислот варианта, выбранные из положений 16, 17, 18, 20, 21, 23, 24, 27, 28 и 29 соответственно, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1. В соответствии с одним из вариантов осуществления предлагается вариант последовательности SEQ ID NO: 33, причем упомянутый вариант отличается от последовательности SEQ ID NO: 33 одной или несколькими аминокислотными заменами,выбранными из группы, которую составляют Gln17, Ala18, Glu21, Ile23, Ala24, Val27 и Gly29. В соответ- 17017849 ствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора,содержащий варианты последовательности SEQ ID NO: 33, где от 1 до 2 аминокислот варианта, выбранные из положений 17-26, отличаются от соответствующей аминокислоты последовательности SEQ IDNO: 1. В соответствии с одним из вариантов осуществления предлагается вариант последовательностиSEQ ID NO: 33, где упомянутый вариант отличается от последовательности SEQ ID NO: 33 аминокислотной заменой, выбранной из группы, которую составляют Gln17, Ala18, Glu21, Ile23 и А 1 а 24. В соответствии с одним из вариантов осуществления предлагается вариант последовательности SEQ ID NO: 33,где упомянутый вариант отличается от последовательности SEQ ID NO: 33 аминокислотной заменой в положении 18, где замененная аминокислота выбрана из группы, которую составляют Ala, Ser, Thr, Pro иGly. В соответствии с одним из вариантов осуществления предлагается вариант последовательности SEQID NO: 33, причем упомянутый вариант отличается от последовательности SEQ ID NO: 33 заменой аминокислоты Ala в положении 18. Такие варианты предусматриваются последовательностью SEQ ID NO: 55. В другом варианте осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, содержащий варианты последовательности SEQ ID NO: 33, где от 1 до 2 аминокислот варианта, выбранные из положений 17-22, отличаются от соответствующей аминокислоты последовательности SEQ ID NO:1, и в соответствии с еще одним вариантом осуществления предлагается вариант последовательности SEQ IDNO: 33, причем упомянутый вариант отличается от последовательности SEQ ID NO: 33 1 или 2 аминокислотными заменами в положениях 20 и 21. В соответствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, содержащий последовательность NH2-His-Ser-GlnGly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Xaa-Phe-Val-Xaa-Trp-Leu-MetXaa-Xaa-R (последовательность SEQ ID NO: 51), причем Хаа в положении 15 представляет собой Asp,Glu, цистеиновую кислоту, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Хаа в положении 16 представляет собой Ser, Glu, Gln, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Хаа в положении 20 представляет собой Gln, Lys, Arg, Orn или цитруллин, Хаа в положении 21 представляет собой Asp, Glu, гомоглутаминовую кислоту либо гомоцистеиновую кислоту, Хаа в положении 24 представляет собой Gln или Glu, Хаа в положении 28 представляет собой Asn, Lys либо кислую аминокислоту, Хаа в положении 29 представляет собой Thr или кислую аминокислоту и R представляет собой СООН или CONH2. В одном из вариантов осуществления R представляет собой CONH2. В соответствии с одним из вариантов осуществления предлагается соагонист глюкагонового/GLP-1-рецептора, содержащий вариант последовательностей SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 47, SEQ ID NO: 48 или SEQ ID NO: 49, где упомянутый вариант отличается от упомянутой последовательности аминокислотной заменой в положении 20. В одном из вариантов осуществления аминокислотная замена для положения 20 выбрана из группы, которую составляют Lys, Arg, Orn и цитруллин. В одном из вариантов осуществления предлагается агонист глюкагона, содержащий пептид-аналог последовательности SEQ ID NO: 34, причем упомянутый аналог отличается от последовательности SEQID NO: 34 наличием в положении 2 аминокислоты, отличающейся от серина. В одном из вариантов осуществления остаток серина заменен аминоизомасляной кислотой либо аланином, и в одном из вариантов осуществления остаток серина заменен аминоизомасляной кислотой. Такие модификации подавляют расщепление дипептидилпептидазой IV с одновременным сохранением специфической активности исходного соединения (например, по меньшей мере 75, 80, 85, 90, 95% или более активности исходного соединения). В одном из вариантов осуществления растворимость аналога повышается, например, введением 1, 2, 3 или более заряженных аминокислот на С-концевой участок нативного глюкагона, предпочтительно в С-концевом направлении относительно положения 27. В дальнейших вариантах осуществления 1, 2, 3 или все заряженные аминокислоты являются отрицательно заряженными. В другом варианте осуществления упомянутый аналог дополнительно содержит замену нативной аминокислоты кислой аминокислотой в положении 28 или 29 или кислую аминокислоту, добавленную к карбоксильному концу пептида последовательности SEQ ID NO: 34. В одном из вариантов осуществления аналоги глюкагона, раскрытые в настоящем описании, дополнительно модифицированы в положении 1 или положении 2 для снижения восприимчивости к расщеплению дипептидилпептидазой IV. В одном из вариантов осуществления предлагается аналог глюкагона последовательностей SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 илиSEQ ID NO: 15, причем упомянутый аналог отличается от исходной молекулы заменой в положении 2 и проявляет пониженную восприимчивость (т.е. устойчивость) к расщеплению дипептидилпептидазой IV. Конкретнее, в одном из вариантов осуществления положение 2 пептида-аналога заменено аминокислотой, выбранной из группы, которую составляют d-серин, аланин, валин, амино-н-масляная кислота, глицин, N-метилсерин и аминоизомасляная кислота. В одном из вариантов осуществления положение 2 пептида-аналога заменено аминокислотой, выбранной из группы, которую составляют d-серин, аланин, глицин, N-метилсерин и аминоизомасляная кислота. В другом варианте осуществления положение 2 пептида-аналога заменено аминокислотой, выбранной из группы, которую составляют d-серин, глицин, Nметилсерин и аминоизомасляная кислота. В одном из вариантов осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 21 или последовательность SEQ ID NO: 22. В одном из вариантов осуществления предлагается аналог глюкагона последовательностей SEQ IDNO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, причем упомянутый аналог отличается от исходной молекулы заменой в положении 1 и проявляет пониженную восприимчивость (т.е. устойчивость) к расщеплению дипептидилпептидазой IV. Конкретнее, положение 1 пептида-аналога заменено аминокислотой, выбранной из группы, которую составляют d-гистидин, ,диметилимидазолуксусная кислота (DMIA), N-метилгистидин, -метилгистидин, имидазолуксусная кислота, дезаминогистидин, гидроксигистидин, ацетилгистидин и гомогистидин. В другом варианте осуществления предлагается агонист глюкагона, содержащий пептид-аналог последовательности SEQ ID NO: 34, где упомянутый аналог отличается от последовательности SEQ ID NO: 34 наличием в положении 1 аминокислоты, отличающейся от гистидина. В одном из вариантов осуществления растворимость аналога повышена,например, посредством введения 1, 2, 3 или более заряженных аминокислот на С-концевом участке нативного глюкагона, предпочтительно в С-концевом направлении относительно положения 27. В иллюстративных вариантах осуществления 1, 2, 3 или все заряженные аминокислоты являются отрицательно заряженными. В другом варианте осуществления аналог дополнительно содержит замену нативной аминокислоты кислой аминокислотой в положении 28 или 29 или кислую аминокислоту, добавленную к карбоксильному концу пептида последовательности SEQ ID NO: 34. В одном из вариантов осуществления кислой аминокислотой является аспарагиновая кислота либо глутаминовая кислота. В одном из вариантов осуществления соагонист глюкагонового/GLP-1-рецептора содержит последовательность SEQ ID NO: 20, дополнительно содержащую дополнительный карбоксиконцевой удлиняющий сегмент из одной аминокислоты либо пептида, выбранный из группы, которую составляют последовательности SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В одном из вариантов осуществления в случае, когда к карбоксильному концу последовательности SEQ ID NO: 20 добавлена одна аминокислота, упомянутая аминокислота, как правило, выбрана из числа 20 традиционных аминокислот, и в одном из вариантов осуществления дополнительная карбоксиконцевая аминокислота имеет амидную группу вместо карбоксильной группы нативной аминокислоты. В одном из вариантов осуществления дополнительная аминокислота выбрана из группы, которую составляют глутаминовая кислота, аспарагиновая кислота и глицин. В альтернативном варианте осуществления предлагается соагонист глюкагонового/GLP-1 рецептора, где пептид содержит по меньшей мере один лактамный цикл, образованный между боковой цепью остатка глутаминовой кислоты и остатком лизина, где остаток глутаминовой кислоты и остаток лизина разделены тремя аминокислотами. В одном из вариантов осуществления карбоксиконцевая аминокислота лактама, содержащая глюкагоновый пептид, имеет амидную группу вместо карбоксильной группы нативной аминокислоты. Конкретнее, в одном из вариантов осуществления предлагается соагонист глюкагона и GLP-1, содержащий модифицированный глюкагоновый пептид, выбранный из группы, которую составляют где Хаа в положении 28=Asp или Asn, Xaa в положении 29 представляет собой Thr или Gly, R выбран из группы, которую составляют СООН, CONH2, глутаминовая кислота, аспарагиновая кислота, глицин, последовательности SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, а лактамный мостик образован между Lys в положении 12 и Glu в положении 16 для последовательности SEQ ID NO: 66, между Glu в положении 16 и Lys в положении 20 для последовательности SEQ ID NO: 67, между Lys в положении 20 и Glu в положении 24 для последовательности SEQ ID NO: 68, между Glu в положении 24 и Lys в положении 28 для последовательности SEQ ID NO: 69, между Lys в положении 12 и Glu в положении 16 и междуSEQ ID NO: 17, между Glu в положении 16 и Lys в положении 20 и между Glu в положении 24 и Lys в положении 28 для последовательности SEQ ID NO: 18. В одном из вариантов осуществления R выбран из группы, которую составляют СООН, CONH2, глутаминовая кислота, аспарагиновая кислота и глицин,аминокислотой в положении 28 является Asn и аминокислотой в положении 29 является треонин. В одном из вариантов осуществления R - CONH2, аминокислотой в положении 28 является Asn и аминокислотой в положении 29 является треонин. В другом варианте осуществления R выбран из группы, которую составляют последовательности SEQ ID NO: 26, SEQ ID NO: 29 и SEQ ID NO: 65, и аминокислотой в положении 29 является глицин. В еще одном варианте осуществления соагонист глюкагонового/GLP-1-рецептора выбран из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ IDNO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, где упомянутый пептид дополнительно содержит дополнительный карбоксиконцевой удлиняющий сегмент из одной аминокислоты либо пептида, выбранный из группы, которую составляют последовательности SEQ ID NO: 26, SEQ IDNO: 27 и SEQ ID NO: 28. В одном из вариантов осуществления концевой удлиняющий сегмент содержит последовательности SEQ ID NO: 26, SEQ ID NO: 29 и SEQ ID NO: 65, и глюкагоновый пептид содержит последовательность SEQ ID NO: 55. В одном из вариантов осуществления соагонист глюкагонового/GLP-1-рецептора содержит последовательность SEQ ID NO: 33, в которой аминокислотой в положении 16 является глутаминовая кислота, аминокислотой в положении 20 является лизин,аминокислотой в положении 28 является аспарагин и аминокислотная последовательность SEQ ID NO: 26 или SEQ ID NO: 29 присоединена к карбоксильному концу последовательности SEQ ID NO: 33. В упомянутом варианте осуществления, в котором одна аминокислота добавлена к карбоксильному концу последовательности SEQ ID NO: 20, упомянутая аминокислота, как правило, выбрана из числа 20 традиционных аминокислот, и в одном из вариантов осуществления упомянутая аминокислота имеет амидную группу вместо карбоксильной группы нативной аминокислоты. В одном из вариантов осуществления дополнительная аминокислота выбрана из группы, которую составляют глутаминовая кислота,аспарагиновая кислота и глицин. В упомянутых вариантах осуществления, в которых аналог агониста глюкагона дополнительно содержит карбоксиконцевой удлиняющий сегмент, карбоксиконцевая аминокислота удлиняющего сегмента в одном из вариантов осуществления заканчивается не карбоксильной группой, а амидной группой либо сложноэфирной группой. В другом варианте осуществления соагонист глюкагонового/GLP-1-рецептора содержит последовательность NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-AspPhe-Val-Gln-Trp-Leu-Met-Asn-Thr-Xaa-CONH2 (последовательность SEQ ID NO: 19), в которой Хаа в положении 30 представляет любую аминокислоту. В одном из вариантов осуществления Хаа выбрана из числа 20 традиционных аминокислот, и в одном из вариантов осуществления упомянутой аминокислотой является глутаминовая кислота, аспарагиновая кислота или глицин. Растворимость этого пептида может быть дополнительно улучшена посредством ковалентного присоединения полиэтиленгликолевой цепи к боковой цепи аминокислоты в положении 17, 21, 24 или 30 последовательности SEQ ID NO: 19. В еще одном варианте осуществления пептид содержит дополнительный карбоксиконцевой удлиняющий сегмент пептида, выбранный из группы, которую составляют последовательности SEQ ID NO: 26, SEQID NO: 27 и SEQ ID NO: 28. В соответствии с одним из вариантов осуществления соагонист глюкагонового/GLP-1-рецептора содержит последовательности SEQ ID NO: 30, SEQ ID NO: 31 и SEQ ID NO: 32. Дополнительные сайт-специфические модификации в пределах последовательностей SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 64 глюкагона могут осуществляться для получения набора агонистов глюкагона, обладающих различной степенью GLP-1 агонизма. Таким образом, были получены и охарактеризованы пептиды, обладающие фактически идентичной in vitro активностью на каждом рецепторе. Подобным же образом были идентифицированы и охарактеризованы пептиды с десятикратно избирательно повышенной активностью на каждом из двух рецепторов. Как отмечалось выше, замена остатка серина в положении 16 глутаминовой кислотой повышает активность нативного глюкагона как на глюкагоновом, так и на GLP-1-рецепторе, однако поддерживает приблизительно десятикратную избирательность в отношении глюкагонового рецептора. Кроме того, посредством замены нативного глутамина в положении 3 глутаминовой кислотой (последовательность SEQ ID NO: 22) получают аналог глюкагона,который проявляет приблизительно десятикратную избирательность в отношении GLP-1-рецептора. Растворимость пептидов-соагонистов глюкагона/GLP-1 может быть дополнительно повышена в водных растворах при физиологическом рН с одновременным сохранением высокой биологической активности, в сопоставлении с нативным глюкагоном, посредством введения гидрофильных групп в положениях 16, 17, 21 и 24 пептида либо посредством добавления одной модифицированной аминокислоты(т.е. аминокислоты, модифицированной для включения гидрофильной группы) на карбоксильном конце пептида-соагониста глюкагона/GLP-1. В соответствии с одним из вариантов осуществления гидрофильная группа содержит полиэтиленгликолевую (PEG) цепь. Конкретнее, в одном из вариантов осуществле- 20017849 ния глюкагоновый пептид содержит последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, где полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислот в положении 16, 17,21, 24, 29 либо к С-концевой аминокислоте глюкагонового пептида при условии, что в случае, когда пептид содержит последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13,полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 17, 21 или 24, когда пептид содержит последовательность SEQ ID NO: 14 или SEQ ID NO: 15, полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 16, 17 или 21, и когда пептид содержит последовательности SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 17 или 21. В одном из вариантов осуществления глюкагоновый пептид содержит последовательности SEQ IDNO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, причем полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислот в положении 17, 21, 24 или к С-концевой аминокислоте глюкагонового пептида, и карбоксиконцевая аминокислота пептида имеет амидную группу вместо карбоксильной группы нативной аминокислоты. В одном из вариантов осуществления пептид-соагонист глюкагонового/GLP-1-рецептора содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, причем полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислоты в положении 17, 21 или 24 последовательностей SEQ IDNO: 14 и SEQ ID NO: 15, или в положении 17 или 21 последовательностей SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18 глюкагонового пептида. В другом варианте осуществления пептид-соагонист глюкагонового/GLP-1-рецептора содержит последовательность SEQ ID NO: 11 или SEQ ID NO: 19, причем полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислоты в положении 17, 21 или 24 либо к С-концевой аминокислоте глюкагонового пептида. В соответствии с одним из вариантов осуществления и в соответствии с оговоренными ограничениями, описание которых приведено в предшествующих параграфах, пептид-соагонист глюкагона модифицирован с включением одной или нескольких замен аминокислот в положениях 16, 17, 21, 24 или 29 либо С-концевой аминокислоты, где нативная аминокислота заменена аминокислотой, имеющей боковую цепь, пригодную для образования мостиковых связей с гидрофильными составляющими, в том числе, например, с полиэтиленгликолем. Нативный пептид может быть заменен природной аминокислотой либо синтетической (искусственной) аминокислотой. Определения "синтетические" либо "искусственные" аминокислоты касаются аминокислот, которые не встречаются в природных условиях in vivo, но которые, тем не менее, могут быть частью пептидных структур, соответствующих приведенному описанию. В альтернативном варианте аминокислота, имеющая боковую цепь, пригодную для образования мостиковых связей с гидрофильными фрагментами, в том числе, например, с полиэтиленгликолем, может быть добавлена к карбоксильному концу любого из аналогов глюкагона, раскрытых в настоящем описании. В соответствии с одним из вариантов осуществления аминокислотная замена производится в пептиде-соагонисте глюкагонового/GLP-1-рецептора в положении, выбранном из группы, которую составляют положения 16, 17, 21, 24 либо 29, с заменой нативной аминокислоты аминокислотой, выбранной из группы, которую составляют лизин, цистеин, орнитин, гомоцистеин и ацетилфенилаланин, причем заменяющая аминокислота дополнительно содержит полиэтиленгликолевую цепь, ковалентно присоединенную к боковой цепи аминокислоты. В одном из вариантов осуществления глюкагоновый пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 12, SEQ ID NO: 13,SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, дополнительно модифицирован с включением полиэтиленгликолевой цепи, ковалентно присоединенной к боковой цепи аминокислоты в положении 17 или положении 21 глюкагонового пептида. В одном из вариантов осуществления пегилированный соагонист глюкагонового/GLP-1-рецепора дополнительно содержит последовательности SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 29. В другом варианте осуществления глюкагоновый пептид, содержащий последовательность SEQ IDNO: 55 или SEQ ID NO: 56, дополнительно содержит С-концевой удлиняющий сегмент последовательностей SEQ ID NO: 26, SEQ ID NO: 29 или SEQ ID NO: 65, присоединенный к С-концевой аминокислоте последовательности SEQ ID NO: 55 или SEQ ID NO: 56 и факультативно дополнительно содержит полиэтиленгликолевую цепь, ковалентно присоединенную к боковой цепи аминокислот в положениях 17, 18,21, 24 или 29 либо к С-концевой аминокислоте пептида. В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56, где полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислот в положении 21 или положении 24 глюкагонового пептида, и пептид дополнительно содержит С-концевой удлиняющий сегмент последовательностей SEQ ID NO: 26 или SEQ ID NO: 29. В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 55, SEQ ID NO: 33 либо SEQ ID NO: 34, где дополнительная аминокислота добавлена к карбоксильному концу последовательности SEQ ID NO: 33 или SEQ ID NO: 34, и полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи добавленной аминокислоты. В еще одном варианте осуществления пегилированный аналог глюкагона дополнительно содержит С-концевой удлиняющий сегмент последовательностей SEQ ID NO: 26 или SEQ ID NO: 29, присоединенный к С-концевой аминокислоте последовательности SEQ ID NO: 33 или SEQ ID NO: 34. В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 19, где полиэтиленгликолевая цепь ковалентно присоединена к боковой цепи аминокислоты в положении 30 глюкагонового пептида, и пептид дополнительно содержит С-концевой удлиняющий сегмент последовательностей SEQ ID NO: 26 или SEQ ID NO: 29, присоединенный к С-концевой аминокислоте последовательности SEQ ID NO: 19. Полиэтиленгликолевая цепь может иметь форму прямой цепи либо она может быть разветвленной. В соответствии с одним из вариантов осуществления полиэтиленгликолевая цепь имеет среднюю молекулярную массу, выбранную в пределах от приблизительно 500 до приблизительно 10000 Да. В одном из вариантов осуществления полиэтиленгликолевая цепь имеет среднюю молекулярную массу, выбранную в пределах от приблизительно 1000 до приблизительно 5000 Да. В альтернативном варианте осуществления полиэтиленгликолевая цепь имеет среднюю молекулярную массу, выбранную в пределах от приблизительно 10000 до приблизительно 20000 Да. В соответствии с одним из вариантов осуществления пегилированный глюкагоновый пептид содержит две или более полиэтиленгликолевых цепей, ковалентно присоединенных к глюкагоновому пептиду, где общая молекулярная масса глюкагоновых цепей составляет от приблизительно 1000 до приблизительно 5000 Да. В одном из вариантов осуществления пегилированный агонист глюкагона содержит пептид (последовательность SEQ ID NO: 5) либо аналог агониста глюкагона (последовательность SEQ ID NO: 5), где полиэтиленгликолевая цепь ковалентно присоединена к остатку аминокислоты в положении 21 и в положении 24 и где объединенная молекулярная масса двух полиэтиленгликолевых цепей составляет от приблизительно 1000 до приблизительно 5000 Да. Как подробно описано в примерах, агонисты глюкагона, соответствующие настоящему изобретению, имеют повышенную биофизическую стабильность и водорастворимость, проявляя, наряду с этим,повышенную биоактивность по сравнению с нативным пептидом. Соответственно, полагают, что агонисты глюкагона, соответствующие настоящему изобретению, пригодны для любого применения, описанного выше для нативного глюкагонового пептида. Таким образом, модифицированные глюкагоновые пептиды, описание которых приведено в данном документе, могут применяться для лечения гипогликемии либо для повышения уровня глюкозы в крови, для инициирования временного паралича кишечника для рентгенологических исследований либо для лечения других болезней обмена веществ, являющихся следствием низкого уровня глюкагона в крови. Ожидается также, что глюкагоновые пептиды, описание которых приведено в данном документе, могут быть применены для уменьшения либо поддержания массы тела, или для лечения гипергликемии, или для снижения уровня глюкозы в крови, или для нормализации уровня глюкозы в крови. Глюкагоновые пептиды, соответствующие настоящему изобретению, могут вводиться отдельно либо в сочетании с другими антидиабетическими препаратами либо средствами против ожирения. К числу антидиабетических препаратов, известных в данной области либо находящихся в процессе исследования,относятся инсулин, сульфонилмочевины, такие как толбутамид (Orinase), ацетогексамид (Dymelor), толазамид (Tolinase), хлорпропамид (Diabinese), глипизид (Glucotrol), глибурид (Diabeta, Micronase, Glynase),глимепирид (Amaryl) или гликлазид (Diamicron); меглитиниды, такие как репаглинид (Prandin) или натеглинид (Starlix); бигуаниды, такие как метформин (Glucophage) или фенформин; тиазолидиндионы,такие как росиглитазон (Avandia), пиоглитазон (Actos), троглитазон (Rezulin) или другие ингибиторыPPARg (активатор пероксисомальной пролиферации); ингибиторы -глюкозидазы, угнетающие переваривание углеводов, такие как миглитол (Glyset), акарбос (Precose/Glucobay); эксенатид (Byetta) или прамлинтид; ингибиторы дипептидилпептидазы-4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрийзависимый переносчик глюкозы); или ингибиторы фруктоза-1,6 бисфосфатазы. К числу средств против ожирения, известных в данной области либо находящихся в процессе исследования, относятся средства, подавляющие аппетит, в том числе стимуляторы типа фенэтиламина,фентермин (факультативно с фенфлурамином либо дексфенфлурамином), диэтилпропион (Tenuate),фендиметразин (Prelu-2, Bontril), бензфетамин (Didrex), сибутрамин (Meridia, Reductil); римонабант (Acomplia), другие антагонисты каннабиноидного рецептора; оксинтомодулин; флуоксетина гидрохлорид (Prozac); препарат Qnexa (топирамат и фентермин), препарат Excalia (бупропион и зонисамид) или препарат Contrave (бупропион и налтрексон); или ингибиторы липаз, подобные ксеникалу (Orlistat) либо препарату Cetilistat (известному также как ATL-962), или препарат GT 389-255. Один из аспектов настоящего описания касается заранее изготовленного водного раствора, раскрытого в настоящем описании глюкагонового агониста для применения при лечении гипогликемии. Улучшенная стабильность и растворимость композиций агониста, соответствующего приведенному описанию, предоставляет возможность заранее изготовлять водные растворы для быстрого введения и лечения гипогликемии. В одном из вариантов осуществления предлагается раствор, содержащий пегилированный агонист глюкагона, для введения пациенту, страдающему гипогликемией, где общая молекулярная масса полиэтиленгликолевых цепей, присоединенных к пегилированному агонисту глюкагона, составляет от приблизительно 500 до приблизительно 5000 Да. В одном из вариантов осуществления пегилированный агонист глюкагона содержит пептид, выбранный из группы, которую составляют последовательностиSEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25 и аналоги агониста глюкагона последовательностейSEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, либо пегилированную лактамную производную глюкагона, содержащую последовательность SEQ ID NO: 20, где боковая цепь аминокислотного остатка упомянутого глюкагонового пептида ковалентно присоединена к полиэтиленгликолевой цепи. Способ лечения гипогликемии, соответствующий настоящему изобретению, включает стадии введения пациенту раскрытых в настоящем описании агонистов глюкагона любым обычным путем введения, в том числе парентерально, например внутривенно, внутрибрюшинно, подкожно либо внутримышечно, внутриоболочечно, чрезкожно, ректально, перорально, назально либо посредством ингаляции. В одном из вариантов осуществления упомянутая композиция вводится подкожно либо внутримышечно. В одном из вариантов осуществления упомянутая композиция вводится парентерально, и композиция, содержащая глюкагон, расфасовывается в шприцы. Неожиданно заявители обнаружили, что могут быть получены пегилированные глюкагоновые пептиды, сохраняющие биологическую активность и специфичность исходного пептида. Однако увеличение длины полиэтиленгликолевой цепи либо присоединение многочисленных полиэтиленгликолевых цепей к пептиду так, что общая молекулярная масса присоединенного полиэтиленгликоля превышает 5000 Да,начинает замедлять время действия модифицированного глюкагона. В соответствии с одним из вариантов осуществления предлагается глюкагоновый пептид последовательностей SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25, или аналог агониста глюкагона, или пегилированная лактамная производная глюкагона, содержащая последовательность SEQ ID NO: 20, где пептид содержит одну или несколько полиэтиленгликолевых цепей, где общая молекулярная масса присоединенного полиэтиленгликоля превышает 5000 Да и в одном из вариантов осуществления составляет более чем 10000 Да, но менее чем 40000 Да. Такие модифицированные глюкагоновые пептиды имеют пролонгированное время действия, но без снижения биологической активности. Следовательно, такие соединения могут быть введены для пролонгирования эффекта введенного глюкагонового пептида. Глюкагоновые пептиды, модифицированные для ковалентного присоединения к полиэтиленгликолевой цепи, имеющей молекулярную массу более 10000 Да, могут быть введены в сочетании с инсулином для смягчения действия инсулина и поддержания стабильного уровня глюкозы в крови у больных диабетом. Модифицированные глюкагоновые пептиды, соответствующие настоящему описанию, могут быть введены вместе с инсулином в виде одной композиции, введены одновременно в виде отдельных растворов или в альтернативном варианте инсулин и модифицированный глюкагоновый пептид могут быть введены в разное время. В одном из вариантов осуществления композиция, содержащая инсулин, и композиция, содержащая модифицированный глюкагоновый пептид, вводятся с разрывом в 12 ч. Точное соотношение между модифицированным глюкагоновым пептидом и введенным инсулином будет зависеть, отчасти, от определения уровня глюкагона больного и может определяться посредством общепринятой практики экспериментирования. В соответствии с одним из вариантов осуществления предлагается композиция, содержащая инсулин и модифицированный глюкагоновый пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и аналоги агониста глюкагона, где модифицированный глюкагоновый пептид дополнительно содержит полиэтиленгликолевую цепь, ковалентно присоединенную к боковой цепи аминокислоты в положении 17, 21, 24 либо 21 и 24. В одном из вариантов осуществления композиция представляет собой водный раствор, содержащий инсулин и аналог глюкагона. В вариантах осуществления, в которых глюкагоновый пептид содержит последовательность SEQ ID NO: 24 или SEQ ID NO: 25, полиэтиленгликолевая цепь ковалентно присоединена к глюкагоновому пептиду в положении 21 или положении 24. В одном из вариантов осуществления полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 10000 до приблизительно 40000 Да. В соответствии с одним из вариантов осуществления модифицированные глюкагоновые пептиды,раскрытые в настоящем описании, применяют для инициирования временного паралича кишечника. Этот способ пригоден для рентгенологических исследований и включает стадию введения эффективного количества фармацевтической композиции, содержащей пегилированный глюкагоновый пептид, глюкагоновый пептид, содержащий С-концевой удлиняющий сегмент, либо димер таких пептидов. В одном из вариантов осуществления глюкагоновый пептид содержит последовательность, выбранную из группы,которую составляют последовательности SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5,SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15. В одном из вариантов осуществления глюкагоновый пептид дополнительно содержит полиэтиленгликолевую цепь массой от приблизительно 1000 до 40000 Да, ковалентно присоединенную к аминокислотному остатку в положении 21 либо положении 24. В одном из вариантов осуществления глюкагоновый пептид выбран из группы, которую составляют последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ IDNO: 15. В одном из вариантов осуществления полиэтиленгликолевая цепь имеет молекулярную массу от приблизительно 500 до приблизительно 5000 Да. В еще одном варианте осуществления композиция, применяемая для инициирования временного паралича кишечника, содержит первый модифицированный глюкагоновый пептид и второй модифицированный глюкагоновый пептид. Первый модифицированный пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 23, SEQ ID NO: 24 и SEQ IDNO: 25, факультативно присоединенную к полиэтиленгликолевой цепи массой от приблизительно 500 до приблизительно 5000 Да, и второй пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25, факультативно присоединенную к полиэтиленгликолевой цепи массой от приблизительно 10000 до приблизительно 40000 Да. В соответствии с этим вариантом осуществления полиэтиленгликолевая цепь каждого пептида ковалентно присоединена к аминокислотному остатку соответствующего пептида в любом из положений 17,21 либо 24 независимо друг от друга. Сообщалось, что оксинтомодулин, природный пищеварительный гормон, обнаруживаемый в тонкой кишке, вызывает снижение массы тела при введении крысам или людям (см. Diabetes 2005; 54:23902395). Оксинтомодулин представляет собой пептид из 37 аминокислот, содержащий последовательность глюкагона из 29 аминокислот (т.е. последовательность SEQ ID NO: 1), за которой следует карбоксиконцевой удлиняющий сегмент из 8 аминокислот последовательности SEQ ID NO: 27 (KRNRNNIA). Таким образом, заявители полагают, что биологическая активность оксинтомодулина может быть сохранена(т.е. подавление аппетита и инициированное снижение массы/сохранение массы) с одновременным улучшением растворимости и стабильности соединения и улучшением фармакокинетики посредством замены части оксинтомодулина, соответствующей глюкагоновому пептиду, модифицированными глюкагоновыми пептидами, раскрытыми в настоящем описании. Кроме того, заявители полагают также, что усеченная молекула оксинтомодулина, содержащая глюкагоновый пептид, соответствующий настоящему изобретению, при удалении четырех конечных аминокислот оксинтомодулина, также будет эффективна в отношении подавления аппетита и инициирования снижения массы/сохранения массы. Таким образом, настоящим изобретением предусматриваются также модифицированные глюкагоновые пептиды, соответствующие настоящему изобретению, имеющие карбоксиконцевой удлиняющий сегмент последовательностей SEQ ID NO: 27 (KRNRNNIA) либо SEQ ID NO: 28. Эти соединения могут быть введены пациентам для инициирования снижения массы тела либо предотвращения прироста массы тела. В одном из вариантов осуществления аналог агониста глюкагона последовательностей SEQ ID NO: 33 либо SEQ ID NO: 20, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) либо SEQ ID NO: 28, присоединенную к аминокислоте 29 глюкагонового пептида, вводят пациентам для инициирования снижения массы либо предотвращения прироста массы тела. Конкретнее, глюкагоновый пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15,дополнительно содержащую аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) либоSEQ ID NO: 28, присоединенную к аминокислоте 29 глюкагонового пептида. Эксендин-4 представляет собой пептид, состоящий из 39 аминокислот. Это мощный стимулятор рецептора, известный как GLP-1. Сообщалось также, что этот пептид подавляет аппетит и инициирует снижение массы тела. Заявители обнаружили, что концевая последовательность эксендина-4, в случае ее добавления к карбоксильному концу глюкагона, улучшает растворимость и стабильность глюкагона без ухудшения биологической активности последнего. В одном из вариантов осуществления десять концевых аминокислот эксендина-4 (т.е. последовательность SEQ ID NO: 26 (GPSSGAPPS присоединены к карбоксильному концу глюкагонового пептида, соответствующего настоящему описанию. Предполагается, что эти гибридные белки обладают фармакологической активностью для подавления аппетита и инициирования снижения массы/поддержания массы тела. В соответствии с одним из вариантов осуществления аналог агониста глюкагона последовательностей SEQ ID NO: 33 либо SEQ ID NO: 20, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPS) либо SEQ IDNO: 29, присоединенную к аминокислоте 29 глюкагонового пептида, вводят пациентам для инициирования снижения массы либо предупреждения прироста массы тела. Конкретнее, глюкагоновый пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ IDNO: 56, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPS) либо SEQ ID NO: 29, присоединенную к аминокислоте 29 глюкагонового пептида. В одном из вариантов осуществления введенный аналог глюкагонового пептида содержит последовательность SEQ ID NO: 64. Настоящее описание охватывает также мультимеры модифицированных глюкагоновых пептидов,раскрытых в настоящем описании. Два или более модифицированных глюкагоновых пептида могут быть соединены друг с другом с помощью обычных связывающих агентов и способов, известных специалистам в данной области. Например, между двумя модифицированными глюкагоновыми пептидами могут образовываться димеры посредством применения бифункциональных тиоловых агентов сшивания и бифункциональных аминовых агентов сшивания, в особенности для глюкагоновых пептидов, у которых были произведены замены остатками цистеина, лизина, орнитина, гомоцистеина либо ацетилфенилаланина (например, последовательности SEQ ID NO: 3 и SEQ ID NO: 4). Димер может быть гомодимером или в альтернативном варианте гетеродимером. Согласно одному из примеров осуществления димер содержит гомодимер глюкагонового гибридного пептида, где часть глюкагонового пептида содержит последовательность SEQ ID NO: 11 или SEQ ID NO: 20 и аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), последовательность SEQ ID NO: 27 (KRNRNNIA) либо SEQ ID NO: 28 (KRNR), присоединенную к аминокислоте 29 глюкагонового пептида. В другом варианте осуществления димер содержит гомодимер аналога глюкагонового агониста (последовательность SEQ ID NO: 11), где глюкагоновый пептид дополнительно содержит полиэтиленгликолевую цепь, ковалентно присоединенную к положению 21 или положению 24 глюкагонового пептида. В соответствии с одним из вариантов осуществления предлагается димер, содержащий первый глюкагоновый пептид, присоединенный к второму глюкагоновому пептиду посредством линкера, где первый глюкагоновый пептид содержит пептид, выбранный из группы, которую составляют последовательности SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 и SEQ ID NO: 11, и второй глюкагоновый пептид содержит последовательность SEQ ID NO: 20. В соответствии с другим вариантом осуществления предлагается димер, содержащий первый глюкагоновый пептид, присоединенный к второму глюкагоновому пептиду посредством линкера, где упомянутый первый глюкагоновый пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 2, SEQ ID NO: 3,SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, и второй глюкагоновый пептид содержит последовательность SEQ ID NO: 11 и фармацевтически приемлемые соли упомянутых глюкагоновых полипептидов. В соответствии с другим вариантом осуществления предлагается димер, содержащий первый глюкагоновый пептид, присоединенный к второму глюкагоновому пептиду посредством линкера, где первый глюкагоновый пептид выбран из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ IDNO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и второй глюкагоновый пептид независимо выбран из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13,SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и фармацевтически приемлемые соли упомянутых глюкагоновых полипептидов. В одном из вариантов осуществления первый глюкагоновый пептид выбран из группы, которую составляет последовательность SEQ ID NO: 20, и второй глюкагоновый пептид независимо выбран из группы, которую составляют последовательности SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 11. В одном из вариантов осуществления димер образован между двумя пептидами, где каждый пептид содержит аминокислотную последовательность SEQ ID NO: 11. Модифицированные глюкагоновые пептиды, соответствующие настоящему изобретению, могут предлагаться в соответствии с одним из вариантов осуществления как часть набора. В одном из вариантов осуществления предлагается набор для введения антагониста глюкагона пациенту, нуждающемуся в нем, где набор включает в себя модифицированный глюкагоновый пептид, выбранный из группы, которую составляют: 1) глюкагоновый пептид, содержащий последовательности SEQ ID NO: 20, SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11; 2) глюкагоновый гибридный пептид, содержащий аналог агониста глюкагона последовательностей SEQ ID NO: 11, SEQ ID NO: 20 или SEQ ID NO: 55 и аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) либо SEQ ID NO: 28(KRNR), присоединенную к аминокислоте 29 глюкагонового пептида; и 3) пегилированный глюкагоновый пептид последовательности SEQ ID NO: 11 либо SEQ ID NO:51, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) либо SEQID NO: 28 (KRNR), присоединенную к аминокислоте 29 глюкагонового пептида, где полиэтиленгликолевая цепь, ковалентно присоединенная в положении 17, 21 либо 24, имеет молекулярную массу от приблизительно 500 до приблизительно 40000 Да. В одном из вариантов осуществления набор включает в себя соагонист глюкагона/GLP-1, где пептид содержит последовательность, выбранную из группы, которую составляют последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14,SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. В одном из вариантов осуществления предлагается набор с устройством для введения глюкагоновой композиции пациенту, например, иглой для шприца, шприцом-инъектором, безыгольным шприцем или другим безыгольным инъектором. Набор в альтернативном варианте или в дополнение может включать один или более контейнеров, например флаконов, пробирок, пузырьков, одно- либо многокамерных предварительно заполненных шприцов, капсул, инфузионных насосов (наружных либо имплантируемых), безыгольных шприцов, предварительно заполненных шприцов-инъекторов и т.п., факультативно содержащих глюкагоновый пептид в лиофилизованном виде или в форме водного раствора. Предпочтительно наборы будут также включать в себя инструкции по применению. В соответствии с одним из вариантов осуществления устройство из набора представляет собой устройство для дозированного распределения аэрозоля, где композиция предварительно расфасована в упомянутое приспособление для дозированного распределения аэрозоля. В другом варианте осуществления набор включает в себя шприц и иглу, и в одном варианте осуществления стерильная глюкагоновая композиция расфасована в шприц. Соединения, соответствующие настоящему изобретению, могут быть получены стандартными методами синтеза, методами рекомбинантных ДНК или любыми другими методами получения пептидов и гибридных белков. Несмотря на то, что некоторые искусственные аминокислоты не могут экспрессироваться обычными методами рекомбинантных ДНК, в этой области известны способы их получения. Соединения, соответствующие настоящему изобретению, содержащие непептидные части, могут быть синтезированы посредством стандартных реакций органической химии в дополнение к обычным реакциям химии пептидов, в случае их применимости. Примеры Общая методика синтеза. Аналоги глюкагона синтезировали посредством одностадийной реакции сочетания HBTUактивизированной смолы (HBTU - о-бензотриазол-тетраметилурония гексафторфосфат) "FastBoc", начиная с 0,2 ммоль смолы Boc Thr(Obzl)Pam, на модифицированном синтезаторе пептидов Applied Biosystem 430 А. Boc аминокислоты и HBTU были получены от компании Midwest Biotech (Fishers,штат Индиана). Применялись приведенные ниже защитные группы боковых цепей: Arg(Tos), Asn(Xan),Asp(OcHex), Cys(pMeBzl), His(Boc), Lys(2Cl-Z), Ser(OBzl), Thr(OBzl), Tyr(2Br-Z) и Trp(СНО). В качестве защитной группы боковой цепи N-концевого His применяли Boc (трет-бутилоксикарбонил). Каждую из полученных пептидильных смол обрабатывали 20% раствором пиперидина в диметилформамиде для удаления формильной группы из триптофана. Расщепление жидким фтороводородом осуществляли в присутствии n-крезола и диметилсульфида. Расщепление осуществляли в течение 1 ч на ледяной бане с помощью фтороводородной установки (компания Penninsula Labs). После выпаривания фтороводорода остаток суспендировали в диэтиловом эфире, и твердые материалы отфильтровывали. Каждый пептид экстрагировали в 30-70 мл водного раствора уксусной кислоты и разбавленную аликвоту анализировали средствами HPLC (высокоэффективная жидкостная хроматография) [Beckman SystemGold, колонка Zorbax C8 0,46'5 см, 1 мл/мин, 45 С, 214 нм, буфер А - 0,1% раствор TFA (трифторуксусная кислота), В - 0,1% раствор TFA/90% раствор ацетонитрила, градиент от 10 до 80% В в течение 10 мин]. Очистку осуществляли средствами FPLC (быстрая хроматография белков (полипептидов и полинуклеотидов) высокого разрешения) на колонке Kromasil C18 2,2'25 см с УФ-мониторингом при 214 нм со сбором 5 мин фракций. Однородные фракции объединяли и лиофилизировали с получением продукта(чистота 95%). Откорректированную молекулярную массу и степень чистоты подтверждали с помощьюMALDI (масс-спектрометрия с ионизацией методом лазерной десорбции в матричном растворе)-массспектрального анализа. Общая методика пегилирования (Cys-малеимид).Cys-аналог глюкагона, как правило, растворяют в забуференном фосфатом солевом растворе (5-10 мг/мл), и добавляют 0,01 М раствор этилендиаминтетрауксусной кислоты (10-15% от общего объема). Добавляют излишек (2-кратный) малеимидметоксиполиэтиленгликолевого реактива (компания Nektar), и реакционную смесь перемешивают при комнатной температуре с мониторингом развития реакции средствами HPLC. Через 8-24 ч реакционную смесь подкисляют и загружают в колонку для препаративной хроматографии с обратной фазой для очистки с помощью градиентного 0,1% раствораTFA/ацетонитрила. Соответствующие фракции объединяли и лиофилизировали с получением необходимых пегилированных аналогов. Пример 1. Синтез глюкагона Cys17(1-29) и подобных моноCys-аналогов. 0,2 ммоль смолы Вос Thr(Obzl) Pam (компания SynChem Inc.) в 60 мл реакторе и приведенную ниже последовательность помещали в модифицированный синтезатор пептидов Applied Biosystems 430A с последующим использованием FastBoc HBTU-активизированных одностадийных реакций сочетания.(последовательность SEQ ID NO: 35). Применялись приведенные ниже защитные группы боковых цепей: Arg(Tos), Asp(OcHex),Asn(Xan), Cys(pMeBzl), Glu(OcHex), His(Boc), Lys(2Cl-Z), Ser(Bzl), Thr(Bzl), Trp(CHO) и Tyr(Br-Z). Полученную пептидильную смолу обрабатывали 20% раствором пиперидина в диметилформамиде для удаления формильной группы из триптофана, затем переносили во фтороводородный реактор и сушили в вакууме. Добавляли 1,0 мл n-крезола и 0,5 мл диметилсульфида с перемешиванием с помощью магнитной мешалки. Реактор присоединяли к фтороводородной установке (компания Penninsula Labs), охлаждали на бане со смесью сухого льда с метанолом, откачивали газ и конденсировали приблизительно 10 мл жидкого фтороводорода. Реакционную смесь перемешивали на ледяной бане в течение 1 ч, после чего фтороводород удаляли в вакууме. Остаток суспендировали в этиловом эфире; твердые вещества отфильтровывали, промывали эфиром и пептид экстрагировали в 50 мл водного раствора уксусной кислоты. Небольшую пробу расщепленного экстракта подвергали аналитическому HPLC [колонка Zorbax C8 0,46'5 см, 1 мл/мин, 45 С, 214 нм, буфер А - 0,1% раствор TFA, буфер В - 0,1% раствор TFA/90% растворACN (ацетонитрил), градиент от 10 до 80% В в течение 10 мин]. Остаток экстракта загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см и градиент ацетонитрила прогоняли с помощью системы FPLC компании Pharmacia. 5 мин фракции собирали с УФ-мониторингом при 214 нм (2,0 А). А - 0,1% раствор TFA, В - 0,1% раствор TFA/50%) раствор ацетонитрила. Градиент от 30 до 100% В в течение 450 мин. Фракции, содержащие самый чистый продукт (48-52), объединяли, замораживали и лиофилизировали с получением 30,1 мг. Анализ продукта средствами HPLC показал степень чистоты 90%, аMALDI-масс-спектральный анализ показал необходимую массу 3429,7. Подобным же образом получили глюкагон Cys21, глюкагон Cys24 и глюкагон Cys29. Пример 2. Синтез глюкагона-Сех и других аналогов с С-концевым удлиняющим сегментом. 285 мг (0,2 ммоль) метоксибензгидриламина (компания Midwest Biotech) в реакторе емкостью 60 мл и приведенную ниже последовательность помещали в модифицированный синтезатор пептидов Applied(последовательность SEQ ID NO: 36). Применялись приведенные ниже защитные группы боковых цепей: Arg(Tos), Asp(OcHex),Asn(Xan), Cys(pMeBzl), Glu(OcHex), His(Boc), Lys(2Cl-Z), Ser(Bzl), Thr(Bzl), Trp(CHO) и Tyr(Br-Z). Полученную пептидильную смолу обрабатывали 20% раствором пиперидина в диметилформамиде для удаления защитной формильной группы из триптофана, затем переносили во фтороводородный реактор и сушили в вакууме. Добавляли 1,0 мл n-крезола и 0,5 мл диметилсульфида с перемешиванием с помощью магнитной мешалки. Реактор присоединяли к фтороводородной установке (компания Penninsula Lab.),охлаждали на бане со смесью сухого льда с метанолом, откачивали газ и конденсировали приблизительно 10 мл жидкого фтороводорода. Реакционную смесь перемешивали на ледяной бане в течение 1 ч, после чего фтороводород удаляли в вакууме. Остаток суспендировали в этиловом эфире; твердые вещества отфильтровывали, промывали эфиром и пептид экстрагировали в 50 мл водного раствора уксусной кислоты. Аликвоту расщепленного экстракта подвергали аналитическому HPLC [колонка Zorbax C8 0,46'5 см, 1 мл/мин, 45 С, 214 нм, буфер А - 0,1% раствор TFA, буфер В - 0,1% раствор TFA/90% раствор ACN,градиент от 10 до 80% В в течение 10 мин]. Экстракт загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см и градиент ацетонитрила прогоняли с помощью системыFPLC компании Pharmacia. 5 мин фракции собирали с УФ-мониторингом при 214 нм (2,0 А). А - 0,1% раствор TFA, В - 0,1% раствор TFA/50% раствор ацетонитрила. Градиент от 30 до 100% В в течение 450 мин. Фракции 58-65 объединяли, замораживали и лиофилизировали с получением 198,1 мг. Анализ продукта средствами HPLC показал степень чистоты более 95%. MALDI-массспектральный анализ показал присутствие необходимой теоретической массы 4316,7 с продуктом в виде С-концевого амида. Подобным же образом в виде С-концевых карбоксильных кислот были получены оксинтомодулин и оксинтомодулин-KRNH, начиная с соответствующим образом загруженной полиакриламидной смолы. Пример 3. Глюкагон Cys17Mal-PEG-5K. 15,1 мг глюкагона Cys17(1-29) и 27,3 мг метоксиполи(этиленгликоль)малеимида (средняя молекулярная масса 5000, mPEG-Mal-5000, компания Nektar Therapeutics) растворяли в 3,5 мл забуференного фосфатом солевого раствора (PBS) и добавляли 0,5 мл 0,01 М раствора этилендиаминтетрауксусной кислоты (EDTA). Реакционную смесь перемешивали при комнатной температуре и развитие реакции контролировали посредством HPLC анализа [колонка Zorbax C8 0,46'5 см, 1 мл/мин, 45 С, 214 нм (0,5 А), А 0,1% раствор TFA, В - 0,1% раствор TFA/90% раствор ACN, градиент от 10 до 80% В в течение 10 мин]. Через 5 ч реакционную смесь загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см. Градиент ацетонитрила прогоняли с помощью системы FPLC компанииPharmacia с УФ-мониторингом при длине волны 214 нм и сбором 5 мин фракций. А - 0,1% раствор TFA,В - 0,1% раствор TFA/50%) раствор ацетонитрила, градиент от 30 до 100% В в течение 450 мин. Фракции, соответствующие продукту, объединяли, замораживали и лиофилизировали с получением 25,9 мг. Этот продукт подвергали HPLC анализу [колонка Zorbax C8 0,46'5 см, 1 мл/мин, 45 С, 214 нм (0,5 А), А - 0,1% раствор TFA, В - 0,1% раствор TFA/90% раствор ACN, градиент от 10 до 80% В в течение 10 мин], который показал приблизительно 90% чистоту. MALDI (масс-спектрометрия с ионизацией методом лазерной десорбции в матричном растворе)-масс-спектральный анализ показал широкий диапазон массы (что типично для производных полиэтиленгликоля) от 8700 до 9500. Это указывает на добавление к массе исходного глюкагонового пептида (3429) приблизительно 5000 атомных единиц массы. Пример 4. Глюкагон Cys21Mal-PEG-5K. 21,6 мг глюкагона Cys21(l-29) и 24 мг mPEG-Mal-5000 (компания Nektar Therapeutics) растворяли в 3,5 мл забуференного фосфатом солевого раствора (PBS), и добавляли 0,5 мл 0,01 М раствора этилендиаминтетрауксусной кислоты (EDTA). Реакционную смесь перемешивали при комнатной температуре. Через 2 ч добавляли еще 12,7 мг mPEG-Mal-5000. Через 8 ч реакционную смесь загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см и градиент ацетонитрила прогоняли (4 мл/мин) с помощью системы FPLC компании Pharmacia со сбором 5 мин фракций. А - 0,1% раствор TFA, В - 0,1% раствор TFA/50% раствор ацетонитрила. Градиент от 20 до 80% В в течение 450 мин. Фракции, соответствующие появлению продукта, объединяли, замораживали и лиофилизировали с получением 34 мг. Анализ этого продукта средствами аналитической HPLC [колонка Zorbax C8 0,46'5 см,1 мл/мин, 45 С, 214 нм (0,5 А), А - 0,1% раствор TFA, В - 0,1% раствор TFA/90% раствор ACN, градиент от 10 до 80% В в течение 10 мин] показал наличие однородного продукта, отличающегося от исходного глюкагонового пептида. MALDI (масс-спектрометрия с ионизацией методом лазерной десорбции в матричном растворе)-масс-спектральный анализ показал широкий диапазон массы (что типично для производных полиэтиленгликоля) от 8700 до 9700. Это указывает на добавление к массе исходного глюкагонового пептида (3470) приблизительно 5000 атомных единиц массы. Пример 5. Глюкагон Cys24Mal-PEG-5K. 20,1 мг глюкагона Cys24(1-29) и 39,5 мг mPEG-Mal-5000 (компания Nektar Therapeutics) растворяли в 3,5 мл PBS с перемешиванием и добавляли 0,5 мл 0,01 М раствора EDTA. Реакционную смесь перемешивали при комнатной температуре в течение 7 ч, после чего добавляли еще 40 мг mPEG-Mal-5000. Приблизительно через 15 ч реакционную смесь загружали в колонку для препаративной хроматографии с обратной фазой Vydac C18 2,2'25 см и градиент ацетонитрила прогоняли с помощью системы FPLC компании Pharmacia. 5 мин фракции собирали с УФ-мониторингом при 214 нм (2,0 А). Буфер А - 0,1% раствор TFA, буфер В - 0,1% раствор TFA/50% раствор ацетонитрила, градиент от 30 до 100% В в течение 450 мин. Фракции, соответствующие продукту, объединяли, замораживали и лиофилизировали с получением 45,8 мг. MALDI-масс-спектральный анализ показал типичный для полиэтиленгликоля широкий сигнал с максимумом при 9175,2, что приблизительно на 5000 атомных единиц массы больше, чем у глюкагона С 24 (3457,8). Пример 6. Глюкагон Cys24Mal-PEG-20K. 25,7 мг глюкагона Cys24(1-29) и 40,7 мг mPEG-Mal-20K (компания Nektar Therapeutics) растворяли в 3,5 мл PBS с перемешиванием при комнатной температуре и добавляли 0,5 мл 0,01 М раствора EDTA. Через 6 ч соотношение между исходным материалом и продуктом (по результатам определения средствами HPLC) составляло приблизительно 60:4. Добавляли еще 25,1 мг mPEG-Mal-20K и реакционную смесь перемешивали в течение последующих 16 ч. Соотношение продукта существенно не улучшилось,поэтому реакционную смесь загружали в колонку для препаративной хроматографии с обратной фазойKromasil С 18 и очищали с помощью системы FPLC компании Pharmacia с использованием градиента от 30 до 100% В в течение 450 мин. Буфер А - 0,1% раствор TFA, буфер В - 0,1% раствор TFA/50% раствор ацетонитрила, расход - 4 мл/мин. 5 мин фракции собирали с УФ-мониторингом при 214 нм (2,0 А). Фракции, содержащие однородный продукт, объединяли, замораживали и лиофилизировали с получением 25,7 мг. Чистота, по результатам определения средствами аналитической HPLC, достигала уровня 90%. MALDI-масс-спектральный анализ показал широкий пик от 23000 до 27000, что приблизительно на 20000 атомных единиц массы больше, чем у исходного глюкагона С 24 (3457,8). Пример 7. Глюкагон Cys29Mal-PEG-5K. 20,0 мг глюкагона Cys29(l-29) и 24,7 мг mPEG-Mal-5000 (компания Nektar Therapeutics) растворяли в 3,5 мл PBS с перемешиванием при комнатной температуре и добавляли 0,5 мл 0,01 М раствора EDTA. Через 4 ч добавляли еще 15,6 мг mPEG-Mal-5000 для доведения реакции до завершения. Через 8 ч реакционную смесь загружали в колонку для препаративной хроматографии с обратной фазой Vydac C18 2,2'25 см, и градиент ацетонитрила прогоняли с помощью системы FPLC компании Pharmacia. 5 мин фракции собирали с УФ-мониторингом при 214 нм (2,0 А). А - 0,1% раствор TFA, В - 0,1% растворTFA/50% раствор ацетонитрила. Фракции 75-97 объединяли, замораживали и лиофилизировали с получением 40,0 мг продукта, отличающегося от выделенного посредством FIPLC исходного материала(фракции 58-63). Анализ этого продукта средствами аналитической HPLC [колонка Zorbax C8 0,46'5 см,1 мл/мин, 45 С, 214 нм (0,5 А), А - 0,1% раствор TFA, В - 0,1% раствор TFA/90% раствор ACN, градиент от 10 до 80% В в течение 10 мин] показал степень чистоты, превышающую 95%. MALDI-массспектральный анализ показал присутствие полиэтиленгликолевой составляющей с диапазоном массы от 8000 до 10000 (максимум при 9025,3), что на 5540 атомных единиц массы больше, чем у исходного материала (3484,8). Пример 8. Глюкагон Cys24(2-бутиролактон). К 24,7 мг глюкагона Cys24(l-29) добавляли 4 мл 0,05 М раствора бикарбоната аммония/50% раствора ацетонитрила и 5,5 мкл раствора 2-бромо-4-гидроксимасляной кислоты-g-лактона (100 мкл в 900 мкл ацетонитрила). Через 3 ч перемешивания при комнатной температуре к реакционной смеси добавляли еще 105 мкл лактонового раствора и перемешивали в течение следующих 15 ч. Реакционную смесь разбавляли до 10 мл 10% водным раствором уксусной кислоты, и загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см. Градиент ацетонитрила от 20 до 80% В в течение 450 мин прогоняли с помощью системы FPLC (компания Pharmacia) со сбором 5 мин фракций и с УФ-мониторингом при 214 нм (2,0 А). Расход - 4 мл/мин, А - 0,1% раствор TFA, В - 0,1% растворTFA/50% раствор ацетонитрила. Фракции 74-77 объединяли, замораживали и лиофилизировали с получением 7,5 мг. Анализ средствами HPLC показал чистоту 95%, и MALDI-масс-спектральный анализ показал массу 3540,7, что на 84 атомные единицы массы больше, чем у исходного материала. Этот результат соответствует добавлению одной бутиролактоновой составляющей. Пример 9. Глюкагон Cys24(S-карбоксиметил). 18,1 мг глюкагона Cys24(l-29) растворили в 9,4 мл 0,1 М натрийфосфатного буфера (рН 9,2) и добавили 0,6 мл раствора бромуксусной кислоты (1,3 мг/мл в ацетонитриле). Реакционную смесь перемешивали при комнатной температуре и развитие реакции контролировали средствами аналитической HPLC. Через 1 ч добавили еще 0,1 мл раствора бромуксусной кислоты. Реакционную смесь перемешивали в течение последующих 60 мин, после чего его подкисляли водным раствором уксусной кислоты и загружали в колонку для препаративной хроматографии с обратной фазой Kromasil C18 2,2'25 см для очистки. Градиент ацетонитрила прогоняли с помощью системы FPLC (компания Pharmacia) (расход - 4 мл/мин) со сбором 5 мин фракций и с УФ-мониторингом при 214 нм (2,0 А). А - 0,1% раствор TFA, В - 0,1% раствор TFA/50% раствор ацетонитрила. Фракции 26-29 объединяли, замораживали и лиофилизировали с получением нескольких мг продукта. Анализ средствами аналитической HPLC показал чистоту 90% иMALDI-масс-спектральный анализ подтвердил массу 3515 необходимого продукта. Пример 10. Глюкагон Cys24 малеимидоPEG-3,4K-димер. 16 мг глюкагона Cys24 и 1,2 мг Mal-PEG-Mal-3400 (поли(этиленгликоль)-бис-малеимид, средняя молекулярная масса 3400 (компания Nektar Therapeutics растворяли в 3,5 мл забуференного фосфатом солевого раствора и 0,5 мл 0,01 М раствора EDTA и реакционную смесь перемешивали при комнатной температуре. Через 16 ч добавляли еще 16 мг глюкагона Cys24 и перемешивание продолжали. Приблизительно через 40 ч реакционную смесь загружали в колонку Pharmacia PepRPC 16/10 и градиент ацетонитрила прогоняли с помощью системы FPLC компании Pharmacia со сбором 2 мин фракций и с УФмониторингом при 214 нм (2,0 А). Расход - 2 мл/мин, А - 0,1% раствор TFA, В - 0,1% раствор TFA/50% раствор ацетонитрила. Фракции 69-74 объединяли, замораживали и лиофилизировали с получением 10,4 мг. Анализ средствами аналитической HPLC показал 90% чистоту, MALDI-масс-спектральный анализ показал компонент в диапазоне 9500-11000, что соответствует необходимому димеру. Пример 11. Синтез лактамов глюкагона 285 мг (0,2 ммоль) метоксибензгидриламиновой смолы(компания Midwest Biotech) загружали в реактор емкостью 60 мл и приведенную ниже последовательность собирали в модифицированном синтезаторе пептидов Applied Biosystems 430A посредством Вос(12-16 лактам; последовательность SEQ ID NO: 12) Применялись приведенные ниже защитные группы боковых цепей: Arg(Tos), Asp(OcHex),Asn(Xan), Glu(OFm), His(BOM), Lys(Fmoc), Ser(Bzl), Thr(Bzl), Trp(CHO), Tyr(Br-Z). Lys(Cl-Z) применяли в положении 12, если лактамы конструировали из 16-20, 20-24 либо 24-28. Полученную пептидильную смолу обрабатывали 20% раствором пиперидина в диметилформамиде в течение 1 ч с перемешиванием для удаления защитной формильной группы из триптофана, а также защитных групп Fmoc и OFm из
МПК / Метки
МПК: A61K 38/26, C07K 14/605
Метки: соагонисты
Код ссылки
<a href="https://eas.patents.su/30-17849-soagonisty-glyukagonovyh-glp-1-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Соагонисты глюкагоновых/glp-1-рецепторов</a>
Предыдущий патент: Способ получения агомелатина
Следующий патент: Мобильный коммуникатор
Случайный патент: Устройство базовой станции, устройство мобильного терминала, система беспроводной связи и способ беспроводной связи


































