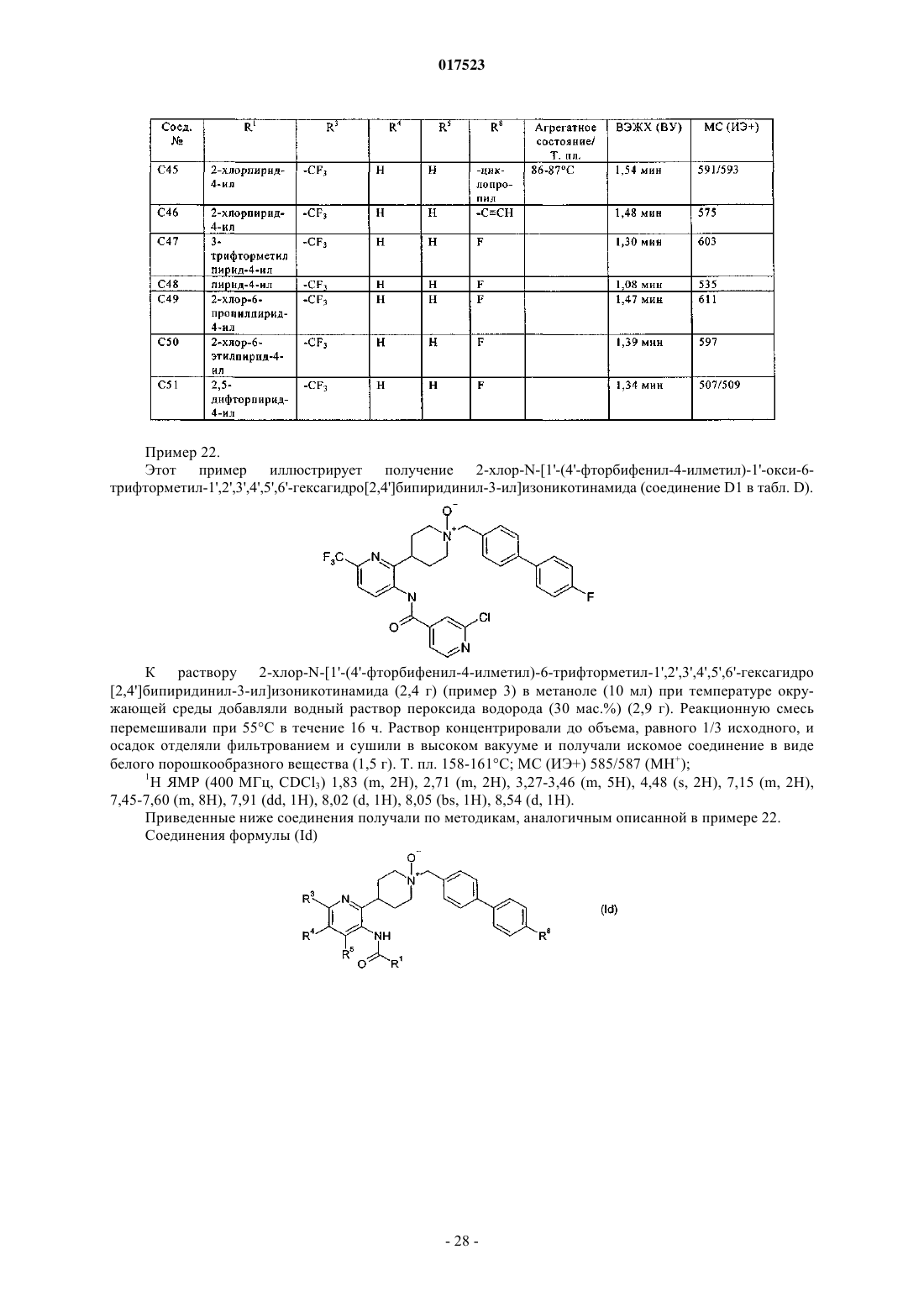
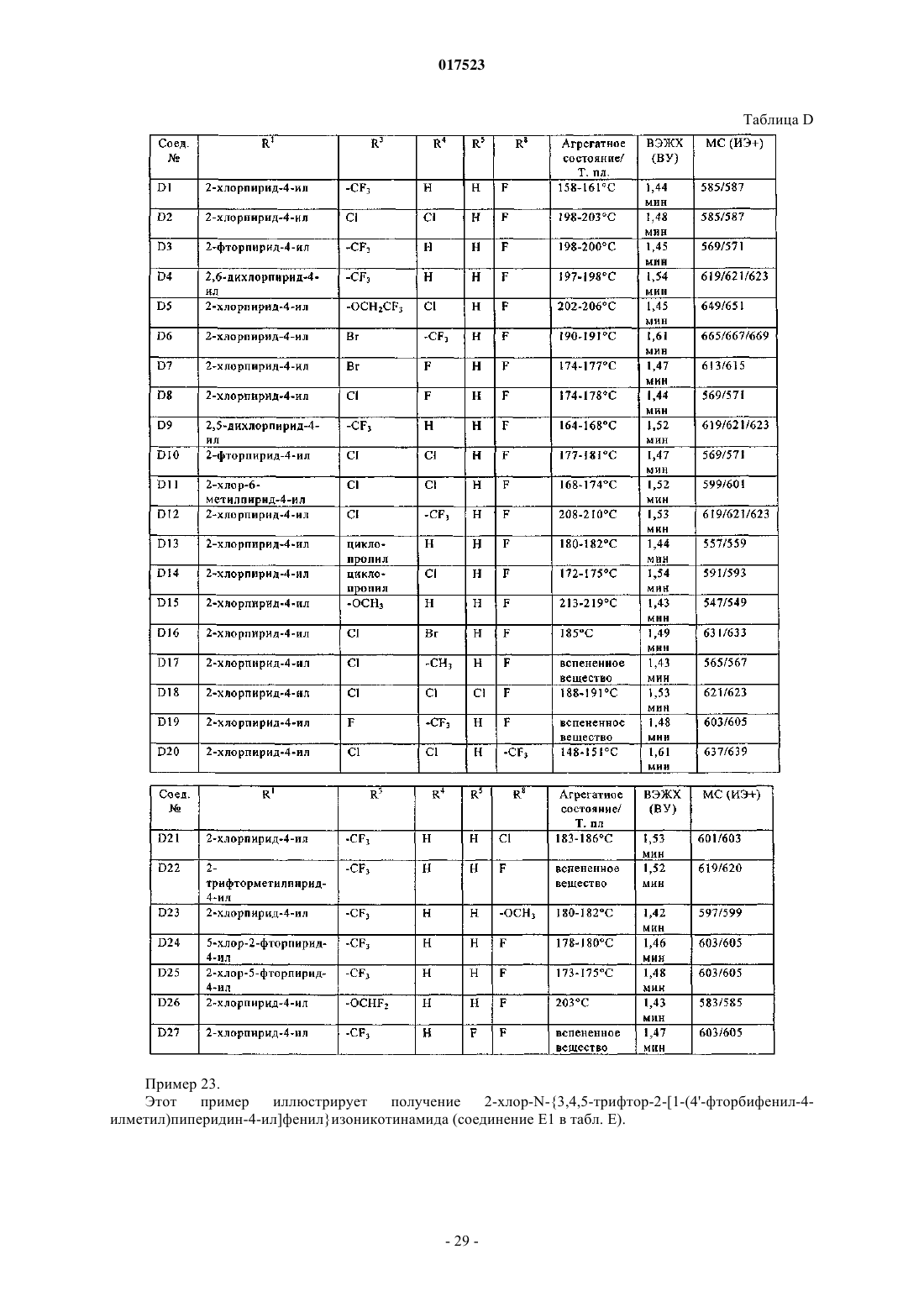
Инсектицидные фенил- или пиридилпиперидины
Номер патента: 17523
Опубликовано: 30.01.2013
Авторы: Корси Камилла, Майенфиш Петер, Кассаир Жером Ив, Питтерна Томас
Формула / Реферат
1. Соединение формулы (I)
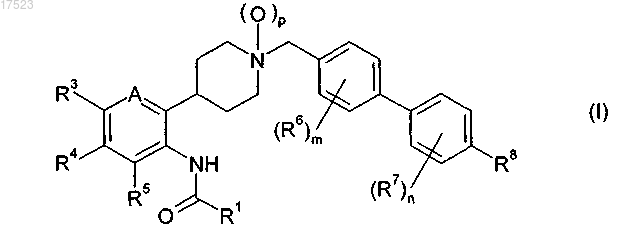
в которой
A обозначает CR2 или N;
p равно 0 или 1;
R1 обозначает пирид-4-ил, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из галогена, C1-C3-алкила или C1-C3-галогеналкила;
R2 обозначает водород, галоген, C1-C3-галогеналкил или C1-C3-галогеналкоксигруппу;
R3 и R4 независимо обозначают водород, галоген, цианогруппу, C1-C6-алкил, C1-C8-галогеналкил, C2-C8-алкенил, C2-C8-галогеналкенил, C3-C8-циклоалкил, C3-C8-галогенциклоалкил, C1-C8-алкоксигруппу, C1-C8-галогеналкоксигруппу, C1-C8-алкилтиогруппу или C1-C8-галогеналкилтиогруппу;
R5 обозначает водород или галоген;
каждый R6 и R7 независимо обозначает галоген, C1-C8-алкил, C1-C8-галогеналкил, C1-C8-алкоксигруппу или C1-C8-галогеналкоксигруппу;
m равно 0, 1 или 2;
n равно 0, 1 или 2 и
R8 обозначает водород, галоген, цианогруппу, C1-C8-алкил, C1-C8-галогеналкил, C3-C8-циклоалкил, C2-C8-алкенил, C2-C8-галогеналкенил, C2-C8-алкинил, C1-C8-алкоксигруппу или C1-C8-галогеналкоксигруппу;
или его соль.
2. Соединение по п.1, в котором R1 обозначает пирид-4-ил, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из фтора, хлора, брома, метила, дифторметила, хлордифторметила или трифторметила.
3. Соединение по п.1 или 2, в котором R3 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6-галогеналкил, C2-C6-алкенил, C3-C6-циклоалкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1-C6-алкилтиогруппу или C1-C6-галогеналкилтиогруппу.
4. Соединение по любому из предшествующих пунктов, в котором R4 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6-галогеналкил, C2-C6-алкенил, C3-C6-циклоалкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1-C6-алкилтиогруппу или C1-C6-галогеналкилтиогруппу.
5. Соединение по любому из предшествующих пунктов, в котором R5 обозначает водород, фтор, хлор или бром.
6. Соединение по любому из предшествующих пунктов, в котором каждый R6 независимо обозначает галоген, C1-C6-алкил или C1-C6-алкоксигруппу.
7. Соединение по любому из предшествующих пунктов, в котором m равно 0 или 1.
8. Соединение по любому из предшествующих пунктов, в котором каждый R7 независимо обозначает галоген, C1-C6-алкил или C1-C6-алкоксигруппу.
9. Соединение по любому из предшествующих пунктов, в котором n равно 0 или 1.
10. Соединение по любому из предшествующих пунктов, в котором R8 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6-галогеналкил, C3-C6-циклоалкил, C2-C6-алкенил, C2-C6-галогеналкенил, C2-C6-алкинил, C1-C6-алкоксигруппу или C1-C6-галогеналкоксигруппу.
11. Способ борьбы с насекомыми, клещами, нематодами или моллюсками и их уничтожения, который включает нанесение на вредителей, на очаг вредителей или на растения, подверженные нашествию вредителей, соединения формулы (I) по любому из пп.1-10 в инсектицидно, акарицидно, нематоцидно или моллюскоцидно эффективном количестве.
12. Инсектицидная, акарицидная, нематоцидная или моллюскоцидная композиция, включающая соединение формулы (I) по любому из пп.1-10 в инсектицидно, акарицидно, нематоцидно или моллюскоцидно эффективном количестве.
Текст
В изобретении описано соединение формулы (I) в которой A, p, R1, R3, R4, R5, R6, m, R7, n и R8 являются такими, как определено в п.1. Кроме того, описаны промежуточные продукты, применяющиеся для получения соединений формулы(I), и способы их применения для борьбы с насекомыми-, клещами-, нематодами- и моллюскамивредителями и их уничтожения. 017523 Настоящее изобретение относится к некоторым производным пиперидина, к промежуточным продуктам, применяющимся для их получения, к способам их применения для борьбы с насекомыми-, клещами-, нематодами- и моллюсками-вредителями и их уничтожения и к содержащим их инсектицидным,акарицидным, нематоцидным и моллюскоцидным композициям. Производные пиперидина, обладающие инсектицидной способностью, раскрыты, например, в WO 2006/003494. Согласно изобретению неожиданно было установлено, что некоторые производные пиперидина обладают улучшенными инсектицидными свойствами. Поэтому настоящее изобретение относится к соединению формулы (I)R1 обозначает пирид-4-ил, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из галогена, C1-C3-алкила или C1-C3-галогеналкила;R5 обозначает водород или галоген; каждый R6 и R7 независимо обозначает галоген, C1-C8-алкил, C1-C8-галогеналкил, C1-C8 алкоксигруппу или C1-C8-галогеналкоксигруппу;R8 обозначает водород, галоген, цианогруппу, C1-C8-алкил, C1-C8-галогеналкил, C3-C8-циклоалкил,C2-C8-алкенил, C2-C8-галогеналкенил, C2-C8-алкинил, C1-C8-алкоксигруппу или C1-C8-галогеналкоксигруппу; или к его соли. Соединения формулы (I) могут существовать в различных геометрических изомерных или оптических изомерных или таутомерных формах. В объем настоящего изобретения входят все такие изомеры и таутомеры и их смеси во всех соотношениях, а также изотопозамещенные формы, такие как дейтерированные соединения. Каждый алкильный фрагмент, по отдельности или в виде части большей группы (такой как алкоксигруппа или алкилтиогруппа), обладает линейной или разветвленной цепью и означает, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил. Алкильные группы предпочтительно представляют собой C1-C6-алкильные группы, более предпочтительно C1-C4-алкильные группы и наиболее предпочтительно C1-C3-алкильные группы. Алкенильные и алкинильные фрагменты могут находиться в виде линейных или разветвленных цепей и алкенильные фрагменты, если это является подходящим, могут находиться в (E)- или (Z)конфигурации. Примерами являются винил, аллил и пропаргил. Алкенильные и алкинильные группы предпочтительно представляют собой C2-C6-алкенильные или -алкинильные группы, более предпочтительно C2-C4- и наиболее предпочтительно C2-C3-алкенильные или -алкинильные группы. Галоген означает фтор, хлор, бром или йод. Галогеналкильные группы (по отдельности или в виде части более большой группы, такой как галогеналкоксигруппа или галогеналкилтиогруппа) представляют собой алкильные группы, которые замещены одним или большим количеством одинаковых или разных атомов галогенов и представляют собой,например -CF3, -CF2Cl, -CH2CF3 или -CH2CHF2. Галогеналкильные группы представляют собой алкильные группы, которые замещены одним или большим количеством одинаковых или разных атомов галогенов и представляют собой, например,CH=CF2 или CCl=CClF. Циклоалкильные группы могут быть моно- или бициклическими и необязательно могут быть замещены одной или более метильными группами. Циклоалкильные группы предпочтительно содержат от 3 до 8 атомов углерода, более предпочтительно от 3 до 6 атомов углерода. Примерами моноциклических циклоалкильных групп являются циклопропил, 1-метилциклопропил, 2-метилциклопропил, циклобутил,циклопентил и циклогексил. Галогенциклоалкильные группы представляют собой циклоалкильные группы, которые замещены-1 017523 одним или большим количеством одинаковых или разных атомов галогенов и необязательно могут быть замещены одним или большим количеством метильных групп. Примерами моноциклических галогенциклоалкильных групп являются 2,2-дихлорциклопропил-, 2,2-дихлор-1-метилциклопропил и 2-хлор-4 фторциклогексил. Соли состоят из заряженной модификации соединения формулы (I) и противоположно заряженного противоиона. Соединения формулы (I) могут быть положительно заряжены, например, по атому азота пиперидинового кольца, если атом азота кватернизован путем протонирования с помощью органической или неорганической кислоты. Подходящие органические кислоты включают бутилсульфоновую кислоту,2-хлорбензойную кислоту, этилсульфоновую кислоту, 3-гидроксипропансульфоновую кислоту, 4 метилбензолсульфоновую кислоту, метансульфоновую кислоту, 3-феноксипропионовую кислоту, тридекановую кислоту и трифторуксусную кислоту. Подходящие неорганические кислоты включают хлористо-водородную кислоту и фосфорную кислоту.N-оксиды представляют собой соединения формулы (I), в которой атом азота окислен. В частности,N-оксиды представляют собой соединения формулы (I), в которой окислен атом азота пиперидинового кольца. Окислительные реагенты, с помощью которых соединение формулы (I) можно превратить в Nоксид формулы (I), включают водный раствор пероксида водорода. Предпочтительные группы и значения для R1, R2, R3, R4, R5, R6, m, R7, n и R8 в любой их комбинации являются такими, как указано ниже. Предпочтительно, если R1 обозначает пирид-4-ил, необязательно содержащий 1 или 2 заместителя,каждый из которых независимо выбран из группы, включающей фтор, хлор, бром, метил, дифторметил,хлордифторметил и трифторметил; более предпочтительно, если R1 обозначает пирид-4-ил, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор и метил; наиболее предпочтительно, если R1 обозначает пирид-4-ил, содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей фтор и хлор. Предпочтительно, чтобы один заместитель находился в положении 2 пирид-4-илового кольца и чтобы второй заместитель необязательно находился в положении 5 или положении 6 пирид-4-илового кольца. Примеры наиболее предпочтительных групп R1 включают 2-фторпирид-4-ил, 2-хлорпирид-4-ил,2,5-дихлорпирид-4-ил и 2,6-дихлорпирид-4-ил. Предпочтительно, если R2 обозначает водород или галоген. Более предпочтительно, если R2 обозначает водород, фтор или хлор. Еще более предпочтительно, если R2 обозначает водород или фтор. Наиболее предпочтительно, если R2 обозначает водород. Предпочтительно, если R3 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6 галогеналкил, C2-C6-алкенил, C3-C6-циклоалкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1C6-алкилтиогруппу или C1-C6-галогеналкилтиогруппу. Более предпочтительно, если R3 обозначает водород, фтор, хлор, бром, цианогруппу, метил, изопропил, фторметил, дифторметил, трифторметил, гептафторизопропил, винил, циклопропил, метоксигруппу, этоксигруппу, дифторметоксигруппу, трифторметоксигруппу, 2,2,2-трифторэтоксигруппу или трифторметилтиогруппу. Еще более предпочтительно, если R3 обозначает водород, фтор, хлор, бром, дифторметил, трифторметил, гептафторизопропил, винил, циклопропил, метоксигруппу, дифторметоксигруппу, трифторметоксигруппу или 2,2,2-трифторэтоксигруппу. Еще более предпочтительно, если R3 обозначает водород, фтор, хлор, бром, трифторметил, циклопропил или трифторметоксигруппу. Наиболее предпочтительно, если R3 обозначает трифторметил. Предпочтительно, если R4 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6 галогеналкил, C2-C6-алкенил, C3-C6-циклоалкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1C6-алкилтиогруппу или C1-C6-галогеналкилтиогруппу. Более предпочтительно, если R4 обозначает водород, фтор, хлор, бром, метил, изопропил, фторметил, дифторметил, трифторметил, гептафторизопропил, винил, циклопропил, метоксигруппу, этоксигруппу, дифторметоксигруппу, трифторметоксигруппу или 2,2,2-трифторэтоксигруппу. Еще более предпочтительно, если R4 обозначает водород, фтор, хлор, метил или трифторметил. Наиболее предпочтительно, если R4 обозначает водород. Предпочтительно, если R5 обозначает водород, фтор, хлор или бром. Более предпочтительно, если R5 обозначает водород или фтор. Наиболее предпочтительно, если R5 обозначает водород. Предпочтительно, если каждый R6 независимо обозначает галоген, C1-C6-алкил или C1-C6 алкоксигруппу. Более предпочтительно, если каждый R6 независимо обозначает фтор, хлор, метил или метоксигруппу. Наиболее предпочтительно, если каждый R6 независимо обозначает фтор или хлор. Предпочтительно, если m равно 0 или 1.-2 017523 Наиболее предпочтительно, если m равно 0. Предпочтительно, если каждый R7 независимо обозначает галоген, C1-C6-алкил или C1-C6 алкоксигруппу. Более предпочтительно, если каждый R7 независимо обозначает фтор, хлор, метил или метоксигруппу. Наиболее предпочтительно, если каждый R7 независимо обозначает фтор или хлор. Предпочтительно, если n равно 0 или 1. Наиболее предпочтительно, если n равно 0. Предпочтительно, если R8 обозначает водород, галоген, цианогруппу, C1-C6-алкил, C1-C6 галогеналкил, C3-C6-циклоалкил, C2-C6-алкенил, C2-C6-галогеналкенил, C2-C6-алкинил, C1-C6 алкоксигруппу или C1-C6-галогеналкоксигруппу. Более предпочтительно, если R8 обозначает водород, фтор, хлор, бром, цианогруппу, метил, трифторметил, циклопропил, этинил, метоксигруппу или трифторметоксигруппу. Еще более предпочтительно, если R8 обозначает фтор, хлор, бром, трифторметил или трифторметоксигруппу. Еще более предпочтительно, если R8 обозначает фтор, хлор или трифторметил. Наиболее предпочтительно, если R8 обозначает фтор. Предпочтительным вариантом осуществления являются соединения формулы (Ia), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), А обозначает C-H, и m, n и p равны 0. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (Ib), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), А обозначает C-H, m и n равны 0, и p равно 1. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (Ic), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), А обозначает N, и m, n и p равны 0. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (Id), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), А обозначает N, m и n равны 0,и p равно 1. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (Ie), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), А обозначает C-F, и m, n и p равны 0. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (If), в которой A, R1,3 6R , R , m, R7, n и R8 являются такими, как определено для соединения формулы (I), R 4 и R5 обозначают H,и p равно 0, при условии, что по меньшей мере один из m или n не равен 0. Предпочтения для R1, R3, R6,m, R7, n и R8 являются такими же, как указанные для соединения формулы (I), за исключением того, что по меньшей мере один из m и n не равен 0. Предпочтительным вариантом осуществления являются соединения формулы (Ig), в которой R1, R3,4 5R , R и R8 являются такими, как определено для соединения формулы (I), и А обозначает C-F, m и n равны 0 и p равно 1. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соединения формулы (Ih), в которой A, R1,3 6R , R , m, R7, n и R8 являются такими, как определено для соединения формулы (I), R4 и R5 обозначают H и p равно 1, при условии, что по меньшей мере один из m или n не равен 0. Предпочтения для R1, R3, R6,m, R7, n и R8 являются такими же, как указанные для соединения формулы (I), за исключением того, что по меньшей мере один из m и n не равен 0. Предпочтительным вариантом осуществления являются соли формулы (Ij), в которой R1, R3, R4, R5 8 и R являются такими, как определено для соединения формулы (I), А обозначает C-H, m и n равны 0, p равно 1 и HX выбран из группы, включающей 2-хлорбензойную кислоту, этансульфоновую кислоту,хлористо-водородную кислоту, 3-гидроксипропан-1-сульфоновую кислоту, метансульфоновую кислоту,(4-метилфенил)сульфоновую кислоту, 3-феноксипропионовую кислоту, фосфорную кислоту, тридекановую кислоту, трифторуксусную кислоту. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Предпочтительным вариантом осуществления являются соли формулы (Ik), в которой R1, R3, R4, R5 8 и R являются такими, как определено для соединения формулы (I), НХ является таким, как определено для соединения формулы (Ij), A обозначает N, m и n равны 0 и p равно 1. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I).-3 017523 Предпочтительным вариантом осуществления являются соли формулы (Im), в которой R1, R3, R4, R5 и R являются такими, как определено для соединения формулы (I), HX является таким, как определено для соединения формулы (Ij), A обозначает N и m, n и р равны 0. Предпочтения для R1, R3, R4, R5 и R8 являются такими же, как указанные для соединения формулы (I). Некоторые промежуточные продукты являются новыми и образуют еще один объект настоящего изобретения. Одной такой группой промежуточных продуктов являются соединения формулы (II) 8 в которой R1, R3, R4 и R5 являются такими, как определено для соединения формулы (I). Предпочтения для R1, R3, R4 и R5 являются такими же, как указанные для соединения формулы (I). Другой группой промежуточных продуктов являются соединения формулы (III) в которой R1, R3, R4 и R5 являются такими, как определено для соединения формулы (I); и R11 обозначаетC1-C6-алкил, такой как трет-бутил, C2-C6-алкенил, такой как аллил, или бензил, необязательно содержащий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, C1-C6-алкил, C1-C6 галогеналкил, C1-C6-алкоксигруппу и C1-C6-галогеналкоксигруппу. Предпочтения для R1, R3, R4 и R5 являются такими же, как указанные для соединения формулы (I). 11R предпочтительно обозначает трет-бутил. Другой группой промежуточных продуктов являются соединения формулы (IV) в которой R3, R4 и R5 являются такими, как определено для соединения формулы (I), или R3 и R5 обозначают водород и R4 обозначает фтор, хлор или трифторметил; и R11 является таким, как определено для соединения формулы (III). Предпочтения для R3, R4 и R5 являются такими же, как указанные для соединения формулы (I). Предпочтение для R11 является таким же, как указанное для соединения формулы(III). Другой группой промежуточных продуктов являются соединения формулы (V) в которой R3, R4 и R5 являются такими, как определено для соединения формулы (I), или R3 и R5 обозначают водород и R4 обозначает фтор, хлор или трифторметил; и R11 является таким, как определено для соединения формулы (III). Предпочтения для R3, R4 и R5 являются такими же, как указанные для соединения формулы (I). Предпочтение для R11 является таким же, как указанное для соединения формулы(III). Другой группой промежуточных продуктов являются соединения формулы (VI) в которой R3, R4 и R5 являются такими, как определено для соединения формулы (I); и R11 являются таким, как определено для соединения формулы (III). Предпочтения для R3, R4 и R5 являются такими же,как указанные для соединения формулы (I). Предпочтение для R11 является таким же, как указанное для соединения формулы (III). Соединения, предлагаемые в настоящем изобретении, можно получить по различным методикам,как это описано в WO 2006/003494. Например, соединения формулы (I) можно получить в соответствии со схемами 1, 2 и 3. Таким образом, соединение формулы (1), в которой A, R1, R3, R4, R5, R6, m, R7, n и R8 являются такими, как определено для соединения формулы (I), можно получить из соединения формулы (2), в которой A, R1, R3, R4 и R5 являются такими, как определено для соединения формулы (I), по реакции с соединением формулы (3), в которой R6, m, R7, n и R8 являются такими, как определено для соединения формулы (I) и X обозначает отщепляющуюся группу, такую как галогенид (например, хлорид, бромид или йодид) или сульфонат (например, мезилат или тозилат), в присутствии основания, такого как третичный амин (например, диизопропилэтиламин или триэтиламин), в органическом растворителе, таком как дихлорметан, ацетонитрил или N,N-диметилформамид, при температуре, равной от 0 до 100C, обычно при температуре окружающей среды, как показано на схеме 1. Схема 1 Альтернативно, соединение формулы (1), определенное выше, можно получить из соединения формулы (2), определенного выше, по реакции с альдегидом формулы (4), в которой R8 является таким, как определено для соединения формулы (I), в присутствии восстановительного реагента, такого как (триацетокси)борогидрид натрия, цианоборогидрид натрия или боран и т.п., в органическом растворителе,таком как тетрагидрофуран, метанол или этанол, при температуре, равной от 0 до 100C, обычно при температуре окружающей среды, как показано на схеме 2. Схема 2 Соединения формулы (2) можно получить так, как описано в WO 2006/003494. Примеры этих методик приведены в примерах получения соединений.-5 017523 Соединения формулы (3) и (4) являются известными соединениями или их можно получить по методикам, известным специалисту в данной области техники. Примеры этих методик приведены в примерах получения соединений. Схема 3N-оксиды формулы (5) можно получить путем окисления соединения формулы (1) окислительным реагентом, таким как пероксид водорода или 3-хлорпероксибензойная кислота, в органическом растворителе, таком как дихлорметан, этанол, метанол или вода, или в смеси растворителей, при температуре,равной от -78 до 100C, обычно при температуре окружающей среды, как показано на схеме 3. Соединения формулы (I) обладают улучшенной пестицидной способностью. Например, соединения могут обладать повышенной инсектицидной активностью и/или улучшенной светостойкостью. Соединения формулы (I) можно использовать для борьбы с нашествиями указанных ниже вредителей-насекомых и их уничтожения, таких как чешуекрылые, двукрылые, полужесткокрылые, бахромчатокрылые, прямокрылые, тараканы, жесткокрылые, блохи, перепончатокрылые и термиты, а также другие беспозвоночные вредители, например клещи, нематоды и моллюски. Насекомые, клещи, нематоды и моллюски далее совместно будут называться вредителями. Вредители, с которыми можно бороться и которых можно уничтожать путем применения соединений, предлагаемых в настоящем изобретении,включают вредителей, связанных с земледелием (этот термин включает выращивание урожая для получения пищевых продуктов и продуктов из волокон), плодоводством и животноводством, домашними животными, лесоводством и хранением продуктов растительного происхождения (таких как плоды, зерно и древесина); вредителей, связанных с повреждением искусственных сооружений и передачей болезней человеку и животным; а также раздражающих вредителей (таких как мухи). Примеры видов вредителей, бороться с которыми можно с помощью соединений формулы (I),включают Myzus persicae (тля), Aphis gossypii (тля), Aphis fabae (тля), Lygus spp. (клопы), Dysdercus spp.spp. (пухоеды и вши), Meloidogyne spp. (корневые нематоды), Globodera spp. и Heterodera spp. (гетеродериды), Pratylenchus spp. (повреждающие растения нематоды), Rhodopholus spp. (банановые норовые или сверлящие нематоды), Tylenchulus spp. (цитрусовые нематоды), Haemonchus contortus (гемонхус),Caenorhabditis elegans (уксусная нематода), Trichostrongylus spp. (желудочно-кишечные нематоды) и-6 017523 Поэтому настоящее изобретение относится к способу борьбы с насекомыми, клещами, нематодами и моллюсками и их уничтожения, который включает нанесение соединения формулы (I) или композиции, содержащей соединение формулы (I), в инсектицидно, акарицидно, нематоцидно или моллюскоцидно эффективном количестве на вредителей, на очаг вредителей, предпочтительно на растение, или на растение, подверженное нашествию вредителей. Соединения формулы (I) предпочтительно использовать против насекомых, клещей или нематод. При использовании в настоящем изобретении термин "растение" включает сеянцы, кустарники и деревья. Культуры следует понимать и как включающие такие культуры, которым придана стойкость к гербицидам или классам гербицидов (например, к ингибиторам ALS-, GS-, EPSPS-, PPO-, ACCase и HPPD) с помощью обычных методик селекции или генной инженерии. Примером культуры, которой с помощью обычных методик селекции придана стойкость, например, к имидазолинонам, например к имазамоксу,является сурепица Clearfield (канола). Примерами культур, которым с помощью методик генной инженерии придана стойкость к гербицидам, являются сорта кукурузы, стойкие, например, к глифосату или глуфосинату, которые имеются в продаже под торговыми названиями RoundupReady и LibertyLink. Под культурами также следует понимать такие, у которых методами генной инженерии была выработана стойкость к насекомым-вредителям, например Bt-кукуруза (стойкая по отношению к кукурузному мотыльку), Bt-хлопчатник (устойчивый к хлопковому долгоносику), а также различные сорта Btкартофеля (устойчивого к колорадскому жуку). Примерами Bt-кукурузы являются гибриды кукурузы Bt 176 сорта NK (Syngenta Seeds). Примерами трансгенных растений, которые содержат один или большее количество генов, которые кодируют стойкость к инсектицидам и вырабатывают один или большее количество токсинов, являются KnockOut (кукуруза), Yield Gard (кукуруза), NuCOTIN33B (хлопок),Bollgard (хлопок), NewLeaf (картофель), NatureGard и Protexcta. Культурные растения и их семенной материал может быть стойким по отношению к гербицидам и одновременно также к поеданию насекомыми (совмещенные трансгенные характеристики). Семена могут, например, обладать способностью вырабатывать обладающий инсектицидной активностью белокCry3 и одновременно являться стойкими по отношению к глифосату. Под культурами также следует понимать такие, которые получены по обычным методикам селекции или генной инженерии и собранный урожай которых обладает дополнительными характеристиками(например, улучшенной стабильностью при хранении, большей питательной ценностью и улучшенным вкусом). Для нанесения соединения формулы (I) в виде инсектицида, акарицида, нематоцида или моллюскоцида на вредителей, на очаг вредителей или на растения, подверженные нашествию вредителей, соединение формулы (I) обычно вносят в композицию, которая в дополнение к соединению формулы (I) включает подходящий инертный разбавитель или носитель и необязательно поверхностно-активное вещество(ПАВ). ПАВ являются химикатами, которые способны изменять свойства границы раздела (например,границ раздела жидкость/твердое вещество, жидкость/воздух или жидкость/жидкость) путем снижения поверхностного натяжения, что приводит к изменениям других свойств (например, диспергирования,эмульгирования и смачивания). Предпочтительно, чтобы все композиции (и твердые, и жидкие препараты) включали, в мас.%, от 0,0001 до 95%, более предпочтительно от 1 до 85%, например от 5 до 60% соединения формулы (I). Композицию обычно применяют для борьбы с вредителями таким образом, чтобы соединение формулы (I) наносилось в количестве, составляющем от 0,1 г до 10 кг на 1 га, предпочтительно от 1 г до 6 кг на 1 га, более предпочтительно от 1 г до 1 кг на 1 га. При использовании для протравливания семян соединение формулы (I) применяется в количестве,составляющем от 0,0001 до 10 г (например, 0,001 г или 0,05 г), предпочтительно от 0,005 до 10 г, более предпочтительно от 0,005 до 4 г на 1 кг семян. Другим объектом настоящего изобретения является инсектицидная, акарицидная, нематоцидная или моллюскоцидная композиция, включающая соединение формулы (I) в инсектицидно, акарицидно,нематоцидно или моллюскоцидно эффективном количестве и его подходящий носитель или разбавитель. Композиция предпочтительно является инсектицидной, акарицидной, нематоцидной или моллюскоцидной композицией. Еще одним объектом настоящего изобретения является способ борьбы с вредителями в очаге, который включает обработку вредителей или очага вредителей с помощью композиции, содержащей соединение формулы (I) в инсектицидно, акарицидно, нематоцидно или моллюскоцидно эффективном количестве. Соединения формулы (I) предпочтительно использовать против насекомых, клещей или нематод. Композиции можно выбрать из целого ряда типов препаратов, включая порошки для опыления(ДГ), смачивающиеся порошки (СП), гранулы (ГР) (с медленным или быстрым высвобождением), растворимые концентраты (РК), смешивающиеся с маслом жидкости (МЖ), жидкости сверхмалого объема(ЖС), эмульгирующиеся концентраты (ЭК), диспергирующиеся концентраты (ДК), эмульсии (и масло-вводе (ЭМ), и вода-в-масле (ЭВ, микроэмульсии (МЭ), концентраты суспензий (СК), аэрозоли, препара-7 017523 ты для мелкокапельного опрыскивания/фумигации, капсулированные суспензии (КС) и препараты для обработки семян. Выбранный тип композиции в любом случае будет зависеть от конкретного назначения и физических, химических и биологических характеристик соединения формулы (I). Порошки для опыления (ПО) можно получить путем смешивания соединения формулы (I) с одним или большим количеством твердых разбавителей (например, природными глинами, каолином, пирофиллитом, бентонитом, оксидом алюминия, монтмориллонитом, кизельгуром, мелом, диатомовой землей,фосфатами кальция, карбонатами кальция и магния, серой, известью, разными типами муки, тальком и другими органическими и неорганическими твердыми носителями) и механического размола смеси в тонкоизмельченный порошок. Растворимые порошки (РП) можно получить путем смешивания соединения формулы (I) с одним или большим количеством растворимых в воде неорганических солей (таких как бикарбонат натрия, карбонат натрия или сульфат магния) или с одним или большим количеством растворимых в воде органических твердых веществ (таких как полисахарид) и, необязательно, с одним или большим количеством смачивающих агентов, с одним или большим количеством диспергирующих агентов или смесью таких агентов для улучшения диспергируемости/растворимости в воде. Затем смесь размалывают в тонкоизмельченный порошок. Аналогичные композиции также можно гранулировать с получением растворимых в воде гранул (ВГ). Смачивающиеся порошки (СП) можно получить путем смешивания соединения формулы (I) с одним или большим количеством твердых разбавителей или носителей, с одним или большим количеством смачивающих агентов и предпочтительно с одним или большим количеством диспергирующих агентов и, необязательно, с одним или большим количеством суспендирующих агентов для облегчения диспергирования в жидкостях. Затем смесь размалывают в тонкоизмельченный порошок. Аналогичные композиции также можно гранулировать с получением диспергирующихся в воде гранул (ДГ). Гранулы (ГР) можно получить или путем гранулирования смеси соединения формулы (I) с одним или большим количеством порошкообразных твердых разбавителей или носителей, или из предварительно сформованных не содержащих активный ингредиент гранул путем абсорбции соединения формулы (I) (или его раствора в подходящем агенте) в пористом гранулированном материале (таком как пемза,аттапульгитовые глины, фуллерова земля, кизельгур, диатомовая земля или размолотые кукурузные кочерыжки) или путем адсорбции соединения формулы (I) (или его раствора в подходящем агенте) в твердом наполнителе (таком как песок, силикаты, неорганические карбонаты, сульфаты или фосфаты) с проведением сушки в случае необходимости. Агенты, которые обычно применяются для содействия абсорбции или адсорбции, включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, простые эфиры, кетоны и сложные эфиры) и склеивающие агенты (такие как поливинилацетаты, поливиниловые спирты, декстрины, сахара и растительные масла). В гранулы также можно включить одну или большее количество других добавок (например, эмульгирующий агент, смачивающий агент или диспергирующий агент). Диспергирующиеся концентраты (ДК) можно получить путем растворения соединения формулы (I) в воде или органическом растворителе, таком как кетон, спирт или простой эфир гликоля. Эти растворы могут содержать поверхностно-активное вещество (например, для улучшения разбавления водой или предотвращения кристаллизации в баке для опрыскивания). Эмульгирующиеся концентраты (ЭК) или эмульсии масло-в-воде (ЭМ) можно получить путем растворения соединения формулы (I) в органическом растворителе (необязательно содержащем один или более смачивающих агентов, один или более эмульгирующих агентов или смесь таких агентов). Подходящие для использования в ЭК органические растворители включают ароматические углеводороды (такие как алкилбензолы или алкильнафталины, примерами которых являются SOLVESSO 100, SOLVESSO 150 и SOLVESSO 200; SOLVESSO является зарегистрированным товарным знаком), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или N-октилпирролидон), диметиламиды жирных кислот (такие как диметиламид жирной кислоты C8-C10) и хлорированные углеводороды. Готовый ЭК может самопроизвольно эмульгироваться при добавлении к воде с образованием эмульсии,обладающей достаточной стабильностью, чтобы с помощью подходящего оборудования было возможно проведение опрыскивания. Получение ЭМ включает получение соединения формулы (I) в виде жидкости(если при комнатной температуре оно не является жидкостью, то его можно расплавить при подходящей температуре, обычно ниже 70C) или раствора (путем растворения в подходящем растворителе) с последующим эмульгированием полученной жидкости или раствора в воде, содержащей одно или большее количество ПАВ, при большом сдвиговом усилии, с получением эмульсии. Подходящие для использования в ЭМ растворители включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкильнафталины) и другие подходящие органические растворители, которые обладают низкой растворимостью в воде. Микроэмульсии (МЭ) можно получить путем смешивания воды со смесью одного или большего количества растворителей с одним или большим количеством ПАВ для обеспечения самопроизвольного образования термодинамически стабильного изотропного жидкого препарата. Соединение формулы (I)-8 017523 первоначально содержится или в воде, или в смеси растворитель/ПАВ. Подходящие для использования в МЭ растворители включают описанные выше для применения в ЭК или ЭМ. МЭ может представлять собой систему масло-в-воде или вода-в-масле (определить тип имеющейся системы можно путем измерения электропроводности) и она может быть подходящей для смешивания растворимых в воде и растворимых в масле пестицидов в одном и том же препарате. МЭ пригодна для разбавления водой, в которой она остается микроэмульсией или образует обычную эмульсию масло-в-воде. Концентраты суспензий (СК) могут включать водные или неводные суспензии тонкоизмельченных нерастворимых твердых частиц соединения формулы (I). CK можно получить путем размола на шаровой или бисерной мельнице твердого соединения формулы (I) в подходящей среде, необязательно с одним или большим количеством диспергирующих агентов и получить тонкоизмельченную суспензию соединения. В композицию можно включить один или большее количество смачивающих агентов и можно включить суспендирующий агент для снижения скорости оседания частиц. Альтернативно, соединение формулы (I) можно подвергнуть сухому размолу и добавить к воде, содержащей агенты, описанные выше в настоящем изобретении, и получить искомый готовый продукт. Аэрозольные препараты включают соединение формулы (I) и подходящий пропеллент (например,н-бутан). Соединение формулы (I) также можно растворить или диспергировать в подходящей среде (например, в воде или смешивающейся с водой жидкости, такой как н-пропанол) и получить композиции для использования в не находящихся под давлением емкостях для распыления, действующих с помощью ручных насосов. Соединение формулы (I) можно в сухом виде смешать с пиротехнической смесью и получить композицию, пригодную для образования в закрытом пространстве дыма, содержащего соединение. Капсулированные суспензии (КС) можно получить способом, сходным со способом получения препаратов ЭМ, но с включением дополнительной стадии полимеризации так, чтобы образовалась водная дисперсия капелек масла, в которой каждая капелька масла капсулирована с помощью полимерной оболочки и содержит соединение формулы (I) и, необязательно, его носитель или разбавитель. Полимерную оболочку можно получить с помощью межфазной реакции поликонденсации или по методике коацервации. Композиции могут использоваться для регулируемого высвобождения соединения формулы (I) и их можно использовать для обработки семян. Соединение формулы (I) также можно включить в биологически разлагающуюся полимерную матрицу и обеспечить медленное, регулируемое высвобождение соединения. Композиция может включать одну или большее количество добавок для улучшения биологических рабочих характеристик композиции (например, путем улучшения смачивания, удерживания или распределения на поверхностях; стойкости к воздействию дождя на обработанные поверхности; или впитывания или подвижности соединения формулы (I. Такие добавки включают поверхностно-активные вещества, добавки для опрыскивания на основе масел, например, некоторых минеральных масел или натуральных растительных масел (таких как соевое масло и рапсовое масло), и их смеси с другими усиливающими биологическое воздействие вспомогательными веществами (ингредиентами, которые могут содействовать воздействию соединения формулы (I) или изменять его воздействие). Соединение формулы (I) также можно приготовить для применения в качестве средства обработки семян, например в виде порошкообразной композиции, включая порошок для сухой обработки семян(ПС), растворимый в воде порошок (ВП) и диспергирующийся в воде порошок для обработки взвесью(ДП), или в виде жидкой композиции, включая текучий концентрат (ТК), раствор (PC) и капсулированную суспензию (КС). Получение композиций ПС, ВП, ДП, ТК и PC является очень сходным с получением описанных выше композиций ПО, РП, СП, СК и ДК соответственно. Композиции для обработки семян могут включать агент, способствующий адгезии композиции к семенам (например, минеральное масло или пленкообразующее защитное вещество). Смачивающие агенты, диспергирующие агенты и эмульгирующие агенты могут представлять собой ПАВ катионогенного, анионогенного, амфотерного или неионогенного типа. Подходящие ПАВ катионогенного типа включают четвертичные аммониевые соединения (например, цетилтриметиламмонийбромид), имидазолины и соли аминов. Подходящие анионогенные ПАВ включают соли щелочных металлов жирных кислот, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция,бутилнафталинсульфонат и смеси диизопропил- и триизопропилнафталинсульфонатов натрия), сульфаты простых эфиров, сульфаты простых эфиров спиртов (например, лаурет-3-сульфат натрия), карбоксилаты простых эфиров (например, лаурет-3-карбоксилат натрия), фосфатные сложные эфиры (продукты реакции одного или большего количества жирных спиртов с фосфорной кислотой (преимущественно сложные моноэфиры) или с пентаоксидом фосфора (преимущественно сложные диэфиры), например, продукты реакции лаурилового спирта с тетрафосфорной кислотой; эти продукты также могут быть этоксилированы), сульфосукцинаматы, сульфонаты парафинов или олефинов, таураты и лигносульфонаты. Подходящие ПАВ амфотерного типа включают бетаины, пропионаты и глицинаты. Подходящие ПАВ неионогенного типа включают продукты конденсации алкиленоксидов, таких как-9 017523 этиленоксид, пропиленоксид, бутиленоксид, или их смесей с жирными спиртами (такими как олеиловый спирт или цетиловый спирт) или с алкилфенолами (такими как октилфенол, нонилфенол или октилкрезол); частичные сложные эфиры, полученные из жирных кислот с длинными цепями или ангидридов гексита; продукты конденсации указанных частичных сложных эфиров с этиленоксидом; блок-полимеры(включающие этиленоксид и пропиленоксид); алканоламиды; обычные сложные эфиры (например, полиэтиленгликолевые эфиры жирных кислот); оксиды аминов (например, лаурилдиметиламиноксид); и лецитины. Подходящие суспендирующие агенты включают гидрофильные коллоиды (такие как полисахариды,поливинилпирролидон или натриевая соль карбоксиметилцеллюлозы) и набухающие глины (такие как бентонит или аттапульгит). Соединение формулы (I) можно вносить любыми известными способами нанесения пестицидных соединений. Например, его можно нанести, одно или в композиции, на вредителей или на очаг вредителей (такой как место обитания вредителей или выращиваемое растение, подверженное заражению вредителями) или на любую часть растения, включая листву, стебли, ветви или корни, на семена перед их высеванием или на другие среды, в которых произрастает или должно быть посеяно растение (такие как почва, окружающая корни, почва в целом, вода для затопления или гидропонные системы выращивания),непосредственно или его можно вносить путем разбрызгивания, опыления, наносить погружением, вносить в виде препарата, представляющего собой крем или пасту, вносить в виде паров или вносить путем распределения композиции (такой как гранулированная композиция или композиция, упакованная в растворимый в воде пакет) в почве или в водной среде или включения в нее. Соединение формулы (I) также можно ввести в растения путем инъекции или опрыскивания растительного покрова с использованием электродинамических методик опрыскивания или других малообъемных методик или внести на участок с помощью наземных или авиационных систем орошения. Композиции для применения в качестве водных препаратов (водных растворов или дисперсий) обычно поставляются в виде концентрата, содержащего значительную долю активного ингредиента, и перед применением концентрат добавляют к воде. Эти концентраты, которые могут представлять собой ДК, СК, ЭК, ЭМ, МЭ, ВГ, РП, СП, ДГ и КС, часто должны выдерживать хранение в течение продолжительных периодов времени и после такого хранения после добавления к воде должны быть способны образовывать водные препараты, которые остаются однородными в течение времени, достаточного для того, чтобы их можно было вносить с помощью обычного оборудования для разбрызгивания. Такие водные препараты могут содержать разные количества соединения формулы (I) (например, от 0,0001 до 10 мас.%) в зависимости от цели их применения. Соединение формулы (I) можно применять в смесях с удобрениями (например, азот-, калий- или фосфорсодержащими удобрениями). Подходящие типы препаратов включают гранулы удобрения. Предпочтительно, чтобы смеси содержали до 25 мас.% соединения формулы (I). Поэтому настоящее изобретение также относится к композиции удобрения, содержащей удобрение и соединение формулы (I). Композиции, предлагаемые в настоящем изобретении, могут содержать другие соединения, обладающие биологической активностью, например микроудобрения или соединения, обладающие фунгицидной активностью или обладающие регулирующей рост растения, гербицидной, инсектицидной, нематоцидной или акарицидной активностью. Соединение формулы (I) может являться единственным активным ингредиентом композиции или оно может быть смешано с одним или большим количеством дополнительных активных ингредиентов,таких как пестицид, фунгицид, синергетик, гербицид или регулятор роста растений, если это целесообразно. Дополнительный активный ингредиент может: давать композицию, обладающую более широким спектром активности или повышенной устойчивостью в очаге распространения; усиливать воздействие или дополнять воздействие (например, путем увеличения скорости воздействия или преодоления невосприимчивости) соединения формулы (I); или способствовать преодолению или предупреждению развития резистентности по отношению к отдельным компонентам. То, какой конкретный дополнительный активный ингредиент будет использоваться, зависит от назначения композиции. Примеры подходящих пестицидов включают следующие:a) пиретроиды, такие как перметрин, циперметрин, фенвалерат, эсфенвалерат, дельтаметрин, цигалотрин (в частности, лямбда-цигалотрин), бифентрин, фенпропатрин, цифлутрин, тефлутрин, безопасные для рыб пиретроиды (например, этофенпрокс), натуральный пиретрин, тетраметрин, s-биоаллетрин,фенфлутрин,праллетрин или 5-бензил-3-фурилметил(E)-(1R,3S)-2,2-диметил-3-(2-оксотиолан-3 илиденметил)циклопропанкарбоксилат;f) пиразолы, такие как тебуфенпирад и фенпироксимат;g) макролиды, такие как авермектины или милбемицины, например абамектин, эмамектинбензоат,ивермектин, милбемицин или спиносад, спинеторам или азадирахтин;j) амидины, такие как хлордимеформ или амитраз;n) дифениловые эфиры, такие как диофенолан или пирипроксифен;t) циенопирафен или цифлуметофен илиu) сульфоксафлор. В дополнение к основным химическим классам пестицидов, перечисленным выше, в композициях можно использовать другие пестициды, воздействующие на определенных вредителей, если это целесообразно для предназначения композиции. Например, можно использовать инсектициды, селективные для конкретных культур, например специфичные по отношению к стеблевым пилильщикам инсектициды(такие как картап) или специфичные для амбаров инсектициды (такие как бупрофезин) для применения для риса. Альтернативно, в композицию также можно включать инсектициды или акарициды, специфичные для конкретных видов/стадий развития насекомых (например, акарицидные оволарвициды, такие как клофентезин, флукбензимин, гекситиазокс или тетрадифон; акарицидные мотилициды, такие как дикофол или пропаргит; акарициды, такие как бромпропилат или хлорбензилат; или регуляторы роста, такие как гидраметилнон, циромазин, метопрен, хлорфлуазурон или дифлубензурон). Примерами фунгицидных соединений, которые можно включать в композицию, предлагаемую в настоящем изобретении, являются (E)-N-метил-2-[2-(2,5-диметилфеноксиметил)фенил]-2-метоксииминоацетамид (SSF-129), 4-бром-2-циано-N,N-диметил-6-трифторметилбензимидазол-1-сульфонамид, -[N(3-хлор-2,6-ксилил)-2-метоксиацетамидо]бутиролактон, 4-хлор-2-циано-N,N-диметил-5-п-толилимидазол-1-сульфонамид(АС 382042), N-(2-метокси-5-пиридил)циклопропанкарбоксамид, ацибензолар (CGA245704), аланикарб,альдиморф, анилазин, азаконазол, азоксистробин, беналаксил, беномил, билоксазол, битертанол, бластицидин S, бромуконазол, бупиримат, каптафол, каптан, карбендазим, карбендазимхлоргидрат, карбоксин,карпропамид, карвон, CGA41396, CGA41397, хинометионат, хлороталонил, хлорозолинат, клозилакон,содержащие медь соединения, такие как оксихлорид меди(II), оксихинолат меди(II), сульфат меди(II),таллат меди(II) и бордосская жидкость, цимоксанил, ципроконазол, ципродинил, дебакарб, ди-2 пиридилдисульфид-1,1'-диоксид, дихлофлуанид, дикломезин, диклоран, диэтофенкарб, дифеноконазол,дифензокват, дифлуметорим, O,O-диизопропил-S-бензилтиофосфат, димефлуазол, диметконазол, диметоморф, диметиримол, диниконазол, динокап, дитианон, додецилдиметиламмонийхлорид, додеморф,додин, догуадин, эдифенфос, эпоксиконазол, этиримол, этил-(Z)-N-бензил-N-([метил(метилтиоэтилиденаминооксикарбонил)амино]тио)аланинат, этридиазол, фамоксадон, фенамидон (RPA407213),фенаримол, фенбуконазол, фенфурам, фенгексамид (KBR2738), фенпиклонил, фенпропидин, фенпропиморф, фентинацетат, фентингидроксид, фербам, феримзон, флуазинам, флудиоксонил, флуметовер, фторимид, флухинконазол, флусилазол, флутоланил, флутриафол, фолпет, фуберидазол, фуралаксил, фураметпир, гуазатин, гексаконазол, гидроксиизоксазол, гимексазол, имазалил, имибенконазол, иминоктадин,иминоктадинтриацетат, ипконазол, ипробенфос, ипродион, ипроваликарб (SZX0722), изопропанилбутилкарбамат, изопротиолан, касугамицин, крезоксим-метил, LY186054, LY211795, LY248908, манкозеб,манеб, мефеноксам, мепанипирим, мепронил, металаксил, метконазол, метирам, метирам-цинк, метоминостробин, миклобутанил, неоасозин, диметилдитиокарбамат никеля, нитротал-изопропил, нуаримол,офурац, ртутьорганические соединения, оксадиксил, оксасульфурон, оксолиновая кислота, окспоконазол,оксикарбоксин, перфуразоат, пенконазол, пенцикурон, феназиноксид, фосетил-А 1, фосфорсодержащие- 11017523 кислоты, фталид, пикоксистробин (ZA1963), полиоксин D, полирам, пробеназол, прохлораз, процимидон, пропамокарб, пропиконазол, пропинеб, пропионовая кислота, пиразофос, пирифенокс, пириметанил,пирохилон, пироксифур, пирролнитрин, четвертичные аммониевые соединения, хинометионат, хиноксифен, квинтоцен, сипконазол (F-155), пентахлорфенат натрия, спироксамин, стрептомицин, сера, тебуконазол, теклофталам, текназен, тетраконазол, тиабендазол, тифлузамид, 2-(тиоцианометилтио)бензотиазол, тиофанат-метил, тирам, тимибенконазол, толклофос-метил, толилфлуанид, триадимефон, триадименол, триазбутил, триазоксид, трициклазол, тридеморф, трифлоксистробин (CGA279202), трифорин,трифлумизол, тритиконазол, валидамицин A, вапам, винклозолин, зинеб и зирам. Соединения формулы (I) можно смешивать с почвой, торфом или другими средами для укоренения с целью защиты растений от распространяемых семенами, передаваемых через почву или листовых грибковых болезней. Примеры синергистов, подходящих для применения в композициях, включают пиперонилбутоксид,сезамекс, сафроксан и додецилимидазол. То, какие гербициды и регуляторы роста растений окажутся подходящими для включения в композиции, будет зависеть от объекта воздействия и необходимого эффекта. Примером селективного гербицида для риса, который можно включить, является пропанил. Примером регулятора роста растений, предназначенного для хлопка, является PIX. Некоторые смеси могут включать активные ингредиенты, которые обладают существенно иными физическими, химическими или биологическими характеристиками, так что сами по себе они нелегко включаются в такой же обычный тип препарата. В таких случаях можно получить другие типы препаратов. Например, если один активный ингредиент представляет собой не растворимое в воде твердое вещество, а другойне растворимую в воде жидкость, все же можно диспергировать каждый активный ингредиент в одной и той же непрерывной водной фазе путем диспергирования твердого активного ингредиента в виде суспензии (с использованием методики, аналогичной применяющейся для получения СК),но диспергирования жидкого активного ингредиента в виде эмульсии (с использованием методики, аналогичной применяющейся для получения ЭМ). Полученная композиция представляет собой препарат суспензия-эмульсия (СЭ). Настоящее изобретение иллюстрируется приведенными ниже примерами. ЖХМС (жидкостная хроматография-масс-спектроскопия). Спектры снимали на масс-спектрометреZMD (Micromass, Manchester UK) или на спектрометре ZQ (Waters Corp. Milford, MA, USA), снабженном источником электрораспыления (ИЭР; температура источника от 80 до 100C; температура десольватации от 200 до 250C; напряжение на конусе 30 В; скорость газа на конусе 50 л/ч, скорость газа при десольватации от 400 до 600 л/ч, диапазон масс от 150 до 1000 Да), и с помощью прибора Agilent 1100MeCN/MeOH/HCOOH 80:20:0,04; градиентный режим: 0 мин 5% В; 2-2,8 мин 100% В; 2,9-3 мин 5% В; УФ-детектирование: 200-500 нм, разрешение 2 нм. Перед анализом с помощью МС поток разделяли после его прохождения через колонку. ВУ означает время удерживания. Альтернативно, для соединений A25, A26, A27, A28, A27, C27 и C29 использовали методику ЖХМС (Waters Alliance 2795 LC) и приведенные ниже условия градиентного режима для ВЭЖХ (растворитель А: 0,1% муравьиной кислоты в воде и растворитель B: 0,1% муравьиной кислоты в ацетонитриле). Тип колонки: Waters atlantis dc18; длина колонки: 20 мм; внутренний диаметр колонки: 3 мм; размер частиц: 3 мкм; температура: 40C. Пример 1. Этот пример иллюстрирует получение 2-хлор-N-4,5-дифтор-2-[1-(4'-фторбифенил-4 илметил)пиперидин-4-ил]фенилизоникотинамида (соединение A3 в табл. A).- 12017523 Смесь 2-хлор-N-(4,5-дифтор-2-пиперидин-4-илфенил)изоникотинамида (100 мг) (получали по методикам, аналогичным описанным в WO 2006/003494), 4-хлорметил-4'-фторбифенила (52,1 мг) (получали так, как это описано в WO 2003/084916) и карбоната калия (104 мг) в ацетонитриле (10 мл) перемешивали при 60C в течение 48 ч. Растворитель выпаривали и остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат+1% метанола) и получали искомое соединение (100 мг) в виде белого аморфного твердого вещества. МС (ИЭ+) (масс-спектрометрия с ионизацией электрораспылением) 536/538 (MH+); 1H ЯМР (400 МГц, CDCl3) 1,77 (m, 4H), 2,08 (m, 2H), 2,55 (m, 1H), 3,06 (m, 2H), 3,56 (s, 2H), 7,077,73 (m, 13H), 8,60 (d, 1H). Приведенные ниже соединения получали по методикам, аналогичным описанной в примере 1. Соединения формулы (Ia) Т. пл. = температура плавления. Пример 2. Этот пример иллюстрирует получение 2-хлор-N-4,5-дифтор-2-[1-(4'-фторбифенил-4-илметил)-1 оксипиперидин-4-ил]фенилизоникотинамида (соединение B1 в табл. B). Раствор 3-хлорпероксибензойной кислоты (21,6 мг) в дихлорметане (1 мл) при -40C по каплям добавляли к раствору 2-хлор-N-4,5-дифтор-2-[1-(4'-фторбифенил-4-илметил)-пиперидин-4-ил]фенилизоникотинамида (пример 1) (47 мг) в дихлорметане (5 мл). Раствор перемешивали при -40C в течение 1 ч,затем нагревали до 0C и реакцию останавливали путем добавления водного раствора карбоната калия(10 мас.%) (3 мл). Смесь 3 раза экстрагировали дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия, концентрировали в вакууме и получали искомое соединение в виде аморфного твердого вещества. MC (ИЭ+) 552/554 (MH+); 1H ЯМР (400 МГц, MeOD) 1,80 (m, 2H), 2,40 (m, 2H), 2,93 (m, 1H), 3,23 (m, 2H), 3,48 (m, 2H), 4,44 (s,2H), 7,18 (t, 2H), 7,28 (dd, 1H), 7,43 (dd, 1H), 7,64 (m, 6H), 7,83 (d, 1H), 7,95 (s, 1H), 8,56 (d, 1H). Приведенные ниже соединения получали по методикам, аналогичным описанной в примере 2: Соединения формулы (Ib) Пример 3. Этот пример иллюстрирует получение 2-хлор-N-[1'-(4'-фторбифенил-4-илметил)-6-трифторметил 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C1 в табл. C).(получали так, как это описано в WO 2006/003494) и тетракис(трифенилфосфин)палладия (0,200 г) в 1,2 диметоксиэтане (45 мл) обрабатывали водным раствором фосфата калия (1,1 М) (1,92 г). Реакционную смесь перемешивали при 80C в течение 3 ч. Обработка водного раствора этилацетатом давала остаток,который очищали с помощью хроматографии на силикагеле (элюент: гексан/этилацетат 1:1) и получали трет-бутиловый эфир 3-амино-6-трифторметил-3',6'-дигидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (1,5 г) в виде белого твердого вещества. МС (ИЭ+) 288 (M-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,50 (s, 9H), 2,61 (m, 2H), 3,67 (t, 2H), 4,10 (m, 2H), 4,21 (s, 2H), 6,11 (s,1H), 7,03 (d, 1H), 7,33 (d, 1H). Стадия В. Соединение, полученное на стадии А (1 г), растворяли в этаноле (40 мл) и после дегазирования добавляли палладий на древесном угле (10 мас.%) (100 мг). Реакционную смесь перемешивали в атмосфере водорода при температуре окружающей среды в течение 2 дней. Фильтрование через целит давало трет-бутиловый эфир 3-амино-6-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'карбоновой кислоты (1 г) в виде белого твердого вещества. МС (ИЭ+) 290/292 (М-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,48 (s, 9H), 1,85 (m, 4H), 2,77 (m, 1H), 2,88 (m, 2H), 3,97 (s, 2H), 4,24 (m,2H), 6,97 (d, 1H), 7,32 (d, 1H). Стадия С. Раствор соединения, полученного на стадии C (1 г), в толуоле (40 мл) обрабатывали N,Nдиизопропилэтиламином (1,05 мл) и затем 2-хлоризоникотиноилхлоридом. 2-Хлоризоникотиноилхлорид получали из 2-хлоризоникотиновой кислоты (0,496 г) и оксалилхлорида (0,346 мл) в дихлорметане (40 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч, выливали в насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом, промывали водой,сушили над сульфатом натрия и затем концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (элюент: гексан/этилацетат 1:1) и получали трет-бутиловый эфир 3-[(2 хлорпиридин-4-карбонил)амино]-6-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (1,1 г). МС (ИЭ+) 485/487 (MH+), 429/431 (М-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,47 (s, 9H), 1,79 (m, 2H), 1,96 (m, 2H), 2,88 (m, 2H), 2,95 (m, 1H), 4,25 (m,2H), 7,61 (d, 1H), 7,66 (m, 1H), 7,79 (s, 1H), 8,05 (s, 1H), 8,32 (d, 1H), 8,64 (d, 1H). Стадия D. Раствор соединения, полученного на стадии С (300 мг), в дихлорметане (15 мл) обрабатывали трифторуксусной кислотой (1,2 мл) при температуре окружающей среды в течение 1 ч. Выпаривание растворителя и сушка твердого вещества в высоком вакууме давали 2-хлор-N-(6-трифторметил 1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил)изоникотинамидтрифторацетат. Свободное основание получали с помощью щелочной экстракции (этилацетат, насыщенный водный раствор гидрокарбоната). Стадия Е. Методика А. Смесь 2-хлор-N-(6-трифторметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3 ил)изоникотинамида (150 мг), 4-хлорметил-4'-фторбифенила (получали так, как это описано в WO 2003/084916) (68 мг) и N,N-диизопропилэтиламина (0,21 мл) в ацетонитриле (10 мл) перемешивали при температуре окружающей среды в течение 16 ч. Растворитель выпаривали и остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат) и получали искомое соединение (79 мг). Методика В. К смеси 2-хлор-N-(6-трифторметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил)изоникотинамида (3 г) (получали так, как это описано в WO 2006/003494) и 4'-фтор[1,1'-бифенил]-4 карбоксальдегида (1,24 г) в тетрагидрофуране (120 мл) при температуре окружающей среды добавляли(триацетокси)борогидрид натрия (2 г). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали путем добавления насыщенного водного раствора гидрокарбоната натрия. Смесь экстрагировали этилацетатом. Органический экстракт сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат) и получали искомое соединение в виде твердого вещества (2,4 г). 2-Хлор-N-[1'-(4'-фторбифенил-4-илметил)-6-трифторметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил]изоникотинамид: Т. пл. 63-66C; МС (ИЭ+) 569/571 (MH+); 1H ЯМР (400 МГц, CDCl3) 1,80 (m, 2H), 2,18 (m, 4H), 2,79 (m, 1H), 3,10 (m, 2H), 3,59 (s, 2H), 7,11 (m,2H), 7,39-7,61 (m, 8H), 7,76 (s, 1H), 7,87 (bs, 1H), 8,45 (d, 1H), 8,64 (d, 1H). Пример 4. Этот пример иллюстрирует получение 2-хлор-N-[6-хлор-5-фтор-1'-(4'-фторбифенил-4-илметил)1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C17 в табл. C). Искомое соединение получали из 2-хлор-N-(6-хлор-5-фтор-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил)изоникотинамида так, как это описано на стадии Е примера 3. 2-Хлор-N-(6-хлор-5-фтор 1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил)изоникотинамид получали следующим образом: Стадия А. Дегазированный раствор 2-хлор-5-фтор-3-аминопиридина (3,5 г), трет-бутилового эфира 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (8,89 г)(получали так, как это описано в WO 2006/003494) и бис(трифенилфосфин)палладий(II)хлорида (0,84 г) в диоксане (157 мл) обрабатывали дегазированным раствором карбоната натрия (7,6 г) в воде (72 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 1 ч, охлаждали до температуры окружающей среды и растворитель выпаривали в вакууме. Остаток разбавляли этилацетатом, промывали водой и рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография на силикагеле (элюент: циклогексан/этилацетат 8:2) давала трет-бутиловый эфир 3-амино-5 фтор-3',6'-дигидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (4,6 г) в виде твердого вещества. МСH ЯМР (400 МГц, CDCl3) 1,48 (s, 9H), 2,53 (m, 2H), 3,64 (t, 2H), 3,99 (m, 2H), 4,08 (m, 2H), 5,99 (m,1H), 6,70 (dd, 1H), 7,85 (d, 1H). Стадия В. Соединение, полученное на стадии А (4,4 г), растворяли в этаноле (170 мл). Добавляли формиат аммония (9,4 г) и затем палладий на древесном угле (10 мас.%) (1 г). Реакционную смесь перемешивали при температуре окружающей среды в течение 90 мин, фильтровали через целит и растворитель удаляли в вакууме и получали трет-бутиловый эфир 3-амино-5-фтор-3',4',5',6'-тетрагидро-2'Н[2,4']бипиридинил-1'-карбоновой кислоты (4,3 г) в виде твердого вещества. МС (ИЭ+) 296 (MH+), 240H ЯМР (400 МГц, CDCl3) 1,45 (s, 9H), 1,77 (m, 4H), 2,69 (m, 1H), 2,81 (m, 2H), 4,23 (m, 4H), 6,67 (dd,1H), 7,85 (d, 1H). Стадия С. Раствор соединения, полученного на стадии В (3,4 г), и N-хлорсукцинимида (1,72 г) в Nметилпирролидиноне (35 мл) перемешивали при 110C в течение 1 ч. Реакционную смесь охлаждали до температуры окружающей среды, выливали в воду и несколько раз экстрагировали диэтиловым эфиром. Объединенные органические слои промывали разбавленным водным раствором хлористо-водородной кислоты и водой, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: циклогексан/этилацетат 8:2) давала трет-бутиловый эфир 3-амино-5-фтор-6-хлор 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (2,9 г) в виде твердого вещества. МСH ЯМР (400 МГц, CDCl3) 1,47 (s, 9H), 1,77 (m, 4H), 2,64 (m, 1H), 2,81 (m, 2H), 3,78 (m, 2H), 4,25 (m,2H), 6,76 (d, 1H). Стадия D. Раствор соединения, полученного на стадии С (2 г), в дихлорметане (100 мл) обрабатывали гидрокарбонатом натрия (5 г) и затем 2-хлоризоникотиноилхлоридом. 2-Хлоризоникотиноилхлорид получали из 2-хлоризоникотиновой кислоты (1,24 г) и оксалилхлорида (0,72 мл) в дихлорметане (100 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч, выливали в насыщенный водный раствор гидрокарбоната натрия, экстрагировали дихлорметаном, промывали водой,сушили над сульфатом натрия и затем концентрировали в вакууме и получали трет-бутиловый эфир 6 хлор-3-[(2-хлорпиридин-4-карбонил)амино]-5-фтор-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (2,2 г). МС (ИЭ+) 369/371 (MH+-BOC). Стадия Е. Раствор соединения, полученного на стадии D (366 мг), в дихлорметане (10 мл) обрабатывали трифторуксусной кислотой (0,6 мл) при температуре окружающей среды в течение 1 ч 30 мин. Выпаривание растворителя и осаждение из диэтилового эфира давали 2-хлор-N-(6-хлор-5-фтор 1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил)изоникотинамидтрифторацетат. Пример 5. Этот пример иллюстрирует получение 2-хлор-N-[5,6-дихлор-1'-(4'-фторбифенил-4-илметил)1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение С 2 в табл. С). Искомое соединение получали из 2-хлор-N-(5,6-дихлор-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил 3-ил)изоникотинамида по методикам, аналогичным описанным в примере 4, используя в качестве исходного вещества 2,5-дихлор-3-аминопиридин вместо 2-хлор-5-фтор-3-аминопиридина. Вместо стадии В использовали приведенную ниже методику. Стадия В'. Промежуточный тетрагидропиридин, полученный на стадии А (3 г), гидрировали в метаноле (350 мл) в присутствии 1,1'-бис(диизопропилфосфино)ферроцен(1,5-циклооктадиен)родий(I)тетрафторбората (46 мг) при 80C и давлении водорода, равном 100 бар, в течение 21 ч и получали третбутиловый эфир 3-амино-5-фтор-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты. Альтернативно, последний промежуточный продукт можно получить так, как это описано в WO 2006/003494, по реакции сочетания Негиши 2,5-дихлор-3-аминопиридина и трет-бутилового эфира 4 йодпиперидин-1-карбоновой кислоты. Пример 6. Этот пример иллюстрирует получение N-[6-бром-5-фтор-1'-(4'-фторбифенил-4-илметил)1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]-2-хлоризоникотинамида (соединение С 5 в табл. С). Искомое соединение получали по методикам, аналогичным описанным в примере 4, путем замены на стадии С N-хлорсукцинимида на N-бромсукцинимид. Пример 7. Этот пример иллюстрирует получение 2-хлор-N-[6-хлор-1'-(4'-фторбифенил-4-илметил)-5-метил 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение С 16 в табл. С). Искомое соединение получали по методикам, аналогичным описанным в примере 4, используя в качестве исходного вещества 3-амино-2-хлор-5-трифторметилпиридин (получали так, как это описано вEP 178260, EP 272824) вместо 2-хлор-5-фтор-3-аминопиридина. Альтернативно, последний промежуточный продукт можно получить непосредственно по реакции сочетания Судзуки 3-амино-2,6-дихлор-5-трифторметилпиридина и трет-бутилового эфира 4-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (получали так,как это описано в WO 2006/003494) с использованием условий, описанных в примере 3, с последующим гомогенным каталитическим гидрированием так, как это описано в примере 5 (стадия В'). Получение 3-амино-2,6-дихлор-5-трифторметилпиридина из 3-амино-2-хлор-5-трифторметилпиридина проводили следующим образом. Раствор 3-амино-2-хлор-5-трифторметилпиридина (5 г) (получали так, как это описано в EP 178260,EP 272824) и N-хлорсукцинимида (3,7 г) в ацетонитриле (125 мл) перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь выливали в воду, экстрагировали этилацетатом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 3:1) давала 3-амино-2,6-дихлор-5-трифторметилпиридин (3,5 г): МС (ИЭ+) 231/233/235H ЯМР (400 МГц, CDCl3) 4,34 (s, 2H), 7,35 (s, 1H). Пример 8. Этот пример иллюстрирует получение 2-хлор-N-[6-бром-1'-(4'-фторбифенил-4-илметил)-5-метил- 19017523 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C15 в табл. С). Искомое соединение получали по методикам, аналогичным описанным в примере 7, путем заменыN-хлорсукцинимида на N-бромсукцинимид. Пример 9. Этот пример иллюстрирует получение 2-хлор-N-4,5,6-трихлор-1'-(4'-фторбифенил-4-илметил)1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-илизоникотинамида (соединение C30 в табл. С). Искомое соединение получали по методикам, аналогичным описанным в примере 5, с использованием 2 экв. N-хлорсукцинимида на стадии хлорирования (стадия С). Пример 10. Этот пример иллюстрирует получение 2-хлор-N-1'-(4'-фторбифенил-4-илметил)-4-фтор-6 трифторметил-1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-илизоникотинамида (соединение С 41 в табл. С). Стадия А. Раствор соединения, полученного на стадии В примера 3 (10,35 г), и N-хлорсукцинимида(4,4 г) в N-метилпирролидиноне (150 мл) перемешивали при температуре окружающей среды в течение 2,5 ч. Реакционную смесь выливали в воду и несколько раз экстрагировали этилацетатом. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 1:1) давала трет-бутиловый эфир 3 амино-4-хлор-6-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (9,6 г) в виде вспененного вещества. МС (ИЭ+) 380/382 (MH+), 324/326 (М-изопрен); 1(s, 1H). Стадия В. Раствор соединения, полученного на стадии А (7,6 г), и трифторуксусной кислоты (61,7 мл) в дихлорметане (380 мл) нагревали до 55C. При этой же температуре в течение 30 мин медленно добавляли водный раствор пероксида водорода (30 мас.%) (23 мл). Реакционную смесь выдерживали при этой же температуре в течение еще 2 ч. Реакционную смесь выливали в воду и несколько раз экстрагировали дихлорметаном. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Остаток повторно растворяли в дихлорметане (200 мл). Затем добавляли ди-трет-бутилдикарбонат (5,4 г) и N,N-диизопропилэтиламин (14,2 мл) и реакционную смесь перемешивали в течение 16 ч. Реакцию останавливали водой и смесь экстрагировали дихлорметаном. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 5:1) давала третбутиловый эфир 4-хлор-3-нитро-6-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'карбоновой кислоты (4,9 г) в виде вспененного вещества. МС (ИЭ+) 410/412 (MH+), 354/356 (Мизопрен); 1H ЯМР (400 МГц, CDCl3) 1,48 (s, 9H), 1,77 (m, 2H), 1,95 (m, 2H), 2,85 (m, 3H), 4,26 (m, 2H), 7,74 (s,1H). Стадия С. Раствор соединения, полученного на стадии В (1,2 г), и высушенного распылением фторида калия (339 мг) в диметилсульфоксиде (57 мл) перемешивали при 80C в течение 1 ч. Реакционную смесь выливали в воду и несколько раз экстрагировали этилацетатом. Объединенные органические слои- 20017523 промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 5:1) давала трет-бутиловый эфир 4-фтор-3-нитро-6 трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (0,7 г) в виде вспененного вещества. МС (ИЭ+) 338/339 (М-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,48 (s, 9H), 1,79 (m, 2H), 1,94 (m, 2H), 2,79 (m, 2H), 2,99 (m, 1H), 4,26 (m,2H), 7,51 (d, 1H). Стадия D. Соединение, полученное на стадии С (1,8 г), растворяли в этаноле (48 мл) и после дегазирования добавляли палладий на древесном угле (10 мас.%) (500 мг). Реакционную смесь перемешивали в атмосфере водорода при температуре окружающей среды в течение 1 дня. Фильтрование через целит давало трет-бутиловый эфир 3-амино-4-фтор-6-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (1,6 г) в виде белого твердого вещества. МС (ИЭ+) 364/365 (MH+), 308/309(d, 1H). Затем соединение, полученное на стадии D, обрабатывали по методикам, описанным в примере 3(стадия С и стадия D), и получали искомое соединение. Пример 11. Этот пример иллюстрирует получение 2-хлор-N-1'-(4'-фторбифенил-4-илметил)-6-фтор-5 трифторметил-1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-илизоникотинамида (соединение C31 в табл. С). Стадия А. К раствору промежуточного трет-бутилового эфира 3-амино-6-хлор-5-трифторметил 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (4 г), полученного так, как это описано в примере 8, по реакции сочетания Судзуки с последующим каталитическим гидрированием, в дихлорметане (200 мл), добавляли трифторуксусную кислоту (32 мл). Раствор нагревали до 55C и при этой же температуре в течение 30 мин медленно добавляли водный раствор пероксида водорода (30 мас.%)(10,5 мл). Реакционную смесь выдерживали при этой же температуре в течение еще 90 мин, затем выливали в воду и несколько раз экстрагировали дихлорметаном. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Остаток повторно растворяли в дихлорметане (110 мл). Затем добавляли ди-трет-бутилдикарбонат (3,5 г) и N,Nдиизопропилэтиламин (7,6 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали водой и смесь экстрагировали дихлорметаном. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 10:1) давала трет-бутиловый эфир 6 хлор-3-нитро-5-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (3 г) в виде вспененного вещества. МС (ИЭ+) 410/412 (MH+), 354/356 (М-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,49 (s, 9H), 1,89 (m, 4H), 2,84 (m, 2H), 3,50 (m, 1H), 4,29 (m, 2H), 8,48 (s,1H). Стадия В. Раствор соединения, полученного на стадии А (2,5 г), и высушенного распылением фторида калия (710 мг) в диметилсульфоксиде (120 мл) перемешивали при 80C в течение 40 мин. Реакционную смесь выливали в смесь воды со льдом и несколько раз экстрагировали этилацетатом. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 5:1) давала трет-бутиловый эфир 6 фтор-3-нитро-5-трифторметил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (1,13 г) в виде вспененного вещества. МС (ИЭ+) 338/339 (М-изопрен); 1H ЯМР (400 МГц, CDCl3) 1,48 (s, 9H), 1,90 (m, 4H), 2,84 (m, 2H), 3,53 (m, 1H), 4,29 (m, 2H), 8,57 (d,1H). Затем соединение, полученное на стадии В, обрабатывали по методикам, описанным в примере 3(стадия В, стадия С и стадия D), и получали искомое соединение. Пример 12. Этот пример иллюстрирует получение 2-хлор-N-1'-(4'-фторбифенил-4-илметил)-5,6-дифтор 1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-илизоникотинамида (соединение С 25 в табл. С). Стадия А. К раствору соединения, полученного на стадии С примера 4 (5 г), и трифторуксусной кислоты (46,5 мл) в хлороформе (324 мл) при 50C по каплям добавляли водный раствор пероксида водорода (30 мас.%) (15,7 мл). Реакционную смесь перемешивали при 55C в течение 1 ч, охлаждали до температуры окружающей среды и разбавляли дихлорметаном. Раствор промывали водой и рассолом, сушили над сульфатом натрия и концентрировали в вакууме и получали промежуточный продукт, 6-хлор-5 фтор-3-нитро-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил (4 г), в виде масла. МС (ИЭ+) 260 (MH+). Промежуточный продукт обрабатывали ди-трет-бутилдикарбонатом (4 г) и триэтиламином (6,3 мл) в дихлорметане (250 мл) в течение 12 ч и после обработки водой получали трет-бутиловый эфир 6-хлор-5 фтор-3-нитро-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (4,3 г) в виде красного масла. МС (ИЭ+) 360 (MH+), 345 (М-изопрен + CH3CN), 305 (М-изопрен), 260 (MH+-BOC). Стадия В. Продукт, полученный на стадии А (3,3 г), высушенный распылением фторид калия (1,06 г) и тетрафенилфосфонийбромид (7,6 г) растворяли в ацетонитриле (23 мл) и реакционную смесь кипятили с обратным холодильником в течение 8 ч. Реакционную смесь охлаждали до температуры окружающей среды, белое твердое вещество удаляли фильтрованием и фильтрат концентрировали в вакууме. Хроматография на силикагеле (элюент: циклогексан/этилацетат 9:1) давала трет-бутиловый эфир 5,6 дифтор-3-нитро-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (0,85 г): МС (ИЭ+) 329 (М-изопрен+CH3CN), 288 (М-изопрен), 244 (MH+-ВОС); 1H ЯМР (400 МГц, CDCl3) 1,45 (s, 9H), 1,80 (m, 4H), 2,79 (m, 1H), 3,43 (m, 2H), 4,22 (m, 2H), 8,13 (t,1H). Стадия С. Продукт, полученный на стадии В (694 мг), гидрировали в метаноле при температуре окружающей среды и получали трет-бутиловый эфир 3-амино-5,6-дифтор-3',4',5',6'-тетрагидро-2'Н[2,4']бипиридинил-1'-карбоновой кислоты (390 мг) в виде желтого масла: МС (ИЭ+) 314 (MH+), 258 (Мизопрен); 1H ЯМР (400 МГц, CDCl3) 1,45 (s, 9H), 1,75 (m, 4H), 2,70 (m, 1H), 2,80 (m, 2H), 3,90 (m, 2H), 4,23 (m,2H), 6,90 (t, 1H). Продукт, полученный на стадии С (313 мг), превращали в искомый продукт по методикам, аналогичным описанным в примере 4 (стадия D и стадия E). Пример 13. Этот пример иллюстрирует получение 2-хлор-N-1'-(4'-фторбифенил-4-илметил)-6-дифторметил 1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-илизоникотинамида (соединение C6 в табл. С). Стадия А. 6-(Хлордифторметил)-никотинонитрил (35,4 г, получали так, как это описано в публикации Tetrahedron Letters, 39 (43), 1998, 7965) суспендировали в концентрированной хлористо-водородной кислоте (245 мл) и перемешивали при 110C в течение 16 ч. Реакционную смесь охлаждали до температуры окружающей среды и добавляли смесь воды со льдом. Белое твердое вещество отделяли фильтрованием и сушили в высоком вакууме и получали 6-(хлордифторметил)никотиновую кислоту (36 г); 1H ЯМР (400 МГц, ДМСО-d6) 3,30 (br s, 1H), 8,00 (dd, 1H), 8,51 (dd, 1H), 9,17 (d, 1H). Стадия В. В атмосфере азота готовили раствор трет-бутанола (100 мл), порошкообразных молекулярных сит (4 ) (23 г) и триэтиламина (9,36 мл). После перемешивания при температуре окружающей среды в течение 5 мин добавляли соединение, полученное на стадии А (10 г), затем дифенилфосфорилазид (16,3 г). Реакционную смесь кипятили с обратным холодильником в течение 3 ч и затем фильтровали через целит. Реакционную смесь выливали в воду и несколько раз экстрагировали диэтиловым эфиром. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 5:1) давала третбутиловый эфир [6-(хлордифторметил)пиридин-3-ил]карбаминовой кислоты (10,6 г). МС (ИЭ+) 279/281- 22017523 Стадия С. Соединение, полученное на стадии В (5,57 г), растворяли в этаноле (110 мл) и после дегазирования добавляли палладий на древесном угле (10 мас.%) (1 г). Реакционную смесь перемешивали в атмосфере водорода при температуре окружающей среды в течение 5 ч. Фильтрование через целит давало трет-бутиловый эфир (6-дифторметилпиридин-3-ил)карбаминовой кислоты (4,8 г) в виде вспененного вещества. МС (ИЭ+) 245/246 (MH+); 1H ЯМР (400 МГц, CDCl3) 1,54 (s, 9H), 7,15 (t, 1H), 7,91 (m, 1H), 9,03 (m, 1H), 9,33 (m, 2H). Стадия D. Раствор соединения, полученного на стадии С (5,9 г), в дихлорметане (80 мл) обрабатывали трифторуксусной кислотой (3,7 мл) при температуре окружающей среды в течение 12 ч. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и несколько раз промывали дихлорметаном. Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 1:1) давала 6-дифторметилпиридин-3-иламин (2,1 г); 1H ЯМР (400 МГц, CDCl3) 3,98 (br s, 2H), 6,56 (t, 1H), 7,03 (dd, 1H), 7,40 (d, 1H), 8,06 (d, 1H). Стадия E. Раствор соединения, полученного на стадии D (2,1 г), и N-бромсукцинимида (2,56 г) в ацетонитриле (50 мл) перемешивали при 0C в течение 10 мин. Реакционную смесь выливали в воду и несколько раз экстрагировали этилацетатом. Объединенные органические слои промывали рассолом,сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 1:1) давала 2-бром-6-дифторметилпиридин-3-иламин (2,5 г) в виде твердого вещества. МС (ИЭ+) 223/225 (MH+); 1H ЯМР (400 МГц, CDCl3) 4,38 (br s, 2H), 6,52 (t, 1H), 7,08 (d, 1H), 7,41 (d, 1H). Затем соединение, полученное на стадии Е, обрабатывали по методикам, описанным в примере 4(стадия А, стадия В, стадия С и стадия D), и получали искомое соединение. Пример 14. Этот пример иллюстрирует получение 2-хлор-N-1'-(4'-фторбифенил-4-илметил)-6-дифторметокси 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-илизоникотинамида (соединение С 40 в табл. С). Искомое соединение получали из 2-бром-6-дифторметоксипиридин-3-иламина по методикам, описанным в примере 4. 2-Бром-6-дифторметоксипиридин-3-иламин получали следующим образом. Стадия А. 2-Гидрокси-5-нитропиридин (5 г) обрабатывали хлордифторацетатом натрия (11,5 г) в кипящем ацетонитриле (186 мл) в течение 2 дней. Растворитель выпаривали, остаток выливали в этилацетат, промывали рассолом, сушили над сульфатом натрия и затем концентрировали в вакууме. Хроматография на силикагеле (элюент: гексан/этилацетат 1:1) давала 2-дифторметокси-5-нитропиридин (1 г,15%) и 1-дифторметил-5-нитро-1H-пиридин-2-он (90 мг, 1,5%). 2-Дифторметокси-5-нитропиридин. МСH ЯМР (400 МГц, CDCl3) 7,05 (d, 1H), 7,51 (t, 1H), 8,53 (dd, 1H), 9,09 (d, 1H). 1-Дифторметил-5-нитро-1 Н-пиридин-2-он. МС (ИЭ+) 191 (MH+); 6,65 (d, 1H), 7,63 (t, 1H), 8,14 (dd,1H), 8,73 (d, 1H). Стадия В. 2-Дифторметокси-5-нитропиридин, полученный на стадии А (1,6 г), обрабатывали железом (5 г) и концентрированной хлористо-водородной кислотой (0,23 мл) в этаноле (15 мл) и воде (2,5 мл) при 80C в течение 20 мин. Фильтрование через целит и выпаривание растворителя давало 6 дифторметоксипиридин-3-иламин (1,4 г) в виде оранжевого твердого вещества. 1H ЯМР (400 МГц, CDCl3) 3,51 (br s, 2H), 6,89 (d, 1H), 7,23 (d, 1H), 7,44 (dd, 1H), 7,80 (d, 1H). Стадия С. 6-Дифторметоксипиридин-3-иламин, полученный на стадии В (1,36 г), обрабатывали Nбромсукцинимидом (1,51 г) в ацетонитриле в течение 10 мин. Раствор выливали в воду, экстрагировали этилацетатом, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Хроматография на силикагеле (элюент: циклогексан/этилацетат 7:3) давала 2-бром-6-дифторметоксипиридин-3 иламин в виде красного масла. 1H ЯМР (400 МГц, CDCl3) 3,95 (br s, 2H), 6,72 (d, 1H), 7,07 (d, 1H), 7,24 (dd, 1H). Пример 15. Этот пример иллюстрирует получение 2-хлор-N-[5-хлор-1'-(4'-фторбифенил-4-илметил)-6-(2,2,2 трифторэтокси)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил]изоникотинамида (соединение C9 в табл. С). Искомое соединение получали из 2-бром-5-хлор-6-трифторэтоксипиридин-3-иламина по методикам, описанным в примере 5 (без проведения стадии С). 2-Бром-5-хлор-6-трифторэтоксипиридин-3 иламин получали следующим образом. Стадия А. Раствор 2,3-дихлор-5-нитропиридина (5 г, Synthesis, 1990 (6), 499-501), 2,2,2 трифторэтанола (2,6 г) и карбоната калия (5,4 г) в N,N-диметилформамиде (50 мл) перемешивали при 80C в течение 1 ч. Реакционную смесь выливали в воду со льдом. Осадок отделяли фильтрованием и сушили в высоком вакууме и получали 3-хлор-5-нитро-2-(2,2,2-трифторэтокси)пиридин (5,65 г). Стадия В. 3-Хлор-5-нитро-2-(2,2,2-трифторэтокси)пиридин (5,39 г), полученный на стадии А, восстанавливали с использованием железа (13,6 г) и концентрированной хлористо-водородной кислоты(0,73 мл) в этаноле (6,5 мл) и воде (1 мл) при 80C в течение 1 ч. Фильтрование через целит и выпаривание растворителя с последующей хроматографией на силикагеле (элюент: циклогексан/этилацетат 9:1) давали 3-хлор-5-амино-2-(2,2,2-трифторэтокси)пиридин (3,1 г). Стадия С. 3-Хлор-5-амино-2-(2,2,2-трифторэтокси)пиридин (3,05 г), полученный на стадии В, бромировали N-бромсукцинимидом (2,4 г) в ацетонитриле (68 мл), так как это описано в примере 14, стадия С, и получали 2-бром-5-хлор-6-трифторэтоксипиридин-3-иламин (4,12 г) в виде красного масла. МСH ЯМР (400 МГц, CDCl3) 3,80 (br s, 2H), 4,65 (q, 2H), 7,10 (s, 1H). Пример 16. Этот пример иллюстрирует получение 2-хлор-N-[1'-(4'-фторбифенил-4-илметил)-6-метокси 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C10 в табл. С). Искомое соединение получали из 2-хлор-6-метоксипиридин-3-иламина по методикам, описанным в примере 3. Пример 17. Этот пример иллюстрирует получение 2-хлор-N-[1'-(4'-фторбифенил-4-илметил)-6-винил 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C11 в табл. С). Искомое соединение получали из трет-бутилового эфира 3-амино-6-винил-3',4',5',6'-тетрагидро-2'Н[2,4']бипиридинил-1'-карбоновой кислоты по методикам, описанным в примере 3, стадии C-E. Третбутиловый эфир 3-амино-6-винил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты получали следующим образом. Раствор трет-бутилового эфира 3-амино-6-бром-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'карбоновой кислоты (0,49 г, получали из 3-амино-2-бромпиридина по методикам, описанным в примере 6, стадии A-C), трибутилвинилолова (0,36 г) и тетракис(трифенилфосфин)палладия (0,035 г) в толуоле(20 мл) кипятили с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до температуры окружающей среды и растворитель удаляли в вакууме. Остаток очищали с помощью хроматографии на силикагеле (элюент: циклогексан/этилацетат 1:1) и получали трет-бутиловый эфир 3-амино-6 винил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (0,32 г) в виде желтого твердого вещества. МС (ИЭ+) 443/445 (MH+); 1- 24017523 Пример 18. Этот пример иллюстрирует получение 2-хлор-N-[5-хлор-6-циклопропил-1'-(4'-фторбифенил-4 илметил)-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил-3-ил]изоникотинамида (соединение C13 в табл. С). Искомое соединение получали из трет-бутилового эфира 3-амино-5-хлор-6-циклопропил-3',4',5',6'тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты по методикам, описанным в примере 3, стадии С-Е. трет-Бутиловый эфир 3-амино-5-хлор-6-циклопропил-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'карбоновой кислоты получали следующим образом. Раствор трет-бутилового эфира 3-амино-5-хлор-6-бром-3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил 1'-карбоновой кислоты (0,59 г, получали по методикам, описанным в примере 5, с использованием Nбромсукцинимида вместо N-хлорсукцинимида на стадии С), циклопропилбороновой кислоты (0,086 г),тетракис(трифенилфосфин)палладия (0,094 г) и карбоната калия (0,14 г) в 1,2-диметоксиэтане (5 мл) и воде (0,2 мл) облучали в микроволновой печи при 150C в течение 20 мин. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли этилацетатом, промывали насыщенным водным раствором гидрокарбоната натрия, водой и затем рассолом. Органический слой сушили над сульфатом натрия и растворитель удаляли в вакууме. Остаток очищали с помощью хроматографии на силикагеле(элюент: дихлорметан/этилацетат 9:1) и получали трет-бутиловый эфир 3-амино-5-хлор-6-циклопропил 3',4',5',6'-тетрагидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (0,30 г) в виде желтого твердого вещества. МС (ИЭ+) 491/493 (MH+); 1(m, 1H), 2,80 (m, 2H), 4,20 (m, 2H), 7,65 (d, 1H), 7,75 (s, 1H), 7,80 (s, 1H), 7,9 (m, 1H), 8,60 (d, 1H). Пример 19. Этот пример иллюстрирует получение N-[5-бром-1'-(4'-фторбифенил-4-илметил)-1',2',3',4',5',6'гексагидро[2,4']бипиридинил-3-ил]-2-хлоризоникотинамида (соединение C23 в табл. С). Искомое соединение получали из 2,5-дибром-3-аминопиридина по методикам, описанным в примере 5, не проводя стадию С. Пример 20. Этот пример иллюстрирует получение N-[5-бром-6-хлор-1'-(4'-фторбифенил-4-илметил)1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]-2-хлоризоникотинамида (соединение C24 в табл. С). Искомое соединение получали из 2,5-дибром-3-аминопиридина по методикам, описанным в примере 5. Пример 21. Этот пример иллюстрирует получение 2-хлор-N-[6-хлор-1'-(4'-фторбифенил-4-илметил)-5-метил 1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение C26 в табл. С). Искомое соединение получали из 2-бром-5-метил-3-аминопиридина по методикам, описанным в примере 4. Приведенные ниже соединения получали по методикам, аналогичным описанным в примерах 3-21. Соединения формулы (Ic) Пример 22. Этот пример иллюстрирует получение 2-хлор-N-[1'-(4'-фторбифенил-4-илметил)-1'-окси-6 трифторметил-1',2',3',4',5',6'-гексагидро[2,4']бипиридинил-3-ил]изоникотинамида (соединение D1 в табл. D).[2,4']бипиридинил-3-ил]изоникотинамида (2,4 г) (пример 3) в метаноле (10 мл) при температуре окружающей среды добавляли водный раствор пероксида водорода (30 мас.%) (2,9 г). Реакционную смесь перемешивали при 55C в течение 16 ч. Раствор концентрировали до объема, равного 1/3 исходного, и осадок отделяли фильтрованием и сушили в высоком вакууме и получали искомое соединение в виде белого порошкообразного вещества (1,5 г). Т. пл. 158-161C; МС (ИЭ+) 585/587 (MH+); 1H ЯМР (400 МГц, CDCl3) 1,83 (m, 2H), 2,71 (m, 2H), 3,27-3,46 (m, 5H), 4,48 (s, 2H), 7,15 (m, 2H),7,45-7,60 (m, 8H), 7,91 (dd, 1H), 8,02 (d, 1H), 8,05 (bs, 1H), 8,54 (d, 1H). Приведенные ниже соединения получали по методикам, аналогичным описанной в примере 22. Соединения формулы (Id) Пример 23. Этот пример иллюстрирует получение 2-хлор-N-3,4,5-трифтор-2-[1-(4'-фторбифенил-4 илметил)пиперидин-4-ил]фенилизоникотинамида (соединение E1 в табл. E).
МПК / Метки
МПК: C07D 401/12, A01N 43/40, C07D 401/14
Метки: фенил, пиридилпиперидины, инсектицидные
Код ссылки
<a href="https://eas.patents.su/30-17523-insekticidnye-fenil-ili-piridilpiperidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Инсектицидные фенил- или пиридилпиперидины</a>
Предыдущий патент: Двигатель с камерой переменного объема
Следующий патент: Инсектицидные комбинации
Случайный патент: Каталитические реакторы