Бивалентные миметики smac и их применения
Номер патента: 17279
Опубликовано: 30.11.2012
Авторы: Цю Су, Сунь Хайин, Николовска-Цолеска Занета, Ван Шаомэн, Лу Цзяньфэн, Цай Цянь, Пэн Юэфэн, Цинь Дунгуан
Формула / Реферат
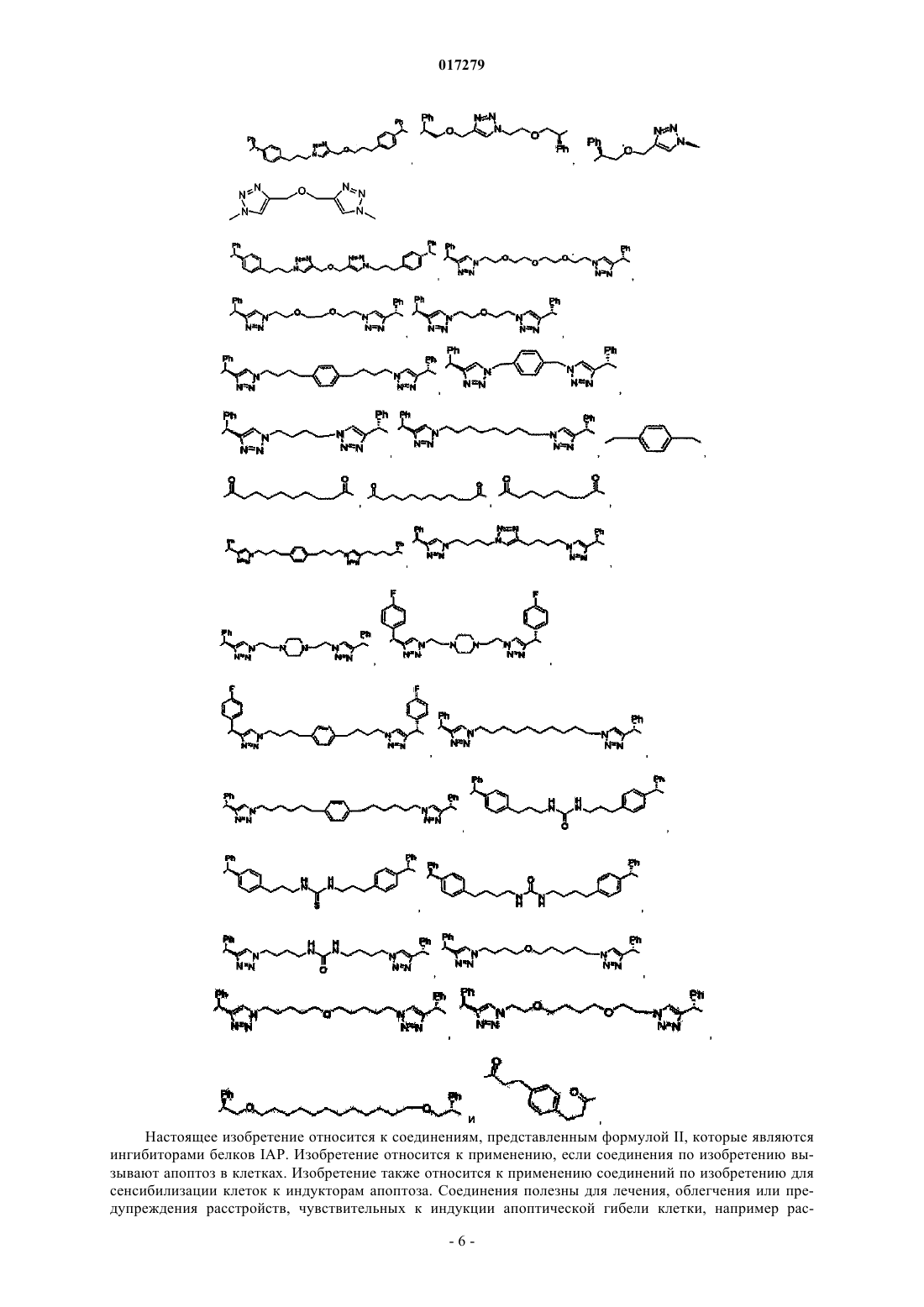
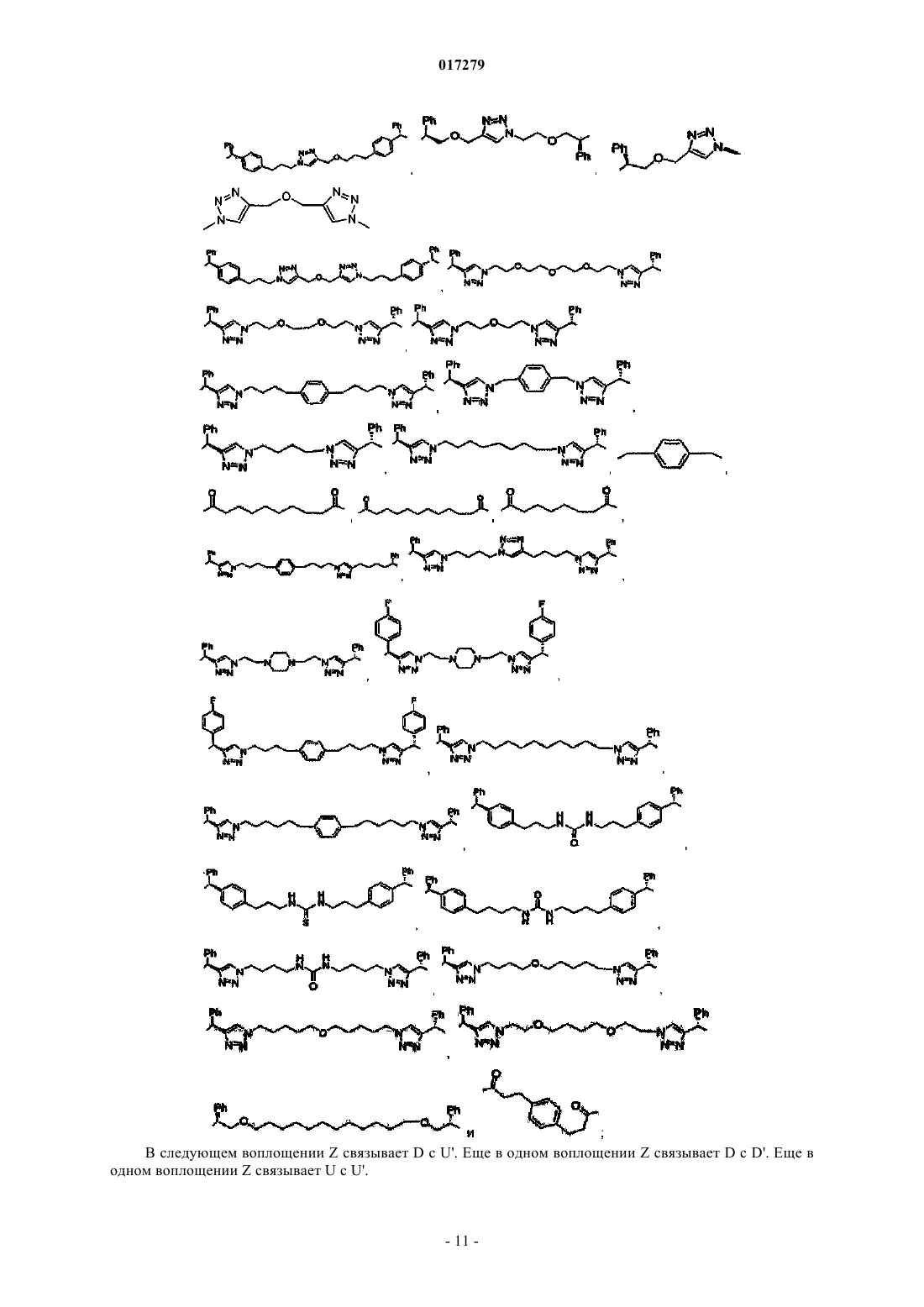
1. Соединение, имеющее формулу II
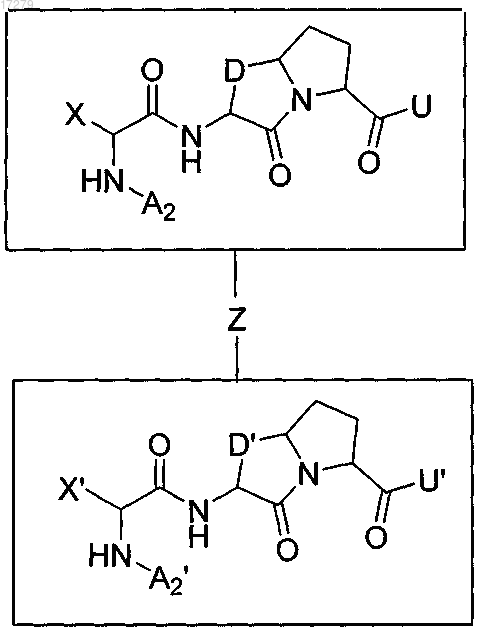
где А2 и А2' независимо выбраны из группы, состоящей из атома водорода и C1-3алкила, который является незамещенным или замещен одним из следующего: ОН или С(О)C1-3алкил;
X и X' независимо представляют собой C1-3алкил, который является незамещенным или замещен одним индолом;
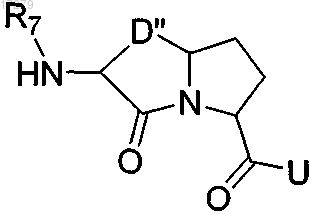
D и D' независимо выбраны из группы, состоящей из и
и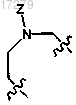 U и U' независимо выбраны из группы, состоящей из NHZ,
U и U' независимо выбраны из группы, состоящей из NHZ,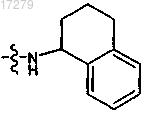 и
и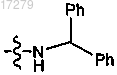
Z представляет собой линкер, ковалентно связывающий один из D и U с одним из D' и U', выбранный из группы, состоящей из
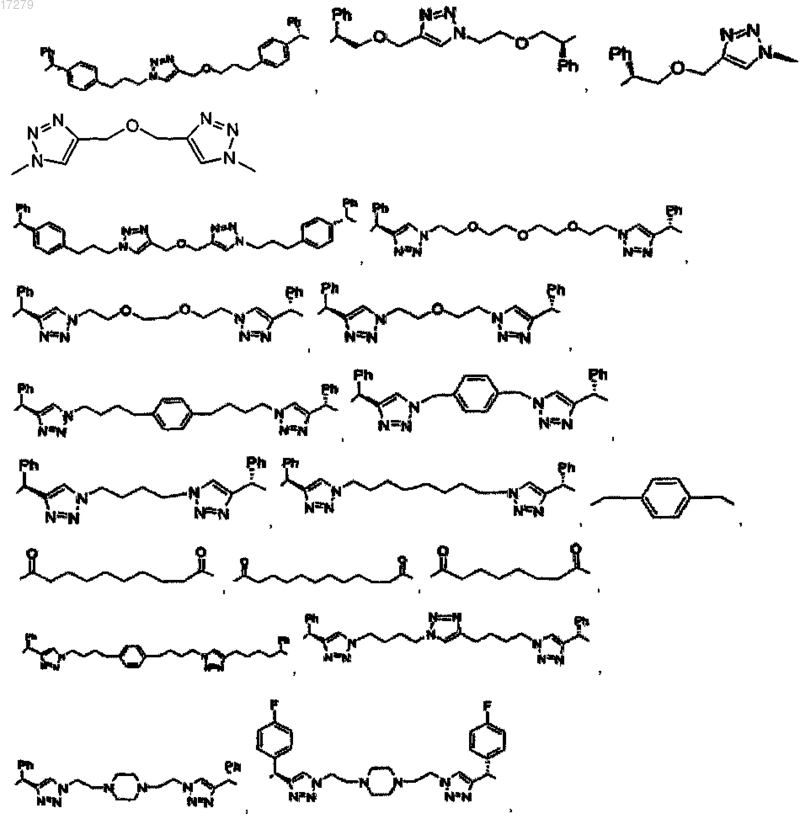
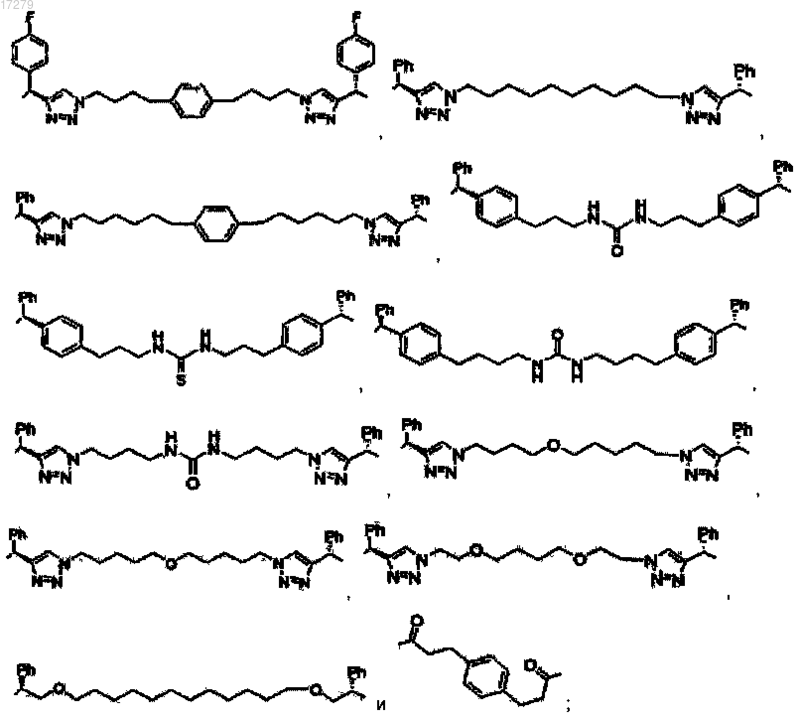
или его фармацевтически приемлемые соли.
2. Соединение по п.1, где Z связывает D с U'.
3. Соединение по п.1, где Z связывает D с D'.
4. Соединение по п.1, где Z связывает U с U'.
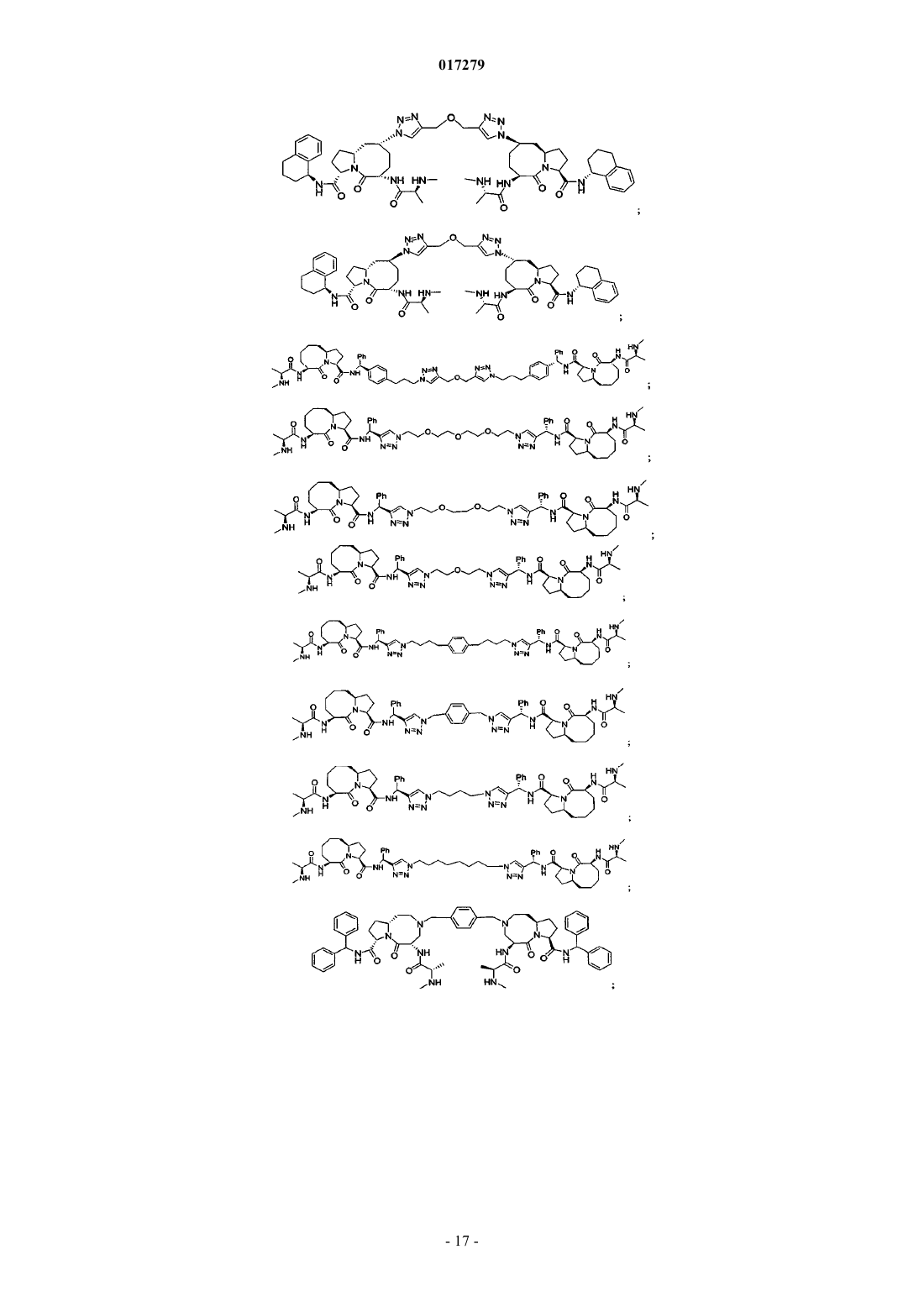
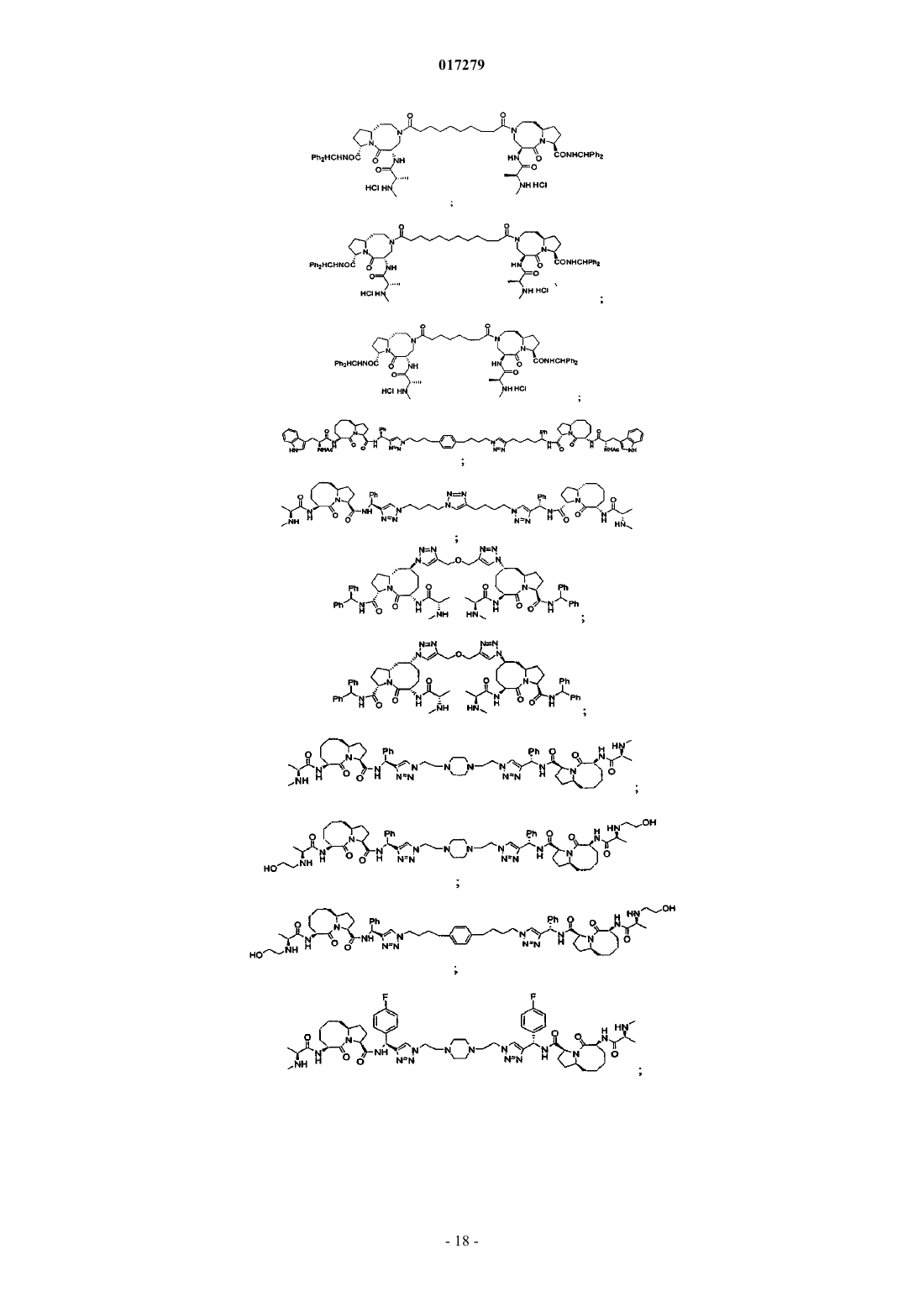
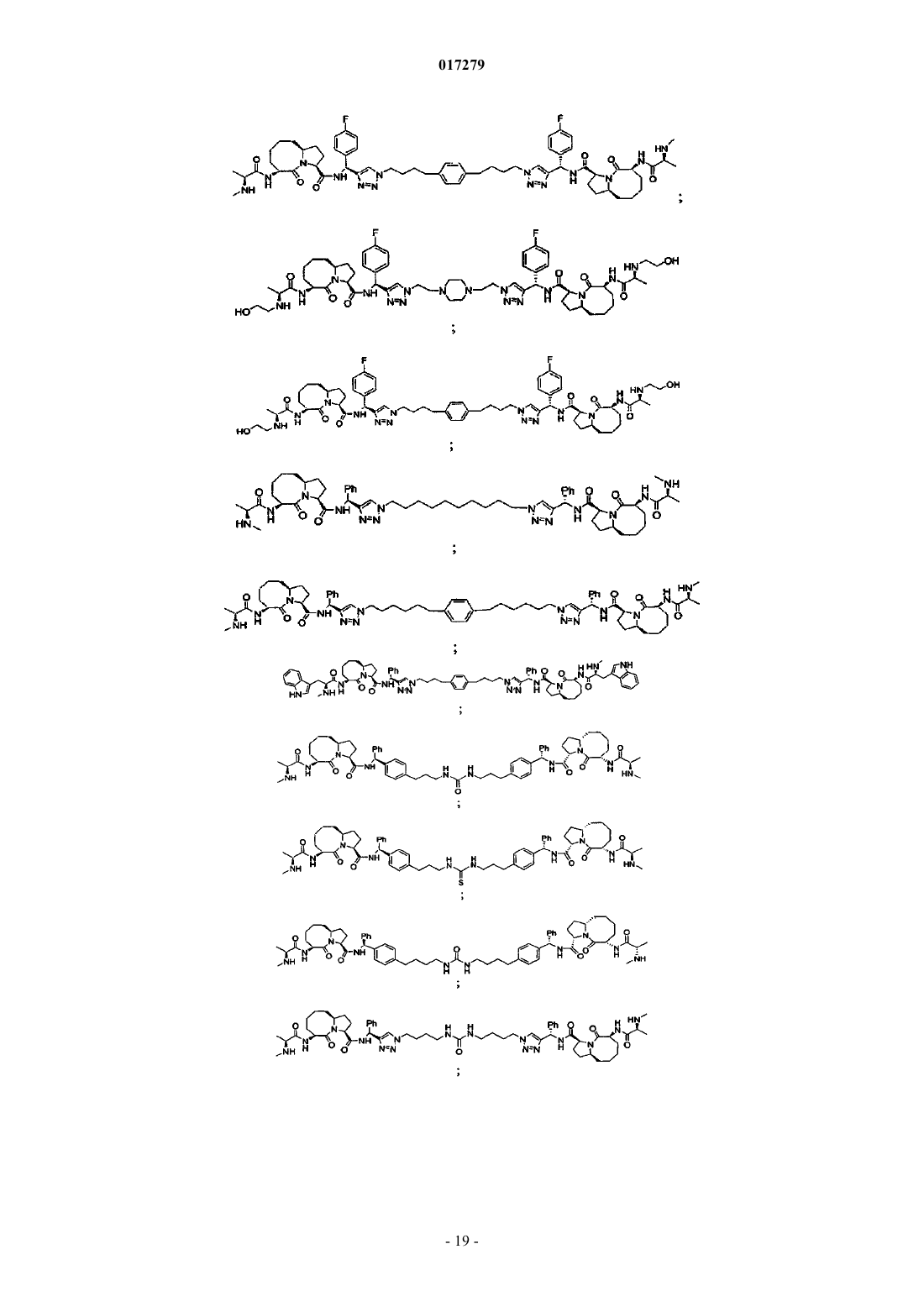
5. Соединение по п.1, выбранное из группы, состоящей из
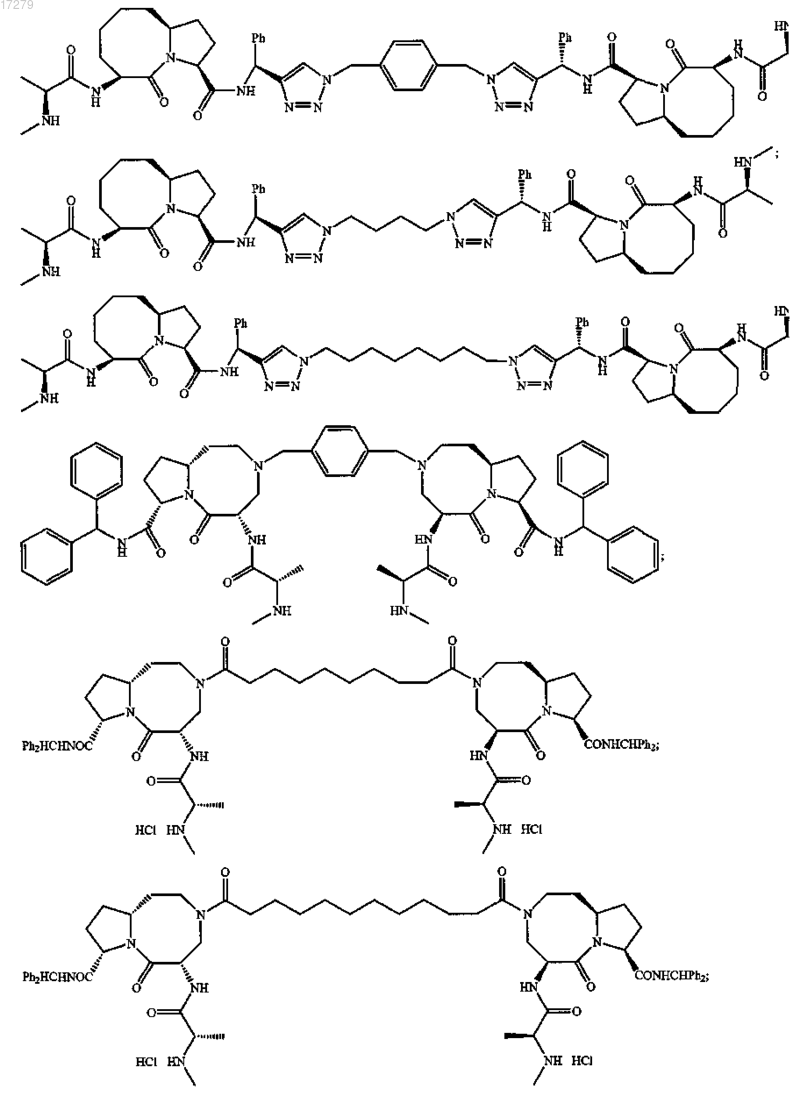
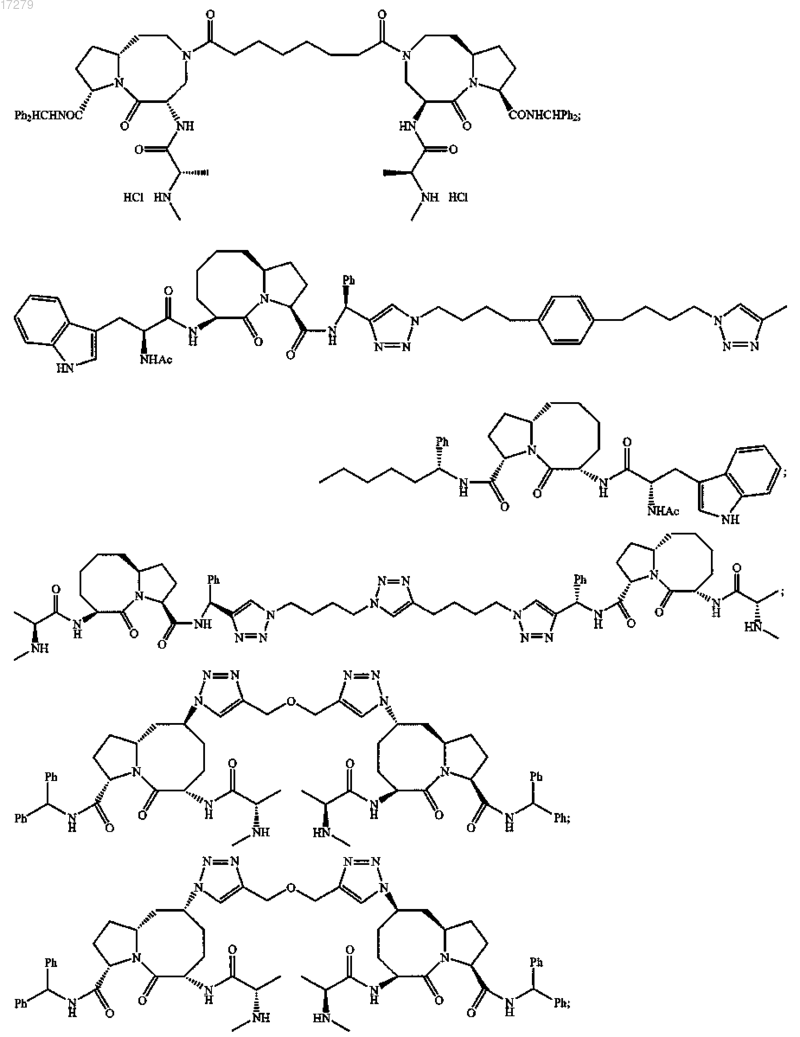
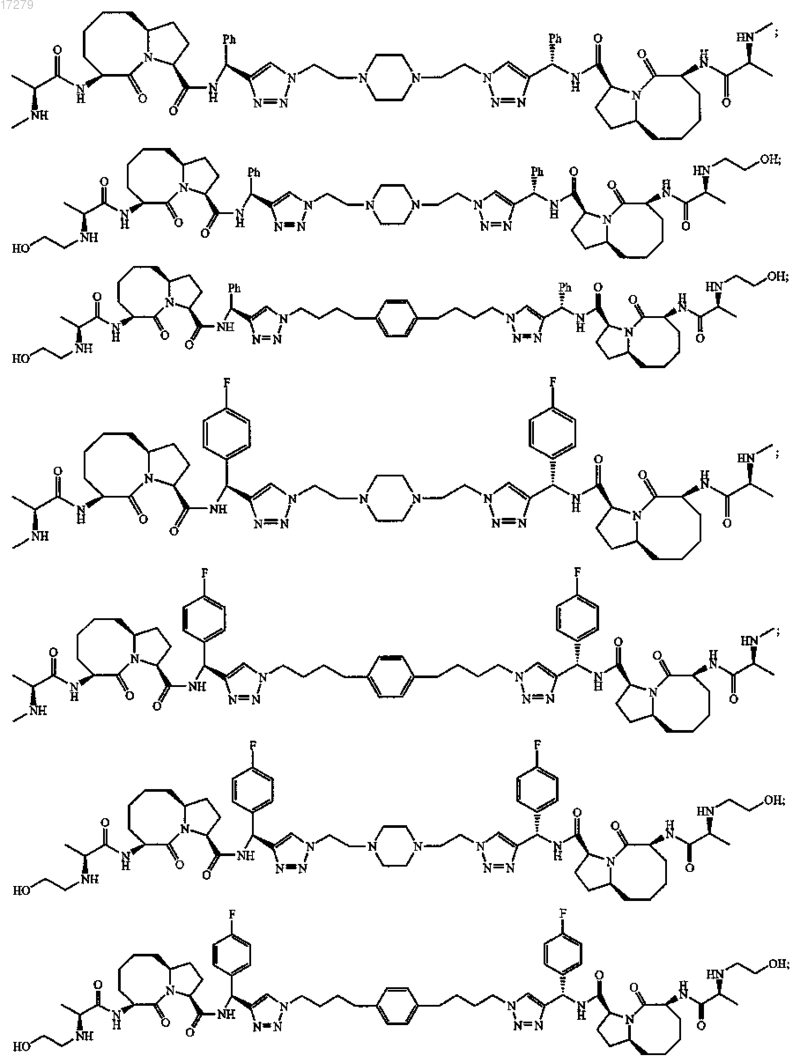
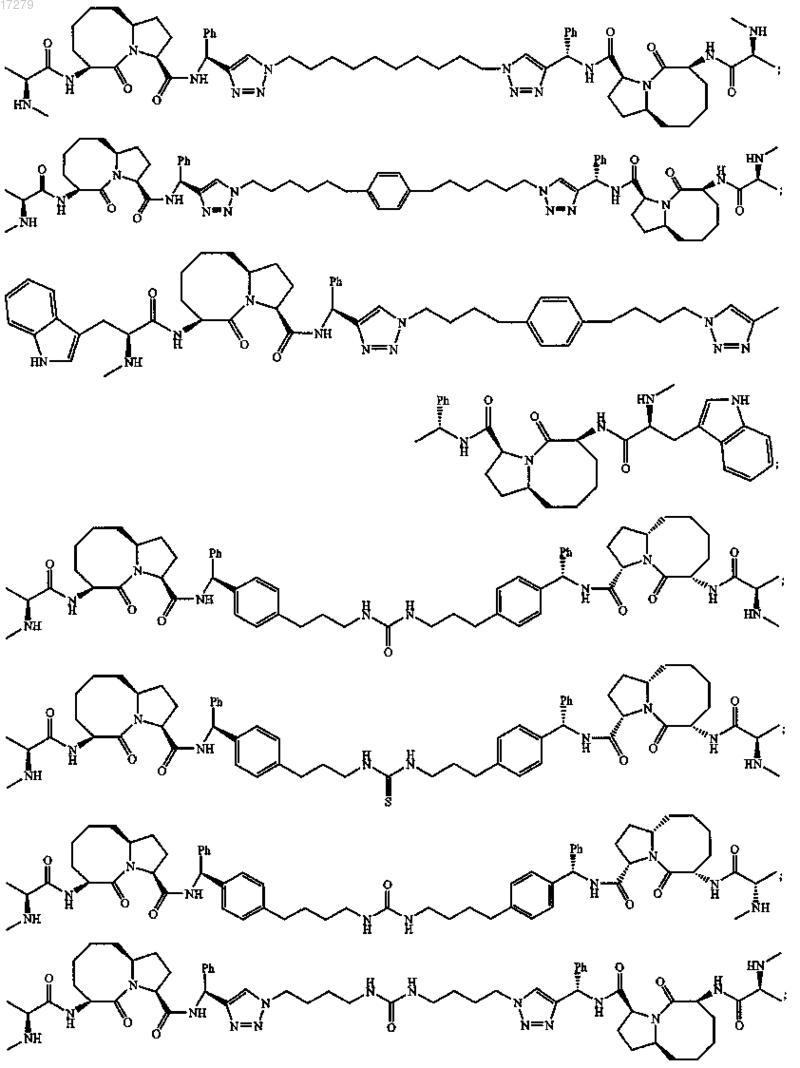
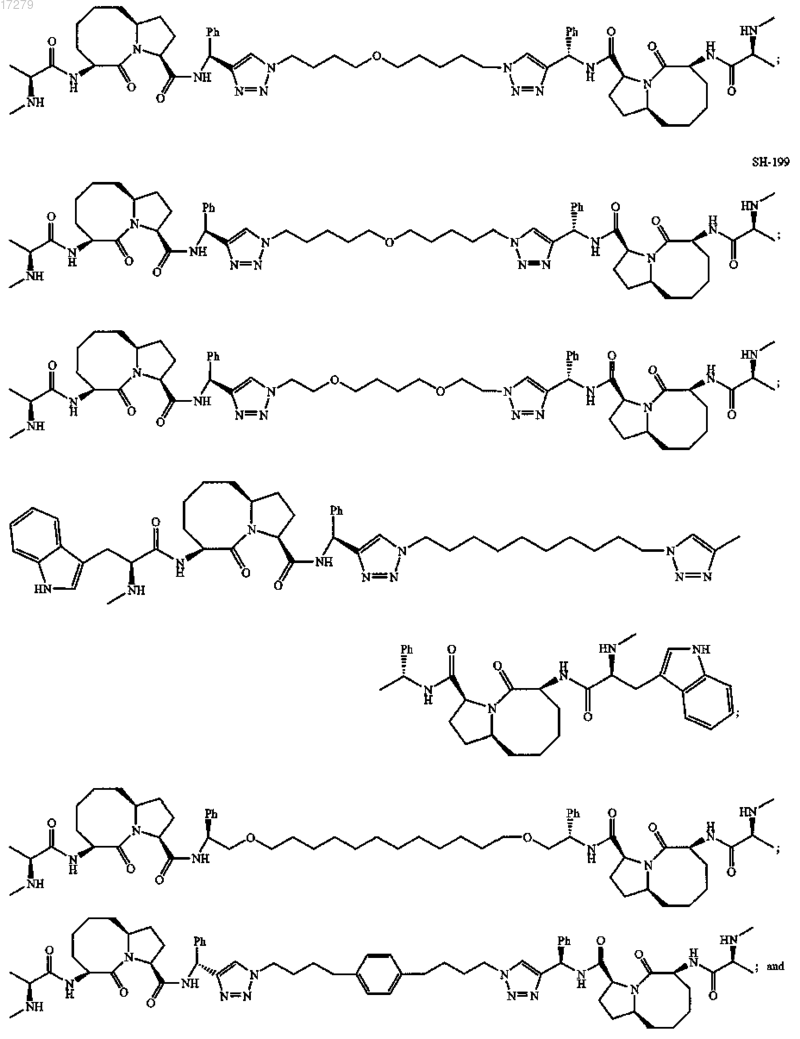
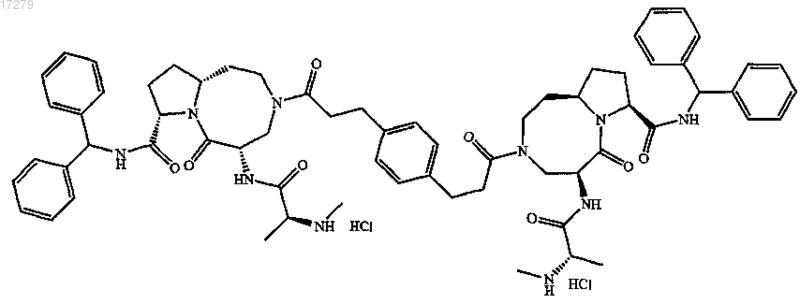
или их свободного основания, или их другой фармацевтически приемлемой соли.
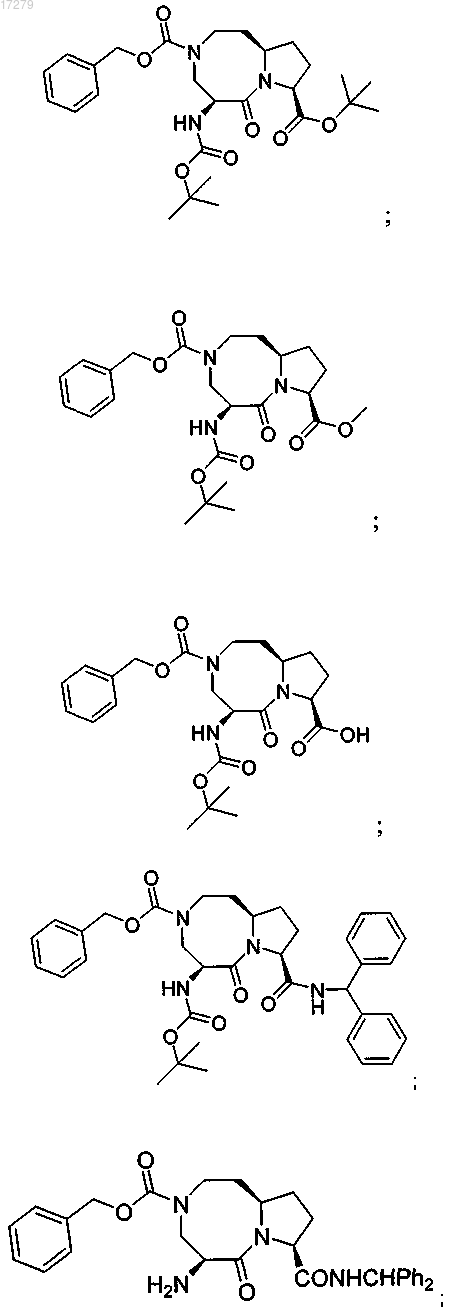
6. Соединение, имеющее формулу XIII
где D" представляет собой (CH2)-R5c-(CH2)m;
U выбран из группы, состоящей из OtBu, -OMe, -ОН и -NHCHPh2;
m равно 2 или 3;
R5c выбран из группы, состоящей из NH и NCO2CH2Ph;
R7 выбран из группы, состоящей из атома водорода, CO2tBu и COCH(R7b)N(R7c)CO2tBu;
R7b представляет собой незамещенный C1-3алкил;
R7c представляет собой незамещенный C1-3алкил.
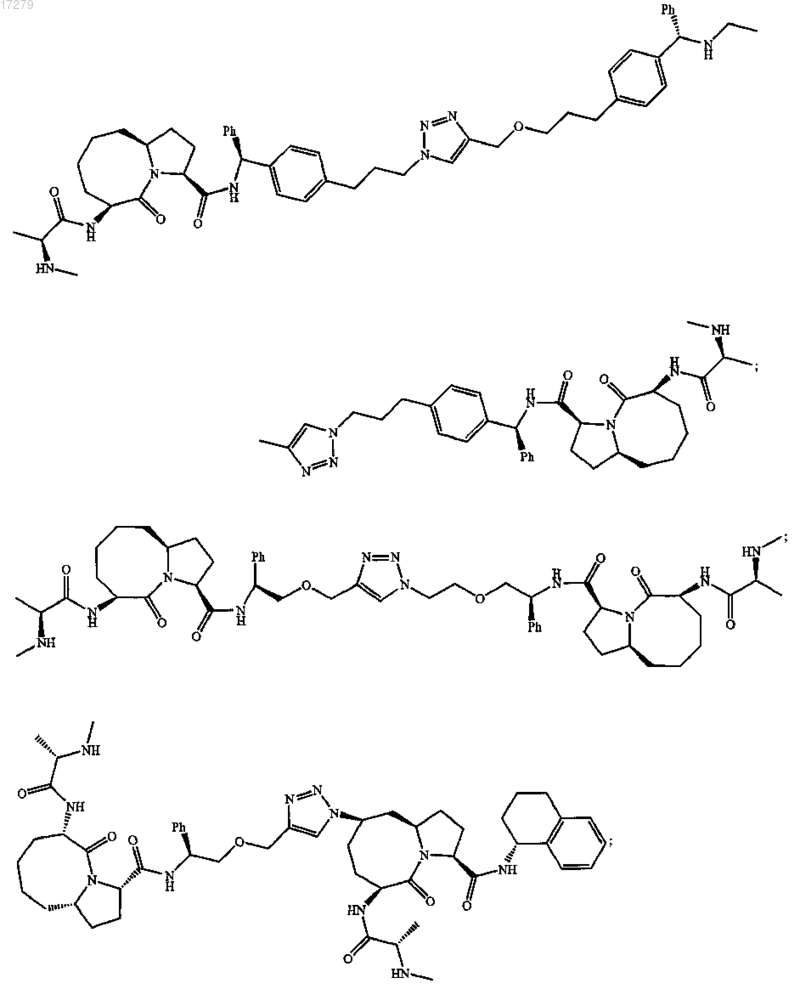
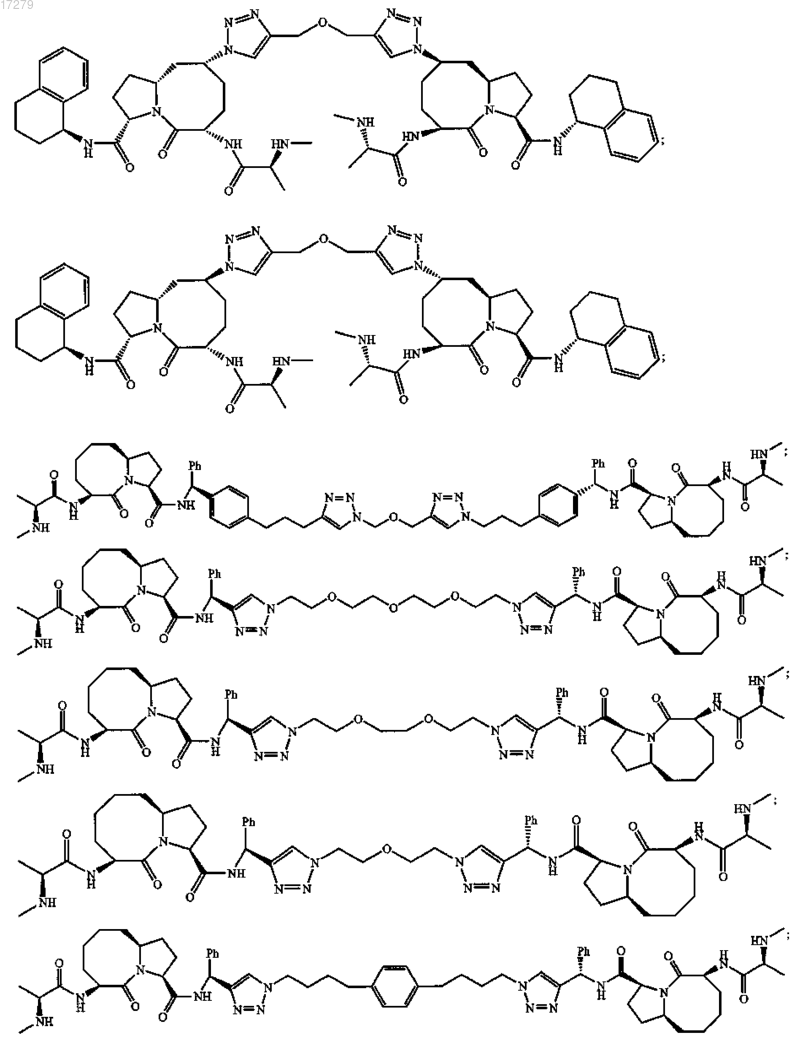
7. Соединение по п.6, выбранное из группы, состоящей из

8. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
9. Способ индукции апоптоза в клетке, при котором клетку приводят в контакт с соединением по п.1.
10. Способ сенсибилизации клетки к индуктору апоптоза, при котором клетку приводят в контакт с соединением по п.1.
11. Способ по п.10, дополнительно включающий приведение клетки в контакт с индуктором апоптоза.
12. Способ по п.11, где указанный индуктор апоптоза представляет собой химиотерапевтический агент.
13. Способ по п.11, где указанный индуктор апоптоза представляет собой облучение.
14. Способ по п.11, где указанный индуктор апоптоза представляет собой фактор некроза опухоли (TNF), TNF-связанный лиганд или агонист TRAIL-R1 или TRAIL-R2.
15. Способ по п.14, где указанный TNF-связанный лиганд выбран из группы, состоящей из лиганда TRAMP, лиганда Fas/CD95, лиганда TNFR-1 и TRAIL.
16. Способ по п.15, где указанный TNF-связанный лиганд представляет собой TRAIL.
17. Способ по п.15, где указанный агонист TRAIL-R1 или TRAIL-R2 представляет собой антитело.
18. Способ лечения, облегчения или предупреждения расстройств, чувствительных к индукции апоптоза, у животного, при котором указанному животному вводят терапевтически эффективное количество соединения по п.1.
19. Способ по п.18, при котором дополнительно вводят индуктор апоптоза.
20. Способ по п.18, где указанный индуктор апоптоза представляет собой химиотерапевтический агент.
21. Способ по п.19, где указанный индуктор апоптоза представляет собой облучение.
22. Способ по п.19, где указанный индуктор апоптоза представляет собой TNF, TNF-связанный лиганд или агонист TRAIL-R1 или TRAIL-R2.
23. Способ по п.22, где указанный TNF-связанный лиганд выбран из группы, состоящей из лиганда TRAMP, лиганда Fas/CD95, лиганда TNFR-1 и TRAIL.
24. Способ по п.23, где указанный TNF-связанный лиганд представляет собой TRAIL.
25. Способ по п.22, где указанный агонист TRAIL-R1 или TRAIL-R2 представляет собой антитело.
26. Способ по п.18, где указанное расстройство, чувствительное к индукции апоптоза, представляет собой гиперпролиферативное заболевание.
27. Способ по п.26, где указанное гиперпролиферативное заболевание представляет собой рак.
28. Способ по п.19, где указанное соединение по п.1 вводят перед указанным индуктором апоптоза.
29. Способ по п.19, где указанное соединение по п.1 вводят после указанного индуктора апоптоза.
30. Способ по п.19, где указанное соединение по п.1 вводят одновременно с указанным индуктором апоптоза.
31. Способ лечения, облегчения или предупреждения гиперпролиферативного заболевания у животного, при котором указанному животному вводят терапевтически эффективное количество соединения по п.1.
32. Способ по п.31, при котором дополнительно вводят индуктор апоптоза.
33. Способ по п.32, где указанный индуктор апоптоза представляет собой химиотерапевтический агент.
34. Способ по п.32, где указанный индуктор апоптоза представляет собой облучение.
35. Способ по п.32, где указанный индуктор апоптоза представляет собой TNF, TNF-связанный лиганд или агонист TRAIL-R1 или TRAIL-R2.
36. Способ по п.35, где указанный TNF-связанный лиганд выбран из группы, состоящей из лиганда TRAMP, лиганда Fas/CD95, лиганда TNFR-1 и TRAIL.
37. Способ по п.36, где указанный TNF-связанный лиганд представляет собой TRAIL.
38. Способ по п.35, где указанный агонист TRAIL-R1 или TRAIL-R2 представляет собой антитело.
39. Способ по п.31, где указанное гиперпролиферативное заболевание представляет собой рак.
40. Способ по п.32, где указанное соединение по п.1 вводят перед указанным индуктором апоптоза.
41. Способ по п.32, где указанное соединение по п.1 вводят после указанного индуктора апоптоза.
42. Способ по п.32, где указанное соединение по п.1 вводят одновременно с указанным индуктором апоптоза.
43. Набор, включающий соединение по п.1, и инструкции по введению указанного соединения животному.
44. Набор по п.43, дополнительно включающий индуктор апоптоза.
45. Набор по п.44, где указанный индуктор апоптоза представляет собой химиотерапевтический агент.
46. Набор по п.45, где указанный индуктор апоптоза представляет собой TNF, TNF-связанный лиганд или агонист TRAIL-R1 или TRAIL-R2.
47. Набор по п.46, где TNF-связанный лиганд выбран из группы, состоящей из лиганда TRAMP, лиганда Fas/CD95, лиганда TNFR-1 и TRAIL.
48. Набор по п.47, где указанный TNF-связанный лиганд представляет собой TRAIL.
49. Набор по п.46, где указанный агонист TRAIL-R1 или TRAIL-R2 представляет собой антитело.
50. Набор по п.43, где указанные инструкции даны для введения указанного соединения животным, страдающим гиперпролиферативным заболеванием.
51. Набор по п.50, где указанное гиперпролиферативное заболевание представляет собой рак.
Текст
Изобретение относится к бивалентным миметикам Smac, которые функционируют в качестве ингибиторов ингибитора белков апоптоза. Изобретение также относится к применению этих миметиков для индукции апоптической гибели клеток и для сенсибилизации клеток к индукторам апоптоза.(71)(73) Заявитель и патентовладелец: ДЗЕ РИДЖЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ МИЧИГАН (US) 017279 Предшествующий уровень техники В заявке на данное изобретение заявлен приоритет по отношению к временной патентной заявке США, серийный номер 60/798018, поданной 05.05.2006, и к временной патентной заявке США, серийный номер 60/923415, поданной 04.13.2007, каждая из которых включена в описание путем ссылки в полном объеме. Область изобретения Данное изобретение относится к области медицинской химии. В частности, изобретение относится к бивалентным миметикам N-концевой последовательности Smac, которые функционируют в качестве ингибиторов ингибитора белков апоптоза. Изобретение также относится к применению этих миметиков для индукции или сенсибилизации клетки к индукции апоптической гибели клеток. Уровень техники Агрессивный фенотип раковой клетки является результатом ряда генетических и эпигенетических изменений, приводящих к отмене регуляции внутриклеточных биохимических путей передачи сигнала(Ponder, Nature. 411:336 (2001. Общим для всех раковых клеток, однако, является их неспособность к выполнению апоптической программы, и отсутствие правильного апоптоза вследствие дефектов в нормальных апоптических механизмах является отличительной чертой рака (Lowe et al., Carcinogenesis. 21:485 (2000. Большая часть современных противораковых терапий, включая химиотерапевтические агенты, облучение и иммунотерапию, действуют, косвенно вызывая апоптоз в раковых клетках. Неспособность раковых клеток к выполнению апоптической программы вследствие дефектов в нормальных апоптических механизмах, таким образом, часто связана с увеличением резистентности к химиотерапии,облучению или апоптозу, индуцированному иммунотерапией. Первичная или приобретенная резистентность рака различного происхождения у человека к современным протоколам лечения вследствие дефектов апоптоза является главной проблемой в современной терапии рака (Lowe et al., Carcinogenesis. 21:485(2000); Nicholson, Nature. 407:810 (2000. Соответственно, усилия в настоящее время и в будущем по созданию и развитию новых молекулярных целевых противораковых терапий для улучшения жизнеспособности и качества жизни пациентов с раком должны включать стратегии, которые специфично направлены против резистентности раковой клетки к апоптозу. В этом отношении направленность на критические отрицательные регуляторы, которые играют центральную роль в прямом ингибировании апоптоза в раковых клетках, представляет весьма многообещающую терапевтическую стратегию для разработки новых противораковых лекарственных средств. Идентифицировано два класса центральных отрицательных регуляторов апоптоза. Первый класс регуляторов составляет семейство белков Bcl-2, примерами которых являются две эффективные антиапоптические молекулы, белки Bcl-2 и Bcl-XL (Adams et al., Science. 281:1322 (1998); Reed, Adv.Pharmacol. 47:501 (1997); Reed et al., J. Cell. Biochem. 60:23 (1996. Широко рассмотрены терапевтические стратегии направленной доставки Bcl-2 и Bcl-XL при раке для восстановления чувствительности раковых клеток и преодоления резистентности раковых клеток к апоптозу (Adams et al., Science. 281:1322(1998); Reed, Adv. Pharmacol. 41:501 (1997); Reed et al., J. Cell. Biochem. 60:23 (1996. Несколько лабораторий занято проектированием небольших молекул - ингибиторов Bcl-2 и Bcl-XL. Второй класс центральных отрицательных регуляторов апоптоза составляют ингибиторы белков апоптоза (IAP) (Deveraux et al., Genes Dev. 13:239 (1999); Salvesen et al., Nat. Rev. Mol. Cell. Biol. 3:401(2002. Этот класс включает белки, такие как XIAP, cIAP-1, cIAP-2, ML-IAP, HIAP, KIAP, TSIAP, NAIP,сурвивин, ливин, ILP-2, аполлон и BRUCE. Белки IAP эффективно подавляют апоптоз, индуцированный целым рядом апоптических стимулов в раковых клетках, включая химиотерапевтические агенты, облучение и иммунотерапию. Х-связанный IAP (XIAP) является самым эффективным ингибитором при подавлении апоптоза среди всех представителей IAP (Holcik et al., Apoptosis 6:253 (2001); LaCasse et al., Oncogene 77:3247 (1998);Takahashi et al., J. Biol. Chem. 273:7787 (1998); Deveraux et al., Nature. 388:300 (1997); Sun et al., Nature. 401:818 (1999); Deveraux et al., EMBO J. 18:5242 (1999); Asselin et al., Cancer Res. 61:1862 (2001. XIAP играет ключевую роль в отрицательной регуляции апоптоза в обоих биохимических путях как опосредованном рецептором смерти, так и опосредованном митохондриями. XIAP функционирует как эффективный эндогенный ингибитор апоптоза путем непосредственного связывания и сильного ингибирования трех представителей семейства ферментов каспаз: каспазы-3, -7 и -9 (Takahashi et al., J. Biol Chem. 273:7787 (1998); Deveraux et al., Nature. 388:300 (1997); Sun et al., Nature. 401:818 (1999); Deveraux et al.,EMBO J. 18:5242 (1999); Asselin et al., Cancer Res. 61:1862 (2001); Riedl et al., Cell. 104:791 (2001); Chai etal. Cell. 104:169 (2001); Huang et al., Cell. 704:781 (2001. XIAP содержит три повторяющихся домена бакуловирусного ингибитора апоптоза (BIR), а также С-концевой RING-домен. Избирательной мишенью третьего домена BIR (BIR3) является каспаза-9, инициаторная каспаза в митохондриальном биохимическом пути, тогда как область линкера между BIR1 и BIR2 ингибирует и каспазу-3, и каспазу-7 (Salvesenet al., Nat. Rev. Mol. Cell. Biol. 3:401 (2002. В то время как связывание с XIAP предотвращает активацию всех трех каспаз, очевидно, что взаимодействие с каспазой-9 является наиболее критичным для ингибирования ими апоптоза (Ekert et al., J. Cell. Biol. 152:483 (2001); Srinivasula et al., Nature. 470:112 (2001. Поскольку XIAP блокирует апоптоз в эффекторной фазе по ходу транскрипции, в точке, где сходятся-1 017279 многочисленные пути передачи сигналов, для преодоления резистентности раковых клеток к апоптозу особенно эффективными могут оказаться стратегии, нацеленные на XIAP (Fulda et al., Nature. Med. 8:808(2002); Arnt et al., J. Biol. Chem. 277:44236 (2002. Хотя точная роль XIAP при каждом типе рака далека от полного понимания, появляются свидетельства, указывающие на то, что имеет место обширная гиперэкспрессия XIAP при многих типах рака и может играть важную роль в резистентности раковых клеток к ряду современных терапевтических агентов (Holcik et al., Apoptosis 6:253 (2001); LaCasse et al., Oncogene. 77:3247 (1998. Обнаружено, что белок XIAP экспрессируется в большинстве линий раковых клеток NCI 60 человека (Tamm et al., Clin. Cancer Res. 6:1796 (2000. Анализ образцов опухоли у 78 ранее не подвергавшихся лечению пациентов показал, что пациенты с более низкими уровнями XIAP имели значительно более длительный срок жизни (Tamm et al., Clin. Cancer Res. 6:1796 (2000. Обнаружено, что XIAP экспрессируется при злокачественной глиоме человека (Wagenknecht et al., Cell. Death Differ. 6:370 (1999); Fulda etal., Nature. Med. 8:808 (2002. Обнаружено, что XIAP экспрессируется в раковых клетках простаты человека и блокирует апоптоз, обусловленный лигандом Аро 2/фактором некроза опухоли, индуцирующий опосредованный лигандом апоптоз раковых клеток простаты в присутствии митохондриальной активации (McEleny et al., Prostate 51:133 (2002); Ng et al., Mol Cancer Ther. 1:1051 (2002. Имеет место гиперэкспрессия XIAP при немелкоклеточном раке легкого (НМКРЛ) у пациентов, и он вовлечен в патогенез НМКРЛ (Hofmann et al., J. Cancer Res. Clin. Oncol. 128:554 (2002. Экспрессия XIAP и отсутствие понижающей регуляции XIAP при лечении цисплатином привели к резистентности к цисплатину при раке яичника человека (Li et al. Endocrinology 142:310 (2001); Cheng et al. Drug Resist. Update. 5:131 (2002. Взятые вместе, эти данные дают возможность предположить, что XIAP может играть важную роль в резистентности некоторых видов рака человека к современным терапевтическим агентам. Апоптоз не является отдельным процессом, вероятнее, он вовлечен в ряд различных, иногда взаимосвязанных, путей передачи сигнала, приводящих к распаду клетки. Пути, участвующие в конкретной форме апоптоза, зависят от многих факторов, таких как поражение или поражения, которые инициируют процесс. Другие факторы включают активацию или гиперактивацию специфичных рецепторов, например активацию "рецепторов смерти" фактором некроза опухоли альфа (TNF), лигандом индукции апоптоза, связанным с фактором некроза опухоли (TRAIL или Apo2L), или лигандом FAS. Другим определяющим фактором является тип вовлеченной клетки, поскольку для клеток так называемого типа I и типа II после активации рецептора Fas или TNF показаны различные пути передачи сигналов. Показано, что TRAIL (Apo2L) является селективным и эффективным индуктором апоптоза в раковых клетках (но не в нормальных клетках) при связывании с любым из двух проапоптических рецепторов TRAIL, TRAIL-R1 (или DR4) (Pan et al. Science. 276:111 (1997 или TRAIL-R2 (KILLER или DR5)(Wu et al., Nat. Genet. 17:141-143 (1997); Pan et al., Science. 277:815 (1997); Walczak et al., EMBO J. 16:5386 (1997. Активация проапоптических рецепторов смерти посредством TRAIL индуцирует образование сигнального комплекса, индуцирующего клеточную гибель (DISC), который состоит из рецептора FADD в качестве адаптера (Kischkel et al., Immunity 12:611 (2000); Kuang et al., J. Biol Chem. 275:25065(2000 и каспазы-8 в качестве инициирующей каспазы. После образования DISC каспаза-8 претерпевает самостоятельный процессинг и активируется путем индукции при сближении (Medema et al, EMBO J. 16:2794 (1997); Muzio et al., J. Biol. Chem. 273:2926 (1998.TRAIL вызвал значительный интерес в качестве потенциального терапевтического средства при лечении рака (French et al., Nat. Med. 5:146 (1999 в связи с его избирательной направленностью на раковые клетки, тогда как большинство нормальных клеток, по-видимому, является устойчивыми к TRAIL(Ashkenazi et al., Science. 281:1305 (1998); Walczak et al., Nat. Med. 5:157 (1999. Доказано, что системное введение TRAIL является безопасным и эффективным при лизисе ксенотрансплантатов опухолей молочной железы или ободочной кишки и при продлении продолжительности жизни мышей (Walczak et al.,Nat. Med. 5:157 (1999. Хотя TRAIL может специфично убивать многие типы раковых клеток, многие другие проявляют резистентность к TRAIL (Kim et al., Clin. Cancer Res. 6:335 (2000); Zhang et al., CancerRes. 59:2747 (1999. Кроме того, раковые клетки уничтожали путем применения антител (моноклональных или поликлональных), которые специфично распознают как TRAIL-R1, так и TRAIL-R2. В качестве потенциальных факторов, ответственных за резистентность к TRAIL, идентифицировано множество механизмов. Такие механизмы существуют на множестве уровней, включая рецепторный уровень, митохондриальный уровень, постмитохондриальный уровень и уровень DISC. Например, утрата экспрессии каспазы-8 (Teitz et al., Nat. Med. 6:529 (2000); Griffith et al., J. Immunol. 767:2833 (1998 или высокая экспрессия клеточного ингибиторного белка FLICE (cFLIP) (Kim et al., Clin. Cancer Res. 6:335(2000); Zhang et al., Cancer Res. 59:2747 (1999); Kataoka et al., J. Immunol. 767:3936 (1998 делают раковые клетки устойчивыми к TRAIL. Yeh et al. показали, что cFLIP-дефицитные эмбриональные фибробласты мыши особенно чувствительны к рецептор-опосредованному апоптозу (Yeh et al., Immunity. 72:533(2000. Известно несколько вариантов сплайсинга cFLIP, включая короткий вариант сплайсинга, cFLIPS, и более длинный вариант сплайсинга, cFLIP-L. Показано, что cFLIP-дефицитные эмбриональные фибробласты мыши становятся резистентными к TRAIL-индуцированному апоптозу в результате опосредо-2 017279 ванной ретровирусом трансдукции cFLIP-S (Bin et al., FEBS Lett. 510:37 (2002. Хотя TRAIL является потенциально многообещающим кандидатом для активации рецептора смерти, селективной для опухоли (т.е. он вызывает апоптоз преимущественно в опухолевых клетках, но не в нормальных тканях), многие раковые клетки являются резистентными к лекарствам, вызывающим апоптоз, как обсуждено выше. В результате для достижения терапевтического эффекта лечение такими лекарствами часто требует сопутствующего лечения облучением и/или цитотоксическими химическими соединениями. Однако как облучение, так и химиотерапия имеют значительные побочные эффекты, и,как правило, их избегают, если возможно. Таким образом, существует необходимость в агенте, который может селективно и эффективно сенсибилизировать опухолевые клетки к селективным лекарственным средствам, вызывающим апоптоз,таким как TRAIL или антитела к рецептору TRAIL, без такой же сенсибилизации окружающих нормальных клеток. Такой агент также был бы полезным для уменьшения или предотвращения резистентности к лекарству, обычно связанной с применением рецептор-опосредованных апоптических противораковых лекарств, таким образом улучшая их эффективность и устраняя потребность в комбинированных терапиях. Недавно был идентифицирован Smac/DIABLO (второй активатор каспаз митохондриального происхождения) в виде белка, высвобождаемого из митохондрий в цитозоль в ответ на апоптические стимулы (Budihardjo et al., Annu. Rev. Cell. Dev. Biol. 15:269 (1999); Du et al., Cell. 102:33 (2000. Smac синтезируется с N-концевой последовательностью, направленной на митохондрии, которая претерпевает протеолитическое отщепление во время созревания до зрелого полипептида. Показано, что Smac непосредственно взаимодействует с XIAP и другими IAP и прерывает их связывание с каспазами и облегчает активацию каспаз. Smac является эффективным эндогенным ингибитором XIAP. Недавно с высокой разрешающей способностью определены экспериментальные трехмерные (3D) структуры домена BIR3 XIAP в комплексе с белком Smac и пептидом (Sun et al., J. Biol. Chem. 275:36152AVPI (SEQ ID NO: 1 распознает поверхностную бороздку на домене BIR3 XIAP путем образования нескольких водородных связей и ван-дер-ваальсовых взаимодействий. Также показано, что во взаимодействие между BIR3 и каспазой-9 вовлечено четыре остатка (Ala-Thr-Pro-Phe или ATPF (SEQ ID NO: 2 на аминоконце малой субъединицы каспазы-9 с такой же поверхностной бороздкой на домене BIR3. В нескольких недавних исследованиях убедительно продемонстрировано, что Smac стимулирует каталитическую активность каспазы-9 путем конкурентного взаимодействия с каспазой-9 за ту же связывающую бороздку на поверхности домена BIR3 (Ekert et al., J. Cell. Biol. 152:483 (2001); Srinivasula et al., Nature. 410:112 (2001. В отличие от большинства белок-белковых взаимодействий, взаимодействие Smac-XIAP опосредовано только четырьмя аминокислотными остатками на белке Smac и хорошо выраженной бороздкой на поверхности домена BIR3 XIAP. Величина Kd для Smac пептида AVPI (SEQ ID NO:1) относительноXIAP (Kd=0,4 мкМ) является, по существу, такой же, как и для зрелого белка Smac (Kd=0,42 мкМ). Этот хорошо выраженный сайт взаимодействия является идеальным для конструирования непептидных малых молекул, подобных лекарству, которые имитируют связывание Smac с XIAP. Проницаемый для клетки Smac пептид, который состоит из первых четырех аминокислотных остатков (AVPI (SEQ ID NO: 1 N-конца Smac, связанный с пептидом-носителем для облегчения внутриклеточной доставки, как недавно было показано, сенсибилизирует различные опухолевые клетки in vitro и клетки злокачественной глиомы in vivo к апоптозу, индуцированному лигированием рецептора смерти или цитотоксическими лекарственными средствами (Fulda et al., Nature. Med. 8:808 (2002. Что важно,этот Smac пептид сильно увеличивал противоопухолевую активность Apo2L/TRAIL в модели ксенотрансплантата внутричерепной злокачественной глиомы in vivo. Полное уничтожение установленных опухолей и выживание мышей были достигнуты только после комбинированной обработки пептидамиSmac и Apo2L/TRAIL. Важно отметить, что Smac пептид не обладает обнаружимой токсичностью по отношению к нормальной ткани головного мозга. Второе недавнее независимое исследование также показало, что пептиды, состоящие из первых четырех-восьми остатков аминокислоты N-конца Smac, связанные с другим пептидом-носителем, усиливали индукцию апоптоза и долговременные антипролиферативные эффекты разнообразных химиотерапевтических лекарственных средств, включая паклитаксел, этопозид, SN-38 и доксорубицин в MCF-7 и других клеточных линиях рака молочной железы человека (Arnt et al., J. Biol. Chem. 277:44236 (2002. Это исследование окончательно показало, что XIAP и cIAP-1 представляют собой первичные молекулярные мишени для этих пептидов в клетках. Третье исследование показало, что пептид Smac из первых семи остатков N-конца, связанный с полиаргинином, восстанавливал апоптосомную активность и вызывал обратное развитие резистентности к апоптозу в клетках Н 460 немелкоклеточного рака легкого (Yang et al., Cancer Res. 63:831 (2003. Было показано, что XIAP является ответственным за дефект в апоптосомной активности и подавление активности каспазы в клетках Н 460. При использовании в комбинации с химиотерапией проницаемый для клетки пептид Smac вызывал замедление роста опухоли in vivo при незначительной токсичности для мышей. В своей совокупности эти последние независимые исследования дают веские основания предпо-3 017279 ложить, что эффективный, стабильный, проницаемый для клетки миметик Smac может обладать большим терапевтическим потенциалом при лечении рака молочной железы человека и других типов рака. Ингибиторы на основе пептидов являются полезными инструментами для объяснения антиапоптической функции IAP и роли IAP в ответе раковых клеток на химиотерапевтические агенты. Но ингибиторы на основе пептидов обычно имеют ограничения, свойственные им как потенциально полезным терапевтическим агентам. Эти ограничения включают их слабую проницаемость в клетки и слабую стабильность in vivo. Действительно, в этих трех опубликованных исследованиях с использованием пептидных ингибиторов на основе Smac эти пептиды должны были быть гибридизованы с пептидами-носителями,чтобы сделать их относительно проницаемыми в клетку. В опубликованной заявке США 2005/0197403 раскрыты димерные миметические соединения где R1 и R1' выбраны из атома водорода, возможно замещенного метила и гидроксила;R2 и R2' выбраны из возможно замещенного метила и возможно замещенного этила;R3 и R3' выбраны из СН 2, NH, О и S;R4 и R4' выбраны из СН и N;R5-R8 и R5'-R8' выбраны из атома водорода, возможно гетероалкила, возможно замещенного алкила,возможно гетероалкенила, возможно замещенного алкенила, возможно гетероалкинила, возможно замещенного алкинила, возможно гетероарила, возможно замещенного арила;L представляет собой линкер, ковалентно связывающий R2, R5, R6 или R7 с R2', R5', R6' или R7',или их фармацевтически приемлемая соль. Чтобы преодолеть ограничения, свойственные ингибиторам на основе пептидов, настоящее изобретение включает конструирование бивалентных конформационно фиксированных миметиков Smac. Краткое изложение сущности изобретения Общепринято, что неспособность раковых клеток или их поддерживающих клеток подвергаться апоптозу в ответ на генетические повреждения или воздействие индукторов апоптоза (например, противораковых агентов и облучения) является главным фактором в начальной стадии и прогрессировании рака. Полагают, что индукция апоптоза в раковых клетках или их поддерживающих клетках (например, в неоваскулярных клетках в сосудистой сети опухоли) является универсальным механизмом действия практически для всех эффективных противораковых терапевтических лекарственных средств или лучевых терапий, имеющихся в настоящее время в продаже или в практике. Одной из причин неспособности клетки подвергаться апоптозу является повышенная экспрессия и аккумуляция IAP. В настоящем изобретении рассмотрено, что воздействие на животных, страдающих раком или другими гиперпролиферативными расстройствами или заболеваниями, связанными с нарушением регуляции апоптоза, терапевтически эффективных количеств лекарственного средства(средств) (например, малых молекул), которые ингибируют функцию(и) IAP, полностью уничтожает больные клетки или поддерживающие клетки (те клетки, длительное выживание которых зависит от гиперактивности или гиперэкспрессии IAP) и/или делает такие клетки как популяцию более восприимчивыми к активности терапевтическими противораковых лекарственных средств или лучевых терапий, индуцирующей клеточную гибель. В настоящем изобретении рассмотрено, что ингибиторы IAP соответствуют неудовлетворенной потребности в лечении разнообразных типов рака либо при введении в качестве монотерапии, чтобы вызвать апоптоз в раковых клетках, зависимых от функции IAP, либо при введении во временном взаимоотношении с другими терапевтическими противораковыми лекарственными средствами или лучевыми терапиями, индуцирующими клеточную гибель, чтобы сделать большую долю раковых клеток или поддерживающих клеток восприимчивыми к выполнению программы апоптоза по сравнению с соответствующей долей клеток у животного, подвергающегося лечению только противораковым терапевтическим лекарственным препаратом или только лучевой терапией.-4 017279 В определенных воплощениях изобретения комбинированное лечение животных терапевтически эффективным количеством соединения по настоящему изобретению и курсом противоракового агента или облучения дает больший ответ опухоли и клиническую пользу у таких животных по сравнению с животными, которые подвергались лечению только этим соединением или только одними противораковыми лекарственными средствами/облучением. Другими словами, поскольку соединения понижают апоптический порог всех клеток, которые экспрессируют IAP, увеличивается доля клеток, которые успешно выполняют программу апоптоз в ответ на индуцирующую апоптоз активность противораковых лекарственных средств/облучения. С другой стороны, соединения по настоящему изобретению можно применять, чтобы дать возможность введения более низкой и поэтому менее токсичной и более переносимой дозы противоракового агента и/или облучения, чтобы давать такой же ответ опухоли/клиническую пользу, как и при общепринятой дозе одного противоракового агента/облучения. Поскольку дозы для всех одобренных противораковых лекарственных средств и лучевой терапии известны,в настоящем изобретении рассмотрены различные их комбинации с соединениями по настоящему изобретению. Кроме того, поскольку соединения по настоящему изобретению действуют, по меньшей мере частично, посредством ингибирования IAP, может оказаться, что воздействие терапевтически эффективных количеств соединений на раковые клетки и поддерживающие клетки может быть временно связано таким образом, чтобы совпадать с попытками клеток выполнить программу апоптоза в ответ на противораковый агент или лучевую терапию. Таким образом, в некоторых воплощениях введение композиций по настоящему изобретению при определенной временной взаимосвязи обеспечивает особенно эффективную терапевтическую практику. Настоящее изобретение относится к миметикам Smac, которые полезны для ингибирования активности белков IAP и увеличения чувствительности клеток к индукторам апоптоза. В одном конкретном воплощении миметики Smac представляют собой соединения формулы II где А 2 и А 2' независимо выбраны из группы, состоящей из атома водорода и C1-3 алкила, который является незамещенным или замещен одним из следующего: ОН или С(О)C1-3 алкил;X и X' независимо представляют собой C1-3 алкил, который является незамещенным или замещен одним индолом;D и D' независимо выбраны из группы, состоящей изU и U' независимо выбраны из группы, состоящей изZ представляет собой линкер, ковалентно связывающий один из D и U с одним из D' и U', выбранный из группы, состоящей из Настоящее изобретение относится к соединениям, представленным формулой II, которые являются ингибиторами белков IAP. Изобретение относится к применению, если соединения по изобретению вызывают апоптоз в клетках. Изобретение также относится к применению соединений по изобретению для сенсибилизации клеток к индукторам апоптоза. Соединения полезны для лечения, облегчения или предупреждения расстройств, чувствительных к индукции апоптической гибели клетки, например рас-6 017279 стройств, характеризующихся нарушением регуляции апоптоза, включая гиперпролиферативные заболевания, такие как рак. В определенных воплощениях соединения можно применять для лечения, облегчения или предупреждения рака, который характеризуется резистентностью к противораковым терапиям(например, тех, которые являются химиорезистентными, радиационно-резистентными, гормональнорезистентными и т.п.). В других воплощениях соединения можно применять для лечения гиперпролиферативных заболеваний, характеризующихся гиперэкспрессией IAP. В настоящем изобретении предложены фармацевтические композиции, содержащие соединение формулы II в терапевтически эффективном количестве, чтобы вызвать апоптоз в клетках или сенсибилизировать клетки к индукторам апоптоза. В изобретении дополнительно предложены наборы, включающие соединение формулы II и инструкции по введению соединения животному. Эти наборы могут возможно содержать другие терапевтические агенты, например противораковые агенты или агенты модуляции апоптоза. Краткое описание графических материалов На фиг. 1 показано конкурентное связывание миметиков Smac с белком XIAP BIR3. На фиг. 2 показано ингибирование роста клеток в клетках MDA-MB-231, MAMLE-3M, SK-OV-3 иOVCAR-4 под действием SH-164. На фиг. 3 показана индукция клеточной гибели в клетках MDA-MB-231, MAMLE-3M и OVCAR-4 под действием SH-164. На фиг. 4 А-4 В показано ингибирование роста клеток в клетках MDA-MB-231 (A), MDA-MB-453 (Б) и РС-3 (В) под действием SH-164 в комбинации с TRAIL. На фиг. 5 показано ингибирование роста клеток в клетках MDA-MB-231 под действием SH-164 в комбинации с цисплатином или митоксантроном. На фиг. 6 показана индукция апоптоза под действием SH-164 в клеточной линии MDA-MB-231 рака молочной железы. Подробное описание изобретения Настоящее изобретение относится к бивалентным конформационно фиксированным соединениям,представленным формулой II, которые являются миметиками Smac и функционируют как ингибиторыIAP. Эти соединения сенсибилизируют клетки к индукторам апоптоза и в некоторых случаях непосредственно вызывают апоптоз, ингибируя IAP. Следовательно, изобретение относится к способам сенсибилизации клеток к индукторам апоптоза и к способам индукции апоптоза в клетках, при которых клетки приводят в контакт только с соединениями формулы II или в комбинации с индуктором апоптоза. Кроме того, изобретение относится к способам лечения, облегчения или предупреждения расстройств у животного, которые являются восприимчивыми к индукции апоптоза, при которых животному вводят соединение формулы II и индуктор апоптоза. Такие расстройства включают расстройства, характеризующиеся нарушением регуляции апоптоза, а также расстройства, характеризующиеся гиперэкспрессией IAP. Термин "белки IAP", используемый здесь, относится к любому известному представителю семейства IAP (ингибитора белков апоптоза), включающего, но не ограниченного ими, XIAP, cIAP-1, cIAP-2,ML-IAP, HIAP, TSIAP, KIAP, NAIP, сурвивин, ливин, ILP-2, аполлон и BRUCE. Термин "гиперэкспрессия IAP", используемый здесь, относится к повышенному уровню (например,аберрантному уровню) иРНК, кодирующих белок(белки) IAP и/или к повышенным уровням белка(белков) IAP в клетках по сравнению с подобными соответствующими непатологическими клетками,экспрессирующими базальные уровни иРНК, кодирующих белки IAP, или имеющими базальные уровни белков IAP. Способы определения уровней иРНК, кодирующих белки IAP, или уровней белков IAP в клетке включают, но не ограничиваются ими, Вестерн-блоттинг с использованием антител белков IAP,иммуногистохимические методы, а также методы амплификации нуклеиновой кислоты или прямого обнаружения РНК. Столь же важным, как и определение абсолютного уровня белков IAP в клетках, должно быть определение того, что в них имеет место гиперэкспрессия белков IAP, а также уровень белков IAP по отношению к другим проапоптическим сигнальным молекулам (например, проапоптическим белкам семейства Bcl-2) в таких клетках. Когда баланс этих двух параметров таков, что если бы это не относилось к уровням белков IAP, проапоптических, сигнальных молекул было бы достаточно, чтобы заставить клетки выполнить программу апоптоза и погибнуть, то указанные клетки должны быть зависимыми от белков IAP для своего выживания. В таких клетках воздействие ингибирующего эффективного количества ингибитора белка IAP должно быть достаточно, чтобы заставить клетки выполнить программу апоптоза и погибнуть. Таким образом, термин "гиперэкспрессия белка IAP" также относится к клеткам,которые из-за относительных уровней проапоптических сигналов и антиапоптических сигналов подвергаются апоптозу в ответ на ингибирующие эффективные количества соединений, которые ингибируют функцию белков IAP. Термины "противораковый агент" и "противораковое лекарственное средство", используемые здесь,относятся к любым терапевтическим агентам (например, химиотерапевтическим соединениям и/или молекулярным терапевтическим соединениям), лучевым терапиям или хирургическим вмешательствам,применяемым при лечении гиперпролиферативных заболеваний, таких как рак (например, у млекопитающих).-7 017279 Термин "пролекарство", используемый здесь, относится к фармакологически неактивному производному молекулы исходного "лекарства", которое требует биотрансформации (например, самопроизвольной или ферментативной) в целевой физиологической системе для высвобождения или преобразования (например, ферментативного, физиологического, механического, электромагнитного) пролекарства в активное лекарственное средство. Пролекарства разрабатывают для решения проблем, связанных со стабильностью, токсичностью,неспецифичностью или ограниченной биодоступностью. Примерные пролекарства включают непосредственно молекулу активного препарата и химическую маскирующую группу (например, группу, которая обратимо подавляет активность лекарства). Некоторые предпочтительные пролекарства представляют собой вариации или производные соединений, у которых есть группы, отщепляемые в условиях метаболизма. Типичные пролекарства становятся фармацевтически активными in vivo или in vitro, где они подвергаются сольволизу в физиологических условиях или подвергаются ферментативному расщеплению или другому биохимическому преобразованию (например, фосфорилированию, гидрогенизации, дегидрогенизации, гликозилированию). Пролекарства часто предоставляют преимущества растворимости,тканевой совместимости или замедленного высвобождения в организме млекопитающего. (См., например, Bundgard, Design of Prodrugs, p. 7-9, 21-24, Elsevier, Amsterdam (1985); а также Silverman, TheOrganic Chemistry of Drug Design and Drug Action, p. 352-401, Academic Press, San Diego, CA (1992. Обычные пролекарства включают производные кислот, такие как сложные эфиры, получаемые взаимодействием исходных кислот с подходящим спиртом (например, низшим алканолом), амиды, получаемые взаимодействием исходного кислого соединения с амином или основными группами, которые реагируют с образованием ацилированного производного основания (например, низшего алкиламида). Термин "фармацевтически приемлемая соль", используемый здесь, относится к любой соли (например, полученной взаимодействием с кислотой или основанием) соединения по настоящему изобретению,которое физиологически переносится целевым животным (например, млекопитающим). Соли соединений по настоящему изобретению можно получать из неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничены ими, соляную, бромисто-водородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную,паратолуолсульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, сульфоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоты и т.п. Другие кислоты, такие как щавелевая кислота, хотя сами и не являются фармацевтически приемлемыми, можно применять при получении солей, полезных в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых солей присоединения кислоты. Примеры оснований включают, но не ограничены ими, гидроксиды щелочного металла (например,натрия), гидроксиды щлочно-земельного металла (например, магния), аммиак и соединения формулыNW4+, где W представляет собой C1-4 алкил, и т.п. Примеры солей включают, но не ограничены ими, ацетат, адипинат, альгинат, аспартат, бензоат,бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат,диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат,гептаноат, гексаноат, хлорид, бромид, йодид, 2-гидроксиэтансульфонат, лактат, малеат, мезилат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат,пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и т.п. Другие примеры солей включают анионы соединений по настоящему изобретению, объединенные с подходящим катионом, например Na+, NH4+ и NW4+ (где W представляет собой C1-4 алкильную группу) и т.п. Соли соединений по настоящему изобретению рассмотрены как фармацевтически приемлемые для терапевтического применения. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми,могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Термин "терапевтически эффективное количество", используемый здесь, относится к такому количеству терапевтического агента, которого достаточно для того, чтобы привести в результате к облегчению одного или более чем одного симптома расстройства, либо к предупреждению прогрессирования расстройства, либо к вызову регрессии симптомов расстройства. Например, относительно лечения рака,терапевтически эффективное количество предпочтительно относится к количеству терапевтического агента, которое уменьшает скорость роста опухоли, уменьшает массу опухоли, сокращает число метастазов, увеличивает время до прогрессирования опухоли или увеличивает продолжительность жизни по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%.-8 017279 Термины "сенсибилизировать" и "сенсибилизирующий", используемые здесь, относятся к тому, как путем введения первого агента (например, соединения формулы II) сделать животное или клетки животного более восприимчивыми или более чувствительными к биологическим эффектам (например, стимуляции или замедлению аспекта клеточной функции, включая, но не ограничиваясь ими, деление клетки,рост клетки, пролиферацию, инвазию, ангиогенез или апоптоз) второго агента. Сенсибилизирующий эффект первого агента на клетку-мишень может быть измерен как различие в предполагаемом биологическом эффекте (например, стимуляции или замедлении аспекта клеточной функции, включая, но не ограничиваясь ими, рост клетки, пролиферацию, инвазию, ангиогенез или апоптоз), наблюдаемом при введении второго агента с введением и без введения первого агента. Ответ сенсибилизированной клетки можно увеличить по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350%, по меньшей мере на 400%, по меньшей мере на 450% или по меньшей мере на 500% относительно ответа в отсутствие первого агента. Термин "нарушение регуляции апоптоза", используемый здесь, относится к любой аберрации в способности (например, предрасположенности) клетки претерпевать клеточную гибель посредством апоптоза. Нарушение регуляции апоптоза связано или вызвано множеством состояний, включающих, например,аутоиммунные расстройства (например, системную красную волчанку, ревматоидный артрит, заболевание трансплантат против хозяина, тяжелую миастению или синдром Шегрена), хронические воспалительные состояния (например, псориаз, астму или болезнь Крона), гиперпролиферативные расстройства(например, опухоли, лимфомы В- клеток или лимфомы Т-клеток), вирусные инфекции (например, герпес, папиллому или ВИЧ) и другие состояния, такие как остеоартрит и атеросклероз. Следует отметить,что, когда нарушение регуляции вызвано вирусной инфекцией или связано с ней, вирусная инфекция может быть обнаружима или не обнаружима в то время, когда имеет место или наблюдается нарушение регуляции. Таким образом, индуцированное вирусом нарушение регуляция может иметь место даже после исчезновения симптомов вирусной инфекции. Термин "гиперпролиферативное заболевание", используемый здесь, относится к любому состоянию, при котором локализованная популяция пролиферирующих клеток у животного не управляется обычными ограничениями нормального роста. Примеры гиперпролиферативных расстройств включают,но не ограничены ими, опухоли, новообразования, лимфомы и т.п. Новообразование называют доброкачественным, если оно не претерпевает инвазии или метастазов, и злокачественным, если оно претерпевает любое из них. "Метастатическая" клетка означает, что клетка может инвазировать и разрушать соседние структуры организма. Гиперплазия представляет собой форму клеточной пролиферации, включающую увеличение числа клеток в ткани или органе без значительного изменения в структуре или функции. Метаплазия представляет собой форму регулируемого роста клетки, при котором один тип полностью дифференцированных клеток заменяется другим типом дифференцированных клеток. Патологический рост активированных лимфоидных клеток часто приводит в результате к аутоиммунному расстройству или хроническому воспалительному состоянию. Используемый здесь термин "аутоиммунное расстройство" относится к любому состоянию, при котором организм продуцирует антитела или иммунные клетки, которые распознают молекулы, клетки или ткани собственного организма. Не ограничивающие примеры аутоиммунных расстройств включают аутоиммунную гемолитическую анемию, аутоиммунный гепатит, болезнь Бергера или IgA нефропатию, глютеновую энтеропатию, синдром хронической усталости, болезнь Крона, дерматомиозит, фибромиалгию, заболевание трансплантат против хозяина, диффузный токсический зоб, тиреоидит Хасимото, идиопатическую тромбоцитопеническую пурпуру, красный плоский лишай, рассеянный склероз, тяжелую миастению, псориаз, ревматизм,ревматоидный артрит, склеродерму, синдром Шегрена, системную красную волчанку, диабет 1 типа,неспецифический язвенный колит, витилиго и т.п. Термин "новообразование", используемый здесь, относится к любому аномальному росту клеток,являющихся либо доброкачественными (нераковыми), либо злокачественными (раковыми). Термин "противоопухолевый агент", используемый здесь, относится к любому соединению, которое замедляет пролиферацию, рост или распространение целевого (например, злокачественного) новообразования. Термины "предупреждать", "предупреждающий" и "предупреждение", используемые здесь, относятся к уменьшению возникновения патологических клеток (например, гиперпролиферативных или опухолевых клеток) у животного. Предупреждение может быть полным, например полное отсутствие патологических клеток у субъекта. Предупреждение также может быть частичным, так что возникновение патологических клеток у субъекта является меньшим, чем то, которое произошло бы без настоящего изобретения.-9 017279 Термин "агенты, модулирующие апоптоз", используемый здесь, относится к агентам, которые вовлечены в модуляцию (например, ингибирование, уменьшение, увеличение, стимуляцию) апоптоза. Примеры агентов, модулирующих апоптоз, включают белки, которые содержат домен смерти, такие как,но не ограниченные ими, Fas/CD95, TRAMP, TNF R1, DR1, DR2, DR3, DR4, DR5, DR6, FADD и RIP. Другие примеры агентов, модулирующих апоптоз, включают, но не ограничены ими, TNF, лиганд Fas,антитела к Fas/CD95 и другим рецепторам семейства TNF, TRAIL (также известный как лиганд Аро 2 илиApo2L/TRAIL), агонисты (например, моноклональные или поликлональные агонистические антитела)TRAIL-R1 или TRAIL-R2, Bcl-2, p53, BAX, BAD, Akt, CAD, PI3 киназу, PPI и белки каспазы. Модулирующие агенты в широком смысле включают агонисты и антагонисты рецепторов семейства TNF и лиганды семейства TNF. Агенты, модулирующие апоптоз, могут быть растворимыми или связанными с мембраной (например, лиганд или рецептор). Предпочтительные агенты, модулирующие апоптоз, являются индукторами апоптоза, такими как TNF или TNF-связанный лиганд, в частности лиганд TRAMP,лиганд Fas/CD95, лиганд TNFR-I или TRAIL. Ингибиторы IAP по настоящему изобретению представляют собой соединения, имеющие общую формулу II где А 2 и A2' независимо выбраны из группы, состоящей из атома водорода и C1-3 алкила, который является незамещенным или замещен одним из следующего: ОН или С(О)C1-3 алкил;X и X' независимо представляют собой C1-3 алкил, который является незамещенным или замещен одним индолом;D и D' независимо выбраны из группы, состоящей изU и U' независимо выбраны из группы, состоящей изZ представляет собой линкер, ковалентно связывающий один из D и U с одним из D' и U', выбранный из группы, состоящей из- 11017279 В другом конкретном воплощении промежуточные соединения, пригодные для получения IAP по настоящему изобретению, представляют собой соединения формулы XIIIR7 выбран из группы, состоящей из атома водорода, CO2tBu и COCH(R7b)N(R7c)CO2tBu;R7b представляет собой незамещенный C1-3 алкил;R7c представляет собой незамещенный C1-3 алкил. Линкер используют для соединения двух соединений-миметиков Smac в бивалентную структуру. Соединенные вместе, соединения-миметики Smac могут быть одинаковыми или разными и могут представлять собой любое соединение-миметик Smac, известное как связывающееся с IAP и ингибирующее взаимодействие IAP и каспаз. В одном воплощении миметики Smac являются конформационно фиксированными. В другом воплощении миметики Smac не содержат каких-либо природных аминокислот. В другом воплощении миметики Smac не содержат каких-либо пептидных связей. Примеры известных соединений-миметиков Smac, которые полезны в качестве исходных веществ в настоящем изобретении,включают приведенное ниже. В публикации WO 2005/069888 раскрыты соединения-пептидомиметики Smac формулы VI или их фармацевтически приемлемая соль или пролекарство,где R1 представляет собой C1-2 алкил или C1-2 галогеноалкил;R2 представляет собой разветвленный или неразветвленный алкил, либо циклоалкил, либо замещенный или незамещенный арил, алкиларил, гетероарил или алкилгетероарил;R3 представляет собой разветвленный или неразветвленный алкил, либо циклоалкил, либо замещенный или незамещенный арил, алкиларил, гетероарил или алкилгетероарил;Y представляет собой (СН 2)0-3, где один или более чем один атом углерода может быть замещен одним или более чем одним гетероатомом, выбранным из кислорода, серы и азота, и один или более чем один атом водорода в группах СН 2 может быть замещен разветвленным или неразветвленным алкилом,либо циклическим алкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом; иZ представляет собой CONH, CH2O, NHCO, (CH2)1-4, (CH2)1-3CONH(CH2)0-3, (CH2)1-3S(CH2)0-3,(CH2)1-3NH(CH2)0-3,(CH2)1-3NHCO(CH2)0-3,(CH2)1-3NHSO2(CH2)0-3,(CH2)1-3NHC(O)NH(CH2)0-3,(CH2)1-3NHC(S)NH(CH2)0-3 или (CH2)1-3NNR'X(CH2)0-3, где R' представляет собой разветвленный или неразветвленный алкил, либо циклоалкил, либо замещенный или незамещенный арил, алкиларил, гетероарил или алкилгетероарил. В публикации WO 2005/069894 раскрыты миметики Smac формулы VII или их фармацевтически приемлемая соль или пролекарство,где R1 представляет собой C1-2 алкил или C1-2 галогеноалкил;R2 представляет собой разветвленный или неразветвленный алкил, либо циклоалкил, либо замещенный или незамещенный арил, алкиларил, гетероарил или алкилгетероарил;Y1 представляет собой (CH2)1-5, где один или более чем один атом углерода может быть замещен одним или более чем одним гетероатомом, выбранным из кислорода, серы и азота, и один или более чем один атом водорода в группах СН 2 может быть замещен разветвленным или неразветвленным алкилом,либо циклоалкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом;Y2 представляет собой (CH2)1-5, где один или более чем один атом углерода может быть замещен одним или более чем одним гетероатомом, выбранным из кислорода, серы и азота, и один или более чем один атом водорода в группах СН 2 может быть замещен разветвленным или неразветвленным алкилом,либо циклоалкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом; иR' представляет собой разветвленный или неразветвленный алкил, либо циклоалкил, либо замещенный или незамещенный арил, алкиларил, гетероарил или алкилгетероарил. В публикации WO 2006/010118 раскрыты миметики Smac формулы VIII или их фармацевтически приемлемая соль или пролекарство,где А представляет собой NR1R2 или N+R1R2R3;R1, R2 и R3 представляют собой независимо атом водорода или возможно замещеннуюC1-8 алкильную, C2-8 алкенильную или C2-8 алкинильную группу, в которой один или более чем один атом углерода может быть замещен группой С=О, C=S или гетероатомом, выбранным из О, S и N, и один или более чем один атом водорода в группах СН, СН 2 или СН 3 может быть замещен атомом фтора, разветвленным или неразветвленным алкилом, либо циклоалкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом, либо OR4, SR4 или NR4R5;R4 и R5 представляют собой независимо атом водорода или возможно замещенную алкильную C1-4,алкенильную C2-5 или алкинильную C2-5 группу, в которой один или более чем один атом углерода может быть замещен гетероатомом, выбранным из О, S и N или возможно замещенной арильной, алкиларильной, гетероарильной или алкилгетероарильной группой; или любые две группы из R1, R2 и R3, взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу, в которой один или более чем один атом углерода может быть замещен группами С=О, C=S или гетероатомом, выбранным из О, S и N, при условии, что гетероатом отделен от атома азота по меньшей мере двумя атомами углерода; В представляет собой возможно замещенный C1-4 алкил, С 2-4 алкенил или C2-4 алкинил, где один или более чем один атом водорода может быть замещен атомом фтора;U представляет собой CONH, C(O)O, C(S)O, C(S)NH, C(NH)NH или (CH2)1-5, где один или более чем один атом углерода может быть замещен гетероатомом, выбранным из О, S и N;V и W независимо представляют собой (CH2)1-5, где один или более чем один атом углерода может быть замещен группами С=О, C=S или гетероатомом, выбранным из О, S и N, и один или более чем один атом водорода в группах СН 2 может быть замещен разветвленным или неразветвленным алкилом, либо циклоалкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом, либо OR4, SR4 или NR4R5;X представляет собой возможно замещенный C1-18 алкил, C2-18 алкенил, C2-18 алкинил, арил или гетероарил, где один или более чем один атом углерода может быть замещен группами С=О, C=S или гетероатомом, выбранным из О, S и N, и один или более чем один атом водорода в группах СН, CH2 или СН 3 может быть замещен разветвленным или неразветвленным алкилом, либо цикпоалкилом, либо замещенным или незамещенным арилом, алкиларилом, гетероарилом или алкилгетероарилом, либо OR4, SR4 илиY представляет собой СН или N;Z представляет собой СН 2, С=О, C=S, CHSR, CHOR или CHNR;R представляет собой атом водорода или возможно замещенный C1-4 алкил, C2-4 алкенил или С 2-4 алкинил. В опубликованной заявке США 2005/0234042 раскрыты соединения согласно формуле IX где R1 представляет собой Н; алкильную С 1-С 4; алкенильную C1-C4; алкинильную C1-C4 или С 3-С 10 циклоалкильную группы, которые являются незамещенными или замещенными;R2 представляет собой Н; C1-C4-алкил; C1-C4-алкенил; C1-C4-алкинил или C3-C10-циклоалкил, которые являются незамещенными или замещенными;R3 вместе с атомом азота образует гетероциклическое кольцо;R4 представляет собой прямоцепочечный или разветвленный C1-C16-алкил; C1-C16-алкенил; C1-C16 алкинил или C3-C10-циклоалкил; -(CH2)1-6Z1; -(СН 2)0-6-арил и -(CH2)0-6-Het; где алкильная, циклоалкильная и фенильная группы являются незамещенными или замещенными;Z1 представляет собой -N(R8)-C(O)-C1-C10-алкил; -N(R8)-C(O)-(CH2)1-6-C3-C7-циклоалкил; -N(R8)С(О)-(СН 2)0-6-фенил; -N(R8)-C(O)-(CH2)1-6-Het; -C(O)-N(R9)(R10); -С(О)-О-С 1-С 10-алкил; -С(О)-О-(СН 2)1-6 С 3-С 7-циклоалкил; -С(О)-О-(СН 2)1-6-фенил; -C(O)-O-(CH2)1-6-Het; -О-С(О)-С 1-С 10-алкил; -О-С(О)-(СН 2)1-6 С 3-С 7-циклоалкил; -O-С(О)-(СН 2)0-6-фенил; -O-C(O)-(CH2)1-6-Het; где алкильная, циклоалкильная и фенильная группы являются незамещенными или замещенными;Het представляет собой 5-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из N, О и S, или 8-12-членную конденсированную кольцевую систему, включающую по меньшей мере одно 5-7-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных изN, О и S, где это гетероциклическое кольцо или конденсированная кольцевая система являются незамещенными или замещенными на атоме углерода или азота;R9 и R10, каждый независимо, представляют собой Н; C1-С 4-алкил; С 3-С 7-циклоалкил; -(СН 2)1-6-С 3 С 7-циклоалкил; -(СН 2)0-6-фенил; где алкильная, циклоалкильная и фенильная группы являются незамещенными или замещенными, либо R9 и R10 вместе с атомом азота образуют Het;-(СН 2)0-6-СН(фенил)2; -инданил; -С(О)-C1-C10-алкил; -С(О)-(СН 2)1-6-С 3-С 7-циклоалкил; -С(О)-(СН 2)0-6 фенил; -(СН 2)0-6-С(О)-фенил; -(CH2)0-6-Het; -C(O)-(CH2)1-6-Het; либо R5 представляет собой остаток аминокислоты, где алкильные, циклоалкильные, фенильные и арильные заместители являются незамещенными или замещенными;Ra и Rb представляют собой независимо атом О, S или N или C0-8 алкил, где один или более чем один атом углерода в алкильной цепи может быть замещен гетероатомом, выбранным из О, S или N и где алкильная группа может быть незамещенной или замещенной;Rc представляет собой Н, либо Rc и Rd могут вместе образовывать циклоалкильную или гетероциклическую группу; причем если Rd и Rc образуют циклоалкильную или гетероциклическую группу, то R5 присоединена к образованному кольцу на атоме С или N; р и q независимо равны 0 или 1;Re представляет собой C1-C8-алкил или алкилиден и Re может быть незамещенным или замещенным;Ar1 и Ar2 представляют собой замещенную или незамещенную арильную или гетероциклическую группу;-S(O)2-NR11R12; -NR11-S(O)2-R12; S-C1-C10-алкил; арил-C1-С 4-алкил; Het-C1-C4-алкил, где алкильная,циклоалкильная, гетероциклическая или арильная группы являются незамещенными или замещенными; -SO2-C1-C2-алкил; -SO2-C1-C2-алкилфенил; -О-C1-C4-алкил; либо Rg и Rf образуют кольцо, выбранное из Het или арила;D представляет собой -СО-; -C(O)-C1-7 алкилен или арилен; -CF2-; -О-; -S(O)r, где r равно 0-2; 1,3-диоксолан; или C1-7 алкил-ОН; где алкильная, алкиленовая или ариленовая группа может быть незамещенной или замещенной одним или более чем одним атомом галогена, ОН, -O-C1-C6-алкилом,-S-C1-C6-алкилом или -CF3; либо D представляет собой -N(Rh), где Rh представляет собой Н; C1-7 алкил-S(O)2-R11; -S(O)2-NR11R12; -NR11-S(O)2-R12; где алкильная, циклоалкильная и арильная группы являются незамещенными или замещенными; и R6, R7, R'6 и R'7 могут быть объединены с образованием кольцевой системы;R11 и R12 независимо представляют собой Н; C1-C10-алкил; -(СН 2)0-6-C3-C7-циклоалкил;-C(S)-NH-(CH2)0-6-арил; -C(S)-(CH2)0-6-арил; -C(S)-(CH2)1-6-Het; где алкильная, циклоалкильная и арильная группы являются незамещенными или замещенными; либо R11 и R12 представляют собой заместители, которые способствуют транспорту молекулы через клеточную мембрану; либо R11 и R12 вместе с атомом азота образуют Het; где алкильные заместители R11 и R12 могут быть незамещенными или замещенными одним или более чем одним заместителем, выбранным из C1-C10-алкила, галогено, ОН, -O-С 1-C6-алкила, -S-C1-C6 алкила или -CF3; замещенные циклоалкильные заместители R11 и R12 замещены одним или более чем одним заместителем, выбранным из C1-C10-алкена; C1-C6-алкила; галогено; ОН; -О-С 1-С 6-алкила; -S-С 1-C6-алкила или-CF3; либо замещенные фенильные или арильные группы R11 и R12 замещены одним или более чем одним заместителем, выбранным из галогено; гидрокси; C1-C4-алкила; C1-C4-алкокси; нитро; -CN;-О-С(О)-C1-С 4-алкила и -С(О)-О-C1-С 4-арила,или их фармацевтически приемлемые соли. В опубликованной заявке США 2005/0261203 раскрыты соединения формулы XI где X1 и Х 2 независимо представляют собой О или S;R1 представляет собой алкил, карбоциклил, алкил, замещенный карбоциклилом, гетероциклил или алкил, замещенный гетероциклилом, где каждая группа возможно замещена галогеном, гидроксилом,меркапто, карбоксилом, алкилом, галогеноалкилом, алкокси, алкилсульфонилом, амино, нитро, арилом и гетероарилом;R4 и R4' независимо представляют собой Н, алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или гетероаралкил, где каждая группа возможно замещена галогеном, гидроксилом, меркапто,карбоксилом, алкилом, галогеноалкилом, алкокси, амино и нитро;R6 представляет собой Н или алкил; а также их соли и сольваты. В опубликованной заявке США 2006/0014700 раскрыты соединения формулы XII где Х 1, Х 2 и Х 3 независимо представляют собой О или S;- 15017279 А представляет собой 5-членный гетероцикл, содержащий от 1 до 4 гетероатомов, возможно замещенных амино, гидроксилом, меркапто, галогеном, карбоксилом, амидино, гуанидино, алкилом, алкокси, арилом, арилокси, ацилом, ацилокси, ациламино, алкоксикарбониламино, циклоалкилом, алкилтио, алкилсульфинилом, алкилсульфонилом, аминосульфонилом, алкиламиносульфонилом, алкилсульфониламино или гетероциклом; где каждый алкильный, алкокси-, арильный, арилокси-, ацильный, ацилокси-, ациламино-, циклоалкильный и гетероциклический заместитель возможно замещены гидроксилом, галогеном, меркапто, карбоксилом, алкилом, алкокси, галогеноалкилом, амино, нитро, циано, циклоалкилом, арилом или гетероциклом;R2 представляет собой алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероцикл или гетероциклоалкил; где каждый возможно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом,алкилом, галогеноалкилом, алкокси или алкилтио;R4 и R4' независимо представляют собой Н, гидроксил, амино, алкил, арил, аралкил, циклоалкил,циклоалкилалкил, гетероарил или гетероарилалкил, где каждая алкильная, арильная, аралкильная, циклоалкильная, циклоалкилалкильная, гетероарильная и гетероарилалкильная группа возможно замещена галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино и нитро;R6 и R6', каждый независимо, представляют собой Н, алкил, арил или аралкил; а также их соли и сольваты. Некоторые из соединений по настоящему изобретению могут существовать в виде стереоизомеров,включая оптические изомеры. Изобретение охватывает все стереоизомеры, как чистые индивидуальные препараты стереоизомеров, так и препараты, обогащенные каждым из них, а также как рацемические смеси таких стереоизомеров, так и индивидуальные энантиомеры, которые могут быть выделены согласно методам, которые хорошо известны специалистам в данной области техники. В некоторых воплощениях изобретения соединение формулы II выбрано из группы, состоящей из: или их свободных оснований или их других фармацевтически приемлемых солей. Соединения по настоящему изобретению можно получать с использованием способов, известных специалистам в данной области техники. Конкретно, соединения формулы II можно получить, как проиллюстрировано примерными реакциями в примерах. Важным аспектом настоящего изобретения является то, что соединения формулы II вызывают апоптоз, а также потенцируют индукцию апоптоза в ответ на сигналы индукции апоптоза. Поэтому предполагают, что эти соединения сенсибилизируют клетки к индукторам апоптоза, включая клетки,которые являются резистентными к таким индукторам. Ингибиторы IAP по настоящему изобретению можно применять для индукции апоптоза при любом расстройстве, которое можно лечить, облегчать или предупреждать путем индукции апоптоза. Таким образом, в настоящем изобретении предложены композиции и способы, направленные на животных, характеризующихся гиперэкспрессией белка IAP. В некоторых из воплощений клетки (например, раковые клетки) проявляют повышенные уровни экспрессии белков IAP по сравнению с непатологическими образцами (например, не раковыми клетками). В других воплощениях клетки оперативно проявляют повышенные уровни экспрессии белков IAP посредством выполнения программы апоптоза и гибели в ответ на ингибирующее эффективное количество соединения формулы I, причем указанный ответ проявляется, по меньшей мере частично, вследствие зависимости в таких клетках от функции белка IAP для их выживания. В другом воплощении изобретение относится к модулированию состояния, обусловленного апоптозом, которое связано с одним или более чем одним агентом, модулирующим апоптоз. Примеры агентов,модулирующих апоптоз, включают, но не ограничены ими, Fas/CD95, TRAMP, TNF R1, DR1, DR2, DR3,DR4, DR5, DR6, FADD, RIP, TNF, лиганд Fas, TRAIL, антитела к TRAIL-R1 или TRAIL-R2, Bcl-2, p53,BAX, BAD, Akt, CAD, PI3 киназу, РР 1 и белки каспазы. Также включены другие агенты, которые вовлечены в фазу инициации, выбора решения и деградации апоптоза. Примеры агентов, модулирующих апоптоз, включают агенты, активность, присутствие или изменение в концентрации которых может модулировать апоптоз у субъекта. Предпочтительные агенты, модулирующие апоптоз, представляют собой индукторы апоптоза, например TNF или TNF-связанный лиганд, в частности лиганд TRAMP, лиганд- 20017279 В некоторых воплощениях композиции и способы по настоящему изобретению применяют для лечения больных клеток, тканей, органов или патологических состояний и/или болезненных состояний у животного (например, у субъекта млекопитающего, включая, но не ограничиваясь ими, людей и домашних животных). В этой связи различные заболевания и патологии поддаются лечению или профилактике с использованием настоящих способов и композиций. Не ограничивающий примерный перечень этих заболеваний и состояний включает, но не ограничен ими, рак молочной железы, рак простаты, лимфому,рак кожи, рак поджелудочной железы, рак ободочной кишки, меланому, злокачественную меланому, рак яичника, рак головного мозга, первичную карциному головного мозга, рак головы и шеи, глиому, глиобластому, рак печени, рак мочевого пузыря, немелкоклеточный рак легкого, карциному головы или шеи,карциному молочной железы, карциному яичника, карциному легкого, мелкоклеточный рак легкого,опухоль Вильмса, карциному шейки матки, карциному яичка, карциному мочевого пузыря, карциному поджелудочной железы, карциному желудка, карциному ободочной кишки, карциному простаты, карциному мочеполовых путей, карциному щитовидной железы, карциному пищевода, миелому, множественную миелому, карциному надпочечников, рак почки, карциному эндометрия, карциному коры надпочечников, злокачественную инсулиному поджелудочной железы, злокачественную карциноидную карциному, хориокарциному, грибовидный микоз, злокачественную гиперкальцемию, гиперплазию шейки матки,лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, хронический гранулоцитарный лейкоз, острый гранулоцитарный лейкоз, волосатоклеточный лейкоз, нейробластому, рабдомиосаркому, саркому Капоши, истинную полицитемию, идиопатический тромбоцитоз, болезнь Ходжкина, неходжкинскую лимфому, саркому мягких тканей, остеогенную саркому, первичную макроглобулинемию, ретинобластому и т.п., аутоиммунные заболевания, опосредованные Т- и В-клетками; воспалительные заболевания; инфекции; гиперпролиферативные болезни; СПИД; дегенеративные состояния, заболевания кровеносных сосудов и т.п. В некоторых воплощениях раковые клетки, подлежащие лечению, являются метастатическими. В других воплощениях раковые клетки, подлежащие лечению, являются резистентными к противораковым агентам. В некоторых воплощениях инфекции, пригодные для лечения композициями и способами по настоящему изобретению, включают, но не ограничены ими, инфекции, вызванные вирусами, бактериями,грибами, микоплазмой, прионами и т.п. В некоторых воплощениях настоящего изобретения предложены способы введения эффективного количества соединения формулы I и по меньшей мере одного дополнительного терапевтического агента(включая, но не ограничиваясь ими, химиотерапевтические противоопухолевые средства, агенты, модулирующие апоптоз, антибактериальные средства, противовирусные средства, противогрибковые средства и противовоспалительные агенты) и/или терапевтическую методику (например, хирургическое вмешательство и/или лучевую терапию). Для применения в способах по настоящему изобретению рассмотрен ряд подходящих противораковых агентов. Действительно, в настоящем изобретении рассмотрено, но не ограничено, введение многочисленных противораковых агентов, таких как агенты, которые индуцируют апоптоз; полинуклеотиды(например, антисмысловые, рибозимы, малая интерферирующая РНК); полипептиды (например, ферменты и антитела); биологические миметики (например, госсипол или миметики ВН 3); агенты, которые связываются (например, образуют олигомеры или комплекс) с белком семейства Bcl-2, таким как Вах; алкалоиды; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные или поликлональные антитела (например, антитела, конъюгированные с противораковыми лекарственными средствами, токсинами, дефензинами), токсины; радионуклиды; модификаторы биологического ответа (например, интерфероны (например, ИФН-) и интерлейкины (например, IL-2; агенты для адоптивной иммунотерапии; гемопоэтические факторы роста; агенты, которые вызывают дифференциацию клетки опухоли (например, полностью трансретиноевая кислота); реагенты для генотерапии (например, реагенты и нуклеотиды для антисмысловой терапии); противоопухолевые вакцины; ингибиторы ангиогенеза; ингибиторы протеосом: модуляторы NF-KB; соединения анти-CDK; ингибиторы HDAC и т.п. Многочисленные другие примеры химиотерапевтических соединений и противораковых терапий, пригодные для совместного введения с раскрытыми соединениями, известны специалистам в данной области техники. В предпочтительных воплощениях противораковые агенты включают агенты, которые вызывают или стимулируют апоптоз. Агенты, которые вызывают апоптоз, включают, но не ограничены ими, облучение (например, рентгеновские лучи, гамма-лучи, УФ-облучение); факторы, связанные с фактором некроза опухоли (TNF) (например, белки рецептора семейства TNF, лиганды семейства TNF, TRAIL, антитела к TRAIL-R1 или TRAIL-R2); ингибиторы киназ (например, ингибитор киназы рецептора эпидермального фактора роста (EGFR), ингибитор киназы рецептора сосудистого фактора роста (VGFR), ингибитор киназы рецептора фактора роста фибробластов (FGFR), ингибитор киназы рецептора фактора роста тромбоцитарного происхождения (PDGFR) и ингибиторы киназы Bcr-Ab1 (например, гливек; антисмысловые молекулы; антитела (например, герцептин, ритуксан, зевалин и авастин); антиэстрогены (например, ралоксифен и тамоксифен); антиандрогены (например, флутамид, бикалутамид, финастерид,аминоглутетамид, кетоконазол и кортикостероиды); ингибиторы циклооксигеназы 2 (СОХ-2) (например,- 21017279 целекоксиб, мелоксикам, NS-398, а также нестероидные противовоспалительные лекарственные средства(НСПВЛ; противовоспалительные лекарственные средства (например, бутазолидин, декадрон, дельтазон, дексаметазон, дексаметазон интензол, дексон, гексадрол, гидроксихлорохин, метикортен, орадексон,орасон, оксифенбутазон, педиапред, фенилбутазон, плаквенил, преднизолон, преднизон, прелон и тандеарил) и химиотерапевтические противораковые лекарственные средства (например, иринотекан (камптосар), СРТ-11, флударабин (флудара), дакарбазин (ДТИК), дексаметазон, митоксантрон, милотарг, VP16, цисплатин, карбоплатин, оксалиплатин, 5-ФУ, доксорубицин, гемцитабин, бортезомиб, гефитиниб,бевацизумаб, таксотер или таксол); молекулы клеточной передачи сигнала; керамиды и цитокины; стауроспорин и т.п. Еще в других воплощениях композиции и способы по настоящему изобретению обеспечивают соединение формулы II и по меньшей мере один антигиперпролиферативный или противоопухолевый агент, выбранный из алкилирующих агентов, антиметаболитов и натуральных продуктов (например, лекарственных растений и других соединений растительного и/или животного происхождения). Алкилирующие агенты, пригодные для применения в настоящих композициях и способах, включают, но не ограничены ими: 1) азотистый иприт (например, мехлорэтамин, циклофосфамид, ифосфамид,мелфалан (L-сарколизин) и хлорамбуцил); 2) этиленимины и метилмеламины (например, гексаметилмеламин и тиотепа); 3) алкилсульфонаты (например, бусульфан); 4) нитрозомочевины (например, кармустин (BCNU); ломустин (CCNU); семустин (метил-CCNU) и стрептозоцин (стрептозотоцин; 5) триазены (например, дакарбазин (ДТИК; диметилтриазеноимидазолкарбоксамид). В некоторых воплощениях антиметаболиты, пригодные для применения в настоящих композициях и способах, включают, но не ограничены ими: 1) аналоги фолиевой кислоты (например, метотрексат(фтордезоксиуридин; FudR) и цитарабин (цитозин арабинозид; 3) аналоги пуринов (например, меркаптопурин (6-меркаптопурин; 6-МП), тиогуанин (6-тиогуанин; ТГ) и пентостатин (2'-дезоксикоформицин. Еще в одних других воплощениях химиотерапевтические агенты, пригодные для применения в композициях и способах по настоящему изобретению, включают, но не ограничены ими: 1) алкалоиды барвинка (например, винбластин (VLB), винкристин); 2) эпиподофиллотоксины (например, этопозид и тенипозид); 3) антибиотики (например, дактиномицин (актиномицин D), даунорубицин (дауномицин; рубидомицин), доксорубицин, блеомицин, пликамицин (митрамицин) и митомицин (митомицин С; 4) ферменты (например, L-аспарагиназа); 5) модификаторы биологического ответа (например, интерферональфа); 6) координационные комплексы платины (например, цисплатин (цис-ДДП) и карбоплатин); 7) антрацендионы (например, митоксантрон); 8) замещенные мочевины (например, гидроксимочевина); 9) производные метилгидразина (например, прокарбазин (N-метилгидразин; М 1 Н; 10) адренокортикальные супрессивные средства (например, митотан (o,p'-DDD) и аминоглутетимид); 11) адренокортикостероиды (например преднизон); 12) прогестины (например, гидроксипрогестерон капроат, медроксипрогестерон ацетат и мегестрол ацетат); 13) эстрогены (например, диэтилстильбэстрол и этинилэстрадиол); 14) антиэстрогены (например, тамоксифен); 15) андрогены (например, пропионат тестостерона и флуоксиместерон); 16) антиандрогены (например, флутамид); 17) аналоги гонадотропин-рилизинг гормона (например, лейпролид). Любой онколитический агент, который обычно применяют при лечении рака, находит применение в композициях и способах по настоящему изобретению. Например, FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) утверждает формуляр онколитических агентов, одобренных для применения в Соединенных Штатах. Международные агентства, являющиеся партнерами FDA, утверждают подобные формуляры. В табл. 1 представлен список примерных противоопухолевых агентов, одобренных для применения в США. Специалистам в данной области техники должно быть понятно, что в "товарных этикетках", требуемых для всех одобренных в США химиотерапевтических агентов, описаны утвержденные указания по применению, информация о дозировке, данные о токсичности и т.п. для этих примерных агентов. Противораковые агенты дополнительно включают соединения, которые идентифицированы как обладающие противораковой активностью, но в настоящее время не одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США или другими партнерскими агентствами или проходят испытания для нового применения. Примеры включают, но не ограничены ими, 3-АР,12-О-тетрадеканоилфорбол-13-ацетат, 17AAG, 852 А, ABI-007, ABR-217620, ABT-751, ADI-PEG 20,- 29
МПК / Метки
МПК: A61K 31/00
Метки: применения, миметики, бивалентные
Код ссылки
<a href="https://eas.patents.su/30-17279-bivalentnye-mimetiki-smac-i-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Бивалентные миметики smac и их применения</a>
Предыдущий патент: Соединения азаиндазола и способы применения
Следующий патент: Производные 3-циано-4-(4-фенилпиперидин-1-ил)пиридин-2-она
Случайный патент: Новая кристаллическая форма iv агомелатина, способ её получения и фармацевтические композиции, которые её содержат