Фармацевтическая композиция для лечения гиперпролиферативных заболеваний и ее применение
Формула / Реферат
1. Фармацевтическая композиция для лечения гиперпролиферативных заболеваний, включая онкологические заболевания, обладающая антипролиферативной и цитотоксической активностью, включающая:
а) химерный пептид, содержащий функциональную последовательность из белка-ингибитора циклиновых киназ p16INK4a (SEQ ID NO: 1) или p21/CIP/KIP (SEQ ID NO: 6) и транспортную последовательность, которые соединены между собой посредством группы X, где X представляет собой аминокислотную последовательность, содержащую от 1 до 50 аминокислотных остатков;
б) терапевтически активное вещество, выбранное из группы, включающей 5-фторурацил, этопозид;
в) фармацевтически приемлемые носители.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a, SEQ ID NO: 1 и транспортную 16-аминокислотную последовательность из белка Antp, SEQ ID NO: 2.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a, SEQ ID NO: 1 и транспортную 11-аминокислотную последовательность из белка Tat, SEQ ID NO: 5.
5. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 8-аминокислотную последовательность из белка-ингибитора р21/CIP/KIP, SEQ ID NO: 6 и транспортную 11-аминокислотную последовательность из белка Tat, SEQ ID NO: 5.
6. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 3.
7. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 4.
8. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 7.
9. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит химерный пептид в количестве до 400 мг/кг.
10. Применение фармацевтической композиции по п. 1 для получения лекарственного средства для лечения онкологических заболеваний.
11. Применение по п.10, при котором онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
12. Способ лечения онкологического заболевания, включающий введение млекопитающему, нуждающемуся в таком лечении, фармацевтической композиции по п.1 в терапевтически приемлемой дозе.
13. Способ по п.12, в котором онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
Текст
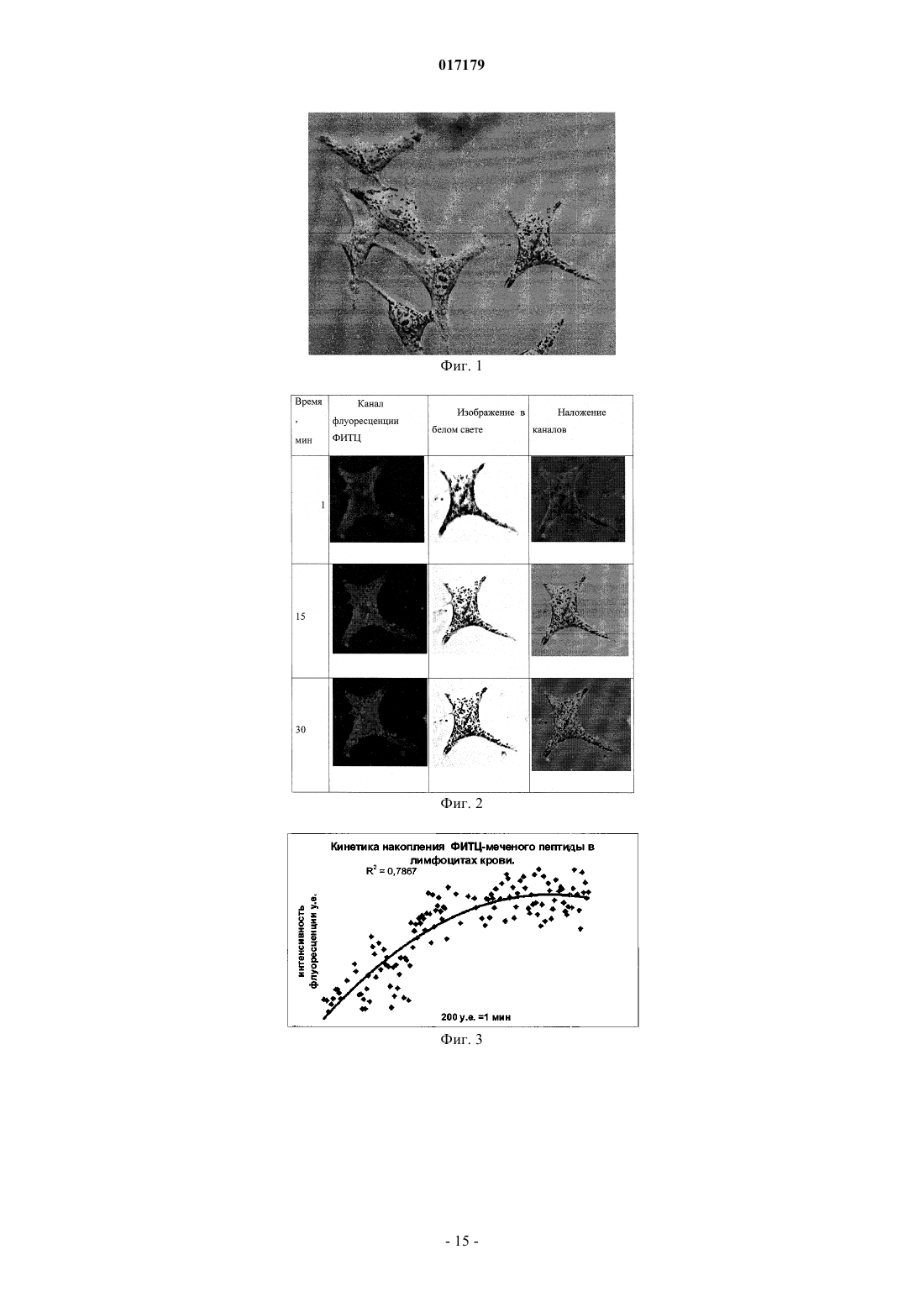
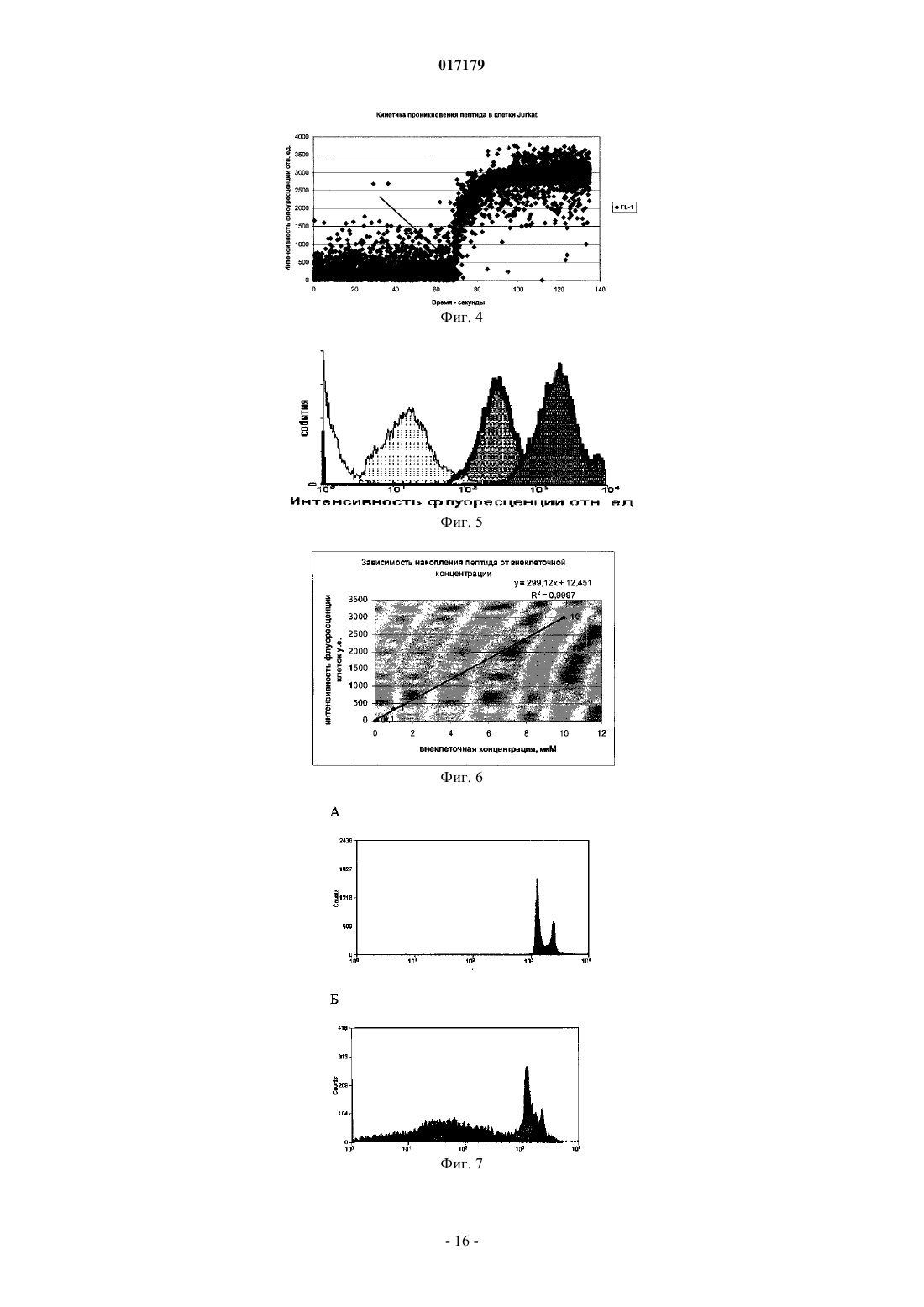
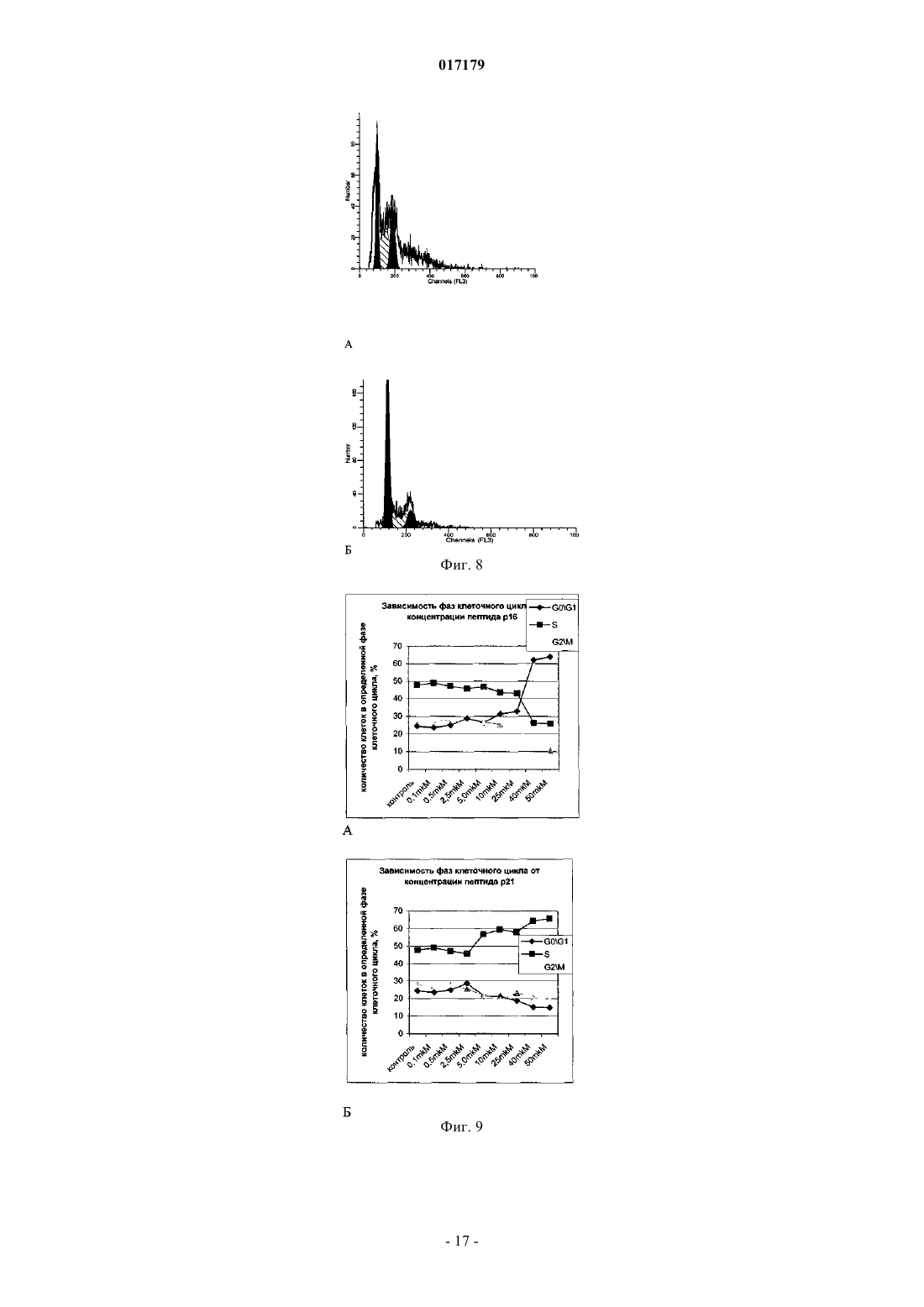
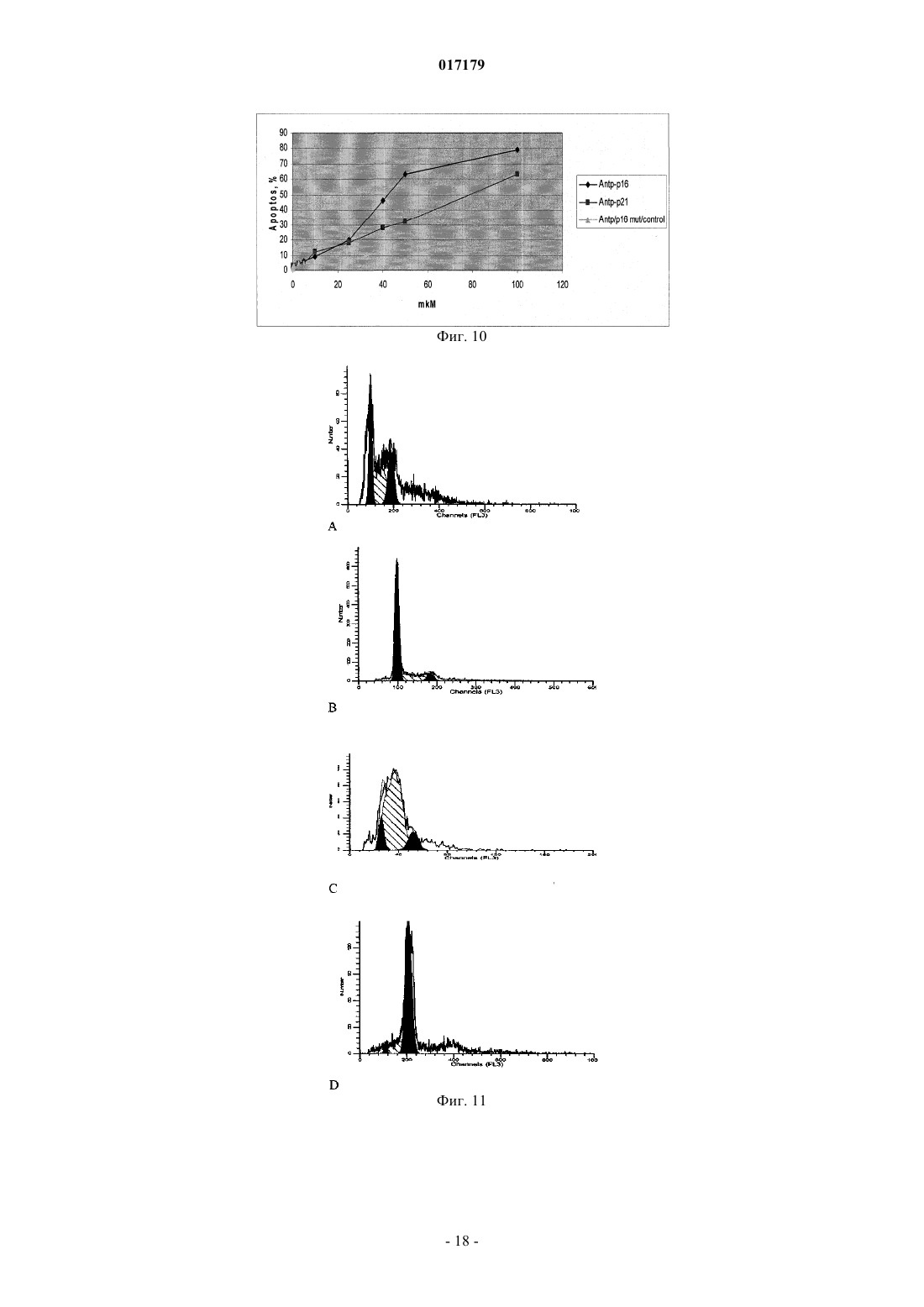
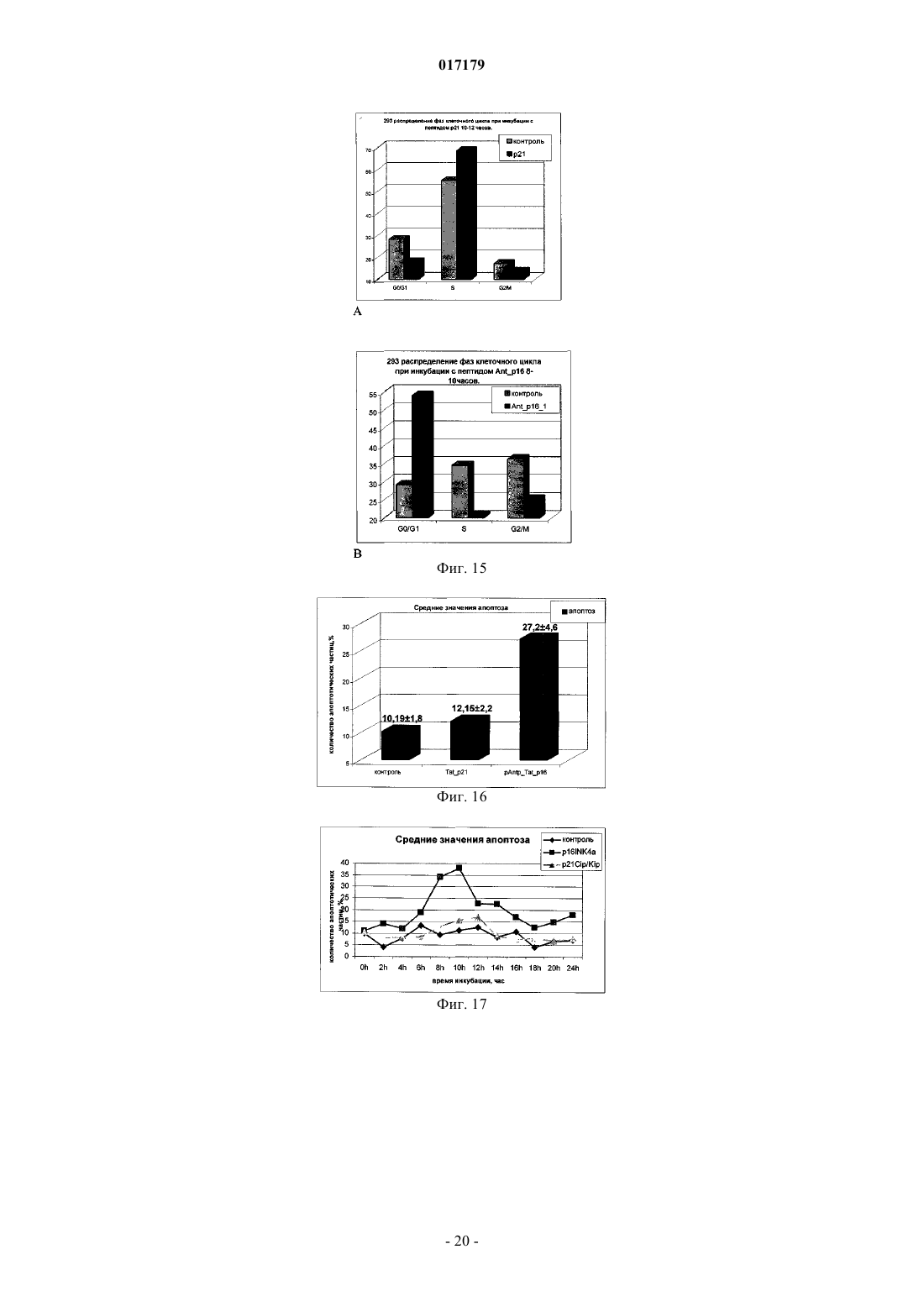
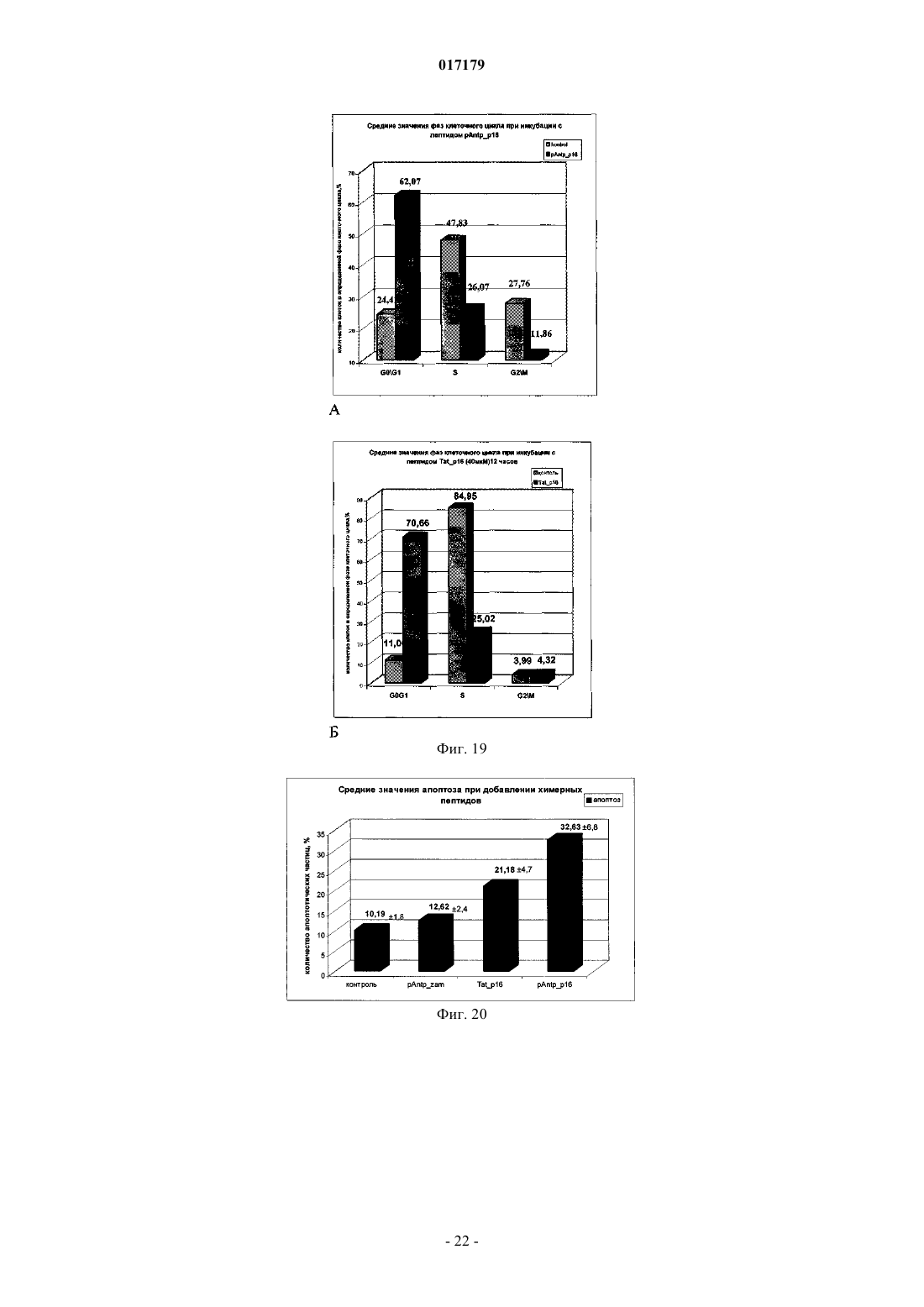
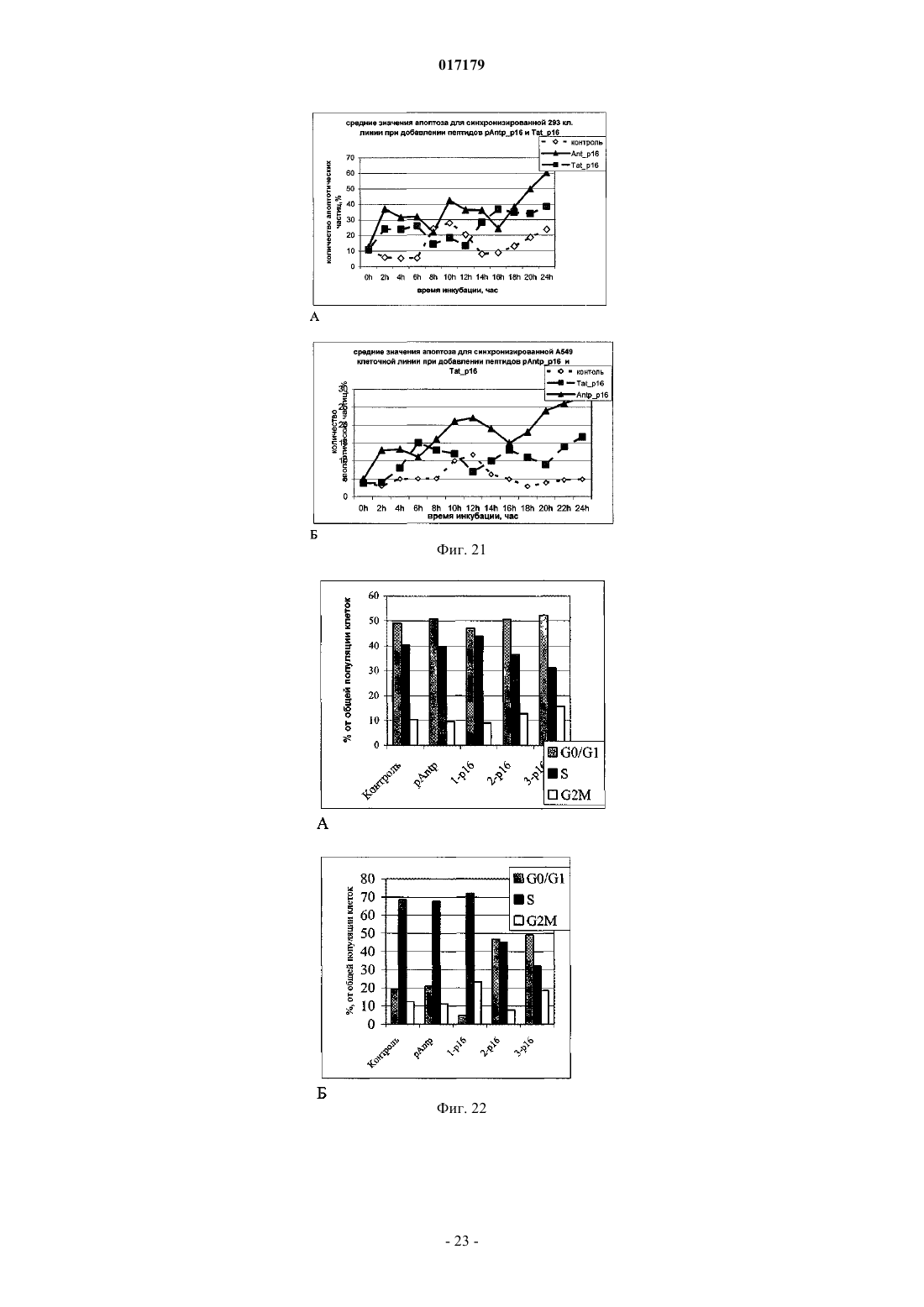
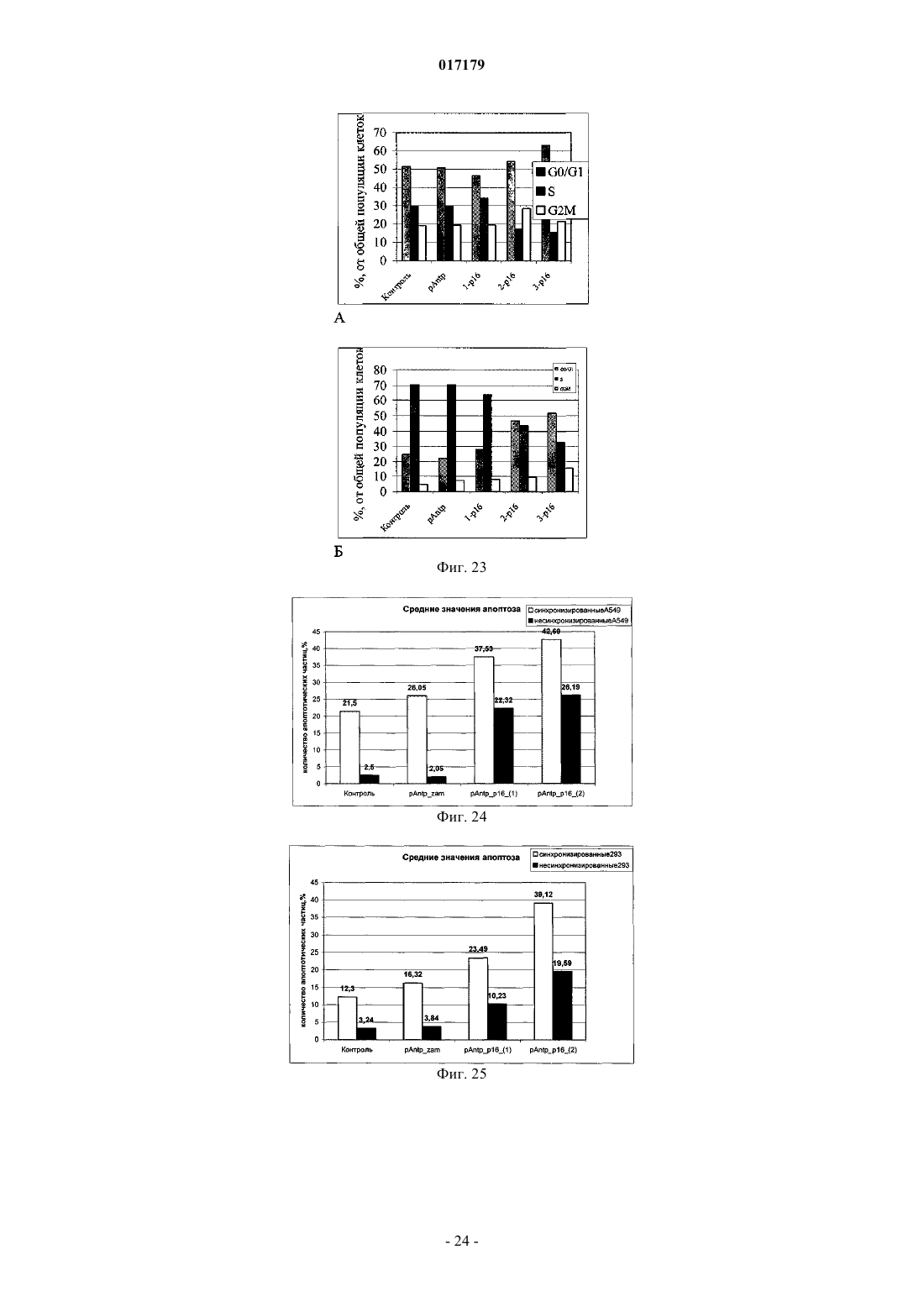
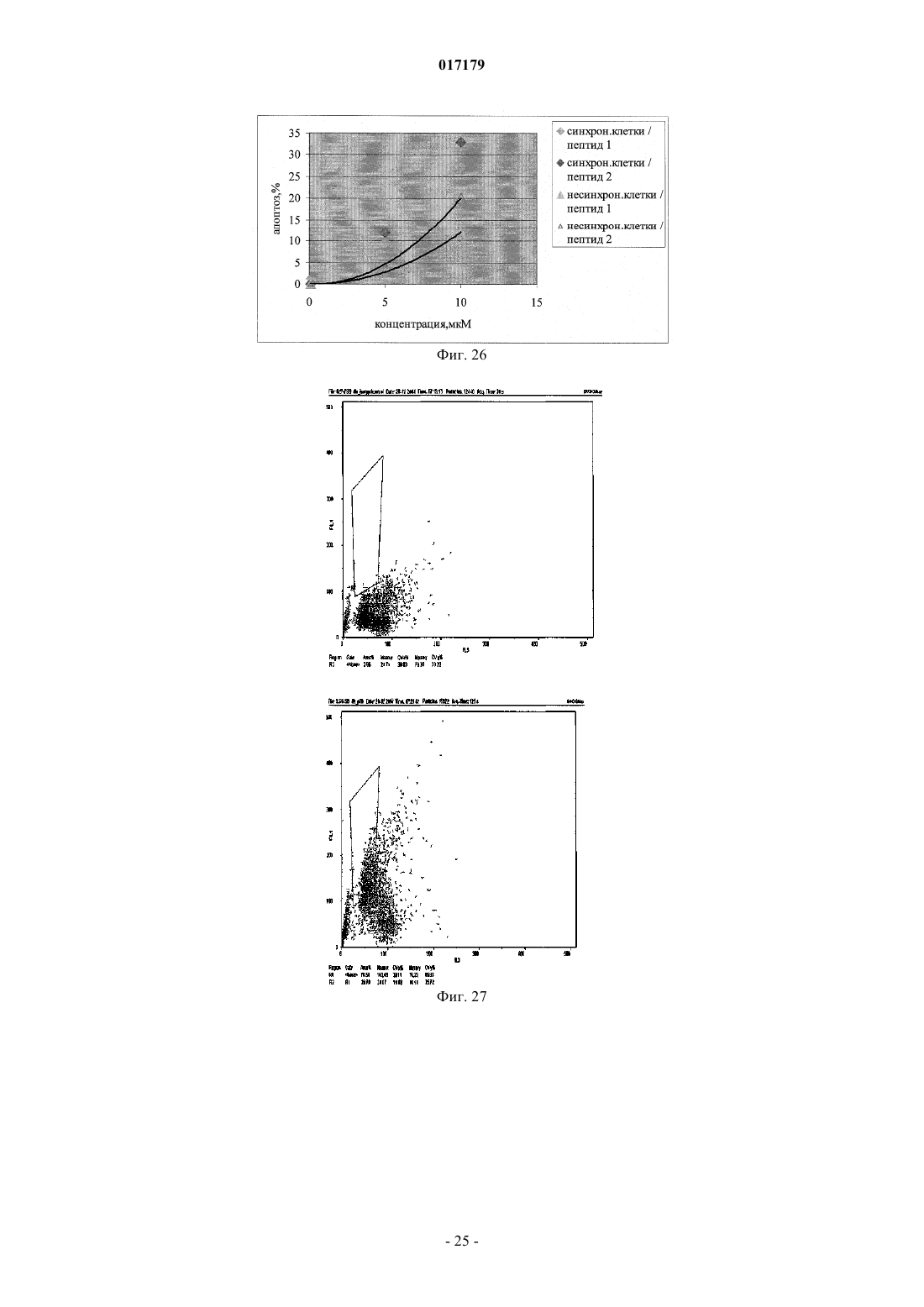
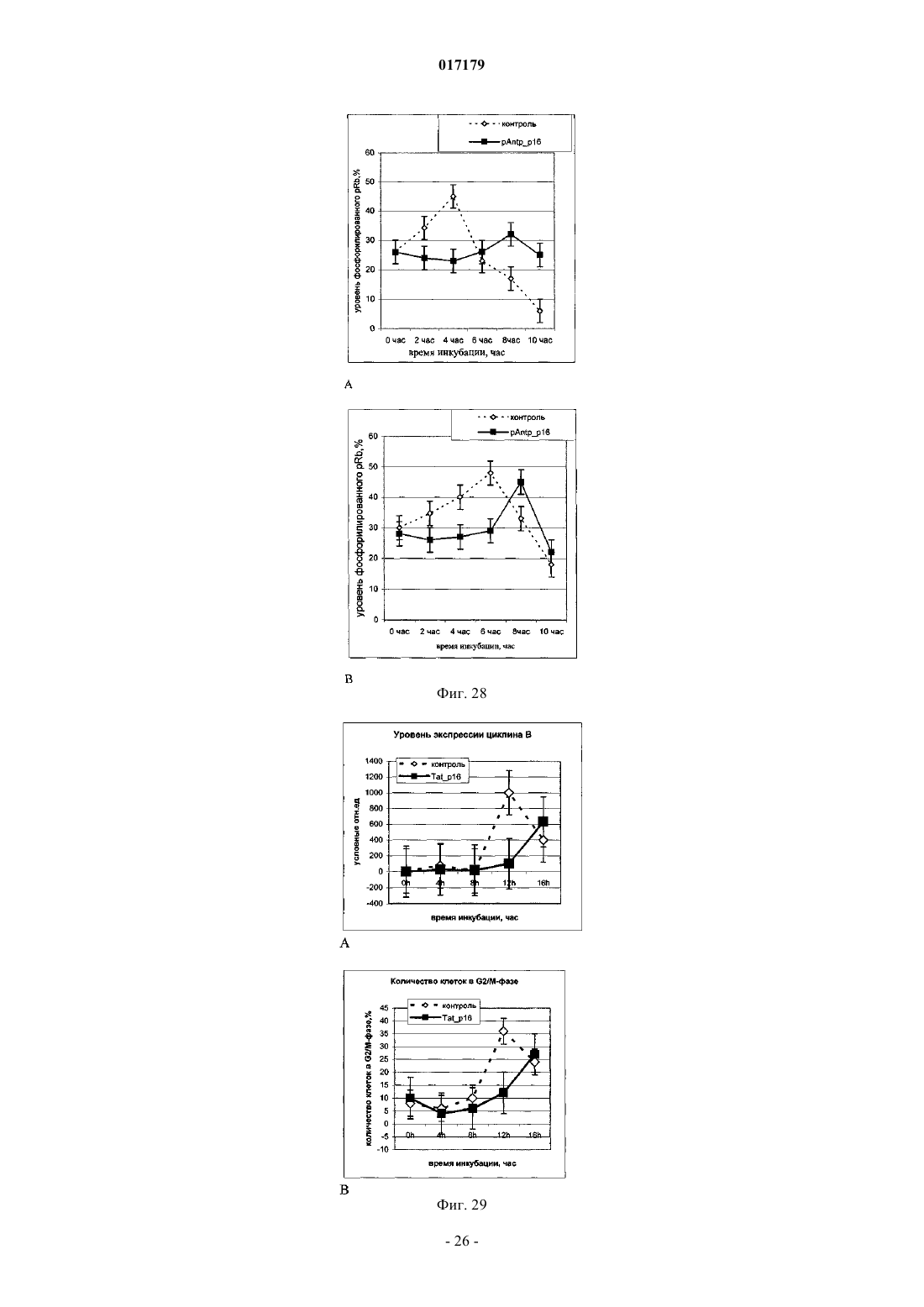
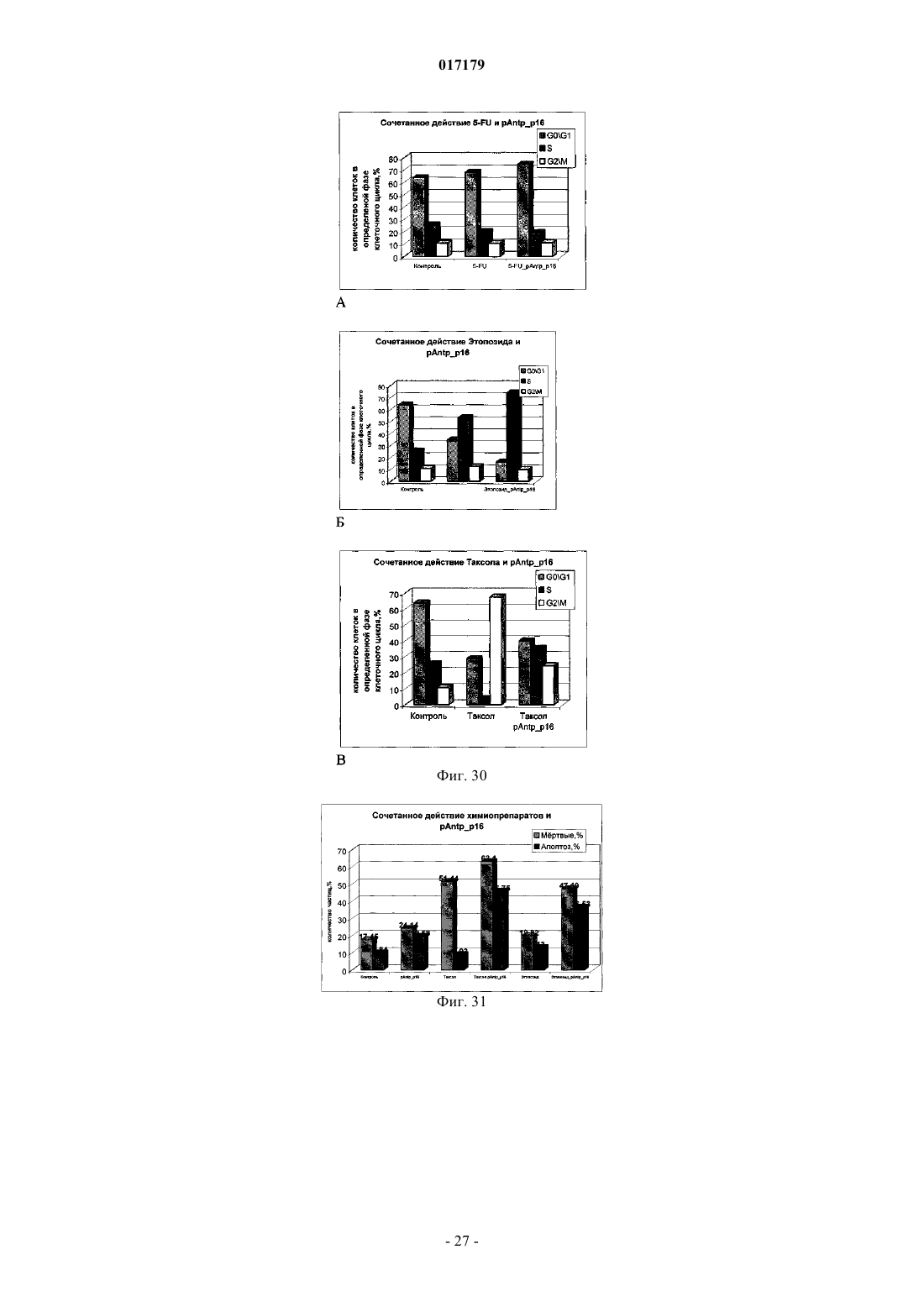
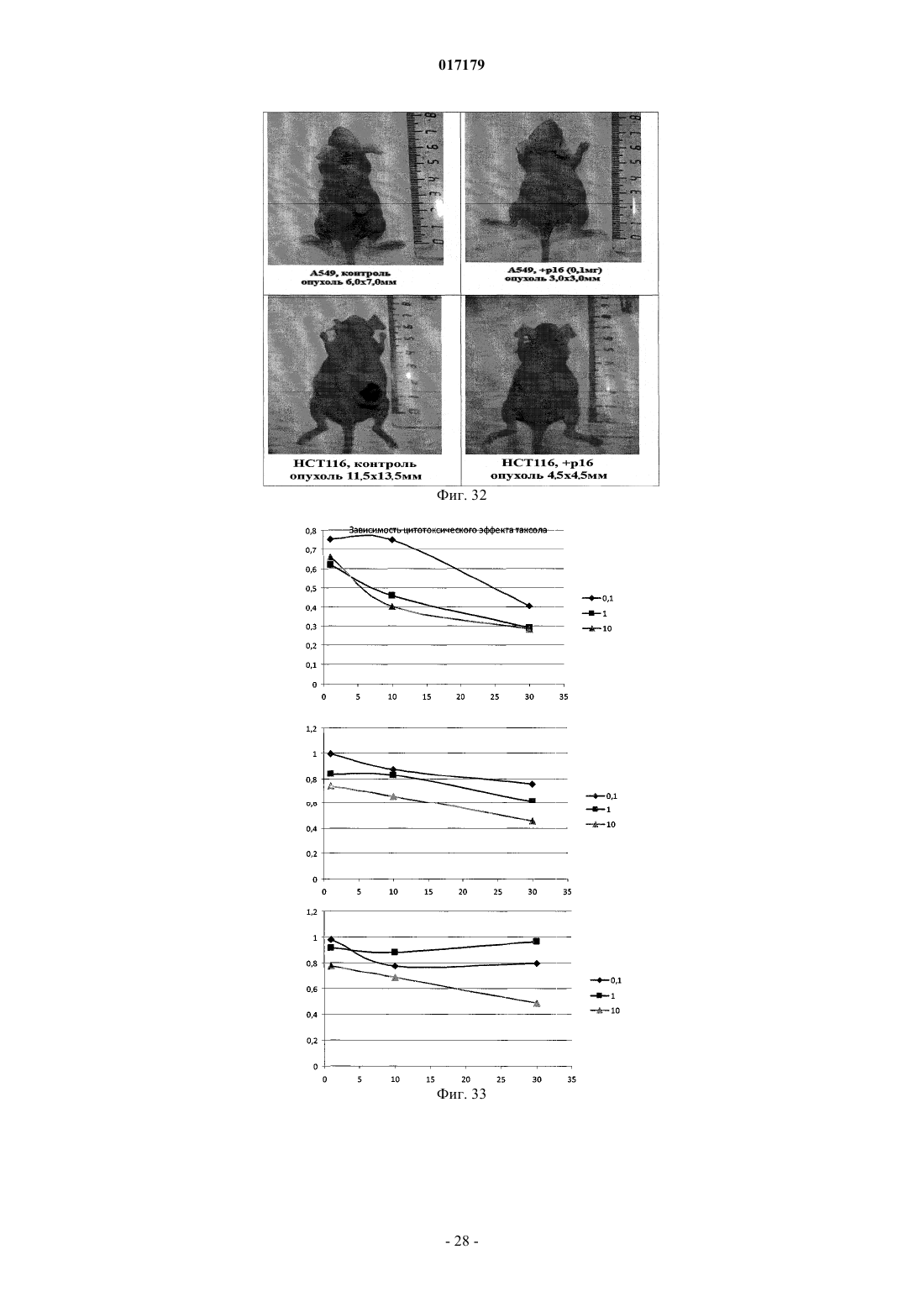
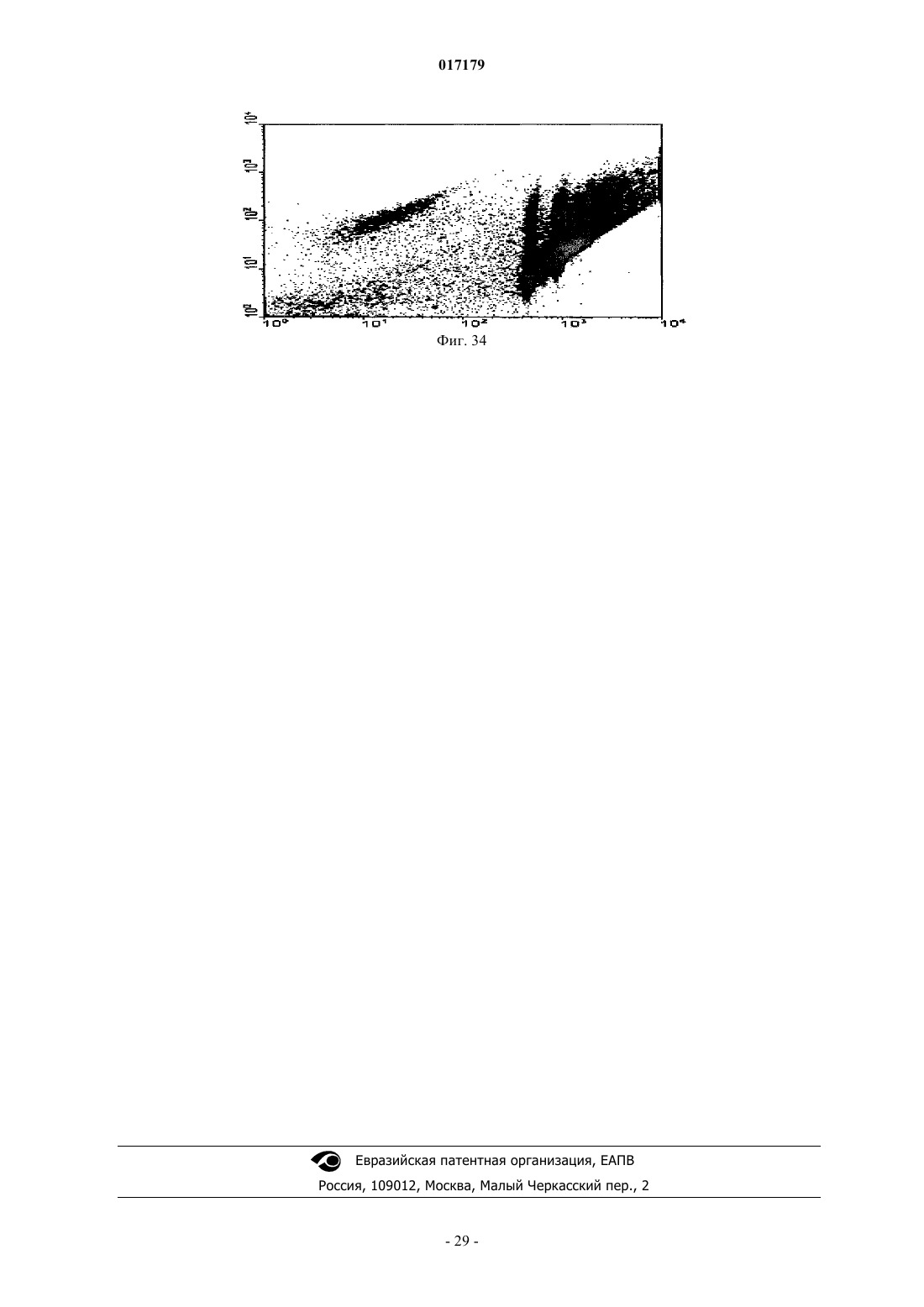
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И Е ПРИМЕНЕНИЕ Изобретение относится к области биотехнологии и медицины, в частности к фармацевтической композиции, обладающей антипролиферативной активностью, и способу лечения онкологических заболеваний, включающему введение указанной композиции нуждающемуся в таком лечении млекопитающему. Задачей изобретения является разработка препарата, эффективно проникающего в клетки-мишени и обладающего высоким цитостатическим и цитотоксическим действием.(56) ЕР-B1-1076561 ОЛФЕРЬЕВ М.А. и др. Использование технологии проникающих пептидов для доставки физиологически активных пептидов внутрь клетки. Серия. Критические технологии. Мембраны, 2003,17, с. 30-35 017179 Область техники, к которой относится изобретение Настоящее изобретение относится к области биотехнологии и медицины, в частности к фармацевтической композиции для лечения гиперпролиферативных заболеваний, включая онкологические заболевания, обладающей антипролиферативной активностью, которая включает а) химерный пептид, содержащий функциональную последовательность из белка-ингибитора циклиновых киназ p16INK4a (SEQ ID NO: 1) или p21/CIP/KIP (SEQ ID NO: 6), и транспортную последовательность, которые соединены между собой посредством группы X, где X представляет собой аминокислотную последовательность, содержащую от 1 до 50 аминокислотных остатков. б) терапевтически активное вещество, выбранное из группы, включающей, 5-фторурацил, этопозид; в) фармацевтически приемлемые носители. Изобретение также относится к применению вышеуказанной фармацевтической композиции для лечения онкологических заболеваний, а также к способу лечения онкологических заболеваний, включающему введение указанной фармацевтической композиции нуждающемуся в таком лечении млекопитающему. Задачей изобретения является разработка препарата, эффективно проникающего в клеткимишени и обладающего высоким цитостатическим и цитотоксическим действием. Уровень техники С начала 90-х годов в России ежегодно диагностируют более 400 тысяч случаев злокачественных новообразований. При этом в Европе ежегодная смертность от онкологических заболеваний за период с 1985 года но 2002 продолжает расти. В структуре причин смертности онкологические заболевания занимают 2-ое место после заболеваний сердечно-сосудистой системы. Поэтому поиск новых лекарственных противоопухолевых препаратов является одной из актуальных задач современной биологии и медицины. В настоящее время большое количество работ посвящено созданию новых лекарственных противоопухолевых препаратов на основании достижений молекулярной биологии (Richard J.P. et al, 2003; Takeshima К. et al, 2003; Jyotika A. et al., 2005, Копнин Б.П., 2000). Общепринято, что основополагающим признаком неопластической клетки является нарушение регуляции клеточного цикла и апоптоза (ChappuisP.O., Kapusta L., 2005). Известно, что регуляция процессов пролиферации клетки контролируется путем последовательной активации циклинов и соответствующих циклин-зависимых киназ (CDK). Активность циклиновых киназ определяется уровнем экспрессии соответствующих циклинов и активностью специфических ингибиторов циклиновых киназ (Kastan M.B., Bartek J., 2004). Имеется несколько семейств ингибиторов циклиновых киназ. Наиболее изученными и практически важными из них являются p16INK4a, p21CIP/KIP, p27 KIP1 (Lowe S.W. et al., 2004). Мутации или гиперметилирование промоторов генов ингибиторов циклиновых киназах наблюдаются в 40-60% случаев злокачественных лимфом, раке поджелудочной железы и ряде других злокачественных новообразований (Sawyers С, 2004; Ortega S. и др., 2002). Основываясь на этих результатах, был синтезирован ряд низкомолекулярных ингибиторов циклиновых киназ, часть из которых проходит их экспериментальное изучение (Ross M.F., Murphy M.P., 2004) а один UCN-1 проходит первую фазу клинических исследований. Другим возможным направлением для создания ингибиторов циклиновых киназ может быть использование функциональных последовательностей из соответствующих внутриклеточных ингибиторов (Ziegler A. et al 2005). Белок р 16 INK4a является одним из наиболее интересных кандидатов группы ингибиторов Cdk (Xu D. et al., 2004; Zhang Y. etal., 2005). Известно, что белок p16INK4a ингибирует циклин-зависимые киназы D и тем самым прохождение G1 фазы клеточного цикла (Fu G.H. et al., 2005; Ben-Saadon R. et al., 2004). Показано, что его функция нарушена при широком спектре онкологических заболеваний (Li J.Q. et al., 2004). В последнее время стали появляться экспериментальные работы, описывающие применение гена p16INK4a для генной терапии опухолей различного генеза (Lee A.W.C.,Li J-H et. al. 2003; Liu S.X., Tang S.Q., Liang C.Y., 2003;Zhang Y., Liu J. et al. 2005). Дополнительным мотивом к поиску технологий применения естественных белковых ингибиторов пролиферации стало открытие коротких последовательностей аминокислот(n=15-30), способных выполнять векторные (транспортные) функции в отношении пептидных последовательностей и соединений другой химической природы (РНК, ДНК) (Fawell S., Seery J. et al., 1994; VivesE., Brodin P., Lebleu B. 1997; Kaplan I.M. et al., 2005; Gupta B. et al., 2005; Fernandez-Carneado J. et al.,2005). До настоящего времени проблему восстановления нарушенной функции внутриклеточных белков пытались решать на основе методов доставки гена (генная терапия). Однако эта технология до настоящего времени не получила широкого выхода в клиническую практику из-за ряда принципиальных проблем. Альтернативный способ решения этой задачи, основанный на технологии пептидных векторов, обладающих способностью проникать в клетки, не повреждая плазматическую мембрану, является весьма перспективным ввиду слабой иммуногенности таких соединений и способности переносить достаточно крупные молекулы. Соединение возможности целевой доставки пептидов в клетку и обнаружение коротких функциональных доменов в белках, регуляторах различных клеточных функций, создали предпосылки для конструирования молекул имеющих патогенетическую направленность (Schutze-Redelmeier М.Р. и др., 2004;Trehin R., Merkle H.P., 2004; Cong-Mei Wu и др., 2004). Относительная простота синтеза таких молекул-1 017179 позволяет говорить о принципиальной возможности создания индивидуальных химиопрепаратов на их основе, т.е. влияющих на патологические изменения, свойственные данной конкретной опухоли (PereaS.E. и др., 2004). Открытие пептидов, способных проникать в клетку без участия мембранных белков и способных осуществлять внутриклеточный транспорт связанных с ними белковых фрагментов и олигонуклеотидов открывает новый этап в развитии биологии и медицины. Одним из эффективных переносчиков крупных молекул внутрь клеток является пептид pAntp. Его свойства известны, в частности, из публикацийproteins in mammalian cells.// Nat. Biotechnology. 19 (2001) 1173-1176. В документе US 6569833 B1 (Cyclacel Limited, GB) раскрываются пептиды, которые связываются с циклиновыми киназами и включают аминокислотные остатки 84-103 полноцепочечного белка р 16 и могут быть объединены с последовательностью транспортного белка пенетратина посредством дисульфидной связи, образующейся между остатками цистеина, специально присоединенными к С-концу пептида р 16 и N-концу пептида Antp. Недостатком данного подхода является необходимость избирательного и многоступенчатого синтеза химерной молекулы, что усложняет схему получения целевого продукта и увеличивает общие временные затраты на синтез. Процитированные публикации свидетельствуют о том, что ингибирование циклиновых киназ может иметь решающее значение для генной терапии опухолей различного генеза. В отношении терапевтических средств на основе пептидов, которые связываются с циклиновыми киназами и объединены с последовательностью транспортного белка, характерны определенные проблемы, связанные с биологической доступностью и стабильностью. Поэтому существует необходимость в разработке новых терапевтических средств, обладающих антипролиферативной активностью в отношении конкретных онкологических заболеваний. В основу настоящего изобретения была положена задача получить фармацевтическую композицию,обладающую антипролиферативной и цитотоксической активностью, за счет выраженного синергетического эффекта при совместном использовании химерного пептида с уже существующими химиотерапевтическими противоопухолевыми препаратами, такими, как таксол, 5-фторурацил, этопозид. Техническим результатом настоящего изобретения является улучшение биологического эффекта в сравнении с известными из уровня техники решениями, который заключается в усилении цитотоксического и цитостатического действия средства на клетки опухолей. Технический результат достигается благодаря получению фармацевтической композиции, обладающей антипролиферативной и цитотоксической активностью, которая включает два активных вещества, где первым активным веществом является химерный пептид, содержащий функциональную 20 аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a (SEQ ID NO: 1),или аминокислотную последовательность из белка-ингибитора p21/CIP/KIP (SEQ ID NO: 6) и транспортную последовательность. В качестве второго активного вещества используется химиотерапевтическое противоопухолевое средство, выбранное из группы, включающей таксол, 5-фторурацил, этопозид. В предпочтительном варианте осуществления фармацевтическая композиция предназначена для лечения онкологического заболевания, выбранного из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки,рак предстательной железы, рак желудка и рак яичника. В наиболее предпочтительном варианте осуществления фармацевтическая композиция может быть использована для лечения колоректального рака. В другом варианте осуществления настоящее изобретение относится к применению указанной фармацевтической композиции для получения лекарственного средства, предназначенного для лечения онкологических заболеваний. В предпочтительном варианте осуществления указанная фармацевтическая композиция может применяться для лечения онкологических заболеваний, выбранных из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника. В другом варианте осуществления настоящее изобретение относится к способу лечения онкологического заболевания, который включает введение млекопитающему, нуждающемуся в таком лечении,вышеуказанной фармацевтической композиции. В предпочтительном варианте осуществления вышеуказанного способа, онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы,рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника. Краткое описание фигур Фиг. 1. Сканирование клеточной линии А 549, инкубированной в течение 15 мин с пептидом с использованием лазерного сканирующего микроскопа LeicaTCS SP2 (Предоставлен Одесским государственным медицинским университетом). На фиг. изображены клетки, в которых химерный пептид pAntp-2 017179 р 16-ФИТС виден как светящиеся точки. Фиг. 2. Распределение белка pAntpp16 в клетках А 549 во времени. Через 1, 15 и 30 минут после добавления белка. Лазерный сканирующий микроскоп Leika. Фиг. 3. Кинетика накопления ФИТЦ- меченого пептида p16pAntp в лимфоциты периферической крови in vitro. Ось X - время в у.е., ось Y - интенсивность флуоресценции (у.е.). Фиг. 4. Динамика накопления ФИТЦ меченного химерного пептида pAntpp16 на примере клеточной линии Jurkat. Стрелкой указано время добавления химерного пептида в кювету проточного питометра. Фиг. 5. Зависимость интенсивности внутриклеточной флуоресценции и концентрации препарата в среде. Первый пик отражает интенсивность флуоресценции при добавлении к клеточной культуре Raji химерного пептида Antpp16 меченного ФИТЦ, в концентрации 0,1 мкМоль, инкубация с пептидом 15 минут в темноте; второй и третий пики - изменение интенсивности внутриклеточной флуоресценции при изменении внеклеточной концентрации пептида на 1 и 10 мкМоль, соответственно. Фиг. 6. Зависимость интенсивности флуоресценции клеток и внеклеточной концентрации химерного пептида. Фиг. 7. Пример ДНК-гистограмм, полученных методом проточной цитофлуриметрии. По оси X интенсивность флуоресценции, по оси Y - количество клеток. Частицы, находящиеся в области перед расположением диплоидных клеток (преддиплоидный пик), являются апоптозными фрагментами клеток. Их количество пропорционально уровню апоптоза в анализируемой клеточной популяции. А - контрольные клетки А 549; Б- клетки, обработанные pAntp-p16 (40 мкМ). 24 часа инкубации. Фиг. 8. Пример ДНК-гистограмм, полученных методом проточной цитофлуриметрии с использованием программы ModFit LT 3.0; А - контрольные клетки А 549, Б - клетки, обработанные pAntp-p16(5 мкМ). На фиг. указаны фазы клеточного цикла G0/G1, S, G2/M. По площади занимаемого данной фазой пика программа Modfit LT 3.0 высчитывает относительное количество клеток в фазе. Фиг. 9. Зависимость средних значений фаз клеточного цикла от концентраций пептидов. А - интернализируемые пептиды с активным центром p16INK4a, Б -интернализируемые пептиды с активным центром р 21. При концентрации пептидов 40 мкМоль наблюдается изменение в соотношении фаз клеточного цикла, достоверно отличающееся от контрольного образца. Фиг. 10. Зависимость средних значений уровня апоптоза от концентраций пептидов. При концентрации исследуемых химерных пептидов уровень апоптоза значимо отличается от контроля. Фиг. 11. Синхронизация клеточных культур. Рисунок А -распределение фаз клеточного цикла для несинхронизированной культуры клеток; В - синхронизированная в G0G1-фазе культура методом обедненной среды; С - синхронизация в S - фазе с помощью методики двойного тимидинового блока; D синхронизация в G2M - фазе инкубацией с Taxol. Фиг. 12. Выход из синхронизации и изменение процентного соотношения клеток, находящихся в разных фазах клеточного цикла для НЕК 293 клеточной линии, синхронизированной в G0G1 - фазе. Фиг. 13. Влияние химерных пептидов, включающих фрагмент p16INK4a, на прохождение клеточного цикла в синхронизированной культуре клеток НЕК 293. А -изменение количества клеток в G0G1 фазе, В - изменение количества клеток в S - фазе клеточного цикла. Ось X - время инкубации, часы; осьY - количество клеток, находящихся в определенной фазе клеточного цикла, %. Фиг. 14. Влияние химерного пептида, включающего фрагмент р 21 и интернализуемую последовательность Tat, на прохождение клеточного цикла в синхронизированной культуре клеток НЕК 293. А изменение количества клеток, находящихся в S- фазе клеточного цикла. В - изменение количества клеток, находящихся в G2M - фазе клеточного цикла. Ось X - время инкубации, часы; ось Y - количество клеток, находящихся в определенной фазе клеточного цикла, %. Фиг. 15. Распределение по фазам клеточного цикла для синхронизированной НЕК 293 клеточной линии при добавлении химерных пептидов с активными центрами р 21 и р 16. Время инкубации 24 ч. Максимальные различия между контрольными и опытными образцами для р 21 - 10 - 12 ч, для р 16 - 8-10 ч. Средние значения по шести удачным экспериментам. Фиг. 16. Средние значения апоптоза для синхронизированной культуры клеток НЕК 293 в ряде экспериментов с использованием интернализируемых пептидов с активными центрами р 21 и р 16. Время инкубации с пептидом составляло 24 ч. Концентрация пептидов - 40 мкМоль. Ось Y - % апоптотических частиц. Фиг. 17. Средние значения уровня апоптоза в зависимости от времени инкубации для контрольных образцов, образцов с фрагментом p16INK4a и образцов с фрагментом р 21. Ось X - время инкубации, осьY - процент апоптотических частиц. На фиг. виден четкий максимум в уровне апоптоза в образцах с пептидами с активным центром р 16 после 10 ч инкубации. Фиг. 18. Влияние химерных пептидов с функциональной группой p16INK4a на прохождение фаз клеточного цикла. Средние значения по 5 удачным экспериментам для пептида pAntpp16 (A - изменение фазы G0/G1 при инкубации клеток с химерным пептидом pAntpp16, Б - изменение фазы S, пептид взят в концентрации 40 мкМоль) и средние значения по 3 удачным экспериментам для пептида Tatp16(С - изменение фазы G0/G1 при инкубации клеток с химерным пептидом Tatp16, Д - изменение фазы S,-3 017179 пептид взят в концентрации 40 мкМоль). Фиг. 19. Распределение по фазам клеточного цикла для синхронизированной НЕК НЕК 293 клеточной линии при добавлении химерных пептидов с активными центрами р 16 и пептидными векторамиpAntp (фиг. 20 А) и Tat (фиг. 20 Б). Моменты максимальных различий между контрольными и опытными образцами для pAntpp16 -10 ч, для Tatp16 - 12 ч. Средние значения по шести экспериментам. Концентрация пептидов - 40 мкМ. Фиг. 20. Средние значения апоптоза в синхронизированной культуре НЕК 293 при добавлении химерных пептидов Tatp16 и pAntpp16. На фиг. показан уровень апоптоза, который регистрируется после снятия блока синхронизации в синхронизированной в G0/G1-фазе культуре НЕК 293, в момент снятия блока добавлялись исследуемые пептиды, и эффект оценивали через 24 ч. Фиг. 21. Изменение уровня апоптоза в культурах клеток в зависимости от времени при инкубации с пептидами Tatp16 и pAntpp16. Фиг. 22. Влияние химерных пептидов pAntp, содержащих фрагмент p16INK4a, на клеточный цикл. А - несинхронизированная клеточная линия - НЕК 293, Б -синхронизированная в S-фазе клеточная линия- НЕК 293. Концентрация пептидов -40 мкМ. pAntp и трех пептидов 1,2,3, где 1 и 2 это синтетические петиды, отличающиеся расположением 20-аминокислотного фрагмента р 16 относительно pAntp и 3 - это генноинженерный пептид, включающий вставку из 50 аминокислот из белка Antp. Фиг. 23. Влияние химерных пептидов pAntp, содержащих фрагмент p16INK4a, на клеточный цикл. А - несинхронизированная клеточная линия - 549, Б -синхронизированная клеточная линия - 549. Концентрация пептидов - 40 мкМ. pAntp -pAntpzam. Фиг. 24. Влияние химерных пептидов, содержащих фрагмент p16INK4a, на изменение уровня апоптоза в несинхронизированной и синхронизированной клеточной линии А 549, концентрация пептидов 40 мкМ. По оси Y -% апоптозных тел. Фиг. 25. Влияние химерных пептидов, содержащих фрагмент p16INK4a, на изменение уровня апоптоза в несинхронизированной и синхронизированной клеточной линии НЕК 293, концентрация пептидов- 40 мкМ. По оси Y -% апоптозных тел. Фиг. 26. Сравнения цитотоксического влияния химерных пептидов pAntpp16(1, 2) на НЕК 293 клеточную культуру. Фиг. 27. Изменение уровня фиксации антител к недофосфорилированному pRB, полученных методом проточной цитофлуорометрии. А 549 клеточная линия, синхронизированная обедненной средой, через 4 часа после снятия блока синхронизации. А - изотипический контроль, В - окраска на pRb, указана зона клеток, в которых Rb находится в фосфорилированном состоянии. Контрольный образец. Фиг. 28. Процент фосфорилированного pRb, в зависимости от времени инкубации для контрольных образцов и образцов с пептидом pAntpр 16 (40 мкМ). А - клеточная линия А 549, В - клеточная линия НЕК 293. Ось X - время инкубации (час), ось Y - % клеток с фосфорилированным pRb. Фиг. 29. Исследование синтеза циклина В в культуре клеток НЕК 293 при добавлении пептидаTatp16 (30 мкМоль). На фиг. 30 А представлено изменение уровня циклина В в контрольном образце и в образце инкубированном с химерным пептидом Tatp16 в синхронизированной в G0/G1-фазе клеточной культуре НЕК 293 после снятия блока синхронизации. На фиг. 30 В. показано изменение количества клеток, находящихся в G2/М-фазе клеточного цикла в том же эксперименте. Ось X - время инкубации (час),ось Y - условные единицы. Фиг. 30. Сочетанное действие химиопрепаратов 5-фторурацила, этопозида и таксола в концентрациях 100 нМоль и химерного пептида pAntpp16 (2) в концентрации 40 мкМоль. Распределение по фазам клеточного цикла культуры клеток А 549 через 24 ч инкубации совместно с химиопрепаратом и исследуемым пептидом. Рисунок А -сочетанное действие 5-фторурацила и химерного пептида; рисунок Б сочетанное действие этопозида и пептида pAntpp16 (2); В - сочетанное действие таксола и химерного пептида. Фиг. 31. Цитотоксическое воздействие химиопрепаратов Таксол и Этопозид в концентрациях 100 нМоль и химерного пептида pAntpp16 (2) в концентрации 40 мкМоль, сочетанное воздействие. Ось Y % частиц. Фиг. 32. показаны фотографии экспериментальных животных на момент 7 инъекции исследуемого интернализуемого пептида P16Antp. А и В - фотографии мышей с перевитыми клетками А 549, А мышь из контрольной группы на 16 день эксперимента, опухоль имеет размер 6,07,0 мм. В - мышь из опытной группы на 16 день эксперимента при введении P16Antp в дозе ОД мг, опухоль размером 3,03,0 мм. Фигуры С и D - мыши с перевитыми клетками НСТ-116, С - мышь из контрольной группы на 18 день после перевивки опухолевых клеток (опухоль размером 11,513,5 мм). D - мышь из опытной группы после 7 инъекций P16Antp в дозе 0,1 мг, опухоль размером 4,54,5 мм. Фиг. 33. Количество выживших клеток (линия SBR3 -рак молочной железы) оценка по МТТ тесту. Каждая точка среднее по трем лункам. По оси X - концентрация химиопрепарата. Верхний график - таксол+пептид. Средний - этопозид+пептид. Нижний -5 фтор-урацил+пептид. На каждом графике три кривых - для трех концентраций пептидов. Концентрации химиопрепаратов 1, 10, 30 мкМ. Концентрации-4 017179 пептида - 0.1, 1, 10 мкМ. Фиг. 34. Двухпараметрическая цитограмма клеток молочной железы. По оси X -окраска PI, по осиY- окраска цитокератином. Регион - цитокератин-положительный апоптоз указан стрелкой. Осуществление изобретения Исследовали свойства 6 химерных пептидов, включающих различные интернализуемые последовательности и функциональные группы, ответственные за ингибирование циклиновых киназ. В качестве интернализуемых векторов были использованы последовательности из белков Antennapedia (pAntp) антеннапедия, выполняет морфогенетическую функцию формирования антенны у мухи DrosophiliaMelanogaster; и интернализуемая последовательность Tat - белок, выполняющий трансактиваторную функцию у вируса СПИДа. В качестве функциональных групп исследовались последовательность из белка p16INK4a - ингибитора циклиновых киназ типа D и последовательность PVKRRLDL - имеющая большую степень гомологии с функциональным фрагментом ингибитора циклиновых киназ р 21. Большая часть последовательностей была получена методом твердофазного синтеза (табл. 3), одна последовательность получена генноинженерным способом. Данный пептид отличается большей длиной фрагмента, выполняющего транспортную функцию, так как имеет вставку из 44 аминокислот из белка Antennapedia, которая по литературным данным не имеет каких-либо функциональных нагрузок. Необходимость увеличения длины пептидной последовательности является следствием практических ограничений на минимальный размер экспрессируемого белка в E.coli. Так, как предполагаемым внутриклеточным эффектом исследуемых пептидов является ингибирование циклиновых киназ, был синтезирован контрольный пептид (Antpzam), содержащий аналогичную последовательность из белка p16INK4a (АКП 82-102) с заменой 92 тирозин - на 92 аланин. Данная замена была выбрана потому, что ранее в работе Ferouse et al., было показано, что замены 91 или 92 АКО приводят к утрате этим пептидом ингибирующей способности, свойственной для последовательностиp16INK4a. Таблица 1. Структура исследуемых интернализируемых пептидов. Пептиды 1-3 состоят из функциональной части p16INK4a и ингернализуемой последовательности pAntp и отличаются по местоположению функциональной группы относительно N-, С- концов молекулы и по наличию вставки для пептида 3 (получен генноинженерным методом). Пептид Antpzam (4) содержит последовательность из белкаp16INK4a (АКП 82-102) с заменой 92 тирозин - 92 на аланин. Данная замена была выбрана потому, что ранее в работе Ferouse et al.,98 было показано, что замены 91 или 92 АКО приводят к утрате этим пептидом ингибирующей способности, свойственной для этой последовательности. Пептиды 5 и 6 состоят из интернализуемой последовательности Tat и имеют разные функциональные группы p16NK4a и Одна из задач работы заключалась в изучении влияния положения функциональной группы и раз-5 017179 мера пептида на их биологическую активность, для этого были синтезированы три пептида pAntpp16 (13) (табл. 1). Пептиды pAntpp16 (1-2) отличаются местоположением функциональной группы p16INK4a: пептид 1 - p16INK4a расположен на С-конце молекулы, пептид 2 - p16INK4a расположен на N-конце,пептиды получены методом твердофазного синтеза. В случае химерного пептида pAntpp16(3), полученного генноинженерным методом, функциональная группа p16INK4a располагается на N-конце, но имеется вставка из 44 АКО. Кроме того, в исследования были включены как р 16+, так и р 16- культуры клеток. Экспрессия генов р 16 и р 53 для используемых в работе клеточных линий приведена в табл. 2. Цитотоксический эффект не зависел от экспрессии p16. Таблица 2 Пример 1. Изучение проникающей способности интернализуемых пептидов. Для регистрации проникновения пептидов внутрь клетки и исследования динамики накопления использовали идентичные химерные последовательности конъюгированные с флуоресцентной меткой флоуресцеин-изотиоцианатом (ФИТЦ). Т.к. включение молекул ФИТЦ в готовый полипептидный продукт часто приводит к существенному изменению его физико-химических свойств и потере физиологической активности, поэтому к исходной последовательности на N конце присоединялась молекула лизина, которая и несла одну молекулу ФИТЦ. Методом световой флуоресцентной микроскопии было показано, что изучаемые пептиды связываются с клетками и проникают в клеточные линии Raji, Jurkatt, A549, НЕК 293 и периферические лимфоциты крови человека. Методом проточной цитофлуорометрии было показано связывание пептида с клетками и отсутствие эффекта тушения флуоресценции трипановым синим. Что свидетельствует о накоплении пептида внутри клетки. Наиболее объективные данные о накоплении пептида внутри клетки были получены с использованием метода сканирующей лазерной микроскопии (фиг. 1). Белок, меченный флюоресцеинизотиоцианатом, был растворн в 0,9% NaCl. Клеточные линии А 549, НЕК 293 выращивались на предметных стерильных стклах и помещались в специальной камере непосредственно под окуляры микроскопа. Среда замещалась на среду с исследуемым белком. Насыщение белком наблюдали во времени. Кроме того, производилось послойное сканирование клеток с целью определения локализации пептида. Анализ полученных изображений при данном увеличении не выявил преимущественного расположения белка pAntp-p16 в клетке. Очевидно, что белок распределяется в компартментах клетки равномерно. Проникновение белка внутрь клетки происходит достаточно быстро. И уже через 15 мин инкубации можно наблюдать относительно гомогенное распределение его во внутриклеточном пространстве (фиг. 2). Скорость проникновения пептида в периферические лимфоциты крови человека, а также лимфоциты клеточных линий (Raji, Jurkatt) была оценена с использованием метода проточной цитофлуорометрии. Данный метод позволяет исследовать большие концентрации клеток во времени и удобен для оценки скорости проникновения исследуемого пептида. Измерялась флуоресценция лимфоцитов под действием белка р 16-pAntp-ФИТЦ при рН 7.5 и рН 6.0. Принцип метода основан на меньшем квантовом выходе флуоресценции ФИТЦ в растворах с более кислым рН. Так как скорость измерения происходит достаточно быстро, то значение рН внутри клетки не может измениться. Лимфоциты инкубировались с пептидом в течение 1-15 мин, после этого к ним сразу добавлялся 20 кратный объм фосфатного буфера с рН 6.0 и рН 7.5. При этом оценивалась разность интенсивности флуоресценции. В большинстве измерений интенсивности флуоресценции достоверно не отличались после 15 мин инкубации. Таким образом, можно предположить, что после 15 минут инкубации пептид полностью проникает внутрь клетки. Для исследования скорости накопления пептида внутри клетки использовали метод проточной цитофлуорометрии. Для этого меченный ФИТЦ пептид вводили непосредственно в измерительную пробирку проточного цитометра, что позволяло регистрировать динамику изменения флуоресценции клеток. Исследовалась мононуклеарная фракция лейкоцитов крови здоровых доноров, выделенная на градиенте фиколла. Видно, что посленебольшой лаг-фазы, происходит быстрое накопление пептида в клетках нормальных лимфоцитов. Конечная концентрация достигается за время равное 1 мин. На фиг. 3 показан только фрагмент кривой отражающий кинетику накопления химерного белка в клетке. Полученная кривая кинетики лучше описывается степенной функцией типа С= constl - const2t2+const3, что отражает коэффициент регрессии (=0,79). Похожая кинетика накопления пептида получена и для клеток злокачественных лимфом. В качестве-6 017179 моделей исследовались линии Jurkat (происходящая из лимфобластного лейкоза и имеющая Т-клеточный фенотип) и Raji -происходящая из В-клеточной лимфомы Беркита. На фиг. 4 показана динамика накопления меченого ФИТЦ пептида в клетках Jurkat. Приведенный график показывает, что и в опухолевые клетки пептид проникает с большой скоростью. Время достижения максимальной концентрации - менее 1 мин. Кинетика накопления исследовалась при комнатной температуре (t=20 C). Следует подчеркнуть, что механизм проникновения исследуемого класса пептидов до настоящего времени не известен. Однако показано, что накопление происходит одинаково эффективно даже при температуре +5 С и не связано с затратами энергии в клетке, не опосредуется клеточными рецепторами и не использует фаго- и пиноцитозный путь. Мы также подтвердили факт накопления синтезированного нами пептида, содержащего интернализуемый фрагмент, при разных температурах (до +5 С). Также исследовали зависимость накопившегося в клетках пептида от внеклеточной его концентрации. На фиг. 5 и 6 показано изменение интенсивности флуоресценции клеток в зависимости от внеклеточной концентрации. На фиг. 6 приведены те же данные, иллюстрирующие тот факт, что соотношение вне- и внутриклеточной концентрации имеет линейный характер (в исследованном диапазоне концентраций). Т.к. исследуемые пептиды могут преодолевать клеточную мембрану в обоих направлениях, можно предположить,что накопленные в клетке пептиды могут выходить из нее при снижении внеклеточной концентрации. Исследование процессов экспорта пептидов из клетки могут быть темой отдельных исследований. Таким образом, в результате проведенных экспериментов было показано, что кинетика накопления химерного пептида, содержащего интернализуемый фрагмент и фрагмент белка p16INK4a, имеет степенной характер с зависимостью типа С= const1+const2t2. Показано также, что динамика накопления и внутриклеточного распределения пептида в нормальных и опухолевых клетках не отличается по характеру и по скорости накопления. Пример 2. Сравнительная оценка функциональной активности пептидов, включающих активные центры p16INK4a и p21CIP/KIP. Одним из основных условий при конструировании химерных пептидов на основе белков - ингибиторов циклиновых киназ было наличие доказанных ингибирующих свойств для конкретных пептидных фрагментов. Поэтому в работе сравнивались фрагменты из белков p16INK4a и p21CIP/KIP, у которых такие последовательности описаны. Продукты генов р 16 и р 21 являются ингибиторами образования комплексов циклин - циклинзависимая киназа и, соответственно, являются регуляторами клеточного цикла. Поэтому при исследовании функции экзогенных химерных пептидов с функциональными группами р 16 и р 21, основное внимание уделялось исследованию пролиферативной активности и исследованию уровня апоптоза в культурах при их инкубации с интернализуемыми пептидами. В экспериментах с клеточными линиями оценивали распределение клеток по фазам клеточного цикла и рассчитывали индекс пролиферации. Для анализа использовали программу FloMax 2.0 (встроенная опция в проточном цитофлуориметре), а также программу Modfit LT 3.0 (фиг. 7, 8). Также производилось определение доли клеток, вступивших в апоптоз по величине пре-G1 - гиподиплоидного пика на ДНК гистограмме (фиг. 8(Б. Эксперименты проводились как на синхронизированных в фазе G1/S,так и не синхронизированных клеточных линиях Raji, Jurkatt, A549, НЕК 293, MCF-7. В ряде предварительных экспериментов с участием всех исследуемых пептидных последовательностей была установлена оптимальная концентрация пептидов, которая достигает 100 мкМ (фиг. 10), что предполагает возможную концентрацию препарата около 400 мг/кг. Однако уже при концентрации 40 мкМ наблюдается стойкий антипролиферативный эффект на всех исследуемых клеточных линиях, который значимо не меняется при увеличении концентрации препарата (фиг. 9). Количество живых клеток не снижается ниже 50%. Количество апоптотических частиц при данной концентрации и времени инкубации 24 часа составляет порядка 40% и увеличивается до 60% при увеличении концентрации до 50 мкМ(фиг. 10). Из фиг. 10 и 11 видно, что антипролиферативный и цитотоксический эффекты имеют концентрационную зависимость. На малых концентрациях до 5 мкМ эффект препарата проявляется очень слабо, хотя,как было сказано выше, пептид проникает в клетки при внеклеточной концентрации 0,1 мкМ. Таким образом, была подобрана концентрация, равная 40 мкМоль, которая удовлетворяла приведенным выше требованиям и была адекватна для всех исследуемых пептидов. Исследование влияния пептидов проводилось на перевивных культурах клеток. Для исследования изменения экспрессии конкретных внутриклеточных регуляторов и большей наглядности экспериментов клетки предварительно синхронизировали. В зависимости от метода синхронизации культуры клеток задерживаются в G0/G1, S или G2/M фазе клеточного цикла (фиг. 11). На фиг. 12 показано, как в синхронизованной в G0G1 - фазе культуре, меняется распределение клеток в разных фазах клеточного цикла после снятия блока синхронизации. В момент времени 0 (момент снятия блока синхронизации) большинство клеток находилось в G0G1-фазе (73%), а в фазах S и G2M -7 017179 15% и 8% соответственно, затем можно наблюдать, как происходит снижение G0G1-фазы и одновременно рост S-фазы, через определенный промежуток времени начинает увеличиваться процент клеток вG2 М-фазе. Данный характер выхода из блока синхронизации типичен для всех исследуемых клеточных культур, также следует отметить, что время удвоения всех исследуемых клеток составляло примерно 24 часа. Пример 3. Оценка антипролиферативной активности химерных пептидов с разными активными центрами На первом этапе оценки полученных результатов было проведено исследование влияния химерных интернализируемых пептидов с разными активными центрами -p16INK4a и p21CIP/KIP. К культуре клеток исследуемый химерный пептид добавлялся в момент снятия блока синхронизации. Анализ клеточного цикла проводился через каждые 2 ч в течение 24 ч после снятия блока. При исследовании антипролиферативной активности данных пептидов, установили, что пептиды с активным центром p16INK4a, вызывают задержку клеток в G0G1-фазе клеточного цикла (фиг. 13). Такой эффект более наглядно виден на культуре клеток синхронизированной в G0-фазе с помощью метода синхронизации обедненной средой. И регистрируется только при прохождении первого клеточного деления после снятия блока синхронизации. Из фиг. 13 видно, что в контроле (синхронизованные клетки без добавления химерного пептида),увеличение S - фазы наблюдается через 4 ч после отмены синхронизирующего фактора, также видно, что уменьшается G0G1 - фаза. При добавлении химерных пептидов с активным центром р 16 снижениеG0G1 и рост S происходят позже, чем в контроле, G0G1 начинает снижаться после 6 часов инкубации, а видимый рост S - фазы можно наблюдать после 8 часов инкубации. При исследовании химерного пептида p21Cip/Kip (фиг. 14) было обнаружено, что измененияG0G1-фазы в контроле не отличаются от таковых в образце с пептидом, однако, высокий уровень Sфазы в опытном образце (65-70%) остается до 14 ч инкубации, в то время как в контрольном образце уровень S-фазы начинает снижаться уже после 10 ч инкубации и к 14 ч инкубации составляет в среднем 45%. Уровень G2 М-фазы в образце с пептидом достигает максимального значения в среднем после 1820 ч инкубации, а в контроле после 10-12 ч. Таким образом можно сделать заключение, что основной антипролиферативный эффект пептида с активным центром p21Cip/Kip-задержка перехода клеток из S вG2M фазу (фиг. 14). Как и в случае с химерными пептидами, включающими фрагмент p16INK4a, для более наглядной иллюстрации эффекта, вызываемого пептидом Tatp21, нами была выбрана синхронизация в GO-фазе с помощью обедненной среды. Как видно из фиг. 13 и 14, в определенный момент времени можно выявить максимальные различия между фазами клеточного цикла в контрольных и опытных образцах. Для исследуемых пептидов время максимальных различий составляло 8-12 ч с момента снятия блока синхронизации. Если учитывать, что накопление пептида внутри клетки происходит в течение нескольких первых минут после внесения пептида во внеклеточную среду, то можно предположить, что наблюдаемый эффект связан с моментом воздействия активного центра химерного пептида на геном клетки, для пептидов с активным центром р 16,максимальные отличия наблюдаются на момент 8-10 ч инкубации, а для пептида с активным центром р 21 - 10-12 ч (фиг. 15). Возможно, это небольшое отличие связано с тем, что, как уже обсуждалось выше,р 16 вызывает задержку перехода G1 - S, а р 21 задержку S - G2M перехода. Пример 4. Исследование влияния на уровень апоптоза химерных пептидов, включающих функциональные группы р 16INK4 а и р 21CIP/KIP. Одной из основных тенденций при разработке противоопухолевых препаратов является поиск лекарственных средств, способных избирательно индуцировать апоптоз в опухолевых клетках. Апоптоз является генетически контролируемым процессом. В большом количестве работ показана связь ухода клетки в апоптоз с невозможностью преодолеть одну из контрольных точек (chiek-point) при прохождении клеткой фаз пролиферации. Мы показали, что исследуемые химерные пептиды способны активировать апоптоз в различных клеточных линиях (фиг. 16). При исследовании различий цитотоксического эффекта от структуры активного центра было обнаружено, что химерные пептиды, включающие функциональную последовательность из белка p16INK4a,обладают более выраженным цитотоксическим эффектом по сравнению с пептидами, включающими последовательность из р 21CIP/KIP. При сравнении средних величин апоптоза для пептидов Tatp21 и пептидов pAntpp16 совместно с Tatp16 было установлено, что достоверных отличий между контрольными и образцами с пептидом Tatp21 нет (фиг. 16). Анализируя уровень апоптоза в зависимости от времени инкубации с пептидом, для пептидов с активным центром p16INK4a была установлена зависимость уровня апоптоза от времени инкубации. В случае химерного пептида с фрагментом р 21 такой зависимости получено не было. Как видно из фиг. 17,уровень апоптоза при исследовании пептидов, включающих фрагмент р 16, имеет некий максимум, который расположен на 8-10 ч инкубации, и т.о. совпадает по времени с вызываемой им задержкой перехода-8 017179 Пример 5. Исследование влияния структуры пептидного вектора на примере Tat и pAnt. Нами были исследованы два типа пептидных переносчиков - Tat и pAntp. В главе обзор литературы обсуждались структура и особенности данных векторов. Исследовались химерные пептиды, несущие активный центр p16INK4a и имеющие разные типы векторов - Tat и pAntp. Исследуя влияние типа вектора на процессы пролиферации клетки, было обнаружено, что исследуемые Tatp16 и pAntpp16 влияют на одинаковые фазы клеточного цикла, вызывая задержку G1-S перехода. Как видно из фиг. 18, графики зависимости количества клеток в фазах клеточного цикла близки по виду для обоих типов пептидных векторов, несущих фрагмент р 16. В контрольных образцах -синхронизированная культура клеток без добавления исследуемого пептида, количество клеток в G0/G1-фазе начинает снижаться уже через 2 ч после снятия блока синхронизации, а через 10 ч регистрируется наименьшее количество клеток в G0/G1 фазе. S-фаза в контрольных образцах начинает расти после 4-6 ч отмены блока синхронизации и достигает максимума в 12 ч. В образцах с химерными пептидами, как видно из фиг. 18, наблюдается задержка в G0/G1-фазе. Так, при инкубации с пептидамиpAntpp16, уровень фазы G0/G1 начинает снижаться после 6-8 ч инкубации и достигает наименьшего уровня через 14 ч, а уровень S-фазы начинает возрастать после 10 ч инкубации. В случае с химерным пептидом Tatp16, четких переходов в возрастании S и убывании G0/G1 фаз нет, убывать G0/G1 начинает вместе с G0/G1-фазой контрольного образца, однако ее уровень снижается более медленно, чем в контроле. S-фаза в образце с исследуемым пептидом Tatp16 начинает увеличиваться после 12 ч инкубации и имеет максимум на 14 ч инкубации с пептидом. В контрольных образцах максимум S-фазы регистрируется через 12 ч после снятия блока синхронизации.PAntpp16 и Tatp16 оказывают одинаковую по времени задержку пролиферации клетки, максимальные различия в контрольных и опытных образцах соответствуют примерно 12 ч инкубации (фиг. 19). Данный временной интервал в контрольной группе отражает переход G1-S. Таким образом, можно предположить, что в случае с химерными пептидами с активным центром p16INK4a, структура вектора не влияет на оказываемый антипролиферативный эффект пептида. При оценке влияния структуры пептидного вектора на оказываемый цитотоксический эффект наблюдали, что в случае с химерным пептидом pAntpp16, уровень апоптоза в образцах выше, чем при инкубации с пептидом Tatp16 (фиг. 20). Индуцируемый добавлением исследуемого химерного пептида к культуре апоптоз зависит от клеточной линии и от апоптоза в контрольном образце. В клеточных линиях А 549 и MCF-7 уровень апоптоза в контрольных образцах находится на уровне 5%, а при инкубации с химерным пептидом Antpp16 увеличивается в среднем до 25%. В линиях Raji, Jurkat в контрольных образцах уровень апоптоза составляет 12%, в образцах с пептидом - 35%. У клеток линии НЕК 293 апоптоз в контроле имеет самый высокий уровень и составляет около 20%, при инкубации НЕК 293 клеточной линии с химерным пептидом Antpp16 в течение 24 ч апоптоз увеличивается до 60%. Концентрация пептидов - 40 мкМ. Ось Y - % апоптотических частиц. Из фиг. 20 и 21 видно, что как pAntpp16, так и Tatp16 вызывают апоптоз у большего числа клеток, чем в контрольных образцах. Максимальный уровень апоптоза в образцах с пептидами наблюдается после 24 ч инкубации, однако было замечено, что хотя уровень апоптоза увеличивается в зависимости от времени инкубации, увеличение количества апоптотических частиц не происходит равномерно. При исследовании изменений уровня апоптоза в зависимости от времени инкубации образцов с пептидами были обнаружены временные отрезки, для которых характерно усиленное образование апоптотических телец. Так, при инкубации синхронизированной культуры клеток НЕК 293 с химерными пептидами pAntpp16 точками с увеличенным апоптозом являются 2 и 10 ч инкубации, а с пептидом Tatp16 - 6 и 16 ч (фиг. 21). Наличие таких временных отрезков с усилением апоптоза характерно для всех исследованных культур, причем эти максимумы апоптоза для исследованных клеточных культур находятся в примерно одинаковых временных интервалах и отличаются по уровню апоптоза (фиг. 21). А - НЕК 293 клеточная линия синхронизированная в G0/G1-фазе после снятия блока синхронизации и добавления исследуемых пептидов. Б - А 549 клеточная линия синхронизированная в G0/G1-фазе после снятия блока синхронизации и добавления исследуемых пептидов. Ось X - время инкубации, ось Y - количество апоптозных частиц, %. Пример 6. Исследование влияния положения и размера пептидного вектора на антипролиферативную активность химерных пептидов. В работе использовались три варианта химерных пептидов, содержащих активный центр p16INK4a и вектор- pAntp. Отличаются данные химерные пептиды по месту расположения активного центра относительно N-C концов молекулы и по наличию вставки из 44 аминокислот (SERKRGRQTYTRYQTLELEKEFHFNRYLTRRRRIEIAHALCLTE) для пептида 3, полученного генно-инженерным методом(табл. 1). При исследовании свойств данных пептидов также исследовались синхронизированные и несинхронизированные клеточные культуры. В синхронизированную культуру пептид добавлялся в момент снятия блока синхронизации, в несинхронизированную - при плотности монослоя (для адгезионных культур) 50%.-9 017179 Результаты по изменению распределения клеток по фазам клеточного цикла для пептидов pAntpp16INK4a (1,2,3) приведены на фиг. 22 и 23. Как видно из фиг. 26, при добавлении контрольного пептидаpAntpzam к синхронизированным и несинхронизированным клеткам, изменения фаз клеточного цикла в опытных образцах не отличается от контроля. Добавление химерного пептида (1) (табл. 1), содержащего фрагмент p16INK4a, также не вызывает ожидаемого цитостатического эффекта. Как в случае синхронизированной, так и несинхронизированной культуры распределение клеток по фазам клеточного цикла практически не отличается по сравнению с контролем. Однако добавление пептидов 2 и 3 приводит заметному снижению S - фазы, при этом также возрастает количество клеток в G0/1. Более четко это видно в экспериментах на синхронизированных культурах. Эксперименты, проведенные на клеточной линии А 549 (фиг. 23), обнаружили сходные изменения клеточного цикла для всех исследованных пептидов. Полученные результаты указывают, что химерный пептид pAntp-p16INK4a (1) не оказывает антипролиферативного действия на клетки. В то время как добавление химерных пептидов pAntp-p16INK4a(2 и 3) оказывает антипролиферативный эффект на клетки и приводит к увеличению клеток, находящихся в фазе G1. Отсутствие цитостатического эффекта при добавлении химерного пептида 1 возможно связано с изменением конформации пептидной молекулы из-за расположения интернализующей последовательности pAntp с N - конца химерного пептида (в случае пептидов 2 и 3, pAntp расположен с С - конца). На следующем этапе работы проводилась оценка зависимости цитотоксического эффекта, оказываемого исследуемыми химерными пептидами с пептидным вектором pAntp. Эксперимент по определению уровня апоптоза проводили на клеточных линиях А 549 (человек, карцинома легкого), НЕК 293 (человек, почка эмбриона) и MCF-7 (человек, аденокарцинома молочной железы). Клетки культивировали по стандартной методике в среде DMEM, содержащей 10% ФСБ. Часть клеток была предварительно синхронизирована, используя методики двойного тимидинового блока и методику синхронизации с помощью обедненной среды (см. "Эксперимент, части"), В культуральную среду добавляли исследуемые химерные пептиды pAntp-p16 (1 и 2). В качестве отрицательного контроля использовали клетки обработанные пептидом pAntpzam (фиг. 24, 25). Как видно из фиг. 24, 25, на уровень апоптоза не влияет добавление контрольного пептидаpAntpzam, в то время как добавление pAntp-p16 (1, 2) заметно увеличивает количество клеток, вошедших в апоптоз. При этом отличий в величине эффекта в зависимости от типа клеток (для линий А 549 и НЕК 293) не обнаружено. Сравнение влияния пептидов pAntp-p16 1 и 2 на уровень апоптоза для клеточной линии НЕК 293 представлено на фиг. 26. На фиг. 26 видно, что зависимость количества апоптозных тел от концентрации pAntp-p16 имеет степенной характер. Сравнение уровня апоптоза при добавлении химерных пептидов, показало, что уровень апоптоза в случае добавления пептида 2 практически в 2 раза выше уровня апоптоза в эксперименте с химерным пептидом 1. Более выраженный цитотоксический эффект наблюдается на синхронизированной культуре. Таким образом, обнаружено, что химерные пептидыpAntp 1 и 2, содержащие фрагмент p16INK4a, обладают выраженными цитотоксичеческими действиями по отношению к культурам клеток. При сравнении цитотоксического и цитостатического действия химерных пептидов pAntp-p16 1 и 2,можно сделать вывод, что изменение положения интернализуемой последовательности pAntp в химерном пептиде с С - конца на N - конец приводит к исчезновению цитостатического эффекта и снижению цитотоксического эффекта. Пример 7. Исследование изменения количества фосфорилированного pRb при инкубации клеточных культур с химерными пептидами. Одной из задач работы было доказать, что антипролиферативные эффекты исследуемых пептидов связаны со специфическим действием фрагментов ингибиторов циклиновых киназ, входящих в их структуру. Хотя в литературе и описано сохранение игибирующих свойств таких пептидов на фосфорилирующую функцию циклинзависимых киназ, эти подтверждения получены на клеточных экстрактах. Мы провели исследование изменения уровня фосфорилирования pRB - молекулярной мишени циклиновых киназ D типа на фоне действия исследуемых пептидов - включающих ингибирующие последовательности из соответствующих белковых ингибиторв p16INK4a и р 21. Активация в клетке собственного p16INK4a приводит к ингибированию фосфорилирования pRb. Накопление недофосфорилированного pRb приводит к ингибированию E2F1 и снижению экспрессии циклинов А и В, что является одним из ключевых механизмов в остановке клеточного цикла. По количеству фосфорилированного pRb можно судить об активности р 16. Метод проточной цитометрии позволяет визуализировать клетки, в которых продукт pRb находится в "недофосфорилированном" ("undephosphorylated") состоянии. Меченные флуоресцентной меткой антитела взаимодействуют с "недофосфорилированным" pRb. На фиг. 27, А - изотипитический контроль,нужный для исключения неспецифической флуоресценции, В - контрольный образец, в котором в части клеток pRb находится в недофосфорилированном состоянии. Для определения количества "недофосфорилированного" pRb был проведен ряд экспериментов, к синхронизированным методом обедненной среды культурам клеток после снятия блока синхронизации- 10017179 добавлялись исследуемые химерные пептиды, затем клетки снимались через каждые два часа. С каждой чашки часть клеток фиксировалась для дальнейшего определения фаз клеточного цикла, а часть по методике, описанной в разделе "Материалы и методы", для определения количества "недофосфорилированного" pRb. Также был поставлен отрицательный контроль в виде образцов синхронизированных клеток,но без добавления пептидов. Было показано, что внесение в культуру клеток химерного пептида вызывает задержку фосфорилирования pRb и снижает его максимальный уровень в культуре (фиг. 28). Как видно из фиг. 28, начальный уровень "недофосфорилированного" pRb примерно одинаковый в контроле и в опытных образцах, но после снятия блока синхронизации в образцах без добавления химерных пептидов его уровень начинает расти и к определенному моменту (4 или 6 ч инкубации), в зависимости от клеточной линии, достигает максимального значения, а затем начинает снижаться. В образцах с химерным пептидом уровень "недофосфорилированного" pRb начинает увеличиваться позднее и достигает своего максимального значения через 8 ч инкубации, причем это значение ниже, чем в контрольных образцах. Пример 8. Исследование изменения уровня экспрессии мРНК циклина В с помощью методики RTPCR. Известно, что фосфорилирование рРВ является пусковой стадией для активации экспрессии циклинов А и В и перехода клетки из G1 в S фазу клеточного цикла. Методом количественной ПЦР был исследован уровень экспрессии мРНК для циклина В при воздействии пептида Татр 16. Для этого в ходе эксперимента на синхронизированной культуре при добавлении химерного пептида Tatp16 в концентрации 40 мкМоль параллельно производили отбор клеток из образцов для выделения РНК, а часть клеток шла на определение фаз клеточного цикла. Дальнейшая обработка материала - выделение РНК и постановка реакции количественной ПЦР (RT-PCPL), шла по протоколу. На фиг. 29 показано, полученное с помощью методики количественной ПЦР, изменение количества мРНК циклина В, которое отражает изменение уровня экспрессии циклина В, фиг. 29 А. И приведено изменение количества клеток в G2/М-фазе клеточного цикла, фиг. 29 В, полученное с помощью проточной цитофлуориметрии. Из фиг. 29 видно, химерный пептид Tatp16 вызывает задержку экспрессии циклина В и, соответственно, задержку перехода S-G2. Из результатов, приведенных на рисунке 14. В видно, что количество клеток в G2 - фазе в контрольном образце имеет максимум на 12 ч инкубации, а в образце с пептидом увеличение G2 - фазы происходит только к 16 часам инкубации. На фиг. А показано изменение уровня экспрессии циклина В, видно, что в контроле также имеется максимум на 12 ч, который совпадает с максимумом клеток в G2-фазе. В образце с пептидом Tatp16 уровень экспрессии возрастает к 16 ч инкубации. Добавление пептида приводит к задержке экспрессии циклина В. Таким образом было подтверждено, что наблюдаемый цитостатический эффект, связан с влиянием на процесс фосфорилирования рРВ и,как следствие, на торможение экспрессии циклинов. Пример 9. Исследование сочетанного действия химерных пептидов и химиопрепаратов. В медицинской практике при лечении злокачественных новообразований широко используются химиопрепараты - цитостатики. Их эффект основан на том, что клетки под их воздействием останавливаются на определенной фазе клеточного цикла, а сочетанное введение препарата, обладающего цитотоксической активностью на этой фазе цикла, позволяет добиться гибели большого числа клеток. Исследуемые химерные пептиды обладают, как было показано, цитостатической и цитотоксической активностью. Причем, цитостатическая активность специфична и является результатом непосредственного влияния пептида на геном клетки. Однако, как было показано выше, эффект воздействия химерного пептида на культуру клеток недостаточен для получения терапевтически значимых результатов. Вследствие этого было предложено исследовать сочетанное действие интернализируемых пептидов и химиопрепаратов. Были исследованы следующие химиопрепараты, применяемые в медицинской практике и влияющие на клеточный цикл: Таксол, вызывающий задержку клеток в фазе G2M, Этопозид - задержка в Sфазе и 5-фторурацил - задержка в G0G1-фазе клеточного цикла. Наиболее информативные результаты при сочетанием действии химиопрепаратов и химерных пептидов были получены при применении пептида pAntpp16 (2) (Фиг. ЗЗ). В предварительных экспериментах на клеточных линиях НЕК 293 и А 549 получили ожидаемые эффекты задержки клеточного цикла на фазах, характерных для каждого исследуемого препарата, и подобрали оптимальную концентрацию, которая позволяет наблюдать эффект, не вызывая тотальную гибель клеток. Данная концентрация для всех препаратов составила 100 нМоль. При исследовании сочетанного воздействия химиопрепаратов и химерного пептида pAntpp16 (2) наблюдали усиление цитостатического действия для препаратов 5-фторурацил и Этопозид - увеличениеG0G1 (фиг. 30 А) и S (фиг. 30 Б) - фаз соответственно. При совместной инкубации клеток с pAntpp16 и Таксолом - снижение G2 М-фазы по сравнению с образцами с Таксолом, увеличение G0G1-фазы (фиг. 30 В) и усиление цитотоксического влияния. На фиг. 30 показано изменение фаз клеточного цикла при сочетанном действии химиопрепаратов и исследуемых пептидов. Также было показано, что при сочетанном применении химиопрепаратов и исследуемых химерных пептидов происходит усиление цитотоксического эффекта. При инкубации клеток с химиопрепаратом и- 11017179 химерным пептидом происходит увеличение уровня апоптоза относительно уровня апоптоза в образцах только с химиопрепаратом. Также был определен уровень погибших клеток, который высчитывался по количеству живых клеток в образцах с помощью камеры Горяева. Уровень мертвых (погибших) клеток возрастает в образцах, инкубированных с химиопрепаратом и с исследуемым пептидом. На фиг. 31 приведены результаты цитотоксических эффектов при сочетанном применении химиопрепаратов и химерного пептида pAntpp16 (2). При исследовании сочетанного воздействия химиопрепаратов и исследуемых пептидов pAntpp16,было установлено, что происходит значительное усиление цитотоксической активности исследуемых химиопрепаратов. Цитотоксический сочетанный эффект напрямую зависит от характера цитотоксического эффекта химиопрепарата. Пример 10. Исследование противоопухолевой активности химерного пептида p16Antp in vivo (местное введение). На бестимусных мышах (Nude) исследовалась противоопухолевая активность химерного интернализуемого пептида P16Antp. Мышам были перевиты опухолевые культуры клеток человека линий А 549 и НСТ-116 в количестве около 1 млн. клеток на мышь. 39 мышам были привиты клетки А 549, из них 20 мышей составили контрольную группу, им в дальнейшем вводили плацебо. 10 мышей составили 1 опытную группу. Им после образования пальпируемой опухоли (через 4 дня после перевивки клеток) стали вводить непосредственно в опухоль исследуемый пептид в дозе 0,1 мг. 9 мышей составили 2 опытную группу, им также после образования опухолевого узла на 4 день перевивки стали вводить в ложе опухоли по 0,2 мг пептида. Пептид в опытных группах вводили один раз в два дня. Эксперимент продолжался 24 дня. В опытных группах наблюдали снижение темпов роста опухолей и на 6 день после начала введения пептида можно наблюдать заметное снижение объема опухолей в опытных группах по сравнению с контрольной (фиг. 32). Эксперимент продолжался 24 дня. За это время в опытных группах было проведено 10 инъекций химерного пептида. В контрольной группе на 24 день эксперимента средний объем опухолей у мышей составил 95,24 мм 3, одна мышь погибла. В первой опытной группе (доза вводимого пептида- 0,1 мг) средний объем опухолей составил 39,29 мм 3, одна мышь погибла. Во второй опытной группе(доза вводимого пептида - 0,2 мг) средний объем опухолей составил 57,51 мм 3, но погибших животных не было. При введении мышам перевивной культуры человека НСТ-116 животных разделили на две группы: контрольная - 10 мышей, которым в последующем не вводили исследуемый пептид и опытная группа (10 мышей), которым вводили исследуемый химерный пептид P16Antp в дозе 0,1 мг в область опухолевого узла. Эксперимент продолжался 28 дней, было сделано в опытной группе 11 инъекций пептида, первая инъекция была сделана на 6 день после перевивки опухолевых клеток. Опухолевый узел из клеток НСТ 116 отличался большими размерами и наличием изъязвлений. В контрольной группе на 28 день эксперимента средний объем опухолей составил 679 мм 3, за время эксперимента погибло 3 мыши. В опытной группе отмечался более низкий темп роста опухоли (фиг. 32), на 28 день эксперимента средний объем опухолей составил 225,4 мм 3, погибших животных в опытной группе было 2. На фиг. 32 представлены пары мышей из разных групп после 7 проведенных инъекций исследуемого пептида. Видно заметное уменьшение опухолевого узла в опытных группах. Таким образом, местное введение химерного пептида p16-Antp приводит к достоверному (более 50%) торможению роста экспериментальных моделей опухолей человека (рак молочной железы, колоректальный рак). Пример 11. Исследование цитотоксических свойств химерных пептидов на краткосрочных культурах опухолей человека. Исследовалась противоопухолевая активность химерных пептидов, включающих интернализуемый фрагмент Antp и функциональные фрагменты ингибиторов циклиновых киназ p16INK4a(DAAREGPLDTLVVLHRAGAR-S-RQIKIWFQNRRMKWKK (SEQ ID NO.3. Были синтезированы 150 мг пептида p16-Antp методом твердофазного синтеза (см. раздел методы). Для исследования эффектов на опухолях человека использовали метод краткосрочных культур. Методика получения краткосрочных культур опухолей из операционного материала. Краткосрочные культуры получали из операционного материала. Забор участка для приготовления культуры проводился по возможности в кратчайшие сроки после операции и с участием патологоанатома. Вырезался участок ткани, в среднем 1,5 см 3. Ткань механически размельчалась, суспензия клеток помещалась в среду RPMI, содержащую 5% ФБС. Через 24 ч инкубации при 37 С и 5% CO2, среда заменялась на среду, содержащую химерный пептид (p16Antp в концентрации 40 мкМоль), либо для ряда экспериментов на Таксол в концентрации 100 нМоль или 500 нМоль, содержащую и пептид и Таксол. В контрольных образцах среда заменялась на свежую. Снималась первая точка - 0 ч. Инкубация проходила при 37 С и 5% CO2 24 ч, для ряда экспериментов 24 и 48 ч. Оценивали результаты методом проточной цитофлуориметрии с использованием двойной окраски образцов AnnexinV-PI и окраски фиксированного материала PI. Оценивали уровень частиц, положитель- 12017179 ных по AnnexinV (ранний апоптоз), уровень частиц, положительных по двойной метке AnnexinV-PI(поздний апоптоз), количество частиц в нефиксированных образцах, способных включать PI (некроз); распределение клеток по фазам клеточного цикла, уровень субдиплоидного пика (количество частиц с фрагментированной ДНК, апоптоз). Для выявления апоптоза эпителиальных клеток использовали двойную окраску антитела к цитокератину-ФИТЦ - PL (фиг. 35). Всего проанализировано 126 образца ткани: из них 63 - образца патологических тканей (и 63 образца нормальных тканей в качестве контролей). Из 63 патологических образцов было исследовано опухолей злокачественного генеза 47 (10 - рак молочной железы, 15 - рака почки, 6 рака матки, 4 рака предстательной железы, 3 рака яичника и рака легкого и по 2 случая рака желудка, рака поджелудочной железы,мочевого пузыря.) Кроме того, исследовались образцы ткани фиброаденом (N=9), а также 7 образцов ткани молочной железы при простой протоковой гиперплазии. Уровень апоптоза анализировали через 24 и 48 ч после добавления пептидов в концентрации 40 мкМ. Часть экспериментов провели для изучения сочетанного цитотоксического действия на клетки опухоли традиционных химиотерапевтических препаратов и пептида p16Antp. Пример 12. Исследование противоопухолевой активности пептида p16Antp. Суммарные результаты по цитотоксической активности пептида p16Antp приведены в табл. 3. Таблица 3. Средний уровень индуцированного апоптоза в краткосрочных культурах опухолей при воздействии пептида p16Antp. (24 час, 40 мкМ) Анализ полученных результатов показывает, что наиболее чувствительными формами рака для цитотоксического действия пептида p16Antp являются: рак почки, молочной железы, желудка, мочевого пузыря. Следует отметить, что для краткосрочных культур рака мочевого пузыря характерен очень высокий уровень спонтанного апоптоза (до 60-70%). Несмотря на то что добавление пептида повышает этот уровень незначительно, на этом фоне полученные результаты могут иметь нерепрезентативный характер. Пример 13. Исследование цитотоксического действия на клетки фиброаденомы молочной железы. Исследовали образцы тканей фиброаденомы молочной железы. В краткосрочных культурах этих клеток при невысоком уровне спонтанного апоптоза (максимальный до 20 %, средний 12,8%) пептид р 16 оказывал существенное цитотоксическое действие и вызывал выраженный апоптоз через 24 ч со средним уровнем 38,2 % при максимально до 80%. Менее выраженное цитотоксическое действие было обнаружено для клеток молочной железы, имеющих признаки простой протоковой гиперплазии (средний уровень индуцированного апоптоза 14,5%). Эти результаты согласуются с полученными автором данными по изучению соотношения активности пролиферации и уровня спонтанного апотоза в патологических тканях молочной железы. Было показано, что соотношение пролиферации и спонтанного апоптоза наиболее высоко для ткани фиброаденомы, а клетки рака молочной железы по этому показателю находятся на втором месте, далее следует простая протоковая гиперплазия и ткань нормальной молочной железы. Если одним из факторов, определяющих чувствительность клеток к цитотоксическому действию пептидов,содержащих ингибиторы пролиферации, является активность клеточного деления, то чувствительность клеток фиброаденомы к пептиду p16Antp является вполне логичной. Обнаруженный эффект чувствительности доброкачественных пролиферативных процессов в ткани молочной железы может оказаться перспективным для их лечения. Результаты по локальному введению пептидов для лечения перевивных солидных опухолей позволяют предположить эффективность их при локальном введении в область доброкачественных пролиферативных процессов в тканях молочной железы. Полученный результаты позволили выявить спектр чувствительных к пептиду p16Antp опухолей- 13017179 человека. Обнаружено, что такие локализации, как рак молочной железы, колоректальный рак, рак желудка, рак мочевого пузыря, рак почки, являются перспективными объектами для дальнейшего изучения цитотоксического (противоопухолевого) действия изучаемого пептида. Полученные результаты являются новыми, т.к. в доступной литературе нет данных по изучению влияния анализируемого пептида на опухоли человека. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для лечения гиперпролиферативных заболеваний, включая онкологические заболевания, обладающая антипролиферативной и цитотоксической активностью, включающая: а) химерный пептид, содержащий функциональную последовательность из белка-ингибитора циклиновых киназ p16INK4a (SEQ ID NO: 1) или p21/CIP/KIP (SEQ ID NO: 6) и транспортную последовательность, которые соединены между собой посредством группы X, где X представляет собой аминокислотную последовательность, содержащую от 1 до 50 аминокислотных остатков; б) терапевтически активное вещество, выбранное из группы, включающей 5-фторурацил, этопозид; в) фармацевтически приемлемые носители. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника. 3. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a, SEQ ID NO: 1 и транспортную 16-аминокислотную последовательность из белкаAntp, SEQ ID NO: 2. 4. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a, SEQ ID NO: 1 и транспортную 11-аминокислотную последовательность из белкаTat, SEQ ID NO: 5. 5. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид содержит функциональную 8-аминокислотную последовательность из белка-ингибитора р 21/CIP/KIP, SEQ ID NO: 6 и транспортную 11-аминокислотную последовательность из белка Tat, SEQID NO: 5. 6. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 3. 7. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 4. 8. Фармацевтическая композиция по п.1, отличающаяся тем, что входящий в ее состав химерный пептид имеет аминокислотную последовательность, SEQ ID NO: 7. 9. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит химерный пептид в количестве до 400 мг/кг. 10. Применение фармацевтической композиции по п. 1 для получения лекарственного средства для лечения онкологических заболеваний. 11. Применение по п.10, при котором онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника. 12. Способ лечения онкологического заболевания, включающий введение млекопитающему, нуждающемуся в таком лечении, фармацевтической композиции по п.1 в терапевтически приемлемой дозе. 13. Способ по п.12, в котором онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
МПК / Метки
МПК: A61K 38/16, A61P 35/00
Метки: фармацевтическая, применение, композиция, гиперпролиферативных, заболеваний, лечения
Код ссылки
<a href="https://eas.patents.su/30-17179-farmacevticheskaya-kompoziciya-dlya-lecheniya-giperproliferativnyh-zabolevanijj-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция для лечения гиперпролиферативных заболеваний и ее применение</a>
Предыдущий патент: Единая система идентификации изделий, продукции или услуг original и способ идентификации изделий, продукции или услуг
Следующий патент: Новая кристаллическая модификация фипронила и ее применение
Случайный патент: Ограждение