Фармацевтическая композиция для лечения вирусных заболеваний
Формула / Реферат
1. Применение 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоты, индивидуального оптического изомера или фармацевтически приемлемой соли её в качестве активного ингредиента для получения фармацевтической композиции для ингибирования репликации респираторно-синцитиального вируса у человека.
2. Применение по п.1, отличающееся тем, что фармацевтическая композиция находится в виде дозы, содержащей от 5 до 50 мг активного ингредиента.
3. Применение по п.1, отличающееся тем, что фармацевтическая композиция предназначена для лечения острого бронхита или вирусной пневмонии.
4. Применение по п.1, отличающееся тем, что фармацевтическая композиция дополнительно содержит, по меньшей мере, один фармацевтически приемлемый носитель или наполнитель.
5. Применение по любому из пп.1-4, отличающееся тем, что фармацевтическая композиция находится в форме, пригодной для орального применения.
6. Применение по п.5, отличающееся тем, что фармацевтическая композиция находится в виде таблеток, капсул, порошков, эликсиров, сиропов, растворов или суспензий.
7. Применение по любому из пп.1-4, отличающееся тем, что фармацевтическая композиция находится в форме, пригодной для ректального применения.
8. Применение по п.7, отличающееся тем, что фармацевтическая композиция находится в форме суппозиториев.
9. Применение по п.6, отличающееся тем, что фармацевтическая композиция находится в виде раствора или суспензии, содержащей, по меньшей мере, 0,1 вес.% активного ингредиента.
10. Применение фармацевтической композиции, содержащей 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусную кислоту, индивидуальный оптический изомер или фармацевтически приемлемую соль её в качестве активного ингредиента в терапевтически эффективном количестве и фармацевтически приемлемый носитель, для ингибирования репликации респираторно-синцитиального вируса у человека.
Текст
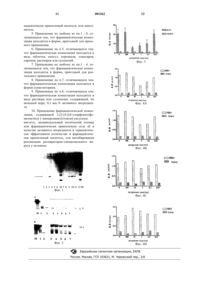
1 Данное изобретение относится к области фармацевтических композиций и методов лечения вирусных заболеваний человека. Более конкретно, данное изобретение относится к фармацевтическим композициям для лечения заболеваний, вызванных респираторно-синцитиальным вирусом (RSV). Хорошо известно, что рецидивирующие вирусные инфекции дыхательных путей увеличивают чувствительность по отношению к одному или нескольким антигенам с повышенными уровнями иммуноглобулинов Е, см., например, Oscar L. FRICK в J. Allergy Clin. Immunol.(November 1986), pp. 1013-1018. Кроме того,основным вирусом, вызывающим стридор у человека, и особенно у детей, является респираторно-синцитиальный вирус. Последний особенно часто наблюдается у детей в возрасте до 2 лет, у которых он вызывает бронхит и пневмонию. Т. CHONMAITREE et al. в Journal of Infections Diseases, vol. 164 (3), pp. 592-594 (1991) показывает, что мононуклеарные лейкоциты нормальных индивидуумов вырабатывают гистаминоген, гистамин-рилизинг фактор (HRF), (в ответ) при попадании в организм респираторных вирусов, полагая, что этот цитокин может играть роль в механизме вызванного вирусом бронхоспазма. Однако эти авторы также показали, что этот HRF, по-видимому, отличается от большинства других цитокинов, таких как интерлейкины-1-6, 8 и 9 или факторы роста гранулоцитов.R. С. WELLIVER et al. в New England Journal of Medicine vol. 305 (15), pp. 841-846 (1981) показывает, что специфичные относительно респираторно-синцитиального вируса (RSV) иммуноглобулины Е наряду с гистамином обнаружены у большинства младенцев с различными формами вызванного RSV респираторного заболевания и со стридором (затрудненным шумным дыханием). Однако прямой корреляции между титрами RSV-IgE и количеством образовавшегося (выделяемого) гистамина нельзя было провести. Существует много теоретических механизмов, по которым вирусы могли бы вызывать или обострять воспаление нижних дыхательных(воздухоносных) путей. Помимо альвеолярных макрофагов, при респираторно-синцитиальной вирусной инфекции наблюдается перибронхиальная инфильтрация нейтрофилов. Нейтрофилы представляют собой не только клетки, способные фагоцитировать и высвобождать низкомолекулярный медиатор воспаления, они также обладают способностью (потенциалом) секретировать множественные провоспалительные(предшествующие воспалению) цитокины. Недавно были описаны новые цитокины, названные хемокинами, как активирующие воспалительные клетки, см., например, Piotr KUNA вBook (1995) pp. 23-31. В этом семействе хемокинов интерлейкин-8 (IL-8) является мощным хемотактическим фактором полиморфоядерных клеток. Этот хемокин, согласно В. KОNIG et al. в Journal of Leukocyte Biology (July 1996), в больших количествах вырабатывается человеческими полиморфонуклеарными клетками при респираторно-синцитиальной вирусной инфекции. В другом исследовании, опубликованном(1995), приводится доказательство того, что в мононуклеарных клетках периферической крови синтезируется и секретируется провоспалительный цитокин IL-8 с последующим инфицированием респираторно-синцитиальным вирусом(RSV) даже в малых дозах. Авторы этого исследования полагают, что высвобождение мощного хемотоксина IL-8 мононуклеарными клетками периферической крови может быть ответственным за явно выраженное аккумулирование полиморфоядерных гранулоцитов в альвеолярном пространстве при вызванном RSV бронхите. Н.Р. HECKERT et al. в Berliner Мnсhnеr Тiеrrzi Wschr. Vol. 106 (7), pp. 230-235 (1993) обсуждает способ лечения бычьей RSVинфекции. Помимо антибиотиков изучалось действие антигистаминного препарата дифенилгидрамина путем измерения внутренней температуры тела. В случае ежедневного применения антигистаминного препарата в качестве дополнения к антибиотикам температура тела животных снижалась значительно быстрее. Однако эта работа строго ограничивается лишь бычьимRSV и, с другой стороны, в ней нет удовлетворительного объяснения механизмов действия каждого составляющего приведенной комбинации. Относительно терапии нужно сказать, что нет специфического способа лечения респираторно-синцитиальных вирусных инфекций. Более того, хорошо известно, что некоторые лекарства, применяемые при терапии аллергии и астмы (кортикостероиды, теофиллин, кетотифен), оказывают ингибирующее воздействие на клетки, непосредственно участвующие в механизмах иммунной защиты, повышая таким образом риск бактериальной и вирусной инфекции. Таким образом, целью данного изобретения является создание фармацевтических композиций для лечения заболеваний, вызванных респираторно-синцитиальным вирусом у человека. В основе данного изобретения лежит неожиданное обнаружение того факта, что известное вещество 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусная кислота,индивидуальный оптический изомер или его фармацевтически приемлемая соль, проявляет заметный ингибирующий эффект в отношении вирусной репликации одновременно с ингибирующим эффектом вызванной RSV модифика 3 ции клеток (образование IL-8). Более того, этот фармакологический эффект имеет место без ослабления иммунной системы больного. Было обнаружено наличие неожиданного защитного эффекта при терапии заболеваний,таких как острый бронхит или вирусная пневмония, вызванных у человека респираторносинцитиальным вирусом, по методу, который включает введение индивидууму при необходимости такой терапии, фармацевтической композиции, содержащей в качестве активного ингредиента эффективное количество, по меньшей мере, одного соединения, выбранного из 2-[2-[4[(4-хлорфенил)фенилметил]-1-пиперазинил] этокси]-уксусной кислоты, индивидуального оптического изомера или его фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль", употребляемый в данном описании по отношению к 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоте,означает не только соли присоединения нетоксических органических или неорганических кислот, таких как уксусная, лимонная, янтарная,аскорбиновая, соляная, бромисто-водородная,серная и фосфорная кислоты и тому подобное,но также соли металлов (например, калиевая или натриевая соли), аммониевые соли, включая соли четвертичных аммониевых оснований и соли аминокислот. Термин "индивидуальный оптический изомер", применяемый в данном описании означает е левовращающий и правовращающий энантиомеры (оптические изомеры). Как хорошо известно в технике, очистка таких энантиомеров является достаточно трудным процессом,зависящим от выбранного способа получения соединения и от чистоты исходного вещества. Следовательно, термин "индивидуальный оптический изомер", применяемый в данном смысле означает, что указанное соединение содержит,по меньшей мере, 90%, предпочтительно, по меньшей мере, 95 вес.% указанного индивидуального (право- или левовращающего) оптического изомера и, самое большее, 10%, предпочтительно, не более 5 вес.% другого индивидуального (соответственно, лево- или правовращающего) оптического изомера. Каждый индивидуальный оптический изомер может быть получен (выделен) из смеси рацематов с применением известных методов, например, таких,которые раскрываются в патентной заявке Великобритании 2,225,321. Кроме того, каждый индивидуальный оптический изомер может быть приготовлен из смеси рацематов путем ферментативного биокаталитического расщепления, как например, раскрывается в патентах США 4,800,162 и 5,057,427. Наиболее предпочтительными активными ингредиентами по данному изобретению являются рацемат 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусная кислота 4 и е соль дигидрохлорид, которая представляет собой антагонист гистаминовых H1-рецепторов,хорошо известный под названием цетиризиндигидрохлорид, и его левовращающий и правовращающий энантиомеры. Для воплощения данного изобретения описанная выше композиция (состав) должна содержать эффективное количество 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоты, е фармацевтически приемлемой соли или е индивидуального оптического изомера. Эффективное количество может быть легко определено с помощью соответствующих методов и наблюдений за результатами, полученными в аналогичных обстоятельствах. При определении эффективного количества принимается во внимание ряд факторов, включая следующие, но не ограничивается только ими: вид больного; его размеры, возраст и общее состояние здоровья; его специфические заболевания; степень заболевания или тяжести болезни; реакция конкретного больного; конкретное вводимое соединение; выбранная дозировка; и применение сопутствующего лечения. Эффективное количество 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоты, е фармацевтически приемлемой соли или их индивидуального оптического изомера в композиции по данному изобретению обычно меняется от, примерно, 0,1 миллиграмма на килограмм веса тела в день(мг/кг/день) до примерно 0,5 мг/кг/день. Предпочтительный прием (доза) составляет от около 5 мг до примерно 50 мг, предпочтительно один или два раза в день. Состав по данному изобретению может назначаться больному в любой форме и любым способом, который делает композицию биодоступной в эффективных количествах, а именно,путем орального введения. Например, е можно вводить перорально, через нос, ректально. Обычно предпочитают вводить перорально. Специалисты в области приготовления рецептур могут легко выбрать соответствующую форму и способ введения в зависимости от конкретных характеристик болезненного состояния, которое должно подвергаться лечению, стадии заболевания и других релевантных обстоятельств. Композиции по данному изобретению могут содержать 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусную кислоту,е фармацевтически приемлемую соль или их индивидуальный оптический изомер - отдельно или в сочетании, по меньшей мере, с одним фармацевтически приемлемым носителем или наполнителем, соотношение и природа которого определяется растворимостью и химическими свойствами выбранной композиции, выбранным путем введения и стандартной фармацевтической практикой. Материал носителя может быть твердым,полутвердым или жидким, могущим служить в 5 качестве носителя или среды для активного ингредиента. Соответствующие материалы для носителей хорошо известны в технике. Фармацевтические композиции по данному изобретению можно применять для перорального введения и назначать больным в форме таблеток,капсул, порошков, эликсиров, сиропов, растворов, суспензий и тому подобное. Фармацевтическая композиция по данному изобретению может быть адаптирована для ректального применения, и тогда она назначается больному в форме суппозиториев. Материал носителя выбирают так, чтобы он соответствовал предполагаемой форме введения и согласовывался с обычной фармацевтической практикой. Например, для орального введения в форме таблеток или капсул терапевтически активные лекарственные компоненты могут объединяться с любым оральным нетоксическим фармацевтически приемлемым инертным носителем, таким как лактоза или крахмал. Фармацевтическая композиция по данному изобретению может, но не обязательно, содержать также связующее, например микрокристаллическую целлюлозу, смолу трагаканта или желатин; разрыхлитель, например альгиновая кислота; смазки, например стеарат магния; вещества,облегчающие проглатывание, например коллоидный диоксид кремния; подсластители, например сахароза или сахарин; красители или вкусовые добавки, например мята перечная или метилсалицилат. Из-за простоты введения таблетки и капсулы представляют собой наиболее предпочтительную форму стандартной дозы для орального применения. По желанию таблетки могут быть покрыты, с помощью водных и неводных методов, сахаром, шеллаком или другими подходящими для желудочно-кишечного тракта агентами, образующими оболочку. Желательно, чтобы каждая таблетка или капсула содержала от примерно 5 мг до примерно 50 мг активного ингредиента. Для орального введения с целью терапии композиции по данному изобретению могут быть в виде раствора или суспензии. Эти препараты должны содержать, по меньшей мере, 0,1% весовых активного ингредиента композиции по данному изобретению. Такие растворы или суспензии могут также содержать один или более следующих адъювантов: стерильный разбавитель, например такой как вода для инъекций, физиологический солевой раствор, масла, полиэтиленгликоли,глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, например, бензиловый спирт; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, например диаминтетрауксусная кислота; буферы, например ацетаты, цитраты или фосфаты; и агенты для повышения тонуса, например хлористый 6 натрий или декстроза. Препарат можно поместить в ампулы или флаконы для многократных доз из стекла или пластика. Далее изобретение поясняется ссылками на следующие примеры, подробно описывающие композиции по данному изобретению, а также их полезность. Хотя данное изобретение описано и проиллюстрировано несколькими предпочтительными формами его воплощения, специалисты в данной области поймут, что различные изменения, модификации и замены могут в них быть произведены без утраты сущности изобретения. Например, могут применяться эффективные дозы активных ингредиентов иные, нежели предпочтительные интервалы, представленные вышев данном описании, в соответствии с изменениями чувствительности индивидуума, лечение которого проводится, тяжести симптомов,вызываемых дозой побочных эффектов, если таковые наблюдаются, и другие подобные соображения. Соответственно, такие ожидаемые вариации или различия в применении данного изобретения и полученные при этом результаты также находятся в соответствии (входят в объм) с целями и практикой данного изобретения. Материалы и методы Буфер Буфер, применяемый для отмывания полиморфоядерных клеток, содержал 137 мМNaCl, 8 мМ Na2HPO4, 3 мМ КСl и 3 мМ КН 2 РO4,рН 7,4 (модифицированный по Дульбекко физиологический раствор, буферизованный фосфатом). Для получения стимуляции (раздражения) клетки суспендировали в среде RPMI 1640(Gibco BRL, Eggenstein, Germany). Получение полиморфоядерных (PMN) нейтрофильных гранулоцитов Человеческие гранулоциты выделяли из 200 мл гепаринизированной крови (15 Ед/мл) здоровых доноров, фракционированной градиентным центрифугированием в Фиколлметризоате с последующим осаждением декстраном и двукратным отмыванием (накопленного) количества 300 г. Этот метод дал PMN с чистотой более 95%. Клетки разводили до конечной плотности 1 х 106 PMN. Жизнеспособность клеток Жизнеспособность клеток изучали методом исключения трипанового синего, анализом лактатдегидрогеназы (Boehringer, Mannheim,Germany), а также определением митохондриальной активности с помощью WST-1 (Boehringer, Mannheim, Germany) у стимулированных и нестимулированных клеток. Анализы проводили так, как описано производителем(Boehringer, Mannheim, Germany). Все эксперименты проводили в условиях, при которых жизнеспособность видов клеток во всех трх аналитических системах было выше 80%. 7 Культура клеток Эпителиальные клетки Нер-2, эпителиальная опухолевая клеточная линия - АТСС CCL23- были получены из Американской Коллекции Культур Клеток и культивировались при 37 С в 5%-ной двуокиси углерода в модифицированной по Дульбекко среде Игла, содержащей 5% термоинактивированной эмбриональной телячьей сыворотки, 4 мМ L-глутамина и 80 мкг/мл гентамицина. Клетки пересевали дважды в неделю. Получение вируса Получение вируса осуществляли, как описано R. ARNOLD et al. в Immunology, 82. 126133 (1994). Для исходного препарата выращивали респираторно-синцитиальный вирус (RSV),Long Strain (АТСС), и титровали в клетках НЕР 2. Титр RSV определяли анализом (бляшкообразования-подсчтом) бляшкообразующих единиц(PFU). Титр исходного раствора вирусного пула(для разведения), используемого в исследовании, составлял 5 х 106 PFU/мл. Исходный раствор до момента использования хранили при 70 С. Содержание интерлейкина-8 (IL-8) в исходном растворе было ниже предела обнаружения при анализе методом твердофазного иммунноферментного анализа (ELISA). Отсутствие микоплазмы определяли с помощью микоплазма-специфичного PCR. Эксперименты по стимуляции Если не указано иначе, человеческие PMN(1 х 106/мл) обрабатывали различными количествами RSV (103-107) бляшкообразующих единиц [PFU], соответствующими множественности инфекции [m.o.i.] от 0,001 до 10 в объеме 1 мл среды RPMI-1640 для указанных временных интервалов. Термостатирование осуществляли в отсутствие или в присутствии дигидрохлорида цетиризина в указанных концентрациях. Надосадочные жидкости клеток в экспериментах по стимуляции отделяли центрифугированием и хранили при -70 С до момента использования в анализе. Надосадочные жидкости (супернатант) клеток использовали для обнаружения IL-8; клеточный осадок применяли для определения геномной рибонуклеиновой кислоты (РНК)PMN суспендировали в среде RPMI с концентрацией 1 х 106/мл. Клетки культивировали в присутствии соответствующего стимулятора до 24 ч. Супернатанты культур собирали и анализировали содержание IL-8. Секрецию IL-8 определяли, применяя сэндвич-ELISA согласно методу, указанному в данном описании выше. Коротко говоря, в каждой лунке 96-луночного планшета (Nunc Maxisorb, Roskilde, Denmark) в течение ночи адсорбировали при 4 С 100 мкл буфера/полиоксиэтилен-сорбит монолаурат(продукт, продаваемый под торговым названиемTWEEN 20) (0,1%), содержащего антитела против IL-8 с концентрацией 5 мкг/мл. Плашки от 001262 8 мывали трижды системой буфер/Tween, добавляли соответствующие образцы стандарта IL-8(рекомбинантный человеческий IL-8; Calbiochem, Bad Soden, Germany) и термостатировали 2 ч при 37 С. Затем добавляли конъюгированные со щелочной фосфатазой антитела против(15 мг/мл) были использованы для количественного определения (планшет)-ридер ELISA, а для расчетов программное обеспечение Mikrotek(SLT Labinstruments, Crailsheim, Germany). Анализ геномной РНК RSV Анализ RSV-специфичной геномной РНК проводился путем определения с помощью обратной транскрипции, сопряжнной с полимеразной цепной реакцией PCR, геномной РНКRSV, кодирующей гидрофобный белок малого размера (SH) RSV, как ранее описано R.(1994). Тотальную РНК как неинфицированных,так и RSV-инфицированных PMN (1 х 106) экстрагировали Тризолом (Gibco, Niedereggenstein,Germany). Тотальную РНК растворяли в 30 мкл Н 2 О. Экспрессию геномной РНК RSVSH анализировали после обратной транскрипции с помощью смысловых праймеров и PCRамплификации транскриптов кДНК. На стадии обратной транскрипции реакционная смесь (конечный объем 20 мкл) содержала 10 мМ ТрисНСl (рН 8,3), 50 мМ КСl, 5 мМ MgCl2, 1 мМ дезоксинуклеотидов, 100 пМ смысловых праймеров для RSVSH, 10 Ед ингибитора РНК-азы, 10 мкл образца РНК и 200 Ед обратной транскриптазы вируса лейкемии Moloney-Murine (Gibco,Eggenstein, Germany). Реакции обратной транскрипции проводили в течение 60 мин при 37 С. С целью PCR-амплификации продуктов кДНК реакционные смеси смешивали с 50 пМ смысловых и антисмысловых праймеров и 2 Ед полимеразы Tag (Gibco, Eggenstein, Germany). Продукты 20, 25 и 30 циклов (1 мин 94 С; 2 мин 53 С; 3 мин 72 С) анализировали на агарозном геле и проявляли, окрашивая этидиумбромидом. Соответствующие праймеры для RSVSH представляли собой: смысловой 5'-ACCAATGGACTATGTGTTG-3'. Предсказанный размер продукта амплификации был 204 пар оснований дляARNOLD et al. Статистический анализ Если не указано иначе, все приведнные данные представляют собой средние значения,по мeньшей мере, трх отдельных экспериментов с клетками трх различных доноров. Влияние цетиризина на синтез RSVспецифичной РНК Недавно мы показали, что RSVспецифичная геномная РНК находится внутриPMN до 24 ч. Мы проанализировали влияние цетиризина на экспрессию RSV-специфичной мРНК после стимуляции человеческих PMN с 9 помощью RSV. С этой целью в первой серии экспериментов человеческие PMN (1 х 106/мл) были обработаны RSV с m.o.i. 1-, 0,5-, 0,050,005- в течение 2 ч, а также в течение 16 ч. Результаты этих экспериментов изображены на фиг. 1. Человеческие PMN (1 х 106/мл) были оставлены необработанными (дорожки 1,2 и 7,8) или были обработаны с помощью RSV (1 m.o.i.: дорожки 3,9; 0,5 m.o.i: дорожки 4,10; 0,05 m.o.i: дорожки 5,11; 0,005 m.o.i: дорожки 6,12) в течение 2 часов (дорожки 1-6), а также в течение 16 ч (дорожки 7-12) при 37 С. Клеточные осадки после центрифугирования были проанализированы на RSV-специфичную мРНК-экспрессию гена SH. Стрелки указывают амплифицированный PCR-продукт. М:лэддер из 123 пар оснований (Gibco BRL, Eggenstein, Germany). На фиг.1 показано, что количество RSV-специфичной мРНК увеличивается в PMN при продолжительном времени термостатирования. Далее, человеческие PMN (1 х 106/мл) обрабатывали RSV (103-107) при m.o.i. 1 в отсутствие и в присутствии цетиризина. Результаты этих экспериментов приведены на фиг. 2: человеческие PMN, необработанные (дорожка 1) или обработанные RSV (1 m.o.i.) в отсутствие (дорожка 2) или в присутствии цетиризина (дорожки 3-7; 100-, 10-, 1-, 0,1-, 0,01 мкг/106 PMN). Термостатирование проводили в течение 2 ч(фиг. 2 А) и в течение 16 ч (фиг. 2 В) при 37 С. Клеточные осадки анализировали на RSVспецифичную мРНК RSV-SH-гена с помощьюRT-PCR. Стрелкой показан амплифицированный продукт соответствующего размера М:лэддер из 123 пары оснований (Gibco BRL,Eggenstein, Germany). Фигура 2 показывает, что добавление цетиризина ингибирует RSVспецифичную мРНК-экспрессию (малого) гидрофобного (SH) гена малого размера. Уменьшение RSV-специфичной мРНК-экспрессии наблюдали во всм интервале концентраций цетиризина. Более того, уменьшение RSVспецифичной мРНК является показателем уменьшения репликационного вируса. Надо заметить, что такое ингибирование вирусной репликации антигистамином ранее никогда не наблюдалось. Влияние цетиризиндихлорида на RSVиндуцированную секрецию IL-8 человеческими(m.o.i.) 1 в отсутствие и в присутствии цетиризиндихлорида (100-, 10-, 1-, 0,1-, 0,01 мкг/мл) в течение общего времени термостатирования 2 ч при 37 С. В качестве контроля клетки обрабатывали с цетиризином (100-, 10-, 1-, 0,1-, 0,01 мкг/мл) или без цетиризина, в отсутствие RSV(буферный контроль). Надосадочные жидкости после центрифугирования клеток анализировали на секрецию IL-8 методом ELISA. Результаты этих экспериментов показаны на фигуре 3: дан 001262 10 ные представляют значения среднего и стандартного отклонения из 8 независимых экспериментов. На фиг. 3 видно, что цетиризиндихлорид (далее в этом описании называемый "цетиризин") регулирует в сторону снижения RSVиндуцированную секрецию IL-8. Однако, действие цетиризина не зависит от дозы. То есть, цетиризин в концентрациях 0,01 мкг/мл, но 100 мкг/мл приводит к значительному снижениюRSV-индуцированной секреции IL-8. Сходные результаты были получены после термостатирования в течение 24 ч, а также при концентрациях RSV вплоть до 5 m.o.i. Следует заметить, что такая взаимозависимость между антигистамином и индукцией IL-8 вирусом RSV ранее никогда не наблюдалась. Влияние цетиризиндихлорида на процесс секреции IL-8 индуцированной вирусом RSV Дальнейшие эксперименты осуществлялись с целью проанализировать влияние цетиризина на процесс секреции IL-8, индуцированной вирусом RSV. С этой целью человеческиеPMN (1 х 106/мл) обрабатывали RSV (1 m.o.i.) и цетиризином (100 мкг, 10 мкг, 1 мкг, 0,1 мкг,0,01 мкг). Цетиризин или добавляли сразу (фиг. 4 А) или спустя 30 мин (фиг. 4 В), 60 мин (фиг. 4 С) или 90 мин (фиг. 4D) после обработки RSV; было выбрано общее время 2 ч термостатирования при 37 С. Клеточные надосадочные жидкости анализировались на секрецию IL-8 методомELISA. Наши данные показывают, что цетиризин регулирует протекание индуцированнойRSV секреции IL-8, понижая е. Однако наиболее (чтко) определнно это влияние наблюдалось, когда цетиризин прибавляли одновременно с обработкой RSV. Снижение секреции IL-8,индуцированной RSV, было наиболее отчетливо заметно при концентрациях цетиризина 0,01 мкг/мл и 10 мкг/мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоты, индивидуального оптического изомера или фармацевтически приемлемой соли е в качестве активного ингредиента для получения фармацевтической композиции для ингибирования репликации респираторно-синцитиального вируса у человека. 2. Применение по п.1, отличающееся тем,что фармацевтическая композиция находится в виде дозы, содержащей от 5 до 50 мг активного ингредиента. 3. Применение по п.1, отличающееся тем,что фармацевтическая композиция предназначена для лечения острого бронхита или вирусной пневмонии. 4. Применение по п.1, отличающееся тем,что фармацевтическая композиция дополнительно содержит, по меньшей мере, один фар 11 мацевтически приемлемый носитель или наполнитель. 5. Применение по любому из пп.1 - 4, отличающееся тем, что фармацевтическая композиция находится в форме, пригодной для орального применения. 6. Применение по п.5, отличающееся тем,что фармацевтическая композиция находится в виде таблеток, капсул, порошков, эликсиров,сиропов, растворов или суспензий. 7. Применение по любому из пп.1 - 4, отличающееся тем, что фармацевтическая композиция находится в форме, пригодной для ректального применения. 8. Применение по п.7, отличающееся тем,что фармацевтическая композиция находится в форме суппозиториев. 9. Применение по п.6, отличающееся тем,что фармацевтическая композиция находится в виде раствора или суспензии, содержащей, по меньшей мере, 0,1 вес.% активного ингредиента. 10. Применение фармацевтической композиции, содержащей 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусную кислоту, индивидуальный оптический изомер или фармацевтически приемлемую соль е в качестве активного ингредиента в терапевтически эффективном количестве и фармацевтически приемлемый носитель, для ингибирования репликации респираторно-синцитиального вируса у человека.
МПК / Метки
МПК: A61K 31/495
Метки: композиция, вирусных, заболеваний, фармацевтическая, лечения
Код ссылки
<a href="https://eas.patents.su/7-1262-farmacevticheskaya-kompoziciya-dlya-lecheniya-virusnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция для лечения вирусных заболеваний</a>