Человеческие моноклональные антитела против о8е и их применение
Номер патента: 17086
Опубликовано: 28.09.2012
Авторы: Селби Марк Дж., Лу Ли-Шэн, Хуан Хайчунь, Корман Алан Дж., Витте Элисон
Формула / Реферат
1. Выделенное человеческое моноклональное антитело или его антигенсвязывающая часть, содержащее вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность, которая по меньшей мере примерно на 90% гомологична аминокислотной последовательности, кодируемой геном VH4-34 человека, геном VH3-53 человека или геном VH3-9, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность, которая по меньшей мере примерно на 90% гомологична аминокислотной последовательности, кодируемой геном VKA27 или геном VKL6 человека, где указанное антитело или его антигенсвязывающая часть:
(a) специфически связывается с человеческим O8E с KD=1´10-7 M или менее;
(b) индуцирует лизис O8E+ опухолевых клеток карциномы молочной железы SKBR3 и O8E-трансфицированных клеток SKOV3 посредством антитело-зависимой клеточной цитотоксичности (ADCC);
(c) интернализуется O8E+ опухолевыми клетками карциномы молочной железы SKBR3.
2. Антитело или его антигенсвязывающая часть по п.1, которые представляют собой полноразмерное антитело изотипа IgG1 или IgG4 или его антигенсвязывающую часть.
3. Антитело или его антигенсвязывающая часть по п.1, которые представляют собой фрагменты Fab, Fab' или Fab'2 или одноцепочечное антитело.
4. Антитело или его антигенсвязывающая часть по п.1, где указанное антитело или его антигенсвязывающая часть связываются с человеческим O8E с KD=5,5´10-9 M или менее.
5. Антитело или его антигенсвязывающая часть по п.1, где указанное антитело или его антигенсвязывающая часть связываются с человеческим O8E с KD=3´10-9 M или менее.
6. Антитело или его антигенсвязывающая часть по п.1, где указанное антитело или его антигенсвязывающая часть связываются с человеческим O8E с KD=2´10-9 M или менее.
7. Антитело или его антигенсвязывающая часть по п.1, где указанное антитело или его антигенсвязывающая часть не содержит фукозильных остатков.
8. Антитело или его антигенсвязывающая часть по п.1, содержащие:
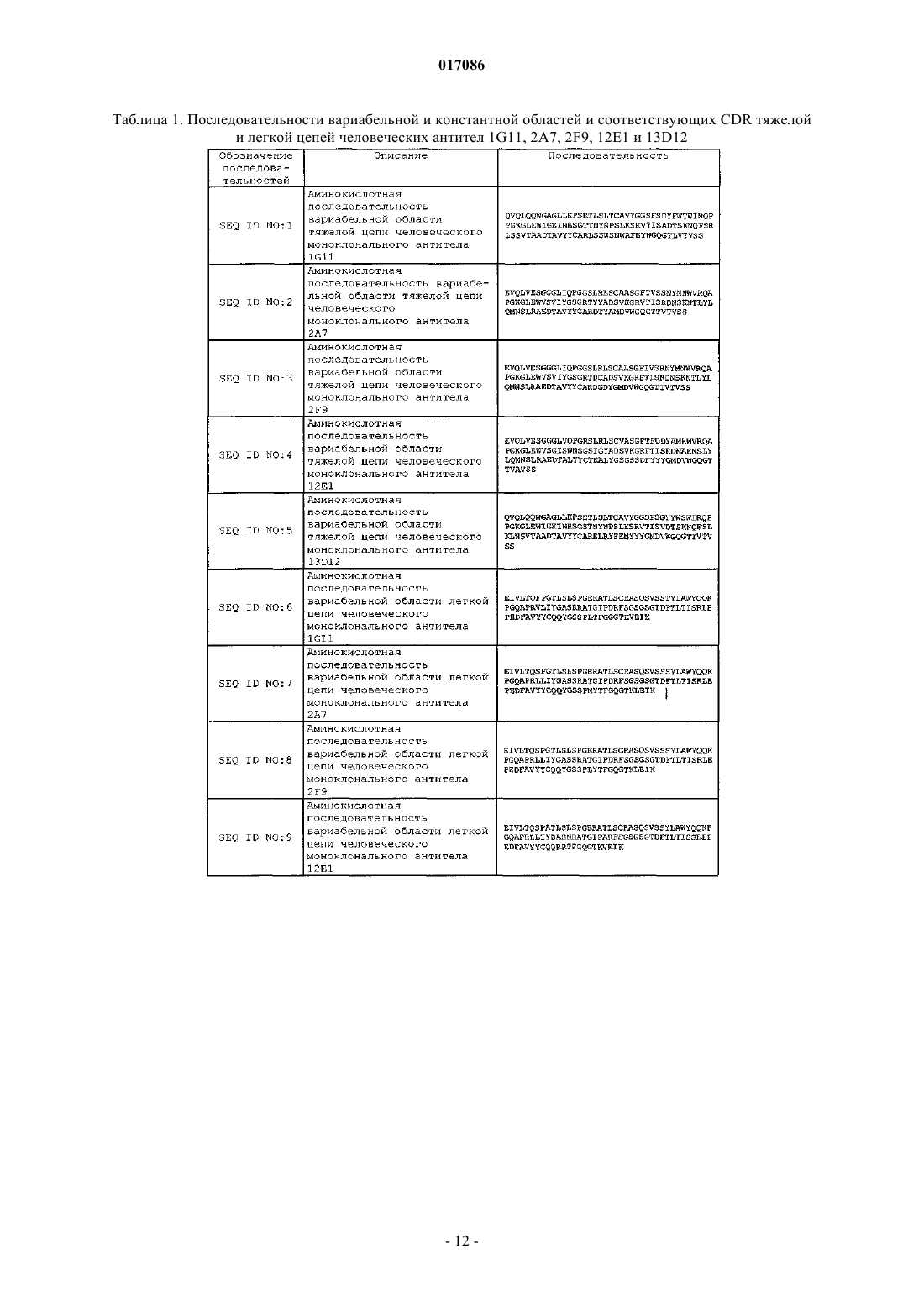
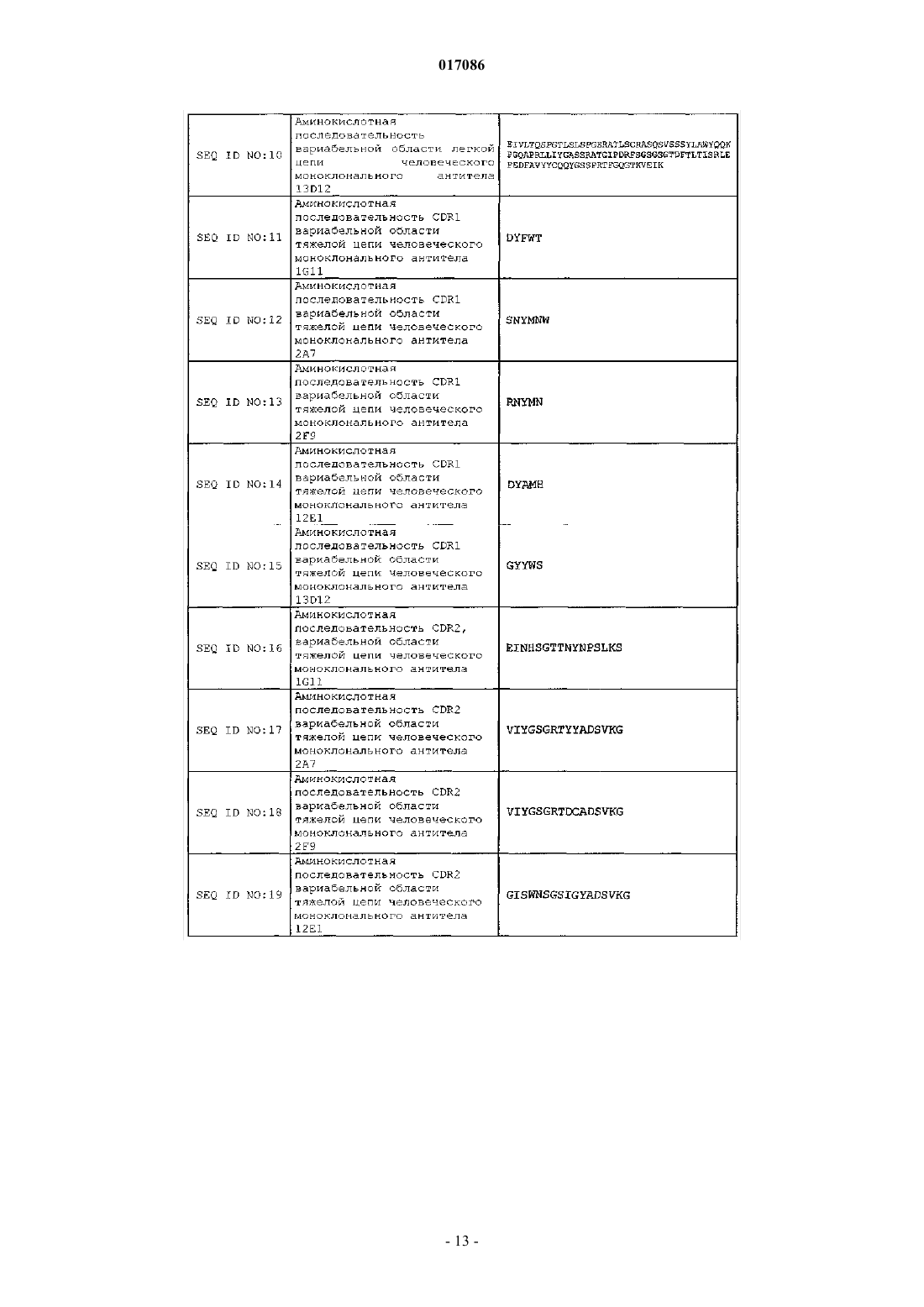
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 11;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 16;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 21;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 26;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 31;
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 36.
9. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 12;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 17;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 22;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 27;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 32; и
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 37.
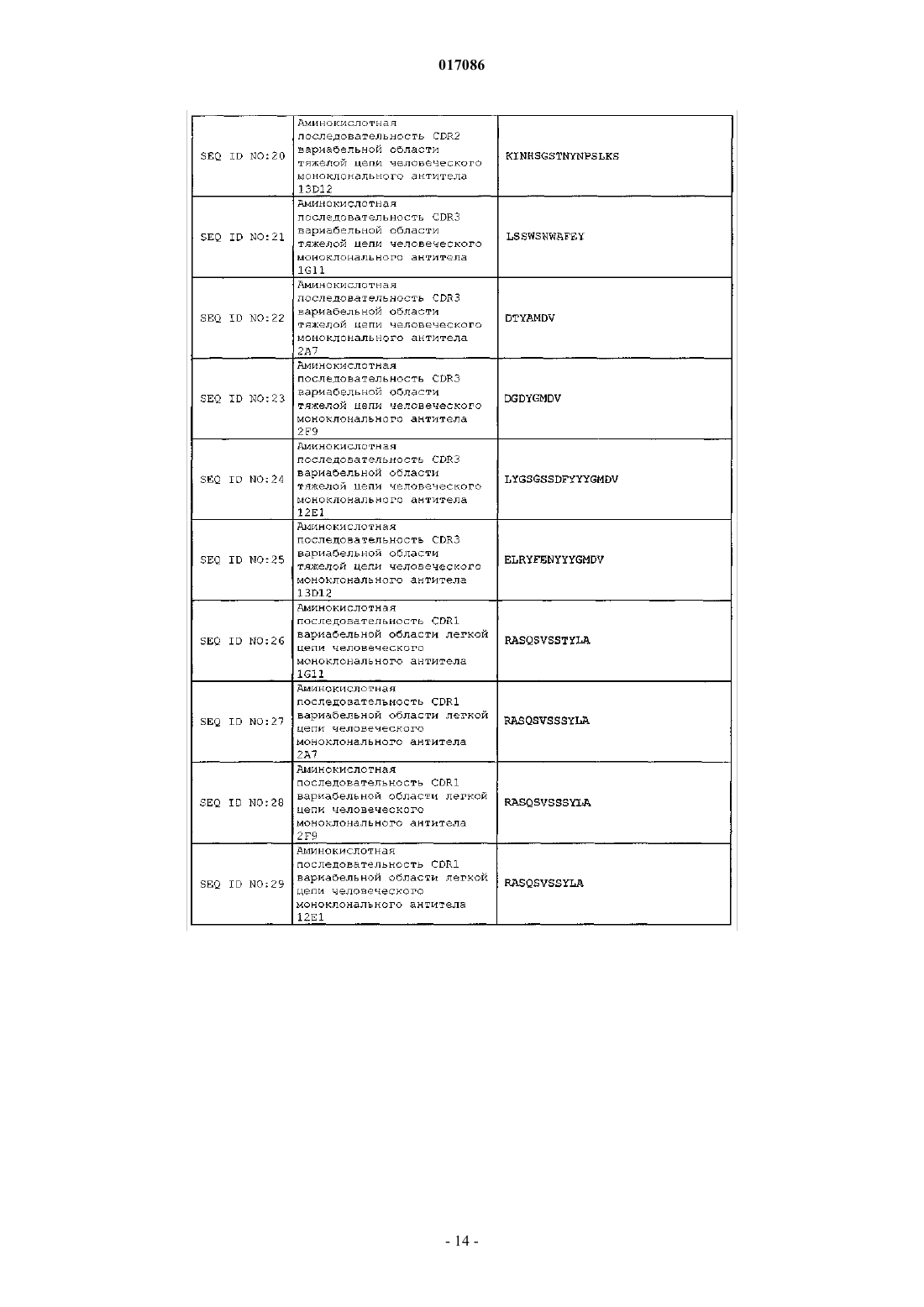
10. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 23;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 28;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 33; и
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 38.
11. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 14;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 19;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 24;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 29;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 34; и
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 39.
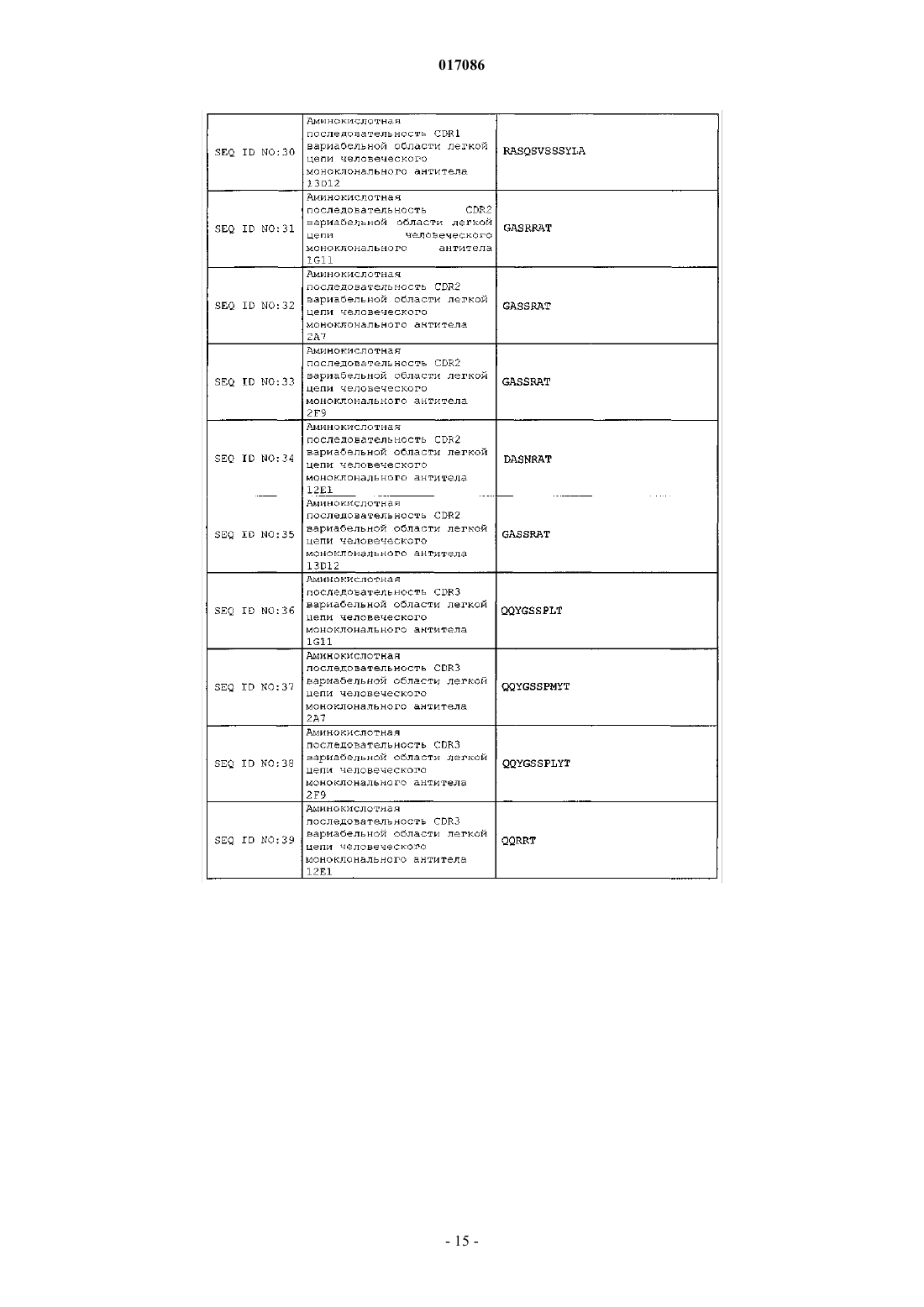
12. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 15;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 25;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 30;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 35; и
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 40.
13. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 1; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 6.
14. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 2; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 7.
15. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 3; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 8.
16. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 4; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 9.
17. Антитело или его антигенсвязывающая часть по п.1, содержащие:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 5; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95% гомологична аминокислотной последовательности SEQ ID NO: 10.
18. Антитело или его антигенсвязывающая часть по п.1, содержащие вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3, и вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3, где:
(a) последовательность CDR3 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 21, 22, 23, 24 и 25 и их консервативных модификаций, и
(b) последовательность CDR3 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 36, 37, 38, 39 и 40 и их консервативных модификаций.
19. Антитело или его антигенсвязывающая часть по п.18, где:
(a) последовательность CDR2 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 16, 17, 18, 19 и 20 и их консервативных модификаций, и
(b) последовательность CDR2 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 31, 32, 33, 34 и 35 и их консервативных модификаций.
20. Антитело или его антигенсвязывающая часть по п.18, где:
(a) последовательность CDR1 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 11, 12, 13, 14 и 15 и их консервативных модификаций, и
(b) последовательность CDR1 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 26, 27, 28, 29 и 30 и их консервативных модификаций.
21. Композиция, содержащая антитело или его антигенсвязывающую часть по любому из пп.1-20 и фармацевтически приемлемый носитель.
22. Иммуноконъюгат, содержащий антитело или его антигенсвязывающую часть по любому из пп.1-20, связанные с терапевтическим средством.
23. Композиция, содержащая иммуноконъюгат по п.22 и фармацевтически приемлемый носитель.
24. Иммуноконъюгат по п.22, где терапевтическим средством является цитотоксин.
25. Композиция, содержащая иммуноконъюгат по п.24 и фармацевтически приемлемый носитель.
26. Иммуноконъюгат по п.22, где терапевтическим средством является радиоактивный изотоп.
27. Композиция, содержащая иммуноконъюгат по п.26 и фармацевтически приемлемый носитель.
28. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающую часть по любому из пп.1-20.
29. Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты по п.28.
30. Клетка-хозяин, содержащая экспрессирующий вектор по п.29.
31. Способ получения анти-O8E-антитела, включающий экспрессию указанного антитела в клетке-хозяине по п.30 и выделение указанного антитела из клетки-хозяина.
32. Способ лечения или предупреждения заболевания, характеризующегося ростом опухолевых клеток, экспрессирующих O8E, где указанный способ включает введение индивидууму антитела или его антигенсвязывающей части по любому из пп.1-20 в количестве, эффективном для лечения или предупреждения указанного заболевания.
33. Способ по п.32, где указанным заболеванием является рак.
34. Способ по п.33, где указанным раковым заболеванием является карцинома молочной железы.
35. Способ по п.33, где указанным раковым заболеванием является рак яичника.
36. Способ по п.33, где указанным раковым заболеванием является рак почек.
37. Способ по п.33, где указанным раковым заболеванием является рак головы и шеи.
38. Выделенное моноклональное антитело или его антигенсвязывающая часть, которые содержат:
(a) CDR1 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 12;
(b) CDR2 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 17;
(c) CDR3 вариабельной области тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 22;
(d) CDR1 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 27;
(e) CDR2 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 32; и
(f) CDR3 вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 37,
где указанное антитело специфически связывается с O8E.
39. Выделенное моноклональное антитело или его антигенсвязывающая часть, которые содержат:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2;
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 7,
где указанное антитело специфически связывается с O8E.
Текст
ЧЕЛОВЕЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ О 8 Е И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к выделенным моноклональным антителам, а в частности к человеческим моноклональным антителам, которые специфически связываются с O8E с высокой аффинностью. Настоящее изобретение относится также к молекулам нуклеиновой кислоты,кодирующим антитела согласно изобретению, к экспрессирующим векторам, к клеткам-хозяевам и к способам экспрессии антител согласно изобретению. Настоящее изобретение относится также к иммуноконъюгатам, к биспецифическим молекулам и фармацевтическим композициям,содержащим антитела согласно изобретению. Настоящее изобретение относится также к способам лечения рака. 017086 Перекрестная ссылка на родственные заявки В настоящей заявке испрашивается приоритет предварительной заявки на патент США рег.60/748914, поданной 8 декабря 2005 г., и предварительной заявки на патент США рег.60/824593, поданной 5 сентября 2006 г., которые вводятся в настоящее описание посредством ссылки. Область техники, к которой относится изобретение В общих чертах, настоящее изобретение относится к области иммунологии и молекулярной биологии. Более конкретно, настоящее изобретение относится к человеческим моноклональным антителам против O8E, нуклеиновым кислотам, кодирующим человеческие моноклональные антитела против O8E,к способам получения человеческих моноклональных антител против O8E и к способам лечения заболеваний, таких как рак, характеризующийся пролиферацией клеток, экспрессирующих O8E. Предшествующий уровень техники В Соединенных Штатах рак молочной железы и рак яичника являются главными причинами смертности среди женщин, и по количеству смертельных исходов, они занимают второе и четвертое место,соответственно (данные и цифры, представленные Американским Обществом по борьбе с раком (2005. Американским Обществом по борьбе с раком было установлено, что в 2005 г. в Соединенных штатах от рака молочной железы умерло приблизительно 40000 женщин, и примерно 16000 женщин умерло от рака яичника. Свыше 80% из всех злокачественных опухолей яичника составляют опухоли поверхностного эпителия, которыми являются опухоли серозной оболочки, опухоли слизистой, эндометриоидные опухоли и светлоклеточные карциномы (Seidman et al. "Blaustein's Pathology of the Female Genital Tract" 791-4(Kurman, editor, 5th ed. New York, Springer-Verlag, 2002). Рак яичника часто обнаруживается уже на запущенной стадии, когда метастазы распространяются в региональные и периферические участки организма (Pettersson, (1994) Int. Fed. Of Gyn. and Obstetrics, Vol. 22; и Heintz et al (2001) J. Epidermiol. Biostat. 6: 107-38). Таким образом, хотя вероятность развития рака молочной железы на протяжении всей жизни значительно выше, чем вероятность развития рака яичника, однако продолжительность жизни пациентов с раком молочной железы, в основном, на 5 лет выше, чем продолжительность жизни пациентов с раком яичника. В 7-подобные молекулы принадлежат к суперсемейству иммуноглобулинов (Ig). Внеклеточные части B7-подобных молекул содержат по одному домену IgV и IgC и имеют 20-40%-ную степень идентичности аминокислот. B7-подобные молекулы играют важную роль в регуляции и тонкой коррекции антигенспецифических иммунных ответов. Молекула O8E, известная также как B7H4, B7x и B7S1, является членом семейства B7 и, очевидно, играет определенную роль в стимулирующей и ингибирующей регуляции T-клеточных ответов (Carreno et al., (2002) Ann. Rev. Immunol. 20:29-53 и Khoury et al., (2004) Immunity 20:529-538). Человеческий O8E был картриван по хромосоме 1, и было установлено, что он состоит из шести экзонов и пяти интронов, охватывающих 66 т.п.н., из которых экзон 6 используется для альтернативного сплайсинга с последующим генерированием двух различных транскриптов (Choi et al.O8E осуществляет свою физиологическую функцию посредством связывания с рецептором на Tклетках, который, в свою очередь, индуцирует прерывание клеточного цикла и ингибирует секрецию цитокинов, а также развитие цитотоксичности и продуцирование цитокинов CD4+- и CD8+-T-клетками(Prasad et al. (2003) Immunity 18:863-873; Sica et al. (2003) Immunity 18:849-861; Wang et al (2004) Microbes Infect. 6:759-66; и Zang et al. (2003) Proc. Natl. Acad. Sci U.S.A. 100:10388-10392). Было высказано предположение, что O8E может служить аттенюатором воспалительных ответов и может играть определенную роль в ингибировании антигенспецифических иммунных и противоопухолевых ответов (Zang et(2003) Immunity 18:849-861; Choi et al (2003) J. Immunol. 121:4650-4654 и Carreno et al. (2003) Trends Immunol. 24:524-7). Экспрессия мРНК O8E, но не белка O8E, была обнаружена в нормальных соматических тканях широкого ряда, включая ткани печени, скелетной мышцы, почек, поджелудочной железы и тонкого кишечника (Sica et al. (2003) Immunity 18:849-61 и Choi et al. (2003) J. Immunol. 171:4650-4). O8E индуцируется после стимуляции T-клеток, B-клеток, моноцитов и дендритных клеток, однако иммуногистохимический анализ выявил лишь очень незначительную экспрессию O8E в некоторых периферических тканях, за исключением позитивного окрашивания в некоторых раковых опухолях яичника и легких (Id.). Кроме того,стабильная сверхзкспрессия O8E наблюдается в первичных и в метастатических раковых опухолях молочной железы, независимо от степени злокачественности или стадии развития опухоли, что дает основание сделать предположение о важной роли этого белка в биологии развития рака молочной железы(Tringler et al. (2005) Clinical Cancer Res. 11: 1842-48). См. также патенты США 6962980; 6699664; 6468546; 6488931; 6670463 и 6528253, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки. Для лечения запущенного рака молочной железы и яичника применяются терапевтические методы широкого ряда, включая лучевую терапию, стандартную химиотерапию с применением цитотоксических противоопухолевых средств, гормональных терапевтических средств (ингибиторов ароматазы, аналогов рилизинг-фактора лютеинизирующего гормона), бисфосфонатов и ингибиторов передачи сигнала (Smith(2002) Lancet, 360:790-2). Однако, к сожалению, у многих пациентов либо вырабатывается недостаточный ответ на эти терапевтические средства, либо вообще не вырабатывается ответа ни на одно из указанных терапевтических средств. Таким образом, необходимость поиска новых молекулярных маркеров для обнаружения рака молочной железы и яичника и новых терапевтических средств против таких раковых заболеваний остается актуальной. В соответствии с этим, O8E представляет собой важную мишень,на которую может быть нацелено терапевтическое средство для лечения рака, включая рак яичника, рак молочной железы и ряд других заболеваний, характеризующихся экспрессией O8E. Описание сущности изобретения Настоящее изобретение относится к выделенным моноклональным антителам, в частности к моноклональным антителам с человеческой последовательностью, которые связываются с O8E (также обозначаемым (a/k/a) B7H4, B7S1 и B7x), и которые обладают различными нужными свойствами. Такими свойствами являются высокая аффинность связывания с человеческим O8E. Настоящее изобретение относится также к способам лечения различных O8E-опосредуемых заболеваний с использованием антител и композиций согласно изобретению. В одном из своих аспектов настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, где указанное антитело:(b) связывается с человеческими клетками CHO, трансфицированными O8E. В некоторых вариантах изобретения указанное антитело связывается с опухолевой клеточной линией карциномы молочной железы, такой как клеточная линия SKBR3 (АТСС рег.HTB-30). Обычно таким антителом является человеческое антитело, хотя в альтернативных вариантах изобретения таким антителом может быть мышиное антитело, химерное антитело или гуманизованное антитело. В одном из вариантов изобретения указанное антитело связывается с человеческим O8E с KD 510-8M или менее, с человеческим O8E с KD 210-8 М или менее, с человеческим O8E с KD 110-8 М или менее, с человеческим O8E с KD 510-9 M или менее, с человеческим O8E с KD 410-9 М или менее, с человеческим O8E с KD 310-9 М или менее, или с человеческим O8E с KD 210-9 М или менее. В другом варианте изобретения указанное антитело интернализуется опухолевыми клетками карциномы молочной железы SKBR3 после связывания с O8E, экспрессируемым на этих клетках. В другом своем варианте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, где указанное антитело конкурирует с эталонным антителом за перекрестное связывание с O8E, где указанное эталонное антитело:(b) связывается с человеческими клетками CHO, трансфицированными O8E. В различных вариантах изобретения эталонное антитело включает в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 6; либо эталонное антитело включает в себя(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 7; либо эталонное антитело включает в себя(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 8; либо эталонное антитело включает в себя(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 9; либо эталонное антитело включает в себя(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 10. В одном из своих аспектов настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область тяжелой цепи,которая представляет собой продукт человеческого гена VH 4-34 (белковый продукт которого представлен здесь как SEQ ID NO: 51) или происходит от этого продукта, где указанное антитело специфически связывается с O8E. Настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область тяжелой цепи, которая-2 017086 представляет собой продукт человеческого гена VH 3-53 (белковый продукт которого представлен здесь как SEQ ID NO: 52) происходит от этого продукта, где указанное антитело специфически связывается сO8E. Настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область тяжелой цепи, которая представляет собой продукт комбинации человеческих генов VH 3-9/D3-10/JH6b (белковый продукт которого представлен здесь как SEQ ID NO: 53) происходит от этого продукта, где указанное антитело специфически связывается с O8E. Настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область легкой цепи, которая представляет собой продукт человеческого гена VK A-27 (белковый продукт которого представлен здесь как SEQ IDNO: 54) происходит от этого продукта, где указанное антитело специфически связывается с O8E. Настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область легкой цепи, которая представляет собой продукт комбинации человеческих генов VK L6/JK1 (белковый продукт которого представлен здесь какSEQ ID NO: 55) происходит от этого продукта, где указанное антитело специфически связывается с O8E. В других своих аспектах настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя:(a) вариабельную область тяжелой цепи человеческого гена VH 4-34, 3-53 или 3-9; и(b) вариабельную область легкой цепи человеческого VK A27 или VK L6; где указанное антитело специфически связывается с O8E. В родственном варианте изобретения указанное антитело включает в себя вариабельную область тяжелой цепи человеческого гена VH 4-34 и вариабельную область легкой цепи человеческого гена VKA27. В другом родственном варианте изобретения указанное антитело включает в себя вариабельную область тяжелой цепи человеческого гена VH 3-53 и вариабельную область легкой цепи человеческого гена VK A27. В еще одном родственном варианте изобретения указанное антитело включает в себя вариабельную область тяжелой цепи человеческого гена VH 3-9 и вариабельную область легкой цепи человеческого гена VK L6. В другом своем аспекте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим вариабельную область тяжелой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3; и вариабельную область легкой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3, где:(a) последовательность CDR3 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей(b) последовательность CDR3 вариабельной области легкой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID(c) указанное антитело связывается с человеческим O8E с KD=110-7 M или менее;(d) указанное антитело связывается с человеческими клетками CHO, трансфицированными O8E. Обычно последовательность CDR2 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностейSEQ ID NO: 16, 17, 18, 19 и 20 и их консервативных модификаций, а последовательность CDR2 вариабельной области легкой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 31, 32, 33, 34 и 35 и их консервативных модификаций. Обычно, последовательность CDR1 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 11, 12, 13, 14 и 15 и их консервативных модификаций, а последовательность CDR1 вариабельной области легкой цепи включает в себя аминокислотную последовательность,выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 26, 27, 28, 29 и 30 и их консервативных модификаций. Конкретная комбинация включает в себя:(a) последовательность CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 11;(b) последовательность CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 16;(c) последовательность CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 21;(d) последовательность CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 26;(e) последовательность CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 31; и(f) последовательность CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 36. Другая конкретная комбинация включает в себя:(a) последовательность CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 12;(b) последовательность CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 17;(c) последовательность CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 22;(d) последовательность CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 27;(e) последовательность CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 32; и(f) последовательность CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 37. Другая конкретная комбинация включает в себя:(a) последовательность CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 13;(b) последовательность CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 18;(c) последовательность CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 23;(d) последовательность CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 28;(e) последовательность CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 33; и(f) последовательность CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 38. Другая конкретная комбинация включает в себя:(a) последовательность CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 14;(b) последовательность CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 19;(c) последовательность CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 24;(d) последовательность CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 29;(e) последовательность CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 34; и(f) последовательность CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 39. Другая конкретная комбинация включает в себя:(a) последовательность CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 15;(b) последовательность CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 20;(c) последовательность CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 25;(d) последовательность CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 30;(e) последовательность CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 35; и(f) последовательность CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 40. Другие конкретные антитела согласно изобретению или их антигенсвязывающие части включают в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 6. Другая конкретная комбинация включает в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 7. Другая конкретная комбинация включает в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO:8. Другая конкретная комбинация включает в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 9. Другая конкретная комбинация включает в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ IDNO: 10. В другом своем аспекте настоящее изобретение относится к антителам или к их антигенсвязывающим частям, которые конкурируют с любыми вышеупомянутыми антителами за связывание с O8E. Антителами согласно изобретению могут быть, например, полноразмерные антитела, например, антитела изотипа IgG1, IgG2 или IgG4. Альтернативно, такими антителами могут быть их фрагменты, такие как Fab-, Fab'- или F(ab')2-фрагменты, или одноцепочечные антитела (например, scFv). Настоящее изобретение относится также к иммуноконъюгату, содержащему антитело согласно изобретению или его антигенсвязывающую часть, присоединенные к терапевтическому средству, такому как цитотоксин или радиоактивный изотоп. Настоящее изобретение относится также к биспецифической молекуле, включающей в себя антитело согласно изобретению или его антигенсвязывающую часть, присоединенные ко второй функциональной молекуле, имеющей специфичность связывания, отличающуюся от специфичности связывания указанного антитела или его антигенсвязывающей части. Настоящее изобретение относится также к композициям, содержащим антитело или его антигенсвязывающую часть, или иммуноконъюгат или биспецифическую молекулу согласно изобретению и фарма-4 017086 цевтически приемлемый носитель. Настоящее изобретение относится также к молекулам нуклеиновой кислоты, кодирующим антитела или их антигенсвязывающие части согласно изобретению, а также к экспрессирующим векторам, содержащим указанные нуклеиновые кислоты, к клеткам-хозяевам, содержащим такие экспрессирующие векторы, и к способам получения анти-O8E-антител с использованием таких клеток-хозяев. Кроме того, настоящее изобретение относится к трансгенным мышам, имеющим трансгены тяжелой и легкой цепей человеческого иммуноглобулина, где у указанной мыши экспрессируется антитело согласно изобретению, а также к гибридомам, полученным от такой мыши, где указанная гибридома продуцирует антитело согласно изобретению. В другом своем аспекте настоящее изобретение относится к способу лечения или предупреждения заболевания, характеризующегося ростом опухолевых клеток, экспрессирующих O8E, где указанный способ включает в себя введение индивидууму человеческого анти-O8E-антитела согласно изобретению в количестве, эффективном для лечения или предупреждения указанного заболевания. Таким заболеванием может быть рак, например карцинома молочной железы. В еще одном своем аспекте настоящее изобретение относится к способу лечения аутоиммунного расстройства, где указанный способ включает в себя введение индивидууму человеческого анти- O8Eантитела согласно изобретению в количестве, эффективном для лечения указанного аутоиммунного расстройства. Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из подробного описания изобретения и из примеров, которые не должны рассматриваться как ограничивающие изобретение. Содержание всех публикаций, данных Genbank, патентов и опубликованных патентных заявок, цитируемых в настоящей заявке, во всей своей полноте вводится в настоящее описание посредством ссылки. Краткое описание графического материала и идентификаторов последовательностей На фиг. 1 А представлена нуклеотидная последовательность (SEQ ID NO: 41) и аминокислотная последовательность (SEQ ID NO: 1) вариабельной области тяжелой цепи человеческого моноклонального антитела 1G11. Также указаны области CDR1 (SEQ ID NO: 11), CDR2 (SEQ ID NO: 16) и CDR3 (SEQ IDNO: 21) и производные V и J зародышевой линии. На фиг. 1 В представлена нуклеотидная последовательность (SEQ ID NO: 46) и аминокислотная последовательность (SEQ ID NO: 6) вариабельной области легкой цепи человеческого моноклонального антитела 1G11. Также указаны области CDR1 (SEQ ID NO: 26), CDR2 (SEQ ID NO: 31) и CDR3 (SEQ IDNO: 36) и производные V и J зародышевой линии. На фиг. 2 А представлена нуклеотидная последовательность (SEQ ID NO: 42) и аминокислотная последовательность (SEQ ID NO: 2) вариабельной области тяжелой цепи человеческого моноклонального антитела 2A7. Также указаны области CDR1 (SEQ ID NO: 12), CDR2 (SEQ ID NO: 17) и CDR3 (SEQ IDNO: 22) и производные V, D и J зародышевой линии. На фиг. 2 В представлена нуклеотидная последовательность (SEQ ID NO: 47) и аминокислотная последовательность (SEQ ID NO: 7) вариабельной области легкой цепи человеческого моноклонального антитела 2A7. Также указаны области CDR1 (SEQ ID NO: 27), CDR2 (SEQ ID NO: 32) и CDR3 (SEQ IDNO: 37) и производные V и J зародышевой линии. На фиг. 3A представлена нуклеотидная последовательность (SEQ ID NO: 43) и аминокислотная последовательность (SEQ ID NO: 3) вариабельной области тяжелой цепи человеческого моноклонального антитела 2F9. Также указаны области CDR1 (SEQ ID NO: 13), CDR2 (SEQ ID NO: 18) и CDR3 (SEQ IDNO: 23) и производные V, D и J зародышевой линии. На фиг. 3B представлена нуклеотидная последовательность (SEQ ID NO: 48) и аминокислотная последовательность (SEQ ID NO: 8) вариабельной области легкой цепи человеческого моноклонального антитела 2F9. Также указаны области CDR1 (SEQ ID NO: 28), CDR2 (SEQ ID NO: 33) и CDR3 (SEQ IDNO: 38) и производные V и J зародышевой линии. На фиг. 4 А представлена нуклеотидная последовательность (SEQ ID NO: 44) и аминокислотная последовательность (SEQ ID NO: 4) вариабельной области тяжелой цепи человеческого моноклонального антитела 12E1. Также указаны области CDR1 (SEQ ID NO: 14), CDR2 (SEQ ID NO: 19) и CDR3 (SEQ IDNO: 24) и производные V, D и J зародышевой линии. На фиг. 4 В представлена нуклеотидная последовательность (SEQ ID NO: 49) и аминокислотная последовательность (SEQ ID NO: 9) вариабельной области легкой цепи человеческого моноклонального антитела 12E1. Также указаны области CDR1 (SEQ ID NO: 29), CDR2 (SEQ ID NO: 34) и CDR3 (SEQ IDNO: 39) и производные V и J зародышевой линии. На фиг. 5 А представлена нуклеотидная последовательность (SEQ ID NO: 45) и аминокислотная последовательность (SEQ ID NO: 5) вариабельной области тяжелой цепи человеческого моноклонального антитела 13D12. Также указаны области CDR1 (SEQ ID NO: 15), CDR2 (SEQ ID NO: 20) и CDR3 (SEQ IDNO: 25) и производные V, D и J зародышевой линии. На фиг. 5 В представлена нуклеотидная последовательность (SEQ ID NO: 50) и аминокислотная последовательность (SEQ ID NO: 10) вариабельной области легкой цепи человеческого моноклонального-5 017086 антитела 13D12. Также указаны области CDR1 (SEQ ID NO: 30), CDR2 (SEQ ID NO: 35) и CDR3 (SEQ IDNO: 40) и производные V и J зародышевой линии. На фиг. 6 проиллюстрировано сопоставление аминокислотной последовательности вариабельной области тяжелой цепи 1G11 и 13D12 с аминокислотной последовательностью VH4-34 человеческой зародышевой линии (SEQ ID NO: 51). На фиг. 7 проиллюстрировано сопоставление аминокислотной последовательности вариабельной области тяжелой цепи 2A7 и 2F9 с аминокислотной последовательностью VH3-53 человеческой зародышевой линии (SEQ ID NO: 52). На фиг. 8 проиллюстрировано сопоставление аминокислотной последовательности вариабельной области тяжелой цепи 12E1 с объединенной аминокислотной последовательностью VH3-9/D3-10/JH6b человеческой зародышевой линии (SEQ ID NO:53). На фиг. 9 проиллюстрировано сопоставление аминокислотной последовательности вариабельной области легкой цепи 1G11, 2A7, 2F9 и 13D12 с аминокислотной последовательностью VKA27 человеческой зародышевой линии (SEQ ID NO:54). На фиг. 10 проиллюстрировано сопоставление аминокислотной последовательности вариабельной области легкой цепи 12E1 с объединенной аминокислотной последовательностью VKL6/JK1 человеческой зародышевой линии (SEQ ID NO:55). На фиг. 11A и 11B представлены результаты ELISA-экспериментов, которые продемонстрировали,что человеческие моноклональные антитела против человеческого O8E специфически связываются сO8E. На фиг. 11A представлены результаты, полученные на ELISA-планшете, покрытом человеческими анти-O8E-антителами, в который был затем добавлен очищенный белок O8E, и который был детектирован кроличьей анти-O8E-антисывороткой. На фиг. 11 В представлены результаты, полученные на ELISAпланшете, покрытом антителом против мышиного Fc, а затем моноклональным анти-C9-антителом (0,6 мкг/мл), с последующим титрованием белком Penta-O8E, как показано на фигуре, а затем человеческими анти-O8E-антителами при 1 мкг/мл. На фиг. 12 представлены результаты экспериментов, проводимых с помощью проточной цитометрии, указывающие на то, что человеческое моноклональное анти-O8E-антитело 2A7 связывается с O8Eтрансфицированными клетками CHO. На фиг. 13 представлены результаты экспериментов, проводимых с помощью проточной цитометрии, где указанные результаты продемонстрировали экспрессию O8E в клетках карциномы молочной железы SKBR3, а также в O8E-трансфицированных клетках SKOV3 и HEK. На фиг. 14 представлены результаты экспериментов по интернализации Hum-Zap, указывающие на то, что человеческие моноклональные антитела против человеческого O8E могут интернализоваться вO8E+-клетки CHO. На фиг. 15 представлены результаты экспериментов по интернализации Hum-Zap, указывающие на то, что человеческие моноклональные антитела против человеческого O8E могут интернализоваться вO8E+-клетки SKBR3. На фиг. 16 представлены результаты экспериментов по картированию эпитопов, проводимых с использованием различных человеческих моноклональных анти-O8E-антител, включая антитела 1G11,2A7, 2F9 и 13D12. На фиг. 17 представлены результаты исследований на антитело-зависимую клеточную цитотоксичность (ADCC), указывающие на то, что человеческие моноклональные анти-O8E-антитела обеспечиваютADCC-зависимое уничтожение человеческой клеточной линии рака молочной железы SKBR3. На фиг. 18 представлены результаты анализов на антитело-зависимую клеточную цитотоксичность(ADCC), указывающие на то, что человеческие моноклональные анти-O8E-антитела обеспечиваютADCC-зависимое уничтожение O8E-трансфицированных клеток SKOV3. На фиг. 19 представлены результаты анализов на антитело-зависимую клеточную цитотоксичность(ADCC), указывающие на то, что человеческие моноклональные анти-O8E-антитела обеспечивают зависимое от концентрации и ADCC-зависимое уничтожение клеточной линии рака человеческой молочной железы SKBR3. На фиг. 20 представлены результаты in vivo исследований на мышах SCID, указывающие на ингибирование роста HEK-B7H4-опухоли анти-O8E-антителами. Подробное описание изобретения Настоящее изобретение относится к выделенным моноклональным антителам, в частности, к моноклональным антителам с человеческой последовательностью, которые специфически и с высокой аффинностью связываются с O8E (также обозначаемым B7H4, B7S1 и B7x). В некоторых вариантах изобретения антитела согласно изобретению происходят от конкретных последовательностей тяжелой и легкой цепей зародышевой линии и/или имеют конкретные структурные признаки, такие как областиCDR, содержащие конкретные аминокислотные последовательности. Настоящее изобретение относится к выделенным антителам, к способам получения таких антител, к иммуноконъюгатам и к биспецифическим молекулам, включающим в себя указанные антитела, а также к фармацевтическим композициям,содержащим указанные антитела, иммуноконъюгаты или биспецифические молекулы согласно изобре-6 017086 тению. Настоящее изобретение относится также к способам применения указанных антител, например,для детекции O8E, а также для лечения заболеваний, ассоциированных с экспрессией O8E, таких как рак. В соответствии с этим настоящее изобретение относится также к способам применения анти-O8Eантител согласно изобретению для лечения различных раковых заболеваний, например, для лечения карциномы молочной железы, метастазов рака молочной железы, карциномы яичника, метастазов рака яичника и карциномы почек. Для лучшего понимания настоящего изобретения ниже приводится определение некоторых терминов. Определение других терминов приводится в процессе подробного описания настоящего изобретения. Используемые здесь термины "O8E," "B7H4," "B7x" и "B7S1" являются взаимозаменяемыми и включают в себя варианты, изоформы, гомологи, ортологи и паралоги человеческого O8E. Так, например, в некоторых случаях антитела, специфичные в отношении O8E, могут перекрестно реагировать с белком O8E, происходящим не от человека, а от других видов. В других вариантах изобретения антитела, специфичные в отношении человеческого O8E, могут быть специфичны только в отношении человеческого O8E и не способны перекрестно реагировать с O8E, происходящим от других видов, или с O8E других типов. Термин "человеческий O8E" означает человеческую последовательность человеческогоO8E, такую как полноразмерная аминокислотная последовательность человеческого O8E, имеющаяся в базе данных Genbank рег.NP 078902 (SEQ ID NO: 56). O8E также известен специалистам как, например, BL-CAM, B3, Leu-14 и Lyb-8. Последовательность человеческого O8E может отличаться от последовательности человеческоого O8E SEQ ID NO:56, например, консервативными мутациями или мутациями в неконсервативных областях, a CD22, по существу, обладает такой же биологической функцией,как и человеческий O8E, имеющий последовательность SEQ ID NO: 56. Так, например, биологическая функция человеческого O8E состоит в том, что он имеет эпитоп во внеклеточном домене O8E, который специфически связывается с антителом согласно изобретению, либо биологическая функция человеческого O8E заключается, например, в ингибировании пролиферации T-клеток, ингибировании продуцирования цитокинов, ингибировании клеточного цикла или в связывании с T-клеточными рецепторами. Конкретная последовательность человеческого O8E в основном по меньшей мере на 90% идентична аминокислотной последовательности человеческого O8E SEQ ID NO: 56 и содержит аминокислотные остатки, которые, при их сравнении с аминокислотными остатками последовательности O8E других видов (например, с мышиной последовательностью), указывают на то, что такая аминокислотная последовательность является человеческой. В некоторых случаях последовательность человеческого O8E может быть по меньшей мере на 95%,или даже по меньшей мере на 96, 97, 98 или 99% идентична аминокислотной последовательности O8ESEQ ID NO:56. В некоторых вариантах изобретения последовательность человеческого O8E имеет не более чем 10 аминокислот, отличающихся от аминокислот O8E SEQ ID NO:56. В некоторых вариантах изобретения последовательность человеческого O8E может иметь не более чем 5 или даже не более чем 4, 3, 2 или 1 аминокислоту, отличающиеся от аминокислот O8E SEQ ID NO:56. Процент идентичности может быть определен, как описано в настоящей заявке. Термин "иммунный ответ" означает действие, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитарных клеток, гранулоцитов и растворимых макромолекул, продуцируемых вышеописанными клетками или клетками печени (включая антитела, цитокины и комплемент), которое приводит к селективному разрушению или деструкции в человеческом организме или к элиминации из человеческого организма инвазивных патогенов, клеток или тканей, инфицированных патогенами, раковых клеток или, в случае аутоиммунного ответа или патологического воспаления, нормальных человеческих клеток или тканей. Термин "путь передачи сигнала" означает биохимическую взаимосвязь между различными молекулами передачи сигнала, которые играют определенную роль в передаче сигнала от одной части клетки в другую часть клетки. Используемый здесь термин "рецептор клеточной поверхности" включает в себя,например, молекулы и комплексы молекул, способных принимать сигнал и передавать этот сигнал через плазматическую клеточную мембрану. Примером "рецептора клеточной поверхности" согласно изобретению является рецептор O8E. Используемый здесь термин "антитело" означает интактные антитела и их любой антигенсвязывающий фрагмент (то есть "антигенсвязывающую часть") или их отдельные цепи. Термин "антитело" означает гликопротеин, содержащий по меньшей мере две тяжелых цепи (H) и две легких цепи (L), соединенных между собой дисульфидными связями, или их антигенсвязывающую часть. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой здесь VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой здесь VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. VH- и VL-области могут быть также подразделены на гипервариабельные области, называемые комплементарность-определяющими областями (CDR) и чередующиеся с областями, которые являются более консервативными и называются каркасными областями (FR). Каждая VH- и VL-область-7 017086 состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторые клетки) и первый компонент (CIq) классической системы комплемента. Используемый здесь термин "антигенсвязывающая часть" антитела (или "часть антитела") означает один или несколько фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (например, с O8E). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами полноразмерного антитела. Примерами связывающих фрагментов, которые входят в определение термина "антигенсвязывающая часть" антитела, являются:Fab-фрагмент, т.е. одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1;F(ab')2-фрагмент, т.е. двухвалентный фрагмент, состоящий из двух Fab-фрагментов, связанных в шарнирной области дисульфидным мостиком;(iii) Fab'-фрагмент, который, по существу, представляет собой Fab-фрагмент с частью шарнирной области (см. Fundamental Immunology (Paul ed., 3rd ed. 1993;(vi) dAb-фрагмент (Ward et al, (1989) Nature 341:544-546), который состоит из VH-домена;(vii) изолированная гипервариабельная область (CDR); и(viii) наноантитело, у которого вариабельная область тяжелой цепи содержит один вариабельный домен и два константных домена. Кроме того, хотя указанные два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, однако они могут быть присоединены друг к другу рекомбинантными методами посредством синтетического линкера, что позволяет получить эти фрагменты в виде одной белковой цепи, в которой пара VL- и VH-областей образует одновалентные молекулы (известные как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl.Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также входят в определение термина"антигенсвязывающая часть" антитела. Указанные фрагменты антител получают стандартными методами, известными специалистам, и такие фрагменты скринируют на эффективность способом, аналогичным способу скрининга интактных антител. Используемый здесь термин "выделенное антитело" означает антитело, которое, по существу, не содержит других антител, обладающих другой антигенной специфичностью (например, выделенное антитело, специфически связывающееся с O8E, по существу, не содержит антител, которые специфически связываются с антигенами, отличающимися от O8E). Однако выделенное антитело, которое специфически связывается с O8E, может обладать перекрестной реактивностью с другими антигенами, такими как молекулы O8E, происходящие от других видов. Кроме того, выделенное антитело может, по существу,не содержать других клеточных веществ и/или химических веществ. Используемые здесь термины "моноклональное антитело" или "композиция моноклональных антител" означают препарат молекул антитела, имеющих один и тот же молекулярный состав. Композиция моноклональных антител имеет одну специфичность связывания и аффинность к конкретному эпитопу. Используемый здесь термин "человеческое антитело" или "антитело с человеческой последовательностью" означает антитела, имеющие вариабельные области, в которых каркасная и CDR-области происходят от последовательностей иммуноглобулина человеческой зародышевой линии. Кроме того, если данное антитело содержит константную область, то такая константная область также происходит от последовательностей иммуноглобулина человеческой зародышевой линии. Такие человеческие антитела могут иметь более поздние модификации, включая природные или синтетические модификации. Человеческие антитела согласно изобретению могут включать аминокислотные остатки, которые не кодируются последовательностями иммуноглобулина человеческой зародышевой линии (например, мутации, внесенные посредством неспецифического или сайт-специфического мутагенеза in vitro, или посредством соматической мутации in vivo). Однако используемый здесь термин "человеческое антитело" не включает в себя антитела, у которых в человеческие каркасные последовательности были введены последовательности CDR, происходящие от молекул зародышевой линии млекопитающих других видов, таких как мышь. Термин "человеческое моноклональное антитело", который после слова "человеческое" может включать слово "последовательность", означает антитела, обладающие одной специфичностью связывания и имеющие вариабельные области, в которых каркасная область и CDR-области происходят от последовательностей иммуноглобулина человеческой зародышевой линии. В одном из вариантов изобретения указанные человеческие моноклинальные антитела продуцируются гибридомами, которыми являются B-клетки, полученные от трансгенного животного, не являющегося человеком, например, от трансгенной мыши, имеющей геном, содержащий человеческий трансген тяжелой цепи и трансген легкой цепи, встроенный в иммортализованную клетку. Используемый здесь термин "рекомбинантное человеческое антитело" включает в себя все челове-8 017086 ческие антитела, которые были получены, экспрессированы, созданы или выделены рекомбинантными методами, такие как (a) антитела, выделенные у животного (например, мыши), которое является трансгенным или трансхромосомным по генам человеческого иммуноглобулина; или гибридомы, полученные от этих животных (подробно описанные ниже), (b) антитела, выделенные из клеток-хозяев, трансформированных так, чтобы они экспрессировали человеческое антитело, например, из клеток трансфектомы,(c) антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные любыми другими методами,включающими в себя сплайсинг последовательностей генов человеческого иммуноглобулина с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные области, в которых каркасная область и CDR-области происходят от последовательностей иммуноглобулинов человеческой зародышевой линии. Однако в некоторых вариантах изобретения такие рекомбинантные человеческие антитела могут быть подвергнуты мутагенезу in vitro (или, в случае использования животного, трансгенного по последовательностям человеческих Ig, соматического мутагенеза in vivo), а поэтому аминокислотные последовательности VH- и VL-областей рекомбинантных антител, несмотря на то,что они происходят от VH-и VL-последовательностей человеческой зародышевой линии и являются родственными таким последовательностям, могут отсутствовать в репертуаре антител человеческой зародышевой линии in vivo. Используемый здесь термин "изотип" означает класс антитела (например, IgM или IgG1), которое кодируется генами константной области тяжелой цепи. Используемые здесь термины "антитело, распознающее антиген" и "антитело, специфичное к антигену" являются синонимами термина "антитело, которое специфически связывается с антигеном". Термин "производные человеческого антитела" означает любую модифицированную форму человеческого антитела, например конъюгат антитела с другим агентом или антителом. Термин "гуманизованное антитело" означает антитела, в которых последовательности CDR, происходящие от зародышевой линии млекопитающих других видов, таких как мышь, были введены в человеческие каркасные последовательности. В указанные человеческие каркасные последовательности могут быть внесены дополнительные модификации. Термин "химерное антитело" означает антитела, в которых последовательности вариабельной области происходят от животного одного вида, а последовательности константной области происходят от животных других видов, например такие антитела, в которых последовательности вариабельной области происходят от мышиного антитела, а последовательности константной области происходят от человеческого антитела. Используемый здесь термин "антитело, которое специфически связывается с человеческим O8E" означает антитело, которое связывается с человеческим O8E с KD=110-7 M или менее, более предпочтительно 510-8 М или менее, еще более предпочтительно 310-8 М или менее, еще более предпочтительно 110-9 М или менее, а наиболее предпочтительно 510-9 М или менее. Используемый здесь термин "антитело, которое, по существу, не связывается" с белком или клетками, означает антитело, которое вообще не связывается с белком или с клетками или не связывается с белком или клетками с высокой аффинностью, то есть связывается с белком или с клетками с KD=110-6M или более, более предпочтительно 110-5 М или более, более предпочтительно 110-4 М или более,еще более предпочтительно 110-3 М или более, а наиболее предпочтительно 110-2 M или более. Используемый здесь термин "Kacc" или "Ka" означает скорость ассоциации конкретного взаимодействия "антитело-антиген", а используемый здесь термин "Kдис" или "Kd" означает скорость диссоциации конкретного взаимодействия "антитело-антиген". Используемый здесь термин "KD" означает константу диссоциации, которую вычисляют исходя из отношения Kd к Ka (т.e., Kd/Ka) и выражают в виде молярной концентрации (М). Величины KD для антител могут быть определены методами, хорошо известными специалистам. Предпочтительным методом определения KD антитела является поверхностный плазмонный резонанс, а предпочтительно метод с использованием биосенсорной системы, такой как системаBiacore. Используемый здесь термин "высокая аффинность" антитела IgG означает, что данное антитело связывается с антигеном-мишенью с KD, равным 110-7 М или менее, более предпочтительно 510-8 М или менее,более предпочтительно 110-9 M или менее, а наиболее предпочтительно 510-9 М или менее. Однако "высокая аффинность" связывания для антител других изотипов может варьироваться. Так, например, "высокая аффинность" связывания антитела изотипа IgM означает связывание антитела с KD=10-6 M или менее, более предпочтительно, 10-7 М или менее, а наиболее предпочтительно, 10-8 М или менее. Используемый здесь термин "индивидуум" включает в себя человека или любое животное, не являющееся человеком. Термин "животное, не являющееся человеком" включает в себя всех позвоночных,например млекопитающих и не-млекопитающих, таких как приматы, не являющиеся человеком, овцы,собаки, кошки, лошади, коровы, куры, амфибии, рыбы, рептилии и т.п. Используемый здесь термин "O8E" является синонимом терминам "B7H4," "B7S1" и "B7x", и все эти термины встречаются в научной литературе. Аминокислотная последовательность O8E (B7H4) име-9 017086 ется в общедоступной базе данных GenBank под рег.AAZ17406, AAS13400, AAP37283, CAI12739 иCAI12737 и описана в публикациях Prasad et at (2003) Immunity 18:863-873; Sica et al. (2003) Immunity 18:849-861; а также в патенте США 6891030, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Различные аспекты настоящего изобретения более подробно описаны в нижеследующих разделах. Анти-O8E-антитела Антитела согласно изобретению отличаются по своим конкретным функциональным признакам или свойствам. Так, например, указанные антитела специфически связываются с человеческим O8E. Предпочтительно, антитело согласно изобретению связывается с O8E с высокой аффинностью, например, с KD=110-7 M или менее. Анти-O8E-антитела согласно изобретению обычно обладают по меньшей мере одним или несколькими из следующих свойств, а именно:(b) способностью связываться с клетками CHO, трансфицированными человеческим O8E. Обычно, указанное антитело связывается с человеческим O8E с KD=510-8 М или менее, с KD=1108 М или менее, с KD=510-9 М или менее, с KD=410-9 M или менее, с KD=310-9 M или менее, с KD=210-9 М ИЛИ менее или с KD=110- 9 M или менее. Стандартные анализы для оценки способности антител связываться с O8E известны специалистам,включая, например, ELISA, вестерн-блот-анализ, РИА и проточный цитометрический анализ. Подходящие анализы подробно описаны в примерах. Кинетика связывания (например, аффинность связывания) антител может быть также оценена с помощью стандартных анализов, известных специалистам, таких как ELISA-анализ, анализ по Скэтчарду и анализ в системе Biacore. Другим примером служат антитела согласно изобретению, которые могут связываться с опухолевой клеточной линией карциномы молочной железы, например с клеточной линией SKBR3. Моноклональные антитела 1G11, 2A7, 2F9, 12E1 и 13D12. Предпочтительными антителами согласно изобретению являются человеческие моноклональные антитела 1G11, 2A7, 2F9, 12E1 и 13D12, выделенные и структурно охарактеризованные, как описано в примерах 1 и 2. Аминокислотные последовательности VH антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 1, 2, 3, 4 и 5, соответственно. Аминокислотные последовательности VL антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO:6, 7, 8, 9 и 10, соответственно. Принимая во внимание тот факт, что каждое из этих антител может связываться с O8E, следует отметить, что последовательности VH и VL могут быть "смешаны и соответствующим образом подобраны" для создания других O8E-связывающих молекул антител согласно изобретению. Такие "смешанные и соответствующим образом подобранные" антитела, связывающиеся с O8E, могут быть протестированы с помощью анализов на связывание, описанных выше и в примерах (например, FACS или ELISA). При смешивании и подборе VH и VL-цепей предпочтительно, чтобы последовательность VH в конкретной паре VH/VL, была заменена структурно сходной последовательностью VH. Аналогичным образом, предпочтительно, чтобы последовательность VL в конкретной паре VH/VL была заменена структурно сходной последовательностью VL. В соответствии с этим в одном из своих аспектов настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 2, 3, 4 и 5; и(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 7, 8, 9 и 10, где указанное антитело специфически связывается с O8E, а предпочтительно с человеческим O8E. Предпочтительные комбинации тяжелой и легкой цепей включают в себя:(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ IDNO: 1; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ(b) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ IDNO: 2; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ(c) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ IDNO: 3; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ(d) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ IDNO:4; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ(e) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ IDNO: 5; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ- 10017086 В другом своем аспекте настоящее изобретение относится к антителам, содержащим CDR1, CDR2 иCDR3 тяжелой и легкой цепей антител 1G11, 2A7, 2F9, 12E1 и 13D12 или их комбинации. Аминокислотные последовательности CDR1 VH антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 11,12, 13, 14 и 15, соответственно. Аминокислотные последовательности CDR2 VH антител 1G11, 2A7, 2F9,12E1 и 13D12 представлены в SEQ ID NO: 16, 17, 18, 19 и 20, соответственно. Аминокислотные последовательности CDR3 VH антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 21, 22, 23, 24 и 25, соответственно. Аминокислотные последовательности CDR1 VK антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 26, 27, 28, 29 и 30, соответственно. Аминокислотные последовательности CDR2 VK антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 31, 32, 33, 34 и 35,соответственно. Аминокислотные последовательности CDR3 VK антител 1G11, 2A7, 2F9, 12E1 и 13D12 представлены в SEQ ID NO: 36, 37, 38, 39 и 40, соответственно. CDR-области пронумерованы по системе Кэбата (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No 91-3242). Каждая из вышеупомянутых аминокислотных и нуклеотидных последовательностей человеческих антител, представленных здесь антителами 1G11, 2A7, 2F9, 12E1 и 13D12, приводится в нижеследующей табл. 1 и в списке последовательностей.- 11017086 Таблица 1. Последовательности вариабельной и константной областей и соответствующих CDR тяжелой и легкой цепей человеческих антител 1G11, 2A7, 2F9, 12E1 и 13D12 Принимая во внимание тот факт, что каждое из указанных человеческих антител, обозначенных 1G11, 2A7, 2F9, 12E1 и 13D12, может связываться с O8E, и что специфичность связывания с антигеном обеспечивается, главным образом, областями CDR1, CDR2 и CDR3, то следует отметить, что последовательности областей CDR1, CDR2 и CDR3 VH и последовательности областей CDR1, CDR2 и CDR3 VK могут быть "смешаны и соответствующим образом подобраны" (то есть CDR от различных антител могут быть смешаны и соответствующим образом подобраны, хотя каждое антитело должно содержатьCDR1, CDR2 и CDR3 VH и CDR1, CDR2 и CDR3 VK) с получением других молекул антител, связывающихся с O8E, согласно изобретению. Связывание таких "смешанных и соответствующим образом подобранных" антител с O8E может быть протестировано с помощью анализов на связывание, описанных выше и в примерах (например, FACS, ELISA и анализ в системе Biacore). Обычно при смешивании и подборе последовательностей CDR VH предпочтительно, чтобы последовательности CDR1, CDR2 и/илиCDR3 VH в конкретной последовательности VH были заменены структурно сходной(ыми) последовательностью(ями) CDR. Аналогичным образом, при смешивании и подборе последовательностей CDR VK предпочтительно,чтобы последовательности CDR1, CDR2 и/или CDR3 в конкретной последовательности VK были заменены структурно сходной(ыми) последовательностью(ями) CDR. Среднему специалисту в данной области очевидно, что новые последовательности VH и VL могут быть получены путем замены одной или нескольких последовательностей области CDR VH и/или VL структурно сходными последовательностями,происходящими от последовательностей CDR, описанных в настоящей заявке для моноклональных антител 1G11, 2A7, 2F9, 12E1 и 13D12. В соответствии с этим, в другом своем аспекте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 12, 13, 14 и 15;(b) CDR2 вариабельной области тяжелой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16, 17, 18, 19 и 20;(c) CDR3 вариабельной области тяжелой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 21, 22, 23, 24 и 25;(d) CDR1 вариабельной области легкой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, 27, 28, 29 и 30;(e) CDR2 вариабельной области легкой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, 32, 33, 34 и 35; и(f) CDR3 вариабельной области легкой цепи, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 36, 37, 38, 39 и 40, где указанное антитело спе- 17017086 цифически связывается с O8E, а предпочтительно с человеческим O8E. В предпочтительном варианте изобретения указанное антитело содержит:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(b) CDR2 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(c) CDR3 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID NO: 21;(d) CDR1 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 26;(e) CDR2 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 31; и(f) CDR3 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 36. В другом предпочтительном варианте изобретения указанное антитело содержит:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(b) CDR2 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(c) CDR3 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(d) CDR1 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 27;(e) CDR2 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 32; и(f) CDR3 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 37. В другом предпочтительном варианте изобретения указанное антитело содержит:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(b) CDR2 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(c) CDR3 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(d) CDR1 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 28;(e) CDR2 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 33; и(f) CDR3 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 38. В другом предпочтительном варианте изобретения указанное антитело содержит:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(b) CDR2 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(c) CDR3 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(d) CDR1 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 29;(e) CDR2 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 34; и(f) CDR3 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 39. В другом предпочтительном варианте изобретения указанное антитело содержит:(a) CDR1 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(b) CDR2 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(c) CDR3 вариабельной области тяжелой цепи, включающую в себя последовательность SEQ ID(d) CDR1 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 30;(e) CDR2 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID(f) CDR3 вариабельной области легкой цепи, включающую в себя последовательность SEQ ID NO: 40.- 18017086 Хорошо известно, что один домен CDR3, независимо от домена(ов) CDR1 и/или CDR2, может определять специфичность связывания антитела с когнатным антигеном и что, как предполагается, исходя из известной последовательности CDR3, может быть генерировано множество антител, обладающих одной и той же специфичностью связывания. См., например, публикацию Klimka et al., British J. of Cancer 83 (2):252-260 (2000) (где описано продуцирование гуманизованного анти-CD30-антитела с использованием только CDR3 вариабельного домена тяжелой цепи мышиного анти-CD30 антитела Ki-4); публикацию Beiboer et al., J. Mol. Biol. 296:833-849 (2000) (где описано продуцирование рекомбинантных антител против эпителиального гликопротеина-2 (EGP-2) с использованием только последовательности CDR3 тяжелой цепи родительского мышиного анти-EGP-2 антитела МОС-31); публикацию Rader et al., Proc.Natl. Acad. Sci U.S.A. 95:8910-8915 (1998) (где описано продуцирование панели гуманизованных антител против интегрина v3 с использованием CDR3 вариабельного домена тяжелой и легкой цепей мышиного антитела против интегрина v3 LM609, где каждое из указанных антител содержит отличающуюся последовательность, находящуются за пределами домена CDR3 и способную связываться с тем же эпитопом, с которым связывается родительское мышиное антитело, и с такой же аффинностью, как и родительское мышиное антитело, или с более высокой аффинностью); публикацию Barbas et al., J. Am. Chem.Soc. 116:2161-2162 (1994) (где описано, что домен CDR3 играет главную роль в связывании с антигеном); публикацию Barbas et al., Proc. Natl. Acad. Sci. U.S.A. 92:2529-2533 (1995) (где описано встраивание последовательностей CDR3 тяжелой цепи трех Fab-фрагментов антитела (SI-1, SI-40 и SI-32) против ДНК человеческой плаценты в тяжелую цепь Fab-фрагмента против столбнячного токсоида, где указанное введение приводит к замене CDR3, присутствующего в тяжелой цепи, и указывает на то, что специфичность связывания определяется лишь одним доменом CDR3); и публикацию Ditzel et al., J. Immunol. 157:739-749 (1996) (где описаны исследования по встраиванию, которые показали, что перенос только одного домена CDR3 тяжелой цепи Fab родительского полиспецифического антитела LNA3 в тяжелую цепь Fab моноспецифического антитела IgG p313 против столбнячного токсоида является достаточным для сохранения специфичности связывания родительского Fab). Каждая из этих публикаций во всей своей полноте вводится в настоящее описание посредством ссылки. В соответствии с этим, в некоторых своих аспектах настоящее изобретение относится к моноклональным антителам, содержащим один или несколько доменов CDR3 тяжелой и/или легкой цепей, происходящих от нечеловеческого антитела, такого как мышиное или крысиное антитело, где указанное моноклинальное антитело обладает способностью специфически связываться с O8E. В некоторых вариантах изобретения, такие антитела согласно изобретению, содержащие один или несколько доменов CDR3 тяжелой и/или легкой цепей, происходящих от нечеловеческого антитела, (a) обладают способностью конкурировать за связывание с соответствующим родительским нечеловеческим антителом; (b) сохраняют функциональные свойства указанного родительского антитела; (c) связываются с таким же эпитопом и/или (d) обладают такой же аффинностью связывания, как и соответствующее родительское нечеловеческое антитело. В других своих аспектах настоящее изобретение относится к моноклональным антителам, содержащим один или несколько доменов CDR3 тяжелой и/или легкой цепей, происходящих от первого человеческого антитела, такого как, например, человеческое антитело, полученное от животного, не являющегося человеком, где указанное первое человеческое антитело обладает способностью специфически связываться с O8E, и где указанный домен CDR3 первого человеческого антитела заменяет домен CDR3 в человеческом антителе, которое не обладает способностью специфически связываться с O8E, в результате чего образуется второе человеческое антитело, обладающее способностью специфически связываться с O8E. В некоторых вариантах изобретения, антитела согласно изобретению, содержащие один или несколько доменов CDR3 тяжелой и/или легкой цепей, происходящих от первого человеческого антитела, (a) обладают способностью конкурировать за связывание с соответствующим родительским первым человеческим антителом; (b) сохраняют функциональные свойства указанного родительского антитела;(c) связываются с таким же эпитопом и/или (d) обладают такой же аффинностью связывания, как и соответствующее родительское первое человеческое антитело. Антитела, имеющие конкретные последовательности зародышевой линии В некоторых вариантах изобретения антитело согласно изобретению содержит вариабельную область тяжелой цепи, происходящую от конкретного гена тяжелой цепи иммуноглобулина зародышевой линии и/или вариабельную область легкой цепи, происходящую от конкретного гена легкой цепи иммуноглобулина зародышевой линии. Так, например, в своем предпочтительном варианте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим вариабельную область тяжелой цепи, которая является продуктом человеческого гена VH4-34 или происходит от этого продукта, где указанное антитело специфически связывается с O8E. В другом своем предпочтительном варианте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область тяжелой цепи, которая является продуктом человеческого гена VH3-53 или происходит от этого продукта, где указанное антитело специфи- 19017086 чески связывается с O8E. В другом своем предпочтительном варианте настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающей вариабельную область тяжелой цепи, которая является продуктом комбинированного человеческого генаVH3-9/D3-10/JH6b или происходит от этого продукта, где указанное антитело специфически связывается с O8E. В другом своем предпочтительном варианте настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область легкой цепи, которая является продуктом человеческого гена VKA27 или происходит от этого продукта, где указанное антитело специфически связывается с O8E. В другом своем предпочтительном варианте настоящее изобретение относится также к выделенному моноклональному антителу или к его антигенсвязывающей части, включающим в себя вариабельную область легкой цепи, которая является продуктом комбинированого человеческого гена VKL6/JK1 или происходит от этого продукта, где указанное антитело специфически связывается с O8E. В еще одном своем предпочтительном варианте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, где указанное антитело:(a) содержит вариабельную область тяжелой цепи, которая является продуктом или происходит от продукта человеческого гена VH4-34, человеческого гена VH3-53 или комбинированного человеческого гена VH3-9/D3-10/JH6b (которые кодируют аминокислотные последовательности, представленные в SEQ(b) содержит вариабельную область легкой цепи, которая является продуктом или происходит от продукта человеческого гена VKA27 или комбинированного человеческого гена VKL6/JK1 (которые кодируют аминокислотные последовательности, представленные в SEQ ID NO: 54 и 55, соответственно); и(c) специфически связывается с O8E, а предпочтительно, с человеческим O8E. Примерами антител, имеющих VH и VK, кодируемых генами VH4-34 и VKA27, соответственно, являются 1G11 и 13D12. Примерами антител, имеющих VH и VK, кодируемых генами VH3-53 и VKA27, соответственно, являются 2A7 и 2F9. Примером антитела, имеющего VH и VK, кодируемых генами VH39/D3-10/JH6b и VKL6/JK1, соответственно, является 12E1. Используемое здесь человеческое антитело содержит вариабельные области тяжелой или легкой цепей, которые являются "продуктом" или "происходят от" конкретной последовательности зародышевой линии, если вариабельные области указанного антитела были получены из системы, в которой используются гены иммуноглобулина человеческой зародышевой линии. Такие системы включают в себя иммунизацию трансгенной мыши, несущей гены человеческого иммуноглобулина, представляющим интерес антигеном, или скрининг библиотеки генов человеческого иммуноглобулина, представленных на фаге, с использованием представляющего интерес антигена. Человеческое антитело, которое является"продуктом" последовательности или "происходит от" последовательности иммуноглобулина человеческой зародышевой линии, может быть идентифицировано путем сравнения аминокислотной последовательности человеческого антитела с аминокислотными последовательностями иммуноглобулинов человеческой зародышевой линии и отбора последовательности иммуноглобулина человеческой зародышевой линии, которая является наиболее сходной (то есть имеет наибольший % идентичности) с последовательностью человеческого антитела. Человеческое антитело, которое является "продуктом" конкретной последовательности иммуноглобулина человеческой зародышевой линии или "происходит от" такой последовательности, может содержать аминокислоты, отличающиеся от аминокислот сравниваемой последовательности зародышевой линии, что обусловлено, например, природными соматическими мутациями или искусственным введением сайт-направленной мутации. Однако аминокислотная последовательность выбранного человеческого антитела, обычно по меньшей мере на 90% идентична аминокислотной последовательности, кодируемой геном иммуноглобулина человеческой зародышевой линии и содержит аминокислотные остатки, которые позволяют идентифицировать данное антитело как человеческое антитело при его сравнении с аминокислотными последовательностями иммуноглобулина зародышевой линии других видов (например, с последовательностями мышиной зародышевой линии). В некоторых случаях, аминокислотная последовательность человеческого антитела может быть по меньшей мере на 95%, или даже по меньшей мере на 96, 97, 98 или 99% идентична аминокислотной последовательности,кодируемой геном иммуноглобулина зародышевой линии. В некоторых вариантах изобретения человеческое антитело, происходящее от конкретной последовательности человеческой зародышевой линии,имеет не более чем 10 аминокислот, отличающихся от аминокислот последовательности, кодируемой геном иммуноглобулина человеческой зародышевой линии. В некоторых других вариантах изобретения указанное человеческое антитело может иметь не более чем 5, или даже не более чем 4, 3, 2 или 1 аминокислоту, отличающихся от аминокислот последовательности, кодируемой геном иммуноглобулина человеческой зародышевой линии. Гомологичные антитела В другом варианте осуществления изобретения антитело согласно изобретению содержит вариабельные области тяжелой и легкой цепей, включающие в себя аминокислотные последовательности, гомологичные аминокислотным последовательностям описанных здесь предпочтительных антител, где- 20017086 указанные антитела сохраняют нужные функциональные свойства анти-O8E-антител согласно изобретению. Так, например, настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:(a) указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность,которая по меньшей мере на 80% гомологична аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4 и 5;(b) указанная вариабельная область легкой цепи содержит аминокислотную последовательность,которая по меньшей мере на 80% гомологична аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 6, 7, 8, 9 и 10;(c) указанное антитело связывается с человеческим O8E с KD=110-7 M или менее;(d) указанное антитело связывается с клетками CHO, трансфицированными человеческим O8E. В других вариантах изобретения, указанным антителом может быть, например, человеческое антитело, гуманизованное антитело или химерное антитело. В других вариантах изобретения, аминокислотные последовательности VH и/или VL могут быть на 85, 90, 95, 96, 97, 98 или 99% гомологичны вышеуказанным последовательностям. Антитело, имеющее области VH и VL, являющиеся в высокой степени (то есть на 80% или более) гомологичными областям VH и VL вышеуказанных последовательностей, могут быть получены путем мутагенеза (например, сайтнаправленного или ПЦР-опосредуемого мутагенеза) молекул нуклеиновой кислоты, кодирующих последовательности SEQ ID NO: 41, 42, 43, 44, 45, 46, 47, 48, 4 9 и 50, с последующим тестированием кодируемого модифицированного антитела на сохранение его функций (то есть функций, указанных выше в пунктах (c)-(d в соответствии с описанными здесь функциональными анализами. Используемый здесь термин "процент гомологии двух аминокислотных последовательностей" эквивалентен термину "процент идентичности двух последовательностей". Процент идентичности двух последовательностей зависит от числа положений идентичных аминокислот в этих двух последовательностях (то есть % гомологии =идентичных аминокислот в данных положениях/общее число положений 100) с учетом числа пробелов и длины каждого пробела, которые необходимо ввести для оптимального сопоставления двух последовательностей путем выравнивания. Сравнение последовательностей и определение процента идентичности двух последовательностей может быть осуществлено с помощью математического алгоритма, описанного ниже в неограничивающих примерах. Процент идентичности двух аминокислотных последовательностей может быть определен с помощью алгоритма E. Meyers and W. Miller (Comput. Appl. Biosci., 4:11-17 (1988, который был введен в программу ALIGN (version 2.0), с использованием таблицы "весов" остатков PAM120, штрафа на пробелудлинение=12, и штрафа на пробел-пропуск=4. Кроме того, процент идентичности двух аминокислотных последовательностей может быть определен с помощью алгоритма Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970, который был введен в программу GAP, входящую в пакет программ GCG (доступных на сайте www.gcg.com), с использованием либо матрицы Blossum 62, либо матрицы PAM250 и "весов" пробелов-пропусков, составляющих 16, 14, 12, 10, 8, 6, или 4 и "весов" длин (участков), составляющих 1,2, 3, 4, 5 или 6. Дополнительно или альтернативно, последовательности белка согласно изобретению могут быть также использованы в качестве "запрашиваемой последовательности" для осуществления поиска в общедоступных базах данных, например, в целях идентификации родственных последовательностей. Такой поиск может быть проведен с помощью программы XBLAST (version 2.0) Altschul, et al. (1990) J. Mol.Biol. 215:403-10. Поиск белков BLAST может быть осуществлен с помощью программы XBLAST, где при "весовом коэффициенте"=50 и длине "слова"=3, могут быть получены аминокислотные последовательности, гомологичные последовательностям молекул антител согласно изобретению. Для осуществления выравнивания с пробелами в целях сопоставления последовательностей может быть использована программа Gapped BLAST, описанная Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При работе с программами BLAST и Gapped BLAST могут быть использованы параметры по умолчанию, установленные в соответствующих программах (например, XBLAST и NBLAST). См. www.ncbi.nlm.nih.gov. Антитела с консервативными модификациями В некоторых вариантах изобретения антитело согласно изобретению содержит вариабельную область тяжелой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3, и вариабельную область легкой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3, где один или несколько указанных последовательностей CDR имеют конкретные аминокислотные последовательности,полученные на основе последовательностей описанных здесь предпочтительных антител (например,1G11, 2A7, 2F9, 12E1 и 13D12) или их консервативные модификации, и где указанные антитела сохраняют нужные функциональные свойства анти-O8E-антител согласно изобретению. В соответствии с этим настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим вариабельную область тяжелой цепи, включающую в себя последовательно- 21017086 сти CDR1, CDR2 и CDR3, и вариабельную область легкой цепи, включающую в себя последовательности(a) последовательность CDR3 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей(b) последовательность CDR3 вариабельной области легкой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID(c) указанное антитело связывается с человеческим O8E с KD=110-7 M или менее; и(d) указанное антитело связывается с клетками CHO, трансфицированными человеческим O8E. В предпочтительном варианте изобретения указанная последовательность CDR2 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 16, 17, 18, 19 и 20 и их консервативных модификаций; а последовательность CDR2 вариабельной области легкой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 31, 32, 33, 34 и 35 и их консервативных модификаций. В другом предпочтительном варианте изобретения указанная последовательность CDR1 вариабельной области тяжелой цепи включает в себя аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 11, 12, 13, 14 и 15 и их консервативных модификаций; а последовательность CDR1 вариабельной области легкой цепи включает в себя аминокислотную последовательность,выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 26, 27, 28, 29 и 30 и их консервативных модификаций. В различных вариантах изобретения указанным антителом могут быть, например, человеческие антитела, гуманизованные антитела или химерные антитела. Используемый здесь термин "консервативные модификации последовательности" означает аминокислотные модификации, которые не оказывают значительного воздействия или влияния на связывающие свойства антитела, содержащего данную аминокислотную последовательность. Такими консервативными модификациями являются аминокислотные замены, добавления и делеции. Модификации могут быть введены в антитело согласно изобретению стандартными методами, известными специалистам,такими как сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез. Консервативными аминокислотными заменами являются замены, в которых данный аминокислотный остаток заменен аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, известны специалистам. Такие семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), аминокислоты с кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота); аминокислоты с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан); аминокислоты с неполярными боковыми цепями (например, аланин, валин, лейцин,изолейцин, пролин, фенилаланин, метионин); аминокислоты с бета-разветвленными боковыми цепями(например, треонин, валин, изолейцин) и аминокислоты с ароматическими боковыми цепями (например,тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в областях CDR антитела согласно изобретению могут быть заменены другими аминокислотными остатками, принадлежащими к семейству аминокислотных остатков, имеющих аналогичные боковые цепи, и такое модифицированное антитело может быть протестировано на сохранение его функции. Антитела, которые связываются с таким же эпитопом, как и анти-O8E-антитела согласно изобретению В другом своем варианте настоящее изобретение относится к антителам, которые связываются с таким же эпитопом на человеческом O8E, как и анти-O8E-антитела согласно изобретению (то есть антитела, которые обладают способностью конкурировать с любым из моноклональных антител согласно изобретению за перекрестное связывание с O8E). В предпочтительных вариантах изобретения эталонным антителом, используемым в исследованиях на конкуренцию за перекрестное связывание, может быть моноклональное антитело 1G11 (имеющее последовательности VH и VL, представленные в SEQ ID NO: 1 и 6, соответственно), или моноклональное антитело 2A7 (имеющее последовательности VH и VL, представленные в SEQ ID NO: 2 и 7, соответственно), или моноклональное антитело 2F9 (имеющее последовательности VH и VL, представленные в SEQ ID NO: 3 и 8, соответственно), или моноклональное антитело 12E1 (имеющее последовательности VH и VL, представленные в SEQ ID NO: 4 и 9, соответственно),или моноклональное антитело 13D12 (имеющее последовательности VH и VL, представленные в SEQ IDNO: 5 и 10, соответственно). Такие конкурирующие за перекрестное связывание антитела могут быть идентифицированы по их способности конкурировать за перекрестное связывание с 1G11, 2A7, 2F9,12E1 и 13D12 в стандартных анализах на связывание с O8E. Так, например, анализ в системе BIAcore,анализ ELISA или проточный цитометрический анализ могут быть использованы для иллюстрации конкуренции за перекрестное связывание с антителами согласно изобретению. Способность тестируемого антитела ингибировать связывание антитела, например, 1G11, 2A7, 2F9, 12E1 или 13D12 с человеческимO8E, указывает на то, что тестируемое антитело может конкурировать с антителами 1G11, 2A7, 2F9,12E1 и 13D12 за связывание с человеческим O8E, а, поэтому оно связывается с тем же эпитопом на человеческом O8E, с которым связываются антитела 1G11, 2A7, 2F9, 12E1 или 13D12. В предпочтительном варианте изобретения антитело, которое связывается с тем же эпитопом на человеческом O8E, с которым связываются антитела 1G11, 2A7, 2F9, 12E1 и 13D12, представляет собой человеческое моноклональное антитело. Такие человеческие моноклональные антитела могут быть получены и выделены как описано в примерах. Сконструированные и модифицированные антитела. Антитело согласно изобретению может быть также получено с использованием антитела, имеющего одну или несколько описанных здесь последовательностей VH и/или VL В качестве исходного материала для конструирования модифицированного антитела, где указанное модифицированное антитело может обладать свойствами, отличающимися от свойств исходного антитела. Антитело может быть сконструировано путем модификации одного или нескольких остатков в одной или обеих вариабельных областях (то есть VH и/или VL), например, в одной или нескольких областях CDR и/или в одной или нескольких каркасных областях. Дополнительно или альтернативно, антитело может быть сконструировано путем модификации остатков в константной(ых) области(ях), например, в целях изменения эффекторной(ых) функции(й) указанного антитела. Одним из подходящих методов конструирования вариабельных областей является присоединение CDR. Антитела взаимодействуют с антигеном-мишенью преимущественно посредством аминокислотных остатков, которые локализованы в шести гипервариабельных областях (CDR) тяжелой и легкой цепей. По этой причине аминокислотные последовательности CDR в отдельных антителах имеют большие отличия, чем последовательности, расположенные за пределами этих CDR. Поскольку последовательности CDR являются ответственными за большинство взаимодействий антитело-антиген, то могут быть экспрессированы рекомбинантные антитела, которые имитируют свойства конкретных природных антител, путем конструирования экспрессирующих векторов, включающих в себя последовательности CDR, происходящие от специфических природных антител, присоединенных к каркасным последовательностями другого антитела с другими свойствами (см., например, Riechmann, L. et al. (1998) Nature 332:323-327; Jones,P. et al. (1986) Nature 321:522-525; Queen, C et al. (1989) Proc. Natl. Acad. Sci. U.S.A. 86:10029-10033; патент США 5225539, Winter и патенты США 5530101, 5585089, 5693762 и 6180370, Queen et al. ). В соответствии с этим в другом своем варианте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающей части, содержащим вариабельную область тяжелой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3, имеющие аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 12, 13, 14 и 15; SEQ IDNO: 16, 17, 18, 19 и 20 и SEQ ID NO: 21, 22, 23, 24 и 25, соответственно, и вариабельную область легкой цепи, включающую в себя последовательности CDR1, CDR2 и CDR3, имеющие аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, 27, 28, 29 и 30; SEQ ID NO: 31, 32,33, 34 и 35; и SEQ ID NO: 36, 37, 38, 39 и 40, соответственно. Таким образом, указанные антитела содержат последовательности CDR VH и VL моноклональных антител 1G11, 2A7, 2F9, 12E1 и 13D12, и они могут также содержать различные каркасные последовательности этих антител. Такие каркасные последовательности могут быть получены из общедоступных баз данных ДНК или известных последовательностей, которые включают в себя последовательности генов антител зародышевой линии. Так, например, последовательности ДНК зародышевой линии, включающие в себя гены вариабельной области человеческой тяжелой и легкой цепей, можно найти в базе данных последовательностей человеческой зародышевой линии "VBase" (доступной в Интернете на сайте www.mrccpe.cam.ac.uk/vbase), a также в публикациях Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication91-3242;Directory of Human Germ-line VH Segments Reveals a Strong Bias in their Usage" Eur. J. Immunol. 24:827836; содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки. В другом примере, последовательности ДНК генов вариабельной области тяжелой и легкой цепей человеческой зародышевой линии можно найти в базе данных Genbank. Так, например, нижеследующие последовательности тяжелой цепи зародышевой линии, присутствующие в мышином HuMAb HCo7, имеются в базе данных Genbank под соответствующими регистрационными номерами: 1-69 (NG0010109,NT024637 и BC070333), 3-33 (NG0010109 и NT024637) и 3-7 (NG0010109 и NT024637). В другом примере, нижеследующие последовательности тяжелой цепи зародышевой линии, присутствующие в мышином HuMAb HCo12, имеются в базе данных Genbank под соответствующими регистрационными номерами: 1-69 (NGJ3010109, NT024637 и ВС 070333), 5-51 (NG0010109 и NT024637), 4-34(NG0010109 NT024637), 3-30.3 (CAJ556644) и 3-23 (AJ406678). Белковые последовательности антитела сравнивали с последовательностями белков, имеющихся в компилированной базе данных, с применением программ поиска сходства последовательностей, называемых Gapped BLAST (Altschul et al. (1997) Nucleic Acids Research 25:3389-3402), которые хорошо известны специалистам. BLAST представляет собой эвристический алгоритм, в котором при статистически значимом сопоставлении путем выравнивания последовательности антитела с последовательностью базы- 23017086 данных, выравниваемые "слова", вероятно, содержат пары сегментов с высокими "весовыми коэффициентами" (HSP). Пары сегментов, "весовые коэффициенты" которых не могут быть улучшены путем удлинения или усечения, называются "наилучшими совпадениями". Вкратце, нуклеотидные последовательности в начале последовательности VBASE (vbase.mrc-cpe.cam.ac.uk/vbase1/list2.php) были транслированы, а область между каркасными областями FR1-FR3, включительно, сохранялась. Последовательности базы данных имеют среднюю длину в 98 остатков. Дубликаты последовательностей, которые имеют точные соответствия по всей длине белка, были удалены. Поиск белков в BLAST, проводимый с использованием программы blastp со стандартными параметрами по умолчанию, за исключением"фильтра" для последовательностей низкой сложности, который был "отключен", и матрицы замен BLOSUM62, выявил 5 наилучших совпадений последовательностей. Эти нуклеотидные последовательности были транслированы во всех шести рамках считывания, и рамка считывания без стоп-кодонов в сегменте соответствующей последовательности базы данных рассматривалась как последовательность, имеющая,по всей вероятности, наилучшее совпадение. Это, в свою очередь, было подтверждено с помощью программы tblastx, входящей в пакет BLAST и позволяющей транслировать последовательности антитела во всех шести рамках считывания и сравнивать эти транслированные последовательности с нуклеотидными последовательностями VBASE, динамически транслируемыми всех шести рамках считывания. Идентичность означает точные соответствия между последовательностью антитела и последовательностью белка в базе данных на протяжении всей длины данной последовательности. Положительные"веса" (идентичность + соответствие замен) означают лишь идентичности аминокислотных замен, присваиваемых матрицей замен BLOSUM62. Если последовательность антитела соответствует двум последовательностям в базе данных с той же степенью идентичности, то совпадение с наибольшим положительным "весом" должно рассматриваться как наилучшее совпадение последовательностей. Предпочтительными каркасными последовательностями, используемыми в антителах согласно изобретению, являются последовательности, которые имеют структурное сходство с каркасными последовательностями, используемыми в выбранных антителах согласно изобретению, например, они имеют сходство с каркасными последовательностями VH4-34 (SEQ ID NO: 51) и/или каркасными последовательностями VH3-53 (SEQ ID NO: 52) и/или с комбинированными каркасными последовательностями VH3-9/D310/JH6b (SEQ ID NO: 53) и/или каркасными последовательностями VKA27 (SEQ ID NO: 54) и/или с комбинированными каркасными последовательностями VKL6/JK1 (SEQ ID NO: 55), используемым в предпочтительных моноклональных антителах согласно изобретению. Последовательности CDR1, CDR2 иCDR3 VH и последовательности CDR1, CDR2 и CDR3 VK могут быть присоединены к каркасным областям, которые имеют последовательности, идентичные последовательностям, обнаруженным в гене иммуноглобулина зародышевой линии, от которого происходит данная каркасная последовательность, либо последовательности CDR могут быть присоединены к каркасным областям, содержащим одну или несколько мутаций по сравнению с последовательностями зародышевой линии. Так, например, было обнаружено, что в некоторых случаях может оказаться предпочтительным введение мутаций в положения остатков в каркасных областях в целях сохранения или усиления антигенсвязывающей способности антитела (см., например, патенты США 5530101; 5585089; 5693762 и 6180370, Queen et al.). Модификация вариабельной области другого типа представляет собой мутацию аминокислотных остатков в областях CDR1, CDR2 и/или CDR3 VH и/или VK, которую вводят в целях улучшения одного или нескольких связывающих свойств (например, аффинности) представляющего интерес антитела. Сайт-направленный мутагенез или ПЦР-опосредованный мутагенез может быть проведен для введения мутации(й), и их влияние на связывание антитела или другое представляющее интерес функциональное свойство может быть оценено в in vitro или in vivo анализах, описанных выше и в примерах. Предпочтительными являются консервативные модификации (обсуждаемые выше). Такими мутациями могут быть аминокислотные замены, добавления или делеции, однако предпочтительными являются замены. Кроме того, обычно в область CDR вводят не более чем одну, две, три, четыре или пять модификаций остатков. В соответствии с этим в другом своем варианте настоящее изобретение относится к выделенным моноклональным антителам против O8E или к их антигенсвязывающим частям, включающим в себя вариабельную область тяжелой цепи, содержащую:(a) область CDR1 VH, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 12, 13, 14 и 15, или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению с(b) область CDR2 VH, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16, 17, 18, 19 и 20, или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению с(c) область CDR3 VH, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 21, 22, 23, 24 и 25, или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению с(d) область CDR1 VK, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, 27, 28, 29 и 30; или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению с(e) область CDR2 VK, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, 32, 33, 34 и 35, или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению с(f) область CDR3 VK, включающую в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 36, 37, 38, 39 и 40; или аминокислотную последовательность, имеющую одну, две, три, четыре или пять аминокислотных замен, делеций или добавлений по сравнению сSEQ ID NO: 36, 37, 38, 39 и 40. Сконструированными антителами согласно изобретению являются антитела, у которых в VH и/или в VK были сделаны модификации каркасных остатков в целях улучшения свойств данного антитела. Обычно, такие модификации в каркасных областях вводят в целях снижения иммуногенности антитела. Так, например, одним из методов является введение "обратной мутации" одного или нескольких каркасных остатков в соответствующую последовательность зародышевой линии. Более конкретно, антитело,которое было подвергнуто соматической мутации, может содержать каркасные остатки, отличающиеся от остатков последовательности зародышевой линии, от которой происходит данное антитело. Такие остатки могут быть идентифицированы путем сравнения каркасных последовательностей антитела с последовательностями зародышевой линии, от которых происходит данное антитело. Так, например, в 1G11, аминокислотным остатком 71 (в FR3) VH является аланин, а соответствующим остатком в последовательности VH4-34 зародышевой линии является валин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, соматические мутации могут быть подвергнуты "обратной мутации" с получением последовательности зародышевой линии, например, посредством сайт-направленного мутагенеза или ПЦРопосредуемого мутагенеза (например, остаток 71 в области FR3 в VH антитела 1G11 может быть подвергнут "обратной мутации" путем замены аланина на валин). Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 1G11, аминокислотным остатком 81 (в FR3) VH является аргинин, а соответствующим остатком в последовательности VH4-34 зародышевой линии является лизин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 81 в области FR3 в VH антитела 1G11 может быть подвергнут "обратной мутации" путем замены аргинина на лизин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 13D12, аминокислотным остатком 83 (в FR3) VH является аспарагин, а соответствующим остатком в последовательности VH4-34 зародышевой линии является серин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 83 в области FR3 в VH антитела 13D12 может быть подвергнут "обратной мутации" путем замены аспарагина на серин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 2A7, аминокислотным остатком 67 (в FR3) VH является валин, а соответствующим остатком в последовательности VH3-53 зародышевой линии является фенилаланин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 67 в области FR3 в VH антитела 2A7 может быть подвергнут "обратной мутации" путем замены валина на фенилаланин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 2F9, аминокислотным остатком 28 (в FR1) VH является изолейцин, а соответствующим остатком в последовательности VH3-53 зародышевой линии является треонин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 28 в области FR1 в VH антитела 2F9 может быть подвергнут "обратной мутации" путем замены изолейцина на треонин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 12E1, аминокислотным остатком 23 (в FR1) VH является валин, а соответствующим остатком в последовательности VH3-9 зародышевой линии является аланин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 23 в области FR1 в VH антитела 12E1 может быть подвергнут "обратной мутации" путем замены валина на аланин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 1G11, аминокислотным остатком 7 (в FR1) VK является фенилаланин, а соответствующим остатком в последовательности VKA27 зародышевой линии является серин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародыше- 25017086 вой линии, например, остаток 7 в области FR1 в VK антитела 1G11 может быть подвергнут "обратной мутации" путем замены фенилаланина на серин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. В другом примере, в 1G11, аминокислотным остатком 47 (в FR2) VK является валин, а соответствующим остатком в последовательности VKA27 зародышевой линии является лейцин. Для возвращения последовательностям каркасной области конфигураций, которые они имели в исходной зародышевой линии, например, остаток 47 в области FR2 в VK антитела 1G11 может быть подвергнут "обратной мутации" путем замены валина на лейцин. Такие антитела "с обратными мутациями" также входят в объем настоящего изобретения. Модификация каркасной области другого типа включает в себя мутацию одного или нескольких остатков в каркасной области или даже в одной или нескольких областях CDR, вводимую в целях удаленияT-клеточных эпитопов для снижения потенциальной иммуногенности антитела. Этот метод также называется "деиммунизацией" и подробно описан в публикации заявки на патент США 2003/0153043, Carret al. Сконструированными антителами согласно изобретению также являются антитела, в которые были внесены модификации аминокислотных остатков в целях усиления или ослабления иммуногенных ответов, где указанные модификации приводят к изменению взаимодействия T-клеточного эпитопа с данным антителом (см. патенты США 6835550; 6897049 и 6936249). Помимо модификаций или в качестве альтернативы модификациям, вводимым в каркасные области или в области CDR, антитела согласно изобретению могут быть сконструированы так, чтобы они имели модификации в Fc-области, которые обычно приводят к изменению одного или нескольких функциональных свойств данного антитела, таких как время полужизни в сыворотке, фиксация комплемента, связывание с Fc-рецептором и/или антигензависимая клеточная цитотоксичность. Кроме того, антитело согласно изобретению может быть химически модифицировано (например, к такому антителу могут быть присоединены одна или несколько химических групп), или оно может быть модифицировано для изменения уровней его гликозилирования, которое также осуществляют в целях изменения одного или нескольких функциональных свойств антитела. Каждый из этих вариантов изобретения более подробно описан ниже. Остатки в Fc-области пронумерованы в соответствии с Европейской нумерацией по Кэбату. В одном из вариантов изобретения шарнирную область CH1 модифицируют в целях изменения числа цистеиновых остатков в этой области, например, для их увеличения или снижения. Этот метод подробно описан в патенте США 5677425, Bodmer et al. Число цистеиновых остатков в шарнирной области CH1 изменяют, например, для облегчения сборки легкой и тяжелой цепей или для повышения, или снижения стабильности антитела. В другом варианте изобретения шарнирную область Fc антитела подвергают мутации для уменьшения биологического времени полужизни данного антитела. Более конкретно, одну или несколько аминокислотных мутаций вводят в область стыка доменов CH2-CH3 шарнирного Fc-фрагмента для того, чтобы данное антитело обладало ослабленной способностью связываться со стафиллококковым белком A(SpA) по сравнению со SpA-связывающим доменом нативной Fc-шарнирной области. Этот метод подробно описан в патенте США 6165745, Ward et al. В другом варианте изобретения, указанное антитело модифицируют в целях увеличения его биологического времени полужизни. Для этого могут быть применены различные методы. Так, например, могут быть введены одна или несколько из нижеследующих мутаций: T252L, T254S, T256F, как описано в патенте США 6277375, Ward. Альтернативно, для увеличения биологического времени полужизни,указанное антитело может быть модифицировано в области CH1 или CL, так, чтобы оно содержало эпитоп связывания с рецептором "спасения", происходящий от двух "петель" домена CH2 в Fc-области IgG, как описано в патентах США 5869046 и 6121022, Presta et al. В других вариантах изобретения Fc-область модифицируют путем замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком в целях изменения эффекторной(ых) функции(й) антитела. Так, например, одна или несколько аминокислот, выбранных из аминокислотных остатков 234, 235, 236, 237, 297, 318, 320 и 322, могут быть заменены другим аминокислотным остатком, так,чтобы данная замена приводила к изменению аффинности данного антитела по отношению к эффекторному лиганду, но с сохранением антигенсвязывающей способности родительского антитела. Эффекторным лигандом, по отношению к которому может быть изменена аффинность антитела, может быть, например, Fc-рецептор или компонент C1 комплемента. Этот метод подробно описан в патентах США 5624821 и 5648260, Winter et al. В другом примере одна или несколько аминокислот, выбранных из аминокислотных остатков 329,331 и 322, могут быть заменены другими аминокислотными остатками так, чтобы данная замена приводила к изменению способности данного антитела связываться с CIq и/или к снижению или устранению комплементзависимой цитотоксичности (CDC). Этот метод подробно описан в патенте США 6194551,Idusogie et al. В другом примере, один или несколько аминокислотных остатков в положениях аминокислот 231 и- 26017086 239 модифицируют в целях изменения способности антитела к фиксации комплемента. Этот метод подробно описан в публикации заявки PCT WO 94/29351, Bodmer et al. В еще одном примере Fc-область модифицируют в целях повышения способности антитела опосредовать антитело-зависимую клеточную цитотоксичность (ADCC) и/или в целях повышения аффинности данного антитела к Fc-рецептору путем модификации одной или нескольких аминокислот в следующих положениях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283,285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327,329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434,435, 437, 438 или 439. Этот метод подробно описан в публикации заявки PCT WO 00/42072, Presta. Кроме того, сайты связывания на человеческих IgG1 для FcRI, FcRII, FcRIII и FcRn были картированы, и были описаны варианты с улучшенной способностью к связыванию (см. Shields, R.L. et al. (2001) J. Biol.Chem. 27 6:6591-6604). Было показано, что специфические мутации в положениях 256, 290, 298, 333, 334 и 339 приводят к повышению уровня связывания с FcRIII. Кроме того, было показано, что нижеследующие комбинации мутаций, а именно, T256A/S298A, S298A/E333A, S298A/K224A иS298A/E333A/K334A, приводят к повышению уровня связывания с FcRIII. В еще одном варианте изобретения рассматриваются изменения уровня гликозилирования антитела. Так, например, может быть получено негликозилированное антитело (то есть антитело, не содержащее гликозильных групп). Уровень гликозилирования может быть, например, изменен в целях повышения аффинности данного антитела к антигену. Такие углеводные модификации могут быть осуществлены, например, путем введения изменений в один или несколько сайтов гликозилирования в последовательности антитела. Так, например, могут быть введены одна или несколько аминокислотных замен,приводящих к элиминации одного или нескольких сайтов гликозилирования каркасного участка вариабельной области и, тем самым, к удалению гликозильных групп в данном сайте. Такое агликозилирование может приводить к повышению аффинности антитела по отношению к антигену. Этот метод был подробно описан в патентах США 5714350 и 6350861, Co et al. Дополнительно или альтернативно может быть получено антитело, имеющее измененный тип гликозилирования, такое как гипофукозилированное антитело, имеющее пониженное количество фукозильных остатков, или антитело, имеющее большое число групп GlcNac, расщепляющихся между двумя остатками. Было продемонстрировано, что такое изменение характера гликозилирования будет приводить к повышению ADCC-активности антитела. Указанные углеводные модификации могут быть осуществлены, например, путем экспрессии антитела в клетке-хозяине с измененным характером гликозилирования. Клетки с измененным характером гликозилирования описаны в литературе и могут быть использованы в качестве клеток-хозяев, в которых экспрессируются рекомбинантные антитела согласно изобретению и,тем самым, продуцируются антитела с измененным характером гликозилирования. Так, например, в клеточных линиях Ms704, Ms705 и Ms709 отсутствует ген фукозилтрансферазы, FUT8 (альфа-(1,6)фукозилтрансферазы), а поэтому антитела, экспрессируемые в клеточных линиях Ms704, Ms705 и Ms709 не содержат фукозу в своих углеводах. FUT8-/клеточные линии Ms704, Ms705 и Ms709 были созданы путем направленной дизрупции гена FUT8 в клетках CHO/DG44 с использованием двух векторов замещения (см. публикацию патента США 20040110704, Yamane et al. и публикацию Yamane-Ohnuki et al.(2004) Biotechnol. Bioeng. 87:614-22). Другим примером является клеточная линия, описанная в EP 1176195, Hanai et al., а именно, клеточная линия с функционально инактивированным геном FUT8, который кодирует фукозилтрансферазу, а поэтому антитела, экспрессируемые в такой клеточной линии обнаруживают гипофукозилирование в результате снижения уровня фермента с альфа-1,6-связью или его элиминации. В работе Hanai и др. также описаны клеточные линии, которые обладают низкой ферментативной активностью в отношении присоединения фукозы к N-ацетилглюкозамину, связывающемуся сFc-областью антитела, или не обладают такой ферментативной активностью, например, клеточная линия крысиной миеломы YB2/0 (ATCC CRL 1662). В публикации заявки PCT WO 03/035835, Presta, описан вариант клеточной линии CHO, а именно, клетки Lec 13, которые обладают пониженной способностью присоединять фукозу к Asn(297)-связанным углеводам, что также приводит к гипофукозилированию антител, экспрессирующихся в данной клетке-хозяине (см. также Shields, R.L. et al. (2002) J. Biol. Chem. 277:26733-26740). В публикации заявки PCT WO 99/54342, Umana et al. описаны клеточные линии, сконструированные в целях экспрессии гликопротеин-модифицирующих гликозилтрансфераз (например, бета(1,4)-N-ацетилглюкозаминил-трансферазы III (GnTIII, в результате чего антитела, экспрессируемые в сконструированных клеточных линиях, будут иметь большое число групп GlcNac, расщепляющихся между двумя остатками, что будет приводить к повышению ADCC-активности этих антител (см. такжеUmana et al. (1999) Nat. Biotech. J7:176-180). Альтернативно, фукозные остатки антитела могут быть отщеплены под действием фермента фукозидазы. Так, например, альфа-L-фукозидаза удаляет фукозильные остатки из антител (Tarentino, A.L. et al. (1975) Biochem. 14:5516-23). Другой модификацией описанных здесь антител, рассматриваемой в настоящем изобретении, является ПЭГилирование. Антитело может быть ПЭГилировано, например, в целях увеличения биологического времени полужизни антитела (например, в сыворотке). Для ПЭГилирования антитела указанное- 27017086 антитело или его фрагмент обычно подвергают реакции с полиэтиленгликолем (ПЭГ), таким как реакционноспособное сложноэфирное или альдегидное производное ПЭГ, в условиях, при которых одна или несколько групп ПЭГ присоединяются к антителу или к его фрагменту. Предпочтительно, ПЭГилирование осуществляют посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой ПЭГ (или с аналогичным реакционноспособным водорастворимым полимером). Используемый здесь термин "полиэтиленгликоль" охватывает любые формы ПЭГ, которые были использованы для дериватизации других белков, такие как моно-(C1-C10)-алкокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. В некоторых вариантах изобретения, ПЭГилируемым антителом является агликозилированное антитело. Методы ПЭГилирования белков известны специалистам и могут быть применены к антителам согласно изобретению. См., например, EP0154316, Nishimura et al. и EP 0401384, Ishikawa et al. Методы конструирования антител Как обсуждалось выше, анти-O8E-антитела, имеющие описанные здесь последовательности VH иVK, могут быть использованы для создания новых анти-O8E-антител путем модификации последовательностей VH и/или VK или присоединенной(ых) к ним константной(ых) области(ей). Таким образом, в другом аспекте изобретения, структурные особенности анти-O8E-антитела согласно изобретению, например, 1G11, 2A7, 2F9, 12E1 или 13D12, используются для создания структурно родственных антиO8E-антител, которые сохраняют по меньшей мере одно функциональное свойство антител согласно изобретению, такое как связывание с человеческим O8E. Так, например, одна или несколько областейCDR антител 1G11, 2A7, 2F9, 12E1 или 13D12 или их мутантов могут быть объединены рекомбинантными методами с известными каркасными областями и/или с другими CDR с получением дополнительных рекомбинантно сконструированных анти-O8E-антител согласно изобретению, обсуждаемых выше. Модификациями других типов являются модификации, описанные в предыдущем разделе. Исходным материалом для такого метода конструирования являются одна или несколько из описанных здесь последовательностей VH и/или VK или одна или несколько их CDR-областей. Для создания сконструированного антитела, фактически, необязательно получать (то есть экспрессировать в виде белка) антитело, имеющее одну или несколько рассматриваемых здесь последовательностей VH и/или VK или одну или несколько их CDR-областей. Точнее говоря, информация, содержащаяся в указанной(ых) последовательности(ях), используется в качестве исходного материала для создания последовательности(ей) "второй генерации", происходящей(их) от исходной(ых) последовательности(ей), с последующим получением последовательности(ей) "второй генерации" и их экспрессии в виде белка. В соответствии с этим, в другом своем варианте настоящее изобретение относится к способу получения анти-O8E-антитела включающему в себя:(a) создание антитела, имеющего: (i) последовательность вариабельной области тяжелой цепи антитела, включающую в себя последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 11, 12, 13, 14 и 15; последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 16, 17,18, 19 и 20; и/или последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 21, 22, 23,24 и 25; и/или (ii) последовательность вариабельной области легкой цепи антитела, включающую в себя последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 26, 27, 28, 29 и 30; последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 31, 32, 33, 34 и 35; и/или последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 36, 37, 38, 39 и 40;(b) модификацию по меньшей мере одного аминокислотного остатка в последовательности вариабельной области тяжелой цепи антитела, и/или в последовательности вариабельной области легкой цепи антитела, в целях создания по меньшей мере одной модифицированной последовательности антитела; и(c) экспрессию указанной модифицированной последовательности антитела в виде белка. Для получения и экспрессии модифицированной последовательности антитела могут быть применены стандартные методы молекулярной биологии. Обычно, антителом, кодируемым модифицированной(ыми) генныой(ыми) последовательностью(ями) антител, является антитело, которое сохраняет одно, несколько или все функциональные свойства описанных здесь анти-O8E-антител, где такими функциональными свойствами являются, но не ограничиваются ими;(ii) связывание с O8E-трансфицированными человеческими клетками CHO. Функциональные свойства модифицированных антител могут быть оценены с помощью стандартных анализов, известных специалистам и/или описанных в настоящей заявке, таких как анализы, описанные в примерах (например, анализы с применением проточной цитометрии, анализы на связывание). В некоторых вариантах методов конструирования антител согласно изобретению, в полноразмерную последовательность, кодирующую анти-O8E-антитело или в ее часть, могут быть введены неспецифические или специфические мутации, и полученные модифицированные анти-O8E-антитела могут быть скринированы на активность связывания и/или другие описанные здесь функциональные свойства. Методы введения мутаций описаны в литературе. Так, например, в публикации заявки PCT WO 02/092780,Short, описаны методы создания и скрининга мутированных антител с применением сайт-насыщенного- 28017086 мутагенеза, синтетической сборки путем лигирования или их комбинаций. Альтернативно, в публикацииPCT WO 03/074679, Lazar et al., описаны компьютеризированные методы скрининга для оптимизации физико-химических свойств антител. Молекулы нуклеиновых кислот, кодирующие антитела согласно изобретению В другом своем аспекте настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим антитела согласно изобретению. Такие нуклеиновые кислоты могут присутствовать в целых клетках, в клеточных лизатах или в частично очищенной или, по существу, в чистой форме. Нуклеиновая кислота является "выделенной" или "по существу, чистой", если она очищена от других клеточных компонентов или других примесей, например, от других клеточных нуклеиновых кислот или белков, стандартными методами, включая обработку щелочью/ДСН, центрифугирование в градиенте плотности CsCl,колоночную хроматографию, электрофорез на агарозном геле и другие методы, хорошо известные специалистам. См. F. Ausubel, et al., ed. (1987) Current Protocols in Molecular Biology, Greene Publishing andWiley Interscience, New York. Нуклеиновая кислота согласно изобретению, может представлять собой,например, ДНК или РНК, и может содержать, а может и не содержать, интронные последовательности. В предпочтительном варианте изобретения нуклеиновой кислотой является молекула кДНК. Нуклеиновые кислоты согласно изобретению могут быть получены стандартными методами молекулярной биологии. Для антител, экспрессируемых гибридомами (например, гибридомами, полученными от трансгенных мышей, несущих гены человеческого иммуноглобулина и подробно описанных ниже), кДНК, кодирующие легкую и тяжелую цепи антитела, продуцируемого гибридомами, могут быть получены стандартными методами ПЦР-амплификации или клонирования кДНК. Для антител, полученных из библиотеки генов иммуноглобулина (например, с применением методов фагового представления), нуклеиновая кислота, кодирующая указанное антитело, может быть выделена из этой библиотеки. Предпочтительными молекулами нуклеиновой кислоты согласно изобретению являются молекулы,кодирующие последовательности VH и VL моноклональных антител 1G11, 2A7, 2F9, 12E1 или 13D12. Последовательности ДНК, кодирующие последовательности VH антител 1G11, 2A7, 2F9, 12E1 и 13D12,представлены в SEQ ID NO: 41, 42, 43, 44 и 45, соответственно. Последовательности ДНК, кодирующие последовательности VL антител 1G11, 2A7, 2F9, 12E1 и 13D12, представлены в SEQ ID NO: 46, 47, 48, 49 и 50, соответственно. После получения фрагментов ДНК, кодирующих сегменты VH и VL, эти фрагменты ДНК могут быть затем модифицированы стандартными методами рекомбинантных ДНК, например, для конверсии генов вариабельной области в гены, кодирующие цепь полноразмерного антитела, в гены Fab-фрагмента или в ген scFv. При этих манипуляциях VL- или VH-кодирующий ДНК-фрагмент функционально присоединяют к другому ДНК-фрагменту, кодирующему другой белок, такой как константная область антитела или гибкий линкер. Термин "функционально присоединенный", используемый в данном контексте, означает, что два ДНК-фрагмента присоединены друг к другу так, что аминокислотные последовательности кодируются этими двумя ДНК-фрагментами с сохранением рамки считывания. Выделенная ДНК, кодирующая область VH, может быть трансформирована в ген, кодирующий полноразмерную тяжелую цепь, путем функционального присоединения VH-кодирующей ДНК к другой молекуле ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константной области человеческой тяжелой цепи известны специалистам (см., например, Kabat, E.Human Services, NIH Publication No 91-3242), а ДНК-фрагменты, включающие в себя эти области, могут быть получены стандартным методом ПЦР-амплификации. Константной областью тяжелой цепи могут быть константные области IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, а наиболее предпочтительно,константная область IgG1 или IgG4. Для гена Fab-фрагмента тяжелой цепи, VH-кодирующая ДНК может быть функционально присоединена к другой молекуле ДНК, кодирующей только константную областьCH1 тяжелой цепи. Выделенная ДНК, кодирующая область VL, может быть превращена в ген полноразмерной легкой цепи (а также в ген легкой цепи Fab) путем функционального присоединения VL-кодирующей ДНК к другой молекуле ДНК, кодирующей константную область легкой цепи, CL. Последовательности генов человеческой константной области легкой цепи известны специалистам (см., например, Rabat, E. A., et al.Services, NIH Publication No 91-3242), а ДНК-фрагменты, включающие в себя эти области, могут быть получены стандартным методом ПЦР-амплификации. Константной областью легкой цепи может быть константная область каппа или лямбда, а наиболее предпочтительно константная область каппа. Для создания гена scFv, VH- и VL-кодирующие ДНК-фрагменты функционально присоединяют к другому фрагменту, кодирующему гибкий линкер, например, кодирующему аминокислотную последовательность (Gly4-Ser)3, так, чтобы последовательности VH и VL могли экспрессироваться в виде единого одноцепочечного белка, причем указанные области VL и VH присоединены друг к другу посредством гибкого линкера (см., например, Bird et al. (1988), Science 242:423-426; Huston et al. (1988), Proc. Natl.
МПК / Метки
МПК: G01N 33/53, A61P 35/00, C07K 16/28
Метки: человеческие, применение, моноклональные, о8е, против, антитела
Код ссылки
<a href="https://eas.patents.su/30-17086-chelovecheskie-monoklonalnye-antitela-protiv-o8e-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Человеческие моноклональные антитела против о8е и их применение</a>
Предыдущий патент: Лиофилизированная композиция терапевтического пептидного антитела
Следующий патент: Отверждающие агенты для эпоксифункциональных соединений
Случайный патент: Силовой аксоидный механизм