Производные циклогексиламида арилкарбоновой кислоты
Номер патента: 17000
Опубликовано: 28.09.2012
Авторы: Хершпергер Рене, Янзер Филипп, Мильтц Вольфганг
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
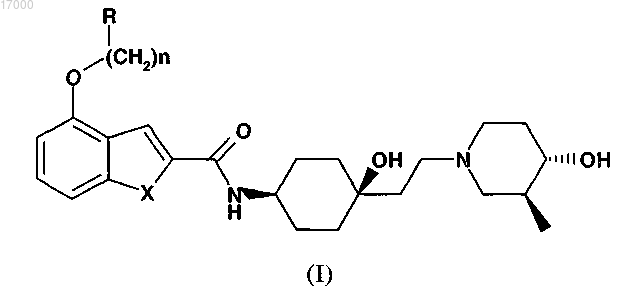
в которой X обозначает CH2 или NH;
n равно 1 или 2;
R выбран из группы, включающей C3-C10-циклоалкил, C3-C10-гетероциклоалкил, в котором гетероатом представляет собой O или S, C3-C10-гетероарил, содержащий один или два гетероатома, выбранных из O, N или S, C6-C10-арил;
R включает необязательно сконденсированную с ним группу B, выбранную из C3-C8-циклоалкила, C6-C10-арила; и
R и B, каждый независимо, являются незамещенным или замещенным R1, который обозначает один, два или три заместителя, независимо выбранных из группы, включающей галоген, C1-C7-алкоксигруппу, оксогруппу, C1-C7-алкил, C1-C7-алкокси-C1-C7-алкоксигруппу; R1 сам является незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из C1-C6-алкила, C1-C6-алкоксигруппы.
2. Соединение по п.1, в котором X обозначает NH.
3. Соединение по п.1 или 2, в котором R обозначает C3-C10-гетероарил, и R и В, каждый независимо, являются незамещенным или замещенным R1, значения которого определены в п.1.
4. Соединение по любому из предыдущих пунктов, в котором R обозначает бензофуранил.
5. Соединение по любому из предыдущих пунктов, выбранное из группы, включающей:
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-циклобутилметокси-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(тетрагидрофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(фуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(2-хлортиазол-4-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6-метоксипиридин-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[(S)-1-(2,3-дигидробензофуран-3-ил)метокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-((R,S)-6-метокси-2,3-дигидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(4-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(4,6-дифторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(5-хлорбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6-этоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6-циклопропилметоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[6-(2-этоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[6-((RS)-2-метокси-1-метилэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[6-(2-изопропоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[6-(3-метоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[6-(3-этоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-{6-[(S)-(тетрагидрофуран-3-ил)окси]бензофуран-3-илметокси}-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(6-фторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-(7-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(2-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(3-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(4-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(2-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(6-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты,
{4-гидрокси-4-[2-((3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексил}амид 4-[2-(6-метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновой кислоты.
6. Способ получения соединения формулы (I) по п.1, включающий реакцию соединения формулы (III)
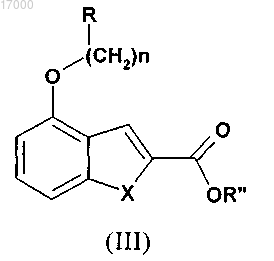
в которой R" обозначает H или C1-C7-алкильную группу, с соединением формулы (IV)
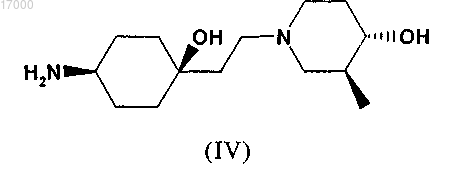
и извлечение полученного соединения формулы (I) в свободной форме или в форме соли.
7. Фармацевтическая композиция, включающая соединение по п.1 вместе с фармацевтически приемлемым разбавителем или носителем.
8. Применение соединения по п.1 для приготовления лекарственного средства, предназначенного для применения для лечения аутоиммунного или воспалительного заболевания или патологического состояния.
9. Применение соединения по п.1 для приготовления лекарственного средства, предназначенного для борьбы с инфицированием посредством ВИЧ или СПИД.
10. Способ ингибирования хемокиновых рецепторов или макрофагального белка или ослабления воспаления у субъекта, нуждающегося в таком лечении, который включает введение указанному субъекту соединения по п.1 в эффективном количестве.
11. Способ лечения воспалительного или аутоиммунного заболевания или патологического состояния, включающий введение указанному субъекту соединения по п.1 в эффективном количестве.
12. Способ борьбы с инфицированием посредством ВИЧ или СПИД, включающий введение указанному субъекту соединения по п.1 в эффективном количестве.
13. Применение соединения по п.1 в комбинации с одним или более средствами, выбранными из группы, включающей метотрексат, анти-TNF средство, анти-IL-1 средство, нуклеозидный или ненуклеозидный ингибитор обратной транскриптазы, ингибитор протеазы ВИЧ, ингибитор слияния и антиретровирусное средство для лечения воспалительного или аутоиммунного заболевания или патологического состояния или для борьбы с ВИЧ или СПИД.
Текст
ПРОИЗВОДНЫЕ ЦИКЛОГЕКСИЛАМИДА АРИЛКАРБОНОВОЙ КИСЛОТЫ Настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где варианты значений R и X определены в описании. 017000 Настоящее изобретение относится к бициклическим карбониламинопроизводным, которые являются антагонистами хемокинового рецептора 2 (CCR-2) и хемокинового рецептора 5 (CCR-5), и к их применению для лечения заболеваний и нарушений, которые включают миграцию и активацию моноцитов иT-клеток, включая воспалительные заболевания. Первым объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая сольR выбран из группы, включающей C3-C10-циклоалкил, C3-C10-гетероциклоалкил, в котором гетероатом представляет собой O или S, C3-C10-гетероарил, содержащий один или два гетероатома, выбранных из O, N или S, C6-C10-арил;R включает необязательно сконденсированную с ним группу B, выбранную из C3-C8-циклоалкила,C6-C10-арила; иR и B, каждый независимо, являются незамещенным или замещенным R1, который обозначает один, два или три заместителя, независимо выбранных из группы, включающей галоген, C1-C7 алкоксигруппу, оксогруппу, C1-C7-алкил, C1-C7-алкокси-C1-C7-алкоксигруппу;R1 сам является незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из C1-C6-алкила, C1-C6-алкоксигруппы. Для исключения сомнений следует понимать, что приведенные ниже термины обладают указанными значениями во всем описании и формуле изобретения. Термин "низш." в названиях органических радикалов и соединений означает соединение или радикал, который может быть разветвленным или неразветвленным и содержит до 7 атомов углерода включительно. Низш. алкильная группа может быть разветвленной, неразветвленной или циклической и содержать от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Низш. алкил означает, например: метил, этил, пропил, бутил, изопропил, изобутил, трет-бутил или 2,2-диметилпропил. Низш. алкоксигруппа может быть разветвленной или неразветвленной и содержать от 1 до 7 атомов углерода, предпочтительно от 1 до 6 атомов углерода. Низш. алкоксигруппа означает, например: метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, изопропоксигруппу, изобутоксигруппу или трет-бутоксигруппу. Низш. алкоксигруппа включает циклоалкилоксигруппу и циклоалкил-низш. алкилоксигруппу. В настоящей заявке заместители, содержащие кислород, например алкоксигруппа, алкенилоксигруппа, алкинилоксигруппа, карбонил и т.п. включают их серусодержащие гомологи, например тиоалкоксигруппу, тиоалкенилоксигруппу, тиоалкинилоксигруппу, тиокарбонил, сульфон, сульфоксид и т.п. Галоген означает хлор, фтор, бром или йод. Арил означает карбоциклический арил, гетероарил или биарил. Карбоциклический арил означает ароматический циклический углеводород, содержащий от 6 до 10 кольцевых атомов. Он может быть моноциклическим, бициклическим или трициклическим, например нафтил, фенил, или фенил, моно-, ди- или тризамещенный 1, 2 или 3 заместителями. Гетероарил означает ароматический моноциклический или бициклический углеводород, содержащий от 3 до 10 кольцевых атомов, один или два из которых являются гетероатомами, выбранными из O,N и S. Предпочтительно, если содержатся 1 или 2 гетероатома. Гетероарил означает, например пиридил,индолил, хиноксалинил, хинолинил, изохинолинил, бензотиенил, бензофуранил, бснзопиранил, бензотиопиранил, фуранил, пирролил, тиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил,имидазолил, тиенил, тиазолил. Гетероарил также включает такие замещенные радикалы. Циклоалкил означает моно-, ди- или трициклический углеводород, который может быть насыщенным или ненасыщенным и который содержит от 3 до 10 кольцевых атомов, предпочтительно от 3 до 6 кольцевых атомов. Циклоалкил включает мостиковые и конденсированные кольцевые системы. Циклоалкил означает, например, циклопропил, циклобутил, циклопентил или циклогексил. Циклоалкил необязательно может быть замещенным. Гетероциклоалкил означает моно-, ди- или трициклический углеводород, который может быть насыщенным или ненасыщенным и который содержит один гетероатом, выбранный из O или S. Предпочтительно, если он содержит от 3 до 10 кольцевых атомов. Термин гетероциклоалкил также включает мостиковые и конденсированные гетероциклоалкильные группы, такие как 3-гидрокси-8 азабицикло[3.2.1]окт-8-ил.-1 017000 Фармацевтически приемлемые пролекарства-сложные эфиры представляют собой сложноэфирные производные, которые путем сольволиза или при физиологических условиях способны превращаться в свободную карбоновую кислоту формулы (I). Такие сложные эфиры представляют собой, например,низш. алкиловые сложные эфиры (такие как метиловые или этиловые сложные эфиры), карбокси-низш. алкиловые сложные эфиры, такие как карбоксиметиловый сложный эфир, нитроокси-низш. алкиловые сложные эфиры (такие как 4-нитрооксибутиловый сложный эфир). В формуле (I) предпочтительно, если X обозначает NH. Предпочтительно, если n равно 1. Более предпочтительно, если R обозначает тиазолил, пиридинил, бензофуранил, бензофуранил или 4,5,6,7-тетрагидробензофуранил, который является незамещенным или замещенным R1, значения которого определены выше. Еще более предпочтительно, если R обозначает бензофуранил, который является незамещенным или замещенным R1, значения которого определены выше. Еще более предпочтительно, если R обозначает тетрагидрофуранил или 2,3-дигидробензофуранил. В каждом случае R является незамещенным или замещенным, как определено выше. Предпочтительными соединениями формулы I являются: 4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-циклобутилметокси-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(тетрагидрофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(фуран-3 илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(2-хлортиазол-4-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-метоксипиридин-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4-оксо 4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[(S)-1-(2,3 дигидробензофуран-3-ил)метокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-R,S)-6 метокси-2,3-дигидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4,6-дифторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(5-хлорбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-этоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-циклопропилметоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[6-(2-этоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[6-RS)-2 метокси-1-метилэтокси)бензофуран-3-илметокси]-1 Н-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[6-(2-изопропоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[6-(3-метоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[6-(3-этоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-6-[(S)(тетрагидрофуран-3-ил)окси]бензофуран-3-илметокси-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-фторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(7-метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,-2 017000 4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(2-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(3-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(4-метоксифенил)этокси]-1H-индоп-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(2-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(6-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(6-метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновой кислоты. Соединение формулы (I) может быть использовано в качестве лекарственного средства, предназначенного для предупреждения, облегчения протекания или лечения аутоиммунного или воспалительного заболевания или патологического состояния. Другим объектом настоящего изобретения является способ получения соединения формулы (I),включающий реакцию соединения формулы (III) и извлечение полученного соединения формулы (I) в свободной форме или в форме соли. Способ, предлагаемый в настоящем изобретении, осуществляют обычным образом. Способ представляет собой реакцию конденсации между кислотой или сложным эфиром и амином. Его обычно осуществляют путем реакции кислоты с амином в присутствии реагентов сочетания, например, TBTU/ДИЭА в растворителе, таком как ДМФ, или по реакции сложного эфира с амином в присутствии реагента сочетания, такого как НОВТ/ЭДХ. Соответствующее соединение формулы (III) можно получить, как описано ниже, по схеме реакций 4 из этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты, которую саму можно получить, как показано на схеме 1. Соединение формулы (IV) можно получить в соответствии со схемами 2 и 3, приведенными ниже. Соединения, предлагаемые в настоящем изобретении, можно выделить из реакционной смеси и очистить обычным образом. Изомеры, такие как энантиомеры, можно получить обычным образом, например, с помощью фракционированной кристаллизации или асимметрического синтеза из соответствующих асимметрически замещенных, например, оптически активных исходных веществ. Исходные вещества и промежуточные продукты являются известными или их можно получить по обычным методикам или аналогично, как это описано в примерах. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение формулы (I) вместе с фармацевтически приемлемым разбавителем или носителем. Другим объектом настоящего изобретения является применение соединения формулы (I) для приготовления лекарственного средства, предназначенного для применения для лечения аутоиммунного или воспалительного заболевания или патологического состояния. Другим объектом настоящего изобретения является способ ингибирования хемокиновых рецепторов или макрофагальных белков или ослабления воспаления у субъекта, нуждающегося в таком лечении,который включает введение указанному субъекту эффективного количества соединения формулы (I). Другим объектом настоящего изобретения является способ лечения воспалительного или аутоиммунного заболевания или патологического состояния, включающий введение указанному субъекту эффективного количества соединения формулы (I). Средства, предлагаемые в настоящем изобретении, можно получить по описанным ниже методикам.EtOAc: Этиловый эфир уксусной кислоты НС 1: Хлористо-водородная кислота НОВТ: Бензотриазол-1-ол АГЛ: Алюмогидрид литияTBTU: O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат трет-BuOH: 2-Метилпропан-2-ол ТГФ: Тетрагидрофуран ТСХ: Тонкослойная хроматография Спектры H-ЯМР снимают на ЯМР спектрометре Varian Gemini 400 МГц. Основные пики приведены в следующем порядке: мультиплетность (s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет;br, широкий) и количество протонов. Масс-спектры с ионизацией электрораспылением (ИЭР) снимают на масс-спектрометре Hewlett Packard 5989A. Данные масс-спектрометрии приведены в виде отношений массы к заряду. Очистку с помощью препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) проводят на колонках XTerraNV RP18 19150 мм, используя в качестве элюентов смеси ацетонитрил/вода или MeOH/вода. Все реагенты, исходные вещества и промежуточные продукты, используемые в этих примерах, имеются в продаже или их можно легко получить по методикам, известным специалисту в данной области техники. Синтез структурного элемента, индола. Структурный элемент, индол 2, получают по приведенной ниже схеме реакций. Схема реакций 1(1). Этиловый эфир 4-бензилокси-1H-индол-2-карбоновой кислоты (50 г, 169 ммоль) и диметиламинопиридин (ДМАП) суспендируют в 100 мл этилацетата. По каплям добавляют раствор Boc2O (36,9 г, 169 ммоль) в этилацетате и смесь перемешивают при комнатной температуре в течение 5 ч. Смесь последовательно промывают водой и рассолом. Органический слой сушат над сульфатом натрия и выпаривают при пониженном давлении. Желтое твердое вещество используют на следующей стадии без дополнительной очистки. МС (ИЭР): 396 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 7,5 (d, 1H), 7,48 (d, 2H), 7,36 (d, 2H), 7,34(m, 1H), 7,31 (m, 1H), 7,22 (s, 1H), 6,92 (d, 1H), 5,26 (s, 2H), 4,28 (q, 2H), 1,56 (s, 9H), 1,31 (t, 3H). Стадия B: 1-трет-Бутиловый эфир, 2-этиловый эфир 4-гидроксииндол-1,2-дикарбоновой кислоты (2). В круглодонную колбу в атмосфере аргона помещают 10% палладий на угле (1 г) и заливают с помощью 50 мл этанола. Добавляют раствор 1-трет-бутилового эфира,2-этилового эфира (4 бензилоксииндол-1,2-дикарбоновой кислоты (1) (35 г, 88,5 ммоль) в 250 мл этанола, затем добавляют формиат аммония (6,3 г, 97,4 ммоль). Смесь перемешивают при КТ в течение 30 мин (за протеканием реакции следят с помощью ТСХ). После завершения реакции смесь фильтруют и выпаривание смеси-4 017000 дает белое твердое вещество, которое затем очищают путем перекристаллизации из смеси диэтиловый эфир/гексаны. МС (ИЭР): 208 [M]+, 1H-ЯМР (ДМСО-d6):(част./млн) 10,2 (br, 1H), 7,4 (d, 1H), 7,28 (s, 1H), 7,25(dd, 1H), 6,67 (d, 1H), 4,3 (q, 2H), 1,53 (s, 9H), 1,3 (t, 3H). Синтез структурных элементов, аминов. Структурные элементы, амины 6 и 14, получают по приведенной ниже схеме реакций. Схема реакций 2 Синтез (3S,4S)-3-метилпиперидин-4-илового эфира 2,2-диметилпропионовой кислоты (6). Стадия А: (1-RS,3-RS)-1-Бензил-3-метилпиперидин-4-ол (3). 1-Бензил-3-метил-4-пиперидон (25 г, 123 ммоль) растворяют в 200 мл метанола и перемешивают при КТ. В течение 1 ч небольшими порциями добавляют NaBH4 (2,3 г, 61,5 ммоль) (экзотермическая реакция, 30C). Желтый раствор перемешивают при комнатной температуре в течение еще 30 мин. Затем смесь выпаривают при пониженном давлении, растворяют в этилацетате и промывают водой. МС (ИЭР): 205 [M]+, 1H-ЯМР (CDCl3):(част./млн) 7,15-7,3 (m, 5H), 4,5 и 4,3 (d, OH), 3,38 (s, 2H),3,55 и 2,89 (m, 1H), 2,6-2,75 (m, 2H), 1,9 (dt, 1H), 1,7 (m, 1H), 1,65 (m, 1H), 1,3-1,5 (m, 2H), 0,84 (d, 3H). Стадия В: (3RS,4RS)-1-Бензил-3-метилпиперидин-4-иловый эфир 2,2-диметилпропионовой кислоты(1-RS,3-RS)-1-Бензил-3-метилпиперидин-4-ол (3) (24,9 г, 121 ммоль) растворяют в 500 мл сухого ТГФ. Добавляют триэтиламин (25,4 мл, 182 ммоль), затем медленно добавляют пивалоилхлорид (21,9 г,182 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи (80C). Смесь фильтруют и разбавляют диэтиловым эфиром. Органический слой промывают 1 н. водным раствором гидроксида натрия и рассолом, сушат над Na2SO4 и выпаривают при пониженном давлении. Неочищенный продукт (смесь цис/транс-изомеров) очищают с помощью флэш-хроматографии (силикагель, этилацетат/гексаны 5:95) и получают чистый транс-изомер. МС (ИЭР): 290 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 7,28 (m, 5H), 4,75 (m, 1H), 3,42 (d, 2H), 2,5(m, 2H), 1,9-2,2 (m, 3H), 1,7 (m, 2H), 1,15 (s, 9H), 0,78 (d, 3H). Стадия С: (3RS,4RS)-3-Метилпиперидин-4-иловый эфир 2,2-диметилпропионовой кислоты (5). В круглодонную колбу в атмосфере аргона помещают гидроксид палладия (20% на угле, 1,5 г) и заливают метанолом. Добавляют раствор (3RS,4RS)-1-бензил-3-метилпиперидин-4-илового эфира 2,2 диметилпропионовой кислоты (4) (15 г, 51,8 ммоль) в 300 мл метанола, затем добавляют 1,3 М метанольный раствор HCl (62 мл, 78 ммоль). Затем смесь гидрируют при атмосферном давлении в течение 20 ч. Раствор фильтруют через целит и выпаривают при пониженном давлении. Остаток растворяют в диэтиловом эфире и промывают 1 н. водным раствором гидроксида натрия и рассолом. Объединенные органические слои сушат над Na2SO4 и выпаривают при пониженном давлении. МС (ИЭР): 200 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 4,32 (dt, 1H), 3,3 (br, 1H), 2,85 (m, 2H), 2,45(3RS,4RS)-3-Метилпиперидин-4-иловый эфир 2,2-диметилпропионовой кислоты (5) (9,6 г, 48 ммоль) растворяют в 50 мл этилацетата. По каплям добавляют раствор (-)-дибензоилтартрата (8,6 г, 24 ммоль) в этилацетате. Осадок отфильтровывают и промывают охлажденным этилацетатом и получают бесцветные кристаллы. Синтез (3S,4S)-1-[2-(цис-4-амино-1-гидроксициклогексил)этил]-3-метилпиперидин-4-ола (14). Стадия A: (Циклогекс-2-енсульфонил)бензол (7). Бромциклогексен (35,9 мл, 310,5 ммоль) растворяют в 1 л ДМФ, охлаждают до 0C и после добавления натриевой соли бензолсульфиновой кислоты (86,6 г, 527,8 ммоль) смесь перемешивают при комнатной температуре в течение 17 ч. Затем смесь выпаривают в высоком вакууме. Остаток разбавляют эфиром, промывают водой, сушат над Na2SO4 и выпаривают при пониженном давлении. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (1:9), 1 кг силикагеля). МС (ИЭР): 223,3 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 7,88 (d, 2H), 7,65 (d, 1H), 7,56 (dd, 2H), 6,1(m, 1H), 6,8 (m, 1H), 3,75 (m, 1H), 1,4-2,0 (m, 6H). Стадия B: [2-(1-Бензолсульфонилциклогекс-2-енил)этоксиметил]бензол (8). Циклогекс-2-енсульфонилбензол (7) (10 г, 45 ммоль) растворяют в 450 мл сухого ТГФ и охлаждают до -20C. Затем добавляют 1,6 М BuLi в гексане (30,9 мл, 49,5 ммоль) и смесь перемешивают в течение 15 мин. После добавления бензил-2-бромэтилового эфира (8,5 мл, 54 ммоль) смесь перемешивают при 0C в течение 1 ч. Затем смесь выпаривают досуха. Остаток обрабатывают смесью лед/1 М HCl и дважды экстрагируют эфиром. Объединенные органические слои сушат над Na2SO4 и выпаривают при пониженном давлении. Продукт используют на следующей стадии без дополнительной очистки. МС (ИЭР): 357,2 [M+H]+, 1H-ЯМР (CDCl3):(част./мли) 7,85 (d, 2H), 7,85 (dd, 1H), 7,55 (dd, 2H),7,25-7,35 (m, 5H), 6,15 (m, 1H), 5,65 (d, 1H), 4,45 (s, 2H), 3,5-3,8 (m, 3H), 1,4-2,3 (m, 7H). Стадия C: (2-Циклогекса-1,3-диенилэтоксиметил)бензол (9).[2-(1-Бензолсульфонилциклогекс-2-енил)этоксиметил]бензол (8) (16 г, 44,9 ммоль) растворяют в трет-бутаноле (450 мл) и после добавления трет-бутоксида калия (11,1 г, 98,7 ммоль) смесь перемешивают при 80C в течение 32 ч. Затем смесь выливают на лед и экстрагируют пентаном. Органический слой отделяют, промывают насыщенным раствором NaCl и сушат над Na2SO4. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (1:9), силикагель). МС (ИЭР): 215 [M+H]+, 1H-ЯМР (CDCl3):(част./млн), 7,2-7,4 (m, 5H), 5,84 (m, 1H), 5,65 (m, 2H),4,45 (m, 2H), 3,55 (t, 2H), 2,32 (t, 2H), 2,0-2,3 (m, 4H). Стадия D: трет-Бутиловый эфир (1S,4S)-1-(2-бензилоксиэтил)-2-окса-3-азабицикло[2.2.2]окт-5-ен-3 карбоновой кислоты (10).(2-Циклогекса-1,3-диенилэтоксиметил)бензол (9) (6 г, 28 ммоль) растворяют в 280 мл сухого метиленхлорида и охлаждают до 0C. Небольшими порциями добавляют молекулярные сита (6 г, UOP Type 4A) и N-BOC-гидроксиламин (5,6 г, 42 ммоль), затем небольшими порциями медленно добавляют тетрапропиламмоний(мета)периодат (10,8 г, 28 ммоль) и смесь перемешивают в течение 1 ч. Затем смесь разбавляют с помощью CH2Cl2 и охлаждают до -10C. Медленно добавляют 2 М раствор Na2S2O5 (экзотермическая реакция). Смесь промывают водой, сушат над Na2SO4 и выпаривают при пониженном давлении. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (1:9), силикагель). МС (ИЭР): 346 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 7,3 (m, 5H), 6,53 (dd, 1H), 6,44 (dd, 1H), 4,56(m, 1H), 4,45 (s, 2H), 3,62 (m, 1H), 1,5-2,1 (m, 6H), 1,34 (s, 9H). Стадия Е: трет-Бутиловый эфир 1-(2-гидроксиэтил)-2-окса-3-азабицикло[2.2.2]октан-3-карбоновой кислоты (11). В круглодонную колбу в атмосфере аргона помещают 1 г Pd-C и заливают этанолом. Добавляют раствор трет-бутилового эфира (1S,4S)-1-(2-бензилоксиэтил)-2-окса-3-азабицикло[2.2.2]окт-5-ен-3 карбоновой кислоты (10) (2 г, 5,8 ммоль) в 58 мл этанола и смесь гидрируют при КТ в течение 6 ч. Затем смесь фильтруют через целит и выпаривают при пониженном давлении. Продукт используют на следующей стадии без дополнительной очистки. МС (ИЭР): 258 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 4,28 (t, 1H), 3,86 (m, 1H), 3,49 (dt, 2H), 1,6-6 017000 1,95 (m, 8H), 1,56 (t, 2H), 1,41 (s, 9H). Стадия F: трет-Бутиловый эфир l-2-[(3S,4S)-4-(2,2-диметилпропионилокси)-3-метилпиперидин-1 ил]этил-2-окса-3-азабицикло[2.2.2]октан-3-карбоновой кислоты (12). трет-Бутиловый эфир (1S,4S)-1-(2-гидроксиэтил)-2-окса-3-азабицикло[2.2.2]окт-5-ен-3-карбоновой кислоты (11) (620 мг, 2,41 ммоль) растворяют в 24 мл пропионитрила и после добавления амина 6 (480 мг, 2,41 ммоль), цианометилтриметилфосфониййодида (796 мг, 6 ммоль) и диизопропилэтиламина (2 мл,12 ммоль) смесь перемешивают при 120C в течение 16 ч. Затем смесь выпаривают при пониженном давлении. Остаток разбавляют этилацетатом, промывают 10% раствором K2CO3 и NaCl и сушат надNa2SO4. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (9,5:0,5),силикагель). МС (ИЭР): 258 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 4,25 (m, 1H), 3,86 (m, 1H), 2,75 (m, 2H), 2,33(m, 2H), 1,5-2,0 (m, 15H), 1,42 (s, 9H), 1,14 (s, 9H), 0,82 (d, 3H). Стадия G: Гидрохлорид (3S,4S)-3-метил-1-[2-(2-окса-3-азабицикло[2.2.2]окт-1-ил)этил]пиперидин 4-ола (13). трет-Бутиловый эфир (1S,4S)-1-2-[(3S,4S)-4-(2,2-диметилпропионилокси)-3-метилпиперидин-1 ил]этил-2-окса-3-азабицикло[2.2.2]окт-5-ен-3-карбоновой кислоты (12) (880 мг, 2 ммоль) растворяют в 20 мл воды и после добавления водного раствора концентрированной HCl (38%, 1,2 мл) смесь перемешивают при 100C в течение 16 ч. Затем смесь выпаривают досуха. Остаток 3 раза обрабатывают метанолом и выпаривают при пониженном давлении. Остаток разбавляют этилацетатом, экстрагируют 2 М раствором K2CO3, сушат над Na2SO4 и выпаривают при пониженном давлении. Продукт используют на следующей стадии без дополнительной очистки. МС (ИЭР): 255 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 12,18 (s, 2H), 3,73 (s, 1H), 3,3-3,4 (m, 2H),3,15 (m, 2H), 2,99 (m, 2H), 2,9 (m, 1H), 2,59 (m, 2H), 2,1 (m, 2H), 1,99 (m, 2H), 1,6-1,9 (m, 8H), 0,9 (d, 3H). Стадия H: (3S,4S)-1-[2-(4-Амино-1-гидроксициклогексил)этил]-3-метилпиперидин-4-ол (14). В круглодонную колбу в атмосфере аргона помещают 10% Pd-C (240 мг) и заливают метанолом. Добавляют раствор (3S,4S)-3-метил-1-[2-(2-окса-3-азабицикло[2.2.2]окт-1-ил)этил]пиперидин-4-ола (13)(584 мг, 2,3 ммоль) в 20 мл метанола и смесь гидрируют при комнатной температуре в течение 2 ч. Затем смесь фильтруют через целит и выпаривают при пониженном давлении. Продукт используют на следующей стадии без дополнительной очистки. МС (ИЭР): 257 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 4,67 (br, 1H), 4,5 (d, 1H), 2,88 (m, 1H), 2,78(m, 4H), 1,3 (m, 2H), 0,86 (d, 3H). Синтез структурных элементов, алкилоксииндолов Структурные элементы, алкоксииндолы, получают по приведенной ниже схеме реакций. Схема реакций 4 Стадия A: Этиловый эфир 4-циклобутилметокси-1H-индол-2-карбоновой кислоты (15 а). К раствору этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты (2 г, 9,75 ммоль), трифенилфосфина (3,58 г, 13,65 ммоль) и циклобутилметанола (1,25 мл, 12,26 ммоль) в 20 мл ТГФ медленно добавляют ДЭАД (2,1 мл, 13,65 ммоль) таким образом, чтобы температура всегда оставалась ниже 30C. Перемешивание продолжают в течение 2 ч и затем растворитель выпаривают. Неочищенный остаток очищают с помощью хроматографии (циклогексан:EtOAc /95:5). МС (ИЭР): 274,2 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 8,83 (s, 1H), 7,35 (s, 1H), 7,21 (t, 1H), 6,98(d, 1H), 6,49 (d, 1H), 4,4 (q, 2H), 4,07 (d, 2H), 2,85 (m, 1H), 2,17 (m, 2H), 1,95 (m, 4H), 1,42 (t, 3H). Стадия B: 4-Циклобутилметокси-1H-индол-2-карбоновая кислота (16 а). Полученный выше этиловый эфир 4-циклобутилметокси-1H-индол-2-карбоновой кислоты (15 а) смешивают с 2 М раствором KOH в EtOH (16,9 мл, 33,8 ммоль) и перемешивают в течение 24 ч. Затем растворитель выпаривают и остаток подвергают распределению между водой и ДХМ. Водный слой подкисляют с помощью HCl и дважды экстрагируют с помощью EtOAc. Объединенные органические слои промывают рассолом, сушат над безводным сульфатом натрия, фильтруют и выпаривают и получают 4-(Тетрагидрофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16b) синтезируют аналогично синтезу соединения 16 а из 4-(тетрагидрофуран-3-ил)метанола и этилового эфира 4-гидрокси-1H-индол-2 карбоновой кислоты. МС (ИЭР): 260,1 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,76 (br s, 1H), 7,14 (t, 1H), 7,03 (m,2H), 6,52 (d, 1H), 4,05 (m, 2H), 3,83 (m, 2H), 3,69 (m, 1H), 3,6 (m, 1H), 2,74 (m, 1H), 2,05 (m, 1H), 1,73 (m,1H). Синтез 4-(фуран-2-илметокси)-1H-индол-2-карбоновой кислоты (16c) 4-(Фуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16 с) синтезируют аналогично синтезу соединения 16 а из фуран-3-илметанола и этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты. МС (ИЭР): 258,0 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,79 (br s, 1H), 11,71 (s, 1H), 7,81 (s,1H), 7,67 (s, 1H), 7,13 (m, 1H), 7,01 (m, 2H), 6,62 (m, 2H), 5,07 (s, 2H). Синтез 4-(2-хлортиазол-4-илметокси)-1H-индол-2-карбоновой кислоты (16d) 4-(2-Хлортиазол-4-илметокси)-1H-индол-2-карбоновую кислоту (16d) синтезируют аналогично синтезу соединения 16 а из 4-(2-хлортиазол-4-ил)метанола и этилового эфира 4-гидрокси-1H-индол-2 карбоновой кислоты. МС (ИЭР): 309, 311 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,9 (s, 1H), 11,8 (s, 1H), 7,85 (s, 1H),7,15 (dd, 1H), 7,1 (m, 1H), 7,05 (d, 2H), 6,67 (d, 1H), 5,25 (s, 2H). Синтез 4-(6-метоксипиридин-3-илметокси)-1H-индол-2-карбоновой кислоты (16e) 4-(6-Метоксипиридин-3-илметокси)-1H-индол-2-карбоновую кислоту (16 е) синтезируют аналогично синтезу соединения 16 а из 4-(6-метоксипиридин-3-ил)метанола и этилового эфира 4-гидрокси-1Hиндол-2-карбоновой кислоты. 1 4-(4-Оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16f) синтезируют аналогично синтезу соединения 16 а из 4-оксо-4,5,6,7-тетрагидробензофуран-3-илметанола и этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты. МС (ИЭР): 326 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,78 (br s, 1H), 7,88 (s, 1H), 7,16 (t, 1H),7,11 (s, 1H), 7,03 (d, 1H), 6,59 (d, 1H), 5,21 (s, 2H), 3,3-3,9 (v br s, 1H), 2,91 (t, 2H), 2,45 (t, 2H), 2,11 (m, 2H). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (16g) 4-(6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16g) синтезируют аналогично синтезу соединения 16 а из 4-(6,6-диметил-4-оксо-4,5,6,7 тетрагидробензофуран-3-ил)метанола 19 (описание синтеза см. ниже) и этилового эфира 4-гидрокси-1Hиндол-2-карбоновой кислоты. МС (ИЭР): 353 [M]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,8 (br s, 1H), 11,7 (s, 1H), 7,86 (s, 1H), 7,15 Стадия A: 6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновая кислота (17). 5,5-Диметил-1,3-циклогександион растворяют в 15 мл метанола и охлаждают до 0C. По каплям добавляют раствор KOH (2 г, 35,7 ммоль) в 15 мл метанола. По каплям добавляют раствор этилового эфира 3-бром-2-оксопропионовой кислоты (4,7 мл, 37,5 ммоль) в 15 мл метанола. Смеси дают нагреться до комнатной температуры и перемешивают в течение 16 ч. Затем добавляют 15 мл 45% водного раствора гидроксида натрия. Еще через 4 ч при комнатной температуре добавляют 25 мл концентрированной HCl. Метанол медленно выпаривают при пониженном давлении, при этом продукт осаждается в виде светлых кристаллов. Продукт отфильтровывают и промывают водой. МС (ИЭР): 209,0 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,96 (br s, 1H), 8,38 (s, 1H), 2,86 (s, 2H),2,49 (s, 2H), 1,07 (s, 6H). Стадия B: 6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметанол (18). 6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновую кислоту (17) (1 г, 4,8 ммоль) растворяют в 80 мл дихлорметана и после добавления 187 мкл ДМФ (2,4 ммоль) смесь охлаждают до 1015C. По каплям добавляют оксалилхлорид (619 мкл, 7,2 ммоль) и смесь перемешивают при комнатной температуре в течение 30 мин. Смесь выпаривают при пониженном давлении, растворяют в ТГФ и охлаждают до -55C. Шприцем добавляют раствор NaBH4 (1,3 г, 34,1 ммоль) в 10 мл ДМФ. Белую суспензию перемешивают при -55C в течение еще 1,5 ч. При этой температуре добавляют 4 мл уксусной кислоты и смесь выливают в 150 мл 5% водного раствора NaHCO3. Смесь разбавляют этилацетатом и промывают рассолом. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (4:6),силикагель). МС (ИЭР): 195,0 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 7,47 (s, 1H), 4,95 (t, 1H), 4,5 (d,2H), 2,76 (s, 2H), 2,32 (s, 2H), 1,06 (s, 6H). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (16h) 4-(6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16h) синтезируют аналогично синтезу соединения 16 а из (R)-1-(2,3-дигидробензофуран-3 ил)метанола и этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты. МС (ИЭР): 307,9 [М-Н]-, 1H-ЯМР (ДМСО-d6):(част./млн) 7,44 (d, 1H), 7,15 (m, 2H), 7,04 (m, 2H),6,87 (t, 1H), 6,82 (d, 1H), 6,57 (d, 1H), 4,75 (t, 1H), 4,48 (dd, 1H), 4,3 (dd, 1H), 4,21 (dd, 1H), 4,02 (m, 1H). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (16i) 4-(6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (16i) синтезируют аналогично синтезу соединения 16 а из (R,S)-(6-метокси-2,3-дигидробензофуран-3 ил)метанола 20 (описание синтеза см. ниже) и этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты. МС (ИЭР): 339,9 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,8 (br s, 1H), 7,3 (d, 1H), 7,14 (t, 1H),7,05 (m, 2H), 6,55 (d, 1H), 6,45 (m, 2H), 4,75 (t, 1H), 4,5 (dd, 1H), 4,25 (m, 1H), 4,15 (m, 1H), 3,93 (m, 1H),3,7 (s, 3H). Синтез (R,S)-(6-метокси-2,3-дигидробензофуран-3-ил)метанола (23) Стадия A: (R,S)-2-(2-Йод-5-метоксифеноксиметил)оксиран (19). 2-Йод-5-метоксифенол (2 г, 8 ммоль) растворяют в 15 мл ДМФ добавляют карбонат цезия (3,9 г, 12 ммоль) и 2-хлорметилоксиран (0,94 мл, 12 ммоль) и смесь перемешивают в течение 60 ч. Затем реакционную смесь обрабатывают с помощью 10 мл 2 н. раствора NaOH и экстрагируют диэтиловым эфиром. Эфирный слой промывают 1 н. раствором NaOH, водой и рассолом, сушат над сульфатом натрия и выпаривают. Неочищенное масло используют на следующей стадии без дополнительной очистки. МС (ИЭР): 306,8 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 7,56 (d, 1H), 6,4 (d, 1H), 6,28 (dd, 1H), 4,2(dd, 1H), 3,97 (dd, 1H), 3,72 (s, 3H), 3,33 (m, 1H), 2,85 (m, 2H). Стадия B: (R)-1-(2,3-Дигидробензофуран-3-ил)метанол (20). Полученный выше неочищенный оксиран 19 (2,4 г, 7,84 ммоль) растворяют в 50 мл ТГФ и охлаждают до -78C в бане с твердым диоксидом углерода. При этой температуре по каплям добавляют н-BuLi(1,6 М в гексане, 4,9 мл, 7,84 ммоль). Затем смесь перемешивают в течение 1 ч и ей дают нагреться до 0C. После тщательного гидролиза и экстракции с помощью EtOAc неочищенное вещество очищают с помощью флэш-хроматографии (этилацетат/гексаны (от 5:95 до 25:75), силикагель). МС (ИЭР): 180,9 [M+H]+, 1H-ЯМР (CDCl3):(част./млн) 7,1 (d, 1H), 6,46 (d, 1H), 6,42 (s, 1H), 4,67 4-[2-(2-Метоксифенил)этокси]-1H-индол-2-карбоновю кислоту (16j) синтезируют аналогично синтезу соединения 16 а из 2-(2-метоксифенил)этанола и этилового эфира 4-гидрокси-1H-индол-2- 10017000 карбоновой кислоты. МС (ИЭР): 312 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 10,75 (br, 1H), 7,28 (dd,1H), 7,20 (ddd, 1H), 6,97 (d, 1H), 6,83-6,92 (m, 3H), 6,47 (s, 1H), 6,38 (dd, 1H), 4,17 (t, 2H), 3,81 (s, 3H), 3,07 4-[2-(3-Метоксифенил)этокси]-1H-индол-2-карбоновую кислоту (16k) синтезируют аналогично синтезу соединения 16 а из 2-(3-метоксифенил)этанола и этилового эфира 4-гидрокси-1H-индол-2 карбоновой кислоты. МС (ИЭР): 312 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,8 (br, 1H), 11,69 (s, 1H), 7,22 (dd, 1H),7,11 (dd, 1H), 6,91-6,99 (m, 2H), 6,79 (m. 1H), 6,50 (d, 1H), 4,27 (t, 2H), 3,74 (s, 3H), 3,06 (t, 2H). Синтез 4-[2-(4-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты (16l) 4-[2-(4-Метоксифенил)этокси]-1H-индол-2-карбоновую кислоту (16l) синтезируют аналогично синтезу соединения 16 а из 2-(4-метоксифенил)этанола и этилового эфира 4-гидрокси-1H-индол-2 карбоновой кислоты. МС (ИЭР): 312 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,85 (br, 1H), 11,69 (s, 1H), 7,28 (d, 2H),7,1 (dd, 1H), 6,96-6,95 (m, 2H), 6,87 (d, 2H), 6,50 (d, 1H), 4,23 (t, 2H), 3,72 (s, 3H), 3,04 (t, 2H). Синтез 4-[2-(2-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты (16m) 4-[2-(2-Метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновую кислоту (16m) синтезируют аналогично синтезу соединения 16 а из 4-[2-(2-метоксипиридин-3-ил)этанола и этилового эфира 4-гидрокси 1H-индол-2-карбоновой кислоты. МС (ИЭР): 313,2 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,74 (s, 1H), 8,06 (d, 1H), 7,71 (d, 1H),7,13 (t, 1H), 6,97 (m, 2H), 6,55 (d, 1H), 4,26 (t, 2H), 3,9 (s, 3H), 3,07 (t, 2H). Синтез 4-[2-(6-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты (16n) 4-[2-(6-Метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновую кислоту (16n) синтезируют аналогично синтезу соединения 16 а из 4-[2-(6-метоксипиридин-3-ил)этанола и этилового эфира 4-гидрокси 1H-индол-2-карбоновой кислоты. МС (ИЭР): 313,0 [M+H]+. Синтез 4-[2-(6-метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновой кислоты (16o) 4-[2-(6-Метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновую кислоту (16 о) синтезируют аналогично синтезу соединения 16 а из 4-[2-(6-метоксибензофуран-3-ил)этанола 21 (описание синтеза см. ниже) и этилового эфира 4-гидрокси-1H-индол-2-карбоновой кислоты. 1 Раствор (6-метоксибензофуран-3-ил)уксусной кислоты (10,16 г, 49,3 ммоль) в 500 мл ТГФ охлаждают в бане со льдом. К этому раствору добавляют АГЛ (1M в ТГФ, 49,3 мл, 49,3 ммоль) и перемешивание продолжают в течение 1 ч. Затем реакционную смесь в охлажденную льдом 1 н. HCl и 3 раза экстрагируют с помощью EtOAc. Объединенные органические слои сушат и выпаривают. 1(s, 3H), 2,91 (t, 2H), 1,6 (v br s, 1H). Синтез структурных элементов, бензофуранов Структурный элемент, бензофуран 26, получают по приведенной ниже схеме реакций. Схема реакций 5 Синтез этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты (26). Стадия A: Этиловый эфир (3-метоксифенокси)уксусной кислоты (22). 3-Метоксифенол (43,4 мл, 400 ммоль) растворяют в ацетоне (800 мл) и после добавления этилового эфира хлоруксусной кислоты (42,6 мл, 400 ммоль) и K2CO3 (111 г, 800 ммоль) смесь кипятят с обратным холодильником в течение 22 ч. После охлаждения до 0C смесь фильтруют и фильтрат выпаривают при пониженном давлении. Остаток разбавляют этилацетатом, охлаждают до 0C и промывают водным раствором NaOH. Органический слой сушат над сульфатом натрия и выпаривают при пониженном давлении. МС (ИЭР): 211,54 [M+H]+, 1 Н-ЯМР (ДМСО-d6):(част./млн) 7,20 (dd, 1H), 6,56 (dd, 1H), 6,50 (m,2H), 4,77 (s, 2H), 4,19 (q, 2H), 3,75 (s, 3H), 1,23 (t, 3H). Стадия B: Диэтиловый эфир 2-(3-метоксифенокси)-3-оксоянтарной кислоты (23). Этоксид натрия (32,5 г, 454 ммоль) заливают с помощью 1 л сухого диэтилового эфира. В течение 20 мин по каплям добавляют диэтиловый эфир щавелевой кислоты (55,2 мл, 416 ммоль). После перемешивания при комнатной температуре в течение 30 мин смесь кипятят с обратным холодильником. В течение 30 мин по каплям добавляют раствор этилового эфира (3-метоксифенокси)уксусной кислоты (22)(79,5 г, 378 ммоль) в 80 мл сухого диэтилового эфира и смесь кипятят с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры реакционную смесь выливают в смесь 2 М HCl(400 мл)/лед (400 г) и экстрагируют диэтиловым эфиром. Органические слои сушат над сульфатом натрия, фильтруют и выпаривают. МС (ИЭР): 310 [M]+, 1H-ЯМР (ДМСО-d6):(част./млн) 7,15-7,2 (m, 1H), 6,5-6,6 (m, 1H), 6,4-6,5 (m,1H), 4,25 (m, 4H), 4,0-4,2 (m, 3H), 3,71 (s, 3H), 1,05-1,3 (m, 6H). Стадия C: Диэтиловый эфир 6-метоксибензофуран-2,3-дикарбоновой кислоты (24). Диэтиловый эфир 2-(3-метоксифенокси)-3-оксоянтарной кислоты (23) (60 г, 193,4 ммоль) растворяют в 32 мл охлажденной (-15C) концентрированной серной кислоты и перемешивают в течение 3 ч,- 12017000 при этом реакционная смесь медленно нагревается до комнатной температуры. Затем смесь выливают в 1 кг льда и экстрагируют диэтиловым эфиром. Органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и выпаривают. Неочищенный продукт очищают с помощью флэшхроматографии (силикагель, этилацетат/гексаны 1:9). МС (ИЭР): 293,67 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 7,7 (d, 1H), 7,39 (d, 1H), 7,06 (dd, 1H),4,38 (q, 2H), 4,36 (q, 2H), 3,64 (s, 3H), 1,34 (t, 3H), 1,32 (t, 3H). Стадия D: Этиловый эфир 6-метоксибензофуран-3-карбоновой кислоты (25). Диэтиловый эфир 6-метоксибензофуран-2,3-дикарбоновой кислоты (24) (27 г, 92 ммоль) растворяют в 200 мл ДМСО и смесь нагревают до 170C. Затем добавляют хлорид натрия (10,7 г, 184 ммоль) и воду (3,3 мл) и смесь перемешивают при 160C (температура реакционной смеси) в течение 2 ч. Затем смеси дают охладиться и ее выпаривают в высоком вакууме. Остаток растворяют в этилацетате, промывают водой и рассолом и сушат над сульфатом натрия. Выпаривание дает коричневое твердое вещество,которое затем очищают с помощью флэш-хроматографии (силикагель, этилацетат/гексаны 3:7). МС (ИЭР): 221 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 8,6 (s, 1H), 7,79 (d, 1H), 7,3 (d, 1H), 7,01(dd, 1H), 4,32 (q, 2H), 3,81 (s, 3H), 1,34 (t, 3H). Стадия Е: Этиловый эфир 6-гидроксибензофуран-3-карбоновой кислоты (26). Этиловый эфир 6-метоксибензофуран-3-карбоновой кислоты (25) (9,3 г, 42 ммоль) растворяют в 80 мл дихлорметана и охлаждают до 0C. Добавляют 1 М раствор BBr3 в дихлорметане (84,5 мл, 84,5 ммоль) и смесь перемешивают при КТ в течение 2 ч. Смесь выливают в охлажденную льдом воду и нейтрализуют гидрокарбонатом натрия. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают при пониженном давлении. МС (ИЭР): 205 [М-Н]-, 1H-ЯМР (ДМСО-d6):(част./млн) 9,74 (br, 1H), 8,50 (s, 1H), 7,69 (d, 1H), 6,98(d, 1H), 6,86 (dd, 1H), 4,31 (q, 2H), 1,32 (t, 3H). Синтез структурных элементов, бензофуранилметоксииндолов Структурные элементы, алкоксииндолы, получают по приведенной ниже схеме реакций. Схема реакций 6 Стадия A: Этиловый эфир 6-этоксибензофуран-3-карбоновой кислоты (27 а) Этиловый эфир 6-гидроксибензофуран-3-карбоновой кислоты (26) (8 г, 39 ммоль) растворяют в 80 мл ДМФ и после добавления бромэтана (5,8 мл, 78 ммоль) и Cs2CO3 (15,2 г, 46,6 ммоль) смесь перемешивают при 100C в течение 2 ч. После выпаривания смеси в высоком вакууме остаток растворяют в этилацетате, промывают водой и рассолом, сушат над сульфатом натрия и выпаривают при пониженном давлении. Желтое твердое вещество используют на следующей стадии без дополнительной очистки. МС (ИЭР): 235 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 8,58 (s, 1H), 7,77 (d, 1H), 7,27 (s, 1H), 6,99(d, 1H), 4,31 (q, 2H), 4,07 (q, 2H), 1,35 (t, 3H), 1,33 (t, 3H). Стадия B: (6-Этоксибензофуран-3-ил)метанол (28 а). 1 М раствор LiAlH4 в ТГФ (47,6 мл, 47,6 ммоль) разбавляют с помощью 200 мл ТГФ и охлаждают до 0C. Этиловый эфир 6-этоксибензофуран-3-карбоновой кислоты (27 а) (5,6 г, 23,8 ммоль) растворяют в 100 мл ТГФ и в течение 30 мин по каплям добавляют к смеси. После завершения добавления смесь перемешивают при 0C в течение 2 ч. Затем реакционную смесь охлаждают до -15C и очень медленно добавляют 10 мл 1 М раствора NaOH. Затем смесь фильтруют через целит, промывают с помощью ТГФ и- 13017000 выпаривают при пониженном давлении. МС (ИЭР): 193 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 7,7 (s, 1H), 7,5 (d, 1H), 7,12 (d, 1H), 7,85(dd, 1H), 5,1 (br s, 1H), 4,58 (s, 2H), 4,05 (q, 2H), 1,35 (t, 3H). Стадия C: 1-трет-Бутиловый эфир 2-этиловый эфир 4-(6-этоксибензофуран-3-илметокси)индол-1,2 дикарбоновой кислоты (29 а). 1-трет-Бутиловый эфир,2-этиловый эфир 4-гидроксииндол-1,2-дикарбоновой кислоты (2) (5,2 г,17,2 ммоль), (6-этоксибензофуран-3-ил)метанол (28 а) (3,3 г, 17,2 ммоль) и трифенилфосфин (5,4 г, 20,6 ммоль) растворяют в 30 мл ТГФ и охлаждают до 0C. Затем по каплям добавляют 40% раствор этилазодикарбоксилата в ТГФ (9 мл, 20,6 ммоль). После завершения добавления смесь перемешивают при КТ в течение 16 ч (за протеканием реакции следят с помощью ТСХ). Затем смесь выпаривают при пониженном давлении. Остаток разбавляют этилацетатом, промывают насыщенными растворами NaHCO3 и NaCl и сушат над Na2SO4. Неочищенный продукт очищают с помощью флэш-хроматографии (этилацетат/гексаны (1:9), силикагель). МС (ИЭР): 480 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 8,04 (s, 1H), 7,55 (d, 1H), 7,52 (d, 1H), 7,39(s, 9 H), 1,34 (t, 3H), 1,29 (t, 3H). Стадия D. 4-(6-Этоксибензофуран-3-илметокси)-1H-индол-2-карбоновая кислота (30 а). 1-трет-Бутиловый эфир, 2-этиловый эфир 4-(6-этоксибензофуран-3-илметокси)индол-1,2 дикарбоновой кислоты (29 а) (7,5 г, 15,6 ммоль) растворяют в 150 мл смеси 1:1:1 ТГФ, этанола и воды. И после добавления гранул KOH (4,4 г, 78,2 ммоль) смесь перемешивают при 85C в течение 2 ч (за протеканием реакции следят с помощью ТСХ). Затем органический растворитель удаляют при пониженном давлении. Остаток охлаждают до 0C и обрабатывают с помощью 2 М HCl. Неочищенный продукт отфильтровывают и сушат в высоком вакууме. Неочищенный продукт перекристаллизовывают из этилацетата. МС (ИЭР): 352 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 12,81 (br s, 1H), 11,72 (s, 1H), 8,01 (s, 1H),7,56 (d, 1H), 7,17 (s, 1H), 7,14 (dd, 1H), 7,02 (m, 2H), 6,89 (d, 1H), 6,71 (d, 1H), 5,33 (s, 2H), 4,05 (q, 2H),1,34 (t, 3H). Синтез 4-(6-циклопропилметоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (30b) 4-(6-Циклопропилметоксибензофуран-3-илметокси)-1H-индол-2-карбоновую кислоту (30b) синтезируют аналогично синтезу соединения 30 а из этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты (26) и бромметилциклопропана. МС (ИЭР): 376 [М-Н]-, 1H-ЯМР (ДМСО-d6):(част./млн) 12,82 (br s, 1H), 11,72 (s, 1H), 8,01 (s, 1H),7,57 (d, 1H), 7,16 (d, 1H), 7,14 (d, 1H), 7,02 (m, 2H), 6,91 (dd, 1H), 6,71 (d, 1H), 5,34 (s, 2H), 3,85 (d, 2H),1,24 (m, 1H), 0,58 (m, 2H), 0,34 (m, 2H). Синтез 4-[6-(2-этоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты (30 с) (методика А) 4-[6-(2-Этоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновую кислоту (30 с) синтезируют аналогично синтезу соединения 30 а из этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты Стадия A: Этиловый эфир 6-(2-метокси-1-метилэтокси)бензофуран-3-карбоновой кислоты (27d) Этиловый эфир 6-гидроксибензофуран-3-карбоновой кислоты (26) (0,5 г, 2,4 ммоль) растворяют в 24 мл сухого ТГФ и после добавления 1-метокси-2-пропанола (262 мг, 2,9 ммоль) и трифенилфосфина(763 мг, 2,9 ммоль) смесь охлаждают до 0C. Затем по каплям добавляют 40% раствор этилазодикарбоксилата в толуоле (1,3 мл, 2,9 ммоль) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Затем смесь выпаривают при пониженном давлении и неочищенный продукт очищают с помощью флэш-хроматографии (силикагель, этилацетат/гексаны 1:9) и получают бесцветное масло. МС (ИЭР): 279 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 8,58 (s, 1H), 7,77 (d, 1H), 7,33 (d, 1H), 6,99(dd, 1H), 4,67 (m, 1H), 4,31 (q, 2H), 3,48 (m, 2H), 3,28 (d, 3H), 1,33 (t, 3H), 1,23 (d, 3H). Стадии от В до D проводят по методике синтеза соединения 30 а. 4-[6-(2-Метокси-1-метилэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновая кислота (30d) МС (ИЭР): 396,64 [M+H]+. Синтез 4-[6-(2-изопропоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты (30 е) 4-[6-(2-Изопропоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновую кислоту (30e) синтезируют аналогично синтезу соединения 30d из этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты (26) и 2-изопропоксиэтанола. МС (ИЭР): 408 [М-Н]-,1H-ЯМР (ДМСО-d6):(част./млн) 12,8 (br s, 1H), 11,73 (s, 1H), 8,03 (s, 1H),7,56 (d, 1H), 7,21 (s, 1H), 7,15 (dd, 1H), 7,03 (s, 1H), 7,0 (m, 1H), 6,93 (dd, 1H), 6,73 (d, 1H), 5,35 (s, 2H), 4,1 4-[6-(3-Метоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновую кислоту (30f) синтезируют аналогично синтезу соединения 30d из этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты (26) и 3-метокси-1-пропанола. Синтез 4-[6-(3-этоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты (30g) 4-[6-(3-Этоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновую кислоту (30g) синтезируют аналогично синтезу соединения 30d из этилового эфира 6-гидроксибензофуран-3-карбоновой кислоты (26) и 3-этокси-1-пропанола. Синтез 4-6-[(S)-(тетрагидрофуран-3-ил)окси]бензофуран-3-илметокси-1H-индол-2-карбоновой кислоты (30b) (методика В)(30b) синтезируют аналогично синтезу соединения 30d из этилового эфира 6-гидроксибензофуран-3 карбоновой кислоты (26) и (S)-(-)-3-гидрокситетрагидрофурана. МС (ИЭР): 392 [М-Н]-, 1H-ЯМР (ДМСО-d6):(част./млн) 12,79 (br s, 1H), 11,72 (s, 1H), 8,03 (s, 1H),7,58 (d, 1H), 7,19 (d, I H), 7,14 (dd, 1H), 7,01 (s, 1H), 7,0 (m, 1H), 6,89 (dd, 1H), 6,71 (d, 1H), 5,34 (s, 2H),5,07 (m, 1H), 3,7-3,95 (m, 4H), 2,22 (m, 1H), 1,99 (m, 1H). Синтез индол-2-карбоксамидов Индол-2-карбоксамиды обычно получают путем катализируемой с помощью TBTU реакции сочетания соответственно замещенных индол-2-карбоновых кислот с соответствующими аминами в присутствии основания Хюнига (схема реакций 7). Схема реакций 7 Иллюстративные примеры приведены ниже. Пример 1. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4 циклобутилметокси-1H-индол-2-карбоновой кислоты.(0,263 мл, 1,532 ммоль) в 5 мл ДМФ обрабатывают твердым TBTU (139 мг, 0,421 ммоль). Смесь перемешивают при КТ в течение 2 ч и выпаривают. Неочищенный остаток растворяют в EtOAc и экстрагируют 1 М раствором HCl. Водный слой отделяют, значение его рН доводят до 14 и 3 раза экстрагируют с помощью ДХМ. Органические слои сушат над сульфатом натрия и выпаривают. Затем неочищенный продукт очищают с помощью хроматографии на силикагеле с использованием смеси метанола и ДХМ (насыщенный аммиаком) от 1:99 до 5:95. Получение гидрохлоридов можно осуществить путем обработки раствора свободного основания в ДХМ или ацетоне при 0C 2 М раствором HCl в метаноле. МС (ИЭР): 484 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 8,26 (d, 1H), 7,25 (s, 1H),7,04 (t, 1H), 6,98 (d, 1H), 6,48 (d, 1H), 4,89 (br s, 1H), 4,56 (d, 1H), 4,04 (d, 2H), 3,73 (m, 1H), 2,71-2,97 (m,4H), 2,42 (m, 2H), 2,12 (m, 2H), 1,82-2,02 (m, 5H), 1,44-1,81 (m, 10H), 1,2-1,43 (m, 4H), 0,87 (d, 3H). Пример 2. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4(тетрагидрофуран-3-илметокси)-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(тетрагидрофуран-3 илметокси)-1H-индол-2-карбоновой кислоты 16b и амина 14. МС (ИЭР): 500 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,42 (s, 1H), 8,21 (d, 1H), 7,22 (s, 1H),7,02 (t, 1H), 6,97 (d, 1H), 6,47 (d, 1H), 4,82 (s, 1H), 4,51 (d, 1H), 3,93-4,08 (m, 2H), 3,57-3,88 (m, 5H), 2,642,96 (m, 4H), 2,4 (m, 2H), 2,05 (m, 1H), 1,87 (m, 1H), 1,67-1,8 (m, 4H), 1,45-1,66 (m, 7H), 1,24-1,42 (m, 4H),0,87 (d, 3H). Пример 3. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4(фуран-3-илметокси)-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(фуран-3-илметокси)1H-индол-2-карбоновой кислоты 16 с и амина 14. МС (ИЭР): 496 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,42 (s, 1H), 8,15 (d, 1H), 7,81 (s, 1H),7,67 (s, 1H), 7,25 (s, 1H), 7,04 (t, 1H), 6,98 (d, 1H), 6,61 (s, 1H), 6,58 (d, 1H), 5,02 (s, 2H), 4,8 (s, 1H), 4,51 (d,1H), 3,71 (m, 1H), 2,72-2,94 (m, 3H), 2,4 (m, 2H), 1,86 (m, 1H), 1,44-1,8 (m, 10H), 1,22-1,43 (m, 4H), 0,87 (d,3H). Пример 4. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4(2-хлортиазол-4-илметокси)-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(2-хлортиазол-4 илметокси)-1H-индол-2-карбоновой кислоты 16d и амина 14. МС (ИЭР): 547 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,5 (s, 1H), 9,45 (br, 1H), 8,20 (d, 1H), 7,8 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6-метоксипиридин-3 илметокси)-1H-индол-2-карбоновой кислоты 16 е и амина 14. МС (ИЭР): 537 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,44 (s, 1H), 8,32 (d, 1H), 8,16 (d, 1H),7,85 (dd, 1H), 7,26 (d, 1H), 7,07 (t, 1H), 7,0 (d, 1H), 6,87 (d, 1H), 6,62 (d, 1H), 5,13 (s, 2H), 4,81 (s, 1H), 4,52 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(4-оксо-4,5,6,7 тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты 16f и амина 14. МС (ИЭР): 564 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,43 (s, 1H), 8,14 (d, 1H), 7,79 (s, 1H),7,26 (s, 1H), 7,06 (t, 1H), 7,0 (d, 1H), 6,56 (d, 1H), 5,18 (s, 2H), 4,82 (s, 1H), 4,52 (d, 1H), 3,71 (m, 1H), 2,92 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6,6-диметил-4-оксо 4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты 16g и амина 14. МС (ИЭР): 592 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 9,9 (br s, 1H), 8,17 (d, 1H),7,79 (s, 1H), 7,23 (s, 1H), 7,03 (dd, 1H), 7,0 (dd, 1H), 6,56 (d, 1H), 5,2 (br, 1H), 5,18 (s, 2H), 4,37 (br, 1H), 3,74 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[(S)-1-(2,3 дигидробензофуран-3-ил)метокси]-1H-индол-2-карбоновой кислоты 16h и амина 14. МС (ИЭР): 548 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 8,25 (d, 1H), 7,45 (d, 1H),7,27 (s, 1H), 7,15 (t, 1H), 6,99-7,06 (m, 2H), 6,87 (t, 1H), 6,81 (d, 1H), 6,52 (d, 1H), 4,85 (br s, 1H), 4,73 (t,1H), 4,53 (d, 1H), 4,48 (dd, 1H), 4,31 (m, 1H), 4,28 (m, 1H), 4,02 (m, 1H), 3,74 (m, 1H), 2,77-2,95 (m, 3H),2,42 (m, 2H), 1,89 (m, 1H), 1,47-1,81 (m, 10H), 1,27-1,42 (m, 4H), 0,88 (d, 3H). Пример 9. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4R,S)-6-метокси-2,3-дигидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-R,S)-6-метокси-2,3 дигидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты 16i и амина 14. МС (ИЭР): 578 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 8,25 (d, 1H), 7,32 (d, 1H),7,27 (s, 1H), 6,99-7,06 (m, 2H), 6,52 (d, 1H), 6,43 (m, 2H), 4,85 (br s, 1H), 4,74 (t, 1H), 4,54 (br s, 1H), 4,49 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(4 метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2,соединение 122) и амина 14. МС (ИЭР): 576 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,43 (s, 1H), 8,11 (d, 1H), 8,01 (s, 1H),7,27 (m, 2H), 7,2 (d, 1H), 7,08 (t, 1H), 7,01 (d, 1H), 6,81 (d, 1H), 6,65 (d, 1H), 5,34 (s, 2H), 4,81 (m, 1H), 4,52 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(4,6 дифторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2,соединение 115) и амина 14. МС (ИЭР): 582 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,45 (s, 1H), 8,26 (s, 1H), 8,14 (d, 1H),7,54 (dd, 1H), 7,22 (m, 2H), 7,08 (t, 1H), 7,02 (d, 1H), 6,68 (d, 1H), 5,3 (s, 2H), 4,8 (m, 1H), 4,51 (d, 1H), 3,7 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(5-хлорбензофуран-3 илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2, соединение 113) и амина 14. МС (ИЭР): 581 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,49 (s, 1H), 8,27 (s, 1H), 8,16 (d, 1H),7,81 (d, 1H), 7,69 (d, 1H), 7,41 (d, 1H), 7,39 (s, 1H), 7,26 (s, 1H), 7,11 (t, 1H), 7,05 (d, 1H), 6,72 (d, 1H), 5,37 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6 метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2,соединение 120) и амина 14. МС (ИЭР): 576 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,44 (s, 1H), 8,14 (d, 1H), 8,03 (s, 1H),7,57 (d, 1H), 7,22 (m, 2H), 7,08 (t, 1H), 7,01 (d, 1H), 6,93 (dd, 1H), 6,69 (d, 1H), 5,31 (s, 2H), 4,8 (br s, 1H),- 19017000 4,51 (d, 1H), 3,81 (s, 3H), 3,7 (m, 1H), 2,73-2,96 (m, 3H), 2,4 (m, 2H), 1,86 (m, 1H), 1,45-1,79 (m, 10H), 1,241,42 (m, 4H), 0,87 (d, 3H). Пример 14. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6-этоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6-этоксибензофуран 3-илметокси)-1H-индол-2-карбоновой кислоты 30 а и амина 14. МС (ИЭР): 590 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,45 (s, 1H), 9,3 (br, 1H), 8,15 (d, 1H),8,03 (s, 1H), 7,55 (d, 1H), 7,23 (s, 1H), 7,19 (s, 1H), 7,08 (dd, 1H), 7,02 (d, 1H), 6,92 (m, 1H), 6,7 (d, 1H), 5,3 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6 циклопропилметоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты 30b и амина 14. МС (ИЭР): 616 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,45 (s, 1H), 9,7 (br, 1H), 8,17 (d, 1H),8,02 (s, 1H), 7,55 (d, 1H), 7,22 (d, 1H), 7,18 (d, 1H), 7,08 (dd, 1H), 7,0 (d, 1H), 6,9 (dd, 1H), 6,68 (d, 1H), 5,7 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[6-(2 этоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты 30 с и амина 14. МС (ИЭР): 634 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,44 (s, 1H), 9,7 (br, 1H), 8,15 (d, 1H),8,02 (s, 1H), 7,56 (d, 1H), 7,22 (d, 1H), 7,2 (m, 1H), 7,08 (dd, 1H), 7,0 (d, 1H), 6,92 (dd, 1H), 6,68 (d, 1H), 5,3 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[6-RS)-2-метокси-1 метилэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты 30d и амина 14. МС (ИЭР): 634,4 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,45 (s, 1H), 9,53 (br, 1H), 8,15 (d, 1H),8,03 (s, 1H), 7,55 (d, 1H), 7,22 (m, 1H), 7,21 (m, 1H), 7,08 (dd, 1H), 7,0 (d, 1H), 6,9 (dd, 1H), 6,68 (d, 1H), 5,3 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[6-(2 изопропоксиэтокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты 30e и амина 14. МС (ИЭР): 648,4 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 9,9 (br, 1H), 8,15 (d, 1H),8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,22 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1H), 6,92 (dd, 1H), 6,69 (d, 1H), 5,3 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[6-(3 метоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты 30f и амина 14. МС (ИЭР): 634 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 9,92 (br, 1H), 8,15 (d, 1H),8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,19 (s, 1H), 7,05 (dd, 1H), 7,01 (d, 1H), 6,91 (d, 1H), 6,68 (d, 1H), 5,3 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[6-(3 этоксипропокси)бензофуран-3-илметокси]-1H-индол-2-карбоновой кислоты 30g и амина 14. МС (ИЭР): 648,5 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,47 (s, 1H), 10,1 (br, 1H), 8,15 (d, 1H),8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,19 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1H), 6,91 (d, 1H), 6,68 (d, 1H), 5,29 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-6-[(S)(тетрагидрофуран-3-ил)окси]бензофуран-3-илметокси-1H-индол-2-карбоновой кислоты 30h и амина 14. МС (ИЭР): 632 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,45 (s, 1H), 9,8 (br, 1H), 8,15 (d, 1H),8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,19 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1H), 6,90 (d, 1H), 6,69 (d, 1H), 5,29 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(6-фторбензофуран-3 илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2, соединение 106) и амина 14. МС (ИЭР): 564 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,44 (s, 1H), 8,19 (s, 1H), 8,13 (d, 1H),7,72 (dd, 1H), 7,58 (dd, 1H), 7,23 (s, 1H), 7,19 (m, 1H), 7,08 (t, 1H), 7,01 (d, 1H), 6,7 (d, 1H), 5,35 (s, 2H), 4,79 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-(7 метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты (синтез описан в WO 2005077932A2,- 22017000 соединение 119) и амина 14. МС (ИЭР): 576 [М+Н]+, 1 Н-ЯМР (ДМСО-d6):(част./млн) 11,46 (s, 1H), 8,16 (d, 1H), 8,13 (s, 1H),7,27 (m, 1H), 7,17-7,25 (m, 2H), 7,05-7,1 (m, 1H), 7,02 (m, 1H), 6,97 (m, 1H), 6,71 (m, 1H), 5,33 (s, 2H), 4,99 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(2 метоксифенил)этокси]-1H-индол-2-карбоновой кислоты 16j и амина 14. МС (ИЭР): 550 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,44 (s, 1H), 8,22 (d, 1H), 7,79 (d, 0,5H),7,54 (d, 0,5H), 7,2-7,32 (m, 4H), 6,96-7,05 (m, 3H), 6,9 (t, 1H), 6,5 (d, 1H), 4,73 (br s, 1H), 4,23 (t, 2H), 3,82 (s,3H), 3,73 (m, 1H), 3,1 (t, 2H), 2,93-3.06 (br m, 3H), 2,6-2,75 (br m, 2H), 1,41-1,87 (m, 11H), 1,14-1,4 (m, 3H),0,91 (d, 3H). Пример 25. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(3-метоксифенил)этокси]-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(3 метоксифенил)этокси]-1H-индол-2-карбоновой кислоты 16k и амина 14. МС (ИЭР): 550 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,41 (s, 1H), 8,2 (d, 1H), 7,24 (s, 1H), 7,22 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(4 метоксифенил)этокси]-1H-индол-2-карбоновой кислоты 161 и амина 14. МС (ИЭР): 550 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,42 (s, 1H), 8,21 (d, 1H), 7,28 (d, 2H),7,24 (s, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,87 (d, 2H), 6,48 (d, 1H), 4,84 (br s, 1H),4,52 (d, 1H), 4,23 (t, 2H), 3,72 Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(2 метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты 16m и амина 14. МС (ИЭР): 551 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,42 (s, 1H), 8,18 (d, 1H), 8,05 (m, 1H),7,68 (m, 1H), 7,21 (s, 1H), 7,03 (t, 1H), 6,94-6,98 (m, 2H), 6,51 (d, 1H), 4,84 (br s, 1H), 4,53 (d, 1H), 4,28 (t,2H), 3,9 (s, 3H), 3,72 (m, 1H), 3,08 (t, 2H), 2,75-2,95 (m, 3H), 2,42 (t, 2H), 1,88 (m, 1H), 1,45-1,81 (m, 10H),1,25-1,44 (m, 4H), 0,88 (d, 3H). Пример 28. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(6-метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(6 метоксипиридин-3-ил)этокси]-1H-индол-2-карбоновой кислоты 16n и амина 14. МС (ИЭР): 551 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,43 (s, 1H), 8,21 (d, 1H), 8,15 (d, 1H),7,73 (dd, 1H), 7,23 (s, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,77 (d, 1H), 6,48 (d, 1H), 4,84 (br s, 1H), 4,53 (d, 1H),4,25 (t, 2H), 3,82 (s, 3H), 3,73 (m, 1H), 3,06 (t, 2H), 2,77-2,94 (m, 3H), 2,42 (t, 2H), 1,88 (m, 1H), 1,46-1,81 (m,10H), 1,24-1,43 (m, 4H), 0,88 (d, 3H). Пример 29. 4-Гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[2-(6-метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновой кислоты. Это соединение синтезируют аналогично синтезу соединения примера 1 из 4-[2-(6 метоксибензофуран-3-ил)этокси]-1H-индол-2-карбоновой кислоты 16 о и амина 14. МС (ИЭР): 590 [M+H]+, 1H-ЯМР (ДМСО-d6):(част./млн) 11,42 (s, 1H), 8,19 (d, 1H), 7,76 (s, 1H),7,61 (d, 1H), 7,25 (s, 1H), 7,14 (d, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,87 (dd, 1H), 6,5 (d, 1H), 4,82 (br s, 1H),4,52 (d, 1H), 4,34 (t, 2H), 3,78 (s, 3H), 3,71 (m, 1H), 3,15 (t, 2H), 2,74-2,93 (m, 3H), 2,41 (t, 2H), 1,87 (m, 1H),1,46-1,8 (m, 10H), 1,25-1,42 (m, 4H), 0,87 (d, 3H). Соединения формулы I в свободной форме или в форме фармацевтически приемлемой соли обладают ценными фармакологическими характеристиками, например, как антагонисты CCR2 и CCR5, о чем свидетельствуют результаты исследований in vitro, описанных ниже. а) Исследование связывания CCR2 с мембраной. Методологию ПСА (проксимально-сцинтилляционный анализ) используют, чтобы показать, что исследуемые соединения предупреждают связывание МСР-1 с клеточными мембранами, экспрессирующими рецептор CCR2. Трансфицированные клетки CHO-dukX, стабильно экспрессирующие ген hCCR2b,выращивают в среде МПС альфа (минимальная поддерживающая среда) до слияния, составляющего от 70 до 80%. После удаления среды прибавляют 30 мл охлажденного льдом физиологического буферного раствора, содержащего 1 мМ ЭДТК (этилендиаминтетрауксусная кислота), и клетки извлекают из планшета скребком. Суспензию клеток центрифугируют при 800 g в течение 10 мин при 4C и таблетку клеток повторно суспендируют в буфере. Лизис клеток проводят с помощью прибора Polytron PTI300D при 28000 об./мин 2 раза по 30 с на льду. Мембраны собирают с помощью центрифугирования при 42000 g в течение 20 мин при 4C и вторично подвергают лизису (Polytron, 28000 об./мин, 230 с на льду). После центрифугирования при 42000 g в течение 20 мин при 4C мембраны повторно суспендируют в буфере- 24017000 при концентрации белка, равной 2 мг/мл, и хранят при -80C. Готовят 10 мМ исходные растворы исследуемых соединений в 100% ДМСО. Исследуемые соединения дополнительно разводят в буфере и получают четырехкратно разведенные растворы для исследований, которые используют в диапазоне 10-10-10-5 М. Исследование с помощью ПСА проводят при конечном объеме, равном 200 мкл/лунка, в 96-луночных планшетах. Компоненты прибавляют в лунки в следующем порядке: 50 мкл Буфер (+/- исследуемое соединение) 50 мкл Гранулы ПАК (полиакрилат натрия) с агглютинином зародышей пшеницы (1,25 мг/лунка) в буфере 50 мкл Суспензия мембран CCR2B, разведенная буфером до 0,04 мг/мл (2 мкг/лунка), альтернативно - 50000 клеток/лунка 50 мкл [125I] MCP-1 в буфере (конечная концентрация 60 пМ, 2,5 мкКи/планшет). После прибавления всех компонентов планшет герметизируют и инкубируют в течение 90 мин при комнатной температуре при постоянном встряхивании. После инкубации планшет центрифугируют при 1000 оборотов/мин в центрифуге Sorvall RC3B в течение 4 мин при комнатной температуре и проводят подсчет в течение 3 мин/лунка на приборе TOP COUNT (Packard). Скорректированные на тушение количества импульсов используют для исследования связывания радиолиганда. Соединения формулы I обладают значениями IC50, равными от 0,002 до 10 мкМ: Аналогичным образом проведены исследования связывания с рецепторами CCR2 крыс, мышей и макак-резусов. Вследствие специфичности антагонистов CCR2 для разных видов соединения формулы I обладают значениями IC50, равными от 0,015 до 10 мкМ для CCR2 мышей и от 0,020 до 10 мкМ дляb) Функциональное исследование CCR2 - хемотаксис. Микрочрезклеточное исследование хемотаксиса с использованием моноцитов периферической крови человека используют для исследования антагонистов CCR2. Мононуклеары периферической крови человека (МНПК) выделяют из лейкоцитарной пленки донорной крови с помощью центрифугирования в градиенте плотности Ficoll-Paque. МНГЖ, собранные на границе раздела, промывают и до использования замораживают при -80C. Исследования хемотаксиса проводят в 96-луночных планшетах MultiScreen-MIC с поликарбонатными фильтрами, обладающими порами размером 5 мкм. Суспензии клеток и МСР-1 (1 нМ) готовят в среде RPMI1640 с глютамаксом с прибавлением 1% заменимых аминокислот,пирувата натрия, смеси пенициллин/стрептомицин, 50 мкМ бета-меркаптоэтанола и 1% альбумина человека. Замороженные МНПК оттаивают, промывают и повторно суспендируют при 210 /мл. Для оценки ингибирующего влияния соединений на опосредуемый с помощью CCR2 хемотаксис, клетки, МСР-1 и соединения готовят в виде разведенных вдвое концентрированных растворов, перемешивают и помещают в фильтровальный планшет и приемный планшет. Важно отметить, что соединения предварительно разводят в ДМСО при 2000-кратном молярном избытке, так что конечная концентрация ДМСО при исследовании хемотаксиса равна 0,05% (показано, что эта концентрация ДМСО не влияет на хемотаксис). Для создания однородной концентрации соединения прибавляют в верхнее отделение (клетки), а также в нижнее отделение (хемокин). После миграции в течение 3 ч при 37C в инкубаторе фильтрующий планшет осторожно снимают с приемного планшета и отбрасывают. Мигрировавшие клетки в приемном планшете повторно суспендируют и переносят в круглодонный 96-луночный планшет, центрифугируют и повторно суспендируют в 100 мкл ЗФР (забуференный фосфатом физиологический раствор), содержащего 2% ФТС и 0,1% NaN3. Исходные клетки (100 мкл) обрабатывают аналогичным образом. Для оценки специфической миграции прибавляют фиксированное количество гранул (10000) в 20 мкл буфера и суспензию анализируют посредством проточной цитометрии с использованием прибора FACScalibur, снабженного автоматическим пробоотборником AutoSampler MAS-1, и программного обеспечения CellQuest с использованием заданных настроек для МНПК и гранул. Моноциты идентифицируют по данным о рассеянии вперед (FSC) и боковом рассеянии (SSC). Хемотаксис характеризуют в процентах от количества исходных моноцитов по следующей формуле: моноциты, %/гранулы,%)/(исходные моноциты,%/исходные гранулы, %100. с) Функциональное исследование CCR5 - хемотаксис. Микрочрезклеточное исследование хемотаксиса с использованием мышиных В-клетокпредшественников L1.2, трансфицированных с помощью CCR5 человека, используют для исследования антагонистов CCR5. Клетки выращивают в среде RPMI1640 с глютамаксом с прибавлением 1% заменимых аминокислот, пирувата натрия, смеси пенициллин/стрептомицин, 50 мкМ бета-меркаптоэтанола(далее в настоящем изобретении называемой полной средой RPMI) и 10% инактивированных нагреванием ФТС. Клетки обычно хранят в культуре при плотности, равной менее 1,510 клеток/мл. За день до проведения эксперимента клетки разводят до плотности, равной 0,210 клеток/мл. Исследования хемотаксиса проводят в 96-луночных планшетах MultiScreen-MIC с поликарбонатными фильтрами, обладающими порами размером 5 мкм. Суспензии клеток и MIP-1 разводят в полной среде RPMI, содержащей 1% альбумина человека. 100 мкл 210 клеток/мл прибавляют в лунки фильтровального планшета и затем фильтровальный планшет осторожно помещают на приемный планшет, содержащий 150 мкл среды, яв- 25017000 ляющейся контролем, или определенного разведения MIP-1. Для оценки ингибирующего влияния соединений на опосредуемый с помощью CCR5 хемотаксис, клетки, MIP-1 и соединения готовят в виде разведенных вдвое концентрированных растворов, перемешивают и помещают в фильтровальный планшет и приемный планшет. Важно отметить, что соединения предварительно разводят в ДМСО при 2000 кратном молярном избытке, так что конечная концентрация ДМСО при исследовании хемотаксиса равна 0,05% (показано, что эта концентрация ДМСО не влияет на хемотаксис). Для создания однородной концентрации соединения прибавляют в верхнее отделение (клетки), а также в нижнее отделение (MIP-1). После миграции в течение 4 ч при 37C в инкубаторе фильтрующий планшет осторожно снимают с приемного планшета и отбрасывают. Мигрировавшие клетки в приемном планшете повторно суспендируют и переносят в круглодонный 96-луночный планшет, центрифугируют и повторно суспендируют в 100 мкл ЗФР, содержащего 2% ФТС и 0,1% NaN3. Исходные клетки (100 мкл) обрабатывают аналогичным образом. Для оценки специфической миграции прибавляют фиксированное количество гранул (10000) в 20 мкл буфера FACS и суспензию анализируют посредством проточной цитометрии с использованием прибора FACScalibur, снабженного автоматическим пробоотборником AutoSampler MAS-1, и программного обеспечения CellQuest с использованием заданных настроек для клеток 300-19 и гранул. Хемотаксис характеризуют в процентах от количества исходных клеток по следующей формуле: клетки,%/%/гранулы,%)/(исходные клетки, %/исходные гранулы, %100.CCR5 человека используют для получения стабильных трансфектантов в клетках CHO K1. Мембраны, приготовленные из этих трансфектантов CCR5, применяют для исследования связывания радиолигандов с использованием 125-I-MIP-1 в качестве лиганда и исследуют ингибирующую активность соединений формулы I. Данные приводят в виде значений IC50, т.е. концентрации соединения, необходимой для обеспечения 50% ингибирования связывания [I-125]MIP-1. По данным этого исследования соединения формулы I обладают значениями IC50, равными от 0,004 до 10 мкМ. По данным этих исследований соединения формулы I обладают значениями IC50, равными от 0,0002 до 10 мкМ. Конкретные данные приведены в прилагаемых таблицах. Средства, предлагаемые в настоящем изобретении, являются эффективными в качестве двойных антагонистов CCR-2 и CCR-5. Поэтому средства, предлагаемые в настоящем изобретении, применимы для профилактики и лечения опосредуемых с помощью CCR-2 и CCR-5 заболеваний или патологических состояний. CCR-2 и CCR-5 играют важную роль в переносе лейкоцитов, в частности, в миграции моноцитов к участкам воспаления и поэтому средства, предлагаемые в настоящем изобретении, можно применять для подавления миграции моноцитов, например, для лечения воспалительных патологических состояний, аллергий и аллергических патологических состояний, аутоиммунных заболеваний, хронической боли, отторжения трансплантатов, раковых заболеваний, которые включают инфильтрацию лейкоцитов, стеноза или рестеноза, атеросклероза, ревматоидного артрита, остеоартрита и хронической боли. Заболевания или патологические состояния, которые можно лечить средствами, предлагаемыми в настоящем изобретении, включают: воспалительные или аллергические патологические состояния,включая респираторные аллергические заболевания, такие как астма, аллергический ринит, ХОЗЛ (хроническое обструктивное заболевание легких), аллергические заболевания легких, гиперчувствительный пневмонит, интерстициальный легочный процесс (ИЛП), (например, идиопатический фиброз легких или ИЛП, связанное с аутоиммунными заболеваниями, такие как RA, SLE и т.п.); хроническое обструктивное- 26017000 заболевание легких, анафилаксия или реакции гиперчувствительности, лекарственные аллергии (например, на пенициллины или цефалоспорины) и аллергические реакции на укус насекомого; воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит; спондилоартропатии, склеродермия; псориаз и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, уртикария; васкулит; аутоиммунные заболевания, в частности аутоиммунные заболевания с этиологией, включающей воспалительный компонент, такие как артрит (например, ревматоидный артрит, хронический прогрессирующий артрит, псориатический артрит и деформирующий артрит) и ревматические заболевания, включающие воспалительные патологические состояния, и заболевания, включающие потерю костной массы, воспалительную боль, гиперчувствительность (включая и гиперчувствительность дыхательных путей, и кожную гиперчувствительность) и аллергии. Конкретные аутоиммунные заболевания, при которых можно применять антитела, предлагаемые в настоящем изобретении, включают аутоиммунные гематологические нарушения (включая, например, гемолитическую анемию, апластическую анемию, истинную эритроцитарную анемию и идиопатическую тромбоцитопению), системную красную волчанку, полихондрит, склеродермию, грануломатоз Вегенера, дерматомиозит, хронический активный гепатит, миастению gravis, псориаз, синдром Стивенса - Джонсона, идиопатический спру, аутоиммунное воспалительное заболевание кишечника (включая, например, язвенный колит, болезнь Крона и синдром раздраженной толстой кишки), аутоиммунный тиреоидит, болезнь Бехчета, эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, рассеянный склероз, первичный биллиарный цирроз, юношеский диабет (сахарный диабет типа I), увеит (передний и задний), сухой кератоконъюнктивит и весенний кератоконъюнктивит, интерстициальный фиброз легких и гломерулонефрит (с нефротическим синдромом и без него, например, включая идиопатический нефротический синдром, или нефропатия с минимальными изменениями); отторжение трансплантата (например, при трансплантации сердца, легких, комбинированной сердца-легких, печени, почек, поджелудочной железы, кожи и роговицы), включая отторжение аллотрансплантата или отторжение ксенотрансплантата или реакцию "трансплантат против хозяина", и атеросклероз, связанный с трансплантацией органа; рак с инфильтрацией лейкоцитов в кожу или органы; рак молочной железы; стеноз или рестеноз сосудистой сети, в частности артерий, например, коронарной артерии, включая стеноз или рестеноз, вызванный операцией на сосудах, а также неоинтимальная гиперплазия; удар; и другие заболевания или патологические состояния, включающие воспалительные реакции, включая реперфузионное поражение, злокачественные заболевания крови, обусловленную цитокинами токсичность (например, септический шок или эндотоксический шок), полимиозит, дерматомиозит, и гранулематозные заболевания, включая саркоидоз; инфекционные заболевания, включая ВИЧ (вирус иммунодефицита человека) и СПИД (синдром приобретенного иммунодефицита). Термин "лечение" при использовании в настоящем изобретении следует понимать как включающий терапевтический и профилактический режимы лечения, например, в связи с лечением неоплазии лечение для предупреждения проявления клинически или доклинически обнаруживаемой неоплазии или предупреждение образования злокачественных клеток, или остановку или обращение прогрессирования предраковых клеток в раковые, а также предупреждение или подавление роста или метастазирования новообразований. В этом контексте настоящее изобретение предпочтительно относится к применению соединений, предлагаемых в настоящем изобретении, для подавления или предупреждения развития рака кожи,например, сквамозной или базально-клеточной карциномы после воздействия ультрафиолетового излучения, например, обусловленной длительным воздействием солнечного света. Средства, предлагаемые в настоящем изобретении, являются особенно подходящими для лечения заболеваний костей и нарушений метаболизма хрящей, включая остеоартрит, остеопороз и другие воспалительные поражение кожи ревматического или подагрического происхождения, например ревматоидный артрит и потерю костной массы, включая возрастную потерю костной массы, и, в особенности, заболевания периодонта. Средства, предлагаемые в настоящем изобретении, также можно применять в офтальмологии,включая лечение глазных болезней, в частности воспалительных глазных нарушений, глазной боли,включая боль, связанную с операциями глаз, такими как фоторефракционная кератоэктомия и удаление катаракты, аллергическими заболеваниями глаз, фотофобией различной этиологии, повышенным внутриглазным давлением (при глаукоме) путем подавления образования белка, индуцирующего глюкокортикоидный ответ трабекулярной сети (TIGR), и сухого кератита. Разумеется, при указанных выше показаниях подходящая доза будет меняться, например, в зависимости от конкретного использующегося средства, предлагаемого в настоящем изобретении, подвергающегося лечению субъекта, пути введения и природы и тяжести подвергающегося лечению патологического состояния. Однако указывают, что при использовании для профилактики удовлетворительные результаты обычно обеспечиваются при дозах, составляющих от примерно 0,05 до примерно 10 мг/(кг массы тела), чаще - от примерно 0,1 до примерно 5 мг/(кг массы тела). Частота введения при профилактике обычно находится в диапазоне от примерно одного раза в неделю до примерно одного раза в 3 месяца,- 27017000 чаще - в диапазоне от примерно одного раза в 2 недели до примерно одного раза в 10 недель, например,один раз в 4 или 8 недель. Средство, предлагаемое в настоящем изобретении, обычно вводят парентерально, внутривенно, например, в находящуюся кпереди от локтевого сустава или другую периферическую вену, внутримышечно или подкожно. Например, профилактическое лечение обычно включает введение средства, предлагаемого в настоящем изобретении, от одного раза в месяц до одного раза в 2-3 месяца или реже. Средства, предлагаемые в настоящем изобретении, можно вводить в комбинации с другим активным средством. Подходящие активные средства включают антиметаболиты (например, метотрексат),средства против фактора некроза опухоли (например, ремикаде (инфликсимаб), энорел (этанерцепт), гумира (адалумимаб, средства против IL-1 (например, пралнакасан, ACZ885), нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы ВИЧ протеазы, ингибиторы слияния и другие антиретровирусные средства. Активное средство или средства можно вводить одновременно, по отдельности или последовательно со средством, предлагаемым в настоящем изобретении. Фармацевтические композиции, предлагаемые в настоящем изобретении, можно готовить обычным образом. Композицию, предлагаемую в настоящем изобретении, предпочтительно готовят в лиофилизированной форме. Для немедленного введения ее растворяют в подходящем водном носителе, например стерильной воде для инъекций или в стерильном забуференном физиологическом растворе. Если считают желательным приготовление большего объема раствора для введения путем вливания, а не болюсной инъекции, то в физиологический раствор во время приготовления предпочтительно прибавлять сывороточный альбумин человека или собственную гепаринизированную кровь пациента. Наличие избытка такого физиологически инертного белка предотвращает потерю антител вследствие адсорбции на стенках контейнера и трубок, использующихся с раствором для вливания. Если используется альбумин, то подходящая концентрация составляет от 0,5 до 4,5 мас.% в пересчете на массу физиологического раствора. Средства, предлагаемые в настоящем изобретении, можно вводить любым обычным путем, например перорально, например, в виде растворов для питья, таблеток или капсул, или парентерально, например, в виде растворов или суспензий для инъекций. Обычно для системного введения предпочтительны пероральные дозированные формы, хотя при некоторых показаниях средства, предлагаемые в настоящем изобретении, также можно вводить местно или дермально, например, в виде кожного крема или геля или аналогичных препаратов или, для введения в глаза, в виде глазного крема, геля или капель; или можно вводить путем ингаляции, например, для лечения астмы. Разовые дозированные формы, подходящие для перорального введения, содержат в разовой дозированной форме, например, от 25 до 250 мг средства,предлагаемого в настоящем изобретении. Средства, предлагаемые в настоящем изобретении, обычно обладают благоприятными фармакокинетическими характеристиками, т.е. такими как относительно быстрое выведение. Быстрое выведение обычно указывает на улучшенную переносимость и обычно связывается с меньшим количеством побочных эффектов. Его можно оценить путем определения, например, зависимости занятости рецептораCCR2 от времени. Исследование занятости рецептора можно проводить в 96-луночных планшетах. 45 мкл Свежеотобранных проб крови инкубируют с 5 мкл раствора МСР-1 (нескольких концентраций для построения зависимости для связывания). Концентрация указанного раствора МСР-1 составляет от 0,01 до 100 нМ и готовят разведения в RPMI1640 с глютамаксом с прибавлением 1% заменимых аминокислот, пирувата натрия, смеси пенициллин/стрептомицин, 50 мкл бета-меркаптоэтанола и 1% альбумина человека. Указанную инкубацию проводят в течение 30 мин при 37C и затем останавливают путем прибавления 180 мкл литического раствора BD FACS с последующим центрифугированием. Указанное прибавление литического раствора и центрифугирование повторяют еще раз и затем оставшиеся клетки промывают холодным буфером FACS (ФБС (фетальная бычья сыворотка), содержащим 2% ФТС (фетальная телячья сыворотка) и 0,1% NaN3). Затем клетки окрашивают антителами для исследования с помощьюFACS. Затем клетки трижды окрашивают с помощью FITC-конъюгированного анти-CD14, РЕконъюгированного анти-HLA-DR и АРС-конъюгированного анти-CCR2. Антитела разводят в буфереFACS, прибавляют 3 мг/мл IgG человека и окрашивание проводят всего в 25 мкл в течение 30 мин на льду. Окрашенные клетки дважды промывают холодным буфером FACS и затем анализируют посредством проточной цитометрии с использованием прибора FACScalibur и программного обеспеченияCellQuest. Определяют экспрессирование CCR2 на CD-14- и HLA-DR-положительных моноцитах и результаты представляют в виде средней интенсивности флуоресценции (СИФ). Относительное экспрессирование CCR2 выражают в процентах от окрашивания контроля. Для соединений, предлагаемых в настоящем изобретении, приведенные данные свидетельствуют о значительном уменьшении блокирования рецепторов через 24 ч по сравнению с соединениями имеющегося уровня техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая сольR выбран из группы, включающей C3-C10-циклоалкил, C3-C10-гетероциклоалкил, в котором гетероатом представляет собой O или S, C3-C10-гетероарил, содержащий один или два гетероатома, выбранных из O, N или S, C6-C10-арил;R включает необязательно сконденсированную с ним группу B, выбранную из C3-C8-циклоалкила,C6-C10-арила; иR и B, каждый независимо, являются незамещенным или замещенным R1, который обозначает один, два или три заместителя, независимо выбранных из группы, включающей галоген, C1-C7 алкоксигруппу, оксогруппу, C1-C7-алкил, C1-C7-алкокси-C1-C7-алкоксигруппу; R1 сам является незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из C1-C6-алкила, C1-C6 алкоксигруппы. 2. Соединение по п.1, в котором X обозначает NH. 3. Соединение по п.1 или 2, в котором R обозначает C3-C10-гетероарил, и R и В, каждый независимо,являются незамещенным или замещенным R1, значения которого определены в п.1. 4. Соединение по любому из предыдущих пунктов, в котором R обозначает бензофуранил. 5. Соединение по любому из предыдущих пунктов, выбранное из группы, включающей: 4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4 циклобутилметокси-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4(тетрагидрофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(фуран-3 илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(2 хлортиазол-4-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6 метоксипиридин-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4-оксо 4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(6,6 диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-[(S)-1-(2,3 дигидробензофуран-3-ил)метокси]-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-R,S)-6 метокси-2,3-дигидробензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4 метоксибензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(4,6 дифторбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,4-гидрокси-4-[2-3S,4S)-4-гидрокси-3-метилпиперидин-1-ил)этил]циклогексиламид 4-(5 хлорбензофуран-3-илметокси)-1H-индол-2-карбоновой кислоты,- 29
МПК / Метки
МПК: C07D 417/14, C07D 405/14, A61P 31/18, A61P 29/00, C07D 401/12, A61K 31/435, C07D 401/14
Метки: циклогексиламида, арилкарбоновой, кислоты, производные
Код ссылки
<a href="https://eas.patents.su/30-17000-proizvodnye-ciklogeksilamida-arilkarbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклогексиламида арилкарбоновой кислоты</a>
Предыдущий патент: Устройство для электрогидравлического воздействия на призабойную зону скважины
Следующий патент: Способ получения легких олефинов из кислородсодержащего, галогенсодержащего или серосодержащего сырья
Случайный патент: Железобетонная плита или панель перекрытия, содержащая полые блоки












