Производные терфенила для лечения болезни альцгеймера
Номер патента: 16908
Опубликовано: 30.08.2012
Авторы: Зунузэ Михиро, Рид Элисон, Тэйлор Джесс, Мэйджер Джереми, Ридер Вэлери, Лёформаль Эдэляйн, Зэнг Ен, Хо Чи Янг, Вилсн Фрэнцис, Хэррисон Ричард Джон, Хернадез-Перни Рэмэдиос, Буссар Сирилль, Буркхардт Свенья, Смэлт Кэсрин, Кэнсфильд Эндру
Формула / Реферат
1. Соединение общей формулы (I)
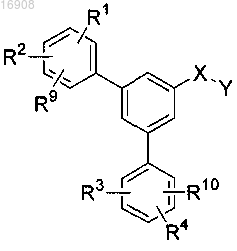
где X означает связь или группу -CR5R6, где R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН3, С2Н5, изо-С3Н7, н-C3H7, изо-С4Н9, н-C4H9, втор-C4H9, трет-С4Н9;
R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; S(O)2R7; N(R7R8); C(O)R7; замещенного или незамещенного С1-С4-алкила и замещенного или незамещенного С1-С4-алкокси, и где заместители обеих групп С1-С4-алкил и С1-С4-алкокси выбраны из F, Cl, Br, I;
R7, R8, означают С1-С4-алкил;
R9 и R10 независимо означают Н, F или CF3;
Y означает карбоксильную группу -С(О)ОН;
а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли.
2. Соединение по п.1,
где X означает группу -CR5R6, где R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-C4H9, втор-C4H9, трет-С4Н9;
R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н, -N(СН3)2, -SO2CH3, CN, OCF3, -С(О)СН3, ОСН3, CF3, F и Cl;
Y означает карбоксильную группу -С(О)ОН;
а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли.
3. Соединение по п.2,
где X означает группу -CR5R6, где R5 и R6 означают Н или R5 означает Н, a R6 означает СН3, С2Н5, C3H7 или С4Н9 или их изомеры;
а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли.
4. Соединение, выбранное из группы, состоящей из
(i) (4"-хлор-4-трифторметил-[1,1';3,1"]терфенил-5'-ил)уксусной кислоты,
(ii) (4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(iii) (3-хлор-4"-фторметил [1,1';3'1"]терфенил-5'-ил)уксусной кислоты,
(iv) (4-гидрокси-4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(v) (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(vi) [1,1';3',1"]терфенил-5'-ил-уксусной кислоты,
(vii) (4,4"-бис-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(viii) (4,4"-дифтор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(ix) (3,3"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(х) (3,3"-бис-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(xi) (4,4"-диметил-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты,
(xii) (4,4"-диметокси-[1,1';3',1"]терфенил-5'-ил)уксусиой кислоты,
(xiii) 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты,
(xiv) (R)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты,
(xv) (S)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты,
(xvi) 4,4"-дихлор-[1,1';3',1']терфенил-5'-карбоновой кислоты,
(xvii) 5-(4,4"-дихлор-[1,1';3',1']терфенил-5'-ил)-1Н-тетразола,
(xviii) 2-(4,4"-бис-трифторметил-[1,1';3',1"]терфенил-5'-ил)-4-метилпентановой кислоты,
а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли.
5. Соединение, выбранное из группы, состоящей из
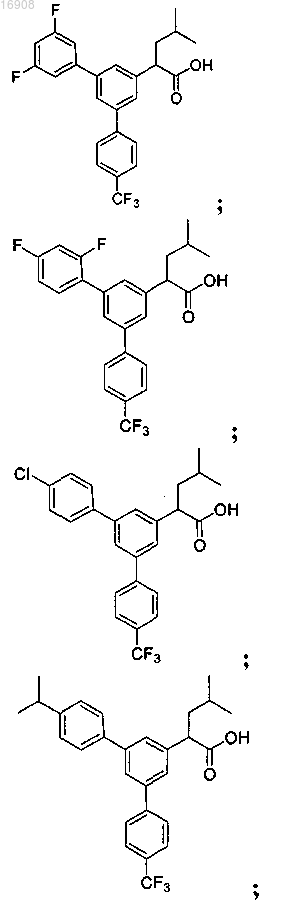
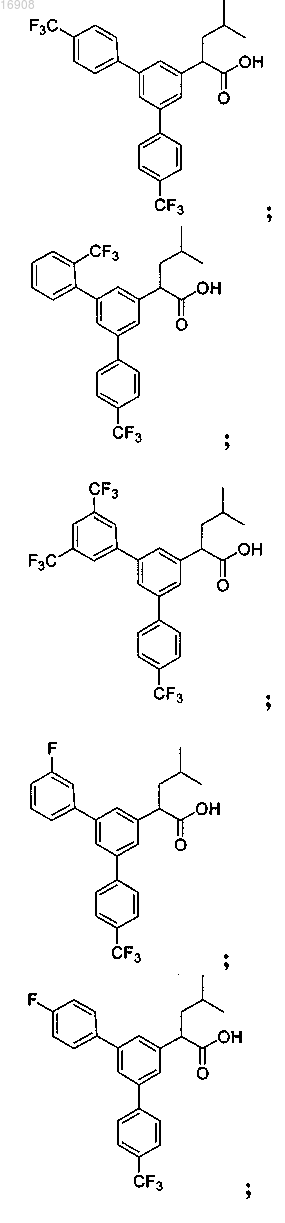
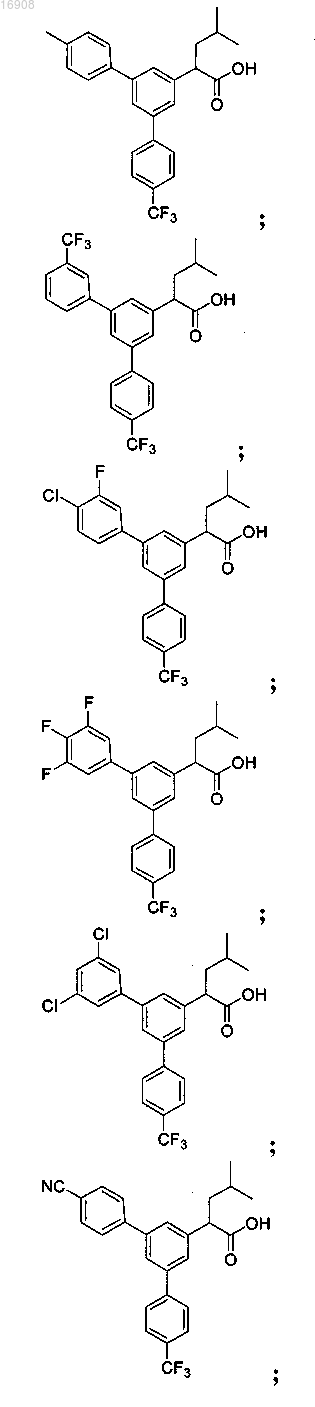
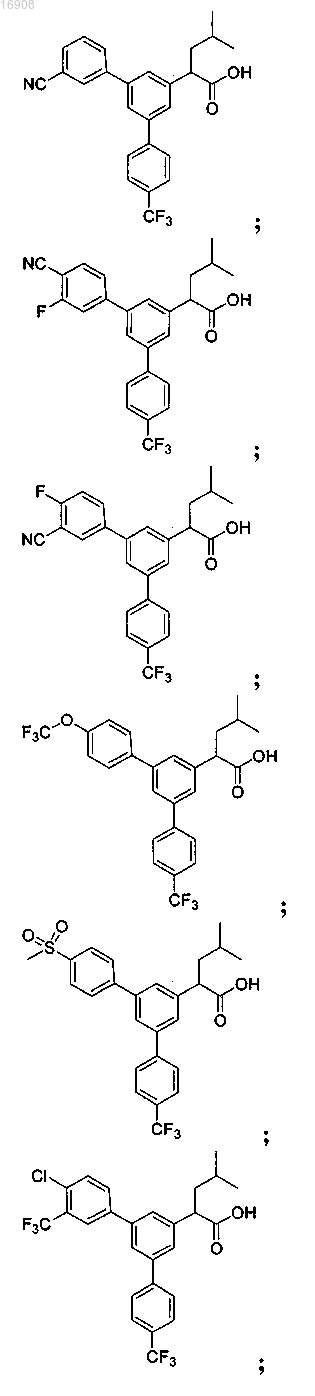
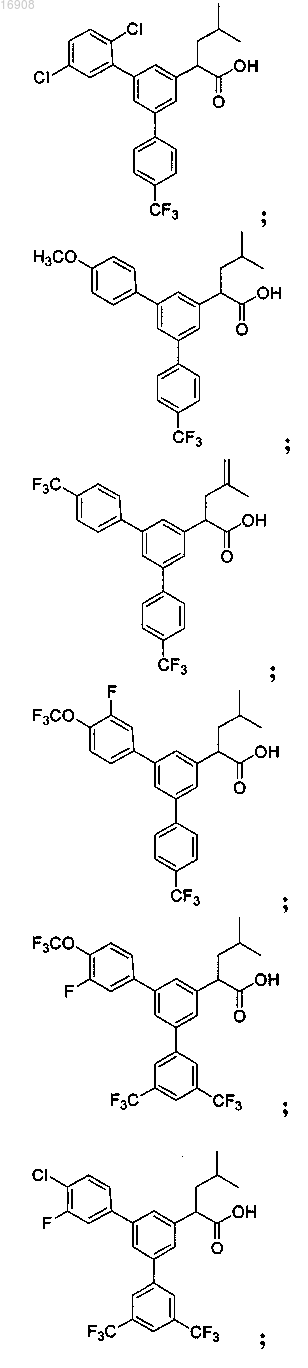
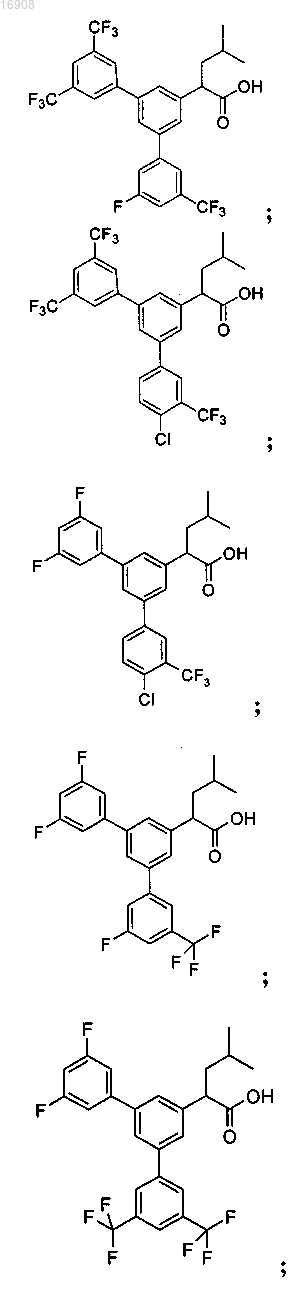
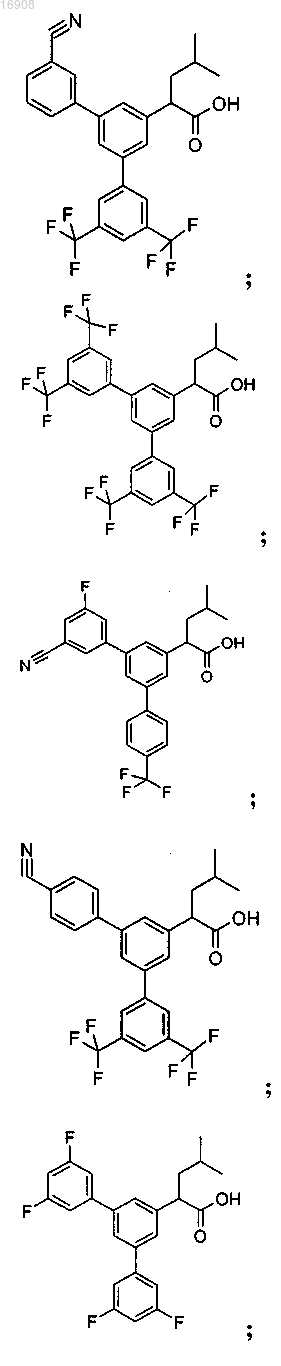
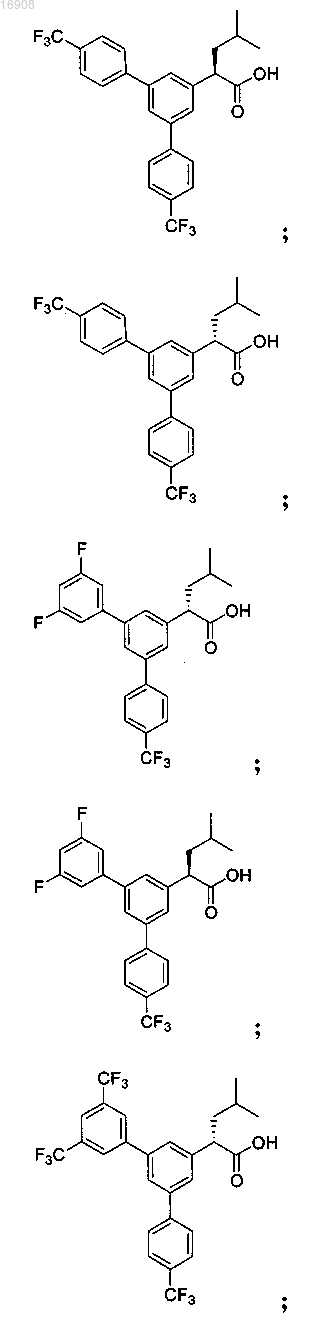
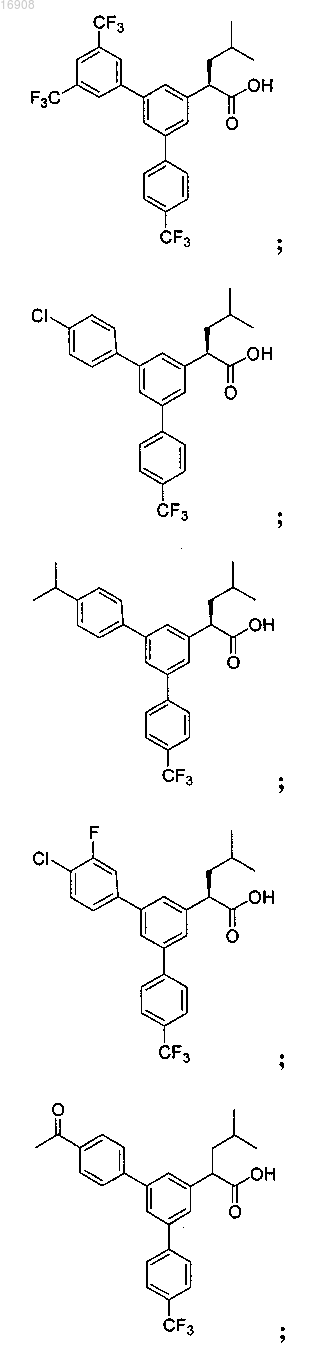
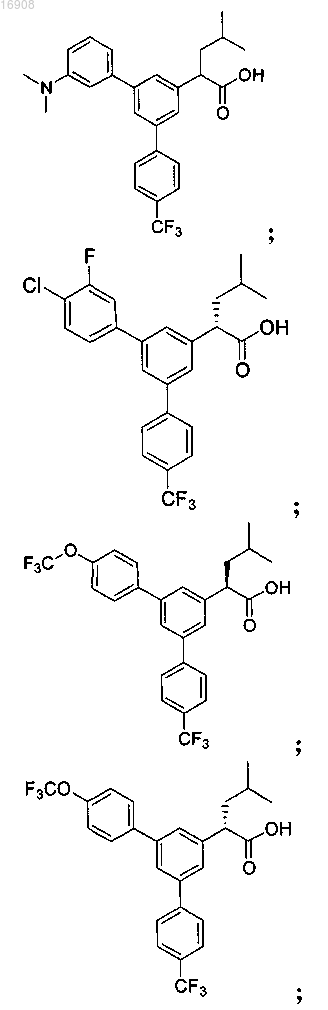
а также его сольваты, гидраты, сложные эфиры и фармацевтические приемлемые соли.
6. Соединение по любому из пп.1-5 для применения в качестве лекарственного средства.
7. Применение соединения по любому из пп.1-5 для получения лекарственного средства для модуляции γ-секретазы.
8. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения болезни, связанной с повышенным уровнем продуцирования Аβ42.
9. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения болезни Альцгеймера.
10. Фармацевтическая композиция, содержащая соединение по любому из п.1-5 в смеси с инертным носителем.
11. Способ приготовления соединения по любому из пп.1-5, включающий следующие стадии:
a) обработку дигалогенфторбензольного соединения, предпочтительно дибромфторбензола, бензиловым спиртом в присутствии гидрида щелочного металла;
b) обработку продукта реакции подходящим производным малонового эфира в присутствии гидрида щелочного металла и галогенида металла;
c) обработку в кислотном растворителе;
d) взаимодействие с производным бороновой кислоты;
e) удаление бензиловоэфирной защитной группы;
f) преобразование полученного гидроксисоединения в трифлат и взаимодействие с бороновой кислотой;
g) при необходимости, алкилирование полученного трифенильного соединения;
h) преобразование сложного эфира в кислоту.
12. Способ приготовления соединения по любому из пп.1-5, включающий следующие стадии:
a) преобразование производного дигидроксифенилуксусной кислоты в бис-трифлат;
b) взаимодействие бис-трифлата с бороновой кислотой;
c) при необходимости, алкилирование полученного трифенильного соединения;
d) преобразование сложного эфира в кислоту;
e) разделение рацемической смеси на энантиомеры.
13. Способ приготовления соединения по любому из пп.1-5, включающий следующие стадии:
a) преобразование дигидроксибензонитрила в бис-трифлат;
b) взаимодействие бис-трифлата с бороновой кислотой;
c) гидролиз нитрильной группы или
d) преобразование нитрильной группы в тетразол.
14. Способ получения лекарственного средства, включающий стадии:
a) приготовления соединения по п.1 и
b) приготовления препаративной формы лекарственного средства, содержащего указанное соединение.
15. Способ лечения млекопитающего для модуляции активности γ-секретазы, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-5.
16. Способ лечения у млекопитающего заболевания, связанного с повышенным уровнем продуцирования Аβ42, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-5.
17. Способ лечения болезни Альцгеймера у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-5.
Текст
ПРОИЗВОДНЫЕ ТЕРФЕНИЛА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА Настоящее изобретение касается соединений общей формулы (I) со значениями X, Y, R1, R2, R3, R4, R9, R10, приведенными выше, и к их сольватам, гидратам,сложным эфирам и фармацевтически приемлемым солям. Кроме того, изобретение касается применения указанных соединений для лечения болезни Альцгеймера и их применения для модуляции активности -секретазы. 016908 Настоящее изобретение относится к соединениям общей формулы (I) с приведенными ниже определениями X, R1-R4 и/или к их соли или сложному эфиру. Кроме того, изобретение относится к использованию указанных соединений для лечения болезни Альцгеймера и модуляции активности -секретазы. Болезнь Альцгеймера (БА) является прогрессирующим нейродегенеративным расстройством, характеризующимся потерей памяти, познавательных способностей и поведенческой стабильности. БА поражает 6-10% населения в возрасте старше 65 лет и 50% в возрасте старше 85 лет. Она занимает лидирующее место среди причин деменции и третье место среди причин смертности после сердечнососудистых заболеваний и рака. На настоящий момент эффективные способы лечения БА отсутствуют. В США общие чистые расходы, связанные с БА, превышают 100 млрдв год. БА не имеет простой этиологии, однако ассоциируется с определенными факторами риска, включающими (1) возраст, (2) семейный анамнез и (3) травму головы; другие факторы включают токсичность окружающей среды и низкий уровень образования. Специфические невропатологические поражения в лимбической коре и коре головного мозга включают внутриклеточные нейрофибриллярные сплетения,состоящие из гиперфосфорилированного -протеина, и внеклеточное депонирование фибриллярных агрегатов амилоидных -пептидов (амилоидных бляшек). Главным компонентом амилоидных бляшек являются амилоидные бета (А) пептиды различной длины. Его вариант - A1-42-пептид (А-42) - считается главной причиной образования амилоида. Еще одним вариантом является A1-40-пептида (А-40). Амилоид бета является протеолитическим продуктом белка-предшественника, белка-предшественника бета амилоида (-АРР или АРР). Семейные, рано возникающие аутосомные доминантные формы БА связывают с миссенсмутациями в белке-предшественнике -амилоида (-АРР или АРР) и в пресенелине-1 и -2. У некоторых пациентов поздно наступающие формы БА связывают со специфическим аллелем гена аполипротеина Е(АроЕ) и в последнее время с нахождением мутации в 2-макроглобулине, которая может быть связана по крайней мере с 20% случаев заболевания БА. Вопреки этой гетерогенности все формы БА демонстрируют одинаковые патологические показатели. Генетический анализ обеспечил наилучший логический терапевтический подход к БА. Все обнаруженные к настоящему моменту мутации оказывают воздействие на количественное и качественное продуцирование амилоидогенных пептидов, известных как Aпептиды (А), а именно АР 42, и обеспечили сильную поддержку гипотезе "амилоидного каскада" БА(Tanzi и Bertram, 2005, Cell 120, 545). Вероятная связь между генерацией А-пептида и патологией БА подчеркивает необходимость лучшего понимания механизма продуцирования А и служит большой поддержкой для терапевтического подхода к модулированию уровней А. Выброс А-пептидов модулируется по крайней мере двумя протеолитическими активностями, называемыми расщеплением - и -секретазой по N-концу (связь Met-Asp) и С-концу (остатки 37-42) Апептида соответственно. На секреторном пути имеются свидетельства того, что -секретаза расщепляет первой, приводя к секреции s-APP (s) и удержанию 11 кДа связанных с мембраной карбоксильных концевых фрагментов (ККФ). Считается, что последнее создает А-пептиды вслед за расщеплением секретазой. Количество более длинной изоформы - А 42 - селективно увеличивается у пациентовносителей определенных мутаций в определенном протеине (пресенилине), и эти мутации ассоциируют с семейной формой болезни Альцгеймера, характеризующейся ранним наступлением. Поэтому многие исследователи считают А 42 главным виновником патогенеза болезни Альцгеймера. Теперь стало ясно, что активность -секретазы нельзя приписывать одному определенному протеину; в действительности она связана с совокупностью различных протеинов. Активность -секретазы связана с мультипротеиновым комплексом, содержащим по крайней мере четыре компонента: гетеродимер пресенилина (PS), никастрин, aph-1 и pen-2. Гетеродимер PS состоит из амино- и карбокситерминальных фрагментов PS, созданных эндопротеолизом белка-предшественника. Два аспартата каталитического сайта находятся на границе этого гетеродимера. Недавно было высказано предположение, что никастрин служит рецептором -секретазного субстрата. Функции других компонентов -секретазы неизвестны, но все они требуются для активности (Steiner, 2004. Curr. Alzheimer Research 1(3): 175-181). Итак, хотя молекулярный механизм второго шага расщепления до сих пор остается неясным, комплекс -секретазы стал одной из важнейших мишеней в поиске соединений для лечения болезни Альцгеймера. Предлагались различные стратегии, целью которых является секретаза при болезни Альцгеймера,начиная от нацеливания непосредственно на каталитический сайт, разработки субстрат-специфических ингибиторов и модуляторов активности -секретазы (Marjaux et al., 2004. Drug Discovery Today: Therapeutic Strategies, Volume 1, 1-6). Соответственно, было описано большое количество разнообразных соединений, мишенью которых является секретаза (Larner, 2004. Secretases as therapeutics targets in Alzheimer's disease: patents 2000-2004. Expert Opin. Ther. Patents 14, 1403-1420). Действительно, это открытие было недавно поддержано биохимическими исследованиями, продемонстрировавшими воздействие определенных нестероидных противовоспалительных препаратовMorihara et al. (2002) J. Neurochem. 83, 1009; Eriksen (2003) J. Clin. Invest. 112, 440). Потенциальными ограничениями для использования НПВП для предотвращения или лечения БА являются их ингибирование активности энзимов, что может привести к нежелательным побочным эффектами, и их низкое проникновение в ЦНС (Peretto et al., 2005, J. Med. Chem. 48, 5705-5720). Таким образом, существует большая необходимость в новых соединениях, модулирующих активность усекретазы и открывающих тем самым новые перспективы в лечении болезни Альцгеймера. Целью настоящего изобретения является обеспечение таких соединений. Изобретение направлено на новые соединения формулы I, где X означает связь или группу -CR5R6,R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9;R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; S(O)2R7; N(R7R8);C(O)R7; замещенного или незамещенного C1-C4-алкила и замещенного или незамещенного С 1-С 4 алкокси, и где заместители обеих групп С 1-С 4-алкил и С 1-С 4-алкокси выбраны из F, Cl, Br, I;Y означает карбоксильную группу -С(О)ОН; а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. Применительно к данному тексту термин "замещенный" включает как частичное, так и полное замещение. Заместители могут быть насыщенными или ненасыщенными. Сложными эфирами по формуле (I) являются те, в которых Н карбоксильной группы замещен органическим остатком R7a. Специалистам в данной области известны подходящие органические остатки. Предпочтительный R7a включает следующие: незамещенный или, по крайней мере, монозамещенный алкил, предпочтительно C1-C10-алкил, алкенил, предпочтительно С 2-С 10-алкенил, алкинил, предпочтительно С 3-С 10-алкинил, а также незамещенное или, по крайней мере, монозамещенное, насыщенное или ненасыщенное, неароматическое или ароматическое кольцо, имеющее 3-6 атомов С, которое может содержать один или более гетероатомов из группы N, S или О, которые могут быть одинаковыми или разными в случае, если присутствует более одного гетероатома. Указанные заместители выбираются из группы, состоящей из галогена, алкила, алкенила, алкинила, N, S, О, карбокси, сульфонила и т.п., и могут далее замещаться. Примеры ароматических групп включают арильные группы, например фенильные группы, и гетероарильные группы, которые могут замещаться предпочтительно приведенными выше заместителями. В другом исполнении изобретенияX означает группу -CR5R6, где R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9;R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н, С 1-С 4-алкила, С 1-C4-алкокси,-N(CH3)2, -SO2CH3, CN, OCF3, -C(O)CH3, OCH3, CF3, F и Cl; где указанные С 1-С 4-алкил и С 1-С 4-алкокси независимо могут быть необязательно замещены одним, двумя или тремя заместителями, выбранными из группы, состоящей из I, Br, F и Cl; и/илиY означает карбоксильную группу,а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. В еще одном исполнении данного изобретенияR1, R2, R3 и R4 выбраны независимо друг от друга из группы, состоящей из Н, С 1-С 4-алкила, С 1-С 4 алкокси, -N(CH3)2, -SO2CH3, CN, OCF3, -C(O)CH3, OCH3, CF3, F и Cl; где указанные С 1-С 4-алкил и С 1-С 4 алкокси могут быть необязательно независимо замещены одним, двумя или тремя заместителями, выбранными из группы, состоящей из I, Br, F и Cl;Y означает карбоксильную группу; а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. В еще одном исполнении настоящего изобретенияR1, R2, R3 и R4 выбраны независимо друг от друга из группы, состоящей из Н, С 1-С 4-алкила,-N(CH3)2, -SO2CH3, CN, OCF3, -C(O)CH3, OCH3, CF3, F, и Cl; а также его сольваты, гидраты, сложные эфиры и их фармацевтически приемлемые соли. Целью еще одного исполнения изобретения являются соединения формулы IX означает связь или группу -CR5R6, где R5 и R6 представляют собой независимо друг от друга водород (Н); алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, н-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, третС 4 Н 9;R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; S(O)2R7; N(R7R8);C(O)R7; замещенного или незамещенного С 1-С 4-алкила и замещенного или незамещенного С 1-С 4 алкокси, и где заместители обеих групп С 1-С 4-алкил и С 1-С 4-алкокси выбраны из F, Cl, Br, I;Y означает карбоксильную группу -С(О)ОН; и/или их соль или сложный эфир. Применительно к данному тексту термин "замещенный" включает как частичное, так и полное замещение. Заместители могут быть насыщенные или ненасыщенные. Сложными эфирами по формуле (I) являются такие эфиры, в которых Н карбоксильной группы замещен органическим остатком R7a. Специалистам в данной области известны подходящие органические остатки. Предпочтительные R7a включают незамещенный или, по крайней мере, монозамещенный алкил, предпочтительно C1-С 10-алкил, алкенил, предпочтительно С 2-С 10-алкенил, алкинил, предпочтительно С 3-С 10-алкинил, и незамещенный или, по крайней мере, монозамещенный, насыщенный или ненасыщенный, неароматический или ароматическое кольцо, имеющее 3-6 атомов, который может содержать один или более гетероатомов из группы N, S или О, которые могут быть идентичными или разными в случае присутствия более одного гетероатома. Указанные заместители выбраны и группы, состоящей из галогена, алкила, алкенила, алкинила, N, S, О, карбокси, сульфонила и т.п., и которые могут далее замещаться. Пример ароматических групп включают арильные группы, например фенильные группы, и гетероарильные группы, которые могут замещаться предпочтительно вышеприведенными заместителями. Термин "С 1-С 4-алкил" относится к метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу,втор-бутилу и трет-бутилу. В предпочтительных исполнениях изобретение относится к соединениям общей формулы (I), где X;Y; R1 и R2, а также R3, R4, R5 и R6 имеют независимо друг от друга следующие значения:X означает группу -CR5R6, где R5 и R6 выбраны независимо друг от друга из группы, состоящей из Н; алкила, выбранного из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; и/илиR1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н; С 1-С 4-алкила или С 1-С 4-алкокси,частично или полностью замещенных F, Cl, Br, I; и/илиY означает карбоксильную группу и/или их соль или сложный эфир. В данной группе исполнений еще более предпочтительно, если все группы X; Y; R1, R2, R3, R4, R5 иR6 имеют указанные выше значения. Еще более предпочтительно, если X; Y; R1 и R2 и R3, R4, R5 и R6 имеют независимо друг от друга следующие значения:R1, R2, R3 и R4 выбраны независимо друг от друга из группы, состоящей из Н; С 1-С 4-алкила или С 1 С 4-алкокси, частично или полностью замещенных F, Cl, Br, I; и/илиY означает карбоксильную группу и/или соль или сложный эфир этого соединения. В данной группе исполнений изобретения еще предпочтительней, если все группы X; Y; R1, R2, R3,R4, R5 и R6 имеют вышеуказанные значения. Еще предпочтительней, если X; Y; R1 и R2 и R3, R4, R5 и R6 имеют независимо друг от друга следующие значения:R1, R2, R3 и R4 независимо выбраны из группы, состоящей из Н, СН 3, ОСН 3, CF3, F и Cl; и/или его соль или сложный эфир. В данной группе исполнений изобретения еще предпочтительней, если все группы X; Y; R1 и R2 иR3, R4, R5 и R6 имеют вышеуказанные значения. В еще более предпочтительном исполнении изобретение относится к соединениям, выбранным из группы, включающей(i) 4-хлор-4-трифторметил-[1,1';3,1"]терфенил-5'-ил)уксусную кислоту,(ii) (4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(iii) (3-хлор-4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(iv) (4-гидрокси-4"-трифторметил[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(v) (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(vi) [1,1';3',1"]терфенил-5'-ил-уксусную кислоту,(vii) (4,4"-бис-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(viii) (4,4"-дифтор-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(ix) (3,3"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(х) (3,3"-бис-трифторметил-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(xi) (4,4"-диметил-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(xii) (4,4"-диметокси-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту,(xiii) 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановую кислоту,(xiv) (R)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановую кислоту,(xv) (S)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановую кислоту,(xvi) 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбоновую кислоту,(xvii) 5-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)-1H-тетразол и их сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. Некоторые соединения, описываемые в настоящем изобретении, и/или их соли или сложные эфиры существуют в различных стереоизомерных формах. Все эти формы являются предметом настоящего изобретения. В еще одном исполнении изобретение относится к соединениям, выбранным из группы, включающей а также сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли этих соединений. Ниже приводятся примеры включенных в данный патент солей соединений, описываемых в настоящем патенте. Приводимый ниже список различных солей не является полным и ограничивающим. Описываемые в изобретении соединения, содержащие одну или более кислотных групп, могут использоваться в соответствии с изобретением, например, в виде солей щелочных металлов, солей щелочно-земельных металлов или аммонийных солей. Более конкретные примеры таких солей включают соли натрия, соли калия, соли кальция, соли магния или соли с аммиаком или органическими аминами, такими как, например, этиламин, этаноламин, триэтаноламин или аминокислоты. Описываемые соединения, содержащие одну или более основных групп, т.е. групп, которые могут быть протонированы, могут использоваться согласно изобретению в виде своих солей с неорганическими или органическими кислотами. Примеры подходящих кислот включают соляную кислоту, бромистый водород, фосфорную кисло-9 016908 ту, серную кислоту, азотную кислоту, метансульфоновую кислоту, паратолуолсульфоновую кислоту,нафталиндисульфоновую кислоту, щавелевую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, салициловую кислоту, бензойную кислоту, муравьиную кислоту, пропионовую кислоту, пивалеваю кислоту, диэтилуксусную кислоту, малоновую кислоту, янтарную кислоту, пимелиновую кислоту,фумаровую кислоту, малеиновую кислоту, яблочную кислоту, сульфаминовую кислоту, фенилпропионовую кислоту, глюконовую кислоту, аскорбиновую кислоту, изоникотиновую кислоту, лимонную кислоту, адипиновую кислоту и другие кислоты, известные специалистам в данной области. Термин "фармацевтически приемлемый" означает одобренный контрольным органом, таким как ЕМЕА (Европейское агентство лекарственных средств, Европа) и/или FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, США) и/или любым другим национальным контрольным органом, регулирующим применение для животных, предпочтительно для людей. Описываемые в изобретении соединения, содержащие несколько основных групп, могут одновременно образовывать различные соли. Если соединение по настоящему изобретению в молекуле одновременно содержит кислотную и основную группу, изобретение также включает, кроме указанных форм солей, другие соли или бетаины. Соответствующие соли соединений, описываемых в изобретении, могут быть получены обычными методами, известными специалистам в данной области, например их реакцией с органической или неорганической солью или основанием в растворителе или диспергаторе или путем анионирования или катионирования с другими солями. Кроме того, изобретение включает все соли описываемых соединений, которые благодаря своей низкой физиологической совместимости не подходят для прямого использования в фармацевтических препаратах, но которые могут использоваться, например, в качестве промежуточных химических соединений для химических реакций или для приготовления фармацевтически приемлемых солей или которые могли бы подходить для изучения активности описываемого в изобретении соединения, модулирующего-секретазу, любым подходящим способом, включая любой анализ in vitro. Настоящее изобретение включает также все сольваты соединений, описываемых в изобретении. Кроме того, изобретение включает производные/пролекарства (включая их соли) описываемых соединений, которые содержат физиологически переносимые и легкорасщепляющиеся группы и которые в процессе обмена веществ у животных, предпочтительно у млекопитающих, еще предпочтительней у людей, превращаются в соединение, описываемое в изобретении. Изобретение также включает метаболиты соединений, описываемых в изобретении. Термин "метаболиты" относится ко всем молекулам, полученным из любого из соединений, описываемых в изобретении, в клетке или организме, предпочтительно у млекопитающих. Термин "метаболиты" предпочтительно относится к молекулам, которые отличаются от любой молекулы, присутствующей в любой такой клетке или организме в физиологических условиях. Структура метаболитов соединений по изобретению будет очевидна любому специалисту в данной области, использующему разнообразные подходящие методы. Соединения общей формулы (I) можно получить, используя методы, опубликованные в литературе,или другие аналогичные методы. В зависимости от обстоятельств конкретного случая и во избежание побочных реакций во время синтеза соединения общей формулы (I) может быть необходимым или предпочтительным временно блокировать функциональные группы путем введении защитных групп и снять с них защиту на более поздней стадии синтеза или ввести функциональные группы в форме групп-предшественников и преобразовать их на более поздней стадии в желаемые функциональные группы. Подходящие стратегии синтеза,защитные группы и группы-предшественники известны специалистам в данной области. При желании соединения формулы (I) могут быть очищены с использованием обычных процедур очистки, например методом рекристаллизации или хроматографии. Исходные материалы для приготовления соединений формулы (I) либо имеются в продаже, либо могут быть получены, используя известные в литературе или аналогичные процедуры. Они могут служить основой для получения других соединений по настоящему изобретению несколькими способами, хорошо известными специалистам в данной области. Изобретение также относится к соединению, предлагаемому в изобретении, для использования в качестве лекарственного средства. Соединениями являются вышеописанные соединения; кроме того, в отношении нижеизложенных медикаментозных исполнений использования изобретения, это, например,составы, аппликации и композиции, которые также применимы к данному аспекту изобретения. В частности, соединения по данному изобретению применимы для лечения болезни Альцгеймера. Детали, относящиеся к указанному использованию, раскрываются ниже. Соединения могут использоваться для модулирования активности -секретазы. Применительно к данному тексту термин "модулирование активности -секретазы" относится к воздействию на обработку АРР комплексом -секретазы. Предпочтительно он относится к такому воздействию, при котором общая скорость обработки АРР остается в основном такой же, как и без приме- 10016908 нения указанных соединений, но при котором относительные количества обработанного продукта изменяются, предпочтительней таким образом, что количество продуцированного АР 42-пептида сокращается. Например, может продуцироваться другая разновидность A (например, A-38 или иная разновидность пептида A, имеющая более короткую аминокислотную последовательность, вместо A-42) или же относительные количества продуктов могут быть иными (например, изменяется отношение A-40 кA 42, предпочтительно в сторону увеличения). Активность -секретазы может, например, измеряться посредством определения обработки АРР,например посредством определения уровней продуцированной разновидности A-пептида, важнее всего уровней A-42 (см. ниже раздел Примеры). Ранее было показано, что комплекс -секретазы также вовлечен в обработку Notch-протеина. Notch является сигнальным протеином, который играет важную роль в процессах развития (e.g. reviewed inSchweisguth F (2004) Curr. Biol. 14, R129). Что касается использования этих соединений для модулирования активности -секретазы в терапии,кажется предпочтительным не вмешиваться в активность -секретазы, направленную на обработкуNotch, во избежание предполагаемых нежелательных побочных эффектов. Таким образом, предпочтительны те соединения, которые не оказывают воздействия на активность комплекса -секретазы, направленную на обработку Notch. В рамках данного изобретения "воздействие на активность по обработке Notch" включает как ингибирование, так и активизацию с определенным коэффициентом активности по обработке Notch. Считается, что соединение не оказывает воздействия на активность по обработке Notch, если указанный коэффициент менее 20, предпочтительно менее 10, еще предпочтительней менее 5 и наиболее предпочтительно менее 2 в соответствующих анализах, как описано у Shimizu et al. (2000) Mol. Cell. Biol,20: 6913 при концентрации 30 мкМ. Такая модуляция -секретазы может быть выполнена, например, у животных, таких как млекопитающие. Примерами млекопитающих являются мыши, крысы, морские свинки, обезьяны, собаки, коты. Модуляцию можно также выполнить у людей. В определенном исполнении изобретения данная модуляция выполняется in vitro или на клеточной культуре. Как известно специалистам в данной области, имеется несколько анализов in vitro и на клеточной культуре. Примерные анализы, применимые для измерения продуцирования С-терминальных фрагментов АРР на клеточных линиях или трансгенных животных посредством анализа Western blot, включают, но не ограничиваются, анализы, описанные в Yan et al., 1999, Nature 402, 533-537. Пример анализа -секретазы in vitro описан в WO-03/008635. В этом анализе подходящий субстрат пептида соединяется с препаратом -секретазы и измеряется способность расщеплять субстрат. Концентрации различных продуктов расщепления -секретазы (А-пептидов) можно определять различными методами, известными специалистам в данной области. Примеры таких методов включают определение пептидов посредством масс-спектроскопии или обнаружения антител. Примерные анализы, применимые для характеристики профиля растворимых A-пептидов в культивируемых клеточных средах и биологических жидкостях, включают, но не ограничиваются, анализы,описанные в Wang et al., 1996, J. Biol. Chem. 271, 31894-31902. В этом анализе используется комбинация иммунопреципитации A-пептидов со специфическими антителами и обнаружения и количественного анализа разновидностей A-пептидов посредством ионизационной время-пролетной масс-спектроскопии с матрично-активированной лазерной десорбцией. Примерные анализы, применимые для измерения продуцирования пептидов A-40 или A-42 методом ELISA, включают, не ограничиваясь, анализы, описанные в Vassar et al., 1999, Science 286, 735-741. Дальнейшая информация раскрывается, например, в N. Ida et al. (1996) J. Biol. Chem. 271, 22908, и М.Jensen et al. (2000) Mol. Med. 6, 291. Подходящие антитела можно получить от The Genetics Company,Inc., Швейцария. Имеются также наборы на основе антител от Innogenetics, Бельгия. Клетки, которые можно использовать в таких анализах, включают клетки, которые эндогенно экспрессируют комплекс -секретазы, и трансфицированные клетки, которые временно или устойчиво экспрессируют некоторые или все компоненты комплекса -секретазы. Специалистам в данной области известны многочисленные доступные клеточные линии. Особо подходят клетки и клеточные линии нейронного или глиального происхождения. Кроме того, могут использоваться клетки и ткани мозга, а также их гомогенаты и мембранные препараты (Xia et al., 1998, Biochemistry 37, 16465-16471). Такие анализы могли бы проводиться, например, для изучения действия описываемых в изобретении соединений в различных экспериментальных условиях и конфигурациях. Кроме того, такие анализы могли бы проводиться как часть функционального исследования комплекса -секретазы. Например, можно экспрессировать один или более компонентов (либо в их исходной форме, либо с определенными мутациями и/или модификациями) комплекса -секретазы животного, предпочтительно млекопитающего, еще предпочтительней человека, в определенных клеточных линиях и изучить дейст- 11016908 вие соединений, описываемых в данном изобретении. Мутировавшие формы компонента (компонентов) могут быть либо мутировавшими формами, которые были ранее описаны у определенных животных, предпочтительно у млекопитающих, еще предпочтительней у человека, либо мутировавшими формами, которые не были ранее описаны у указанных млекопитающих. Модификации компонентов комплекса -секретазы включают как любую физиологическую модификацию указанных компонентов, так и другие модификации, которые уже были описаны как модификации протеинов в биологической системе. Примеры таких модификаций включают, не ограничиваясь, гликозилирование, фосфорилирование,пренилирование, миристилирование и фарнезилирование. Кроме того, соединения, описываемые в изобретении, могут применяться для получения лекарственного средства для модулирования активности -секретазы. Изобретение также относится к применению указанных соединений для получения лекарственного средства для модулирования активности -секретазы. Активность -секретазы может модулироваться различными способами, т.е. приводить к получению различных профилей различных А-пептидов. Предпочтительными являются такие применения соединения для модулирования активности Апептидов, которые приводят к снижению относительных количеств продуцируемых А 42-пептидов. Соответствующие дозы, способы применения, составы и т.д. описаны ниже. Изобретение также относится к использованию описываемых соединений для лечения болезни, связанной с повышенным уровнем продуцирования А 42. Болезнь, сопровождаемая повышенными уровнями продуцирования и отложения в мозге A-пептида - это обычно болезнь Альцгеймера (БА), церебральная амилоидная ангиопатия, многоинфарктная деменция, деменция боксеров или синдром Дауна,предпочтительно БА. Применительно к данному тексту термин "лечение" относится ко всем процессам, при которых наблюдается замедление, прерывание, задержка или прекращение прогрессирования болезни, но не обязательно обозначает полное уничтожение всех симптомов. Применительно к данному тексту термин "повышенный уровень продуцирования А 42" относится к условию, при котором скорость продуцирования А 42-пептида увеличивается благодаря общему увеличению обработки АРР, или предпочтительно к условию, при котором производство А 42-пептида увеличивается благодаря модифицированию профиля обработки АРР по сравнению с исходным АРР или к ситуации, когда патология отсутствует. Как указано выше, такой повышенный уровень А 42 является признаком пациентов, у которых развивается или которые страдают болезнью Альцгеймера. Одним из преимуществ описываемых соединений или части этих соединений является их повышенное проникновение в ЦНС. Кроме того, изобретение относится к фармацевтической композиции, включающей предлагаемое соединение в смеси с инертным носителем. В предпочтительном исполнении изобретение относится к фармацевтической композиции, включающей соединение, описываемое в изобретении, в смеси с инертным носителем, где инертный носитель является фармацевтическим носителем. Термин "носитель" относится к разбавителю, адъюванту или наполнителю, с которым вещество принимается. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода или масла, включая жидкости нефтяного, животного, растительного или синтетического происхождения,включая, но не ограничиваясь, арахисовое масло, соевое масло, минеральное масло, сезамовое масло и т.п. Когда фармацевтическая композиция принимается перорально, предпочтительным носителем является вода. Физиологический раствор и водная декстроза предпочтительны при внутривенном введении лекарственного средства. Физиологические растворы и водные растворы декстрозы и глицерина предпочтительно используются как жидкие носители для инъекций. Подходящими фармацевтическими наполнителями являются крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель,стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухой снятый латекс, глицерин, пропилен,гликоль, вода, этанол и т.п. При желании в композицию можно включать небольшие количества увлажняющих или эмульгирующих веществ. Композиция может быть составлена как суппозитории с такими традиционными связующими и носителями, как триглицериды. Пероральные составы могут включать стандартные носители, такие как фармацевтические разновидности маннитола, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и т.д. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" E.B. Мартина (E.W. Martin). Такие композиции будут содержать терапевтически эффективные количества соединения предпочтительно в очищенном виде вместе с подходящим количеством носителя для обеспечения удобной для применения формы. Состав должен соответствовать форме применения. Изобретение относится также к способам получения соединения по изобретению.- 12016908 В одном из исполнений получения соединения, предлагаемого в настоящем изобретении, дибромфторбензол можно обрабатывать бензиловым спиртом в присутствии гидрида щелочного металла, обычно гидрида натрия, в подходящем апротонном растворителе, таком как тетрагидрофуран. Продукт можно обрабатывать подходящим производным малоновой кислоты, таким как сложный трет-бутиловый этиловый эфир малоновой кислоты в присутствии гидрида щелочного металла, обычно гидрида натрия и галогенида металла, обычно галогенида меди, предпочтительно бромида меди. Дальнейшая обработка в кислотном растворителе, таком как уксусная кислота, при повышенной температуре дает сложный эфир бензилоксибромфенилуксусной кислоты. Его можно соединить с бороновой кислотой при разнообразных условиях, известных специалистам в данной области как связывание по Сузуки, используя растворители, такие как 1,2-диметоксиэтан и вода, карбонат щелочного металла, такой как карбонат калия, и палладиевое соединение, такое как тетракис(трифенилфосфин)палладий(0). Защитная группа простого бензилового эфира может быть удалена при различных условиях, известных специалистам в данной области как снятие защитных групп, используя палладиевый катализатор, такой как 10% палладий на угле в подходящем растворителе, таком как этанол, и в атмосфере водорода. Полученное в результате гидроксильное соединение может быть преобразовано в трифлат посредством использования, например трифторметансульфонового ангидрида, органического основания, такого как пиридин, и в подходящем растворителе, таком как дихлорметан. Затем этот трифлат присоединяется к бороновой кислоте в различных условиях, известных специалистам в данной области как связывание по Сузуки, обычно используя растворители, такие как 1,2-диметоксиэтан и вода, карбонат щелочного метала, такой как карбонат калия, и палладиевое соединение, такое как бис(три-третбутилфосфин)палладий(0). В случае необходимости, трифенилкарбоновую кислоту можно алкилировать, обрабатывая в подходящем апротонном растворителе, таком как тетрагидрофуран, подходящим основанием, таким как алкиламид металла, обычно литийдиизопропиламид (LDA), подходящим галогениде при подходящей температуре, обычно -78 С. Преобразование сложного эфира в кислоту может осуществляться с использованием основания, такого как гидроксид щелочного металла, обычно гидроксид натрия, в присутствии воды и других подходящих растворителей, таких как этанол. В другом исполнении производное дигидроксифенилуксусной кислоты можно преобразовывать в бис-трифлат, используя, например, трифторметансульфоновый ангидрид, органическое основание, такое как пиридин, и в подходящем растворителе, таком как дихлорметан. Этот трифлат можно затем связать с бороновой кислотой при различных условиях, известных специалистам в данной области как связывание по Сузуки, обычно используя растворители, такие как 1,2-диметоксиэтан и вода, карбонат щелочного металла, такой как карбонат калия, и палладиевое соединение, такое как бис(три-третбутилфосфин)палладий(0). При необходимости, трифенилкарбоновую кислоту можно алкилировать обработкой в подходящем апротонном растворителе, таком как тетрагидрофуран, подходящим основанием, таким как алкиламид металла, обычно литийдиизопропиламид (LDA), и подходящим галогенидом обычно при температуре-78 С. Преобразование сложного эфира в кислоту может осуществляться с использованием основания, такого как гидроксид щелочного металла, обычно гидроксид натрия, в присутствии воды и других подходящих растворителей, таких как этанол. В еще одном исполнении дигидроксибензонитрил можно преобразовывать в бис-трифлат, используя, например, трифторметансульфоновый ангидрид, органическое основание, такое как пиридин, и в подходящем растворителе, таком как дихлорметан. Затем этот трифлат связывается с бороновой кислотой при разнообразных условиях, известных специалистам в данной области как связывание по Сузуки,обычно используя растворители, такие как 1,2-диметоксиэтан и вода, карбонат щелочного металла, такой как карбонат калий, и палладиевое соединение, такое как бис(три-трет-бутилфосфин)палладий(0). Гидролиз нитрила до кислоты можно производить, используя основание, такое как гидроксид щелочного металла, обычно гидроксид натрия, в присутствии воды и других подходящих растворителей,таких как этанол, при повышенной температуре. Или же нитрил можно преобразовывать в тетразол, обрабатывая его азидом щелочного металла,обычно азидом натрия, галогенидом аммония, таким как хлорид аммония, и в подходящим растворителе,таком как ДМФ, при повышенной температуре. Когда предлагаемые соединения получают в виде рацемических соединений, их можно разделять на энантиомеры методами, известными специалистам в данной области, обычно используя хиральную колонку ВЭЖХ. Кроме того, изобретение относится к способу получения лекарственного средства, включающему следующие шаги:a) приготовление соединения, предлагаемого в изобретении,b) приготовление препаративной формы лекарственного средства, содержащего это соединение.- 13016908 Соединения, предлагаемые в изобретении, и их фармацевтически приемлемые соли, необязательно в сочетании с другими фармацевтически активными соединениями, применимы для лечения и предотвращения болезни Альцгеймера или ее симптомов. Такие дополнительные соединения включают лекарственные препараты, стимулирующие познавательные способности, такие как ингибиторы ацетилхолинестеразы (например, донепезил, такрин, галантамин, ривастигмин), NMDA-антагонисты (например,мемантин), ингибиторы PDE4 (например, арифло) или любые иные лекарственные препараты, известные специалистам в данной области и способные лечить или предотвращать болезнь Альцгеймера. Такие соединения также включают лекарственные препараты, снижающие уровень холестерина, такие как статины (например, симвастатин). Эти соединения можно вводить животным, предпочтительно млекопитающим, в частности людям, как самостоятельные лекарственные средства, в смесях друг с другом или в виде фармацевтических препаратов. Известны и могут применяться различные системы доставки соединения, предлагаемого в изобретении, при лечении болезни Альцгеймера или для модулирования активности -секретазы, например инкапсуляция в липосомы, микрочастицы и микрокапсулы. Если соединение не доставляется непосредственно в центральную нервную систему, желательно выбирать и/или модифицировать способы приема таким образом, чтобы позволить фармацевтическому соединению преодолеть барьер между кровью и мозгом. Способы введения включают, не ограничиваясь, интрадермальный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный. Соединения могут вводиться любым удобным способом, например инфузионным, в виде болюсной инъекции, путем абсорбции через эпителиальную или слизисто-кожную выстилку, а также с другими биологически активными агентами. Введение может быть системным и местным. Кроме того, может быть желательным вводить фармацевтические композиции, описываемые в изобретении, в центральную нервную систему любым подходящим способом, включая интравентрикулярные и интратекальные инъекции; интравентрикулярная инъекция может облегчаться использованием интравентрикулярного катетера, например, присоединенного к резервуару, такому как резервуар Оммайя. Внутрилегочное введение также может применяться,например, используя ингаляторы или распылители и составы, содержащие аэрозолируемый агент. В еще одном исполнении соединение может доставляться в везикуле, в частности в липосоме(Langer (1990) Science 249, 1527; Treat et al. (1989) Liposomes in the Therapy of Infectious Disease и Cancer,Lopez-Berestein и Fidler, eds., Liss, New York, 353; Lopez-Berestein, ibid., 317). В еще одном исполнении соединение может доставляться посредством системы контролируемого высвобождения. В одном из исполнений может использоваться насос (1987) CRC Crit. Ref. Biomed. Eng. 14, 201; Buchwald et al. (1980) Surgery 88, 507; Saudek et al. (1989) N. Engl. J. Med. 321, 574). В другом могут использоваться полимерные материалы (Ranger и Peppas (1983) Macromol. Sci. Rev. Macromol.(1989) J. Neurosurg. 71, 858). В еще одном исполнении система контролируемого высвобождения может быть размещена рядом с терапевтической мишенью, т.е. мозгом, требуя, таким образом, лишь доли системной дозы (e.g. Goodson, 1984, In: Medical Applications of Controlled Release, supra, Vol. 2, 115). Другие системы контролируемого высвобождения обсуждаются в обзоре Лангера (1990, Science 249, 1527). Для выбора подходящего способа введения специалист в данной области также рассмотрит способы введения, известные для других лекарственных средств, используемых для лечения болезни Альцгеймера. Например, арицепт/донепезил и когнекс/такрин (все они являются ингибиторами ацетилхолинестеразы) вводятся перорально, аксура/мемантин (антагонист рецептора NVDA) выпускаются как в виде таблеток и жидкости, так и в виде раствора для внутривенного введения. Кроме того, специалисты в данной области примут во внимание имеющуюся информацию о способах применения членов семейства NSAID в клинических испытаниях и других исследованиях, направленных на изучение их воздействия на болезнь Альцгеймера. С целью выбора подходящей дозы специалист в данной области выберет ту дозу, которая проявила себя как нетоксичная во время доклинических и/или клинических исследований и которая может соответствовать описанным выше качествам или может иметь отклонения от них. Точная доза, которая должна применяться в составе, будет также зависеть от способа введения и серьезности заболевания или расстройства; решение об этом должно приниматься лечащим врачом с учетом обстоятельств каждого конкретного случая. Однако диапазоны подходящих доз для внутривенного введения составляют обычно 20-500 мкг активного вещества на 1 кг веса тела. Подходящие дозы для интраназального введения обычно составляют от 0,01 мг/кг до 1 мг на 1 кг веса тела. Эффективные дозы могут экстраполироваться от кривых эффекта доз, полученных с использованием тестовых системin vitro или экспериментальной модели на животных. Примерной экспериментальной моделью на животных является линия трансгенной мыши "Tg2576",содержащая АРР 695-форму с двойной мутацией KM670/671NL. Для информации см., например, патентFrautschy et al. (1998) Am. J. Pathol. 152, 307; Irizarry et al. (1997) J. Neuropathol. Exp. Neurol. 56, 965; Lehman et al. (2003) Neurobiol. Aging 24, 645. Специалисты в данной области могут найти в различных исследованиях существенную и полезную информацию относительно выбора подходящих доз для выбранной лечебной схемы. Применительно к настоящему тексту термин "терапевтически эффективное количество" означает количество активного соединения или фармацевтического агента, которое вызывает искомую исследователем, ветеринаром, врачом или другим клиницистом биологическую или лечебную реакцию в системе тканей, животном или человеке, которая включает облегчение симптомов заболевания или расстройства,на которое направлено лечение. В том случае, когда настоящее изобретение используется для сотерапии или комбинированной терапии, включающей применение одного или более соединений, "терапевтически эффективное количество" будет означать количество комбинации агентов, взятых вместе, которое обеспечивают совокупный эффект, вызывающий желаемую биологическую или лечебную реакцию. Кроме того, специалисты в данной области понимают, что в случае сотерапии количество каждого компонента комбинации, взятое в отдельности, может быть, а может и не быть терапевтически эффективным количеством. Были опубликованы многочисленные исследования, описывающие воздействие молекул на активность -секретазы. Примерами могут быть Lim et al. (2001) Neurobiol. Aging 22, 983; Lim et al. (2000) J.al. (2003) J. Neurosci. 23, 7504. Если не указано иное, применительно к данному тексту термин "изолированная форма" означает,что соединение присутствует в форме, которая отделена от любой твердой смеси с другим веществом или веществами, системы растворителей или биологической среды. Если не указано иное, применительно к данному тексту термин "существенно чистое основание" означает, что мольный процент примесей в изолированной форме составляет менее примерно 5 мол.%,предпочтительно менее примерно 2%, еще предпочтительней менее примерно 0,5 мол.% и наиболее предпочтительно менее примерно 0,1 мол.%. Если не указано иное, применительно к данному тексту термин "существенно свободный от соответствующей солевой формы (форм)" при использовании для описания соединения формулы (I) означает, что мольный процент соответствующей солевой формы (форм) в изолированном основании формулы(I) составляет менее чем примерно 5 мол.%, предпочтительно менее примерно 2 мол.%, еще предпочтительней менее примерно 0,5 мол.% и наиболее предпочтительно менее примерно 0,1 мол.%. Термин "фармацевтически приемлемый" означает нетоксичный материал, который не препятствует эффективной биологической активности действующих ингредиентов. Такие препараты обычно могут содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов, совместимых носителей или, при необходимости, других терапевтических агентов. Общее описание синтеза Следующее общее описание приводится только с целью иллюстрации и ни в коем случае не является ограничением изобретения. Соединения формулы I, где X, R1, R2, R3, R4, R9 и R10 имеют значения, указанные в формуле I, a Y означает СО 2 Н, могут быть получены посредством гидролиза сложного эфира II при стандартных условиях кислотного или основного гидролиза, включая реакцию с NaOH, при комнатной температуре в течение нескольких часов в подходящей смеси растворителей, таких как вода, тетрагидрофуран (ТГФ) и метанол. В целях иллюстрации сложный эфир II показан с X, означающим CHR5, но специалистам в данной области понятно, что гидролиз простого эфира будет работать для всех X, как показано в формуле I Соединение II можно получить, связывая соединение IIIa или IIIb с арилбороновой кислотой или со сложным эфиром арилбороновой кислоты и пинакола при типичных условиях Сузуки, например в водном диметоксиэтане (ДМЭ) или тетрагидрофуране (ТГФ) в присутствии карбоната натрия и Pd(PPh3)4. Соединение II можно также получить реакцией связывания соединения IIIa или IIIb с бромидом арилолова или с бромидом арилцинка в условиях связывания Стилле, например в ТГФ или ДМЭ с Pd(PPh3)4.- 15016908 Соединение IIIa можно получать реакцией фенола IIIc с трифторметансульфоновым ангидридом (Tf2O) в дихлорметане (ДХМ) в присутствии амина, такого как триэтиламин, при температуре 0 С. Промежуточное соединение IIIb можно получать реакцией фенола IIIc с концентратом HCl или HBr, HI при повышенной температуре (25-150 С). Или же соединение IIIb можно получать в мягких условиях посредством обработки соответствующих трифлатов IIIc с пинаколбораном в диоксане в присутствии триэтиламина,катализированного PdCl2 с получением сложного эфира арилпинаколбороната, который затем обрабатывается галогенидом меди(II) по метанол-водной методике, описанной у Nesmejanow et al. (Chem Ber. 1960, 2729). Или же соединение IIIb, где Q означает йод, можно получить реакцией вышеуказанного арилпинаколбороната с NaI в водном ТГФ в присутствии хлораминов-Т, как описано у J. W. Huffman et.al. (Synthesis, 2005, 547). Соединение IIIc можно получить дебензилированием соединения IV посредством гидрирования в спирте, например, МеОН или EtOH в присутствии Pd-C. Дебензилирование можно также выполнять другими способами, такими как BBr3 в DCM, NaCN в DMSO/120-200 С или LiCN в DMF/120-200 С. Соединение IV можно получить алкилированием соединения V либо алкил-, либо алкенилгалогенидом. Обработка соединения V основанием, таким, например, как литий бис(трисметилсилил)амид,натрий бис(трисметилсилил)амид или литий диизопропиламид при температуре -78 С в ТГФ или в другом апротонном растворителе с последующим добавлением электрофила, например алкил- или алкенилгалогенида, дает алкилированное соединение IV. Соединение V можно получить из соединения VI посредством реакции связывания с арилбороновой кислотой в условиях Сузуки водного карбоната натрия в ДМЭ в присутствии Pd(PPh3)4. Аналогичным образом трифлаты можно преобразовать в сложные эфиры - боронаты в вышеописанных условиях и затем связывать с арилбромидами или арилхлоридами для получения соединения V. Промежуточное соединение VI можно получить из соединения VII с трифторметансульфоновым ангидридом в ДХМ в присутствии 1 экв. пиридина при 0 С. Промежуточное соединение VII можно получить посредством монодебензилирования соединенияVIII. Селективное монодебензилирование соединения VIII можно осуществить обработкой 1,1 экв. осно- 16016908 вания, например гидроксида натрия или гидроксида калия, в растворе этанола или метанола в присутствии катализатора Pd-C в атмосфере водорода в аппарате Парра. Промежуточное соединение VIII можно легко получить реакцией имеющегося в продаже сложного метилового эфира 3,5-дигидроксифенлуксусной кислоты с бромистым бензилом и карбонатом калия в ДМФ при комнатной температуре. Соединение I имеет хиральный центрпри карбоксильной группе и может существовать как один или два энантиомера (или их смесь, где излишек энантиомера может присутствовать или отсутствовать). Показаны энантиомеры Ia (энантиомер R) и Ib (энантиомер S). Чистые энантиомеры Ia и Ib можно получить хиральным разделением, используя хиральную колонку. Энантиомеры Ia и Ib можно также разделить растворением через образование хиральных аминных солей путем фракционной перекристаллизации. Энантиомеры Ia и Ib можно также получить кинетическим растворением рацемической смеси соответствующих сложных эфиров, используя энзимы липазы, например AmanoAk, Amano lipase PS, AmanolipaseA, Amano lipase M, Amano lipase F-15 Amano lipase G (от Biocatalytics Inc.) в водных органических растворителях, например в водных ДМФ, DMSO, трет-бутилэтиловым простом эфире или водных растворах triton X-100. Оба энантиомера соединения I можно получить хиральным синтезом. Соединения Ia и Ib можно получить удалением хиральных вспомогательных групп из соединении IXa и IXb соответственно, гидроксидом лития в водном растворе ТГФ в присутствии перекиси водорода. Соединения IXa и IXb можно получить, связывая соединения Ха или Xb соответственно с арилбороновой кислотой или сложным эфиром арилбороновой кислоты и пинакола в условиях Сузуки, например в водных ДМЭ или ТГФ в присутствии карбоната натрия и Pd(PPh3)4. Соединения IXa и IXb также можно получить, связывая соединения Ха или Xb, соответственно, с бромидом арилолова или бромидом арилцинка в условиях связывания Стилле, например в ТГФ или ДМЭ с Pd(PPh3)4. Соединения Ха и Xb можно получить реакцией фенолов XIa и XIb, соответственно, с трифторметансульфоновым ангидридом в ДХМ в присутствии амина, такого как триэтиламин, при температуре 0 С. Соединения XIa и XIb можно получить дебензилированием соединений XIIa и XIIb, соответственно,посредством гидрирования в спиртовом растворителе, например, МеОН или EtOH, в присутствии Pd-C. Соединения XIIa и XIIb можно получить алкилированием соединений XIIIa и XIIIb, соответственно, алкилгалогенидом или алкенилгалогенидом. Обработка соединений XIIIa и XIIIb основаниями, например литий бис(трисметилсилил)амидом, натрий бис(трисметилсилил)амидом или литийдиизопропиламидом, при температуре -78 С в ТГФ или других апротонных растворителях с последующим добавлением электрофилов, например алкилгалогенидов или алкенилгалогенидов, дает алкилированные соединения XIIa и XIIb соответственно. Соединения XIIIa и XIIIb можно получить из общего промежуточного соединения XIV посредством связывания либо с R-изомером 4-бензилоксазолидинона XVa, либо с S-изомером 4-бензилоксазолидинона XVb по методу Эванса. Промежуточное соединение XIV может реагировать с пивалоилхлоридом,оксалилхлоридом или изопропилхлоридом в ТГФ в присутствии основания, например триэтиламина илиN-метилморфолина, образуя смешанные ангидриды и кислые хлориды, которые затем реагируют с литиевой солью соединения XVa или XVb в ТГФ. Промежуточное соединение XIV можно получить сложноэфирным гидролизом соединения V основаниями в водно-спиртовом растворе, например LiOH или NaOH в водном растворе метанола. Процессы синтеза Если не было указано иное, все реакции проводились в инертной атмосфере. Спектр ЯМР получали на Bruker dpx400. ЖХ/МС выполняли на Agilent 1100, используя колонку ZORBAX SB-C18, 4,675 мм,3,5 мкм методом А. Скорость потока в колонке составляла 1 мл/мин, а в качестве растворителей использовалась вода и ацетонитрил (0,1% TFA) с вводимым объемом 10 мкл. Длины волны составляли 254 и 210 нм. Ниже описаны способы Примеры Пример (i). Получение (4-хлор-4-трифторметил-[1,1';3,1"]терфенил-5'-ил)уксусной кислоты. Получение 1-бензилокси-3,5-дибромбензола. В суспензию NaH (4,0 г 60% суспензии в минеральном масле, 100 ммоль) в ТГФ (150 мл) по каплям добавили бензиловый спирт (9,7 мл, 94 ммоль) при комнатной температуре и смесь перемешивали в течение 1 ч при комнатной температуре, после чего добавили 1,3-дибром-5-фторбензол (15,9 г, 62,5 ммоль). Реакция проходила в течение 12 ч при перемешивании при комнатной температуре. Осторожно добавили воду и выпарили ТГФ при пониженном давлении. Остаток экстрагировали изогексаном (3) и объединенные органические экстракты промыли раствором NaOH (1M вод.), водой, рассолом, высушили(MgSO4), отфильтровали и концентрировали при пониженном давлении. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир), получая 1-бензилокси-3,5-дибромбензол в виде бесцветной жидкости, 14,7 г с выходом 69%. 1 Н NMR (CDCl3)7.45-7.33 (m, 5H), 7.30-7.28 (m, 1H), 7.10-7.08 (m, 2H), 5.02 (s, 2H). Получение сложного этилового эфира (3-бензилокси-5-бромфенил)уксусной кислоты. К суспензии NaH (2,2 г 60% суспензии в минеральном масле, 53,8 ммоль) в диоксане (200 мл) по каплям добавили при комнатной температуре сложный трет-бутиловый этиловый эфир малоновой кислоты (10,2 мл, 53,8 ммоль) и смесь перемешивали при этой температуре в течение 1 ч, прежде чем добавить CuBr (7,7 г, 53,8 ммоль) и 1-бензилокси-3,5-дибромбензол (9,2 г, 26,9 ммоль). Реакционную смесь нагревали в течение 5 ч с обратным холодильником. Осторожно добавили раствор HCl (1 М вод., 100 мл) и смесь экстрагировали изогексаном (3). Объединенные органические экстракты промыли растворомHCl (1 М вод.), водой, рассолом, высушили MgSO4), отфильтровали и концентрировали при пониженном давлении. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир) и получили элюированием восстановленный 1-бензилокси-3,5-дибромбензол (3,2 г, 9,4 ммоль) с выходом 35% и сложный трет-бутиловый этиловый эфир 2-(3-бензилокси-5-бромфенил)малоновой кислоты(7,2 г, содержит 1,4 экв. сложного трет-бутилового этилового эфира малоновой кислоты, 10 ммоль) в виде бесцветной жидкости с выходом 37%. Сложный трет-бутиловый этиловый эфир 2-(3-бензилокси-5-бромфенил)малоновой кислоты (7,2 г,содержит 1,4 экв. сложного трет-бутилового этилового эфира малоновой кислоты 10 ммоль) растворяли в ледяной АсОН (50 мл) и нагревали с обратным холодильником в течение 12 ч. АсОН удалили при пониженном давлении. Остаток вылили в раствор Na2CO3 (нас. вод.) и смесь экстрагировали EtOAc (3). Объединенные органические экстракты промыли водой, рассолом, высушили (MgSO4), отфильтровали и концентрировали при пониженном давлении, получая сложный этиловый эфир (3-бензилокса-5 бромфенил)уксусной кислоты в виде желтой жидкости с выходом 6,8 г (97%). 1 Н NMR (CDCl3)7.44-7.30 (m, 5H), 7.07-7.03 (m, 2H), 6.87-6.84 (m, 1H), 5.03 (s, 2H), 4.15 (q, 2H),3.54 (s, 2H), 1.26 (t, 3 Н). Сложный этиловый эфир (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты. В раствор 4-(трифторметил)фенилбороновой кислоты (1,5 г, 8,0 ммоль) и K2CO3 (14,4 ммоль, 2 М вод.) в ДМЭ (25 мл) добавили сложный этиловый эфир (3-бензилокси-5-бромфенил)уксусной кислоты(2,50 г, 7,2 ммоль). В течение 10 мин перед добавлением тетракис(трифенилфосфин)палладия(0) (10 вес.%) через реакционную смесь продували азот и полученную в результате смесь нагревали до 80 С в- 20016908 течение 4 ч в инертной атмосфере. Реакционную смесь разбавили водой и экстрагировали при помощиEtOAc (3). Объединенные органические экстракты промыли нас. Na2CO3, рассолом, высушили (MgSO4),отфильтровали и концентрировали при пониженном давлении. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир) и получили сложный этиловый эфир (5-бензилокси 4'-трифторметилбифенилбифенил-3-ил)уксусной кислоты (2,2 г) в виде бесцветной смолы с выходом 74%. 1 Н NMR (CDCl3)7.59-7.54 (m, 2H), 7.48-7.30 (m, 8H), 7.13-7.11 (m, 2H), 6.94-6.91 (m, 1H), 5.12 (s,2H), 4.16 (q, 2H), 3.64 (s, 2H), 1.27 (t, 3 Н). Получение сложного эфира (5-гидрокси-4'-трифторметилбифенил-3-ил)уксусной кислоты. В раствор (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (2,5 г, 5,5 ммоль) в EtOH(50 мл) добавили 10% Pd/C (5 вес.%), и полученную черную суспензию перемешивали в атмосфере Н 2 в течение 5 ч. Полученную в результате смесь отфильтровали через целит и выпарили до сухости. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир) и получили сложный этиловый эфир (5-гидрокси-4'-трифторметилбифенил-3-ил)уксусной кислоты в виде белого твердого вещества с выходом 2,3 г (93%). Получение сложного этилового эфира (5-трифторметансульфонилокси-4'-трифторметилбифенил-3 ил)уксусной кислоты. Трифторметансульфоновый ангидрид (570 мг, 2,0 ммоль) по каплям добавили в раствор сложного этилового эфира (5-гидрокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (546 мг, 1,69 ммоль) и пиридина (0,41 мл, 5,0 ммоль) в ДХМ (10 мл) при 0 С. Температуру поддерживали на уровне 0 С в течение 15 мин, после чего подняли ее до уровня комнатной и смесь перемешивали в течение 18 ч. Затем реакционную смесь разбавили ДХМ, промыли Н 2 О, Na2CO3, разбавленной HCl, рассолом, высушили(MgSO4) и выпарили при пониженном давлении, получив масло желтого цвета. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир), выход 695 мг (96%). 1 Н NMR (CDCl3)7.72 (d, 2H), 7.66 (d, 2H), 7.54 (t, 1H), 7.39 (t, 1H), 7.28 (t, 1 Н), 4.19 (q, 2H), 3.73 (s,2H), 1.28 (t, 3 Н). Получение сложного метилового эфира (4"-хлор-4-трифторметил-[1,1';3'1]терфенил-5'-ил)уксусной кислоты. Раствор сложного этилового эфира (5-трифторметансульфонилокси-4'-трифторметилбифенил-3 ил)уксусной кислоты (100 мг, 0,2 ммоль), 4-хлорфенилбороновой кислоты (41 мг, 0,24 ммоль), K2CO3(2 М раствор в Н 2 О, 220 мкл, 0,4 ммоль) в ДМЭ (2,0 мл) нагревали до 80 С в присутствии бис(три-третбутилфосфин)палладия(0) (кат.) в течение 2 ч. Смесь охладили до комнатной температуры, отфильтровали, разбавили EtOAc, промыли Na2CO3, разбавленной HCl, рассолом, высушили (MgSO4) и выпарили при пониженном давлении, получив беловатое твердое вещество. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир). 1 Н NMR (CDCl3)7.71 (s, 4 Н), 7.65-7.68 (m, 1H), 7.42 (d, 2 Н), 7.52-7.48 (m, 2 Н), 7.36 (d, 2 Н), 3.77 (s,2H), 3.74 (s, 3 Н). Получение (4-хлор-4-трифторметил-[1,1';3,1"]терфенил-5'-ил)уксусной кислоты. Раствор NaOH (1 мл, 1 М вод.) добавили в раствор сложного этилового эфира (5 бензилоксибифенил-3-ил)уксусной кислоты (50 мг) в EtOH (2 мл) и смесь перемешивали в течение 12 ч при комнатной температуре. Реакционную смесь разбавили раствором HCl (2 М вод.) и экстрагировалиEtOAc (3). Объединенные органические экстракты промыли водой, рассолом, высушили (MgSO4), отфильтровали и концентрировали при пониженном давлении, получив бесцветное твердое вещество с выходом 90%. 1H NMR (CDCl3)7.71 (s, 4H), 7.65-7.68 (m, 1H), 7.42 (d, 2H), 7.52-7.48 (m, 2H), 7.36 (d, 2H), 3.79 (s,2 Н). ЖХМС RT = 3,4 мин (389 М-Н). Аналогичным образом, используя соответствующую бороновую кислоту, были получены- 21016908 Пример (v). Получение (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты. Получение сложного метилового эфира (3,5-бис-трифторметансульфонилоксифенил)уксусной кислоты. Трифторметансульфоновый ангидрид (7,05 г, 25,0 ммоль) по каплям добавили в раствор сложного метилового эфира 3,5-дигидроксифенилуксусной кислоты (1,80 г, 10,0 ммоль) и пиридина (4,9 мл, 60,0 ммоль) в ДХМ (20 мл) при 0 С. Температуру поддерживали на уровне 0 С в течение 15 мин, после чего подняли ее до уровня комнатной и перемешивали смесь в течение 18 ч. Реакционную смесь разбавили ДХМ, промыли Н 2 О, Na2CO3, разбав. HCl, рассолом, высушили (MgSO4) и выпарили при пониженном давлении, получив масло желтого цвета. Остаток очистили хроматографией на испарительной колонкеH NMR (CDCl3)7.31 (d, 2 Н), 7.17 (t, 1H), 3.74 (s, 3 Н), 7.73 (s, 2H). Получение сложного метилового эфира (4.4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты. Раствор сложного метилового эфира (3,5-бис-трифторметансульфонилоксифенил)уксусной кислоты(кат.) в течение 4 ч. Смесь охладили до комнатной температуры, отфильтровали, развели EtOAc, промыли Na2CO3, развед. HCl, рассолом, высушили (MgSO4) и выпарили при пониженном давлении, получив беловатое твердое вещество. Остаток очистили хроматографией на испарительной колонке (EtOAc: петролейный эфир). 1 Н NMR (CDCl3)7.61 (t, 1H), 7.55 (d, 4H), 7.46 (d, 2H), 7.42 (d, 4H), 3,75 (s, 2H), 3.73 (s, 3 Н). Получение (4,4"-дихлор-[1,1';3'1"]терфенил-5'-ил)уксусной кислоты. Сложный метиловый эфир (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты гидролизовали в ранее описанных условиях, получив (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусную кислоту в виде прозрачного масла. 1 Н NMR (CDCl3)7.61-7.63 (m, 1H), 7.54 (d, 4H), 7.45-7.62 (m, 2H), 7.42 (d, 2H), 3.78 (s, 2H), ЖХМС метод A RT=3,5 мин. Аналогичным образом, используя подходящую бороновую кислоту, были получены Пример (xiii). Получение 2-(4,4"-дихлор-[1,1';3'1"]терфенил-5'-ил)пентановой кислоты. Получение сложного метилового эфира 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты.- 22016908 Раствор LDA (0,18 мл 1,8 М в ТГФ, 0,31 ммоль) по каплям добавили в перемешиваемый раствор сложного метилового эфира (4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)уксусной кислоты (100 мг, 0,26 ммоль) в ТГФ (10 мл) при -78 С. Реакционную смесь перемешивали в течение 30 мин при -78 С, после чего по каплям добавили йодопропан (0,035 мл, 0,31 ммоль). В течение ночи реакционную смесь нагревали до комнатной температуры. Осторожно добавили насыщенный водный раствор хлорида аммония(10 мл) и остаток распределили между EtOAc и водой. Водные слои экстрагировали EtOAc (3). Объединенные органические слои промыли водой, рассолом, высушили (MgSO4), отфильтровали и концентрировали при пониженном давлении. Остаток очистили хроматографией на испарительной колонкеH NMR (CDCl3)7.60 (t, 1 Н), 7.55 (d, 4H), 7.48 (d, 2H), 7.42 (d, 4H), 3.65-3.72 (m, 4H), 2.11-2.23 (m,1H), 1.78-1.89 (m, 1H), 1.28-1.40 (m, 4H), 0.94 (t, 3 Н). Получение 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты. Сложный метиловый эфир 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты гидролизовали в ранее описанных условиях для получения 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты в виде прозрачного масла. Примеры (xiv) и (xv). Получение (R)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты и(S)-2-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)пентановой кислоты. Энантиомеры 2-(4,4"-дихлор-[1,1';3',1"]терфенил-5"-ил)пентановой кислоты разделили на 80 мм I.D. Динамическая колонка с аксиальным сжатием, наполненная 500 г 20-мкм Chiralpak AD [3,5 диметилфенилкарбаматом амилозы (Daicel)] длины фильтрующего слоя: 21 см с этанолом и 0,1% ТФУ в качестве элюента при скорости потока 80 мл/мин при температуре окружающей среды. Первый пик колонны при 18.25 мин был обозначен как R, а второй пик при 24,75 мин был обозначен как S. Пример (xvi). Получение 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбоновой кислоты. Получение 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбонитрила. 4,4"-Дихлор-[1,1';3',1"]терфенил-5'-карбонитрил получили аналогично примеру 5, заменив сложный метиловый эфир 3,5-дигидроксифенилуксусной кислоты 3,5-дигидроксибензонитрилом. 1 Н NMR (CDCl3)7.91 (t, 1H), 7.80 (d, 2 Н), 7.52-7.52 (m, 4H), 7.45-7.49 (m, 4H). Получение 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбоновой кислоты. Суспензию 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбонитрила (40 мг, 0,12 ммоль) в EtOH (1 мл) иNaOH (25% вод., 0,5 мл) нагревали с обратным холодильником в течение 3 ч. Полученный коричневый раствор выпарили до сухости, подкислили развед. HCl, и полученный осадок экстрагировали EtOAc. Органический слой промыли рассолом, высушили (MgSO4) и выпарили, получив беловатое твердое вещество. В результате растирания с бензином/EtOAc образовалось бежевое твердое вещество с выходом 23 мгRT=3,6 мин. Пример (xvii). Получение 5-(4,4"-дихлор-[1,1';3',1"]терфенил-5'-ил)-1 Н-тетразола. Смесь 4,4"-дихлор-[1,1';3',1"]терфенил-5'-карбонитрила (50 мг, 0,15 ммоль), азида натрия (20 мг,0,31 ммоль) и хлорида аммония (16 мг, 0,31 ммоль) в ДМФ (1 мл) нагревали до 100 С в течение 16 ч. Реакционную смесь подкислили 1 М раствора HCl, налитого в воду, и экстрагировали этилацетатом. Органический слой промыли рассолом, высушили (Na2SO4) и растворитель удалили под вакуумом, получив 5(4,4"-дихлор-[1,1';3',"]терфенил-5'-ил)-1H-тетразол с выходом 36 мг (64%) в виде беловатого твердого вещества. 1 Н NMR (DMSO)7.49 (d, 2H), 7.23 (t, 1 Н), 7.17 (s br, 1 Н), 6.96-6.99 (m, 4 Н), 6.71-6.74 (m, 4 Н),ЖХМС метод А RT=3,5 мин. Пример 1. 2-(3,5-Дифтор-4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)-4-метилпентановая кислота а) Сложный метиловый эфир (3,5-бис-бензилоксифенил)уксусной кислоты Смесь сложного метилового эфира (3,5-дигидроксифенил)уксусной кислоты (от Aldrich, 70 г, 0,385 моль), бензилбромида (137 мл, 1,16 моль), карбоната калия (160 г, 1,16 моль) и ДМФ (1,5 л) в атмосфереN2 механически перемешивали при комнатной температуре в течение ночи. Полученную реакционную смесь вылили при перемешивании в смесь 1,5 л воды со льдом. Осадок был получен фильтрацией и затем промыт гептаном, чтобы удалить бензилбромид и получить указанные в заголовке соединения (123,7 г) в виде коричневого твердого вещества, которое затем было высушено воздухом для следующей реакции. 1b) Сложный этиловый эфир 3-бензилокси-5-гидроксифенил)уксусной кислоты Раствор 50 г (1,38 моль) сложного метилового эфира 3,5-бис-бензилоксифенил)уксусной кислоты иNaOH (6,6 г, 1,65 моль) в 1 л EtOH в присутствии 10% Pd-C гидрировали в аппарате Парра до израсходования 1 экв. водорода. Смесь подкислили концентрированной HCl и затем удалили катализатор и растворитель, получив масляный остаток. Неочищенный продукт очистили хроматографией на силикагелевой колонке ISCO, используя в качестве элюентов EtOAC (градиент от 10 до 75% EtOAc), и получили 25 г(s, 1H), 7.20-7.35 (m, 5H). Рассчит. для С 17 Н 18 О 4 (M+H) 287.3, найдено 287. с) Сложный этиловый эфир (3-бензилокси-5-трифторметансульфонилоксифенил)уксусной кислоты В раствор сложного этилового эфира 3-(бензилокси-5-гидроксифенил)уксусной кислоты (74,4 г,0,26 моль) в дихлорметане (700 мл) добавили пиридин (62,5 мл, 0,78 моль). Смесь охладили до 0 С. К охлажденной смеси добавляли трифторметансульфоновый ангидрид (65,6 мл, 0,39 моль) в течение 1,5 ч,поддерживая внутреннюю температуру ниже 5 С, и перемешивали еще 0,5 ч при 0 С. Эту реакционную смесь вылили в смесь 1N HCl (420 мл) и водного льда (105 г) и перемешивали в течение 0,5 ч. Водный слой экстрагировали дихлорметаном (2100 мл). Объединенные фракции промыли водой (2100 мл),насыщенным водным раствором NaHCO3 (2100 мл) и рассолом (2100 мл). Органические вещества высушили (MgSO4) и концентрировали под вакуумом, получив красноватую жидкость (108 г), которая использовалась на следующей ступени без дальнейшей очистки. Рассчит. для C18H17F3O6S (М+Н) 419.07, найдено 419,1.d) Сложный этиловый эфир (5-бензилокси-4'-трифторменилбифенил-3-ил)уксусной кислоты Смесь сложного этилового эфира (3-бензилокси-5-трифторметансульфонилоксифенил)уксусной кислоты (108 г, 0,26 моль), 4-(трифторметил)фенилбороновой кислоты (55,6 г, 0,29 моль), 1,2 диметоксиэтана (1,1 л) и водного Na2CO3 (2 М, 129 мл, 0,26 моль) механически перемешивали, продуваяN2, при комнатной температуре в течение 10 мин. К этой системе добавили Pd(Ph3)4 (480 мг, 0,42 ммоль) и нагревали с обратным холодильником (95 С) в течение 2,5 ч. Красно-коричневую смесь разбавилиEtOAc (0,5 л) и промыли насыщенным водным раствором NaHCO3 (3200 мл) и рассолом (2200 мл). Органическую фракцию высушили (Na2SO4) и концентрировали под вакуумом. Неочищенный продукт очистили хроматографией на колонке с силикагелем ISCO и получили сложный этиловый эфир (5 бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (107 г, 100%). 1H-NMR (CDCl3):1.26 (t, 3 Н), 3.66 (s, 2H), 4.17 (q, 2H), 5.12 (s, 2H), 6.99 (s, 1H), 7.12 (s, 2H), 7.347.49 (m, 5H), 7.67 (s, 4H). Рассчит. для C24H21F3O3 (М+Н) 415.14, найдено 415.2. е) Сложный этиловый эфир 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-4-метилпент-4-ановой кислотыLi[N(SiMe3)2] (1N в THF, 14,2 мл, 14,2 ммоль). Реакционную смесь перемешивали в течение 1 ч при-78 С и затем по каплям добавили 3-бром-2-метилпропен (1,25 мл, 12,4 ммоль). Раствор медленно подогрели до -35 С и перемешивали при -35 С в течение 0,5 ч. Реакцию резко остановили насыщенным раствором NH4Cl и экстрагировали EtOAc. Органические экстракты высушили (Na2SO4), концентрировали и очистили хроматографией на колонках, получив указанное в названии соединение (5,1 г, 92%) в виде прозрачного масла. 1f) Сложный этиловый эфир 2-(5-гидрокси-4'-трифторметилбифенил-3-ил)-4-метилпентановой кислоты Смесь соединения 1 е (5,1 г, 10,9 ммоль), 10% Pd/C (500 мг) в EtOH (50 мл) гидрировали в атмосфере Н 2 (40 пси) в смесителе в течение 20 ч. Полученную в результате смесь отфильтровали через целит, а фильтрат концентрировали, получив указанное в названии соединение (4,2 г, 100%) в виде прозрачного масла. 1g) Сложный этиловый эфир 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3 ил)пентановой кислоты В раствор соединения 1f (2,8 г, 7,36 ммоль) и N-фенил-бис-(трифторметансульфонимида) (3,16 г,- 25016908 8,83 ммоль) в ТГФ (30 мл) в атмосфере N2 добавили Et3N (2,05 мл, 14,7 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи. После охлаждения до комнатной температуры раствор концентрировали и очистили хроматографией на колонках, получив указанное в заголовке соединение (3,7 г, 98%) в виде бесцветного густого масла. 1h) 2-(3,5-Дифтор-4"-трифторметил-[1,1';3',1"]терфенил-5'-ил)-4-метилпентановая кислота. Смесь соединения 1g (50 мг, 0,098 ммоль), 3,5-дифторбензолбороновой кислоты (23 мг, 0,146 ммоль), Pd(PPh3)4 (23 мг, 0,0196 ммоль) и Na2CO3 (2N в Н 2 О, 0,098 мл, 0,196 ммоль) в ДМЭ (1 мл) нагревали при 85 С в течение 3 ч. После охлаждения до комнатной температуры раствор распределили междуEtOAc и Н 2 О. Органический слой высушили (Na2SO4), концентрировали и очистили хроматографией на колонках, получив промежуточное соединение сложного этилового спирта. Смесь промежуточного соединения и NaOH (2N в Н 2 О, 0,147 мл, 0,294 ммоль) в ТГФ-МеОН (0,6 мл-0,6 мл) перемешивали в течение 18 ч и концентрировали. Добавили CH2Cl2 и воду и смесь подкислили 1N HCl. Органическую фазу отделили, а водную фазу экстрагировали CH2Cl2. Объединенные органические слои высушили, концентрировали и очистили хроматографией на колонках, получив 30 мг (69%,2 шага) указанного в заголовке соединения в виде твердого белого вещества. 1 Соединение, указанное в заголовке, было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединения из примера 1g) с 2,4-дифторфенилбороновой кислотой при условиях, описанных в примере 1. 1 Соединение, указанное в заголовке, было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 4-хлорфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение получили посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты(промежуточное соединение из примера 1g) с 4-изопропилфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 4-трифторметилфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 2-трифторметилфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного- 27016908 этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 3,5-бис-трифторметилфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 2-фторфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение получили посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты(промежуточное соединение из примера lg) с 3-фторфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 4-фторфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 4-метилфенилбороновой кислотой в условиях,описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединения из примера 1g) с 3-трифторметилфенилбороновой кислотой в условиях, описанных в примере 1. 1 Указанное в заголовке соединение было получено посредством связывания по Сузуки сложного этилового эфира 4-метил-2-(5-трифторметансульфонилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (промежуточное соединение из примера 1g) с 4-хлор-3-фторфенилбороновой кислотой в условиях, описанных в примере 1. 1
МПК / Метки
МПК: C07C 57/58, C07C 57/38, A61P 25/28, C07D 257/04, C07C 59/64, A61K 31/192, C07C 51/09
Метки: лечения, болезни, терфенила, производные, альцгеймера
Код ссылки
<a href="https://eas.patents.su/30-16908-proizvodnye-terfenila-dlya-lecheniya-bolezni-alcgejjmera.html" rel="bookmark" title="База патентов Евразийского Союза">Производные терфенила для лечения болезни альцгеймера</a>
Предыдущий патент: Способ получения комплексной полиолефиновой нити формованием из расплава и пряжа, изготовленная из нее
Следующий патент: Пестицидные смеси
Случайный патент: Пероральная пищевая добавка для лечения хронических изнуряющих заболеваний












