2,5-бис-диамин-[ 1,4 ] бензохиноновые производные для лечения болезни альцгеймера, способ их получения и промежуточные продукты
Номер патента: 7909
Опубликовано: 27.02.2007
Авторы: Кавалли Андреа, Андризано Винченца, Мелькиорре Карло, Болоньези Мария Лаура, Бартолини Мануэла, Реканатини Маурицио
Формула / Реферат
1. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I)

где R1 представляет собой заместитель, выбранный из группы, включающей
водород,
насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одного-пяти атомов углерода, и
заместитель, обладающий электроноакцепторным индукционным свойством;
R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-5 атомами углерода; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей
водород,
насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из 1-5 атомов углерода,
ОМе и
SMe;
X представляет собой радикал, выбранный из группы, включающей
-НС=СН-,
-HC=N-,
-S-,
-О- и
-NH-;
Т представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный от 1 до 4 атомами углерода;
Z представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный двумя-тринадцатью атомами углерода.
2. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей
водород,
заместитель, обладающий электроноакцепторным индукционным свойством.
3. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей
водород,
галоген,
NO2 и
МеО;
R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-4 атомами углерода; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей
водород,
насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из 1-5 атомов углерода,
Т представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный 1-3 атомами углерода;
Z представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный 2-12 атомами углерода.
4. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей
водород,
галоген,
MeO;
R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-2 атомами углерода; R4 и R5, каждый, независимо от другого, представляют собой заместитель, выбранный из группы, включающей
водород,
насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одного-четырех атомов углерода,
X представляет собой радикал -НС=СН- или радикал -O-;
Т представляет собой радикал -CH2-; и
Z представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный двумя-семью атомами углерода.
5. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.3, где R3 представляет собой водород; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей
водород,
насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одного-пяти атомов углерода,
разветвленную алкильную группу из 3-4 атомов углерода,
Z представляет собой насыщенный линейный алкил, представленный 2-7 атомами углерода.
6. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по одному из пп.1-4, где R1 находится в положении 2 по отношению к Т.
7. 2,5-бис-Диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I) по одному из пп.1-5, где Z представляет собой насыщенную линейную алкильную группу, представленную 2-7 атомами углерода.
8. 2,5-бис-{6-[Этил-(2-метоксибензил)амино]гексиламино}-[1,4]бензохинон (XVI).
9. 2,5-бис-{3-[Этил-(2-метоксибензил)амино]пропиламино}-[1,4]бензохинон (XII).
10. 2,5-бис-[6-(Бензилэтиламино)гексиламино]-[1,4]бензохинон (XVII).
11. 2,5-бис-{6-[Этил-(3-метоксибензил)амино]гексиламино}-[1,4]бензохинон (XXXIII).
12. 2,5-бис-{6-[Этил-(4-метоксибензил)амино]гексиламино}-[1,4]бензохинон (XXXVII).
13. 2,5-бис-{2-[Этил-(2-метоксибензил)амино]этиламино}-[1,4]бензохинон (XLV).
14. 2,5-бис-{7-[Этил-(2-метоксибензил)амино]гептиламино}-[1,4]бензохинон (IL).
15. 2,5-бис-{6-[(2-Метоксибензил)метиламино]гексиламино}-[1,4]бензохинон (LIV).
16. 2,5-бис-{6-[Этил-(2-метоксибензил)амино]гексиламино}-3,6-диметил-[1,4]бензохинон (LV).
17. 2,5-бис-[6-(2-Метоксибензиламино)гексиламино]-[1,4]бензохинон (LI).
18. 2,5-бис-[6-(Этилфуран-2-илметиламино)гексиламино]-[1,4]бензохинон (XLI).
19. 2,5-бис-{6-[Этил-(2-нитробензил)амино]гексиламино}-[1,4]бензохинон (XXIX).
20. 2,5-бис-{6-[Этил-(2-хлорбензил)амино]гексиламино}-[1,4]бензохинон (XVIII).
21. Лекарственное средство, включающее 2,5-бис-диамин-[1,4]бензохиноновое производное по одному из пп.1-20.
22. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 в качестве лекарственного средства.
23. Фармацевтический препарат, характеризующийся тем, что он включает 2,5-бис-диамин-[1,4] бензохиноновое производное по одному из пп.1-20, или одну из его фармацевтически приемлемых солей и фармацевтически приемлемое вспомогательное вещество и/или растворитель.
24. Способ получения 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20, который включает стадию нуклеофильного замещения, где п-бензохинон, имеющий общую формулу (VIII)
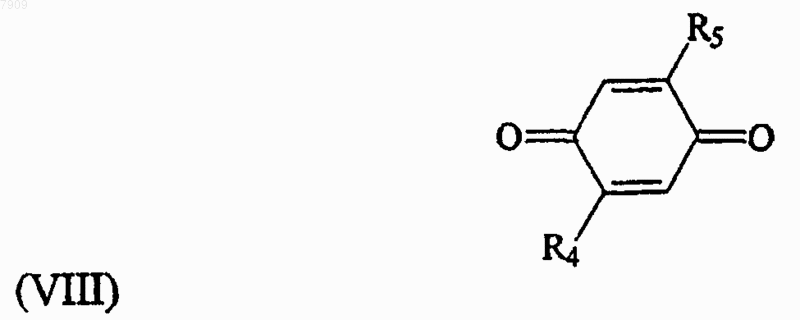
подвергают реакции замещения с первым промежуточным соединением, имеющим общую формулу (VII)
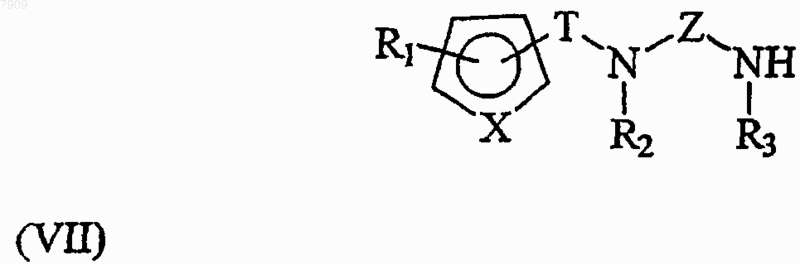
с получением 2,5-бис-диамин-[1,4]бензохинонового производного общей формулы (I).
25. Способ по п.24, включающий фазу гидролиза, в которой второе промежуточное соединение общей формулы (VI)
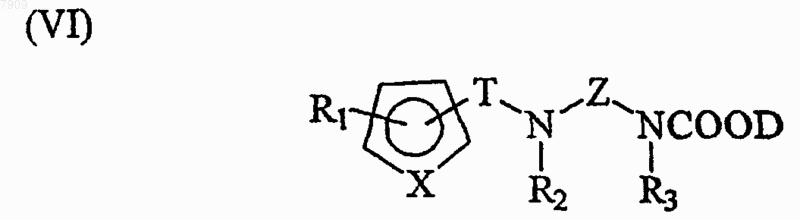
где D представляет собой Bn или другую защитную группу, которая преимущественно является стабильной в основной среде, гидролизуют с получением указанного первого промежуточного соединения общей формулы (VII).
26. Способ по п.25, включающий дополнительную стадию, в которой третье промежуточное соединение общей формулы (IV)
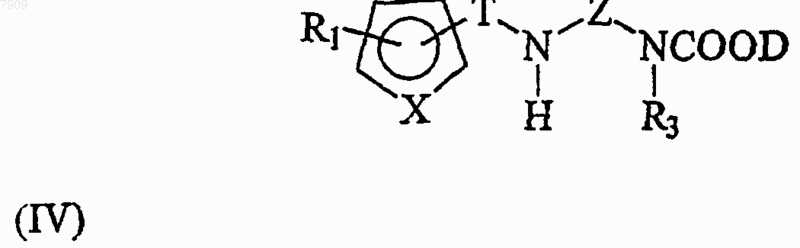
подвергают взаимодействию в присутствии основания с соединением общей формулы (V)
(R2)fA, (V)
где А представляет собой группу, притягивающую электроны, f равно 1 или 2, с целью получения второго указанного промежуточного соединения общей формулы (VI).
27. Способ по п.26, включающий вторую дополнительную фазу, в которой защищенную (аминоалкил)карбамовую кислоту общей формулы (II)
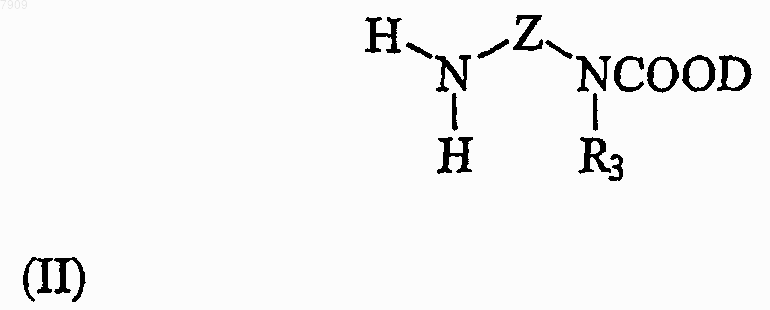
добавляют к соединению общей формулы (III)
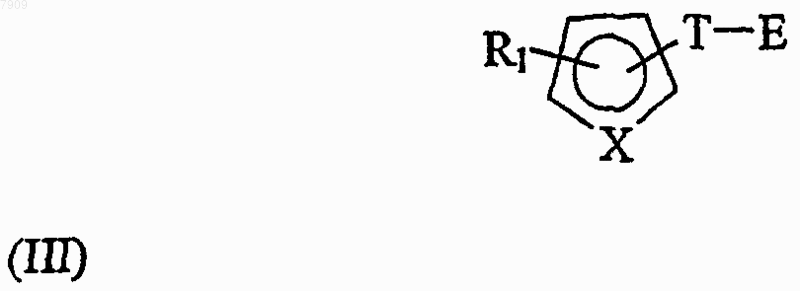
в которой Е представляет собой остаток, выбранный из группы, включающей
=O,
-Сl,
-Br или
I;
с получением указанного третьего промежуточного соединения общей формулы (IV); при условии, что, когда Е представляет собой =O, способ включает стадию восстановления с получением указанного третьего промежуточного соединения общей формулы (IV).
28. Промежуточэюх соединение общей формулы (VII) по п.24.
29. Соединение общей формулы (VI) по п.25.
30. Соединение общей формулы (IV) по п.24.
31. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения болезни Альцгеймера у млекопитающих.
32. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения патологий, характеризующихся отложениями b-амилоидного белка (Ab) у млекопитающих.
33. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения дегенеративных патологий нервной системы у млекопитающих.
34. Способ лечения болезни Альцгеймера у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20.
35. Способ лечения заболевания патологии, характеризующейся отложениями b-амилоидного белка (Ab) у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20.
36. Способ лечения дегенеративной патологии нервной системы у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4] бензохинонового производного по одному из пп.1-20.
Текст
007909 Область техники Настоящее изобретение относится к новым 2,5-бис-диамин-[1,4]бензохиноновым производным. Изобретение также относится к применению данных соединений в качестве лекарственных препаратов, в частности для лечения болезни Альцгеймера, их применению для создания фармацевтических препаратов для лечения болезни Альцгеймера, фармацевтических препаратов, которые их содержат, способов их получения и промежуточных продуктов для указанных способов. Настоящее изобретение также относится к применению 2,5-бис-диамин-[1,4]бензохиноновых производных для получения фармацевтических препаратов, имеющих антиагрегантные свойства в отношении белка -амилоида (A) и для лечения дегенеративных патологий нервной системы. Предпосылки изобретения Болезнь Альцгеймера (БА (AD представляет собой нейродегенеративный синдром, обычно связанный со старением, который приводит к прогрессирующему ухудшению у пациентов когнитивных и поведенческих функций. Большая часть случаев БА имеет причины, которые к настоящему времени в основном неизвестны. Также по этой причине в настоящее время все еще не существует терапевтического лечения, способного остановить прогрессирование заболевания, хотя в последнее время на рынке появились некоторые лекарственные препараты, предназначенные главным образом для регуляции когнитивных симптомов. Такие лекарственные препараты - такрин (Cognex), донепезил (Aricept) и ривастигмин (Exelon) - имеют один и тот же механизм действия, который включает ингибирование ацетилхолинэстеразы (АХЭ (AChE. Терапевтический подход, основанный на ингибировании АХЭ, основан на том наблюдении, что деградация нейронов, связанная с БА появляется, преимущественно, в областях головного мозга, иннервируемых холинергическими нейронами. Потеря холинергической активности в данных областях (кора и гиппокамп, особенно) является ответственной за когнитивные дисфункции, типичные для БА. АХЭ представляет собой фермент, который инактивирует холинергический нейромедиатор ацетилхолин (АХ(ACh, и была высказана гипотеза, что блокирование функционирования данного фермента может пролонгировать стимуляцию рецептора, усиливая холинергическую передачу. Известные лекарственные средства, указанные выше, получены при применении данной гипотезы, называемой холинэргической гипотезой (Bartus, R.T.; Dean, R.L., 3rd; Beer, В.; Lippa, A.S. The cholinergic hypothesis of geriatric memorydysfunction. Science 1982, Vol.217, pp. 408-414). Однако нельзя не обращать внимание на ограничения этого подхода, которые состоят, главным образом, в отсутствии действия на прогрессирование заболевания и в присутствии нежелательных побочных эффектов, которые ограничивают дозу и могут провоцировать пациента к прекращению применения одного из лекарственных средств, указанных выше. Хотя усиление холинергической передачи посредством ингибирования АХЭ представляет собой полезный подход к лечению когнитивных симптомов, связанных с БА, недавно было высказано предположение, что потеря нейронов и последующее появление когнитивных симптомов являются результатом каскада биохимических событий, связанных с повышенной продукцией белка -амилоида в определенных областях головного мозга. Этот белок имеет тенденцию к агрегации, образовывая внеклеточные отложения, которые вызывают типичные патологические изменения, обнаруживаемые в головном мозге пациентов с БА: сенильные бляшки. Присутствие этих бляшек способствует развитию ответов воспалительного и окислительного типа в окружающей ткани, запуская цепь токсических событий, включая повышение фосфорилирования тау белка, из-за активации ферментов воспаления и образования окисленных видов радикалов. Прогрессирование нейродегенерации происходит в результате невозможности регуляции распространения этих опасных эффектов. Поэтому является необходимой разработка фармакологических приспособлений, которые способны действовать настолько высоко, насколько возможно в нейродегенеративном каскаде. Более того, важно подчеркнуть, что существуют другие патологические состояния, кроме болезни Альцгеймера, характеризующиеся отложениями A. Эти патологические состояния включают: синдром Дауна, наследственные кровоизлияния в головной мозг, связанные с амилоидозом Датского типа, амилоидоз, связанный с хроническим воспалением, амилоидоз, связанный со множественными миеломами и другие дискразии В-лимфоидных кровяных клеток, амилоидоз, связанный с диабетом типа II, амилоидоз, связанный с заболеваниями, имеющими прионовое происхождение,такими как болезнь Крейтцфельда-Якоба, синдром Гертсманна-Штраусслера, куру и скрепи у овец (WO 02/00603). Из вышеуказанного ясно, что в настоящее время существует значительная потребность в создании лекарственных средств, которые могут использоваться для лечения БА и для лечения патологических состояний, характеризующихся отложениями A. Описание изобретения Целью изобретения, следовательно, является разработка веществ, которые могут быть использованы для улучшения лечения БА, всех других синдромов, связанных с накоплением A, в частности, предотвращая указанное накопление, и дегенеративных патологических состояний нервной системы. В соответствии с настоящим изобретением, предложено 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I): в которой R1 представляет собой заместитель, выбранный из группы, включающей: водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, содержащую от 1 до 5 атомов углерода, и заместитель с индукционным электроноакцепторным действием;R2 и R3, каждый независимо друг от друга, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-5 атомами углерода;R4 и R5, каждый независимо друг от друга, представляют собой заместитель, выбранный из группы,включающей: водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-5 атомами углерода,ОMе и-NH-; Т представляет собой насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-4 атомами углерода;Z представляет собой насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-13 атомами углерода; предпочтительно, R1 представляет собой заместитель,выбранный из группы, включающей: водород,заместитель с индукционным электроноакцепторным действием. Предпочтительно в 2,5-бис-диамин-[1,4]бензохиноновом производном, имеющем общую формулуR2 и R3, каждый независимо друг от друг, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-4 атомами углерода; R4 и R5, каждый независимо от другого, представляют собой заместитель, выбранный из группы, включающей: водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-5 атомами углерода;-NH-; Т представляет собой насыщенный или ненасыщенный линейный алкил, представленный 1-3 атомами углерода;Z представляет собой насыщенный или ненасыщенный линейный алкил, представленный 2-12 атомами углерода. Предпочтительно, в 2,5-бис-диамин-[1,4]бензохиноновом производном, имеющим общую формулуR2 и R3, каждый независимо друг от друга, представляют собой водород или насыщенную или ненасыщенную линейную алкильную группу, представленную одним-двумя атомами углерода;R4 и R5, каждый независимо друг от друга, представляют собой заместитель, выбранный из группы,включающей: водород,насыщенную линейную или разветвленную алкильную группу, представленную 1-4 атомов углерода,X представляет собой радикал -НС=СН- или -О-; Т представляет собой радикал -СН 2-; иZ представляет собой насыщенный линейный алкил, представленный двумя - семью атомами углерода. В соответствии с особенно предпочтительными вариантами воплощения изобретения, в 2,5-бисдиамин-[1,4]бензохиноновом производном, имеющем общую формулу (I) R1 представляет собой заместитель, выбранный из группы, включающей: водород,галоген,МеО;R2 представляет собой водород или насыщенную линейную алкильную группу, представленную 1-2 атомами углерода; R3 представляет собой водород; R4 и R5, каждый независимо друг от друга представляют собой заместитель, выбранный из группы, включающей: водород, насыщенную линейную алкильную группу, представленную одним-двумя атомами углерода,разветвленную алкильную группу, представленную тремя-четырьмя атомами углерода,X представляет собой радикал -НС=СН- или -О-; Т представляет собой радикал -СН 2-; иZ представляет собой насыщенный линейный алкил, представленный двумя - семью атомами углерода. Особенно предпочтительными являются варианты воплощения изобретения, в соответствии с которыми в 2,5-бис-диамин-[1,4]бензохиноновом производном, имеющем общую формулу (I), R1 находится в положении 2 в отношении Т. Предпочтительными также являются варианты воплощения изобретения, в соответствии с которыми Z представляет собой насыщенный линейный алкил, представленный 2-7 атомами углерода, и варианты воплощения изобретения, в которых X представляет собой радикал -СН=СН-. Еще более предпочтительными являются варианты воплощения изобретения, в соответствии с которыми 2,5-бис-диамин-[1,4]бензохиноновое производное выбрано из группы, включающей 2,5-бисдиамин-[1,4]бензохиноновые производные, проиллюстрированные в приложенных примерах. 2,5-бис-Диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I), может существовать в различных стереоизомерных формах, таких как энантиомер или диастереоизомер. Изобретение относится к энантиомерам и диастереоизомерам или их смесям. Данные смеси могут быть разделены на их стереоизомерически однородные компоненты известными способами. В соответствии с настоящим изобретением, 2,5-бис-диамин-[1,4]бензохиноновое производное,имеющее общую формулу (I), предложено для использования в качестве лекарственного средства. В соответствии с настоящим изобретением 2,5-бис-диамин-[1,4]бензохиноновое производное,имеющее общую формулу (I), предложено для лечения болезни Альцгеймера у млекопитающих. В соответствии с настоящим изобретением, предложен способ лечения болезни Альцгеймера у млекопитающих, включающий введение указанному млекопитающему эффективного количества 2,5-бисдиамин-[1,4]бензохинонового производного, имеющего общую формулу (I). В соответствии с настоящим изобретением, предложен фармацевтический препарат, характеризующийся тем, что он содержит 2, 5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I), или одну из его фармацевтически приемлемых солей и фармацевтически приемлемое вспомогательное вещество и/или растворитель. В соответствии с настоящим изобретением, предложено применение 2,5-бис-диамин[1,4]бензохинонового производного, имеющего общую формулу (I) для получения фармацевтического препарата для лечения болезни Альцгеймера у млекопитающих. В соответствии с настоящим изобретением, предложен способ получения 2,5-бис-диамин[1,4]бензохинонового производного, имеющего общую формулу 2 (I); способ включает стадию замещения, по которой п-бензохинон, имеющий общую формулу (VIII): подвергают реакции замещение с соединением (VII):(I). В соответствии с настоящим изобретением также предложены соединения, охарактеризованные в пп.8-20 формулы изобретения. В соответствии со следующим аспектом настоящего изобретения, предложено применение 2,5-бисдиамин-[1,4]бензохинонового производного, имеющего общую формулу (I), для получения фармацевтического препарата для лечения патологических состояний, характеризующихся отложениями белка амилоида (A) у млекопитающих. В соответствии с настоящим изобретением, предложен способ лечения патологии, характеризующейся отложениями белка -амилоида (A) у млекопитающих, включающий введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4]бензохинонового производного, имеющего общую формулу (I). В соответствии со следующим аспектом настоящего изобретения, предложено применение 2,5-бисдиамин-[1,4]бензохинонового производного, имеющего общую формулу (I), для получения фармацевтического препарата для лечения дегенеративной патологии нервной системы у млекопитающих. Краткое описание чертежей Далее изобретение будет описано со ссылкой на приложенные чертежи, которые иллюстрируют пример варианта воплощения изобретения без ограничений, на которых фиг. 1 иллюстрирует экспериментальный график Lineweaver-Burk; фиг. 2 - экспериментальный график, отображающий градиентную функцию линий графика на фиг. 1 в отношении концентрации 2,5-бис-диамин-[1,4]бензохинонового производного, имеющего общую формулу (I); и фиг. 3 - интенсивность флуоресценции (выражаемую в единицах флуоресценции) тиофлавина, образующего комплекс с фибриллами A в присутствии различных концентраций 2,5-бис-диамин[1,4]бензохинонового производного, имеющего общую формулу (I); фиг. 4 А, 4 В и 4 С - венечные сечения базальных отделов переднего мозга, соответственно, нетрансгенных мышей, трансгенных мышей (AD11), получавших физиологический раствор и трансгенных мышей (AD11), получавших 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу(I); фиг. 5 - общее количество холинергических нейронов в базальном отделе переднего мозга; фиг. 6 - общее количество холинергических нейронов в базальном ядре Мейнерта; фиг. 7 А, 7 В и 7 С иллюстрируют отложения АПБ в сосудах головного мозга, соответственно, нетрансгенных мышей, трансгенных мышей (AD11), получавших физиологический раствор, трансгенных мышей (AD11), получавших 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I); фиг. 8 А, 8 В и 8 С - венечные сечения энторинальной коры, соответственно, нетрансгенных мышей,трансгенных мышей (AD11), получавших физиологический раствор, трансгенных мышей (AD11), получавших 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I); фиг. 9 А, 9 В и 9 С - венечные сечения базальных отделов переднего мозга, соответственно, нетрансгенных мышей, трансгенных мышей (AD11) и трансгенных мышей (AD11), получавших 2,5-бис-диамин[1,4]бензохиноновое производное, имеющее общую формулу (I) ; фиг. 10 А, 10 В и 10 С - венечные сечения энторинальной коры, соответственно, нетрансгенных мышей, трансгенных мышей (AD11), трансгенных мышей (AD11), получавших 2,5-бис-диамин[1,4]бензохиноновое производное, имеющее общую формулу (I); Фиг. 11 А, 11 В и 11 С - сечения гиппокампа, соответственно, нетрансгенных мышей (AD11), трансгенных мышей (AD11) и трансгенных мышей (AD11)получавших 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I); фиг. 12, 13, 14 и 21 - индексы различия, обнаруженные в эксперименте; фиг. 15 и 16 - общее количество холинергических нейронов, обнаруженных в базальных отделах переднего мозга;-4 007909 фиг. 17 и 18 - количество нейронов, которые экспрессируют фосфо-тау в энторинальной коре; фиг. 19 - внеклеточный заряд БПА; и фиг. 20 иллюстрирует количество клеток, накопивших -амилоид. 2,5-бис-Диамин- [1,4]бензохиноновые производные, представленные общей формулой (I), описанные выше, могут быть получены, например, исходя из защищенной (аминоалкил)карбамовой кислоты,имеющей общую формулу (II) в которой D представляет собой бензил (Бн (Вn или другую стабильную защитную группу, в основной среде. Соединение, имеющее общую формулу (III), добавляют к (аминоалкил)карбамовой кислоте (II) при условии, что, когда Е представляет собой =O, взаимодействие осуществляют в присутствии подходящего восстанавливающего агента. Предпочтительно, указанный восстанавливающий агент представляет собой NaBH4, реакцию проводят в протонном органическом растворителе, например, этаноле, при температуре от 15 до 35 С, по существу в частности при 25 С в присутствии молекулярного сита (в частности 4). В этих условиях соединение (IV) подвергают реакции в присутствии основания с соединением,имеющим общую формулу (V):(R2)fA,в которой А представляет собой электроноакцепторную группу, и f составляет 1 или 2, с получением промежуточного соединения, имеющего общую формулу (VI): Предпочтительно, соединение (V) представляет собой (R2)2SO4, в частности Et2SO4, и реакцию проводят в инертном органическом растворителе, который не меняется в условиях реакции, и при температуре от 80 до 170 С, по существу в частности при 111 С. Растворители, которые могут быть использованы, включают: простые эфиры, такие как диэтиловый эфир или тетрагидрофуран; галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, 1,2-дихлорэтан, трихлорэтан, тетрахлорэтан,1,2-дихлорэтилен или трихлорэтилен; углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или петролейный эфир, нитрометан, диметилформамид, ацетон или ацетонитрил. Также возможно использовать смеси упомянутых растворителей. Толуол является растворителем, особенно предпочтительным для данной реакции. На данной стадии карбамовую функциональную группу соединения (IV) гидролизуют с получением соединения, имеющего общую формулу (VII): Гидролиз, предпочтительно, проводят в кислой среде, и используемым растворителем является уксусная кислота. В соответствии с особенно предпочтительным вариантом воплощения изобретения, для гидролиза используют HBr. На данной стадии п-бензохинон, имеющий общую формулу (VIII): подвергают реакции замещения соединением (VII) с получением 2,5-бис-диамин-[1,4]бензохинонового производного, имеющего общую формулу (I). Неожиданно 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I), показало относительно высокую активность в лечении болезни Альцгеймера (БА) у млекопитающих. Более того, неожиданно 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I) проявило относительно очень высокую активность ингибирования фермента ацетилхолинэстеразы (АХЭ). В частности, 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I), проявило активность ингибирования АХЭ, относительно значительно более высокую, чем активность того же самого 2,5-бис-диамин-[1,4]бензохинонового производного, представленного в отношении фермента бутирилхолинэстеразы (БХЭ (BuChE. С этой точки зрения является важным подчеркнуть, что способность 2,5-бис-диамин-[1,4]бензохинонового производного (I) связываться предпочтительно с АХЭ, более, чем с БХЭ, позволяет не отвлекать 2, 5-бис-диамин-[1,4]бензохиноновое производное (I) от его основной цели (которой является АХЭ). Ранее предполагалось, что БХЭ действует как ферментная система, защищающая АХЭ от ложного субстрата. Более того, 2,5-бис-диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I), неожиданно проявляло ингибирующую активность в отношении агрегации A, индуцируемой АХЭ. Важно подчеркнуть, что хиноновая функциональная группа проявляет защитную антиоксидантную активность в отношении воздействия окислителей из-за накопления A. Ингибирующая активность в отношении A и антиоксидантная активность, неожиданно, вместе дают синергетический эффект, существенно улучшая состояние пациентов, страдающих патологическими состояниями, характеризующимися отложениями A. В частности, важно подчеркнуть, что относительно высокая активность ингибирования АХЭ, относительно низкая активность ингибирования БХЭ, ингибирующая активность в отношении агрегации A и антиоксидантная активность, вместе, неожиданно, дают синергетический эффект, существенно улучшая состояния пациентов, пораженных БА. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) или их фармацевтически приемлемые соли могут быть введены в виде чистых соединений, однако, предпочтительно, они представлены в форме фармацевтического препарата. Неограничивающие примеры подходящих фармацевтических препаратов перечислены ниже. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) могут быть в виде препарата для перорального, парентерального или ректального введения или в формах, подходящих для введения путем ингаляции или инсуффляции (как через рот, так и через нос). Препараты для перорального и парентерального введения являются предпочтительными. Для перорального введения, фармацевтические препараты могут быть, например, в виде таблеток или капсул, полученных известными способами, со вспомогательными веществами, приемлемыми с фармацевтической точки зрения, в качестве связующих агентов (например, пептизированный кукурузный крахмал, поливинилпирролидон или метилцеллюлоза); наполнителей (например, лактоза, микрокристаллическая целлюлоза или кислый фосфаткальция); добавок (например, стеарат магния, тальк, диоксид кремния); разрыхляющих агентов (например, картофельный крахмал); и/или смазывающих агентов (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой обычными способами. Жидкие препараты для перорального введения могут иметь вид, например, сиропообразных растворов или суспензий, или они могут быть в виде сухого продукта, который может быть растворен в воде или дру-6 007909 гой жидкости перед применением. Такие препараты могут быть получены известными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбит, производные целлюлозы, съедобные гидрированные жиры); эмульгирующие агенты (например, лецитин или гуммиарабик); безводные жидкости (например, миндальное масло, жирные эфиры, этиловый спирт или фракционированные растительные масла); и/или консерванты (например метил- или пропилгидроксибензоаты, сорбиновая кислота или аскорбиновая кислота). Препараты также могут содержать, в соответствующих случаях, забуферивающие соли, красящие, ароматические и/или подслащающие агенты. Препараты для перорального введения могут быть получены известным способом, чтобы обеспечить регулируемое высвобождение активного соединения. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) могут быть подготовлены известным образом для парентерального введения путем инъекции или вливания. Препараты для инъекций могут быть в виде отдельных доз, например, в ампулах или мультидозовых контейнерах, содержащих консерванты. Композиция может быть в виде суспензии, в водных или масляных жидкостях, и она может содержать элементы состава, такие как диспергирующие и стабилизирующие агенты. В качестве альтернативы, активное соединение может быть в виде порошка для растворения непосредственно перед применением в подходящей жидкости, например, стерилизованной воде. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) могут быть подготовлены для ректального введения в виде суппозиториев или промывания кишечника, например, содержащие вспомогательные вещества для суппозиториев известного типа, такие как масло какао или другие жиры. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) также могут быть подготовлены, известным способом в виде композиций с пролонгированным высвобождением. Такие композиции с пролонгированным высвобождением могут быть введены как имплантаты (например, подкожных или внутримышечных) или путем внутримышечнной инъекции. Так, например, 2,5-бис-диамин-[1,4]бензохиноновые производные (I) могут входить в состав препарата с подходящими полимерными или гидрофобными веществами (например, эмульсией или маслом) или камедями с обменом ионов, или относительно плохо растворимыми производными, такими как относительно плохо растворимые соли. Для интраназального введения 2,5-бис-диамин-[1,4]бензохиноновые производные (I) могут входить в состав препарата, который вводят с помощью (известного) устройства, например, в виде порошка с подходящими носителями. Доза 2,5-бис-Диамин-[1,4]бензохиноновых производных (I) зависит от возраста и состояния пациента, так что конкретная доза должна определяться время от времени врачом. Доза также будет зависеть от средства введения и от конкретного выбранного соединения. Применимые дозы могут быть, например, между 0,1 и 400 мг/кг в отношении к массе тела в день. 2,5-бис-Диамин-[1,4]бензохиноновые производные (I) могут вводиться в комбинации с одним или более подходящими терапевтическими агентами и входить в состав препарата, изготовленного любым известным применимым способом. Другие характеристики настоящего изобретения станут более ясными из следующего описания, которое относится к вариантам воплощения изобретения, рассматриваемым исключительно как примеры,без каких-либо ограничений. Пример 1. Данный пример описывает синтез кислотного [3-(2-метоксибензиламино)пропил] карбамового бензилового эфира (IX), имеющего формулу К раствору кислотного (3-аминопропил)карбамового бензилового эфира (1,04 г, 5 ммоль) в 50 мл этанола, содержащего молекулярное сито (4) добавляли 2-метоксибензальдегид (0,75 г, 5,5 ммоль). Смесь оставляли при перемешивании при температуре окружающей среды в течение 20 мин, затем при охлаждении добавляли NaBH4 (0,2 г, 5 ммоль). Оставляли для протекания реакции в течение 6 ч, аккуратно подкисляли 2 н. НСl, сито фильтровали и выпаривали растворитель; остаток опять разбавляли H2O и экстрагировали диэтиловым эфиром (3 х 10 мл). Водный раствор затем подщелачивали при помощи 40%NaOH и экстрагировали СНСl3 (4 х 20 мл). Безводные и выпаренные органические экстракты давали 1,5 г соединения IX в виде чистого прозрачного масла, с помощью ТСХ (элюент:СНСl3/ЕtОН/NН 4OН 9,0:1,0:0,1). Выход 90%. 1 Н ЯМР (свободное основание; CDCl3) : 1,61-1,79 (м, 2 Н+1 Н взаимозаменяемый с D2O), 2,70 (т, 2 Н), 3,32 (кв, 2 Н), 3,78 (с, 2 Н), 3,84 (с, 3 Н), 5,11 (с, 2 Н), 5,73 (с увеличенный, 1 Н взаимозаменяемый с D2O), 6,84-6,95 (м, 2 Н), 7,19-7,40 (м, 7 Н). Пример 2. Данный пример описывает синтез кислотного 3-[этил-(2-метоксибензил)амино]пропил карбамового бензилового эфира (X), имеющего формулу К раствору [3-(2-метоксибензиламино)пропил]карбамового бензилового эфира (1,4 г; 4,3 ммоль) в 70 мл толуола добавляли диэтилсульфат (1,24 мл; 9,5 ммоль) и нагревали при кипячении с обратным холодильником в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и гасили конц.NaOH (50 мл). Органическую фазу отделяли, после обезвоживания и выпаривания получали сырой продукт, который очищали флэш-хроматографией. Элюирование СН 2 Сl2/петролейный эфир/МеОН/NН 4 ОН 4,6:5,0:0,4:0,04 давало 1,4 г соединения X в виде чистого прозрачного масла, с помощью ТСХ (элюент:CHCl3/MeOH/NH4OH 9,5:0,5:0,05). Выход 91%. 1 Н ЯМР (свободное основание; CDCl3) : 1,08 (т, 3H),1,61-1,79 (м, 2 Н), 2,53-2,75 (м, 4 Н), 3,32 (кв, 2 Н), 3,78 (с, 2 Н), 3,84 (с, 3H), 5,11 (с, 2 Н), 5,73 (с увеличенный, 1 Н взаимозаменяемый с D2O), 6,84-6,95 (м, 2 Н), 7,19-7,40 (м, 7 Н). Пример 3. Данный пример описывает синтез N1-этил-N1-(2-метоксибензил)пропан-1,3-диамина К раствору 3-[этил-(2-метоксибензил)амино]пропилкарбамового бензилового эфира (1,4 г; 3,9 ммоль) в 15 мл ледяной СН 3 СООН осторожно добавляли 3,5 мл 33% раствора HBr в СН 3 СООН. Смесь оставляли перемешиваться в течение 2 ч, затем гидробромат осаждали 100 мл диэтилового эфира. Образующееся белое твердое вещество растворяли в Н 2O, подщелачивали с помощью 2 н. NaOH и экстрагировали СНСl3 (5 х 20 мл). Безводную органическую фазу выпаривали в вакууме с получением 0,87 г соединения XI, в виде чистого прозрачного масла с помощью ТСХ (элюент: CHCl3/MeOH/NH4OH 9,0:1,0:0,1); количественный выход; 1 Н ЯМР (свободное основание; CDCl3) : 1,07 (т, 3H), 1,50 (с увеличенный, 2 Н взаимозаменяемый с D2O), 1,57-1,71 (м, 2 Н), 2,55 (кв, 4 Н), 2,73 (т, 2 Н), 3,60 (с, 2 Н), 3,84 (с, 3H), 6,83-6,99(м, 2 Н), 7,19-7,44 (м, 2 Н). Пример 4. Данный пример описывает синтез 2,5-бис-3-[этил-(2-метоксибензил)амино]пропиламино-[1,4]бензохинона (XII), имеющего формулу К раствору п-бензохинона (0,1 г; 0,92 ммоль) в 70 мл МеОН добавляли холодный N1-этил-N1-(2 метоксибензил) пропан-1,3-диамин (0,45 г; 2,0 ммоль). Реакционную смесь перемешивали при комнатной температуре и без света в течение 6 ч, выпаривали в вакууме с получением сырого вещества, которое очищали с помощью флэш-хроматографией. Элюирование CH2Cl2/МеОН/NH4OH 9,75:0,25:0,025 давало 0,23 г соединения XII, в виде прозрачного твердого вещества красного цвета с помощью ТСХ (элюент:CHCl3/MeOH/NH4OH 9,5:0,5:0,05). Выход 45%. 1 Н ЯМР (свободное основание; CDCl3) : 1,11 (т, 6 Н),1,72-1,85 (м, 4 Н), 2,56 (кв, 8 Н), 3,18 (кв, 4 Н), 3,62 (с, 4 Н), 3,82 (с, 6 Н), 5,26 (с, 2 Н), 6,83-6,95 (м, 4 Н), 7,197,43 (м, 4 Н + 2 Н взаимозаменяемый с D2O). EI-MC: m/z = 548 (М+). Пример 5. Данный пример описывает синтез кислотного [6-(2-метоксибензиламингексил] карбамового бензилового сложного эфира (XIII) Соединение XIII получали в виде прозрачного масла из кислотного (6-аминогексил)карбамового бензилового эфира (2,50 г, 10 ммоль), следуя методике, описанной в примере 1; выход 81%. 1 Н ЯМР(свободное основание; CDCl3) : 1,22-1,38 (м, 4 Н), 1,41-1,57 (м, 4 Н), 1,65 (с увеличенный, 1 Н взаимозаменяемый с D2O), 2,58 (т, 2 Н), 3,18 (кв, 2 Н), 3,77 (с, 2 Н), 3,84 (с, 3H), 4,76 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,09 (с, 2 Н), 6,82-6,93 (м, 2 Н), 7,20-7,40 (м, 7 Н). Пример 6. Данный пример описывает синтез кислотного 6-[этил-(2-метоксибензил)амино]гексил карбамового бензилового эфира (XIV) Соединение XIV получали в виде прозрачного масла из кислотного [6-(2-метоксибензиламино)гексил]карбамового бензилового эфира (2,91 г, 7,85 ммоль), следуя методике, описанной в примере 2. Выход 76%. 1 Н ЯМР (свободное основание; CDCl3) : 1,05 (т, 3H), 1,21-1,32 (м, 4 Н), 1,40-1,57 (м, 4 Н), 2,412,59 (м, 4 Н), 3,16 (кв, 2 Н), 3,60 (с, 2 Н), 3,80 (с, 3H), 4,73 (с увеличенный, 1 Н взаимозаменяемый с D2O),5,08 (с, 2 Н), 6,82-6,94 (м, 2 Н), 7,18-7,42 (м, 7 Н). Пример 7. Данный пример описывает синтез N1-этил-N1-(2-метоксибензил)гексан-1,6-диамина (XV) Соединение XV получали в виде прозрачного масла из кислотного 6-[этил-(2 метоксибензил)амино]гексилкарбамового бензилового эфира (2,31 г; 6,01 ммоль), следуя методике,описанной в примере 3. Выход 98%. 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 3H), 1,12-1,48 (м,8 Н+2 Н взаимозаменяемый с D2O), 2,41-2,53 (м, 4 Н), 2,65 (т, 2 Н), 3,57 (с, 2 Н), 3,81 (с, 3H), 6,82-6,94 (м,2 Н), 7,16-7,42 (м, 2 Н). Пример 8. Данный пример описывает синтез 2,5-бис-6-[этил-(2-метоксибензил)амино] гексиламино-[1,4] бензохинона (XVI) Соединение XVI получали в виде твердого вещества красного цвета из N1-этил-N1-(2-метоксибензил) гексан-1,6-диамина (1,05 г; 4 ммоль) и п-бензохинона (0,2 г; 1,84 ммоль), следуя методике, описанной в примере 4. Выход 17%. 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 6 Н), 1,14-1,38 (м, 8 Н),1,43-1,53 (м, 4 Н), 1,57-1,65 (м, 4 Н), 2,41-2,56 (м, 8 Н), 3,10 (кв, 4 Н), 3,57 (с, 4 Н), 3,81 (с, 6 Н), 5,28 (с, 2 Н),6,59 (т увеличенный, 2 Н взаимозаменяемый с D2O), 6,83-6,95 (м, 4 Н), 7,21 (т, 2 Н), 7,39 (д, 2 Н). EI-MC:m/z=632 (М+). Пример 9. Данный пример описывает синтез 2,5-бис-[6-(бензилэтиламино)гексиламино]-[1,4]бензохинона (XVII) Соединение XVII получали в виде твердого вещества красного цвета из N1-этил-N1-бензилгексан 1,6-диамина (0,47 г; 2 ммоль) и п-бензохинона (0,1 г; 0,92 ммоль), следуя методике, описанной в примере 8. Выход 20%. 1 Н ЯМР (свободное основание; CDCl3) : 1,05 (т, 6 Н), 1,14-1,39 (м, 8 Н), 1,43-1,53 (м, 4 Н),1,58-1,65 (м, 4 Н), 2,41-2,56 (м, 8 Н), 3,10 (кв, 4 Н), 3,71 (с, 4 Н), 5,28 (с, 2 Н), 6,44 (т увеличенный, 2 Н взаимозаменяемый с D2O), 7,10-7,24 (м, 10 Н). EI-MC: m/z=572 (М+). N1-этил-N1-бензилгексан-1,6-диамин получали способами, аналогичными описанным в примерах 1-4, с использованием соответствующих исходных соединений. Пример 10. Данный пример описывает синтез 2,5-бис-6-[этил-(2-хлорбензил)амино]гексиламино[1,4]бензохинона (XVIII) Соединение XVIII получали в виде твердого вещества красного цвета из N1-этил-N1-(2-хлорбензил) гексан-1,6-диамина (0,54 г; 2 ммоль) и п-бензохинона (0,1 г; 0,92 ммоль), следуя той же методике, что описана в примере 8. Выход 15%. 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 6 Н), 1,10-1,35 (м, 8 Н),1,43-1,53 (м, 4 Н), 1,57-1,65 (м, 4 Н), 2,41-2,56 (м, 8 Н), 3,08 (кв, 4 Н), 3,46 (с, 4 Н), 5,28 (с, 2 Н), 6,59 (т увеличенный, 2 Н взаимозаменяемый с D2O), 7,05-7,23 (м, 6 Н), 7,45 (д, 2 Н). EI-MC: m/z=641 (М+). N1-этил-N1-9 007909(2-хлорбензил)гексан-1,6-диамин получали способами, аналогичными описанным в примерах 1-4, с использованием соответствующих исходных соединений. Пример 11. Данный пример описывает синтез 2,5-ди-трет-3,6-бис-3-[этил-(2-метоксибензил)амино]пропиламино-[1,4]бензохинона (XIX) Соединение XIX получали в виде твердого вещества цвета фуксии из соединения, имеющего формулу XI (90 мг; 0,40 ммоль) и 2,5-ди-трет-бутил[1,4]бензохинона (40 мг; 0,18 ммоль), следуя методике,описанной в примере 8. Выход 10%. 1 Н ЯМР (свободное основание; CDCl3) : 1,09 (т, 6 Н), 1,15 (с, 9 Н),1,27 (с, 9 Н), 1,70-1,83 (м, 4 Н), 2,52-2,64 (м, 8 Н), 3,15 (с, 3H), 3,54-3,71 (м, 4 Н), 3,83 (с, 3H), 6,81-6,96 (м,4 Н), 7,18-7,44 (м, 4 Н). EI-MC: m/z=660 (М+). Пример 12. Данный пример описывает синтез кислотного [6-бензиламиногексил]карбамового бензилового эфира (XX), имеющего формулу Соединение XX получали в виде прозрачного масла из кислотного (6-аминогексил)карбамового бензилового эфира (4,00 г; 16 ммоль), следуя методике, описанной в примере 1. Количественный выход. 1 Н ЯМР (свободное основание; CDCl3) : 1,22-1,57 (м, 6 Н+1 Н взаимозаменяемый с D2O), 1,78-1,97 (м,2 Н), 2,75 (т, 2 Н), 3,18 (кв, 2 Н), 4,05 (с, 2 Н), 5,01 (т увеличенный, 1 Н взаимозаменяемый с D2O), 5,15 (с,2 Н), 7,30-7,45 (м, 8 Н), 7,57-7,65 (м, 2 Н). Пример 13. Данный пример описывает синтез кислотного [6-этилбензиламино)гексил]карбамового бензилового эфира (XXI) Соединение XXI получали в виде прозрачного масла из кислотного [6-бензиламиногексил]карбамового бензилового эфира (5,00 г; 14 ммоль), следуя методике, описанной в примере 2. Выход 30%. 1 Н ЯМР (свободное основание; CDCl3) 6: 1,10 (т, 3H), 1,22-1,40 (м, 4 Н), 2,40-2,62 (м, 4 Н), 3,16 (кв, 2 Н), 3,58(с, 2 Н), 5,05 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,18 (с, 2 Н), 7,22-7,40 (м, 10 Н). Пример 14. Данный пример описывает синтез N1-этил-N1-бензилгексан-1,6-диамина (XXII) Соединение XXII получали в виде прозрачного масла из кислотного 6-[этилбензиламино]гексил карбамового бензилового эфира (0,9 г; 2,45 ммоль), следуя методике, описанной в примере 3. Количественный выход; 1 Н ЯМР (свободное основание; CDCl3) : 1,03 (т, 3H), 1,15 (с увеличенный, 2 Н взаимозаменяемый с D2O), 1,21-1,58 (м, 8 Н), 2,37-2,58 (м, 4 Н), 2,65 (т, 2 Н), 3,56 (с, 2 Н), 7,20-7,38 (м, 5 Н). Пример 15. Данный пример описывает синтез кислотного [6-(2-хлорбензиламиногексил]карбамового бензилового эфира (XXIII) Соединение XXIII получали в виде прозрачного масла из кислотного (6-аминогексил)карбамового бензилового эфира (4,00 г; 16 ммоль), следуя методике, описанной в примере 1. Выход 65%; 1 Н ЯМР(м, 9 Н). Пример 16. Данный пример описывает синтез кислотного 6-[этил-(2-хлорбензил)амино]гексил карбамового бензилового эфира (XXIV) Соединение XXIV получали в виде прозрачного масла из кислотного [6-(2-хлорбензиламино)гек- 10007909 сил]карбамового бензилового эфира (2,00 г; 5,35 ммоль), следуя методике, описанной в примере 2. Выход 40%; 1 Н ЯМР (свободное основание; CDCl3) : 1,08 (т, 3H), 1,21-1,58 (м, 8 Н), 2,40-2,62 (м, 4 Н), 3,15(кв, 2 Н), 3,63 (с, 2 Н), 4,82 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,12 (с, 2 Н), 7,10-7,41 (м, 8 Н),7,57 (д, 1 Н). Пример 17. Данный пример описывает синтез N1-этил-N1-(2-хлорбензил)гексан-1,6-диамина (XXV) Соединение XXV получали в виде желтого масла из кислотного 6-[этил-(2-хлорбензил)амино]гексилкарбамового бензилового эфира (0,80 г; 1,99 ммоль), следуя методике, описанной в примере 3. Выход 98%; 1 Н ЯМР (свободное основание; CDCl3) : 1,05 (т, 3H), 1,12-1,54 (м, 8 Н+2 Н взаимозаменяемый сD2O), 2,38-2,66 (м, 6 Н), 3,61 (с, 2 Н), 7,05-7,37 (м, 3H), 7,53 (д, 1 Н). Пример 18. Данный пример описывает синтез кислотного [6-(2-нитробензиламино)гексил]карбамового бензилового эфира (XXVI) Соединение XXVI получали в виде прозрачного масла из кислотного (6-аминогексил)карбамового бензилового эфира (5,00 г; 20 ммоль), следуя методике, описанной в примере 1. Выход 95%; 1H ЯМР(м, 6 Н), 7,58-7,66 (м, 2 Н), 7,95 (д, 1 Н). Пример 19. Данный пример описывает синтез кислотного 6-[этил-(2-нитробензил)амино]гексил карбамового бензилового эфира (XXVII) Соединение XXVII получали в виде зеленоватого масла из кислотного [6-(2-нитробензиламино) гексил]карбамового бензилового эфира (3,00 г; 7,79 ммоль), следуя методике, описанной в примере 2. Выход 40%; 1 Н ЯМР (свободное основание; CDCl3) : 1,02 (т, 3H), 1,20-1,57 (м, 8 Н), 2,37-2,56 (м, 4 Н),3,18 (кв, 2 Н), 3,83 (с, 2 Н), 4,76 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,12 (с, 2 Н), 7,29-7,41 (м,6 Н), 7,50-7,61 (м, 1 Н), 7,66-7,72 (м, 1 Н), 7,79-7,83 (м, 1 Н). Пример 20. Данный пример описывает синтез N1-этил-N1-(2-нитробензил)гексан-1,6-диамина Соединение XXVIII получали в виде желтого масла из кислотного 6-[этил-(2-нитробензил)амино] гексилкарбамового бензилового эфира (0,80 г; 2,00 ммоль), следуя методике, описанной в примере 3. Выход 98%; 1 Н ЯМР (свободное основание; CDCl3) : 1,02 (т, 3H), 1,20-1,57 (м, 8 Н), 2,05 (с увеличенный,2 Н взаимозаменяемый с D2O), 2,37-2,56 (м, 4 Н), 2,73 (т, 2 Н), 3,83 (с, 2 Н), 7,32-7,41 (м, 1 Н), 7,50-7,61 (м,1 Н), 7,70-7,76 (м, 1 Н), 7,79-7,83 (м, 1 Н). Пример 21. Данный пример описывает синтез 2,5-бис-6-[этил-(2-нитробензил)амино]гексиламино-[1,4]бензохинона (XXIX) Соединение XXIX получали в виде воскообразного твердого вещества красного цвета из N1-этилN -(2-нитробензил) гексан-1,6-диамина (0,65 г; 2,33 ммоль) и п-бензохинона (0,12 г; 1,1 ммоль), следуя методике, описанной в примере 4. Выход 15%; 1 Н ЯМР (свободное основание; CDCl3) : 0,98 (т, 6 Н),1,19-1,50 (м, 12 Н), 1,52-1,72 (м, 4 Н), 2,35-2,57 (м, 8 Н), 3,13 (кв, 4 Н), 3,83 (с, 4 Н), 5,30 (с, 2 Н), 6,58-6,66 (т увеличенный, 2 Н взаимозаменяемый с D2O), 7,32-7,41 (м, 2 Н), 7,48-7,58 (м, 2 Н), 7,62-7,70 (м, 2 Н), 7,787,82 (м, 2 Н). МС (ESI+) m/z=663 (М+Н)+. Пример 22. Данный пример описывает синтез кислотного [6-(3-метоксибензиламиногексил]карбамового бензилового эфира (XXX) 1 Соединение XXX получали в виде прозрачного масла из кислотного (6-аминогексил)карбамового бензилового эфира (4,00 г; 16 ммоль), следуя методике, описанной в примере 1. Выход 76%; 1 Н ЯМР(свободное основание; CDCl3) : 1,22-1,38 (м, 4 Н), 1,41-1,62 (м, 4 Н), 2,58 (с увеличенный, 1 Н взаимозаменяемый с D2O), 2,62 (т, 2 Н), 3,18 (кв, 2 Н), 3,78 (с, 2 Н), 3,81 (с, 3H), 4,83 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,08 (с, 2 Н), 6,79-6,95 (м, 3H), 7,20-7,41 (м, 6 Н). Пример 23. Данный пример описывает синтез кислотного 6-[этил-(3-метоксибензил)амино]гексил карбамового бензилового эфира (XXXI) Соединение XXXI получали в виде прозрачного масла из кислотного [6-(3-метоксибензиламино) гексил]карбамового бензилового эфира (2,91 г; 7,85 ммоль), следуя методике, описанной в примере 2. Выход 50%; 1 Н ЯМР (свободное основание; CDCl3) : 1,05 (т, 3H), 1,21-1,38 (м, 4 Н), 1,40-1,57 (м, 4 Н),2,43 (т, 2 Н), 2,73 (т, 2 Н), 3,18 (кв, 2 Н), 3,56 (с, 2 Н), 3,80 (с, 3H), 4,83 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,09 (с, 2 Н), 6,79-6,82 (м, 1 Н), 6,85-6,88 (м, 2 Н), 7,22 (т, 1 Н), 7,29-7,42 (м, 5 Н). Пример 24. Данный пример описывает синтез N1-этил-N1-(3-метоксибензил)гексан-1,6-диамина Соединение XXXII получали в виде прозрачного масла из кислотного 6-[этил-(3-метоксибензил) амино]гексилкарбамового бензилового эфира (2,31 г; 6,01 ммоль), следуя методике, описанной в примере 3. Выход 90%; Yield 90%; 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 3H), 1,22-1,65 (м, 8 Н+2 Н взаимозаменяемый с D2O), 2,38-2,58 (м, 4 Н), 2,65 (т, 2 Н), 3,58 (с, 2 Н), 3,82 (с, 3H), 6,72-6,92 (м, 3H), 7,167,29 (м, 1 Н). Пример 25. Данный пример описывает синтез 2,5-бис-6-[этил-(3-метоксибензил)амино] гексиламино-[1,4]бензохинона (XXXIII) Соединение XXXIII получали в виде воскообразного твердого вещества красного цвета из N1-этилN -(3-метоксибензил)гексан-1,6-диамина (1,0 г; 4,24 ммоль) и п-бензохинона (0,2 г; 1,84 ммоль), следуя методике, описанной в примере 4. Выход 15%; 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 6 Н),1,24-1,57 (м, 12 Н), 1,60-1,75 (м, 4 Н), 2,39-2,60 (м, 8 Н), 3,09 (кв, 4 Н), 3,57 (с, 4 Н), 3,81 (с, 6 Н), 5,32 (с, 2 Н),6,63 (т увеличенный, 2 Н взаимозаменяемый с D2O), 6,76-6,95 (м, 6 Н), 7,18-7,28 (т, 2 Н). МС (ESI+ )m/z=633 (М+Н)+. Пример 26. Данный пример описывает синтез кислотного [6-(4-метоксибензиламиногексил] карбамового бензилового эфира (XXXIV) 1 Соединение XXXIV получали в виде желтого масла из кислотного (6-аминогексил)карбамового бензилового эфира (2,50 г; 10 ммоль), следуя методике, описанной в примере 1. Выход 90%; 1 Н ЯМР(свободное основание; CDCl3) : 1,25-1,38 (м, 4 Н), 1,41-1,57 (м, 4 Н+1 Н взаимозаменяемый с D2O), 2,62 (т,1 Н), 3,19 (кв, 2 Н), 3,75 (с, 2 Н), 3,82 (с, 3H), 4,76 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,12 (с,2 Н), 6,82-6,93 (м, 2 Н), 7,20-7,43 (м, 7 Н). Пример 27. Данный пример описывает синтез кислотного 6-[этил-(4-метоксибензил)амино]гексил карбамового бензилового эфира (XXXV)- 12007909 Соединение XXXV получали в виде прозрачного масла из кислотного [6-(2-метоксибензиламино) гексил]карбамового бензилового эфира (2,91 г; 7,85 ммоль), следуя методике, описанной в примере 2. Выход 40%; 1 Н ЯМР (свободное основание; CDCl3) : 1,07 (т, 3H), 1,23-1,38 (м, 4 Н), 1,42-1,57 (м, 4 Н),2,42 (т, 2 Н), 2,56 (кв, 2 Н), 3,21 (кв, 2 Н), 3,52 (с, 2 Н), 3,82 (с, 3H), 4,83 (с увеличенный, 1 Н взаимозаменяемый с D2O), 5,12 (с, 2 Н), 6,84 (д, 2 Н), 7,25 (д, 2 Н), 7,32-7,42 (м, 5 Н). Пример 28. Данный пример описывает синтез N1-этил-N1-(4-метоксибензил)гексан-1,6-диамина Соединение XXXVI получали в виде прозрачного масла из кислотного 6-[этил-(4-метоксибензил) амино]гексилкарбамового бензилового эфира (2,31 г; 6,01 ммоль), следуя методике, описанной в примере 3. Количественный выход; 1 Н ЯМР (свободное основание; CDCl3) : 1,06 (т, 3H), 1,22-1,56 (м,8 Н+2 Н взаимозаменяемый с D2O), 2,38-2,57 (м, 4 Н), 2,66 (т, 2 Н), 3,55 (с, 2 Н), 3,81 (с, 3H), 6,82-6,94 (м,2 Н), 7,20-7,31 (м, 2 Н). Пример 29. Данный пример описывает синтез 2,5-бис-6-[этил-(4-метоксибензил)амино]гексиламино-[1,4]бензохинона (XXXVII) Соединение XXXVII получали в виде воскообразного твердого вещества красного цвета из N1-этилN -(4-метоксибензил)гексан-1,6-диамина (1,05 г; 4 ммоль) и п-бензохинона (0,2 г; 1,84 ммоль), следуя методике, описанной в примере 4. Выход 12%; 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 6 Н),1,22-1,56 (м, 12 Н), 1,58-1,72 (м, 4 Н), 2,38-2,56 (м, 8 Н), 3,12 (кв, 4 Н), 3,47 (с, 4 Н), 3,79 (с, 6 Н), 5,32 (с, 2 Н),6,59 (т увеличенный, 2 Н взаимозаменяемый с D2O), 6,82-6,93 (м, 4 Н), 7,21-7,30 (м, 4 Н). МС (ESI+)m/z=633 (М+Н)+. Пример 30. Данный пример описывает синтез кислотного 6-[(фуран-2-илметил)амино]гексил карбамового бензилового эфира (XXXVIII) 1 Соединение XXXVIII получали в виде коричневого твердого вещества из (6 аминогексил)карбамового бензилового эфира (4,00 г; 16 ммоль), следуя методике, описанной в примере 1. Выход 72%; 1 Н ЯМР (свободное основание; CDCl3) : 1,22-1,50 (м, 8 Н), 1,73-1,98 (м, 2 Н+1 Н взаимозаменяемый с D2O), 2,69-2,94 (м, 2 Н), 3,18 (кв, 10 2 Н), 4,28 (с, 2 Н), 4,99-5,18 (м, 2 Н+1 Н взаимозаменяемый с D2O), 6,39-6,42 (м, 1 Н), 6,72-6,79 (м, 1 Н), 7,28-7,40 (м, 5 Н), 7,46-7,50 (м, 1 Н). P.f.=132-135 С. Пример 31. Данный пример описывает синтез кислотного [6-(этилфуран-2-илметиламино)гексил карбамового бензилового эфира (XXXIX) Соединение XXXIX получали в виде желтого масла из кислотного 6-[(фуран-2 илметил)амино]гексилкарбамового бензилового эфира (2,70 г; 8,18 ммоль), следуя методике, описанной в примере 2. Выход 35%; 1 Н ЯМР (свободное основание; CDCl3) : 1,15-1,60 (м, 9 Н), 1,82-1,99 (м, 2 Н),2,79-2,88 (м, 2 Н), 2,99 (кв, 2 Н), 3,21 (кв, 2 Н), 4,22 (с, 2 Н), 4,96 (с увеличенный, 1 Н взаимозаменяемый сD2O), 5,15 (с, 2 Н), 6,43-6,49 (м, 1 Н), 6,62-6,68 (м, 1 Н), 7,32-7,41 (м, 5 Н), 7,53-7,56 (м, 1 Н). Пример 32. Данный пример описывает синтез N1-этил-N1-фуран-2-илметилгексан-1,6-диамина (XL) Соединение XL получали в виде прозрачного масла из кислотного [6-(этилфуран-2 илметиламино)гексил]карбамового бензилового эфира (1,05 г; 2,92 ммоль), следуя методике, описанной в примере 3. Выход 85%; 1 Н ЯМР (свободное основание; CDCl3) : 1,08 (т, 3H), 1,22-1,58 (м, 8 Н+2 Н взаимозаменяемый с D2O), 2,38-2,61 (м, 4 Н), 2,67 (т, 2 Н), 3,62 (с, 2 Н), 6,18-6,20 (м, 1 Н), 6,32-6,38 (м, 1 Н),7,38-7,42 (м, 1 Н). Пример 33. Данный пример описывает синтез 2,5-бис-[6-(этилфуран-2-илметиламино)гексиламино]-[1,4]бензохинона (XLI) Соединение XLI получали в виде воскообразного красного вещества из N1-этил-N1-фуран-2 илметилгексан-1,6-диамина (0,55 г; 2,45 ммоль) и п-бензохинона (0,14 г; 1,23 ммоль), следуя методике,описанной в примере 4. Выход 16%; 1 Н ЯМР (свободное основание; CDCl3) : 1,09 (т, 6 Н), 1,22-1,58 (м,12 Н), 1,60-1,73 (м, 4 Н), 2,43 (т, 4 Н), 2,57 (кв, 4 Н), 3,18 (кв, 4 Н), 3,63 (с, 4 Н), 5,32 (с, 2 Н), 6,18-6,22 (м, 2 Н),6,32-6,39 (м, 2 Н), 6,62 (т увеличенный, 2 Н взаимозаменяемый с D2O), 7,38-7,41 (м, 2 Н). МС (ESI+)m/z=553 (М+Н)+. Пример 34. Данный пример описывает синтез кислотного [2-(2-метоксибензиламиноэтил]карбамового бензилового эфира (XLII) Соединение XLII получали в виде желтого масла из кислотного (2-аминоэтил)карбамового бензилового эфира (5,00 г; 25,8 ммоль), следуя методике, описанной в примере 1. Выход 80%; 1 Н ЯМР (свободное основание; CDCl3) : 1,63 (с увеличенный, 1 Н взаимозаменяемый с D2O), 2,75 (т, 2 Н), 3,33 (кв,2 Н), 3,78 (с, 2 Н), 3,83 (с, 3H), 5,18 (с, 2 Н), 5,38 (с увеличенный, 1 Н взаимозаменяемый с D2O), 6,82-6,93(м, 2 Н), 7,20-7,41 (м, 7 Н). Пример 35. Данный пример описывает синтез кислотного 2-[этил-(2-метоксибензил)амино]этил карбамового бензилового эфира (XLIII) Соединение XLIII получали в виде прозрачного масла из кислотного [2-(2-метоксибензиламино) этил]карбамового бензилового эфира (2,00 г; 19,7 ммоль), следуя методике, описанной в примере 2. Выход 45%; 1 Н ЯМР (свободное основание; CDCl3) : 1,05 (т, 3H), 2,58 (кв, 2 Н), 2,62 (т, 2 Н), 3,38 (кв, 2 Н),3,62 (с, 2 Н), 3,82 (с, 3H), 5,20 (с, 2 Н), 5,78 (с увеличенный, 1 Н взаимозаменяемый с D2O), 6,85-6,99 (м,2 Н), 7,23-7,44 (м, 7 Н). Пример 36. Данный пример описывает синтез N1-этил-N1-(2-метоксибензил)этан-1,2-диамина Соединение XLIV получали в виде прозрачного масла из кислотного 2-[этил-(2-метоксибензил) амино]этилкарбамового бензилового эфира (1,50 г; 4,35 ммоль), следуя методике, описанной в примере 3. Выход 98%; 1 Н ЯМР (свободное основание; CDCl3) : 1,04 (т, 3H), 2,00 (с увеличенный, 2 Н взаимозаменяемый с D2O), 2,65 (кв, 2 Н), 2,98 (т, 2 Н), 3,21 (т, 2 Н), 3,78 (с, 2 Н), 3,85 (с, 3H), 6,85-7,01 (м, 2 Н), 7,207,42 (м, 2 Н). Пример 37. Данный пример описывает синтез 2,5-бис-2-[этил-(2-метоксибензил)амино]этиламино-[1,4]бензохинона (XLV) Соединение XLV получали в виде твердого вещества темно-красного цвета из N1-этил-N1-(2-метоксибензил)этан-1,2-диамина кислотного (1,40 г; 6,27 ммоль) и п-бензохинона (0,34 г; 3,12 ммоль), следуя методике, описанной в примере 4. Выход 10%; 1 Н ЯМР (свободное основание; CDCl3) : 1,15 (т, 6 Н), 2,64m/z=521 (М+H)+. P.f.=127-130 С. Пример 38. Данный пример описывает синтез кислотного [7-(2-метоксибензиламиногептил]карбамового бензилового эфира (XLVI) Соединение XLVI получали в виде желтого масла из кислотного (7-аминогептил)карбамового бензилового эфира (2,50 г; 9,4 ммоль), следуя методике, описанной в примере 1. Выход 90%; 1H ЯМР (свободное основание; CDCl3) : 1,22-1,38 (т, 6 Н), 1,38-1,64 (м, 4 Н+1 Н взаимозаменяемый с D2O), 2,62 (т,2 Н), 3,13 (кв, 2 Н), 3,81 (с, 3H), 3,84 (с, 2 Н), 5,09 (с, 2 Н), 5,22 (с увеличенный, 1 Н взаимозаменяемый сD2O), 6,80-6,93 (м, 2 Н), 7,19-7,40 (м, 7 Н). Пример 39. Данный пример описывает синтез кислотного 7-[этил-(2-метоксибензил)амино]гептилкарбамового бензилового эфира (XLVII) Соединение XLVII получали в виде прозрачного масла из кислотного [7-(2-метоксибензиламино) гептил]карбамового бензилового эфира (3,30 г; 8,0 ммоль), следуя методике, описанной в примере 2. Выход 35%; 1 Н ЯМР (свободное основание; CDCl3) : 1,12 (т, 3H), 1,25-1,38 (м, 6 Н), 1,43-1,61 (м, 4 Н), 2,452,61 (м, 4 Н), 3,20 (кв, 2 Н), 3,65 (с, 2 Н), 3,83 (с, 3H), 5,02 (с увеличенный, 1 Н взаимозаменяемый с D2O),5,19 (с, 2 Н), 6,84-7,02 (м, 2 Н), 7,21-7,51 (м, 7 Н). Пример 40. Данный пример описывает синтез N1-этил-N1-(2-метоксибензил)гептан-1,7-диамина Соединение XLVIII получали в виде желтого масла из кислотного 7-[этил-(2-метоксибензил)амино]гептилкарбамового бензилового эфира (1,10 г; 2,50 ммоль), следуя методике, описанной в примере 3. Количественный выход; 1 Н ЯМР (свободное основание; CDCl3) : 0,98 (т, 3H), 1,12-1,53 (м, 10 Н+2 Н взаимозаменяемый с D2O), 2,35-2,52 (м, 4 Н), 2,55-2,63 (м, 2 Н), 3,55 (с, 2 Н), 3,72 (с, 3H), 6,72-6,80 (м, 1 Н),6,83 (т, 1 Н), 7,14 (т, 1 Н), 7,38 (д, 1 Н). Пример 41. Данный пример описывает синтез 2,5-бис-7-[этил-(2-метоксибензил)амино] гептиламино-[1,4]бензохинона (IL) Соединение IL получали в виде красного масла из N1-этил-N1-(2-метоксибензил)гептан-1,7-диаминаm/z=661 (М+Н)+. Пример 42. Данный пример описывает синтез N-(2-метоксибензил)гексан-1,6-диамина (L) Соединение L получали в виде желтого масла из кислотного [6-(2-метоксибензиламиногексил]карбамового бензилового эфира (2,0 г; 5,40 ммоль), следуя методике, описанной в примере 3. Выход 65%; 1H ЯМР (свободное основание; CDCl3) : 1,12-1,42 (м, 8 Н+3H взаимозаменяемый с D2O), 2,38-2,56 (м,4 Н), 3,60 (с, 2 Н), 3,62 (с, 3H), 6,63-6,79 (м, 2 Н), 7,01-7,15 (м, 2 Н). Пример 43. Данный пример описывает синтез 2,5-бис[6-(2-метоксибензиламино)гексиламино]-[1,4] бензохинона (LI)- 15007909 Соединение LI получали в виде твердого вещества красного цвета из N-(2-метоксибензил)гексан 1,6-диамина (0,70 г; 2,96 ммоль) и п-бензохинона (0,15 г; 1,38 ммоль), следуя методике, описанной в примере 4. Выход 18%; 1 Н ЯМР (свободное основание; CDCl3) : 1,28-1,42 (м, 8 Н), 1,52-1,76 (м, 8 Н), 2,63(т, 4 Н), 3,16 (кв, 4 Н), 3,78-3,85 (м, 10+2 Н взаимозаменяемый с D2O), 5,32 (с, 2 Н), 6,62 (т увеличенный, 2 Н взаимозаменяемый с D2O), 6,85-6,96 (м, 4 Н), 7,22-7,35 (м, 4 Н). МС (ESI+) m/z= 577 (М+Н)+. P.f.=205 С. Пример 44. Данный пример описывает синтез кислотного 6-[(2-метоксибензил)метиламино]гексилкарбамового бензилового эфира (LII) К суспензии кислотного [6-(2-метоксибензиламиногексил]карбамового бензилового эфира (5,0 г; 13,5 ммоль) в 8 мл H2O добавляли НСООН (1,6 мл; 40,5 ммоль) и НСНО (3,1 мл; 40,5 ммоль). Смесь оставляли перемешиваться при кипячении с обратным холодильником в течение 6 ч при комнатной температуре в течение одной ночи, затем водный раствор подщелачивали с помощью 40% NaOH и экстрагировали СНСl3 (3 х 100 мл). Собранные и обезвоженные органические экстракты выпаривали в вакууме, и полученный остаток очищали флэш-хроматографией. Элюируя СНСl3/петролейный эфир/МеОН/NH4 ОН(8:2:0,7:0,05) получали 1,6 г соединения LII в виде желтого масла. Выход 75%; 1 Н ЯМР (свободное основание; CDCl3) : 1,23-1,39 (м, 4 Н), 1,40-1,63 (м, 4 Н), 2,23 (с, 3H), 2,44 (т, 2 Н), 3,17 (кв, 2H), 3,58 (с, 2 Н),3,82 (с, 3H), 5,12 (с, 2 Н), 5,22 (с увеличенный, 1 Н взаимозаменяемый с D2O), 6,82-7,00 (м, 2); 7,20-7,38 (м,7). Пример 45. Данный пример описывает синтез N1-(2-метоксибензил)-N1-метил-1,6-гександиамина Соединение LIII получали в виде желтого масла из кислотного 6-[(2-метоксибензил)метиламино] гексилкарбамового бензилового эфира (1,60 г; 4,20 ммоль), следуя методике, описанной в примере 3. Количественный выход; 1 Н ЯМР (свободное основание; CDCl3) : 1,18-1,56 (м, 8 Н+2 Н взаимозаменяемый с D2O)3 2,18 (с, 3H), 2,38 (т, 2 Н), 2,62 (т, 2 Н), 3,45 (с, 2 Н), 3,78 (с, 3H), 6,78-6,92 (м, 2 Н), 7,19 (т, 1 Н),7,28-7,31 (м, 1 Н). Пример 46. Данный пример описывает синтез 2,5-бис-6-[(2-метоксибензил)метиламино] гексиламино-[1,4]бензохинона (LIV) Соединение LIV получали в виде воскообразного твердого вещества красного цвета из N1-(2 метоксибензил)-N1-метил-1,6-гександиамина (0,90 г; 3,60 ммоль) и п-бензохинона (0,18 г; 1,66 ммоль),следуя методике, описанной в примере 4. Выход 10%; 1 Н ЯМР (свободное основание; CDCl3) : 1,31-1,48(м, 16 Н), 2,22 (с, 6 Н), 2,41 (т, 4 Н), 3,15 (кв, 4 Н), 3,52 (с, 4 Н), 3,83 (с, 6 Н), 5,32 (с, 2 Н), 6,62 (т увеличенный, 2 Н взаимозаменяемый с D2O), 6,83-6,99 (м, 4 Н), 7,19-7,38 (м, 4 Н). МС (ESI+) m/z= 605 (М+Н)+. Пример 47. Данный пример описывает синтез 2,5-бис-6-[этил-(2-метоксибензил)амино] гексиламино-3,6-диметил-[1,4]бензохинона (LV) Соединение LV получали в виде красного масла из N1-(2-метоксибензил)-N1-этил-1,6 гександиамина (0,82 г; 3,10 ммоль) и 2,5-диметилбензохинона (0,20 г; 1,85 ммоль), следуя методике, описанной в примере 4. Выход 10%; 1 Н ЯМР (свободное основание; CDCl3) : 1,12 (т, 6 Н), 1,22-1,43 (м, 8 Н),1,45-1,63 (м, 8), 2,11 (с, 6 Н), 2,48-2,62 (м, 8 Н), 3,53 (кв, 4 Н), 3,63 (с, 4 Н), 3,83 (с, 6 Н), 6,72 (т увеличенный,2 Н взаимозаменяемый с D2O), 6,83-7,01 (м, 4 Н), 7,23 (т, 2 Н), 7,42 (м, 2 Н). МС (ESI+) m/z= 661 (М+Н)+. Пример 48. Данный пример описывает определение ингибирующей способности и селективности соединений XVI и XII, а также сравнение этих свойств с некоторыми лекарственными средствами,имеющимися на рынке. Ингибирующую силу (ИК 50) определяли с использованием спектрофотометрического метода Элл- 16007909 мана (Ellman, G.L.; Courtney, K.D.; Andres, V.; Featherstone, R.M. A New and Rapid Colorimetric Determination of Acetylcholinesterase Activity. Biochem. Pharmacol. 1961, vol. 7, pp. 88-95). Значение ИК 50 определяли с использованием постоянных концентраций субстрата и фермента, и варьируя концентрацию ингибитора с постепенным увеличением. Таким образом определяли активность фермента на основании обнаружения образования анионных окрашенных молекулярных образцов (2 нитро-4-тиобензоат) (max=412 нм), которые получали после реакции между тиохолином - продуктом ферментного гидролиза ацетилхолина (субстата АХЭ) или бутирилтиохолина (субстрата БХЭ) - и 5,5'дитио-бис-нитробензойной кислотой (реактив Эллмана). Колебания оптической плотности при 412 нм (что является колебаниями поглощения 2-нитро-4 тиобензоата в минуту (П/мин) (ферментативная скорость) зависит от концентрации субстрата и от ферментативной активности АХЭ (из человеческих эритроцитов, амфифильная форма, ЕС 3.1.1.7) и БХЭ (из человеческой плазмы, ЕС 3.1.1.8) в соответствии с кинетикой Michaelis Menten. Для расчета ИК 50 использовали постоянные концентрации насыщения субстрата, которые способны индуцировать максимальную ферментативную скорость (Vmax) и фиксированную скорость фермента. Затем тестировали пять нарастающих концентраций исследуемых соединений, способных индуцировать ингибирование от 20% до 1'80% от Vmax. Затем получали линии ингибирования, помещая на график процент ингибирования Vmax как функцию десятичного логарифма наномолярной концентрации ингибитора. Оценивали параметры линейной регрессии для каждой линии и ИК 50 (концентрация, способная инактивировать максимальную ферментную активность на 50%), которую получали путем интерполяции соответствующей линии. Таблица I Среднее двух независимых измерений, повторенных три раза;Acetylcholinesterase inhibitors. Current Medicinal Chemistry 2000, vol.7, pp. 303-339. Табл. I показывает ИК 50, полученные с использованием способа, описанного выше и относящиеся к соединениям XVI, XII, к такрину и донепезилу. ИК 50 для АХЭ указана как ИК 50(АХЭ), ИК 50 для БХЭ указана как ИК 50(БХЭ). Селективность определяли как соотношение между ИК 50(АХЭ) И ИК 50(БХЭ) И она показывала способность ингибитора связываться предпочтительно с АХЭ, более чем с БХЭ. Соединения XVI и XII показали относительно очень хорошие ИК 50(АХЭ) (табл. I), в два раза меньше,чем ИК 50(АХЭ) такрина (Cognex) и значительно ниже, чем таковая донепезила (Aricept). Селективность была относительно очень хорошей, выше, чем такрина и сравнимая с таковой донепезила. Пример 49. Данный пример описывает определение константы ингибирования (Ки) соединенияXVI. Оценка кинетики ингибитора может давать важную информацию о природе связи между ферментом и ингибитором, участке или участках связи и количественной эффективности связи, выраженной Ки. Фактически Ки описывает состояние равновесия между свободным ферментом (в конкретном случае АХЭ, из человеческих эритроцитов ЕС 3.1.1.7), ингибитором (в конкретном случае соединение XVI) и комплексом фермент-ингибитор, представляя собой константу диссоциации комплекса ферментингибитор. Определение Ки комплекса АХЭ-соединение XVI проводили с использованием способа LineweaverBurk (Dixon, M., Webb, E.C., Enzymes, Second edition, Chapter VIII, p. 315, Longmans, Green and Co. Ltd,1964, London, UK). Для каждой концентрации соединения XVI оценивали ферментативную активность с колебаниями концентрации субстрата ацетилхолина (111-550 мкМ). Полученные данные о ферментативной активности наносили на график (фиг. 1), показывая каждую концентрацию соединения XVI, обратную скорости, как функцию, обратную концентрации субстрата. Значения градиентов линий, полученных для каждой концентрации ингибитора, затем наносили на график (фиг. 2), как функцию соответствующей концентрации ингибитора. Отсекаемый отрезок на оси Х-координат полученной линии, не проходя через ноль, давал значение Ки, равное 2,6 нМ для соединения XVI. Из анализа графика Lineweaver-Burk (фиг. 1) можно видеть линии с нарастающими градиентами,которые показывают изменения и Vmax и Ки в присутствии ингибитора. Такой характер, возможно, покаb- 17007909 зывает конкурентное ингибирование смешанного типа, которое происходит из достоверного взаимодействия соединения XVI со свободным ферментом, и с ацетилированным ферментом. Из этих результатов похоже, что соединение XVI обладает относительно сильным взаимодействием, не только с активным участком, а также с другим вспомогательным участком, возможно представленным периферическим участком фермента. Следовательно, соединение XVI является относительно сильным, обратимым, быстрым, конкурирующим ингибитором смешанного типа, который главным образом следует кинетикеMichaelis Menten. Пример 50. Соединения в следующей таблице тестировали методом Эллмана (см. пример 48) с рекомбинантной человеческой АХЭ (ЧелАХЭ (HuAChE, EC 3.1.1.7) и БХЭ (из человеческой сыворотки,УС 3.1.1.8). Таблица также показывает данные, имеющие отношение к ингибирующей силе двух контрольных препаратов, такрина и донепезила, тестируемых в тех же самых экспериментальных условиях, и соединений XVI и XII. Среднее двух независимых измерений, повторенных три раза. Пример 51. Данный пример описывает определение эффективности соединения XVI против агрегации амилоида. Так как похоже, что индукция образования фибрилл A АХЭ происходит из-за взаимодействия между периферическим участком фермента и пептида (Inestrosa, N.C.; Alvarez, A.; Perez, С.А.; Moreno,R.D.; Vicente, M. et al. Acetylcholinesterase accelerates assembly of amyloid-beta-peptides into Alzheimer'sfibrils: possible role of the peripheral site of the enzyme. Neurone 1996, vol. 16, pp. 881-891), и так как видимо соединение XVI связывается с этим участком, оценивали способность соединения XVI ингибировать взаимодействие между ферментом и A и, следовательно, блокировать образование фибрилл, индуцированное АХЭ. Для этого использовали флуориметрический метод, который способен выявить способность АХЭ (рекомбинантной человеческой, ЕС 3.1.1.7) усиливать образование фибрилл пептида A (1-40). Сначала A (230 мкМ) инкубировали с ферментом (2,3 мкМ) в молярном соотношении 100:1, при температуре окружающей среды водного фосфатного буфера с рН=8,0, 0,215 М. Для оценки образования фибрилл, индуцируемого АХЭ, инкубированный раствор переносили в 2 мл буфера с рН=8,5, состоящего из гидроксида глицин-натрия (50 мМ), содержащего тиофлавин Т (1,5 мкМ). Тиофлавин Т селективно взаимодействует с фибриллами A в бета конформации, давая характерную флуоресценцию. Интенсивность флуоресценции данного раствора (еm=490 нм) через 300 с, обнаруживали, фиксируя еxc=446 нм. Затем проводили анализ флуоресценции 300 с, для получения стабильного значения флуоресцентного сигнала, из которого вычитали вклад базальной флуоресценции тиофлавина Т. Для получения значения интенсивности флуоресценции, относящейся только к взаимодействию тиофлавина Т с фибриллами амилоида, вычитали вклад сигналов, состоящих из A и АХЭ, инкубируемых отдельно в тех же условиях.- 18007909 Затем после проверки условий агрегации A, индуцированной АХЭ, антиагрегационную эффективность соединения XVI определяли в тех же условиях. Соединение инкубировали вместе с A и АХЭ в условиях, описанных выше. Концентрацию соединения XVI варьировали между 10 и 250 мкМ. В присутствии соединения XVI отмечалось снижение специфического сигнала интенсивности флуоресценции тиофлавина, образующего комплекс с фибриллами A, показывая эффект против агрегации амилоида. Сигнал флуоресценции был прямо пропорционален десятичному логарифму концентрации соединенияXVI. Концентрация соединения XVI, способная снижать сигнал флуоресценции на 50%, была равной 28,3 0,3 мкМ (фиг. 3). Среди других соединений, ингибирующих АХЭ (которыми являются такрин, донепезил, физостигмин, пропидий, декаметоний), тестируемых в описанных условиях, только пропидий показал ингибирующую силу (ИК 50=12,60,3 мкМ) такой же величины, как ингибирующая сила соединения XVI. В этот момент важно подчеркнуть, что пропидий описан как неконкурентный ингибитор АХЭ, способный селективно связываться с периферическим участком фермента (Taylor, P.; Lappi, S. Interaction of fluorescence probes with acetylcholinesterase. The site and specificity of propidium binding. Biochemistry 1975, vol. 14, p. 1989-1997). Следовательно, антиагрегантные свойства соединения XVI подтверждают, что эта молекула способна устанавливать связующие взаимодействия с периферическим участком АХЭ, который имеет высокую афинность к A. Пример 52. Следуя способу, сходному с таковым, описанным в предыдущем примере, экспериментально определили, что соединение XII в концентрации 100 мкМ вызывает ингибирование около 90% агрегации,индуцируемой АХЭ%. Пример 53. Данный пример описывает сравнение между пИК 50 2,5-бис-диамин-[1,4]бензохиноновых производных, представленных общей формулой (I) и известными соединениями, имеющими общую формулу(Соединения, имеющие общую формулу LVI описаны в Melchiorre et al., Acetylcholinerase noncovalent inhibitors based on a polyamine backbone for potential use against Alzheimer's disease, J. Med. Chem. 1998, vol. 41, pp. 4186-4189). Может быть видно из табл. 2, что 2,5-бис-диамин-[1,4]бензохиноновые производные, представленные общей формулой (I), имеют более низкую ИК 50(АХЭ) И более высокую селективность, чем известные соединения, имеющие общую формулу (LVI). Пример 54. Данный пример описывает оценку активности соединения XVI в модели на животных.- 19007909 Тесты in vivo проводили с использованием осуществляемых в последнее время моделей на животных (Ruberti, et al., J. Neurosci. 2000, vol. 20, pp .2589-2601), которые представляют собой фенотипически очень сходные с болезнью Альцгеймера у людей. В частности, модель представляет собой трансгенную мышь, которая экспрессирует антитела к фактору роста нервов (ФРН (NGF и вследствие этого проявляет обширную потерю нейронов в коре головного мозга, образование бляшек амилоидаи клубки внутриклеточных нейрофибрилл, а также дисфункции в поведении. В частности, для получения трансгенной мыши анти-ФРН (AD11) различные участки легких и тяжелых цепей анти-ФРН моноклонального антитела D11 связывали с устойчивыми человеческими участкамии 1 для получения химерного антитела человека/мыши D11, и затем помещали под транскрипционный контроль промотора раннего участка человеческого цитомегаловируса (ЦМВ (CMV. Мышей, зкспрессирующих функциональные анти-ФРН антитела (мыши AD11) получали путем скрещивания мышей, которые экспрессировали легкую цепь (CMV-VK D11) с мышами, которые экспрессировали тяжелую цепь (CMV-VH D11). Мышей AD11 обрабатывали соединением XVI (7 мг/кг в физиологическом растворе) посредством интраперитонеальной инъекции ежедневно в течение 15 дней с возраста 1,5 месяцев до 2 месяцев. Рассматривали две контрольные группы: мыши AD11 того же выводка, получавшие физиологический раствор и нетрансгенные мыши той же породы и того же возраста. Иммуногистохимические исследования проводили, как следует далее. Мышей AD11, которые получали соединение XVI, таковых, получавших физиологический раствор и нетрансгенных мышей анестезировали избыточной дозой хлоралгидрата. Удаляли головной мозг и фиксировали в течение 24 ч в растворе 4% параформальдегида в фосфатном буфере (PBS) и затем защищали от переохлаждения в 30% сахарозе. Венечные сечения базальных отделов переднего мозга и энторинальной коры нарезали толщиной 40 мкм и помещали в 6-луночные планшеты, содержащие 1% параформальдегид в PBS. Следующие первичные антитела использовали для иммуногистохимического анализа: анти-холинацетилтрансферазаZwijnaarde, Belgium) и анти-белок-предшественник амилоида (клон 2.F2.19B4 Chemicon Inc.). После инкубации с первичными антителами, сечения промывали перед добавлением биотинилированного антитела против козьего IgG (1:200, Vector Laboratories, Burlingame, CA) или против мышиного IgG (Dako A/S,Glostrup, Denmark). Стереологический анализ проводили для определения количества холинергических нейронов, положительных по холинацетилтрансферазе (ХАТ (ChAT). Объем базальных отделов переднего мозга рассчитывали с использованием метода Cavalieri, описанного Michel and Cruz-Olive (J. Microsc. 1988, vol. 150, pp. 117-146) и Peterson et al. (J. Comp. Neurol. 1999, vol. 404, pp. 1-20), тогда как оценку общего количества нейронов, положительных по ХАТ получали с использованием метода оптического фракционирования (West M. J., Neurobiol. Aging 1993, vol. 14, pp. 275-285; Peterson D. A., et al., J. Comp. Neurol. 1999,vol. 404, pp. 1-20). Для определения, может ли XVI предотвращать потерю ХАТ-положительных нейронов в базальных отделах переднего мозга и в базальном ядре Мейнерта, соединение вводили ежедневно мышам AD11 при очень ранней стадии нейродегенерации (от 1,5 до 2 месяцев; n=6). Из фиг. 4 А-4 С может быть видно, что лечение оказалось способным предотвратить холинэргический дефицит в базальных отделах переднего мозга; такой же результат определяли из стереологических расчетов, суммированных в графике на фиг. 5. Более того, XVI оказалось эффективным в предотвращении потери холинэргических нейронов в базальном ядре Мейнерта, как показано данными, показанными в графике на фиг. 6. По отношению к другим маркерам БА, исследовали эффект XVI на отложение белка-предшественника амилоида(БПА) и на гиперфосфорилирование тау белка у мышей AD11 2 месяцев. В возрасте 2 месяца отложение БПА в сосудах головного мозга отсутствовало у контрольных мышей (фиг. 7 А), но значительно у мышей AD11 (фиг. 7 В). Отложение БПА в сосудах головного мозга относительно предотвращалось после введения XVI (фиг. 7 С). Из сравнения фиг. 7 А, 7 В и 7 С может быть выведено, что соединение XVI способно значительно снижать цереброваскулярное отложение БПА после введения в течение 15 дней. Для определения, может ли соединение XVI предотвратить или устранить гиперфосфорилирование тау в коре, проводили иммуногистохимическое исследование на срезах, полученных от леченных мышей AD11 2 месяцев и мышей, получавших только растворитель. Тогда как у контрольных мышей не проявлялся гиперфосфорилированный тау в соматодендритическом отделе клетки (фиг. 8 А),нелеченные животные AD11 или получавшие растворитель, проявляли интенсивную окраску в теле нейрона (фиг. 4 В). Гиперфосфорилирование тау частично предотвращалось после введения XVI (фиг. 4 С). В заключение экспериментальных тестов, проводимых in vivo в трансгенной модели БА, может быть сказано, что соединения по изобретению имеют профиль активности, сходный с восстановлением холинэргического функционирования (повышение ХАТ-положительных нейронов) и снижением маркеров БА (снижение цереброваскулярного отложения БПА и гиперфосфорилирования тау). Пример 55. Данный пример описывает дальнейшие оценки активности in vivo соединения XVI в модели на животных.- 20007909 Дозы и средства введения Соединение XVI растворяли в этаноле в дозе в 50 раз более концентрированной, чем таковая для введения животному и затем разводили в физиологическом растворе, для интраперитонеальных инъекций, или в воде, для перорального введения. Для исследования эффективности после перорального введения, соединение XVI вводили мышамAD11 в возрасте 15 месяцев в дозе 7 мг/кг/день. Для анализа эффективности соединения XVI в лечении когнитивного дефицита у мышей AD11 в возрасте 6 и 12 месяцев и предотвращении амнезии, индуцированной скополамином (Weiss В., Heller A.Methodological problems in evaluating the role of cholinergic mechanisms in behavior. Fed Proc. 28, 135-146,1969) использовали дозу 15 мг/кг/день, вводимую в течение 15 дней. В возрасте 2 и 6 месяцев способность соединения XVI улучшать фенотип Альцгеймера у мышейAD11 сравнивали с таковой других ингибиторов АХЭ и ФРН. Мыши получали ежедневные инъекции соединения XVI в дозе 7 мг/кг. Только в случае проведения поведенческого анализа они получали дозу 15 мг/кг/день перорально. Такрин вводили путем интраперитонеальной инъекции в дозе (0,1 и 3,5 мг/кг/день) с возраста 1,5 месяцев в течение 15 дней, тогда как галантамин вводили путем интраперитонеальной инъекции в течение такого же периода и с возраста 6 месяцев. Более того, его вводили в течение 4 месяцев с возраста 2 месяца перорально (3,5 мг/кг/день). Во всех экспериментах контрольными мышами являлись подобранные по возрасту нетрансгенные мыши, подобранные по возрасту мыши AD11, которым вводили физиологический раствор посредством интраперитонеальной инъекции или воду, содержащую такое же процентное содержание этанола, присутствующее в растворе соединения XVI. Гистология и нейростереология В конце лечения мышей анестезировали 8 мкл/г хлоралгидрата. Головной мозг удаляли и помещали в ледяные чашки Петри. Головной мозг фиксировали в 4% параформальдегиде в фосфатном буфере в течение 24 ч и затем защищали от переохлаждения в растворе 30% сахарозы в фосфатном буфере. Венечные сечения головного мозга получали при помощи скользящего замораживающего микротома. Серийные срезы помещали в раствор 1% параформальдегида в фосфатном буфере. Для оценки эффектов на морфологические изменения, сечения инкубировали со следующими первичными антителами против холинацетилтрансферазы (анти-ХАТ; Chemicon), белка-предшественника амилоида БПА (Chemicon), фосфорилированной фракции тау белка (клон АТ 8; Innogenetics), N-концу амилоида (Santa Cruz). Нейростереологический количественный анализ проводили на базальных отделах переднего мозга и энторинальной коре с использованием метода оптического фракционирования (West M.J., NeurobiolL.M. J. Microsc. 150, 117-136, 1988). Плотность внеклеточных отложений БПА рассчитывали в соответствии со способом, используемымSchenk (Schenk D., Nature 400, 173-177, 1999), в котором процент области коры, занятой внеклеточными отложениями рассчитывали в отношении к общей области энторинальной коры. Количество кластеров -амилоид позитивных клеток рассчитывали в каудальной части гиппокампа с использованием метода оптического фракционирования. Тест идентификации объекта Эффективность соединения XVI в помощи от нарушений поведения у мышей AD11 анализировали с использованием теста идентификации объекта. Анализ состоял из исследования способности различения между новым объектом и знакомым (Bartus, R.T. On neurodegenerative disease, models, and treatmentstrategies: lessons learned and lessons forgotten a generation following the cholinergic hypothesis. Exp Neurol 163, 495-529, 2000). Мыши AD11 показали прогрессивное снижение такой способности отличать новый объект от старых (Capsoni, S., Ugolini, G., Comparini, A., Ruberti, F., Berardi, N.Cattaneo, A., A. Alzheimer-like neurodegeneration in antinerve growth factor transgenic mice. Proc. Natl. Acad. Sci. USA 97, 68266831, 2000). Перед началом исследования мыши в возрасте 6 и 12 месяцев получали лечение соединением XVI в течение 15 дней в дозе 15/мг/кг/день перорально. Контрольными служили подобранные по возрасту нетрансгенные мыши и трансгенные мыши AD11, получавшие воду и такой же процент этанола (2%). Когнитивные нарушения также индуцировали в группе 2-месячных нетрансгенных мышей путем подкожного введения 0,5 мг/кг скополамина, антагониста мускариновых рецепторов (Weiss В., Heller A.Methodological problems in evaluating the role of cholinergic mechanisms in behavior. Fed Proc 28, 135-146,1969). Вторая группа животных получала соединение XVI (перорально, 15 мг/кг) за 20 мин до инъекции скополамина. Третью группу нетрансгенных мышей формировали из нетрансгенных мышей, не получавших лечение. Эффективность галантамина в предотвращении поведенческого дефицита у мышей AD11 анализировали после перорального введения 3,5 мг/кг/день, начиная с возраста 2 месяцев до возраста 6 месяцев.- 21007909 Для проведения эксперимента мышей помещали в коробку, сделанную из органического стекла(60 х 60 х 60 см). Стенки и пол коробки покрывали светонепроницаемым, моющимся материалом. Коробка и объекты, используемые в данном тесте, также были моющимися. Коробку и объекты очищали между исследованиями для предотвращения формирования обонятельных знаков. Мыши получали 3 сеанса продолжительностью 10 мин в пустой коробке для возможности познакомиться с прибором. В течение теста, каждую мышь помещали обратно в коробку и показывали два идентичных объекта (объект А 1 и А 2, например, 2 кубика 12 см шириной) в течение 10 мин. Экспериментатор измерял общее время, понадобившееся для изучения каждого из двух объектов. Затем мышь возвращали в клетку. В течение интервала 1 мин,1 ч и 24 ч, объекты удаляли из коробки и один из двух заменяли его идентичной копией (A3), тогда как другой заменяли совершенно новым объектом (объект В). После отсрочки 1 мин, 1 ч и 24 ч мышь помещали обратно в коробку и показывали знакомый объект A3 и новый объект В в течение 10 мин. Объекты помещали в те же расположения, что и предыдущие. Экспериментатор снова измерял общее время, потребовавшееся для изучения каждого из двух объектов. Время исследования функционально определяли как время, в течение которого мышь непосредственно занималась объектом головой, на расстоянии не более чем 2 см от объекта. Индекс дискриминации рассчитывали, используя формулу (N-F/N+F), где N представляет собой время, потраченное на исследование нового объекта, и F - время, потраченное на знакомый объект. Результаты(а) Эффективность блокирования холинергического дефицита, фосфорилирования тау и агрегации-амилоида у взрослых мышей AD11 после перорального введения. Нейродегенерация у мышей AD11 ухудшается с возрастом и полностью разворачивается в возрасте 15 месяцев. В этом возрасте в головном мозге мышей AD11 можно наблюдать следующее: смерть нейронов, холинергический дефицит (Melchiorre, С., Andrisano, V., Bolognesi, M.L., Budriesi, R., Cavalli, A.,Cavrini, V., Rosini, M., Tumiatti, V.Recanatini, M. Acetylcholinesterase noncovalent inhibitors based on apolyamine backbone for potential use against Alzheimer's disease. J. Med. Chem. 41, 4186-4189, 1998; Selkoe,D.J. Alzheimer's disease: genes, proteins, and therapy. Physiol Rev 81, 741-766, 2001), присутствие внеклеточных -амилоидных бляшек (Inestrosa, N.C., Alvarez A., Perez C.A., Moreno R.D., Vicente M., Linker C.,Casanueva O.I., Soto C., Garrido J.Acetylcholinesterase accelerates assembly of amyloid-beta-peptides into Alzheimer's fibrils: possible role of the peripheral site of the enzyme. Neuron 16, 881-91, 1996), дистрофические невриты и внутриклеточные клубки, состоящие из гиперфосфорилированной формы тау-белка. Соединение XVI вводили перорально в дозе 7 мг/кг день в течение 1 месяца мышам AD11 в возрасте 15 месяцев (n=6, n представляет собой число используемых мышей). Лечение определяли как улучшение в количестве холинэргических нейронов в базальных отделах переднего мозга (фиг. 9). Внутриклеточное накопление гиперфосфорилированного тау снижалось у мышей, получавших соединение XVI (фиг. 10 С) по сравнению с мышами, получавшими плацебо (фиг. 10 В). Количество клеток,содержащих фосфорилированный тау в соматодендритическом отделе было приблизительно таким же,как таковое у нетрансгенных мышей, подобранных по возрасту (фиг. 10 А). Введение соединения XVI определяло снижение количества -амилоидных бляшек у мышей AD11(фиг. 11 С) по сравнению с мышами, получавшими плацебо). Хотя количество бляшек не достигало уровня, который можно наблюдать у нетрансгенных мышей, подобранных по возрасту (фиг. 11 А), морфология бляшек отличалась от таковой, наблюдаемой у мышей, получавших плацебо: количество клеток, связанных с бляшками у мышей, получавших соединение XVI (фиг. 11 С) было меньше, чем у мышей, получавших плацебо (фиг. 11 В). В заключение, описанные результаты демонстрируют, что: соединение XVI является активным даже после перорального введения и что соединение XVI способно улучшать нейродегенерацию также у взрослых мышей, у которых патология полностью развилась и в развернутой стадии.(b) Эффекты соединения XVI на поведенческий дефицит у мышей AD11 и у мышей, получавших скополамин. Эффективность соединения XVI в лечении поведенческого дефицита у мышей AD11 анализировали с использованием теста узнавания объекта. Анализ состоял из исследования способности различать между новыми и знакомыми объектами (Bartus, R.T. On neurodegenerative disease, models, and treatment strategies: lessons learned and lessons forgotten a generation following the cholinergic hypothesis. Exp. Neurol. 163,495-529, 2000). Мыши AD11 проявляли прогрессивное снижение в этой способности отличать новые объекты от таковых, уже изученных (Selkoe, D.J. Alzheimer's disease: genes, proteins, and therapy. Physiol.Rev. 81, 741-766, 2001). Введение соединения XVI (15 мг/кг/день перорально) позволяло улучшить дефицит у мышей AD11 в возрасте 6 месяцев (n=10, фиг. 12) и 12 месяцев (n=8; фиг. 13). Тот же самый тест проводили у нетрансгенных мышей, получавших соединение XVI за 20 мин перед введением скополамина. У мышей, получавших соединение XVI, не развились какие-либо признаки амнезии, и они были способны отличать знакомые объекты от новых (фиг. 14).- 22007909 В заключение соединение XVI способно облегчать когнитивный дефицит, определяемый лишением ФРН у трансгенных мышей и путем введения скополамина нетрансгенным мышам.(c) Эффекты введения соединения XVI мышам AD11 по сравнению с эффектами других ингибиторов АХЭ. Соединение XVI, галантамин и такрин вводили ежедневно мышам AD11. Лекарственные средства вводили перорально (соединение XVI и галантамин) или посредством интраперитонеальной инъекции(соединение XVI, галантамин и такрин). Их вводили, начиная с возраста 1,5 месяцев до возраста 2 месяцев. Лечение соединением XVI и галантамином предотвращало снижение количества холинэргических нейронов в базальных отделах переднего мозга, тогда как такрин ухудшал холинэргический дефицит(фиг. 15). Соединение XVI, галантамин и капроктамин также вводили мышам в возрасте с 6 месяцев в течение 15 дней. Тогда как соединение XVI и галантамин оказались способны предотвращать холинэргический дефицит в базальных отделах переднего мозга, капроктамин не оказывал эффекта на количество холинэргических нейронов (фиг. 16). После лечения соединением XVI в течение 15 дней, начиная с возраста 1,5 месяцев или 6 месяцев,соединение XVI снижало количество нейронов, меченных антителами против фосфо-тау (фиг. 17 и 18). Галантамин (фиг. 17 и 18) и капроктамин (фиг. 18) были неэффективными. У 6-месячных мышей AD11 введение соединения XVI и галантамина снижало внеклеточное отложение БПА, тогда как капроктамин был неэффективным (фиг. 19). Лечение соединением XVI, начиная с возраста 6 месяцев, оказалось способным снижать количество клеток, накапливающих -амилоидный белок в гиппокампе мышей AD11. Такой же результат получили с использованием галантамина, тогда как капроктамин был неэффективным (фиг. 20). Введение соединения XVI в течение 2 недель с возраста 6 месяцев определяло заметное улучшение поведенческого дефицита, что проявлялось также при галантамине (фиг 21). В заключение, соединение XVI является таким же эффективным как галантамин, но сильнее его в обращении аспекта нейродегенерации, связанной с гиперфосфорилированием тау. Капроктамин оказался неэффективным против всех аспектов нейродегенерации Альцгеймера. Обратите внимание также, что в приложенных чертежах данные, обозначенныепредставляют Р 0,05. Пример 56. Тестировали антиоксидантную эффективность XVI, выражаемую как способность улавливать радикалы кислорода, с использованием набора Randox Laboratories LTD (UK) (общее антиоксидантное состояние) [Rice-Evans С. and Miller N.J. Total antioxidant status in plasma and body fluids, MethodsEnzymol. 234 (1994) 279-293], после соответствующей экспериментальной модификации. Метод, используемый для оценки способности нейтрализовывать свободные радикалы, является колориметрическим методом. Он основан на реакционной способности соединения пероксидазы, метмиоглобина (6,1 мкМ) (HXFe3+), который в присутствии перекиси водорода (250 мкМ) в водном буфере с физиологическим уровнем рН, стимулирует образование радикалов кислорода, которые образуют комплексы в форме ферримиоглобина (Х- [Fe4+=O]). Ферримиоглобин забирает электрон от катиона(ABTS) (2,2'-азино-ди-[3-этилбензтиазолин сульфонат]) (610 мкМ), превращаясь обратно в метмиоглобин и преобразуя ABTS в окрашенный радикал, определяемый при 600 нм. Захват свободных радикалов кислорода антиоксидантом, присутствующим в растворе, уменьшает образование окрашенных образцов и соответствующее поглощение при 600 нм в фиксированное время. В качестве контрольного антиоксиданта, способного ингибировать хромогенную реакцию образом,зависящим от концентрации, использовали водорастворимое производное витамина Е, тролокс (6 гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота). Основа состоит из фосфатного буфера (80 мМ, рН 7,4), метмиоглобина и ABTS, инкубируемых при 37 С, контроль содержит, кроме того, тролокс, тогда как образец содержит, кроме того, соединениеXVI. Субстрат Н 2 О 2 добавляли в каждый образец и смотрели поглощение при 600 нм в фиксированные моменты времени (t0 и через 3 мин). Процент потери окраски основы мог использоваться как указатель антиоксидантной активности тестируемого образца.% ингибирования = Abcwhite - Abctest/Abcwhite x 100. Были получены следующие данные: Среднее двух независимых измерений, повторенных три раза Модификация указанного метода подразумевает добавление человеческого альбумина сыворотки(25 мкМ) в образец, содержащий соединение XVI для улучшения его растворения и его соответствую- 23007909 щей чистоты. В описанной системе соединение XVI продемонстрировало антиоксидантную активность (захват свободных радикалов), так как оно ингибировало образование окрашенных видов радикалов. Антиоксидантная эффективность соединения приблизительно в 6 раз меньше, чем тролокса. Однако необходимо подчеркнуть, что соединение XVI тестировали в окисленной хиноновой форме, которая in vivo в контакте с ферментными восстанавливающими системами может быть преобразована в более активную гидрохиноновую восстановленную форму. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) где R1 представляет собой заместитель, выбранный из группы, включающей водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одного-пяти атомов углерода, и заместитель, обладающий электроноакцепторным индукционным свойством;R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-5 атомами углерода; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из 1-5 атомов углерода,ОМе и-NH-; Т представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный от 1 до 4 атомами углерода;Z представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный двумя-тринадцатью атомами углерода. 2. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей водород,заместитель, обладающий электроноакцепторным индукционным свойством. 3. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей водород,галоген,NO2 и МеО;R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-4 атомами углерода; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из 1-5 атомов углерода,Т представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, пред- 24007909 ставленный 1-3 атомами углерода;Z представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный 2-12 атомами углерода. 4. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.1, где R1 представляет собой заместитель, выбранный из группы, включающей водород,галоген,MeO;R2 и R3, каждый независимо от другого, представляют собой водород или насыщенную или ненасыщенную, линейную или разветвленную алкильную группу, представленную 1-2 атомами углерода; R4 и R5, каждый, независимо от другого, представляют собой заместитель, выбранный из группы, включающей водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одногочетырех атомов углерода,X представляет собой радикал -НС=СН- или радикал -O-; Т представляет собой радикал -CH2-; иZ представляет собой насыщенный или ненасыщенный, линейный или разветвленный алкил, представленный двумя-семью атомами углерода. 5. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по п.3, где R3 представляет собой водород; R4 и R5, каждый независимо от другого, представляет собой заместитель, выбранный из группы, включающей водород,насыщенную или ненасыщенную, линейную или разветвленную алкильную группу из одного-пяти атомов углерода,разветвленную алкильную группу из 3-4 атомов углерода,Z представляет собой насыщенный линейный алкил, представленный 2-7 атомами углерода. 6. 2,5-бис-Диамин-[1,4]бензохиноновое производное общей формулы (I) по одному из пп.1-4, где R1 находится в положении 2 по отношению к Т. 7. 2,5-бис-Диамин-[1,4]бензохиноновое производное, имеющее общую формулу (I) по одному из пп.1-5, где Z представляет собой насыщенную линейную алкильную группу, представленную 2-7 атомами углерода. 8. 2,5-бис-6-[Этил-(2-метоксибензил)амино]гексиламино-[1,4]бензохинон (XVI). 9. 2,5-бис-3-[Этил-(2-метоксибензил)амино]пропиламино-[1,4]бензохинон (XII). 10. 2,5-бис-[6-(Бензилэтиламино)гексиламино]-[1,4]бензохинон (XVII). 11. 2,5-бис-6-[Этил-(3-метоксибензил)амино]гексиламино-[1,4]бензохинон (XXXIII). 12. 2,5-бис-6-[Этил-(4-метоксибензил)амино]гексиламино-[1,4]бензохинон (XXXVII). 13. 2,5-бис-2-[Этил-(2-метоксибензил)амино]этиламино-[1,4]бензохинон (XLV). 14. 2,5-бис-7-[Этил-(2-метоксибензил)амино]гептиламино-[1,4]бензохинон (IL). 15. 2,5-бис-6-[(2-Метоксибензил)метиламино]гексиламино-[1,4]бензохинон (LIV). 16. 2,5-бис-6-[Этил-(2-метоксибензил)амино]гексиламино-3,6-диметил-[1,4]бензохинон (LV). 17. 2,5-бис-[6-(2-Метоксибензиламино)гексиламино]-[1,4]бензохинон (LI). 18. 2,5-бис-[6-(Этилфуран-2-илметиламино)гексиламино]-[1,4]бензохинон (XLI). 19. 2,5-бис-6-[Этил-(2-нитробензил)амино]гексиламино-[1,4]бензохинон (XXIX). 20. 2,5-бис-6-[Этил-(2-хлорбензил)амино]гексиламино-[1,4]бензохинон (XVIII). 21. Лекарственное средство, включающее 2,5-бис-диамин-[1,4]бензохиноновое производное по одному из пп.1-20. 22. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 в качестве лекарственного средства. 23. Фармацевтический препарат, характеризующийся тем, что он включает 2,5-бис-диамин-[1,4] бензохиноновое производное по одному из пп.1-20, или одну из его фармацевтически приемлемых солей и фармацевтически приемлемое вспомогательное вещество и/или растворитель. 24. Способ получения 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20,который включает стадию нуклеофильного замещения, где п-бензохинон, имеющий общую формулу- 25007909 подвергают реакции замещения с первым промежуточным соединением, имеющим общую формулу с получением 2,5-бис-диамин-[1,4]бензохинонового производного общей формулы (I). 25. Способ по п.24, включающий фазу гидролиза, в которой второе промежуточное соединение общей формулы (VI) где D представляет собой Bn или другую защитную группу, которая преимущественно является стабильной в основной среде, гидролизуют с получением указанного первого промежуточного соединения общей формулы (VII). 26. Способ по п.25, включающий дополнительную стадию, в которой третье промежуточное соединение общей формулы (IV) подвергают взаимодействию в присутствии основания с соединением общей формулы (V)(R2)fA,где А представляет собой группу, притягивающую электроны, f равно 1 или 2, с целью получения второго указанного промежуточного соединения общей формулы (VI). 27. Способ по п.26, включающий вторую дополнительную фазу, в которой защищенную (аминоалкил)карбамовую кислоту общей формулы (II) добавляют к соединению общей формулы (III)I; с получением указанного третьего промежуточного соединения общей формулы (IV); при условии,что, когда Е представляет собой =O, способ включает стадию восстановления с получением указанного третьего промежуточного соединения общей формулы (IV). 28. Промежуточное соединение общей формулы (VII) по п.24. 29. Соединение общей формулы (VI) по п.25. 30. Соединение общей формулы (IV) по п.24. 31. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения болезни Альцгеймера у млекопитающих. 32. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения патологий, характеризующихся отложениями амилоидного белка (A) у млекопитающих.- 26007909 33. Применение 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20 для получения фармацевтического препарата для лечения дегенеративных патологий нервной системы у млекопитающих. 34. Способ лечения болезни Альцгеймера у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20. 35. Способ лечения заболевания патологии, характеризующейся отложениями -амилоидного белка(A) у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4]бензохинонового производного по одному из пп.1-20. 36. Способ лечения дегенеративной патологии нервной системы у млекопитающих, который включает введение указанному млекопитающему эффективного количества 2,5-бис-диамин-[1,4] бензохинонового производного по одному из пп.1-20.
МПК / Метки
МПК: C07C 225/28, C07C 221/00, A61P 25/28
Метки: промежуточные, лечения, альцгеймера, производные, способ, болезни, бензохиноновые, получения, 2,5-бис-диамин, продукты
Код ссылки
<a href="https://eas.patents.su/30-7909-25-bis-diamin-14-benzohinonovye-proizvodnye-dlya-lecheniya-bolezni-alcgejjmera-sposob-ih-polucheniya-i-promezhutochnye-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">2,5-бис-диамин-[ 1,4 ] бензохиноновые производные для лечения болезни альцгеймера, способ их получения и промежуточные продукты</a>
Предыдущий патент: Карбониламинопроизводные как новые ингибиторы гистондеацетилазы
Следующий патент: Непрерывный способ полимеризации сложных полиэфиров в твердой фазе
Случайный патент: Cпособ исторического согласования имитационной модели с использованием самоорганизующихся карт для генерации областей в имитационной модели












