Циклические конструкты натрийуретических пептидов
Номер патента: 16804
Опубликовано: 30.07.2012
Авторы: Бастос Маргарита, Ян Вэй, Цай Хуэй-Чжи, Шарама Шабх Д.
Формула / Реферат
1. Циклический конструкт формулы V

где Ааа2 и Ааа13 одинаковы или различны и каждый из них представляет собой аминокислотный остаток, образующий циклический мостик посредством боковых цепей каждого из Ааа2 и Ааа13, где R1 образует часть боковой цепи каждого из фрагментов Ааа2 и Ааа13;
Ааа3 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей His, Ala, Ser, Thr, Lys, HLys, Orn, Cys, HCys, Dap или Dab, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей His, Ala, Ser, Thr, Lys, HLys, Orn, Cys, HCys, Dap или Dab, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа4 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные Phe, HPhe или Pgl или Tyr, Leu, Ile, Val, Ala, Nle, Nva или Tle, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные Phe, HPhe или Pgl или Tyr, Leu, Ile, Val, Ala, Nle, Nva или Tle, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа5 - Gly, Sar, L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ala или Aib;
Ааа6 - Gly, Sar, L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ala или Aib;
Ааа7 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, HSer, Thr, Lys, HLys, Orn, Cys, HCys, Cit, Abu, Dap или Dab, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, HSer, Thr, Lys, HLys, Orn, Cys, HCys, Cit, Abu, Dap или Dab, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа8 - Gly, L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Met(O), Met(O2) или Tle, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Met(O), Met(O2) или Tle, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа9 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Asp, Glu, His, Ala, Ser, Thr, Lys, HLys, Cys, HCys, Met(O), Met(O2), Orn, Dap или Dab, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Asp, Glu, His, Ala, Ser, Thr, Lys, HLys, Cys, HCys, Met(O), Met(O2), Orn, Dap или Dab, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа10 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, Thr, Lys, HLys, Cys, HCys, Cit, Met(O), Orn, Dap или Dab, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, Thr, Lys, HLys, Cys, HCys, Met(O), Orn, Dap или Dab, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа11 - Gly или L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Cys, HCys, Abu или Tle, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Cys, HCys, Abu или Tle, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа12 - Gly, L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ser, Nle, Ile, Leu, Val, Phe, Ala, Nva, Arg, Lys, Orn, Cys, HCys, Abu или Tle, или α,α-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Ser, Nle, Ile, Leu, Val, Phe, Ala, Nva, Arg, Lys, Orn, Cys, HCys, Abu или Tle, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
Ааа14 - L- или D-изомер α-аминокислоты или β-аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные Phe, HPhe или Pgl или Tyr, Leu, Ile, Val, Ala, Lys, Orn, Nle, Nva или Tle, или α,α-дизамещенной аминокислоты, являющейся производным замещенного или незамещенного Phe, HPhe или Pgl или Tyr, Leu, Ile, Val, Ala, Lys, Orn, Nle, Nva или Tle, включая все (R)- или (S)-конфигурации α,α-дизамещенных аминокислот, где заместители различны;
R1 - -S-S-, -S-CH2-S-, -S-CH2-, -CH2-S-, -C(=O)-NH-, -NH-C(=O)-, -CH2-NH-, -NH-CH2-, -CH2-S(O)n-, где n - 1 или 2, -S(O)n-CH2-, где n - 1 или 2, -CH2-CH2-, -CH=CH- (Е или Z), -СºС-, -С(=О)-О-, -О-С(=О)-, -С(=О)-СН2-,
-СН2-С(=О)-, -O-C(=O)-NH-, -NH-C(=O)-O- или -NH-C(=O)-NH-;
х - в каждом случае независимо 1 или 2 и
R4 - ОН или NH2.
2. Циклический конструкт по п.1, который представляет собой циклический конструкт формулы VI
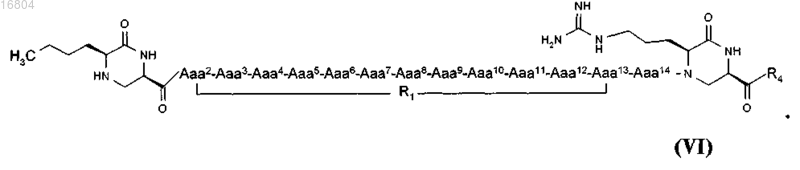
3. Циклический конструкт по п.1, который представляет собой циклический конструкт формулы VII, X, XI или XII

4. Циклический конструкт формул VIII или IX
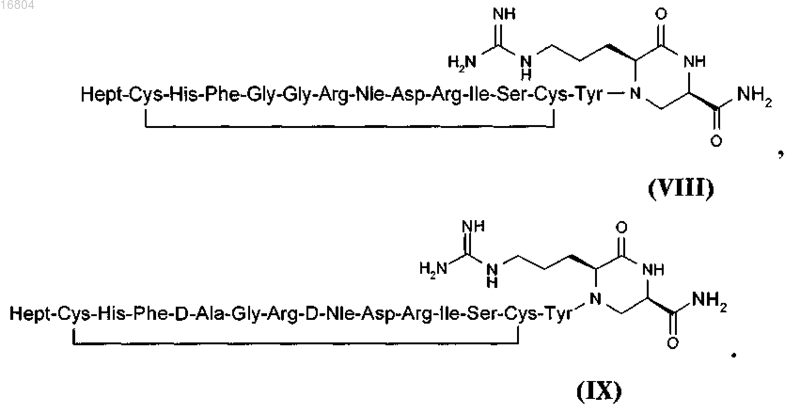
5. Фармацевтическая композиция, содержащая циклический конструкт по одному из пп.1-4 или фармацевтически приемлемую соль этого соединения и фармацевтически приемлемый носитель.
6. Применение соединения по любому из пп.1-4 или фармацевтически приемлемой соли этого соединения для изготовления лекарственного средства, пригодного для лечения или профилактики заболевания, опосредованного рецептором натрийуретического пептида, у пациента, который нуждается в этом.
7. Фармацевтическая композиция, содержащая циклический конструкт формулы IX

или фармацевтически приемлемую соль этого соединения и фармацевтически приемлемый носитель.
Текст
ЦИКЛИЧЕСКИЕ КОНСТРУКТЫ НАТРИЙУРЕТИЧЕСКИХ ПЕПТИДОВ Предметом изобретения является циклический конструкт формулы VR4 соответствуют определениям в формуле изобретения, а также фармацевтические композиции,содержащие такие циклические конструкты, и их применение для изготовления лекарственного средства, пригодного для лечения или профилактики заболевания, опосредованного рецептором натрийуретического пептида. 016804 Перекрестные ссылки на родственные заявки Настоящая заявка претендует на приоритет по предварительной заявке 60/743960 на патент США под названием "Циклические конструкты натрийуретических пептидов (Cyclic Natriuretic PeptideConstructs)", поданной 30 марта 2006 г., и по предварительной заявке 60/743961 на патент США под названием "Циклические конструкты натрийуретических пептидов с модулирующими группами (CyclicNatriuretic Peptide Constructs with Prosthetic Groups)", поданной 30 марта 2006 г., и описания изобретений и формулы изобретений каждой их этих заявок включены в настоящую заявку посредством ссылок. Одновременно с настоящей заявкой подается родственная международная заявка PCT/US 07/65632 под названием "Суррогаты аминокислот для пептидных конструктов (Amino Acid Surrogates for PeptidicConstructs)", номер дела патентного поверенного 0307-043-РСТ, и описание изобретения и формула изобретения из этой заявки включены в настоящую заявку посредством ссылок. Предпосылки создания изобретения Область, к которой относится изобретение (область техники) Настоящее изобретение относится к циклическим конструктам натрийуретических пептидов, содержащим множество аминокислотных остатков, один или несколько циклосодержащих суррогатов аминокислот и факультативно одну или несколько модулирующих групп, причем упомянутые конструкты связывают рецептор натрийуретического пептида и могут быть применены для лечебных целей. Уровень техники Натрийуретическая пептидная система широко исследовалась с момента идентификации аминокислотной последовательности и генной структуры человеческого предсердного натрийуретического пептида (ANP) в 1984 г. ANP иногда называется также "ANF", или предсердный натрийуретический фактор.ANP является частью натрийуретической пептидной системы, которая в человеческом организме включает ген ANP, который в результате различий в посттрансляционных процессах образует как ANP, так и уродилатин - ген, который продуцирует BNP, или мозговой натрийуретический пептид, и ген, продуцирующий CNP, или натрийуретический пептид типа с. ANP, уродилатин, BNP и CNP являются циклическими структурами, содержащими цикл из 17 аминокислот, образованный с участием цистеинцистеиновой дисульфидной связи. Аминокислотная последовательность и структура человеческого ANP(hANP) показаны на фиг. 1. ANP, уродилатин, BNP и CNP являются близкими аналогами, отличающимися некоторыми пятью или шестью аминокислотами в цикле, хотя их N- и С-концевые цепи существенно отличаются друг от друга. Каждый из ANP, BNP и CNP специфичен относительно различных рецепторов - рецепторов натрийуретических пептидов А, В и С (NPRA, NPRB и NPRC). NPRA и NPRB связаны с гуанилилциклазами, a NPRC является рецептором клиренса, связанным с G-протеином. ANP, BNP и CNP являются главными эндогенными натрийуретическими пептидами млекопитающих, идентифицированными к настоящему времени. Однако существует множество натрийуретических пептидов, не продуцируемых в организмах млекопитающих, которые идентифицированы и могут использоваться в терапевтических целях для лечения млекопитающих. К ним относятся натрийуретический или сердечный пептид лосося (sCP),желудочковый натрийуретический пептид (VNP), сердечный натрийуретический пептид, идентифицированный в организмах угрей и различных рыб, натрийуретический пептид дендроасписа (DNP), натрийуретический пептид, идентифицированный в яде мамбы, и три пептида, аналогичных натрийуретикам(TNP-a, TNP-b и TNP-c), выделенные из яда тайпана. Общие сведения см. в работах Тервонена и др.(Tervonen V., Ruskoaho H., Lecklin Т., Ilves M., Vuolteenaho О. "Сердечный натрийуретический пептид лосося как гормон, регулирующий объем" (Salmon cardiac natriuretic peptide is a volume-regulating hormone), Am. J. Physiol. Endocrinol. Metab. 283:E353-361 (2002; Такео и др. (Takei Y., Fukuzawa A., ItaharaY., Watanabe T.X., Yoshizawa Kumagaye K., Nakajima K., Yasuda A., Smith M.P., Duff D.W., Olson K.R.,"Новый натрийуретический пептид, выделенный из предсердий форели Oncorhynchus mykiss (A newnatriuretic peptide isolated from cardiac atria of trout, Oncorhynchus mykiss), FEBS Lett. 414:377-380 (1997; Швайца и др. (Schweitz H., Vigne P., Moinier D., Frelin C, Lazdunski M. "Новый член семейства натрийуретических пептидов, присутствующий в яде зеленой мамбы (Dendroaspis angusticeps) (A new member ofChem. 267:13928-13932 (1992; Лизи и др. (Lisy O., Jougasaki M., Heublein D.M., Schirger J.A., Chen H.H.,Wennberg P.W., Burnett J.C. "Почечное действие синтетического натрийуретического пептида дендроасписа" (Renal actions of synthetic dendroaspis natriuretic peptide), Kidney Int. 56:502-508 (1999; и Фрая и др.(Fry B.G., Wickramaratana J.C, Lemme S., Beuve A., Garbers D., Hodgson W.C., Alewood P. "Новые натрийуретические пептиды из яда змеи Тайпан (Oxyuranus microlepidotus): выделение, химическая и биологическая идентификация" (Novel natriuretic peptides from the venom of the inland (Oxyuranus microlepidotus):ANP эндогенно секретируется преимущественно как реакция на повышенное предсердное давление, однако эндогенной секреции могут способствовать другие факторы, в том числе стимуляция рецепторов цитокинов. Выделенный ANP является гормональным регулятором кровяного давления, гомеостаза натрия и жидкости, обеспечивает сосудорасширяющие эффекты, влияет на сердечно-сосудистую коррекцию и т.п. Таким образом, ANP, в том числе эндогенный ANP, является эффективным лечебным-1 016804 средством при застойной сердечной недостаточности и других сердечно-сосудистых заболеваниях, отчасти вследствие обеспечения защиты от хронического активированного состояния ренин-ангиотензинальдостероновой системы. Циркулирующий ANP быстро удаляется из кровотока под действием двух механизмов: связывания с рецепторами натрийуретического пептида и ферментной деградации. Человеческий ANP упоминается также под названиями "человеческий ANP природного типа",hANP, ANP(l-28) и ANP(99-126) (последнее обозначение относится к соответствующей последовательности в пределах proANP(1-126), который в процессе секреции нормально расщепляется по связи Arg98Ser99 в С-концевой области). Ниже человеческий ANP иногда будет обозначаться как hANP. В общем, считается, что натрийуретические пептиды и их варианты полезны при лечении застойной сердечной недостаточности, почечной гипертензии, острой почечной недостаточности и аналогичных патологических состояний, а также любых состояний, заболеваний или синдромов, при которых диуретическая, натрийуретическая и/или сосудорасширяющая реакция может оказать терапевтическое или профилактическое действие. Обзорной статьей, описывающей натрийуретические пептиды, в том числе ANP, и применение натрийуретических пептидных систем при сердечной недостаточности, является работа Шмитт и др. "Модулирование натрийуретической пептидной системы при сердечной недостаточности" (Schmitt M., Cockcroft J.R., Frenneaux M.P. Modulation of the natriuretic peptide system in heartfailure: from bench to bedside Clinical Science 105:141-160 (2003. Получены многочисленные имитаторы и вариации ANP; некоторые из них имеют молекулы значительно меньшего размера по сравнению с ANP. Одной из версий ANP, имеющих меньший размер молекулы, но являющихся биологически активными, является 15-мерный циклический дисульфидный пептид(1995). Этот 15-мерный пептид обычно обозначается как "мини-ANP". Известны многочисленные патенты и патентные заявки на различные синтетические имитаторы натрийуретических пептидов, где утверждается их преимущество по сравнению с натрийуретическими пептидами природного типа по одному или нескольким признакам. К ним относятся конструкты, описанные в следующих патентах США:4496544; 4609725; 4656158; 4673732; 4716147; 4757048; 4764504; 4804650; 4816443; 4824937; 4861755; 4904763; 4935492; 4952561; 5047397; 5057495; 5057603; 5091366; 5095004; 5106834; 5114923; 5159061; 5204328; 5212286; 5352587; 5376635; 5418219; 5665704; 5846932; 5583108; 5965533; 6028055; 6083982; 6124430; 6150402; 6407211; 6525022; 6586396 и 6818619; и в следующих опубликованных заявках на патенты США:2004/0002458; 2004/0063630; 2004/0077537; 2005/0113286; 2005/0176641; 2006/0030004. Кроме того, конструкты описаны в различных патентах и патентных заявках других стран, в том числе WO 85/04870; WO 85/04872; WO 88/03537; WO 88/06596; WO 89/10935; WO 89/05654; WO 90/01940; WO 90/14362; WO 92/06998; WO 95/13296; WO 99/08510; WO 99/12576; WO 01/016295; WO 2004/047871; WO 2005/072055; ЕРО 0291999; ЕРО 0323740; ЕРО 0341603; ЕРО 0350318; ЕРО 0356124; ЕРО 0385476; ЕРО 0497368 и ЕРО 0542863. Описаны химерические натрийуретические пептиды, например пептид, названный "вазонатриновый пептид" и описанный как химера ANP и CNP, например, в патенте США 5583108, или в патентах США 6407211 и 6818619, где описаны химерические пептиды дендроасписа. Информация из каждого из вышеуказанных патентов и патентных заявок включена в настоящее описание посредством ссылок, как если бы они были включены в него в полном объеме. Известен натрийуретический пептидный продукт, утвержденный Администрацией США по продуктам питания и лекарственным средствам, поступающий на рынок как дженерик под названием нестиритид, а также под торговым наименованием Natrecor (фирма Scios Inc.). Он представляет собой человеческий натрийуретический пептид, изготавливаемый из Е. coli с применением технологии рекомбинантной ДНК. Этот продукт разрешен к применению только для внутривенных вливаний при лечении больных острой декомпенсированной застойной сердечной недостаточностью, ощущающих удушье в покое или при минимальной активности. Хотя нестиритид является эффективным средством, его фармакокинетика и период полувыведения таковы, что продукт можно применять только путем внутривенной инфузии, что ограничивает область применения этого лекарственного средства условиями стационара или квалифицированного ухода в лечебном центре. Несмотря на значительное количество разработанных соединений, практически ни одно из них не доведено до стадии коммерческого продукта или до активной клинической разработки. Существует значительная потребность в продуктах с усовершенствованными характеристиками, в том числе с повышенной эффективностью, увеличенным периодом полувыведения, расширенными возможностями введения в организм, биодоступностью или продолжительностью действия, которые были бы эффективными при одном или нескольких терапевтических показаниях и предпочительно могли бы применяться в амбулаторных условиях. Сущность изобретения Согласно некоторым вариантам осуществления изобретения в конструкте по настоящему изобретению могут быть использованы один суррогат аминокислоты, два суррогата аминокислоты или более-2 016804 двух суррогатов аминокислоты. Согласно еще одному предпочтительному варианту настоящее изобретение предлагает конструкт, в котором одна или несколько пептидных связей между аминокислотными остатками могут быть заменены непептидными связями. Основной целью настоящего изобретения является создание конструктов, специфичных относительно натрийуретических рецепторов. Другой целью настоящего изобретения является создание конструктов, специфичных относительно натрийуретических рецепторов, в которых один или несколько аминокислотных остатков заменены циклосодержащим суррогатом аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт при введении в организм млекопитающего проявляет одно или несколько преимуществ по сравнению с соответствующей аминокислотной последовательностью, не содержащей суррогат аминокислоты, причем упомянутые преимущества выбраны из группы, включающей повышенную стойкость к ферментному разложению, увеличенный период полувыведения из кровотока, повышенную биодоступность, повышенную эффективность, увеличенную длительность эффекта и сочетания вышеупомянутых характеристик. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт проявляет по меньшей мере 10% максимального стимулирующего воздействия cGMP по сравнению с той же концентрацией соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт проявляет по меньшей мере 50% максимального стимулирующего воздействия cGMP по сравнению с той же концентрацией соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт проявляет по меньшей мере 100% максимального стимулирующего воздействия cGMP по сравнению с той же концентрацией соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт проявляет стимулирующее воздействие cGMP, превышающее 100% максимального воздействия той же концентрации соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает равновесным сродством к связыванию рецептора, определяемым значением Ki (нМ), не превышающим более чем на два логарифмических порядка значение Ki (нМ) для соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает равновесным сродством к связыванию рецептора, определяемым значением Ki (нМ), не превышающим более чем в три раза значение Ki (нМ) для соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает равновесным сродством к связыванию рецептора, определяемым значением Ki (нМ), равным или меньшим по сравнению со значением Ki (нМ) для соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает равновесным сродством к связыванию рецептора, определяемым значением Ki (нМ), меньшим по сравнению со значением Ki (нМ) для соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает сродством связывания по отношению к рецепторунатрийуретического пептида, превышающим сродство связывания упомянутого рецептора для соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относительно натрийуретического рецептора, причем упомянутый конструкт обладает биологической эффективностью, определяемой понижением кровяного давления или повышением диуреза за определенный период времени, по меньшей мере равной или большей по сравнению с эффективностью той же дозы соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание конструкта, специфичного относи-3 016804 тельно натрийуретического рецептора, причем упомянутый конструкт обладает биологической эффективностью, определяемой понижением кровяного давления или повышением диуреза за определенный период времени, превышающей эффективность той же дозы соответствующей аминокислотной последовательности, не содержащей суррогата аминокислоты. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 60% гомологична последовательности натрийуретического пептида. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 80% гомологична последовательности натрийуретического пептида. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 60% гомологична последовательности пептида, связывающегося с рецептором ANP, BNP, CNP, sCP, DNP, TNP-a, TNP-b или TNP-c. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере на приблизительно 80% гомологична последовательности пептида, связывающегося с рецептором ANP, BNP, CNP, sCP, DNP, TNP-a, TNP-b или TNP-c. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 60% гомологична последовательности H-Met-цикло-(Cys-His-Phe-Gly-Gly-Arg-Met-Asp-Arg-Ile-Ser-Cys)-Tyr-Arg-NH2 (последовательность 1). Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 80% гомологична последовательности H-Met-цикло-(Cys-His-Phe-Gly-GIy-Arg-Met-Asp-Arg-Ile-Ser-Cys)-Tyr-Arg-NH2 (последовательность 1). Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 60% гомологична последовательности H-Met-цикло-(Xaa-His-Phe-Gly-Gly-Arg-Met-Asp-Arg-Ile-Ser-Xaa)-Tyr-Arg-NH2 (последовательность 2), где каждый из фрагментов Хаа независимо от другого - любой аминокислотный остаток,образующий в совокупности циклический пептид. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, в котором соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, по меньшей мере приблизительно на 80% гомологична последовательности H-Met-цикло-(Xaa-His-Phe-Gly-Gly-Arg-Met-Asp-Arg-Ile-Ser-Xaa)-Tyr-Arg-NH2 (последовательность 2), где каждый из фрагментов Хаа независимо от другого - любой аминокислотный остаток,образующий в совокупности циклический пептид. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, содержащего суррогат по вышеприведенному определению, причем в упомянутом конструкте соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, представляет собой пептид, связывающийся с рецептором ANP. Еще одной целью настоящего изобретения является создание специфичного относительно натрийуретического рецептора конструкта, содержащего суррогат по вышеприведенному определению, причем в упомянутом конструкте соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, представляет собой пептид, связывающийся с рецептором BNP. Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов, обладающих повышенной биодоступностью и увеличенным периодом полувыведения по сравнению с природными или рекомбинантными формами ANP или BNP. Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов, которые можно применять для пациентов, страдающих застойной сердечной недостаточностью. Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов, которые можно применять по меньшей мере одним способом введения в дополнение к внутривенному введению. Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов, которые можно вводить пациентам путем подкожных или внутримышечных инъекций.-4 016804 Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов, обладающих повышенной стойкостью к разрушению, но значительно повышенным сродством связывания к своему рецептору. Еще одной целью настоящего изобретения является создание специфичных относительно натрийуретических рецепторов конструктов в лекарственной форме с модифицированным высвобождением. Другие цели, преимущества и отличительные признаки, а также дальнейший объем применимости настоящего изобретения частично представлены в нижеследующем подробном описании изобретения,рассматриваемом в сочетании с прилагаемыми фигурами, а частично будут ясны для специалистов в отрасли при рассмотрении нижеследующего описания или выявлены при осуществлении изобретения. Цели и преимущества изобретения могут быть реализованы и достигнуты посредством применения средств и их сочетаний, конкретно указанных в прилагаемой формуле изобретения. Краткое описание отдельных изображений на фигурах Прилагаемые фигуры иллюстрируют один или несколько вариантов осуществления настоящего изобретения и совместно с описанием служат для пояснения принципов изобретения. Фигуры представлены лишь с целью иллюстрации одного или нескольких предпочтительных вариантов осуществления изобретения и не могут рассматриваться как ограничивающие объем изобретения. На фиг. 1 изображена аминокислотная последовательность эндогенного человеческого ANP (hANP) природного типа; на фиг. 2 - график концентрации конструкта 1-18 в организме крыс в зависимости от времени после введения способом подкожного впрыскивания в дозе 5 мг/кг и внутривенным способом в дозе 2 мг/кг; на фиг. 3 - график суммарного диуреза в течение 30 мин для группы из четырех крыс после внутривенного введения конструктов 1-18 и 1-63; на фиг. 4 - график суммарного диуреза в течение 45 мин для группы из четырех крыс после подкожного введения конструкта 1-18 в различных дозах. Подробное описание изобретения Настоящее изобретение предлагает специфичные относительно натрийуретического рецептора конструкты, состоящие из множества аминокислотных остатков, по меньшей мере одного циклосодержащего суррогата аминокислоты и факультативно по меньшей мере одной модулирующей группы. Циклосодержащие суррогаты аминокислоты, применяемые в настоящем изобретении, предпочтительно таковы,что они могут быть синтезированы с N-концом, содержащим известную группу защиты амина, с применением защитной группы, например Fmoc, и реакционноспособным карбоксильным С-концом, и, таким образом, могут быть использованы в известных методах пептидного синтеза; причем подразумевается,что, если суррогат аминокислоты находится в С-концевом положении конструкта, то в составе этого суррогата может быть применен конец, отличный от карбоксила. Таким образом, согласно предпочтительному варианту осуществления настоящее изобретение предлагает синтетически полученные конструкты, синтезированные с применением методов пептидного синтеза, соответствующим образом модифицированных, и содержащие множество аминокислотных остатков и по меньшей мере один циклосодержащий суррогат аминокислоты. Согласно аналогичному предпочтительному варианту упомянутый конструкт дополнительно содержит по меньшей мере одну модулирующую группу. Предпочтительные модулирующие группы включают полимерные группы, содержащие повторяющиеся звенья, содержащие один или несколько атомов углерода и водорода и факультативно другие атомы, в том числе кислород. Такие полимерные группы предпочтительно представляют собой водорастворимые полимеры, предпочтительно полиоксиды алкиленов, поливинилпирролидоны, поливиниловые спирты, полиоксазолины или полиакрилоилморфолины. Среди полиоксидов алкиленов предпочтение отдается полиэтиленгликолям (ПЭГ), факультативно дериватизованным связующими группами. Согласно одному аспекту настоящее изобретение предлагает конструкт с аминокислотной последовательностью, являющейся гомологом известного натрийуретического пептида, например ANP или BNP,или гомологом любого известного пептидного варианта натрийуретического пептида, причем конструкт содержит по меньшей мере один суррогат аминокислоты формулы I или формулы II. Соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты, может быть идентичной известному натрийуретическому пептиду или известному варианту пептида, или может быть гомологичной указанным пептидам, например соответствующая аминокислотная последовательность может быть гомологичной указанным пептидам по меньшей мере на 60% или более предпочтительно по меньшей мере приблизительно на 80%. В значении, употребляемом в настоящем описании, выражение "соответствующая аминокислотная последовательность, не содержащая суррогат аминокислоты", означает аминокислотную последовательность, в том числе известную аминокислотную последовательность, связывающуюся с рецептором натрийуретического пептида и не содержащую вышеупомянутый суррогат. Такая известная аминокислотная последовательность идентична конструкту, если эта аминокислотная последовательность является одинаковой, за исключением замещения одним или несколькими суррогатами аминокислот или присоединения одного или нескольких таких суррогатов. Аналогично, гомология определяется идентичностью известной аминокислотной последовательности, за исключением замещения одним или несколькими суррогатами аминокислот или присоединения одного или нескольких таких сур-5 016804 рогатов. Согласно другому аспекту настоящее изобретение предлагает конструкт, который является моделью известного пептида, связывающегося с рецептором натрийуретического пептида, но содержит один или несколько суррогатов аминокислот, причем эти суррогаты либо замещают один или несколько аминокислотных остатков, содержащихся в известном пептиде, либо дополняют последовательность, составляющую известный пептид. Известными пептидами могут быть любые натрийуретические пептиды,известные в отрасли, в том числе (но не только) пептиды, описанные в любой публикации, патенте, заявке или в источниках, цитированных в настоящем описании, в том числе (но не только) натрийуретические пептиды, описанные в патентах США 4496544; 4609725; 4656158; 4673732; 4716147; 4757048; 4764504; 4804650; 4816443; 4824937; 4861755; 4904763; 4935492; 4952561; 5047397; 5057495; 5057603; 5091366; 5095004; 5106834; 5114923; 5159061; 5204328; 5212286; 5352587; 5376635; 5418219; 5665704; 5846932; 5583108; 5965533; 6028055; 6083982; 6124430; 6150402; 6407211; 6525022; 6586396 или 6818619; в опубликованных заявках на патенты США 2004/0002458; 2004/0063630; 2004/0077537; 2005/0113286; 2005/0176641 или 2006/0030004; или в различных патентах и заявках на патенты других стран, в том числе WO 85/04870; WO 85/04872; WO 88/03537; WO 88/06596; WO 89/10935; WO 89/05654;WO 2004/047871; WO 2005/072055; ЕРО 0291999; ЕРО 0323740; ЕРО 0341603; ЕРО 0350318; ЕРО 0356124; ЕРО 0385476; ЕРО 0497368 или ЕРО 0542863. Согласно одному аспекту известными пептидами являются пептиды или их гомологи, описанные в патентах США 4656158, 4824937, 4935492, 5159061,5204328, 5376635, 5665704, 5846932, 6028055, 6407211, 6525022, 6586396 или 6818619, в заявках на патенты США 2004/0002458, 2004/0063630 или 2005/0176641 или публикациях международных заявок на патенты WO 2004/047871 или WO 2005/072055. Информация из каждого из вышеупомянутых патентов и патентных заявок включена в настоящее описание в полном объеме, как если бы они были представлены полностью. Согласно одному особо предпочтительному варианту осуществления настоящее изобретение предлагает конструкт, содержащий аминокислотную последовательность, связывающуюся с рецептором натрийуретического пептида, в которой один или несколько аминокислотных остатков аминокислотной последовательности, связывающейся с рецептором натрийуретического пептида, заменены суррогатом аминокислоты формулы I. Согласно одному аспекту аминокислотная последовательность, связывающаяся с рецептором натрийуретического пептида, до замещения представляет собой последовательность HMet-цикло-(Cys-His-Phe-Gly-Gly-Arg-Met-Asp-Arg-Ile-Ser-Cys)-Tyr-Arg-NH2 (последовательность 1). Согласно другому аспекту настоящее изобретение предлагает конструкт, связывающийся с рецептором натрийуретического пептида, в том числе с рецептором ANP или BNP, и содержит по меньшей мере один суррогат аминокислоты формулы I или формулы II, причем, однако, этот конструкт не является гомологом любого известного пептида, связывающегося с рецептором натрийуретического пептида. Согласно одному варианту изобретение предлагает циклический конструкт формулы III где Ааа 1 - ацил, включающий линейный алкил C2-C18, разветвленный алкил С 3-С 17, линейный алкенил или алкинил C2-C18 или разветвленный алкенил или алкинил С 3-С 18, или Ааа 1 - суррогат аминокислоты,имеющий структуру где оборванная линия означает пептидную связь; каждый из R и R' независимо друг от друга - Н, линейная или разветвленная алифатическая цепь С 1-С 6; х - 1 или 2; Y - СН 2 или С=О; W - СН 2, NH или NR; Z - Н или СН 3; Q - -Н, -(CH2)m-N(v3)(v4), -(CH2)m-CH3, -(CH2)m-O(v3), -(CH2)m-C(=O)-(v3), -(CH2)m-C(=O)-O-(v3),-(CH2)m-S(v3), -C(=O)-(CH2)m-CH3, -C(=O)-(CH2)m-N(v3)(v4), -C(=O)-(CH2)m-C(=O)-(v3), -C(=O)-(CH2)mO(v3) или -C(=O)-(CH2)m-S(v3); R"' - ацил, линейная или разветвленная алкильная цепь C1-C17, линейная или разветвленная алкилацильная цепь C2-C19, линейный или разветвленный -аминоалифатический радикал С 1-С 17 или линейный или разветвленный -аминоалифатический ацил C1-C17; n - 0, 1 или 2; m - от 0 до 17; у - от 1 до 5; v3 и v4 независимо друг от друга - Н, линейная или разветвленная алкильная цепьC1-C17, линейная или разветвленная алкилацильная цепь С 2-С 19, при условии, что если один из v3 или v4 алкилацильная цепь, то второй из v3 или v4 - H; и атомы углерода, помеченные звездочкой, могут иметь любую стереохимическую конфигурацию; Ааа 2 и Ааа 13 одинаковы или различны, и каждый из них представляет собой L- или D-изомер аминокислотных остатков, образующих циклический мостик через посредство боковых цепей каждого из Ааа 2 и Ааа 13, где связывающей групой циклического мостика является -S-S-, -S-CH2-S-, -S-CH2-, -CH2-S-,-6 016804-C(=O)-NH-, -NH-C(=O)-, -CH2-NH-, -NH-CH2-, -CH2-S(O)n-, где n - 1 или 2, -S(O)n-CH2-, где n - 1 или 2,-CH2-CH2-, -СН=СН- (Е или Z), -С=С-, -С(=О)-О-, -О-С(=О)-, -С(=О)-СН 2-, -СН 2-С(=О)-, -O-C(=O)-NH-,-NH-C(=O)-O- или -NH-C(=O)-NH-; Ааа 3 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей His, Ala, Ser, Thr, Lys, HLys, Orn, Cys,HCys, Dap или Dab, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты,выбранной из группы, включающей His, Ala, Ser, Thr, Lys, HLys, Orn, Cys, HCys, Dap или Dab, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 4 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные Phe,HPhe или Pgl, или Tyr, Leu, Ile, Val, Ala, Nle, Nva или Tle, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные,-дизамещенных аминокислот, где заместители различны; Ааа 5 - Gly, Sar, L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ala или Aib, которая является ,дизамещенной аминокислотой - производной Ala; Ааа 6 - Gly, Sar, L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ala или Aib; Ааа 7 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, HSer, Thr, Lys, HLys,Orn, Cys, HCys, Cit, Abu, Dap или Dab, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы Arg, His, Ala, Ser, HSer, Thr, Lys, HLys, Orn, Cys, HCys, Cit, Abu,Dap или Dab, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 8 - Gly, L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Met(O),Met(O2) или Tie, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Met(O), Met(O2) или Tie, включая все(R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 9 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Asp, Glu, His, Ala, Ser, Thr, Lys, HLys, Cys,HCys, Met(O), Met(O2), Orn, Dap или Dab, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Asp, Glu, His, Ala, Ser, Thr, Lys, HLys, Cys,HCys, Met(O), Met(O2), Orn, Dap или Dab, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 10 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, Thr, Lys, HLys, Cys,HCys, Cit, Met(O), Orn, Dap или Dab, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Arg, His, Ala, Ser, Thr, Lys, HLys, Cys, HCys, Cit,Met(O), Orn, Dap или Dab, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 11 - Gly или L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva,Cys, HCys, Abu или Tle, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Nle, Ile, Leu, Val, Phe, Ala, Nva, Cys, HCys, Abu или Tle, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот, где заместители различны; Ааа 12 - Gly, L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей Ser, Nle, Ile, Leu, Val, Phe, Ala,Nva, Arg, Lys, Orn, Cys, HCys, Abu или Tle, или ,-дизамещенной аминокислоты, являющейся производным аминокислоты, выбранной из группы, включающей Ser, Nle, Ile, Leu, Val, Phe, Ala, Nva, Arg, Lys,Orn, Cys, HCys, Abu или Tle, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот,где заместители различны; Ааа 14 - L- или D-изомер -аминокислоты или -аминокислоты, являющейся аминокислотой или производным аминокислоты, выбранной из группы, включающей замещенные или незамещенные Phe,HPhe или Pgl, или Tyr, Leu, Ile, Val, Ala, Lys, Orn, Nle, Nva или Tle, или ,-дизамещенной аминокислоты, являющейся производным замещенного или незамещенного Phe, HPhe или Pgl, или Tyr, Leu, Ile, Val,Ala, Lys, Orn, Nle, Nva или Tle, включая все (R)- или (S)-конфигурации ,-дизамещенных аминокислот,где заместители различны; и Ааа 15 - суррогат аминокислоты, имеющий структуру где оборванная линия обозначает пептидную связь; по меньшей мере один из R и R' - -(CH2)y-R" и, в случае его присутствия, второй из R и R' - Н, где R" представляет собой -NH-C(=NH)-NH2, х - 1 или 2; Y СН 2 или С=О; W - СН 2, NH или NR'"; Z - Н или СН 3; J - -C(=O)-(CH2)m-OH, -C(=O)-(CH2)m-N(v1)(v2), R ацил, линейная или разветвленная алкильная цепь C1-C17, линейная или разветвленная алкилацильная цепь C2-C19, линейный или разветвленный -аминоалифатический радикал С 1-С 17 или линейный или разветвленный -аминоалифатический ацил C1-С 17; v1 и v2 независимо друг от друга - Н или линейная или разветвленная алкильная цепь C1-C17; n - 0, 1 или 2; m - от 0 до 17; у - от 1 до 5; и атомы углерода, помеченные звездочкой, могут иметь любую стереохимическую конфигурацию. Ниже приведены определения некоторых терминов, применяемых в описании и формуле настоящего изобретения."Конструкты" и "последовательности аминокислотных остатков" по настоящему изобретению могут быть: а) природными (встречающимися в природе), b) полученными путем химического синтеза, с) полученными по технологии рекомбинантной ДНК, d) полученными путем биохимической или ферментной фрагментации более крупных молекул, е) полученными методами, являющимися сочетаниями вышеуказанных способов а)-е), или f) полученными любыми другими способами получения пептидов или аминокислотных последовательностей. Путем применения химического синтеза, который является предпочтительным способом получения, можно вводить различные аминокислоты, которые в естественных условиях не встречаются в конструктах, модифицировать N- или С-концевые группы и т.п., тем самым обеспечивая повышенную стойкость и состав, устойчивость к разрушению протеазами и т.п., и вводить в конструкты один или несколько суррогатов аминокислоты. Термин "пептид" в значении, применяемом в описании и формуле настоящего изобретения, охватывает любую структуру, состоящую из двух или более аминокислот, включая химические модификации и производные аминокислоты. Аминокислотами, образующими пептид или его часть, могут быть природные аминокислоты, стереоизомеры и модификации таких аминокислот, непротеиновые аминокислоты, посттрансляционно модифицированные аминокислоты, ферментно-модифицированные аминокислоты и т.п. Термин "пептид" также охватывает димеры или мультимеры пептидов. Термин "искусственно полученный" пептид означает пептид, полученный путем химического синтеза, по технологии рекомбинантной ДНК, или путем биохимической или ферментной фрагментации более крупных молекул, путем сочетания вышеуказанных способов или вообще полученный любым другим способом. Термин "боковая цепь аминокислоты" в значении, применяемом в описании и формуле настоящего изобретения, означает любую боковую цепь любой аминокислоты, соответствующей определению термина "аминокислота" по данному здесь определению. Таким образом, этот термин охватывает боковые цепи природных аминокислот. Кроме того, он охватывает боковые цепи модифицированных природных аминокислот, например гликозилированных аминокислот. Далее, он охватывает боковые цепи стереоизомеров и модификаций природных протеиновых аминокислот, непротеиновых аминокислот, посттрансляционно модифицированных аминокислот, ферментно-синтезированных аминокислот, дериватизованных аминокислот, конструктов или структур, разработанных с целью имитации аминокислот и т.п. Например, это определение охватывает боковые цепи любых аминокислот, описанных в настоящем документе. Термин "производное боковой цепи аминокислоты" по нижеприведенному определению включен в определение боковой цепи аминокислоты."Производное боковой цепи аминокислоты" - модификация или изменение в любой боковой цепи аминокислоты, в том числе модификация или изменение в боковой цепи природной или неприродной аминокислоты, причем упомянутая модификация или изменение включает: (а) добавление одного или нескольких насыщенных или ненасыщенных атомов углерода к существующму алкилу, арилу или аралкилу; (b) замену атома углерода в боковой цепи другим атомом предпочтительно кислорода или азота;(с) добавление к атому углерода боковой цепи концевой группы, в том числе метила (-СН 3), метоксигруппы (-ОСН 3), нитрогруппы (-NO2), гидроксила (-ОН) или цианогруппы (-CN); (d) в случае присутствия в боковой цепи гидроксилов, меркаптогрупп или аминогрупп - добавление соответствующей группы защиты гидроксила, меркаптогруппы или аминогруппы; или (е) в случае присутствия в боковой цепи циклической структуры - добавление одного или нескольких заместителей при цикле, в том числе гидроксилов, галогенов, алкилов или арилов, присоединенных непосредственно или через промежуточное звено простого эфира. Для аминогрупп соответствующие группы защиты включают Z, Fmoc, Boc, Pbf, Pmc и т.п., но не только упомянутые группы."Аминокислоты", применяемые в вариантах осуществления настоящего изобретения, и соответствующий термин, употребляемый в описании и формуле изобретения, охватывают известные природные-8 016804 протеиновые аминокислоты, обозначаемые как их обычными трехбуквенными сокращениями, так и однобуквенными сокращениями. Общую имформацию см. в монографии под редакцией Грант "Синтетические пептиды - справочник потребителя" (Synthetic Peptides: A User's Guide. G.A. Grant, editor, W.H.FreemanCo., New York (1992), информация из которой включена в настоящее описание посредством ссылки, в том числе текст и таблица на с. 11-24. Термин "аминокислота" охватывает обычные аминокислоты и, кроме того, включает -аминокислоты, ,-дизамещенные аминокислоты и Nзамещенные аминокислоты, где по меньшей мере одна боковая цепь является боковой цепью аминокислоты по вышеприведенному определению. Термин "аминокислота", кроме того, включает N-алкиламинокислоты, где N-концевая аминогруппа имеет в качестве заместителя линейный или разветвленный алкил С 1-С 6. Таким образом, видно,что термин "аминокислота" охватывает стереоизомеры и модификации природных протеиновых аминокислот, непротеиновые аминокислоты, посттрансляционно модифицированные аминокислоты, ферментно-синтезированные аминокислоты, дериватизованные аминокислоты, конструкты или структуры, разработанных с целью имитации аминокислот, и т.п. Общее описание модифицированных и необычных аминокислот дано в вышеупомянутой монографии "Синтетические пептиды - справочник потребителя" и в публикациях Грубы и др. (Hruby V.J., Al-obeidi F., Kazmierski W., Biochem. J. 268:249-262 (1990); и Тоньоло (Toniolo С, Int. J. Peptide Protein Res. 35:287-300 (1990); информация из этих публикаций включена в настоящее описание посредством ссылок. Кроме того, нижеприведенные сокращения, относящиеся к аминокислотам и к защитным и модифицирующим группам для них, имеют следующие значения: В перечне конструктов, соответствующих настоящему изобретению, обычные аминокислотные остатки имеют обычные обозначения, приведенные в главе 2400 "Руководства по патентной экспертизе""Pro" - пролин; "Tyr" - тирозин, "Ser" - серин и т.д. Все остатки имеют конфигурацию L-изомеров за исключением случаев, когда указан D-изомер, например D-Ala для D-аланина. Отдельная аминокислота, в том числе стереоизомер и модификация природной протеиновой аминокислоты, непротеиновой аминокислоты, посттрансляционно модифицированная аминокислота, ферментно-синтезированная аминокислота, дериватизованная аминокислота, ,-дизамещенная аминокислота - производное любой из вышеупомянутых аминокислот (т.е. ,-дизамещенная аминокислота, где по меньшей мере одна боковая цепь одинакова с боковой цепью остатка, производным которого является дизамещенная аминокислота), -аминокислота - производное любой из вышеупомянутых аминокислот(т.е. -аминокислота, которая за исключением присутствия -углерода одинакова с остатком, производным которого она является) и т.п., включая все вышеупомянутые аминокислоты, иногда обозначается в настоящем описании термином "остаток". Термин ",-дизамещенная аминокислота" означает любую -аминокислоту, имеющую дополнительный заместитель в -положении, причем этот заместитель может быть одинаковым или отличным от боковой цепи -аминокислоты. Соответствующие заместители помимо боковой цепи -аминокислоты включают линейные или разветвленные алкилы С 1-С 6. Примером ,-дизамещенной аминокислоты является Aib. Хотя ,-дизамещенные аминокислоты могут обозначаться с использованием обычных символов для L- и D-изомеров, следует иметь в виду, что такие символы употребляются для удобства и что в случаях, когда заместители в -положении различны, такая аминокислота может взаимозаменяемо обозначаться как ,-дизамещенная аминокислота - производное соответственно L- или D-изомера остатка,содержащего указанную боковую цепь аминокислоты. Таким образом, (S)-2-амино-2-метилгексановая кислота может обозначаться либо как ,-дизамещенная аминокислота - производное L-Nle, либо как,-дизамещенная аминокислота - производное D-Ala. Во всех случаях употребления обозначения ,дизамещенной аминокислоты подразумевается, что имеются в виду все ее (R)- и (S)-конфигурации. Термин "N-замещенная аминокислота" означает любую аминокислоту, где боковая цепь аминокислоты ковалентно соединена с аминогруппой каркаса и факультативно в -положении к углероду нет других заместителей кроме Н. Примером N-замещенной аминокислоты является саркозин. Например, саркозин можно обозначить как N-замещенную аминокислоту - производное Ala, поскольку боковые цепи саркозина и Ala одинаковы (метил). Термин "суррогат аминокислоты" означает описанную в настоящем документе молекулу, которая является имитацией остатка, в том числе (но не только) молекулы с пиперазиновым ядром, кетопиперазиновым ядром и диазепиновым ядром. Если не указано иное, подразумевается, что суррогат аминокислоты содержит как карбоксил, так и аминогруппу, а также группу, соответствующую боковой цепи аминокислоты, или, в случае суррогата аминокислоты глицина, не содержит боковых цепей кроме водорода. Таким образом, суррогат аминокислоты означает молекулу вышеприведенной общей формулы I или- 10016804 формулы II. Кроме того, термин "суррогат аминокислоты" охватывает молекулы любой из нижеследующих структур, причем следует иметь в виду, что для удобства такие структуры изображены как изолированные суррогаты, не включающие никаких защитных групп и не связанные одной или двумя пептидными связями с одним или двумя аминокислотными остатками, образующими часть конструкта по настоящему изобретению где R, R', х и звездочки соответствуют определениям для суррогата формулы I. Кроме того, термин "суррогат аминокислоты" охватывает молекулы любой из нижеследующих структур, причем также следует иметь в виду, что для удобства такие структуры изображены как изолированные суррогаты, не содержащие никаких защитных групп и не связанные одной или двумя пептидными связями с одним или двумя аминокислотными остатками, образующими часть конструкта по настоящему изобретению где R, R', х и звездочки соответствуют определениям для суррогата формулы I. Для целей синтеза либо карбоксил, либо аминогруппа любого суррогата аминокислоты предпочтительно может быть защищена группой защиты, так что она не является реакционноспособной в присутствии группы защиты, и аналогично любая реакционноспособная группа, образующая часть R или R', может также быть защищена группой защиты. Следует иметь в виду, что суррогаты по настоящему изобретению имеют более одного асимметричного центра и, соответственно, могут существовать в более чем одной стереоизомерной форме. Некоторые из этих соединений могут существовать также в виде геометрических изомеров и ротамеров. Кроме того, некоторые соединения по настоящему изобретению могут обладать также конформациальной аксиальной хиральностью, результатом чего является существование атропизомеров. Изобретение охватывает все эти индивидуальные формы, а также их смеси, в том числе рацематы. Согласно одному аспекту изомеры суррогатов можно разделить обычным способом, используя хроматографические методы или разделяющие средства. Согласно другому аспекту индивидуальные изомеры суррогатов, или энантиомерно чистые суррогаты, получают синтетическим путем, например, по схемам, приведенным в настоящем описании или по вариантам таких схем, применяя асимметрический синтез с использованием хиральных промежуточных соединений, реагентов или катализаторов. Термин "группа защиты С-конца" означает любую концевую группу, присоединенную через концевой углеродный атом цикла или через концевую карбоксильную группу (в случае ее присутствия) Сконца конструкта. Концевой углеродный атом цикла или концевая карбоксильная группа (в случае ее присутствия) может образовывать часть остатка или часть суррогата аминокислоты. Согласно предпочтительному аспекту группа защиты С-конца образует часть суррогата аминокислоты, находящегося в Сконцевом положении конструкта. Группы защиты С-конца включают следующие группы (но не ограничены ими): -(CH2)n-OH, -(CH2)n-C(=O)-OH, -(CH2)m-OH, -(CH2)n-C(=O)-N(v1)(v2 -(CH2)n-C(=O)-(CH2)mN(v1)(v2), -(CH2)n-O-(CH2)m-СН 3, -(CH2)n-C(=O)-NH-(CH2)m-CH3, -(CH2)n-C(=O)-NH-(CH2)m-N(v1)(v2),-(CH2)n-C(=O)-N-CH2)m-N(v1)(v22, -(CH2)n-C(=O)-NH-CH(-C(=O)-OH)-(CH2)m-N(v1)(v2), -C(=O)-NH(CH2)m-NH-C(=O)-CH(N(v1)(v2CH2)m-N(v1)(v2 или-(CH2)n-C(=O)-NH-CH(-C(=O)-NH2)-(CH2)mN(v1)(v2), в том числе все (R)- или (S)-конфигурации вышеуказанных групп, где v1 и v2 независимо друг от друга - Н, линейная или разветвленная алкильная цепь С 1-С 17, m - от 0 до 17 и n - от 0 до 2; или любой-аминоалифатический радикал, концевой арил или аралкил, включая такие группы, как метил, диметил,этил, пропил, изопропил, бутил, изобутил, пентил, гексил, аллил, циклопропанметил, гексаноил, гептаноил, ацетил, пропионоил, бутаноил, фенилацетил, циклогексилацетил, нафтилацетил, циннамоил, фенил, бензил, бензоил, 12-Ado, 7'-аминогептаноил, 6-Ahx, Amc или 8-Аос, или любая отдельная природная или неприродная -аминокислота, -аминокислота или ,-дизамещенная аминокислота, включая все(R)- и (S)-конфигурации любой из вышеуказанных групп, факультативно в сочетании с любой из вышеуказанных неаминокислотных групп защиты. В вышеизложенном следует иметь в виду, что, например,-C(=O)-NH-(CH2)m-NH-C(=O)-CH(N(v1)(v2CH2)m-N(v1)(v2 имеет строение Термин "группа защиты N-конца" означает любую концевую группу, присоединенную через концевой амин N-конца конструкта. Концевой амин образовывает часть остатка или часть суррогата аминокислоты. Согласно предпочтительному аспекту группа защиты N-конца образует часть суррогата аминокислоты, находящегося в N-концевом положении конструкта. Группы защиты N-конца включают следующие группы (но не ограничены ими): любой -аминоалифатический радикал, ацил или концевой арил или аралкил, включая такие группы, как метил, диметил, этил, пропил, изопропил, бутил, изобутил,пентил, гексил, аллил, циклопропанметил, гексаноил, гептаноил, ацетил, пропионоил, бутаноил, фенилацетил, циклогексилацетил, нафтилацетил, циннамоил, фенил, бензил, бензоил, 12-Ado, 7'аминогептаноил, 6-Ahx, Amc или 8-Аос; в альтернативных вариантах группой защиты N-конца является-(CH2)m-NH(v3), -(СН 2)m-СН 3, -С(=О)-(СН 2)m-СН 3, -C(=O)-(CH2)m-NH(v3), -C(=O)-(CH2)m-C(=O)-OH,-С(=О)-(CH2)m-C(=O)-(v4), -(СН 2)m-С(=О)-ОН, -(CH2)m-C(=O)-(v4), С(=О)-(СН 2)m-O(v3), -(CH2)m-O(v3),C(=O)-(CH2)m-S(v3) или -(CH2)m-S(v3), где v3 - Н или линейная или разветвленная алкильная цепь С 1-С 17, иv4 - линейная или разветвленная алкильная цепь С 1-С 17, и m - от 0 до 17. Фенильный цикл является "замещенным", если он содержит один или несколько заместителей, независимо друг от друга содержащих гидроксил, галоген, алкил или арил, присоединенных непосредственно или через промежуточную группу простого эфира. Если фенильный цикл замещен таким образом,то аминокислотный остаток может называться замещенным, например замещенным Phe, замещеннымHPhe или замещенным Pgl. Термин "алкен" охватывает ненасыщенные углеводороды, которые содержат одну или несколько двойных углерод-углеродных связей. Примеры алкеновых групп включают этилен, пропен и т.п. Термин "алкенил" означает линейный одновалентный углеводородный радикал, содержащий от двух до шести атомов углерода, или разветвленный одновалентный углеводородный радикал, содержащий от трех до шести атомов углерода и имеющий по меньшей мере одну двойную связь; примеры упомянутых радикалов включают этенил, 2-пропенил и т.п. К "алкилам", упоминаемым в настоящем описании, относятся алкильные радикалы обозначенной длины, имеющие либо линейную, или разветвленную конфигурацию. К примерам алкильных радикалов относятся метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, изопентил, гексил,изогексил и т.п. Термин "алкинил" означает линейный одновалентный углеводородный радикал, содержащий от двух до шести атомов углерода, или разветвленный одновалентный углеводородный радикал, содержащий от трех до шести атомов углерода и имеющий по меньшей мере одну тройную связь; примеры упомянутых радикалов охватывают этинил, пропинил, бутинил и т.п. Термин "арил" означает моноциклический или бициклический ароматический углеводородный радикал, содержащий в цикле от 6 до 12 атомов и факультативно замещенный одним или независимыми друг от друга несколькими заместителями, выбранными из группы, которую составляют алкил, галогеналкил, циклоалкил, алкокси-, алкилтиогруппа, галоген, нитрогруппа, ацил, циано-, аминогруппа, монозамещенная аминогруппа, дизамещенная аминогруппа, гидроксил, карбоксил и алкоксикарбонил. Примеры арильных групп охватывают фенил, бифенил, нафтил, 1-нафтил и 2-нафтил, их производные и т.п. Термин "аралкил" означает радикал -RaRb, где Ra - алкиленовая (двухвалентная алкильная) группа иR - арильная группа, соответствующая приведенному выше определению. Примеры аралкильных групп охватывают бензил, фенилэтил, 3-(3-хлорфенил)-2-метилпентил и т.п. Термин "алифатический [углеводород]" охватывает соединения с углеводородными цепями, например алканы, алкены, алкины и их производные. Термин "ацил" означает группу R-C(=O)-, где R - органическая группа. Примером является ацетильная группа СН 3-С(=О)-, обозначаемая в данном документе как Ас. Пептид или алифатическая группа является "ацилированной", когда арильная, алкильная или замещенная алкильная группа, соответствующая приведенному выше определению, присоединена через одну или несколько карбонильных -(С=О)- групп. Пептид наиболее часто ацилирован при N-конце. Термин "-аминоалифатический [углеводород]" охватывает алифатическую группу с концевой аминогруппой. Примеры -аминоалифатических [углеводородов] включают 7'-аминогептаноил и аминокислотные боковые цепи орнитина и лизина. Термин "гетероарил" охватывает моно- и бициклические ароматические системы, содержащие от 1 до 4 гетероатомов, выбранных из группы, которую составляют азот, кислород и сера. Термин "5- или 6 членный гетероарил" обозначает моноциклические гетероароматические системы, примеры которых включают тиазол, оксазол, тиофен, фуран, пиррол, имидазол, изоксазол, пиразол, триазол, тиадиазол,тетразол, оксадиазол, пиридин, пиридазин, пиримидин, пиразин и т.п. Бициклические гетероароматиче- 12016804 ские системы включают, но без ограничения ими, бензотиадиазол, индол, бензотиофен, бензофуран, бензимидазол, бензизоксазол, бензотиазол, хинолин, бензотриазол, бензоксазол, изохинолин, пурин, фуропиридин и тиенопиридин. Термин "амид" означает соединения, которые содержат трехвалентный азот, присоединенный к карбонильной группе (-C(=O)-NH2), например метиламид, этиламид, пропиламид и т.п. Термин "имид" охватывает соединения, которые содержат имидогруппу (-C(=O)-NH-C(=O)-). Термин"амин" охватывает соединения, которые содержат аминогруппу (-NH2). Термин "нитрил" охватывает соединения, которые являются производными карбоновой кислоты и содержат группу (-CN), присоединенную к органической группе. Термин "галоген" предназначен для обозначения атомов галогенов фтора, хлора, брома и иода и групп, содержащих один или несколько атомов галогенов, например -CF3 и т.п. Термин "композиция", например, в составе термина "фармацевтическая композиция" предназначен для обозначения продукта, содержащего активный(ые) ингредиент(ы) и инертный(ые) ингредиент(ы),которые являются частью носителя, а также любого продукта, непосредственно или опосредованно полученного в результате объединения, комплексообразования или агрегирования любых двух или нескольких ингредиентов, или диссоциации одного или нескольких ингредиентов, или других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, изготовленную путем смешивания конструкта по настоящему изобретению и фармацевтически приемлемого носителя. Термин "ЕС 50" предназначен для обозначения молярной концентрации агониста, которая вызывает 50% максимальной возможной реакции для этого агониста. Например, конструкт, который в концентрации 72 нМ вызывает 50% максимальной возможной реакции для этого конструкта, определенной в испытании с применением cGMP, имеет ЕС 50 72 нМ. Если не указано иное, молярная концентрация, связанная с определением ЕС 50, выражается в наномолях (нМ). Термин "Ki (нМ)" предназначен для обозначения равновесного сродства связывания рецептора, соответствующего молярной концентрации конкурирующего соединения, связывающей половину мест связывания рецептора в равновесии в отсутствие конкурентов. Как правило, Ki находится в обратной корреляции со сродством соединения к рецептору, так что, если значение Ki низко, то сродство высоко. где [ligand] означает концентрацию лиганда, который может быть радиомеченым лигандом, и Kd - обратная величина сродства к рецептору, которое обеспечивает занятие 50% рецепторов. Если не указано иное, молярная концентрация, связанная с определением Ki, выражается в нМ. Методика формирования химических наименований и структурных формул, применяемая в настоящем документе, использует принципы формирования химических наименований, применяемых в программе ChemDraw (поставляется фирмой Cambridgesoft Corp., Cambridge, Mass.), и основывается на этих принципах. В частности, некоторые наименования соединений сформированы на основе структурных формул с применением программы Autonom, используемой в программном обеспечении ChemdrawUltra, или на основе программы ISIS (разработка фирмы MDL Corp.). Как правило, в структурных формулах не обозначены атомы водорода, соединенные с атомами углерода, за исключением концевых групп и других специальных случаев. Некоторые структурные формулы и рисунки в настоящем документе, например, включенные в табл. 1 и 2, характеризуют конструкты, состоящие из суррогатов аминокислот и аминокислотных остатков, при этом суррогаты идентифицированы структурными формулами, а аминокислотные остатки идентифицированы трехбуквенными сокращениями. Если не указано иное, то имеется в виду, что связь между суррогатом и остатком, или между остатком и суррогатом, или между суррогатом и остатками на обеих N-концевой и С-концевой сторонах суррогата является обычной пептидной связью -C(=O)-NH- или, в случае, если пептидная связь соединена с атомом азота цикла на N-конце суррогата, -C(=O)-N-. Как правило, при обозначении таких связей атомы суррогата аминокислоты изображены (например, -С(=О)- или-N), а атомы аминокислотного остатка не изображены. Лекарственные формы и полезность Конструкты, описанные в настоящем документе, могут быть применены как в медицинских целях,так и в области животноводства и ветеринарии. Как правило, упомянутые конструкты или фармацевтические композиции, содержащие конструкты, применяются для лечения людей, но могут быть также применены для лечения других млекопитающих. Термин "пациент" предназначен для обозначения млекопитающего и применяется в описании и формуле изобретения именно в этом смысле. Основной областью применения настоящего изобретения является лечение пациентов-людей, однако изобретение может быть применено к лабораторным, сельскохозяйственным, диким, домашним животным, к животным,- 13016804 содержащимся в зоопарках, к животным, используемым в спорте, или к другим животным. Конструкты, описанные в настоящем документе, могут быть использованы для лечения любого состояния, синдрома или заболевания, при котором желательным является индуцирование противогипертензивного действия, воздействие на сердечно-сосудистую систему, почки и/или железы внутренней секреции. Конкретно этот перечень включает любое состояние, синдром или заболевание, при котором можно применять природные натрийуретические пептиды. Таким образом, описанные конструкты можно применять для индуцирования у пациента желательного натрийуреза, диуреза и/или расширения сосудов. Согласно одному аспекту конструкты, описанные в настоящем документе, применяются при лечении ранней стадии (например, класса 1) застойной сердечной недостаточности. Согласно одному аспекту конструкты, описанные в настоящем документе, применяются при лечении хронической или декомпенсированной застойной сердечной недостаточности. Согласно еще одному аспекту конструкты, описанные в настоящем документе, применяются при лечении острой застойной сердечной недостаточности, в том числе острой декомпенсированной застойной сердечной недостаточности у пациентов с одышкой в покое или при минимальной активности. Солевые формы конструктов. Конструкты по настоящему изобретению могут быть в форме любой фармацевтически приемлемой соли. Термин "фармацевтически приемлемые соли" означает соли, полученные из фармацевтически приемлемых нетоксичных оснований или кислот, в том числе неорганических или органических оснований и неорганических или органических кислот. Соли - производные неорганических оснований включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия,цинка и т.п. Особенно предпочтительны соли аммония, кальция, лития, магния, калия и натрия. Соли производные фармацевтически приемлемых органических нетоксичных оснований включают соли первичных, вторичных и третичных аминов, замещенных аминов, в том числе природных замещенных аминов, циклических аминов, и основных ионообменных смол, например аргинина, бетаина, кофеина, холина, N,N'-дибензилэтилендиамина, диэтиламина, 2-диэтиламиноэтанола, 2-диметиламиноэтанола, этаноламина, этилендиамина, N-этилморфолина, N-этилпипередина, глюкамина, глюкозамина, гистидина,гидрабамина, изопропиламина, лизина, метилглюкамина, морфолина, пиперазина, пипередина, полиаминных смол, прокаина, пуринов, теоброма, триэтиламина, триметиламина, трипропиламина, трометамина и т.п. Когда конструкт по настоящему изобретению имеет основной характер, могут быть получены соли с кислотами с применением фармацевтически приемлемых нетоксичных кислот, в том числе неорганических и органических кислот. К таким кислотам относятся уксусная, бензолсульфоновая, бензойная, камфорсульфоновая, карбоновая, лимонная, этансульфоновая, муравьиная, фумаровая, глюконовая, глутаминовая, бромисто-водородная, хлористо-водородная, изэтионовая, молочная, малеиновая, яблочная,миндальная, метансульфоновая, малоновая, слизевая, азотная, памовая, пантотеновая, фосфорная, пропионовая, янтарная, серная, винная, п-толуолсульфоновая кислота, трифторуксусная кислота и т.п. Соли конструктов по настоящему изобретению с кислотами получают в соответствующем растворителе из конструкта и избытка кислоты, например хлористо-водородной, бромисто-водородной, серной, фосфорной, уксусной, трифторуксусной, лимонной, винной, малеиновой, янтарной или метансульфоновой кислоты. Особенно полезными являются ацетаты. Когда конструкты по вариантам осуществления данного изобретения содержат кислотную группу, соответствующие фармацевтически приемлемые соли могут охватывать соли щелочных металлов, например соли натрия или калия, или соли щелочно-земельных металлов, например соли кальция или магния. Кроме того, заявители обнаружили, что некоторые солевые формы пептидных конструктов по настоящему изобретению, в том числе памоат, октаноат, деканоат, олеат, стеарат, натрий-таннат и пальмитат, имеют увеличенный период полувыведения из кровотока, в некоторых случаях вдвое превышающий соответствующий показатель для обычной ацетатной формы. Эти солевые формы особенно пригодны для введения в организм путем подкожной инъекции или внутримышечной инъекции, в частности для лечения хронических заболеваний, вследствие пониженной частоты введения, которая может быть достигнута в результате удлинения периода полувыведения. Не прибегая к теоретическим соображениям,можно считать, что увеличение периода полувыведения связано с понижением растворимости по сравнению с ацетатной формой. Солевые формы пептидных конструктов по настоящему изобретению с увеличенным периодом полувыведения можно получать любым способом, в том числе, например, методом ионного обмена, смешивания раствора ацетатной формы конструкта с динатрийпамоатом для получения суспензии памоата или применения желательной соли на конечной стадии(стадиях) очистки при получении конструкта. Фармацевтические композиции. Другой вариант осуществления настоящего изобретения предлагает фармацевтическую композицию, содержащую конструкт по настоящему изобретению и фармацевтически приемлемый носитель. Носителем может быть жидкий состав, предпочтительно изотонический водный раствор, содержащий буфер. Фармацевтически приемлемые носители включают также наполнители, например разбавители, носители и т.п., и добавки, например стабилизаторы, консерванты, солюби- 14016804 лизаторы, буферы и т.п., как описано ниже. Конструкты по некоторым вариантам настоящего изобретения могут быть введены в состав фармацевтических композиций, содержащих по меньшей мере один конструкт по настоящему изобретению вместе с одним или несколькими фармацевтически приемлемыми наполнителями, например разбавителями, носителями и т.п., и добавками, например стабилизаторами, консервантами, солюбилизаторами,буферами и т.п., по необходимости. Наполнители лекарственных форм могут включать поливинилпирролидон, желатин, гидроксицеллюлозу, аравийскую камедь, полиэтиленгликоль, маннит, хлорид натрия и цитрат натрия. В лекарственных формах для инъекций или других видов введения жидкостей предпочтительно применяется вода, содержащая по меньшей мере одно или несколько буферных соединений, а также при необходимости стабилизаторы, консерванты и солюбилизаторы. Для твердых лекарственных форм могут применяться любые разнообразные загустители, наполнители, набухающие добавки и носители, например крахмалы, сахара, жирные кислоты и т.п. В лекарственных формах для местного применения могут применяться любые разнообразные кремы, мази, гели, лосьоны и т.п. В составе большинства фармацевтических композиций преобладающую по массе или объему часть составляют неактивные ингредиенты. Подразумевается также, что в лекарственных формах могут применяться любые разнообразные композиции и добавки, обеспечивающие дозированное, замедленное или отсроченное высвобождение активного вещества, так что лекарственная форма может иметь состав, способствующий доставке конструкта по настоящему изобретению на протяжении определенного периода времени. Например, желатин, натриевая карбоксиметилцеллюлоза и/или другие целлюлозные наполнители могут быть включены для получения лекарственных форм с длительным или замедленным высвобождением активного вещества, особенно для введения путем подкожных и внутримышечных инъекций. Как правило, конкретное количество конструктов, вводимое в организм пациента, варьирует в довольно широких пределах в зависимости от режима применения, применяемой лекарственной формы и желательной реакции. При практическом применении упомянутые конструкты можно вводить в качестве активного ингредиента в смесь с фармацевтическим носителем в соответствии с обычными способами приготовления фармацевтических композиций. Носитель может иметь разнообразные формы в зависимости от формы препарата, желательной для конкретного применения, например перорального, парэнтерального (в том числе внутривенного), уретрального, вагинального, назального, дермального, чрескожного, легочного,глубоколегочного, ингаляционного, буккального, сублингвального и т.п. способа введения. При приготовлении композиций для пероральных лекарственных форм можно применять любые обычные фармацевтические вспомогательные вещества, например воду, гликоли, масла, спирты, вкусоароматические добавки, красители и т.п. в случае жидких пероральных лекарственных форм, например суспензий, эликсиров и растворов; или носители, например крахмалы, сахара, микрокристаллическую целлюлозу, наполнители, смазывающие средства, связующие, разрыхлители и т.п. в случае твердых пероральных лекарственных форм, например порошков, твердых и мягких капсул и таблеток. Таблетки и капсулы являются предпочтительными дозированными единицами лекарственных форм вследствие простоты их применения. При желании на композицию, содержащую конструкт по настоящему изобретению, может быть нанесено покрытие с применением стандартных водных или неводных способов. Количество активного конструкта в таких терапевтически приемлемых композициях обеспечивает эффективную дозировку. В других предпочтительных дозированных единицах могут быть применены сублингвальные фармацевтические композиции, например, в виде пастилок, вафель, таблеток и т.п. Активный конструкт может быть применен также назальным способом в виде, например, жидких капель или спрея. Таблетки, драже, капсулы и т.п. могут также содержать связующее, например трагантовую камедь,аравийскую камедь, кукурузный крахмал или желатин; наполнители, например дикальцийфосфат; разрыхлитель, например кукурузный крахмал, картофельный крахмал или альгиновую кислоту; смазывающее средство, например стеарат магния; и подслащивающее средство, например сахарозу, лактозу или сахарин. Если единицей дозировки является капсула, то она может содержать кроме материалов вышеупомянутых типов жидкий носитель, например масло. В качестве покрытий или для модифицирования физической формы дозированной единицы можно использовать разнообразные другие материалы. Например, таблетки могут иметь покрытие из шеллака,сахара или обоих этих веществ. Сироп или эликсир может содержать помимо активного ингредиента сахарозу как подслащивающее средство, метил- и пропилпарабены как консерванты, краситель и ароматизатор, например вишневый или апельсиновый ароматизатор. Конструкты можно вводить в организм также парэнтеральным путем. Можно приготовлять растворы или суспензии этих активных пептидов в воде, смешанной с соответствующим поверхностноактивным веществом, например гидроксипропилцеллюлозой. Можно приготовлять также дисперсии в глицерине, жидких полиэтиленгликолях и смесях этих веществ в маслах. Эти препараты могут факультативно содержать консервант для предотвращения развития микроорганизмов. Можно использовать также лиофилизованные дозированные единицы лекарственных форм, восстанавливаемые, например, физиологическим раствором, непосредственно перед введением и, соответственно, не требующие консер- 15016804 вантов. Фармацевтические формы, пригодные для применения путем инъекций, включают, например, стерильные водные растворы или дисперсии и стерильные порошки, например лиофилизированные лекарственные формы, для немедленного приготовления стерильных растворов или дисперсий для инъекций. В любом случае такая лекарственная форма должна быть стерильной и обладать достаточной текучестью для введения с помощью шприца. Такая форма должна быть устойчивой в условиях приготовления и хранения и должна быть предохранена от загрязняющего действия микроорганизмов, например бактерий и грибков. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду,этанол, многоатомный спирт, например глицерин, пропиленгликоль или жидкий полиэтиленгликоль,соответствующие смеси этих веществ и растительные масла. Конструкты, описанные в настоящем документе, могут терапевтически применяться путем назального введения. Термин "назальное введение" означает любую форму назального применения любого конструкта по настоящему изобретению. Конструкты могут быть в водном растворе, например в растворе, содержащем физиологический раствор, цитрат или другие известные разбавители или консерванты. Конструкты также могут входить в состав сухой или порошкообразной лекарственной формы. Согласно альтернативному варианту осуществления изобретения конструкты могут вводиться непосредственно в легкие. Внутрилегочное введение можно выполнять с помощью дозирующего ингалятора - устройства, обеспечивающего самостоятельное введение пациентом отмеренной дозы конструкта по настоящему изобретению при приведении устройства в действие во время вдыхания. При этом можно применять ингаляцию как порошка, так и распыленного аэрозоля. В соответствии с еще одним вариантом осуществления настоящего изобретения конструкты по настоящему изобретению могут быть введены в состав лекарственной формы в сочетании с любым из разнообразных средств, повышающих эффективность назального всасывания лекарственных веществ, в том числе пептидных лекарственных веществ. Эти средства должны усиливать назальное всасывание без неприемлемого повреждения слизистой оболочки. В патентах США 5693608, 5977070 и 5908825 наряду с другими описаны многочисленные фармацевтические композиции, применимые для этой цели,включающие усилители всасывания, и информация из каждого из вышеуказанных патентов и всех литературных источников и патентов, на которые в вышеуказанных патентах имеются ссылки, включены в настоящее описание посредством ссылки. При введении в водный раствор некоторых конструктов по настоящему изобретению могут быть применены соответствующие буферы, например солевой, ацетатный, фосфатный, цитратный или другие,которые могут обеспечивать физиологически приемлемые значения рН, как правило, от приблизительно 4 до приблизительно 7. Можно применять также сочетания буферных соединений, например солевой раствор с фосфатным буфером, солевой и ацетатный буферы и т.п. В случае солевого раствора можно применять 0,9% раствор хлорида натрия. В случае фосфата, ацетата, цитрата и т.п. можно применять 50 мМ раствор. Кроме буферных соединений можно применять соответствующий консервант для предотвращения или ограничения развития бактерий и других микроорганизмов. Одним из таких консервантов является 0,05% хлорид бензалкония. Также возможно и подразумевается, что конструкт может находиться в сухой и тонкодисперсной форме. Согласно предпочтительному варианту осуществления размер частиц составляет от приблизительно 0,5 до 6,0 мкм, так что частицы обладают достаточной массой для осаждения на поверхности легких и не выдыхаются, однако, достаточно малы, чтобы не осаждаться на поверхности воздушных путей,не достигая легких. Для получения сухих тонкодисперсных порошков можно применять разнообразные способы, в том числе (но не только) тонкий размол, распылительную сушку и быстрое замораживание аэрозоля с последующей лиофилизацией. В форме микрочастиц конструкты могут осаждаться в глубине легких, при этом обеспечивается быстрое и эффективное всасывание в кровоток. Кроме того, в таком варианте не требуются усилители всасывания, которые необходимы в некоторых случаях при введении через слизистые оболочки носа, рта или через кожу. Можно применять любые разнообразные ингаляторы, в том числе с использованием аэрозолей на основе пропеллентов, распылители, однодозовые ингаляторы для сухих порошков и многодозовые ингаляторы для сухих порошков. Обычными устройствами,применяемыми в настоящее время, являются дозирующие ингаляторы, используемые для введения лекарственных средств для лечения астмы, хронического обструктивного заболевания легких и т.п. Предпочтение отдается ингаляторам для сухих порошков, рассчитанным на образование клуба или аэрозоля тонкого порошка, частицы которого всегда имеют размер меньше чем приблизительно 6,0 мкм. Величину частиц тонкодисперсного порошка, в том числе распределение по среднему размеру,можно регулировать путем подбора способа изготовления. При тонком размоле размер частиц регулируется размером мельничной головки, скоростью ротора, длительностью обработки и т.п. При распылительной сушке размер частиц регулируется размером сопла, скоростью потока, температурой в сушилке и т.п. При изготовлении порошков способом быстрого замораживания аэрозолей с последующей лиофилизацией размер частиц регулируется размером сопла, скоростью потока, концентрацией распыляемого раствора и т.п. Для регулирования размера частиц можно использовать вышеуказанные и другие параметры.- 16016804 Конструкты по настоящему изобретению можно вводить в терапевтических целях с помощью инъекций лекарственной формы для инъекций с модифицированным высвобождением, как правило, путем глубокой внутримышечной инъекции, например, в ягодичную или дельтовидную мышцу. Согласно одному варианту конструкт по настоящему изобретению вводят в состав композиции с ПЭГ, например с полиэтиленгликолем-3350, и факультативно с одним или несколькими дополнительными наполнителями и консервантами, в том числе (но не только), например, солями, полисорбатом-80, гидроксидом натрия или хлористо-водородной кислотой для установки рН и т.п. Согласно другому варианту конструкт по настоящему изобретению вводят в состав композиции с полиортоэфиром, которым может быть самокатализированный полиортоэфир с любым переменным содержанием молочной кислоты в полимерной цепи, и факультативно с одним или несколькими дополнительными компонентами. В одном варианте используется поли-(D,L-лактид-когликолид) (полимер PLGA), предпочтительно полимер PLGA с гидрофильной концевой группой, например PLGA RG502H фирмы Boehringer Ingelheim, Inc. (Ингельхайм,Германия). Такие лекарственные формы можно получать, например, путем смешивания конструкта по настоящему изобретению в соответствующем растворителе, например в метаноле, с раствором PLGA в дихлорметане и добавления к полученной смеси раствора поливинилового спирта как внешней фазы при соответствующих условиях перемешивания в реакторе. Как правило, в составе лекарственных форм для инъекций с длительным высвобождением можно применять любой из многочисленных пригодных для инъекций биоразлагаемых полимеров, которые предпочтительно являются также адгезивными полимерами. Информация из патентов США 4938763, 6432438 и 6673767 и биоразлагаемые полимеры и способы получения лекарственных форм, описанные в этих патентах, включены в настоящее описание посредством ссылки. Лекарственная форма может быть такой, что может требоваться ее еженедельное,ежемесячное введение или иной периодический режим, в зависимости от концентрации и количества конструкта, скорости биоразложения полимера и других факторов, известных специалистам в отрасли. Пути введения. При введении способом инъекции она может быть внутривенной, подкожной, внутримышечной, внутрибрюшинной или иного вида, известного в отрасли. Конструкты по настоящему изобретению могут быть введены в состав любой лекарственной формы, известной в отрасли, в том числе(но не только) в лекарственные формы в виде таблеток, капсул, каплет, суспензий, порошков, лиофилизованных препаратов, суппозиториев, глазных капель, накожных пластырей, растворимых лекарственных форм для перорального применения, спреев, аэрозолей и т.п., и могут быть смешаны с буферами,связующими, наполнителями, стабилизаторами, антиоксидантами и другими средствами, известными в отрасли. Как правило, может быть применен любой способ введения, посредством которого конструкты по настоящему изобретению вводятся сквозь слой эпидермальных клеток. Таким образом, способы введения включают введение сквозь слизистые оболочки, буккальное введение, пероральное введение, дермальное введение, ингаляционное введение, легочное введение, назальное введение, уретральное введение, вагинальное введение и т.п. Согласно одному аспекту конструкт по настоящему изобретению применяется в виде лекарственной формы для инъекций с пролонгированным высвобождением, например, конструкт по настоящему изобретению в сочетании с ПЭГ, полиортоэфиром или полимером PLGA. Согласно другому аспекту конструкт по настоящему изобретению применяется с помощью автоматического устройства для доставки, обеспечивающего непрерывное или периодическое подкожное введение. Любые вышеупомянутые способы и лекарственные формы особенно пригодны для лечения хронических состояний и синдромов, в том числе хронической застойной сердечной недостаточности и особенно хронической декомпенсированной застойной сердечной недостаточности. Согласно одному аспекту любой конструкт по настоящему изобретению может применяться путем подкожного введения, включая все способы, описанные в патенте США 6586396. Согласно другому аспекту пациент, особенно пациент в относительно компенсированном состоянии или пациент с застойной сердечной недостаточностью, находящийся на амбулаторном лечении, может применять конструкт по настоящему изобретению с использованием способов и доз, описанных в опубликованной заявке на патент США 2004/0077537 и опубликованной международной патентной заявке WO 2003/079979. Согласно еще одному аспекту пациент может применять конструкт по настоящему изобретению с использованием способов, описанных в опубликованной заявке на патент США 2005/0113286. Согласно еще одному аспекту для восстановления сердечной мышцы у пациента с поражением миокарда можно использовать способы, описанные в опубликованной заявке на патент США 2006/0019890. Конструкт по настоящему изобретению можно применять также с помощью чрескожного введения,в том числе с использованием систем доставки, в том числе аппаратуры и способов, описанных в опубликованной заявке на патент США 2006/0034903. Аналогично, гидрогельные лекарственные формы и твердые лекарственные формы, описанные в упомянутой заявке, могут быть адаптированы для применения конструктов по настоящему изобретению. Терапевтически эффективное количество. Как правило, реальное количество конструкта по настоящему изобретению, вводимое в организм пациента, варьирует в достаточно широких пределах в зависимости от способа введения, применяемой лекарственной формы и желательной реакции. Дозировка для лечения определяется введением в организм количества лекарственного средства, достаточного для- 17016804 обеспечения желательного терапевтического эффекта, с использованием любых вышеупомянутых способов или иных способов, известных в отрасли. Таким образом, терапевтически эффективное количество включает количество конструкта или фармацевтической композиции по настоящему изобретению, достаточное для индуцирования желательного эффекта, в том числе конкретно противогипертензивного эффекта, воздействия на сердечно-сосудистую систему, почки и/или эндокринную систему. Согласно одному аспекту терапевтически эффективным количеством является количество, вызывающее желательный натрийурез, диурез и/или расширение сосудов. Как правило, конструкты по настоящему изобретению имеют высокую активность. Например, эти конструкты можно применять в дозах приблизительно 0,001, 0,01, 0,05, 0,1, 0,5, 1, 5, 10 или 100 мг на 1 кг массы тела в зависимости от конкретного выбранного конструкта, желательной терапевтической реакции, способа введения, лекарственной формы и других факторов, известных специалистам в отрасли. Комплексная терапия Возможно и подразумевается также применение конструктов по различным вариантам осуществления настоящего изобретения в сочетании с другими лекарственными веществами или средствами, в частности, при лечении застойной сердечной недостаточности. Согласно еще одному аспекту настоящего изобретения предлагается способ лечения застойной сердечной недостаточности. Способ включает введение в организм пациента, страдающего застойной сердечной недостаточностью, терапевтически эффективного количества конструкта, описанного в настоящем документе, в сочетании с терапевтически эффективным количеством другого соединения, полезного при лечении застойной сердечной недостаточности, или, в альтернативном варианте, полезного для повышения биодоступности конструкта по настоящему изобретению в организме пациента. Согласно одному аспекту пациент может применять конструкт по настоящему изобретению в сочетании с диуретиком, например с употреблением способов и диуретиков, описанных в опубликованной заявке на патент США 2004/0063630. К диуретикам, которые могут применяться в таком сочетании, относятся тиазидные, контурные и калийсберегающие диуретики, в том числе (но не только) гидрохлортиазид (Hydrodiuril), хлорталиндон, фуросемид (Lasix), спиронолактон (Aldactone) и триамтерин. Согласно еще одному аспекту настоящего изобретения предлагается способ лечения застойной сердечной недостаточности путем применения терапевтически эффективного количества конструкта, описанного в настоящем документе, в сочетании с терапевтически эффективным количеством противогипертензивного средства, не являющегося диуретиком. К таким противогипертензивным средствам относятся, как правило, блокаторы кальциевых каналов(в том числе дигидропиридиновые и недигидропиридиновые), симпатолитические средства, неспецифические адреноблокаторные средства, -адренергические антагонисты (в том числе неселективные и селективные 1-блокаторные средства), -блокаторы (в том числе как неселективные, так и селективные блокаторы и блокаторы с собственным симпатомиметическим действием), сосудорасширяющие средства(для лечения стойкой и внезапно появляющейся гипертензии), ингибиторы ферментов преобразования ангиотензинов и антагонисты ангиотензина II. Противогипертензивные средства можно применять в сочетаниях, включающих смешанные - и -антагонисты, например лабетолол (Normodyne); сосудорасширяющие средства, например гиралазин (Apresoline), минокисдил (Loniten), нитропруссид (Nipride) или диазоксид (Hyperstat IV); блокаторы кальция, например нифедипин (Adalat), дилтиазем(Corgard), метопролол (Lopressor) или пиндолол. Другие показания. Хотя основной областью применения конструктов по настоящему изобретению является лечение и облегчение симптомов застойной сердечной недостаточности, острой почечной недостаточности и почечной гипертензии, конструкты по настоящему изобретению могут быть применены в любых схемах и видах лечения, при которых натрийуретические, диуретические и/или сосудорасширяющие соединения обеспечивают терапевтический эффект. Так, согласно одному аспекту конструкты по настоящему изобретению могут быть применены в качестве добавок к растворам для перитонеального диализа, как описано в патенте США 5965533. Согласно другому аспекту конструкты по настоящему изобретению могут быть применены в области офтальмологии, как описано в опубликованной патентной заявке WO 00/18422. Способы синтеза суррогатов аминокислоты Нижеприведенные примеры способов синтеза суррогатов аминокислот по настоящему изобретению имеют исключительно иллюстративный характер, и имеется в виду, что специалист в данной отрасли может внести в них изменения, и такие изменения охватываются объемом данного изобретения.- 18016804 Синтез кетопиперазиновых структур, имитирующих аминокислоты,без функционализированных боковых цепей R (способ А и способ В) Конструкты получали разнообразными способами, описанными в способе А и способе В. Способ А. Дипептиды (3) получали способом смешанных ангидридов, используя Вос-серин (OBn)ОН (1) и сложный -аминоэфир (2). Дипептиды получали с высокими выходами, и, как правило, они не требовали очистки. Восстановление как сложного метилового эфира, так и амидной группы выполняли,используя диборан в среде тетрагидрофурана, с защищенными вторичными аминогруппами и получали промежуточные ди-Вос-защищенные аминоспирты (4). После окисления этих спиртов дихроматом пиридиния (PDC) с сопутствующей циклизацией получали в одну стадию пиперазин-2-оны (5). Группу бензилового простого эфира удаляли гидрированием, после чего посредством замены группы защиты получали Fmoc-защищенные пиперазин-2-оны (6). Наконец, первичный спирт окисляли до кислоты одним из многочисленных различных способов (PDC, окисление по Джоунс (Jones), окисление с применением хлорида рутения и периодата натрия, окисление свободным радикалом 2,2,6,6-тетраметил-1 пиперидинилоксигрупы (TEMPO и получали конечные продукты (7). Способ А Синтез метилового сложного эфира 2-(3-бензилокси-2-трет-бутоксикарбониламинопропиониламино)-2-замещенной уксусной кислоты (3). К раствору 10 ммоль Вос-серинбензилового простого эфира (1) в 30 мл безводного тетрагидрофурана при -20 С в атмосфере азота добавляли 22 ммоль триэтиламина, после чего медленно добавляли 11,4 ммоль изобутилхлорформиата. Белое твердое вещество выпадало в осадок. Образовавшуюся суспензию перемешивали в течение 15 мин и затем добавляли одной порцией 11,1 ммоль сложного аминоэфира (2). Образовавшуюся суспензию перемешивали при -20 С в течение 30 мин и затем позволяли нагреться до комнатной температуры, перемешивали в течение 2 ч и затем выпаривали досуха. Затем смесь распределяли между 50 мл этилацетата и 30 мл 1 н. раствора хлористо-водородной кислоты. Слои разделяли и органический слой промывали 1 н. раствором хлористо-водородной кислоты (120 мл) и насыщенным раствором бикарбоната натрия (120 мл), сушили над сульфатом магния и концентрировали. Соединения (3) обычно получали с выходом приблизительно 90%, и они не требовали очистки. Синтез ди-Вос-2-замещенного-(2-амино-3-бензилоксипропиламино)-этанола (4). К раствору 35 ммоль соединения (3) в 50 мл безводного тетрагидрофурана при комнатной температуре в атмосфере азота добавляли 200 мл 1 н. раствора диборана в тетрагидрофуране. Полученный раствор перемешивали при комнатной температуре в течение ночи и затем медленно выливали в 200 мл охлажденного льдом 1 н. раствора хлористо-водородной кислоты. Полученный двухфазный раствор затем нейтрализовали твердым гидроксидом натрия. Добавляли 140 мл насыщеного раствора бикарбоната натрия, после чего 70 ммоль ди-трет-бутилбикарбоната и смесь перемешивали в течение 2 суток при комнатной температуре, разводили этилацетатом (200 мл) и разделяли слои. Органический слой сушили над сульфатом магния и концентрировали. Продукты (4) очищали хроматографией на колонке с силикагелем. Синтез 1,4-ди-Вос-6-бензилоксиметил-3-замещенного-пиперазин-2-она (5). Раствор 70 ммоль соединения (4) и 400 ммоль дихромата пиридиния в 300 мл безводного диметилформамида перемешивали при 48 С в атмосфере азота в течение 6 ч, охлаждали до комнатной температуры, выливали в 1500 мл воды и экстрагировали 4500 мл диэтилового эфира. Эфирные слои объединяли, сушили над сульфатом магния и концентрировали. Продукты (5) очищали хроматографией на колонке с силикагелем. Синтез 4-Fmoc-6-гидроксиметил-3-замещенного-пиперазин-2-она (6). Суспензию 19 ммоль соединения (5) и 2 г 10% палладия на угле в 200 мл этанола гидрировали при комнатной температуре и атмосферном давлении в течение ночи. Суспензию фильтровали через целит и концентрировали. Остаток снова растворяли в 40 мл 50% раствора трифторуксусной кислоты в дихлорметане. Полученный раствор перемешивали при комнатной температуре в течение 2 ч и затем концентрировали. Остаток снова растворяли в 60 мл тетрагидрофурана и 40 мл воды и нейтрализовали твердым бикарбонатом натрия, после чего добавляли 40 ммоль твердого бикарбоната натрия и 20 ммоль хлоридаFmoc. Затем смесь перемешивали при комнатной температуре в течение 2 ч, разводили этилацетатом(300 мл) и слои разделяли. Органический слой сушили над сульфатом магния, концентрировали и очищали хроматографией на колонке с силикагелем.(а) К двухфазному раствору 10 ммоль соединения (6) в 180 мл ацетонитрила, 180 мл тетрахлорметана и 240 мл воды, охлажденному до 0 С, добавляли 112 ммоль твердого периодата натрия, после чего 340 мг хлорида рутения. Реакционной смеси позволяли нагреться до комнатной температуры, перемешивали в течение 2 ч и затем фильтровали через целит. Слои разделяли и водный слой повторно экстрагировали этилацетатом (275 мл). Органические слои объединяли, сушили над сульфатом магния и концентрировали.(b) Раствор 12 ммоль соединения (6) и 59 ммоль PDC в 60 мл безводного диметилформамида перемешивали при 48 С в атмосфере азота в течение приблизительно 5 ч, охлаждали до комнатной температуры, выливали в 600 мл воды и экстрагировали дихлорметаном (3200 мл). Органические слои объединяли, сушили над сульфатом магния и концентрировали.(c) К раствору 17 ммоль соединения (6) в 350 мл ацетона при комнатной температуре добавляли 25- 21016804 мл реагента Джоунса (приготовленного из 8,0 г хромовой кислоты, 17,4 мл воды и 6,9 мл концентрированной серной кислоты). Смесь перемешивали в течение 1 ч, добавляли 150 мл изопропанола и смесь фильтровали через целит. Целит промывали этилацетатом. Органические слои объединяли и концентрировали. Остаток растворяли в 250 мл этилацетата и промывали водой (250 мл), сушили над сульфатом магния и концентрировали.(d) К раствору 81 ммоль спирта (6) в 810 мл ацетонитрила при комнатной температуре добавляли раствор фосфатного буфера (приготовленного из 7,2 г моноосновного фосфата натрия и 14,3 г двухосновного фосфата натрия в 295 мл воды), после чего добавляли 3,3 г (20,7 ммоль) соединения TEMPO и 18,6 г (164,4 ммоль) хлорита натрия, полученный двухфазный раствор помещали в масляную баню, нагретую до 43 С, и затем медленно добавляли 43,3 мл (25,9 ммоль) раствора гипохлорита натрия (приготовленного смешиванием 19,3 мл 10-13% раствора гипохлорита натрия и 24 мл воды). Реакционную смесь перемешивали при 43 С в течение 4 ч. Полученный раствор охлаждали до комнатной температуры и добавляли 200 мл 10% раствора гидросульфита натрия, перемешивали в течение 10 мин, разводили этилацетатом (500 мл) и слои разделяли. Органический слой промывали рассолом (1100 мл), 1 н. раствором хлористо-водородной кислоты (1160 мл), сушили над сульфатом натрия и концентрировали. Продукты (7) очищали хроматографией на колонке с силикагелем. Способ В. Промежуточные ди-Вос-2-замещенные-(2-амино-3-бензилоксипропиламино)этанолы (4),полученные, как описано в способе А, окисляли до кислот, используя реагент TEMPO с изоциануровой кислотой, и затем эстерифицировали йодметаном, получая полностью защищенные восстановленные аналоги дипептидов (8). После отщепления Вос-групп и группы бензилового простого эфира получали 3 замещенные 5-гидроксиметилпиперазин-2-оны, которые защищали как Fmoc-производные, получая соединение (6), которое окисляли до конечного продукта, как описано в способе А. Способ В Синтез метилового сложного эфира ди-Вос-(2-амино-3-бензилоксипропиламино)-2-замещенной уксусной кислоты (8).- 22016804 К суспензии 76 ммоль соединения (4) в 680 мл ацетона и 210 мл насыщенного раствора бикарбоната натрия при 0 С добавляли 21 ммоль твердого бромида натрия и 2,9 ммоль TEMPO, после чего медленно добавляли 156 ммоль трихлоризоциануровой кислоты. Реакционную смесь перемешивали в течение 30 мин при 0 С и затем при комнатной температуре в течение ночи подкисляли 1 н. раствором хлористо-водородной кислоты и экстрагировали этилацетатом (2300 мл). Органический слой промывали 1 н. раствором хлористо-водородной кислоты (350 мл), сушили над сульфатом магния и концентрировали. Остаток снова растворяли в смеси 40 мл безводного диметилформамида и 95 ммоль твердого бикарбоната натрия, добавляли 112 ммоль йодметана и смесь перемешивали при комнатной температуре в атмосфере азота, пока высокоэффективная жидкостная хроматография (ВЭЖХ) не показала завершение реакции; полученный раствор затем разводили диэтиловым эфиром (200 мл) и промывали водой (2100 мл),сушили над сульфатом магния и концентрировали. Продукты (8) очищали хроматографией на колонке с силикагелем. Синтез 4-Fmoc-6-гидроксиметил-3-замещенного-пиперазин-2-она (6). Раствор 36 ммоль соединения (8) в 40 мл 50% раствора трифторуксусной кислоты в дихлорметане перемешивали при комнатной температуре в течение 2 ч и затем выливали в 200 мл насыщенного раствора бикарбоната натрия. Слои разделяли и органический слой концентрировали. Остаток снова растворяли в 100 мл этилацетата, промывали водой (250 мл), сушили над сульфатом магния и концентрировали. Остаток растворяли в 100 мл этанола, добавляли 5 г 10% палладия на угле и 35 мл 1 н. раствора хлористо-водородной кислоты и смесь гидрировали при комнатной температуре и атмосферном давлении,пока высокоэффективная жидкостная хроматография (ВЭЖХ) не показала завершение реакции; затем полученный раствор фильтровали через целит и концентрировали. Остаток снова растворяли в 80 мл этилацетата, добавляли раствор 70 ммоль бикарбоната натрия в 30 мл воды и смесь перемешивали при комнатной температуре в течение ночи. Этилацетат удаляли и добавляли 100 мл тетрагидрофурана, после чего 178 ммоль твердого бикарбоната натрия и 43 ммоль хлорида Fmoc и смесь перемешивали, пока ВЭЖХ не показала завершение реакции, разводили этилацетатом (300 мл) и слои разделяли. Органический слой промывали водой (250 мл), сушили над сульфатом магния и концентрировали. Продукты (6) очищали хроматографией на колонке с силикагелем. Синтез 4-Fmoc-5-замещенной-6-оксопиперазин-2-карбоновой кислоты (7). Соединения (7) получали, как описано в способе А. Общая схема синтеза для получения кетопиперазиновых структур, пригодных для соединений с функционализированными боковыми цепями R или без таких цепей (способы С, E, F) Способ С: метиловые сложные эфиры (2-Fmoc-амино-3-R'-O-пропиламино)-2-замещенной уксусной кислоты (10) получали восстановительным аминированием Fmoc-O-защищенного сериналя (альдегида серина) (9) сложными -аминоэфирами (2), используя в качестве восстановительного реагента или цианоборгидрид натрия, или триацетоксиборгидрид натрия. Fmoc-O-защищенный сериналь (9), необходимый для восстановительного аминирования, получали в соответствии со способом D восстановлением сложного эфира (12) гидридом диизобутилалюминия, окислением Fmoc-O-защищенного серинола (13) периодинином по Дессу-Мартину (Dess-Martin) или восстановлением вайнреб-амида Fmoc-Oзащищенного серина (14) алюмогидридом лития. Предпочтительным способом получения Fmoc-Oзащищенных сериналей (9) является восстановление аналога вайнреб-амида. Затем метиловые сложные эфиры (2-Fmoc-амино-3-R'-О-пропиламино)-2-замещенной уксусной кислоты (10) подвергали отщеплению групп защиты N и О, циклизовали и вводили группу защиты Fmoc, получая 3-замещенные 6 гидроксиметилпиперазин-2-оны (6), которые затем окисляли до конечного продукта, как описано в способе А. Группы защиты (R') при гидроксильной группе Fmoc-O-защищенного сериналя (9), используемые в синтезе, зависели от природы боковой цепи R сложного аминоэфира. Если R не содержал функциональ- 23016804 ных групп, боковую цепь Fmoc-серина защищали как трет-бутиловый простой эфир. Если R содержал функциональные группы, боковую цепь Fmoc-серина защищали как тритиловый простой эфир. Способ С Способ D. Синтез различных Fmoc-O-защищенных сериналей (9). Синтез метилового сложного эфира Fmoc-O-R'-серина (12). Разбавленную суспензию 80 ммоль Fmoc-O-R'-серина (11), 10,0 г (120 ммоль) твердого бикарбоната натрия и 10,0 мл (160 ммоль) йодметана в 80 мл безводного диметилформамида перемешивали при комнатной температуре в атмосфере азота в течение ночи. Затем реакционную смесь выливали в 500 мл воды и образовавшееся твердое вещество отфильтровывали. Твердое вещество снова растворяли в 800 мл этилацетата, промывали водой (1200 мл), сушили над сульфатом магния и концентрировали. Очистка не требовалась.- 24016804 Синтез Fmoc-O-R'-серинола (13). К раствору 10,0 ммоль Fmoc-O-R'-серина (11) в 50 мл безводного тетрагидрофурана при -20 С в атмосфере азота добавляли 1,77 мл (12,7 ммоль) триэтиламина, после чего медленно добавляли 1,57 мл(12,0 ммоль) изобутилхлорформиата. Смесь перемешивали в течение 30 мин и затем медленно выливали в охлажденный льдом раствор 3,77 г (99,6 ммоль) боргидрида натрия в 10 мл воды, поддерживая температуру ниже 5 С. Реакционную смесь перемешивали при 0 С в течение 15 мин и затем гасили 1 н. раствором хлористо-водородной кислоты. Реакционную смесь разводили этилацетатом (100 мл) и слои разделяли. Органический слой промывали 1 н. раствором хлористо-водородной кислоты (225 мл), водой(225 мл), сушили над сульфатом магния и концентрировали. Соединения очищали хроматографией на колонке с силикагелем. Синтез вайнреб-амида Fmoc-O-R'-серина (14). Суспензию 20,2 ммоль Fmoc-O-R'-серина (11), 6,98 г (21,6 ммоль) тетрафторбората 2-(1Hбензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU) и 2,5 мл (22,7 ммоль) N-метилморфолина в 80 мл безводного дихлорметана перемешивали при комнатной температуре в атмосфере азота в течение 20 мин и затем добавляли 3,02 г (31 ммоль) гидрохлорида N,О-диметилгидроксиламина и 3,3 мл (30 ммоль) Nметилморфолина и суспензию перемешивали при комнатной температуре в течение ночи. Затем образовавшийся раствор выпаривали досуха, остаток распределяли между 200 мл этилацетата и 100 мл воды,промывали 1 н. раствором хлористо-водородной кислоты (240 мл) и затем насыщенным раствором бикарбоната натрия (240 мл), сушили над сульфатом магния и концентрировали. Очистка не требовалась. Синтез Fmoc-O-R'-сериналя (9) из сложного эфира (12). К раствору 3,5 ммоль соединения (12) в 5 мл тетрагидрофурана при -78 С в атмосфере азота медленно добавляли 10 мл 1 н. раствора гидрида диизобутилалюминия (DIBAL), перемешивали в течение 15 мин и гасили медленным добавлением насыщеного раствора тартрата натрия-калия. Реакционной смеси позволяли нагреться до комнатной температуры, разводили этилацетатом (50 мл) и добавляли 50 мл насыщеного раствора тартрата натрия-калия. Слои разделяли и водный слой повторно экстрагировали этилацетатом (150 мл). Органические слои объединяли, сушили над сульфатом магния и концентрировали. Соединения (9) использовали на следующей стадии без дополнительной очистки. Синтез Fmoc-O-R'-сериналя (9) из спирта (13). К раствору 80 ммоль Fmoc-O-R'-серинола (13) в 200 мл безводного дихлорметана при комнатной температуре в атмосфере азота добавляли 88 ммоль периодинана Десса-Мартина и реакционную смесь перемешивали в течение 2,5 ч и гасили добавлением 400 мл 10% водного раствора тиосульфата натрия. Слои разделяли, органический слой концентрировали, разводили диэтиловым эфиром (300 мл) и промывали трижды насыщенным водным раствором бикарбоната, содержащим 10% тиосульфата натрия, сушили над сульфатом магния и концентрировали. Синтез Fmoc-O-R'-сериналя (9) из вайнреб-амида (14). К раствору 8,8 г (20,2 ммоль) неочищенного промежуточного вайнреб-амида Fmoc-O-R'-серина (14) в 60 мл безводного тетрагидрофурана, охлажденному до -78 С, в атмосфере азота, добавляли 30 мл 1 н. раствора алюмогидрида лития в тетрагидрофуране. Полученный раствор перемешивали в течение 15 мин и затем гасили медленным добавлением 30 мл 1,4 н. раствора гидросульфата калия. После нагревания до комнатной температуры образовавшееся твердое вещество отфильтровывали и фильтрат выпаривали досуха. Остаток снова распределяли между 50 мл этилацетата и 25 мл 1 н. раствора хлористо-водородной кислоты. Слои разделяли и органический слой сушили над сульфатом магния, фильтровали и концентрировали. Синтез метилового сложного эфира (2-Fmoc-амино-3-R'-O-пропиламино)-2-замещенной уксусной кислоты (10). Соединения (10) получали восстановительным аминированием, используя в качестве восстановительного реагента цианоборгидрид натрия или триацетоксиборгидрид натрия. Способ с использованием цианоборгидрида натрия. К раствору 8,5 ммоль гидрохлорида соединения(2) в 20 мл метанола при комнатной температуре в атмосфере азота добавляли 2,3 ммоль твердого гидроксида калия и смесь перемешивали в течение 25 мин. К вышеупомянутой суспензии добавляли растворFmoc-O-R'-сериналя (9) в 10 мл метанола и реакционную смесь перемешивали в течение 1 ч. Медленно добавляли 8,5 мл 1 н. раствора цианоборгидрида натрия в тетрагидрофуране, реакционную смесь перемешивали еще 1 ч, фильтровали и концентрировали. Остаток распределяли между этилацетатом и водой и органический слой промывали насыщенным раствором бикарбоната натрия (120 мл), сушили над сульфатом натрия и концентрировали. Способ с использованием триацетоксиборгидрида натрия. Суспензию 21 ммоль гидрохлорида соединения (2) и 2,9 мл (21 ммоль) триэтиламина в 50 мл безводного тетрагидрофурана перемешивали при комнатной температуре в течение 45 мин и затем добавляли раствор приблизительно 20 ммоль неочищенного Fmoc-(О-R')-сериналя (9) в 30 мл тетрагидрофурана, после чего 1,7 г порошкообразного молекулярного сита 4 и суспензию перемешивали в течение еще 2 ч. Добавляли 6,4 г (30 ммоль) твердого триацетоксиборгидрида натрия и суспензию перемешивали при комнатной температуре в течение ночи. Суспензию разводили метанолом, молекулярное сито отфильтровывали и фильтрат концентрировали. Остаток распределяли между 100 мл этилацетата и 50 мл воды. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Соединения (10) очищали хроматографией на колонке с силикагелем. Синтез 4-Fmoc-6-гидроксиметил-3-замещенного-пиперазин-2-она (6). Для получения соединений (6) необходимы три стадии: (а) отщепление группы защиты Fmoc с одновременной циклизацией, (b) введение группы защиты Fmoc и (с) отщепление группы защиты гидроксила. Отщепление группы Fmoc и циклизация. Раствор 10 ммоль циклического соединения в 30 мл 30% раствора диэтиламина в этилацетате перемешивали при комнатной температуре в течение ночи и затем выпаривали досуха.(a) Введение группы защиты Fmoc. К двухфазному раствору 10 ммоль соединения в 20 мл тетрагидрофурана и 10 мл воды добавляли 2,52 г (30 ммоль) твердого бикарбоната натрия, после чего добавляли 3,36 г (13 ммоль) соединения Fmoc-Cl. Смесь перемешивали в течение 3 ч, разводили этилацетатом,слои разделяли и органический слой промывали водой, сушили над сульфатом магния и концентрировали.(b) Отщепление группы защиты гидроксила. Для соединений, которые содержат группу защиты трет-бутилового простого эфира. Соединения подвергали отщеплению группы защиты 90% раствором трифторуксусной кислоты в дихлорметане в течение 1-2 ч и затем выпаривали досуха. Остаток растворяли в этилацетате и промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом магния и затем концентрировали. Для соединений, которые содержат группу защиты Trt простого эфира,соединения подвергали отщеплению группы защиты добавлением 1-10% раствора трифторуксусной кислоты в дихлорметане, содержащего 2-10% триизопропилсилана. Реакция проходила мгновенно. Полученный раствор затем нейтрализовали, выливая его в насыщенный раствор бикарбоната натрия. Слои разделяли, сушили над сульфатом натрия и концентрировали. Соединения (6) очищали хроматографией на колонке с силикагелем.
МПК / Метки
МПК: A61K 38/12
Метки: конструкты, циклические, натрийуретических, пептидов
Код ссылки
<a href="https://eas.patents.su/30-16804-ciklicheskie-konstrukty-natrijjureticheskih-peptidov.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические конструкты натрийуретических пептидов</a>
Предыдущий патент: Лечение инфекционных заболеваний
Следующий патент: Способ изготовления пирога с применением фосфолипазы
Случайный патент: Способ обеспечения экспрессии аполипопротеина в растениях и растения и их семена, содержащие аполипопротеин












