Производные 5-тиоксилопиранозы
Формула / Реферат
1. Производное тиоксилозы, характеризующееся тем, что оно выбрано из соединений формулы
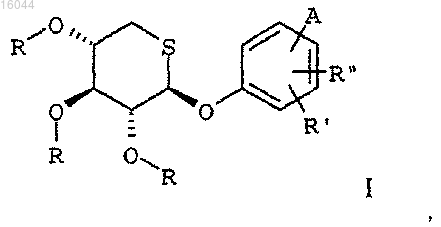
где R представляет собой атом водорода или C2-C6 ацильную группу,
каждый из R' и R" независимо представляет собой атом водорода, атом галогена или C1-C4 алкильную группу,
A представляет собой 5- или 6-членное гетероароматическое кольцо формулы
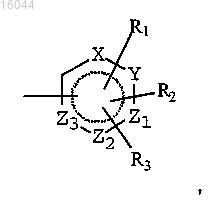
где X представляет собой атом азота, кислорода или серы,
Y представляет собой атом углерода или простую связь,
каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота,
каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу, C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или C1-C4 диалкиламиногруппу или
R1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу, и их солей присоединения.
2. Соединение по п.1, где R1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A представляет собой бензотиазолильную, бензофуранильную, индолильную или бензотиенильную группу.
3. Соединение по п.1 или 2, характеризующееся тем, что 5-тио-β-D-ксилопиранозильная группа и A находятся на бензольном кольце в мета-положении относительно друг друга.
4. Соединение по п.1 или 2, характеризующееся тем, что 5-тио-β-D-ксилопиранозильная группа и A находятся на бензольном кольце в пара-положении относительно друг друга.
5. Соединение по любому из пп.1-4, характеризующееся тем, что A представляет собой пиридиновое кольцо, возможно имеющее в качестве заместителей по меньшей мере одну из групп R1, R2 и R3, таких как определено в п.1.
6. Соединение по любому из пп.1-5, характеризующееся тем, что R представляет собой атом водорода.
7. Соединение по любому из пп.1-5, характеризующееся тем, что R представляет собой группу COCH3.
8. Способ получения соединения по п.1, включающий следующие стадии: а) взаимодействия соединения формулы

где Hal представляет собой атом галогена, каждый из R' и R" независимо представляет собой атом водорода, атом галогена (кроме атома брома или иода) или C1-C4 алкильную группу и R представляет собой атом водорода или C2-C6 ацильную группу, с гетероарилбороновой кислотой или алкилгетероарилборонатом формулы

где X представляет собой атом азота, кислорода или серы,
Y представляет собой атом углерода или простую связь,
каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота,
каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу, C1-C4 алкильную группу, гидроксильную группу C1-C4 алкоксигруппу, трифторметильную группу или C1-C4 диалкиламиногруппу или
R1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу,
Alk представляет собой атом водорода или C1-C4 алкильную группу, или
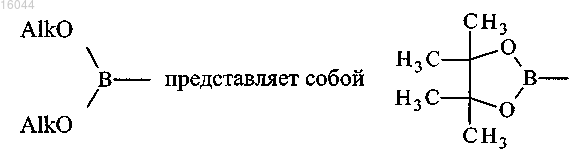
в присутствии палладиевого катализатора и фторида цезия или карбоната натрия, или других неорганических оснований, в полярном растворителе при температуре от 70 до 150°C в течение интервала времени от 5 мин до 72 ч, с получением соединения формулы
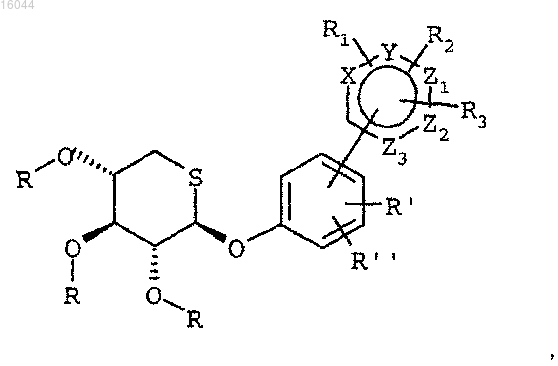
где R, R1, R2, R3, R', R", X, Y, Z1, Z2 и Z3 имеют те же значения, что и в формулах исходных веществ;
б) при необходимости, взаимодействия полученного на предыдущей стадии соединения формулы I с раствором аммиака в метаноле с выполнением деацилирования и, соответственно, замещением ацильной группы атомами водорода с получением соединения формулы
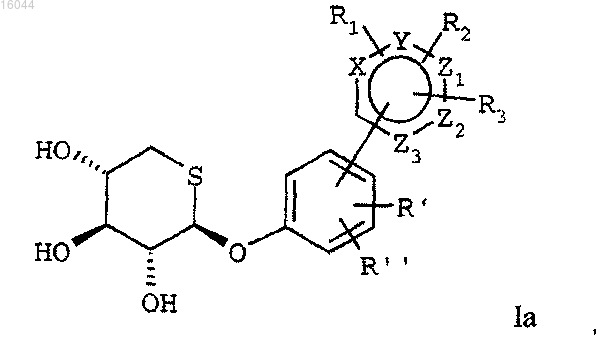
где R1, R2, R3, R', R", X, Y, Z1, Z2 и Z3 имеют те же значения, что и выше;
в) при необходимости, взаимодействия полученных на предыдущих стадиях соединений I или Ia с кислотой с получением соответствующей соли присоединения.
9. Применение соединения по любому из пп.1-7 в качестве фармакологически активного вещества.
10. Применение соединения по любому из пп.1-7 для приготовления лекарства, предназначенного для предупреждения или лечения тромбоза.
11. Применение по п.10 для приготовления лекарства, предназначенного для предупреждения или лечения венозного тромбоза.
12. Применение соединения по любому из пп.1-7 для приготовления лекарства, предназначенного для предупреждения рестеноза после ангиопластики или для предупреждения патологий тромбоэмболического типа.
13. Применение соединения по любому из пп.1-7 для приготовления лекарства, предназначенного для предупреждения или лечения сердечной недостаточности.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Данное изобретение относится к новым соединениям 5-тиоксилозы, предпочтительно к производным 5-тиоксилопиранозы, формулы (I) к способу их получения и к применению указанных соединений в качестве активного ингредиента в лекарствах, предназначенных главным образом для лечения или предупреждения тромбоза, или сердечной недостаточности, или тромбоэмболических заболеваний. 016044 Изобретение относится к новым производным 5-тиоксилозы, предпочтительно к производным 5 тиоксилопиранозы, к способу их получения и к применению указанных соединений в качестве активного вещества в лекарствах, предназначенных, в частности, для лечения или предупреждения тромбоза. Предшествующий уровень техники Производные D-ксилозы или 5D-тиоксилозы уже известны, например описаны в EP 051023 B1,EP 290321 B1, EP 365397 B1, EP 367321 B1, EP 421829 B1, EP 451007 B1 и WO 2005/030785 или в публикациях J. Med. Chem. Vol. 36,7, pp 898-903 и Eur. J. Med. Chem., Vol. 30, pp 101S-105S (1995). Соединения, описанные в данных документах, являются полезными для снижения риска возникновения венозного тромбоза у человека. Механизм действия данных соединений обусловлен, по-видимому, их воздействием на гликозаминогликаны (J. Biol. Chem., Vol. 270,6, pp 2662-68; Thromb. Haemost., 1999, 81, pp 945-950). Данные соединения содержат агликоновую часть, имеющую ароматическую структуру, такую как различные замещенные бензопираноновые, бензофеноновые, фенильные или пиридиновые производные. В контексте данного описания термин "агликоновая часть" означает несахарный (non-glucide) компонент данных соединений. Кроме того, известно, что благоприятное действие транслюминальной коронарной ангиопластики может быть снижено вследствие рестеноза данного кровеносного сосуда, что, соответственно, приводит к новой обструкции просвета артерии. Соответственно, наибольшее преимущество в плане поддержания удовлетворительного состояния после хирургического вмешательства по поводу артериосклероза отдается соединениям, которые позволяют предотвратить рестеноз. Объект изобретения Объектом настоящего изобретения являются открытые новые соединения, которые структурно отличаются от соединений, уже известных в данной области техники, обладают хорошей эффективностью при пероральном введении и дают отличный фармакологический результат (обычно приблизительно 100%) при использовании для снижения риска возникновения артериального или венозного тромбоза. Краткое изложение сущности изобретения Соединения согласно изобретению отличаются тем, что они выбраны из соединений формулы где R представляет собой атом водорода или C2-C6 ацильную группу,каждый из R' и R" независимо представляет собой атом водорода, атом галогена или C1-C4 алкильную группу,A представляет собой 5- или 6-членное гетероароматическое кольцо формулы где X представляет собой атом азота, кислорода или серы,Y представляет собой атом углерода или простую связь,каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота,каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу илиR1, и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу,и их солей присоединения. Изобретение также относится к применению соединений формулы I в качестве фармакологически активного вещества. В частности, изобретение относится к применению по меньшей мере одного вещества, выбранного из соединений формулы I и их нетоксичных солей, в приготовлении лекарства, полезного в терапии человека или животного, предназначенного для предупреждения или лечения тромбоза, в частности венозного тромбоза. Соединения согласно изобретению также являются полезными в качестве активных веществ в лекарствах, предназначенных для предупреждения рестеноза после транслюминальной коронарной ангиопластики. Так как соединения согласно изобретению в соответствии с механизмом их действия проявляют активность в отношении гликозаминогликанов, они также могут являться полезными в каче-1 016044 стве активного вещества в лекарстве, предназначенном для лечения или предупреждения любого другого заболевания, в которое вовлечены гликозаминогликаны. Подробное описание изобретения В контексте данного описания термин "C1-C4 алкильная группа" в формуле I означает насыщенную нормальную или разветвленную углеводородную цепь, имеющую от 1 до 4 атомов углерода, или частично или полностью циклизованную насыщенную нормальную или разветвленную углеводородную цепь,имеющую от 1 до 4 атомов углерода, где циклическая часть имеет 3 или 4 атома углерода. В качестве примеров C1-C4 алкильных групп можно привести, в частности, метильную, этильную, пропильную, бутильную, 1-метилэтильную, 1,1-диметилэтильную, 1-метилпропильную, 2-метилпропильную, циклопропильную или циклопропилметильную группу. В контексте данного описания термин "галоген" означает атом фтора, хлора, брома или иода, и предпочтительно атом фтора или хлора. В контексте данного описания термин "C2-C6 ацильная группа" означает группу R-CO-, где R представляет собой алкильную группу, такую, как определено выше, имеющую от 1 до 5 атомов углерода. В качестве примеров C2-C6 ацильных групп можно привести, в частности, ацетильную, пропаноильную,бутаноильную, пентаноильную или гексаноильную группу и их гомологи, которые могут иметь разветвленную цепь. В контексте данного описания термин "C1-C4 алкоксигруппа" означает группу RO-, где R представляет собой алкильную группу, имеющую от 1 до 4 атомов углерода, такую, как определено выше. В качестве примеров C1-C4 алкоксигрупп можно привести метокси-, этокси-, пропокси-, бутокси-, 1 метилэтокси-, 1,1-диметилэтокси-, 1-метилпропокси-, 2-метилпропокси- или циклопропилметоксигруппу. В контексте данного описания термин "диалкиламиногруппа" означает группу -NRR", где R и R" независимо представляют собой C1-C4 алкильную группу, такую как определено выше. В контексте данного описания термин "соли присоединения" означает соли присоединения, полученные путем взаимодействия соединения формулы I с неорганической или органической кислотой. Предпочтительно, когда соли присоединения представляют собой фармацевтически приемлемые соли присоединения. Гидраты или сольват соединений формулы I или солей соединений формулы I также входят в объем изобретения. Среди неорганических кислот, подходящих для образования солей основных соединений формулыI, предпочтение отдается соляной, бромистоводородной, фосфорной и серной кислоте. Среди органических кислот, подходящих для образования солей основных соединений формулы I, предпочтение отдается метансульфоновой, бензолсульфоновой, толуолсульфоновой, малеиновой, фумаровой, щавелевой,лимонной, винной, молочной и трифторуксусной кислоте. В контексте данного описания термин "активные метаболиты" означает соединения, которые продуцируются в биологической среде из соединений формулы I и имеют фармакологическую активность той же природы, что и соединения формулы I, описанные в настоящей заявке на патент. Например, соединения формулы I могут быть метаболизированы в результате реакции гидроксилирования с получением нового соединения (метаболита), которое(ый) проявляет фармакологическую активность той же природы, что и исходные соединения формулы I. В качестве конкретных примеров конденсированных бициклических групп, представленных A в том случае, когда R1 и R2 вместе образуют ароматическое кольцо, содержащее 6 атомов углерода, можно привести бензофуранильную, бензотиенильную, бензизоксазолильную, бензоксазолильную, бензимидазолильную, хинолинильную, хиноксалинильную, хиназолинильную, индолильную, бензотиазолильную или индазолильную группу. Среди соединений согласно настоящему изобретению особое предпочтение отдается тем соединениям, у которых A представляет собой пиридинильное кольцо. Среди соединений согласно настоящему изобретению предпочтение отдается также тем соединениям, у которых R представляет собой атом водорода или группу -COCH3. Соединения, которые являются в особенности предпочтительными согласно настоящему изобретению, представляют собой соединения формулы I, у которых пиридинильное кольцо и тиоксилозидная группа находятся на бензольном кольце в мета-положении относительно друг друга. Другие предпочтительные соединения в контексте настоящего изобретения представляют собой соединения вышеупомянутой формулы I, у которых пиридинильное кольцо и тиоксилозидная группа находятся на бензольном кольце в пара-положении относительно друг друга. Соединения формулы I согласно изобретению могут быть получены с использованием методик гликозилирования, известных специалисту в данной области техники, в частности: а) методики Хельфериха, описанной в работе "The Carbohydrate, Chemistry and Biochemistry", 2ndedition, Academic Press, New York-London, 1972, Volume IA, pp 292-294, путем конденсации перацетилированного сахара с производным фенола в присутствии кислоты Льюиса; б) методики Кенигса-Кнорра (там же, рр 295-299), путем конденсации галогензамещенной ацилозы(acylose) с гидроксильной группой, имеющей фенольную природу, в присутствии акцептора протонов,-2 016044 такого как цианистая ртуть, имидазолат серебра или трифторметансульфонат серебра; в) методики Шмидта, путем конденсации озила (osyl) трихлорацетимидата с производным фенола в присутствии кислоты Льюиса, такой как, например, триметилсилил трифторметансульфонат или эфират трифторида бора. Соединения формулы I предпочтительно получают в соответствии со способами, разработанными на основе вышеприведенных методик. Первый из указанных общих способов включает выполнение следующих стадий: а) взаимодействия фенола формулы где каждый из R' и R" независимо представляет собой атом водорода, атом галогена или C1-C4 алкильную группу,A представляет собой 5- или 6-членное ароматическое кольцо формулы где X представляет собой атом азота, кислорода или серы;Y представляет собой атом углерода или простую связь; каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота; каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или диалкиламиногруппу или;R1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу, в частности бензотиазолильную, бензофуранильную, индолильную или бензотиенильную группу, с производным 5-тиоксилопиранозы формулы где Hal представляет собой атом галогена, предпочтительно атом брома, и R представляет собой C2C6 ацильную группу, предпочтительно ацетильную группу, в апротонном растворителе, таком как ацетонитрил или толуол, в присутствии соли серебра, в частности оксида или имидазолата серебра, или соли цинка (в частности оксида или хлорида), в безводной среде при температуре от 25 до 110C в течение 110 ч, с целью получения соединения формулы где A, R, R' и R" имеют те же значения, что и в формулах исходных соединений; б) при необходимости, взаимодействия полученного на предыдущей стадии соединения формулы I с раствором аммиака в метаноле с целью выполнения деацилирования и, соответственно, замещения ацильной группы атомами водорода с получением соединения формулы где R1 и R2 имеют те же значения, что и выше; в) при необходимости, взаимодействия полученных на предыдущих стадиях соединений I или Ia с кислотой в соответствии с методиками, известными специалисту в данной области техники, с целью получения соответствующей соли присоединения. Альтернативно с целью получения соединения формулы Ia из соединения формулы I, где R представляет собой C2-C6 ацильную группу, описанное выше замещение ацильной группы атомом водорода(стадия б) может быть осуществлено действием каталитического количества алкоксида металла, пред-3 016044 почтительно метилата натрия, в метаноле при температуре от 0 до 30C в течение 0,5-2 ч. В соответствии со вторым способом соединения формулы I могут быть получены путем взаимодействия тетра-O-ацетил-5-тиоксилопиранозы формулы где Ac представляет собой ацетильную группу, с фенолом формулы где каждый из R' и R" независимо представляет собой атом водорода, атом галогена или C1-C4 алкильную группу,A представляет собой 5- или 6-членное ароматическое кольцо формулы где X представляет собой атом азота, кислорода или серы;Y представляет собой атом углерода или простую связь; каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота; каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или диалкиламиногруппу; илиR1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу, в частности бензотиазолильную, бензофуранильную, индолильную или бензотиенильную группу, в апротонном растворителе, таком как, например, дихлорметан, в присутствии катализатора типа кислоты Льюиса, например тетрахлорида олова, при температуре от 20 до 60C в течение 1-2 ч; с целью получения соединения формулы где A, R, R' и R" имеют те же значения, что и в формулах исходных соединений. С целью получения незамещенного пиранозильного соединения (Ia) и/или соли присоединения кислоты соединение формулы I может быть подвергнуто дальнейшему превращению в соответствии с описанным выше протоколом предыдущего способа. В соответствии с третьим способом соединения формулы I могут быть получены путем взаимодействия производного тиоксилозы формулы где Ac представляет собой ацетильную группу, с фенолом формулы где каждый из R' и R" независимо представляет собой атом водорода, атом галогена или C1-C4 алкильную группу,A представляет собой 5- или 6-членное ароматическое кольцо формулы где X представляет собой атом азота, кислорода или серы,Y представляет собой атом углерода или простую связь,каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота,-4 016044 каждый из R1, R2 И R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или диалкиламиногруппу илиR1, и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, и A, соответственно, представляет собой конденсированную бициклическую группу, в частности бензотиазолильную, бензофуранильную, индолильную или бензотиенильную группу, в апротонном растворителе, таком как дихлорметан, в присутствии катализатора, такого как триметилсилил трифторметансульфонат, при температуре в диапазоне от -25C до температуры окружающей среды в течение 1-5 ч, с целью получения тиоксилопиранозида формулы где A, R' и R" имеют те же значения, что и в формулах исходных соединений. Соединение формулы Iб, полученное таким образом, может быть подвергнуто дальнейшему превращению с целью получения незамещенных пиранозильных соединений и/или солей присоединения кислот. Соединения формулы I согласно изобретению также могут быть получены предпочтительно из галогензамещенных производных гликозилированного бензольного кольца в результате реакции сочетания Сузуки между двумя ароматическими и гетероароматическими кольцами. Общий способ включает выполнение следующих стадий: а) взаимодействия соединения формулы где Hal представляет собой атом галогена, предпочтительно атом брома или иода, каждый из R' иR" независимо представляет собой атом водорода, атом галогена (кроме атома брома или иода) или C1-C4 алкильную группу и R представляет собой атом водорода или C2-C6 ацильную группу, с гетероарилбороновой кислотой или алкилгетероарилборонатом формулы где X представляет собой атом азота, кислорода или серы,Y представляет собой атом углерода или простую связь,каждый из Z1, Z2 и Z3 независимо представляет собой атом углерода или азота,каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или диалкиламиногруппу илиR1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода,Alk представляет собой атом водорода или C1-C4 алкильную группу, кроме того, комбинация возможно представляет собой группу "4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил", которая далее в тексте сокращенно называется "пинаколборан", в присутствии палладиевого катализатора, такого как комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия с дихлорметаном, палладиевый катализатор, иммобилизованный на смоле или катализатор Херрмана (Herrmann), и фторида цезия или карбоната натрия, или других неорганических оснований, возможно с добавлением хлорида лития, в полярном растворителе, таком как метанол, при температуре от 70 до 150C в течение интервала времени от 5 мин до 72 ч с использованием микроволнового излучения или стандартной методики нагревания, с целью получения соединения формулы где R, R1, R2, R3, R', R", X, Y, Z1, Z2 и Z3 имеют те же значения, что и в формулах исходных веществ; б) при необходимости, взаимодействия полученного на предыдущей стадии соединения формулы I с раствором аммиака в метаноле с целью выполнения деацилирования и, соответственно, замещения ацильной группы атомами водорода, с получением соединения формулы где R1, R2, R3, R', R", X, Y, Z1, Z2 и Z3 имеют те же значения, что и выше; в) при необходимости, взаимодействия полученных на предыдущих стадиях соединений I или Ia с кислотой в соответствии с методиками, известными специалисту в данной области техники, с целью получения соответствующей соли присоединения. Соединения данного типа могут быть получены другим сходным способом, включающим взаимодействие гликозилированной фенилбороновой кислоты или гликозилированного фенилбороната формулы где R представляет собой атом водорода или C2-C6 ацильную группу, каждый из R' и R" независимо представляет собой атом водорода, атом галогена (кроме атома брома или иода) или C1-C4 алкильную группу и Alk представляет собой атом водорода или C1-C4 алкильную группу, кроме того, комбинация возможно представляет собой группу "пинаколборан", с гетероарилгалидом формулы где Hal представляет собой атом галогена, предпочтительно атом брома или иода, и каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, цианогруппу,C1-C4 алкильную группу, гидроксильную группу, C1-C4 алкоксигруппу, трифторметильную группу или диалкиламиногруппу илиR1 и R2 вместе с атомами гетероцикла, к которому они присоединены, образуют ароматическое кольцо, содержащее 6 атомов углерода, в таких же условиях, как указано выше, с целью получения соединения формулы где R, R1, R2, R3, R', R", X, Y, Z1, Z2 и Z3 имеют те же значения, что и в формулах исходных веществ. Когда задача состоит в том, чтобы получить производное -D-5-тиоксилопиранозы, обычно предпочтительно использовать 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозилбромид или тетра-O-ацетил-5 тиоD-ксилопиранозу.-6 016044 Известные или новые арил- или гетероарилбороновые соединения могут быть получены в соответствии с методиками, известными специалисту в данной области техники, с использованием в качестве исходных веществ галогенизированных ароматических или гетероароматических производных, в результате взаимодействия, например, с бис(пинаколато)дибором, соответствующий бороновый эфир может быть получен путем замещения атома галогена. Реакции гликозилирования, описанные выше, обычно приводят к получению смеси изомеров - и-конфигурации, и для преимущественного получения изомера -конфигурации обычно требуется оптимизация условий реакции. По той же причине для получения чистого -изомера может потребоваться выполнение очистки либо путем перекристаллизации, либо путем хроматографии. В основных описанных способах синтеза соединений согласно изобретению использованы стандартные методики нагревания (нагрев в масляной бане, нагрев с использованием колбонагревателя, нагрев через рубашку и тому подобное). Данные методики нагревания могут быть заменены нагреванием с использованием микроволнового излучения. В этом случае время, в течение которого требуется поддерживать температуру, значительно уменьшается. Следующие примеры приведены с иллюстративными целями и никоим образом не ограничивают объем изобретения. Температуру плавления определяли с использованием блока Кофлера. Использованы следующие аббревиатуры. мМ означает миллимоль (10-3 моль), ДМСО означает диметилсульфоксид, ТГФ означает тетрагидрофуран, CHCl3 означает хлороформ, CH3OH означает метанол. Группа "пинаколборан" означает Подготовительный пример I. 3-Иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Расплавляли 38,63 г (0,28 моль) хлорида цинка путем нагревания в атмосфере аргона в химическом реакторе. После охлаждения реакционной смеси добавляли 800 мл толуола, 800 мл ацетонитрила и 44 г молекулярного сита (4). Реакционную смесь перемешивали при температуре окружающей среды в течение 90 мин и добавляли 25 г (0,113 моль) 3-иодфенола. Температуру реакционной смеси доводили до 90C и через 2 мин добавляли 39 мл (0,28 моль) триэтиламина и 44,39 г (0,12 моль) 2,3,4-три-O-ацетил-5 тиоD-ксилопиранозилбромида. Реакционную смесь перемешивали при 80C в течение 30 мин. После охлаждения добавляли воду и этилацетат, и удаляли путем фильтрации нерастворимые соединения. Органическую фазу промывали последовательно водой, 1 н. раствором гидроксида натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, обесцвечивали с использованием активного угля, фильтровали и упаривали при пониженном давлении. Остаток очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь циклогексан/этилацетат (70/30; об./об.), и перекристаллизовывали из изопропанола. Желаемый продукт получали в виде белого порошка с выходом 37%. Т. пл. = 127C.[]D 29 = -11 (с = 0,43; ДМСО). Следующие промежуточные соединения получали в соответствии с методикой, аналогичной методике подготовительного примера I, с использованием в качестве исходных веществ подходящих галогенизированных фенолов. Подготовительный пример II. 4-Иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого порошка (выход = 32%). Т. пл. = 148C.[] D29 = -7C (с = 0,35; ДМСО). Подготовительный пример III. 4-Бром-3,5-диметилфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде розового порошка (выход = 25%). Т. пл. = 159C.[] D30 =9,2 (с = 0,1; ДМСО). Подготовительный пример IV. 2-Бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого порошка (выход = 33%). Т. пл. = 176C[] D29 = -242 (с = 0,2; CH3OH). Подготовительный пример V. 2-Бром-5-фторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого твердого вещества (выход = 61%). Т. пл. = 174C.[] D26 =-109(с = 0,18; ДМСО). Подготовительный пример VI. 4-Бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого твердого вещества (выход = 46%). Т. пл. = 131C.-7 016044 Получали в виде белого твердого вещества (выход = 32%). Т. пл. = 157C.[]D32 =-21 (с = 0,44; ДМСО). Подготовительный пример VIII. 5-Бром-2,3-дифторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде порошка кремового цвета (выход = 73%). Т. пл. = 135C.[]D 25 = -62 (с = 0,36; CHCl3). Подготовительный пример IX. 3-Бром-4-хлорфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого порошка (выход = 37%). Т. пл. = 177C (после кристаллизации из диэтилового эфира).[]D27 =-7(с = 0,16; ДМСО). Подготовительный пример X. 5-Бром-2-хлорфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого порошка (выход = 35%). Т. пл. = 250C (после кристаллизации из диэтилового эфира).[] D30 =-27(с = 0,21; ДМСО). Подготовительный пример XI. 5-Бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Получали в виде белого твердого вещества (выход = 56%). Т. пл. = 122C.[]D35 = 43 (с = 0,40; ДМСО). Подготовительный пример XII. 5-Бром-2-пиридинил ацетат. Готовили суспензию 0,5 г (2,87 ммоль) 5-бром-2-пиридинола в 10 мл диэтилового эфира, и при температуре окружающей среды добавляли 1 мл (7,1 ммоль) триэтиламина и затем 1 мл (14 ммоль) ацетилхлорида. Данную смесь перемешивали при температуре окружающей среды в течение 24 ч, и затем удаляли путем фильтрации нерастворимые вещества. Фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали путем хроматографии на силикагеле, используя для выполнения элюирования смесь толуол/2-пропанол (9/1; об./об.). Желаемый продукт получали в виде бледно-желтого порошка с выходом 52%. 1H ЯМР (ДМСО; 300 МГц) : 8.52 (d, 1H); 8.19 (dd, 1H); 7.23 (d, 1H); 2.30 (s, 3H). Пример 1. 3-(4-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. 0,4 г (0,809 ммоль) 3-иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере I, помещали в атмосфере аргона в микроволновый химический реактор объемом 10 мл, оснащенный магнитной мешалкой. Добавляли 3,8 мл (1,01 ммоль) 4-пиридинбороновой кислоты в виде раствора в 6 мл диметоксиэтана и затем 2 М раствор карбоната калия (2,18 ммоль). В заключение добавляли 62 мг (0,08 ммоль) транс-ди(-ацетато)бис[2-(ди-о-толилфосфино)бензил]дипалладия (II), и химический реактор закрывали. Реакционную смесь нагревали при 112C в течение 1 ч с использованием микроволнового излучения и затем фильтровали. Оставшееся на фильтре твердое вещество промывали метанолом и объединенный фильтрат концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, переносили в этилацетат и промывали насыщенным раствором хлорида аммония. После сушки над сульфатом магния органическую фазу концентрировали при пониженном давлении. Полученный продукт очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь дихлорметан/этилацетат (15/85 до 20/80; об./об.). Желаемый продукт получали в виде желтого порошка с выходом 91%. Т. пл. = 112C.[]D27 = -72 (с = 0,42; CHCl3). Пример 2. 3-(4-Пиридинил)фенил-5-тиоD-ксилопиранозид. 0,435 г (1,04 ммоль) продукта, полученного в примере 1, растворяли в 8 мл ТГФ и добавляли 5,5 мл воды и 307 мг (7,28 ммоль) гидроксида лития. Данную реакционную смесь перемешивали в течение 2 ч при 44C. ТГФ выпаривали при пониженном давлении и остаток, полученный в результате выпаривания,переносили в воду и нейтрализовали путем добавления 1 н. соляной кислоты до получения нейтральногоpH. Образовавшийся осадок отделяли путем фильтрации и сушили в вакуумной печи. Желаемый продукт получали в виде светло-коричневого порошка с выходом 96%. Т. пл. = 253C.[]D28 =-79(с = 0,31; ДМСО). Пример 3. 5-Фтор-2-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. В герметично закрываемый химический реактор, подходящий для микроволнового излучения, помещали раствор 0,930 г (2 ммоль) 2-бром-5-фторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида,полученного в подготовительном примере V, в 8 мл диметоксиэтана и добавляли раствор 0,318 г (3 ммоль) карбоната натрия в 2 мл воды, 0,163 г (0,2 ммоль) комплекса [1,1'-бис(дифенилфосфино) ферроцен]дихлорпалладия(II) с дихлорметаном и 0,492 г (4 ммоль) 3-пиридинбороновой кислоты. Данную реакционную смесь нагревали при 110C в течение 20 мин с использованием микроволнового излучения и охлаждали, добавляли воду и проводили экстракцию этилацетатом. Органическую фазу промывали 0,5 М раствором карбоната натрия и затем водой до получения нейтрального pH, сушили над сульфатом-8 016044 магния и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь дихлорметан/этилацетат (97/3; об./об.). Желаемый продукт получали в виде белого твердого вещества с выходом 88%. Т. пл. = 66C.[]D30 = -65 (с = 0,24; ДМСО). Пример 4. 5-Фтор-2-(3-пиридинил)фенил-5-тиоD-ксилопиранозид. 0,4 г (0,86 ммоль) продукта, полученного в примере 3, перемешивали при температуре окружающей среды в течение 3 ч с 10 мл 7 М раствора аммиака в метаноле. Реакционную смесь концентрировали при пониженном давлении и полученный твердый продукт перекристаллизовывали из смеси CH3OH/H2O(90/10; об./об.). Желаемый продукт получали в виде белого твердого вещества с выходом 91%. Т. пл. = 110C.[]D31 =-69 (с = 0,19; ДМСО). Пример 5. 4-(3-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 1, используя в качестве исходных веществ 4-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере II, и 3-пиридинбороновую кислоту. Желаемый продукт получали в виде желтого твердого вещества с выходом 79%. Т. пл. = 150C.[]D28 = -47 (с = 0,45; CHCl3). Пример 6. 4-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид. 4-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 5. Желаемый продукт получали в виде светло-желтого порошка с выходом 83%. Т. пл. = 166C.[]D29 = -240 (с = 0,37; ДМСО). Пример 7. 4-(4-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 4-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере II, и 4-пиридинбороновую кислоту. Желаемый продукт получали в виде порошка кремового цвета с выходом 78%. Т. пл. = 180C.[]D27 = -46 (с = 0,39; CHCl3). Пример 8. 4-(4-Пиридинил)фенил-5-тиоD-ксилопиранозид. 4-(4-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 7. Желаемый продукт получали в виде светло-коричневого порошка с выходом 89%. Т. пл. = 217C.[]D28 =-44 (с = 0,28; ДМСО). Пример 9. 4-(2-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. 0,499 г (0,101 ммоль) 4-иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере II, в безводных условиях и в атмосфере аргона помещали в микроволновый химический реактор объемом 20 мл, оснащенный магнитной мешалкой. Добавляли 0,542 г (2,02 ммоль)N-фенилдиэтаноламин-2-пиридилбороната в виде раствора в 12,5 мл диметоксиэтана и затем 1,38 мл 2 М раствора карбоната калия (2,76 ммоль). В заключение добавляли 77 мг (0,41 ммоль) иодида меди и 83 мг(0,101 ммоль) комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном, и химический реактор закрывали. Реакционную смесь нагревали при 112C в течение 1 ч в микроволновой печи. Охлажденную реакционную смесь разбавляли водой и этилацетатом. Органическую фазу отделяли,затем фильтровали и концентрировали при пониженном давлении. Полученный продукт переносили в этилацетат и затем промывали раствором хлорида аммония до получения нейтрального pH. Затем органическую фазу сушили над сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь дихлорметан/этилацетат (0/100 до 6/94; об./об.). Желаемый продукт получали в виде белого порошка с выходом 49%. Т. пл. = 125-130C.[]D26 = -62 (с = 0,24; CH3OH). Пример 10. 4-(2-Пиридинил)фенил 5-тиоD-ксилопиранозид. 4-(2-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 9. Желаемый продукт получали в виде бледно-желтого порошка с выходом 97%. Т. пл. = 197C.-9 016044 Пример 11. 3-(2-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 9, используя в качестве исходного вещества 3-иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид, полученный в подготовительном примере I. Желаемый продукт получали в виде белых хлопьев с выходом 60%. Т. пл. = 68-97C.[]D 27 = -46 (с = 0,24; CH3OH). Пример 12. 3-(2-Пиридинил)фенил 5-тиоD-ксилопиранозид. 3-(2-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 11. Желаемый продукт получали в виде желтого порошка с выходом 79%. Т. пл. = 138-139C.[] D27 = -88 (с = 0,3; ДМСО). Пример 13. 3,5-Диметил-4-(4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. 1 г (2,1 ммоль) 4-бром-3,5-диметилфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере III, смешивали с 0,310 г (2,52 ммоль) 4-пиридинбороновой кислоты в микроволновом химическом реакторе объемом 10 мл и затем добавляли 1,6 г (4,8 ммоль) макропористой полистирольной смолы MP-Carbonate (macroporous triethylammonium methylpolystyrene carbonate) (содержание привитой смолы: 3,03 ммоль/г; Argonaut) и 0,182 г (0,22 ммоль) комплекса [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном. Добавляли смесь диметоксиэтан/метанол (7 мл/3 мл) и температуру реакционной смеси доводили до 120C в течение 30 мин в микроволновой печи. После охлаждения реакционную смесь фильтровали, и фильтрат промывали метанолом, и затем концентрировали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь толуол/изопропанол(9/1; об./об.), и затем кристаллизовали из изопропилового эфира. Желаемый продукт получали в виде желтоватого порошка с выходом 31%. Т. пл. = 170-171C.[] D30 =-21 (с = 0,2; ДМСО). Пример 14. 3,5-Диметил-4-(4-пиридинил)фенил 5-тиоD-ксилопиранозид. Готовили суспензию 0,3 г (0,6 ммоль) продукта, полученного в примере 13, в 10 мл метанола. Добавляли 0,3 мл (1,04 ммоль) раствора метилата натрия в метаноле (3,47 моль/л) и данную реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Сначала продукт находился в суспензии в растворенном состоянии, затем формировался осадок, который отфильтровывали. Полученное твердое вещество сушили при пониженном давлении при 70C в течение 3 ч. Желаемый продукт получали в виде белого порошка с выходом 28%. Т. пл. = 106-107C.[] D30 =-54(с = 0,16; ДМСО). Пример 15. 2-(4-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 1, используя в качестве исходных веществ 2-бромфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере IV, и 4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого порошка с выходом 65%. Т. пл. = 165C.[]D29 = -108 (с = 0,25, CH3OH). Пример 18. 2-(4-Пиридинил)фенил 5-тиоD-ксилопиранозид. 2-(4-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 15. Желаемый продукт получали в виде белого порошка с выходом 52%. Т. пл. = 134C.[]D29 =-138(с = 0,1; CH3OH). Пример 17. 2-(3-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 1, из 2 бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примереIV, и 3-пиридинбороновой кислоты, в качестве исходных веществ, и, не выделяя, сразу использовали на следующей стадии. Пример 18. 2-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид. 2-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 17. Желаемый продукт получали в виде белого порошка с общим выходом выход (пример 17 и пример 18) 27%. Т. пл. = 195C.[]D28 =-168(с = 0,1; CH3OH). Пример 19. 3,5-Диметил-4-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 13, используя в качестве исходных веществ 4-бром-3,5-диметилфенил 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозид, полученный в подготовительном примере III, и 3-пиридинбороновую кислоту. Желаемый продукт получали в виде бесцветной пены с выходом 45%. Т. пл. = 75-80C.[]D30=-1(с = 0,22; ДМСО). Пример 20. 3,5-Диметил-4-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 19. Желаемый продукт получали в виде коричневого твердого вещества с выходом 73%. Т. пл. = 215C.[] D30 =-44(с = 0,21; ДМСО). Пример 21. 3-(3-Пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере I, и 3-пиридинбороновую кислоту. Желаемый продукт получали в виде светло-коричневого порошка с выходом 66%. Т. пл. = 123-126C.[]D27 = -68 (с = 0,4; CHCl3). Пример 22. 3-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид. 3-(3-Пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой, аналогичной методике примера 2, используя в качестве исходного вещества продукт, полученный в примере 21. Желаемый продукт получали в виде порошка кремового цвета с выходом 99%. Т. пл. = 197C.[]D28 = -84 (с = 0,29; ДМСО). Пример 23. 2-Фтор-4-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 4-бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере VI, и 3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 61%. Т. пл. = 122C.[]D28 = 8 (с = 0,36; ДМСО). Пример 24. 2-Фтор-4-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. 2-Фтор-4-(3-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 23. Желаемый продукт получали в виде белого твердого вещества с выходом 73%. Т. пл. = 207C.[]D28 = -27 (с = 0,43; ДМСО). Пример 25. 2-Фтор-4-(4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 4-бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере VI, и 4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 51%. Т. пл. = 179C.[]D28 = 14 (с = 0,38; ДМСО). Пример 26. 2-Фтор-4-(4-пиридинил)фенил 5-тиоD-ксилопиранозид. 2-Фтор-4-(4-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 25. Желаемый продукт получали в виде белого твердого вещества с выходом 73%. Т. пл =215C.[]D28 = -24 (с = 0,39; ДМСО). Пример 27. 5-Фтор-2-(4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 2-бром-5-фтор-фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере V, и 4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 79%. Т. пл. = 187C.- 11016044 Пример 28. 5-Фтор-2-(4-пиридинил)фенил 5-тиоD-ксилопиранозид. 5-Фтор-2-(4-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 27. Желаемый продукт получали в виде белого твердого вещества с выходом 33%. Т. пл. = 209C.[]D31= -80 (с = 0,29; ДМСО). Пример 29. 3-(6-Метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид. 500 мг (1,12 ммоль) 3-бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере VII, и 260 мг (1,68 ммоль) 6-метил-3-пиридинбороновой кислоты помещали в подходящий микроволновый химический реактор, и затем добавляли 500 мг полистирольной смолы PSPPh3-Pd (Polystyrene triphenylphosphine palladium(0 (Argonaut) и 730 мг (2,24 ммоль) карбоната цезия. Добавляли смесь 7 мл диметоксиэтана и 3 мл метанола и температуру полученной реакционной смеси доводили до 120C в течение 1 ч. После охлаждения реакционную смесь фильтровали, и фильтрат промывали метанолом, и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь дихлорметан/метанол(90/10; об./об.), и затем перекристаллизовывали из воды. 3-(6-Метил-3-пиридинил)фенил 5-тиоDксилопиранозид получали в виде белого твердого вещества с выходом 65%. Т. пл. = 177C.[]D 29 =-89 (с = 0,13; ДМСО). Пример 30. 3-(6-Фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере I, и 6-фтор-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого порошка с выходом 55%. Т. пл. = 115C.[]D 29 =-15 (с = 0,13; ДМСО). Пример 31. 3-(6-Фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. 3-(6-Фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 30. Желаемый продукт получали в виде белого твердого вещества с выходом 73%. Т. пл. = 170C.[]D29 =-70(с = 0,13; ДМСО). Пример 32. 3-(2-Метокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере I, и 2-метокси-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого порошка с выходом 66%. Т. пл. = 179C.[]D29 = -26 (с = 0,40; ДМСО). Пример 33. 3-(2-Метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. 3-(2-Метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 32. Желаемый продукт получали в виде белого твердого вещества с выходом 64%. Т. пл. = 194C.[] D30 = -62 (с = 0,22; ДМСО). Пример 34. 3-(6-Циано-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-бромфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере VII, и 6-циано-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 45%. Т. пл. = 130C.[]D29 = -6 (с = 0,28; ДМСО). Пример 35. 3-(6-Циано-3-пиридинил)фенил 5-тиоD-ксилопиранозид. 3-(6-Циано-3-пиридинил)фенил 5-тиоD-ксилопиранозид получали в соответствии с методикой,аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 34. Желаемый продукт получали в виде белого порошка с выходом 42%. Т. пл. = 179C.- 12016044 Смесь, состоящую из 1 г (5,81 ммоль) 3-бром-4-метилпиридина, 8 мл ДМЭ, 0,142 г (0,17 ммоль) комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном, 2,21 г (8,72 ммоль) бис(пинаколато)дибора и 1,7 г (17,4 ммоль) ацетата калия, нагревали при 120C в течение 60 мин в атмосфере инертного газа с использованием микроволнового излучения. После охлаждения реакционную смесь фильтровали и к полученному фильтрату добавляли 1,73 г (3,86 ммоль) 3-бромфенил 2,3,4 три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере VII, 0,32 г (0,39 ммоль) комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном и 5,8 мл 1 М водного раствора карбоната натрия. Смесь снова нагревали при 120C в течение 30 мин с использованием микроволнового излучения. Смесь охлаждали, разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали водным раствором бикарбоната натрия и затем водой, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь толуол/ацетон (80/20; об./об.) Желаемый продукт получали в виде желтоватого твердого вещества с выходом 21%. Т. пл = 170C.[]D29 =-14(с = 0,40; ДМСО). Пример 37. 3-(4-Метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 36. Желаемое соединение получали в виде серовато-белого порошка с выходом 55%. Т. пл. = 143C.[]D30 = -52 (с = 0,34; ДМСО). Пример 38. 3-(5-Метокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 36, используя в качестве исходного вещества 3-бром-5-метоксипиридин. Желаемое соединение получали в виде белого твердого вещества с выходом 58%. Т. пл. = 167C.[]D29 =-17 (с = 0,39; ДМСО). Пример 39. 3-(5-Метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 38. Желаемое соединение получали в виде белого твердого вещества с выходом 82%. Т. пл. = 194C.[]D29 =-69 (с = 0,31; ДМСО). Пример 40. 3-(2-Метил-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 36, используя в качестве исходного вещества 2-метил-3-пиридинил трифторметансульфонат. Желаемое соединение получали в виде бежевого твердого вещества с выходом 38%. Т. пл. = 153C.[]D29 =-19(с = 0,32; ДМСО). Пример 41. 3-(2-Метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 40. Желаемое соединение получали в виде серовато-белого твердого вещества с выходом 58%. Т. пл. = 162-164C.[]D25 = -78 (с = 0,40; ДМСО). Пример 42. 3-(5-Метил-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 36, используя в качестве исходного вещества 3-бром-5-метилпиридин. Желаемое соединение получали в виде бежевого твердого вещества с выходом 31%. Т. пл. = 156C.[]D27 =-17 (с = 0,20; ДМСО). Пример 43. 3-(5-Метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 42. Желаемое соединение получали в виде белого твердого вещества с выходом 55%. Т. пл. = 239-240C.- 13016044 Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 36, используя в качестве исходного вещества 2-хлор-3-фторпиридин. Желаемое соединение получали в виде мелкозернистого белого твердого вещества с выходом 7%. Т. пл. = 51C.[]D29 = -32 (с = 0,08; ДМСО). Пример 45. 3-(3-Фтор-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 44. Желаемое соединение получали в виде белого порошка с выходом 42%. Т. пл. = 150C.[]D29 = -87 (с = 0,09; ДМСО). Пример 46. 3-(6-Метокси-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 36, используя в качестве исходного вещества 2-бром-6-метоксипиридин. Желаемое соединение получали в виде бежевого порошка с выходом 50%. Т. пл. = 195C (после кристаллизации из 2-пропанола).[]D27 =-21 (с = 0,40; ДМСО). Пример 47. 3-(6-Метокси-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 46. Желаемое соединение получали в виде белого игловидного вещества с выходом 63%. Т. пл. = 206C (после кристаллизации из смеси этанол/вод).[]D27 = -86 (с = 0,23; ДМСО). Пример 48. 3-(2,4-Диметил-5-тиазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. а) 3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Смесь, состоящую из 8 г (17,9 ммоль) 3-бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида,полученного в подготовительном примере VII, 30 мл ДМЭ, 0,438 г (0,537 ммоль) комплекса [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном, 6,8 г (26,8 ммоль) бис(пинаколато)дибора и 5,2 г (53,7 ммоль) ацетата калия, нагревали при 150C в течение 35 мин в атмосфере инертного газа с использованием микроволнового излучения. Затем реакционную смесь концентрировали при пониженном давлении, и оставшийся продукт очищали путем хроматографии на силикагелевой колонке,используя для выполнения элюирования смесь толуол/изопропиловый эфир (6/4; об./об.). Желаемый продукт получали в виде белых кристаллов с выходом 69%. Т. пл. = 198-200C.[]D27 =-16(с = 0,59; ДМСО). б) 3-(2,4-Диметил-5-тиазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. В атмосфере инертного газа смешивали 0,9 г (1,82 ммоль) соединения, полученного на стадии (а),0,437 г (0,18 ммоль) 5-бром-2,4-диметилтиазола, 0,15 г (0,18 ммоль) комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном и 1,36 мл 2 М водного раствора карбоната калия. Смесь нагревали при 120C в течение 30 мин с использованием микроволнового излучения. Смесь охлаждали, разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали водным раствором хлорида аммония и затем водой, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагелевой колонке, используя для выполнения элюирования смесь дихлорметан/этилацетат (градиент от 9/1 до 7/3; об./об.). Желаемый продукт получали в виде бледно-желтого твердого вещества с выходом 70%. Т. пл. = 114-120C.[]D23 = -23 (с = 0,20; ДМСО). Пример 49. 3-(2,4-Диметил-5-тиазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 48. Желаемое соединение получали в виде желтоватых кристаллов с выходом 78%. Т. пл. = 158-164C.[]D23 = -74 (с = 0,63; ДМСО). Пример 50. 3-(4-Хлор-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 48, используя в качестве исходного вещества 2-бром-4-хлорпиридин. Желаемое соединение получали в виде белых кристаллов с выходом 35%. Т. пл. = 152C (после кристаллизации из диэтилового эфира).- 14016044 Пример 51. 3-(4-Хлор-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 50. Желаемое соединение получали в виде желтоватого твердого вещества с выходом 94%. Т. пл =97-105C.[]D26=-76 (с = 0,18; ДМСО). Пример 52. 3-(5-Метил-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 48, используя в качестве исходного вещества 2-бром-5-метилпиридин. Желаемое соединение получали в виде белых кристаллов с выходом 28% Т. пл. = 140C (после кристаллизации из диэтилового эфира).[]D26=-11(с = 0,17; ДМСО). Пример 53. 3-(5-Метил-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 52. Желаемое соединение получали в виде белого твердого вещества с выходом 76% Т. пл. = 185-189C.[]D26=-76(с = 0,15; ДМСО). Пример 54. 3-(6-Хлор-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 48, используя в качестве исходного вещества 2-бром-6-хлорпиридин. Желаемое соединение получали в виде белых кристаллов с выходом 71%. Т. пл. = 186-189C (после кристаллизации из диэтилового эфира).[]D27 =-19(с = 0,36; ДМСО). Пример 55. 3-(6-Хлор-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 54. Желаемое соединение получали в виде белых кристаллов с выходом 44%. Т. пл. = 180-222C.[]D27 = -50 (с = 0,36; ДМСО). Пример 56. 3-(Пиразинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 48, используя в качестве исходного вещества иодпиразин. Желаемое соединение получали в виде желтоватого твердого вещества с выходом 18%. Т. пл. = 92C.[] D30 =-13(с = 0,19; ДМСО). Пример 57. 3-(Пиразинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 56. Желаемое соединение получали в виде белых кристаллов с выходом 86%. Т. пл. = 206-209C (после кристаллизации из метанола).[] D30 = -80 (с = 0,22; ДМСО). Пример 58. 3-(6-Гидрокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 48, используя в качестве исходных веществ соединение, полученное в подготовительном примере XII, и 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, который не выделяли из раствора, полученного в результате синтеза данного соединения в соответствии с методикой примера 48 а, и сразу использовали после простой фильтрации. Желаемое соединение получали в виде белого твердого вещества с выходом 29%. Т. пл. = 131C.[] D30 =-15 (с = 0,14; ДМСО). Пример 59. 3-(6-Гидрокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 58. Желаемое соединение получали в виде белого твердого вещества с выходом 44%. Т. пл. = 200C.[]D30=-60 (с = 0,10; ДМСО). Пример 60. 3-[1-Метил-3-(трифторметил)-1H-пиразол-4-ил]фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 4-бром-1-метил-3-(трифторметил)-1H-пиразол.- 15016044 Желаемое соединение получали в виде бежевого твердого вещества с выходом 24%. Т. пл. = 131-133C.[]D29 = -25 (с = 0,25; ДМСО). Пример 61. 3-[1-Метил-3-(трифторметил)1H-пиразол-4-ил]фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 60. Желаемое соединение получали в виде бежевого твердого вещества с выходом 61%. Т. пл. = 182-185C.[]D29 = -63 (с = 0,22; ДМСО). Пример 62. 3-[5-Метил-3-(трифторметил)-1H-пиразол-4-ил]фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 4-бром-5-метил-3-(трифторметил)-1H-пиразол. Желаемое соединение получали в виде бежевого твердого вещества с выходом 20%. Т. пл. = 194C.[] D30 =-14 (с = 0,19; ДМСО). Пример 63. 3-[5-Метил-3-(трифторметил)-1H-пиразол-4-ил]фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 62. Желаемое соединение получали в виде белого твердого вещества с выходом 60%. Т. пл. = 104-109C.[] D30 =-53(с = 0,21; ДМСО). Пример 64. 3-(2-Триазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 2-бромтиазол. Желаемое соединение получали в виде бежевого твердого вещества с выходом 7%. Т. пл. = 65C.[] D30 =-17(с = 0,21, ДМСО). Пример 65. 3-(2-Триазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 64. Желаемое соединение получали в виде белых хлопьев с выходом 76%. Т. пл. = 209-223C.[]D30 = -90 (с = 0,27; ДМСО). Пример 66. 3-(5-Фтор-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 2-бром-5-фторпиридин. Желаемое соединение получали в виде белых кристаллов с выходом 22%. Т. пл. = 113C (после кристаллизации из диэтилового эфира).[]D24= -20 (с = 0,24; ДМСО). Пример 67. 3-(5-Фтор-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 66. Желаемое соединение получали в виде белых хлопьев с выходом 40%. Т. пл. = 168-201C.[] D30 = -93 (с = 0,30; ДМСО). Пример 68. 3-(3-Хлор-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 2,3-дихлорпиридин. Желаемое соединение получали в виде белого твердого вещества с выходом 58%. Т. пл. = 148C (после кристаллизации из диэтилового эфира).[]D29 =-32 (с = 0,11; ДМСО). Пример 69. 3-(3-Хлор-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 68. Желаемое соединение получали в виде коричневого игловидного вещества с выходом 83%. Т. пл. = 217C (после кристаллизации из смеси этанол/вод).[]D29 =-68 (с = 0,41; ДМСО). Пример 70. 3-(5-Метил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике- 16016044 примера 58, используя в качестве исходного вещества 5-метил-4-иодизоксазол. Желаемое соединение получали в виде белого твердого вещества с выходом 69%. Т. пл. = 60C.[]D29 =-43(с = 0,19; ДМСО). Пример 71. 3-(5-Метил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 70. Желаемое соединение получали в виде белого твердого вещества с выходом 47%. Т. пл. = 180C.[]D28 = -90 (с = 0,23, ДМСО). Пример 72. 3-(4-Метил-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 2-бром-4-метилпиридин. Желаемое соединение получали в виде белого твердого вещества с выходом 20%. Т. пл. = 116C.[]D29 = -25 (с = 0,26; ДМСО). Пример 73. 3-(4-Метил-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 72. Желаемое соединение получали в виде бежевого порошка с выходом 23%. Т. пл. = 194C.[]D29 = -112 (с = 0,25; ДМСО). Пример 74. 3-[6-(Диметиламино)-3-пиридинил]фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 5-бром-2-(диметиламино)пиридин. Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии деацетилирования. Пример 75. 3-[6-(Диметиламино)-3-пиридинил]фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 74. Желаемое соединение получали в виде белого твердого вещества с выходом 20%. Т. пл. = 186C.[] D30 =-59(с = 0,17; ДМСО). Пример 76. 3-[6-(Диметиламино)-3-пиридинил]фенил 5-тиоD-ксилопиранозид(гидрохлорид). Готовили раствор 0,05 г (0,248 ммоль) соединения, полученного в примере 75, в 3 мл метанола, и добавляли 0,2 мл (0,25 ммоль) 1,25 М раствора соляной кислоты в метаноле. Данную смесь перемешивали при температуре окружающей среды в течение 5 мин и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, переносили в 5 мл воды и полученный раствор лиофилизировали. Лиофилизат кристаллизовали из смеси метанол/эфир и затем отфильтровывали и сушили. Желаемое соединение получали в виде белого твердого вещества с выходом 91%. Т. пл. = 119C.[]D31 =-71(с = 0,18; ДМСО). Пример 77. 2-Хлор-5-(3,5-диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходных веществ 5-бром-2-хлорфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере X, и 3,5-диметил-4-иодизоксазол. Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии деацетилирования. Пример 78. 2-Хлор-5-(3,5-диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 77. Желаемое соединение получали в виде белого твердого вещества с выходом 26%. Т. пл. = 194C.[]D31 =-64(с = 0,12; ДМСО). Пример 79. 2-Хлор-5-(5-метил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 77, используя в качестве исходного вещества 5-метил-4-иодизоксазол. Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии- 17016044 деацетилирования. Пример 80. 2-Хлор-5-(5-метил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 79. Желаемое соединение получали в виде белого твердого вещества с выходом 15%. Т. пл = 183C.[]D31 =-28(с = 0,10; ДМСО). Пример 81. 2-Хлор-5-(2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 77, используя в качестве исходного вещества 2-хлорпиридин. Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии деацетилирования. Пример 82. 2-Хлор-5-(2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 81. Желаемое соединение получали в виде белого твердого вещества с выходом 18%. Т. пл. = 108C.[]D31 =-45(с = 0,10; ДМСО). Пример 83. 2,3-Дифтор-5-(2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходных веществ 5-бром-2,3-дифторфенил 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозид, полученный в подготовительном примере VIII, и 2-хлорпиридин. Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии деацетилирования. Пример 84. 2,3-Дифтор-5-(2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 83. Желаемое соединение получали в виде белого твердого вещества с выходом 39%. Т. пл. = 162C.[]D26= -55 (с = 0,20; ДМСО). Пример 85. 3-(6-Метил-2-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 58, используя в качестве исходного вещества 2-хлор-6-метилпиридин Желаемое соединение получали в виде неочищенного продукта, который использовали без дополнительной очистки на стадии деацетилирования. Пример 86. 3-(6-Метил-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 85. Желаемое соединение получали в виде желтого твердого вещества с выходом 16%. Т. пл. = 143C.[]D29 =-34(с = 0,15; ДМСО). Пример 87. 3-(1,3,5-Триметил-1H-пиразол-4-ил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид, полученный в подготовительном примере VII, и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)-1,3,5-триметил-1H-пиразол. Желаемый продукт получали в виде белого твердого вещества с выходом 46%. Т. пл. = 164C.[]D29 = -32 (с = 0,24; ДМСО). Пример 88. 3-(1,3,5-Триметил-1H-пиразол-4-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 87. Желаемое соединение получали в виде белого твердого вещества с выходом 35%. Т. пл. = 95C.[]D32 = -77 (с = 0,27; ДМСО). Пример 89. 3-(5-Хлор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 87, используя в качестве исходного вещества 5-хлор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан 2-ил)пиридин. Желаемый продукт получали в виде белого твердого вещества с выходом 26%.[]D29 = -23 (с = 0,27, ДМСО). Пример 90. 3-(5-Хлор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 89. Желаемое соединение получали в виде белого твердого вещества с выходом 89%. Т. пл. = 239-241C.[]D29 =-77 (с = 0,19; ДМСО). Пример 91. 3-(5-Фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 87, используя в качестве исходного вещества 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан 2-ил)пиридин. Желаемый продукт получали в виде белого твердого вещества с выходом 44% Т. пл. = 135C.[]D26 =-18 (с = 0,31; ДМСО). Пример 92. 3-(5-Фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 91. Желаемое соединение получали в виде белого твердого вещества с выходом 90%. Т. пл. = 211-212C.[]D29 =-75(с = 0,41; ДМСО). Пример 93. 3-(1-Метил-1H-пиразол-4-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 87, используя в качестве исходного вещества 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразол. Желаемый продукт получали в виде белого твердого вещества с выходом 50%. Т. пл. = 140C.[]D29 =-20(с = 0,18; ДМСО). Пример 94. 3-(1-Метил-1H-пиразол-4-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 93. Желаемое соединение получали в виде белого твердого вещества с выходом 39%. Т. пл. = 213C.[]D30 = -73 (с = 0,25; ДМСО). Пример 95. 3-(3,5-Диметил-1H-пиразол-4-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 87, используя в качестве исходного вещества 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)-1H-пиразол. Желаемый продукт получали в виде белого порошка с выходом 59%. Т. пл. = 195C (после кристаллизации из диэтилового эфира).[]D29 =-32 (с = 0,21; ДМСО). Пример 96. 3-(3,5-Диметил-1H-пиразол-4-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 95. Желаемое соединение получали в виде белого порошка с выходом 55%. Т. пл. = 213C (после кристаллизации из метанола).[]D29 = -99 (с = 0,28; ДМСО). Пример 97. 2-Хлор-5-(1-метил-1H-пиразол-4-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 87, из 1 метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола и 5-бром-2-хлорфенил 2,3,4-три-Oацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере X, в качестве исходных веществ, и без дополнительной очистки подвергали дальнейшему превращению с целью получения неацетилированного ксилозида. Пример 98. 2-Хлор-5-(1-метил-1H-пиразол-4-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 97. Желаемое соединение получали в виде белого твердого вещества с выходом 54%. Т. пл. = 158C.[] D30 = -54 (с = 0,24; ДМСО). Пример 99. 2,3-Дифтор-5-(1-метил-1H-пиразол-4-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 97, из 5 бром-2,3-дифторфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида, полученного в подготовительном- 19016044 примере VIII, в качестве исходного вещества, и без дополнительной очистки подвергали дальнейшему превращению с целью получения неацетилированного ксилозида. Пример 100. 2,3-Дифтор-5-(1-метил-1H-пиразол-4-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 99. Желаемое соединение получали в виде белого твердого вещества с выходом 35%. Т. пл. = 184C.[]D27 =-44(с = 0,18; ДМСО). Пример 101. 2-Хлор-5-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 5-бром-2-хлорфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере X. Желаемый продукт получали в виде розового порошка с выходом 57%. Т. пл. = 155C (после кристаллизации из диэтилового эфира).[]D30=-14(с = 0,30; ДМСО). Пример 102. 2-Хлор-5-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 101. Желаемое соединение получали в виде белого порошка с выходом 99%. Т. пл. = 172C.[] D30 = -43 (с = 0,60; ДМСО). Пример 103. 4-Хлор-3-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 3-бром-4-хлорфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере IX. Желаемый продукт получали в виде белого порошка с выходом 50%. Т. пл. = 133C (после кристаллизации из изопропилового эфира).[]D27 = -8 (с = 0,23; ДМСО). Пример 104. 4-Хлор-3-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 103. Желаемое соединение получали в виде белого порошка с выходом 27%. Т. пл. = 139C.[]D27 =-59 (с = 0,21; ДМСО). Пример 105. 2,3-Дифтор-5-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 5-бром-2,3-дифторфенил 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозид, полученный в подготовительном примере VIII. Желаемый продукт получали в виде белого порошка с выходом 87%. Т. пл. = 134C.[]D26 = -23 (с = 0,23; CHCl3). Пример 106. 2,3-Дифтор-5-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 105. Желаемое соединение получали в виде белого порошка с выходом 93%. Т. пл. = 177C.[]D26 =-31 (с = 0,32; ДМСО). Пример 107. 2-Фтор-5-(3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 5-бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере XI. Желаемый продукт получали в виде белого твердого вещества с выходом 25%. Т. пл. = 152C.[]D33 = 14 (с = 0,40; ДМСО). Пример 108. 2-Фтор-5-(3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 107. Желаемое соединение получали в виде рыхлого белого твердого вещества с выходом 71%. Т. пл. = 100C (после кристаллизации из воды).- 20016044 Пример 109. 3-(2-Фтор-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-бромфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере VII, и 2-фтор-4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 52%. Т. пл. = 117C.[]D29 =-19 (с = 0,19; ДМСО). Пример 110. 3-(2-Фтор-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 109. Желаемое соединение получали в виде белого твердого вещества с выходом 74%. Т. пл. = 199C.[]D30 =-82(с = 0,19; ДМСО). Пример 111. 3-(3-Хлор-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 3-хлор-4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 12%. Т. пл. = 169-171C.[]D25 = -23 (с = 0,24; ДМСО). Пример 112. 3-(3-Хлор-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 3-хлор-4-пиридинбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 23%. Т. пл. = 158-161C.[]D29 = -63 (с = 0,37; ДМСО). Пример 113. 3-(2-Хлор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 2-хлор-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 48%. Т. пл. = 146-147C.[]D29 = -20 (с = 0,34; ДМСО). Пример 114. 3-(2-Хлор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества соединение, полученное в примере 113. Желаемое соединение получали в виде белого твердого вещества с выходом 34%. Т. пл. = 130C.[]D29 = -70 (с = 0,27; ДМСО). Пример 115. 3-(2-Тиенил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 2-тиофенбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 18%. Т. пл. = 122-123C.[]D28 = -15 (с = 0,21; ДМСО). Пример 116. 3-(2-Тиенил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества соединение, полученное в примере 115. Желаемое соединение получали в виде бежевого твердого вещества с выходом 92%. Т. пл. = 165-166C.[]D28 = -65 (с = 0,22; ДМСО). Пример 117. 3-(2-Фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 2-фтор-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 78%. Т. пл. = 116C.[]D27 = -28 (с = 0,24; ДМСО). Пример 118. 3-(2-Фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества соединение, полученное в примере 117. Желаемое соединение получали в виде белого твердого вещества с выходом 25%. Т пл = 160C.- 21016044 Пример 119. 3-(3-Тиенил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 13, используя в качестве исходных веществ 3-бромфенил 2,3,4-три-O-ацетил-5-тио-[3-Oксилопиранозид, полученный в подготовительном примере VII, и 3-тиофенбороновую кислоту. Желаемый продукт получали в виде белых кристаллов с выходом 26%. Т пл. = 111C (после кристаллизации из изопропилового эфира).[]D26 =-11(с = 0,27; ДМСО). Пример 120. 3-(3-Тиенил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества соединение, полученное в примере 119. Желаемое соединение получали в виде белых кристаллов с выходом 38%. Т. пл. = 182C.[]D27 =-50(с = 0,31; ДМСО). Пример 121. 3-(5-Метил-2-фурил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 5-метил-2-фуранбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 31%. Т. пл. = 132C.[]D 28 =-10(с = 0,27; ДМСО). Пример 122. 3-(5-Метил-2-фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества соединение, полученное в примере 121. Желаемое соединение получали в виде белого твердого вещества с выходом 46%. Т. пл. = 156C.[]D29 = -75 (с = 0,22; ДМСО). Пример 123. 3-(6-Хлор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 6-хлор-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белой пены с выходом 24%. Т. пл. = 129C.[]D 28 =-14 (с = 0,29; ДМСО). Пример 124. 3-(6-Хлор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества соединение, полученное в примере 123. Желаемое соединение получали в виде белого твердого вещества с выходом 83%. Т. пл. = 189C.[] D30 = -67 (с = 0,44; ДМСО). Пример 125. 3-(6-Метокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 109, используя в качестве исходного вещества 6-метокси-3-пиридинбороновую кислоту. Желаемый продукт получали в виде белого твердого вещества с выходом 47%. Т. пл. = 132C.[] D30 = -7 (с = 0,26; ДМСО). Пример 126. 3-(6-Метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества соединение, полученное в примере 125. Желаемое соединение получали в виде белого твердого вещества с выходом 74%. Т. пл. = 174C.[]D29 =-80 (с = 0,31; ДМСО). Пример 127. 3-(3,5-Диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 13, используя в качестве исходных веществ 3-иодфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере I, и 3,5-диметил-4-изоксазолбороновую кислоту. Желаемый продукт получали в виде розового порошка с выходом 53%. Т. пл. = 167-169C.[]D 28 =-31 (с = 0,13; ДМСО). Пример 128. 3-(3,5-Диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества соединение, полученное в примере 127. Желаемое соединение получали в виде белого твердого вещества с выходом 66%. Т. пл. = 170C.[]D 28 = -86 (с = 0,30; ДМСО). Пример 129. 2,3-Дифтор-5-(4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 5-бром-2,3-дифторфенил 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозид, полученный в подготовительном примере VIII, и 4-пиридинбороновую кислоту. Желаемый продукт получали в виде белого порошка с выходом 81%. Т. пл. = 139C.[]D28 = -36 (с = 0,33; CHCl3). Пример 130. 2,3-Дифтор-5-(4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 129. Желаемое соединение получали в виде порошка кремового цвета с выходом 99%. Т. пл. = 151C.[]D29 = -52 (с = 0,35; MeOH). Пример 131. 2,3-Дифтор-5-(3,5-диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 3,5-диметил-4-изоксазолбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 132. 2,3-Дифтор-5-(3,5-диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 131. Желаемое соединение получали в виде белого твердого вещества с выходом 30%. Т. пл. = 171C.[] D30 =-82(с = 0,10; ДМСО). Пример 133. 2,3-Дифтор-5-(6-метил-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 6-метил-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 134. 2,3-Дифтор-5-(6-метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 133. Желаемое соединение получали в виде белого твердого вещества с выходом 56%. Т. пл.= 186C.[]D33 =-46 (с = 0,15; ДМСО). Пример 135. 2,3-Дифтор-5-(2-метил-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 2-метил-4-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 136. 2,3-Дифтор-5-(2-метил-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 135. Желаемое соединение получали в виде белого твердого вещества с выходом 25%. Т пл. = 171C.[]D30 =-45 (с = 0,10; ДМСО). Пример 137. 2,3-Дифтор-5-(2-метокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 2-метокси-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 138. 2,3-Дифтор-5-(2-метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 137. Желаемое соединение получали в виде белого твердого вещества с выходом 75%. Т. пл. = 127C.- 23016044 Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 2-фтор-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 140. 2,3-Дифтор-5-(2-фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 139. Желаемое соединение получали в виде белого твердого вещества с выходом 21%. Т. пл. = 170C.[]D29 =-18 (с = 0,12; ДМСО). Пример 141. 2,3-Дифтор-5-(5-пиримидинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 5-пиримидинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 142. 2,3-Дифтор-5-(5-пиримидинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 141. Желаемое соединение получали в виде белого твердого вещества с выходом 20%. Т. пл. = 191C.[]D29 =-12(с = 0,10; ДМСО). Пример 143. 2,3-Дифтор-5-(2-фтор-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 2-фтор-4-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 144. 2,3-Дифтор-5-(2-фтор-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 143. Желаемое соединение получали в виде белого порошка с выходом 68%. Т. пл. = 184C.[] D30 =-37(с = 0,10; ДМСО). Пример 145. 2,3-Дифтор-5-(6-фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 129, используя в качестве исходного вещества 6-фтор-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 146. 2,3-Дифтор-5-(6-фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 145. Желаемое соединение получали в виде желтоватого твердого вещества с выходом 53%. Т. пл. = 179C.[]D30 =-121(с = 0,10; ДМСО). Пример 147. 2-(3,5-Диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 2-бромфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере IV, и 3,5-диметил-4-изоксазолбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 76%. Т. пл. = 136-138C.[]D28 =-61(с = 0,13; ДМСО). Пример 148. 2-(3,5-Диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 147. Желаемое соединение получали в виде белого порошка с выходом 99%. Т. пл. = 110-117C.[]D28 = -55 (с = 0,24; ДМСО). Пример 149. 2-Фтор-4-(3,5-диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 4-бром-2-фторфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере VI, и 3,5-диметил-4-изоксазолбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 59%.[]D26 =-1(с = 0,26; ДМСО). Пример 150. 2-Фтор-4-(3,5-диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 149. Желаемое соединение получали в виде белого твердого вещества с выходом 74%. Т. пл = 140C.[]D30 = -41 (с = 0,37; ДМСО). Пример 151. 2-Фтор-4-(3-фурил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 149, используя в качестве исходного вещества 3-фуранбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 95%. Т. пл. = 137C.[]D29 =1 (с = 0,37; ДМСО). Пример 152. 2-Фтор-4-(3-фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 151. Желаемое соединение получали в виде белого твердого вещества с выходом 40%. Т. пл. = 155C.[]D28 = -26 (с = 0,47; ДМСО). Пример 153. 5-Фтор-2-(3-фурил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 3-фуранбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 61%.[] D33 = -93 (с = 0,27; ДМСО). Пример 154. 5-Фтор-2-(3-фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 153. Желаемое соединение получали в виде белого твердого вещества с выходом 91%. Т. пл. = 139C.[]D32 =-105 (с = 0,28; ДМСО). Пример 155. 5-Фтор-2-(3,5-диметил-4-изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходного вещества 3,5-диметил-4-изоксазолбороновую кислоту. Желаемое соединение получали в виде бежевого твердого вещества с выходом 53%.[]D30 = -64 (с = 0,24; ДМСО). Пример 156. 5-Фтор-2-(3,5-диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 155. Желаемое соединение получали в виде белого твердого вещества с выходом 78%. Т. пл. = 192C.[]D31 =-50(с = 0,19; ДМСО). Пример 157. 2-Хлор-5-(2-метил-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 5-бром-2-хлорфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере X, и 2-метил-4-пиридинбороновую кислоту,и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 158. 2-Хлор-5-(2-метил-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 157. Желаемое соединение получали в виде белого твердого вещества с выходом 31%. Т. пл. = 137C.[]D31 =-49(с = 0,11; ДМСО). Пример 159. 2-Хлор-5-(6-метил-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 6-метил-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 160. 2-Хлор-5-(6-метил-3-пиридинил)фенил 5-тиоD-ксилопиранозид.- 25016044 Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 159. Желаемое соединение получали в виде белого твердого вещества с выходом 48%. Т. пл. =201C.[] D30 = -84 (с = 0,25; ДМСО). Пример 161. 2-Хлор-5-(2-метокси-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 2-метокси-3-пиридинбороновуго кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 162. 2-Хлор-5-(2-метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 161. Желаемое соединение получали в виде белого твердого вещества с выходом 43%. Т. пл. = 119C.[] D30 =-55 (с = 0,14; ДМСО). Пример 163. 2-Хлор-5-(2-фтор-4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 2-фтор-4-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 164. 2-Хлор-5-(2-фтор-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 163. Желаемое соединение получали в виде белого твердого вещества с выходом 40%. Т. пл. = 162C.[]D30=-65(с = 0,16; ДМСО). Пример 165. 2-Хлор-5-(2-фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 2-фтор-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 166. 2-Хлор-5-(2-фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 165. Желаемое соединение получали в виде белого твердого вещества с выходом 15%. Т. пл. = 165C.[]D30 =-49(с = 0,10; ДМСО). Пример 167. 2-Хлор-5-(4-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 4-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 168. 2-Хлор-5-(4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продует, полученный в примере 167. Желаемое соединение получали в виде белого твердого вещества с выходом 29%. Т. пл. = 189C.[] D30 =-68(с = 0,16; ДМСО). Пример 169. 2-Хлор-5-(5-пиримидинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 5-пиримидинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 170. 2-Хлор-5-(5-пиримидинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 169. Желаемое соединение получали в виде белого твердого вещества с выходом 31%. Т. пл. = 186C.[]D27 = -58 (с = 0,24; ДМСО). Пример 171. 2-Хлор-5-(6-фтор-3-пиридинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 157, используя в качестве исходного вещества 6-фтор-3-пиридинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению.- 26016044 Пример 172. 2-Хлор-5-(6-фтор-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 171. Желаемое соединение получали в виде белого твердого вещества с выходом 38%. Т. пл. = 185C.[]D26 =-59(с = 0,12; ДМСО). Пример 173. 4-(2-Фурил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 4-иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид, полученный в подготовительном примере II, и 2-фуранбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 174. 4-(2-Фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 173. Желаемое соединение получали в виде желтого порошка с выходом 30%. Т. пл. = 200C.[]D31 = -49 (с = 0,20; CH3OH). Пример 175. 3-(2-Фурил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-иодфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид, полученный в подготовительном примере I, и 2-фуранбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 176. 3-(2-Фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 175. Желаемое соединение получали в виде белого порошка с выходом 30%. Т. пл. = 138C.[]D28 = -96 (с = 0,22; CH3OH). Пример 177. 3-(2-Метокси-5-пиримидинил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 3, используя в качестве исходных веществ 3-бромфенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид, полученный в подготовительном примере VII, и 2-метокси-5-пиримидинбороновую кислоту, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 178. 3-(2-Метокси-5-пиримидинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 177. Желаемое соединение получали в виде белого твердого вещества с выходом 69%. Т. пл. = 171C.(5,6 ммоль) 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозилбромида, 1 г (4,77 ммоль) 4-хлор-2-(5 изоксазолил)-5-метилфенола, 1 г (5,7 ммоль) имидазолата серебра, 5 мл толуола и 5 мл ацетонитрила. Смесь перемешивали при 80C в течение 90 мин и затем охлаждали и фильтровали. Оставшееся на фильтре твердое вещество промывали метанолом, и объединенный фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали путем хроматографии на силикагеле,используя для выполнения элюирования смесь дихлорметан/этилацетат (9/1; об./об.). Фракцию, содержащую чистый продукт, кристаллизовали из диэтилового эфира. В результате получали желаемое соединение в виде белого твердого вещества с выходом 10%. Т. пл. = 203C.[]D28 =-49(с = 0,18; ДМСО). Пример 180. 4-Хлор-2-(5-изоксазолил)-5-метилфенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 179. Желаемое соединение получали в виде белого твердого вещества с выходом 45%. Т. пл. = 239C.[]D29 =-78(с = 0,17, ДМСО). Пример 181. 4-Хлор-5-метил-2-(1-фенил-1H-пиразол-5-ил)фенил 2,3,4-три-O-ацетил-5-тиоD- 27016044 ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 179, используя в качестве исходного вещества 4-хлор-5-метил-2-(1-фенил-1H-пиразол-5-ил)фенол, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 182. 4-Хлор-5-метил-2-(1-фенил-1H-пиразол-5-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 181. Желаемое соединение получали в виде белого твердого вещества с выходом 2%. Т. пл. = 95-99C.[]D27 = -109 (с = 0,22; ДМСО). Пример 183. 2-(5-Изоксазолил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике подготовительного примера I, используя в качестве исходного вещества 2-(5-изоксазолил)фенол Желаемое соединение получали в виде белого твердого вещества с выходом 18%. Т. пл = 75C.[]D26 = -92 (с = 0,22; ДМСО). Пример 184. 2-(5-Изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 183. Желаемое соединение получали в виде белого твердого вещества с выходом 70%. Т. пл. = 200C.[]D25 =-106 (с = 0,24; ДМСО). Пример 185. 2-(1H-Индол-1-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике подготовительного примера I, используя в качестве исходного вещества 2-(1H-индол-1-ил)фенол, и с целью получения неацетилированного ксилозида без дополнительной очистки подвергали дальнейшему превращению. Пример 186. 2-(1H-Индол-1-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 185. Желаемое соединение получали в виде белого твердого вещества с выходом 10%. Т. пл. = 70-73C.(7,5 ммоль) диизопропилазодикарбоксилата. Данную реакционную смесь перемешивали при 0C в течение 1 ч и затем при температуре окружающей среды в течение 4 ч и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали путем хроматографии на силикагеле, используя для выполнения элюирования смесь толуол/изопропанол (98/2; об./об.). Фракцию, содержащую чистый продукт, кристаллизовали из смеси этилацетат/диэтиловый эфир. В результате получали желаемое соединение в виде белого твердого вещества с выходом 32%. Т. пл. = 168C.[]D29 =-81(с = 0,25; ДМСО). Пример 188. 2-(2-Бензотиазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 4, используя в качестве исходного вещества продукт, полученный в примере 187. Желаемое соединение получали в виде белого твердого вещества с выходом 60%. Т. пл. = 196C.[] D29 =-47(с = 0,21; ДМСО). Пример 189. 4-(1H-Имидазол-1-ил)фенил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Готовили смесь, состоящую из 3 г (22 ммоль) хлорида цинка, 5 г молекулярного сита (4), 6,5 г оксида цинка, 9 г (25 ммоль) 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозилбромида, 3,2 г (20 ммоль) 4(1H-имидазол-1-ил)фенола, 70 мл толуола и 70 мл ацетонитрила. Данную смесь перемешивали при 55C в течение 24 ч и затем охлаждали и фильтровали. Оставшееся на фильтре твердое вещество промывали этилацетатом и объединенный фильтрат последовательно промывали водой, 1 н. раствором гидроксида натрия и снова водой до получения нейтрального pH. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали путем хроматографии на силикагеле, используя для выполнения элюирования смесь этилацетат/диэтиловый эфир (8/5; об./об.). В результате получали желаемое соединение в виде порошкообразно- 28016044 го твердого вещества, которое подвергали дальнейшему превращению с целью получения неацетилированного ксилозида. Пример 190. 4-(1H-Имидазол-1-ил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 14, используя в качестве исходного вещества продукт, полученный в примере 189. Желаемое соединение получали в виде рыхлого белого твердого вещества с выходом 5%. Т. пл. = 180C.[]D22 = -62 (с = 0,30; ДМСО). Пример 191. 3-(3-Метил-2-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 3-метил-2-пиридинбороновую кислоту. Желаемое соединение получали в виде светло-серого твердого вещества с выходом 23%. Т. пл. = 97-109C.[]D29 = -50 (с = 0,34; ДМСО). Пример 192. 3-(4-Метокси-3-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 4-метокси-3-пиридинбороновую кислоту. Желаемое соединение получали в виде белого твердого вещества с выходом 8%. Т. пл. = 195C.[]D27 = -52 (с = 0,22; ДМСО). Пример 193. 3-(2-Хлор-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 2-хлор-4-пиридинбороновую кислоту. Желаемое соединение получали в виде белого порошка с выходом 14%. Т. пл. = 207C (после кристаллизации из смеси вода/изопропанол).[]D29 = -79 (с = 0,26; ДМСО). Пример 194. 3-(2-Метил-4-пиридинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 2-метил-4-пиридинбороновую кислоту. Желаемое соединение получали в виде белого порошка с выходом 50%. Т. пл. = 223C.[]D28 = -76 (с = 0,39; ДМСО). Пример 195. 3-(5-Пиримидинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 5-пиримидинбороновую кислоту. Желаемое соединение получали в виде белых кристаллов с выходом 46%. Т. пл. = 241C (после кристаллизации из воды).[]D29 =-87 (с = 0,12; ДМСО). Пример 196. 3-(2-Пиримидинил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 2-пиримидинбороновую кислоту. Желаемое соединение получали в виде бежевого твердого вещества с выходом 33%. Т. пл. = 164-166C.[]D26 = -69 (с = 0,28; ДМСО). Пример 197. 3-(3-Фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходного вещества 3-фуранбороновую кислоту. Желаемое соединение получали в виде белого порошка с выходом 65%. Т. пл. = 152C.[]D27 =-73 (с = 0,15; MeOH). Пример 198. 2-(3-Фурил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходных веществ 2-бромфенил 2,3,4-три-O-ацетил-5-тиоDксилопиранозид, полученный в подготовительном примере IV, и 3-фуранбороновую кислоту. Желаемое соединение получали в виде белых хлопьев с выходом 57%. Т. пл. = 102C.[] D32 =-107 (с = 0,16; MeOH). Пример 199. 4-(3,5-Диметил-4-изоксазолил)фенил 5-тиоD-ксилопиранозид. Указанное в заголовке соединение получали в соответствии с методикой, аналогичной методике примера 29, используя в качестве исходных веществ 4-иодфенил 2,3,4-три-O-ацетил-5-тиоD- 29
МПК / Метки
МПК: A61K 31/70, C07H 15/203
Метки: 5-тиоксилопиранозы, производные
Код ссылки
<a href="https://eas.patents.su/30-16044-proizvodnye-5-tioksilopiranozy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-тиоксилопиранозы</a>
Предыдущий патент: Косметические или дерматологические препараты, содержащие n-ацетилцистеин
Следующий патент: Пестицидная композиция, включающая производное 2-пиридилметилбензамида и инсектицидное соединение
Случайный патент: Дверь пластмассовая со стопорным устройством дверного замка, а также стопорное устройство дверного замка для нее


































