Новые производные 5-тиоксилопиранозы
Номер патента: 15303
Опубликовано: 30.06.2011
Авторы: Барберусс Вероник, Бонду Мишель, Перу Винсен, Тома Дидье
Формула / Реферат
1. Производное тиоксилозы, отличающееся тем, что данное соединение выбрано из
а) соединений формулы
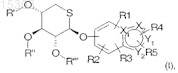
где пентапиранозильная группа представляет собой свободную или замещенную 5-тио-b-D-ксилопиранозильную группу,
каждый из R', R" и R'" независимо представляет собой атом водорода или С2-С6 ацильную группу, или два соседних радикала из R', R" и R'" образуют 1-метилэтилиденовый мостик,
каждый из X1 и Х2 представляют собой атом углерода или азота,
каждый из Y1 и Y2независимо представляет собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1представляет собой атом углерода или азота,
R1, R2, R3, R4и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, где R6 представляет собой атом водорода или С1-С4алкил, С1-С4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, C2-C6 ацильную группу, группу С1-С5алкил-СН(ОН), бензоильную группу или фенильное кольцо;
б) солей присоединения соединений формулы I.
2. Соединение по п.1, отличающееся тем, что в вышеприведенной формуле (I) R1, R2, R3, R4 и R5независимо друг от друга представляют собой атом водорода, С1-С4алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо или атом галогена, С1-С4 алкоксигруппу, С2-С6ацильную группу, бензоильную группу или фенильное кольцо.
3. Соединение по п.1 или 2, отличающееся тем, что в формуле (I) X1 и Y2 представляют собой атом азота, а Х2 и Y1 представляют собой атом углерода.
4. Соединение по любому из пп.1-3, отличающееся тем, что в формуле (I) R', R" и R'" представляют собой атом водорода.
5. Соединение по любому из пп.1-3, отличающееся тем, что в формуле (I) R', R" и R'" представляют собой группу СОСН3.
6. Способ получения соединения по любому из пп.1-5, отличающийся тем, что данный способ включает следующие стадии:
взаимодействие ароматической системы, содержащей гидроксильную группу фенольной природы, формулы
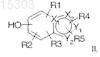
где каждый из X1 и Х2 представляют собой атом углерода или азота,
Y1 и Y2представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,
R1, R2, R3, R4и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, где R6 представляет собой атом водорода или С1-С4алкил, С1-С4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, С1-С4 алкоксигруппу, С2-С6ацильную группу, группу С1-С5алкил-СН(ОН), бензоильную группу или фенильное кольцо, с производным 5-тиоксилопиранозы формулы
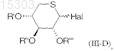
где Hal представляет собой атом галогена, и R', R" и R'" представляют собой С2-С6 ацильную группу, в апротонном растворителе, таком как ацетонитрил или толуол, в присутствии соли или оксида серебра, или соли или оксида цинка в безводной среде, при температуре от 25 до 110°C в течение 1-10 ч с целью получения соединения формулы
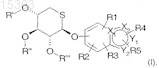
где Х1, Х2, Y1, Y2, R', R", R'", R1, R2, R3, R4и R5 являются такими, как в исходных соединениях.
7. Способ по п.6, где галоген представляет собой атом брома, С2-С6 ацильная группа представляет собой ацетильную группу,
соль серебра представляет собой имидазолат серебра,
соль цинка представляет собой хлорид.
8. Способ получения соединения по любому из пп.1-5, где два соседних заместителя из R', R" и R'" образуют 1-метилэтилиденовый мостик, а третий заместитель представляет собой атом водорода, отличающийся тем, что данный способ включает следующие стадии:
взаимодействие соединения формулы la,
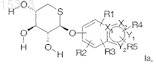
где каждый из Х1 и Х2представляют собой атом углерода или азота,
Y1 и Y2представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,
R1, R2, R3, R4и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, где R6 представляет собой атом водорода или С1-С4алкил, С1-С4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С2-С6 ацильную группу, группу С1-С5алкил-СН(ОН), бензоильную группу или фенильное кольцо,
с 2-метоксипропеном в безводном растворителе и в кислой среде с целью получения соединения формулы I, где два соседних заместителя из R', R" и R'" образуют 1-метилэтилиденовый мостик, а третий заместитель представляет собой атом водорода.
9. Применение соединения по любому из пп.1-5 в качестве фармакологически активного вещества.
10. Применение соединения по любому из пп.1-5 для приготовления лекарства для предупреждения или лечения тромбозов.
11. Применение по п.10 для приготовления лекарства для предупреждения или лечения венозных тромбозов.
Текст
Изобретение относится к новым производным 5-тиоксилозы, предпочтительно к производным типа 5-тиоксилопиранозы, а также к способу их получения и к их применению в качестве активного ингредиента лекарств, в частности лекарств, предназначенных для лечения или предупреждения тромбозов. Соединения имеют формулу (I) где пентапиранозильная группа представляет собой свободную или замещенную 5-тиоDксилопиранозильную группу; каждый из R', R" и R'" независимо представляет собой атом водорода или С 2-С 6 ацильную группу, или два соседних радикала из R', R" и R'" образуют 1 метилэтилиденовый мостик; каждый из X1 и Х 2 представляют собой атом углерода или азота; каждый из Y1 и Y2 независимо представляет собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота; R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, где R6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, С 1-С 4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо; соли присоединения соединений формулы (I) и активные метаболиты соединений формулы (I). 015303 Изобретение относится к новым производным 5-тиоксилозы, предпочтительно к производным 5 тиоксилопиранозы, а также к способу их получения и к их применению в качестве активного ингредиента лекарств, в частности лекарств для применения в лечении или предупреждении тромбозов. Предшествующий уровень техники Некоторые производные D-ксилозы уже известны, например производные, описанные в документах ЕР 051023 В 1, US 4877808, ЕР 421829 В 1 и WO 05/030785 или в публикации J. Med. Chem. Vol. 367, р 898-903. Данные известные соединения рекомендованы для использования с целью уменьшения риска возникновения венозного тромбоза у человека. В основе механизма действия этих соединений, повидимому, лежит их способность воздействовать на гликозаминогликаны плазмы (J. Biol. Chem., Vol. 270,6, p. 2662-68; Thromb. Haemost. 1999, 81, p. 945-950). Объект изобретения В данном изобретении раскрыто новое семейство соединений, производных тиоксилозы, которые обладают значительной антитромботической активностью и могут быть эффективно синтезированы. Краткое изложение сущности изобретения Новые соединения по изобретению отличаются тем, что данные соединения выбраны из а) соединений формулы где пентапиранозильная группа представляет собой свободную или замещенную 5-тиоDксилопиранозильную группу,каждый из R', R" и R независимо представляет собой атом водорода или С 2-С 6 ацильную группу,или два соседних радикала из R', R" и R"' образуют 1-метилэтилиденовый мостик,каждый из X1 и Х 2 представляют собой атом углерода или азота,каждый из Y1 и Y2 независимо представляет собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, гдеR6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо; б) солей присоединения соединений формулы I; в) активных метаболитов соединений формулы I. Изобретение также относится к применению соединений формулы I в качестве фармакологически активного вещества. В частности, изобретение относится к применению по меньшей мере одного вещества, выбранного из соединений формулы I и их нетоксичных солей присоединения, в приготовлении лекарства для применения в лечении человека или животного, в предупреждении или лечении тромбозов, в частности венозных тромбозов. Так как соединения по изобретению являются активными согласно способу их действия, включающему воздействие на гликозаминогликаны, они могут являться полезными в качестве активного ингредиента лекарства для применения в лечении или предупреждении любых других заболеваний, в которые вовлечены гликозаминогликаны. Подробное описание изобретения В описании формулы I термин "C1-C4 алкильная группа" предназначен для обозначения насыщенной углеводородной цепи, содержащей от 1 до 4 атомов углерода, которая является нормальной или разветвленной или частично или полностью циклической, при этом циклическая часть содержит 3 или 4 атома углерода. Примерами C1-C4 алкильных групп являются, в частности, метильная, этильная, пропильная, бутильная, 1-метилэтильная, 1,1-диметилэтильная, 1-метилпропильная, 2-метилпропильная,циклопропильная или циклопропилметильная группа. Термин "С 2-С 6 ацильная группа" предназначен для обозначения группы R-CO-, у которой R представляет собой алкильную группу, такую как определено выше, содержащую от 1 до 5 атомов углерода. Примерами С 2-С 6 ацетильных групп являются, в частности, ацетильная, пропаноильная, бутаноильная,пентаноильная или гексаноильная группа, а также их гомологи, которые могут иметь разветвленную цепь. Термин "С 1-С 4 алкоксигруппа" предназначен для обозначения группы RO-, у которой R представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода, такую как определено выше. В качестве примеров С 1-С 4 алкоксигрупп могут быть приведены метокси-, этокси-, пропокси-, бутокси-, 1 метилэтокси-, 1,1-диметилэтокси-, 1-метилпропокси-, 2-метилпропокси- или циклопропилметоксигруппа. Термин "соли присоединения" предназначен для обозначения солей присоединения, полученных-1 015303 путем взаимодействия соединения формулы I с неорганической или органической кислотой. Предпочтительно, когда данные соли представляют собой фармацевтически приемлемые соли присоединения. Гидраты или сольваты соединений формулы I или солей соединений формулы I также являются неотъемлемой частью изобретения. К предпочтительным неорганическим кислотам, которые подходят для образования солей основного соединения формулы I, относятся соляная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота. К предпочтительным органическим кислотам, которые подходят для образования солей основного соединения формулы I, относятся метансульфоновая кислота, бензолсульфоновая кислота,толуолсульфоновая кислота, малеиновая кислота, фумаровая кислота, щавелевая кислота, лимонная кислота, винная кислота, молочная кислота и трифторуксусная кислота. Термин "активные метаболиты" предназначен для обозначения соединений, продуцируемых в биологическом окружении из соединений формулы I и обладающих фармакологической активностью той же природы, что и соединения формулы I, описанные в настоящей заявке. Например, соединения формулыI, у которых R1 представляет собой ацильную группу, могут быть метаболизированы путем восстановления кетоновой функциональной группы до спиртовой функциональной группы (-СНОН-) с получением нового соединения (метаболита), которое сохраняет фармакологическую активность той же природы, что и фармакологическая активность соединений формулы I. Соединения, которые иллюстрируют данное изобретение, представляют собой соединения формулы I, у которых пентапиранозильная группа представляет собой свободную или ацилированную, предпочтительно ацетилированную, 5-тиоD-ксилопиранозильную группу; илиX1 и Y2 представляют собой атом азота, а Х 2 и Y1 представляют собой атом углерода; илиY2 представляет собой атом кислорода и Х 1, Х 2 и Y1 представляют собой атом углерода; илиY2 представляет собой атом азота и Х 1, Х 2 и Y1 представляют собой атом углерода; или Х 2 представляет собой атом кислорода, Y2 представляет собой атом азота и X1 и Y1 представляют собой атом углерода; или Х 2 представляет собой атом серы, Y2 представляет собой атом азота и X1 и Y1 представляют собой атом углерода; или Х 2 и Y2 представляют собой атом азота и X1 и Y1, представляют собой атом углерода; илиY1 представляет собой атом азота и Y2 представляет собой атом кислорода и X1 и Х 2 представляют собой атом углерода; илиY1 представляет собой атом кислорода и Y2 представляет собой атом азота и Х 1 и Х 2 представляют собой атом углерода; или Х 2, Y1 и Y2 представляют собой атом азота и Х 1 представляет собой атом углерода; илиX1, X2 и Y2 представляют собой атом азота и Y1 представляет собой атом углерода. Среди соединений по настоящему изобретению предпочтительными являются соединения, у которых X1 и Y2 представляют собой атом азота, а Х 2 и Y1 представляют собой атом углерода, а также соединения, у которых X1, X2 и Y2 представляют собой атом азота и Y1 представляет собой атом углерода. Среди соединений по настоящему изобретению предпочтительными являются соединения, у которых R представляет собой атом водорода или группу СОСН 3. Соединения формулы I по изобретению могут быть получены с помощью методик гликозилирования, известных специалистам в данной области техники, в частности с использованием а) методики Хельфериха, описанной в книге " The Carbohydrate, Chemistry and Biochemistry ", 2ndedition, Academic Press, New York-London 1972, Volume IA pages 292-294, путем конденсации перацетилированного сахара и ароматического гидроксигетероцикла в присутствии кислоты Льюиса; б) методики Кенигса-Кнорра (там же, страницы 295-299), путем конденсации галогенизированной ацилозы и гидроксильной группы фенольной природы в присутствии акцептора протонов, такого как цианистая ртуть, имидазолат серебра или трифторметилсульфонат серебра; в) методики Мицунобу (Duynstee et al., Tet. Lett. 39 (1998), р.4129-4132), путем конденсации частично ацетилированной ацилозы и ароматического гидроксигетероцикла в присутствии алкилазодикарбоксилата и основания Льюиса. Соединения формулы I предпочтительно получают в соответствии со способами, основанными на упомянутых выше методиках. В соответствии с первым общим способом выполняют следующие стадии: а) взаимодействие ароматической системы, содержащей гидроксильную группу фенольной природы, формулы где каждый из Х 1 и Х 2 представляют собой атом углерода или азота,-2 015303Y1 и Y2 представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу-COOR6, гдеR6 представляет собой атом водорода или C1-C4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо,с производным 5-тиоксилопиранозы формулы где Hal представляет собой атом галогена, предпочтительно атом брома, и R', R" и R'" представляют собой С 2-С 6 ацильную группу, предпочтительно ацетильную группу, в апротонном растворителе, таком как ацетонитрил или толуол, в присутствии соли серебра, в частности оксида серебра или имидазолата серебра, или соли цинка (в частности оксида или хлорида) в безводной среде, при температуре от 25 до 110 С в течение 1-10 ч, с целью получения соединения формулы где X1, Х 2, Y1, Y2, R', R", R'", R1, R2, R3, R4 и R5 являются такими, как в исходных соединениях; б) при необходимости, взаимодействие соединения формулы I, полученного на предыдущей стадии,с раствором аммиака в метаноле с целью выполнения деацилирования тиоксилопиранозильного остатка и замены ацильной группы атомом водорода с получением соединения формулы где X1, X2, Y1, Y2, R1, R2, R3, R4 и R5 являются такими, как описано выше; в) при необходимости, взаимодействие одного из соединений I или Ia, полученных на предыдущих стадиях, с кислотой в соответствии с методиками, известными специалистам в данной области техники, с целью получения соответствующей соли присоединения. В качестве варианта описанной выше стадии (б), с целью получения соединения формулы Ia из соединения формулы I, где R представляет собой С 2-С 6 ацильную группу, замена ацильной группы атомом водорода может быть выполнена путем обработки каталитическим количеством алкоксида металла,предпочтительно метилата натрия, в метаноле при температуре от 0 до 30 С в течение 0,5-2 ч. В соответствии со вторым способом соединения формулы I могут быть получены путем взаимодействия тетра-О-ацетил-5-тиоксилопиранозы формулы где Ас представляет собой ацетильную группу, с соединением формулы где каждый из X1 и Х 2 представляют собой атом углерода или азота,Y1 и Y2 представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу-COOR6, гдеR6 представляет собой атом водорода или C1-C4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо,в апротонном растворителе, таком как, например, дихлорметан, в присутствии катализатора типа кислоты Льюиса, например тетрахлорида олова, при температуре от 20 до 60 С в течение 1-2 ч с целью получения соединения формулы-3 015303 где X1, X2, Y1, Y2, R1, R2, R3, R4 и R5 являются такими, как в исходных соединениях. Затем соединение формулы Iб может быть подвергнуто взаимодействию в соответствии с протоколом вышеописанного способа с целью получения незамещенного пиранозильного соединения формулыIa и/или соли (при взаимодействии с кислотой). Вышеупомянутые соединения формулы II являются продуктами, которые либо имеются в продаже,либо легко могут быть синтезированы специалистами в данной области техники в соответствии с методиками, описанными в литературе. В соответствии с третьим способом соединения по изобретению могут быть получены также путем прямого гликозилирования, данный способ включает взаимодействие гетероароматического производного, имеющего гидроксильную группу фенольной природы, с 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозой в присутствии алкилазодикарбоксилатного соединения, такого как диэтилазодикарбоксилат, основания Льюиса, такого как трифенилфосфин, в апротонном полярном растворителе, таком как тетрагидрофуран,при температуре от -20 до 70 С в течение интервала времени от 5 мин до 72 ч с целью получения соответствующего гликозилированного соединения. Затем данное соединение может быть подвергнуто взаимодействию в соответствии с протоколом вышеописанного способа с целью получения незамещенного пиранозильного соединения формулы Ia и/или соли (при взаимодействии с кислотой). Соединения по изобретению, у которых Х 1 и Y2 представляют собой атом азота, а Х 2 и Y1 представляют собой атом углерода (производные имидазо[1,2-а]пиридинового семейства), формулы могут быть получены также путем циклизации гликозилированного пиридина, имеющего аминогруппу в орто-положении по отношению к азоту пиридинового кольца, и карбоксилированного хлорзамещенного производного (J.J.Kaminski et al., J.Med.Chem, 28(7), 1985 p. 876). В соответствии с данным способом выполняют следующие стадии: а) взаимодействие соединения формулы где R', R" и R представляют собой С 2-С 6 ацильную группу и R1, R2 и R3 независимо представляют собой атом водорода, C1-C4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, или атом галогена, С 1-С 4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо, с -галогенизированным кетоном формулы где Hal представляет собой атом галогена, предпочтительно атом хлора или брома, и R4 и R5 независимо представляют собой атом водорода, группу -COOR6, где R6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо,в присутствии протонного полярного растворителя, такого как этанол, при температуре от 60 С до 130 С, в течение интервала времени от 5 мин до 4 ч с целью получения соединения формулы где R, R1, R2, R3, R4 и R5 являются такими, как в исходных продуктах,б) при необходимости, реакцию снятия защитных групп для деблокирования 2,3,4-три-O-ацетил-5 тиоD-ксилопиранозильной группы с целью получения соединения формулы V, у которого R', R" и R'" представляют собой атом водорода. Соединения по изобретению, у которых X1,X2 и Y2 представляют собой атом азота и Y1 представляет собой атом углерода (производные [1,2,4]триазоло[1,5-а] пиридинового семейства), формулы-4 015303 могут быть получены также путем циклизации гликозилированного N,N-диметил-N'-2-пиридинилметанимидамида и гидроксиламин-О-сульфоновой кислоты. В соответствии с данным способом выполняют следующие стадии: а) взаимодействие соединения формулы где R', R" и R'" представляют собой С 2-С 6 ацильную группу и R1, R2 и R3 независимо представляют собой атом водорода, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо или атом галогена, С 1-С 4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо, с диметилформамида диацеталем в присутствии протонного полярного растворителя, такого как этанол, при температуре от 60 С до 130 С, в течение интервала времени от 5 мин до 4 ч с целью получения соединения формулы где R', R", R'", R1, R2 и R3 являются такими, как в исходных продуктах,б) взаимодействие соединения формулы XI с гидроксиламин-О-сульфоновой кислотой в полярном растворителе, таком как, например, метанол, в присутствии пиридина при температуре окружающей среды в течение 1-3 ч с целью получения [1,2,4]триазоло[1,5-а]пиридинил 2,3,4-три-О-ацетил-5-тиоDксилопиранозида формулы VIII,в) при необходимости, реакцию снятия защитных групп для деблокирования 2,3,4-три-О-ацетил-5 тиоD-ксилопиранозильной группы с целью получения соединения формулы VIII, у которого R', R" иR"' представляют собой атом водорода. Согласно изобретению некоторые соединения формулы I характеризуются тем, что R' и R" вместе образуют 1-метилэтилиденовый мостик и R'" представляет собой атом водорода или R" и R'" вместе образуют 1-метилэтилиденовый мостик и R' представляет собой атом водорода. Данные соединения, соответственно, могут быть представлены следующей формулой: Данные соединения могут быть получены с использованием в качестве исходного вещества соединения формулы I, где R', R" и R'" представляют собой атом водорода, путем взаимодействия с 2 метоксипропеном в безводном полярном растворителе, таком как, например, диметилформамид, в присутствии кислоты, такой как камфорсульфоновая кислота, при температуре от 15 до 70 С в течение 2-48 ч. Затем данные соединения выделяют и очищают в соответствии с методиками, известными специалистам в данной области техники, например путем кристаллизации или путем хроматографии. В общем случае, когда возникают проблемы с получением производного -D-5-тиоксилопиранозы,используют 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозил бромид или тетра-O-ацетил-5-тиоDксилопиранозу. Описанные выше реакции гликозилирования чаще всего приводят к получению смеси изомеров и -конфигурации, и обычно для получения преимущественно изомера -конфигурации требуется оптимизация технологических условий. По той же причине с целью получения чистого -изомера также может потребоваться выполнение очистки либо путем перекристаллизации, либо путем хроматографии. Нижеследующие примеры приведены с целью иллюстрации изобретения и никоим образом не могут ограничивать объем изобретения. В данных примерах температуры плавления измерены с помощью блока Кофлера или капиллярной трубки и спектральные значения ядерного магнитного резонанса характеризуются химическим сдвигом, рассчитанным относительно TMS (тетраметилсилана), количеством протонов, ассоциированных с данным сигналом, и формой сигнала (s - синглет, d - дуплет , t - триплет, q- квадруплет, m - мультиплет). Использованная рабочая частота и растворитель указаны для каждого соединения. Температура окружающей среды представляет собой температуру в диапазоне 20 С 4 С.-5 015303 Использованы следующие аббревиатуры: мМ означает миллимоль (10-3 молей);DME означает диметоксиэтан; ДМФА означает диметилформамид; ДМСО означает диметилсульфоксид; ТГФ означает тетрагидрофуран; ТФУ означает трифторуксусная кислота. Подготовительный пример 1. 2-Амино-3-пиридинил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. 1,45 г 10% палладия на угле добавляли к раствору 14,5 г (35,4 мМ) 2-нитро-3-пиридинил 2,3,4-триО-ацетил-5-тиоD-ксилопиранозида в 290 мл ТГФ. Данную смесь перемешивали в атмосфере водорода при температуре окружающей среды в течение 15 ч и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Желаемый продукт получали в виде бежевого твердого вещества с выходом 98%. Т. пл. (температура плавления) = 145 С. []D33 = -68 (с = 0,44; ДМСО). Подготовительный пример 2. 5-[(2,3,4-три-O-ацетил-5-тио-D-ксилопиранозил)окси]-1H-индол-1 карбоновой кислоты 1,1-диметилэтиловый эфир. Раствор 1,75 г (7,51 мМ) 5-гидрокси-1H-индол-1-карбоновой кислоты трет-бутилового эфира в 25 мл ТГФ, 2,73 г (13,5 мМ) диизопропилазодикарбоксилата и 3,54 г (13,5 мМ) трифенилфосфина добавляли к раствору 2,85 г (9,75 мМ) 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозы в 50 мл ТГФ. Данную реакционную смесь перемешивали при 45 С в течение 3 ч и затем концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, растворяли в этилацетате, и органическую фазу промывали 1 н. раствором гидроксида натрия и затем концентрированным водным раствором хлорида аммония. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на С 18-модифицированном силикагеле, выполняя элюирование смесью ацетонитрил/вода (7/3; об./об.). Желаемый продукт получали в виде бледно-желтого твердого вещества с выходом 11%. Т. пл. = 58-62 С. Подготовительный пример 3. 2-Метил-8-гидроксиимидазо[1,2-а]пиридин. Раствор 1,27 г (5,8 мМ) диметилкарбаминовой кислоты 2-метилимидазо[1,2-а]пиридин-7-илового эфира в 15 мл метанола добавляли к раствору метилата натрия, полученного из 0,2 г (8,7 мМ) натрия и 20 мл метанола. Температуру данной реакционной смеси доводили до температуры дефлегмации в течение 15 ч, и затем смесь охлаждали. Затем рН среды доводили до 8,5 2 н. раствором серной кислоты и затем концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (9/1; об./об.). Желаемый продукт получали в виде коричневого твердого вещества с выходом 87%. Т. пл. = 154 С. Подготовительный пример 4. 2-Метил-6-метоксиимидазо[1,2-а]пиридин. 0,74 г (8,04 мМ) хлорацетона добавляли к раствору 0,5 г ( мМ) 2-амино-5-метоксипиридина в 17 мл этанола. Данную смесь подвергали дефлегмации в течение 20 ч и затем концентрировали при пониженном давлении. К остатку, полученному в результате упаривания, добавляли этилацетат, и органическую фазу промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на NH2 (аминогруппа)-модифицированном силикагеле, выполняя элюирование смесью толуол/изопропиловый спирт (99/1; об./об.). Желаемый продукт получали в виде оранжевого масла с выходом 54%. 1 Н ЯМР (300 МГц; ДМСО) = 8.15 (d, 1H); 7.57 (s, 1H); 7.34 (d, 1H); 16.94 (dd, 1 Н); 3.77 (s, 3 Н); 2.29 (s, 3 Н). Подготовительный пример 5. 2-Метил-6-гидроксиимидазо[1,2-а]пиридин. Смесь, состоящую из 1,92 г (11 мМ) 2-метил-6-метоксиимидазо[1,2-а]пиридина и 7,26 г (45 мМ) пиридиния гидробромида, нагревали до температуры плавления в течение 8 ч. Затем смесь охлаждали и добавляли воду. Водную фазу подводили бикарбонатом натрия до щелочного рН и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. В результате получали желаемый продукт в виде бежевого твердого вещества с выходом 30%. Т. пл. = 174 С. Подготовительный пример 6. N,N-диметил-N'-[3-[(2,3,4-три-O-ацетил-5-тиоD-ксилопиранозил) окси]-2-пиридинил]метанимидамид. 0,31 г (2,6 мМ) 1,1-диметокси-N,N-диметилэтанамина (N,N-диметилформамида диметилацеталя) добавляли к раствору 1 г (2,6 мМ) 2-амино-3-пиридинил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозида(подготовительный пример 1) в 10 мл этанола. Данную смесь нагревали при перемешивании, в контейнере для микроволновой печи, при 120 С в течение 20 мин в микроволновой печи. Затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагеле, выполняя элюирование этилацетатом. Желаемый продукт получали в виде белого твердо-6 015303 го вещества с выходом 46%. Т. пл. = 120 С. []D32 =-82 (с = 0,19; ДМСО). Подготовительный пример 7. 2,1-Бензизоксазол-7-ол. 18,5 мл 1 М раствора бромида бора в дихлорметане добавляли к раствору 1,38 г (9,25 мМ) 7 метокси-2,1-бензизоксазола в 50 мл дихлорметана, охлажденному до -78 С, и затем данную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь вливали в воду, и данную смесь подводили до рН = 7-8 путем добавления раствора карбоната натрия и затем экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом магния и концентрировали под вакуумом. Полученный неочищенный продукт очищали путем хроматографии на силикагеле, выполняя элюирование смесью метилциклогексан/этилацетат (градиент от 100/0 до 50/50; об./об.). Желаемый продукт получали в виде желтого твердого вещества с выходом 10%. 1 Н ЯМР (300 МГц; ДМСО)= 10.46 (s, 1H); 9.69(s, 1H); 7.11 (d, 1H); 6.87 (dd, 1H);6.54(d, 1H). Подготовительный пример 8. 3-Метил-1,2-бензизоксазол-6-ол. 1,98 г 1-(2,4-дигидроксифенил)этанона оксима (12 мМ) и 1 г гидроксида калия (18 мМ) подвергали дефлегмации в течение 4 суток в смеси метанол/вода (100 мл/100 мл). Затем реакционную смесь концентрировали при пониженном давлении, подкисляли до рН = 1 путем добавления 1 н. HCl и затем экстрагировали этилацетатом. Полученную органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле (градиент метилциклогексан/этилацетат от 70/30 до 30/70; об./об.). Желаемый продукт получали в виде белого твердого вещества (0,39 г) с выходом 22%. Т. пл. = 122-136 С. Пример 1. 2-Метилимидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Методика А. 3,6 г (0,39 мМ) хлорацетона добавляли к раствору 3 г (7,8 мМ) 2-амино-3-пиридинил 2,3,4-три-Оацетил-5-тиоD-ксилопиранозида, полученного в подготовительном примере 1, в 15 мл этанола. Данную смесь нагревали при перемешивании в контейнере для микроволновой печи при 120 С в течение 30 мин. Затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате, и органическую фазу промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия и сушили над сульфатом магния. Затем органическую фазу фильтровали и концентрировали при пониженном давлении. Получали 3,8 г неочищенного продукта, который сразу без дополнительной очистки использовали на следующей стадии (описанной в примере 2). Методика Б. 0,44 г (3 мМ) 8-гидрокси-2-метилимидазо[1,2-а]пиридина, 1,18 г (4,5 мМ) трифенилфосфина и 3,46 г (4,5 мМ) диэтилазодикарбоксилата на подложке из полистирола (1,3 мМ/г) добавляли к раствору 1,32 г(4,5 мМ) 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозы в 30 мл ТГФ, охлажденному до -10 С. Данную реакционную смесь перемешивали при -10 С в течение 30 мин и затем при температуре окружающей среды в течение 15 ч. Затем реакционную смесь фильтровали и затем концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате, и органическую фазу промывали 1 н. раствором гидроксида натрия и затем водой. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем обратнофазовой хроматографии на С 18-модифицированном силикагеле, выполняя элюирование градиентом вода/ацетонитрил. Желаемый продукт получали в виде белого твердого вещества с выходом 14%. Т. пл. = 180 С. []D28 = -80 (с = 0,25; ДМСО). Пример 2. 2-Метилимидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Продукт, полученный в примере 1, в 40 мл 7 М раствора аммиака в метаноле перемешивали при температуре окружающей среды в течение 15 ч. Реакционную смесь концентрировали при пониженном давлении, и полученный неочищенный продукт очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (градиент от 100/0 до 80/20; об./об.). Полученный продукт перемешивали в 200 мл холодной воды и затем фильтровали, Желаемый продукт получали в виде белого порошка с выходом 53%. Т. пл. = 145 С. []D30 = -89 (с = 0,40; ДМСО). Пример 3. 2-Фенилимидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксило-пиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества 2-хлор-1-фенилэтанона, с выходом 52%, в виде сероватобежевого твердого вещества. Т. пл. = 205 С. []D29 =-94 (с = 0,38; ДМСО). Пример 4. 2-Фенилимидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 3, с выходом 42%, в виде белого твердого вещества. Т. пл. = 173 С. []D29 =-77 (с = 0,48; ДМСО). Пример 5. 3-Метилимидазо[1,2-а]пиридин-8-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества 2-хлорпропанола, с выходом 24%, в виде белого твердого вещества. Т. пл. = 150 С. []D29 = -83 (с = 0,25; ДМСО).-7 015303 Пример 6. 3-Метилимидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 5, с выходом 57%, в виде белого твердого вещества. Т. пл. = 119 С. []D29 = -69 (с = 0,38; ДМСО). Пример 7. 2-Ацетил-7-бензофуранил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Смесь, состоящую из 1,93 г (14,1 мМ) безводного хлорида цинка, 1 г (5,7 мМ) 2-ацетил-7-гидроксибензофурана и 2,2 г молекулярного сита 13 Х, перемешивали в 13 мл толуола и 13 мл ацетонитрила. Температуру смеси доводили до 90 С, и добавляли 1,42 г (14,1 мМ) триэтиламина и 2,22 г (6,27 мМ) 2,3,4 три-О-ацетил-5-тио-D-ксилопиранозил бромида, поддерживая температуру смеси на уровне 90 С. Затем смесь перемешивали в течение 20 мин, поддерживая температуру 90 С. Затем смесь охлаждали, добавляли 65 мл 0,5 н. раствора гидроксида натрия, и полученную смесь перемешивали в течение одного часа. Смесь фильтровали, и осадок промывали этилацетатом. Затем полученный фильтрат отделяли путем отстаивания. Органическую фазу промывали насыщенным водным раствором хлорида аммония, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле, выполняя элюирование смесью циклогексан/этилацетат (7/3; об./об.). Желаемый продукт получали в виде желтоватого твердого вещества с выходом 37%. Т. пл. = 208-209 С. [] D27 = -77 (с = 0,48; ДМСО). Пример 8. 2-Ацетил-7-бензофуранил 5-тио- D-ксилопиранозид. 0,118 мл раствора метилата натрия (18,7% по массе) в метаноле (0,41 мМ) добавляли, при температуре окружающей среды, к суспензии 1,85 г (4,1 мМ) продукта, полученного в примере 7, в 40 мл метанола. Данную реакционную смесь перемешивали при 40 С в течение 70 мин. Затем смесь охлаждали при перемешивании, и затем добавляли смолу Amberlite IR 120 Н+. Затем смолу удаляли путем фильтрации и промывали смесью метанол/тетрагидрофуран. Фильтрат концентрировали при пониженном давлении, и полученный остаток растирали в диэтиловом эфире и фильтровали. Полученное после фильтрации твердое вещество сушили. В результате получали желаемое соединение в виде желтых кристаллов с выходом 76%. Т. пл. = 116-120 С. []D24 =-73 (с= 0,55; ДМСО). Пример 9. 1 Н-Индол-5-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. 0,089 г (0,82 мМ) анизола и 7 мл трифторуксусной кислоты добавляли к раствору 0,42 г (0,82 мМ) продукта, полученного в подготовительном примере 2, в 60 мл дихлорметана. Данную реакционную смесь перемешивали при температуре дефлегмации в течение 1,5 ч и затем, после охлаждения, концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле, выполняя элюирование смесью толуол/ацетон (95/5; об./об.). Желаемый продукт получали в виде бесцветного масла с выходом 30%. Пример 10. 1 Н-индол-5-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 8, с использованием в качестве исходного вещества продукта, полученного в примере 9, с выходом 53% в виде белого твердого вещества. ЯМР (250 МГц, ДМСО)= 10.95 (s, 1H), 7.29 (m, 3 Н), 6.84 (dd, 1H), 6.35 (m, 1 Н), 5.45 (d, 1 Н), 5.04(d, 1 Н), 4.99 (d, 1 Н J= 8.88 Гц), 4.94 (d, 1 Н), 3.52 (m, 2 Н), 3.13 (m, 1 Н), 2.55 (m, 2 Н). Пример 11. 2-Метил-5-бензотиазолил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 2 метил-5-гидроксибензотиазола, с выходом 6%, в виде белых кристаллов. Т. пл. = 158 С (после перекристаллизации из изопропилового спирта). []D27 = -23 (с = 0,48; СН 3 ОН). Пример 12. 2-Метил-5-бензотиазолил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 8, с использованием в качестве исходного вещества продукта, полученного в примере 11, с выходом 73%, в виде белых кристаллов. Т. пл. = 210-211 С. []D27 = -79 (с = 0,41; СН 3 ОН). Пример 13. 5-Ацетил-4,7-диметокси-6-бензофуранил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 5 ацетил-4,7-диметокси-6-гидроксибензофурана, и сразу использовали на следующей стадии снятия защитных групп без дополнительной очистки. Пример 14. 5-Ацетил-4,7-диметокси-6-бензофуранил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 13, с выходом 25%, в виде белого твердого вещества. Т. пл. = 207-209 С. []D26 = -40 (с = 0,29; ДМСО). Пример 15. 4-Бензоксазолил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с ис-8 015303 пользованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 4 гидроксибензоксазола, с выходом 41%, в виде белого твердого вещества. Т. пл. = 139 С. [] = -61 (с = 0,23; ДМСО). Пример 16. 4-Бензоксазолил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 15, с выходом 61%, в виде желтоватого порошка. Т. пл. = 172 С. []D29 = -94 (с = 0,19; ДМСО). Пример 17. 7-Бензофуранил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-O-ксилопиранозил бромида и 7 гидроксибензофурана, с выходом 14%, в виде белого твердого вещества. Т. пл. = 152 С. []D30 = -47 (с = 0,32; ДМСО). Пример 18. 7-Бензофуранил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 17, с выходом 50%, в виде белого твердого вещества. Т. пл. = 160 С. []D30 = -85 (с = 0,24; ДМСО). Пример 19. 3-Бензоил-5-бензофуранил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 3 бензоил-5-гидроксибензофурана, с выходом 20%, в виде белого твердого вещества. Т. пл. = 182 С. []D27=+1(с = 0,22;ДМСО). Пример 20. 3-Бензоил-5-бензофуранил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 19, с выходом 40%, в виде белого твердого вещества. Т. пл. = 163 С. []D30 = -52 (с = 0,33; ДМСО). Пример 21. 2,3-Диметилимидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике Б примера 1, с использованием в качестве исходного вещества 8-гидрокси-2,3-диметилимидазо[1,2-а]пиридина, с выходом 11%, в виде белого твердого вещества. Т. пл. = 213 С. []D28 = -103 (с = 0,23; ДМСО). Пример 22. 2,3-Диметилимидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 21, с выходом 26%, в виде белого твердого вещества. Т. пл. = 125-130 С. []D28 = -99 (с = 0,22; ДМСО). Пример 23. Имидазо[1,2-а]пиридин-8-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества бромацетальдегида, с выходом 35%, в виде сероватобежевого твердого вещества. Т. пл. = 130 С. []D28 = -76 (с = 0,50; ДМСО). Пример 24. Имидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 23, с выходом 53%, в виде белого твердого вещества. Т. пл. = 102 С. []D29 = -52 (с = 0,20; ДМСО). Пример 25. 2-(1-Метилэтил)имидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества 2-метил-4-бром-3-бутанона, с выходом 31%, в виде белого твердого вещества. Т. пл. = 182 С. []D35 = -72 (с = 0,20; ДМСО). Пример 26. 2-(1-Метилэтил)имидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 25, с выходом 55%, в виде белого твердого вещества. Т. пл. = 83 С. []D35 = -125 (с = 0,20; ДМСО). Пример 27. 2-Метилимидазо[1,2-а]пиридин-7-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 2 метил-7-гидроксиимидазо[1,2-а]-пиридина, полученного в соответствии с методикой подготовительного примера 3, с выходом 38%, в виде белого твердого вещества. Полученный продукт сразу использовали на стадии деацетилирования. Пример 28. 2-Метилимидазо[1,2-а]пиридин-7-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 27, с выходом 35%, в-9 015303 виде розоватого твердого вещества. Т. пл. = 172 С. []D35 = -107 (с = 0,20; ДМСО). Пример 29. 1-Метил-1H-бензимидазол-4-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 4 гидрокси-1-метил-1H-бензимидазола, с выходом 38%, в виде белого твердого вещества. Полученный продукт сразу использовали на стадии деацетилирования. Пример 30. 1-Метил-1H-бензимидазол-4-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 8, с использованием в качестве исходного вещества продукта, полученного в примере 29, с выходом 70%, в виде коричневого твердого вещества. Т. пл. = 180 С. []D32 = -87 (с = 0,20; ДМСО). Пример 31. 2-(Хлорметил)имидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества 1,3-дихлорацетона, с выходом 42%, в виде белого твердого вещества. Т. пл. = 166 С. [] D29 = -75 (с = 0,20; ДМСО). Пример 32. 2-(Фенилметил)имидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Раствор 0,108 г (1,02 мМ) карбоната натрия в 2 мл воды, 0,055 г (0,0678 мМ) [1,1'-бис (дифенилфосфино)ферроцен]дихлорпалладия (II) дихлорметана и 0,277 г (1,35 мМ) 4,4,5,5-тетраметил-2-фенил 1,2,3-диоксаборолана добавляли к раствору 0,31 г (0,678 мМ) 2-хлорметилимидазо[1,2-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозида, полученного в соответствии с методикой примера 31, в 4 мл DME. Данную реакционную смесь нагревали в микроволновой печи при 120 С в течение 30 мин. После охлаждения добавляли воду, и полученную смесь экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (97/3; об./об.), и затем кристаллизовали из диэтилового эфира. Желаемый продукт получали в виде белого твердого вещества с выходом 42%. Т. пл. = 152 С. []D29 =-83(с = 0,19;ДМСО). Пример 33. 2-(Фенилметил)имидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 32, с выходом 90%, в виде белого твердого вещества. Т. пл. = 114 С. []D29 =-81(с = 0,20; ДМСО). Пример 34. 2-Метилимидазо[1,2-а]пиридин-6-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходных веществ 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозил бромида и 2 метил-6-гидроксиимидазо[1,2-а]пиридина, полученного в соответствии с методикой подготовительного примера 5, с выходом 13%, в виде белого твердого вещества. Т. пл. = 83 С. []D24 = +35 (с = 0,20; ДМСО). Пример 35. 2-Метилимидазо[1,2-а]пиридин-6-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 8, с использованием в качестве исходного вещества продукта, полученного в примере 34, с выходом 66%, в виде белого твердого вещества. Т. пл. = 194 С. []D31 =-21 (с = 1,00; ДМСО). Пример 36. 2-Метилимидазо[1,2-а]пиридин-8-ил 2,3-О-(1 -метилэтил иден)-5-тиоD-ксилопиранозид. Раствор 725 мг (2,66 мМ) 2-метилимидазо[1,2-а]пиридин-8-ил 5-тиоD-ксилопиранозида (пример 2) и 406 мг (5,63 мМ) 2-метоксипропена в 1,5 мл ДМФА готовили при температуре окружающей среды и затем охлаждали до -8 С. К данному раствору добавляли 710 мг (3,05 мМ) камфорсульфоновой кислоты,и полученную смесь перемешивали при температуре окружающей среды в течение 24 ч. Реакционную смесь вливали в раствор бикарбоната натрия (0,5 н.) и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия и затем сушили над сульфатом магния и концентрировали под вакуумом. Полученный остаток очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (88/12; об ./об.). Желаемый продукт получали в виде белого порошка с выходом 7%. Т. пл. = 196 С. []D30 =-252 (с = 0,25; CHCl3). Пример 37. 2-Метилимидазо[1,2-а]пиридин-8-ил 3,4-О-(1-метилэтилиден)-5-тиоD-ксилопиранозид. Данное соединение получали одновременно с соединением примера 36. Два данных продукта разделяли во время очистки на силикагеле. Желаемый продукт получали в виде белого порошка с выходом 16,5%. Т. пл. = 190 С. []D30 =-252 (с = 0,2; CHCl3). Пример 38. [1,2,4]Триазоло[1,5-а]пиридин-8-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. 0,1 мл пиридина и 0,068 г (0,6 мМ) гидроксиламин-О-сульфоновой кислоты добавляли к раствору 0,22 г (0,5 мМ) соединения, полученного в подготовительном примере 6, в 5 мл метанола. Данную смесь- 10015303 перемешивали при температуре окружающей среды в течение 2 ч, и получали осадок белого цвета. Затем реакционную смесь концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, растворяли в дихлорметане, и органическую фазу промывали водой. Затем органическую фазу сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/этилацетат(градиент от 90/10 до 80/20; об./об.). Желаемый продукт (в виде смеси с исходным продуктом предыдущей стадии) получали в виде белого твердого вещества с выходом 30%. Затем данный продукт использовали на следующей стадии без дополнительной очистки. Пример 39. [1,2,4]Триазоло[1,5-а]пиридин-8-ил 5-тиоD-ксилопиранозид. Смесь, состоящую из продукта, полученного в примере 38, в 5 мл 7 М раствора аммиака в метаноле,перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, и полученный неочищенный продукт очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (97/3; об./об.). Полученный продукт промывали холодной водой и затем фильтровали и сушили. Желаемый продукт получали в виде белого твердого веществас выходом 36%. Т. пл. = 155 С. []D32 =-106(с = 0,2; ДМСО). Пример 40. 2,1-Бензизоксазол-7-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Смесь, состоящую из 0,25 г (1,85 мМ) безводного хлорида цинка и 0,22 г молекулярного сита 13 Х, в 2 мл толуола и 2 мл ацетонитрила перемешивали, и добавляли 0,1 г (0,74 мМ) 2,1-бензизоксазол-7-ола,полученного в подготовительном примере 7, и 0,19 г (1,85 мМ) триэтиламина. Температуру данной смеси доводили до 90 С, и, поддерживая данную температуру, добавляли 0,29 г (0,82 мМ) 2,3,4-три-Oацетил-5-тио-D-ксилопиранозил бромида. Эту смесь дополнительно перемешивали в течение 20 минут,поддерживая температуру 90 С. Затем смесь охлаждали, фильтровали и затем концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле, выполняя элюирование смесью метилциклогексан/этилацетат (градиент от 100/0 до 50/50; об./об.). Желаемый продукт получали в виде бежевого твердого вещества с выходом 30%. Т. пл. = 157 С.[]D25 = -38 (с = 0,14; ДМСО). Пример 41. 2,1-Бензизоксазол-7-ил 5-тиоD-ксилопиранозид. Смесь, состоящую из продукта, полученного в примере 40, в 5 мл метанола и 10 капель раствора метилата натрия (8%) в метаноле, перемешивали при температуре окружающей среды в течение 3 ч. Затем реакционную смесь нейтрализовали с использованием смолы IR 120 Н+ до получения рН = 5, фильтровали и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали путем хроматографии на силикагеле, выполняя элюирование смесью дихлорметан/метанол (градиент от 100/0 до 80/20; об./об.), и затем путем полупрепаративной ЖХВД (жидкостной хроматографии высокого давления (колонка: Waters, Atlantis, 19 X 100 мм. Элюант: градиент ацетонитрил/Н 2 О/0,1%ТФУ). Желаемый продукт получали в виде бежевого твердого вещества с выходом 32%. Т. пл. = 115 С. []D28 =-116(с= 0,11; ДМСО). Пример 42. 8-[(2,3,4-три-O-ацетил-5-тиоD-ксилопиранозил)окси]имидазо[1,2-а]-пиридин-2-уксусной кислоты этиловый эфир. Желаемый продукт получали в соответствии с методикой, аналогичной методике А примера 1, с использованием в качестве исходного вещества 2-амино-3-пиридинил 2,3,4-три-О-ацетил-5-тиоDксилопиранозида и 4-хлор-3-оксобутановой кислоты этилового эфира, с выходом 54%, в виде белого твердого вещества. Т. пл. = 120 С. []D30= -75 (с = 0,29; ДМСО). Пример 43. 8-[(5-тиоD-ксилопиранозил)окси]имидазо[1,2-а]пиридин-2-уксусная кислота, соль трифторуксусной кислоты. К раствору 0,55 г (1,11 мМ) соединения, полученного в примере 42, в 6 мл ТГФ добавляли 6 мл воды и затем 0,23 г (5,55 мМ) гидроксида лития, и данную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали при пониженном давлении и затем подкисляли раствором соляной кислоты (1 М) до получения рН = 3-4, и лиофилизировали. В конце полученный продукт очищали путем полупрепаративной ЖХВД (колонка: Waters, Atlantis, 19 X 100 мм. Элюант: градиент ацетонитрил/Н 2 О/0,1%ТФУ). Желаемый продукт получали в форме соли трифторуксусной кислоты, в виде белого ватообразного вещества с выходом 31%. Т. пл. = 86 С. []D27 = -54 (с = 0,33; ДМСО). Пример 44: 2-Метил-6-бензотиазолил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 2-метил-6-гидроксибензотиазола, с выходом 24%, в виде серовато-бежевого твердого вещества. Т. пл. = 160 С. []D28 = -3 (с = 0,3; ДМСО). Пример 45. 2-Метил-6-бензотиазолил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 44, с выходом 70%, в виде белого твердого вещества. Т. пл. = 184 С. []D27 = -40 (с = 0,34; ДМСО). Пример 46. 2-Метил-5-бензоксазолил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид.- 11015303 Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 2-метил-5-гидроксибензоксазола, с выходом 26%, в виде белого твердого вещества. Т. пл. = 168 С. []D28 =-30 (с = 0,12; ДМСО). Пример 47. 2-Метил-5-бензоксазолил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 46, с выходом 62%, после кристаллизации из 2-пропанола, в виде белого твердого вещества. Т. пл. = 187-189 С. []D25 =-86 (с= 0,23; ДМСО). Пример 48. 2-Метил-4-бензоксазолил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 2-метил-4-гидроксибензоксазола, с выходом 9%, в виде белого твердого вещества. Т. пл. = 149-151 С. []D25 = -55 (с = 0,27; ДМСО). Пример 49. 2-Метил-4-бензоксазолил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 48, с выходом 91%, после кристаллизации из воды, в виде белого твердого вещества. Т. пл. = 164-167 С. []D25 = -73 (с = 0,53; ДМСО). Пример 50. 3-Метил-1,2-бензизоксазол-4-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 3-метил-4-гидрокси-1,2-бензизоксазола, с выходом 14%, в виде твердого вещества кремового цвета. Т. пл. = 155-158 С(МеОН). []D25 = -83 (с = 0,78; ДМСО). Пример 51. 3-Метил-1,2-бензизоксазол-4-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества соединения, полученного в примере 50, с выходом 89%,после кристаллизации из воды, в виде белого твердого вещества. Т. пл. = 165-168 С. []D28 = -74 (с = 0,18; ДМСО). Пример 52. 1-Метил-1H-1,2,3-бензотриазол-5-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 5-гидрокси-1-метил-1H-1,2,3-бензотриазола, с выходом 11%, в виде белого твердого вещества. Т. пл. = 80 С. []D28 = -9 (с = 0,26; ДМСО). Пример 53. 1-Метил-1H-1,2,3-бензотриазол-5-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества соединения, полученного в примере 52, с выходом 61%, в виде белого твердого вещества. Т. пл. = 220 С. []D25 =-113 (с = 0,26; ДМСО). Пример 54. 6-Бензотиазолил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 6-гидроксибензотиазола, с выходом 30%, в виде белого твердого вещества. Т. пл. = 166 С. []D27 = -2,4 (с = 0,2; ДМСО). Пример 55. 6-Бензотиазолил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества соединения, полученного в примере 54, с выходом 72%, в виде белого твердого вещества. Т. пл. = 192 С. []D27 = -48 (с = 0,25; ДМСО). Пример 56. 6-[(2,3,4-три-O-ацетил-5-тиоD-ксилопиранозил)окси]-1H-индол-1-карбоновая кислота, 1,1-диметилэтиловый эфир. Раствор 2,66 г (11,41 мМ) 6-гидрокси-1H-индол-1-карбоновой кислоты трет-бутилового эфира в 50 мл ТГФ, 4,16 г (20,6 мМ) диизопропилазодикарбоксилата и 5,39 г (20,6 мМ) трифенилфосфина добавляли к раствору 4,34 г (14,84 мМ) 2,3,4-три-О-ацетил-5-тио-D-ксилопиранозы в 150 мл ТГФ. Данную реакционную смесь перемешивали при 50 С в течение 4 ч и затем концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, растворяли в этилацетате, и органическую фазу промывали 1 н. раствором гидроксида натрия и затем концентрированным водным раствором хлорида аммония. Затем органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток, полученный в результате упаривания, очищали путем хроматографии на силикагеле,выполняя элюирование смесью метилциклогексан/этилацетат (градиент от 9/1 до 7/3; об./об.). Затем полученный остаток очищали путем хроматографии на С 18-модифицированном силикагеле, выполняя элюирование смесью ацетонитрил/вода (6/4; об./об.). Желаемый продукт получали в виде белого твердого вещества с выходом 3%. Т. пл. = 147-158 С. []D28 =14(с = 0,11;ДМСО). Пример 57. 1H-индол-6-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. К раствору 0,043 г (0,085 мМ) соединения, полученного в примере 56, в 4,5 мл дихлорметана добавляли 0,092 г (0,085 мМ) анизола и 0,5 мл трифторуксусной кислоты. Данную реакционную смесь перемешивали при температуре дефлегмации в течение 3 ч и затем, после охлаждения, концентрировали при- 12015303 пониженном давлении. Остаток, полученный в результате упаривания, очищали путем полупрепаративной ЖХВД (колонка: Waters, Atlantis, 19 X 100 мм, Элюант: градиент ацетонитрил/Н 2 О/0,1%ТФУ). Желаемый продукт получали в виде серо-белого твердого вещества с выходом 16%. Т. пл. = 172-175 С.[]D23 =-10(с = 0,16 ДМСО). Пример 58. 3-Метил-1,2-бензизоксазол-6-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества продукта, полученного в подготовительном примере 8, с выходом 17%, в виде белого твердого вещества. Т. пл. = 170-180 С. []D22 = - 7 (с = 0,33 ДМСО). Пример 59. 3-Метил-1,2-бензоизоксазол-6-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 41, с использованием в качестве исходного вещества соединения, полученного в примере 58, с выходом 53%, в виде белого твердого вещества. Т. пл. = 148-161 С. []D23 =-79(с = 0,13 ДМСО). Пример 60. 1-метил-1H-1,2,3-бензотриазол-6-ил 2,3,4-три-O-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 1-метил-1 Н-1,2,3-бензотриазол-6-ола, с выходом 60%, в виде белого твердого вещества. Т. пл. = 143 С. []D24 = 3 (с = 0,2 ДМСО). Пример 61. 1-метил-1H-1 ,2,3-бензотриазол-6-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 60, с выходом 51%, после кристаллизации из воды, в виде белого твердого вещества. Т. пл. = 211 С. []D25 =-86 (с = 0,24; ДМСО). Пример 62. 1,2-Диметил-1H-бензимидазол-4-ил 2,3,4-три-О-ацетил-5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 7, с использованием в качестве исходного вещества 1,2-диметил-4-гидрокси-1H-бензимидазола, с выходом 4%,в виде бежевого порошка. Т. пл. = 192 С. []D24 =-11 (с = 0,11 ДМСО). Пример 63. 1,2-Диметил-1H-бензимидазол-4-ил 5-тиоD-ксилопиранозид. Желаемый продукт получали в соответствии с методикой, аналогичной методике примера 2, с использованием в качестве исходного вещества продукта, полученного в примере 62, с выходом 20%, в виде коричневого порошка. Т. пл. = 153 С. []D26 =-37 (с = 0,2; ДМСО). Структуры описанных выше соединений формулы I еще раз описаны в нижеприведенной таблице. ТХ указывает позиции заместителей у тиоксилозы; Ас = СОСН 3;: соль трифторуксусной кислоты. Антитромботическую активность соединений по изобретению изучали in vivo у крыс с помощью теста, который воспроизводит венозный тромбоз. Венозный тромбоз вызывали в соответствии с протоколом, описанным в Thromb. Haemost. 1992,67(1), 176-179. Активность после перорального введения изучали в соответствии со следующим рабочим протоколом. Эксперимент проводили на самцах крыс Wistar весом от 250 до 280 г, которых не ограничивали в корме, крыс распределяли на группы, по 8-10 животных в каждой группе. Исследуемые продукты вводили перорально (с помощью трубки) в виде раствора или суспензии в растворе метилцеллюлозы (0,5% в воде). Концентрацию соединений рассчитывали исходя из того, что перорально абсорбируемое количество раствора составляет 10 мл/кг. Тромбоз вызывали в момент времени Т (между 2 и 8 ч) после введения продукта, и образовавшийся тромб удаляли и взвешивали. С целью индукции тромбоза вызывали венозный стаз с гиперкоагуляцией в соответствии с методикой, описанной WESSLER (J. Applied Physiol. 1959, 943-946), с использованием в качестве агента, вызывающего гиперкоагуляцию, раствора активированного фактора X (Ха), поставляемого компанией Biogenic (Montpellier) и имеющего концентрацию 7,5 нкат/кг. Венозный стаз наступал точно через 10 с после инъекции агента, вызывающего гиперкоагуляцию. Активность исследуемых соединений подтверждали для различных доз, после их введения. Тромбоз вызывали через 2-8 ч после введения соединения. В качестве примера в таблице ниже приведены данные описанного исследования для некоторых соединений по изобретению (активность выражена в виде процента ингибирования образования тромба, наблюдаемого в присутствии соединения по изобретению, относительно массы тромба, образованного в отсутствии соединения).- 14015303 Таблица I. Активность после перорального введения Данные результаты показывают, что соединения по изобретению обладают активностью в отношении венозного тромбоза. Поэтому объектом настоящего изобретения является соединение по изобретению формулы I, а также его фармацевтически приемлемые соли, образованные с кислотой, сольваты и гидраты, для применения в качестве лекарства. Соединение формулы I или его фармацевтически приемлемую соль, сольват или гидрат можно применять в приготовлении антитромботического лекарства для применения, в частности, в лечении или предупреждении состояний венозного кровообращения, и особенно для корректировки некоторых гематологических параметров, которые являются чувствительными к данному состоянию вен. Поэтому объектом настоящего изобретения также являются фармацевтические композиции, содержащие соединение формулы I или его фармацевтически приемлемую соль, сольват или гидрат. Данные фармацевтические композиции обычно содержат подходящие эксципиенты. Выбор указанных эксципиентов определяется фармацевтической формой и желательным путем введения, в частности пероральным введением или введением путем инъекции. Данные фармацевтические композиции готовят в соответствии со стандартными методиками, известными специалистам в данной области техники. Например, соединения по изобретению могут быть приготовлены в виде препарата с физиологически приемлемыми эксципиентами с целью получения готовой инъецируемой формы, инъецируемой формы, приготовленной для немедленного приема, или твердой формы для перорального введения, такой как, например, желатиновая капсула или таблетка. Например, предпочтительно, когда инъецируемая форма может быть приготовлена путем лиофилизации отфильтрованного и стерильного раствора, содержащего соединение по изобретению и растворимый эксципиент в количестве, необходимом и достаточном для получения изотонического раствора после добавления воды для немедленного введения путем инъекции. Полученный раствор может быть введен либо путем однократной подкожной или внутримышечной инъекции, либо путем медленной перфузии. Обычно является предпочтительным пероральный путь введения препарата в форме желатиновой капсулы, содержащей соединение по изобретению, тонкоизмельченное или еще лучше микронизированное, и смешанное с эксципиентами, известными специалистам в данной области техники, например с лактозой, желатинированным крахмалом или стеаратом магния. Для получения желаемого терапевтического или профилактического эффекта каждая стандартная доза может содержать от 10 до 500 мг по меньшей мере одного соединения по изобретению. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное тиоксилозы, отличающееся тем, что данное соединение выбрано из а) соединений формулы где пентапиранозильная группа представляет собой свободную или замещенную 5-тиоDксилопиранозильную группу,каждый из R', R" и R'" независимо представляет собой атом водорода или С 2-С 6 ацильную группу,или два соседних радикала из R', R" и R'" образуют 1-метилэтилиденовый мостик,каждый из X1 и Х 2 представляют собой атом углерода или азота,каждый из Y1 и Y2 независимо представляет собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, гдеR6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, C2-C6 ацильную группу, группу С 1-С 5 алкил-СН(ОН), бензоильную группу или фенильное кольцо; б) солей присоединения соединений формулы I.- 15015303 2. Соединение по п.1, отличающееся тем, что в вышеприведенной формуле (I) R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо или атом галогена, С 1-С 4 алкоксигруппу, С 2-С 6 ацильную группу, бензоильную группу или фенильное кольцо. 3. Соединение по п.1 или 2, отличающееся тем, что в формуле (I) X1 и Y2 представляют собой атом азота, а Х 2 и Y1 представляют собой атом углерода. 4. Соединение по любому из пп.1-3, отличающееся тем, что в формуле (I) R', R" и R'" представляют собой атом водорода. 5. Соединение по любому из пп.1-3, отличающееся тем, что в формуле (I) R', R" и R'" представляют собой группу СОСН 3. 6. Способ получения соединения по любому из пп.1-5, отличающийся тем, что данный способ включает следующие стадии: взаимодействие ароматической системы, содержащей гидроксильную группу фенольной природы,формулы где каждый из X1 и Х 2 представляют собой атом углерода или азота,Y1 и Y2 представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, гдеR6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, С 1-С 4 алкоксигруппу, С 2-С 6 ацильную группу, группу С 1-С 5 алкил-СН(ОН), бензоильную группу или фенильное кольцо, с производным 5-тиоксилопиранозы формулы где Hal представляет собой атом галогена, и R', R" и R'" представляют собой С 2-С 6 ацильную группу, в апротонном растворителе, таком как ацетонитрил или толуол, в присутствии соли или оксида серебра, или соли или оксида цинка в безводной среде, при температуре от 25 до 110C в течение 1-10 ч с целью получения соединения формулы где Х 1, Х 2, Y1, Y2, R', R", R'", R1, R2, R3, R4 и R5 являются такими, как в исходных соединениях. 7. Способ по п.6, где галоген представляет собой атом брома, С 2-С 6 ацильная группа представляет собой ацетильную группу,соль серебра представляет собой имидазолат серебра,соль цинка представляет собой хлорид. 8. Способ получения соединения по любому из пп.1-5, где два соседних заместителя из R', R" и R'" образуют 1-метилэтилиденовый мостик, а третий заместитель представляет собой атом водорода, отличающийся тем, что данный способ включает следующие стадии: взаимодействие соединения формулы la, где каждый из Х 1 и Х 2 представляют собой атом углерода или азота,Y1 и Y2 представляют собой атом углерода, азота, серы или кислорода, при условии, что, если Y2 представляет собой атом кислорода или серы, Y1 представляет собой атом углерода или азота,R1, R2, R3, R4 и R5 независимо друг от друга представляют собой атом водорода, группу -COOR6, гдеR6 представляет собой атом водорода или С 1-С 4 алкил, С 1-С 4 алкильную группу, возможно имеющую в качестве заместителя фенильное кольцо, атом галогена или группу -COOR6, C1-C4 алкоксигруппу, С 2-С 6 ацильную группу, группу С 1-С 5 алкил-СН(ОН), бензоильную группу или фенильное кольцо,с 2-метоксипропеном в безводном растворителе и в кислой среде с целью получения соединения формулы I, где два соседних заместителя из R', R" и R'" образуют 1-метилэтилиденовый мостик, а третий заместитель представляет собой атом водорода. 9. Применение соединения по любому из пп.1-5 в качестве фармакологически активного вещества.- 16015303 10. Применение соединения по любому из пп.1-5 для приготовления лекарства для предупреждения или лечения тромбозов. 11. Применение по п.10 для приготовления лекарства для предупреждения или лечения венозных тромбозов.
МПК / Метки
МПК: C07H 17/00, A61K 31/7032, C07H 1/00
Метки: новые, 5-тиоксилопиранозы, производные
Код ссылки
<a href="https://eas.patents.su/18-15303-novye-proizvodnye-5-tioksilopiranozy.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные 5-тиоксилопиранозы</a>
Предыдущий патент: Промышленный способ синтеза 17a-ацетокси-11b-[4-(n,n-диметиламино)фенил]-19-норпрегна-4,9-диен-3,20-диона и новые промежуточные соединения, полученные в данном способе
Следующий патент: Лечение ревматоидного заболевания глюкокортикоидами с отсроченным высвобождением
Случайный патент: Антипролиферативные соединения, их конъюгаты, способы их получения и их применение












