2-пиридинкарбоксамидные производные в качестве модуляторов натриевых каналов
Номер патента: 15952
Опубликовано: 30.12.2011
Авторы: Пуансар Седрик, Дентон Стефен Мартин, Штаммен Бланда Луция, Багал Шаранджеет Каур, Кемп Марк Ян, Гибсон Карл Ричард, Глоссоп Мелани Сьюзан
Формула / Реферат
1. Соединение формулы (I)
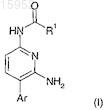
или его фармацевтически приемлемая соль или сольват, где
R1 выбран из:
(i) фенила, необязательно замещенного одним или несколькими заместителями, каждый из которых независимо выбран из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-С4)алкила, галоген(С1-С4)алкокси, (С1-С4)алкокси(С1-С4)алкила, (С1-С4)алкиламино и ди-((C1-C4)алкил)амино; и
(ii) 5-членной гетероарильной группы, включающей либо (а) от 1 до 4 атомов азота, либо (b) один атом кислорода или один атом серы и 1 или 2 атома азота, и при этом указанная гетероарильная группа, необязательно, является замещенной одним заместителем, выбранным из (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкила, галоген(C1-C4)алкокси, (C1-C4)алкокси(C1-С4)алкила, (C1-C4)алкиламино и ди-((C1-C4)алкил)амино; при условии, что R1 не является имидазолилом, оксазолилом или 1,2,4-триазолилом;
Ar представляет собой
![]()
где ® указывает точку присоединения к пиридиновому кольцу;
каждый R2независимо представляет собой (C1-C4)алкил, OR4, (С1-С4)алкокси(С1-С4)алкил, галоген(C1-C4)алкил, циано или галоген;
n имеет значение от 0 до 4;
m имеет значение от 0 до 7;
р имеет значение от 0 до 3;
R3 представляет собой водород, (C1-C4)алкил, OR4, (C1-C4)алкокси(C1-C4)алкил, галоген(C1-C4)алкил, циано или галоген;
R4 представляет собой водород, (C1-C4)алкил, галоген(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил, (C3-C6)циклоалкил, (С3-C6)циклоалкил(C1-C4)алкил, Het1- или Het1(C1-C4)алкил-; и
Het1 представляет собой насыщенное 5- или 6-членное гетероциклическое кольцо, включающее один атом кислорода.
2. Соединение по п.1 или его фармацевтически приемлемая соль или сольват, где R1выбран из:
(i) фенила, необязательно замещенного одним или несколькими заместителями, каждый из которых независимо выбран из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкила или (C1-C4)алкокси(C1-C4)алкила; или
(ii) 5-членной гетероарильной группы, выбранной из пиразолила, изоксазолила, оксадиазолила и 1,2,3-триазолила, каждый из которых, необязательно, является замещенным (C1-C4)алкилом, галоген(C1-C4)алкилом или (C1-C4)алкокси(C1-C4)алкилом.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль или сольват, где R1представляет собой 5-членную гетероарильную группу, выбранную из
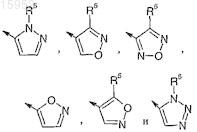
где ® указывает точку присоединения к карбонильной группе и где R5 представляет собой (C1-C4)алкил, галоген(C1-C4)алкил или (C1-C4)алкокси(C1-C4)алкил.
4. Соединение по п.3 или его фармацевтически приемлемая соль или сольват, где R5представляет собой метил, этил, изопропил, метоксиметил или трифторметил.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль или сольват, где Ar представляет собой

где значения R2, R3и n определены в п.1.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль или сольват, где каждый R2 независимо выбран из (C1-C4)алкила, OR4, (C1-C4)алкокси(C1-C4)алкила, галоген(C1-C4)алкила и галогена и где R4 представляет собой водород, (C1-C4)алкил, галоген(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил, (С3-C6) циклоалкил или (C3-C6)циклоалкил(C1-C4)алкил.
7. Соединение по любому из пп.1-6 или его фармацевтически приемлемая соль или сольват, где каждый R2 независимо выбран из метила, этила, пропила, гидрокси, метокси, этокси, пропокси, бутокси, циклопропилокси, метоксиметила, метоксиэтокси, метоксипропокси, циклопропилметокси, дифторметила, трифторметила, 2,2,2-трифторэтила, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, хлора и фтора.
8. Соединение по любому из пп.1-7 или его фармацевтически приемлемая соль или сольват, где R3 представляет собой (C1-C4)алкил, OR4, (C1-C4)алкокси(C1-C4)алкил, галоген(C1-C4)алкил, циано или галоген.
9. Соединение по любому из пп.1-8 или его фармацевтически приемлемая соль или сольват, где R3 представляет собой метил, этил, пропил, гидрокси, метокси, этокси, пропокси, бутокси, циклопропилокси, метоксиметил, метоксиэтокси, метоксипропокси, циклопропилметокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, хлор или фтор.
10. Соединение по любому из пп.1-9, которое выбрано из следующих:
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[5-хлор-2-(трифторметокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-хлор-5-(трифторметокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-1-этил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-фтор-2-(трифторметокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-1-изопропил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(5-фтор-2-пропоксифенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[5-хлор-2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-(циклопропилокси)-5-фторфенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(циклопропилокси)-5-фторфенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(трифторметил)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2,5-дихлорфенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2,3,5-трихлорфенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2,3-дихлор-5-метоксифенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2,5-дихлор-3-метоксифенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-фтор-2-(трифторметил)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2,4-дихлорфенил)пиридин-2-ил]-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-хлор-2-(трифторметокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-5-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-5-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2,5-дихлор-3-метоксифенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2,3,5-трихлорфенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-(дифторметокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[5-фтор-2-(трифторметил)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[2-(дифторметил)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-4-метил-1,2,5-оксадиазол-3-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-4-метил-1,2,5-оксадиазол-3-карбоксамид;
N-[6-амино-5-(2,5-дихлор-3-метоксифенил)пиридин-2-ил]-4-метил-1,2,5-оксадиазол-3-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-1-этил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-1-этил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-1-этил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-хлор-2-(трифторметокси)фенил]пиридин-2-ил}-1-этил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-1-изопропил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-1-изопропил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-1-изопропил-1Н-пиразол-5-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-3-(метоксиметил)изоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-3-(метоксиметил)изоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-5-(метоксиметил)изоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-фторфенил)пиридин-2-ил]-5-(метоксиметил)изоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлорфенил)пиридин-2-ил]-3-(трифторметил)изоксазол-4-карбоксамид;
N-{6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил}-3-(трифторметил)изоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-3-(трифторметил)изоксазол-4-карбоксамид;
N-{6-амино-5-[5-фтор-2-(трифторметокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-этокси-5-фторфенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[5-метокси-2-(трифторметокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[2-(2,2,2-трифторэтил)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
N-[6-амино-5-(2-хлор-5-этоксифенил)пиридин-2-ил]-3-метилизоксазол-4-карбоксамид;
N-{6-амино-5-[5-хлор-2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-фтор-2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-1-метил-1Н-пиразол-5-карбоксамид;
N-{6-амино-5-[5-фтор-2-(2,2,2-трифторэтокси)фенил]пиридин-2-ил}-3-метилизоксазол-4-карбоксамид;
их фармацевтически приемлемых солей и сольватов.
11. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или сольват, определенные в любом из пп.1-10, и один или несколько фармацевтически приемлемых эксципиентов.
12. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных в любом из пп.1-10, в качестве лекарственного средства.
13. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных в любом из пп.1-10, для получения лекарственного средства для лечения заболевания или состояния, для которого показан модулятор NaV1.8 канала.
14. Применение по п.13, где заболевание или состояние представляет собой боль.
15. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных в любом из пп.1-10, для лечения заболевания или состояния, при котором показан модулятор NaV1.8 канала.
16. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных в любом из пп.1-10, для лечения боли.
17. Способ лечения заболевания или состояния, при котором показан модулятор NaV1.8 канала, у млекопитающего, в том числе у человека, включающий введение млекопитающему, которому необходимо такое лечение, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, сольвата, определенного в любом из пп.1-10.
18. Способ по п.17, где заболевание или состояние представляет собой боль.
19. Способ лечения заболевания или состояния, при котором показан модулятор NaV1.8 канала, у млекопитающего, в том числе у человека, включающий введение млекопитающему, которому необходимо такое лечение, композиции по п.11.
20. Способ по п.19, где заболевание или состояние представляет собой боль.
21. Комбинация соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных в любом из пп.1-10, и другого фармакологически активного средства.
Текст
Дата публикации и выдачи патента Номер заявки 2-ПИРИДИНКАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ Настоящее изобретение относится к соединениям формулы (I) Багал Шаранджеет Каур, Гибсон Карл Ричард, Кемп Марк Ян, Пуансар Седрик, Штаммен Бланда Луция,Дэнтон Стефен Мартин, Глоссоп Мелани Сьюзан (GB) и их фармацевтически приемлемым солям и сольватам, к способам их получения, к промежуточным соединениям, используемым при их получении, и к композициям, содержащим такие соединения, и к применениям таких соединений для лечения боли. 015952 Настоящее изобретение относится к пиридиновым производным. Более конкретно, настоящее изобретение относится к гетероарилзамещенным N-[6-амино-5-арилпиридин-2-ил]карбоксамидным производным и к способам получения таких производных, промежуточным соединениям, используемым для их получения, композициям, содержащим такие производные, и к их применению. Пиридиновые производные по настоящему изобретению являются модуляторами натриевых каналов и имеют различные терапевтические применения, в частности, при лечении боли. Более конкретно,пиридиновые производные по настоящему изобретению являются модуляторами Nav1.8. Предпочтительные пиридиновые производные по настоящему изобретению демонстрируют сродство в отношенииNav1.8 канала, которое является более высоким, чем их сродство в отношении Nav1.5 канала и тетродотоксин-чувствительных натриевых каналов (TTX-S).Nav1.8 канал представляет собой потенциалзависимый натриевый канал, который экспрессируется в ноцицепторах, сенсорных нейронах, ответственных за передачу болевых стимулов. Канал крысы и канал человека были клонированы в 1996 и 1998 г., соответственно (Nature 1996; 379: 257-262; Pain 1998 (Nov); 78 (2): 107-114). Navi.s канал ранее был известен как SNS (сенсорный нейрон-специфический) и PN3 (периферический нерв типа 3). Nav1.8 канал является атипичным, поскольку он демонстрирует резистентность к блокирующим эффектам токсина иглобрюхих рыб - тетродотоксина и, как считают, лежит в основе медленных потенциалзависимых и тетродотоксинрезистентных (TTX-R) натриевых токов, зарегистрированных из дорсальных корешковых ганглиевых нейронов. Наиболее близкой Nav1.8 каналу молекулой является Nav1.5 канал, представляющий собой сердечный натриевый канал, с которым он имеет гомологию приблизительно 60%. Nav1.8 канал экспрессируется в наибольшей степени в малых клетках дорсальных корешковых ганглиев (DRG). Считается, что это C- и A-дельта клетки, которые являются предполагаемыми полимодальными ноцицепторами, или болевыми рецепторами. В нормальных условиях Nav1.8 канал не экспрессируется нигде, за исключением субпопуляций DRG нейронов. Считается, чтоNav1.8 каналы вносят свой вклад в процесс сенсибилизации DRG, а также в гипервозбудимость в результате нервного повреждения. Ингибирующая модуляция Nav1.8 каналов направлена на снижение возбудимости ноцицепторов, препятствуя их участию в процессе возбуждения. Исследования показали, что "нокаут" Nav1.8 приводит к фенотипу притуплнной боли, преимущественно к воспалительным стимулам (A.N. Akopian et al., Nat. Neurosci. 1999; 2; 541-548), и что "нокдаун"Nav1.8 уменьшает болевые реакции, в данном случае невропатическую боль (J. Lai et al., Pain, 2002(Jan); 95(1-2): 143-152). Coward et al. and Yiangou et al., показали, что Nav1.8 экспрессируется при состояниях боли (Pain. 2000(March); 85(1-2): 41-50 и FEBS Lett. 2000(Feb 11); 467(2-3): 249-252). Также было показано, что Nav1.8 канал экспрессируется в структурах, относящихся к спинной и зубной пульпе, и есть свидетельства его роли в каузалгии, воспалениях кишечника и рассеянном склерозеProc. Natl. Acad. Sci. USA 2000: 97: 11598-11602). Известны некоторые модуляторы натриевых каналов для использования в качестве противосудорожных средств или антидепрессантов, такие как карбамазепин, амитриптилин, ламотригин и рилузол,которые все нацелены на тетрадотоксинчувствительные (TTX-S) натриевые каналы головного мозга. Недостатком таких TTX-S средств являются дозоограничивающие побочные эффекты, включающие головокружение, атаксию и сонливость, преимущественно в результате действия на TTX-S каналы в головном мозге. В WO-A-2006/011050 обсуждаются 6-амино-2-аминокарбонил-5-фенилпиридиновые производные. Целью настоящего изобретения является обеспечение новых модуляторов Nav1.8 каналов, которые являются хорошими лекарственными средствами-кандидатами. Предпочтительные соединения должны сильно связываться с Nav1.8 каналами, в то же время демонстрируя низкое сродство в отношении других натриевых каналов, в частности Nav1.8 и TTX-S каналов, и должны демонстрировать функциональную активность как модуляторы Nav1.8 каналов. Они должны хорошо абсорбироваться из желудочнокишечного тракта, быть метаболически стабильными и иметь выгодные фармакокинетические свойства. Они должны быть нетоксичными и иметь мало побочных эффектов. Кроме того, идеальное средствокандидат должно существовать в физической форме, которая является стабильной, негигроскопичной и легко формулируемой в композицию. Предпочтительные пиридиновые производные по настоящему изобретению являются селективными в отношении Nav1.8 каналов сравнительно с Nav1.5 и тетрадотоксинчувствительными (TTX-S) натриевыми каналами, что дает улучшение профиля побочных эффектов. Поэтому пиридиновые производные по настоящему изобретению являются потенциально полезными для лечения широкого ряда расстройств, в частности боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, включая боль после хирургической операции, и боли смешанного типа, затрагивающей внутренние органы, желудочнокишечный тракт, краниальные структуры, скелетно-мышечную систему, позвоночник, мочеполовую систему, сердечно-сосудистую систему и ЦНС, включая раковую боль, боль в спине и боль в лицевой части и области рта. Другие состояния, которые можно лечить пиридиновыми производными по настоящему изобрете-1 015952 нию, включают рассеянный склероз, нейродегенеративные расстройства, синдром раздраженной толстой кишки, остеоартрит, ревматоидный артрит, невропатологические расстройства, функциональные кишечные расстройства, воспалительные заболевания кишечника, боль, связанную с дисменореей, боль в области таза, цистит, панкреатит, мигрень, гистаминовую головную боль и головную боль при повышенном давлении, диабетическую невропатию, периферическую невропатическую боль, ишиалгию, фибромиалгию, каузалгию и состояния дисфункции нижних мочевых путей. Настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где(i) фенила, необязательно замещенного одним или несколькими заместителями, каждый из которых независимо выбран из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-C4)алкила, галоген(C1C4)алкокси, (C1-C4)алкокси(C1-C4)алкила, (C1-C4)алкиламино и ди-C1-C4)алкил)амино; и(ii) 5-членной гетероарильной группы, включающей либо (а) от 1 до 4 атомов азота, либо (b) один атом кислорода или один атом серы и 1 или 2 атома азота, и при этом указанная гетероарильная группа,необязательно, является замещенной одним заместителем, выбранным из (C1-C4)алкила, (C1-C4)алкокси,галоген(C1-C4)алкила, галоген(C1-C4)алкокси, (C1-C4)алкокси(C1-С 4)алкила, (C1-C4)алкиламино и ди-C1C4)алкил)амино; при условии, что R1 не является имидазолилом, оксазолилом или 1,2,4-триазолилом; гдеуказывает точку присоединения к пиридиновому кольцу; каждый R2 независимо представляет собой (C1-C4)алкил, OR4, (C1-C4)алкокси(C1-C4)алкил,галоген(C1-C4)алкил, циано или галоген;n имеет значение от 0 до 4;m имеет значение от 0 до 7; р имеет значение от 0 до 3;Het1 представляет собой насыщенное 5- или 6-членное гетероциклическое кольцо, включающее один атом кислорода. В представленных выше определениях галоген означает фтор, хлор, бром или иод. Алкильные и алкоксигруппы, содержащие указанное количество атомов углерода, могут быть неразветвленными или разветвленными. Примеры алкила включают метил, этил, пропил (н-пропил и изопропил) и бутил (нбутил, изобутил, втор-бутил и трет-бутил). Примеры алкокси включают метокси, этокси, пропокси (нпропокси и изопропокси) и бутокси (н-бутокси, изобутокси, втор-бутокси и трет-бутокси). Галогеналкил и галогеналкокси относится к группе алкила или алкокси, содержащей указанное количество атомов углерода, которая является замещенной одним или несколькими атомами галогена. Примеры галогеналкила включают трифторметил и 2,2,2-трифторэтил. Примеры галогеналкокси включают трифторметокси и 2,2,2-трифторэтокси. В предпочтительном аспекте (A) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar представляет собой и n, R1, R2 и R3 имеют значение, определенное выше. Предпочтительно n имеет значение 0, 1 или 2,и p имеет значение 0, 1 или 2. В предпочтительном аспекте (В) настоящее изобретение обеспечивает пиридиновое производное-2 015952 формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar, n, m, p, R1 и R3 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительных аспектах, входящих в (A); и каждый R2 независимо представляет собой (C1-C4)алкил, OR4, (C1-C4)алкокси(C1-C4)алкил,галоген(C1-C4)алкил и галоген; и где R4 представляет собой водород, (C1-C4)алкил, галоген(C1-C4)алкил,(C1-C4)алкокси(C1-C4)алкил, (С 3-C6)циклоалкил или (C3-C6)циклоалкил(C1-C4)алкил; более предпочтительно каждый R2 независимо представляет собой метил, этил, пропил, гидрокси, метокси, этокси, пропокси, бутокси, циклопропилокси, метоксиметил, метоксиэтокси, метоксипропокси, циклопропилметокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси, 2,2,2 трифторэтокси, хлор или фтор; наиболее предпочтительно каждый R2 независимо представляет собой гидрокси, метокси, этокси, пропокси, циклопропилокси, метоксиметил, метоксиэтокси, метоксипропокси, циклопропилметокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, хлор или фтор. В альтернативном предпочтительном аспекте (B1) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar, n, m, р, R1 и R3 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительных аспектах, входящих в (A); и каждый R2 независимо представляет собой (C1-C4)алкил, (C1-C4)алкокси,галоген(C1-C4)алкил, галоген(C1-C4)алкокси, циано или галоген; более предпочтительно каждый R2 независимо представляет собой (C1-C4)алкил, (C1-C4)алкокси, галоген(C1-C4)алкил, галоген (C1-C4)алкокси,или галоген; более предпочтительно каждый R независимо представляет собой метил, этил, пропил, метокси, этокси, пропокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, хлор или фтор. В предпочтительном аспекте (C) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где, когда Ar представляет собойn, R1 и R2 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительных аспектах, входящих в (A), (B) или (B1), и R3 не является водородом; более предпочтительно R3 представляет собой галоген, галоген(C1-C4)алкил, галоген (C1-C4)алкокси, (C1-C4)алкокси, (C1-C4)алкил,гидрокси, (C1-C4)алкокси(C1-C4)алкил, (C3-C6)циклоалкил(C1-C4)алкокси, (C3-C6)циклоалкилокси или (C1C4)алкокси(C1-C4)алкокси; более предпочтительно R3 представляет собой метил, этил, пропил, гидрокси,метокси, этокси, пропокси, бутокси, циклопропилокси, метоксиметил, метоксиэтокси, метоксипропокси,циклопропилметокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси,2,2,2-трифторэтокси, хлор или фтор; наиболее предпочтительно R3 представляет собой этокси, пропокси,циклопропилокси, метоксиэтокси, циклопропилметокси, дифторметил, трифторметил, 2,2,2 трифторэтил, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, хлор или фтор. В альтернативном предпочтительном аспекте (C1) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где, когда Ar представляет собойn, R1 и R2 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительных аспектах, входящих в (A), (B) или (B1), и R3 представляет собой галоген, галоген(C1-C4)алкил,галоген (C1-C4)алкокси, (C1-C4)алкокси или (C1-C4)алкил; более предпочтительно - хлор, фтор, метил,этил, пропил, метокси, этокси, пропокси, бутокси, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси или 2,2,2-трифторэтокси; более предпочтительно - хлор, фтор, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторметокси, трифторметокси или 2,2,2-трифторэтокси; наиболее предпочтительно - хлор, трифторметил или трифторметокси. В альтернативном предпочтительном аспекте (C2) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar представляет собойC4)алкил, где R4 представляет собой водород, (C1-C4)алкокси (C1-C4)алкил, (С 3-С 6)циклоалкил, (C3C6)циклоалкил(C1-C4)алкил, Het1- или Het1 (C1-C4)алкил-; более предпочтительно R3 представляет собой гидрокси, (C1-C4)алкокси(C1-C4)алкил, (C3-C6)циклоалкил(C1-C4)алкокси, (C3-C6)циклоалкилокси или (C1C4)алкокси (C1-C4)алкокси; более предпочтительно R3 представляет собой (C3-C6)циклоалкил(C1C4)алкокси или (С 3-С 6)циклоалкилокси [например, циклопропилокси или циклопропилметокси]; более предпочтительно R3 представляет собой (C3-C6)циклоалкилокси; еще более предпочтительно R3 представляет собой циклопропилокси. В альтернативном предпочтительном аспекте (C3) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar представляет собойn, R1 и R2 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительных аспектах, входящих в (А), (В) или (В 1), и R3 представляет собой галоген, более предпочтительно - хлор. В предпочтительном аспекте (D) настоящее изобретение обеспечивает пиридиновое производное формулы (I) или его фармацевтически приемлемую соль или сольват, где Ar, n, m, р, R1, R2 и R3 имеют значения, определенные выше, либо в самом широком аспекте, либо в предпочтительном аспекте, входящем в (А), (В), (В 1), (С), (C1), (C2) или (С 3); и конкретные примеры R1 включают фенил, пирролил,пиразолил, изоксазолил, тиазолил, изотиазолил, 1,2,3-триазолил, оксадиазолил, тиадиазолил и тетразолил(i) фенила, необязательно замещенного одним или несколькими заместителями, каждый из которых независимо выбран из галогена, циано, (C1-C4)алкила, (C1-C4)алкокси, галоген(C1-С 4)алкила или (С 1 С 4)алкокси(C1-C4)алкила; и гдеуказывает точку присоединения к карбонильной группе, и где каждый R5 независимо представляет собой (C1-C4)алкил, галоген(C1-C4)алкил или (C1-C4)алкокси (C1-C4)алкил; более предпочтительно R5 представляет собой метил, этил, пропил, трифторметил или метоксиметил; наиболее предпочтительно R5 представляет собой метил или этил. Конкретные предпочтительные пиридиновые производные в соответствии с настоящим изобретением представляют собой соединения, представленные в разделе "Примеры" ниже, и фармацевтически приемлемые соли и сольваты таких соединений. Соединения формулы (I), являющиеся модуляторами Nav1.8 каналов, являются потенциально полезными для лечения ряда расстройств. Лечение боли, в частности хронической, воспалительной, невропатической, ноцицептивной и висцеральной боли, является предпочтительным применением. Физиологическая боль является важным защитным механизмом, предназначенным для предупреждения об опасности, исходящей от потенциально вредных стимулов из внешнего окружения. Система работает через специфический ряд первичных сенсорных нейронов и активируется посредством вредных стимулов через периферические механизмы передачи (см. обзор Millan, 1999, Prog. Neurobiol., 57, 1-164). Эти сенсорные волокна известны как ноцицепторы и они представляют собой аксоны характерно малого диаметра с медленными скоростями проводимости. Ноцицепторы кодируют силу, длительность и качество вредного стимула и, благодаря их топографически организованной проекции в спинной мозг, локализацию стимула. Ноцицепторы присутствуют на ноцицептивных нервных волокнах, которые подразделяются на два основных типа, А-дельта волокна (миелинизированные) и С волокна (немиелинизированные). Активность, генерируемая входным сигналом ноцицептора, передается после комплексного процессинга, в спинной рог, либо непосредственно, либо через переключающие ядра ствола головного моз-4 015952 га, в вентробазальный таламус и затем в кору головного мозга, где происходит генерация ощущения боли. Боль, в основном, можно классифицировать как острую или хроническую. Острая боль начинается неожиданно и продолжается недолго (обычно двенадцать недель или меньше). Ее обычно связывают с конкретной причиной, такой как конкретное повреждение, и она часто является очень острой и сильной. Это тип боли, которая может возникать после специфических повреждений в результате хирургической операции, лечения зубов, нагрузки или растяжения. Острая боль, как правило, не приводит к какомулибо персистентному физиологическому ответу. В отличие от этого хроническая боль представляет собой продолжительную боль, типично длящуюся в течение более трех месяцев и приводящую к существенным физиологическим и эмоциональным проблемам. Типичными примерами хронической боли являются невропатическая боль (например, болезненная диабетическая невропатия, невралгия после опоясывающего лишая), запястный туннельный синдром, боль в спине, головная боль, раковая боль, артритная боль и хроническая послеоперационная боль. Когда происходит существенное повреждение ткани организма, в результате заболевания или травмы, характеристики ноцицепторной активации изменяются и происходит сенсибилизация на периферии,локально вокруг повреждения и центрально, где заканчиваются ноцицепторы. Эти эффекты приводят к усиленному ощущению боли. При острой боли эти механизмы могут быть полезными для промотирования защитных реакций, которые могут лучше способствовать процессам восстановления. Обычно ожидается, что чувствительность возвратится к норме как только произойдет заживление раны. Однако при многих состояниях хронической боли гиперчевствительность намного продолжительней, чем процесс заживления, и это часто является результатом поражения нервной системы. Это поражение часто приводит к аномалиям в сенсорных нервных волокнах, связанных с дизадаптацией и аберрантной активностью(WoolfSalter, 2000, Science, 288, 1765-1768). Клиническая боль присутствует, когда характерными симптомами у пациента являются дискомфорт и аномальная чувствительность. Пациенты обычно являются совершено гетерогенными, и у них могут быть различные болевые симптомы. Такие симптомы включают: 1) спонтанную боль, которая может быть ноющей, жгучей или колющей; 2) гиперболизированные болевые ответы на вредные стимулы(гипералгезия) и 3) боль, вызываемую обычно безвредными стимулами (аллодиния - Meyer et al., 1994,Textbook of Pain, 13-44). Хотя пациенты, страдающие от различных форм острой и хронической боли,могут иметь одинаковые симптомы, лежащие в основе этого механизмы могут быть разными, и поэтому могут потребоваться разные стратегии лечения. Поэтому боль можно также подразделить на ряд различных подтипов в соответствии с различной патофизиологией, включающих ноцицептивную, воспалительную и невропатическую боль. Ноцицептивная боль индуцируется повреждением ткани или сильными стимулами, которые потенциально могут вызвать повреждение. Болевые афференты активируются посредством трансдукции стимулов ноцицепторами на участке поражения и активируют нейроны в спинном мозге на уровне их терминации. Затем это передается вверх по спинномозговому нервному пути в головной мозг, где происходит восприятие боли (Meyer et al., 1994, Textbook of Pain, 13-44). Активация ноцицепторов активирует два типа афферентных нервных волокон. Миелинизированные А-дельта волокна осуществляют передачу быстро и являются ответственными за острые и резкие болевые ощущения, тогда как немиелинизированные С волокна осуществляют передачу с более медленной скоростью и сообщают тупую или ноющую боль. Ноцицептивная боль от умеренной до сильной и острой является явным признаком боли в результате травмы центральной нервной системы, напряжения/растяжения, ожогов, инфаркта миокарда и острого панкреатита, послеоперационной боли (боль после любых хирургических процедур), посттравматической боли, почечных колик, раковой боли и боли в спине. Раковая боль может представлять собой хроническую боль, такую как связанная с опухолью боль (например, боль в кости, головная боль, боль в лицевой части или висцеральная боль), или боль, связанную с противораковой терапией (например, синдром после химиотерапии, хронический послеоперационный болевой синдром или синдром после лучевой терапии). Раковая боль также может возникать в ответ на химиотерапию, иммунотерапию, гормональную терапию или лучевую терапию. Боль в спине может быть в результате грыжи или разрушения межпозвоночных дисков или аномалий суставных поверхностей поясничных суставов, крестцовых суставов, околопозвоночных мышц или заднепродольной связки. Боль в спине может пройти естественным образом, но у некоторых пациентов,когда она длится более 12 недель, она становится хроническим состоянием, которое может быть особенно изнуряющим. Невропатическую боль обычно определяют как боль, инициированную или вызванную первичным повреждением или дисфункцией в нервной системе. Нервное повреждение может быть вызвано травмой и заболеванием, и, таким образом, термин невропатическая боль охватывает многие расстройства с различной этиологией. Эти расстройства включают, но не ограничиваются этим, периферическую невропатию, диабетическую невропатию, невралгию после опоясывающего лишая, невралгию тройничного нерва, боль в спине, невропатию при раке, ВИЧ невропатию, фантомные боли в конечностях, запястный туннельный синдром, центральную боль после удара и боль, связанную с хроническим алкоголизмом,-5 015952 гипотиреозом, уремией, рассеянным склерозом, повреждением спинного мозга, болезнью Паркинсона,эпилепсией и дефицитом витаминов. Невропатическая боль является патологической, поскольку она не имеет никакой защитной роли. Она часто присутствует долго после устранения изначальной причины,продолжаясь обычно в течение нескольких лет, существенно снижая качество жизни пациента (Woolfand Mannion, 1999, Lancet, 353, 1959-1964). Симптомы невропатической боли трудно лечить, поскольку они часто являются гетерогенными даже у пациентов с одним и тем же заболеванием (WoolfDecosterd,1999, Pain Supp., 6, S141-S147; Woolf and Mannion, 1999, Lancet, 353, 1959-1964). Они включают спонтанную боль, которая может быть продолжительной, и пароксисмальную или аномально возникающую боль, такую как гипералгезия (повышенная чувствительность к вредным стимулам) и аллодиния (чувствительность к обычно безвредным стимулам). Воспалительной процесс представляют собой сложную серию биохимических и клеточных событий, активирующихся в ответ на повреждение ткани или присутствие чужеродных веществ, которые приводят к опуханию и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Артритная боль является наиболее распространенной воспалительной болью. Ревматоидное заболевание представляют собой одно из самых распространенных хронических воспалительных состояний в развитых странах, и ревматоидный артрит является обычной причиной нарушения трудоспособности. Точная этиология ревматоидного артрита неизвестна, но существующие гипотезы предполагают, что важное значение могут иметь как генетические, так и микробиологические факторы (GrennanJayson, 1994, Textbook of Pain, 397-407). Было установлено, что почти 16 млн американцев имеют симптоматический остеоартрит (ОА) или дегенеративное заболевание суставов, большинство из них старше 60 лет, и это число, как ожидают, увеличится до 40 млн с увеличением возраста населения, что делает эту проблему здоровья населения чрезвычайно важной (HougeMersfelder, 2002, Ann Pharmacother., 36, 679-686; McCarthy et al., 1994, Textbookof Pain, 387-395). Большинство пациентов с остеоартритом нуждаются в медицинской помощи из-за связанной с этим заболеванием боли. Артрит оказывает существенное влияние на психосоциальную и физическую функцию и, как известно, является основной причиной нарушения трудоспособности в последующей жизни. Анкилозирующий спондилоартрит также представляет собой ревматическое заболевание, которое вызывает артрит суставов позвоночника и крестцовых суставов. Он имеет разные формы от перемежающихся эпизодов боли в спине, которые имеют место на протяжении жизни, до тяжелого хронического заболевания, которое поражает позвоночник, периферические суставы и другие органы. Другим типом воспалительной боли является висцеральная боль, которая включает боль, связанную с воспалительным заболеванием кишечника (IBD). Висцеральная боль представляют собой боль, связанную с внутренними органами, которая охватывает органы брюшной полости. Эти органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанную с внутренними органами,можно подразделить на связанную с пищеварительной системой висцеральную боль и не связанную с пищеварительной системой висцеральную боль. Обычно встречающиеся желудочно-кишечные (GI) расстройства, которые вызывают боль, включают функциональное кишечное расстройство (FBD) и воспалительное заболевание кишечника (IBD). Эти GI расстройства включают широкий ряд различных болезненных состояний, которые в настоящее время можно лишь в умеренной степени контролировать, включающих, в том, что касается FBD, гастро-эзофагеальный рефлюкс, диспепсию, синдром раздраженной толстой кишки (IBS) и функциональный абдоминальный болевой синдром (FAPS), и в том, что касаетсяIBD, болезнь Крона, илеит и язвенный колит, которые все регулярно вызывают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, цистит и панкреатит, а также боль в области таза. Следует отметить, что некоторые типы боли имеют множественные этиологии и, таким образом,могут классифицироваться в более чем одной области, например боль в спине и раковая боль имеют как ноцицептивные, так и невропатические компоненты. Другие типы боли включают боль в результате мышечно-скелетных расстройств, включающую миалгию, фибромиалгию, спондилоартрит, серо-отрицательные (неревматоидные) артропатии, неартикулярный ревматизм, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит; сердечную и сосудистую боль, включающую боль, вызванную стенокардией, инфарктом миокарда,митральным стенозом, перикрадитом, болезнью Рейно, склеродермой и ишемией скелетных мышц; головную боль, такую как мигрень (включающую мигрень с аурой и мигрень без ауры), гистаминовую головную боль,головную боль при повышенном давлении и головную боль смешанного типа, а также головную боль, связанную с сосудистыми расстройствами; и боли в лицевой части и области рта, включающие зубную боль, ушную боль, синдром жжения во рту и височно-нижнечелюстную миофасциальную боль. Также ожидается, что пиридиновые производные формулы (I) будут полезными для лечения рассеянного склероза. Настоящее изобретение также относится к терапевтическому применению пиридиновых производ-6 015952 ных формулы (I) в качестве средств для лечения или облегчения симптомов нейродегенеративных расстройств. Такие нейродегенеративные расстройства включают, например, болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона и амиотрофический боковой склероз. Настоящее изобретение также охватывает лечение нейродегенеративных расстройств, называемых острым поражением головного мозга. Эти расстройства включают, но не ограничиваются этим: удар, травму головы и асфиксию. Удар относится к церебральному сосудистому заболеванию, и его также могут называть инсультом (CVA), и он включает острый тромбоэмболический удар. Удар включает как очаговую, так и обширную ишемию. Также, включены транзиторные церебральные ишемические приступы и другие церебральные сосудистые проблемы, сопровождающиеся церебральной ишемией. Эти сосудистые расстройства могут возникать у пациента, подвергаемого каротидной эндартерэктомии, в частности, или другим церебрососудистым или сосудистым хирургическим процедурам, в целом, или диагностическим сосудистым процедурам, включающим церебральную ангиографию и подобные. Другие случаи представляют собой травму головы, травму спинного мозга или поражение в результате общей кислородной недостаточности, гипоксии, гипогликемии, гипотензии, а также подобных поражений, возникающих в ходе процедур в результате эмбола, гиперфузии и гипоксии. Настоящее изобретение будет полезным в ряде случаев, например в ходе операции шунтирования сосудов сердца, в случаях интракраниального кровоизлияния, при перинатальной асфиксии, при остановке сердца и эпилептических состояниях. Опытный врач сможет определить соответствующую ситуацию, в которой субъекты подвержены или имеют риск, например, получить удар, а также страдающих от удара для введения способами по настоящему изобретению. Соединения по настоящему изобретению являются полезными для лечения состояний дисфункции нижних мочевых путей, включающих, но не ограничивающихся исключительно этим, гиперактивный мочевой пузырь, повышенную частоту мочеиспускания в дневное время, ночную полиурию, частые позывы на мочеиспускание, недержание мочи (любое состояние, при котором имеет место непроизвольное вытекание мочи), включающее недержание мочи при напряжении, недержание мочи при позывах на мочеиспускание и недержание мочи смешанного типа, гиперактивный мочевой пузырь и связанное с этим недержание мочи, энурез, ночной энурез, постоянное недержание мочи и ситуационное недержание мочи, такое как недержание мочи по время полового акта. Активность таких соединений на функцию нижних мочевых путей и, таким образом, их потенциальная полезность для лечения состояний, включающих дисфункцию нижних мочевых путей, можно исследовать и оценить с использованием ряда стандартныхcanine urethral pressure profilometry and abdominal leak point pressure models. J Urol. 2001, 166:1555-9). Настоящее изобретение также относится к терапевтическому применению пиридиновых производных формулы (I) в качестве средств для лечения ревматоидного артрита. Ревматоидный артрит (RA) считается хроническим аутоиммунным и воспалительным заболеванием, при котором происходит воспаление суставов, которые в результате опухают, становятся болезненными, и происходит разрушение хряща,кости и связок суставов. Результатом RA являются деформация, нестабильность и тугоподвижность сустава и образование рубцов внутри сустава. Суставы разрушаются с очень разной скоростью. Многие факторы, включающие генетическую предрасположенность, могут влиять на характер заболевания. У людей с ревматоидным артритом заболевание может протекать в мягкой форме с временными вспышками и с долгими периодами ремиссии без заболевания, или может быть стабильно прогрессирующее заболевание, которое может быть медленным или быстрым. Ревматоидный артрит может возникать внезапно,при этом многие суставы воспаляются одновременно. Более часто он начинается незаметно, постепенно поражая разные суставы. Обычно воспаление является симметричным, с поражением суставов как в правой, так и в левой части тела. Типично, сначала воспаляются небольшие суставы пальцев рук, пальцев стоп, рук, ног, запястьев, локтей и голеностопные суставы, затем коленные и бедренные суставы. Соединения по настоящему изобретению будут полезными для лечения артрита, включающего ревматоидный артрит, остеоартрит, реактивный артрит (синдром Рейтера), инфекционный артрит, псориатический артрит, полиартрит, юношеский артрит, юношеский ревматоидный артрит, юношеский реактивный артрит и юношеский псориатический артрит. Суставная боль, также называемая артралгией,может поражать один или несколько суставов. Суставная боль может быть вызвана различными типами повреждений или состояний, включающими ревматоидный артрит, остеоартрит и бурсит (т.е. воспаление синовиальной сумки). Другие состояния, которые можно лечить пиридиновыми производными по настоящему изобретению, включают анкилозирующий спондилоартрит; ревматизм; гонококковый артрит; серповидноклеточную анемию; инфекцию суставов; болезнь Лайма; псориаз; ревматическую полимиалгию; гемофилию; рак; гормональное расстройство; расстройство нервной системы; сифилис; недифференцированную спондилоартропатию (USpA); подагру; болезнь Крона; рассеянный склероз; нейродегенеративные расстройства; синдром раздраженной толстой кишки; невропатологические расстройства; функциональ-7 015952 ные кишечные расстройства; воспалительное заболевание кишечника; боль, связанную с дисменореей; боль в области таза; цистит; панкреатит; мигрень; гистаминовую головную боль и головную боль при повышенном давлении; диабетическую невропатию; периферическую невропатическую боль; ишиалгию; фибромиалгию; каузалгию; состояния дисфункции нижних мочевых путей; мистению gravis; синдром Гильена-Барре; аутоиммунный увеит; аутоиммунную гемолитическую анемию; пернициозную анемию; аутоиммунную тромбоцитопению; темпоральный артериит; антифосфолипидный синдром; васкулитиды,такие как гранулематоз Вегенера; болезнь Бехчета; псориаз; герпетиформный дерматит; обыкновенную пузырчатку; витилиго; первичный билиарный цирроз; аутоиммунный гепатит; сахарный диабет типа 1 или иммунно-опосредованный сахарный диабет; аллергический ринит; синусит; риносинусит; хронический отит; рецидивирующий средний отит; аллергические реакции на лекарственные средства; аллергические реакции на укусы насекомых; аллергические реакции на латекс; конъюнктивит; крапивницу; анафилаксические реакции; анафилактоидные реакции; атопический дерматит; астму; аллергию на пищевые продукты; болезнь Грейва; тиреоидит Хашимото; аутоиммунный оофорит и орхит; аутоиммунное расстройство надпочечников; системную красную волчанку; склеродерму; полимиозит; дерматомиозит; анкилозирующий спондилоартрит; синдром Шегрена и язвенный колит. Пиридиновые производные формулы (I) также являются полезными для лечения астмы любого типа, этиологии или патогенеза, в частности астмы, которая является членом, выбранным из группы, включающей атопическую астму, неатопическую астму, аллергическую астму, атопическую бронхиальнуюIgE-опосредованную астму, бронхиальную астму, нервную астму, истинную астму, наследственную бронхиальную астму, вызванную патофизиологическими отклонениями, приобретенную бронхиальную астму, вызванную экологическими факторами, нервную астму неизвестного или неясного происхождения, неатопическую астму, вызванную бронхитом астму, эмфизематозную астму, астму, вызванную физическими нагрузками, астму, вызванную аллергенами, астму, вызванную холодным воздухом, профессиональную астму, инфекционную астму, вызванную бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергическую астму, начальную стадию астмы, синдром хриплого дыхания у младенцев и бронхиолит и обструктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивного или воспалительного заболевания дыхательных путей, которое является членом, выбранным из группы, включающей хроническую эозинофильную пневмонию, хроническое обструктивное заболевание легких (COPD), COPD, которое включает хронический бронхит, эмфизему легких или одышку, связанную или не связанную с COPD, COPD, которое характеризуется необратимой, прогрессирующей обструкцией дыхательных путей, респираторный дистресс-синдром взрослых (ARDS), обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии и заболевание дыхательных путей, которое связано с легочной гипертензией. Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли и соли оснований. Подходящие кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли. Примеры включают такие соли, как ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдисилат, эсилат, формиат, фумарат, глюцептат,глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеинат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат,никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат. Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина,лизина, магния, меглумина, оламин, калия, натрия, трометамина и цинка. Также могут быть получены гемисоли кислот и оснований, например гемисульфат и гемикальциевые соли. Обзор подходящих солей см. в Handbook of Pharmaceutical Salts: Properties, Selection, and Use byStahl and Wermuth (Wiley-VCH, 2002). Фармацевтически приемлемые соли соединений формулы (I) можно получить одним или несколькими из трех способов:(i) путем взаимодействия соединения формулы (I) с желаемой кислотой или основанием;(ii) путем удаления кислотно- или основно-лабильной защитной группы у подходящего предшественника соединения формулы (I) или(iii) путем преобразования одной соли соединения формулы (I) в другую путем взаимодействия с подходящей кислотой или основанием или с использованием подходящей ионообменной колонки. Все эти три реакции типично осуществляют в растворе. Образовавшаяся соль может осаждаться, и ее можно собирать фильтрованием или выделять путем выпаривания растворителя. Степень ионизации в полученной соли может варьировать от полностью ионизированной до почти неионизированной. Соединения по настоящему изобретению могут существовать в различных формах твердого состояния, от полностью аморфного до полностью кристаллического. Термин аморфный относится к со-8 015952 стоянию, в котором вещество не имеет дальнего порядка структуры на молекулярном уровне и в зависимости от температуры может демонстрировать физические свойства твердого вещества или жидкости. Типично, такие вещества не имеют характерных рентгеновских дифрактограмм, и при том, что они демонстрируют свойства твердого вещества, их более формально описывают как жидкость. При нагревании происходит изменение свойств от твердого до жидкого вещества, что характеризуется изменением состояния, типично второго порядка (стеклование). Термин кристаллический относится к твердой фазе, в которой вещество имеет регулярно упорядоченную внутреннюю структуру на молекулярном уровне и дает характерную рентгеновскую дифрактограмму с четкими пиками. Такие вещества при их достаточном нагреве также будут демонстрировать свойства жидкости, но изменение от твердого состояния до жидкого характеризуется изменением фазы,типично первого порядка (точка плавления). Соединения по настоящему изобретению также могут существовать в несольватированной и в сольватированной формах. Термин сольват используется в настоящей заявке для описания молекулярного комплекса, включающего соединение по настоящему изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например этанола. Термин гидрат используют, когда указанный растворитель представляет собой воду. Принятая в настоящее время система классификации для органических гидратов представляет собой систему, которая определяет гидраты с изолированными участками, канальные или координированные с металлическим ионом гидраты - см. Polymorphism in Pharmaceutical Solids by K. R. Morris (Ed. H. G.Brittain, Marcel Dekker, 1995). Имеющие изолированные участки гидраты представляет собой такие, в которых молекулы воды изолированы от прямого контакта друг с другом, попадая между органическими молекулами. В канальных гидратах молекулы воды находятся в каналах кристаллической решетки, где они находятся в непосредственной близости с другими молекулами воды. В координированных с металлическим ионом гидратах молекулы воды связаны с металлическим ионом. Когда растворитель или вода являются плотно связанными, комплекс будет иметь четко определенную стехиометрию, независимо от влажности. Однако, когда растворитель или вода являются слабо связанными, как в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от состояний влажности и высыхания. В таких случаях, отсутствие стехиометрии будет нормой. Также в объем настоящего изобретения включены мультикомпонентные комплексы (отличные от солей и сольватов), где лекарственное средство и по меньшей мере один другой компонент присутствуют в стехиометрическом или нестехиометрическом количествах. Комплексы такого типа включают клатраты (комплексы включения лекарственное средство-хозяин) и ко-кристаллы. Последние типично определяют как кристаллические комплексы из нейтральных молекулярных составляющих, которые связаны вместе через нековалентные взаимодействия, но также могут представлять собой комплекс нейтральной молекулы с солью. Ко-кристаллы можно получить путем кристаллизации из расплава путем перекристаллизации из растворителей или путем физического измельчения всех компонентов вместе - см. ChemCommun, 17, 1889-1896, by O. Almarsson and M. J. Zaworotko (2004). Общий обзор мультикомпонентных комплексов см. в J Pharm Sci, 64 (8), 1269-1288, by Haleblian (August 1975). Соединения по настоящему изобретению также могут существовать в мезоморфном состоянии (мезофазное или жидкокристаллическое состояние), будучи подверженными соответствующим условиям. Мезоморфное состояние является промежуточным между действительным кристаллическим состоянием и действительным жидким состоянием (либо расплав, либо раствор). Мезоморфизм, возникающий в результате изменения температуры, описан как термотропный, а возникающий в результате добавления второго компонента, такого как вода или другой растворитель, описан как лиотропный. Соединения,которые способны образовывать лиотропные мезофазы, описаны как амфифильные, и они состоят из молекул, которые содержат ионную (такую как -COO-Na+, -COO-K+ или -SO3-Na+) или неионную (такую как -N-N+(СН 3)3) полярную головную группу. Более подробную информацию см. в Crystalls and the Polarizing Microscope by N. H. Hartshorne and A. Stuart, 4th Edition (Edward Arnold, 1970). Далее в настоящей заявке все ссылки на соединения формулы (I) включают ссылки на соли, сольваты, мультикомпонентные комплексы и жидкие кристаллы этих соединений, а также на сольваты, мультикомпонентные комплексы и жидкие кристаллы солей этих соединений. Соединения по настоящему изобретению включают соединения формулы (I), определенные в настоящей заявке, включая все их полиморфы и кристаллические формы, их пролекарства и изомеры(включая оптические, геометрические и таутомерные изомеры), определенные в настоящей заявке, и изотопно-меченные соединения формулы (I). В качестве одного аспекта настоящее изобретение обеспечивает соединение формулы (I), которое представляет собой,по существу,чистую кристаллическую формуN-6-амино-5-[2(трифторметокси)фенил]пиридин-2-ил-3-метилизоксазол-4-карбоксамида. В качестве еще одного аспекта настоящее изобретение обеспечивает соединение формулы (I), которое представляет собой, по существу, чистую кристаллическую форму N-6-амино-5-[2-9 015952(трифторметокси)фенил]пиридин-2-ил-3-метилизоксазол-4-карбоксамида, которая характеризуется порошковой рентгенограммой (PXRD), полученной путем облучения с использованием Cu K излучения(длина волны 1,5418 ), которая включает основные пики при 2-Тета 16,6, 16,8, 23,1, 24,1 и 27,0 +/- 0,1. Кристаллическая формаN-6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил-3-метилизоксазол-4-карбоксамида, кроме того, характеризуется дифференциальной сканирующей калориметрией(DSC), где она демонстрирует резкий эндотермический пик при 158 С 2 С. Кристаллическая формаN-6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил-3 метилизоксазол-4-карбоксамида, кроме того, характеризуется инфракрасным спектром с фурьепреобразованием (FT-IR), который включает полосы поглощения при 1453, 1167, 998 и 760 (+/-2) см-1. Кристаллическая формаN-6-амино-5-[2-(трифторметокси)фенил]пиридин-2-ил-3 метилизоксазол-4-карбоксамида, кроме того, характеризуется спектром комбинационного рассеяния (рамановским спектром) с Фурье-преобразованием (FT), который включает полосы поглощения при 1612,1328, 749 и 686 (+/-2) см-1. Выражение по существу чистый, как это используется в настоящей заявке, означает чистоту по меньшей мере 95 мас.%. Более предпочтительно по существу чистый означает чистоту по меньшей мере 98 мас.% и наиболее предпочтительно чистоту по меньшей мере 99 мас.%. Как это указано, так называемые пролекарства соединений формулы (I) также включены в объем настоящего изобретения. Таким образом, некоторые производные соединений формулы (I), которые сами могут иметь низкую, или вообще не иметь, фармакологическую активность, при их введении в организм или на его поверхность могут преобразовываться в соединения формулы (I), обладающие желаемой активностью, например, путем гидролитического расщепления. Такие производные указаны как пролекарства. Дополнительную информацию по применению пролекарств можно найти в Pro-drugs asCarriers in Drug Design, Pergamon Press, 1987 (Ed. E. B. Roche, American Pharmaceutical Association). Пролекарства в соответствии с настоящим изобретением, например, можно получить путем замещения подходящих функциональных групп, присутствующих в соединениях формулы (I), определенными группами, известными специалистам в данной области как прогруппы , как описано, например, вDesign of Prodrugs by H. Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств в соответствии с настоящим изобретением включают такие, где соединение формулы (I) содержит первичную или вторичную функциональную аминогруппу (-NH2 или-NHR, где RH), его амид, например соединение, где в случае, когда один или оба атома водорода функциональной аминогруппы соединения формулы (I) является/являются замещенными (C1-С 10)алканоилом. Дополнительные примеры групп заместителей в соответствии с приведенными выше примерами и примерами других типов пролекарств можно найти в указанных выше ссылочных документах. Более того, некоторые соединения формулы (I) сами могут действовать как пролекарства других соединений формулы (I). Также в объем настоящего изобретения включены метаболиты соединений формулы (I), т.е. соединения, образованные in vivo при введении лекарственного средства. Некоторые примеры метаболитов в соответствии с настоящим изобретением включают:(i) когда соединение формулы (I) содержит метильную группу, его гидроксиметильное производное(ii) когда соединение формулы (I) содержит алкоксигруппу, его гидроксипроизводное (-ORОН);(iii) когда соединение формулы (I) содержит фенильную группу, его фенольное производное (-Ph-PhOH); и соединения формулы (I), содержащие один или несколько асимметрических атомов углерода, могут существовать в виде двух или более стереоизомеров. Когда структурные изомеры являются взаимопреобразуемыми через низкий энергетический барьер, может иметь место таутомерная изомерия(таутомерия). Это может принимать форму так называемой таутомерии по валентности в соединениях,которые содержат ароматическую группу. Отсюда следует, что отдельное соединение может демонстрировать более чем один тип изомерии. В объем настоящего изобретения включены все стереоизомеры и таутомерные формы соединений формулы (I), включающие соединения, демонстрирующие более чем один тип изомерии, и смеси одной или нескольких таких форм. Также включены кислотно-аддитивные соли или соли оснований, где противоион является оптически активным, например d-лактат или 2-лизин или рацемические, например dl-тартрат или dl-аргинин. Традиционные методы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) можно подвергнуть взаимодействию с подходящим оптически активным соединением, например спиртом, или в случае, когда соединение- 10015952 формулы (I) содержит кислотную или основную группу, с основанием или кислотой, такими как 1 фенилэтиламин или винная кислота. Полученную диастереомерную смесь можно разделить при помощи хроматографии и/или фракционированной кристаллизации и преобразовать один или оба из диастереоизомеров в соответствующий чистый знантиомер(энантиомеры) способом, хорошо известным специалистам в данной области. Хиральные соединения по настоящему изобретению (и их хиральные предшественники) можно получить в энантиомерно-обогащенной форме с использованием хроматографии, типично ВЭЖХ, на асимметричной смоле, с подвижной фазой, состоящей из углеводорода, типично гептана или гексана, содержащей от 0 до 50% об. изопропанола, типично от 2 до 20%, и от 0 до 5 об.% алкиламина, типично 0,1% диэтиламина. Концентрирование элюата дает обогащенную смесь. Когда какой-либо рацемат кристаллизуется, возможны кристаллы двух разных типов. Первый тип представляет собой рацемическое соединение (действительный рацемат), указанный выше, где образуется одна гомогенная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Второй тип представляет собой рацемическую смесь или конгломерат, где образуются две формы кристалла в эквимолярных количествах, каждая из которых включает один энантиомер. Хотя обе кристаллические формы, присутствующие в рацемической смеси, имеют одинаковые физические свойства, они могут иметь разные физические свойства по сравнению с действительным рацематом. Рацемические смеси можно разделить традиционными способами, известными специалистам в данной области - см., например, Stereochemistry of Organic Compoundsby E. L. Eliel and S. H. Wilen(Wiley, 1994). Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения формулы I, где один или несколько атомов замещены атомами, имеющими такое же атомное число,но атомная масса или массовое число которых отличны от атомной массы или массового числа, которые преобладают в природе. Примеры изотопов, подходящих для включения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора,такие как 18F, иода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O,фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые изотопно-меченные соединения формулы (I), например, те, которые включают радиоактивный изотоп, являются полезными в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3 Н, и углерод-14, т.е. 14 С, являются особенно полезными для этих целей в свете простоты их включения и простых способов детекции. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать некоторые терапевтические преимущества как результат лучшей метаболической стабильности, например больший период полураспада in vivo или применение более низких доз, и, следовательно, это может быть предпочтительным в некоторых обстоятельствах. Замещение позитрон-испускающими изотопами, такими как C, 18F, 15O и 13N, может быть полезным в исследованиях методом позитрон-эмиссионной топографии (PET) для исследований связывания рецептора с субстратом. Изотопномеченные соединения формулы (I), как правило, можно получить традиционными способами, известными специалистам в данной области, или способами, аналогичными тем, которые описаны в следующих далее Примерах и Получениях, с использованием подходящего изотопномеченного вместо используемого ранее немеченного реагента. Фармацевтически приемлемые сольваты в соответствии с настоящим изобретением включают такие сольваты, где растворитель кристаллизации может быть изотопно замещен, например, D2O, d6 ацетон, d6-DMSO. Соединения формулы (I) должны быть исследованы на их биофармацевтические свойства, такие как растворимость и стабильность в растворе (при разных значениях pH), проницаемость и т.д., для выбора наиболее подходящей лекарственной формы и пути введения для лечения предполагаемого показания. Соединения по настоящему изобретению, предназначенные для фармацевтического применения,можно вводить в виде кристаллических или аморфных продуктов. Их можно получить, например, в виде твердых тампонов, порошков или пленок способами, такими как осаждение, кристаллизации, лиофилизация, распылительная сушка или сушка выпариванием. Для этих целей можно использовать микроволновую сушку или сушку с использованием волн высокой частоты. Их можно вводить отдельно или в сочетании с одним или несколькими другими соединениями по настоящему изобретению, или в сочетании с одним или несколькими другими лекарственными средствами (или в виде любой комбинации из вышеуказанного). Как правило, их можно вводить в виде композиции в ассоциации с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин эксципиент используется в настоящей заявке для описания любого ингредиента, отличного от соединения(соединений) по настоящему изобретению. Выбор эксципиента в большой степени зависит от таких факторов, как конкретный способ введения, эффект эксципиента на растворимость и стабильность и- 11015952 природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения должны быть очевидны специалистам в данной области. Такие композиции и способы для их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). Соединения по настоящему изобретению можно вводить перорально. Пероральное введение может включать проглатывание, чтобы соединение попадало в желудочно-кишечный тракт, и/или буккальное,лигвальное или сублигвальное введение, так, чтобы соединение попадало в кровоток непосредственно из ротовой полости. Композиции, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие вещество в виде мульти- или наночастиц, жидкости или порошки; лепешки (включая жидко-наполненные); жевательные резинки; гели; быстродиспергируемые лекарственные формы; пленки; сфероидальные капсулы; спреи и буккальные/мукоадгезивные пластыри. Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции можно использовать в качестве наполнителей в мягких или твердых капсулах (например, выполненных из желатина или гидроксипропилметилцеллюлозы), и они типично включают носитель, например воду, этанол,полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих веществ. Жидкие композиции также можно получить путем реструктурирования твердого вещества, например из саше. Соединения по настоящему изобретению также можно использовать в быстрорастворимых, быстроразлагаемых лекарственных формах, таких как описанные в Expert Opinion in Therapeutic Patents, 11(6), 981-986, by Liang and Chen (2001). Для лекарственных форм в виде таблеток, в зависимости от доз, лекарственное средство может составлять от 1 до 80 мас.% лекарственной формы, более типично от 5 до 60 мас.% лекарственной формы. Помимо лекарственного средства таблетки, как правило, содержат разрыхлитель. Примеры разрыхлителей включают натрийкрахмалгликолят, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, натрийкроскармелозу, кросповидон, поливинилпирролидон, метилцеллюлозу,микрокристаллическую целлюлозу, низшую алкилзамещенную гидроксипропилцеллюлозу, крахмал,прежелатинизированный крахмал и альгинат натрия. Как правило, разрыхлитель составляет от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% лекарственной формы. Связующие, как правило, используют для придания когезионных качеств композиции таблеток. Подходящие связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и подобные), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и вторичный кислый фосфат кальция дигидрат. Таблетки, необязательно, могут также включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и агенты скольжения, такие как диоксид кремния и тальк. В случае их присутствия, поверхностно-активные вещества могут составлять от 0,2 до 5 мас.% в расчете на массу таблетки, и агенты скольжения могут составлять от 0,2 до 1 мас.% в расчете на массу таблетки. Как правило, таблетки также содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества, как правило, составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% в расчете на массу таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, отдушки, консерванты и маскирующие вкус вещества. В качестве примера можно привести таблетки, содержащие до около 80% лекарственного средства,от около 10 до около 90 мас. % связующего, от около 0 до около 85 мас.% разбавителя, от около 2 до около 10 мас.% разрыхлителя и от около 0,25 до около 10 мас.% смазывающего вещества. Смеси для таблеток можно подвергнуть непосредственнму прессованию или с использованием ролика для формирования таблеток. Альтернативно, смеси для таблеток или порции таких смесей можно подвергнуть мокрому, сухому гранулированию или гранулированию из расплава, отверждению расплава или экструдированию перед таблетированием. Конечная композиция может включать один или несколько слоев и может быть с покрытием или без покрытия; она даже может быть инкапсулированной. Композиция таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol. 1, by H. Liebermanand L. Lachman (Marcel Dekker, New York, 1980). Пероральные пленки, предназначенные для лечения человека или для применения в ветеринарии,типично, представляют собой гибкие водорастворимые или набухаемые в воде лекарственные формы в виде тонких пленок, которые могут быть быстрорастворимыми или мукоадгезивными, и типично включают соединение формулы (I), пленкообразующий полимер, связующее, растворитель, увлажняющее- 12015952 вещество, пластификатор, стабилизатор или эмульгатор, модулятор вязкости и растворитель. Некоторые компоненты композиции могут выполнять несколько функций. Соединение формулы (I) может быть водорастворимым или нерастворимым в воде. Водорастворимое соединение типично составляет от 1 до 80 мас.%, более типично от 20 до 50 мас.%, от массы растворенных веществ. Менее растворимые соединения могут составлять большую долю композиции, типично до 88 мас.% от массы растворенных веществ. Альтернативно, соединение формулы (I) может быть в форме состоящих из многих частиц гранул. Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидных веществ, и он типично присутствует в количестве от 0,01 до 99 мас.%, более типично от 30 до 80 мас.%. Другие возможные ингредиенты включают антиоксиданты, красители, отдушки и усилители вкуса,консерванты, вещества, стимулирующие слюновыделение, красители, сорастворители (включая масла),увлажнители, вещества, придающие объем, пеноподавители, поверхностно-активные вещества и вещества для маскировки вкуса. Пленки в соответствии с настоящим изобретением типично получают путем испарительной сушки тонких водных пленок, нанесенных на отслаиваемую подложку или бумагу. Это можно осуществить в сушильной печи или туннеле, типично в объединенном устройстве для нанесения покрытия и сушки, или путем сушки вымораживанием или вакуумной сушки. Твердые композиции для перорального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Подходящие композиции модифицированного высвобождения для целей настоящего изобретения описаны в Патенте США 6106864. Подробную информацию о других подходящих способах высвобождения, например, с использованием высоко-энергетических дисперсий и осмотических и имеющих покрытие частиц, можно найти в Pharmaceutical Technology On-line, 25(2), 1-14, by Verma et al (2001). Применение жевательной резинки для получения контролируемого высвобождения описано в WO 00/35298. Соединения по настоящему изобретению также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракраниальное, внутримышечное, интрасиновиальное и подкожное введение. Подходящие устройства для парентерального введения включают иглы (включая микроиглы), инжекторы, безыгольные инжекторы и средства для инфузии. Парентеральные композиции типично представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные вещества (предпочтительно для рН от 3 до 9),но, для некоторых применений, они могут быть более подходящим образом сформулированы в виде стерильного неводного раствора или в виде высушенной формы для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Получение парентеральных композиций в стерильных условиях, например путем лиофилизации,легко можно осуществить с использованием стандартных фармацевтических способов, хорошо известных специалистам в данной области. Растворимость соединений формулы (I), используемых для получения парентеральных растворов,можно улучшить с использованием подходящих методов формулирования, таких как включение веществ, повышающих растворимость. Композиции для парентерального введения могут быть сформулированы с получением композиций немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Таким образом, соединения по настоящему изобретению могут быть сформулированы в виде суспензии или в виде твердого, полутвердого вещества или тиксотропной жидкости для введения в виде импантируемого депо препарата, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают покрытые лекарственным средством стенты и полутвердые вещества и суспензии, включающие заполненные лекарственным средством микросферы из сополимера dl-молочной-гликолевой кислоты (PGLA). Соединения по настоящему изобретению также можно вводить местным, внутрикожным или чрескожным путем при нанесении на кожу или слизистую оболочку. Типичные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, распыляемые порошки, повязки, пены,пленки, кожные пластыри, облатки, имплантаты, губки, волокна, бинты и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители пенетрации - см., например, J Pharm Sci, 88 (10), 955-958, by Finnin and Morgan (October 1999). Другие средства для местного введения включают доставку путем электропорации, ионофореза,фонофореза, сонофореза и микроигольного или безыгольного (например, Powderject, Bioject и т.д.)- 13015952 инжектора. Композиции для местного введения могут быть сформулированы как композиции для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению также можно вводить интраназально или путем ингаляции, типично в форме сухого порошка (либо отдельно, в виде смеси, например, в виде сухой смеси с лактозой, либо в виде частицы, состоящей из смешанных компонентов, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка, в виде аэрозольного спрея из контейнера, в котором создано повышенное давление, насоса, спрея, распылительного устройства (предпочтительно распылительного устройства с использованием электрогидродинамики для осуществления тонкого распыления) или пульверизатора, с использованием или без подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде назальных капель. Для интраназального применения порошок может включать биоадгезивное вещество, например хитозан или циклодекстрин. Находящийся под давлением контейнер, насос, спрей, распылительное устройство или пульверизатор содержат раствор или суспензию соединения(соединений) по настоящему изобретению, включающие, например, этанол, водный раствор этанола или подходящий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного вещества, пропеллент(пропелленты) в качестве растворителя и необязательное поверхностно-активное вещество, такое как сорбитантриолеат,олеиновая кислота или олигомолочная кислота. Перед использованием в композиции сухого порошка или суспензии лекарственный продукт измельчают до размера частиц, подходящего для доставки путем ингаляции (типично меньше чем 5 мкм). Это можно осуществить подходящим способом измельчения, таким как измельчение в спиральной струйной мельнице, измельчение в струйной мельнице с псевдоожиженным слоем, сверхкритическая обработка жидкости с образованием наночастиц, гомогенизация в условиях высокого давления или распылительная сушка. Капсулы (полученные, например, из желатина или гидроксипропилметилцеллюлозы), пузырьки и гильзы для использования в ингаляторе или инсуффляторе могут быть сформулированы таким образом,чтобы они содержали порошкообразную смесь соединения по настоящему изобретению, подходящую основу для порошка, такую как лактоза или крахмал, и модификатор распыления, такой как 1-лейцин,маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, при этом последняя является предпочтительной. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая композиция раствора для использования в распылительном устройстве с использованием электрогидродинамики для осуществления тонкого распыления может содержать от 1 мкг до 20 мг соединения по настоящему изобретению в расчете на одну активацию устройства, и вводимый при активации объем может варьировать от 1 до 100 мкл. Типичная композиция может включать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители,которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Подходящие отдушки, такие как ментол и левоментол, или подсластители, такие как сахарин или натрий сахарин, могут быть добавлены к тем композициям по настоящему изобретению, которые предназначены для введения путем ингаляции/интраназального введения. Композиции для введения путем ингаляции/интраназального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения с использованием, например, PGLA. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного,пульсирующего, контролируемого, направленного и программируемого высвобождения. В случае ингаляторов сухого порошка и аэрозолей единицу дозирования отмеряют при помощи клапана, который доставляет отмеренное количество. Отмериваемые единицы в соответствии с настоящим изобретением типично располагают так, чтобы вводить отмеренную дозу или "пшик". Общую суточную дозу можно вводить в виде одной дозы или, более типично, в виде раздельных доз в течение суток. Соединения по настоящему изобретению можно вводить ректально или вагинально,например, в форме суппозитория, пессария или клизмы. Масло какао представляет собой традиционную основу для суппозиториев, но можно использовать различные альтернативны, если это является подходящим. Композиции для ректального/вагинального введения могут быть сформулированы для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению также можно вводить непосредственно в глаз или ухо, типично в форме капель микронизированной суспензии или раствора в изотоническом, с отрегулируемым рН стерильном физиологическом растворе. Другие композиции, подходящие для введения в глаз или- 14015952 ухо, включают мази, гели, биоразлагаемые (например, абсорбируемые гелевые губчатые, коллагеновые) и бионеразлагаемые (например, силиконовые) имплантаты, облатки, линзы и мелкие частицы или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая смола, могут быть включены вместе с консервантом, таким как бензалконийхлорид. Доставку таких композиций также можно осуществлять методом ионофореза. Композиции для введения в глаз или ухо могут быть сформулированы для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции отсроченного, замедленного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению могут быть объединены с растворимыми макромолекулярными частицами, такими как циклодекстрин и его подходящие производные или полиэтиленгликольсодержащие полимеры, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности для использования в любом из описанных выше способов введения. Комплексы лекарственное средство-циклодекстрин, например, считаются, в основном, полезными для большинства лекарственных форм и путей введения. Можно использовать как комплексы включения, так и не-включения. В качестве альтернативы прямого комплексообразования с лекарственным средством, циклодекстрин можно использовать в качестве вспомогательной добавки, т.е. в качестве носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в Международных Патентных ЗаявкахWO 91/11172, WO 94/02518 и WO 98/55148. Для введения пациенту, которым является человек, общая суточная доза соединения по настоящему изобретению типично находится в пределах от 0,1 до 1000 мг, в зависимости, конечно, от способа введения. Общую суточную дозу можно вводить в виде одной дозы или в виде раздельных доз, и она может,по усмотрению лечащего врача, выходить за рамки типичных пределов, указанных в настоящей заявке. Эти дозы указаны в расчете на среднестатистического человека с массой тела от около 60 до 70 кг. Лечащий врач легко сможет определить дозы для субъектов, масса тела которых не попадает в указанные пределы, таких как дети и пожилые люди. Во избежание сомнений, ссылки в настоящей заявке на "лечение" включают ссылки на вылечивание, паллиативное и профилактическое лечение. Модулятор Nav1.8 канала может дать полезный результат при сочетании с другим фармакологически активным соединением или с двумя или более другими фармакологически активными соединениями, в частности, для лечения боли. Например, модулятор Nav1.8 канала, в частности соединение формулы (I) или его фармацевтически приемлемая соль или сольват, определенные выше, можно вводить одновременно, последовательно или отдельно в сочетании с одним или несколькими средствами, выбранными из следующих: опиоидное аналгетическое средство, например морфин, героин, гидроморфон, оксиморфон, леворфанол, леваллорфан, метадон, меперидин, фентанил, кокаин, кодеин, дигидрокодеин, оксикодон, гидрокодон, пропоксифен, налмефен, налорфин, налоксон, налтрексон, бупренорфин, буторфанол, налбуфин или пентазоцин; нестероидное противовоспалительное лекарственное средство (NSAID), например аспирин, диклофенак, дифлусинал, этодолак, фенбуфен, фенопрофен, флуфенисал, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамовая кислота, мефенамовая кислота, мелоксикам, набуметон,напроксен, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, фенилбутазон, пироксикам, сульфасалазин, сулиндак, толметин или зомепирак; барбитуратное седативное средство, например амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, секобарбитал, талбутал,теамилал или тиопентал; бензодиазепиновое средство, обладающее седативным действием, например хлордиазепоксид, клоразепат, диазепам, флуразепам, лоразепам, оксазепам, темазепам или триазолам; антагонист H1, обладающий седативным действием, например дифенгидрамин, пириламин, прометазин, хлорфенирамин или хлорциклизин; седативное средство, такое как глутетимид, мепробамат, метаквалон или дихлоралфеназон; скелетно-мышечный релаксант, например баклофен, карисопродол, хлорзоксазон, циклобензаприн,метокарбамол или орфенадин; антагонист рецептора NMDA, например декстрометорфан +)-3-гидрокси-N-метилморфинан) или его метаболит декстрорфан +)-3-гидрокси-N-метилморфинан), кетамин, мемантин, пирролохинолин хинин, цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота,будипин, EN-3231 (MorphiDex, комбинированная композиция морфина и декстрометорфана), топирамат, нерамексан или перцинфотел, включая антагонист NR2B, например ифенпродил, траксопродил или (-)-(R)-6-2-[4-(3-фторфенил)-4-гидрокси-1-пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1 Н)-хино- 15015952 линон; альфа-адренергическое средство, например доксазоцин, тамсулозин, клонидин, гуанфацин, дексметатомидин, модафинил или 4-амино-6,7-диметокси-2-(5-метан-сульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин; трициклический антидепрессант, например дезипрамин, имипрамин, амитриптилин или нортриптилин; противосудорожное средство, например карбамазепин, ламотригин, топирамат или валпроат; антагонист тахикинина (NK), в частности антагонист NK-3, NK-2 или NK-1, например (R, 9R)-7[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7 Н-[1,4]диазоцино[2,1g][1,7]-нафтиридин-6-13-дион (ТАК-637), 5-(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3(4-фторфенил)-4-морфолинил]-метил]-1,2-дигидро-3 Н-1,2,4-триазол-3-он (МК-869), апрепитант, ланепитант, дапитант или 3-2-метокси-5-(трифторметокси)фенил]-метиламино]-2-фенилпиперидин (2S,3S); мускариновый антагонист, например оксибутинин, толтеродин, пропиверин, тропсиум хлорид, дарифенацин, солифенацин, темиверин и ипратропиум; селективный ингибитор СОХ-2, например целекоксиб, рофекоксиб, парекоксиб, валдекоксиб, деракоксиб, эторикоксиб или лумиракоксиб; аналгетическое средство на основе каменноугольного дегтя, в частности парацетамол; нейролептическое средство, такое как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипразидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклолрид, зотепин, бифепрунокс, азенапин, луразидон, амисулприд, белаперидон, палиндоре, эпливансерин, озанетант,римонабант, меклинертант, Miraxion или саризотан; агонист ваниллоидного рецептора (например, резинфератоксин) или антагонист (например, капсазепин); бета-адренергическое средство, такое как пропранолол; местный анестетик, такой как мексилетин; кортикостероид, такой как дексаметазон; агонист или антагонист 5-НТ рецептора, в частности агонист 5-HT1B/1D, такой как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан; антагонист 5-НТ 2A рецептора, такой как R(+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенилэтил)]4-пиперидинметанол (MDL-100907); холинергическое (никотиновое) аналгетическое средство, такое как испрониклин (ТС-1734), (Е)-Nметил-4-(3-пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (АВТ-5 94) или никотин;(силденафил),(6R,12aR)-2,3,6,7,12,12 агексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил),2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-3 Нимидазо[5,1-f][1,2,4]триазин-4-он (варденафил), 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3 азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, 5-(5-ацетил-2-пропокси-3-пиридинил)-3 этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он,5-[2-этокси-5-(4 этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он, 4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N(пиримидин-2-илметил)пиримидин-5-карбоксамид, 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид; лиганд альфа-2-дельта, такой как габапентин, прегабалин, 3-метилгабапентин, (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)-уксусная кислота, (3S,5R)-3-аминометил-5-метилгептановая кислота,(3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3 хлорфенокси)пролин, (2S,4S)-4-(3-фторбензил)пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6 ил]уксусная кислота, 3- (1-аминометилциклогексилметил)-4 Н-[1,2,4]оксадиазол-5-он, С-[1-(1 Н-тетразол 5-илметил) циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота,(3S,5R)-3-аминометил-5-метилоктановая кислота, (3S, 5R)-3-амино-5-метилнонановая кислота, (3S,5R)-3 амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота и (3R,4R,5R)-3 амино-4,5-диметилоктановая кислота; каннабиноид; антагонист метаботропного глутаматного рецептора подтипа 1 (mGluR1); ингибитор повторного поглощения серотонина, такой как сертралин, сертралиновый метаболит деметилсертралин, флуоксетин, норфлуоксетин (метаболит флуоксетина десметила), флувоксамин, пароксетин, циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, d,l-фенфлурамин, фемоксетин, ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин и тразодон;- 16015952 ингибитор повторного поглощения норадреналина (норэпинефрина), такой как мапротилин, лофепрамин, миртазепин, оксапротилин, фезоламин, томоксетин, миансерин, бупроприон, метаболит бупроприона гидроксибупроприон, номифензин и вилоксазин (Vivalan ), в частности селективный ингибитор повторного поглощения норадреналина, такой как ребоксетин, в частности (S,S)-ребоксетин; ингибитор двойного действия, являющийся ингибитором повторного поглощения серотонинанорадреналина, такой как венлафаксин, метаболит венлафаксина О-десметилвенлафаксин, кломипрамин,метаболит кломипрамина десметилкломипрамин, дулоксетин, милнаципран и имипрамин; индуцибельный ингибитор синтазы окиси азота (iNOS), такой как S-[2-[(1-иминоэтил)амино]этил]L-гомоцистеин, S-[2-[(l-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1-иминоэтил)амино]этил]2-метил-L-цистеин, (2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5-гептеновая кислота, 2-(1R,3S)3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлор-3-пиридинкарбонитрил; 2-(1R,3S)-3-амино-4 гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил, (2S,4R)-2-амино-4-2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол, 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил)-3 пиридинкарбонитрил, 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлорбензонитрил, N[4-[2-(3-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин или гуанидиноэтилдисульфид; ингибитор ацетилхолинэстеразы, такой как донепезил; антагонист простагландина Е 2 подтипа 4 (ЕР 4), такой как N-[(2-[4-(2-этил-4,6-диметил-1 Нимидазо[4,5-с]пиридин-1-ил)фенил]этиламино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1([5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбониламино)этил]бензойная кислота; антагонист лейкотриена В 4; такой как 1-(3-бифенил-4-илметил-4-гидроксихроман-7-ил)циклопентанкарбоновая кислота(СР-105696),5-[2-(2-карбоксиэтил)-3-[6-(4-метоксифенил)-5 Егексенил]оксифенокси]-валериановая кислота (ONO-4057) или DPC-11870,ингибитор 5-липоксигеназы, такой как зилеутон, 6-[(3-фтор-5-[4-метокси-З,4,5,6-тетрагидро-2 Нпиран-4-ил])фенокси-метил]-1-метил-2-хинолон (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил),1,4 бензохинон (CV-6504); блокатор натриевых каналов, такой как лидокаин; антагонист 5-НТ 3, такой как ондансетрон и их фармацевтически приемлемые соли и сольваты. Такие сочетания предлагают существенные преимущества, в том числе синергетическую активность, в терапии. Поскольку может быть желательным введение комбинации активных соединений, например, в целях лечения конкретного заболевания или состояния, объем настоящего изобретения включает возможность удобного объединения двух или более фармацевтических композиций, по меньшей мере одна из которых содержит соединение по настоящему изобретению, в форме набора, подходящего для совместного введения этих композиций. Таким образом, набор по настоящему изобретению включает две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (I) в соответствии с настоящим изобретением, и средства для отдельного содержания указанных композиций, такие как контейнер, флакон с отделениями или упаковка из фольги с отделениями. Примером такого набора является известная блистерная упаковка, используемая для упаковки таблеток, капсул и т.п. Набор по настоящему изобретению является особенно подходящим для введения разных лекарственных форм, например пероральной и парентеральной, для введения отдельных композиций с разными интервалами введения или для титрования отдельных композиций против друг друга. Для большего удобства, набор типично включает указания по введению и может быть снабжен так называемой памяткой. Все пиридиновые производные формулы (I) можно получить с использованием процедур, описанных в общих способах, представленных ниже, или путем рутинной модификации таких процедур. Настоящее изобретение также охватывает любой один или несколько таких способов получения пиридиновых производных формулы (I), в дополнение к любым новым промежуточным соединениям, используемым в этих способах. В представленных ниже общих способах Ar и R1 имеют значения, определенные выше для пиридинового производного формулы (I), если не указано иное. Если указаны относительные содержания растворителей, они указаны в расчете на объем. В соответствии с первым способом соединения формулы (I) можно получить из соединений формулы (IV), как показано на Схеме 1. М представляет собой группу необязательно замещенного/лигированного металла или бора, подходящую для реакций перекрестного связывания, например триалкилстаннан, дигидроксиборан, диалкоксиборан или галогенцинк.X представляет собой подходящую группу для реакций перекрестного связывания, типично Br или IY представляет собой подходящую удаляемую группу, типично Cl. Соединение (II) является коммерчески доступным. Соединения формулы (III) можно получить путем реакции электрофильного галогенирования в соответствии со стадией реакции (i). Типичные условия включают взаимодействие 2,6-диаминопиридина с галогеном, необязательно в присутствии органического или неорганического основания или в соответствии с литературой J. Org, Chem. 2006, 72, 2922-2925 и J. С. S. Chem. Comm 1980, 1139-1140. Предпочтительные условия включают иод и карбонат калия в 2-метил-тетрагидрофуране, или иод и триэтиламин в этаноле/промышленном метилированном этиловом спирте (3-5% метанола в этаноле). Соединения формулы (IV) можно получить из соединений формулы (III) посредством стадии (ii) способа, реакции перекрестного связывания с ArM, в присутстви подходящей системы катализатора (например, палладия или никеля) и основания. Типично используют условия реакции Сузуки, включающие 1,2-3 эквивалента бороновой кислоты, основание и 0,01-0,25 эквивалента палладиевого катализатора с фосфиновыми лигандами в органическом растворителе при температуре от 50 до 100 С. Предпочтительные условия включают 2 эквивалента бороновой кислоты, 1 эквивалент Cs2CO3 и 0,1 эквивалентаPd(PPh3)4 в смеси 2:1 1,4-диоксан/вода при 80 С или 1,1 эквивалента бороновой кислоты, 1 эквивалент карбоната натрия или калия, 0,015 эквивалента трис(дибензилиденацетон)дипалладия (0) и 0,045 эквивалента три-трет-бутилфосфина в этаноле/воде при 80 С. Соединения формулы (I) можно получить из соединений формулы (IV) в соответствии со стадией(iii) способа, включающей амидное связывание с использованием хлорангидрида кислоты или карбоновой кислоты, активированной подходящим агентом, необязательно в присутствии катализатора, в подходящем растворителе. Типичные условия включают хлорангидрид кислоты и амин формулы (IV), с избыточным количеством подходящего органического основания, такого как триэтиламин, 2,6-лутидин или пиридин, в подходящем растворителе, при температуре от комнатной температуры до 80 С. Предпочтительные условия включают 1,5 эквивалента хлорангидрида кислоты в пиридине при 60 С, или 1,1 эквивалента хлорангидрида кислоты и 1,3 экв. 2,6-лутидина в ацетонитриле при комнатной температуре. В соответствии со вторым способом соединения формулы (I) можно получить из соединений формулы (V), как показано на схеме 2. Схема 2 где М, X и Y имеют значения, определенные для схемы 1. Соединения формулы (V) можно получить из соединений формулы (III) посредством реакции амидного связывания в соответствии со стадией(iii) способа, как описано выше для схемы 1. Соединения формулы (I) можно получить из соединений формулы (V) путем реакции перекрестного связывания в соответствии со стадией способа (ii), как описано выше для схемы 1. В соответствии с третьим способом соединения формулы (IV) можно получить из соединений формулы (VI), как показано на схеме 3. где М и X имеют значения, определенные для схемы 1. Соединения формулы (VI) можно получить из соединений формулы (III) посредством стадии (iv) способа, включающей реакцию металлирования или борирования, необязательно в присутствии катализатора, в подходящем растворителе. Типичные условия включают бис(пинаколато)дибор в присутствии ацетата калия и Pd(dppf)Cl2 в диметилформамиде при 80 С. Соединения формулы (IV) можно получить из соединений формулы (VI) путем реакции перекрестного связывания в соответствии со стадией (ii) способа, как описано выше для схемы 1. В соответствии с четвертым способом соединения формулы (I) можно получить из соединений формулы (VII), как показано на схеме 4. Схема 4 где М и X имеют значения, определенные для схемы 1. Соединения формулы (VII) можно получить из соединений формулы (V) путем реакции металлирования или борирования в соответствии со стадией (iv) способа, как описано выше для схемы 3. Соединения формулы (I) можно получить из соединений формулы (VII) путем реакции перекрестного связывания в соответствии со стадией (ii) способа, как описано выше для схемы 1. В соответствии с пятым способом соединения формулы (III) можно получить из соединений формулы (X), как показано на схеме 5. Схема 5 где X имеет значение, определенное для схемы 1. Соединения формулы (VIII) являются либо коммерчески доступными, либо известны из литературы(J. Org. Chem. 2005, 10, 1711-1779). Соединения формулы (IX) можно получить из соединений формулы (VIII) путем направленного ортометаллирования с последующим электрофильным галогенированием в соответствии со стадией (v) способа. Типичные условия включают избыточное количество трет-BuLi в ТГФ при -78 С с последующим добавлением дибромэтана, при нагревании до комнатной температуры. Соединения формулы (X) можно получить из соединений формулы (IX) путем замещения галогена аммиаком или подходящей замещенной формой аммиака в соответствии со стадией (vi) способа. Типичные условия включают 4 эквивалента RNH2 (R = подходящая защитная группа), 2 эквивалента диизопропилэтиламина в изопропаноле, нагревание при 160 С в течение 4 ч. В случае использования замещенной формы аммиака потребуется соответствующее удаление защитной группы. Соединение формулы (III) можно получить из соединений формулы (X) в соответствии со стадией(vii) способа, включающей реакцию удаления защиты в щелочных или кислотных условиях. Типичные условия включают использование основания, в качестве которого используют основание щелочного ме- 19015952 талла, такое как КОН, в 1,4-диоксане при 100 С. В соответствии с шестым способом соединения формулы (III) можно получить из соединений формулы (XI), как показано на схеме 6. Схема 6 где X имеет значение, определенное для схемы 1. Соединения формулы (XI) известны из литературы (J. Org. Chem. 1996, 61, 4623-4633). Соединения формулы (III) можно получить из соединений формулы (XI) в соответствии со стадией(viii) способа путем реакции гидролиза в щелочных или кислотных условиях с последующей перегруппировкой Курциуса или путем замещения сложного метилового эфира аммиаком с последующей перегруппировкой Хоффмана. Типичные условия включают LiOHH2O в метаноле/воде при 75 С с последующим образованием ацилазида с использованием дифенилфосфорилазида. Предпочтительные условия включают 1,1 эквивалента дифенилфосфорилазида, 1,1 эквивалента триэтиламина с 1,1 эквивалента третбутанола в толуоле при 90 С, с последующим удалением защиты в кислотных условиях с использованием HCl в 1,4-диоксане. При рассмотрении представленных выше общих способов, специалистам в данной области будет очевидно, что, в случае присутствия защитных групп, эти группы, как правило, являются взаимозаменяемыми с другими защитными группами аналогичной природы, например, когда описывается амин как являющийся замещенным трет-бутоксикарбонильной группой, эту группу легко можно заменить подходящей амино-защитной группой. Подходящие защитные группы описаны в 'Protective Groups in OrganicSynthesis' by T. Greene and P. Wuts (3rd edition, 1999, John Wiley and Sons). Настоящее изобретение также относится к новым промежуточным соединениям, определенным выше, ко всем их солям, сольватам и комплексам, и ко всем сольватам и комплексам их солей, определенных выше для пиридиновых производных формулы (I). Настоящее изобретение включает все полиморфы указанных выше видов и их кристаллические формы. При получении пиридиновых производных формулы (I) в соответствии с настоящим изобретением специалист в данной области свободно может выбрать наилучший порядок осуществления стадий для синтеза промежуточных соединений и выбрать форму промежуточных соединений, которая обеспечивает наилучшую комбинацию характерных особенностей для этой цели. Такие характерные особенности включают точку плавления, растворимость, пригодность для химической переработки и выход промежуточной формы, а также достигаемую в результате этого простоту очистки продукта после его выделения. Чтобы выйти на соединения формулы (I), специалист в данной области может осуществлять стадии синтеза, описанные выше, в любом подходящем порядке. Настоящее изобретение иллюстрируется представленными далее репрезентативными примерами. Спектры 1 Н ядерного магнитного резонанса (ЯМР) во всех случаях были согласующимися с предполагаемыми структурами. Характеристические химические сдвигипредставлены в миллионых долях в области ниже от тетраметилсилана с использованием традиционных аббревиатур для обозначения основных пиков: например, с - синглет; д - дублет; т - триплет; кв. квартет; м - мультиплет; шир. - широкий. Масс-спектры (МС) записывали с использованием либо ионизации электроспреем (ESI), либо химической ионизации при атмосферном давлении (APCI). Использовали следующие аббревиатуры и химические формулы для традиционных растворителей: CDCl3 - дейтерохлороформ; D6-DMSO дейтеродиметилсульфоксид; CD3OD - дейтерометанол; ТГФ, тетрагидрофуран. ЖХМС означает жидкостую хроматографию/масс-спектрометрию (Rt = время удерживания). Если указаны отношения растворителей, они указаны как объемные отношения. Некоторые соединения в примерах и получениях очищали с использованием автоматической препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ). Условия обращено-фазовой ВЭЖХ включали использование систем FractionLynx. Образцы для анализа растворяли в 1 мл DMSO. В зависимости от природы соединений и результатов предварительного анализа очистку осуществляли либо в кислотных условиях, либо в щелочных условиях, при температуре окружающей среды. Очистку в кислотных условиях осуществляли на колонке Sunfire Prep C18 OBD (1950 мм, 5 мкм), очистку в щелочных условиях осуществляли на Xterra Prep MS C18 (1950 мм, 5 мкм), все оборудование от компанииWaters. Использовали скорость потока 18 мл/мин с подвижной фазой А: вода + 0,1% модификатора(об/об) и В: ацетонитрил + 0,1% модификатора (об/об). Для очистки в кислотных условиях модификатор представлял собой муравьиную кислоту, для очистки в щелочных условиях модификатор представлял собой диэтиламин. Бинарный ЖХ насос Waters 2525 подавал подвижную фазу с композицией 5%В в течение 1 мин, с последующим увеличением от 5 до 98%В в течение 6 мин, затем с выдержкой в течение 2 мин при 98%В.- 20015952 Детекцию осуществляли с использованием абсорбционного детектора Waters 2487 с двойной длиной волны, установленного на 225 нм, затем установленного в ряд с ним детектора Polymer Labs PL-ELS 2100 и установленного параллельно масс-спектрометра Waters ZQ 2000 4 way MUX. Детектор PL 2100ELSD был установлен на 30 С со скоростью подачи азота 1,6 л/мин. Масс-спектрометр Waters ZQ был настроен на следующие параметры: Пусковые сигналы для сбора фракций получали при помощи как MS, так и ELSD. Анализ контроля качества осуществляли с использованием метода ЖХМС, ортогонального препаративному методу. Серию опытов в кислотных условиях осуществляли на Sunfire C18 (4,650 мм, 5 мкм), серию опытов в щелочных условиях осуществляли на Xterra С 18 (4,650 мм, 5 мкм), все обрудование от компании Waters. Использовали скорость потока 1,5 мл/мин с подвижной фазой А: вода + 0,1% модификатора (об/об) и В: ацетонитрил + 0,1% модификатора (об/об). Для опытов в кислотных условиях модификатор представлял собой муравьиную кислоту, для опытов в щелочных условиях модификатор представлял собой диэтиламин. Использовали бинарный ЖХ насос Waters 1525 с градиентным элюированием от 5 до 95%В в течение 3 мин, затем с выдержкой в течение 1 мин при 95%В. Детекцию осуществляли с использованием детектора Waters MUX UV 2488, установленного на 225 нм, затем установленного в ряд с ним детектора Polymer Labs PL-ELS 2100 и установленного параллельно масс-спектрометраWaters ZQ 2000 4 way MUX. PL 2100 ELSD был установлен на 30 С со скоростью подачи азота 1,6 л/мин. Масс-спектрометр Waters ZQ был настроен на следующие параметры: Если не указано иное, ЖХМС условия осуществляли в соответствии с 6-минутным ЖХМС градиент: Условия и оборудование для ЖХ-МС метода с 6-минутным градиентом Кислотные условия: Способ А. Оксалилхлорид (0,453 г, 3,57 ммоль) добавляли к суспензии 1-метил-1 Н-пиразол-5-карбоновой кислоты (0,150 г, 1,19 ммоль) в дихлорметане (7 мл). Добавляли одну каплю диметилформамида и реакционную смесь оставляли для перемешивания при комнатной температуре в течение 2,5 ч. Реакционную смесь концентрировали в вакууме и подвергали азеотропной перегонке с дихлорметаном. Остаток растворяли в CH3CN с получением 1 М раствора. 0,260 мл 1 М раствора хлорангидрида кислоты (0,260 ммоль) в CH3CN добавляли к охлажденному раствору 3-(2-хлорфенил)пиридин-2,6-диамина (Получение 5, 0,055 г, 0,250 ммоль) и лутидина (0,035 мл, 0,300 ммоль) в CH3CN (2 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. К реакционной смеси добавляли еще 0,130 мл хлорангидрида кислоты в CH3CN (0,130 ммоль) и 0,017 мл лутидина (0,15 ммоль) и перемешивали при комнатной температуре еще в течение 18 ч, затем концентрировали в вакууме. Остаток поглощали в 60 мл этилацетата и промывали при помощи 20 мл насыщенного водного раствора NaHCO3, затем сушили над Na2SO4 и концентрировали в вакууме с получением масла золотистого цвета. Остаток растворяли в 1 мл диметилсульфоксида и очищали с использованием препаративной ВЭЖХ. ЖХМС Rt=3,03 минN-(6-Амино-5-иодпиридин-2-ил)-3-метилизоксазол-4-карбоксамид (Получение 15, 0,040 г, 0,12 ммоль) объединяли с 2-(трифторметил)фенилбороновой кислотой (0,044 г, 0,232 ммоль) и карбонатом цезия (0,038 г, 0,116 ммоль) и суспендировали в смеси 1,4-диоксана (2 мл) и воды (1 мл). Реакционную смесь нагревали до 80 С в небольшом герметично закрытом реакционном сосуде (Reacti-vial ), затем добавляли тетракис(трифенилфосфин)палладий (0,010 г, 0,0087 ммоль).- 22015952 Реакционную смесь нагревали в течение 4 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток распределяли между дихлорметаном и насыщенным водным растворомNa2CO3, затем фильтровали через фазо-разделительный картридж и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения. ЖХМС Rt=3,54 мин Способ С. Оксалилхлорид (4,53 г, 35,7 ммоль) добавляли к суспензии 1-метил-1 Н-пиразол-5-карбоновой кислоты (3,00 г, 23,8 ммоль) в дихлорметане (150 мл). Добавляли пять капель диметилформамида и реакционную смесь оставляли для перемешивания при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали в вакууме до половины объема дихлорметана. 0,825 мл раствора хлорангидрида кислоты в дихлорметане добавляли к охлажденному раствору 3-(2,5-дихлор)пиридин-2,6-диамина (Получение 7, 0,376 г, 1,485 ммоль) в безводном пиридине (5 мл) и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали в вакууме, затем распределяли между NaHCO3(20 мл) и дихлорметаном (20 мл). Дихлорметановый слой промывали насыщенным солевым раствором(20 мл), затем сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью 50:50 этилацетат:гептан, с получением указанного в заголовке соединения (0,146 г, 27% выход). ЖХМС Rt=3,37 мин Способ D. Оксалилхлорид (0,088 г, 0,693 ммоль) добавляли к суспензии 1-метил-1 Н-пиразол-5-карбоновой кислоты (0,066 г, 0,523 ммоль) в дихлорметане (2 мл). Добавляли одну каплю диметилформамида и реакционную смесь оставляли для перемешивания при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали в вакууме и подвергали азеотропной перегонке с дихлорметаном. Остаток растворяли в ТГФ (2 мл) и добавляли диизопропилэтиламин (0,0956 г, 0,693 ммоль) и 4 пирролидинопиридин (0,005 г, 0,035 ммоль). Раствор охлаждали на бане лед/ацетон и добавляли 3-(2,3,5 трихлорфенил)пиридин-2,6-диамин (Получение 6, 0,100 г, 0,347 ммоль) по порциям в течение 1 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором NH4Cl (10 мл), затем насыщенным водным раствором NaHCO3 (10 мл) и затем водой (10 мл), с последующей сушкой надMgSO4 и упариванием в вакууме с получением коричневой смолы. Остаток очищали путем растирания в порошок с пентан с получением указанного в заголовке соединения в виде желтого масла. 1- 23015952 добавляли оксалилхлорид (9,14 мл, 104,8 ммоль) с последующим добавлением 3 капель диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток растворяли в ацетонитриле (42 мл) и добавляли по каплям к охлажденному раствору 3-(2-хлор-5-метоксифенил)пиридин-2,6-диамина (получение 1, 9,5 г, 38 ммоль) и лутидина (6,6 мл,57,1 ммоль) в ацетонитриле (650 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в атмосфере азота в течение 2 ч. Реакцию гасили добавлением воды (300 мл) и концентрировали до небольшого объема в вакууме. Водный остаток промывали дихлорметаном (2300 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат:гептан 1:4, с получением твердого вещества. Это вещество перекристаллизовывали из толуола (100 мл) с получением 6,7 г указанного в заголовке продукта. ЖХМС Rt=1,88 минH ЯМР (d6-DMSO): 3,75 (с, 3H), 4,05 (с, 3H), 5,3 (шир. с, 2H), 6,9 (м, 1H), 6,95 (м, 1H), 7,2 (м, 1H),7,3 (м, 1H), 7,35 (м, 1H), 7,45 (м, 1H), 7,5 (м, 1H), 10,3 (шир. с, 1 Н). Следующие примеры общей формулы: получали способами, аналогичными Способам А, В и D, как описано для примеров 1, 2 и 4 выше. Если не указано иное, подробности получения такие же, как описано для способа, на который ссылаются.N-6-Амино-5-[2-(дифторметокси)фенил]пиридин-2-ил-1-метил-1 Н-пиразол-5 Способ Е. К суспензии N-(6-амино-5-иодпиридин-2-ил)-1-метил-1 Н-пиразол-5-карбоксамида (Получение 16,0,075 г, 0,22 ммоль) в 1,4-диоксане (2 мл) и воде (1 мл) добавляли карбонат цезия (0,071 г, 0,218 ммоль),2-[2-(дифторметокси)фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан (Получение 30, 0,117 г, 0,436 ммоль) и тетракис(трифенилфосфин)палладий (0,0252 г, 0,0218 ммоль). Реакционный сосуд продували азотом, затем герметично закрывали и нагревали в микроволновом реакторе Biotage в течение 5 мин при 120 С. Реакционную смесь затем разбавляли этилацетатом (50 мл) и промывали разбавленным водным раствором NaHCO3, затем сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения. ЖХМС Rt = 2,99 минMS m/z 360 [МН]+ Следующие примеры общей формулы: получали способами, аналогичными Способам А, С и D, как описано для примеров 1, 3 и 4 выше. Если не указано иное, подробности получения такие же, как описано для способа, на который ссылаются. К суспензии 3-метилизоксазол-4-карбоновой кислоты (2,73 г, 21,48 ммоль) в дихлорметане (10 мл) добавляли оксалилхлорид (2,62 мл, 30,1 ммоль) с последующим добавлением 2 капель диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем концентрировали в вакууме. Остаток подвергали азеотропной перегонке с дихлорметаном, растворяли в ацетонитриле
МПК / Метки
МПК: A61K 31/44, A61K 31/4439, C07D 213/75, A61P 25/28, A61K 31/4427, A61P 29/00, C07D 401/12
Метки: каналов, натриевых, модуляторов, 2-пиридинкарбоксамидные, качестве, производные
Код ссылки
<a href="https://eas.patents.su/30-15952-2-piridinkarboksamidnye-proizvodnye-v-kachestve-modulyatorov-natrievyh-kanalov.html" rel="bookmark" title="База патентов Евразийского Союза">2-пиридинкарбоксамидные производные в качестве модуляторов натриевых каналов</a>
Предыдущий патент: Система элементов для монтажа интерьерной перегородки
Следующий патент: Способ и система удаления сероводорода из потока природного газа
Случайный патент: Тягомер