Бензамидные производные как агонисты ер4-рецепторов
Номер патента: 15931
Опубликовано: 30.12.2011
Авторы: Сварбрик Мартин Эдвард, Джаиба Алессандра, Джонсон Кристофер Норберт, Румэнс Сьюзан, Стэнвэй Стивен Джеймс, Хили Марк Патрик
Формула / Реферат
1. Соединение формулы (I), или его фармацевтически приемлемая соль, или сложный эфир, или соль сложного эфира
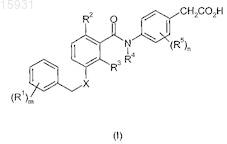
где R1обозначает атом галогена или C1-4 алкил;
R2 обозначает C1-4 алкил или атом хлора;
R3 обозначает H, C1-4 алкил или галоген;
R4 обозначает H;
R5, каждый независимо, обозначает атом галогена или C1-4 алкил;
m равно 0 или 1;
n равно 0, 1 или 2 и
X обозначает O или NH;
при условии, что если n равно 2 и R5 обозначает атом галогена, то группы R5 вместе с фенильной группой, к которой они присоединены, не образуют 2,3-дифторфенильный фрагмент.
2. Соединение по п.1, в котором X обозначает O.
3. Соединение по п.1, в котором X обозначает NH.
4. Соединение по п.1 или 2, в котором R1 обозначает атом галогена.
5. Соединение по п.4, в котором R1 обозначает атом хлора.
6. Соединение по п.5, в котором R1 обозначает атом хлора в C(3) положении фенильного кольца относительно -CH2COOH.
7. Соединение по п.1 или 2, в котором R2 обозначает метил.
8. Соединение по п.1 или 2, в котором R3 обозначает H.
9. Соединение по п.1 или 2, в котором R5 обозначает метил.
10. Соединение по п.9, в котором R5 обозначает метил в C(3) положении фенильного кольца относительно
-CH2COOH.
11. Соединение по п.1 или 2, в котором
R1 обозначает атом галогена;
R2 обозначает C1-4 алкил;
R3 обозначает H;
R5 обозначает C1-4 алкил;
m равно 1 и
n равно 1.
12. Соединение по п.11, в котором
R1 обозначает атом хлора;
R2 обозначает метил;
R3 обозначает H;
R5 обозначает метил;
m равно 1 и
n равно 1.
13. Соединение по п.12, в котором
R1 обозначает атом хлора в C(3) положении фенильного кольца;
R2 обозначает метил;
R3 обозначает H;
R5 обозначает метил в C(3) положении фенильного кольца относительно -CH2COOH;
m равно 1 и
n равно 1.
14. Соединение формулы (I), или его фармацевтически приемлемая соль, или сложный эфир, или соль сложного эфира
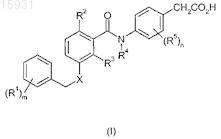
где R1обозначает атом хлора;
R2 обозначает метил;
R3 обозначает H;
R4 обозначает H;
R5 обозначает метил;
m равно 1;
n равно 1 и
X обозначает O.
15. Соединение по п.1, выбранное из группы, включающей следующие соединения:
(3-хлор-4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
{3-хлор-4-[({2-хлор-5-[(фенилметил)окси]фенил}карбонил)амино]фенил}уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-2-фторфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-2,5-дифторфенил)уксусная кислота;
(3-хлор-4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-2-фторфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-3-метилфенил)уксусная кислота;
{4-[({2-хлор-5-[(фенилметил)амино]фенил}карбонил)амино]фенил}уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]амино}фенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(2-хлор-5-{[(2-хлорфенил)метил]амино}фенил)карбонил]амино}фенил)уксусная кислота;
(5-хлор-4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-2-фторфенил)уксусная кислота;
(4-{[(5-{[(3-хлорфенил)метил]окси}-2-метилфенил)карбонил]амино}фенил)уксусная кислота;
{4-[({2-метил-5-[(фенилметил)окси]фенил}карбонил)амино]фенил}уксусная кислота;
(4-{[(6-хлор-3-{[(3-хлорфенил)метил]окси}-2-фторфенил)карбонил]амино}фенил)уксусная кислота;
{4-[({6-хлор-2-фтор-3-[(фенилметил)окси]фенил}карбонил)амино]фенил}уксусная кислота;
{3-хлор-4-[({2-метил-5-[(фенилметил)окси]фенил}карбонил)амино]фенил}уксусная кислота;
(3-хлор-4-{[(5-{[(3-хлорфенил)метил]окси}-2-метилфенил)карбонил]амино}фенил)уксусная кислота;
{3-хлор-4-[({6-хлор-2-фтор-3-[(фенилметил)окси]фенил}карбонил)амино]фенил}уксусная кислота;
(3-хлор-4-{[(6-хлор-3-{[(3-хлорфенил)метил]окси}-2-фторфенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}-3-метилфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(5-{[(3-хлорфенил)метил]окси}-2-метилфенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}-3-метилфенил)уксусная кислота;
(4-{[(2-хлор-5-{[(2-хлорфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(2-хлор-5-{[(2-хлорфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(2-хлор-5-{[(4-хлорфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(2-хлор-5-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(2-хлор-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-фтор-4-{[(5-{[(3-фторфенил)метил]окси}-2-метилфенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(5-{[(3-фторфенил)метил]окси}-2-метилфенил)карбонил]амино}-3-метилфенил)уксусная кислота;
(3-фтор-4-{[(2-метил-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(2-метил-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(2-хлор-5-{[(3-хлорфенил)метил]окси}фенил)карбонил]амино}-3,5-дифторфенил)уксусная кислота;
(3-метил-4-{[(2-метил-5-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(3-хлор-4-{[(5-{[(3-фторфенил)метил]окси}-2-метилфенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(6-хлор-3-{[(3-хлорфенил)метил]окси}-2-фторфенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(5-{[(3-хлорфенил)метил]окси}-2-метилфенил)карбонил]амино}-3,5-дифторфенил)уксусная кислота;
(4-{[(6-хлор-3-{[(3-хлорфенил)метил]окси}-2-фторфенил)карбонил]амино}-3-метилфенил)уксусная кислота;
(3-хлор-4-{[(6-хлор-2-фтор-3-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}фенил)уксусная кислота;
(4-{[(6-хлор-2-фтор-3-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}-3-фторфенил)уксусная кислота;
(4-{[(6-хлор-2-фтор-3-{[(3-фторфенил)метил]окси}фенил)карбонил]амино}-3-метилфенил)уксусная кислота;
(4-{[(6-хлор-2-фтор-3-{[(3-метилфенил)метил]окси}фенил)карбонил]амино}-3-фторфенил)уксусная кислота;
или его фармацевтически приемлемая соль, или сложный эфир, или соль сложного эфира.
16. Соединение по п.1 или 14, которое представляет собой (4-{[(5-{[(3-хлорфенил)метил]окси}-2-метилфенил)карбонил]амино}-3-метилфенил)уксусную кислоту
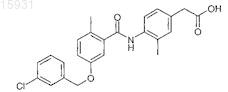
или ее фармацевтически приемлемую соль, или сложный эфир, или соль сложного эфира.
17. Фармацевтическая композиция, содержащая соединение по любому из пп.1-16, и фармацевтически приемлемый носитель или разбавитель.
18. Применение соединения по любому из пп.1-16 для приготовления лекарственного средства для лечения состояния, которое опосредовано действием или ослаблением действия PGE2 на EP4-рецепторах.
19. Применение по п.18, в котором состояние является болью.
20. Применение по п.19, в котором болезненное состояние выбрано из группы, включающей хроническую суставную боль; скелетно-мышечную боль; боль в нижней части спины и шее; вывихи и растяжения; невропатическую боль; симпатическую постоянную боль; миозит; боль, связанную с раковым заболеванием и фибромиалгией; боль, связанную с мигренью; боль, связанную с гриппом или другими вирусными инфекциями; ревматическую атаку; боль, связанную с функциональными нарушениями кишечника; боль, связанную с ишемией миокарда; послеоперационную боль; головную боль; зубную боль и дисменорею.
21. Способ лечения пациента-человека или животного, страдающего от состояния, которое опосредовано действием или ослаблением действия PGE2на EP4-рецепторах, который включает введение указанному субъекту эффективного количества соединения по любому из пп.1-16.
22. Способ по п.21, в котором состояние является болью.
23. Способ по п.22, в котором болезненное состояние выбрано из группы, включающей хроническую суставную боль; скелетно-мышечную боль; боль в нижней части спины и шее; вывихи и растяжения; невропатическую боль; симпатическую постоянную боль; миозит; боль, связанную с раковым заболеванием и фибромиалгией; боль, связанную с мигренью; боль, связанную с гриппом или другими вирусными инфекциями; ревматическую атаку; боль, связанную с функциональными нарушениями кишечника; боль, связанную с ишемией миокарда; послеоперационную боль; головную боль; зубную боль и дисменорею.
Текст
Дата публикации и выдачи патента Номер заявки БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ КАК АГОНИСТЫ ЕР 4-РЕЦЕПТОРОВ Соединение формулы (I) или его фармацевтически приемлемое производное, в котором R1, R2,R3, R4, R5, m, n и X такие, как определено в описании; способ получения таких соединений; фармацевтическая композиция, содержащая такие соединения; и применение таких соединений в медицине.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 015931 Данное изобретение касается бензамидных производных, способа их получения, содержащих их фармацевтических композиций и их применения в медицине. Соединения по настоящему изобретению представляют собой агонисты EP4-рецепторов. В ряде обзорных статей описываются характеристики и терапевтическая актуальность простаноидных рецепторов, а также наиболее широко применяемые селективные агонисты и антагонисты: Eicosanoids; From Biotechnology to Therapeutic Applications, Folco, Samuelsson, Maclouf и Velo eds, PlenumEP4-рецептор представляет собой 7-трансмембранный рецептор, и его природным лигандом является простагландин PGE2. PGE2 также обладает сродством к другим EP-рецепторам (EP1, EP2 и EP3 типов). Простаноидный EP4-рецептор попадает в группу рецепторов, обычно связанных с повышением уровней внутриклеточного циклического аденозинмонофосфата (цАМФ). EP4-рецептор связан с релаксацией гладких мышц, внутриглазным давлением, болью (в частности, с воспалительной, невропатической и висцеральной болью), воспалением, нейропротекцией, дифференцировкой лимфоцитов, метаболическими процессами в костях, аллергической активностью, содействием сну, почечной регуляцией, желудочной или кишечной секрецией слизи и дуоденальной секрецией бикарбоната. Следовательно, агонистыEP4-рецепторов могут быть полезны для лечения боли, воспаления и других состояний, связанных с EP4 рецептором. EP4-рецептор также играет важную роль в закрытии артериального протока, снижении сосудистого тонуса, воспалении и реконструкции костей, как рассматривается в работе Narumiya в ProstaglandinsOther Lipid Mediators 2002, 68-69, 557-73. В ряде публикаций продемонстрировано, что PGE2 действует по подтипу рецепторов EP4, и EP4 агонисты сами по себе могут регулировать воспалительные цитокины после действия воспалительного стимула. Takayama и др. в Journal of Biological Chemistry 2002, 277(46), 44147-54, показали, что PGE2 модулируют воспаление при воспалительных заболеваниях, подавляя производимые макрофагами хемокины посредством EP4-рецепторов. В работе BioorganicMedicinal Chemistry 2002, 10(7), 2103-2110, Maruyama и др. демонстрируют, что селективный агонист EP4-рецепторов (ONO-AE1-437) подавляет LPSиндуцированные TNF- в цельной крови человека, повышая при этом уровни IL-10. В статье из Anesthesiology, 2002, 97, 170-176, предполагается, что селективный агонист EP4-рецепторов (ONO-AE1-329) эффективно ингибирует механическую и тепловую гипералгезию и воспалительные реакции при остром и хроническом моноартрите. В двух независимых статьях Sakuma и др. в Journal of Bone and Mineral Research 2000, 15(2), 218227 и Miyaura и др. в Journal of Biological Chemistry 2000, 275(26), 19819-23, сообщается о понижении образования остеокластов в культивируемых клетках из (EP4-рецептор)-нокаутных мышей. Yoshida и др. в Proceedings of the National Academy of Sciences of the United States of America 2002, 99(7), 4580-4585, используя мышей с дефицитом каждого из EP подтипов рецепторов PGE2, идентифицируют EP4 как рецептор, который опосредует образование костной ткани в ответ на введение PGE2. Они также продемонстрировали, что селективный агонист EP4-рецептора (ONO-4819), соответственно, индуцирует образование костной ткани у мышей дикого типа. Кроме того, Terai и др. в Bone 2005, 37(4), 555-562 показали, что присутствие селективного агониста EP4-рецепторов (ONO-4819) усиливает костеобразующую способностьrhBMP-2, терапевтического цитокина, который может индуцировать образование костной ткани. Дальнейшее исследование Larsen и др. показывает, что эффекты PGE2 на секрецию во второй части двенадцатиперстной кишки человека опосредованы EP4-рецепторами (Acta. Physiol. Scand. 2005, 185,133-140). Также показано, что селективный агонист EP4-рецепторов (ONO-AE1-329) может защищать от колита у крыс (Nitta, в Scandinavian Journal of Immunology 2002, 56(1), 66-75).Dore и др. в The European Journal of Neuroscience 2005, 22(9), 2199-206, показали, что PGE2 могут защищать нейроны от токсичности амилоидных -пептидов посредством воздействия на EP2- и EP4 рецепторы. Кроме того, Dore продемонстрировал в Brain Research 2005, 1066(1-2), 71-77, что агонистEP4-рецепторов (ONO-AE1-329) защищает от нейротоксичности в острой модели экситотоксичности в головном мозге.Woodward и др. в Journal of Lipid Mediators 1993, 6(1-3), 545-53, обнаружили, что внутриглазное давление можно понизить, применяя селективные простаноидные агонисты. В двух статьях в Investigative OphthalmologyVisual Science показано, что простаноидный EP4-рецептор экспрессируется в эпителиальных клетках хрусталика человека (Mukhopadhyay и др., 1999, 40(1), 105-12) и предложена физиологическая роль простаноидного EP4-рецептора в модулировании потока в трабекулярной сети глаза(Hoyng и др., 1999, 40(11), 2622-6). Соединения, демонстрирующие связывающую активность EP4-рецептора описаны, например, в WO 98/55468, WO 00/18744, WO 00/03980, WO 00/15608, WO 0016760, WO 00/21532, EP 0855389, EP 0985663, WO 02/50031, WO 02/50032, WO 02/50033, WO 02/064564, WO 03/103604, WO 03/077910, WO 03/086371, WO 04/037813, WO 04/067524, WO 04/085430, US 2004142969, WO 05/021508, WO 05/105733,WO 05/105732, WO 05/080367, WO 05/037812, WO 05/116010 и WO 06/122403.-1 015931 Производные индопрофена, такие как натриевая соль [4-(1-оксо-1,3-дигидро-2H-бензо[f]изоиндол 2-ил)фенил]-2-пропионовой кислоты, описаны Rufer и др. в Eur. J. Med. Chem. Chimica Therapeutica,1978, 13, 193. Настоящее изобретение касается соединения формулы (I) и/или его фармацевтически приемлемых производных где R1 обозначает атом галогена или C1-4 алкил;R2 обозначает C1-4 алкил или атом хлора;R3 обозначает H, C1-4 алкил или атом галогена;R5, каждый независимо, обозначает атом галогена или C1-4 алкил;R2 обозначает C1-4 алкил или атом хлора;R3 обозначает H, C1-4 алкил или атом галогена;R5, каждый независимо, обозначает атом галогена или C1-4 алкил;X обозначает O или NH; при условии что, если n равно 2 и R5 обозначает атом галогена, группы R5 вместе с фенильной группой, к которой они присоединены, не образуют 2,3-дифторфенильный фрагмент. В одном варианте данного изобретения R1 обозначает атом галогена, например хлора. В другом варианте изобретения R1 присоединен по C(2) положению фенильного кольца и обозначает атом хлора. Еще в одном варианте изобретения R1 присоединен по C(3) положению фенильного кольца и обозначает атом хлора. Еще в одном варианте R1 обозначает метил. Еще в одном варианте R1 обозначает метил и присоединен по C(3) положению фенильного кольца. В другом варианте R1 обозначает атом фтора. В другом варианте R1 обозначает атом фтора и присоединен по C(3) положению фенильного кольца. В одном варианте R2 обозначает атом хлора. В одном варианте изобретения R2 обозначает C1-4 алкил. Еще в одном варианте R2 обозначает метил. В одном варианте изобретения R3 обозначает H. В другом варианте изобретения R3 обозначает атом фтора. В одном варианте изобретения R5 обозначает атом хлора или фтора. В другом варианте изобретения 5R обозначает атом хлора. Еще в одном варианте изобретения R5 обозначает атом фтора. В одном варианте изобретения R5 обозначает C1-4 алкил. Еще в одном варианте R5 обозначает метил. В другом варианте R5 находится в C(3) положении фенильного кольца относительно -CH2COOH. Еще в одном вариантеR5 обозначает метил в C(3) положении фенильного кольца относительно -CH2COOH. В одном варианте изобретения m равно 0. В одном варианте изобретения m равно 1. В одном варианте изобретения n равно 0. В одном варианте изобретения n равно 1. В одном варианте изобретения n равно 2. В другом варианте изобретения n равно 2, один R5 обозначает атом фтора и другой обозначает атом хлора или фтора. В одном варианте изобретения X обозначает O. В другом варианте изобретения X обозначает NH. В одном варианте изобретенияR1 обозначает атом хлора в C(3) положении фенильного кольца;R5 обозначает метил в C(3) положении фенильного кольца относительно -CH2COOH;X обозначает O. В другом варианте изобретения получают соединение формулы (I), выбранное из группы, включающей следующие соединения:(4-[(6-хлор-2-фтор-3-[(3-метилфенил)метил]оксифенил)карбонил]амино-3-фторфенил)уксусная кислота и/или их фармацевтически приемлемые производные. Настоящее изобретение охватывает все комбинации описанных здесь вариантов. Используемый здесь термин C1-4 алкил включает линейные и разветвленные алкильные группы,содержащие от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил и изобутил. Используемый здесь термин галоген обозначает фтор (или фторо), хлор (или хлоро), бром (или бромо) или йод (или йодо). Под фармацевтически приемлемым производным понимают любую фармацевтически приемлемую соль, или сложный эфир, или соль такого сложного эфира соединения формулы (I), или любое другое соединение, которое после введения реципиенту способно обеспечить (прямо или опосредованно) соединение формулы (I) или его активный метаболит или остаток. Понятно, что для фармацевтического применения рассмотренные выше соли являются фармацевтически приемлемыми солями, но и другие соли могут найти применение, например при получении соединений формулы (I) и их фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают соли, описанные Berge, Bighley и Monkhouse, J.Pharm. Sex., 1977, 66, 1-19. Выражение "фармацевтически приемлемые соли" относится к солям, получаемым из фармацевтически приемлемых оснований, включающих неорганические основания и органи-4 015931 ческие основания. Соли, производные неорганических оснований, включают соли алюминия, аммония,кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия, цинка и подобные. Соли, производные фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов; причем замещенные амины включают встречающиеся в природе замещенные амины; и циклических аминов. Конкретные фармацевтически приемлемые органические основания включают аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин,2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин,морфолин, пиперазин, пиперидин, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трис(гидроксиметил)аминометан и др. Соли также можно получать из основных ионообменных смол, например полиаминных смол. Признано, что соединения формулы (I) могут высвобождаться in vivo при метаболизме подходящего пролекарства. Такие пролекарства могут представлять собой, например, физиологически приемлемые метаболически лабильные сложные эфиры соединений формулы (I). Они могут образовываться при этерификации карбоксильной группы в исходном соединении формулы (I) при предварительном введении защиты, если целесообразно, любых других реакционноспособных групп, присутствующих в молекуле, с последующим удалением защиты, если необходимо. Примеры таких метаболически лабильных сложных эфиров включают C1-4 алкиловые сложные эфиры, например метиловые, этиловые или трет-бутиловые сложные эфиры, C3-6 алкениловые сложные эфиры, например аллиловые сложные эфиры, замещенные или незамещенные аминоалкиловые сложные эфиры (например, аминоэтиловый, 2-(N,Nдиэтиламино)этиловый или 2-(4-морфолино)этиловый сложный эфир) или ацилоксиалкиловые сложные эфиры, такие как ацилоксиметиловый или 1-ацилоксиэтиловый, например пивалоилоксиметиловый, 1 пивалоилоксиэтиловый, ацетоксиметиловый, 1-ацетоксиэтиловый, 1-(1-метокси-1-метил)этилкарбонилоксиэтиловый, 1-бензоилоксиэтиловый, изопропоксикарбонилоксиметиловый, 1-изопропоксикарбонилоксиэтиловый, циклогексилкарбонилоксиметиловый, 1-циклогексилкарбонилоксиэтиловый эфир, циклогексилоксикарбонилоксиметиловый, 1-циклогексилоксикарбонилоксиэтиловый, 1-(4-тетрагидропиранилокси)карбонилоксиэтиловый или 1-(4-тетрагидропиранил)карбонилоксиэтиловый. Понятно, что настоящее изобретение включает все изомеры соединения формулы (I) и их фармацевтически приемлемые производные, в том числе все геометрические, таутомерные и оптические формы и их смеси (например, рацемические смеси). Так как соединения формулы (I) предполагаются для использования в фармацевтических композициях, понятно, что все они получаются, по существу, в чистом виде, например, по меньшей мере с 50% степенью чистоты, в более подходящем варианте по меньшей мере с 75% степенью чистоты и предпочтительно по меньшей мере с 95% степенью чистоты (% рассчитывают на основании массы, % мас./мас.). Неочищенные препараты соединений формулы (I) можно использовать для получения более чистых форм, применяемых в фармацевтических композициях. Хотя чистота промежуточных соединений по настоящему изобретению является менее критичной, легко понять, что, по существу, чистая форма является предпочтительной в отношении соединений формулы (I). Когда возможно, предпочтительно получать соединения по настоящему изобретению в кристаллическом виде. При проведении кристаллизации или перекристаллизации некоторых из соединений по данному изобретению из органических растворителей в кристаллическом продукте может присутствовать растворитель кристаллизации. Данное изобретение включает в свою область такие сольваты, в том числе сольваты свободных кислот и сольваты солей, полученных из свободных кислот. Аналогично, некоторые из соединений по данному изобретению можно кристаллизовать или перекристаллизовывать из растворителей, содержащих воду. В таких случаях может образовываться гидратационная вода. Данное изобретение включает в свою область стехиометрические гидраты, а также соединения, содержащие переменные количества воды, которые могут образовываться в ходе таких процессов, как лиофилизация. Кроме того,разные условия кристаллизации могут приводить к образованию различных полиморфных форм кристаллических продуктов. Данное изобретение включает в свою область все полиморфные формы соединений формулы (I). Настоящее изобретение также включает в свой объем все изотопно-меченые соединения формулы(I). Такие соединения идентичны соединениям, перечисленным выше, за исключением того, что один или более атомов в них замещены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть включены в соединения формулы (I), и их фармацевтически приемлемые соли включают изотопы водорода, углерода, азота, кислорода, хлора и фтора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 17O,18O, 36Cl и 18F. Изотопно-меченые соединения формулы (I), например соединения, в которые включены радиоактивные изотопы, такие как 3H, 14C, пригодны для исследований распределения лекарственного средства и/или субстрата в тканях. Меченные тритием, т.е. 3H, и углеродом-14, т.е. 14C, изотопы являются особо предпочтительными, благодаря простоте их получения и детектируемости. Изотопы 11C и 18F особенно-5 015931 полезны для PET (позитронной эмиссионной томографии) и пригодны для получения изображения головного мозга. Дополнительное замещение более тяжелыми изотопами, например дейтерием, т.е. 2H,может обеспечить определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например увеличенный период полураспада in vivo или требование меньшей дозы и, следовательно, в некоторых обстоятельствах может быть предпочтительным. Изотопно-меченые соединения формулы (I) можно получать, осуществляя синтетические методики, раскрытые на приведенных ниже схемах и/или в примерах при замене не меченного изотопами реагента легко доступным изотопно-меченым реагентом. Соединения формулы (I) являются агонистами EP4-рецепторов и, следовательно, могут быть полезны при лечении заболеваний, опосредованных EP4-рецепторами. Эти заболевания включают заболевания, опосредованные действием или ослаблением действия PGE2 на EP4-рецепторах. В частности, соединения формулы (I) могут быть полезны при лечении боли, например хронической суставной боли (например, ревматоидного артрита, остеоартрита, ревматоидного спондилита, подагрического артрита и ювенильного артрита), в том числе для модификации состояния заболевания и сохранении строения суставов; скелетно-мышечной боли; для уменьшения боли в спине и шее; при вывихах и растяжениях; при невропатической боли; симпатической постоянной боли; миозите; боли, связанной с раковым заболеванием и фибромиалгией; боли, связанной с мигренью; боли, связанной с гриппом или другими вирусными инфекциями, такими как общая простуда; ревматическая атака; боли, связанной с функциональными кишечными нарушениями, такими как неязвенная диспепсия, несердечная боль в грудной клетке и синдром раздраженного кишечника; боли, связанной с ишемией миокарда; послеоперационной боли; головной боли; зубной боли и дисменореи. Соединения формулы (I) могут быть особенно полезны при лечении невропатической боли и связанных с ней симптомов. Симптомы невропатической боли включают диабетическую невропатию; ишиас; неспецифическую боль в нижней части спины; боль при рассеянном склерозе; фибромиалгию; ВИЧсвязанную невропатию; постгерпетическую невралгию; тригеминальную невралгию и боль в результате физической травмы, ампутации, рака, действия токсинов или хронических воспалительных состояний. Симптомы невропатической боли включают спонтанный приступ внезапной и острой боли или продолжительную жгучую боль. Кроме того, включена боль, связанная с обычно неболевыми ощущениями,такими как "покалывания" (параэстезия и дизестезия), повышенная чувствительность к прикосновениям(гиперэстезия), болевое ощущение с последующим безвредным раздражением (динамическая, статическая или тепловая аллодиния), повышенная чувствительность к ядовитым раздражителям (тепловая, холодовая, механическая гипералгезия), продолжающееся болевое ощущение после удаления раздражения(гиперпатия) или отсутствие или дефицит селективных сенсорных проводящих путей (гипоалгезия). Соединения формулы (I) могут также быть полезны при лечении воспаления, например при лечении кожных состояний (например, солнечных ожогов, ожогов, экземы, дерматита, псориаза); глазных заболеваний, таких как глаукома, ретинит, ретинопатии, увеит и острого поражения глазной ткани (например, конъюнктивита); легочных заболеваний (например, астмы, бронхита, эмфиземы, аллергического ринита, респираторного дистресс-синдрома, заболевания голубеводов, легочного заболевания фермера,хронического обструктивного заболевания легких (COPD); заболеваний желудочно-кишечного тракта(например, афтозной язвы, болезни Крона, атопического гастрита, вариолиформного гастрита, язвенного колита, болезни брюшной полости, гранулематозной болезни, синдрома раздраженного кишечника, воспалительного заболевания кишечника, желудочно-кишечного рефлюкса, диареи, запора); при трансплантации органов; при других состояниях с воспалительным компонентом, таких как сосудистое заболевание, мигрень, нодозный периартериит, тиреоидит, апластическая анемия, болезнь Ходжкина, склеродома, бульбоспинальный паралич, рассеянный склероз, соркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, ишемия миокарда, лихорадка, системная красная волчанка, тендинит, бурсит и синдром Шегрена. Соединения формулы (I) могут также быть полезны при лечении иммунологических заболеваний,таких как аутоиммунные заболевания, иммунологически дефицитных заболеваний или при трансплантации органов. Соединения формулы (I) могут также быть эффективны для повышения латентности ВИЧинфекций. Соединения формулы (I) могут также быть полезны при лечении заболеваний с чрезмерной или нежелательной активацией тромбоцитов, таких как перемежающаяся хромота, нестабильная стенокардия,удар и острый коронарный синдром (например, окклюзионные сосудистые заболевания). Соединения формулы (I) могут также быть полезны в качестве лекарственных средств с диуретическим действием или могут быть полезны для лечения синдрома сверхактивного мочевого пузыря. Соединения формулы (I) могут также быть полезны при лечении импотенции или эректильной дисфункции. Соединения формулы (I) могут также быть полезны при лечении болезни костей, таких как остеопороз (в особенности, постклимактерический остеопороз), гиперкальцемия, гиперпаратиреоз, заболевания костей Паджета, остеолиз, гиперкальцемия злокачественности с метастазами в кости или без таковых, ревматоидный артрит, периодонтит, остеоартрит, остеодиния, остеопения, калькулез, образование-6 015931 камней или песка (в особенности, мочекаменная болезнь), подагра и анкилозирующий спондилит, тендинит и бурсит. Соединения формулы (I) могут также быть полезны для реконструкции костей, и/или способствования генерации костной ткани, и/или способствования излечению переломов. Соединения формулы (I) могут также быть полезны для ослабления гемодинамических побочных эффектов НПВП и ингибиторов COX-2. Соединения формулы (I) могут также быть полезны при лечении сердечно-сосудистых заболеваний,таких как гипертензия или ишемия миокарда; функциональной или органической венозной недостаточности; варикозной терапии; геморроя и шоковых состояний, связанных с заметным понижением артериального давления (например, септического шока). Соединения формулы (I) могут также быть полезны при лечении нейродегенеративных заболеваний и нейродегенерации, например деменции, в частности дегенеративной деменции (в том числе старческого слабоумия, болезни Альцгеймера, болезни Пика, хореи Хантингтона, болезни Паркинсона и болезни Крейтцфельдта-Якоба, бокового амиотрофического склероза (ALS), заболевания двигательных нейронов); сосудистой деменции (в том числе мультиинфарктной деменции); а также деменции, связанной с поражениями, захватывающими внутричерепное пространство; травмами; инфекциями и родственными состояниями (в том числе ВИЧ-инфекциями); метаболизмом; токсинами; аноксией и дефицитом витаминов; и небольшого когнитивного нарушения, связанного со старением, в частности, возрастного ухудшения памяти. Соединения формулы (I) также могут быть полезны при лечении неврологических нарушений и в качестве нейрозащитных средств. Соединения по изобретению также могут быть полезны при лечении нейродегенерации после припадка, остановки сердца, легочного шунтирования, травматического поражения головного мозга, поражения спинного мозга или др. Соединения формулы (I) также могут быть полезны при лечении осложнений диабета типа 1 (например, диабетической микроангиопатии, диабетической ретинопатии, диабетической нефропатии, мышечной дегенерации, глаукомы), нефротического синдрома, апластической анемии, увеита, болезни Кавасаки и саркоидоза. Соединения формулы (I) могут также быть полезны при лечении дисфункции почек (нефрита, в частности мезангиального пролиферативного гломерулонефрита, нефритного синдрома), дисфункции печени (гепатита, цирроза) и желудочно-кишечной дисфункции (диареи). Понятно, что любое используемое здесь упоминание лечения включает и лечение установленных симптомов, и профилактическую обработку. Согласно еще одному варианту изобретения получают соединение формулы (I) или его фармацевтически приемлемое производное для применения в терапии человека или ветеринарии. Согласно другому варианту изобретения получают соединение формулы (I) или его фармацевтически приемлемое производное для применения при лечении состояния, которое опосредовано действием или ослаблением действия PGE2 на EP4-рецепторах. Согласно еще одному варианту изобретения обеспечен способ лечения пациента-человека или животного, страдающего от состояния, которое опосредовано действием или ослаблением действия PGE2 наEP4-рецепторах, который включает введение указанному субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемого производного. Согласно еще одному варианту изобретения обеспечен способ лечения пациента-человека или животного, страдающего от боли или воспалительного, иммунологического, костного, нейродегенеративного или почечного нарушения, причем указанный способ включает введение указанному субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемого производного. Согласно другому варианту изобретения обеспечено применение соединения формулы (I) или его фармацевтически приемлемого производного с целью производства лекарственного средства для лечения состояния, которое опосредовано действием или ослаблением действия PGE2 на EP4-рецепторах. Согласно другому варианту изобретения обеспечено применение соединения формулы (I) или его фармацевтически приемлемого производного с целью производства лекарственного средства для лечения или предупреждения такого состояния как боль или воспалительного, иммунологического, костного,нейродегенеративного или почечного нарушения. Соединения формулы (I) и их фармацевтически приемлемые производные обычно вводят в виде фармацевтических композиций. Такие композиции удобно представлять для обычного применения в виде смеси с одним или несколькими физиологически приемлемыми носителями или разбавителями. Таким образом, другой аспект изобретения касается фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемое производное, адаптированное для применения при лечении человека или в ветеринарии. При том что возможно вводить соединения формулы (I) или их фармацевтически приемлемые производные в виде химического вещества без дополнительной обработки, предпочтительно представлять их в виде фармацевтического препарата. Препараты по настоящему изобретению содержат соединения формулы (I) или их фармацевтически приемлемые производные вместе с одним или несколькими прием-7 015931 лемыми носителями или разбавителями и необязательно другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и невредным для реципиента. Таким образом, в одном варианте изобретение касается фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемое производное и его фармацевтически приемлемый носитель или разбавитель. Препараты включают носители и разбавители, подходящие для перорального, парентерального введения (в том числе подкожного, например, посредством инъекции или таблетки-депо, интрадермального, интратекального, внутримышечного, например, депо и внутривенного), ректального и наружного введения (в том числе кожного, буккального и подъязычного), хотя наиболее подходящий способ может зависеть, например, от состояния и нарушения реципиента. Препараты можно удобно представить в виде стандартной дозированной формы и можно приготовить любым из способов, хорошо известных в области фармацевтики (см., например, способы, раскрытые в работе Remington - The Science and Practice ofPharmacy, 21st Edition, Lippincott, WilliamsWilkins, USA, 2005 и ссылках к ней). Все способы включают стадию объединения соединения формулы (I) или его фармацевтически приемлемой аддитивной соли кислоты ("активный ингредиент") с носителем, который состоит из одного или нескольких дополнительных ингредиентов. Вообще, препараты получают посредством однородного и тщательного объединения активного ингредиента с жидкими носителями, или высокодисперсными твердыми носителями, или теми и другими и, если необходимо, последующего формования продукта в виде желательного препарата. Препараты по настоящему изобретению, подходящие для перорального введения, можно представить в виде дискретных единиц, таких как капсулы, облатки или таблетки (например, жевательные таблетки, в частности для педиатрического применения), каждая из которых содержит предварительно определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа масло в воде или жидкой эмульсии типа вода в масле. Активный ингредиент можно также представить в виде болюса, электуария или пасты. Таблетку можно получить прессованием или формованием необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно приготовить прессованием на подходящей пресс-машине активного ингредиента в свободнотекущем состоянии, например порошка или гранул, необязательно в смеси со связующим, смазывающим агентом, инертным разбавителем, смазывающим, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно приготовить формованием на подходящем станке смеси порошкового соединения, увлажненного инертным жидким разбавителем. На таблетки можно, необязательно, нанести покрытие или бороздки, и они могут быть составлены таким образом, чтобы обеспечить медленное или регулируемое высвобождение активного ингредиента. Препараты для парентерального введения включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические агенты и растворимые вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые включают суспендирующие агенты и загустители. Препараты можно представить в виде контейнеров с одной дозой или в виде многодозовых контейнеров,например закупоренных ампул и пробирок, и можно хранить в высушенном замораживанием состоянии(лиофилизованном), требующем лишь добавления непосредственно перед применением стерильного жидкого носителя, например воды для инъекций. Приготовленные по индивидуальному рецепту растворы и суспензии для инъекций можно получать из стерильных порошков, гранул и таблеток типа описанных ранее. Препараты для ректального введения можно представить в виде суппозитория с обычными носителями, такими как масло какао, твердый жир или полиэтиленгликоль. Препараты для местного применения в полости рта, например буккального или подъязычного,включают лепешки, содержащие активный ингредиент в ароматной основе, такой как сахароза и аравийская камедь или трагакант, и пастилки, содержащие активный ингредиент в такой основе, как желатин и глицерин, или сахароза и аравийская камедь. Соединения формулы (I) можно также приготовить как препараты-депо. Такие препараты длительного действия можно вводить посредством имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Таким образом, соединения формулы (I) можно приготовить, например, с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле), или ионообменными смолами, или умеренно растворимыми производными, например в виде умеренно растворимой соли. Кроме отдельно упоминаемых выше ингредиентов препараты могут включать другие агенты,обычные в данной области, имеющие отношение к рассматриваемому типу препарата, например препараты, подходящие для перорального введения, могут включать вкусовые агенты. Соединения формулы (I) можно применять в комбинации с другими терапевтическими агентами,например ингибиторами COX-2, такими как селекоксиб, рофекоксиб, вальдекоксиб или парекоксиб; ин-8 015931 гибиторы 5-липоксигеназы; аналгетики, такие как парацетамол; НПВП, такие как диклофенак, индометацин, набуметон, напроксен или ибупрофен; антагонисты лейкотриеновых рецепторов; модифицирующими болезнь антиревматическими препаратами (DMARD), такими как метотрексат; блокаторами натриевых каналов, такими как ламотригин; блокаторами кальциевых каналов N-типа; модуляторамиNMDA-рецепторов, такими как антагонисты глициновых рецепторов; габапентином, прегабалином и родственными соединениями; трициклическими антидепрессантами, такими как амитриптилин; антиэпилептическими лекарственными средствами, стабилизирующими нейроны; ингибиторами моноаминергического захвата, такими как венлафаксин; опиоидными аналгетиками; местными анестетиками; 5HT1-агонистами, такими как триптаны, например суматриптан, наратриптан, золмитриптан, элетриптан,фроватриптан, альмотриптан или ризатриптан; лигандами EP1-рецепторов; лигандами EP2-рецепторов; лигандами EP3-рецепторов; EP1-антагонистами; EP2-антагонистами и EP3-антагонистами; агонистами каннабиноидных рецепторов; VR1-антагонистами. Если соединения применяют в комбинации с другими терапевтическими агентами, то соединения можно вводить либо последовательно, либо одновременно любым удобным способом. Таким образом, еще в одном варианте изобретение касается комбинации, содержащей соединение формулы (I) или его фармацевтически приемлемое производное вместе с дополнительным терапевтическим агентом или агентами. Еще в одном варианте изобретения получают комбинацию, содержащую агонист EP4-рецептора формулы (I) или его фармацевтически приемлемое производное и парацетамол. Упоминаемые выше комбинации можно удобно представить для применения в виде фармацевтического препарата и, таким образом, фармацевтические препараты, содержащие комбинацию, которая определена выше, вместе с фармацевтически приемлемым носителем или разбавителем, составляют дополнительный аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить либо последовательно, либо одновременно в виде отдельных или комбинированных фармацевтических препаратов. Если соединение формулы (I) или его фармацевтически приемлемое производное используют в комбинации со вторым терапевтическим агентом, активным относительно того же заболевания, то доза каждого соединения может отличаться от дозы этого соединения, используемого отдельно. Специалист в данной области легко оценит подходящие дозы. Один вариант изобретения касается способа лечения пациента-человека или животного, страдающего от состояния, которое опосредовано действием или ослаблением действия PGE2 на EP4-рецепторах,который включает введение указанному субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемого производного и парацетамола. Предлагаемая дневная доза соединений формулы (I) или их фармацевтически приемлемых солей для лечения человека составляет от 0,001 до 30 мг/кг массы тела в день и более конкретно от 0,1 до 3 мг/кг массы тела в день в расчете на свободную кислоту, которые можно вводить в виде одной дозы или поделенных доз, например от одного до четырех раз в день. Диапазон доз для взрослых людей обычно составляет от 0,1 до 1000 мг/день, например от 10 до 800 мг/день, предпочтительно от 10 до 200 мг/день в расчете на свободную кислоту. Подходящая дневная доза парацетамола составляет до 4000 мг в день. Подходящие стандартные дозы включают 200, 400, 500 и 1000 мг один, два, три или четыре раза в день. Определение точного количества соединений формулы (I), вводимых реципиенту, в частности пациенту-человеку, является обязанностью лечащего врача. Однако применяемая доза зависит от ряда факторов, в том числе возраста и пола пациента, подлежащего лечению, конкретного состояния и его тяжести, способа введения и возможной комбинационной терапии, которая может применяться. Настоящее изобретение касается способа получения соединений формулы (I) и их фармацевтически приемлемых производных. Таким образом, один вариант касается способа получения соединения формулы (I) или его фармацевтически приемлемого производного, причем указанный способ включает взаимодействие соединения формулы (II) где R1, R2, R3, R4, R5, m, n и X такие, как определено в формуле (I), и R обозначает подходящую алкильную группу в сложноэфирной защитной группе, такую как метильная, этильная или бензильная группа, с водным раствором кислоты и в случае необходимости последующее образование фармацевтически приемлемого производного полученного таким образом соединения. Подходящей кислотой является 2 н. соляная кислота. Упоминаемое выше взаимодействие с вовле-9 015931 чением соединения формулы (II) и кислоты можно удобно проводить в растворителе, таком как уксусная кислота, при повышенной температуре, например 90C. Еще один вариант изобретения касается способа получения соединения формулы (I) или его фармацевтически приемлемого производного, причем указанный способ включает взаимодействие соединения формулы (II) где R1, R2, R3, R4, R5, m, n и X такие, как определено в формуле (I), и R обозначает подходящую алкильную группу в сложноэфирной защитной группе, такую как метильная, этильная или бензильная группа, с основанием и в случае необходимости последующее образование фармацевтически приемлемого производного полученного таким образом соединения. Подходящие основания включают гидроксид натрия и гидроксид лития. Указанное выше взаимодействие, в которое вовлечено соединение (II) и основание, можно удобно проводить в растворителе или смеси растворителей, например метанол/вода, этанол/вода или 1,4-диоксан/вода. Взаимодействие можно проводить при температуре окружающей среды или повышенной. Соединения формулы (II), где X обозначает O или NH, можно получать согласно приведенной ниже схеме 1. Схема 1 на которой R1, R2, R3, R4, R5, m, n и X являются такими, как определено в формуле (I), и R обозначает подходящую алкильную группу в сложноэфирной защитной группе, такую как метильная, этильная или бензильная группа. Соединения формулы (II) можно получать из соединений формул (C) и (D), применяя амидный связывающий реагент, такой как дициклогексилкарбодиимид или N-(3-диметиламинопропил)-N'этилкарбодиимид гидрохлорид. Взаимодействие удобно проводить в растворителе, таком как дихлорметан, с основанием или без него, например триэтиламином, и при температуре окружающей среды или повышенной. Альтернативно, соединения формулы (II) можно получать из соединений формулы (C) по двухстадийной методике, согласно которой сначала проводят преобразование соединения формулы (C) в хлорангидрид кислоты. Это преобразование удобно осуществлять, обрабатывая соединение формулы (C) таким реагентом как тионилхлорид или оксалилхлорид, при температуре окружающей среды или повышенной и необязательно в присутствии субстехиометрического количества диметилформамида. После удаления избытка реагента выпариванием и, если необходимо, азеотропной перегонки с толуолом, сырой хлорангидрид кислоты обрабатывают соединением формулы (D), обычно в растворителе, таком как дихлорметан, в присутствии основания, такого как пиридин или триэтиламин, и при температуре окружающей среды или повышенной. Соединения формулы (D) являются коммерчески доступными или их можно получать согласно способам, известным в данной области. Например, этил-(4-аминофенил)ацетат доступен от LancasterSynthesis. Соединения формулы (C) можно удобно получать, обрабатывая соединение формулы (B) основанием, таким как гидроксид лития. Взаимодействие можно удобно проводить в смеси растворителей, такой как смесь 1,4-диоксан/вода, и при температуре окружающей среды или повышенной, например 60C. Соединения формулы (B) можно получать, обрабатывая соединение формулы (A) бензилирующим агентом, таким как бензилгалогенид. Взаимодействие удобно проводить в растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, и при температуре окружающей среды или повышенной, например 60C. Соединения формулы (A) являются коммерчески доступными или их можно получать согласно способам, известным в данной области. Например, 2-хлор-5-гидроксибензойная кислота доступа от ApinChemicals Ltd., UK. Соединения формулы (II), в которых X обозначает NH, можно также получать согласно приведенной ниже схеме 2: Схема 2 на которой R1, R2, R3, R4, R5, m и n являются такими, как определено в формуле (I), и R обозначает подходящую алкильную группу в сложноэфирной защитной группе, такую как метильная, этильная или бензильная группа. Соединения формулы (II) можно получать, обрабатывая соединение формулы (G) бензилирующим агентом, таким как бензилгалогенид. Взаимодействие удобно проводить в растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, и при температуре окружающей среды или повышенной. Альтернативно, соединения формулы (II) можно получать, обрабатывая соединение формулы (G) альдегидом в присутствии восстановителя, такого как триацетоксиборгидрид натрия, и в растворителе,таком как дихлорметан или дихлорэтан. Взаимодействие обычно проводят при низкой температуре или температуре окружающей среды и в присутствии (или в отсутствие) каталитических количеств кислоты,например уксусной кислоты. Соединения формулы (G) можно получать восстановлением соединения формулы (F) смесью железного порошка и уксусной кислоты в растворителе, таком как этанол. Взаимодействие обычно проводят при повышенной температуре, например 80C. Соединения формулы (F) можно получать из соединений формулы (E) по двухстадийной методике,согласно которой сначала проводят преобразование соединения формулы (E) в хлорангидрид кислоты. Это преобразование удобно осуществлять, обрабатывая соединение формулы (E) таким реагентом, как тионилхлорид или оксалилхлорид, при температуре окружающей среды или повышенной и в присутствии или в отсутствие субстехиометрических количеств диметилформамида. После удаления избытка реагента выпариванием и, если необходимо, азеотропной перегонки с толуолом сырой хлорангидрид кислоты обрабатывают соединением формулы (D) обычно в растворителе, таком как дихлорметан, в присутствии основания, такого как пиридин или триэтиламин, и при температуре окружающей среды или повышенной. Соединения формулы (E) являются коммерчески доступными или их можно получать согласно способам, известным в данной области. Например, 2-хлор-5-нитробензойная кислота доступна от ApolloScientific. Соединения формулы (II), в которых X обозначает O, можно также получать согласно приведенной ниже схеме 3: на которой R1, R2, R3, R4, R5, m и n являются такими, как определено в формуле (I), R обозначает подходящую алкильную группу в сложноэфирной защитной группе, такую как метильная, этильная или бензильная группа. Соединения формулы (II) можно получать, обрабатывая соединение формулы (K) бензилирующим агентом, таким как бензилгалогенид. Взаимодействие удобно проводить в растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, и при температуре окружающей среды или повышенной. Соединения формулы (K) можно получать, обрабатывая соединение формулы (J) таким реагентом,как трибромид бора, в таком растворителе, как дихлорметан, и при пониженной температуре, например от -78 до 0C. Соединения формулы (J) можно получать из соединений формулы (I) по двухстадийной методике,согласно которой сначала проводят преобразование соединения формулы (I) в хлорангидрид кислоты. Это преобразование удобно проводить, обрабатывая соединение формулы (I) таким реагентом, как тионилхлорид или оксалил хлорид, при температуре окружающей среды или повышенной и в присутствии или в отсутствие субстехиометрических количеств диметилформамида. После удаления избытка реагента выпариванием и, если необходимо, азеотропной перегонки с толуолом сырой хлорангидрид кислоты обрабатывают соединением формулы (D) обычно в растворителе, таком как дихлорметан, в присутствии основания, такого как пиридин или триэтиламин, и при температуре окружающей среды или повышенной. Соединения формулы (I) можно получать, обрабатывая соединение формулы (H) металлоорганическим реагентом, таким как н-бутиллитий, а затем твердым диоксидом углерода. Взаимодействие можно удобно проводить в растворителе, таком как тетрагидрофуран, и при температуре от низкой (например, -78C) до температуры окружающей среды. Соединения формулы (H) являются коммерчески доступными или их можно получать согласно способам, известным в данной области. Например, 4-хлор-2-фтор-1-(метилокси)бензол доступен отSigma-Aldrich. Следующие примеры иллюстрируют получение соединений формулы (I). Примеры показывают получение промежуточных продуктов ("промежуточные соединения") и соединений формулы (I) ("примеры"). Исходный материал для получения промежуточных продуктов необязательно может быть получен из рассматриваемой партии, если не указано специально. Промежуточные соединения для получения примеров необязательно могут быть получены из рассматриваемой партии, если не указано специально.NaOH - гидроксид натрия. Аналитическая методика. Для ЖХ/МС данных применяют 5-минутный метод, если не указано по-другому. ЖХ/МС - 5-минутный метод. Оборудование: градиентный насос Agilent 1100; автосемплер Agilent 1100; цифровой детектор фона Agilent 1100; дегазатор Agilent 1100; печь Agilent 1100; регулятор Agilent 1100; масс-спектрометр Waters ZQ или масс-спектрометр Waters ZMD;Waters MassLynx версия 4.0 SP2. Колонка: используют колонку Waters Atlantis со следующими измерениями: 4,6 мм 50 мм. Размер частиц стационарной фазы 3 мкм. Растворители: В указанном выше способе скорость потока составляет 3 мл/мин; объем инъекции для общего способа составляет 5 мкл; температура колонки составляет 30 С; диапазон УФ-детектора составляет от 220 до 330 нм. Все времена удерживания измеряют в минутах. ЖХ/МС - 2-минутный метод. Оборудование: система управления бинарным растворителем Waters Acquity; система управления образцами Waters Acquity; персональное информационное устройство Waters Acquity; масс-спектрометр Waters ZQ;Acquity UP ЖХ ВЕН C18 1,7 мкм 2,1 мм 50 мм. Температуру колоночной печи устанавливают 40C. Растворители:B: органический растворитель = MeCN:вода = 95:5 + 0,05% муравьиная кислота; слабый растворитель для промывания = MeOH:вода = 50:50; сильный растворитель для промывания = MeOH. Инструментальные установки. Объем инъекции: 0,5 мкл. Техника инъекции: заливка с частичным заполнением петли. Слабый раствор для промывания: 500 мкл. Сильный раствор для промывания: 500 мкл. УФ-детектирование: от 220 до 330 нм. Скорость УФ-сканирования: 40 точек/с. МС-диапазон сканирования: от 100 до 1000 а.м.е. МС-скорость сканирования: 0,2 с сканирование с 0,1 с задержкой между сканированиями. МС-функция сканирования: электроспрей-ионизация с автоматическим включением мониторинга положительных-отрицательных ионов. Время цикла: 2 мин и 30 с. Градиент. ЯМР. Спектры 1H ЯМР регистрировали на ЯМР-спектрометре Bruker AVANCE 400 ЯМР или ЯМРспектрометре Bruker DPX250. Химические сдвиги выражены в миллионных долях (м.д.,единиц). Константы взаимодействия (J) выражены в герцах (Гц). Картины расщепления описывают видимые мультиплеты и обозначаются как с (синглет), д (дублет), т (триплет), кв (квартет), дд (дублет дублетов), дт (дублет триплетов), м (мультиплет), ш. (широкий сигнал). Методики очистки. Очистку соединений примеров можно проводить общеизвестными способами, такими как хроматография и/или перекристаллизация, используя подходящие растворители. Хроматографические способы включают колоночную хроматографию, флэш-хроматографию, ВЭЖХ (высокоэффективную жидкостную хроматографию), СЖХ (сверхкритическую жидкостную хроматографию), SCX (хроматографию на сильном катионообменнике) и MDAP (масс-направленное автополучение). Используемый здесь термин "Biotage" относится к коммерчески доступным предварительно упакованным силикагельным картриджам. Масс-направленное автополучение (MDAP). Колонка:Waters Atlantis: 19 мм 100 мм (малый масштаб) и 30 мм 100 мм (большой масштаб). Размер частиц стационарной фазы 5 мкм. Растворители:B: органический растворитель = ацетонитрил + 0,1% муравьиная кислота; составной растворитель = метанол:вода = 80:20; растворитель для ополаскивания игл = метанол. Способы. Применяют пять способов в зависимости от аналитического времени удерживания интересующего соединения:- 14015931 Скорость потока: 20 мл/мин (малый масштаб) или 40 мл/мин (большой масштаб). Примеры Промежуточное соединение 1. (3-Хлорфенил)метил 2-хлор-5-[(3-хлорфенил)метил]оксибензоат. К смеси 2-хлор-5-гидроксибензойной кислоты (500 мг, 2,9 ммоль) в ДМФА (20 мл) добавляют карбонат калия (1,0 г, 7,3 ммоль, 2,5 экв.) и 3-хлорбензилбромид (0,8 мл, 6,1 ммоль, 2,1 экв.). Смесь нагревают при 60C в течение 2,5 ч. После охлаждения смесь разбавляют этилацетатом (300 мл) и промывают водой (2100 мл), а затем насыщенным раствором соли (70 мл). Органический слой сушат и выпаривают в вакууме. Остаток очищают методом колоночной хроматографии (Biotage SP4, колонка с силикагелем,100 г), элюируя 0-30% этилацетатом в гексане и получая указанное в заголовке соединение в виде прозрачного масла (1,16 г). Раствор (3-хлорфенил)метил 2-хлор-5-[(3-хлорфенил)метил]оксибензоата (970 мг, 2,3 ммоль) в диоксане (30 мл) и воде (15 мл) обрабатывают гидроксидом лития (моногидрат) (145 мг, 3,5 ммоль, 1,5 экв.). Результирующую смесь перемешивают при комнатной температуре в течение 2 ч. Затем растворитель выпаривают в вакууме, остаток переносят в воду (50 мл) и промывают эфиром (100 мл). Затем водный слой подкисляют 2 М HCl, экстрагируют эфиром (2150 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат и выпаривают в вакууме, получая указанный в заголовке продукт в виде белого твердого вещества (600 мг). МС (ЭС-) m/z 295 [M-H]-(C14H1035Cl2O3). 1N-Хлорсукцинимид (1 экв., 7,45 г, 55,8 ммоль) добавляют к раствору этил-4-аминофенилацетата (10 г, 55,8 ммоль) в хлороформе (200 мл). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 15 мин. Реакционную смесь промывают водой (250 мл) и органический слой собирают, используя гидрофобную фритту. Органический слой выпаривают досуха, получая темнокоричневое масло, 9,8 г. Масло очищают двумя партиями, используя картридж C18 Biotage Horizon с обращенной фазой,100 г. Продукт элюируют, применяя градиент ацетонитрила в воде 5-100%. Для каждой партии используют примерно 1200 мл растворителя. Чистые фракции из первой партии объединяют и выпаривают досуха, получая указанное в заголовке соединение в виде темного красно-коричневого масла, 2,28 г. Раствор 2-хлор-5-[(3-хлорфенил)метил]оксибензойной кислоты (230 мг, 0,77 ммоль) в дихлорметане (3 мл) обрабатывают гидрохлоридом N-[2-(диметиламино)этил]-N'-этилкарбодиимида (178 мг, 0,93 ммоль, 1,2 экв.) и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор этил(4-амино-3-хлорфенил)ацетата (198 мг, 0,93 ммоль, 1,2 экв.) в дихлорметане (2 мл) и результирующую смесь нагревают при 40C в течение ночи. Поскольку еще присутствует некоторое количество исходного материала, добавляют еще 100 мг гидрохлорида N-[2-(диметиламино)этил]-N'этилкарбодиимида и нагревают смесь при 40C еще в течение 2 ч. После охлаждения смесь разбавляют дихлорметаном (50 мл) и водой (30 мл), слои разделяют и водный слой снова экстрагируют дихлорметаном (50 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают, получая указанное в заголовке соединение в виде желтого масла. Водный слой, содержащий нерастворимое твердое вещество, выпаривают в вакууме, остаток очищают, применяяSCX-картридж и элюируя метанолом, с получением дополнительной порции указанного в заголовке соединения в виде желтого масла (всего 72 мг).H-ЯМР (400 МГц, d6-ДМСО) : 1,20 (3H, т, J=7,2), 3,72 (2H, с), 4,10 (2H, кв, J=7,2), 5,20 (2H, с),7,15-7, 62 (10H, м). Следующие промежуточные соединения 5 и 6 получают аналогично этил(3-хлор-4-[(2-хлор-5-[(3 хлорфенил)метил]оксифенил)карбонил]аминофенил)ацетату, без выделения второй порции из водной фазы и с дополнительной очисткой методом хроматографии на силикагеле. Гидрид натрия (504 мг, 12,6 ммоль) добавляют частями к охлаждаемому на бане со льдом раствору бензилэтилмалоната (2,9 г, 12,6 ммоль) в сухом ДМФА (20 мл) и перемешивают в течение 10 мин. Добавляют при комнатной температуре 3,4-дифторнитробензол (2 г, 12,6 ммоль) и перемешивают в атмосфере аргона. Нагревают при 100C в течение 20 ч. Реакционную смесь охлаждают и распределяют между 2 н. соляной кислотой (75 мл) и этилацетатом (75 мл). Водный слой экстрагируют этилацетатом (275 мл) и объединенные органические слои выпаривают до желтого масла. Проводят очистку методом хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:4), получая указанное в заголовке со- 16015931 единение в виде желтого масла (3,86 г, 10,6 ммоль). ЖХ/МС: Rt=3,40, [MH]+ 362. Промежуточное соединение 8. Этил(4-амино-2-фторфенил)ацетат. Этилфенилметил(2-фтор-4-нитрофенил)пропандиоат (3,86 г, 10,6 ммоль), растворенный в этаноле,обрабатывают формиатом аммония (6,7 г, 10,6 ммоль) и добавляют в атмосфере аргона 10% пасту палладия на угле (380 мг). Реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают и фильтруют, выпаривают и очищают методом хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:1) и получая указанное в заголовке соединение в виде желтого масла (1,26 г). ЖХ/МС: Rt=2,10, [MH]+ 198. Следующие промежуточные соединения 9 и 10 получают аналогично этил(4-амино-2 фторфенил)ацетату, используя подходящие исходные материалы. Промежуточное соединение 10 получают согласно способу получения промежуточного соединения 8 (включающему способ получения промежуточного соединения 7), используя подходящие исходные материалы, кроме следующих отличий. Отличия от способа получения промежуточного соединения 7: перемешивают в течение 30 мин; нагревают при 100C в течение 5 ч и затем в течение ночи; экстрагируют этилацетатом, промывают водой (2) и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и затем выпаривают; хроматографию проводят с градиентом 10-20% этилацетата в гексане. Отличия от способа получения промежуточного соединения 8: нагревают при 60C в течение 2 ч; хроматографию проводят с градиентом от 0 до 50% этилацетата в гексане. Промежуточное соединение 11. Диэтил(2,5-дифтор-4-нитрофенил)пропандиоат. Размельченные гранулы гидроксида натрия (2,26 г, 56,5 ммоль) добавляют частями за 20 мин к раствору 1,2,4-трифтор-5-нитробензола (5,0 г, 28,2 ммоль) и диэтилхлорпропандиоата (4,57 мл, 56,5 ммоль) в сухом ДМФА (50 мл) при 0C в атмосфере аргона. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. Реакционную смесь охлаждают до 0C и подкисляют 2 н. соляной кислотой (50 мл), затем экстрагируют этилацетатом (150 мл) и промывают водой (150 мл). Органический слой сушат над сульфатом магния, фильтруют и выпаривают до оранжевого масла. Очищают- 17015931 методом хроматографии на силикагеле (Biotage SP4, колонка с силикагелем, 100 г), элюируя смесью 020% этилацетат/гексан и получая указанное в заголовке соединение в виде желтого масла (4,84 г, 15,3 ммоль). ЖХ/МС: Rt=3,07, [MH]-316. Следующие промежуточные соединения 12 и 13 получают аналогично диэтил(2,5-дифтор-4 нитрофенил)пропандиоату, используя подходящие исходные материалы. 10% Pd/C (влажная паста, 484 мг) добавляют к раствору диэтил(2,5-дифтор-4-нитрофенил)пропандиоата (4,84 г, 15,3 ммоль) и формиата аммония (5 экв., 4,81 г, 76,34 ммоль) в этаноле (100 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в атмосфере аргона в течение 1 ч. Реакционной смеси дают охладиться и затем фильтруют через целит, удаляя остатки Pd. Фильтрат выпаривают досуха и затем распределяют между этилацетатом (100 мл) и водой (100 мл). Органический слой отделяют, сушат над сульфатом магния, фильтруют и затем выпаривают досуха, получая указанное в заголовке соединение в виде оранжевого масла (4,39 г). ЖХ/МС Rt = 1, 07 мин, [MH]+ 288. Следующие промежуточные соединения 15 и 16 получают аналогично диэтил(4-амино-2,5 дифторфенил)пропандиоату, используя подходящие исходные материалы с дополнительной очисткой методом хроматографии на силикагеле. Гидроксид натрия (903 мг, 22,58 ммоль) в воде (7 мл) добавляют к раствору диэтил(4-амино-2,5 дифторфенил)пропандиоата (4,32 г, 15,05 ммоль) в этаноле (35 мл). Реакционную смесь нагревают до 90C в атмосфере аргона в течение 1 ч. Реакционной смеси дают охладиться и затем выпаривают растворитель. Остаток подкисляют (2 М HCl, 200 мл) и затем экстрагируют этилацетатом (200 мл). Органический слой сушат (MgSO4) и выпаривают растворитель. Остаток очищают методом флэш-хроматографииMS (ES+) m/z 216 [M+H+] (C10H11FNO2). Следующие промежуточные соединения 18 и 19 получают аналогично диэтил(4-амино-2,5 дифторфенил)пропандиоату, используя подходящие исходные материалы. Раствор 2-хлор-5-[(3-хлорфенил)метил]оксибензойной кислоты (207 мг, 0,7 ммоль) в дихлорметане (3 мл) обрабатывают N-[2-(диметиламино)этил]-N'-этилкарбодиимид гидрохлоридом (201 мг, 1,05 ммоль, 1,5 экв.) и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор этил(4-амино-2-фторфенил)ацетата (207 мг, 1,05 ммоль, 1,5 экв.) в дихлорметане (2 мл) и результирующую смесь нагревают при 40C в течение ночи. После охлаждения смесь разбавляют метанолом и очищают, применяя SCX-картридж и элюируя метанолом с получением указанного в заголовке соединения в виде желтого масла (110 мг).H-ЯМР (400 МГц, d6-ДМСО) : 1,19 (3H, т, J=7,2), 3,68 (2H, с), 4,09 (2H, кв, J=7,2), 5,20 (2H, с),7,15-7,68 (10H, м). Следующие промежуточные соединения 21 и 22 и получают аналогично этил(4-[(2-хлор-5-[(3 хлорфенил)метил]оксифенил)карбонил]амино-2-фторфенил)ацетату при добавлении N,N-диметиламинопиридина (ДМАП) в качестве катализатора и большей продолжительности нагревания. Раствор 2-хлор-5-[(3-хлорфенил)метил]оксибензойной кислоты (200 мг, 0,67 ммоль) в дихлорметане (3 мл) обрабатывают оксалилхлоридом (90 мкл, 1,0 ммоль) и ДМФА (1 капля). Наблюдают бурное выделение газа и смесь перемешивают при комнатной температуре в течение 30 мин. Затем выпаривают растворитель в вакууме и проводят азеотропную перегонку с толуолом. Результирующее твердое вещество растворяют в дихлорметане (3 мл) и обрабатывают триэтиламином (140 мкл, 1,0 ммоль) и раствором этил(4-амино-3-хлор-2-фторфенил)ацетата (230 мг, 1,0 ммоль) в дихлорметане (2 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Затем разбавляют смесь ацетонитрилом и очищают,применяя SCX-картридж, элюируя ацетонитрилом. Фракции объединяют и выпаривают, остаток очищают методом MDAP, получая указанное в заголовке соединение в виде белого твердого вещества (110 мг).H-ЯМР (400 МГц, ДМСО-d6) : 1,20 (3H, т, J=7,2), 3,81 (2H, с), 4,12 (2H, кв, J=7,2), 5,20 (2H, с),7,16-7,55 (9H, м). Следующие промежуточные соединения с 24 по 27 получают аналогично этил(3-хлор-4-[(2-хлор 5-[(3-хлорфенил)метил]оксифенил)карбонил]амино-2-фторфенил)ацетату при больших временах взаимодействия, при обработке водой или без необходимости очистки методом MDAP.(3-Хлор-4-[(2-хлор-5-[(3-хлорфенил)метил]оксифенил)карбонил]аминофенил)ук Раствор этил(3-хлор-4-[(2-хлор-5-[(3-хлорфенил)метил]оксифенил)карбонил]аминофенил)ацетата (72 мг, 0,15 ммоль) в уксусной кислоте (3 мл) и 2 М HCl (3 мл) нагревают при 90C в течение 2 ч. После охлаждения добавляют воду и смесь фильтруют. Полученное в результате твердое вещество сушат в вакуумной печи, затем растирают в эфире, получая указанное в заголовке соединение в виде почти белого твердого вещества (32 мг).H-ЯМР (400 МГц, ДМСО-d6) : 3,63 (2H, с), 5,20 (2H, с), 7,17 (1H, дд, J=8,8, J=2,8), 7,25-7,60 (10H,м), 10,18 (1H, с), 12,5 (1H, с). Следующие примеры изобретения получают аналогично примеру 1 из описанных выше промежуточных соединений с добавлением особого реагента или органического растворителя, при большем времени взаимодействия и при дополнительной очистке методом MDAP вместо растирания или в дополнение к нему. 2-Хлор-5-нитробензойную кислоту (1,99 г, 9,87 ммоль) перемешивают в течение 18 ч при 60C в тионилхлориде (10 мл). Избыток тионилхлорида удаляют выпариванием и растворяют сырое масло в хлороформе (20 мл). К этому раствору добавляют этил(4-аминофенил)ацетат (1,18 г, 6,58 ммоль) и реакционную смесь перемешивают при 60C в течение 18 ч. Реакционную смесь разбавляют водой и фазы разделяют. Органический слой сушат (Na2SO4), растворитель выпаривают и остаток очищают методом флэш-хроматографии (Biotage SP4, 40+M 050% этилацетат/гексан), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (2,28 г, 96%).(20 мл) нагревают при 50C. Добавляют 20% водный раствор уксусной кислоты (10 мл), а затем железо(6 экв., 37,6 ммоль, 2,1 г). Смесь нагревают при 80C в течение 30 мин. После охлаждения смесь фильтруют через целит, промывая EtOH. Растворитель выпаривают в вакууме. Остаток переносят в EtOAc и водный бикарбонат натрия. Слои разделяют, водный слой экстрагируют EtOAc (2). Органические слои объединяют и промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают. Остаток очищают методом колоночной хроматографии (Biotage SP4, колонка с силикагелем, 100 г),элюируя смесью 25-75% этилацетата в гексане и получая указанное в заголовке соединение в виде светло-желтого масла (1,8 г). Раствор этил(4-[(5-амино-2-хлорфенил)карбонил]аминофенил)ацетата (300 мг, 0,90 ммоль) в ДМФА (5 мл) обрабатывают карбонатом калия (152 мг, 1,1 ммоль, 1,2 экв.) и бензилбромидом (215 мкл,1,8 ммоль, 2 экв.) и перемешивают при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом (150 мл) и промывают водой (280 мл) и насыщенным раствором соли (80 мл). Органический слой сушат над сульфатом магния и выпаривают в вакууме. Остаток очищают методом колоночной хроматографии (Biotage SP4, 40 г колонка с силикагелем), элюируя смесью 0-25% этилацетата в гексане и получая указанное в заголовке соединение в виде белого твердого вещества (90 мг).H-ЯМР (400 МГц, ДМСО-d6) : 1,18 (3H, т, J=7,2), 3,61 (2H, с), 4,07 (2H, кв, J=7,2), 4,30 (2H, д, J=6),6,62-7,65 (13H, м). Следующие промежуточные соединения 31 и 32 получают аналогично этил 4-[(2-хлор-5[(фенилметил)амино]фенилкарбонил)амино]фенилацетату при меньших временах взаимодействия. Раствор этил 4-[(2-хлор-5-[(фенилметил)амино]фенилкарбонил)амино]фенилацетата (90 мг, 0,21 ммоль) в уксусной кислоте (2 мл) и 2 М HCl (2 мл) нагревают при 90C в течение 2 ч. После охлаждения добавляют воду, затем выпаривают растворитель в вакууме и проводят азеотропную перегонку с толуолом. Остаток очищают методом MDAP, получая указанное в заголовке соединение в виде белого твердого вещества (40 мг).H-ЯМР (400 МГц, ДМСО-d6) : 3,51 (2H, с), 4,30 (2H, д, J=4,4), 6,63-6,73 (3H, м), 7,15-7,36 (10H, м),10,3 (1H, с). Следующие примеры изобретения получают аналогично 4-[(2-хлор-5-[(фенилметил)амино]фенилкарбонил)амино]фенилуксусной кислоте. п-Бутиллития (11,7 мл, 18,77 ммоль) добавляют по капле к раствору 4-хлор-2-фторанизола (2,01 г,12,52 ммоль) в тетрагидрофуране (20 мл) при -78C и перемешивают реакционную смесь в течение 30 мин. Добавляют одной порцией размельченный твердый диоксид углерода и затем дают реакционной смеси нагреться до комнатной температуры. Растворитель выпаривают и остаток растворяют в воде. Добавляют гидроксид натрия (2 М до pH 14) и водный слой экстрагируют этилацетатом. Подкисляют водный слой соляной кислотой (5 М, pH1) и указанное в заголовке соединение собирают в виде бесцветного твердого вещества (2,25 г, 88%). Соединение сушат в вакууме. Оксалилхлорид (193 мкл, 2,21 ммоль) добавляют по капле к раствору 6-хлор-2-фтор-3(метилокси)бензойной кислоты (300 мг, 1,47 ммоль) в дихлорметане (5 мл). К этой смеси добавляют диметилформамид (1 каплю) и реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Растворитель выпаривают, получая желтое полутвердое вещество. Это полутвердое вещество растворяют в дихлорметане (5 мл) и этил(4-аминофенил)ацетате (316 мг, 1,76 ммоль), а затем добавляют триэтиламин (287 мкл, 2,06 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и фазы разделяют. Органический слой сушат (Na2SO4),растворитель выпаривают и остаток очищают методом флэш-хроматографии (Biotage SP4, 25+М колонка с силикагелем, 050% этилацетат/бензин, получая указанное в заголовке соединение в виде желтого полутвердого вещества (506 мг, 94%). Трибромид бора (393 мкл, 4,16 ммоль) добавляют по капле к раствору этил[4-([6-хлор-2-фтор-3- 24015931-78C в атмосфере аргона и реакционную смесь перемешивают в течение ночи при медленном нагревании до 0C. Реакционную смесь гасят, осторожно добавляя воду, перемешивают в течение 1 ч, затем разбавляют этилацетатом, фильтруют, фазы разделяют, органический слой сушат (Na2SO4), растворитель выпаривают и очищают остаток методом флэш-хроматографии (Biotage SP4, 25+М колонка с силикагелем, 080% этилацетат/бензин, чистые фракции собирают), получая указанное в заголовке соединение в виде бесцветной пены (157 мг, 32%). Добавляют 3-хлорбензилбромид (28 мкл, 0,24 ммоль) к суспензии этил(4-[(6-хлор-2-фтор-3 гидроксифенил)карбонил]аминофенил)ацетата (80 мг, 0,228 ммоль) и карбоната калия (38 мг, 0,273 ммоль) в диметилформамиде (3 мл) и реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель выпаривают и остаток распределяют между водой и этилацетатом. Органический слой отделяют, сушат (Na2SO4) и растворитель выпаривают, получая указанное в заголовке соединение в виде бесцветного масла (91 мг, 84%).(1H, т, J=8,75), 7,13 (1H, дд, J=8,75, 1,5), 7,33 (6H, м), 7,41 (1H, с), 7,61 (2H, м). Следующее промежуточное соединение получают аналогично этил(4-[(6-хлор-3-[(3-хлорфенил) метил]окси-2-фторфенил)карбонил]аминофенил)ацетату. Добавляют моногидрат гидроксида лития (12 мг, 0,281 ммоль) к раствору этил (4-[(6-хлор-3-[(3 хлорфенил)метил]окси-2-фторфенил)карбонил]аминофенил)ацетата (91 мг, 0,192 ммоль) в диоксане (2 мл) и воде (1 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают, остаток растворяют в воде (5 мл) и подкисляют (2 М HCl, рН 1). Водный слой экстрагируют этилацетатом, органическую фазу сушат (Na2SO4) и растворитель выпаривают, получая бесцветное твердое вещество, которое собирают фильтрованием. Это вещество очищают методом масснаправленного автополучения (MDAP), получая указанное в заголовке соединение в виде бесцветного(2H, м). Следующий пример изобретения получают аналогично (4-[(6-хлор-3-[(3-хлорфенил)метил]окси 2-фторфенил)карбонил]аминофенил)уксусной кислоте, без необходимости MDAP-очистки. Следующее промежуточное соединение 38 получают аналогично (2,5-дифтор-4-нитрофенил)пропандиоату (промежуточное соединение 11), используя подходящие исходные материалы. Следующее промежуточное соединение 39 получают аналогично диэтил(4-амино-2,5 дифторфенил)ацетату (промежуточное соединение 14), используя подходящие исходные материалы. Следующее промежуточное соединение 40 получают аналогично этил(4-амино-2,5 дифторфенил)ацетату (промежуточное соединение 17), используя подходящие исходные материалы. Трибромид бора (1,5 мл, 15,3 ммоль) добавляют по капле к раствору 6-хлор-2-фтор-3(метилокси)бензойной кислоты (промежуточное соединение 33, 1,04 г, 5,1 ммоль) в дихлорметане (100 мл) при 0C в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Добавляют воду (5 мл) и образовавшееся твердое вещество перемешивают в течение 5 мин. Добавляют гидроксид натрия (2 М, 4 мл), и оставшееся твердое вещество растворяется. Слои разделяют и водный слой выпаривают, получая бесцветное твердое вещество. Это вещество экстрагируют этилацета- 26015931 том (3) и объединенные органические слои выпаривают, получая указанное в заголовке соединение в виде желтого твердого вещества (831 мг). 1H-ЯМР : 7,02 (1H, т, J=10), 7,16 (1H, дд, J=10, 3), 10,48 (1H, с), 13,96 (1H, ш.с). Следующие промежуточные соединения 42-54 получают из замещенной подходящим образом 5 гидроксибензойной кислоты двухстадийным способом (алкилирование с последующим гидролизом сложного эфира), аналогичным способу получения промежуточного соединения 2, при некоторых отличиях от описанных процедур, указанных в следующей таблице:
МПК / Метки
МПК: A61P 25/00, A61P 19/00, C07C 235/56, A61K 31/167
Метки: агонисты, ер4-рецепторов, бензамидные, производные
Код ссылки
<a href="https://eas.patents.su/30-15931-benzamidnye-proizvodnye-kak-agonisty-er4-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Бензамидные производные как агонисты ер4-рецепторов</a>












