Соединения, проявляющие активность в отношении рецептора св1
Номер патента: 15175
Опубликовано: 30.06.2011
Авторы: Коффи Дэвид Скотт, Ху Цзиндань, Таппер Дэвид Эдвард, Шаус Джон Менерт, Крушински Джозеф Херман Джуниор, Кединг Стейси Джо
Формула / Реферат
1. Соединение формулы
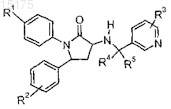
где R1выбран из группы, состоящей из:
a) -H,
b) галогена,
c) -OCF3,
d) -OCH3,
e) метила,
f) -SO2CH3,
g) -CF3 и
h) -CN;
R2 представляет собой по меньшей мере один заместитель, независимо выбранный из группы, состоящей из:
(a) -H,
(b) галогена,
(c) -CF3,
(d) -(C1-C4)алкила,
(e) циклопропила,
(f) -O-циклопропила,
(g) -SCF3,
(h) -OCF3,
(i) -OCH2CF3,
(j) -CN и
(k) -O-(C1-C3)алкила;
R3 представляет собой по меньшей мере один заместитель, независимо выбранный из группы, состоящей из:
a) -H,
b) -CF3,
c) -(C1-C4)алкила,
d) циклопропила,
e) -OCH3,
f) галогена и
g) фенила;
каждый R4и R5 независимо выбран из группы, состоящей из H, метила и этила, или оба R4 и R5могут вместе с атомом углерода, к которому каждый из них присоединен, образовать циклопропильное кольцо;
или фармацевтически приемлемая соль такого соединения.
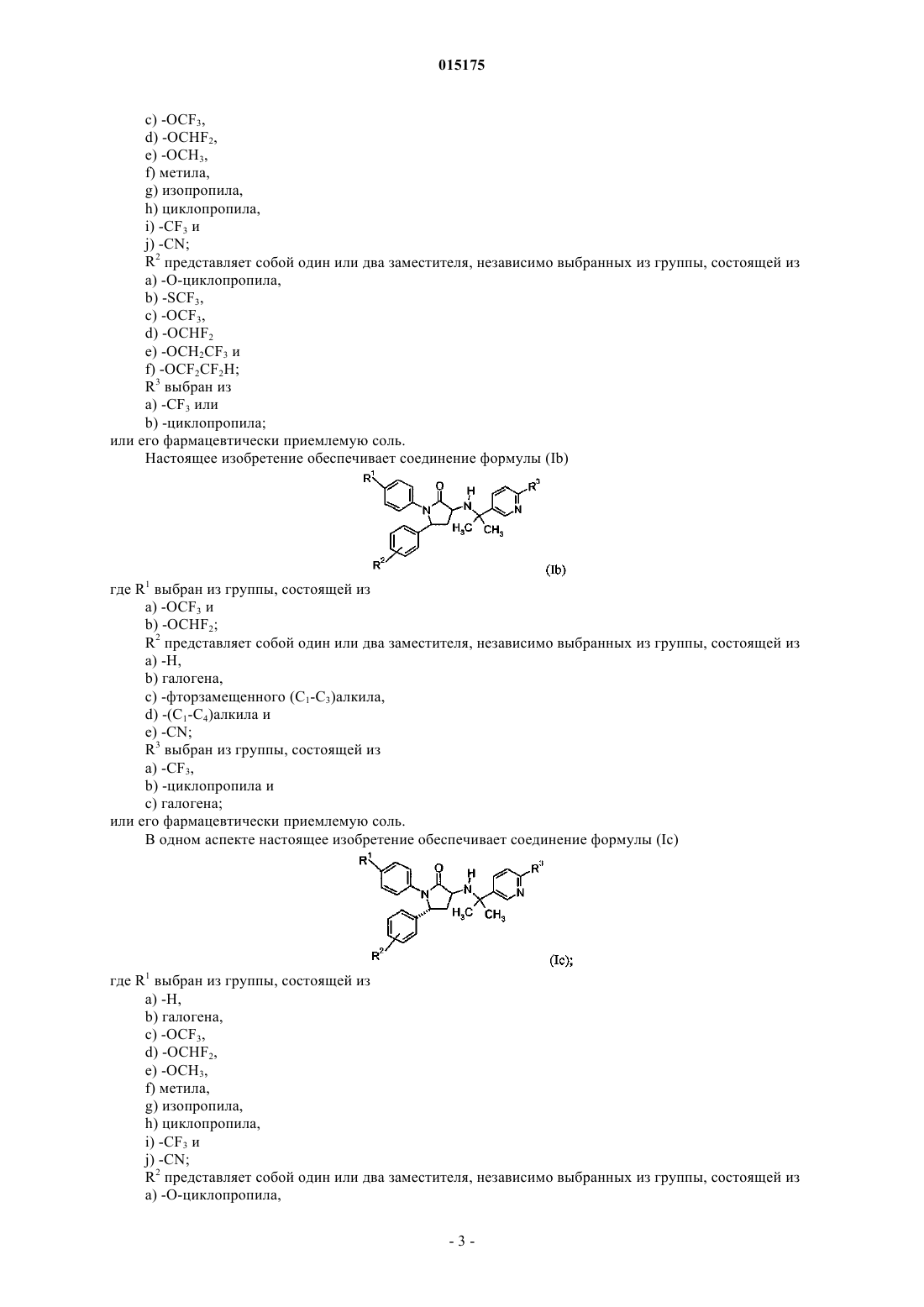
2. Соединение формулы
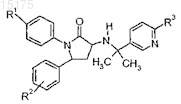
где R1выбран из группы, состоящей из:
a) -H,
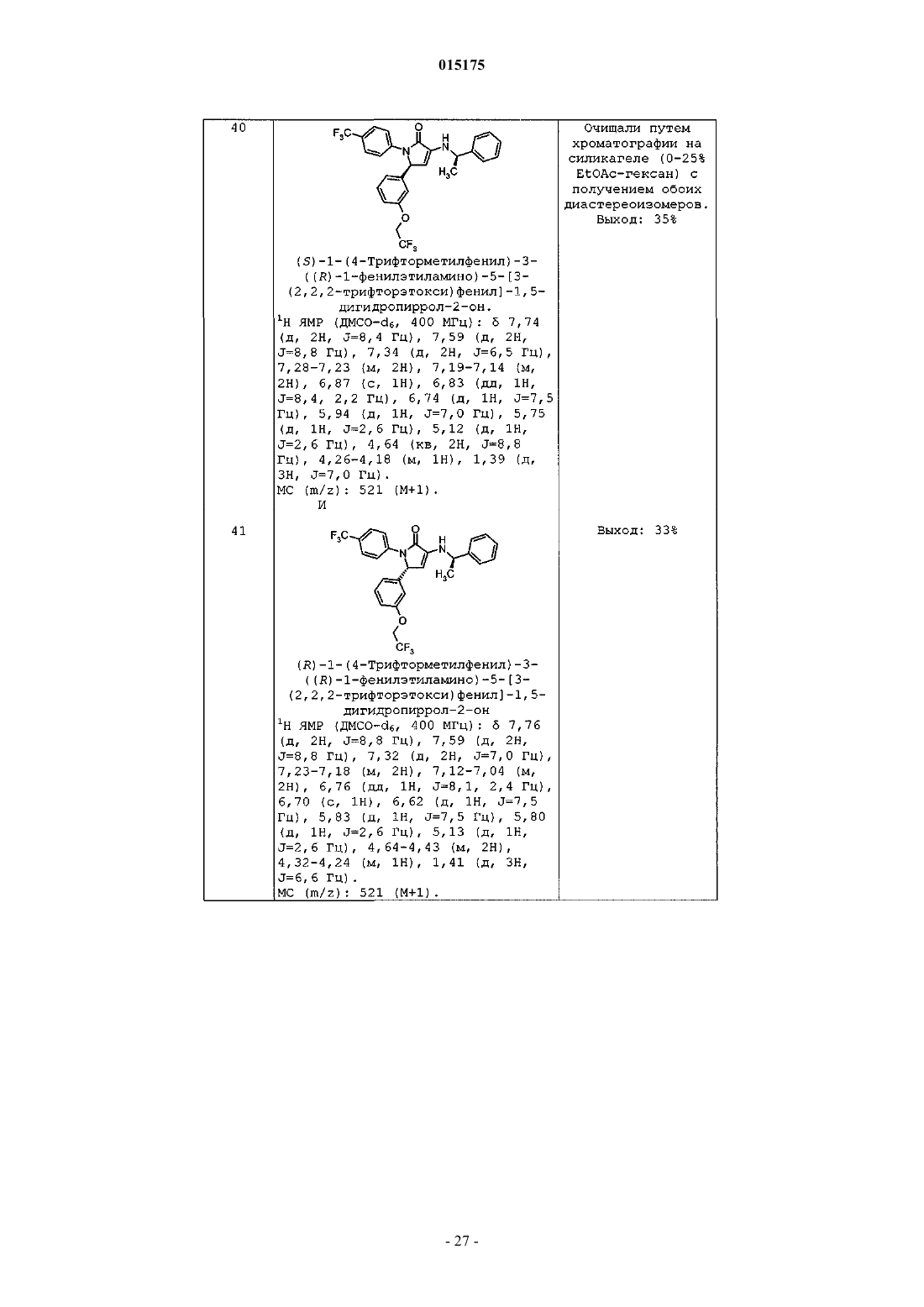
b) галогена,
c) -OCF3,
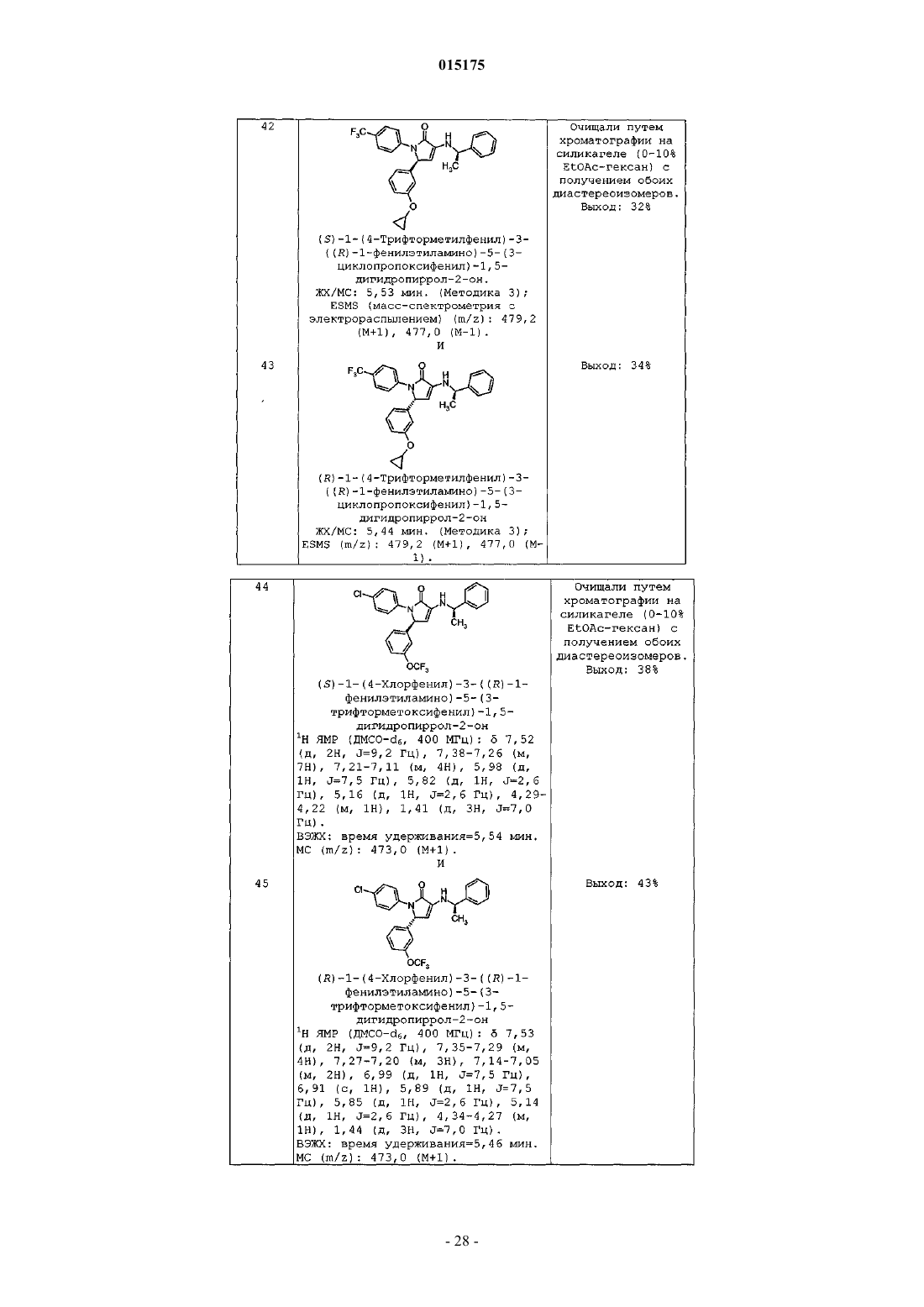
d) -OCHF2,
e) -OCH3,
f) метила,
g) изопропила,
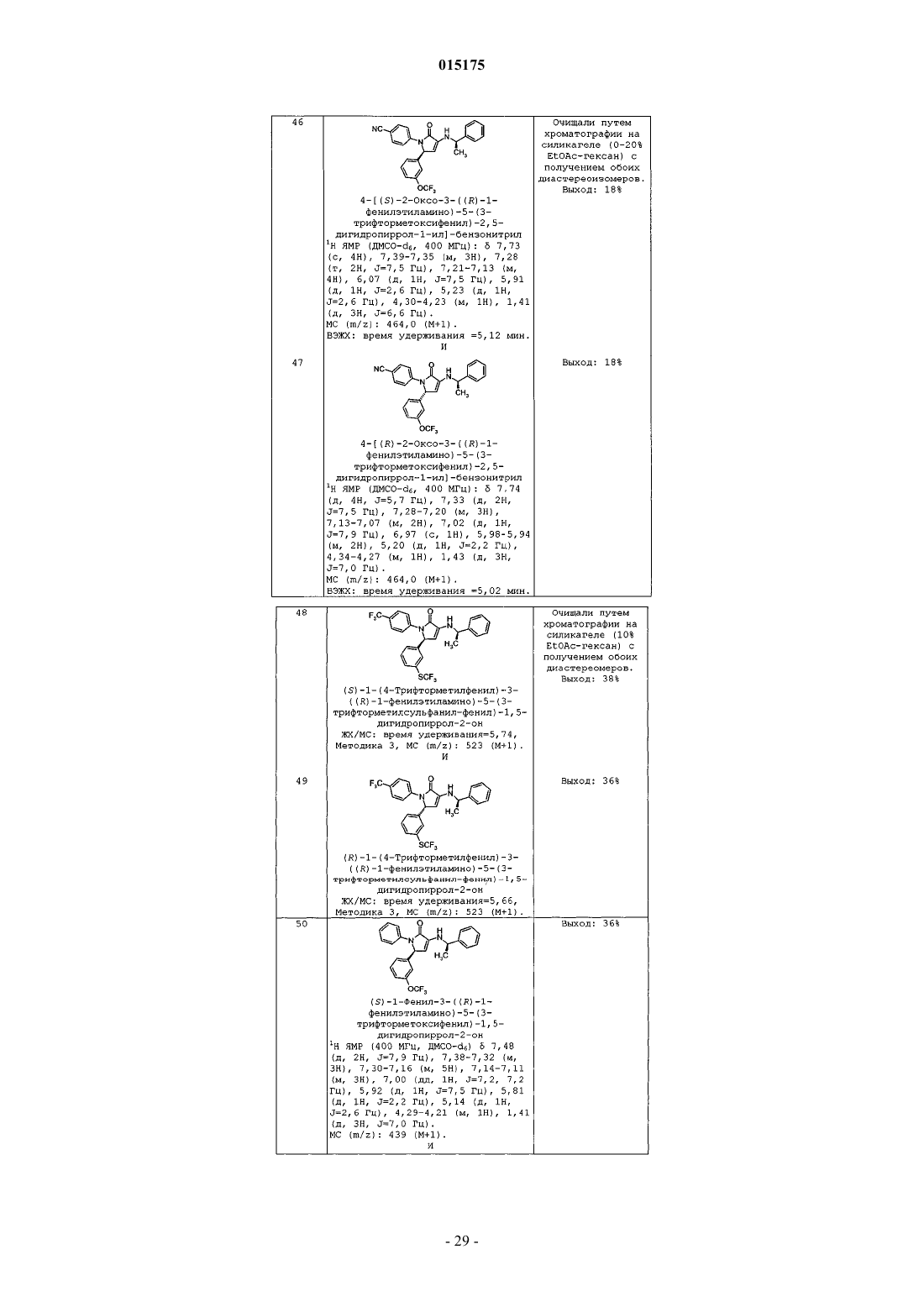
h) циклопропила,
i) -CF3 и
j) -CN;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -O-циклопропила,
b) -SCF3,
c) -OCF3,
d) -OCHF2
e) -OCH2CF3 и
f) -OCF2CF2H;
R3 выбран из:
a) -CF3 или
b) -циклопропила;
или фармацевтически приемлемая соль такого соединения.
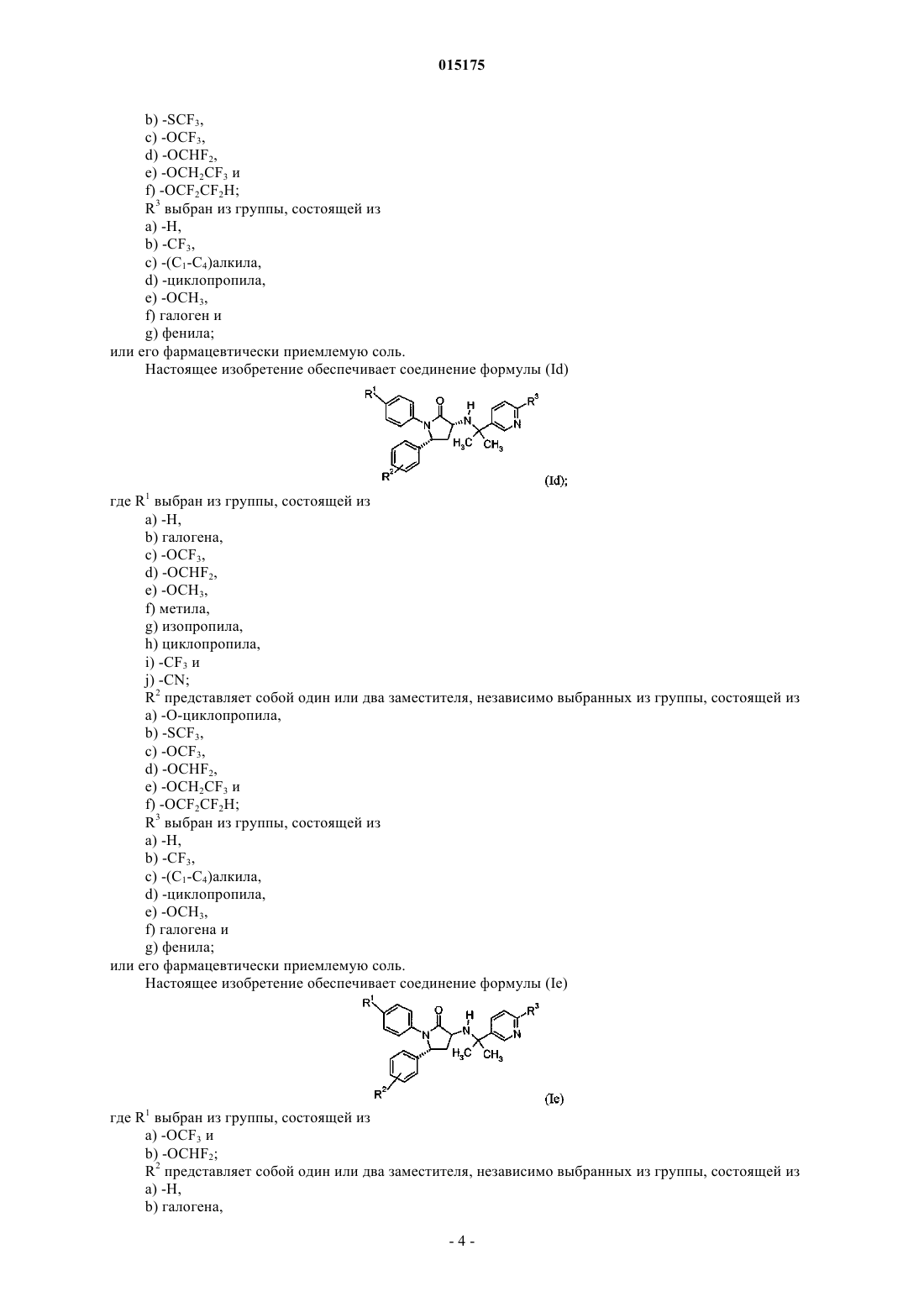
3. Соединение формулы
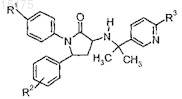
где R1выбран из группы, состоящей из:
a) -OCF3 и
b) -OCHF2;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -H,
b) галогена,
c) -фторзамещенного (C1-C3)алкила,
d) -(C1-C4)алкила и
e) -CN;
R3 выбран из группы, состоящей из:
a) -CF3,
b) -циклопропила и
c) галогена;
или фармацевтически приемлемая соль такого соединения.
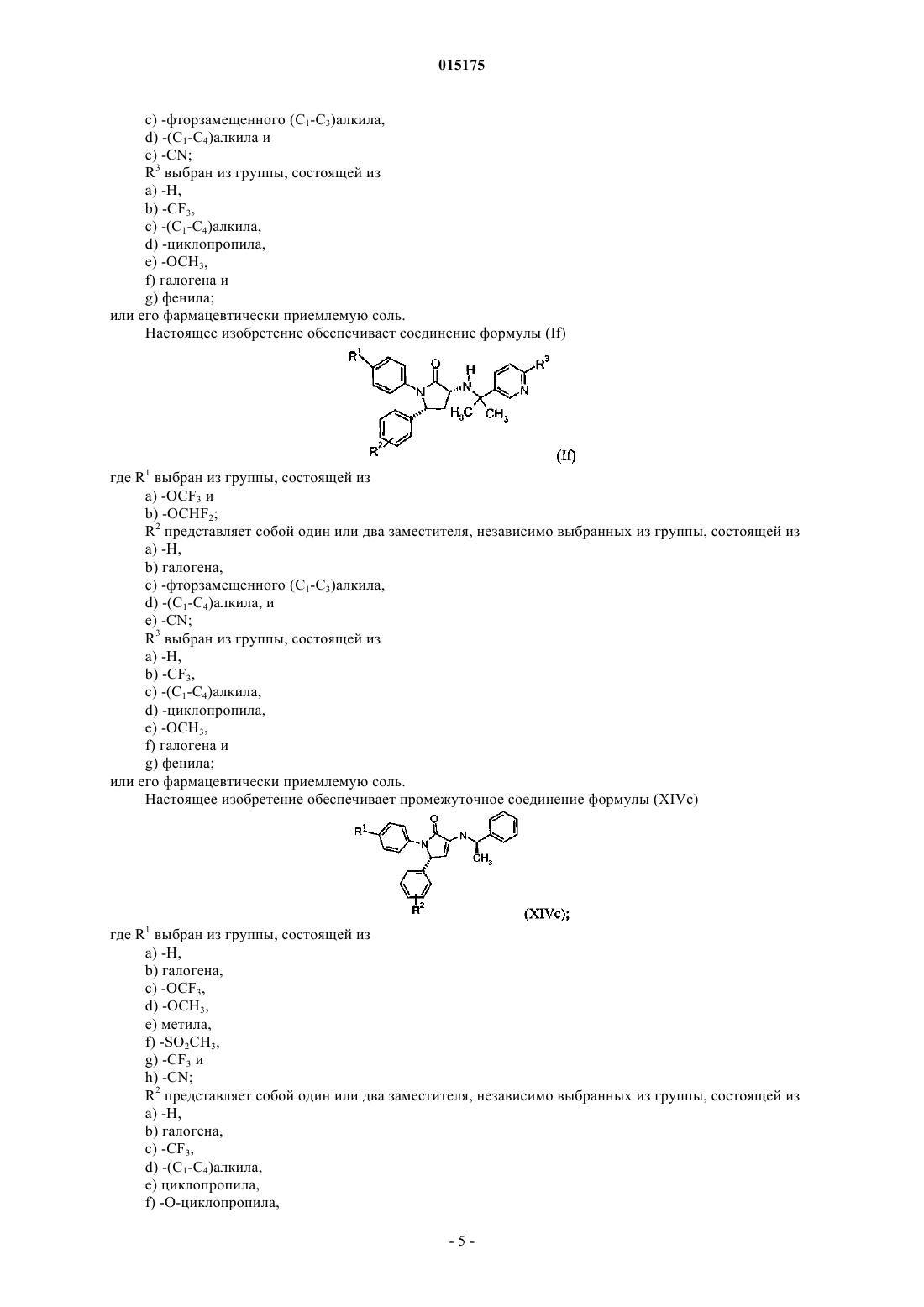
4. Соединение по п.2, имеющее формулу
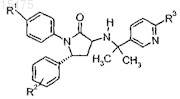
где R1выбран из группы, состоящей из:
a) -H,
b) галогена,
c) -OCF3,
d) -OCHF2,
e) -OCH3,
f) метила,
g) изопропила,
h) циклопропила,
i) -CF3 и
j) -CN;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -O-циклопропила,
b) -SCF3,
c) -OCF3,
d) -OCHF2,
e) -OCH2CF3 и
f) -OCF2CF2H;
R3 выбран из:
a) -CF3 или
b) -циклопропила;
или фармацевтически приемлемая соль такого соединения.
5. Соединение по п.2, имеющее формулу
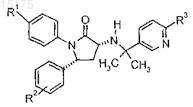
где R1выбран из группы, состоящей из:
a) -H,
b) галогена,
c) -OCF3,
d) -OCHF2,
e) -OCH3,
f) метила,
g) изопропила,
h) циклопропила,
i) -CF3 и
j) -CN;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -O-циклопропила,
b) -SCF3,
c) -OCF3,
d) -OCHF2,
e) -OCH2CF3 и
f) -OCF2CF2H;
R3 выбран из:
a) -CF3 или
b) -циклопропила;
или фармацевтически приемлемая соль такого соединения.
6. Соединение по п.3, имеющее формулу
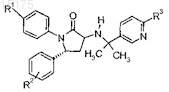
где R1выбран из группы, состоящей из:
a) -OCF3 и
b) -OCHF2;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -H,
b) галогена,
c) -фторзамещенного (C1-C3)алкила,
d) -(C1-C4)алкила и
e) -CN;
R3 выбран из группы, состоящей из:
a) -CF3,
b) -циклопропила и
c) галогена;
или фармацевтически приемлемая соль такого соединения.
7. Соединение по п.3, имеющее формулу
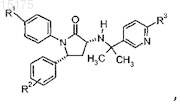
где R1выбран из группы, состоящей из:
a) -OCF3 и
b) -OCHF2;
R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из:
a) -H,
b) галогена,
c) -фторзамещенного (C1-C3)алкила,
d) -(C1-C4)алкила и
e) -CN;
R3 выбран из группы, состоящей из:
a) -CF3,
b) -циклопропила и
c) галогена;
или фармацевтически приемлемая соль такого соединения.
8. Соединение формулы
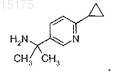
9. Фармацевтическая композиция, включающая соединение по любому из пп.1-7 или фармацевтически приемлемую соль такого соединения, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
10. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли такого соединения в терапии.
11. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли такого соединения в лечении расстройств, выбранных из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством.
12. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли такого соединения в комбинации одновременно, раздельно или последовательно с антипсихотическим средством в лечении расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством.
13. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли такого соединения при получении лекарственного средства для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством.
14. Применение соединения по любому из пп.1-7 или фармацевтически приемлемой соли такого соединения при получении лекарственного средства для применения в комбинированной терапии для лечения расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством, отличающееся тем, что указанный лекарственный препарат вводят в сочетании с антипсихотическим средством путем одновременного, раздельного или последовательного введения.
Текст
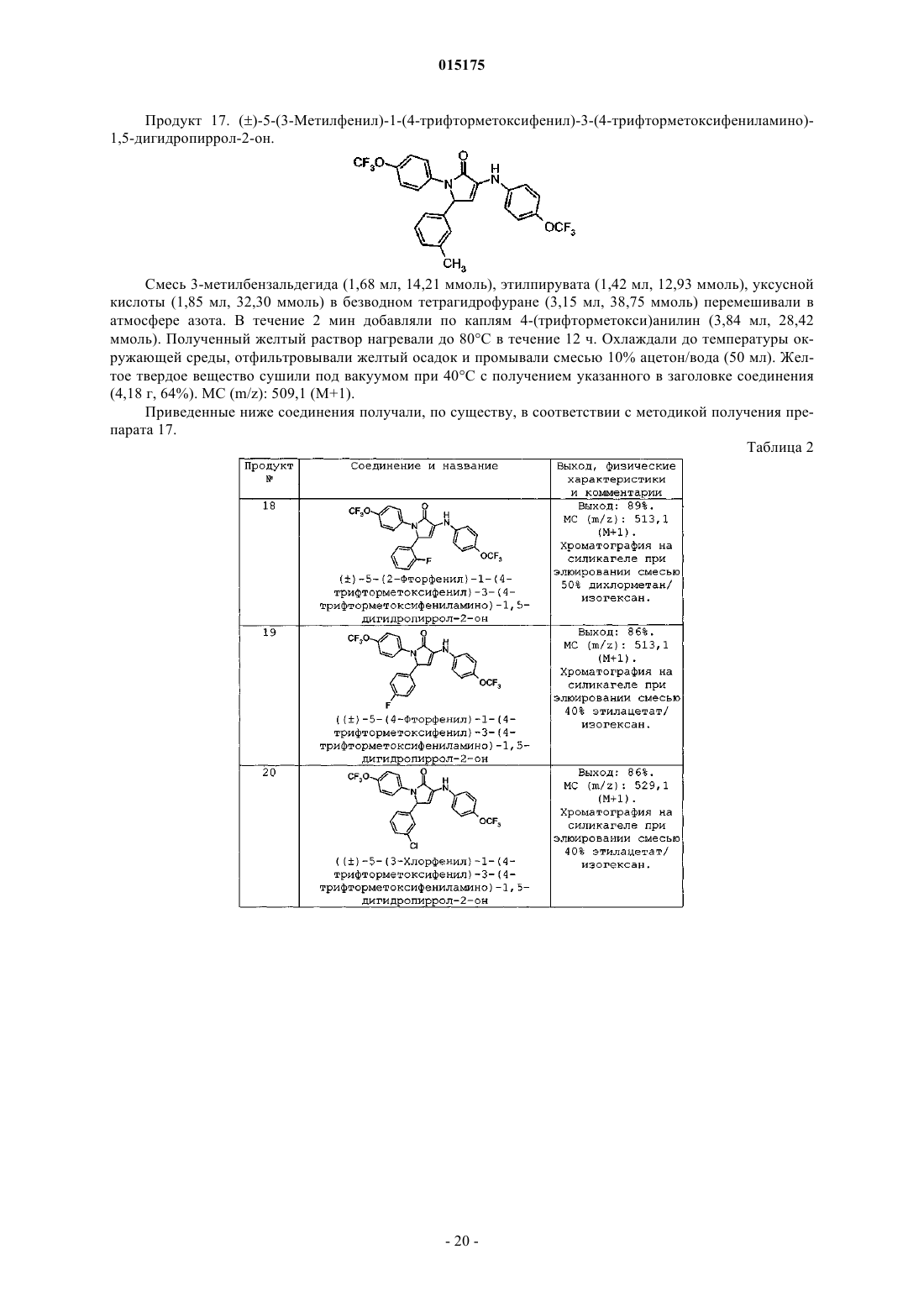
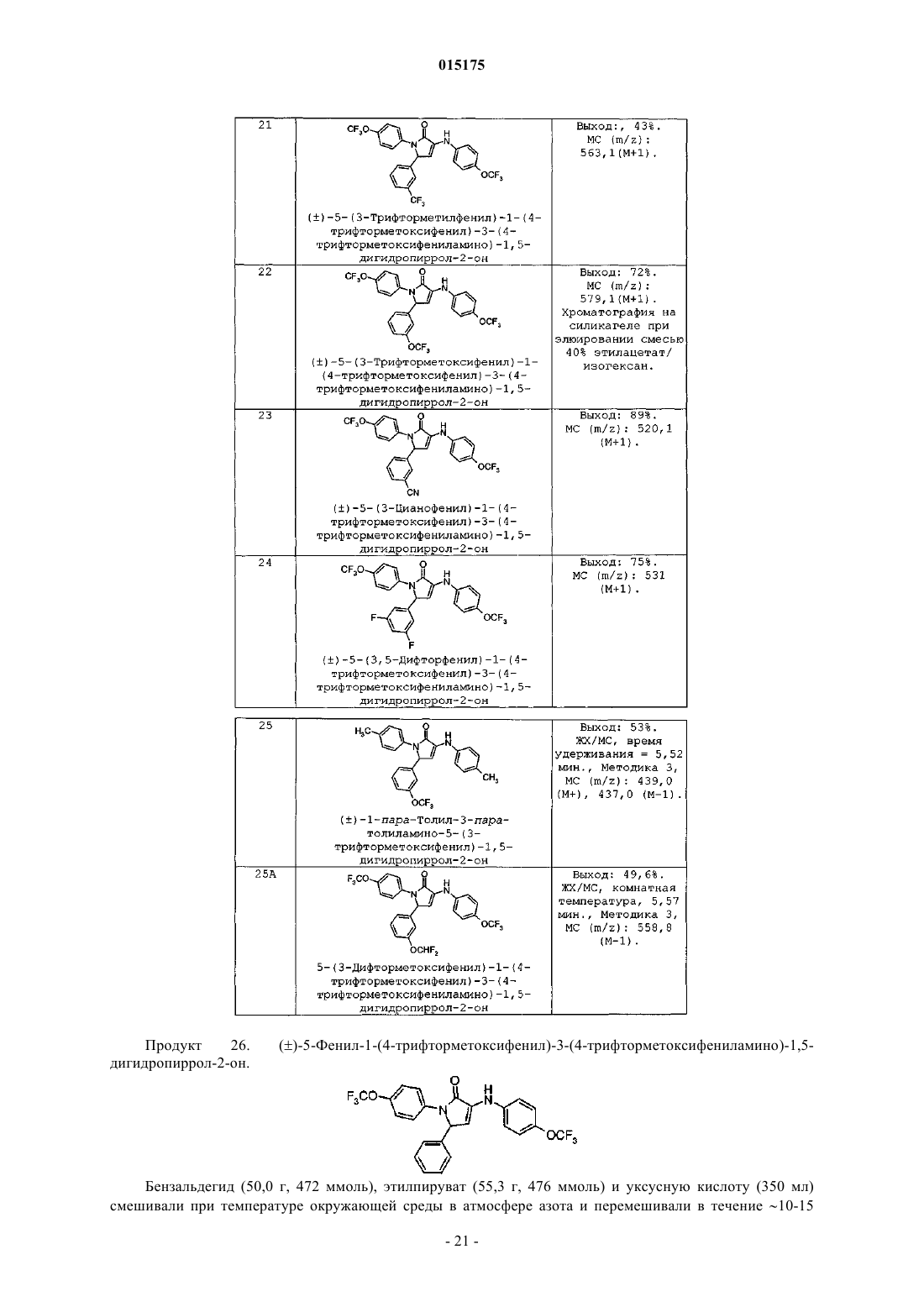
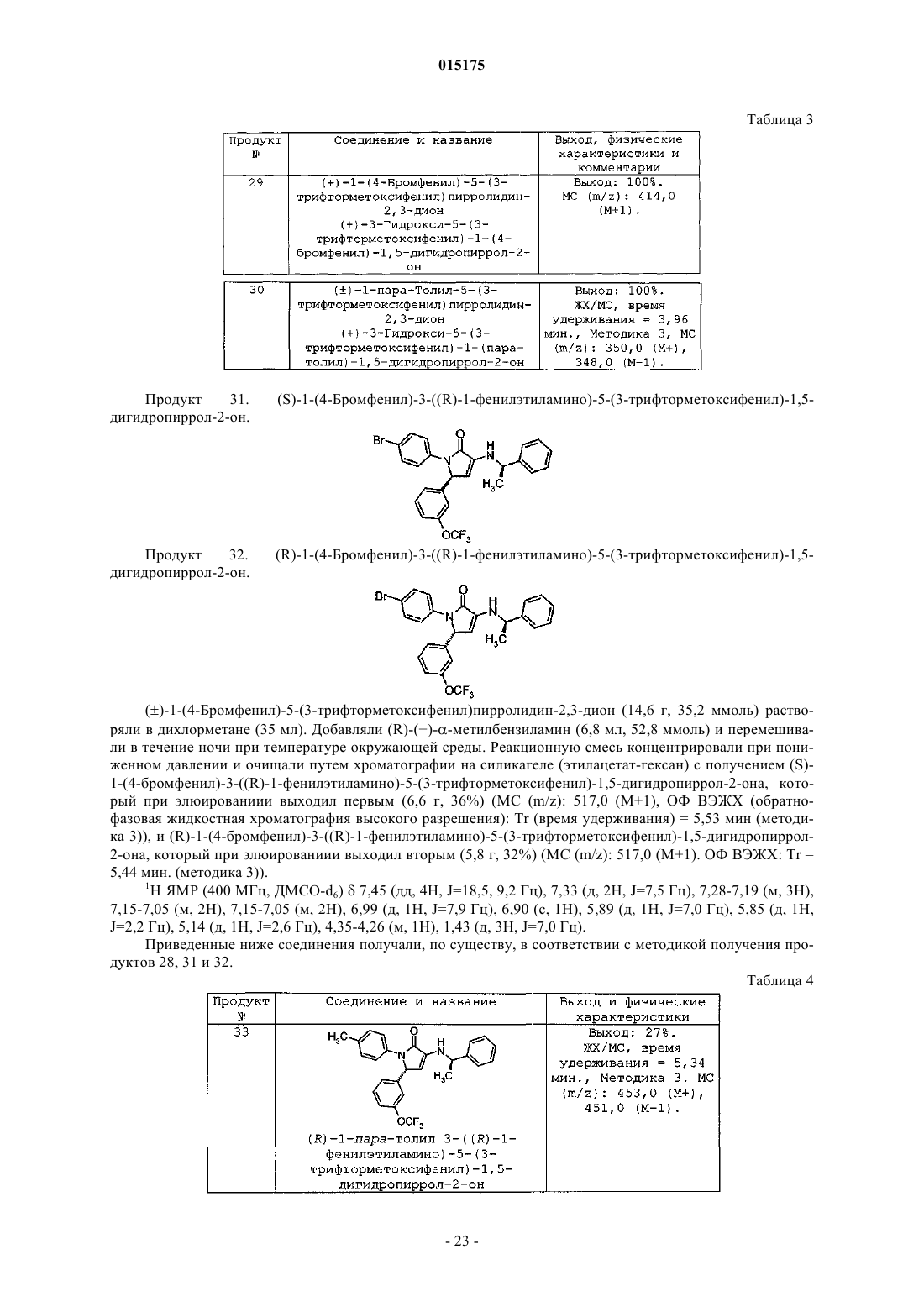
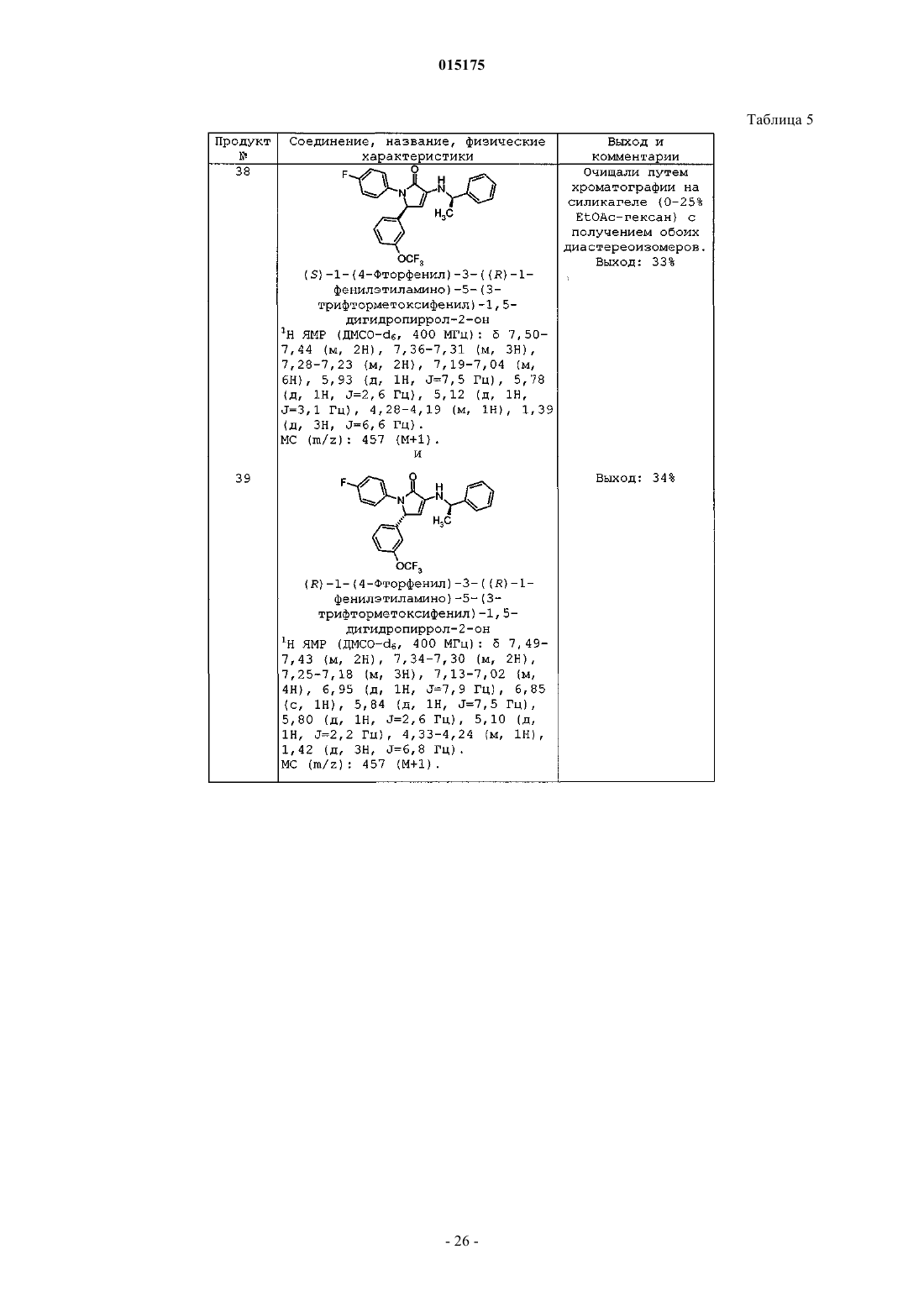
СОЕДИНЕНИЯ, ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ В ОТНОШЕНИИ РЕЦЕПТОРА СВ 1 которые благодаря способности блокировать рецепторы CB1 по механизму обратного агонизма пригодны для снижения массы тела у млекопитающих, лечения когнитивных нарушений, связанных с шизофренией, снижения возникшего в результате лечения увеличения веса, наблюдаемого при лечении антипсихотическими препаратами, и имеют повышенную биодоступность. Коффи Дэвид Скотт, Ху Цзиндань, Кединг Стейси Джо, Крушински Джозеф Херман Джуниор, Шаус Джон Менерт (US), Таппер Дэвид Эдвард (GB)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015175 Уровень техники Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США, серийный номер 60/862540, поданной 23 октября 2006 г. Семейство рецепторов CB1 обнаруживают преимущественно в центральной и периферической нервной системе и, в меньшей степени, в ряде периферических органов. В то же время рецептор CB2 локализуется в основном в иммунной системе. Были исследованы фармакологические свойства и возможности терапевтического применения лигандов каннабиноидных рецепторов (Exp. Opin. Ther. Patents 1998, 8, 301-313; Ann. Rep. Med. Chem., A. Doherty, Ed.; Academic Press, NY 1999, Vol. 34, 199-208; Exp.Opin. Ther. 2000, 10, 1529-1538; Trends in Pharma. Sci. 2000, 21, 218-224). Агонисты рецептора CB1 связывают со стимуляцией аппетита, анемическими свойствами, аналгезией, снижением внутриглазного давления при глаукоме и облегчением мышечных спазмов при рассеянном склерозе. Антагонисты рецептораCB1, напротив, оказались эффективны в снижении аппетита и массы тела в моделях ожирения на животных. Тем не менее, большинство соединений, которые модулируют активность рецептора CB1, в отношении фармакологических свойств характеризуются обратным агонизмом, которое снижает базальный уровень передачи сигнала через рецептор CB1, а также активность блокировки стимуляции рецептора,зависящей от агониста CB1. В настоящее время проводятся исследования, направленные на создание ряда селективных соединений, оказывающих центральное действие на рецептор CB1 для лечения ожирения. Тем не менее, сохраняется потребность в соединениях, проявляющих активность в отношении к рецептору CB1, которые обладали бы повышенной эффективностью in vivo, которые были бы низкомолекулярными и обладали бы фармакокинетическими и фармакодинамическими свойствами, которые обеспечили бы терапевтическую пользу при снижении нежелательных явлений. См., например, WO 2007/020502. Помимо расстройств побуждений было показано, что обратные агонисты CB1 дополнительно усиливают активность антипсихотических средств в тестах. Хотя современные антипсихотические средства лечения более или менее эффективны в контролировании позитивных симптомов, такие терапевтические средства не так эффективны в лечении негативных и когнитивных симптомов, что приводит к тому, что многие пациенты оказываются неспособны вести нормальный образ жизни. Обобщенные данные позволяют предположить, что препараты, которые усиливают активность нейронов в определенных областях мозга, в частности в областях гиппокампа, полосатого тела и коры, будут эффективными в лечении как негативных, так и когнитивных симптомов. Кроме того, было показано, что соединения, проявляющие активность в отношении рецептора CB1, оказывают действие, направленное на снижение веса на моделях животных с индуцированным антипсихотическим лечением увеличением веса и, следовательно, эти соединения могут также оказаться эффективными в контролировании стимулированного лечением увеличения веса и метаболического синдрома, которые наблюдаются при современных антипсихотических методах лечения. Более того, было показано, что соединения, проявляющие активность в отношении рецептора CB1,снижают потребление алкоголя в моделях алкоголизма на животных и поэтому могут быть пригодны для лечения злоупотребления психоактивными веществами. В то время как пероральное введение является предпочтительным путем доставки лекарственных средств, многие соединения, проявляющие активность в отношении рецептора CB1, имеют недостаток,заключающийся в слабой биодоступности при пероральном введении, как следствие их ограниченной растворимости в водной среде и метаболической неустойчивости. Вследствие высокой липофильности эндогенных лигандов каннабиноидных рецепторов и комплементарного сайта, с которым они связываются на рецепторе CB1, известные соединения, проявляющие активность в отношении рецептора CB1,также высоко липофильны. Эта высокая липофильность приводит к слабой растворимости в водной среде, которая ограничивает всасывание и биодоступность при пероральном введении. См., например, WO 2007/020502. Кроме того, соединения, которые быстро метаболизируются в печени, могут подвергаться метаболическим превращениям после всасывания из тонкого кишечника и перед попаданием в общий кровоток. Во время этого процесса возможно образование химически активного промежуточного продукта(ов) метаболизма, который впоследствии может реагировать с другими нуклеофилами в организме (такими как белки, ДНК, РНК и т.д.). Это может привести к проблемам, связанным с токсичностью. Этот так называемый "эффект первичного прохождения" также ограничивает биодоступность лекарственного препарата. См., например, WO 2007/020502. В заключение необходимо отметить, что существует потребность в соединениях, проявляющих активность в отношении рецептора CB1, которые бы обладали хорошей биодоступностю, имели повышенную активность in vivo, являлись высокоселективными по сравнению с CB2, более легкорастворимыми,чем применявшиеся ранее молекулы, и не образовывали бы химически активных метаболитов, которые могли бы впоследствии вызывать проблемы, связанные с токсичностью. Настоящее изобретение удовлетворяет эту потребность, а также обеспечивает связанные с этим преимущества. Краткое описание изобретения Настоящее изобретение обеспечивает соединение формулы (I)R2 представляет собой по меньшей мере один заместитель, независимо выбранный из группы, состоящей изR3 представляет собой по меньшей мере один заместитель, независимо выбранный из группы, состоящей изg) фенила; каждый R4 и R5 независимо выбран из группы, состоящей из водорода, метила и этила, или оба R4 иR5 могут вместе с атомом углерода, к которому каждый из них присоединен, образовать циклопропильное кольцо; или его фармацевтически приемлемую соль. Предпочтительный вариант осуществления настоящего изобретения относится к соединению, отличающемуся тем, что R1 представляет собой -OCF3 или -OCH3. Другой предпочтительный вариант осуществления настоящего изобретения относится к соединению, в котором R1 выбран из группы, состоящей из водорода, галоген, метила, -CF3, и циано-. В еще одном предпочтительном варианте осуществления настоящее изобретение относится к соединению, в котором R2 выбран из группы, состоящей из водорода, галоген, -CF3, -(C1-C4)алкила, -SCF3,-O-циклопропила, -OCF3 и циано-. Другой предпочтительный вариант осуществления настоящего изобретения относится к соединению, в котором R3 представляет собой -CF3. В еще одном предпочтительном варианте осуществления настоящее изобретение относится к соединению, в котором R3 выбран из группы, состоящей из -CF3, циклопропила и галогена. Настоящее изобретение обеспечивает соединение формулы (Ia)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изb) -циклопропила; или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает соединение формулы (Ib)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изc) галогена; или его фармацевтически приемлемую соль. В одном аспекте настоящее изобретение обеспечивает соединение формулы (Ic)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изg) фенила; или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает соединение формулы (Id)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изg) фенила; или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает соединение формулы (Ie)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изg) фенила; или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает соединение формулы (If)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изg) фенила; или его фармацевтически приемлемую соль. Настоящее изобретение обеспечивает промежуточное соединение формулы (XIVc)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изk) -O-(C1-C3)алкила. Настоящее изобретение обеспечивает промежуточное соединение формулы (XIVd)R2 представляет собой один или два заместителя, выбранных из группы, состоящей изc) -O(C1-C3)алкила. Настоящее изобретение обеспечивает промежуточное соединение формулы (XIVe)R2 представляет собой один или два заместителя, независимо выбранных из группы, состоящей изc) -O(C1-C3)алкила. Настоящее изобретение обеспечивает соединение, выбранное из группы, состоящей из примеров 1-61. В другом варианте осуществления настоящее изобретение обеспечивает промежуточное соединение формулы Настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение согласно любой из формул с (I) по (If), или некоторую его фармацевтически приемлемую соль, и некоторый фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Один из вариантов осуществления настоящего изобретения обеспечивает фармацевтическую композицию, в которой указанное соединение формулы (Id) или (If) или фармацевтически приемлемая соль такого соединения присутствует в композиции с оптической чистотой больше 90% э.и. Один из вариантов осуществления настоящего изобретения обеспечивает фармацевтическую композицию, отличающуюся тем, что указанное соединение формулы (Id) или (If) или фармацевтически приемлемая соль такого соединения присутствует в композиции с оптической чистотой больше 95% э.и. Настоящее изобретение обеспечивает соединение согласно любой из формул с (I) по (If) или его фармацевтически приемлемую соль для применения в терапии. Настоящее изобретение обеспечивает соединение согласно любой из формул с (I) по (If) или его фармацевтически приемлемую соль для применения в лечении расстройств, выбранных из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса,наблюдаемого во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает соединение согласно любой из формул с (I) по (If) или его фармацевтически приемлемую соль для применения для одновременного, раздельного или последовательного комбинирования с антипсихотическим средством в лечении расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает применение соединения согласно любой из формул с (I) по(If) или фармацевтически приемлемой соли такого соединения в изготовлении лекарственного препарата для лечения расстройства, выбранного из: расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает применение соединения согласно любой из формул с (I) по(If) или фармацевтически приемлемой соли такого соединения в изготовлении лекарственного препарата для применения в комбинированной терапии для лечения расстройства, выбранного из увеличения веса,ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством,причем указанный лекарственный препарат будут вводить в комбинации: одновременно, раздельно или последовательно, с антипсихотическим средством. Настоящее изобретение обеспечивает способ лечения патологического состояния, причем указанное патологическое состояние представляет собой ожирение, шизофрению, когнитивные нарушения,связанные с шизофренией, злоупотребление психоактивными веществами или алкогольную зависимость,прекращение курения, возникшее в результате лечения увеличение веса, наблюдаемое во время синдрома отмены курения, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения согласно любой из формул с (I) по (If) или фармацевтически приемлемой соли такого соединения в комбинации одновременно, раздельно или последовательно с антипсихотическим средством. Один из вариантов осуществления настоящего изобретения обеспечивает способ, в котором указанное патологическое состояние представляет собой расстройство пищевого поведения, связанное с чрезмерным потреблением пищи. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой ожирение. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой шизофрению. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой когнитивные нарушения, связанные с шизофренией.-7 015175 Один из вариантов осуществления настоящего изобретения обеспечивает способ, в котором указанное патологическое состояние представляет собой злоупотребление психоактивными веществами или алкогольную зависимость. Другой вариант осуществления настоящего изобретения обеспечивает способ, в котором указанное патологическое состояние представляет собой прекращение курения. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой возникшее в результате лечения увеличение веса,наблюдаемое во время синдрома отмены курения. Настоящее изобретение обеспечивает способ лечения патологического состояния, отличающийся тем, что указанное патологическое состояние представляет собой шизофрению, увеличение веса, ожирение, когнитивные нарушения, связанные с шизофренией, злоупотребление психоактивными веществами или алкогольную зависимость, прекращение курения, возникшее в результате лечения увеличение веса,наблюдаемое во время лечения атипичным антипсихотическим средством, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения согласно любой из формул с (I) по (If) или фармацевтически приемлемой соли такого соединения. Один из вариантов осуществления настоящего изобретения обеспечивает способ, в котором указанное патологическое состояние представляет собой шизофрению. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой увеличение веса. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой ожирение. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, отличающийся тем, что указанное патологическое состояние представляет собой когнитивные нарушения, связанные с шизофренией. В еще одном варианте осуществления настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой злоупотребление психоактивными веществами или алкогольную зависимость. Один из вариантов осуществления настоящего изобретения обеспечивает способ, в котором указанное патологическое состояние представляет собой прекращение курения. В еще одном варианте осуществления, настоящее изобретение обеспечивает способ, в котором указанное патологическое состояние представляет собой возникшее в результате лечения увеличение веса,наблюдаемое во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает способ лечения патологического состояния у млекопитающего, которого можно вылечить с помощью блокады CB1 рецепторов через механизм обратного агонизма,указанный способ включает введение пациенту эффективного количества соединения согласно любой из формул (I) или (Ia) или некоторой фармацевтически приемлемой соли такого соединения. Настоящее изобретение обеспечивает способ лечения патологического состояния у млекопитающего, которое можно вылечить путем блокады рецепторов CB1 по механизму обратного агонизма, в комбинации (введение одновременно, раздельно или последовательно) с антипсихотическим средством, причем указанный способ включает введение пациенту эффективного количества соединения согласно любой из формул (I) или (Ia) или фармацевтически приемлемой соли такого соединения. Соединения по формулам (I), (Ia), (Ib), (Ic) и (Ie) могут содержать один или более центров асимметрии и могут поэтому находиться в форме смесей диастереоизомеров, рацемических смесей, отдельных знантиомеров и отдельных диастереомеров. Все подобные изомерные формы указанных соединений формул (I), (Ia), (Ib), (Ic) и (Ie) следует рассматривать как аспекты настоящего изобретения. Хотя соединения формул (I), (Ia), (Ib), (Ic) и (Ie) в рацемической форме являются полезными агентами, обычно предпочтительным является введение соединений формул (I), (Ia), (Ib), (Ic) и (Ie), которые обогащены одной из энантиомерных форм. Предпочтительный аспект настоящего изобретения обеспечивает соединения формул (Id) или (If), которые представляют собой, по существу, чистые энантиомеры. Соответственно, каждый из следующих конкретных классов соединений формул (I), (Ia), (Ib) , (Ic), (Id),(Ie) и (If) следует считать аспектами настоящего изобретения:(a) соединения с энантиомерной чистотой выше 80% энантиомерного избытка;(b) соединения с энантиомерной чистотой выше 90% энантиомерного избытка;(c) соединения с энантиомерной чистотой выше 95% энантиомерного избытка; и(d) соединения с энантиомерной чистотой выше 99% энантиомерного избытка. Эти энантиомерно чистые соединения можно получить путем очистки требуемого энантиомера соединения формулы (I), (Ia), (Ib), (Ic) и (Ie) из смеси энантиомеров данного соединения. Требуемый энантиомер соединения формулы (I), (Ia), (Ib), (Ic) и (Ie) также можно получить путем синтеза согласно следующим общим схемам, путем использования предшественников, которые являются, по существу, энантиомерно чистыми. Для специалистов в данной области очевидно, что любое разделение конечных соединений или промежуточных соединений обеспечит соединения формулы (I), (Ia), (Ib), (Ic) и (Ie), по существу, в энантиомерно чистой форме, в результате чего можно получить, например, соединения фор-8 015175 мул (Id) или (If), и они будут использовать наиболее удобный способ. Также должно быть очевидно, что, по существу, чистый диастереомер можно выделить из смеси диастереомеров, применяя способы, известные в данной области. Способы очистки диастереомеров включают применение хроматографии и кристаллизации. Смесь энантиомеров можно разделить на отдельные, по существу, чистые энантиомеры с помощью метода, известного как разделение. Энантиомеры можно разделить путем применения хроматографии, используя хиральную неподвижную фазу. Подходящие хиральные твердые фазы включают неподвижные фазы на основе полисахаридов, такие какChiralpak AD и Chiracel OJ (продаваемые Chiral Technologies, Inc.). Дополнительно, энантиомеры основных соединений можно разделить путем превращения в смесь диастереомерных солей путем обработки хиральной кислотой. Необходимую диастереомерную соль выделяют, например, путем кристаллизации. По существу, энантиомерно чистое основное соединение можно выделить путем обработки основанием. Примеры хиральных кислот включают (-)-винную кислоту, (+)-винную кислоту, (-)-миндальную кислоту, (+)-миндальную кислоту, (-)-дитолуилвинную кислоту и (+)-дитолуилвинную кислоту. Энантиомеры кислых соединений можно разделить аналогичным образом, используя, по существу, энантиомерно чистое основание. Примеры таких оснований включают Rметилбензиламин, Sметилбензиламин и бруцин. Другой способ разделения рацемической смеси включает реакцию, по существу, с энантиомерно чистым хиральным реагентом (называемым в данной заявке хиральным вспомогательным соединением) с образованием ковалентной связи. Эта реакция дает смесь диастереомеров, которую очищают методами,известными в данной области. Затем все хиральное вспомогательное соединение или его часть можно отщепить от молекулы, в результате чего будет получено соединение, которое является, по существу,энантиомерно чистым. В некоторых случаях центр асимметрии, введенный хиральным вспомогательным соединением, можно сохранить в конечном продукте. Для среднего специалиста в данной области очевидно, что некоторые описанные промежуточные соединения могут существовать в формах с различными положениями присоединения водорода, и поэтому они рассматриваются как таутомерные. Отдельные таутомеры, а также смеси таутомеров, рассматриваются как аспект настоящего изобретения. Каждая из форм таутомера может существовать, превращаться в другие формы и претерпевать таутомеризации при заданных условиях. Соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) являются селективными в отношении к рецептору CB1 по сравнению с рецептором CB2. Существуют данные, указывающие на то, что эти лиганды рецептора CB1 действуют как обратные агонисты. Соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) представляют собой модуляторы CB1 рецептора и по этой причине являются пригодными для предотвращения и лечения патологических состояний, связанных с CB1 рецептором. Такие патологические состояния включают, например, нарушения памяти,когнитивные расстройства, негативные симптомы шизофрении, тревожные расстройства, депрессию,стресс, болезнь Паркинсона, расстройства, связанные со злоупотреблением психоактивными веществамиand Statistical Manual of Mental Disorders 4 ое изд., (1994). DSM-IV и DSM-IV-TR были подготовлены Целевой рабочей группой по номенклатуре и статистике Американской психиатрической ассоциации и содержат описание диагностических категорий. Для специалиста в данной области очевидно, что существуют альтернативные номенклатуры, нозологии и системы классификации патологических физиологических состояний и что эти системы эволюционируют вместе с прогрессом медицинской науки. Соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) также можно применять для облегчения увеличения веса вне зависимости от того, можно ли классифицировать набравшего вес субъекта как страдающего ожирением в клиническим смысле. В качестве практического осуществления описанных способов терапии можно вводить эффективное количество соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) пациенту, нуждающемуся в таком лечении или профилактике. Необходимость профилактического введения согласно способам настоящего изобретения определяют с помощью хорошо известных факторов риска. Эффективное количество отдельного соединения определяет, в конечном итоге, лечащий врач, отвечающий за конкретный случай,но оно зависит от таких факторов, как конкретное заболевание, от которого нужно вылечить, тяжесть заболевания и другие заболевания или патологические состояния, от которых страдает пациент, выбранного пути введения других лекарственных продуктов и терапии, которая может одновременно требоваться пациенту, а также других факторов по усмотрению лечащего врача. Величина профилактической или терапевтической дозы соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie) или (If) будет, конечно же,варьировать в зависимости от природы и тяжести указанного патологического состояния, от которого нужно вылечить, а также от конкретного соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie) или (If) и пути его введения. Дозу можно вводить в виде одной ежедневной дозы, либо общую дневную дозировку можно вводить, разделив на дозы для двух, трех или четырех приемов в день. Более того, на основании свойств отдельного соединения, выбранного для введения, и/или характеристики лекарственной формы (т.е. изме-9 015175 ненное высвобождение), дозу можно вводить реже, например еженедельно, дважды в неделю, ежемесячно и т.д. Единичная доза для менее частого введения может быть соответственно больше. При введении трансдермальным путем или посредством непрерывного внутривенного введения раствора введение дозировки, конечно же, будет скорее непрерывным, чем с перерывами, на протяжении всего режима дозирования. Подробное описание изобретения Выше в тексте и на протяжении всего описания настоящего изобретения следующие термины, если не указано иначе, имеют приведенные ниже значения. В данной заявке термин "(C1-C4)алкил" относится к линейной или разветвленной одновалентной насыщенной алифатической цепи, содержащей от 1 до 4 атомов углерода, и включает, без ограничения,метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Термин "(C1-C4)алкил" включает в свое определение термин "(C1-C3)алкил". В данной заявке термин "галогена" относится к атому хлора, брома или фтора, если в тексте заявки не указано другое. В данной заявке термин "Ph" относится к фенильной группе. В данной заявке термин "-O-(C1-C3)алкил" относится к линейной или разветвленной одновалентной насыщенной алифатической цепи, содержащей от 1 до 3 атомов углерода, присоединенных к атому кислорода. Обычно "-O-(C1-C3)алкильные" группы включают метоксильную, этоксильную, пропоксильную, изопропоксильную и тому подобные группы. В данной заявке термин "фторзамещенный (C1-C3)алкил" относится к линейной или разветвленной одновалентной, насыщенной алифатической цепи, содержащей от 1 до 3 атомов углерода, в которой от 1 до 7 атомов водорода замещены атомом фтора, и включает, без ограничения, (-CF3), (-CF2CF3), (-CHF2),(-CF2CH3) и (-CH2CF3)."Агонист(ы)" обозначает такие соединения, которые стимулируют функциональный ответ рецептора."Нейтральный(е) антагонист(ы)" обозначает такие соединения, которые не изменяют базальный уровень активности рецептора, но блокируют функциональную активность агонистов и обратных агонистов путем возвращения функционального ответа к таковому в базальном (фоновом) состоянии."Обратный(е) агонист(ы)" обозначает такие соединения, которые демонстрирую присущую им отрицательную активность путем обращения конститутивной активности рецептора. Обратные агонисты ингибируют или обращают активность агонистов."Антагонист(ы)" обозначает такие соединения, которые являются нейтральными антагонистами."Ожирение" - это патологическое состояние, заключающееся в большом количестве жира в организме. Человека считают страдающим ожирением, если он или она имеет индекс массы тела (BMI), равный 30 кг/м 2 или выше. Человека с BMI = 27-30 обычно считают имеющим лишний вес. Традиционно люди с нормальным весом имеют BMI от 19,9 до 25,9. Ожирение может возникать по любой причине,либо генетической, либо обусловленной условиями внешней среды. Примеры расстройств, которые могут приводить к ожирению или быть причиной ожирения, включают переедание, пониженную физическую активность и патологические состояния, при которых снижена активность метаболизма."Фармацевтически приемлемые соли" и "соли" относятся к относительно нетоксичным, неорганическим и органическим солям присоединения кислоты и солям присоединения основания, соединений согласно настоящему изобретению. См., например, S.M. Berge, и др., "Pharmaceutical Salts", J. Pharm. Sci.,66, 1-19 (1977). Предполагается, что "фармацевтическая композиция" и "композиция" охватывают продукт, содержащий активный ингридиент, предпочтительно присутствующий в фармацевтически эффективных количествах, и инертный(е) ингридиент(ы) (фармацевтически приемлемые вспомогательные вещества),который образует носитель, а также любой продукт, который получен прямо или опосредованно в результате комбинирования, комплексообразования или агрегации любых двух или более указанных ингридиентов, или в результате диссоциации одного или более указанных ингридиентов, или в результате других типов реакций или взаимодействий одного или более указанных ингридиентов. В соответствии с этим фармацевтические композиции согласно настоящему изобретению охватывают любые композиции,полученные путем смешивания соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie) или (If) и любых фармацевтически приемлемых вспомогательных веществ."Предотвращение" (ожирения) относится к предотвращению возникновения ожирения, если указанное лечение осуществляют перед началом развития состояния тучности. Кроме того, если лечение применяют к уже тучным субъектам, ожидают, что такое лечение предотвратит или предотвратит развитие, медицинских осложнений ожирения (например, артериосклероза, диабета II типа, синдрома поликистозных яичников, сердечно-сосудистых заболеваний, остеоартрита, дерматологических расстройств,гипертонии, устойчивости к инсулину, гиперхолестеринемии, гипертриглицеридемии и желчекаменной болезни)."Сольват" означает физическую ассоциацию какого-либо соединения с одной или более молекулами растворителя. Такая физическая ассоциация включает образование водородных связей. В некоторых примерах сольват можно выделить, например, если одна или более молекул растворителя встраиваются в- 10015175 кристаллическую решетку кристаллического тела. "Сольват" охватывает как жидкофазные, так и поддающиеся выделению сольваты. Типичные сольваты включают гидраты, этаноляты, метаноляты и тому подобные."Лечение" в данной заявке, если не указано другое, означает обращение, снижение выраженности,подавление развития или предотвращение расстройства или патологического состояния, к которому применим такой термин, или одного или более симптомов такого расстройства или патологического состояния. Термин "терапия" в данной заявке, если не указано другое, относится к акту лечения, при этом"ТФУ" в данной заявке, если не указано другое, обозначает трифторуксусную кислоту."р.о." в данной заявке, если не указано другое, означает перорально."ТГФ" в данной заявке, если не указано другое, обозначает тетрагидрофуран."DMAP" в данной заявке, если не указано другое, обозначает 4-(N,N-диметиламино)пиридин."MTBE" в данной заявке, если не указано другое, обозначает метил-трет-бутиловый эфир."TBTU" в данной заявке, если не указано другое, обозначает тетрафторбората O-(бензотриазол-1 ил)-N,N,N',N'-тетраметилуроний."EDCI" в данной заявке, если не указано другое, обозначает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида."ДМФ" в данной заявке, если не указано другое, обозначает диметилформамид."psig" в данной заявке, если не указано другое, обозначает манометрическое давление в фунтах на квадратный дюйм."NaOtBu" и "KOtBu" в данной заявке, если не указано другое, обозначает трет-бутоксид натрия и трет-бутоксид калия соответственно."TosCl" в данной заявке, если не указано другое, обозначает п-толуолсульфонилхлорид."MeOH" в данной заявке, если не указано другое, обозначает метанол."EtOAc" в данной заявке, если не указано другое, обозначает этилацетат."HOBt" в данной заявке, если не указано другое, обозначает N-гидроксибензотриазол."DMEA" в данной заявке, если не указано другое, обозначает N,N-диметилэтаноламин."Ret." в данной заявке, если не указано другое, обозначает время удерживания."ДМСО" в данной заявке, если не указано другое, обозначает диметилсульфоксид."Hex" в данной заявке, если не указано другое, обозначает гексаны. Для терапевтического применения, обсуждаемого в данной заявке, соль заявленных соединений должна быть фармацевтически приемлемой. Дополнительные подробности относительно фармацевтически приемлемых солей можно найти в журнале. Journal of Pharmaceutical Science, 66, 1 (1977). Должно быть очевидно, что соединения согласно настоящему изобретению, описанные ниже, могут существовать в виде отдельных кристаллических форм, полученных путем кристаллизации в контролируемых условиях. Схема I В схеме I соединение формулы (II) можно получить способом, описанным Андрейчиковым и коллегами (Андрейчиков и др. Журнал органической химии 22(10), 2208-13 (1986, в котором смесь амина формулы (1) и альдегида формулы (2) обрабатывали эфиром пировиноградной кислоты (3), где Q1 представляет собой C1-3 алкильную группу, в подходящем растворителе. Подходящие растворители включают ледяную уксусную кислоту, диоксан, тетрагидрофуран, бензол и толуол. Эту реакцию также можно проводить в присутствии смеси растворителей, содержащей указанные растворители. Подходящие эфиры пировиноградной кислоты включают этилпируват. Указанная реакция может протекать при температурах в диапазоне между комнатной температурой и точкой кипения данного растворителя или смеси растворителей. В некоторых случаях продукт (II) может осаждаться в ходе реакции или при добавлении растворителя, в котором указанный продукт плохо растворим. Эти растворители включают диэтиловый эфир, гептан, MTBE, ацетон, воду, толуол и пентан и их смеси. Если образовался осадок, соединение формулы (II) можно выделить путем фильтрации и вакуумной сушки. В качестве альтернативы указанное соединение можно выделить путем концентрирования реакционной смеси и хроматографирования полученного остатка или путем водной экстракции и концентрирования и хроматографирования полученных органических экстрактов. В схеме II соединение формулы (III) можно получить путем обработки соединения формулы (II) водой, возможно, в присутствии кислоты или смеси кислот. Эту реакцию можно также проводить в присутствии дополнительных растворителей, таких как тетрагидрофуран, метанол, уксусная кислота и толуол. Подходящие кислоты включают соляную кислоту, серную кислоту, уксусную кислоту и трифторуксусную кислоту. Подходящие условия реакции включают обработку соединения формулы (II) уксусной кислотой, водой и трифторуксусной кислотой при примерно температуре окружающей среды в течение около 1 ч или обработку соединения формулы (II) смесью уксусной кислоты и соляной кислоты при примерно комнатной температуре в течение около 22 ч. Также соединение формулы (III) можно получить путем гидролиза уксусной кислотой при приблизительно 80C в течение около 8 ч. Также соединение формулы (III) можно получить путем гидролиза при смешивании с ионообменной смолой Dowex 502200 в водном метаноле при примерно температуре окружающей среды в течение около 5 ч. Также соединение формулы (III) можно получить путем гидролиза трифторуксусной кислотой в двухфазной смеси с растворителями толуолом и водой в течение около 1 ч при примерно комнатной температуре. Часто эффективным оказывается проведение этой реакции в присутствии по меньшей мере одного эквивалента 2,5-диметокситетрагидрофурана. После образования соединения формулы (III) его можно выделить путем вливания в воду и экстракции органическими растворителями, такими как дихлорметан, диэтиловый эфир, этилацетат, изопропилацетат и толуол. Полученный экстракт можно высушить над десиккантом,таким как сульфат натрия, и концентрировать, чтобы обеспечить продукт в виде неочищенной смеси. Часто использование этого соединения непосредственно в следующей реакции является более эффективным, чем проведение его дополнительной очистки. В некоторых случаях выливание реакционной смеси на ледяную воду обеспечивает осаждение и выделение соединения формулы (III) путем фильтрации. Схема III В схеме III соединение формулы (IV) можно получить путем обработки раствора соединения формулы (III) соединением формулы (IV). Подходящие растворители включают дихлорметан, тетрагидрофуран или толуол, и реакцию можно проводить при температуре в диапазоне от комнатной температуры до приблизительно 80C. Эту реакцию можно ускорять путем удаления воды по мере ее образования путем обработки дегидратирующим средством, таким как Na2SO4 или MgSO4, или с помощью молекулярных сит 4 или азеотропного удаления воды. Эту реакцию также можно проводить в присутствии катализатора, такого как п-толуолсульфоновая кислота, уксусная кислота или другое кислое соединение. Соединение формулы (IV) можно выделить, если необходимо, способами, изветными в данной области,например путем осаждения растворителем, таким как изопропилацетат, или путем хроматографии на силикагеле. Схема IV В схеме IV соединение формулы (I), (Ia), и (Ib) можно получить путем обработки соединения формулы (IV) в подходящих восстановительных условиях. Подходящие восстановительные условия вклю- 12015175 чают обработку NaCNBH3 в присутствии уксусной кислоты, возможно, с растворителем, таким как дихлорметан, при приблизительно комнатной температуре в течение от около 30 мин до приблизительно 12 ч, обработку NaBH4 в спиртовом растворителе, обработку Na(OAc)3BH в присутствии трифторуксусной кислоты в подходящем растворителе, таком как толуол, при комнатной температуре в течение около 23 ч, и условия гидрогенизации, в которых раствор соединения формулы (IV) обрабатывали подходящим металлическим катализатором в атмосфере водорода. Подходящие растворители включают метанол, этанол, этилацетат и тетрагидрофуран. Подходящие металлические катализаторы включают палладий на углероде и двуокись платины. Соединение формулы (IV) растворяли в смеси этанола и метанола и помещали в атмосферу водорода в присутствии подходящего катализатора, такого как Pd/C, при приблизительно комнатной температуре в течение около 24 ч. Реакционную смесь фильтровали и концентрировали под вакуумом для получения соединения формулы (I), (Ia) или (Ib). Соединение формулы (I), (Ia) или(Ib) можно выделять такими способами, как водная экстракция или осаждение продукта. Дополнительную очистку можно осуществить при помощи таких методик, как SCX-2 ионообменная хроматография,хроматография на силикагеле, сверхкритическая жидкостная хроматография, обращенно-фазовая хроматография и кристаллизация. Очистку также можно проводить путем обработки смесей, содержащих соединение формулы (I), (Ia) или (Ib), кислотой, с получением соли соединения формулы (I), (Ia), или (Ib),которую затем можно очистить путем кристаллизации, с получением очищенной соли указанного соединения формулы (I), (Ia) или (Ib). Предпочтительные соли включают соли, образованные путем присоединения соляной кислоты и п-толуолсульфоновой кислоты. При синтезе соединения формулы (I), (Ia) или (Ib), любое из промежуточных соединений формулы(III) или формулы (IV) можно использовать непосредственно в последующих реакциях без очистки неочищенных промежуточных соединений. Отдельные энантиомеры соединений формулы (I), (Ia) или (Ib) как правило являются более предпочтительными, чем соответствующие рацематы. Эти энантиомеры можно получить путем разделения соединения формулы (I), (Ia) или (Ib), с помощью таких методик, как препаративная хроматография с использованием хиральной неподвижной фазы. Энантиомеры также можно получить путем разделения,которое включает образование соли указанной рацемической смеси с оптически активной кислотой и очистку необходимой диастереомерной соли. Необходимую диастереомерную соль можно очистить путем кристаллизации. В качестве альтернативы можно разделить любое из промежуточных соединений формулы (II), (III) или (IV) с получением, по существу, отдельного энантиомера, который затем можно подвергнуть превращением с применением способов, описанных выше, которые дадут соединение формулы (I), (Ia) или (Ib) в энантиомерно очищенной форме, такой как соединения формулы (Ic), (Id), (Ie) или (If). Промежуточные соединения формулы (II), (III) или (IV) можно получить путем разделения соединений из соответствующего рацемического соединения с применением таких методик, как препаративная хроматография с использованием хиральной неподвижной фазы. Схема V Альтернативный и часто предпочтительный способ получения очищенных энантиомеров соединения формулы (III) представлен на схеме V. Рацемическое соединение формулы (III) подвергали реакции с соединением формулы (5), в которой Q2 представляет собой водород, галоген или (C1-C3)алкоксигруппу, в результате чего получили диастереоизомерную смесь соединений формулы (XIVc), (XIVd) или(XIVe) и (Vb). Предпочтительные соединения формулы (V) включают Rметилбензиламин, S-метилбензиламин, R-4-хлорметилбензиламин, S-4-хлорметилбензиламин, R-4-метоксиметилбензиламин и S-4-метоксиметилбензиламин. Эту конденсацию можно выполнить путем объединения соединения формулы (III) и соединения (5) в инертном растворителе, таком как метиленхлорид, тетрагидрофуран или толуол, и возможно нагревания от комнатной температуры до приблизительно 80C до- 13015175 завершения реакции. Эту реакцию можно ускорить путем удаления воды по мере ее образования путем обработки дегидратирующим средством, таким как Na2SO4 или MgSO4, или с помощью молекулярных сит 4 или азеотропного удаления воды. Эту реакцию также можно вести в присутствии катализатора,такого как п-толуолсульфоновая кислота, уксусная кислота или другое кислое соединение. Диастереомеры формулы (XIVc), (XIVd) или (XIVe) и (Vb) затем разделяли с применением таких методик, как хроматография на силикагеле или кристаллизация из инертных растворителей, таких как изопропанол или смеси растворителей. Необходимый диастереомер (обозначенный как (XIVc), (XIVd) или (XIVe) в схеме V) затем гидролизовали для получения очищенного энантиомера формулы (IIIa). Подходящие условия гидролиза включают обработку раствора необходимого диастереомера в уксусной кислоте водной соляной кислотой. В некоторых случаях неочищенный энантиомер (IIIa) может содержать значительные количества димера формулы (VI). В схеме V рацемическое соединение формулы (III) может быть неочищенным продуктом, полученным способом, представленным на схеме II. Кроме того, очищенный энантиомер формулы (IIIa) можно использовать непосредственно после реакции гидролиза без дополнительной очистки в процессе, представленном на схеме III. В схеме V (R)-энантиомер соединения (5) был выбран для объяснения процесса. Для специалиста в данной области очевидно, что (S)-энантиомер соединения (5) можно также использовать в этом процессе. Выбрать, какой из (R)- и (S)-энантиомера использовать, можно в зависимости от того, который из них даст необходимый диастереомер, который будет легче выделить. Схема VI В схеме VI соединение формулы (IVb) можно также получить путем обработки соединения формулы (VI) соединением (4) в тех же условиях, что описаны для реакции соединения (IIIa) с (4). В некоторых случаях нагревание реакционной смеси в микроволновом реакторе может быть более эффективным. Схема VII В схеме VII соединение формулы (VII) можно получить, как описано. Соединение со структурой (6) объединяют с соединением (1) при использовании реагентов, таких как TBTU, EDCI или HOBt, и возможно катализаторов, таких как DMAP, в подходящем растворителе, таком как диметилформамид и триэтиламин, при приблизительно комнатной температуре в течение около 18 ч. Водно-кислотная экстракция, концентрирование и хроматография на силикагеле или измельчение с растворителями, такими как гексаны, давало соединение со структурой (7). Кетоновую группу соединения (7) переводили в спиртовую группу соединения (8) с помощью восстанавливающего реагента, такого как борогидрид натрия, в смеси растворителей, таких как вода, метанол, этанол и DME, при примерно от комнатной температуры до 0C. Альтернативный и часто предпочтительный способ: соединение (7) можно подвергнуть хиральному восстановлению для получения соединения (8), в котором преобладает один из энантиомеров. Способы хирального восстановления кетонов известны в данной области (см., например, Singh, Synthesis 605(1991. Подходящие хиральные восстановительные условия включают обработку в условиях гидрогенизации, с применением хирального катализатора, такого как (R-Tol-Binap) RuCl2, и восстановление опо- 14015175 средует хиральный оксазаборолидиновый катализатор (также известное как CBS- восстановление; Corey,Bakshi, и Shibata, J. Amer. Chem. Soc. 109, 5551 (1987. Указанную реакцию проводили в сосуде Парра в атмосфере гидрогенизации в подходящем растворителе, таком как метанол, при приблизительно 80C в течение около 24 ч. Соединение (8) выделяли путем водно-кислотной экстракции и концентрирования. На следующем этапе получали лактамовое соединение формулы (VII) путем циклизации соединения (8) в растворителе, таком как тетрагидрофуран, и с добавлением тозилхлорида, с помощью добавления по каплям раствора основания, такого как KOt-Bu, при примерно -40C. Реакционную смесь нагревали до комнатной температуры и добавляли водный хлорид аммония и концентрировали. Остаток растворяли в подходящем растворителе, таком как этилацетат, промывали солевым раствором и высушивали. Экстракция и очистка способами, известными в данной области, такими как хроматография на силикагеле,позволяют получить соединение формулы (VII). В качестве альтернативы, соединение (8) подвергали условиям циклизации, таким как присутствие н-бутиллития, при приблизительно -78C в подходящем растворителе, таком как тетрагидрофуран, в течение около 30 мин. Добавляли птолуолсульфонилхлорид. Через еще приблизительно 18 ч способами, известными в данной области, такими как хиральная хроматография, соединение (VII) очищали. Схема VIII В схеме VIII соединение формулы (VIII), в которой G представляет собой водород, C1-4 алкил, C1-4 галогеналкил или фенил, возможно замещенный C1-3 алкилом или галогеном, получали путем обработки соединения формулы (VII) соединением формулы GCOOQ3, в которой Q3 представляет собой C1-4 алкил,в основной среде, такой как гидрид натрия, в растворителе, таком как толуол, при приблизительно комнатной температуре, после чего проводили хроматографию на силикагеле. Затем получали соединение(IX) путем обработки соединения (VIII) соединением формулы Q4SO2N3, в которой Q4 представляет собой фенил, возможно замещенный C1-3 алкилом, C1-3 алкокси, галогеном или NHCO C1-3 алкилом. Указанную реакцию можно проводить в растворителе, таком как ацетонитрил, при помешивании в течение приблизительно 30 мин. Экстракция и очистка способами, известными в данной области, такими как хроматография на силикагеле, позволяют получить соединение формулы (IX). Схема IX В схеме IX соединение формулы (I), (Ia) и (Ib) можно получить путем обработки раствора диазолактама формулы (IX) соединением (4) в инертном растворителе с подходящим катализатором. Подходящие катализаторы включают Rh2(OAc)4-соединение формулы (IX) и соединение (4) растворяли в толуоле в атмосфере азота и нагревали до приблизительно 45C. Добавляли катализатор, Rh2(OAc)4, и реакционную смесь продолжали помешивать при приблизительно 45C в течение около 30 мин. Концентрирование реакционной смеси давало неочищенное соединение формулы (I), (Ia) или (Ib), которое очищали способами, известными в данной области, такими как SCX-2 ионообменная хроматография, хроматография на силикагеле и сверхкритическая жидкостная хроматография. Схема X- 15015175 В схеме X соединение (4) получали путем обработки соединения (9), в котором R10 представляет собой водород, C1-4 алкил или C1-4 алкил-C(O)-, ацетонитрилом в присутствии кислоты, чтобы обеспечить соединение формулы (10). Подходящие кислоты включают серную кислоту и трифторуксусную кислоту. После объединения вышеперечисленного реакционную смесь нагревали до приблизительно 45C в течение около 28 ч. Реакционную смесь охлаждали до приблизительно 0C и гасили реакцию водным гидроксидом натрия. Соединение (10) выделяли путем осаждения ации в этаноле и воде. Соединение (10) нагревали в растворе водной соляной кислоты до приблизительно 90C в течение около 20 ч. Реакцию гасили с помощью льда и гидроксида натрия. Соединение (4) выделяли после нескольких промывок с помощью трет-бутилметилового эфира и тетрагидрофурана и осаждения в гептане. Схема XI В схеме XI соединение (4) получали из соединения формулы (11). Безводный хлорид церия (III) получали путем нагревания гептагидрата хлорида церия (III) до приблизительно 140C под вакуумом и затем суспендировали в подходящем растворителе, таком как тетрагидрофуран, при комнатной температуре. Реакционную смесь охлаждали до -78C и добавляли по каплям метиллитий. К раствору по каплям добавляли соединение (11) в тетрагидрофуране. Реакционную смесь перемешивали при приблизительно-78C в течение от около 30 мин до 4 ч и нагревали приблизительно до 20C. Через приблизительно от 1 до 20 ч реакционную смесь охлаждали до приблизительно -78C и добавляли водный раствор аммиака. Реакционную смесь нагревали до приблизительно 20C в течение около 1 ч. Соединение (4) очищали известными в данной области способами, такими как хроматография на силикагеле. Продукты и примеры Условия методов ВЭЖХ для всех продуктов и примеров. Метод 1. Колонка ЖХ: Waters XTerra C18 2,150 мм 3,5 мкМ Градиент: 5-100% ацетонитрил/метанол (50/50) вес./0,2% формиата аммония 7,0 мин, затем выдерживание при 100% в течение 1,0 мин Температура колонки: 5010C Температура автосэмплера: окружающей среды Расход: 1,0 мл/мин Сигнал детектировали на длине волны 214 нм. Метод 2. Колонка ЖХ: Waters XTerra C18 2,150 мм 3,5 мкМ Градиент: 5-100% ацетонитрил/метанол (50/50) вес./0,2% формиата аммония 3,5, затем выдерживание при 100% в течение 0,5 мин Температура колонки: 5010C Температура автосэмплера: окружающей среды Расход: 1,0 мл/мин Сигнал детектировали на длине волны 214 нм. Метод 3. Колонка ЖХ: Phenomenex Gemini C18 2,050 мм 3,0 мкМ Градиент: 5-100% ACN ACN вес./0,1% муравьиной кислоты 7,0 мин, затем выдерживание при 100% в течение 1,0 мин Температура колонки: 5010C Температура автосэмплера: окружающей среды Расход: 1,0 мл/мин Сигнал детектировали на длине волны 300 нм. Метод 4. Колонка ЖХ: Zorbax RX-C18 4,6250 мм 5 мкМ Градиент: 50-90% ацетонитрил вес./0,03 М фосфатный буфер (фосфатный буфер = 5,52 г NaH2PO4 и 1,4 мл Н 3 РО 4 в 2 л Milli-Q H2O) 15 мин Температура колонки: 40C Температура автосэмплера: окружающей среды Расход: 1,5 мл/мин Сигнал детектировали на длине волны 260 нм 3-(Трифторметокси)бензальдегид (15,0 г, 78,6 ммоль), 4-фторанилин (22,4 мл, 236 ммоль) и этилпируват (8,65 мл, 78,6 ммоль) перемешивали в ледяной уксусной кислоте (60 мл) при температуре окружающей среды в течение 72 ч. Осадок отфильтровывали и промывали смесью гептан/МТВЕ (3:1). Сушили под вакуумом с получением указанного в заголовке соединения (20,9 г, выход: 60%) в виде желтоватого порошка. МС (масс-спектрометрия) (m/z): 445 (M-1). Приведенные ниже соединения получали, по существу, в соответствии с методикой получения препарата 1. Таблица 1 Смесь 3-метилбензальдегида (1,68 мл, 14,21 ммоль), этилпирувата (1,42 мл, 12,93 ммоль), уксусной кислоты (1,85 мл, 32,30 ммоль) в безводном тетрагидрофуране (3,15 мл, 38,75 ммоль) перемешивали в атмосфере азота. В течение 2 мин добавляли по каплям 4-(трифторметокси)анилин (3,84 мл, 28,42 ммоль). Полученный желтый раствор нагревали до 80C в течение 12 ч. Охлаждали до температуры окружающей среды, отфильтровывали желтый осадок и промывали смесью 10% ацетон/вода (50 мл). Желтое твердое вещество сушили под вакуумом при 40C с получением указанного в заголовке соединения(4,18 г, 64%). МС (m/z): 509,1 (M+1). Приведенные ниже соединения получали, по существу, в соответствии с методикой получения препарата 17. Таблица 2-5-Фенил-1-(4-трифторметоксифенил)-3-(4-трифторметоксифениламино)-1,5 Бензальдегид (50,0 г, 472 ммоль), этилпируват (55,3 г, 476 ммоль) и уксусную кислоту (350 мл) смешивали при температуре окружающей среды в атмосфере азота и перемешивали в течение 10-15- 21015175 мин. В течение 1 ч добавляли по каплям 4-(трифторметокси)анилин (183,8 г, 1038 ммоль), поддерживая температуру при 35C. Полученную смесь перемешивали при температуре окружающей среды в течение ночи (16 ч). Добавляли изопропиловый спирт (350 мл) и воду (350 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 15 мин. Фильтровали и твердое вещество промывали смесью изопропиловый спирт:вода (1:1) (2150 мл). В течение ночи сушили в вакуумной печи при 40C с получением указанного в заголовке соединения в виде желтого твердого вещества (191,4 г, выход: 82%). 1 3-(Трифторметокси)бензальдегид (25,0 г, 132 ммоль) и этилпируват (15,3 г, 132 ммоль) в ледяной уксусной кислоте (125 мл) перемешивали при температуре окружающей среды в течение 10 мин. Продолжая перемешивание, в течение 15 мин добавляли по каплям 4-(трифторметил)анилин (46,7 г, 290 ммоль), данный раствор нагревали до 30C и перемешивали в течение 22-24 ч. Раствор охлаждали до 26C, добавляли изопропиловый спирт (125 мл) и воду (125 мл). Раствор перемешивали при комнатной температуре в течение 15 мин, полученный осадок отфильтровывали и промывали смесью изопропиловый спирт/вода (1:1) (100 мл 2). Сушили под вакуумом при 40C с получением указанного в заголовке соединения (60,46 г, 84%) в виде белого порошка. ВЭЖХ (методика 4), время удерживания: 10,9 мин. МС (m/z): 545,1 (M-1). 1-1-(4-изопропилфенил)-3-(4-изопропилфениламино)-5-(3-трифторметоксифенил)1,5-дигидропиррол-2-он (2,0 г, 4,04 ммоль), ледяную уксусную кислоту (30 мл) и соляную кислоту (20 мл). Данную реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Вливали в смесь лед/вода, осадок отфильтровывали, промывали водой и сушили под вакуумом с получением желтого твердого вещества. Данное желтое твердое вещество собирали и повторяли приведенную выше методику с получением указанного в заголовке соединения (0,9 г, 59%). МС (m/z): 378 (M+1). Приведенные ниже соединения получали, по существу, в соответствии с методикой получения продукта 28.-1-(4-Бромфенил)-5-(3-трифторметоксифенил)пирролидин-2,3-дион (14,6 г, 35,2 ммоль) растворяли в дихлорметане (35 мл). Добавляли (R)-(+)метилбензиламин (6,8 мл, 52,8 ммоль) и перемешивали в течение ночи при температуре окружающей среды. Реакционную смесь концентрировали при пониженном давлении и очищали путем хроматографии на силикагеле (этилацетат-гексан) с получением (S)1-(4-бромфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2-она, который при элюированиии выходил первым (6,6 г, 36%) (МС (m/z): 517,0 (M+1), ОФ ВЭЖХ (обратнофазовая жидкостная хроматография высокого разрешения): Tr (время удерживания) = 5,53 мин (методика 3, и (R)-1-(4-бромфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол 2-она, который при элюированиии выходил вторым (5,8 г, 32%) (МС (m/z): 517,0 (M+1). ОФ ВЭЖХ: Tr = 5,44 мин. (методика 3. 1H ЯМР (400 МГц, ДМСО-d6)7,45 (дд, 4H, J=18,5, 9,2 Гц), 7,33 (д, 2H, J=7,5 Гц), 7,28-7,19 (м, 3H),7,15-7,05 (м, 2H), 7,15-7,05 (м, 2H), 6,99 (д, 1H, J=7,9 Гц), 6,90 (с, 1H), 5,89 (д, 1H, J=7,0 Гц), 5,85 (д, 1H,J=2,2 Гц), 5,14 (д, 1H, J=2,6 Гц), 4,35-4,26 (м, 1H), 1,43 (д, 3H, J=7,0 Гц). Приведенные ниже соединения получали, по существу, в соответствии с методикой получения продуктов 28, 31 и 32. Таблица 4 К раствору -5-[3-(2,2,2-трифторэтокси)фенил]-1-(4-трифторметилфенил)-3-(4-трифторметилфениламино)-1,5-дигидропиррол-2-она (16,0 г, 28,6 ммоль) в ТГФ (102 мл) последовательно добавляли уксусную кислоту (6,54 мл, 114 ммоль), 2,5-диметокситетрагидрофуран (5,55 мл, 42,8 ммоль), воду (32 мл) и ТФУ (4,32 мл, 57,1 ммоль). Данную реакционную смесь нагревали до 35C в течение 22 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли за один прием смесь изопропилацетата (40 мл) и толуола (160 мл). Полученную смесь промывали сначала водой (3), а затем буфером pH 7 (2). Разделяли фазы и определяли, что водная фаза имеет pH 7. Органическую фазу промывали водой (1) и солевым раствором (1). Определяли, что органическая фаза содержит указанное в заголовке соединение. ЖХ/МС ИЭР (жидкостная хроматография/масс-спектрометрия с ионизацией электрораспылением) (m/z): 416 (M-H). Продукт 35. -5-(3-Трифторметоксифенил)-1-(4-трифторметилфенил)-1,5-дигидропирролидин 2,3-дион Смешивали этанол (120 мл), ледяную уксусную кислоту (15 мл), воду (3,0 мл, 164,7 ммоль), трифторуксусную кислоту (6,2 мл, 82,4 ммоль), -5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)-3(4-трифторметилфениламино)-1,5-дигидропиррол-2-он (30,0 г, 54,9 ммоль) и 2,5-диметокситетрагидрофуран (10,7 мл, 82,4 ммоль). Данный раствор нагревали до 50C и реакционную смесь перемешивали в течение 15-18 ч. Нагревание раствора прекращали, добавляли воду (35 мл) и реакционную смесь охлаждали до -19C. Полученную суспензию фильтровали и твердое вещество промывали смесью вода/метанол (1:4; 20 мл). Фильтрат переносили в делительную воронку и промывали 6% солевым раствором (280 мл), затем в органическую фазу добавляли 6% солевой раствор (100 мл), метанол (40 мл), диэтиловый эфир (100 мл) и насыщенный раствор бикарбоната натрия (43 мл). Фазу разделяли, в органическую фазу добавляли метанол (60 мл) и данный раствор концентрировали (до приблизительно 1 объема) с получением остатка, содержащего -3-гидрокси-5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)-1,5-дигидропиррол-2-он. Продукт 36. (S)-1-(4-Трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)- 24015175 1,5-дигидро-пиррол-2-он К органическому слою, содержащему -3-гидрокси-5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)-1,5-дигидропиррол-2-он (продукт 34 или 35, описаннные выше), добавляли (R)(+)-метилбензиламин (45,0 мл, 349,8 ммоль). Данный раствор перемешивали при температуре окружающей среды в течение 72 ч. Реакционную смесь концентрировали и очищали путем хроматографии на силикагеле (5-15% EtOAc-гексан) с получением (S)-1-(4-трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3 трифторметоксифенил)-1,5-дигидропиррол-2-она (32,4 г, 37%) в виде желтовато-коричневый пены и (R)1-(4-трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2 она (26,0 г, 29%) в виде бледно-оранжевого масла.(R)-1-(4-трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2-он: 1H ЯМР (400 МГц, ДМСО-d6)7,76 (д, 2H, J=8,8 Гц), 7,62 (д, 2H, J=8,8 Гц), 7,34 (д, 2H,J=7,0 Гц), 7,28-7,20 (м, 3H), 7,14-7,06 (м, 2H), 7,02 (д, 1H, J=7,9 Гц), 6,96 (с, 1H), 5,96-5,92 (м, 2H), 5,19 (д,1H, J=2,6 Гц), 4,36-4,27 (м, 1H), 1,44 (д, 3H, J=7,0 Гц). МС (m/z): 507 (M+1). Приведенные ниже соединения получали, по существу, в соответствии с методикой получения продуктов (34 или 35) и 36 и 37.
МПК / Метки
МПК: A61P 25/00, A61K 31/4025, C07D 401/12
Метки: активность, проявляющие, отношении, св1, соединения, рецептора
Код ссылки
<a href="https://eas.patents.su/30-15175-soedineniya-proyavlyayushhie-aktivnost-v-otnoshenii-receptora-sv1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, проявляющие активность в отношении рецептора св1</a>
Предыдущий патент: Диаминопиримидины в качестве фунгицидов
Следующий патент: Способ извлечения редких металлов при выщелачивании цинка
Случайный патент: Фунгицидные феноксифенилгидразиновые производные