Проостровковые пептиды человека, их производные и аналоги и способы их применения
Формула / Реферат
1. Изолированный проостровковый пептид человека, включающий аминокислотную последовательность, выбранную из SEQ ID NO:3 и SEQ ID NO:7.
2. Проостровковый пептид человека по п.1, включающий соединение, конъюгированное с проостровковым пептидом человека, в котором соединение выбрано из альбумина, трансферрина и полиэтиленгликоля.
3. Проостровковый пептид человека по п.2, в котором соединение является полиэтиленгликолем.
4. Проостровковый пептид человека по п.2, в котором соединение является ковалентно связанным с проостровковым пептидом человека.
5. Проостровковый пептид человека по п.2, в котором соединение является нековалентно связанным с проостровковым пептидом человека.
6. Фармацевтическая композиция, включающая наполнитель и проостровковый пептид человека, состоящий из аминокислотной последовательности, выбранной из SEQ ID NO:3 и SEQ ID NO:7.
7. Фармацевтическая композиция по п.6, включающая терапевтическое количество проостровкового пептида человека.
8. Фармацевтическая композиция по п.6, дополнительно включающая соединение, конъюгированное с проостровковым пептидом человека, в котором соединение выбрано из альбумина, трансферрина и полиэтиленгликоля.
9. Фармацевтическая композиция по п.8, в которой соединение является полиэтиленгликолем.
10. Фармацевтическая композиция по п.8, в которой соединение ковалентно связано с проостровковым пептидом человека.
11. Фармацевтическая композиция по п.8, в которой соединение нековалентно связано с проостровковым пептидом человека.
12. Способ лечения патологии, связанной с нарушением функции поджелудочной железы у субъекта, нуждающегося в лечении, путем введения субъекту терапевтического количества проостровкового пептида человека, состоящего из аминокислотной последовательности, выбранной из SEQ ID NO:3 и SEQ ID NO:7, тем самым осуществляя лечение патологии, связанной с нарушением функции поджелудочной железы.
13. Способ по п.12, дополнительно включающий этап введения одного или нескольких веществ, стимулирующих регенерацию островковых клеток поджелудочной железы.
14. Способ по п.13, в котором вещества для стимулирования регенерации островковых клеток поджелудочной железы выбирают из проостровкового пептида человека, или его аналога, или производного, амилина, симлинаÔ, прамлинтида, эксендина-4, лираглютида, агонистов рецептора ГПП-1, ГПП-1, аналогов ГПП-1, хомячкового пептида, ассоциированного с островковым неогенезом (INGAP), и его аналогов, желудочного ингибирующего пептида и ингибиторов дипептидил-пептидазы-4 и их сочетаний.
15. Способ по п.12, дополнительно включающий этап введения одного или нескольких веществ, ингибирующих, блокирующих или разрушающих аутоиммунные клетки, выбирающие своей мишенью островковые клетки поджелудочной железы.
16. Способ по п.15, в котором вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие своей мишенью панкреатические островковые клетки, выбирают из анти-CD3 антитела, рапамицина, FK506, белка теплового шока 60, вакцины антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолата, лизофиллина, ритуксимаба, Кэмпаса-1Н, витамина D, вакцины IBC-VSO, CD4+CD25+ антигенспецифических регуляторных Т-клеток и их сочетаний.
17. Способ по п.16, в котором мофетилмикофенолат вводят совместно с даклизумабом.
18. Способ по п.16, в котором витамин D является витамином D3.
19. Способ по п.18, в котором витамин D3 вводят субъекту в количестве, являющемся эффективным для поддержания уровня 25-гидроксивитамина D выше приблизительно 40 нг/мл в организме субъекта.
20. Способ по п.12, в котором в результате введения по меньшей мере одного проостровкового пептида человека обеспечивают лечение или снижение интенсивности по меньшей мере одного симптома патологии, связанной с нарушением функции поджелудочной железы.
21. Способ по п.20, в котором симптом выбран из таких симптомов, как частое мочеиспускание, чрезмерная жажда, сильный голод, необычная потеря веса, повышенная утомляемость, раздражительность, неясное зрение, зуд половых органов, нерегулярные боли и болевые ощущения, ощущение сухости в полости рта, сухая или зудящая кожа, импотенция, вагинальные дрожжевые грибковые инфекции, плохое заживление порезов и царапин, тяжелые или необычные инфекции, гипергликемия, потеря гликемического контроля, колебания постпрандиального содержания глюкозы в крови, колебания содержания глюкагона в крови и колебания содержания триглицеридов в крови и их сочетание.
22. Способ по п.12, дополнительно включающий этап интенсификации гликемического контроля в организме субъекта до введения терапевтического количества проостровкового пептида человека.
23. Способ по п.12, в котором субъекту вводят инсулин во время введения терапевтического количества проостровкового пептида человека.
24. Способ по п.23, в котором дозу инсулина уменьшают после введения терапевтического количества проостровкового пептида человека.
25. Способ по п.23, в котором дозу инсулина уменьшают один или несколько раз после введения терапевтического количества проостровкового пептида человека.
26. Способ по п.23, в котором дозу инсулина уменьшают до нуля.
27. Антитело, селективно связывающееся с проостровковым пептидом человека, включающим аминокислотную последовательность, выбранную из SEQ ID NO:3 и SEQ ID NO:7.
28. Антитело по п.27, в котором антитело является моноклональным антителом.
29. Антитело по п.27, в котором антитело является поликлональным антителом.
30. Набор для лечения пациента, имеющего диабет 1-го типа, преддиабет, диабет 2-го типа или скрытый аутоиммунный диабет зрелого возраста, содержащий терапевтически эффективную дозу проостровкового пептида человека, состоящего из аминокислотной последовательности, выбранной из SEQ ID NO:3 и SEQ ID NO:7, и по меньшей мере одно вещество для стимулирования регенерации островковых клеток поджелудочной железы, и инструкции по его применению.
31. Способ для лечения диабета 1-го типа, преддиабета, диабета 2-го типа или скрытого аутоиммунного диабета зрелого возраста, включающий терапевтически эффективную дозу проостровкового пептида человека, состоящего из аминокислотной последовательности, выбранной из SEQ ID NO:3 и SEQ ID NO:7.
32. Способ для лечения диабета 2-го типа у субъекта, нуждающегося в лечении, путем введения субъекту терапевтического количества проостровкового пептида человека, состоящего из аминокислотной последовательности SEQ ID NO:2, тем самым обеспечивая лечение диабета 2-го типа.
33. Способ по п.32, дополнительно включающий этап введения одного или нескольких веществ для стимулирования регенерации островковых клеток поджелудочной железы.
34. Способ по п.30, в котором вещества для стимулирования регенерации островковых клеток поджелудочной железы выбирают из проостровкового пептида человека, или его аналога, или производного, амилина, симлинаÔ, прамлинтида, эксендина-4, лираглютида, агонистов рецептора ГПП-1, ГПП-1, аналогов ГПП-1, хомячкового пептида, ассоциированного с островковым неогенезом (INGAP), и его аналогов, желудочного ингибирующего пептида и ингибиторов дипептидил-пептидазы-4 и их сочетаний.
35. Способ по п.32, дополнительно включающий этап введения одного или нескольких веществ, ингибирующих, блокирующих или разрушающих аутоиммунные клетки, выбирающие своей мишенью островковые клетки поджелудочной железы.
36. Способ по п.35, в котором вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие своей мишенью панкреатические островковые клетки, выбирают из анти-CD3 антитела, рапамицина, FK506, белка теплового шока 60, вакцины антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолата, лизофиллина, ритуксимаба, Кэмпаса-1Н, витамина D, вакцины IBC-VSO, CD4+CD25+ антигенспецифических регуляторных Т-клеток и их сочетаний.
37. Способ по п.36, в котором мофетилмикофенолат вводят совместно с даклизумабом.
38. Способ по п.36, в котором витамин D является витамином D3.
39. Способ по п.38, в котором витамин D3 вводят субъекту в количестве, являющемся эффективным для поддержания уровня 25-гидроксивитамина D выше приблизительно 40 нг/мл в организме субъекта.
40. Способ по п.32, в котором в результате введения по меньшей мере одного проостровкового пептида человека обеспечивают лечение или снижение по меньшей мере одного симптома патологии, связанной с диабетом 2-го типа.
41. Способ по п.40, в котором симптом выбран из таких симптомов, как частое мочеиспускание, чрезмерная жажда, сильный голод, необычная потеря веса, повышенная утомляемость, раздражительность, неясное зрение, зуд половых органов, нерегулярные боли и болевые ощущения, ощущение сухости в полости рта, сухая или зудящая кожа, импотенция, вагинальные дрожжевые грибковые инфекции, плохое заживление порезов и царапин, тяжелые или необычные инфекции, гипергликемия, потеря гликемического контроля, колебания постпрандиального содержания глюкозы в крови, колебания содержания глюкагона в крови и колебания содержания триглицеридов в крови и их сочетание.
42. Способ по п.32, дополнительно включающий этап интенсификации гликемического контроля в организме субъекта до введения терапевтического количества проостровкового пептида человека.
43. Способ по п.32, в котором субъекту вводят инсулин во время введения терапевтического количества проостровкового пептида человека.
44. Способ по п.43, в котором дозу инсулина уменьшают после введения терапевтического количества проостровкового пептида человека.
45. Способ по п.43, в котором дозу инсулина уменьшают один или несколько раз после введения терапевтического количества проостровкового пептида человека.
46. Способ по п.43, в котором дозу инсулина уменьшают до нуля.
47. Антитело, селективно связывающееся с проостровковым пептидом человека, включающим аминокислотную последовательность SEQ ID NO:2.
48. Антитело по п.47, в котором антитело является моноклональным антителом.
49. Антитело по п.47, в котором антитело является поликлональным антителом.
50. Набор для лечения пациента, имеющего диабет 2-го типа, содержащий терапевтически эффективную дозу проостровкового пептида человека, состоящего из аминокислотной последовательности, выбранной из SEQ ID NO:2, и по меньшей мере одно вещество для стимулирования регенерации островковых клеток поджелудочной железы, и инструкции по его применению.
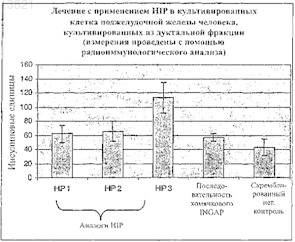
Текст
Проостровковые пептиды человека (HIP) и их аналоги и производные, полученные из последовательности человеческого протеина REG3A или гомологичные в плане последовательности человеческому протеину REG3A, хромосома 2 р 12, способны вызвать островковый неогенез из эндогенных панкреатических клеток-предшественников. Проостровковые пептиды человека используют либо по отдельности, либо в сочетании с другими фармацевтическими препаратами для лечения диабета 1- и 2-го типа или иных патологий, связанных с аберрантным глюкозным, углеводородным и/или липидным метаболизмом, резистентностью к инсулину, избыточным весом,ожирением, синдромом поликистозных яичников, расстройством пищевого поведения и метаболическим синдромом. 013821 Область техники, к которой относится изобретение Настоящее изобретение относится к пептидам и их аналогам и к способам их использования для лечения сахарного диабета 1-го типа, сахарного диабета 2-го типа и иных заболеваний. Настоящее изобретение относится к областям молекулярной биологии, биологии, химии, медицинской химии и фармакологии. Предпосылки создания изобретения С 1922 года инсулин являлся единственным терапевтическим средством для лечения сахарного диабета 1-го типа и иных состояний, связанных с отсутствием инсулина либо со снижением эффективности выработки инсулина организмом. Тем не менее в организме больных сахарным диабетом, использующих инсулин, не протекал нормальный глюкозный метаболизм, так как инсулин является лишь частью недостающей и нарушенной функции поджелудочной железы. Несмотря на десятилетия проведенных исследований, внедрение в 1974 году операций по трансплантации панкреатических островков и на последние заявления относительно успеха использования протокола Эдмонтона для трансплантации панкреатических островков, указанные методы не оказались достаточно эффективными в Соединенных Штатах. Например, спустя четыре года после проведения трансплантации островков, менее 10% пациентов, которым были пересажены островки, оставалось инсулинозависимыми. Кроме того, у 18% пациентов наблюдались серьезные побочные эффекты. Исследователи также проводили исследования на предмет того, возможно ли стимулирование эндогенной выработки инсулина при лечении лекарственными препаратами. Например, за несколько последних десятилетий было изучено несколько методов лечения, участвующих в глюкозном метаболизме, и были определены аналоги этих пептидов. Указанные методы лечения включают последовательности,аналогичные глюкагоноподобному пептиду-1 (ГПП-1) и содержащие аналоги рецептора ГПП-1, эксендин-4, эксенатид/препарат BYETTA, который получают из яда ящерицы Gila Monster, желудочный ингибирующий пептид/глюкозозависимый инсулинотропный полипептид (ГИП) и соединения, сходные с ГПП-1, такие как лираглютид (NN2211), ингибиторы дипептидил-пептидазы-4, ингибирующие деградацию ГПП-1, гастрин, эпидермальный фактор роста и аналоги эпидермального фактора роста и хомячковый пептид, ассоциированный с островковым неогенезом (INGAP). В частности, были определены фрагменты хомячкового пептида, ассоциированного с островковым неогенезом (см. Ronit, R., et al. Journal of Clinical Investigation, May 1997, vol. 99 (9): 2100-2109; U.S.Patent No. 5834590 и U.S. Patent Application Publication No. 2004/0132644). Хомячковый пептид, ассоциированный с островковым неогенезом, может являться эффективным при ускорении неогенеза панкреатических островков. Тем не менее хомячковый пептид, ассоциированный с островковым неогенезом, не является человеческим пептидом и, следовательно, не может быть настолько же эффективным, как человеческий, и он способен вызывать у некоторых пациентов отрицательную иммунную реакцию. Подтверждение адаптационной способности поджелудочной железы в отношении воспроизведения новых панкреатических островков в течение периода жизни человека, сопровождаемого отмиранием,или апоптозом панкреатических островков, позволило опровергнуть существовавшую в течение длительного времени концепцию, заключавшуюся в том, что количество структур, вырабатывающих инсулин островков, является фиксированным при рождении и сохраняется в течение жизни человека, в то время как была точно установлена пластичность и способность бета-клеток разрастаться внутри существующих островков. В настоящее время принята концепция относительно того, что панкреатические островки регенерируют из ранее существовавших панкреатических клеток путем дифференциации прогениторных клеток (клеток-предшественников), обнаруженных среди как эндокринных, так и экзокринных частей поджелудочной железы. Данные указывают на то, что, даже спустя десятилетия после проявления сахарного диабета 1-го типа, секретирующие инсулин островки могут быть регенерированы. Например, у пациентов с сахарным диабетом 1-го типа, в организме которых могут достигаться нормальные уровни С-пептида при протекании беременности. Несколько групп исследователей обнаружили парадоксальное повышение уровней С-пептида в течение первого триместра беременности до нормального предела у одной трети всех беременных пациенток, больных сахарным диабетом 1-го типа (Lewis et al., 1976, Rigget al., 1980, Ilic et al., 2000, Jovanovic et al., 2001). Указанное повышение уровня пептидов сопровождается существенным снижением потребности в инсулине, при этом ряд пациентов был способен полностью временно прекратить прием инсулина в течение первого триместра беременности. Такое повышение уровня С-пептидов у пациентов в процессе беременности, имеющее место в течение периода 10 недель созревания плода, несмотря на то, что до беременности у них не было обнаружено поддающихся измерению уровней С-пептида, указывает на восстановление функционирования островковых структур. Предполагается, что неогенез островков, имеющий место в процессе беременности, происходит в результате сопутствующего повышения производства эндогенных стероидов и понижающей регуляции иммунной системы, предотвращающих иммунную атаку на зародыш, что, вероятно, также влияет на подавление лимфоцитарной атаки на островки.-1 013821 Наряду с иммунной супрессией также предполагается, что существует повышающая регуляция факторов, способствующих росту материнских островков во время беременности, что позволяет компенсировать снижение заданной величины материнской глюкозы при беременности. Аналогичным образом у пациентов, которым в течение длительного времени проводили иммуносупрессию для пересадки почек, наблюдалась регенерация вырабатывающих инсулин островков. В течение последнего десятилетия были проведены клинические опыты с целью оценки воздействия ряда иммунных модуляторов, которые способны блокировать деструкцию бета-клеток поджелудочной железы. Были использованы анти-CD-3 антитела (hOKT371 (Ala-Ala и ChAglyCD3, целью которых является иммунный ответ и которые, в частности, блокируют Т-лимфоциты, вызывающие гибель бетаклеток при сахарном диабете 1-го типа, а также были использованы сиролимус (рапамицин), такролимус(FK506), белок теплового шока 60 (DIAPEP277), вакцина антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент,лизофиллин, ритуксимаб, Кэмпас-1H (анти-CD52 антителом) и витамин D, IBC-VSO вакцина, являющаяся синтетической, метаболически неактивной формой инсулина, предназначенная для предотвращения деструкции панкреатических бета-клеток, вакцинация интерфероном- с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество используют в комбинаторных терапевтических методах по применению регуляторных Т-клеток либо непосредственно, либо путем использования иммунотерапии для блокирования деструкции клеток, производящих инсулин. Цель указанных испытаний заключается в определении способности таких веществ сохранять функции островков путем предотвращения дальнейшей иммунной атаки на бета-клетки островков поджелудочной железы. Кроме того, результаты последних исследований позволили обнаружить, что витамин D может выполнять важную иммуномодулирующую функцию в предотвращении сахарного диабета 1-го типа. До 54,7% населения США независимо от географической широты имеют низкие уровни 25-гидроксивитамина D (Holick, J. Clin. Endorinol. Metab. 2005; 90: 3215-3224). Как было продемонстрировано, недостаток витамина D не только повышает риск заболевания сахарным диабетом 1-го типа и обнаруживается при вновь диагностированном диабете 1-го типа, но и в общем наблюдается среди пациентов с сахарным диабетом как 1-го типа, так и 2-го типа. Для поддержания нормальной иммунной функции рекомендуется сохранять уровни выше 40 нг/мл (Riachy Apoptosis. 2006 Feb.; 11(2): 151-9. Holick. Mayo Clin.Res. 2005; 37(11): 680-3). При дозах до 10000 иммунизирующих единиц/сутки не было обнаружено отрицательного действия лекарственных препаратов (Heaney. Am. J. Clin. Nutr., 204-210, Vieth. Am. J. Clin.Vufr. 2001; 73: 288-294). Тем не менее до настоящего времени отсутствовала единая или комбинаторная терапия, которая нашла бы эффективное применение для лечения основных синдромов заболевания сахарным диабетом 1-го типа, сахарным диабетом 2-го типа или состояний, при которых наблюдается отсутствие или пониженный уровень выработки инсулина и/или изменения глюкозного метаболизма или секреции инсулина,включая ожирение, избыточный вес, инсулинорезистентные синдромы и метаболический синдром. Существует необходимость в новых способах лечения и фармацевтических композициях, которые устраняют основные механизмы для изменений сахарного диабета 1-го типа, сахарного диабета 2-го типа и состояний, при которых наблюдается изменение секреции инсулина. Существует острая необходимость в способах и композициях, которые также позволят проводить лечение многих других состояний, при которых отсутствие или пониженная выработка инсулина являются причиной симптомов или способствуют проявлению симптомов у пациентов, нуждающихся в лечении. В настоящее время, по всей видимости, отсутствует метод лечения, обеспечивающий уменьшение интенсивности симптомов сахарного диабета 1-го типа путем целевого воздействия на механизмы, лежащие в основе всех указанных состояний заболевания. Настоящее изобретение позволяет удовлетворить необходимость в создании усовершенствованных методов лечения сахарного диабета 1- и 2-го типов и иных состояний.-2 013821 Краткое изложение сущности изобретения Настоящее изобретение предусматривает создание проостровкового пептида человека (Humanprolslet Peptide (HIP, либо его аналога, либо его производного, включающего аминокислотную последовательность SEQ ID NO:13. В одном примере осуществления настоящего изобретения длина цепочкиHIP, либо его аналога, либо его производного составляет менее 17 аминокислот. Одна особенность указанного примера осуществления настоящего изобретения заключается в том, что HIP, либо его аналог,либо его производное включает аминокислотную последовательность, выбранную из члена группы, состоящей из SEQ ID NO:2, 3, 4, 5, 6, 7, 18 и 19. Настоящее изобретение также предусматривает создание фармацевтических препаратов, включающих HIP, либо его аналог, либо его производное в сочетании с фармацевтически приемлемым наполнителем. Изобретение также предусматривает создание способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении. Способ реализуется путем введения пациенту терапевтического количества одного или нескольких проостровковых пептидов человека, либо их аналогов, либо их производных, в результате чего обеспечивается лечение сахарного диабета 1- и 2-го типов у пациента. В одном примере осуществления способа лечения сахарного диабета 1- или 2-го типов проостровковый пептид человека включает аминокислотную последовательность, выбранную из члена группы, состоящей из SEQ ID NO:2, 3, 4, 5, 6, 7, 18 и 19. Одной особенностью данного примера осуществления настоящего изобретения является то, что длина цепочки проостровкового пептида человека составляет 17 аминокислот или менее. В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, способ дополнительно включает этап введения одного или нескольких веществ для стимулирования регенерации клеток панкреатических островков. Одна особенность данного примера осуществления изобретения заключается в том, что вещества выбраны из члена группы, состоящей из проостровкового пептида человека, амилина/прамлинтида(INGAP), лираглютида (NN2211) или ингибитора дипептидил-пептидазы, блокирующего деградацию ГПП-1. В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, способ дополнительно включает следующие этапы: 1) интенсификация гликемического контроля; 2) пероральное введение витамина D3 (холекальциферола) для поддержания уровней 25-гидроксивитамина выше 40 нг/мл; 3) проведение одного или нескольких курсов иммунотерапии для защиты формирования новых островковых клеток; 4) введение HIP или аналогов HIP для стимулирования регенерации клеток панкреатических островков, при этом сокращая вводимые дозы инсулина; 5) проведение повторной терапии для защиты островков на 3-24-месячной основе в зависимости от выбранной иммунной терапии и 6) поддержание уровней 25-гидрокси-витамина D выше 40 нг/мл путем перорального приема витамина D3 (холекальциферола). В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, способ дополнительно включает следующие этапы: 1) интенсификация гликемического контроля; 2) введение витамина (холекальциферола) для поддержания уровней 25-гидрокси-витамина выше 40 нг/мл; 3) введение вещества для стимулирования регенерации панкреатических островков, включающее введение HIP или аналогов HIP; 4) совместное введение члена группы, состоящей из амилина/прамлинтида (симлина), эксендина 4 (EXENATIDE), желудочного ингибирующего пептида, ГПП-1, рецепторных агонистов ГПП-1, аналогов ГПП-1, хомячкового пептида, ассоциированного с островковым неогенезом (INGAP), лираглютида(NN2211) или ингибитора дипептидил-пептидазы, блокирующего деградацию ГПП-1, при этом сокращая дозы лекарственных средств при терапии сахарного диабета; и 5) поддержание уровней 25-гидрокси-витамина D выше 40 нг/мл путем перорального приема витамина D3 (холекальциферола). Одна особенность данного примера осуществления изобретения заключается в том, что вещества для стимулирования регенерации панкреатических островков или бета-клеток выбирают из члена группы, состоящей из HIP и аналогов HIP, эксендина-4 (EXENATIDE/BYETTA), гастрина, эпидермального фактора роста и аналога эпидермального фактора роста, желудочного ингибирующего пептида, ГПП-1,-3 013821 рецепторных агонистов ГПП-1, аналогов ГПП-1, хомячкового пептида, ассоциированного с островковым неогенезом (INGAP), лираглютида (NN2211) и/или ингибиторов дипептидил-пептидазы-4. В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, способ дополнительно включает этап введения одного или нескольких веществ, ингибирующих, блокирующих или разрушающих аутоиммунные клетки, выбирающие панкреатические островки в качестве своей мишени. Одна особенность данного примера осуществления настоящего изобретения заключается в том, что вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие в качестве своей мишени панкреатические островки, выбирают из группы, состоящей из анти-CD-3 антител (hOKT31 (Ala-Ala иChAglyCD3, целью которых является иммунный ответ и которые, в частности, блокируют Т-лимфоциты, вызывающие гибель бета-клеток при сахарном диабете 1-го типа, а также из сиролимуса(рапамицина), такролимуса (FK506), белка теплового шока 60 (DIAPEP277), вакцины антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетила микофенолата в отдельности или в сочетании с даклизумабом, анти-CD20 агента, ритуксимаба, Кэмпас-1 Н (анти-CD52 антитело), лизофиллина, витаминаD, IBC-VSO вакцины, являющейся синтетической, метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бета-клеток, из вакцинации интерфероном с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество, используемое в комбинаторных терапевтических методах по применению регуляторных Т-клеток либо непосредственно, либо путем использования иммунотерапии для блокирования деструкции клеток,продуцирующих инсулин. В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, как минимум один симптом патологии, связанный с нарушением функции поджелудочной железы, излечивают или уменьшают его интенсивность в результате введения как минимум одного проостровкового пептида человека. Одна особенность данного примера осуществления изобретения заключается в том, что симптом выбирают из члена группы, состоящей из низких уровней инсулина или инсулиновой активности, резистентности к инсулину, гипергликемии, уровня гемоглобина A1C, превышающего 6,0%, частого мочеиспускания, чрезмерной жажды, сильного голода, необычной потери или повышения веса, повышенной утомляемости, раздражительности, неясного зрения, зуда половых органов, нерегулярных болей и болевых ощущений, ощущения сухости в полости рта, сухой или зудящей кожи, импотенции, вагинальных дрожжевых грибковых инфекций, плохого заживления порезов и царапин, тяжелых или необычных инфекций, потери или ухудшения гликемического контроля, колебаний содержания глюкозы в крови, колебаний содержания глюкагона в крови и колебаний содержания триглицеридов в крови, при этом гипергликемия в конечном счете приводит к микроваскулярным и макроваскулярным осложнениям, которые включают зрительные симптомы, приводящие к слепоте, ускоренному нарушению работы почек, что может привести к почечной недостаточности, требующей применение диализа или пересадки почек, и к невропатии, ведущей к язве ног и ампутации. Кроме того, последние исследования продемонстрировали снижение как микроваскулярного, так и макроваскулярного/кардиоваскулярного риска среди пациентов с диабетом 1-го типа, у которых было достигнуто улучшение гликемического контроля. В другом примере осуществления способа лечения патологии, связанной с нарушением функции поджелудочной железы у пациента, нуждающегося в таком лечении, патология, связанная с нарушением функции поджелудочной железы, является любой патологией сахарного диабета 1-го типа, впервые выявленного диабета 1-го типа, диабета 2-го типа, скрытого аутоиммунного диабета зрелого возраста,преддиабета, нарушенной гликемии натощак, нарушения толерантности к глюкозе, синдрома инсулинорезистентности, метаболического синдрома, заключающегося в избыточном весе, ожирении, гиперлипидемии, гипертриглицеридемии, расстройствах пищевого поведения или синдроме поликистозных яичников. Настоящее изобретение также предусматривает создание антитела, селективно связывающегося сHIP, либо его аналогом, либо его производным, содержащего аминокислотную последовательность, выбранную из члена группы, состоящей из SEQ ID NO:2, 3, 4, 5, 6, 7, 18 и 19. В одном примере осуществления настоящего изобретения антитело является моноклональным антителом. В другом примере осуществления настоящего изобретения антитело является поликлональным антителом. Такие антитела могут быть использованы в диагностических способах, создание которых предусматривается настоящим изобретением, при этом способы включают обнаружение уровней содержания HIP, либо его аналога, либо производного в сыворотке или в тканях млекопитающего. В одном примере осуществления настоящего изобретения такие способы используют для диагностирования заболевания или состояния, связанного аберрантными уровнями HIP; в другом примере осуществления настоящего изобретения диагностический способ используют для контроля, лечения с применением HIP, либо аналога, либо производного с целью обеспечения достижения терапевтически эффективных уровней в организме пациента, проходящего такую терапию.-4 013821 Настоящее изобретение также предусматривает создание набора для лечения пациентов, страдающих от сахарного диабета 1- или 2-го типов, либо иного состояния, при котором наблюдаются аберрантные уровни инсулина, нарушение глюкозного метаболизма или инсулинорезистентности, включающего терапевтически эффективную дозу проостровкового пептида человека и выборочно как минимум одно вещество для стимулирования рецепторов ГПП-1 или повышения уровней ГПП-1, способствующего регенерации бета-клеток, повышенному чувству сытости, уменьшению потребляемого количества пищи и потери веса, снижая при этом потребности в инсулине и иных диабетических препаратах либо в одной и той же, либо в отдельной упаковке и инструкций по его использованию. Настоящее изобретение также предусматривает создание набора для измерения уровней HIP в пробе, набора, включающего HIPспецифическое антитело, и выборочно HIP, и выборочно средство для мечения. Ниже приведено более подробное описание указанных и других особенностей и примеров осуществления настоящего изобретения. Краткое описание чертежей Фиг. 1 - гистограмма, иллюстрирующая повышенное продуцирование инсулина в культуре панкреатической протоковой ткани человека после лечения 3.3 мкМ (окончательная концентрация культуры 165 нМ) HIP1 (SEQ ID NO:7), HIP2 (SEQ ID NO:3) и HIP3 (SEQ ID NO:2) по сравнению с аналогичным лечением с использованием пептида INGAP и при скремблированном негативном контроле. Фиг. 2 - гистограмма, иллюстрирующая повышенное продуцирование инсулина в ткани панкреатических островков человека после лечения 1 мМ для окончательной концентрации культур 500 нМ HIP1(SEQ ID NO:7), HIP2 (SEQ ID NO:3) и HIP3 (SEQ ID NO:2) по сравнению с аналогичным лечением с использованием пептида INGAP и при скремблированном негативном контроле. Фиг. 3 А - микрофотография культуры части панкреатической протоковой ткани после 6 дней культивирования с использованием HIP (SEQ ID NO:2). Внутри клеточной культуры образовалась новая островковая структура. Фиг. 3 В - микрофотография культуры части панкреатической протоковой ткани после культивирования с использованием HIP (SEQ ID NO:2). Внутри клеточной культуры образовалась новая островковая структура. Фиг. 3 С - микрофотография культуры части панкреатической протоковой ткани после культивирования с использованием HIP (SEQ ID NO:2). Внутри клеточной культуры образовалась новая островковая культура. Фиг. 3D - микрофотография культуры части панкреатической протоковой ткани без культуры с HIP(SEQ ID NO:2). Фиг. 3 Е - микрофотография с более высоким увеличением микроснимка, приведенного на фиг. 3 А. Фиг. 4 - гистограмма, иллюстрирующая повышенное продуцирование инсулина в культурах ткани панкреатических островков человека, обработанных пептидами HIP спустя 10 дней в соответствии с протоколом Розенберга. Пептиды 1, 2, 3 являются аналогами HIP SEQ ID NO:7, SEQ ID NO:3 и SEQ ID NO:2 по сравнению с аналогичным лечением пептидом 4 (последовательность хомячкового INGAP) и пептидом 5; скремблированный негативный контроль. Образцы представляют собой 5 мкг суммарного протеина в дублете, и их измерение проводилось путем твердофазного иммуноферментного анализа(ELISA). Фиг. 5 - гистограмма, иллюстрирующая повышенное продуцирование инсулина в культурах ткани панкреатических островков человека, обработанных пептидами HIP спустя 10 дней в соответствии с протоколом Розенберга. HIP1, 2 и 3 являются аналогами HIP SEQ ID NO:7, SEQ ID NO:3 и SEQ ID NO:2 по сравнению с аналогичным лечением пептидом 4 (последовательность хомячкового INGAP) и пептидом 5; скремблированный негативный контроль. Образцы представляют собой 0,002 мкг суммарного протеина в дублете, и их измерение проводилось путем твердофазного иммуноферментного анализа (ELISA). Фиг. 6 А - инвертационная микрофотография панкреатических клеток-предшественников человека,образующих ядро новых островков, вырабатывающих инсулин, после 2 дней лечения HIP. Фиг. 6 В - инвертационная микрофотография панкреатических клеток-предшественников человека,образующих островковоподобную структуру, вырабатывающую инсулин, после 6 дней лечения HIP. Фиг. 7 А - гистограмма, иллюстрирующая повышенное продуцирование инсулина в культурах панкреатической протоковой ткани человека, обработанных двумя концентрациями пептидов HIP. HIP1, 2 и 3 являются аналогами HIP SEQ ID NO:7, SEQ ID NO:3 и SEQ ID NO:2 по сравнению с аналогичным лечением пептидом 4 (последовательность хомячкового INGAP) и пептидом 5; скремблированный негативный контроль. Значения являются средними инсулиновыми единицами (дублирующих проб) в соответствии с измерениями на основе твердофазного иммуноферментного анализа (ELISA). Фиг. 7 В - гистограмма, иллюстрирующая повышенное продуцирование инсулина в культурах панкреатической островковой ткани человека, обработанных двумя концентрациями пептидов HIP. HIP1, 2 и 3 являются аналогами HIP SEQ ID NO:7, SEQ ID NO:3 и SEQ ID NO:2 по сравнению с аналогичным лечением пептидом 4 (последовательность хомячкового INGAP) и пептидом 5; скремблированный негативный контроль. Значения являются средними инсулиновыми единицами (дублирующих проб) в соответствии с измерениями на основе твердофазного иммуноферментного анализа (ELISA).-5 013821 Подробное описание изобретения Настоящее изобретение предусматривает создание проостровковых пептидов человека (HIP) и его аналогов и производных. Проостровковые пептиды человека являются активными фрагментами человеческого протеина, регенерирующего островковый 3-альфа протеин (REG3A) (NM138937.1), также известный как панкреатит-ассоциированный прекурсор протеина (NP002571), инкорпорированный в данное описание путем отсылки, расположенный на хромосоме 2 р 12. HIP вызывает или стимулирует островковый неогенез из клеток-предшественников, находящихся внутри поджелудочной железы. Указанное вещество неогенеза используют для лечения заболеваний, связанных с низкими или недостаточными уровнями инсулина либо низкой или недостаточной активностью инсулина, возникающих в результате аберрантного углеводного обмена веществ, причиной которого может являться дисфункция панкреатических островков или иммунная деструкция, такая как сахарный диабет (диабет 1-го типа), диабет 2-го типа (неинсулинозависимый сахарный диабет и вновь диагностированный диабет зрелого возраста, требующий инсулина, диабет в детском и в подростковом возрасте) или скрытый аутоиммунный диабет зрелого возраста (LADA). Изобретение также предусматривает создание терапевтических композиций и методов для лечения панкреатической дисфункции, включающей диабеты 1- и 2-го типов. В одном примере осуществления настоящего изобретения указанные композиции включают HIP, или его аналог, или производное. В другом примере осуществления настоящего изобретения указанные композиции включают HIP и иные композиции, воздействующие на глюкозный метаболизм. Указанные другие композиции включают вещества, участвующие в неогенезе панкреатических островков, и вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие своей мишенью панкреатические островковые клетки. В одном примере осуществления настоящего изобретения методы лечения настоящего изобретения реализуются путем введения терапевтически эффективной дозы HIP, либо его аналога, либо производного млекопитающему, нуждающемуся в таком лечении. В другом примере осуществления настоящего изобретения методы лечения настоящего изобретения реализуются путем введения терапевтически активной дозы HIP, либо его аналога, либо производного млекопитающему, нуждающемуся в таком лечении, в сочетании с другим гормоном или соединением, воздействующим на глюкозный метаболизм,включая без ограничения гормоны или соединения, участвующие в регенерации бета-клеток, создании чувства насыщения и опорожнения желудка, такие как ГПП-1, желудочный ингибирующий пептид, аналоги рецепторов ГПП-1, аналоги ГПП-1 и ингибиторы дипептидил-пептидазы-4, препятствующие деструкции ГПП-1 и веществ, ингибирующих, блокирующих или разрушающих аутоиммунные клетки, выбирающие своей мишенью панкреатические клетки. В данном последнем примере осуществления настоящего изобретения HIP, либо его аналог, либо производное и другой гормон или вещество могут быть введены отдельно или сначала могут быть смешаны для получения композиции в соответствии с изобретением и одновременного введения. Определения. В целях более ясного понимания описания ниже приведены определения терминов. Если не определено иное, все термины данной области техники, понятия и иные научные или медицинские термины или терминология, используемые в настоящем описании, имеют значения, понимаемые всеми специалистами в химической и медицинской области техники. В ряде случаев для целей ясности и/или для непосредственной ссылки в данном контексте приведены определения терминов с широко понимаемыми значениями, и включение в описание таких определений не должно обязательно истолковываться как представляющее существенное различие от определения терминов, в основном понимаемых в данной области техники. Для целей настоящего описания "лечение" состояния или пациента относится к принятию мер с целью получения благотворных или желаемых результатов, включая клинические результаты. Для целей настоящего изобретения благотворные или желаемые клинические результаты включают без ограничений частичное снятие или улучшение одного или нескольких симптомов диабета, снижение степени тяжести заболевания, задержку или замедление прогрессирования болезни, улучшение, временное облегчение или стабилизацию состояния заболевания или иные, описанные ниже благотворные результаты. Симптомы диабета включают низкие или недостаточные уровни инсулина или инсулиновой активности,частое мочеиспускание, чрезмерную жажду, сильный голод, необычную потерю веса, повышенную утомляемость, раздражительность, неясное зрение, зуд половых органов, нерегулярные боли и болевые ощущения, ощущение сухости в полости рта, сухую или зудящую кожу, импотенцию, вагинальные дрожжевые грибковые инфекции, плохое заживление порезов и царапин, тяжелые или необычные инфекции, гипергликемию, потерю гликемического контроля, колебания содержания глюкозы в крови,возникающие после приема пищи, колебания содержания глюкагона в крови и колебания содержания триглицеридов в крови. Диабет может быть диагностирован с помощью способов, хорошо известных специалистам в данной области техники. Например, обычно у диабетиков уровень глюкозы в плазме крови превышает 126 мг/дл глюкозы. Преддиабет, который также можно лечить с применением композиций и способов настоящего изобретения, обычно диагностируют у пациентов с содержанием глюкозы в крови в пределах от 100 до 125 мг/дл глюкозы. Также могут быть использованы другие симптомы для-6 013821 диагностирования диабета, сопутствующих заболеваний и состояний, а также заболеваний и состояний,возникших в результате снижения функции поджелудочной железы. Для целей настоящего описания термин "уменьшение" интенсивности симптома или симптомов (и грамматические эквиваленты данной фразы) означает снижение тяжести или частотности симптома(ов) или устранение симптома(ов). Для целей настоящего описания фраза "патология, связанная с нарушением функции поджелудочной железы" является фразой, в которой патология связана со сниженной способностью поджелудочной железы пациента вырабатывать и/или секретировать гормоны и/или цитокины. Указанный гормон или цитокин предпочтительно является инсулином. Патологии, связанные с нарушением функции поджелудочной железы, включают диабет 1-го типа, вновь диагностированный диабет 1-го типа, диабет 2-го типа, скрытый аутоиммунный диабет зрелого возраста, преддиабет, нарушение гликемии натощак, нарушение толерантности к глюкозе, синдром инсулинорезистентности, метаболический синдром, заключающийся в избыточном весе, ожирении, гиперлипидемии, гипертриглицеридемии, расстройствах пищевого поведения или синдроме поликистозных яичников. Для целей настоящего описания термин "введение", или "введение" лекарственного средства пациенту (и грамматические эквиваленты указанной фразы), означает как непосредственное введение, в том числе самовведение, так и непрямое введение, включая процедуру прописывания лекарственного средства. Например, для целей настоящего описания врач, дающий инструкции пациенту по самовведению лекарственного средства и/или предоставляющий пациенту рецепт лекарственного средства, вводит лекарственное средство пациенту. Для целей настоящего описания термин "субъект", или "пациент", является млекопитающим, обычно человеком, но в альтернативных случаях он может представлять собой млекопитающее животное,имеющее ветеринарное значение, включая без ограничений лошадей, крупный рогатый скот, овец, собак и кошек. Для целей настоящего описания термин "проявление" заболевания относится к симптому, признаку,анатомическому состоянию (например, отсутствие островковых клеток), физиологическому состоянию(например, уровню глюкозы) или сообщению (например, уровеню триглицерида), которые являются характерными для субъекта с заболеванием. Для целей настоящего описания термин "терапевтически эффективное количество лекарственного средства или вещества" является количеством лекарственного средства или вещества, которое при введении субъекту с заболеванием или состоянием вызывает планируемый терапевтический эффект, например частичное снятие, уменьшение интенсивности, временное ослабление и устранение одного или нескольких проявлений заболевания или состояния у субъекта. Полный терапевтический эффект не обязательно достигается путем введения одной дозы, и он может быть достигнут только после введения серии доз. Таким образом, терапевтически эффективное количество может быть введено за один или несколько приемов. Для целей настоящего описания термин "профилактически эффективное количество лекарственного средства" является количеством лекарственного средства, которое при введении субъекту вызывает планируемый профилактический эффект, например предотвращение или задержку наступления (или рецидива) заболевания или симптомов или снижение вероятности наступления (рецидива) заболевания или симптомов. Полный профилактический эффект не обязательно достигается путем введения одной дозы,и он может быть достигнут только после введения серии доз. Таким образом, профилактически эффективное количество может быть введено за один или несколько приемов. Для целей настоящего описания сокращения "TID", "QD" и "QHS" имеют обычные значения "три раза в день", "один раз в день" и "один раз перед сном" соответственно. Введение вещества "в сочетании с" включает параллельное введение (введение обоих веществ пациенту за период времени, например введение моноклонального антитела и пептидного гормона, такого как гормон инкретина или его аналога через день в течение одного месяца), совместное введение (при котором вещества вводят приблизительно в одно и то же время, например в пределах от приблизительно нескольких минут до нескольких часов одно за другим) и совместная композиция (в которой вещества соединены или объединены в одну лекарственную форму, приемлемую для перорального, подкожного или парентерального введения).GIP - желудочный ингибирующий пептид, также известный глюкозозависимый инсулинотропный полипептид. ГПП-1- глюкагонподобный пептид 1.HIP - один из проостровковых пептидов человека в очищенной, синтезированный или рекомбинантной форме либо включенный в фармацевтическую композицию. Производные и аналоги могут иметь либо полную длину, либо неполную длину. Производные и аналоги нуклеиновых кислот или протеинов в соответствии с изобретением включают без ограничения молекулы, содержащие участки, являющиеся в основном идентичными нуклеиновым кислотам или про-7 013821 теинам в соответствии с настоящим изобретением в различных примерах осуществления по меньшей мере приблизительно на 70, 80 или 95% (при предпочтительной идентичности 80-95%) по сравнению с нуклеиново-кислотной и аминокислотной последовательностью идентичного размера либо по сравнению с выровненной последовательностью, в которой выравнивание производится с помощью компьютерной гомологической программы, известной в данной области техники, кодирующая нуклеиновая кислота которой способна к гибридизации для дополнения последовательности, кодирующей протеины при жестких, умеренно жестких или слабо жестких условиях. См., например, Ausubel, et al. CURRENTPROTOCOLS IN MOLECULAR BIOLOGY, John WileySons, New York, NY, 1993 и ниже. Островковые структуры. В литературе относительно регенеративных процессов поджелудочной железы существовала создающая путаницу терминология. Нередко термин "островковая клетка" использовали синонимично бетаклеткам, а такое разграничение является важным ввиду рассмотрения новых методов лечения сахарного диабета. Панкреатические островки не являются клетками, а представляют собой структуры, каждая из которых состоит по оценкам из 1000 клеток четырех четко различимых типов клеток: 1) бета-клетки,вырабатывающие инсулин и амилин и составляющие 65-80% островковых клеток; 2) альфа-клетки, высвобождающие глюкагоны и составляющие 15-20% клеток; 3) дельта-клетки, вырабатывающие соматостатин; и 4) панкреатические полипептидные клетки, которые в некоторых случаях называют гаммаклетками. Дельта и панкреатические полипептидные клетки составляют менее 10% островковой структуры. Островковые структуры составляют только 1-2% панкреатической массы, но, тем не менее, используют 20% кровотока в поджелудочную железу и рассматриваются как один из наиболее васкуляризированных типов клеток в организме. Внутри островковой структуры существует высокоорганизованное расположение четырех типов клеток. Внутри каждого островка происходит центробежная подача кровяного потока, при этом бетаклетки расположены в центральной части и, таким образом, они получают основное кровоснабжение, в то время как альфа-, дельта- и панкреатические полипептидные клетки расположены за пределами бетаклеток в области с более низкой перфузией. Дополнительно к уровням глюкозы, влияющим на бета-клетки, бета-клетки электрически соединены с другими бета-клетками, но не с другими клетками островка или поджелудочной железы. Такая сложная система связи внутри островка позволяет дать объяснение компенсаторному увеличению альфаклеток внутри островка при существенном снижении массы бета-клеток (Kun et al., J. Clin. Endocrinol.Metab. 88: 2300-2308, 2003, Li et al., Journal of Endocrinology (2000), 165, 93-99). Проостровковые пептиды человека. Проостровковые пептиды человека (HIP) и их аналоги в соответствии с настоящим изобретением являются активными фрагментами протеина REG3A человека или панкреатит-ассоциированного прекурсора протеина на хромосоме 2 р 12. Протеин REG3A, из которого получают HIP в соответствии с настоящим изобретением, приведен в табл. 1. Домен, обеспечивающий создание HIP в соответствии с настоящим изобретением, выделен жирным шрифтом. Таблица 1 Аминокислотная последовательность REG3A/панкреатит-ассоциированного прекурсора протеинаHIP, и его аналоги, и производные в соответствии с настоящим изобретением включают полипептиды, приведенные в табл. 2, в очищенной, синтетической и рекомбинантной форме или содержащиеся в фармацевтической композиции.-8 013821 Таблица 2 Последовательность проостровкового пептида человека и аналогов Указанные пептиды являются человеческими гомологами хомячкового пептида INGAP, раскрытого в патенте США 5834590 и инкорпорированного в настоящее описание путем отсылки во всей его полноте. В указанном патенте раскрываются хомячковый протеин, ассоциированный с островковым неогенезом (INGAP), и ассоциированные пептиды с длиной цепи как минимум 15 аминокислот. BLAST2P выравнивание человеческого REG3A и хомячкового INGAP, выполненное на веб-сайте NCBI, приведено в табл. 3. Таблица 3 Выравнивание BLAST2P REG3A (SEQ ID NO:1) и INGAP золотистого хомячка (SEQ ID NO:8) В табл. 3 жирным шрифтом выделен домен в REG3A, из которого получен HIP (SEQ ID NO:2), и соответствующая хомячковая последовательность в INGAP. В публикации США 2004/0132644, инкорпорированной в настоящее описание путем отсылки во всей ее полноте, раскрывается пептид INGAP, выделенный жирным шрифтом выше в табл. 3. Указанный хомячковый пептид INGAP в настоящее время исследуют в плане его эффективности при неогенезе островков. Настоящее изобретение также обеспечило идентификацию соответствующих HIP-подобных пептидов из животных дополнительно к ранее известному хомячковому INGAP и, таким образом, в соответствии с одной важной особенностью позволяет создать указанные пептиды и их аналоги в основном в чистой и рекомбинантной форме, а также содержащие их фармацевтические препараты, и терапевтические методы в целях их применения для увеличения выработки инсулина. В то время как каждый из указанных HIP-подобных пептидов из животных, за исключением хомячкового, являются исключительно приемлемыми для реализации способа изобретения в организме животного источника происхождения, специалистам в данной области должно быть очевидно из данного описания, что указанные пептиды также могут быть использованы в организмах животных, за исключением организмов животного источника происхождения, и в организме человека в соответствии с идеями настоящего изобретения. В табл. 4 приведены иллюстративные нечеловеческие HIP-подобные пептиды, создание которых предусматривается в соответствии с настоящим изобретением; в целях сравнения показана последовательность хомячкового INGAP.-9 013821 Таблица 4 Выравнивание HIP гомологических последовательностей из других видов млекопитающих Новые последовательности HIP и HIP-подобных пептидов, создание которых предусматривается настоящим изобретением, является высокогомологичными, отражая важность функции таких пептидов индуцирование неогенеза панкреатических островков. Такое сохранение последовательности по отношению к последовательности хомячкового INGAP позволяет в дальнейшем продемонстрировать тот факт,что HIP, и его аналоги, и производные, в том числе нехомячковые HIP-подобные пептиды, приведенные в табл. 4, являются эффективными при стимулировании островкового неогенеза в соответствии с настоящим описанием. Микрочиповый анализ экспрессии генов в мышах линии NOD продемонстрировал наличие повышенной регуляции (активации) Reg генов, в частности, при островковом неогенезе (Vukkadapu et al.,Physiol Genomics. 2005 Apr. 14; 21(2): 201-11). Кроме того, как известно, Reg гены активируются на поздней стадии развития плода для создания популяции в поджелудочной железе развивающегося человека с целью поддержания его собственного глюкозного метаболизма после родов. Нао et al., 2006,Nature Medicine. 12(3): 310-6 продемонстрировал, что совместная пересадка тканей плода с неэндокринными панкреатическими эпителиальными клетками (NEPEC) приводила к стимулированию новых островковых структур из популяции неэндокринных панкреатических эпителиальных клеток. Повышенная регуляция Reg и, таким образом, большое количество HIP в совместно трансплантируемом материале плода, вероятно, являлись стимулом для такого эффекта. Были проведены клинические испытания хомячкового INGAP. Несмотря на то что на фазе I и II опытов была продемонстрирована хорошая переносимость хомячкового INGAP, в ходе испытаний в фазеII произошел большой отсев диабетических больных, связанный с дискомфортом и появлением гематом на участке инъецирования хомячкового INGAP. Кроме того, на фазе II испытаний была обнаружена низкая эффективность хомячкового INGAP. HIP в соответствии с настоящим изобретением не должен приводить к проблемам выбывания пациентов, так как они [пептиды] получены из организма человека в противоположность хомячковой последовательности. Кроме того, введение HIP, и его производных, и аналогов может осуществляться при увеличении количества доз в сутки. Количество суточных доз может составлять 2, 3, 4, 5, 6, 7, 8, 9 или 10. Дозы могут быть введены до принятия пищи с целью повышения их- 10013821 эффективности у ряда пациентов. Предполагается, что HIP стимулирует дифференциацию клетокпредшественников в поджелудочной железе на новые островковые структуры и секретируется в ответ на легкую гипергликемию. Введение HIP непосредственно до принятия пищи и его присутствие во время гипергликемии после приема пищи воспроизводят схему секреции дикого типа, которая может привести к более эффективному лечению пациентов. Несмотря на отрицательное воздействие, обнаруженное при проведении испытаний хомячковогоINGAP в фазе II, INGAP все же продемонстрировал в ходе испытаний определенные признаки эффективности. У пациентов, лечение которых проводилось с введением 600 мг/сутки хомячкового INGAP,наблюдалось повышение секреции С-пептида. Кроме того, в группе больных, лечение которых проводилось путем введения 300 мг/сутки в фазе II,у 22% пациентов наблюдалось 50% увеличение титров антител GAD65. Антитело GAD65 связывается с лимфоцитами, которые атакуют бета-клетки внутри островков. Таким образом, повышение титров антител GAD65 отражает выработку новых бета-клеток, связанных с островковым неогенезом, стимулирование которого осуществлялось с помощью хомячкового INGAP. Также у больных диабетом 2-го типа наблюдалось снижение гемоглобина A1C. Это связано со снижением гликемического воздействия и, таким образом, с более низким средним содержанием глюкозы в крови. Это также дает основание полагать, что хомячковый INGAP оказывает определенное положительное воздействие на островковую функцию у пациентов, несмотря на его негативное воздействие,продемонстрированное в фазе II исследования по применению хомячкового INGAP. Аналоги HIP в соответствии с настоящим изобретением включают любой пептид, содержащий как минимум 6 аминокислотных последовательностей из вышеприведенных последовательностей, выделенных жирным шрифтом, т.е. SEQ ID NO:2. Например, пептидные последовательности из 15 или менее аминокислот (т.е. имеющие 6, 7, 8, 9, 10, 11, 12, 13 или 14 аминокислот), включающие любую из 6 аминокислотных последовательностей, приведенных в табл. 5, рассматриваются как пептиды в соответствии с настоящим изобретением. Таблица 5 Примеры осуществления последовательностей,содержащихся в аналогах HIP В одном примере осуществления настоящего изобретения HIP в соответствии с настоящим изобретением, полученный в очищенной, синтетической или рекомбинантной форме, вызывает неогенез панкреатических островков и полностью состоит из человеческой последовательности. Указанные пептиды имеют преимущества по отношению к нечеловеческим HIP гомологам, таким как хомячковый INGAP,так как они не содержат какой-либо нечеловеческой пептидной последовательности. Таким образом,обеспечивается существенное снижение проявления иммунного ответа при введении указанных пептидов в организм человека по сравнению с хомячковыми пептидами INGAP. Кроме того, пептиды HIP в соответствии с настоящим изобретением могут храниться в течение длительного периода времени в стабильном состоянии. Пептиды HIP в соответствии с настоящим изобретением сохраняют свою стабильность в течение нескольких месяцев при хранении при 20 С в изотоническом растворе. В конкретном примере осуществления настоящего изобретения производное или аналог является функционально активным, т.е. способным проявлять одну или несколько связанных с HIP функциональных активностей. Может быть проведено испытание HIP производных или аналогов на определение требуемой активности с помощью процедур, известных в данной области техники, включая без ограничения использование соответствующих клеточных линий, экспериментальных моделей на животных и клинических опытов. Например, могут быть использованы анализы, описанные в Jamal, A.M., et al. Cell Death Differ. 2005 Jul.; 12(7): 702-12, инкорпорированные в настоящее описание путем отсылки во всей полноте. В частности, производные HIP могут быть получены, изменяя последовательности HIP путем замещений, вставок или делеций, обеспечивающих функционально эквивалентные или улучшенные молекулы. Ввиду дегенерации нуклеотидных кодирующих последовательностей в практике настоящего изобретения могут быть использованы другие последовательности ДНК, кодирующие аналогичную или в- 11013821 основном аналогичную аминокислотную последовательность в виде HIP, или его аналогов, или производных. Они включают без ограничений последовательности нуклеиновых кислот, содержащие все или части HIP, измененные замещением различных кодонов, кодирующих функционально эквивалентный аминокислотный остаток внутри последовательности, тем самым производя "скрытое" изменение. Аналогичным образом, производные HIP в соответствии с настоящим изобретением включают без ограничений производные, содержащие в виде первичной аминокислотной последовательности всю или часть аминокислотной последовательности HIP, в том числе измененные последовательности, в которых остатки внутри последовательности, полученной в результате "скрытого" изменения, заменены функционально эквивалентными аминокислотными остатками. Например, один или несколько аминокислотных остатков внутри последовательности могут быть заменены другой аминокислотой аналогичной полярности, выступающей в качестве функционального эквивалента, полученного в результате "скрытого" изменения. Заместители аминокислоты в последовательности могут быть выбраны из других членов класса, к которому принадлежит аминокислота. Например, неполярные (гидрофобные) аминокислоты включают аланин, леуцин, изолеуцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глютамин. Положительно заряженные (основные) аминокислоты включают аспарагиновую кислоту и глютаминовую кислоту. Производные HIP в соответствии с настоящим изобретением также включают без ограничений производные, содержащие в качестве основной аминокислотной последовательности всю или часть аминокислотной последовательности HIP, в том числе измененные последовательности, в которых остатки с аналогичными химическими свойствами заменены аминокислотными остатками. В конкретном примере осуществления настоящего изобретения аминокислоты 1, 2, 3, 4 или 5 замещены.HIP производные или аналоги включают без ограничений те протеины, которые в основном гомологичны HIP или его фрагментам, либо кодирующая нуклеиновая кислота которых способна гибридизироваться в нуклеиново-кислотную последовательность HIP. В конкретном примере осуществления настоящего изобретения в способе изобретения могут быть использованы рекомбинантные, или слитые, протеины. Для целей настоящего описания "рекомбинантный протеин", или "слитый протеин", включает HIP, или его аналоги, или производные, функционально связанные с не-HIP, или его аналогом, или производным. Внутри такого слитого протеина HIP, или его аналог, или производное могут соответствовать всему или части HIP. В одном примере осуществления настоящего изобретения слитый протеин HIP включает как минимум одну биологически активную частьHIP. Внутри слитого протеина HIP, или его аналог, или производное и не-HIP полипептид являются"функционально связанными", т.е. они слиты в рамке друг с другом. Не-HIP полипептид может быть связан с N- или С-концом HIP, или его аналога, или производного. Например, слитый протеин может представлять собой протеин HIP, содержащий гетерологическую сигнальную последовательность на своемN-конце. В определенных клетках-хозяевах (например, клетках-хозяевах млекопитающих) экспрессия и/или секреция HIP, или его аналога, или производного может быть повышена за счет использования гетерологической сигнальной последовательности. В другом примере осуществления изобретения слитый протеин является слитым протеином HIP-иммуноглобулин, в котором последовательности HIP слиты с последовательностями, полученными из члена семейства иммуноглобулинового протеина. Слитые протеины HIP-иммуноглобулин могут быть включены в фармацевтические композиции и введены субъекту для ингибирования иммунологического ответа в соответствии с настоящим изобретением.HIP, его аналог или производное либо HIP-рекомбинантный или слитый протеин, предназначенные для использования в способах в соответствии с настоящим изобретением, могут быть химически модифицированы с целью повышения биодоступности и/или повышения эффективности, растворимости и стабильности. Например, протеин может быть ковалентно или нековалентно связан с альбумином,трансферрином или полиэтиленгликолем (ПЭГ).HIP, его аналог или производное либо HIP-рекомбинантный или слитый протеин, предназначенные для использования в способе в соответствии с настоящим изобретением, могут быть получены путем применения стандартных технологий рекомбинантных ДНК в соответствии с идеями настоящего изобретения. Например, фрагменты ДНК, кодирующие различные полипептидные последовательности, могут быть сшиты вместе в рамке в соответствии с известными технологиями, например, путем использования тупоконечных или зигзагоконечных концов для сшивания, расщепления рестриктазой с целью обеспечения соответствующих концов, достройки "липких" концов при необходимости, обработки щелочной фосфатазой с целью предотвращения нежелательного слияния и ферментативного сшивания. Кроме того,слитый ген может быть синтезирован с использованием известных технологий, включающих автоматизированные синтезаторы ДНК. В альтернативном случае может быть проведена ПЦР-амплификация фрагментов гена с использованием якорных праймеров, обеспечивающих образование комплементарных"липких" концов ДНК между двумя последовательными фрагментами гена, которые в дельнейшем могут быть ренатурированы и реамплифицированы с целью получения последовательности рекомбинантных генов [см., например, Ausubel, et al. (eds.) CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, JohnWileySons (1992)]. Более того, многие векторы экспрессии, уже кодирующие слитую часть, реализуются на рынке (например, GST полипептид). HIP-кодирующая нуклеиновая кислота может быть клониро- 12013821 вана в такой вектор экспрессии с целью обеспечения связывания слитой части в рамке с HIP. Слитой протеин может представлять собой протеин HIP, слитый с His тагом или эпитопным тагом (например,V5) в целях содействия очистки и обнаружения рекомбинантного HIP, либо в целях маскирования иммунного ответа в организме субъекта. Относительно короткие аминокислотные последовательности HIP и его аналогов и производных также позволяют полностью реализовать получение указанных ценных пептидов путем синтеза, осуществляется серийный выпуск приборов автоматизации синтеза пептидов, и способы синтеза пептидов, не требующие автоматизации, давно известны и могут быть использованы в соответствии с изложенными в настоящем описании идеями для получения HIP, или его аналогов, или производных в соответствии с настоящим изобретением. В ряде примеров осуществления изобретения HIP, либо его аналог, либо производное или HIPрекомбинантный или слитый протеин может быть модифицирован таким образом, чтобы обеспечивалось удлинение его периода полужизни in vivo, используя любые способы известные в данной области техники. Например, фрагмент Fc IgG человека или инертные полимерные молекулы, такие как полиэтиленгликоль с высоким молекулярным весом, могут быть присоединены к HIP, либо к его аналогу, либо к его производному с многофункциональным линкером или без него, либо через сайт-специфическую конъюгацию ПЭГ с N- или С-концом протеина, либо через эпсилон-аминогруппы, присутствующие на лизиновых остатках. Предусматривается использование приема дериватизации линейного или разветвленного полимера, в результате которого обеспечивается минимальная потеря биологической активности. Постоянный контроль за степенью конъюгации обеспечивается путем анализа методом электрофореза в полиакриламидном геле с додецилсульфатом натрия и методом масс-спектроскопии с целью обеспечения надлежащей конъюгации молекул ПЭГ с HIP, или его аналогом, или производным. Непрореагировавший ПЭГ может быть отделен от конъюгатов HIP-ПЭГ путем гель-хроматографии или ионообменной хроматографии. Может быть проведено испытание ПЭГ-дериватизированных конъюгатов в плане их эффективности in vivo, используя способы, известные специалистам в данной области техники. Способы изобретения и используемые в нем вещества. Обзор способов изобретения. Настоящее изобретение предусматривает создание методов лечения на основе HIP, или производных, или аналогов HIP и способов повышения выработки или активности инсулина и иных панкреатических гормонов у субъекта. В одном примере осуществления настоящего изобретения реализуется способ лечения сахарного диабета 1- или 2-го типа и сопутствующих состояний, при которых наблюдается отсутствие или снижение выработки инсулина у пациента, приводящее к аберрантному глюкозному метаболизму. Способ включает введение пациенту вещества, стимулирующего регенерацию панкреатических островков и/или дифференциацию из панкреатических клеток-предшественников в островковые структуры. Указанное вещество является HIP, либо его аналогом, либо производным. Выборочно HIP, или аналог, или производное HIP вводят при одновременном введении вещества, ингибирующего активность аутоиммунных клеток, выбирающих своей мишенью панкреатические островковые бета-клетки, и/или блокирующего или разрушающего их, и выборочно другое вещество, которое может также стимулировать регенерацию панкреатических бета-клеток и/или приводить к повышению ГПП-1 или стимулированию рецепторов ГПП-1 или которое является аналогом ГПП-1 либо ингибитором дипептидилпептидазы-4, ингибирующим деградацию ГПП-1. Терапевтические методы, создание которых предусматривается в соответствии с настоящим изобретением, устраняют ряд различных основополагающих механизмов (симптомов), которые приводят либо к отсутствию, снижению или недостаточному количеству инсулина или иных гормонов, либо которые, так или иначе, вырабатываются в аберрантном количестве. Комбинаторные методы лечения на основе HIP, предусматриваемые настоящим изобретением, позволяют восстановить глюкозный метаболизм в более нормальном режиме, в том числе достижение и поддержание соответствующих уровней инсулина, амилина, постпрандиальной глюкозы, триглицеридов и уровней глюкагона, и способствуют нормализации значительного повышения веса и уменьшению повышенного риска тяжелой гипогликемии, связанной с жестким гликемическим контролем с использованием инсулина или пероральных диабетических лекарственных средств. Настоящее изобретение также предусматривает создание методов лечения с использованием одного вещества для лечения дефицита инсулина, в том числе диабета и сопутствующих состояний. Указанные методы лечения с использованием одного вещества включают методы введения HIP или HIP аналогов,либо производных, стимулирующих регенерацию панкреатических островковых клеток и/или трансформирование новых, вырабатывающих инсулин, островковых клеток из панкреатических клетокпредшественников, расположенных в поджелудочной железе взрослого человека. Неогенез островковых клеток, происходящий в результате введения HIP, может быть использован для лечения диабета и других заболевания и состояний, относящихся к аберрантной регуляции глюкозы. В различных примерах осуществления настоящего изобретения указанные методы предусматривают введение таких веществ,включающих без ограничения HIP, HIP триптофан, безглютаматный HIP, аналог HIP валин-трипитофана,HIP гексапептид, HIP септапептид, HIP второй септапептид или триптофан-безглютаматный HIP по отдельности либо в сочетании с иммуноблокирующим веществом и/или одновременно вводимые с агони- 13013821 стом рецептора ГПП-1, ГПП-1, аналогом ГПП-1 или ингибитором дипептидил-пептидазы в случае лечения диабета 1-го типа, либо HIP в сочетании с агонистом рецептора ГПП-1, ГПП-1, аналогом ГПП-1 или ингибитором дипептидил-пептидазы без необходимости введения иммунного блокатора в случае лечения диабета 2-го типа. Болезненные состояния, подлежащие лечению с применением указанной методологии, включают без ограничения диабет 1- и 2-го типов, при которых указанные методы лечения могут быть использованы для повышения гликемического контроля на основе измерений гемоглобина A1C и для снижения на 10-20% приема болюсного инсулина до приема пищи при снижении колебаний и понижении уровней постпрандиальной глюкозы, глюкагона и триглицеридов. Указанные методы также могут быть использованы для предотвращения развития от нарушения толерантности к глюкозе к диабету и для предотвращения развития от нарушенной гликемии натощак к нарушению толерантности к глюкозе и к диабету и для реверсирования вновь диагностированного диабета 2-го типа. Указанные методы также могут быть использованы для лечения диабета 2-го типа. Экзогенный инъецируемый инсулин используют для лечения и диабета 1-го типа, и иных состояний, при которых инсулин либо отсутствует в организме, либо присутствует в незначительном или недостаточном количестве по отношению к содержанию глюкозы в кровотоке. Инсулиновая терапия не позволяет устранить основные симптомы, приводящие к диабету 1-го типа или иным таким состояниям,при которых имеет место пониженная выработка эндогенного инсулина. Методы лечения, способы, режимы и тактика лечения, приведенные в настоящем описании, предназначены в первую очередь для устранения многочисленных факторов, вызывающих диабет и осложнения в связи с этим заболеванием. Уникальные методы лечения, предусмотренные настоящим изобретением, охватывают различные аспекты диабетологии, метаболизма и иммунологии. Указанные методы лечения включают методы, обеспечивающие восстановление нормальных уровней многих различных гормонов дополнительно к инсулину,количество которых было снижено или которые отсутствовали в организме при диабете 1-го типа. Способы в соответствии с настоящим изобретением предусматривают регенерацию новых вырабатывающих инсулин клеток и выборочно иммуномодуляцию, которые в сочетании способствуют нормализации,снижению и отказу от необходимости приема инсулина среди пациентов с диабетом 1-го типа и с иными состояниями, связанными с недостаточной выработкой и секрецией инсулина. При диабете 1-го типа имеется ряд основных механизмов, приводящих к существенному снижению выработки инсулина. Указанные механизмы включают аутоиммунную деструкцию бета-клеток и снижение регенерационной способности не только внутри бета-клеток, неспособность клетокпредшественников дифференцироваться в новые островки может быть обусловлена изменившейся глюкозной средой. Настоящее изобретение также предусматривает создание комбинаторных методов лечения, которые являются исключительно эффективными, поскольку при блокировке аутоиммунного ответа путем совместного введения иммуносупрессанта с HIP, или HIP аналогом, или производным производится блокировка аутоиммунных клеток, атакующих панкреатические островковые клетки, и вводятся пептиды или другие соединения, стимулирующие регенерацию панкреатических островковых клеток, в результате чего пациент становится зависимым от введения инсулина в меньшей степени. Способы в соответствии с настоящим изобретением даже могут позволить ряду пациентов полностью отказаться от приема инсулина при лечении диабета как 1-, так и 2-го типов. Другие исследованияLevetan et al., Diabetes, 2001; 50 (supple 2): 2105 PO и Levetan et al., Diabetes Care, 2003, 26:1-8, обе инкорпорированные в настоящее описание путем отсылки) показывают, что при замещении гормонов, кроме инсулина, с пониженным количеством обеспечивается существенное снижение потребностей в инсулине у пациентов, больных диабетом 1-го типа, при одновременном улучшении глюкозного контроля. Благодаря стимулированиию дифференциации новых вырабатывающих инсулин островковых структур и блокированию иммунных клеток, которые могут нарушить их функцию, способы настоящего изобретения являются многообещающими, так как они позволяют достичь устойчивой эндогенной выработки инсулина как такового и иных совместно секретируемых гормонов, таких как амилин. Существует необходимость в терапевтической полезности, предусматриваемой настоящим изобретением. Существуют новые лекарственные формы инсулина и подтверждение того, что интенсивная инсулиновая терапия предотвращает летальный исход и снижает частотность потери зрения, ампутаций и почечной недостаточности, при которой требуется проведение диализа. Тем не менее, интенсивная инсулиновая терапия с использованием современных режимов проведения многочисленных инсулиновых инъекций и постоянного поступления в организм инсулина с помощью насосотерапии связаны с двухкратно-трехкратно повышенным риском возникновения тяжелой гипогликемии, при которой требуется помощь другого человека. В условиях проведения клинических исследований, несмотря на нормализацию глюкозы у пациентов с диабетом 1-го типа путем внутривенного введения инсулина и глюкозы,стандартное отклонение уровней глюкозы как в сторону повышения, так и в сторону понижения колеблется в значительно более широких пределах, чем у исследуемых субъектов без диабета при аналогичном среднем уровне глюкозы в организме в течение 24-часового периода. Настоящее изобретение предусматривает альтернативные средства для достижения терапевтической полезности интенсивной инсулиновой терапии без пониженного ятрогенного риска ввиду того, что эндогенная выработка инсулина, сти- 14013821 мулированная настоящими способами, должна обеспечить более нормальный уровень выработки инсулина, который не может быть эффективно воспроизведен при применении интенсивной инсулиновой терапии. Таким образом, несмотря на доступность инсулина и новые технологии, в том числе новые композиции человеческого инсулина, системы самоконтроля глюкозы в крови, датчики постоянного контроля за уровнем глюкозы и насосотерапия, существующие методы лечения не позволяют достичь нормального контроля глюкозы. Более того, основные механизмы, вызывающие диабет 1-го типа, не подлежат устранению с использованием существующих методов лечения у пациентов с диабетом 1-го типа и с состояниями, при которых наблюдается полное отсутствие выработки либо пониженная или недостаточная или аберрантная выработка инсулина или амилина и дисрегуляция секреции глюкагона. Настоящее изобретение предусматривает создание новых способов и фармацевтических композиций для стимулирования островкового неогенеза, повышения выработки инсулина и иных панкреатических гормонов в организме пациента, который нуждается в них, и лечения сахарного диабета 1-го типа,сахарного диабета 2-го типа и других состояний, при которых отсутствие выработки или пониженная выработка инсулина является этиологическим фактором возникновения симптомов заболевания. Способы и композиции в соответствии с настоящим изобретением позволяют реверсировать основополагающие патологические механизмы указанных болезненных состояний. Таким образом, способы настоящего изобретения позволяют снизить и в ряде случаев устранить необходимость введения инсулина пациенту,формально нуждающемуся в нем. В одном примере осуществления указанного способа вещество, стимулирующее островковую регенерацию и/или дифференциацию из панкреатических клеток-предшественников в производящие инсулин островковые структуры, вводят совместно с HIP, или его аналогом, или производным, включая безглютаматный HIP, HIP триптофан, аналог HIP валин-типитофана, HIP гексапептид, HIP септапептид,второй HIP септапептид или типтофан-безглютаматный HIP. Указанное вещество, стимулирующее островковую регенерацию и/или дифференциацию из панкреатических клеток-предшественников в производящие инсулин островковые структуры, может представлять собой HIP, или его аналог, или производное при условии, что оно отличается от первого введенного HIP, или его аналога, или производного. Вещества, которые могут быть введены с HIP или в процессе поэтапных способов использования HIP для лечения диабета 1- и 2-го типов, включают амилин и/или аналог, такой как прамлинтид, желудочный ингибирующий пептид, ГПП-1 и/или гомологичные соединения и аналоги, аналоги рецептора ГПП-1,которые включают эксендин-4, лираглютид (NN2211), хомячковый INGAP, или их аналоги HIP, любой биологически активный пептид HIP и/или ингибиторы дипептидил-пептидазы-4, замедляющие деградацию ГПП-1. Второе вещество может оказывать воздействие на регенерацию бета-клеток, опорожнение желудка, создание чувства насыщения и потребность в инсулине путем воздействия на клеточные рецепторы ГПП-1 и амилина в поджелудочной железе, прилежащие ядра, область area postrema и желудочнокишечный тракт и может быть использовано в таком примере осуществления способа с HIP, или его аналогом, или производным в отличие от первого введенного вещества. Один способ лечения диабета 1-го типа и иных патологий, возникающих в результате снижения функции поджелудочной железы, включает пять стадий:(2) достижение и поддержание уровней 25-гидрокси-витамина D выше 40 нг/дл путем перорального введения холекальциферола (витамин D3);(4) введение HIP и сокращение введения инсулина после прекращения приема как HIP, так и инсулина;(5) повторное использование иммунной модуляции на квартальной или годовой основе в зависимости от выбранной иммунной терапии. Другой способ включает две стадии для лечения диабета 2-го типа, ожирения, избыточного веса,резистентности к инсулину, гиперлипидемии, гипертриглицеридемии и расстройств пищевого поведения: 1) достижение и поддержание уровней 25-гидрокси-витамина D выше 40 нг/дл путем перорального введения холекальциферола (витамин D3) и 2) введение HIP в сочетании с ГПП-1, либо агонистом рецептора ГПП-1, либо аналогом ГПП-1, либо ингибитором дипептидил-пептидазы-4. Ниже приведено более детальное описание стадий (1), (2) для лечения диабета 1-го типа и иных патологий, возникающих в связи с пониженной панкреатической функцией. Стадия 1. Для проведения первой стадии до введения HIP либо до введения HIP аналога или производного и до введения или при одновременном введении вещества, ингибирующего активность аутоиммунных клеток, выбирающих в качестве своей мишени бета-клетки, и/или блокирующего или разрушающего их, выдерживается трехмесячный период жесткой/интенсивной оптимизации глюкозы. Указанный период жесткой/интенсивной оптимизации глюкозы может предусматривать несколько суточных доз инсулина, вводимых подкожно или постоянно вводимых подкожно с помощью инсулинового насоса,- 15013821 и может предусматривать введение синтетического амилина/прамлинтида (симлина), который также отсутствует при диабете 1-го типа и аберрантно секретируется при диабете 2-го типа. Как было продемонстрировано, синтетический амилин/прамлинтид (симлина) снижает гликемические экскурсии (колебания) у пациентов с диабетом 1-го типа, снижая при этом потребности в инсулине до принятия пищи(Levetan et al., Diabetes Care, 2003, 26(1): 1-8). Кроме того, на протяжении всего периода жесткого контроля проводится иммунотерапия, вводитсяHIP и может вводиться витамин D3 (холекалциферол) при дозе 1000-2000 иммунизирующих единиц в сутки. Недавно проведенные исследования продемонстрировали, что до 54,7% населения США независимо от географической широты имеют низкие уровни 25-гидрокси-витамина D (Holick, J. Clin.Endorinol. Metab. 2005; 90: 3215-3224). Как было продемонстрировано, недостаток витамина D не только повышает риск заболевания сахарным диабетом 1-го типа и обнаруживается при вновь диагностированном диабете 1-го типа, но и в общем наблюдается среди пациентов с сахарным диабетом как 1-го типа,так и 2-го типа и для поддержания нормальной иммунной функции у больных с диабетом и без диабета рекомендуется сохранять уровни выше 40 нг/мл (Riachy Apoptosis. 2006 Feb., 11(2): 151-9; Holick. MayoMetab Res. 2005, 37(11): 680-3). При дозах до 10000 иммунизирующих единиц/сутки не было обнаружено отрицательного действия лекарственных препаратов (Heaney. Am. J. Clin. Nutr., 204-210, Vieth. Am. J.Clin. Nutr., 2001, 73: 288-294). Продолжается введение витамина D при дозах 1000-2000 иммунизирующих единиц/сутки для поддержания уровней 25-гидрокси-витамина D выше 40 нг/дл у пациентов с диабетом как 1-го, так и 2-го типа. Стадия 2. До введения HIP, или аналога, или производного HIP в соответствии с предписанными способами предусматривается введение одного из иммуномодуляторов. Такие иммуномодуляторы включают иммуномодуляторные пептиды, блокирующие деструкцию панкреатических островковых клеток. Например, один такой иммуномодулятор представляет собой моноклональное антитело, способное задержать прогрессию потери островков, или замедлить, или остановить начало заболевания диабетом 1-го типа. Анти-CD3 антитела образуют общий класс веществ, являющихся полезными в способах настоящего изобретения. Например, приемлемые анти-CD3 антитела для целей настоящего изобретения включаютTRX4 (Ala-Ala и ChAgly CD3) антитело, разработкой которого занимается в настоящее время ToIerRx, и гуманизированное анти-CD3 антитело, описанное в ссылке Herold et al., 30 May, 2002, NEJM, 546(22): 1692-1698, инкорпорированной в настоящее описание путем отсылки. В одном примере осуществления настоящего изобретения гуманизированное Bluestone анти-CD3 антитело вводят внутривенно в течение 14 дней в год в дозах 1-1,42 мкг/кг на 1-й день, 5,67 мкг/кг на 2-й день, 11,3 мкг/кг на 3-й день,22,6 мкг/кг на 4-й день и 45,4 мкг/кг на 5-14-й дни. Указанные методы лечения также ежегодно необходимо повторять после 3-6 месяцев использования HIP при одновременном снижении количества инсулина по мере образования новых островковых клеток. На этапе лечения с использованием HIP может быть продолжен прием витамина D или использование прамлинтида/симлина. После прекращения введенияHIP и инсулиновой терапии ежегодно повторяется иммунная модуляция для анти-CD3 антител, хотя недавно проведенное исследование позволило обнаружить их эффективность, сохраняющуюся в течение 24 месяцев (Herold. Diabetes. 2005, 54(6): 1763-9). В другом примере осуществления изобретения иммуномодуляторное соединение представляет собой лизофиллин или белок теплового шока, способный блокировать или замедлять деструкцию островковых клеток. Такие протеины включают DIAPEP277, белок теплового шока, разработкой которого занимается компания Develogen AG (см. ссылку Raz et al., 2002, Lancet, 358(9295): 1749-53, инкорпорированную в настоящее описание путем отсылки). В одном примере осуществления настоящего изобретения DIAPEP277 вводят подкожно в количестве 1 мг в 40 мг маннитола в растительном масле на исходном уровне и с интервалом в 1 месяц, а затем с интервалом в 3 месяца. Введение DIAPEP277 продолжают в течение всего периода HIP терапии и после завершения HIP терапии с интервалом в 4 месяца с целью защиты вновь генерированных островков в результате проведения HIP терапии. В одном примере осуществления комбинаторной терапии настоящего изобретения HIP вводят совместно сDIAPEP277 в соответствии с нижеописанной процедурой. Сначала вводят подкожно DIAPEP277 при дозе приблизительно 1 мг приблизительно за 30 дней до начала проведения HIP терапии. Второе введение DIAPEP277 осуществляют в период (30 дней после первого введения) начального проведения HIP терапии. При необходимости HIP терапию можно провести повторно и DIAPEP277 вводят с частотностью приблизительно раз в 3 месяца. В другом примере осуществления настоящего изобретения хомячковый INGAP может быть введен путем 24-часовой непрерывной подкожной инфузии при дозе приблизительно от 8 до 18 мг/кг веса тела пациента в сутки. При необходимости HIP терапию можно провести повторно и DIAPEP277 вводят с частотностью приблизительно раз в 3 месяца.- 16013821 Новые HIP терапевтические способы, предусматриваемые настоящим изобретением, позволяют устранить ряд различных основополагающих симптомов, возникающих в результате отсутствия либо пониженного или недостаточного количества инсулина и иных гормонов, либо которые вырабатываются в аберрантных количествах. Методы лечения на основе HIP, на основе аналогов или производных HIP или на основе комбинаторной терапии, предусматриваемые настоящим изобретением, позволяют восстановить глюкозный метаболизм в более нормальном режиме, включая достижение и поддержание соответствующих уровней инсулина, амилина, постпрандиальной глюкозы, триглицеридов и глюкагона,нормализовать существенное повышение веса и снизить риск тяжелой гипогликемии, связанной с жестким гликемическим контролем. Исходя из описания изобретения, специалистам в данной области техники должно быть очевидно,что может быть использовано сочетание нескольких веществ, стимулирующих островковый неогенез,и/или дифференциацию клеток-предшественников, и/или деградацию в способах настоящего изобретения. Дополнительно при реализации способов настоящего изобретения HIP, или его аналоги, или производные при совместном введении или при отдельном введении другого выбранного вещества, такого как симлин/прамлинтид, ГПП-1, агонист рецептора ГПП-1, агонист ГПП-1 или ингибитор дипептидилпептидазы-4, ингибирующий деградацию ГПП-1, которые позволяют снизить вес, повысить чувство сытости, замедлить абсорбцию глюкозы в желудочно-кишечном тракте, могут быть использованы в сочетании с конкретным веществом, ингибирующим, блокирующим деятельность или разрушающим аутоиммунные клетки, выбирающие своей целью панкреатические бета-клетки. Такие вещества включают, например, пептиды, протеины и синтетические соединения. В одном примере осуществления настоящего изобретения вещество представляет собой моноклональное антитело, белок теплового шока или иное соединение, которое, в частности, замедляет, предотвращает или останавливает аутоиммунную деструкцию островковой функции. Исходя из приведенного описания изобретения, специалистам в данной области техники должно быть очевидно, что может быть использовано сочетание нескольких веществ, блокирующих аутоиммунную деструкцию панкреатической островковой функции, в способах настоящего изобретения. Вещества,ингибирующие, блокирующие деятельность или разрушающие аутоиммунные клетки, выбирающие своей мишенью панкреатическую островковую функцию, включают анти-CD-3 антитела (hOKT31 (Ala-Ala и ChAglyCD3, сиролимус (рапамицин), такролимус (FK506), белок теплового шока 60 (DIAPEP277),вакцину антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент, ритуксимаб, Кэмпас-1 Н (анти-CD52 антитело), лизофиллин и витамин D, IBC-VSO вакцину, являющуюся синтетической метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бета-клеток, вакцинацию интерфероном- с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток либо аналогичное вещество, предназначенное для предотвращения деструкции панкреатических бета-клеток. В данном последнем примере осуществления изобретения вакцинацию интерфероном- с использованиемCD4+CD25+ антигенспецифических регуляторных Т-клеток либо аналогичное вещество используют в сочетании с комбинаторной терапией для применения регуляторных Т-клеток либо непосредственно,либо путем использования анти-CD3 иммунотерапии. Иммунное вещество в соответствии с указанным примером предусматривается использовать, в частности, для введения пациентам с диабетом 1-го типа для защиты вновь образовавшихся островковых клеток от иммунной атаки. Таким образом, комбинаторная терапия и связанные с ней способы настоящего изобретения предусматривают введение HIP, или его аналогов, или производных либо совместное введение HIP или его аналогов и производных с одним или несколькими веществами, стимулирующими дифференциацию островков от клеток в поджелудочной железе взрослого человека, с одним или несколькими веществами,блокирующими аутоиммунную деструкцию панкреатических бета-клеток. Для целей настоящего описания вещество "вводят совместно" или "используют в сочетании" с другим веществом, которое также называется в настоящем описании, как "соединение" или "гормон", когда два или три вещества вводят как часть одного и того же курса терапии. В одном примере осуществления настоящего изобретения первое вещество вводят первым до введения второго вещества и лечение с использованием обоих веществ продолжают на протяжении всего курса терапии. В другом примере осуществления изобретения второе вещество вводят после начала проведения или завершения терапии с использованием первого вещества. В других примерах осуществления настоящего изобретения первое вещество вводят одновременно с началом проведения терапии с использованием второго вещества. В другом примере осуществления изобретения третье вещество вводят одновременно либо до, либо после введения первого или второго вещества или обоих веществ. В одном примере осуществления настоящего изобретения сначала проводят терапию с использованием одного или нескольких веществ для блокирования или уничтожения аутоиммунных клеток, выбирающих своей мишенью панкреатические бета-клетки, вырабатывающие инсулин и амилин,а затем проводят терапию, стимулирующую дифференциацию островков от клеток-предшественников в поджелудочной железе взрослого человека. В другом примере осуществления настоящего изобретения- 17013821 лечение с использованием специфического аутоиммунного блокатора продолжают после прекращения лечения с использованием веществ, стимулирующих дифференциацию островков. До введения иммуномодулирующих веществ или при их одновременном введении проводится трехмесячный интенсивный/жесткий гликемический контроль, который может предусматривать введение нескольких суточных инъекций инсулина, инсулиновую насосотерапию и применение терапии с использованием прамлинтида/симлина и витамина D при дозах 1000-2000 иммунизирующих единиц/сутки для поддержания уровня 25-гидрокси-витамина D выше 40 нг/мл. Реализация способов настоящего изобретения может предусматривать несколько периодов, или"циклов" лечения. Например, введение вещества, стимулирующего дифференциацию островков от клеток-предшественников при одновременном введении вещества, блокирующего аутоиммунные клетки,выбирающие своей мишенью панкреатические бета-клетки, может рассматриваться как один цикл способа настоящего изобретения, включающий совместное введение обоих типов вещества. В альтернативном случае каждое введение дифференцирующего островки вещества может рассматриваться как цикл лечения и при введении блокирующего аутоиммунные клетки вещества оно может быть введено только в виде дополнительной процедуры таких циклов или после последнего введения дифференцирующего островки вещества, например только две инъекции DIAMYD квасцового человеческого рекомбинантного GAD65, введенные подкожно с интервалом в 4 недели для предотвращения дальнейшей деструкции бета-клеток у пациентов с аутоиммунным диабетом (Agardh et al., J. Diabetes Complications. 2005, 19(4): 238-46). Хотя единичный курс с использованием анти-CD3 моноклонального антитела (hOKT31 (AlaAla приводит к улучшению С-пептидных ответов и клинических параметров, терапию с использованием анти-CD3 антитела рекомендуется проводить по меньшей мере в течение 2 лет после наступления диабета 1-го типа (Herold, et al., Diabetes. 2005, 54(6): 1763-9). Таким образом, в зависимости от выбранного иммуноблокатора цикличность терапии может изменяться с целью защиты новых островков от иммунной атаки. Специалистам в данной области техники должно быть очевидно, что вышеприведенные примеры носят исключительно иллюстративный характер и никоим образом не ограничивают настоящее изобретение. Специалистам в данной области техники должно быть очевидно, что во многих случаях схема совместного введения может отличаться при первом или последующем терапевтическом цикле в целях удобства пациента. Комбинаторные методы лечения и связанные с ними способы настоящего изобретения направлены исключительно на основные патологические механизмы диабета 1-го типа при использовании веществ,регенерирующих новые островковые структуры и/или дифференцирующих панкреатические клеткипредшественники, в сочетании с веществами, обеспечивающими целевую иммунотерапию. Указанная комбинаторная терапия реверсирует полностью или частично основные механизмы диабета 1-го типа,представляющего собой аутоиммунное явление, при котором аутоантитела атакуют поджелудочную железу. Существующие методы лечения диабета 1-го типа, которые в основном полагаются на введение инсулина, не позволяют реверсировать дефекты, лежащие в основе диабета 1-го типа. Более того, существующие иммунотерапии для лечения диабета 1-го типа основаны на ослаблении функции панкреатических бета-клеток и не воздействуют на дифференциацию новых полностью функциональных островковых структур, содержащих новые альфа, бета, дельта и полипептидные клетки внутри каждого нового островка. Для пациентов с диабетом 2-го типа не потребуется иммунное блокирующее вещество, так как иммунная деструкция не лежит в основе заболевания, хотя последние исследования указывают на потенциально важную роль дефицита витамина D при диабете 1-го типа, и недавно проведенные исследования позволили обнаружить, что в процессе диагностирования у большего количества пациентов с диабетом 2-го типа наблюдается недостаток витамина D, чем у пациентов с диабетом 1-го типа, и в этой связи рекомендуется поддержание уровней выше 40 нг/мл с целью обеспечения нормальной иммунной функцииDiabetes Metab. 2005; 31(4 Pt. 1): 318-25; Pozzilli. Horm Metab Res. 2005; 37(11): 680-3). При дозах до 10000 иммунизирующих единиц/сутки не было обнаружено отрицательного действия лекарственных препаратов (Heaney. Am. J. Clin. Nutr., 204-210, Vieth. Am. J. Clin. Nutr. 2001; 73: 288-294). Новые способы, предусматриваемые настоящим изобретением, позволяют реверсировать лежащие в основе патологические механизмы диабета 2-го типа, а также заболеваний и состояний, вызванных снижением выработки инсулина ввиду дисбаланса между деструкцией, регенерацией и поддержанием деятельности бета-клеток, путем дифференциации новых островковых структур, содержащих полностью функциональные новые бета-клетки. Способы и соединения в соответствии с настоящим изобретением позволяют снизить потребности в инсулине и противодиабетических препаратах у пациентов, в настоящее время принимающих лекарства ввиду заболевания диабетом 2-го типа или страдающих от иных заболеваний или состояний, и обеспечивают улучшение контроля глюкозы в организме таких пациентов. У ряда пациентов лечение в соответствии со способами настоящего изобретения позволяет снизить количество вводимого инсулина или полностью отказаться от его введения. В нижеприведенном разделе дано- 18013821 описание ряда заболеваний и состояний, для лечения которых могут быть использованы способы и композиции в соответствии с настоящим изобретением, обладающие терапевтической полезностью. Заболевания и состояния, подлежащие лечению. Методы лечения на основе HIP, или аналогов, или производных HIP и комбинаторные методы лечения в соответствии с настоящим изобретением могут быть использованы для лечения любых млекопитающих, включая людей и животных, страдающих от заболеваний, симптомов или состояний, связанных с пониженной выработкой или секрецией инсулина ввиду прекращения или ослабления функции бетаклеток или связанных с необходимостью выработки большего количества инсулина, которое может быть обеспечено субъекту путем дифференциации новых островковых структур от клеток-предшественников путем использования соединений HIP или способов лечения. Такие заболевания и состояния включают сахарный диабет 1-го типа, сахарный диабет 2-го типа,преддиабет, нарушенную гликемию натощак, гиперинсулинемию натощак, включая без ограничений пациентов с диабетом типа 1 а или пациентов со скрытым аутоиммунным диабетом зрелого возраста, у которых могут обнаруживаться антитела (анти-GAD65 антитела, аутоантитела и антиинсулиновые антитела), либо пациентов с диабетом 1-го типа с инсулиновой недостаточностью без аутоиммунности, направленной на бета-клетки (диабет типа 1b). Более того, настоящее изобретение может быть применино с терапевтической полезностью в отношении пациентов с вновь диагностированным диабетом 1-го типа,детей и ближайших родственников пациентов с диабетом 1-го типа и в отношении людей с положительными антителами и иными аутоиммунными состояниями, указывающими на предрасположенность к диабету 1-го типа. В одном примере осуществления настоящего изобретения способы в соответствии с настоящим изобретением применяются для реверсирования диабета 1-го типа у пациентов, нуждающихся в таком лечении. Комбинаторные методы лечения и связанные с ними способы и композиции настоящего изобретения также могут быть применены в качестве дополнительных лечебных мероприятий к инсулиновой терапии при диабете 1-го типа у детей и взрослых для снижения колебаний уровней глюкозы в организме пациентов с диабетом и пациентов со слабо контролируемым диабетом, гипогликемической неосведомленностью и рецидивной гипогликемией при диабете 1-го типа. Методы лечения на основе HIP, или аналогов, или производных HIP и связанные с ними способы и композиции изобретения могут быть использованы для лечения вновь диагностированного у пациентов диабета 2-го типа, диабета 2-го типа у детей и гипогликемии и диабета 2-го типа у взрослых, которые одновременно лечат инсулином, применяя пероральные диабетические и иные подкожные диабетические методы лечения, а также для лечения слабо контролируемого диабета 2-го типа. У ряда пациентов,как детей, так и взрослых, способы и композиции изобретения позволяют реверсировать диабет 1- и 2-го типов. Способы и композиции настоящего изобретения также могут быть использованы для лечения как детей, так и взрослых, имеющих атипичные формы диабета, и пациентов с состоянием постпрандиальной гипергликемии. Методы лечения на основе HIP, или аналогов, или производных HIP и связанные с ними способы и композиции также могут быть применены для лечения как детей, так и взрослых, нуждающихся в снижении веса, уменьшении триглицеридов, липопротеина низкой плотности, включая без ограничений снижение веса или лечение ожирения, снижение избыточного веса у пациентов, имеющих диабет, а также у пациентов, не имеющих диабет 1- или 2-го типа. В одном примере осуществления настоящего изобретения способы и композиции настоящего изобретения применяют для лечения пациентов с патологическим ожирением. В других примерах осуществления настоящего изобретения способы и композиции в соответствии с изобретением применяют для лечения пациентов с патологическим ожирением или пациентов, болеющих анорексией, булимией или иными расстройствами пищевого поведения. Методы лечения с использованием одного вещества и связанные с ними способы и композиции в соответствии с настоящим изобретением могут быть использованы для детей и взрослых, имеющих дисметаболический синдром или метаболический синдром, а также для пациентов, у которых наблюдается состояния синдромов невропатической боли, являющихся следствием измененного глюкозного метаболизма, и пациентов с гипертриглицеридемией с диабетом или без него и с постпрандиальной гипертриглицеридемией. В одном примере осуществления настоящего изобретения указанные способы применяются для лечения синдрома поликистозных яичников у пациентов, нуждающихся в таком лечении. Другие пациенты, которые могут получить пользу от применения терапии на основе HIP, или аналогов, или производных HIP и связанных с ними способов в соответствии с настоящим изобретением,включают детей и взрослых, которым поставлен диагноз таких состояний, как гипергликемия натощак,преддиабет, нарушенная гликемия натощак, нарушенная толерантность к глюкозе и в общем гипергликемические состояния. Методы лечения на основе HIP, или аналогов, или производных HIP и связанные с ними способы и композиции также могут быть применены для лечения пациентов, имеющих синдромы невропатической боли и невропатию независимо от того, поставлен ли пациенту диагноз диабет или нет. Методы лечения на основе HIP, или аналогов, или производных HIP и связанные с ними способы и композиции также могут быть применены для лечения пациентов, имеющих рецидивирующий панкреа- 19013821 тит или рак поджелудочной железы, и могут быть использованы во всех режимах, направленных на формирование новых островковых структур, полученных из клеток-предшественников в поджелудочной железе. В нижеприведенных разделах дано описание веществ, используемых в способах настоящего изобретения. Исходя из описания настоящего изобретения, специалистам в данной области техники должно быть очевидно, что квалифицированный изобретатель может выбрать определенные вещества с учетом заболевания или состояния в процессе их лечения, состояния здоровья и терапевтического состояния пациента. Вещества для стимулирования регенерации панкреатических островков. В одном примере осуществления способов настоящего изобретения вещество, стимулирующее дифференциацию островков из панкреатических клеток-предшественников в вырабатывающие инсулин островковые структуры, выбирают из группы, состоящей из HIP, или его аналога, или производного,включающего безглютаматный HIP, HIP триптофан, HIP валин-трипитофан, HIP гексапептид, HIP септапептид, HIP второй септапептид или триптофан-безглютаматный HIP, амилин и/или аналог, включая без ограничений прамлинтид (симлин), аналоги рецептора ГПП-1, эксендин-4 (EXENATIDE), лираглютид (NN2211), ГПП-1, аналоги ГПП-1, желудочный ингибирующий пептид, ГПП-1, хомячковый INGAP,другие инкретин-миметические гормоны и/или аналогичным образом действующие соединения и вещества и вещества, удлиняющие полужизнь либо повышающие уровень или активность любого из вышеперечисленных соединений и веществ, таких как, например, ингибитор дипептидил-пептидазы-4, замедляющий деградацию ГПП-1. Существуют многочисленные ГПП-1 миметики, которые воздействуют за счет прямой активности агониста на рецепторы ГПП-1 или за счет ингибирования деградации ГПП-1. Указанные вещества являются полезными при использовании в способах настоящего изобретения. ГПП-1 миметики могут быть использованы в сочетании с HIP и/или целевой иммунотерапией для лечения диабета 1-го типа и, как предусмотрено настоящим изобретением, они могут использоваться для улучшения гликемического контроля, повышения чувства сытости, замедления абсорбции глюкозы желудочно-кишечным трактом и реверсирования лежащих в основе механизмов, приводящих к диабету 1-го типа. Указанные вещества и способы позволяют предотвратить развитие нарушенной толерантности к глюкозе при диабете; предотвратить преддиабет, развитие нарушенной гликемии натощак в нарушение толерантности к глюкозе и в диабет; реверсировать вновь диагностированный диабет 2-го типа; лечить диабет 2-го типа и лечить или предотвращать избыточный вес, ожирение, синдром поликистозных яичников и синдромы невропатической боли. Способы, вещества и фармацевтические композиции являются полезными при реализации настоящего изобретения с целью достижения дифференциации панкреатических островков из клетокпредшественников в поджелудочной железе взрослого человека и включают способы, вещества и фармацевтические композиции, описанные в ссылках, каждая из которых инкорпорирована в описание путем отсылки: Rosenberg et al., 1992, Adv. Exp. Med. Biol. 321: 95-104; Mar. 1996, Diabetologia, 59(3): 25662; Jul. 1996, Pancreas i5(1): 38-46 and Nov. 2004, Ann. Surg. 240(5): 875-84; Vinik et al., Jun. 1997, Horm.Metab. Res. 29(6): 278-93. Стимулирование регенерации островков или дифференциация панкреатических клеток-предшественников могут проявиться в форме повышенной выработки и/или секреции инсулина в организме субъекта. В одном примере осуществления настоящего изобретения амилин или его аналог, симлин, прамлинтид используют до введения или при совместном введении с HIP; амилин может быть введен до островковой регенерации и его введение может быть продолжено в течение всего периода островковой регенерации в соответствии с основополагающей ссылкой Young et al., 1997, Curr. Opin. Endocrin. Diabetes 4: 282-290, инкорпорированной путем отсылки. В одном примере осуществления настоящего изобретения амилин и/или его аналог, включая без ограничений прамлинтид, вводят подкожно для оптимизации гликемического контроля до начала лечения с применением HIP и затем может быть использован отдельно или в сочетании с другими пептидами, стимулирующими островки, такими как HIP, или аналог,или производное HIP. В одном примере осуществления настоящего изобретения амилин или прамлинтид вводится в дозах 0,3-0,8 мкг/кг веса пациента. В одном примере осуществления настоящего изобретения указанную дозу вводят подкожно до принятия пищи, например один раз перед сном и в 3 ч ночи. В одном примере осуществления настоящего изобретения терапевтически эффективную дозу вводят подкожно, или через инфузионное устройство/насос, и/или трансдермальную, интраназальную, буккальную систему доставки лекарственного вещества микроиглами, или путем перорального принятия инкапсулированной дозы. В другом примере осуществления настоящего изобретения терапевтически эффективную дозу вводят с использованием композиции замедленного высвобождения, при этом введение инъецированием или с помощью иного способа используется не чаще одного раза в неделю, одного раза в 2 недели и один раз в месяц. Как указывалось выше, в ряде примеров осуществления изобретения амилин или прамлинтид вводят совместно с другим стимулирующим островки веществом.- 20013821 В одном примере осуществления настоящего изобретения аналог рецептора ГПП-1, включающий эксендин-4 или аналог, используют в способе с применением HIP при дозах 5-10 мкг при принятии пищи. Рецептура эксендина-4 может быть составлена и введена в целях настоящего изобретения в соответствии с идеями нижеприведенных ссылок, каждая из которых инкорпорирована в настоящее описание по отсылке: Alcantara et al., 1998, Cell Biochem. Fund. 16(1): 51-6; Dupre et al., 2004, J. Clin. Endocrin. Metab. 89(1): 3469-73; Edwards et al., 1999, Diabetes, 48: 86-93 и Xu et al., 1999, Diabetes 48: 2270-76. В одном примере осуществления настоящего изобретения эксендин-4 дозируется в пределах 5-10 мкг до принятия пищи. В одном примере осуществления настоящего изобретения эксендин-4 вводят подкожно отдельно или в сочетании с HIP и/или со стимулирующими островки пептидами. В одном примере осуществления настоящего изобретения терапевтически эффективную дозу вводят подкожно. В другом примере осуществления изобретения эксендин-4 вводят трансдермально, буккально, перорально в виде капсул, интраназально или с использованием систем доставки лекарственного вещества микроиглами. В другом примере осуществления изобретения терапевтически эффективная доза содержится в композиции замедленного высвобождения, которую необходимо вводить не чаще одного раза в неделю, один раз в 2 недели или один раз в месяц. В одном примере осуществления настоящего изобретения эксендин-4 вводят совместно с HIP или иным веществом, вызывающим неогенез островковых клеток или трансформирование клетокпредшественников, пациентам с диабетом 1- и 2-го типов либо пациентам с ожирением, избытком веса,синдромом резистентности к инсулину, нарушенной гликемии натощак, преддиабетом, синдромом поликистозных яичников, метаболическим синдромом и расстройствами пищевого поведения. Желудочный ингибирующий пептид и ГПП-1 относятся к семейству инкретинов гормонов ростаMetab. 88(6): 2706-13, каждая из которых инкорпорирована в описание путем отсылки), и в одном примере осуществления настоящего изобретения гормон инкретина или аналог при одновременном использовании HIP или без него применяют в способе для стимулирования дифференциации до островков из клеток-предшественников в поджелудочной железе взрослого человека. В одном примере осуществления настоящего изобретения желудочный ингибирующий пептид или аналог применяют в сочетании с HIP или без HIP. Рецептура желудочного ингибирующего пептида может быть составлена и введена для целей настоящего изобретения в соответствии с идеями нижеприведенных ссылок, каждая из которых инкорпорирована в описание путем отсылки: Andersen et al., 1978,Clin. Invest. 62: 152-161; Creutzfeldt et al., Feb. 1980, Diabetes, 29(2): 140-5; Dupre et al., 1973, J. Clin.Nauk et al., 1993, J. Clin. Endocrin. Metab. 76(4): 912-7. В одном примере осуществления настоящего изобретения желудочный ингибирующий пептид вводят внутривенно или подкожно в сочетании с HIP или его аналогом или производным и дозируют в пределах 2-10 нг/км веса пациента с целью обеспечения 30-минутной непрерывной внутривенной или подкожной диффузии за 3-5 мин до принятия пищи, до отхода ко сну и с 3 ч ночи. В одном примере осуществления настоящего изобретения желудочный ингибирующий пептид вводят подкожно до принятия пищи, один раз перед сном и в 3 ч ночи. В одном примере осуществления настоящего изобретения желудочный ингибирующий пептид вводят перорально или с помощью инфузионного устройства, или трансдермальных, интраназальных, буккальных систем доставки лекарственного вещества, или систем доставки микроиглами. В другом примере осуществления настоящего изобретения используют композицию замедленного высвобождения, которую необходимо вводить не чаще одного раза в неделю, одного раза в 2 недели или один раз в месяц путем инъецирования. Описание приемлемых композиций для введения желудочного ингибирующего пептида в соответствии со способами изобретения прведено в ссылке Joneset al., 6 Nov. 1989, Diabetes Res. Clin. Pract. 7(4): 263-9. В одном примере осуществления настоящего изобретения ГПП-1 или аналог, либо агонист рецептора ГПП-1, либо ингибитор дипептидил-пептидазы-4 применяют в сочетании с HIP, или его аналогом,или производным в способе для стимулирования дифференциации островков из клетокпредшественников. ГПП-1, агонисты рецептора ГПП-1, аналоги ГПП-1 и ингибиторы дипептидилпептидазы-4 могут быть составлены в виде рецептуры и введены для целей настоящего изобретения в соответствии с идеями нижеприведенных ссылок, каждая из которых инкорпорирована в описание путем отсылки: Elahi et al., 1994, Regulatory Peptides, 51(1): 65-1 A; Gutniak et al., 1994, Diabetes Care, 77: 103944; Kreymann et al., 1987, Lancet, 2: 1300-1304; Larsen et al., 1996, Diabetes, 45(Suppl. 2): 233A (Abstract);- 21013821 99: 2883-2889 и Zander et al., 2002, Lancet, 359: 824-30. В одном примере осуществления настоящего изобретения ГПП-1, агонисты рецептора ГПП-1 и аналоги ГПП-1 вводят подкожно или ингибиторы дипептидил-пептидазы-4 принимают перорально в сочетании с HIP, или его аналогом, или производным и дозируют в пределах 400-800 мг в сутки при 8-20 мг/кг веса пациента. В одном примере осуществления настоящего изобретения ГПП-1 вводят перорально или подкожно до принятия пищи, один раз перед сном. В одном примере осуществления настоящего изобретения ГПП-1 вводят с использованием устройства непрерывной подкожной инфузии при скорости 1-30 нг/кг веса тела/мин или с использованием трансдермальной, буккальной или микроигольной системы доставки лекарственного вещества с целью обеспечения 30-минутной непрерывной инфузии путем либо внутривенной, либо подкожной доставки лекарственного вещества за 3-5 мин до принятии пищи, перед отходом ко сну и с 3 ч ночи. В другом примере осуществления настоящего изобретения используют композицию замедленного высвобождения, которую необходимо инъекционно вводить не чаще одного раза в неделю, раз в 2 недели или один раз в месяц. В одном примере осуществления настоящего изобретения нечеловеческий/хомячковый INGAP вводят подкожно в сочетании с HIP, или его аналогом, или производным при дозах 5-20 мг/кг веса пациента на вес тела в день. В другом примере осуществления настоящего изобретения хомячковый INGAP вводят при непрерывной подкожной инфузии в течение 24 ч. В другом примере осуществления настоящего изобретения хомячковый INGAP вводят разделенными на курс лечения лекарственными дозами в течение дня до принятия пищи, один раз перед сном. В другом примере осуществления настоящего изобретения хомячковый INGAP вводят путем непрерывной инфузии с помощью устройства внутривенной доставки или подкожной доставки лекарственного вещества, путем непрерывной инфузии с помощью насоса,трансдермального пластыря, путем перорального приема капсул и микроигольной системы доставки лекарственного вещества с целью обеспечения доставки хомячкового INGAP при неизменном базальном уровне. В другом примере осуществления настоящего изобретения хомячковый INGAP доставляют путем непрерывной инфузии либо внутривенно, либо подкожно с доставкой болюса до приема пищи. В другом примере осуществления настоящего изобретения используют композицию замедленного высвобождения, которую необходимо инъекционно вводить не чаще одного раза в неделю, раз в 2 недели или один раз в месяц. В одном примере осуществления настоящего изобретения лираглютид (NN2211) вводят подкожно в сочетании с HIP, или его аналогом, или производным при дозах 10-40 мкг/кг веса тела. В другом примере осуществления настоящего изобретения лираглютид вводят подкожно до принятия пищи, один раз перед сном и в 3 ч ночи. В другом примере осуществления настоящего изобретения лираглютид вводят с использованием инфузионного устройства или систем трансдермальной, буккальной или микроигольной доставки лекарственного вещества с целью обеспечения 30-минутной непрерывной инфузии путем либо внутривенной, либо подкожной доставки за 3-5 мин до принятия пищи, до отхода ко сну и начиная с 3 ч ночи. В другом примере осуществления настоящего изобретения используют композицию замедленного высвобождения, которую необходимо инъекционно вводить не чаще одного раза в неделю, раз в 2 недели или раз в месяц. При применении комбинаторных методов лечения настоящего изобретения лираглютид, илиNN2211, вводят при дозе, составляющей приблизительно 20 мкг/кг веса пациента ежедневно. Указанная доза позволяет пациентам снизить прием болюсного инсулина на 10-20% до принятия пищи при снижении колебаний и пониженном уровне постпрандиальной глюкозы, глюкагона и триглицеридов. Введение лираглютида в соответствии со способом настоящего изобретения может быть использовано для улучшения гликемического контроля на основе измерений, например, без ограничений гемоглобина A1C при диабете 1-го типа; предотвращения развития нарушенной толерантности к глюкозе при диабете; предотвращения развития нарушенной гликемии натощак в нарушение толерантности к глюкозе и в диабет; реверсирования вновь диагностированного диабета 2-го типа и лечения диабета 2-го типа. В примере осуществления комбинаторной терапии в соответствии с настоящим изобретением лираглютид, или NN2211, вводят взрослому пациенту утром, приблизительно за 4 ч до принятия пищи и при отходе ко сну в течение 3 последовательных недель при дозе приблизительно 20 мкг/кг веса пациента. В том случае, когда пациент приступает к лечению при уровнях С-пептида ниже приблизительно 1,0 нг/мл, производится контроль уровней С-пептида, и при превышении ими 0,5 нг/мл вводят антителоhOKT31 (Ala-Ala) в течение 12 последовательных дней. При использовании комбинаторных методов лечения в соответствии с настоящим изобретением эксендин-4, или синтетический эксендин-4, или другой аналог ГПП-1, агонит рецептора ГПП-1 или ингибитор дипептидил-пептидазы-4 вводят отдельно до принятия пищи либо в сочетании с HIP или иным дифференцирующим островки веществом с целью улучшения гликемического контроля до проведенияHIP терапии или на начальном этапе HIP терапии. Такие вещества, доставляемые до принятия пищи, могут привести к снижению необходимого количества инсулина как минимум на 20%, и при принятии HIP или иных дифференцирующих островки лекарственных веществ может быть обеспечено соответствующее постепенное снижение дозы инсулина и диабетических препаратов. (Levetan et al., Diabetes Care,2003 Jan.; 26(1): 1-8). По мере доставки HIP и/или иных лекарственных веществ в организм пациентов с- 22013821 диабетом как 1-, так и 2-го типа необходимо проводить осторожное постепенное снижение дозы инсулина и диабетических препаратов с целью защиты против гипогликемии по мере дифференциации новых островковых клеток от клеток-предшественников. В конечном счете предусматривается сокращение инсулина и диабетических препаратов, включая HIP, по мере репопуляции поджелудочной железы новыми функциональными островковыми клетками. В том случае, когда пациент приступает к лечению при уровнях С-пептида ниже приблизительно 1,0 нг/мл, производится контроль уровней С-пептида, и при превышении ими 0,5 нг/мл проводят тщательный мониторинг и постепенное снижение доз экзогенного инсулина. До того как приступить к лечению с применением HIP и/или иных пептидных соединений пациентам с диабетом 1-го типа вводят до проведения иммунной терапии, в течение или после нее, симлин,хомячковый INGAP, ГПП-1, агонисты рецептора ГПП-1, аналоги ГПП-1, ингибиторы ДПП-4 для защиты вновь образовавшихся островков. Например, антитело hOKT31 (Ala-Ala) вводят в течение 12 последовательных дней, при этом его эффективность проявляется после проведения первого курса лечения по завершении 24 месяцев, в то время как аналогичное гуманизированное моноклональное антитело,ChAglyCD3, может вводиться в течение 6 последовательных дней и затем введение может повторяться ежегодно. Соединение GAD65, разработанное компанией Diamyd, доставляют путем двух подкожных инъекций с интервалом в один месяц. Применение DIAPEP277, белка теплового шока 60, оказалось успешным среди пациентов с вновь диагностированным диабетом, для лечения которых использовались подкожные инъекции в количестве 1 мг с 40 мг маннитола в растительном масле на начальном этапе исследования, спустя 1 месяц и спустя 6 месяцев. Цикличность лечения определяется исходя из выбранного иммуномодулятора. В другом примере осуществления настоящего изобретения DIAPEP277, вакцина белка теплового шока 60, DIAPEP277 и вакцина IBC-VSO, являющаяся синтетической метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бета-клеток, либо вакцинация интерферон-альфа, с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество используют в комбинаторной терапии. В другом примере осуществления настоящего изобретения используют способы, в которых применяют иммуномодуляцию, включающую без ограничения использование анти-CD3 иммунотерапии, при этом иммуномодуляция включает сиролимус (рапамицин), такролимус (FK506), белок теплового шока 60(DIAPEP277), вакцину антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент, ритуксимаб, Кэмпас-1 Н (анти-CD52 антитело) и/или витамин D, используемые по отдельности или в сочетании с терапевтическими способами по применению регуляторных Т-клеток либо непосредственно, либо путем применения анти-CD3 иммунотерапии. Вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие в качестве мишени клетки внутри панкреатических островковых структур. Аутоиммунные клетки, выбирающие в качестве своей мишени панкреатические бета-клетки, являются этиологическим фактором при возникновении, по меньшей мере, ряда заболеваний и состояний,поддающихся к излечению в соответствии со способами настоящего изобретения. См. ссылки Bach et al.,2001, Ann. Rev. Immun. 19: 131-161; Lernmark et al., Endocrin. Metab. Clin. N. Am. 20(3): 589-617 и Mathiset al., Dec. 2001, Nature, 414(6865): 792-798, каждая из которых инкорпорирована в описание путем отсылки. Способы лечения известного уровня техники, предусматривающие введение иммунных веществ пациентам с диабетом 1-го типа, позволяют защитить только те островковые клетки, которые еще не были разрушены в результате иммунной атаки, и не решают проблему репопуляции поджелудочной железы новыми островковыми структурами с полностью функциональными бета-клетками. Указанные способы сочетают неспецифическую и специфическую иммунную модуляцию, направленную на снижение деструкции бета-клеток, и методологию дифференциации новых островковых клеток от клетокпредшественников в поджелудочной железе взрослого человека. В способах настоящего изобретения могут использоваться вещества, специфически ингибирующие активность аутоиммунных клеток, блокирующие или разрушающие аутоиммунные клетки, которые выбирают своей мишенью панкреатические бета-клетки, вырабатывающие инсулин, амилин ил глюкагон. Такие вещества включают иммуномодуляторные пептиды, блокирующие деструкцию панкреатических островковых клеток. Например, одним таким веществом является моноклональное антитело, способное задержать прогрессию потери островковых клеток, либо замедлить, либо остановить наступление заболевания диабетом 1-го типа. Анти-CD3 антитела образуют общий класс веществ, являющихся полезными в способах настоящего изобретения. Например, приемлемые анти-CD3 антитела для целей настоящего изобретения включают антитело TRX4 (Ala-Ala и ChAglyCD3), разработкой которого занимается компания TolerRx, и гуманизированное анти-CD3 антитело, описанное в ссылке Herold et al., 30 May 2002,NEJM, 346(22): 1692-1698, инкорпорированной в описание путем отсылки. В одном примере осуществления настоящего изобретения гуманизированное анти-CD3 антитело доставляют внутривенно в течение 14 дней в год при дозе 1-1,42 мкг/кг на 1-й день, 5,67 мкг/кг на 2-й день, 11,3 мкг/кг на 3-й день,- 23013821 22,6 мкг/кг на 4-й день и 45,4 мкг/кг на 5-14-й дни. Указанные методы лечения могут быть применены повторно каждый год после применения HIP в течение 3-6-месячного периода при одновременном постепенном снижении дозы инсулина по мере образования новых островковых клеток. В течение этапа лечения с применением HIP можно продолжить прием витамина D и использование прамлинтида/симлина. После прекращения введения HIP и инсулиновой терапии ежегодно повторяется иммунная модуляция для анти-CD3 антител, хотя недавно проведенное исследование позволило обнаружить их эффективность, сохраняющуюся в течение 24 месяцев (Herold. Diabetes. 2005; 54(6): 1763-9). В другом примере осуществления настоящего изобретения иммуномодулирующее соединение представляет собой белок теплового шока, способный блокировать или замедлять деструкцию островковых клеток. Такие белки включают DIAPEP277, белок теплового шока, разработка которого ведется компанией Develogen AG (см. ссылку Raz et al., 2002, Lancet, 358(9295): 1749-53, инкорпорированную в описание по отсылке). В одном примере осуществления настоящего изобретения DIAPEP277 доставляют подкожно в количестве 1 мг в 40 мг маннитола в растительном масле на начальном этапе и с интервалом в один месяц, а затем дважды с интервалом в 3 месяца. В одном примере осуществления комбинаторной терапии настоящего изобретения HIP, или аналог, или производное HIP вводят совместно сDIAPEP277 в соответствии с нижеописанной процедурой. Сначала вводят подкожно DIAPEP277 при дозе приблизительно 1 мг приблизительно за 30 дней до начала проведения терапии с применением HIP,или аналога, или производного HIP. Второе введение DIAPEP277 осуществляют в период (90 дней после первого введения) начального проведения терапии с применением HIP, или аналога, или производного HIP.HIP, или его аналог, или производное доставляют путем подкожной инъекции, перорально через везикулы, действующие на печень, или другое липосомное вещество, либо путем 24-часовой непрерывной подкожной инфузии при дозе приблизительно 5-20 мг/кг веса тела пациента таким образом, чтобы доза составила приблизительно 600-800 мг/сутки на пациента. Терапию с применением HIP, или его аналога,или производного проводят в течение 3-6-месячного периода и проводят тщательный контроль на основе выработки С-пептида. Предусматривается проведение иммунотерапии на циклической основе исходя из выбранного иммунного вещества. Например, DIAPEP277 вводят с 3-месячным интервалом в течение полных 6 месяцев и первоначально предусматривается его доставка за 6 месяцев до проведения терапии с применением HIP, или его аналога, или производного (Raz et al., Lancet. 2001 Nov. 24; 358(9295): 174953). Составление, введение и дозирование иммуномодуляторных веществ, используемых в способах настоящего изобретения, может быть осуществлено в соответствии со способами известного уровня техники или способами, приведенными в настоящем описании. Фармацевтические композиции и дополнительные протоколы дозирования и введения для реализации способов изобретения описаны ниже. Аддитивность/синергизм. Композиции HIP, или его аналога, или производного, например безглютаматный HIP, HIP триптофан, HIP валин-трипитофан, HIP гексапептид, HIP септапептид, HIP второй септапептид или триптофанбезглютаматный HIP и их фармацевтически приемлемые соли и сложные эфиры, являются синергически или аддитивно эффективными для осуществления дифференциации клеток-предшественников в новые островковые клетки при лечении диабета или аналогичных заболеваний при сочетании с другими различными соединениями. Указанные соединения включают HIP, или его аналоги, или производные, амилин и/или аналог, включая без ограничений симлин/прамлинтид, ГПП-1, агонисты рецептора ГПП-1,такие как эксендин-4, лираглютид (NN2211), аналоги ГПП-1, ингибиторы дипептидил-пептидазы-4, желудочный ингибирующий пептид, хомячковый INGAP и другие инкретин-миметические гормоны и/или аналогичным образом действующие соединения и вещества, и вещества, удлиняющие время полужизни,либо повышающие уровень или активность любого из вышеперечисленных соединений и веществ, таких как, например, ингибиторы дипептидил-пептидазы-4, замедляющий деградацию ГПП-1, и вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки, выбирающие своей мишенью бета-клетки, и включающие без ограничений анти-CD-3 антитела (hOKT71 (Ala-Ala и ChAglyCD3, сиролимус (рапамицин), такролимус (FK506), белок теплового шока 60 (DIAPEP277), вакцину антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент, ритуксимаб, Кэмпас-1 Н (анти-CD52 антитело), лизофиллин и витаминD, IBC-VSO вакцину, являющуюся синтетической, метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бета-клеток и вакцинацию интерфероном- с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество, предназначенное для предотвращения деструкции панкреатических бета-клеток. В данном последнем примере осуществления изобретения вакцинацию интерфероном- с использованиемCD4+CD25+ антигенспецифических регуляторных Т-клеток либо аналогичное вещество используют в сочетании с комбинаторной терапией для применения регуляторных Т-клеток либо непосредственно,либо путем использования анти-CD3 иммунотерапии.- 24013821 Такие соединения, как сиролимус (рапамицин), такролимус (FK506), антитело TRX4, гиманизироанное анти-CD3 антитело, DYAMID анти-GAD65 антитело и DIAPEP277, также являются синергически или аддитивно эффективными при их совместном применении с HIP или веществом для осуществления дифференциации клеток-предшественников в новые островковые клетки при лечении диабета или аналогичных заболеваний. Синергизм определяется как взаимодействие двух или более веществ, благодаря которому их совместное воздействие сильнее, чем сумма их отдельных воздействий. Например, если воздействие только одного лекарственного препарата А при лечении заболевания составляет 25% и воздействие только одного лекарственного препарата В при лечении заболевания составляет 25%, то при сочетании двух лекарственных препаратов воздействие при лечении болезни составляет 75%, т.е. воздействие препаратов А и В является синергическим. Аддитивность определяется как взаимодействие двух или более веществ, в результате которого их совместное воздействие аналогично среднему их отдельных воздействий. Например, если воздействие только одного лекарственного препарата А при лечении заболевания составляет 25% и воздействие только одного лекарственного препарата В при лечении заболевания составляет 25%, то при сочетании двух лекарственных препаратов воздействие при лечении болезни составляет приблизительно 50% или по меньшей мере превышает 25%, т.е. воздействие препаратов А и В является аддитивным. Улучшение лекарственного лечебного режима может быть достигнуто путем совместного введения двух веществ, обладающих терапевтическим эффектом, если результатом взаимодействие двух или более веществ является их совместное воздействие, обеспечивающее снижение частоты побочных реакций,вызываемых либо одним, либо двумя веществами, используемыми при совместной терапии. Такое снижение частоты побочных реакций может являться результатом, например, введения меньших доз одного либо обоих веществ, используемых при совместной терапии. Например, если воздействие только одного лекарственного препарата А составляет 25% и его частота побочных реакций составляет 45% при использовании этикетированной дозы и воздействие только одного лекарственного препарата В составляет 25% и его частота побочных реакций составляет 30% при использовании этикетированной дозы, то при сочетании двух лекарств при дозах каждого препарата менее этикетированных доз обеспечивается достижение улучшения лекарственного лечебного режима, если общее воздействие составляет 35% и частоте побочных реакций - 20%. Комбинаторная терапия, предусматриваемая настоящим изобретением,включает терапии, демонстрирующие такое улучшение. Фармацевтические композиции, дозирование и введение. Дозирование и введение веществ, применяемых в способах настоящего изобретения в соответствии с описанием, обеспечивают ускоренную дифференциацию островков от клеток-предшественников взрослого человека с целью оптимизации возможностей человека секретировать инсулин из эндогенных вновь образовавшихся островковых структур в сочетании с используемыми методами иммунотерапии и методами лечения, которые обеспечивают минимальную токсичность при одновременной защите от разрушения новых островков. Фармацевтические композиции в соответствии с настоящим изобретением обеспечивают кинетическую доставку указанных веществ, простоту доставки и повышенную эффективность. В одном примере осуществления настоящего изобретения предусматривается дозированное подкожное введение пептида HIP в пределах 20-2000 мг (0,02857-285,7 мг/кг) четыре раза в день препрандиально, до каждого принятия пищи и введение одной дозы при отходе ко сну. В другом примере осуществления настоящего изобретения предусматривается введение пептидаHIP при дозе приблизительно 200 мг (2,857 мг/кг) четыре раза в день препрандиально, до каждого принятия пищи и введение одной дозы при отходе ко сну. Предпочтительно, чтобы пептид HIP доставляли в дозах 10-15 мг/кг путем четырех отдельных подкожных инъекций и общее количество составляло бы приблизительно 800 мг/день. Пептид HIP можно вводить от нескольких раз до максимально 20 раз в день либо путем непрерывной инфузии. Вещества, используемые в способах настоящего изобретения, могут вводиться с использованием различных способов применения. Известные вещества, используемые в способах настоящего изобретения, могут быть введены различными путями с использованием фармацевтических композиций, ранее разработанных для других показаний. Такие пути доставки большинства известных веществ включают,по меньшей мере, пероральную доставку, системы целевой и нецелевой липосомной доставки лекарственных средств для пероральной или подкожной доставки, которые могут включать везикулы, действующие на печень (AMDG/SDG), прикрепленные к HIP или соединениям, используемым в описанных в настоящее патенте методологиях, топическую доставку, включающую системы топической доставки мицелл и наносфер, подкожная доставка, включающая непрерывную инфузию с помощью насоса путем либо внутривенной либо подкожной доставки и одноразовые микронасосы и микроиглы (включая без ограничений микронасосы и микроиглы, производимые компанией Animas Corp.) и буккальную доставку.- 25013821 Конкретный путь введения и фармацевтическая композиция вещества, используемого при реализации способов настоящего изобретения, будут выбраны врачом исходя из заболевания и состояния пациента, проходящего лечение, и исходя из применяемого вещества. В способах настоящего изобретения может быть использовано широкое разнообразие фармацевтических композиций. В ряде примеров осуществления настоящего изобретения препараты широкого применения могут быть использованы для упрощения введения веществ и повышения эффективности. В одном примере осуществления настоящего изобретения одно или несколько веществ, применяемых в настоящем способе, имеют рецептуру, составленную в виде мицеллы. Нередко максимально простое введение достигается путем перорального введения. В то время как синтетические фармацевтические вещества могут быть нередко легко составлены для пероральной доставки, составление фармацевтических веществ на основе пептидов и протеинов для пероральной доставки может оказаться более сложным. Тем не менее, существуют приемлемые технологии для составления композиций, и в соответствии с одной важной особенностью настоящее изобретение предусматривает создание протеиновых и пептидных фармацевтических композиций, составленных для пероральной доставки. В одном примере осуществления настоящего изобретения фармацевтические композиции, применяемые в способах настоящего изобретения и приемлемые для пероральной доставки, в основном составляют в соответствии с известной технологией TECHNOSPHERE, разработанной компанией MannKind Corp., технологиейELIGEN, разработанной компанией Emisphere, и в виде систем назальной доставки, разработанных компанией Nastech, и в форме липосом перорального применения с избирательным воздействием на печень(везикулы доставки лекарственного препарата к печени), разработанных AMDG/SDG. Другие технологии пероральной доставки и инкапсулирования, приемлемые для изготовления фармацевтических композиций настоящего изобретения, включают везикулярный транспорт лекарственного препарата к печени (HDV). Технология везикулярного транспорта лекарственного препарата к желудочной железе (PDV) была предложена компанией CureDM для компании SDG/AMDG в целях возможного ее использования при доставке соединений, описанных в способах в настоящем патенте. ТехнологияHDV может быть использована для доставки соединений в соответствии с описанными методологиями,включая HIP (Davis et al., 2001, J. Diabetes Comp. 15(5): 227-33) и ГПП-1 непосредственно к печени. Технология PDV предусматривает создание липосом с конъюгированным белком или иной молекулой на их поверхности, которая направляет непосредственно к поджелудочной железе вещество, такое как пептид,стимулирующий неогенез островковых клеток. Вещества, рецептура которых может быть составлена для пероральной доставки и которые могут быть использованы в способах настоящего изобретения, включают HIP, или его аналог, или производное,включающее безглютаматный HIP, HIP триптофан, HIP валин-триптофан, HIP гексапептид, HIP септапептид, второй HIP септапептид или триптофан-безглютаматный HIP, симлин/пармлинтид, эксендин-4,лираглютид (NN2211), агонисты рецептора ГПП-1, ГПП-1, аналоги ГПП-1, хомячковый INGAP и его аналоги, желудочный ингибирующий пептид, ингибитор дипептидил-пептидазы-4 и пептиды и протеины или непептидные ниметики с аналогичным действием или гомологией по отношению к предшествующим веществам, использовавшимся с моноклональными антителами или иными специфическими и общими иммунными веществами, предназначенными для замедления прогрессии потери бета-клеток или для предотвращения наступления диабета 1-го типа как у детей, так и у взрослых, включая без ограничений анти-CD-3 антитела (hOKT31 (Ala-Ala и ChAglyCD3, целью которых является иммунный ответ и которые, в частности, блокируют Т-лимфоциты, вызывающие гибель бета-клеток при сахарном диабете 1-го типа, а также сиролимус (рапамицин), такролимус (FK506), белок теплового шока 60(DIAPEP277), вакцину антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент, ритуксимаб, Кэмпас-1 Н (анти-CD52 антитело), лизофиллин и витамин D, IBC-VSO вакцину, являющуюся синтетической, метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бетаклеток, вакцинацию интерфероном- с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество используют в комбинаторных терапевтических методах по применению регуляторных Т-клеток либо непосредственно, либо путем использования иммунотерапии для блокирования деструкции производящих инсулин клеток. Наборы. Настоящее изобретение дополнительно предусматривает создание наборов для лечения пациентов,имеющих диабет 1-го типа или диабет 2-го типа, либо иные расстройства глюкозного метаболизма у детей и взрослых, включающие преддиабет, нарушение гликемии натощак, синдром инсулинорезистентности, метаболический синдром, ожирение, избыточный вес, синдром поликистозных яичников, гиперлипидемию, гипертриглицеридемию, при этом наборы содержат один или несколько терапевтически эффективных способов их лечения с использованием HIP, его аналогов или производного (например, HIP триптофан, безглютаматный HIP, HIP валин-триптофан, HIP гексапептид, HIP септапептид, второй HIP септапептид или триптофан-безглютаматный HIP). Выборочно набор также может содержать другие вещества (например, симлин/пармлинтид, эксендин-4, желудочный ингибирующий пептид, агонисты- 26013821 рецептора ГПП-1, лираглютид (NN2211), аналоги ГПП-1, хомячковый INGAP или ингибитор дипептидил-пептидазы) и/или вещества, ингибирующие, блокирующие или разрушающие аутоиммунные клетки,выбирающие своей мишенью панкреатические островковые клетки, включающие без ограничений антиCD-3 антитела (hOKT31 (Ala-Ala и ChAglyCD3, целью которых является иммунный ответ и которые, в частности, блокируют Т-лимфоциты, вызывающие гибель островковых клеток при сахарном диабете 1-го типа, а также сиролимус (рапамицин), такролимус (FK506), белок теплового шока 60(DIAPEP277), вакцину антиглютаминовой кислоты декарбоксилазы 65 (GAD65), мофетилмикофенолат в отдельности или в сочетании с даклизумабом, анти-CD20 агент, ритуксимаб, Кэмпас-1 Н (анти-CD52 антитело), лизофиллин и витамин D, IBC-VSO вакцину, являющуюся синтетической, метаболически неактивной формой инсулина, предназначенной для предотвращения деструкции панкреатических бетаклеток, вакцинацию интерфероном- с использованием CD4+CD25+ антигенспецифических регуляторных Т-клеток, либо аналогичное вещество используют в комбинаторных терапевтических методах по применению регуляторных Т-клеток либо непосредственно, либо путем использования иммунотерапии для блокирования деструкции производящих инсулин клеток либо в одной и той же, либо в отдельной упаковке с инструкциями по их использованию. Антитела специфические для HIP и его аналогов или производных. В различных примерах осуществления настоящего изобретения для проведения иммунологических анализов могут быть использованы моноклональные или поликлональные антитела, являющиеся специфическими для HIP, или его аналогов, или производных, с целью измерения количества HIP, или его аналогов, или производных либо они могут быть использованы при иммуноаффиной очистке HIP, или его аналогов, или производных. Для идентификации гидрофильных областей белка и для идентификации эпитопов HIP, или его аналогов, или производных может быть использован гидрофильный анализ компании HoppWoods (см. HoppWoods, Proc. Natl. Acad. Sci. U.S.A. 78: 3824-3828 (1981. Антитела, иммуноспецифически связывающиеся с HIP или его аналогами или производными, могут быть получены с помощью любого известного в данной области техники способа для синтезирования антител, в частности, путем химического синтезирования или предпочтительно путем рекомбинантной экспрессии (см., например, U.S. Publication No. 2005/0084449, включенную в настоящее описание по отсылке). Поликлональные антитела, иммуноспецифические для HIP, или его аналогов, или производных, могут быть получены с помощью различных известных в данной области техники способов. Например,HIP, или его аналоги, или производные могут быть введены различным животным-хозяевам, включающим без ограничений кроликов, мышей и крыс, с целью индуцирования выработки содержащих сыворотку поликлональных антител, специфических для HIP, или его аналогов, или производных. С целью повышения иммунологического ответа могут быть использованы различные адъюванты в зависимости от вида хозяина, включающие без ограничений минеральные гели Фрейнда (полные и неполные), такие как гидроокись алюминия, поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки, динитрофенол и потенциально полезные адъюванты человека, такие как BCG (бацилла Камельтта-Герина) и corynebacteriumparvum. Такие адъюванты также хорошо известны в данной области техники. Моноклональные антитела могут быть получены путем использования различных технологий, известных в данной области техники, включая использование гибридомной технологии, рекомбинантной технологии и технологии фагового дисплея или их сочетаний. Например, моноклональные антитела могут быть получены с использованием гибридомных технологий, включающих технологии, известные в данной области техники и идеи которых излагаются, например, в Harlow et al., Antibodies: A Laboratoryand T Cell Hybridomas 563 681 (Elsevier, N.Y., 1981). Термин "моноклональное антитело" для целей настоящего описания не ограничен антителами, полученными путем гибридомной технологии. Термин"моноклональное антитело" относится к антителу, полученному из единичного клона, включающего любой эукариотический, прокариотический или фаговый клон, а не способ, в соответствии с которым он получен. Способы получения и скрининга специфических антител с использованием гибридомной технологии являются стандартными и хорошо известными в данной области техники. Вкратце, мышь может быть иммунизирована немышиным антигеном и после обнаружения иммунного ответа, например при обнаружении в сыворотке мыши антител специфических для антигена, селезенку мыши изымают и выделяют спленоциты. Далее, используя хорошо известные способы, производят слияние спленоцитов с любыми приемлемыми клетками миеломы, например с клетками из клеточной линии SP20, поставляемой компанией АТСС. Гибридомы выбирают и клонируют методом предельного разведения. Далее проводят анализ гибридомных клонов с помощью известных в данной области техники способов на наличие клеток, секретирующих антитела, способные связывать полипептид в соответствии с настоящим изобретением. Асцитная жидкость, обычно содержащая высокие уровни антител, может быть получена путем иммунизации мышей положительными гибридомными клонами.- 27013821 Настоящее изобретение предусматривает создание способов получения моноклональных антител, а также антител, полученных с помощью способа, включающего культивирование гибридомных клеток,секретирующих антитела в соответствии с настоящим изобретением, в которых гибридому предпочтительно получают путем слияния сплентоцитов, выделенных из мышей, иммунизированных немышиным антигеном, с клетками миеломы и путем скрининга гибридом, полученных в результате слияния, на наличие гибридомных клонов, секретирующих антитело, способное связываться с антигеном. Фрагменты антител, распознающие специфические конкретные эпитопы, могут быть получены с помощью любого известного в данной области техники способа. Например, фрагменты Fab и F(ab')2 могут быть получены путем протеолитического расщепления иммуноглобулиновых молекул с использованием энзимов (ферментов), таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2). Фрагменты F(ab')2 содержат вариабельную область, константную область легкой цепи и домен СН 1 тяжелой цепи. Кроме того, антитела в соответствии с настоящим изобретением могут быть получены с использованием различных известных в данной области техники способов фагового дисплея. При использовании способов фагового дисплея функциональные домены антител отображаются на поверхности фаговых частиц, несущих кодирующие их полинуклеотидные последовательности. В частности, последовательности ДНК, кодирующие домены VH (вариабельная область тяжелой цепи) и VL(вариабельная область легкой цепи), усиливаются из библиотек животных комплементарных ДНК (например, библиотеки человеческих или мышиных комплементарных ДНК пораженных тканей). ДНК, кодирующие домены VH и VL, рекомбинируют вместе с линкером scFv путем цепной реакции полимеразы и клонируют в фагемидный вектор. Осуществляют электропорацию вектора в Е.coli и Е.coli инфицируют фагом-помощником. Используемые в указанных способах фаги являются обычно нитчатыми фагами,включающими fd и М 13, и обычно проводят рекомбинантное слияние доменов VH и VL либо с фаговым геном III, либо с геном VIII. Фаг, экспрессирующий антигенсвязывающий домен, который связывается с конкретным антигеном, может быть выбран или определен с антигеном, например, с использованием меченого антигена или антигена, связанного с твердой поверхностью или гранулой, либо захваченного твердой поверхностью или гранулой. Примеры способов фагового дисплея, которые могут быть использованы для получения антител в соответствии с настоящим изобретением, включают способы, описанные в Brinkman et al., 1995, J. Immunol. Methods, 182: 41-50; Ames et al., 1995, J. Immunol. Methods, 184: 177-186; Kettleborough et al., 1994, Eur. J. Immunol. 24: 952-958; Persic et al., 1997, Gene, 187: 9-18; BurtonWO 95/15982; WO 95/20401 и WO 97/13844; патенты США 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108. В соответствии с описанием в вышеприведенных ссылках после выбора фага кодирующие антитело области могут быть выделены из фага и использованы для получения двухвалентных антител или любого иного требуемого антигена, связывающего фрагмент и экспрессирующего в любом требуемом хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например,в соответствии с приведенном ниже описанием. Также могут быть применены технологии для рекомбинантного получения фрагментов Fab, Fab' и F(ab')2 с использованием известных в данной области техники способов, таких как описаны в международной публикации согласно РСТWO 92/22324; Mullinax etal., 1992, BioTechniques, 12(6): 864-869; Sawai et al., 1995, AJRI, 34: 26-34 и Better et al., 1988, Science, 240: 1041-1043. Для получения двухвалентных антител праймеры ПЦР, включающие нуклеотидные последовательности VH или VL, сайт рестрикции и фланкирующую последовательность для защиты сайта рестрикции,могут быть использованы для амплификации последовательностей VH или VL в клонах scFv. Использование технологий клонирования, известных специалистам в данной области техники, позволяет клонировать ПЦР-амплифицированные домены VH в векторы, экспрессирующие константную область VH, например человеческую константную область гамма 4, а ПЦР-амплифицированные домены VL клонировать в векторы, экспрессирующие константную область VL, например в человеческие каппа и лямбда константные области. Предпочтительно, чтобы векторы для экспрессии доменов VH или VL включали промотор EF-1, сигнал секреции, сайт клонирования для вариабельных доменов, константные домены и маркер выделения, такой как неомицин. Домены VH и VL также могут быть клонированы в один вектор,экспрессирующий необходимые константные области. Конверсионные векторы тяжелой цепи и конверсионные векторы легкой цепи далее совместно трансфектируют в клеточные линии с целью получения стабильных или транзиторных клеточных линий, экспрессирующих полноразмерные антитела, напримерIgG, с использованием способов, известных специалистам в данной области техники. Для применения в ряде случаев, включающих использование in vivo антител в организме человека и использование in vitro при проведении диагностических анализов, предпочтительным может явиться использование гуманизированных антител или химерных антител. Человеческие антитела могут быть получены с использованием различных известных в данной области техники способов, включающих вышеописанные способы фагового дисплея, с использованием библиотек антител, полученных из последо- 28013821 вательностей человеческого иммуноглобулина. См. также патенты США 4444887 и 4716111 и международные публикацииWO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096,WO 96/33735 и WO 91/10741. Химерное антитело представляет собой молекулу, в которой различные части антитела получены из различных молекул иммуноглобулина. Способы получения химерных антител известны в данной области техники. См., например, Morrison, 1985, Science, 229: 1202; Oi et al., 1986, BioTechniques, 4: 214; Gillieset al., 1989, J. Immunol. Methods, 125: 191-202 и патенты США 5807715; 4816567; 4816397 и 6311415. Гуманизированное антитело является антителом, либо его вариантом, либо фрагментом, способным связываться с заданным антигеном и включающим каркасную область, имеющую в основном аминокислотную последовательность человеческого иммуноглобулина, и комплементарно определяемую область,имеющую в основном аминокислотную последовательность нечеловеческого иммуноглобулина. Гуманизированное антитело содержит в основном как минимум все из одного и обычно из двух вариабельных доменов (Fab, Fab', F(ab')2, Fabc, Fv), в которых все или в основном все из комплементарно определяемых областей соответствуют областям нечеловеческого иммуноглобулина (т.е. донорское тело) и все или в основном все из каркасных областей являются областями консенсусной последовательности человеческого иммуноглобулина. Предпочтительно, чтобы гуманизированное антитело также содержало как минимум часть константной области иммуноглобулина (Fc), обычно область человеческого иммуноглобулина. Обычно антитело содержит как вариабельную область легкой цепи, так и, по меньшей мере, вариабельную область тяжелой цепи. Антитело также может включать CH1, шарнирные соединения, СН 2, СН 3 и СН 4 участки тяжелой цепи. Гуманизированное антитело может быть выбрано из любого класса иммуноглобулина, включающего IgM, IgG, IgD, IgA и IgE, и любого изотипа, включающего IgG1,IgG2, IgG3 и IgG4. Обычно константный домен является связывающим комплемент константным доменом, и в этом случае желательно, чтобы гуманизированное антитело проявляло цитотоксическую активность и относилось бы к классу IgG1. В тех случаях, когда цитотоксическая активность является нежелательной, константный домен может относиться к классу IgG2. Гуманизированное антитело может включать последовательности более чем из одного класса или изотипа, и выбор конкретных константных доменов для оптимизации требуемых эффекторных функций находится на усмотрении специалистов в данной области техники. Необязательно, чтобы каркасные и комплементарно определяемые области гуманизированного антитела точно соответствовали родительским последовательностям, например донорская комплементарно определяемая область или консенсусный каркас могут быть мутагенезированы путем замещений, вставок или делеций как минимум одного остатка таким образом, чтобы комплементарно определяемая область и каркасный остаток на сайте не соответствовали ни консенсусному, ни импортированному домену. Тем не менее, такие мутации не будут являться экстенсивными. Обычно как минимум 75% остатков гуманизированного антитела соответствуют остаткам последовательностей родительской каркасной области и комплементарно определяемой области, более часто 90% и наиболее предпочтительно свыше 95%. Гуманизированное антитело может быть получено с использованием различных технологий, известных в данной области техники, включающих без ограничения прививку комплементарно определяемой области (европейский патентЕР 239400; международная публикацияWO 91/09967 и патенты США 5225539; 5530101 и 5585089), венирование и шлифовку (европейские патентыEP 592106 и ЕР 519596; Padlan, 1991, Molecular Immunology, 28(4/5): 489, 498; Studnicka et al.,1994, Protein Engineering, 7(6): 805-814 и Roguska et al., 1994, PNAS, 91: 969-973), перетасовку цепей (патент США 5565332) и технологии, раскрытые, например, в патентах США 6407213; 5766886;al., Cancer Res. 55(8): 1717-22 (1995); Sandhu J.S., Gene, 150(2): 409-10 (1994) и Pedersen et al., J. Mol. Biol. 235(3): 959-73 (1994). Нередко каркасные остатки в каркасных областях будут замещены соответствующим остатком из донорского антитела комплементарно определяемой области с целью изменения, предпочтительно улучшения связывания антигена. Указанные каркасные замещения определяются с помощью хорошо известных в данной области техники способов, например путем моделирования взаимодействий комплементарно определяемой области и каркасных остатков с целью определения каркасных остатков, являющихся важными для связывания антигена и сравнения последовательностей для определения необычных каркасных остатков в определенных позициях (см., например, Queen et al., патент США 5585089 и Riechmann et al., 1988, Nature, 332:323). Способы получения HIP и его аналогов или производных. Любые технологии, известные в данной области техники, могут быть использованы для очисткиHIP, или его аналога, или производного, включающие без ограничений разделение путем осаждения,разделение путем адсорбции (например, колончатая хроматография, мембранные адсорбенты, центробежные колонки, периодическая адсорбция, жидкостная хроматография высокого разрешения, ионообменная хроматография, неорганические адсорбенты, гидрофобные адсорбенты, аффинная хроматография с иммобилизованным на носителе металлом, аффинная хроматография) либо разделение в растворе (например, гель-фильтрация, электрофорез, разделения жидкой фазы, разделение с помощью ПАВ, экстрак- 29
МПК / Метки
МПК: A61K 38/08, A61P 5/48, A61P 3/10, A61K 38/10
Метки: проостровковые, аналоги, применения, способы, пептиды, человека, производные
Код ссылки
<a href="https://eas.patents.su/30-13821-proostrovkovye-peptidy-cheloveka-ih-proizvodnye-i-analogi-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Проостровковые пептиды человека, их производные и аналоги и способы их применения</a>


































