Терапевтические агенты на основе токсичных пептидов
Номер патента: 13470
Опубликовано: 30.04.2010
Авторы: Миранда Лесли П., Салливан Джон К., Макдоноу Стефан Л., Нгуэн Хунг Кью, Макгиверн Джозеф Дж., Уокер Кеннет В., Хью Шоу-Фен Силвия
Формула / Реферат
1. Состав формулы
![]()
или его мультимеры,
где F1и F2 обозначают фрагменты, продлевающие период полужизни, a d и е, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из d и е обозначает 1;
X1, Х2 и Х3, каждый независимо, обозначают -(L)f-P-(L)g, a f и g, каждый независимо, обозначают 0 или 1;
Р обозначает ShK токсичный пептид или пептидный аналог ShK протяженностью не более примерно 80 аминокислотных остатков, содержащий по меньшей мере две внутрипептидные дисульфидные связи;
L обозначает линкер и
a, b и с, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из a, b и с обозначает 1,
и его фармацевтически приемлемая соль.
2. Состав по п.1 формулы, выбранный из
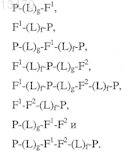
3. Состав по п.1, где F1, или F2, или оба обозначают полиэтиленгликоль, сополимер этиленгликоля, пропиленгликоль, сополимер пропиленгликоля, карбоксиметилцеллюлозу, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этиленгликоля/малеинового ангидрида, полиаминокислоту, декстран н-винилпирролидон, поли-н-винилпирролидон, гомополимер пропиленгликоля, полимер пропиленоксида, полимер этиленоксида, полиоксиэтилированный полиол, поливиниловый спирт, линейную или разветвленную гликозилированную цепь, полиацеталь, длинноцепную жирную кислоту, длинноцепную гидрофобную алифатическую группу, домен Fc иммуноглобулина или его участок, СН2 область домена Fc, петлю домена Fc, альбумин, альбуминсвязывающий белок, транстиретин, тироксинсвязывающий глобулин или лиганд, обладающий сродством к сывороточному белку с продолжительным периодом полужизни, причем указанный лиганд выбирают из группы, состоящей из пептидных лигандов и низкомолекулярных лигандов; или комбинацию любых из этих элементов.
4. Состав по п.1, отличающийся тем, что F1, или F2, или оба представляют собой Fc домен человеческого IgG или его участок.
5. Состав по п.4, отличающийся тем, что Fc домен человеческого IgG представляет собой Fc домен человеческого IgG1.
6. Состав по п.4, отличающийся тем, что Fc домен человеческого IgG представляет собой Fc домен человеческого IgG2.
7. Состав по п.1, отличающийся тем, что F1 или F2 представляют собой различные фрагменты, продлевающие период полужизни.
8. Состав по п.1, отличающийся тем, что F1, или F2, или оба содержат последовательность, выбранную из группы, состоящей из SEQ ID NOS: 2, 4, 70, 71, 72, 74, 75, 76, 1340-1342 и 1359-1363.
9. Состав по п.1, отличающийся тем, что F1, или F2, или оба представляют собой домен белка человеческого сывороточного альбумина или домен белка транстиретина или биологически приемлемый полимер или сополимер.
10. Состав по п.9, отличающийся тем, что биологически приемлемый полимер представляет собой полиэтиленгликоль (ПЭГ) с молекулярной массой от 1 до 100 кДа.
11. Состав по п.10, отличающийся тем, что ПЭГ выбирают из группы, состоящей из ПЭГ с молекулярной массой 5 и 20 кДа.
12. Состав по п.1, отличающийся тем, что формула выбрана из
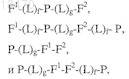
где F1представляет собой Fc домен человеческого IgG или домен белка человеческого сывороточного альбумина и F2 представляет собой ПЭГ, или формула выбрана из
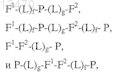
где F2представляет собой Fc домен человеческого IgG или домен белка человеческого сывороточного альбумина и F1 представляет собой ПЭГ.
13. Состав по п.1, дополнительно содержащий одну или более молекул ПЭГ, конъюгированных с не-ПЭГ F1, или с не-ПЭГ F2, или с Р, или с любой комбинацией любого из них.
14. Состав по п.1, в котором токсичный пептид встраивают в петлю Fc домена человеческого IgG1.
15. Состав по п.1, отличающийся тем, что ShK пептид или аналог ShK пептида содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 88-200, 548-561, 884-950 и 1295-1300, представленных в табл. 2.
16. ДНК, кодирующая состав по п.1.
17. Экспрессирующий вектор, содержащий ДНК по п.16.
18. Клетка-хозяин, содержащая экспрессирующий вектор по п.17.
19. Клетка-хозяин по п.18, отличающаяся тем, что она является эукариотической клеткой.
20. Клетка-хозяин по п.18, отличающаяся тем, что клетка является клеткой млекопитающего.
21. Клетка-хозяин по п.18, отличающаяся тем, что она является СНО-клеткой.
22. Клетка-хозяин по п.18, отличающаяся тем, что она является прокариотической клеткой.
23. Клетка-хозяин по п.18, отличающаяся тем, что она является клеткой Е. coli.
24. Состав по п.1, дополнительно содержащий добавочный фармакологически активный ковалентно связанный пептид.
25. Состав по п.1, отличающийся тем, что добавочный пептид связан с F1, или с F2, или с Р.
26. Состав по п.1, дополнительно содержащий пептид, агонистический или антагонистический в отношении активности токсичного пептида, или нацеливающий (таргетирующий) пептид.
27. Состав, включающий аналог ShK токсичного пептида, который содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 88, 89, 92, 148-200, 548-561, 884-949 и 1295-1300, или его фармацевтически приемлемая соль.
28. Фармацевтическая композиция, содержащая состав по любому из пп.1-27 и фармацевтически приемлемый носитель.
29. Применение состава по п.1 или состава, содержащего аналог ShK пептида, содержащего аминокислотную последовательность, выбранную из SEQ ID NO: 88, 89, 92, 148-200, 548-561, 884-949 и 1295-1300, или его фармацевтически приемлемой соли для изготовления состава для предупреждения или подавления рецидива симптома рассеянного склероза.
30. Применение состава по п.1 или состава, содержащего аналог ShK пептида, содержащего аминокислотную последовательность, выбранную из SEQ ID NO: 88, 89, 92, 148-200, 548-561, 884-949 и 1295-1300, или его фармацевтически приемлемой соли для изготовления состава для лечения иммунного нарушения.
31. Состав по п.1, отличающийся тем, что любой f или любой g обозначает 1, a L обозначает пептидный линкер, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 79, 84 и 637-656.
32. Состав по пп.1-27, у которого ShK пептид содержит аминокислотную последовательность SEQ ID NO: 914.
33. Состав по пп.1-27, у которого ShK пептид содержит аминокислотную последовательность SEQ ID NO: 915.
34. Состав по пп.1-27, у которого ShK пептид содержит аминокислотную последовательность SEQ ID NO: 916.
35. Состав по пп.1-27, у которого ShK пептид содержит аминокислотную последовательность SEQ ID NO: 917.
Текст
013470 Область техники Настоящее изобретение относится к области биохимии, в частности к терапевтическим пептидам и конъюгатам. Уровень техники Ионные каналы представляют собой группу молекул, которые содействуют обмену малых неорганических ионов при прохождении через мембраны. Всем клеткам для функционирования требуются ионные каналы, но это особенно справедливо для возбудимых клеток, таких как клетки нервной системы и сердца. Электрические сигналы, управляемые ионньми каналами, контролируют процесс мышления,сердечные сокращения и сокращение мышц. Ионные каналы участвуют в регуляции клеточного объема и контролируют разнообразные процессы передачи сигнала. Семейство ионных каналов включает катионные каналы Na+, K+ и Са 2+ и анионные каналы Cl-. В целом ионные каналы различаются на лигандзависимые (лигандуправляемые) или потенциалзависимые(потенциалуправляемые) каналы. Лигандзависимые каналы включают как внеклеточные, так и внутриклеточные лигандзависимые каналы. Внеклеточные лигандзависимые каналы включают никотиновый ацетилхолиновый рецептор (nAChR), рецепторы серотонина (5-гидрокситриптамин, 5-НТ), рецепторы глицина и -аминомасляной кислоты (GABA, ГАМК) и активируемые глутаматом каналы, включаяkanate, -амино-3-гидрокси-5-метил-4-изоксазолпропионовые рецепторы (AMPA) и N-метил-Dаспартатные (NMDA) рецепторы. (Harte and Ouzounis (2002), FEBS Lett. 514: 129-34). Внеклеточные лигандзависимые каналы включают каналы, активируемые циклическими нуклеотидами (например, cAMP,cGMP), Са 2+ и G-белками. (Harte and Ouzounis (2002), FEBS Lett. 514: 129-34). Потенциалзависимые ионные каналы классифицируют по их селективности по отношению к неорганическим ионам, включая натриевые, калиевые, кальциевые и хлорионные каналы (Harte and Ouzounis (2002), FEBS Lett. 514: 129-34). Недавно была представлена унифицированная номенклатура для классификации потенциалзависимые каналов (Catterall et al. (2000), Pharmacol. Rev. 55: 573-4; Gutman et al. (2000), Pharmacol. Rev. 55, 5836; Catterall et al. (2000), Pharmacol. Rev. 55: 579-81; Catterall et al. (2000), Pharmacol. Rev. 55: 575-8; Hofmann et al. (2000), Pharmacol. Rev. 55: 587-9; Clapham et al. (2000), Pharmacol Rev. 55: 591-6; ChandyK+ каналы составляют самое большое и лучше всего охарактеризованное семейство ионных каналов, описанное до настоящего времени. Калиевые каналы подразделяются на три основные группы: 6 трансмембранных (6 ТМ) K+ каналов, 2 ТМ-2TM/leak (проницаемые) K+ каналы и 2TM/Kir каналы, пропускающие ионы внутрь клетки (Tang et al. (2004), Ann. Rev. Physiol. 66, 131-159). Эти три группы подразделяются далее на семейства на основании подобия последовательностей. Потенциалзависимые K+ каналы, включая (Kv1-6, Kv8-9), EAG, KQT и Slo (ВКСа), являются членами семейства 6 ТМ группы. Группа 2 ТМ-2 ТМ включает TWIK, TREK, TASK, TRAAK и THIK, тогда как группа 2TM/Kir состоит из КМ-7. Два дополнительных класса ионных каналов включают калиевые каналы, пропускающие ионы внутрь клетки (IRK, аномально выпрямляющие), и АТР-зависимые пуринергические (Р 2 Х) каналы.(Harte and Ouzounis (2002), FEBS Lett. 514: 129-34). Токсичные пептиды, продуцируемые различными организмами, выделяются в намеченные (целевые) ионные каналы. Змеи, скорпионы, пауки, пчелы, улитки и актинии представляют собой немногие примеры организмов, которые вырабатывают яд, который может служить в виде источника, богатого малыми биоактивными токсичными пептидами, или "токсинами", которые активно и селективно нацелены на ионные каналы и рецепторы. В большинстве случаев эти токсичные пептиды проявляют себя как мощные антагонисты или ингибиторы ионных каналов, связываясь с порой канала и физически блокируя путь ионной проводимости. В некоторых других случаях, как в случае пептидов токсина тарантула, найдено, что пептид противодействует функции канала, связываясь с областью вне поры (например, с сенсорным доменом потенциалзависимого канала). Токсичные пептиды обычно расположены, примерно, между 20 и 80 аминокислотами в длину, содержат 2-5 дисульфидных связей и образуют очень компактную структуру (см., например, фиг. 10). Токсичные пептиды (например, яда скорпионов, актиний и улиток с колпачковидной раковиной) были выделены и охарактеризованы по их воздействию на ионные каналы. Очевидно, такие пептиды выделяются из относительно малого числа структурных скелетов (остовов), которые особенно подходят для решения важных вопросов активности (эффективности) и стабильности. Большинство токсичных пептидов токсинов скорпиона и улиток с колпачковидной раковиной (Conus) содержат, например, 10-40 аминокислот и до пяти дисульфидных связей, образующих чрезвычайно компактную и напряженную структуру (микропротеины), часто устойчивые к протеолизу. Пептиды конотоксина и токсинов скорпиона можно разделить на ряд суперсемейств на основании их дисульфидных связей и пептидных складок. Разрешение структуры многих из них сделано методом ЯМР-спектроскопии, этот метод иллюстрирует их компактную структуру и подтверждает сохранение их "семейной" складки (например, Tudor et al., Ionisation behaviour and solution properties of the potassium-channel blocker ShK toxin, Eur. J. Biochem. 251(1-2): 133-41sequence but with alpha-like physiological activity, Eur. J. Biochem. 271(12): 2504-16 (2004); ProchnickaChalufour et al., Solution structure of discrepin, a new K+-channel blocking peptide from the alpha- KTxl5 subfamily, Biochem. 45(6): 1795-1804 (2006. Консервативные дисульфидные структуры могут также отражать индивидуальную фармакологическую активность семейства токсинов (Nicke et al. (2004), Eur. J. Biochem. 271: 2305-19, табл. 1; Adams(1999), Drug Develop. Res. 46: 219-34). Например, -конотоксины имеют отчетливые структуры: четыре остатка цистеина/две петли, образуемые дисульфидными связями (Loughnan, 2004), ингибируют никотиновые ацетилхолиновые рецепторы. Напротив, -конотоксины имеют консенсусные структуры: шесть остатков цистеина/три петли, образуемые дисульфидными связями (Nielsen, 2000), блокируют кальциевые каналы. На фиг. 9 показано, что ограниченное число консервативных дисульфидных структур, являющееся общим для разнообразных ядовитых животных от пчелы до улитки и от скорпиона до змеи,нацелено на ионные каналы. На фиг. 7 А-В показано выравнивание альфа-токсина семейства скорпионов и демонстрируется, что консервативный структурный остов (скелет, каркас) используется для образования токсинов, нацеленных на множество калиевых каналов. Благодаря своей эффективной и селективной блокаде специфических ионных каналов токсичные пептиды в течение многих лет использовались в качестве инструмента для исследования фармакологии ионных каналов. Ионные каналы клеток и тканей, отличных от возбудимых клеток и тканей, таких как клетки сердца, мышц и мозга, также важны для невозбудимых клеток, таких как иммунные клетки. Поэтому рассматривалась возможная терапевтическая полезность токсичных пептидов для лечения различных иммунных заболеваний, в частности, с помощью ингибирования калиевых каналов, таких как Kv1.3 и IKCa1, так как эти каналы опосредованно регулируют путь передачи сигнала кальция в лимфоцитах(2006); Mouhat et al., OsK1 derivatives, Международная заявка на патент WO 2006/002850 А 2; B.S. Jensenof Venom Peptides, Nat. Rev. Drug Discov. 2: 790-802 (2003)]. Были также созданы низкомолекулярные ингибиторы калиевых каналов Kv1.3 и IKCa1 и входа кальция в основной кальциевый канал в Т клетках, CRAC, для лечения иммунных нарушений [A. SchmitzBiol. Chem. 276, 32040; С Zitt et al. (2004) J. Biol. Chem. 279, 12427], но затруднительно получить малые молекулы с селективностью к некоторым из этих мишеней. Известно, что мобилизация кальция в лимфоцитах является важным метаболическим путем при активации воспалительных реакций [M.W. Winslow et al. (2003) Current Opinion Immunol. 15, 299]. По сравнению с другими клетками Т клетки проявляют уникальную чувствительность к повышенным уровням внутриклеточного кальция, и ионные каналы, как непосредственно, так и опосредованно, контролируют этот процесс. Инозиттрифосфат (IP3) представляет собой природный вторичный мессенджер, который активирует пути передачи кальциевого сигнала. IP3 продуцируется после лиганд-индуцированной активации Т клеточного рецептора (TCR) и при связывании со своим внеклеточным рецептором (канал) вызывает разгрузку запасов внутриклеточного кальция. Эндоплазматический ретикулум обеспечивает один важнейший запас кальция. Тапсигаргин, ингибитор кальций-АТРазы саркоплазматическогоэндоплазматического ретикулума (SERCA) также вызывает разгрузку внутриклеточных запасов и активацию пути передачи кальциевого сигнала в лимфоцитах. Следовательно, тапсигаргин можно использовать в качестве специфического раздражителя пути передачи кальциевого сигнала в Т клетках. Известно,что разгрузка (выгрузка) запасов внутриклеточного кальция в Т клетках вызывает активацию кальциевого канала на клеточной поверхности, что способствует поступлению кальция извне клетки. Этот управляемый запасом кальция кальциевый канал (SOCC) на Т клетках называется "CRAC" (канал, активируемый высвобождением кальция), и известно, что пролонгированное поступление (инфлюкс, вброс) кальция через этот канал является важным для полной активации Т клеток [S. Feske et al. (2005) J. Exp. Med. 202, 651 и N. Venkatesh et al. (2004) PNAS 101, 8969]. В течение многих лет полагали, что для того, чтобы поддерживать непрерывное поступление (инфлюкс) кальция в Т клетки, клеточная мембрана должна-2 013470 оставаться в гиперполяризованном состоянии за счет эффлюкса (истечения) ионов калия. В Т клетках эффлюкс калия осуществляется через потенциалзависимый калиевый канал Kv1.3 and the calciumactivated potassium channel IKCa1 [K.G. Chandy et al. (2004), TIPS 25, 280]. Таким образом, эти калиевые каналы опосредованно контролируют путь передачи кальциевого сигнала, способствуя необходимому эффлюксу калия, который содействует непрерывному инфлюксу (поступлению) кальция через CRAC. Постоянное увеличение внутриклеточного кальция активирует различные пути в Т клетках, включая те, которые приводят к активации NFAT, NF-kB и АР-1 [Quintana-A (2005) Pflugers Arch. - Eur. J.Physiol. 450, 1]. Эти события приводят к различным Т клеточным ответам, включая изменение размера клетки и организацию мембраны, активацию эффекторных молекул клеточной поверхности, продуцирование и пролиферацию цитокинов. Некоторые молекулы, воспринимающие кальций, передают кальциевый сигнал и управляют клеточным ответом. Кальмодулин представляет собой одно из соединений, которое связывает кальций, но идентифицировано много других соединений (M.J. Berridge et al. (2003), Nat.Rev. Mol. Cell. Biol. 4, 517). Кальций-кальмодулинзависимая кальциневрин-фосфатаза активируется при непрерывном увеличении внутриклеточного кальция и дефосфорилирует NFAT в цитозоле. Дефосфорилированный NFAT быстро транслоцируется в ядро и широко применяется как важнейший фактор транскрипции для активации Т клеток (F. Macian (2005), Nat. Rev. Immunol. 5, 472 и N. Venkatesh et al. (2004),PNAS 101, 8969). Ингибиторы кальциневрина, такие как циклоспорин А (Неорал, Сандиммун) и FK506(Такролимус) являются основными средствами для лечения тяжелых иммунных нарушений, таких, которые вызывают отторжение после трансплантации плотного органа (I.M. Gonzalez-Pinto et al. (2005),Transplant. Proc. 37, 1713 и D.R.J. Kuypers (2005) Transplant International 18, 140). Неорал одобрен для лечения отторжения трансплантата, тяжелого ревматоидного артрита (D.E. Yocum et al. (2000), Rheumatol. 39, 156) и тяжелого псориаза (J. Koo (1998) British J. Dermatol. 139, 88). Недавно полученные преклинические и клинические данные наводят на мысль, что ингибиторы кальциневрина могут найти применение при лечении воспалительного кишечного заболевания (IBD; Baumgart DC (2006) Am. J. Gastroenterol.(2000), J. Clin. Pharmacol. 40, 1211). Волчанка является другим нарушением, при котором могут помочь агенты, блокирующие активацию хелперных Т клеток. Несмотря на важную роль кальциневрина в регуляции NFAT в Т клетках, кальциневрин также экспрессируется в других тканях (например, в почке), а циклоспорин А и FK506 имеет узкую границу безопасности вследствие механизма основной токтичности. Почечная токсичность и гипертензия являются обычными побочными эффектами, которые ограничивают перспетивы применения циклоспорина и FK506. Вследствие токсичности ингибиторы кальциневрина применяются, главным образом, только для лечения тяжелого иммунного заболевания (Bissonnette-R et al. (2006), J. Am. Acad. Dermatol. 54, 472). Ингибиторы Kv1.3 представляют собой более безопасную альтернативу ингибиторам кальциневрина для лечения иммунных заболеваний. Это объясняется тем, что Kv1.3 также действует, контролируя путь передачи кальциевого сигнала в Т клетках, но осуществляет это по другому механизму, нежели ингибиторы кальциневрина, а данные по экспрессии и функции Kv1.3 показывают, что Kv1.3 играет более ограниченную роль в биологии Т клеток по сравнению с кальциневрином, который функционирует также в различных нелимфоидных клетках и тканях. Мобилизация кальция в иммунных клетках также активирует продуцирование в цитокинах интерлейкина 2 (IL-2) и интерферона гамма (IFNg), которые являются важнейшими медиаторами воспаления.IL-2 индуцирует различные биологические реакции от размножения и дифференцировки CD4+ и CD8+ T клеток до активации пролиферации и секреции антитела В клетками, до активации NK клеток [S.L. GaffenK.D. Liu (2004) Cytokine 28, 109]. Секреция IL-2 происходит вскоре после активации Т клеток, а Т клетки являются главным источником этого цитокина. Вскоре после активации высокоаффинный IL-2 рецептор (IL2-R) активируется (позитивно модулируется) на Т клетках, наделяя их способностью пролиферировать в ответ на IL-2. Т клетки, NK клетки, В клетки и профессиональные антигенпрезентирующие клетки (АРС), все, могут секретировать IFNg при активации. Т клетки являются главным источником продукции IFNg при опосредовании специфического (адаптивного) иммунного ответа,тогда как натуральные киллерные (NK) клетки и АРС, по-видимому, являются важным источником в период защиты хозяина от инфекции [K. Schroder et al. (2004), J. Leukoc. Biol. 75, 163]. IFNg, первоначально названный макрофаг-активирующим фактором, позитивно регулирует (активирует) процессирование антигенов и презентирование их моноцитами, макрофагами и дендритными клетками. IFNg опосредует различные биологические активности во многих типах клеток [U. Boehm et al. (1997) Annu. Rev.Immunol. 15, 749], включая рост и дифференцировку, усиление активности NK клеток и регуляцию продукции и переключение класса иммуноглобулинов в В клетках.CD40L представляет собой другой цитокин, экспрессируемый на Т клетках, и после мобилизации кальция при связывании со своим рецептором на В клетках он обеспечивает важный хелперный сигнал,способствующий образованию В клеток в терминальном центре, дифференцировке В клеток и переключению изотипа антитела. Опосредуемая CD40L активация CD40 на В клетках может индуцировать полную дифференцировку и клональную экспансию В клеток, продуцирующих иммуноглобулин (Ig) [S. Quezada et al. (2004) Annu. Rev. Immunol. 22, 307]. Рецептор CD40 можно также обнаружить в дендритных клетках, а передача сигнала CD40L может также опосредовать активацию и дифференцировку дендрит-3 013470 ных клеток. Антиген-презентирующая способность В клеток и дендритных клеток промотируется CD40L связыванием, это также показывает заметную роль, которую играет этот цитокин в адаптивном иммунитете. Учитывая существенную роль CD40 передачи сигнала в биологии В клетки, CD40L изучали в преклинических и клинических исследованиях с целью применения при лечении системной красной волчанки (SLE) - нарушение, характеризующееся отложением комплексов антител в тканях, воспалением и поражением органов [J. Yazdany and J Davis (2004) Lupus 13, 377]. Продуцирование токсичных пептидов является сложным процессом в ядовитых организмах и еще более сложным синтетическим процессом. Вследствие наличия консервативных дисульфидных структур и необходимости в эффективном окислительном рефолдинге токсичные пептиды представляют сложную задачу для синтеза. Хотя токсичные пептиды годами использовались в качестве высокоселективных фармакологических ингибиторов ионных каналов, высокая стоимость синтеза и рефолдинга токсичных пептидов и их короткий период полужизни in vivo затрудняли применение этих пептидов в качестве терапевтических средств. Значительно больше усилий затрачено для того, чтобы идентифицировать низкомолекулярные ингибиторы в качестве терапевтических антагонистов ионных каналов, чем на сами токсичные пептиды. Одним исключением является одобренный недавно для лечения непроходящей боли малый пептид -конотоксина MVIIA (Зиконотид). Однако способ синтеза и рефолдинга Зикотинида дорог и дает малый пептидный продукт с очень коротким периодом полужизни in vivo (около 4 ч). Экономически эффективный способ получения терапевтических средств, таких как, но без ограничения, ингибиторы ионных каналов, является нерешенной задачей, которая решается настоящим изобретением, включающим токсичные пептиды, слитые или иным образом ковалентно конъюгированные с носителем. Сущность изобретения Настоящее изобретение относится к составу формулыF1 и F2 обозначают фрагменты, продлевающие период полужизни, a d и е, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из d и е обозначает 1;X1, X2 и X3, каждый независимо, обозначают -(L)f-P-(L)g-, и f и g, каждый независимо, обозначают 0 или 1; Р обозначает токсичный пептид протяженностью не более примерно 80 аминокислотных остатков,содержащий по меньшей мере две внутрипептидные дисульфидные связи;L обозначает необязательный линкер (присутствует, когда f=1 и/или g=1); и а, b и с, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из a, b и с обозначает 1. Таким образом, настоящее изобретение относится к соединениям, имеющим формулы, являющиеся вариантами формулы I, такими как формулы(IX) P-(L)g-F1-F2-(L)f-P (т.е. b равно 0); или к любым мультимерам любого из них, традиционно стоящим N-концом пептида (пептидов) слева. Все такие соединения формул II-IX охватываются структурной формулой I. Формула I обозначает,что если присутствует более одного токсического пептида (Р), эти токсичные пептиды, присутствующие в композиции по изобретению, могут быть одинаковыми или отличными друг от друга токсичными пептидами, а линкерная частица L)f и/или (L)g), если она присутствует, может быть независимо такой же,как любой другой линкер или как любые другие линкеры, который(е) может(могут) присутствовать в композиции по изобретению. Конъюгация токсичного(токсичных) пептида(пептидов) с фрагментом или с фрагментами, продлевающим(и) период полужизни, может происходить по N-концу и/или С-концу токсичного пептида или может происходить в виде включения в основную аминокислотную последовательность, причем F1 связывается ближе к N-концу токсичного пептида, чем F2. Примеры подходящих фрагментов, продлевающих период полужизни (F1 или F2), включают Fc домен иммуноглобулина, человеческий сывороточный альбумин (HSA) или полиэтиленгликоль (ПЭГ, PEG). Эти и другие фрагменты(частицы) по данному описанию, продлевающие период полужизни, применяются либо отдельно, либо в комбинации. Настоящее изобретение относится также к составу, который включает конъюгированный или неконъюгированный токсичный пептидный аналог ShK, OSK1, ChTx или мауротоксина (maurotoxin)(MTX), модифицированный по одному или более аминокислотных остатков по сравнению с нативными последовательностями, обладающий более высокой антагонистической активностью и/или целевой селективностью в отношении Kv1.3 или IKCa1 по сравнению с пептидами ShK, OSK1 или мауротоксина(МТХ), имеющими нативную последовательность. Токсичные пептидные аналоги содержат любую аминокислотную последовательность, выбранную из последовательностей, приведенных ниже:SEQ ID NO: 36, 59, 344-346 или 1369-1390, представленные в табл. 14. Настоящее изобретение также относится к другим токсичным пептидным аналогам, которые содержат любую аминокислотную последовательность, выбранную из последовательностей, приведенных ниже:SEQ ID NO: 507-518, представленные в табл. 30. Настоящее изобретение относится также к фармацевтической композиции, которая включает состав по изобретению и фармацевтически приемлемый носитель. Составы по настоящему изобретению можно получать традиционными синтетическими методами,методами рекомбинантной ДНК или любыми другими методами получения пептидов и слитых белков,общеизвестными в уровне техники. Составы по данному изобретению, которые содержат непептидные участки, можно синтезировать традиционными методами органической химии помимо традиционных методов пептидной химии, если они применимы. Основное рассматриваемое применение представляет собой применение в виде терапевтических и/или профилактических агентов. Составы по изобретению, включающие токсичный пептид, могут обладать активностью и/или целевой селективностью в отношении ионного канала, сравнимой с активностью и/или целевой селективностью неконъюгированного пептида, или даже превышающей ее. Соответственно, настоящее изобретение включает способ лечения аутоиммунного нарушения, который включает введение пациенту, у которого диагностировано аутоиммунное нарушение, такое как рассеянный склероз, типа 1 диабет, воспалительное заболевание кишечника, контактный дерматит, ревматоидный артрит, псориатический артрит, астма, аллергия, рестеноз, системный склероз, фиброз, склеродермия, гломерулонефрит, синдром Шегрена, воспалительная резорбция кости, отторжение трансплантата, болезнь трансплантат-против-хозяина или волчанка, терапевтически эффективного состава по изобретению (предпочтительно содержащего Kv1.3 антагонистический пептид или IKCa1 антагонистический пептид), при этом у пациента частично снимается по меньшей мере один симптом заболевания. Кроме того, настоящее изобретение относится к способу предупреждения или подавления рецидива симптома рассеянного склероза, причем этот способ включает введение пациенту, у которого ранее был по меньшей мере один симптом рассеянного склероза, профилактически эффективное количество состава по изобретению (предпочтительно содержащего Kv1.3 антагонистический пептид или IKCa1 антагонистический пептид), так что предупреждается или подавляется рецидив по меньшей мере одного симптома рассеянного склероза. Хотя составы по данному изобретению в основном рассматриваются как терапевтические агенты,они могут также применяться при скрининге на терапевтические или диагностические агенты. Например,-5 013470Fc. Фрагмент, продлевающий период полужизни, такой как Fc, может превратить нерастворимые пептиды в растворимые и, следовательно, применимые в ряде анализов. Многочисленные дополнительные аспекты и преимущества настоящего изобретения станут очевидными при рассмотрении фигур и подробного описания изобретения. Краткое описание фигур На фиг. 1 схематически показаны структуры некоторых типичных Fc димеров, которые могут быть получены из IgG1 антитела. "Fc" на фигуре обозначает любой из Fc вариантов, входящих в значение термина "Fc домен" по данному описанию. "X1" и "Х 2" представляют собой пептиды или линкерпептидные комбинации по определению, приведенному ниже в данном описании. Далее приводятся конкретные димеры: фиг. 1 А и 1D: димеры с одной дисульфидной связью; фиг. 1 В и 1E: димеры с двумя дисульфидными связями; фиг. 1 С и 1F: димеры с нековалентной связью. На фиг. 2 схематически показаны структуры некоторых вариантов состава по изобретению, которые изображают единичный элемент фармакологически активного токсичного пептида. На фиг. 2 А изображена одноцепочечная молекула, фиг. 2 А также может изображать конструкцию ДНК молекулы (соединения). На фиг. 2 С показан димер с пептидным участком на обеих цепях. Димер, показанный на фиг. 2 С, образуется спонтанно в некоторых клетках-хозяевах при экспрессии конструкции ДНК, кодирующей единичную цепь, показанную на фиг. 2 А. В случае других клеток-хозяев клетки можно поместить в условия, благоприятствующие образованию димеров, или димеры могут образовываться in vitro. На фиг. 3 А-В показаны типичные нуклеотидная и аминокислотная последовательности (SEQ IDNO: 1 и 2 соответственно) человеческого IgG1 Fc, которые оптимизированы для экспрессии в клетках млекопитающих и могут применяться в данном изобретении. На фиг. 4 А-В показаны типичные нуклеотидная и аминокислотная последовательности (SEQ IDNO: 3 и 4 соответственно) человеческого IgG1 Fc, которые оптимизированы для экспрессии в бактериальных клетках и могут применяться в данном изобретении. На фиг. 5 А показана аминокислотная последовательность зрелого ShK пептида (SEQ ID NO: 5), который может кодироваться нуклеотидной последовательностью, содержащей кодоны, оптимизированные для экспрессии в клетках млекопитающих, бактериальных клетках и клетках дрожжей. На фиг. 5 В показаны три дисульфидные связи (S-S), образованные шестью цистеиновыми остатками в ShK пептиде (SEQ ID NO: 10). На фиг. 6 показано выравнивание ингибитора потенциалзависимого калиевого канала Stichodactylahelianthus (ShK) с последовательностями других близкородственных членов семейства токсинов актиний. Показано выравнивание последовательности зрелого ShK токсина из 35 аминокислот (регистрационный номер Р 29187), выделенной из яда Stichodactyla helianthus, с последовательностями других близкородственных членов семейства токсинов актиний. Показаны консенсусная последовательность и прогнозируемые дисульфидные связи, высококонсервативные остатки закрашены. Показанная последовательность HmK пептидного токсина (Swiss-Protein регистрационный 097436) является последовательностью незрелого предшественника из актинии великолепной (Radianthus magnifica; Heteractis magnifica), a предполагаемый сигнальный пептид подчеркнут. Прогнозируется, что зрелый HmK пептидный токсин должен иметь протяженность 35 аминокислот и охватывать остатки от 40 по 74. AeK является зрелым пептидным токсином, выделенным из яда актинии Actinia equine (Актиния лошадиная, регистрационныйР 81897). Также показаны последовательности зрелого пептидного токсина AsKS (регистрационныйQ9TWG1) и BgK (регистрационныйP29186), выделенные из Anemonia sulcata и Bunodosoma granulifera соответственно. На фиг. 6 А показано выравнивание аминокислотной последовательности (SEQ IDNO: 10) ShK с последовательностями других членов токсинов семейства актиний, HmK (SEQ ID NO: 6(SEQ ID NO: 8) и BgK (SEQ ID NO: 9). Показаны прогнозируемые дисульфидные связи, а консервативные остатки выделены. (HmK, SEQ ID NO: 543; ShK, SEQ ID NO: 10; AeK, SEQ ID NO: 544; AsKS, SEQID NO: 545). На фиг. 6 В показано картирование дисульфидного связывания для этого семейства, содержащего 3 дисульфидные связи (С 1-С 6, С 2-С 4, С 3-С 5). На фиг. 7 А-В показано выравнивание аминокислотной последовательности альфа-токсинов семейства скорпионов, ингибиторов калиевых каналов. (BmKK1, SEQ ID NO: 11; BmKK4, SEQ ID NO: 12;NO:55; CoTx2, SEQ ID NO: 871; BmPo5, SEQ ID NO: 60; ScyTx, SEQ ID NO: 51; P05, SEQ ID NO: 52; тамапин (Tamapin), SEQ ID NO: 53 и TmTx, SEQ ID NO: 691. Высококонсервативные остатки заштрихованы, а консенсусная последовательность дана в списке. Подсемейства -КТх перечислены и взяты из Rodriguez de la Vega, R.C. et al. (2003) TIPS 24: 222-227. Перечень некоторых ионных каналов, известных как вызывающие антагонизм, приводится (IK=IKCa, BK=BKCa, SK=SKCa, Kv=потенциалзависимые К+ каналы). Хотя большинство членов семейства в этом выравнивании являются зрелыми пептидами, некоторые из них представляют собой незрелые или модифицированные формы пептида, они включаютBmKK1, BmKK4, BmKK6, BmKTX, MartenTx, ChTx, ChTx-Lq2, BmTx1, AaTx1, BmTX3, TsK, CoTx1,BmP05. На фиг. 8 показано выравнивание токсичных пептидов, превращенных в пептидные антитела (peptibody, peptide antibody) (Апамин, SEQ ID NO: 68; HaTx1, SEQ ID NO: 494; ProTx1, SEQ ID NO: 56; PaTx2,SEQ ID NO: 57; ShK[2-35], SEQ ID NO: 92; ShK[1-35], SEQ ID NO: 5; HmK, SEQ ID NO: 6; ChTx (K32E),SEQ ID NO: 59; ChTx, SEQ ID NO: 36; IbTx, SEQ ID NO: 38; OSK1 (E16K, K20D), SEQ ID NO: 296;ID NO: 62; BeKm1, SEQ ID NO: 63; ScyTx, SEQ ID NO: 51; GVIA, SEQ ID NO: 64; MVIIa, SEQ ID NO: 65; Ptu1, SEQ ID NO: 66; и СТХ, SEQ ID NO: 67). Указаны оригинальные источники токсинов, так же как число цистеинов в каждом. Перечислены важнейшие нацеленные ионные каналы. Выравнивание показывает разделение токсичных пептидов на группы в зависимости от их источника и воздействия на целевой ионный канал. На фиг. 9 показано распределение дисульфидных групп в семействе токсинов. Указано число дисульфидных групп и порядок дисульфидных связей для каждого подсемейства. Представлен частичный перечень токсинов, которые подпадают под каждую категорию дисульфидного связывания. На фиг. 10 показано, что разрешенные структуры токсинов выявляют компактную структуру. Разрешенные структуры нативных токсинов актинии (ShK), скорпиона (MgTx, MTX, HsTx1), морской улитки с конусообразной раковиной (wGVIA) и тарантула (HaTx1) показывают, что все пептиды из 28-39 аминокислот образуют компактную структуру. Указанные токсины содержат 3 или 4 дисульфидных связи и подпадают под 4 из 6 подсемейств, показанных на фиг. 9. Решенные (разрешенные) структуры нативных токсинов актинии (ShK), скорпиона (MgTx, MTX, HsTx1), морской улитки с конусообразной раковиной (wGVIA) и тарантула (HaTx1) взяты из Банка Данных о Белках (Protein Data Bank, PDB), регистрационные 1ROO (mmdbId: 5247), 1MTX (mmdbId: 4064), 1TXM (mmdbId: 6201), 1QUZ (mmdbId: 36904), 1OMZ (mmdbId: 1816) и 1D1H (mmdbId: 14344) с помощью базы данных трехмерных структурMMDB Entrez 3D-structure [J. Chen et al. (2003) Nucleic Acids Res. 31, 474] и визуализатора. На фиг. 11 А-С показаны нуклеотидные (SEQ ID NO: 69 и SEQ ID NO: 1358) и кодированные аминокислотные (SEQ ID NO: 70, SEQ ID NO: 1359 и SEQ ID NO: 1360) последовательности остатков 51316660 pAMG21ampR-Fc-pep. В последовательностях Fc домена (SEQ ID NO: 71 и 72) исключены пять Сконцевых глициновых остатков. Этот вектор позволяет продуцировать пептидные антитела, в которых пептид-линкерный участок находится на С-конце Fc домена. На фиг. 11D показана круговая диаграмма вектора для бактериальной экспрессии пептидного антитела pAMG21ampR-Fc-pep, содержащего ген хлорамфениколацетилтрансферазы (cat; "CmR" сайт), который заменяется на пептид-линкерную последовательность. На фиг. 12 А-С показаны нуклеотидные (SEQ ID NO: 73 и SEQ ID NO: 1361) и кодированные аминокислотные (SEQ ID NO: 74, SEQ ID NO: 1362 и SEQ ID NO: 1363) последовательности остатков 51316319 pAMG21ampR-Pep-Fc. В последовательностях Fc домена (SEQ ID NO: 75 и 76) исключены пять Nконцевых глициновых остатков. Этот вектор позволяет продуцировать пептидные антитела, в которых пептид-линкерный участок находится на N-конце Fc домена. На фиг. 12D показана круговая диаграмма вектора для бактериальной экспрессии пептидного антитела, в котором сайт устойчивости к зеоцину (ble; "ZeoR") заменяется на пептид-линкерную последовательность. На фиг. 12E-G показана нуклеотидная (SEQ ID NO: 1339) и кодированные аминокислотные последовательности pAMG21ampR-Pep-Fc (SEQ ID NO: 1340, SEQ ID NO: 1341 и SEQ ID NO: 1342). В последовательностях Fc домена (SEQ ID NO: 75 и 76) исключены пять N-концевых глициновых остатков. Этот вектор позволяет продуцировать пептидные антитела, в которых пептид-линкерный участок находится на N-конце Fc домена. На фиг. 13 А изображена круговая диаграмма вектора для экспрессии в клетках млекопитающихpCDNA3.1 (+) CMVi. На фиг. 13 В изображена круговая диаграмма вектора экспрессии в клетках млекопитающихpCDNA3.1(+)CMVi-Fc-2xG4S-Activin RIIb, который содержит Fc область человеческого IgG1, линкер из 10 аминокислот и активин RIIb ген. На фиг. 13 С изображена круговая диаграмма СНО экспрессирующего вектора pDSRa22, содержащего кодирующую последовательность Fc-L10-ShK[2-35].-7 013470 На фиг. 14 А-В показаны нуклеотидная и кодированная аминокислотная последовательности (SEQID NO: 77 и 78 соответственно) молекулы соединения, идентифицированного ниже, в примере 1, как "FcL10-ShK[l-35]". Аминокислотная последовательность линкера L10 (SEQ ID NO: 79) подчеркнута. На фиг. 15 А-В показаны нуклеотидная и кодированная аминокислотная последовательности (SEQID NO: 80 и 81 соответственно) молекулы соединения, идентифицированного ниже, в примере 2, как "FcL10-ShK[2-35]". Та же самая аминокислотная последовательность линкера L10 (SEQ ID NO: 79), которая используется в Fc-L10-ShK[l-35] (фиг. 14 А-В), подчеркнута. На фиг. 16 А-В показаны нуклеотидная и кодированная аминокислотная последовательности (SEQID NO: 82 и 83 соответственно) молекулы соединения, идентифицированного ниже, в примере 2 как "FcL25-ShK[2-35]". Аминокислотная последовательность линкера L25 (SEQ ID NO: 84) подчеркнута. На фиг. 17 дана схема N-концевого пэгилирования ShK пептида (SEQ ID NO: 5 и SEQ ID NO: 10) восстановительным аминированием, описанным также далее, в примере 32. На фиг. 18 дана схема N-концевого пэгилирования; ShK пептида (SEQ ID NO: 5 и SEQ ID NO: 10) через образование амида, описанная также далее, в примере 34. На фиг. 19 дана схема N-концевого пэгилирования ShK пептида (SEQ ID NO: 5 и SEQ ID NO: 10) хемоселективным методом через оксимирование, описанное также далее, в примере 33. На фиг. 20 А показаны результаты обращенно-фазовой ВЭЖХ при 214 нм, а на фиг. 20 В показаны результаты масс-спектрометрии с электрораспылением ShK[2-35], также описанного как складчатый(скрученный) " Des-Arg1-ShK" (пептид 2). На фиг. 21 показаны результаты обращенно-фазовой ВЭЖХ при 214 нм пэгилированного по Nконцу ShK[2-35], также называемого как пэгилированный по N-концу " Des-Arg1-ShK". На фиг. 22 А показаны результаты обращенно-фазовой ВЭЖХ при 214 нм скрученного ShK[1-35],также называемого "ShK". На фиг. 22 В показаны результаты масс-спектрометрии с электрораспылением ShK[1-35], также называемого "ShK". На фиг. 23 иллюстрируется схема N-концевого пэгилирования ShK[2-35] (SEQ ID NO: 92 и SEQ IDNO: 58, также называемого "Des-Arg1-ShK" или "ShK d1") восстановительным аминированием, описанным также далее, в примере 31. На фиг. 24 А показан вестерн-блоттинг кондиционированной среды HEK 293 клеток, транзиторно трансфецированных с помощью Fc-L10-ShK[l-35]. Дорожка 1: маркеры молекулярной массы; дорожка 2: 15 мкл Fc-L10-ShK; дорожка 3: 10 мкл Fc-L10-ShK; дорожка 4: 5 мкл Fc-L10-ShK; дорожка 5; маркеры молекулярной массы; дорожка 6: контроль; дорожка 7: 15 мкл нет ДНК контроля; дорожка 8: 10 мкл нет ДНК контроля; дорожка 9: 5 мкл нет ДНК контроля; дорожка 10; маркеры молекулярной массы. На фиг. 24 В показан вестерн-блоттинг кондиционированной среды клонов клеток яичников китайского хомячка (СНО), стабильно трансфецированных с помощью Fc-L-ShK[1-35]. Дорожки 1-15 нагружают следующим образом: контроль, ВВ 6, маркеры молекулярной массы, ВВ 5, ВВ 4, ВВ 3, ВВ 2, ВВ 1,контроль, BD6, BD5, маркеры молекулярной массы, BD4, BD3, BD2. На фиг. 25 А показан вестерн-блоттинг невосстановленного SDS-PAGE геля, содержащего кондиционированную среду 293 Т клеток, транзиторно трансфецированных при использовании Fc-L-SmIIIA. На фиг. 25 В показан вестерн-блоттинг восстановленного SDS-PAGE геля, содержащего кондиционированную среду 293 Т клеток, транзиторно трансфецированных при использовании Fc-L-SmIIIA. На фиг. 26 А показано спектральное сканирование 10 мкл очищенного Fc-L10-ShK[1-35] продукта при использовании стабильно трансфецированных СНО клеток, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 26 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного Fc-L10-ShK[l-35] продукта. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12, 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 26 С показаны результаты эксклюзионной хроматографии 20 мкг конечного Fc-L10-ShK[l351 продукта, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 26D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-ShK[1-35] на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером: (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 27 А показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного очищенного Fc-L10-ShK[2-35] продукта стабильно трансфецированных СНО клеток. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12, 0,5 мкг не-8 013470 восстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12, 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль и 10 мкг восстановленного продукта. На фиг. 27 В показаны результаты эксклюзионной хроматографии 50 мкг очищенного Fc-L10ShK[2-35], вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМNaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 27 С показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGEFc-L5-ShK[2-35], очищенного от стабильно трансфецированных СНО клеток. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12, 0,5 мкг восстановленного продукта, контроль,2,0 мкг восстановленного продукта, контроль и 10 мкг восстановленного продукта. На фиг. 27D показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGEFc-L25-ShK[2-35], очищенного от стабильно трансфецированных СНО клеток. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль,2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 27 Е показано спектральное сканирование 10 мкл Fc-L10-ShK[2-35] продукта, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 27F показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-ShK[2-35] на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 27G показано спектральное сканирование 10 мкл Fc-L5-ShK[2-35] продукта в 700 мкл PBS(контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 27 Н показаны результаты эксклюзионной хроматографии 50 мкг конечного Fc-L5-ShK[235] продукта, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 27I показаны результаты анализа методом MALDI масс-спектрометрии конечного образца(337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 27J показано спектральное сканирование 20 мкл продукта в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 27K показаны результаты эксклюзионной хроматографии 50 мкг конечного Fc-L25-ShK[235] продукта, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 27L показаны результаты анализа методом MALDI масс-спектрометрии конечного образца(337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 28 А показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGEFc-L10-KTX1, после очистки от бактериальных клеток и рефолдинга. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта,стандарты белков в широком интервале Novex Mark12, 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 28 В показаны результаты эксклюзионной хроматографии 45 мкг очищенного Fc-L10-KTX1,вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 28 С показаны результаты спектрального сканирования 20 мкл Fc-L10-KTX1 продукта, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой-9 013470 кювете с длиной пробега луча 1 см. На фиг. 28D показаны результаты анализа методом MALDI масс-спектрометрии конечного образцаFc-L10-KTX1 на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 29 А показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGEFc-L-AgTx2 после очистки от бактериальных клеток и рефолдинга. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта,контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 29 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGEFc-L10-HaTx1 после очистки от бактериальных клеток и рефолдинга. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта,стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 29 С показаны результаты спектрального сканирования 20 мкл Fc-L10-AgTx2 продукта, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 29D показаны результаты эксклюзионной хроматографии 20 мкг очищенного Fc-L10AgTx2 продукта, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 29 Е показаны результаты анализа методом MALDI масс-спектрометрии конечного образцаFc-L10-AgTx2 на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 29F показаны результаты спектрального сканирования 20 мкл Fc-L10-HaTx1 продукта, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 29G показаны результаты эксклюзионной хроматографии 20 мкг очищенного Fc-L10-HaTx1 продукта, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМNaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 29 Н показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-HaTx1 на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 30 А показано, что Fc-L10-ShK[l-35], очищенный от СНО клеток, вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал. На фиг. 30 В показано время действия блокады калиевых токов с помощью Fc-L10-ShK[l-35] при различных концентрациях. По оценкам, величина IC50 составляет 152 пМ (n = 4 клетки). На фиг. 30 С показано, что синтетический ShK[l-35] (также называемый просто "ShK") вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал. На фиг. 30D показано время действия блокады с помощью ShK[l-35] при различных концентрациях. По оценкам, величина IC50 для ShK составляет 121 пМ (n =4 клетки). На фиг. 31 А показано, что синтетический пептидный аналог ShK[2-35] вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал с IC50 495 пМ (n = 3 клетки). На фиг. 31 В показано, что образованное при использовании СНО-клеток пептидное антитело (peptibody) Fc-L10-ShK[2-35] вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал с IC50 11518 пМ (n = 3 клетки). На фиг. 31 С показано, что пептидное антитело Fc-L5-ShK[2-35] вызывает зависимую от концентра- 10013470 ции блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал с IC50 100 пМ (n = 3 клетки). На фиг. 32 А показано, что Fc-L-KTX1, очищенный от бактериальных клеток, вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал. На фиг. 32 В показано время действия блокады калиевого тока с помощью Fc-L10-KTX1 при различных концентрациях. На фиг. 33 изображено, что методами иммунохимии: показано, что полученное при использовании СНО пептидное антитело Fc-L10-ShK[1-35] окрашивает HEK293 клетки, стабильно трансфецированные человеческим Kv1.3 (фиг. 33 А), тогда как нетрансфецированные HEK293 клетки не окрашиваются пептидным антителом (фиг. 33 В). На фиг. 34 показаны результаты ферментного иммуноанализа с использованием фиксированныхHEK293 клеток, стабильно трансфецированных человеческим Kv1.3. На фиг. 34 А видно, что образованное при использовании СНО пептидное антитело Fc-L10-ShK[l-35] (называемое в данном описании просто "Fc-L10-ShK") вызывает зависимое от дозы усиление ответа, тогда как контролыюе СНО-Fc ("Fc control", "Fc контроль") не вызывает этого. На фиг. 34 В показано, что пептидное антитело Fc-L10-ShK[l-35](называемое в данном описании "Fc-ShK") не выявляет ответ в нетрансфецированных HEK293 клетках в аналогичных условиях и также проявляет другие свойства негативного контроля. На фиг. 35 видно, что СНО-образованное пептидное антитело Fc-L10-ShK[l-35] вызывает зависимое от дозы ингибирование продуцирования IL-2 (фиг. 35 А) и IFN (фиг. 35 В) при использовании человеческих РВМС, стимулированных РМА и антителами к CD3. Пептидное антитело проявляет новое фармакологическое действие, а именно полное ингибирование ответа, тогда как один синтетический пептидShK[l-35] вызывает лишь частичное ингибирование. На фиг. 36 показано, что полученное при использовании клеток млекопитающих пептидное антитело Fc-L10-ShK[l-35] ингибирует пролиферацию Т клеток (включение 3 Н-тимидина) в человеческих РВМС от двух здоровых доноров, стимулированных антителами к CD3 и CD28. На фиг. 36 А показан ответ в клетках донора 1, а на фиг. 36 В показан ответ в клетках донора 2. Преинкубация блокирующим антителом против CD32 (FcgRII) не изменяет чувствительности к пептидному антителу. На фиг. 37 видно, что СНО-образованное пептидное антитело Fc-L10-ShK[l-35] вызывает зависимое от дозы ингибирование продуцирования IL-2 (фиг. 37 А) и IFN (фиг. 37 В) при использовании человеческих РВМС, стимулированных антителами к CD3 и CD28. На фиг. 38 А показано, что пэгилированный ShK[2-35] вызывает зависимую от концентрации блокаду внешнего калиевого тока, регистрируемого в HEK293 клетках, стабильно экспрессирующих человеческий Kv1.3 канал, а время действия блокады калиевого канала при различных концентрациях показано на фиг. 38 В. На фиг. 39 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10-ShK(l-35),разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 39 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE продукта Fc-L10-ShK(l-35). Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале NovexMark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 39 С показаны результаты эксклюзионной хроматографии 50 мкг продукта Fc-L10-ShK(l35), вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 40 А показаны результаты спектрального сканирования 20 мкл продукта Fc-L10-ShK(2-35),разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 40 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта Fc-L10-ShK(2-35). Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта,контроль, 10 мкг восстановленного продукта. На фиг. 40 С показаны результаты эксклюзионной хроматографии 50 мкг конечного продукта FcL10-ShK(2-35), вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 40D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-ShK(2-35) на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным- 11013470 лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 41 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10-OSK1, разведенного в 700 мкл PBS (буфер для состава), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 41 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта Fc-L10-OSK1. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта,контроль, 10 мкг восстановленного продукта. На фиг. 41 С показаны результаты эксклюзионной хроматографии 123 мкг конечного продукта FcL10-OSK1, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМNaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 41D показаны результаты анализа методом жидкостной хроматографии-массспектрометрии, примерно, 4 мкг образца конечного продукта Fc-L10-OSK1 на колонке Vydac C4 с частью элюата, направляющегося в масс-спектрометр с ионной ловушкой LCQ. Развертка масс-спектра производится с помощью программы Bioworks, предоставляемой производителем масс-спектрометра. На фиг. 42 А-В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NO: 1040 иSEQ ID NO: 1047 соответственно) Fc- L10-OSK1[K7S,E16K,K20D]. На фиг. 46 показан Вестерн-блоттинг (при использовании трис-глицин 4- 20% SDS-PAGE) с антителами против человеческого Fc. Дорожки 1-6 нагружают следующим образом: 15 мкл Fc-L10OSK1[K7S,E16K,K20D]; 15 мкл Fc-L10-OSK1[E16K,K20D]; 15 мкл Fc-L10-0SK1[K7S]; 15 мкл Fc-L10OSK1; 15 мкл контроля "отсутствие ДНК" ("No DNA"); маркеры молекулярной массы. На фиг. 47 показан Вестерн-блоттинг (при использовании трис-глицин 4-20% SDS-PAGE) с антителами против человеческого Fc. Дорожки 1-5 нагружают следующим образом: 2 мкл Fc-L10-OSK1; 5 мклFc-L10-OSK1; 10 мкл Fc-L10-OSK1; 20 нг стандарта человеческого IgG; маркеры молекулярной массы. На фиг. 48 показан Вестерн-блоттинг (при использовании трис-глицин 4-20% SDS-PAGE) с антителами против человеческого Fc. Дорожки 1-13 нагружают следующим образом: 20 нг стандарта человеческого IgG; D1; С 3; С 2; В 6; В 5; В 2; B1; A6; А 5; А 4; A3; А 2 (5 мкл кондиционированной для клона среды наносят на дорожки 2-13). На фиг. 49 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10-OsK1, разведенного в 700 мкл PBS (контрольного буфера), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 49 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта Fc-L10-OsK1. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта,контроль, 10 мкг восстановленного продукта. На фиг. 49 С показаны результаты эксклюзионной хроматографии 149 мкг конечного продукта FcL10-OsK1, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМNaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 49D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-OsK1 на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 50 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10-OsK1(K7S),разведенного в 700 мкл PBS (контрольного буфера), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 50 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE- 12013470 конечного продукта Fc-L10-OsK1(K7S). Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 50 С показаны результаты эксклюзионной хроматографии 50 мкг конечного продукта FcL10-OsK1(K7S), вводимого в колонву Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 50D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-OsK1(K7S) на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 51 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10OsK1(E16K, K20D), разведенного в 700 мкл PBS (контрольного буфера), на спектрофотометре HewlettPackard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 51 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта Fc-L10-OsK1(E16K, K20D). Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 51 С показаны результаты эксклюзионной хроматографии 50 мкг конечного продукта FcL10-OsK1(E16K, K20D), вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМNaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 51D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-OsK1(E16K, K20D) на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 52 А показаны результаты спектрального сканирования 50 мкл продукта Fc-L10-OsK1(K7S,E16K, K20D), разведенного в 700 мкл PBS (контрольного буфера), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 52 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта Fc-L10-OsK1(K7S, E16K, K20D). Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль,2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта, контроль, 10 мкг восстановленного продукта. На фиг. 52 С показаны результаты эксклюзионной хроматографии 50 мкг конечного продукта FcL10-OsK1(K7S, E16K, K20D), вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМNaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, с наблюдением за оптической плотностью при 280 нм. На фиг. 52D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта Fc-L10-OsK1(K7S, E16K, K20D) на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. На фиг. 53 показано ингибирование внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческого Kv1.3 канала, синтетическим Osk1, токсичным пептидом из 38 остатков яда азиатского скорпиона Orthochirus scrobiculosus. На фиг. 53 А показана зависимая от концентрации блокада внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческого Kv1.3 канала синтетическим Osk1 токсичным пептидом. На фиг. 53 В время действия блокады синтетическим Osk1 токсичного пептида при различных концентрациях. По оценкам, величина IC50 синтетического Osk1 составляет 3912 пМ (n =4 клетки). На фиг. 54 показано, что при модификации синтетического OSK1 токсичного пептида путем слия- 13013470 ния с Fc-фрагментом антитела (OSK1-пептидного антитела) сохраняется его ингибирующая активность в отношении человеческого Kv1.3 канала. На фиг. 54 А показана зависимая от концентрации блокада внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческогоKv1.3 канала, синтетическим OSK1, связанным с Fc-фрагментом человеческого IgG1 линкерной цепью протяженностью 10 аминокислотных остатков (Fc-L10-OSK1). Слитая конструкция стабильно экспрессируется в клетках яичников китайского хомячка (СНО). На фиг. 54 В показано время действия блокадыFc-L10-OSK1 при различных концентрациях. По оценкам, величина IC50 Fc-L10- OSK1 составляет 198 35 пМ (n = 6 клеток), примерно в 5 сильнее, чем у синтетического OSK1 токсичного пептида. На фиг. 55 показано, что при замене единичного аминокислотного остатка пептидное антителоOSK1 сохраняет ингибирующую активность против человеческого Kv1.3 канала. На фиг. 55 А показана зависимая от концентрации блокада внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческого Kv1.3 канала пептидным антителом OSK1 с единичной аминокислотной заменой (лизин на серии в 7 положении от N-конца, [K7S]) и связанным с Fc-фрагментом человеческого IgG1 линкерной цепью протяженностью 10 аминокислотных остатков (Fc-L10-OSK1[K7S]). Слитая конструкция стабильно экспрессируется в клетках яичников китайского хомячка (СНО). На фиг. 55 В показано время действия блокады Fc-L10-OSK1[K7S] при различных концентрациях. По оценкам, величина IC50 Fc-L10-OSK1 составляет 37271 пМ (n = 4 клетки), примерно в 10 сильнее, чем у синтетического OSK1 токсичного пептида. На фиг. 56 показано, что при замене двух аминокислотных остатков пептидное антитело OSK1 сохраняет ингибирующую активность против человеческого Kv1.3 канала. На фиг. 56 А показана зависимая от концентрации блокада внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческого Kv1.3 канала, пептидным антителом OSK1 с заменой двух аминокислот (глутаминовой кислоты на лизин и лизина на аспарагиновую кислоту в 16 и 20 положении от N-конца соответственно [E16KK20D]) и связанным с Fc-фрагментом человеческого IgG1 линкерной цепью протяженностью 10 аминокислотных остатков (Fc-L10-OSK1[E16KK20D]). Слитая конструкция стабильно экспрессируется в клетках яичников китайского хомячка (СНО). На фиг. 56 В показано время действия блокады калиевого тока с помощью Fc-L10-OSK1[E16KK20D] при различных концентрациях. По оценкам,величина составляет 24863 пМ (n = 3 клетки), примерно в 6 сильнее, чем у синтетического OSK1 токсичного пептида. На фиг. 57 показано, что при замене трех аминокислотных остатков пептидное антитело OSK1 сохраняет ингибирующую активность против человеческого Kv1.3 канала. На фиг. 57 А показана зависимая от концентрации блокада внешнего калиевого тока, регистрируемого при стабильной экспрессии в клетках HEK293 человеческого Kv1.3 канала, пептидным антителом OSK1 с заменой трех аминокислот (лизина на серин, глутаминовой кислоты на лизин и лизина на аспарагиновую кислоту в 7, 16 и 20 положении от N-конца соответственно [K7SE16KK20D]) и связанным с Fc-фрагментом человеческого IgG1 линкерной цепью протяженностью 10 аминокислотных остатков (Fc-L10-OSK1[K7SE16KK20D]). Слитая конструкция стабильно экспрессируется в клетках яичников китайского хомячка (СНО). На фиг. 57 В показано время действия блокады калиевого тока с помощью Fc-L10-OSK1[K7SE16KK20D] при различных концентрациях. По оценкам, величина составляет 81284 пМ (n = 3 клетки), примерно в 21 слабее,чем у синтетического OSK1 токсичного пептида. На фиг. 58 показаны стандартные кривые для ShK (фиг. 58 А) и 20K PEG(ПЭГ)-ShK[1-35] (фиг. 58 В), содержащие участки, отвечающие уравнениям линейной регрессии для каждого стандарта при данном процентном содержании сыворотки. На фиг. 59 показан фармакокинетический профиль у крыс соединения 20K PEG(ПЭГ) ShK[l-35] после инъекции IV. На фиг. 60 показана Kv1.3 ингибирующая активность в сывороточных образцах (5%) крыс, получающих единичную эквимолярную IV инъекцию ингибиторов Kv1.3, ShK по сравнению с 20KPEG(ПЭГ)-ShK[1-35]. На фиг. 61 иллюстрируется экспериментальный дизайн модели ЕАЕ адоптивного переноса (n = 5 крыс на экспериментальную группу). Величины доз в микрограммах на килограмм (мкг/кг) даны в расчете на содержание пептидов. На фиг. 62 показано, что лечение с помощью PEG-ShK ослабляет заболевание у крыс на ЕАЕ модели адоптивного переноса. Оценка по клиническим критериям: 0 = признаки отсутствуют, 0,5 = вялый конец хвоста, 1,0 = вялый хвост, 2,0 = легкий парапарез, атаксия, 3,0 = умеренный парапарез, 3,5 = паралич одной задней лапы, 4,0 = полный паралич задних лап, 5,0 = полный паралич задних лап и недержание, 5,5 = паралич всех четырех конечностей, 6,0 = агония или смерть. Крысы, состояние которых оценивается как 5,5-6 баллов, умирали или их умерщвляли. Показаны значения среднееsem (стандартная ошибка среднего), (n = 5 крыс в экспериментальной группе.) На фиг. 63 показано, что лечение с помощью PEG(ПЭГ)-ShK предупреждает потерю массы тела у ЕАЕ модели адоптивного переноса. Крыс взвешивают в дни -1, 4, 6 и 8 (для выживших крыс). Показаны значения среднееsem.- 14013470 На фиг. 64 показано, что индуцированное тапсигаргином продуцирование IL-2 в клетках человеческой цельной крови подавляется ингибиторами Kv1.3 каналов ShK[1-35] и Fc-L10-ShK[2-35]. Ингибитор кальциневрина циклоспорин А также блокирует ответ. Ингибитор ВКС канала ибериотоксин (IbTx) не проявляет заметной активности. Ответ клеток цельной крови двух разных доноров показан на фиг. 64 А и 64 В. На фиг. 65 показано, что индуцированное тапсигаргином продуцирование IFN-g в клетках человеческой цельной крови подавляется ингибиторами Kv1.3 каналов ShK[1-35] и Fc-L10-ShK[2-35]. Ингибитор кальциневрина циклоспорин А также блокирует ответ. Ингибитор ВКС канала ибериотоксин (IbTx) не проявляет заметной активности. Ответ клеток цельной крови двух разных доноров показан на фиг. 65 А и 65 В. На фиг. 66 показано, что индуцированная тапсигаргином позитивная регуляция (активация) CD40L на Т клетках в человеческой цельной крови подавляется ингибиторами Kv1.3 каналов ShK[1-35] и FcL10-ShK[2-35] (Fc-ShK). Ингибитор кальциневрина циклоспорин A (CsA) также блокирует ответ. На фиг. 66 А показаны результаты эксперимента, в котором изучается ответ CD4+ Т клеток в целом, а такжеCD4+ CD45+ и CD4+ CD45- Т клеток. На фиг. 66 В ингибитор ВКС канала ибериотоксин (IbTx) и ингибитор Kv1.3 каналов дендротоксин-K (DTX-K) не проявляют заметной активности. На фиг. 67 показано, что индуцированная тапсигаргином позитивная регуляция (активация) IL-2R на Т клетках в человеческой цельной крови подавляется ингибиторами Kv1.3 каналов ShK[1-35] и Fc-L10ShK[2-35] (Fc-ShK). Ингибитор кальциневрина циклоспорин A (CsA) также блокирует ответ. На фиг. 67 А показаны результаты эксперимента, в котором изучается ответ CD4+ Т клеток в целом, а такжеCD4+ CD45+ и CD4+ CD45- Т клеток. На Фигуре 67 В ингибитор ВКС канала ибериотоксин (IbTx) и ингибитор Kv1.3 каналов дендротоксин- К (DTX-K) не проявляют заметной активности. На фиг. 68 показаны хроматограммы, полученные при очистке методом катионообменной хроматографии ПЭГ-пептида на колонках с SP Сефарозой HP для очистки PEG (ПЭГ)-Shk (фиг. 68 А) и PEG(ПЭГ)-OSK-1 (фиг. 68 В). На фиг. 69 показаны хроматограммы, полученные методом RP (обращенно-фазовой) ВЭЖХ конечных пулов ПЭГ-пептид, чтобы продемонстрировать, что чистота PEG-Shk 99% (фиг. 69 А), а чистотаPEG-Osk1 97% (фиг. 69 В). На фиг. 70 показана аминокислотная последовательность (SEQ ID NO: 976) типичного FcLoop-L2OsK1-L2, имеющего три связанных домена: Fc N-концевой домен (аминокислотные остатки 1-139); OsK1(подчеркнутые аминокислотные остатки 142-179); и Fc С-концевой домен (аминокислотные остатки 182270). На фиг. 71 показана аминокислотная последовательность (SEQ ID NO: 977) типичного FcLoop-L2ShK-L2, имеющего три связанных домена: Fc N-концевой домен (аминокислотные остатки 1-139); ShK(подчеркнутые аминокислотные остатки 142-176); и Fc С-концевой домен (аминокислотные остатки 179267). На фиг. 72 показана аминокислотная последовательность (SEQ ID NO: 978) типичного FcLoop-L2ShK-L4, имеющего три связанных домена: Fc N-концевой домен (аминокислотные остатки 1-139); ShK(подчеркнутые аминокислотные остатки 142-176); и Fc С-концевой домен (аминокислотные остатки 181267). На фиг. 73 показана аминокислотная последовательность (SEQ ID NO: 979) типичного FcLoop-L4OsK1-L2, имеющего три связанных домена: Fc N-концевой домен (аминокислотные остатки 1-139); OsK1 подчеркнутые аминокислотные остатки 144-181); и Fc С-концевой домен (аминокислотные остатки 184-272). На фиг. 74 показано, что 20K пэгилированный ShK[1-35] обеспечивает эффективную блокаду человеческого Kv1.3, как определено электрофизиологическими экспериментами на фиксированной пробе цельных клеток на HEK293/Kv1.3 клетках. Данные представляют блокаду максимального (пик) тока. На Фигуре 75 схематически показаны структуры некоторых других типичных вариантов состава по изобретению. "X2" и "X3" обозначают токсичные пептиды или комбинации линкер-токсичный пептид(т.е. - (L)f- Р- (L)g-) по данному описанию. Как представлено в данном описании, но не показано на фиг. 75, дополнительный X1 домен и одна или более ПЭГ частиц также охватываются в других вариантах изобретения. Конкретные показанные варианты указаны ниже: На фиг. 75 С, 75D, 75G и 75 Н показана одноцепочечная молекула, которая также может представлять конструкцию ДНК молекулы. На фиг. 75 А, 75 В, 75 Е и 75F: показаны Fc димеры, связанные двумя дисульфидными связями (в положении F2); На фиг. 75 А и 75 В показан димер, имеющий участок токсичного пептида на обеих цепях в положении X1; на фиг. 75 Е и 75F показан димер, имеющий участок токсичного пептида на обеих цепях в положении X2. На фиг. 76 А показано спектральное сканирование 50 мкл продукта ShK[2-35]-Fc, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 76 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE- 15013470 конечного продукта ShK[2-35]-Fc. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта,контроль, 10 мкг восстановленного продукта. На фиг. 76 С показаны результаты эксклюзионной хроматографии 70 мкг конечного продуктаShK[2-35]-Fc, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 76D показаны результата LC (ЖХ)-MS анализа образца конечного продукта ShK[2-35]-Fc с помощью проточной обращенно-фазовой ВЭЖХ на Agilent 1100, причем элюент из колонки непосредственно поступает в источник электрораспыления масс-спектрометра Thermo Finnigan с ионной ловушкойLCQ. Релевантные спектры суммируют и развертку масс-спектра получают с помощью программы Bioworks. На фиг. 77 А показано спектральное сканирование 20 мкл продукта met-ShK[1-35]-Fc, разведенного в 700 мкл PBS (контрольный буфер), на спектрофотометре Hewlett Packard 8453 в кварцевой кювете с длиной пробега луча 1 см. На фиг. 77 В показан окрашенный Кумасси бриллиантовым голубым трис-глицин 4-20% SDS-PAGE конечного продукта met-ShK[1-35]-Fc. Дорожки 1-12 нагружены следующим образом: стандарты белков в широком интервале Novex Mark12 0,5 мкг невосстановленного продукта, контроль, 2,0 мкг невосстановленного продукта, контроль, 10 мкг невосстановленного продукта, стандарты белков в широком интервале Novex Mark12 0,5 мкг восстановленного продукта, контроль, 2,0 мкг восстановленного продукта,контроль, 10 мкг восстановленного продукта. На фиг. 77 С показаны результаты эксклюзионной хроматографии 93 мкг конечного продукта metShK[1-35]-Fc, вводимого в колонку Phenomenex BioSep SEC 3000 (7,8300 мм), в 50 мМ NaH2PO4, 250 мМ NaCl и рН 6,9, при скорости потока 1 мл/мин, наблюдают оптическую плотность при 280 нм. На фиг. 76D показаны результаты анализа методом MALDI масс-спектрометрии образца конечного продукта met-ShK[1-35]-Fc на времяпролетном масс-спектрометре Voyager DE-RP, снабженном азотным лазером (337 нм, 3 нс импульс). Анализируют положительные ионы в линейном режиме с ускоряющим напряжением 25 кВ. Каждый спектр получают накоплением данных от 200 лазерных импульсов. Внешнюю калибровку для измерения масс осуществляют, используя очищенные белки с известными молекулярными массами. Подробное описание вариантов изобретения Определение терминов Термины, применяемые по ходу описания, определяются ниже, если не указано иначе в конкретных примерах. Выражение "фрагмент (частица), продлевающий период полужизни" (т.е. F1 и F2 в формуле I), относится к фармацевтически активному фрагменту (частице), домену или "носителю", ковалентно связанному или конъюгированному с токсичным пептидом, который предупреждает или уменьшает in vivo протеолитическое расщепление или обеспечивает уменьшающую другую активность химическую модификацию токсичного пептида, повышает период полужизни или другие фармакокинетические свойства,такие, но без ограничения, как повышение скорости всасывания, уменьшает токсичность, повышает растворимость, повышает биологическую активность и/или целевую селективность токсичного пептида по отношению к представляющему интерес целевому ионному каналу, повышает технологичность и/или снижает иммуногенность токсичного пептида по сравнению с неконъюгированной формой токсичного пептида. Под "пэгилированным пептидом" понимают пептид или белок, содержащий фрагмент (частицу) полиэтиленгилколя, ковалентно связанный с аминокислотным остатком самого пептида или с пептидильным или с непептидильным линкером (включая, но без ограничения, ароматические линкеры), который ковалентной связью связан с остатком пептида. Под "полиэтиленгликолем" или "ПЭГ" понимают полиалкиленгликоль или его производное, со связывающими агентами или с дериватизацией (или без них) сшивающими или активирующими фрагментами (частицами) (например, альдегидным, гидроксисукцинимидильным, гидразидным, тиольным,трифлатным, трезилатным, азиридиновым, оксирановым, ортопиридилдисульфидным, винилсульфоновым или малеинимидным фрагментом (частицей. Согласно данному изобретению применимый ПЭГ включает практически линейный ПЭГ, разветвленный ПЭГ или дендритный ПЭГ. (См., например,Merrill, патент США 5171264; Harris et al., Multiarmed, monofunctional, polymer for coupling to molecules and surfaces, патент США 5932462; Shen, N-maleimidyl polymer derivatives, патент США 6602498). Термин "пептидное антитело" ("peptibody") относится к соединению формулы I, в которой F1 и/или 2F обозначает Fc домен иммуноглобулина или его часть (участок) такой как СН 2 домен Fc, или в которой токсичный пептид встроен в петлю Fc домена человеческого IgG1, так что F1 и F2, каждый, обозначают- 16013470 участок (часть) Fc домена, при этом токсичный пептид встроен между ними (см., например, фиг. 70-73 и пример 49 в данном описании). Пептидные антитела по настоящему изобретению могут также быть пэгилированными по данному описанию, см. ниже, либо в Fc домене или на его участке, либо на участке токсичного (токсичных) пептида (пептидов) состава по изобретению, либо и там, и там. Термин "нативный Fc" относится к молекуле (фрагменту), или к последовательности, содержащей последовательность неантигенсвязывающего фрагмента, полученную при расщеплении (гидролизе) целого антитела, либо в мономерной, либо в мультимерной форме. Исходный иммуноглобулиновый источник нативного Fc, предпочтительно человеческого происхождения, и может представлять собой любой из иммуноглобулинов, хотя предпочтительными являются IgG1 или IgG2. Нативные Fc are составлены из мономерных полипептидов, которые могут быть связаны в димерные или мультимерные формы ковалентной (например, дисульфидными связями) или нековалентной связью. Число внутримолекулярных дисульфидных связей между мономерными субъединицами молекул нативного Fc равно от 1 до 4 в зависимости от класса (например, IgG, IgA, IgE) или подкласса (например, IgG1, IgG2, IgG3, IgA1, IgGA2),примером нативного Fc является связанный дисульфидной связью димер, полученный при гидролизе IgG с помощью папаина (см. Ellison et al. (1982), Nucleic Acids Res. 10: 4071-9). Термин "нативный Fc" по данному описанию является родовым для мономерных, димерных и мультимерных форм. Термин "Fc вариант" относится к молекуле (фрагмента) или к последовательности, полученной при модификации нативного Fc, но все еще содержащей сайт связывания с рецептором-"мусорщиком" (утилизатором), FcRn. В нескольких опубликованных патентных документах описаны примеры Fc вариантов,а также взаимодействие с рецептором-утилизатором. См. международные заявки WO 97/34631 (опубликована 25 сентября 1997 г.); WO 96/32478, соответствующая патенту США 6096891, выданному 1 августа 2000 г., вводимые ссылкой в данное описание во всей полноте; и WO 04/110472. Так, термин "Fc вариант" включает молекулу (фрагмент) или последовательность, являющейся гуманизированной последовательностью нативного Fc нечеловеческого происхождения. Кроме того, нативный Fc содержит сайты, которые можно удалять, так как они сообщают структурные признаки или биологическую активность, не требующиеся для слитых соединений (молекул) по настоящему изобретению. Так, термин "Fc вариант" включает фрагмент (молекулу) или последовательность, в которой отсутствует один или более сайтов или остатков нативного Fc, которые влияют на (1) образование, (2) несовместимость с выбранной клеткой-хозяином, (3) N-концевую гетерогенность при экспрессии в выбранной клетке-хозяине, (4) гликозилирование, (5) взаимодействие с комплементом, (6) связывание с Fc рецептором, отличным от рецептора-"мусорщика", или (7) антителозависимую клеточную цитотоксичность (ADCC), или участвуют в них. Подробнее Fc представлены далее в данном описании. Термин "Fc домен" охватывает молекулы (фрагменты) и последовательности Fc и Fc вариантов,описанные выше. Что касается Fc вариантов и нативных Fc, термин "Fc домен" включает молекулы(фрагменты) в мономерной или мультимерной форме, вне зависимости от того, получены они гидролизом (расщеплением) целого антитела или другими способами. Термин "мультимер" в приложении к Fc доменам или соединениям, содержащим Fc домены, относится к соединениям, молекулы которых имеют две или более полипептидных цепи, связанные за счет ковалентных, нековалентных или как ковалентных, так и нековалентных взаимодействий. Молекулы IgG обычно образуют димеры; IgM, пентамеры; IgD, димеры; a IgA, мультимеры, используя последовательность и результирующую активность нативного Ig источника Fc, или дериватизацию (описанную ниже) такого нативного Fc. Термин "димер" в применении к Fc доменам или соединениям, содержащим Fc домены, относится к соединениям, молекулы которых имеют две полипептидных цепи, связанные ковалентной или нековалентной связью. Так, примеры димеров, входящих в объем настоящего изобретения, показаны на фиг. 2. Термины "дериватизирующий" и "производное" или "дериватизированный" включают процессы и полученные соединения, соответственно, в которых: (1) соединение содержит циклический фрагмент; например сшивание цистеинильных остатков в соединении; (2) соединение сшито или имеет сайт для сшивания (перекрестного связывания); например соединение содержит цистеинильные остатки и, следовательно, образует сшитые (перекрестно-связанные) димеры в культуре in vivo; (3) одна или более пептидильная связь замещена на непептидильную связь; (4) N-конец замещен на -NRR1, NRC(O)R1,-NRC(O)OR1, -NRS(O)2R1, -NHC(O)NHR, сукцинимидную группу, или замещенную или незамещенную бензилоксикарбонил-NH-, где R и R1 и заместители в цикле имеют значение по определению ниже; (5) Сконец заменен на -C(O)R2 или -NR3R4, где R2, R3 и R4 имеют значение по определению ниже; и (6) соединения, в которых отдельные аминокислотные фрагменты модифицированы с помощью агентов, способных реагировать с выбранными побочными цепями или концевыми остатками. Термин "пептид" относится к соединениям, молекулы которых содержат от 2 примерно до 80 аминокислотных остатков, причем предпочтительными являются соединения, молекулы которых содержат примерно 10-60 аминокислотных остатков, а наиболее предпочтительными являются соединения, молекулы которых содержат примерно 30-50 аминокислотных остатков. Примеры пептидов можно получать произвольно любым известным способом, переносить в пептидную библиотеку (например, библиотеку фагового дисплея) или получать расщеплением белков. В любом пептидном участке составов по изобре- 17013470 тению, например во фрагменте токсичного пептида или пептидного линкера по данному описанию, дополнительные аминокислоты можно включать по любому из концов N- или С-, или по обоим концам данной последовательности. Конечно, эти дополнительные аминокислотные остатки не должны заметно мешать функциональной активности состава. "Токсичные пептиды" включают пептиды, имеющие такую же аминокислотную последовательность, что и природный фармакологически активный пептид, который можно выделить из яда, а также включают модифицированные пептидные аналоги таких природных соединений. Примеры токсичных пептидов для применения на практике настоящего изобретения перечислены в табл. 1-32. Токсичный пептид (Р или, равнозначно, Р 1 на фиг. 2) содержит по меньшей мере две внутрипептидных дисульфидных связи, как показано, например, на фиг. 9. Следовательно, данное изобретение относится к соединениям, молекулы которых содержат: а) С 1-С 3 и С 2-С 4 дисульфидное связывание, где С 1, С 2, С 3 и С 4 представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида слева, причем первый и третий цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь и второй и четвертый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 3, С 2-С 4 паттерном дисульфидного связывания включают, но без ограничения, -конопептиды, PnlA пептиды, PnlB пептиды и MII пептиды и аналоги любых из вышеперечисленных пептидов. б) С 1-С 6, С 2-С 4 и С 3-С 5 дисульфидное связывание, в котором, как описано выше, С 1, С 2, С 3, С 4, С 5 и 6 С представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида(ов) слева, причем первый и шестой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, второй и четвертый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь и третий и пятый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 6, С 2-С 4, С 3-С 5 паттерном дисульфидного связывания включают, но без ограничения, ShK, BgK, HmK, AeKS, AsK и DTX1 и аналоги любых из вышеперечисленных пептидов. в) С 1-С 4, С 2-С 5 и С 3-С 6 дисульфидное связывание, в котором, как описано выше, С 1, С 2, С 3, С 4, С 5 и 6 С представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида(ов) слева, причем первый и четвертый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, второй и пятый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь и третий и шестой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 4, С 2-С 5, С 3-С 6 паттерном дисульфидного связывания включают, но без ограничения, ChTx, MgTx, OSK1, КТХ 1, AgTx2, Pi2, Pi3, NTX, HgTx1, BeKM1,BmKTX, P01, BmKK6, Tc32, Te1, BmTx1, ВтТХ 3, IbTx, P05, ScyTx, TsK, HaTx1, ProTX1, PaTX2, Ptu1,GVIA, MVIIA и SmIIIa и аналоги любых из вышеперечисленных пептидов. г) С 1-С 5, С 2-С 6, С 3-С 7 и С 4-С 8 дисульфидное связывание, в котором С 1, С 2, С 3, С 4, С 5, С 6, С 7 и С 8 представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида(ов) слева, причем первый и пятый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, второй и шестой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, третий и седьмой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь и четвертый и восьмой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 5, С 2-С 6, С 3-С 7, С 4-С 8 паттерном дисульфидного связывания включают, но без ограничения, Anuoroctoxin (AnTx), Pi1, HsTx1, MTX (Р 12 А, Р 20 А) и Pi4 и аналоги любых из вышеперечисленных пептидов. д) С 1-С 4, С 2-С 6, С 3-С 7 и С 5-С 8 дисульфидное связывание, в котором С 1, С 2, С 3, С 4, С 5, С 6, С 7 и С 8 представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида(ов) слева, причем первый и четвертый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, второй и шестой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, третий и седьмой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь и пятый и восьмой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 4, С 2-С 6, С 3-С 7, С 5-С 8 паттерном дисульфидного связывания включают, но без ограничения, хлоротоксин, Bm-12b и аналоги любого из них. е) С 1-С 5, С 2-С 6, С 3-С 4 и С 7-С 8 дисульфидное связывание, в котором С 1, С 2, С 3, С 4, С 5, С 6, С 7 и С 8 представляют порядок, в котором остатки цистеина присутствуют в первичной последовательности токсичного пептида, традиционно установленный с N-конца пептида(ов) слева, причем первый и пятый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, второй и шестой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь, третий и четвертый цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь- 18013470 и седьмой и восьмой цистеиновые остатки в аминокислотной последовательности образуют дисульфидную связь. Примеры токсичных пептидов с таким С 1-С 5, С 2-С 6, С 3-С 4, С 7-С 8 паттерном дисульфидного связывания включают, но без ограничения, пептиды мауротоксина (Maurotoxin) и его аналоги. Термин "рандомизированный" по данному описанию относится к полностью случайным последовательностям (например, выбранных методом фагового дисплея) и последовательностям, в которых один или более остатков в молекуле природного соединения заменен на аминокислотный остаток, не присутствующий в этом положении в молекуле природного соединения. Типичные методы идентификации пептидных последовательностей включают фаговый дисплей, Е. coli дисплей, рибосомный дисплей,скрининг дрожжей, РНК-пептидный скрининг, химический скрининг, рациональный дизайн, структурный анализ белков и т.п. Выражение "физиологически активный" означает, что описанное таким образом вещество, как определено, обладает активностью, которая влияет на медицинский показатель (например, кровяное давление, количество лейкоцитов, уровень холестерина) или болезненное состояние (например, рак, аутоиммунные нарушения). Так, фармакологически активные пептиды представляют собой агонистические пептиды, или миметики, и антагонистические пептиды, определяемые ниже. Термины "-пептид-миметик" и "-пептид-агонист" ("пептидный агонист") относятся к пептиду, обладающему биологической активностью, сравнимой с активностью природного токсичного пептида, например природного ShK токсичного пептида. Кроме того, эти термины включают пептиды, которые непрямо имитируют активность природного токсичного пептида, например, усиливая эффект природного соединения. Термин "-антагонистический пептид" ("пептид-антагонист") или "ингибирующий пептид" относится к пептиду, который блокирует биологическую активность представляющего интерес рецептора или каким-то образом препятствует ее осуществлению, или обладает биологической активностью, сравнимой с биологической активностью известного антагониста или ингибитора представляющего интерес рецептора (такого, но без ограничения, как ионный канал). Термин "кислый остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, содержащие кислотные группы. Примеры кислых остатков включают D и Е. Термин "амидный остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, содержащие амидные производные кислот. Примеры остатков включают N и Q. Термин "ароматический остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, содержащие ароматические группы. Примеры ароматических остатков включают F,Y и W. Термин "основной остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, содержащие основные группы. Примеры основных остатков включают остатки Н, K, R,N-метиларгинина, -аминоаргинина, -метиларгинина, 1-метилгистидина, 3-метилгистидина и гомоаргинина (hR). Термин "гидрофильный остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, содержащие полярные группы. Примеры гидрофильных остатков включают остатки С, S, T, N, Q, D, Е, K и цитриллина (Cit). Термин "нефункциональный остаток" относится к аминокислотным остаткам в D- или L-форме,имеющим побочные цепи, в которых отсутствуют кислые, основные или ароматические группы. Примеры нефункциональных аминокислотных остатков включают М, G, А, V, I, L и норлейцин (Nle). Термин "нейтральный полярный остаток" относится к аминокислотным остаткам в D- или L-форме,имеющим побочные цепи, в которых отсутствуют кислые, основные или полярные группы. Примеры нейтральных полярных остатков включают А, V, L, I, P, W, M и F. Термин "полярный гидрофобный остаток" относится к аминокислотным остаткам в D- или Lформе, имеющим побочные цепи, содержащие полярные группы. Примеры полярных гидрофобных остатков включают Т, G, S, Y, С, Q и N. Термин "гидрофобный остаток" относится к аминокислотным остаткам в D- или L-форме, имеющим побочные цепи, не содержащие основных или кислых групп. Примеры гидрофобных остатков включают А, V, L, I, P, W, M, F, T, G, S, Y, С, Q и N. В некоторых применимых вариантах составов по изобретению аминокислотная последовательность токсичного пептида модифицируется одним или более способов по сравнению с представляющей интерес последовательностью нативного токсичного пептида, такого, но без ограничения, как последовательность нативного ShK или OSK1 их пептидных аналогов или любых других токсичных пептидов, имеющих аминокислотные последовательности, представленные в любой из табл. 1-32. Одна или более применимых модификаций может включать аминокислотные добавления или инсерции, аминокислотные делеции, усечения (процессинг) пептидов, аминокислотные замены и/или химическую дериватизацию аминокислотных остатков, осуществляемую известными химическими методами. Такие модификации можно осуществлять, например, с целью повышения эффективности, селективности и/или протеолитической стабильности или т.п. Специалистам в данной области техники известны методы дизайна пептидных аналогов с такими улучшенными свойствами, такие как аланиновый сканирующий мутагенез, ра- 19013470 циональный дизайн с учетом опосредованного выравниванием мутагенеза с применением последовательностей известных токсичных пептидов и/или молекулярное моделирование. Например, аналоги ShK можно создавать таким образом, чтобы удалить сайты расщепления протеазами (например, сайты расщепления трипсином в остатках K или R и/или сайты расщепления химотрипсином в остатках F, Y илиW) в составе по изобретению, содержащем ShK пептид или ShK аналог, частично с помощью мутагенеза на основании выравнивания последовательностей с применением HmK (см., например, фиг. 6) и молекулярного моделирования (см., например, Kalman et al., ShK-Dap22, a potent Kv1.3-specific immunosuppressive polypeptide, J. Biol. Chem. 273(49): 32697-707 (1998); Kem et al., патент США 6077680; Mouhat etal., OsK1 derivatives, международная патентная заявка WO 2006/002850 A2. Термин "протеаза" является синонимом "пептидазы". Протеазы представляют собой ферменты двух групп: эндопептидазы, которые расщепляют пептидные связи внутри белка, и экзопептидазы, которые удаляют одну или более аминокислот в N- или С-конце соответственно. Термин "протеиназа" также используют в качестве синонима эндопептидазы. В зависимости от механизма протеиназы делятся на четыре класса: сериновые протеиназы, цистеиновые протеиназы, аспарагиновые протеиназы и металлопротеиназы. Помимо этих классов в номенклатуре ферментов существует раздел протеаз, которые относятся к протеазам с неидентифицированным каталитическим механизмом. Это указывает, что каталитический механизм не определен. Номенклатура субсайтов расщепления традиционно берется из схемы, созданной Schechter and Berger (Schechter I.Berger A., On the size of the active site in proteases. I. Papain, Biochemical and Biophysicalthe active site of papain; specific inhibitor peptides of papain, Biochemical and Biophysical Research Communication, 32: 898 (1968. Согласно этой модели аминокислотные остатки в субстрате, подвергающемся расщеплению, обозначаются Р 1, Р 2, Р 3, Р 4 и т.д. в направлении к N-концу от сайта расщепления. Аналогично, остатки в направлении к С-концу обозначают Р 1', Р 2', Р 3', Р 4' и т.д. Опытному специалисту известны разнообразные вспомогательные программы для идентификации представляющих интерес сайтов связывания или расщепления протеазами. Например, программа PeptideCutter доступна через сервер ExPASy (Expert Protein Analysis System) proteomics Швейцарского института биоинформатики (Swiss Institute of Bioinformatics, (SIB; www.expasy.org/tools/peptidecutter. Программа PeptideCutter позволяет искать белковую последовательность в базах данных SWISS-PROT и/илиTrEMBL или проводить поиск сайтов расщепления протеазами в белковой последовательности пользователя. Можно использовать единичные протеазы и химические реагенты, селекцию или целый перечень протеаз и химических реагентов. Имеются различные виды результат-параметров: таблицы сайтов расщепления, либо сгруппированных в алфавитном порядке по названиям ферментов, либо последовательно, по числу аминокислот. Третий вариант для результат-параметров представляет собой карту сайтов расщепления. Последовательность и сайты расщепления, картированные на ней, группируются в блоки,размер которых выбирается пользователем. Также известны другие программы для определения сайтов расщепления протеазами (например, Turk, В. et al., Determinaition of protease cleavage site motifs usingof proteolytic enzymes, Academic Press (1998. Сериновые протеазы включают семейство химотрипсина, которое включает протеазы млекопитающих, такие как химотрипсин, трипсин, или эластазу, или калликреин. Сериновые протеиназы проявляют различные специфичности в отношении субстратов, которые связаны с аминокислотными заменами в различных субсайтах ферментов, взаимодействующих с остатками субстратов. Некоторые ферменты содержат протяженный сайт, взаимодействующий с субстратом, тогда как другие имеют специфичность, ограниченную остатком субстрата Р 1. Трипсин предпочтительно расщепляет по R или K в положении Р 1. В статистическом исследовании, проведенном Keil (1992), описывается негативное влияние остатков, окружающих Arg- и Lys-связи(т.е. положения Р 2 и Р 1' соответственно) в процессе расщепления трипсином. (Keil, В., Specificity of proteolysis, Springer-Verlag Berlin-Heidelberg-New York, 335 (1992. Остаток пролина в положении Р 1' обычно оказывает мощное негативное влияние на расщепление трипсином. Аналогично, позиционирование R и K в Р 1' приводит к ингибированию, так же как отрицательно заряженные остатки в положениях Р 2 и Р 1'. Химиотрипсин предпочтительно расщепляет по W, Y или F в положении Р 1 (высокая специфичность) и, в меньшей степени, по L, М, Н остатку в положении Р 1. (Keil, 1992). Далее приводятся исключения из этого правила: когда W находится в положении Р 1, расщепление блокируется, когда одновременно М или Р находятся в положении Р 1'. Кроме того, остаток пролина в положении Р 1' почти полностью блокирует расщепление вне зависимости от того, какая аминокислота находится в положении Р 1. Когда остаток М находится в положении Р 1, расщепление блокируется в присутствии остатка Y в положении Р 1'. Наконец, когда Н локализован в положении Р 1, присутствие D, М или W остатка также блокирует расщепление. Мембранная металлоэндопептидаза (NEP; нейтральная эндопептидаза, нейтральная протеиназа щеточной каймы, энкефалиназа, ЕС 3.4.24.11) расщепляет пептиды по аминоконцу гидрофобных аминокис- 20013470 лотных остатков (Connelly, J.C. et al., Neutral Endopeptidase 24.11 in Human Neutrophils: Cleavage ofChemotactic Peptide, PNAS, 82(24): 8737-8741 (1985. Тромбин предпочтительно расщепляется по R остатку в положении P1 (Keil, 1992). Нейтральный субстрат тромбина представляет собой фибриноген. Оптимальными сайтами расщепления являются сайты, когда остаток R находятся в положении P1, aGly находится в положении Р 2 и положении Р 1'. То же самое относится к варианту, когда гидрофобные остатки аминокислот находятся в положении Р 4 и положении Р 3, остаток пролина в положении Р 2, остаток R в положении Р 1 и некислый аминокислотный остаток находится в положении Р 1' и положении Р 2'. Очень важным остатком для его (трипсина) природного субстрата фибриногена является остаток D в Р 10. Каспазы представляют собой семейство цистеиновых протеиназ, несущих активный сайт с консервативно аминокислотной последовательностью и расщепляющих пептиды специфически после остатковArg-С протеиназы предпочтительно расщепляют по R остатку в положении Р 1. На поведение при расщеплении, по-видимому, лишь умеренно влияют остатки в положении Р 1' (Keil, 1992). The Asp-Nendopeptidase cleaves specifically bonds with a D residue in position Р 1' (Keil, 1992). Вышеприведенное является лишь примерным, но ни в коем случае не исчерпывающим изложением сведений, доступных специалисту в данной области техники, относительно сайтов связывания и/или расщепления протеазами, которые могут быть интересны специалисту при практическом применении изобретения. В других примерах аминокислотная последовательность токсичного пептида, полученная модификацией аминокислотной последовательности природного токсичного пептида, включает по меньшей мере один аминокислотный остаток, введенный в виде инсерции или замены, по сравнению с представляющей интерес нативной аминокислотной последовательностью токсичного пептида, в которой аминокислотный остаток, введенный в виде инсерции или замены, имеет боковую цепь, содержащую нуклеофильную или электрофильную реакционноспособную (реактивную) функциональную группу, с помощью которой пептид конъюгируется с линкером или с частицей, продлевающей период полужизни. Согласно изобретению применимые примеры таких нуклеофильных или электрофильных реактивных функциональных групп включают, но без ограничения, тиольную, первичную амино-, селено, гидразидную, альдегидную, карбоновой кислоты, кето-, аминоокси-, замаскированную (защищенную) альдегидную или замаскированную (защищенную) кето-функциональную группу. Примеры аминокислотных остатков с боковой цепью, содержащей нуклеофильную реактивную функциональную группу, включают,но без ограничения, остаток лизина, остаток ,-диаминопропионовой кислоты, остаток ,диаминомасляной кислоты, орнитин, цистеин, гомоцистеин, остаток глутаминовой кислоты, остаток аспарагиновой кислоты, остаток селеноцистеиновой кислоты. В представленных подробно в данном описании токсичных пептидах однобуквенная система сокращения часто применяется для обозначения двадцати "канонических" аминокислотных остатков,обычно входящих в состав природных пептидов и белков (табл. 1 А). Такие однобуквенные сокращения совершенно идентичны (взаимозаменяемы) по значению трехбуквенным сокращениям или несокращенным названиям аминокислот. В однобуквенной системе сокращения, применяемой в данном описании,заглавная буква указывает на L-аминокислоту, а строчная указывает на D-аминокислоту, если в данном описании не указано иначе. Например, сокращение R обозначает L-аргинин, а сокращение r обозначаетD-аргинин. Таблица 1 А Однобуквенные сокращения для канонических аминокислот Трехбуквенные сокращения даны в скобках Аминокислотная замена в аминокислотной последовательности обычно в данном описании обозначается следующим образом: однобуквенное сокращение для аминокислотного остатка в конкретном положении, затем номер положения аминокислоты относительно интересующей последовательности нативного токсичного пептида, а затем однобуквенный символ замещающего аминокислотного остатка. Например, "T30D" символизирует замену остатка треонина на аспартат в аминокислотном положении 30 относительно гипотетической нативной последовательности токсичного пептида. Еще пример, "R18hR" или " R18Cit" указывает на замену остатка аргинина на остаток гомоаргинина или цитруллина, соответственно, в аминокислотном положении 18 относительно гипотетического нативного токсичного пептида. Положение аминокислоты в аминокислотной последовательности любого конкретного токсичного пептида (или пептидного аналога) по данному описанию может отличаться от его положения в нативной последовательности, т.е. определяемом при выравнивании N-концевой или С-концевой аминокислотной последовательности пептида с N-концевой или С-концевой, если она подходит, нативной последовательностью токсичного пептида. Например, положение аминокислоты 1 в последовательности SCIDTIPKSRCTAFQCKHSMKYRLSFCRKTCGTC (ShK(2-35); SEQ ID NO: 92), усечение (процессирование) по N-концу нативной ShK последовательности, выравниваемой поэтому с С-концом нативного ShK(1-35)(SEQ ID NO: 5), соответствует положению аминокислоты 2 относительно нативной последовательности,а положение аминокислоты 34 в SEQ ID NO: 92 соответствует положению аминокислоты 35 относительно нативной последовательности (SEQ ID NO: 5). В некоторых вариантах настоящего изобретения аминокислотные замены охватывают неканонические аминокислотные остатки, которые могут включать природные редкие (в пептидах или белках) аминокислотные остатки или неприродные аминокислотные остатки. Неканонические аминокислотные остатки скорее можно вводить в пептид химическим пептидным синтезом, нежели синтезом в биологических системах, таким как экспрессия генов в рекомбинантных клетках, или же специалист в данной области техники может использовать известные методы генной инженерии, в которых применяется экспрессия генов в рекомбинантных клетках (см., например, Link et al., Non-canonical amino acids in proteinengineering, Current Opinion in Biotechnology, 14(6): 603-609 (2003. Термин "неканоническая аминокислота" относится к аминокислотным остаткам в D- или L-форме, которые отсутствуют среди 20 канонических аминокислот, обычно входящих в состав природных белков, к остаткам -аминокислот, гомоаминокислот, циклических аминокислот и аминокислот с дериватизированными боковыми цепями. Примеры включают (в L-форме или D-форме) цитруллин (Cit), гомоцитруллин (hCit), N-метилцитруллин (NMeCit),N-метилгомоцитруллин (NMeHoCit), орнитин (Orn или О), N-метилорнитин (NMeOrn), саркозин (Sar),гомолизин (hK или Hlys), гомоаргинин (hR или hArg), гомоглутамин (hQ), N-метиларгинин (NMeR), iVметиллейцин (NMeL), N-метилгомолизин (NMeHoK), N-метилглутамин (NMeQ), норлейцин (Nle), норвалин (Nva), 1,2,3,4-тетрагидроизохинолин (Tic), нитрофенилаланин (nitrophe), аминофенилаланин(Cha), 4-метил-фенилаланин (MePhe), ,-дифенилаланин (BiPhA), аминомасляную кислоту (Abu), 4 фенил-фенилаланин (4Bip), -аминоизомасляную кислоту (Aib) и дериватизированные формы любого из этих остатков по данному описанию. Номенклатура и символы для обозначения аминокислот и пептидов объединенной комиссии по биохимической номенклатуре UP AC-IUB (Joint Commission on BiochemicalBiochemical Nomenclature and Related Documents, 2nd edition, Portland Press, 1992, pages 39-69. Как заявляется в данном описании, в соответствии с настоящим изобретением пептидные участки составов по изобретению, такие как токсичный пептид или пептидный линкер, можно также дериватизи- 22013470 ровать химическими методами по одному из аминокислотных остатков. Пептиды, которые содержат дериватизированные аминокислотные остатки, можно синтезировать известными методами органического синтеза. "Химическое производное" или "химически дериватизированный" по отношению к пептиду относится к пептиду по изобретению, содержащему один или более остаток, дериватизированный по химической реакции функциональной боковой группы. Такие дериватизированные соединения (молекулы) включают, например, соединения, в которых аминогруппы дериватизированы с образованием гидрохлоридов аминов, п-толуолсульфонильных групп, карбобензоксигрупп, трет-бутилоксикарбонильных групп,хлорацетильных групп или формильных групп. Свободные карбонильные группы можно дериватизировать с образованием солей, сложных метиловых и этиловых эфиров или других сложных эфиров и гидразидов. Свободные гидроксильные группы можно дериватизировать с образованием О-ацильных или Оалкильных производных. Имидазольный азот в гистидине можно дериватизировать с образованием Nim(имидазол)бензилгистидина. Также в виде химических производных включены те пептиды, которые содержат одно или более производных двадцати канонических природных аминокислот либо в L-, либо вD-форме. Например, 4-гидроксипролин можно использовать вместо пролина; 5-гидроксилизин можно использовать вместо лизина; 3-метилгистидин можно использовать вместо гистидина; гомосерин можно использовать вместо серина и орнитин можно использовать вместо лизина. В некоторых вариантах настоящего изобретения основные остатки (например, лизин) представляющего интерес токсичного пептида можно заменить на другие остатки (предпочтительны нефункциональные остатки). Такие соединения менее основны, чем соединения, из которых они образованы, и иным образом сохраняют активность соединений, из которых они образованы, что в результате может дать лучшие показатели стабильности и иммуногенности; однако, настоящее изобретение не следует ограничивать этой теорией. Кроме того, физиологически приемлемые соли составов по изобретению также охватываются настоящим изобретением, включая те случаи, когда составы по изобретению называются в данном описании "молекулы" или "соединения". Под "физиологически приемлемыми солями" понимают любые соли,о которых известно, или позже найдено, что они являются фармацевтически приемлемыми. Некоторые примеры представляют собой ацетаты; трифторацетаты; гидрогалогениды, такие как гидрохлориды или гидробромиды; сульфаты; цитраты малеаты; тартраты; гликоляты; глюконаты; сукцинаты; мезилаты; безилаты и оксалаты. Структура соединений В целом. Рекомбинантные белки в качестве терапевтических агентов получают, наряду с другими методами, ковалентным связыванием с фрагментами (частицами), продлевающими период полужизни. Такие фрагменты включают Fc домен антитела, используемый в энбреле (Enbrel (этанерцепт,а также биологически подходящие полимеры (например, полиэтиленгликоль или ПЭГ), применяемый в Neulasta (пегфилграстим). Feige et al. описали применение таких "продлевателей" периода полужизни в патента США 6660843, выданном 9 декабря 2003 г. (вводится в данное описание ссылкой во всей полноте). Авторы настоящего изобретения установили, что соединения по данному изобретению - пептиды,состоящие примерно из 80 аминокислот или менее и содержащие по меньшей мере две внутрипептидных дисульфидных связи, становятся терапевтически более предпочтительными, когда они связываются ковалентной связью с фрагментами, продлевающими период полужизни. Кроме того, соединения по настоящему изобретению могут содержать дополнительный фармакологически активный ковалентно связанный пептид, который может быть связан с фрагментом, продлевающим период полужизни (F1 и/илиF2), или с пептидным участком (Р). Варианты составов по изобретению, содержащие более одного фрагмента, продлевающего период полужизни (F1 и F2), включают такие составы, в которых F1 и F2 представляют собой одинаковые или различные фрагменты, продлевающие период полужизни. Примеры (содержащие или не содержащие линкер между каждым доменом) включают структуры, показанные на фиг. 75, а также следующие варианты изобретения (и другие по данному описанию и в других представленных примерах). 20KPEG-токсичный пептид-Fc домен, соответствующий формуле [(F1)1-(X2)1-(F2)1]; 20KPEG-токсичный пептид-Fc CH2 домен, соответствующий формуле [(F1)1-(X2)1-(F2)1]; 20KPEG-токсичный пептид-HSA, соответствующий формуле [(F1)2(X2)1-(F2)1]; 20KPEG-Fc домен-токсичный пептид, соответствующий формуле [(F1)1-(F2)1-(X3)1]; 20KPEG-Fc CH2 домен-токсичный пептид, соответствующий формуле [(F1)1-(F2)1-(X3)1]; И 20KPEG-HAS-токсичный пептид, соответствующий формуле [(F1)1-(F2)1-(X3)1]. Токсичные пептиды. По данному изобретению можно использовать любое число токсичных пептидов (т.е. Р или эквивалентное ему Р 1 на фиг. 2). Особый интерес представляют токсичные пептиды ShK,HmK, MgTx, AgTx2, OsK1 (также называемые "OSK1"), агатоксины и HsTx1, а также их модифицированные аналоги и другие пептиды, которые имитируют активность таких токсичных пептидов. Как заявляется выше в данном описании, если в составе по изобретению присутствует более одного токсичного пептида Р, Р может независимо быть одинаковым или от другого (других) токсичного (токсичных) пеп- 23013470 тида (пептидов), также присутствующего (присутствующих) в составе по изобретению. Например, в составе, имеющем формулу Р-(L)g-F1-(L)f-P, оба токсичных пептида Р могут быть одинаковыми пептидными аналогами ShK, различными пептидными аналогами ShK или один может быть пептидным аналогомShK, а другой может быть пептидным аналогом OSK1. В некоторых вариантах изобретения другие важные пептиды особенно применимы в соединениях,имеющих дополнительные признаки по сравнению с соединениями структурной формулы I. В таких соединениях молекула формулы I включает, кроме того, дополнительный фармакологически активный ковалентно связанный пептид, являющийся агонистическим пептидом, антагонистическим пептидом или нацеливающим пептидом; эти пептиды могут быть конъюгированы с F1, или F2, или Р. Такие агонистические пептиды обладают активностью, агонистической к токсичному пептиду, но не обязательной, такая активность проявляется по тому же механизму, что и у токсичного пептида. Пептидные антагонисты также применимы в вариантах изобретения, причем предпочтительными являются пептидные антагонисты, обладающей активностью, которая может быть комплементарной активности токсичного пептида. Нацеливающие пептиды также представляют интерес как пептиды, направляющие соединение к конкретным типам клеток, конкретным органам и т.п. Эти классы пептидов можно обнаружить методами,представленными ссылочными материалами, цитируемыми в данном описании, и в других ссылочных материалах. В частности, фаговый дисплей применим в данном описании для получения токсичных пептидов. Аффинную селекцию при использовании библиотек случайных пептидов можно применять для идентификации пептидных лигандов для любого сайта любого генного продукта. Dedman et al. (1993), J.Biol. Chem. 268: 23025-30. Фаговый дисплей особенно пригоден для идентификации пептидов, которые связываются с такими представляющими интерес белками, как рецепторы клеточной поверхности или любые белки, имеющие линейные эпитопы. Wilson et al. (1998), Can. J. Microbiol. 44: 313-29; Kay et al.(1998), Drug Disc. Today 3: 370-8. Подробный обзор таких белков см. в Herz et al. (1997), J. Receptor andSignal Transduction Res. 17(5): 671-776, который вводится в данное описание ссылкой во всей полноте. Такие представляющие интерес белки являются предпочтительными для применения в данном изобретении. Особенно предпочтительные пептиды представлены в нижеприведенных таблицах. Эти пептиды можно приготовить методами, раскрываемыми в уровне техники или далее в данном описании. Используются однобуквенные сокращения аминокислот. Если не указано иначе, каждый X обозначает независимо нефункциональный остаток. Таблица 1 Пептидные последовательности ингибиторов Kv1.3 Многие пептиды, описанные в табл. 2, можно получать как описано в патенте США 6077680,выданном 20 июня 2000 г. Kem et al., который тем самым вводится в данное описание ссыпкой во всей полноте. Другие пептиды в табл. 2 можно получать методами, известными в уровне техники. Например,ShK(L5) (SEQ ID NO: 950) можно получать как описано в статье Beeton et al., Targeting effector memory Tcells with a selective peptide inhibitor of Kv1.3 channels for therapy of autoimmune diseases, Molec. Pharmacol. 67(4): 1369-81 (2005), которая тем самым вводится в данное описание ссылкой во всей полноте. В табл. 2 и везде в описании Xs15, Xs21, Xs22, Xs23 и Xs27, каждый независимо, обозначает нефункциональные аминокислотные остатки.
МПК / Метки
МПК: A61K 38/16, A61K 47/48, C12N 15/62, A61P 37/06, C07K 14/435
Метки: агенты, токсичных, основе, пептидов, терапевтические
Код ссылки
<a href="https://eas.patents.su/30-13470-terapevticheskie-agenty-na-osnove-toksichnyh-peptidov.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтические агенты на основе токсичных пептидов</a>
Предыдущий патент: Слитый белок, содержащий домен bh3 белка
Следующий патент: Применение агомелатина для получения лекарственных средств, предназначенных для лечения синдрома смита-магениса












