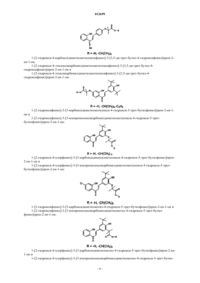
Композиция на основе замещенных производных 1,3-дифенилпроп-2-ен-1-она и ее применение
Формула / Реферат
1. Композиция для лечения или профилактики патологии, относящейся к воспалению, нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или старению кожи или центральной нервной системы, содержащая в фармацевтически приемлемом носителе по меньшей мере одно замещенное производное 1,3-дифенилпроп-2-ен-1-она, представленное формулой (I)
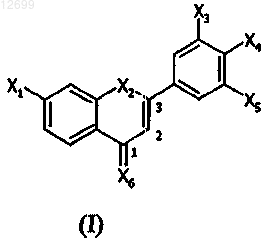
где X1 означает галоген либо группу -R1 или группу, соответствующую следующей формуле: -G1-R1;
Х2 означает атом водорода, или тионитрозогруппу, или гидроксигруппу, или алкилкарбонилоксигруппу, или незамещенную алкоксигруппу, или тиольную группу, или алкилтиогруппу, или алкилкарбонилтиогруппу, где алкильная часть Х2 имеет 1-7 атомов углерода, Х2 может также означать атом кислорода или серы, связанный с углеродом в положении 3 цепи пропена так, чтобы образовать производное 2-фенил-4Н-1-бензопиран-4-она или 2-фенил-4Н-1-бензотиопиран-4-она;
Х3 означает группу -R3 или группу, соответствующую следующей формуле: -G3-R3;
Х4 означает галоген, или тионитрозогруппу, или группу -R4, или группу, соответствующую следующей формуле: -G4-R4;
Х5 означает группу -R5 или группу, соответствующую следующей формуле: -G5-R5;
Х6 означает атом кислорода или атом азота, в случае, где Х6 означает атом азота, он несет атом водорода или гидроксигруппу либо C1-7алкоксигруппу;
R1, R3, R4, R5, которые являются одинаковыми или разными, означают атом водорода или
С1-7алкильную группу, замещенную или нет заместителем, который является частью группы 1 или группы 2, которые определены ниже;
G1, G3, G4, G5, которые являются одинаковыми или разными, означают атом кислорода или серы,
причем по меньшей мере одна из групп X1, X3, Х4 или Х5 соответствует формуле -G-R, в которой G представляет атом серы, и
по меньшей мере одна из групп R1, R3, R4 или R5 присутствует в форме С1-7алкильной группы, содержащей по меньшей мере один заместитель из группы 1 или 2, указанная алкильная группа связана непосредственно с кольцом или соединена с группой G согласно формуле -G-R,
заместители из группы 1 выбраны из группы, состоящей из карбоксигрупп, имеющих формулу
-COOR6, и карбамоильных групп, имеющих формулу -CONR6R7,
заместители из группы 2 выбраны из группы, состоящей из групп сульфоновой кислоты (SO3H) и сульфонамида, имеющих формулу -SO2NR6R7, где R6 и R7, которые являются одинаковыми или разными, означают атом водорода или С1-7алкильную группу, необязательно замещенную по меньшей мере одной группой типа 1 или 2,
за исключением соединений, представленных формулой (I), где
Х2 означает атом водорода и X1 означает -G1-R1, где G1 означает атом кислорода и R1 означает CH2COOH,
оптические и геометрические изомеры, рацематы, таутомеры, соли, гидраты и их смеси.
2. Композиция для лечения или профилактики патологии, относящейся к воспалению, нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или старению кожи или центральной нервной системы, содержащая в фармацевтически приемлемом носителе по меньшей мере одно замещенное производное 1,3-дифенилпроп-2-ен-1-она, представленное формулой (I)
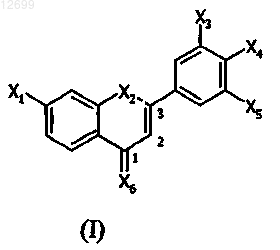
где X1 означает галоген или группу -R1 либо группу, соответствующую следующей формуле: -G1-R1;
Х2 означает атом водорода, или тионитрозогруппу, или гидроксигруппу, или алкилкарбонилоксигруппу, или незамещенную алкоксигруппу, или тиольную группу, или алкилтиогруппу, или алкилкарбонилтиогруппу, где алкильная часть Х2 имеет 1-7 атомов углерода, Х2 может также означать атом серы, связанный с углеродом в положении 3 цепи пропена так, чтобы образовать производное 2-фенил-4Н-1-бензотиопиран-4-она;
Х3 означает группу -R3 или группу, соответствующую следующей формуле: -G3-R3;
Х4 означает галоген, или тионитрозогруппу, или группу -R4, или группу, соответствующую следующей формуле: -G4-R4;
Х5 означает группу -R5 или группу, соответствующую следующей формуле: -G5-R5;
Х6 означает атом кислорода или атом азота, в случае, где Х6 означает атом азота, он несет атом водорода или гидроксигруппу либо С1-7алкоксигруппу,
R1, R3, R4, R5, которые являются одинаковыми или разными, означают атом водорода или
С1-7алкильную группу, замещенную или нет заместителем, который является частью группы 1 или группы 2, которые определены ниже,
G1, G3, G4, G5, которые являются одинаковыми или разными, означают атом кислорода или серы,
причем по меньшей мере с одной из групп X1, Х3, Х4 или Х5, соответствующей формуле -G-R, и ни одна из групп Х3, Х4 и Х5 не является водородом,
по меньшей мере одна из групп R1, R3, R4 или R5 присутствует в форме С1-7алкильной группы, содержащей по меньшей мере один заместитель из группы 1 или 2, указанная алкильная группа связана непосредственно с кольцом или соединена с группой G согласно формуле -G-R,
заместители из группы 1 выбраны из группы, состоящей из карбоксигрупп, имеющих формулу
-COOR6, и карбамоильных групп, имеющих формулу -CONR6R7,
заместители из группы 2 выбраны из группы, состоящей из групп сульфоновой кислоты (SO3H) и сульфонамида, имеющих формулу -SO2NR6R7, где R6 и R7, которые являются одинаковыми или разными, означают атом водорода или С1-7алкильную группу, необязательно замещенную по меньшей мере одной группой типа 1 или 2,
за исключением соединений, представленных формулой (I), где
Х2 означает атом водорода и X1 означает -G1-R1, где G1 означает атом кислорода и R1 означает СН2СООН,
оптические и геометрические изомеры, рацематы, таутомеры, соли, гидраты и их смеси.
3. Композиция по п.1 или 2, отличающаяся тем, что производные могут соответствовать цис- или трансконформации либо их смеси.
4. Композиция по п.1, отличающаяся тем, что ни одна из групп Х3, Х4 и Х5 не означает атом водорода.
5. Композиция по п.1, отличающаяся тем, что одна или две группы Х3, Х4 и Х5 означают атом водорода.
6. Композиция по любому из предшествующих пунктов, отличающаяся тем, что обе группы G1 и G4 представляют атом серы.
7. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х2 означает атом водорода, тионитрозогруппу, или гидроксигруппу, или алкоксигруппу, или тиольную группу, или алкилтиольную группу, где алкильная часть Х2 имеет 1-7 атомов углерода.
8. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает тионитрозогруппу, или группу -R4, или группу, соответствующую формуых -G4-R4, и Х2 означает тионитрозогруппу, или гидроксигруппу, или алкоксигруппу, или тиольную группу, или С1-7алкилтиогруппу, и G4 и R4 являются такими, как определено в п.1 или 2.
9. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1 означает группу -R1 или группу, соответствующую формуле -G1-R1, где R1 означает С1-7алкильную группу, замещенную заместителем, который является частью группы 1, и G1 и заместитель из группы 1 являются такими, как определено в п.1 или 2.
10. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1 означает группу -G1-R1.
11. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1 означает группу -G1-R1, где G1 означает атом кислорода.
12. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1 означает группу -R1 или группу, соответствующую формуле -G1-R1, где R1 означает С1-7алкильную группу, замещенную заместителем, который является частью группы 2, и G1 и заместитель из группы 2 являются такими, как определено в п.1 или 2.
13. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х3 означает группу -R3 или группу, соответствующую формуле -G3-R3, где R3 означает С1-7алкильную группу, замещенную заместителем, который является частью группы 1, и G3 и заместитель из группы 1 являются такими, как определено в пп.1 и 2.
14. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х3 означает группу -R3 или группу, соответствующую формуле -G3-R3, где R3 означает С1-7алкильную группу, замещенную заместителем, который является частьюгруппы 2, и G3 и заместитель из группы 2 являются такими, как определено в пп.1 и 2.
15. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает группу -R4 или группу, соответствующую формуле -G4-R4, где R4 означает С1-7алкильную группу, замещенную заместителем, который является частью группы 1, и G4 и заместитель из группы 1 являются такими, как определено в пп.1 и 2.
16. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает группу -G4-R4.
17. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает группу -G4-R4, где G4 означает атом кислорода.
18. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает группу -G4-R4, где G4 означает атом кислорода, и Х3 или X5, соответственно, означает R3 или -G3-R3, с одной стороны, и R5 или -G5-R5, с другой стороны, группы R3 и R5 означают С1-7алкил, имеющий заместитель из группы 1.
19. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х4 означает группу -R4 или группу, соответствующую формуле -G4-R4, где R4 означает С1-7алкильную группу, замещенную заместителем, который является частью группы 2, и G4 и заместитель из группы 2 являются такими, как определено в п.1 или 2.
20. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1 означает галоген.
21. Композиция по любому из предшествующих пунктов, отличающаяся тем, что Х6 означает атом кислорода.
22. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1, X3, Х4 или Х5 означают ОС(СН3)2COOR6.
23. Композиция по любому из предшествующих пунктов, отличающаяся тем, что X1, X3, Х4 или Х5 означают SC(СН3)2COOR6.
24. Композиция по п.1 или 2, выбранная из группы, состоящей из
1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3,5-ди-трет-бутил-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-этилоксикарбонилдиметилметилоксифенил]-3-[3,5-ди-трет-бутил-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-изопропилоксикарбонилдиметилметилоксифенил]-3-[3,5-ди-трет-бутил-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3-карбоксидиметилметилокси-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3-изопропилоксикарбонилдиметилметилокси-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3-карбоксидиметилметилокси-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3-изопропилоксикарбонилдиметилметилокси-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3-карбоксидиметилметил-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3-изопропилоксикарбонилдиметилметил-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3-карбоксидиметилметил-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3-изопропилоксикарбонилдиметилметил-4-гидрокси-5-трет-бутилфенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметокси-4-карбоксидиметилметилокси]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметокси-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3,5-диметокси-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3,5-диметокси-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3,5-диметокси-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-изопропилоксикарбонилдиметилметилоксифенил]-3-[3,5-диметокси-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,4-дигидрокси-5-карбоксидиметилметилоксифенил]-2-проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,4-дигидрокси-5-изопропилоксикарбонилдиметилметилоксифенил]-2-пропен-1-она,
1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-изопропилоксикарбонилдиметилметилоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[4-карбоксидиметилметилтиофенил]проп-2-ен-1-она,
1-[2-гидроксифенил]-3-[4-изопропилоксикарбонилдиметилметилтиофенил]проп-2-ен-1-она,
1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен-1-она,
1-[4-хлорфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-хлорфенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-хлор-2-гидроксифенил]-3-[4-карбоксидиметилметилтиофенил]проп-2-ен-1-она,
1-[4-карбоксидиметилметилоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-она,
1-[4-метилтиофенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-карбоксидиметилметилтиофенил]-3-[4-метилтиофенил]проп-2-ен-1-она,
1-[2-гидрокси-4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен-1-она,
1-[4-метилтиофенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-метилтиофенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-метилтиофенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[2-метоксифенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-метоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гексилоксифенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гексилоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[2-метилокси-4-хлорфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[2-метилокси-4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гептилфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гептилфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-бромфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она,
1-[4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она.
25. Композиция по п.1 или 2, где производное выбирают из группы, состоящей из
[4-метилтиофенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гексилоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она и
1-[4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она.
26. Композиция по любому из пп.1-25, отличающаяся тем, что патология, относящаяся к воспалению, выбрана из группы, состоящей из атеросклероза, аллергии, астмы, экземы, псориаза и прурита.
27. Композиция по любому из пп.1-25, отличающаяся тем, что патологией, относящейся к нейродегенерации, является болезнь Альцгеймера или болезнь Паркинсона.
28. Композиция по любому из пп.1-25, отличающаяся тем, что патология, относящаяся к прекращению регулирования липидного и/или глюкозного метаболизма, выбрана из группы, состоящей из диабета, атеросклероза и ожирения.
29. Композиция по любому из пп.1-25, где патология, относящаяся к прекращению регулирования липидного и/или глюкозного метаболизма, выбрана из группы, состоящей из диабета, атеросклероза и ожирения, и где производное выбирают из группы, состоящей из
[4-метилтиофенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она,
1-[4-гексилоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она и
1-[4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-она.
30. Композиция по одному из пп.1-25, отличающаяся тем, что патология, относящаяся к пролиферации и/или дифференцировке клеток, выбрана из группы, состоящей из канцерогенеза, псориаза и атеросклероза.
31. Способ лечения и/или профилактики патологии, относящейся к воспалению, нейродегенерации, отсутствию регуляции липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировки и/или к старению кожи или центральной нервной системы, включающий введение пациенту композиции по любому одному из пп.1-25.
Текст
012699 Изобретение относится к композициям, содержащим замещенные производные 1,3-дифенилпроп-2 ен-1-она, и их применению, в частности, в медицине и ветеринарии. Соединения по изобретению имеют свойства фармакологического антиоксиданта и свойства активатора PPAR и PPAR, которые являются полезными. Более конкретно изобретение описывает различные применения указанных соединений и фармацевтические и косметические композиции, содержащие их. Композиции по изобретению применимы, в частности, для профилактики или лечения сердечно-сосудистых болезней, синдрома X, рестеноза, диабета, ожирения, гипертензии, воспалительных болезней, рака или новообразований (доброкачественных или злокачественных опухолей), нейродегенеративных, дерматологических болезней и расстройств, относящихся к оксидативному стрессу, для профилактики или лечения старения вообще и, например, старения кожи, в частности в области косметики (развитие морщин и т.п.). Производные и/или композиции по изобретению могут быть использованы, в частности, для лечения болезней, в которые вовлекаются ткани, экспрессирующие PPAR и PPAR. Более конкретно они преимущественно позволяют лечить воспалительные, пролиферативные, дегенеративные болезни или патологии, поражающие различные органы и ткани, в особенности болезни, приводящие к патологическому ангиогенезу или неоваскуляризации, а также какую-либо патологию или нарушение (например,связанных с возрастом) с вовлечением оксидативного стресса. Преимущественно соединения по изобретению могут быть использованы в лечении болезней или расстройств, поражающих ткани и/или органы, независимо от этиологического компонента.PPAR или "пероксисоматические пролифераторные активированные рецепторы" являются нуклеарными рецепторами из суперсемейства факторов транскрипции, активированных следующими лигандами: стероиды/тироидные гормоны/ретиноиды. На данный момент три изотипа PPAR клонированы на мышах и людях: PPAR, PPAR/ и PPAR. Тогда как экспрессия PPAR/ у людей имеет вид повсеместной, PPAR и PPAR проявляют дифференцированное тканевое распределение (Braissant и Wahli,1998). PPAR экспрессируется в клетках с высокой жирно-кислотной катаболической активностью и в клетках с высокой пероксисоматической активностью (гепатоциты, кардиомиоциты, проксимальные канальцы почки, слизистая кишечника). PPAR/ экспрессируются повсеместно и обильно в большинстве тканей. Насколько экспрессия PPAR представляет интерес, она ограничивается, главным образом, жировой тканью, конкретными клетками иммунной системы и сетчатки и представлена только следовыми количествами в других органах (Braissant и Wahli, 1998).(DBD) распознает специфические последовательности, называемые также чувствительными элементами,которые находятся в регуляторных регионах их целевых генов. Подобно другим нуклеарным регуляторам PPAR также содержат связывающий лиганд домен, активация PPAR их лигандом модулирует экспрессию генов, которые содержат специфические чувствительные к PPAR элементы (PPRE) в промоторном регионе. Чтобы активировать транскрипцию их целевых генов, активированные PPAR должны гетеродимеризоваться с другим нуклеарным рецептором, RXR (ретиноид-Х-рецептор). Например, PPAR: его действие опосредуется классом соединений, таких как фибраты, которые имеют липидпонижающий эффект. Идентифицированы также натуральные лиганды, такие как, например, жирные кислоты, эйкозаноиды (лейкотриен В 4) и 8(S)-гидроксиэйкозатетраеновая кислота (Kliewer, Sundseth et al., 1997).PPAR связаны, главным образом, с липидным и глюкозным метаболизмом. Активаторы PPAR, такие как фибраты, делают возможным регулирование концентраций холестерина и триглицеридов в плазме посредством активации PPAR (Hourton, Delerive et al., 2001). Терапия фибратами ведет к возрастанию окисления жирных кислот в печени. Фибраты также снижают синтез и экспрессию триглицеридов(Staels and Auwerx, 1998). Активаторы PPAR также способны корректировать гипергликемию и содержание инсулина. Фибраты также уменьшают массу жировой ткани посредством механизма, который не зависит от потребления пищи и лептиновой генной экспрессии (Guerre-Millo, Gervois et al., 2000). Интерес для терапии агонистов PPAR широко исследован в лечении диабета типа 2 (Spiegelman,1998). Показано, что агонисты PPAR восстанавливают инсулиновую чувствительность в целевых тканях и снижают содержание в плазме глюкозы, липида и инсулина как на животных моделях диабета типа 2,так и у людей (RAM VJ, 2003). Активация PPAR лигандами также играет роль в регулировании экспрессии генов, которые принимают участие в таких процессах, как воспаление, ангиогенез, пролиферация и дифференцировка клеток,апоптоз и активности iNOS, ММРазы и TIMP. Активация PPAR в кератиноцитах имеет результатом прекращение их пролиферации и экспрессии генов, вовлекаемых в дифференцировку (Komuves, Hanleyet al., 2000). PPAR имеют противовоспалительные свойства, потому что они отрицательно влияют на механизмы транскрипции с вовлечением других факторов транскрипции, подобных NF-kB, или транскрипционных активаторов, подобных (STAT) и АР-1 (Desvergne and Wahli, 1999). Указанные противовоспалительные и антипролиферативные свойства делают PPAR (и особенно PPAR) интересными терапевтическими объектами воздействия для лечения болезней, таких как сосудистые окклюзивные болезни (атеросклероз и т.д.), гипертензия, болезни, имеющие отношение к неоваскуляризации (диабетическая рети-1 012699 нопатия и т.п.), воспалительные болезни (воспалительная болезнь кишечника, псориаз и т.д.) и неопластические болезни (канцерогенез и т.п.). Свободные радикалы играют роль в очень большом диапазоне патологий, включая аллергию, возникновение и промотирование опухоли, сердечно-сосудистые болезни (атеросклероз, ишемия), генетические и метаболические нарушения (диабет), инфекционные и дегенеративные болезни (болезнь Альцгеймера, болезнь Паркинсона, Приона и т.д.) и нарушения зрения (Mates, Perez-Gomez et al., 1999). Реакционноспособные кислородные частицы (ROS) образуются при нормальном функционировании клеток. ROS содержат гидроксильные радикалы (ОН), супероксидный анион (O2-), пероксид водорода (Н 2 О 2) и оксид азота (NO). Указанные частицы очень лабильны и, благодаря их высокой химической реакционной активности, представляют опасность для биологических функций клеток. Они вызывают перокисление липидов, окисление конкретных ферментов и очень интенсивное окисление протеинов,приводящее к их деградации. Защита против перокисления липидов является существенным процессом в аэробных организмах, потому что продукты перокисления могут вызывать повреждение ДНК. Так, прекращение регулирования или модификация равновесия между образованием, переработкой и ликвидацией радикальных частиц естественными антиокислительными защитными реакциями ведет к установлению процессов, которые вредны клетке или организму.ROS перерабатываются посредством антиокислительной системы, которая содержит ферментный компонент и неферментный компонент. Ферментная система состоит из нескольких ферментов, которые имеют следующие характеристики: супероксид-дисмутаза (SOD) разрушает радикал супероксида превращением его в пероксид. Пероксид, в свою очередь, подвергается воздействию другой ферментной системы. Низкие уровни содержанияSOD непрерывно образуются путем аэробной респирации. У людей идентифицировано три класса SOD,каждый из которых содержит Cu, Zn, Fe, Mn или Ni в качестве кофактора. Три формы SOD человека распределены следующим образом: цитозольная Cu-Zn-SOD, митохондриальная Mn-SOD и внеклеточнаяSOD; каталаза является очень эффективной при превращении пероксида водорода (H2O2) в воду и O2. Пероксид водорода ферментативно катаболизируется в аэробных организмах. Каталаза также катализирует восстановление разнообразных гидропероксидов (ROOH); глутатион-пероксидаза использует селен в качестве кофактора и катализирует восстановление гидропероксидов (ROOH и Н 2 О 2) путем утилизации глутатиона и тем самым защищает клетки против оксидативного повреждения. Неферментные антиокислительные защитные реакции содержат молекулы, которые синтезируются или поставляются с питанием. Молекулы антиоксиданта присутствуют в различных отделах клетки. Ферменты детоксификации,например, уничтожают свободные радикалы и являются существенными для жизни клетки. Тремя наиболее важными типами антиоксидантных соединений являются каротиноиды, витамин С и витамин Е(Gildun-Sherki, Melamed et al., 2001). Неожиданно показано, что соединения по изобретению обладают агонистической в отношенииPPAR активностью и антиоксидантными свойствами. Соединения по изобретению способны поэтому быть помехой по меньшей мере на двух сигнальных путях, которые активируются, в частности, при воспалении: образование цитокина и образование свободных радикалов. Действуя синергически, соединения по изобретению создают полезные терапевтически средства для лечения патологий, имеющих отношение к воспалению (атеросклероза, аллергии, астмы, экземы, прурита и т.д.), нейродегенерации (болезни Альцгеймера, болезни Паркинсона и т.д.), прекращению регулирования липидного и/или глюкозного метаболизма (диабет, атеросклероз, ожирение и т.д.), клеточной пролиферации/дифференцировке (канцерогенез и т.д.), и нарушений, имеющих отношение к старению (кожи или центральной нервной системы и т.д.). Показано, что соединения по изобретению одновременно имеют свойства активатора PPAR, антиоксиданта и противовоспалительные свойства. Таким образом, изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно замещенное производное 1,3-дифенилпроп-2-ен-1-она, для лечения патологий, имеющих отношение к воспалению, нэйродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или к старению кожи или центральной нервной системы. В частности, тогда изобретение имеет в качестве объекта композицию, содержащую в фармацевтически приемлемом носителе по меньшей мере одно замещенное производное 1,3-дифенилпроп-2-ен-1 она, представленное формулой (I) ниже где X1 означает галоген или группу -R1 либо группу, соответствующую следующей формуле: -G1-R1; Х 2 означает атом водорода, или тионитрозогруппу, или гидроксигруппу, или алкилкарбонилоксигруппу, или незамещенную алкоксигруппу, или тиольную группу, или алкилтиогруппу, или алкилкарбонилтиогруппу, где алкильная часть Х 2 имеет 1-7 атомов углерода, Х 2 может также означать атом кислорода или серы, связанный с углеродом в положении 3 цепи пропена так, чтобы образовать производное 2-фенил-4 Н-1-бензопиран-4-она или 2-фенил-4 Н-1-бензотиопиран-4-она; Х 3 означает группу -R3 или группу, соответствующую следующей формуле: -G3-R3; Х 4 означает галоген, или тионитрозогруппу, или группу -R4, или группу, соответствующую следующей формуле: -G4-R4; Х 5 означает группу -R5 или группу, соответствующую следующей формуле: -G5-R5; Х 6 означает атом кислорода или атом азота, в случае, где Х 6 означает атом азота, он несет атом водорода или гидроксигруппу либо C1-7 алкоксигруппу;R1, R3, R4, R5, которые являются одинаковыми или разными, означают атом водорода или С 1-7 алкильную группу, замещенную или нет заместителем, который является частью группы 1 или группы 2, которые определены ниже;G1, G3, G4, G5, которые являются одинаковыми или разными, означают атом кислорода или серы,причем по меньшей мере одна из групп X1, X3, Х 4 или X5 соответствует формуле -G-R, в которой G представляет атом серы, и по меньшей мере одна из групп R1, R3, R4 или R5 присутствует в форме С 1-7 алкильной группы, содержащей по меньшей мере один заместитель из группы 1 или 2, указанная алкильная группа связана непосредственно с кольцом или соединена с группой G согласно формуле -G-R,заместители из группы 1 выбраны из группы, состоящей из карбоксигрупп, имеющих формулу-COOR6, и карбамоильных групп, имеющих формулу -CONR6R7,заместители из группы 2 выбраны из группы, состоящей из групп сульфоновой кислоты (SO3H) и сульфонамида, имеющих формулу -SO2NR6R7, где R6 и R7 являются одинаковыми или разными, означающими атом водорода или С 1-7 алкильную группу, необязательно замещенную по меньшей мере одной группой типа 1 или 2,за исключением соединений, представленных формулой (I), где Х 2 означает атом водорода и X1 означает -G1-R1, где G1 означает атом кислорода и R1 означает СН 2 СООН,оптические и геометрические изомеры, рацематы, таутомеры, соли, гидраты и их смеси. Указанная композиция может быть использована, в частности, для лечения или профилактики патологии, имеющей отношение к воспалению, нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или старению кожи или центральной нервной системы. Изобретение также относится к композиции, содержащей пролекарства соединений, представленных формулой (I), которые после введения субъекту превращаются в соединения, представленные формулой (I), и/или метаболиты соединений, представленных формулой (I), которые проявляют терапевтическую активность, подобную активности соединений, представленных формулой (I), возможно в сочетании с другим терапевтическим агентом для лечения или профилактики патологии, имеющей отношение к воспалению, нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или старению кожи или центральной нервной системы. В объем изобретения включены также производные, представленные формулой (I), определение которых дано в описании выше, в цис- или транс-конформации. Композиция по изобретению может, следовательно, содержать производные, соответствующие цис- или транс-конформации или их смесь. Преимущественно ни одна из групп Х 3, Х 4 и Х 5 не означает атом водорода. Соединения формулы(I), которые отвечают этому определению, представляют соединения общей формулы (II). Преимущественно, одна или две группы Х 3, Х 4 и Х 5 означают атом водорода и X1 означает незамещенную алкильную группу. Преимущественно Х 2 означает тионитрозогруппу, или гидроксигруппу, или алкоксигруппу, или тиольную группу, или алкилтиогруппу. Производные, имеющие формулу (I), где Х 2 отвечает этому опре-3 012699 делению, представляют производные, представленные общей формулой (IX). Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (X), так что Х 4 означает тионитрозогруппу, или группу -R4, или группу, соответствующую формуле -G4-R4, и Х 2 означает тионитрозогруппу, или гидроксигруппу, или алкоксигруппу, или тиольную группу, или алкилтиогруппу, G4 и R4 имеют значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XI), так что X1 означает группу -R1 или группу, соответствующую формуле -G1-R1, где R1 означает алкильную группу, замещенную заместителем, который является частью группы 1, и G1 и заместитель из группы 1 имеют значения, указанные в описании выше. Более предпочтительно другой объект изобретения касается производных, представленных формулой (XI), таких как описанные в описании выше, характеризующихся тем, что Х 1 означает группу -G1-R1. Еще более предпочтительно другой объект изобретения касается производных, представленных формулой (XI), таких как описанные в описании выше, характеризующихся тем, что X1 означает группу-G1-R1, где G1 означает атом кислорода. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XII), так что X1 означает группу -R1 или группу, соответствующую формуле -G1-R1, гдеR1 означает алкильную группу, замещенную заместителем, который является частью группы 2, и G1 и заместитель из группы 2 имеют значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XIII), так что Х 3 означает группу -R3 или группу, соответствующую формуле -G3-R3, гдеR3 означает алкильную группу, замещенную заместителем, который является частью группы 1, и G3 и заместитель из группы 1 имеют значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XIV), так что Х 3 означает группу -R3 или группу, соответствующую формуле -G3-R3, гдеR3 означает алкильную группу, замещенную заместителем, который является частью группы 2, и G3 и заместитель из группы 2 имеют значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XV), так что Х 4 означает группу -R4 или группу, соответствующую формуле -G4-R4, гдеR4 означает алкильную группу, замещенную заместителем, который является частью группы 1, и G4 и заместитель из группы 1 имеют значения, указанные в описании выше. Более предпочтительно другой объект изобретения касается производных, представленных формулой (XV), таких как описанные в описании выше, характеризующихся тем, что Х 4 означает -G4-R4 группу. Еще более предпочтительно другой объект изобретения касается производных, представленных формулой (XV), таких как описанные в описании выше, характеризующихся тем, что Х 4 означает группу-G4-R4, где G4 означает атом кислорода. Еще более предпочтительно другой объект изобретения касается производных, представленных формулой (XV), таких как описанные в описании выше, характеризующихся тем, что Х 4 означает группу-G4-R4, где G4 означает атом кислорода, и Х 3 или Х 5 соответственно означают R3 или -G3-R3, с одной стороны, и R5 или -G5-R5, с другой стороны, где R3 или R5 означают алкильные группы, несущие заместитель из группы 1, указанный заместитель из группы 1 имеет значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XVI), так что Х 4 означает группу -R4 или группу, соответствующую формуле -G4-R4, гдеR4 означает алкильную группу, замещенную заместителем, который является частью группы 2, и G4 и заместитель из группы 2 имеют значения, указанные в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XVII), так что X1 означает галоген. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XVIII), так что X1 означает группу -R1, причем R1 означает C1-C4 алкильную группу, замещенную или нет по меньшей мере одним заместителем, который является частью группы 1 или группы 2, указанных в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XIX), так что X1 означает группу -G1-R1, где R1 означает C1-С 3 алкильную группу, замещенную или нет по меньшей мере одним заместителем, который является частью группы 1 или группы 2,указанных в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XX), так что X1 означает группу -R1, причем R1 означает С 5-С 24 алкильную группу, замещенную или нет по меньшей мере одним заместителем, который является частью группы 1 или группы 2,указанных в описании выше. Другие предпочтительные производные, представленные формулой (I), по изобретению имеют общую формулу (XXI), так что X1 означает группу -G1-R1, где R1 означает С 4-С 24 алкильную группу, замещенную или нет по меньшей мере одним заместителем, который является частью группы 1 или группы 2,-4 012699 указанных в описании выше. Другой объект изобретения касается производных, представленных формулой (I), где X1, X3, Х 4 или Х 5 означают ОС(СН 3)2COOR6, где R6 имеет значения, указанные в описании выше. Другой объект изобретения касается производных, представленных формулой (I), где X1, X3, Х 4 или Х 5 означают SC(СН 3)2COOR6, где R6 имеет значения, указанные в описании выше. Согласно изобретению термин "алкил" означает насыщенную углеводородную функциональную группу линейную, разветвленную или циклическую, галогенированную или нет, имеющую более конкретно от 1 до 24, предпочтительно от 1 до 10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, неопентил, н-гексил. Группы, содержащие один или два атома углерода или содержащие от двух до семи атомов углерода, особенно предпочтительны. Группы метил и этил еще более предпочтительны. Термин тионитрозо относится к нитрозогруппе, связанной с ароматическим кольцом через атом серы. Термин галоген означает атом хлора, или атом брома, или атом йода, или атом фтора. Термин алкокси означает алкильную цепь, связанную с кольцом через атом кислорода. Алкильная цепь определена ранее. Термин алкилтио относится к алкильной цепи, связанной с ароматическим кольцом через атом серы (простая тиоэфирная связь). Алкильная цепь определена ранее. Согласно конкретному варианту изобретения предпочтительные соединения показаны ниже с их соответствующими формулами: 1-[2-гидрокси-4-хлорфенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-он и 1-[2-гидрокси-4-хлорфенил]-3-[4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-он: 1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3,5-дибром-4-гидроксифенил]проп-2-ен-1 он,1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3-гидроксифенил]проп-2-ен-1-он,1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен-1-он,1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен-1-он,1-[2,4-дигидроксифенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[2-гидроксифенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-хлорфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1 он,1-[4-хлорфенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1 он,1-[4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-хлорфенил]проп-2-ен-1-он,1-[2-гидроксифенил]-3-[4-карбоксидиметилметилтиофенил]проп-2-ен-1-он,1-[4-хлор-2-гидроксифенил]-3-[4-карбоксидиметилметилтиофенил]проп-2-ен-1-он,1-[4-карбоксидиметилметилоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-он,1-[4-метилтиофенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-карбоксидиметилметилоксифенил]-3-[4-хлорфенил]проп-2-ен-1-он,1-[4-карбоксидиметилметилтиофенил]-3-[4-метилтиофенил]проп-2-ен-1-он,1-[2-гидрокси-4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен-1-он,1-[4-метилтиофенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2 ен-1-он,1-[4-метилтиофенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен 1-он,1-[4-метилтиофенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[2-метоксифенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен 1-он,1-[2-метоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-гексилоксифенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2 ен-1-он,1-[4-гексилоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,2-(3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил)-7-хлор-4 Н-1-бензопиран-4-он,2-(3,5-диметил-4-карбоксидиметилметилоксифенил)-7-хлор-4 Н-1-бензопиран-4-он,1-[2-метилокси-4-хлорфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-он,1-[2-метилокси-4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-гептилфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1 он,1-[4-гептилфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,1-[4-бромфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1 он,1-[4-бромфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1-он,-9 012699 1-[2-гидроксифенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен 1-он. Соединения по изобретению получают способом, который включает контактирование в среде основного характера или кислотного характера по меньшей мере одного соединения, представленного формулой (А) по меньшей мере с одним соединением, представленным формулой (В), причем формулами (А) и (В) являются где X1, Х 2, Х 3, Х 4 и Х 5 имеют значения, которые указаны в описании выше. Условия для проведения указанной реакции в среде кислотного или основного характера известны специалисту в этой области и могут широко изменяться. Указанные два соединения вводят во взаимодействие преимущественно в стехиометрических пропорциях. Взаимодействие предпочтительно осуществляют при комнатной температуре (приблизительно между 18 и 25 С) и при атмосферном давлении. В среде основного характера реакцию предпочтительно проводят в присутствии сильного основания, такого как гидроксид щелочного металла, подобного гидроксиду натрия, или алкоголята щелочного металла, подобного этилату натрия. В кислотной среде реакцию предпочтительно проводят в присутствии сильной кислоты, такой как хлороводородная кислота. Схема реакции может быть изображена следующим образом: Синтез в среде основного характера может быть проведен следующим образом. Один молярный эквивалент кетона (соединение (А и один молярный эквивалент альдегида (соединение (В солюбилизируют в водно-спиртовом растворе 20 молярных эквивалентов гидроксида натрия. Смесь перемешивают приблизительно 18 ч при комнатной температуре (между 18 и 25 С). Реакционную среду затем подкисляют (в частности, до рН приблизительно 2), в частности, хлороводородной кислотой. Ожидаемый замещенный 1,3-дифенилпроп-2-ен-1-он может быть получен осаждением или экстракцией в системе твердое тело/жидкость после выпаривания реакционной среды. Затем он может быть очищен хроматографией на силикагеле или кристаллизацией. Синтез в кислотной среде может быть проведен следующим образом. Один молярный эквивалент кетона (соединение (А и один молярный эквивалент альдегида (соединение (В солюбилизируют в растворе этанола, насыщенном газообразной хлороводородной кислотой. Смесь перемешивают при комнатной температуре приблизительно 6 ч, растворитель удаляют, в частности, выпариванием в вакууме. Замещенный 1,3-дифенилпроп-2-ен-1-он очищают, в частности, хроматографией на силикагеле. Фармацевтические композиции или соединения, представленные формулой (I), по изобретению преимущественно используются для лечения или профилактики патологий, относящихся к воспалению,нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или к старению кожи или центральной нервной системы и более конкретно одной или нескольких таких патологий, как аллергия, астма, экзема, псориаз, прурит, болезнь Альцгеймера, болезнь Паркинсона, диабет, атеросклероз, ожирение, канцерогенез и т.д. Фактически было обнаружено неожиданно, что соединения, представленные формулой (I), имеют полезные фармакологические свойства, такие как антиоксиданты и активаторы PPAR и PPAR. В случае, когда композиция по изобретению предназначается для лечения или профилактики патологии, относящейся к нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или старению кожи или центральной- 10012699 нервной системы, соединения, представленные формулой (I), могут необязательно включать соединения формулы (I), где Х 2 означает атом водорода и X1 означает -G1-R1, где G1 означает атом кислорода и R1 означает СН 2 СООН. Предпочтительно, однако, чтобы указанные соединения были исключены. В случае, когда композиция по изобретению предназначается для лечения или профилактики патологии, относящейся к воспалению, нейродегенерации, клеточной пролиферации и/или дифференцировке и/или к старению кожи или центральной нервной системы и более конкретно одной или нескольких таких патологий, как аллергия, астма, экзема, псориаз, прурит, болезнь Альцгеймера, болезнь Паркинсона или канцерогенез, соединения, представленные формулой (I), могут необязательно включать те, которые имеют формулу (I), где каждый из X1, Х 2, Х 3 и Х 5 означает атом водорода, Х 6 означает атом кислорода и Х 4 означает группу, соответствующую формуле -O-CR8R9-COOR10, где R8 и R9, которые являются одинаковыми или разными, означают C1-C2 алкильную группу (содержащую один или два атома углерода) и R10 означает атом водорода или C1-C7 алкильную группу,каждый из Х 2, Х 3 и Х 5 означает атом водорода, X1 означает атом галогена или R1 или группу -G1-R1,где R1 означает незамещенную С 1-С 2 алкильную группу и G1 означает атом кислорода, Х 6 означает атом кислорода и Х 4 означает группу, соответствующую формуле -O-CR11R12-COOR10, где R11 и R12, которые являются одинаковыми или разными, означают атом водорода или C1-C2 алкильную группу и R10 означает атом водорода или C1-C7 алкильную группу (содержащую от одного до семи атомов углерода). Изобретение также относится к способу лечения патологий, относящихся к воспалению, нейродегенерации, прекращению регулирования липидного и/или глюкозного метаболизма, клеточной пролиферации и/или дифференцировке и/или к старению кожи или центральной нервной системы и более конкретно одной или нескольких таких патологий, как аллергия, астма, экзема, псориаз, прурит, болезнь Альцгеймера, болезнь Паркинсона, диабет, атеросклероз, ожирение, канцерогенез, содержащему введение субъекту, в особенности человеку, эффективной дозы соединения, представленного общей формулой (I),или фармацевтической композиции, определение которой дано в описании выше. Фармацевтические композиции по изобретению предпочтительно содержат один или несколько фармацевтически приемлемых наполнителей или носителей. Примеры включают насыщенный раствор соли, физиологические, изотонические, забуференные растворы и т.п., совместимые с фармацевтическим применением и известные специалистам в этой области. Композиции могут содержать один или несколько агентов или носителей, выбранных из группы, состоящей из диспергаторов, солюбилизаторов,стабилизаторов, консервантов и т.п. Агентами или носителями, которые могут быть использованы в композициях (жидких, и/или пригодных для инъекций, и/или твердых), являются, в частности, метилцеллюлоза, гидроксиметилцеллюлоза, карбоксиметилцеллюлоза, полисорбат 80, маннит, желатин, лактоза, растительные масла, камедь акации и т.п. Композиции могут быть приготовлены как суспензии для инъекций, гели, масла, таблетки, суппозитории, порошки, капсулы, пастилки и т.п., возможно посредством фармацевтических форм или устройств, обеспечивающих пролонгированное и/или отсроченное высвобождение. Для этого типа композиций преимущественно используют такой агент, как целлюлоза,карбонаты или крахмал. Соединения или композиции по изобретению могут быть введены различными путями и в различных формах. Например, они могут быть введены через рот или системным путем, таким как, например,внутривенный, внутримышечный, подкожный, чрескожный, интраартериальный путь и т.д. Для инъекций соединения обычно готовят как жидкие суспензии, которые могут быть введены инъекцией через шприцы или вливанием, например. Понятно, что скорость инъекции и/или доза, вводимая путем инъекции, могут быть подобраны специалистами соответственно пациенту, патологии, способу введения и т.д. Обычно соединения вводят в дозах от 1 мкг до 2 г на введение, предпочтительно от 0,1 мг до 1 г на введение. Введения могут быть суточными или повторяющимися несколько раз в сутки в зависимости от возможного случая. Кроме того, композиции по изобретению могут дополнительно содержать другие активные ингредиенты или агенты. Другие аспекты и преимущества изобретения станут более явными в следующих примерах, которые поясняют, не ограничивая, настоящее изобретение. Описание фигур Фиг. 1-1, 1-2, 1-3: оценка антиоксидантных свойств соединения 2, соединения 3, соединения 12, соединения 14 и соединения 17 на окислении LDL медью (Cu). Фиг. 1-1 показывает результаты экспериментального измерения образования конъюгированных диенов во времени. Можно видеть, что инкубирование LDL с испытуемыми соединениями при концентрации 10-4 М задерживает образование конъюгированных диенов. Лаг-фаза для одной меди была 111 мин по сравнению с лаг-фазой 132, 145, 134 и 203 мин, соответственно, когда LDL инкубировали с соединением 3, соединением 12, соединением 14, соединением 17. Лаг-фаза была более чем 480 мин, когда LDL инкубировали с соединением 2. Эта задержка образования конъюгированных диенов является характеристикой антиоксидантов. Фиг. 1-2 показывает скорость образования диенов после различных обработок. Инкубирование соединений с LDL в присутствии меди показывает скорость образования конъюгированных диенов. Эта- 11012699 скорость составляла 2 нмоль/мин/мг LDL с одной медью, 1,7 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии 10-4 М соединения 17, и не определена для соединения 2 при 10-4 М (не поддающаяся измерению, так как слишком мала). Фиг. 1-3 представляет максимальное количество конъюгированных диенов, образовавшихся во времени. Инкубирование LDL с медью привело к образованию 348 нмоль конъюгированных диенов на мгLDL, инкубирование с соединением 2 при 10-4 М привело к снижению на 84% образования конъюгированных диенов (54,4 нмоль на мг LDL). В присутствии соединений 3 и 17 образование конъюгированных диенов составляло соответственно 303 и 327 нмоль на 1 мг LDL. Фиг. 1-4, 1-5, 1-6: оценка антиоксидантных свойств соединения 18, соединения 19, соединения 21 и соединения 22 на окислении LDL медью (Cu). Фиг. 1-4 показывает, что инкубирование LDL с испытуемыми соединениями при концентрации 10-4 М задерживает образование конъюгированных диенов. Лаг-фаза для одной меди составляла 178 мин по сравнению с лаг-фазой 241, 182 и 241 мин (из экспериментального определения), соответственно, когда LDL инкубировали с соединением 18, соединением 19 или соединением 22. Лаг-фаза составляла более чем 480 мин, когда LDL инкубировали с соединением 21. Эта задержка образования конъюгированных диенов является характеристикой антиоксидантов. Фиг. 1-5 показывает скорость образования диенов после различных обработок. Скорость образования конъюгированных диенов была 1,6 нмоль/мин/мг LDL с одной медью, 1,4 нмоль/мин/мг LDL, когдаLDL инкубировали в присутствии соединения 18 при 10-4 М, 1,3 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 22, и не определена для соединения 21 при 10-4 М (не поддающаяся измерению, так как слишком мала). Фиг. 1-6 представляет максимальное количество конъюгированных диенов, образовавшихся во времени. Инкубирование LDL с медью привело к образованию 353 нмоль конъюгированных диенов на мгLDL. Инкубирование с соединением 21 при 10-4 М ингибировало образование конъюгированных диенов. Образование конъюгированных диенов составляло, соответственно, 305, 345 и 345 нмоль на мг LDL в присутствии соединений 18, 19 и 22. Фиг. 1-7, 1-8: оценка антиоксидантных свойств соединения 25 и соединения 28 на окислении LDL медью (Cu). Фиг. 1-7 показывает результаты экспериментального измерения образования конъюгированных диенов во времени. Можно видеть, что инкубирование LDL с испытуемыми соединениями при концентрации 10-4 М задерживает образование конъюгированных диенов. Лаг-фаза для одной меди составляла 82 мин по сравнению с лаг-фазой 120 и 135 мин (из экспериментального определения), соответственно,когда LDL инкубировали с соединением 25 и соединением 29. Фиг. 1-8 представляет максимальное количество конъюгированных диенов, образовавшихся во времени. Инкубирование LDL с медью привело к образованию 393 нмоль конъюгированных диенов на мгLDL. В присутствии соединения 25 эта величина составляла 378 нмоль на мг LDL. Фиг. 1-9, 1-10, 1-11: оценка антиоксидантных свойств соединения 31, соединения 33 и соединения 35 на окислении LDL медью (Cu). Фиг. 1-9 показывает результаты экспериментального измерения образования конъюгированных диенов во времени. Можно видеть, что инкубирование LDL с испытуемыми соединениями при концентрации 10-4 М задерживает образование конъюгированных диенов. Лаг-фаза для одной меди составляла 80 мин по сравнению с лаг-фазой 139, 247 и 149 мин (из экспериментального определения), соответственно, когда LDL инкубировали с соединением 31, соединением 33 и соединением 35. Эта задержка образования конъюгированных диенов является характеристикой антиоксидантов. Фиг. 1-10 показывает скорость образования диенов после различных обработок. Инкубирование соединений с LDL в присутствии меди показывает скорость образования конъюгированных диенов. Эта скорость составляла 1,9 нмоль/мин/мг LDL с одной медью, 1,6 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 31 при 10-4 М, 0,8 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 33, и 1,5 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 35. Фиг. 1-11 представляет максимальное количество конъюгированных диенов, образовавшихся во времени. Инкубирование LDL с медью привело к образованию 298 нмоль конъюгированных диенов на мгLDL по сравнению с 257 нмоль на мг LDL в присутствии соединения 33. Фиг. 1-12, 1-13, 1-14: оценка антиоксидантных свойств соединения 37, соединения 38 и соединения 41 на окислении LDL медью (Cu). Фиг. 1-12 показывает результаты экспериментального измерения образования конъюгированных диенов во времени. Можно видеть, что инкубирование LDL с испытуемыми соединениями при концентрации 10-4 М задерживает образование конъюгированных диенов. Лаг-фаза для одной меди составляла 120 мин по сравнению с лаг-фазой 196, 284 и 411 мин (из экспериментального определения), соответст- 12012699 венно, когда LDL инкубировали с соединением 37, соединением 38 и соединением 41. Фиг. 1-13 показывает скорость образования диенов после различных обработок. Инкубирование соединений с LDL в присутствии меди показывает скорость образования конъюгированных диенов. Эта скорость составляла 1,8 нмоль/мин/мг LDL с одной медью, 1,49 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 37 при 10-4 М, 0,71 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 38, и 0,54 нмоль/мин/мг LDL, когда LDL инкубировали в присутствии соединения 41. Фиг. 1-14 представляет максимальное количество конъюгированных диенов, образовавшихся во времени. Инкубирование LDL с медью привело к образованию 372 нмоль конъюгированных диенов на мгLDL по сравнению с 338 нмоль на мг LDL, 244 нмоль на мг LDL и 71 нмоль на мг LDL в присутствии соединений 37, 38 и 41 соответственно. Лаг-фаза в образовании конъюгированных диенов, уменьшение скорости образования диенов и уменьшение общего количества образовавшихся диенов являются характеристиками антиоксидантов. Фиг. 2-1, 2-2, 2-3, 2-4, 2-5, 2-6: оценка свойств соединений по изобретению как агонистов PPAR в системе трансактивации PPAR/Gal4. Клетки RK13 инкубировали с различными соединениями при концентрациях 10, 30 и 100 мкМ или 1, 10 и 100 мкМ в течение 24 ч. Результаты выражены как фактор индукции (люминесцентный сигнал по отношению к необработанным клеткам) после различных обработок. Чем выше фактор индукции, тем сильнее активность агониста PPAR. Фиг. 2-1. Результаты показывают факторы индукции для соединений 3, 4, 7, 8 и 9. Величины этих факторов индукции приведены в табл. 2-1. Таблица 2-1 Результаты показывают, что соединение 3 создает максимальную 27-кратную индукцию при концентрации 30 мкМ, соединение 4 имеет максимальный фактор индукции 60 при 100 мкМ, 22 при 30 мкМ и 4 при 10 мкМ. Соединение 7 имеет максимальный фактор индукции 50 при 100 мкМ. Соединение 8 активирует систему с максимальным фактором индукции 10 при 100 мкМ. Соединение 9 имеет фактор индукции 28 при 100 мкМ, наивысшей концентрации. Фиг. 2-2. Результаты показывают факторы индукции для соединений 11, 12, 13, 14 и 17. Величины этих факторов индукции приведены в табл. 2-2. Таблица 2-2 Результаты показывают, что соединение 11 создает максимальную 10-кратную индукцию при концентрации 100 мкМ, соединение 12 имеет максимальный фактор индукции 22 при 100 мкМ, 8 при 30 мкМ и 1 при 10 мкМ. Соединения 13 и 14 имеют факторы индукции между 1,1 и 1,5 при различных испытанных концентрациях. Соединение 17 активирует систему с максимальным фактором индукции 85 при 10 мкМ и минимальным фактором индукции 13,8 при концентрации 100 мкМ. Фиг. 2-3. Результаты показывают факторы индукции для соединений 19, 20, 21 и 22. Величины этих факторов индукции приведены в табл. 2-3. Таблица 2-3 Результаты показывают, что соединение 19 создает максимальную 15,6-кратную индукцию при 10 мкМ, соединение 20 имеет максимальный фактор индукции 53 при 10 мкМ. Соединение 21 имеет факторы индукции между 0,8 и 22 при различных испытанных концентрациях. Соединение 22 активирует систему с максимальным фактором индукции 50 при концентрации 10 мкМ. Фиг. 2-4. Результаты показывают факторы индукции для соединений 23, 24, 25, 26 и 29. Величины этих факторов индукции приведены в табл. 2-4. Таблица 2-4 Соединение 23 имеет максимальный фактор индукции 3,6 при 10 мкМ, соединение 24 имеет максимальный фактор индукции 11 при 10 мкМ. Соединение 25 активирует систему с факторами индукции между 7 и 21 согласно испытанным концентрациям. Соединение 26 имеет максимальный фактор индукции 7,8 при концентрации 10 мкМ, соединение 29 имеет факторы индукции 28 и 25 при 1 и 10 мкМ, соответственно. Фиг. 2-5. Результаты показывают факторы индукции для соединений 31 и 33. Величины этих факторов индукции приведены в табл. 2-5. Соединение 31 активирует систему с фактором индукции 15,5 при концентрации 10 мкМ. Факторы индукции для соединения 33 равны 22, 44 и 77 при концентрациях 1, 10 и 100 мкМ соответственно. Фиг. 2-6. Результаты показывают факторы индукции для соединений 37, 38 и 41. Величины этих факторов индукции приведены в табл. 2-6. Таблица 2-6 Максимальные факторы индукции для соединений 37, 38 и 41 равны 27, 22 и 31 соответственно при концентрации 10 мкМ. Эти результаты демонстрируют, что испытанные соединения по изобретению обнаруживают активность лиганда PPAR и, следовательно, дают возможность транскрипционной активации его. Фиг. 2-7: оценка свойств соединений по изобретению как агонистов PPAR в системе трансактивации PPAR/Gal4. Клетки RK13 инкубировали с различными соединениями при концентрациях 1, 10 и 100 мкМ в течение 24 ч. Результаты выражены как фактор индукции (люминесцентный сигнал по отношению к необработанным клеткам) после различных обработок. Чем выше фактор индукции, тем сильнее активность агониста PPAR. Результаты на фигуре показывают факторы индукции для соединений 17, 33 и 29. Величины этих факторов индукции приведены в табл. 2-7. Таблица 2-7 Результаты показывают, что соединение 17 имеет максимальный фактор индукции 25 при 10 мкМ. Соединение 33 имеет максимальный фактор индукции 45,6 при 100 мкМ, и соединение 29 - 33,9 при 10 мкМ. Эти результаты демонстрируют, что испытанные соединения по изобретению обнаруживают активность лиганда PPAR, и, следовательно, дают возможность транскрипционной активации его. Фиг. 3-1, 3-2, 3-3, 3-4: оценка воздействия соединения 7 и соединения 17 на метаболизм триглицеридов и холестерина.Фиг. 3-1, 3-2, 3-3 и 3-4 иллюстрируют влияния обработки соединениями 7 и 17 на метаболизм триглицеридов и холестерина на трансгенных мышах Аро Е 2/Е 2. Животным давали путем кормления через желудочный зонд каждое соединение в дозе 200 мг/кг в течение 7 дней. Фиг. 3-1 и 3-2 иллюстрируют снижение концентраций в плазме триглицеридов и холестерина, вызываемое соединениями 7 и 17. Фиг. 3-3 и 3-4 показывают распределение триглицеридов и холестерина в липочастицах, оцениваемое вытеснительной хроматографией. Типичное распределение триглицеридов и холестерина наблюдается, главным образом, в липочастицах больших размеров. Можно также видеть, что обработка соединениями 7 и 17 уменьшает количество триглицеридов и холестерина в указанной субфракции липочастиц. Фиг. 3-5, 3-6, 3-7, 3-8 иллюстрируют влияния обработки соединением 29 по изобретению на метаболизм триглицеридов и холестерина на трансгенных мышах Аро Е 2/Е 2. Животным давали соединение- 15012699 29 в следующих дозах 200, 50, 12,5 и 3,15 мг/кг/сутки в течение 7 дней. Фиг. 3-5 и 3-6 иллюстрируют зависимое от дозы снижение концентраций в плазме триглицеридов и холестерина, причем снижение становится более значительным с увеличением доз соединения 29. Фиг. 3-7 и 3-8 показывают распределение триглицеридов и холестерина в липочастицах, оцениваемое вытеснительной хроматографией. Типичное распределение триглицеридов и холестерина наблюдается, главным образом, в липочастицах больших размеров. Снижение содержания триглицеридов и холестерина в указанной субфракции липочастиц также можно видеть. Фиг. 3-9 и 3-10 иллюстрируют воздействие соединений 33 и 41 по изобретению на метаболизм триглицеридов и холестерина на трансгенных мышах Аро Е 2/Е 2. Животным давали различные соединения в дозе 50 мг/кг/сутки в течение 8 дней. Фиг. 3-9 и 3-10 показывают снижение концентраций в плазме триглицеридов и холестерина, вызываемое соединениями 33 и 41. Фиг. 3-11 и 3-12 показывают распределение триглицеридов и холестерина в липочастицах, оцениваемое вытеснительной хроматографией. Типичное распределение триглицеридов и холестерина наблюдается, главным образом, в липочастицах больших размеров также, как снижение содержания триглицеридов и холестерина в указанной субфракции липочастиц под влиянием соединений 33 и 41. Другие аспекты и преимущества изобретения станут более явными в следующих примерах, которые даны для целей пояснения, а не для ограничения. Примеры Соединения по изобретению получают согласно обычным способам, охарактеризованным в общих чертах ниже. Описание общих способов синтеза по изобретению Синтез 1,3-дифенилпроп-2-ен-1-онов Общий способ 1. Синтез 1,3-дифенилпроп-2-ен-1-онов в кислотной среде. Кетон (1 экв.) и альдегид (1 экв.) растворяют в растворе этанола, насыщенном газообразной хлороводородной кислотой. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч и растворитель затем удаляют выпариванием в вакууме. 1,3-Дифенилпроп-2-ен-1-он очищают хроматографией на силикагеле. Общий способ 2. Синтез 1,3-дифенилпроп-2-ен-1-онов в среде основного характера. Кетон (1 экв.) и альдегид (1 экв.) растворяют в водно-спиртовом растворе гидроксида натрия(20 экв.). Смесь перемешивают при комнатной температуре в течение 18 ч. Среду подкисляют до pH 2 хлороводородной кислотой. 1,3-Дифенилпроп-2-ен-1-он получают осаждением или экстракцией в системе твердое/жидкость после выпаривания реакционной среды. Его очищают хроматографией на силикагеле или перекристаллизацией. Общий способ 3. Синтез замещенных 1,3-дифенилпроп-2-ен-1-онов в присутствии этилата натрия. Натрий (1 экв.) растворяют в абсолютном этаноле. Кетон (1 экв.) и альдегид (1 экв.) добавляют. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч и затем добавляют 2 н. гидроксид натрия (5 экв.). Смесь поддерживают при 100 С в течение 12 ч. Реакционную среду подкисляют добавлением 6 н. водного раствора хлороводородной кислоты. Растворитель удаляют выпариванием в вакууме. Остаток очищают хроматографией на силикагеле или перекристаллизацией. О-Алкилирование фенолов и S-алкилирование тиофенолов. Фенол (1 экв.) растворяют в ацетонитриле. Затем добавляют галогенированное производное(1-10 экв.) и карбонат калия (5 экв.). Реакционную среду энергично перемешивают при кипячении с возвращением флегмы в течение приблизительно 10 ч. Соли удаляют фильтрованием, растворитель и избыточный реагент удаляют выпариванием в вакууме и ожидаемый продукт очищают хроматографией на силикагеле. Кислотный гидролиз трет-бутиловых сложных эфиров Общий способ 5. трет-Бутиловый сложный эфир (1 экв.) растворяют в дихлорметане, добавляют трифторуксусную кислоту (10 экв.) и смесь перемешивают при комнатной температуре в течение 12 ч. Полученный продукт очищают хроматографией на силикагеле или перекристаллизацией. Синтез исходных материалов, используемых для синтеза соединений по изобретению Исходный материал 1: 2'-гидрокси-4'-(этоксикарбонилдиметилметокси)ацетофенон Указанное соединение синтезируют из 2',4'-дигидроксиацетофенона и этилбромизобутирата (1 экв.)- 17012699 согласно общему способу 4, описанному ранее. Его очищают хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 1,25 (т, J=7,17 Гц, 3 Н), 1,67 (с, 6 Н), 2,56 (с, 3 Н), 4,24 (кв, J=7,17 Гц, 2 Н),6,27 (д, J=2,55 Гц, 1 Н), 6,37 (дд, J=2,55 Гц, J=8,72 Гц, 1 Н), 7,62 (д, J=8,72 Гц, 1 Н), 12,6 (сигнал, 1 Н). Ссылка: патент США 3629290 (1970), Fisons Pharmaceutical. Исходный материал 2: 3-хлорфенилацетат(2 экв.). Смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель удаляют выпариванием в вакууме. Остаток после выпаривания забирают в дихлорметан, сушат на сульфате магния и растворитель удаляют выпариванием в вакууме. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). 1 Н ЯМР CDCl3 ч./млн: 2,29 (с, 3 Н), 6,99-7,33 (м, 4 Н). Исходный материал 3: 4'-хлор-2'-гидроксиацетофенон 3-Хлорфенилацетат (исходный материал 2) смешивают с хлоридом алюминия (3 экв.). Смесь нагревают при 200 С в течение 1 ч. Реакционную среду охлаждают до комнатной температуры, затем выливают в лед. Водную фазу экстрагируют метиленхлоридом, который сушат на сульфате магния, затем выпаривают в вакууме. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). 1 Н ЯМР CDCl3 ч./млн: 3,41 (с, 3 Н), 6,81 (дд, J=8,82 Гц, J=1,47 Гц, 1 Н), 6,91 (д, J=1,47 Гц, 1 Н), 7,60 Указанное соединение синтезируют из 4-гидроксибензальдегида и этилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Указанное соединение синтезируют из 3,5-диметилокси-4-гидроксибензальдегида и этилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: 1,33 (т, J=7,29 Гц, 3 Н), 1,50 (с, 6 Н), 3,84 (с, 6 Н), 4,27 (кв, J=7,29 Гц, 2 Н),7,08 (с, 2 Н), 9,86 (с, 1 Н). Исходный материал 6: 3,5-диметил-4-этилоксикарбонилдиметилметилоксибензальдегид Указанное соединение синтезируют из 3,5-диметил-4-гидроксибензальдегида и этилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). Указанное соединение синтезируют из 3-гидроксибензальдегида и этилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 1,24 (т, J=7,27 Гц, 3 Н), 1,62 (с, 6 Н), 4,25 (кв, J=7,27 Гц, 2 Н), 7,11 (м, 1 Н),7,31 (м, 1 Н), 7,40 (т, J=8,19 Гц, 1 Н), 7,49 (м, 1 Н), 9,93 (с, 1 Н). Исходный материал 8: 4-этилоксикарбонилдиметилметилтиобензальдегид 4-Метилтиобензальдегид (1 экв.) растворяют в метиленхлориде и раствор охлаждают до 0 С. Метахлорпербензойную кислоту (1,5 экв.) добавляют небольшими фракциями. Реакцию сопровождают тонкослойной хроматографией. Дополнительную метахлорпербензойную кислоту необязательно добавляют так, чтобы достичь полного исчезновения исходного продукта. Осадок удаляют фильтрованием. Гидроксид кальция (1,5 экв.) добавляют и смесь перемешивают еще 15 мин. Твердое вещество удаляют фильтрованием, фильтрат сушат на сульфате магния и метиленхлорид затем удаляют выпариванием в вакууме. Остаток после выпаривания забирают в уксусный ангидрид, затем нагревают при кипячении с возвращением флегмы в течение 30 мин и выпаривают до сухости. Остаток забирают в раствор метанол/триэтиламин, перемешивают при комнатной температуре в течение 15 мин, затем растворители удаляют выпариванием в вакууме. Маслянистый остаток забирают в насыщенный водный раствор хлорида аммония, затем экстрагируют метиленхлоридом. Органическую фазу сушат на сульфате магния и выпаривают в вакууме. Полученное промежуточное соединение 4-меркаптобензальдегид используют без дополнительной очистки. Его алкилируют согласно общему способу 4, чтобы получить 4-этилоксикарбонилдиметилметилтиобензальдегид. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 1,22 (т, J=7,46 Гц, 3 Н), 2,60 (с, 6 Н), 4,15 (кв, J=7,46 Гц, 2 Н), 7,53 (д, J=8,38 Гц, 2 Н), 7,88 (д, J=8,39 Гц, 2 Н), 9,99 (с, 1 Н). Ссылка: Young N.R., Gauthier J.Y., Coombs W. (1984). Tetrahedron Letters 25(17): 1753-1756. Исходный материал 9: 4'-этилоксикарбонилдиметилметилоксиацетофенон. Указанное соединение синтезируют из 4'-гидроксиацетофенона и этилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 1,17 (т, J=5,64 Гц, 3 Н), 1,61 (с, 6 Н), 2,50 (с, 3 Н), 4,18 (кв, J=5,64 Гц, 2 Н),6,78 (д, J=8,82 Гц, 2 Н), 7,83 (д, J=8,81 Гц, 2 Н). Исходный материал 10: 3-бромфенилацетат 3-Бромфенол растворяют в дихлорметане. Триэтиламин (1 экв.) и уксусный ангидрид (2 экв.) добавляют и смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель удаляют выпариванием в вакууме. Остаток после выпаривания забирают в дихлорметан, затем сушат на сульфате магния. Растворитель удаляют выпариванием в вакууме.- 19012699 Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). 3-Бромфенилацетат (исходный материал 10) смешивают с хлоридом алюминия (3 экв.) и смесь нагревают при 200 С в течение 1 ч. Реакционную среду охлаждают до комнатной температуры, затем выливают в лед. Водную фазу экстрагируют метиленхлоридом, который сушат на сульфате магния. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). 1 4'-Метилтиоацетофенон растворяют в метиленхлориде и раствор охлаждают до 0 С. Метахлорпербензойную кислоту (1,5 экв.) добавляют небольшими фракциями. Реакцию сопровождают тонкослойной хроматографией. Дополнительную метахлорпербензойную кислоту необязательно добавляют так, чтобы достичь полного исчезновения исходного продукта. Осадок удаляют фильтрованием. Гидроксид кальция(1,5 экв.) добавляют и смесь перемешивают еще 15 мин. Твердое вещество удаляют фильтрованием,фильтрат сушат на сульфате магния и метиленхлорид затем удаляют выпариванием в вакууме. Остаток после выпаривания забирают в уксусный ангидрид, затем нагревают при кипячении с возвращением флегмы в течение 30 мин и выпаривают до сухости. Остаток забирают в раствор метанол/триэтиламин, перемешивают при комнатной температуре в течение 15 мин, затем растворители удаляют выпариванием в вакууме. Маслянистый остаток забирают в насыщенный водный раствор хлорида аммония, затем экстрагируют метиленхлоридом. Органическую фазу сушат на сульфате магния, затем выпаривают в вакууме. Полученное промежуточное соединение 4-меркаптоацетофенон используют без дополнительной очистки. Его алкилируют согласно общему способу 4, чтобы получить 4-этилоксикарбонилдиметилметилтиоацетофенон. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). Ссылка: Young N.R., Gauthier J.Y., Coombs W. (1984). Tetrahedron Letters 25 (17): 1753-1756. 1H ЯМР CDCl3 ч./млн: 1,21 (т, J=7,32 Гц, 3 Н), 1,51 (с, 6 Н), 2,59 (с, 3 Н), 4,12 (кв, J=7,32 Гц, 2 Н),7,51 (д, J=8,40 Гц, 2 Н), 7,79 (д, J=8,40 Гц, 2 Н). Синтез промежуточных соединений, используемых для синтеза соединений по изобретению Промежуточное соединение 1: 1-[4-хлорфенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 4-хлорацетофенона и 3,5-диметил-4-гидроксибензальдегида,согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 95:5). 1 Н ЯМР CDCl3 ч./млн: 2,30 (с, 6 Н), 7,32 (с, 2 Н), 7,34 (д, J=15,25 Гц, 1 Н), 7,47 (д, J=8,86 Гц, 2 Н),7,75 (д, J=15,26 Гц, 1 Н), 7,97 (д, J=8,86 Гц, 2 Н). Промежуточное соединение 2: 1-[4-метилтиофенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1 он Указанное соединение синтезируют из 4'-метилтиоацетофенона гидроксибензальдегида, согласно общему способу 1, описанному ранее. 3,5-диметил-4 012699 Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 8:2). Указанное соединение синтезируют из 2'-метоксиацетофенона и 3,5-диметил-4 гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 8:2). 1 Н ЯМР ДМСОч./млн: 2,39 (с, 6 Н), 2,22 (с, 6 Н), 7,58 (с, 2 Н), 7,67-7,62 (м, 3 Н), 7,82 (д, J=15,5 Гц,1 Н), 8,17 (д, 1 Н), 12,96 (с, 1 Н). Промежуточное соединение 4: 1-[4-гексилоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен 1-он Указанное соединение синтезируют из 4-гексилоксиацетофенона и 3,5-диметил-4 гидроксибензальдегида, согласно общему способу 1, описанному ранее. Ожидаемое соединение осаждается в реакционной среде, его сушат и используют без дополнительной очистки для следующей реакции. 1 Н ЯМР ДМСОч./млн: 0,88 (м, 3 Н), 1,28-1,43 (м, 6 Н), 1,72 (м, 2 Н), 2,21 (с, 6 Н), 4,05 (т, J=6,42 Гц,2 Н), 7,40 (д, J=8,43 Гц, 2 Н), 7,48 (с, 2 Н), 7,57 (д, J=15,24 Гц, 1 Н), 7,72 (д, J=15,24 Гц, 1 Н), 8,12 (д, J=8,43 Гц, 2 Н), 8,89 (с, 1 Н). Промежуточное соединение 5: 1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметил-4-гидроксифенил]проп 2-ен-1-он Указанное соединение синтезируют из 4'-хлор-2'-гидроксиацетофенона (исходный материал 3) и 3,5-диметил-4-гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (толуол:10). 1 Указанное соединение синтезируют из 1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметил-4 гидроксифенил]проп-2-ен-1-она (промежуточное соединение 5), согласно следующему способу: 1-[2-гидрокси-4-хлорфенил]-3-[3,5-диметил-4-гидроксифенил]проп-2-ен-1-он растворяют в диметилсульфоксиде, добавляют кристалл йода и смесь поддерживают при кипячении с возвращением флегмы в течение 10 мин. Реакционную среду доводят до комнатной температуры, гидролизуют. Осадок сушат, промывают раствором тиосульфата натрия, затем водой. Очистку проводят растворением в метиленхлориде и осаждением добавлением гептана. Указанное соединение синтезируют из 4'-хлор-2'-метоксиацетофенона и 3,5-диметил-4 гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 85:15). 1 Указанное соединение синтезируют из 4'-бромацетофенона и 3,5-диметил-4 гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 85:15). 1 Указанное соединение синтезируют из 4'-гептилацетофенона и 3,5-диметил-4 гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 85:15). 1H ЯМР ДМСОч./млн: 0,84 (м, 3 Н), 1,25 (м, 8 Н), 1,60 (м, 2 Н), 2,21 (с, 6 Н), 2,65 (т, J=7,50 Гц, 2 Н),7,35 (д, J=8,02 Гц, 2 Н), 7,48 (с, 2 Н), 7,60 (д, J=15,48 Гц, 1 Н), 7,71 (д, J=15,48 Гц, 1H), 8,05 (д, J=8,02 Гц,2H), 8,92 (с, 1 Н). Синтез соединений по изобретению Соединение 1: 1-[2-гидрокси-4-этоксикарбонилдиметилметилоксифенил]-3-[3,5-ди-трет-бутил-4 гидроксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 2'-гидрокси-4'-(этоксикарбонилдиметилметокси)ацетофенона (исходный материал 1) и 3,5-ди-трет-бутил-4-гидроксибензальдегида, согласно общему способу 1, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Указанное соединение синтезируют из 1-[2-гидрокси-4-этоксикарбонилдиметилметилоксифенил]-3[3,5-ди-трет-бутил-4-гидроксифенил]проп-2-ен-1-она (соединение 1), согласно следующему способу. Сложный эфир растворяют в этаноле, добавляют водный 1 н. раствор гидроксида натрия (5 экв.) и смесь поддерживают при кипячении с возвращением флегмы в течение 10 ч. Среду подкисляют добавлением 12 н. хлороводородной кислоты, затем экстрагируют этилацетатом. Органическую фазу сушат на сульфате магния, затем выпаривают в вакууме. Очистку проводят препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода-метанол-трифторуксусная кислота: 22:78:0,1). 1 Указанное соединение синтезируют из 2'-гидрокси-4'-хлорацетофенона и 4-этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 9), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Указанное соединение синтезируют из 2'-гидроксиацетофенона и 4-этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 4), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР ДМСОч./млн: 1,58 (с, 6 Н), 6,88 (д, 2 Н), 7,01 (м, 2 Н), 7,57 (т, 1 Н), 7,81 (д, J=15,5 Гц, 1 Н),7,87 (д, 2 Н), 7,93 (д, J=15,5 Гц, 1 Н), 8,26 (д, 1 Н), 12,69 (с, 1 Н). МС (ES-MC): 325,1 (М-1). Соединение 5: 1-[2-гидроксифенил]-3-[3,5-диметокси-4-карбоксидиметилметилоксифенил]проп-2 ен-1-он Указанное соединение синтезируют из 2'-гидроксиацетофенона и 3,5-диметилокси-4 этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 5), согласно общему способу 2,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР ДМСОч./млн: 1,35 (с, 6 Н), 3,80 (с, 6 Н), 7,00-7,03 (м, 2 Н), 7,25 (с, 2 Н), 7,59 (т, 1H, J=8,07 Гц, 1 Н), 7,81 (д, J=15,5 Гц, 1 Н), 8,00 (д, J=15,5 Гц, 1 Н), 8,31 (д, J= 8,07 Гц, 1 Н), 12,36 (с, 1 Н), 12,69 (с, 1 Н). Указанное соединение синтезируют из 2'-гидрокси-4'-хлорацетофенона (исходный материал 3) и 3,5-диметилокси-4-этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 5), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР ДМСОч./млн: 1,34 (с, 6 Н), 3,80 (с, 6 Н), 7,08 (дд, J=1,77 Гц, 1 Н), 7,12 (д, J=1,77 Гц, 1 Н),7,24 (с, 2 Н), 7,79 (д, J=15,4 Гц, 1 Н), 7,93 (д, J=15,4 Гц, 1 Н), 8,27 (д, J=8,3 Гц, 1 Н), 12,36 (с, 1 Н), 12,69 (с,1 Н). Указанное соединение синтезируют из 2'-гидрокси-4'-хлорацетофенона (исходный материал 3) и 3,5-диметил-4-этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 6), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР ДМСОч./млн: 1,39 (с, 6 Н), 2,22 (с, 6 Н), 7,07 (м, 1 Н), 7,12 (д, J=2,07 Гц, 1 Н), 7,61 (с, 2 Н),7,74 (д, J=15,5 Гц, 1 Н), 7,87 (д, J=15,5 Гц, 1 Н), 8,26 (д, 1 Н), 12,76 (с, 1 Н). MC (ES-MS): 387,1 (M-1). Соединение 8: 1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[3,5-дибром-4-гидроксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 2'-гидрокси-4'-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 1) и 3,5-дибром-4-гидроксибензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 1,60 (с, 6 Н), 6,24 (д, J=2,47 Гц, 1 Н), 6,43 (дд, J=2,47 Гц, J=8,52 Гц, 1 Н), 7,70 Указанное соединение синтезируют из 2'-гидроксиацетофенона и 3-этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 7), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). Указанное соединение синтезируют из 2'-гидрокси-4'-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 1) и 3-гидроксибензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). 1 Н ЯМР ДМСОч./млн: 1,60 (с, 6 Н), 6,25 (д, J=2,47 Гц, 1 Н), 6,43 (дд, J=2,47 Гц, 9,09 Гц, 1 Н), 6,89 Указанное соединение синтезируют из 2'-гидроксиацетофенона и 3,5-диметил-4 этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 6), согласно общему способу 2,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат: 9/1) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Н ЯМР ДМСОч./млн: 1,57 (с, 6 Н), 2,31 (с, 6 Н), 6,96 (т, J=8,17 Гц, 1 Н), 7,04 (д, J=8,72 Гц, 1 Н),7,35 (с, 2 Н), 7,49 (т, J=8,2 Гц, 1 Н), 7,58 (д, J=15,8 Гц,1 Н), 7,84 (д, J=15,8 Гц, 1 Н), 7,94 (д, J=8,7 Гц, 1 Н),12,87 (с, 1 Н). МС (ES-MS): 353,1 (М-1). Соединение 12: 1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-метилтиофенил]проп-2-ен 1-он Указанное соединение синтезируют из 2'-гидрокси-4'-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 1) и 4-метилтиобензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9/1) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,3). 1 Н ЯМР ДМСОч./млн: 1,60 (с, 6 Н), 2,54 (с, 3 Н), 6,25 (д, 1 Н), 6,43 (дд, J=2,47 Гц, 1 Н), 7,33 (д,J=8,56 Гц, 2 Н), 7,8 (д, 15,5 Гц, 1 Н), 7,86 (д, J=8,56 Гц, 2 Н), 7,98 (д, J=15,5 Гц, 1 Н), 8,29 (д, J=9,1 Гц, 1 Н),13,34 (с, 1 Н). МС (ES-MS): 373,1 (М-1). Соединение 13: 1-[2,4-дигидроксифенил]-3-[4-карбоксидиметилметилоксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 2',4'-дигидроксиацетофенона и 4-этоксикарбонилдиметилметилоксибензальдегида (исходный материал 4), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9/1) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 34/66/0,1). 1 Указанное соединение синтезируют из 4'-гидроксиацетофенона и 4-этоксикарбонилдиметилметилоксибензальдегида (исходный материал 4), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 34/66/0,1). 1 Н ЯМР ДМСОч./млн: 1,56 (с, 6 Н), 6,85 (д, J=8,63 Гц, 2 Н), 6,90 (д, J=9,21 Гц, 2 Н), 7,63 (д, J=15,54 Гц, 1 Н), 7,78 (м, 3 Н), 8,05 (д, J=8,61 Гц, 2 Н), 10,40 (с, 1 Н), 13,22 (с, 1 Н). МС (MALDI-TOF): 327,1 (М+1). Соединение 15: 1-[4-хлорфенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 1-[4-хлорфенил]-3-[3,5-диметил-4-гидроксифенил]проп-2 ен-1-она (промежуточное соединение 1) и изопропилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9/1). 1 Указанное соединение синтезируют из 1-[4-хлорфенил]-3-[3,5-диметил-4-гидроксифенил]проп-2 ен-1-она (промежуточное соединение 1) и трет-бутилбромизобутирата, согласно общему способу 4, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9/1). Соединение 17: 1-[4-хлорфенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен-1- 26012699 он Указанное соединение синтезируют из 1-[4-хлорфенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она (соединение 16), согласно общему способу 5, описанному ранее. Очистку проводят хроматографией на силикагеле(элюирование: дихлорметан/метанол 98/2). 1 Н ЯМР ДМСОч./млн: 1,39 (с, 6 Н), 2,22 (с, 6 Н), 7,58 (с, 2 Н), 7,67-7,62 (м, 3 Н), 7,82 (д, J=15,5 Гц,1 Н), 8,17 (д, 1 Н), 12,96 (с, 1 Н). МС (MALDI-TOF): 373,3 (М+1). Соединение 18: 1-[2-гидрокси-4-карбоксидиметилметилоксифенил]-3-[4-хлорфенил]проп-2-ен-1-он Указанное соединение синтезируют из 2'-гидрокси-4'-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 1) и 4-хлорбензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Н ЯМР ДМСОч./млн: 1,60 (с, 6 Н), 6,25 (д, J=2,47 Гц, 1 Н), 6,45 (дд, J=2,47 Гц, J=9,12 Гц, 1 Н), 6,55 Указанное соединение синтезируют из 2'-гидроксиацетофенона и этилоксикарбонилдиметилметилтиобензальдегида (исходный материал 8), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95/5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4'-хлор-2'-гидроксиацетофенона (исходный материал 3) и 4 этилоксикарбонилдиметилметилтиобензальдегида (исходный материал 8), согласно общему способу 2,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с по- 27012699 следующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Н ЯМР ДМСОч./млн: 1,43 (с, 6 Н), 7,05 (дд, J=1,7 Гц, J=8,46 Гц, 1 Н), 7,11 (д, J=2,25 Гц, 1 Н), 7,51 Указанное соединение синтезируют из 4-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 9) и 3,5-диметил-4-гидроксибензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4'-метилтиоацетофенона (исходный материал 12) и 4 этилоксикарбонилдиметилметилоксибензальдегида (исходный материал 9), согласно общему способу 2,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 9) и 4-хлорбензальдегида, согласно общему способу 3, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4-этилоксикарбонилдиметилметилтиоацетофенона (исход- 28012699 ный материал 12) и 4-метилтиобензальдегида, согласно общему способу 3, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4'-бром-2'-гидроксиацетофенона (исходный материал 11) и 3,5-диметил-4-этилоксикарбонилдиметилоксибензальдегида (исходный материал 6), согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Указанное соединение синтезируют из 4'-этилоксикарбонилдиметилметилоксиацетофенона (исходный материал 9) и 4-метилтиобензальдегида, согласно общему способу 2, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол: 95:5) с последующей препаративной ВЭЖХ (обращенная фаза RP18, Microspher 12 мкм, элюирование: вода/метанол/трифторуксусная кислота: 22/78/0,1). 1 Н ЯМР ДМСОч./млн: 1,60 (с, 6 Н), 2,53 (с, 3 Н), 6,93 (д, J=9,00 Гц, 2 Н), 7,32 (д, J=8,49 Гц, 2 Н),7,68 (д, J=15,51 Гц, 1 Н), 7,82 (д, J=8,52 Гц, 2 Н), 7,89 (д, J=15,51 Гц, 1 Н), 8,13 (д, 9,00 Гц, 2 Н), 13,30 (с,1 Н). МС (MALDI-TOF): 355,0 (М+1). Соединение 27: 1-[4-метилтиофенил]-3-[3,5-диметил-4-трет-бутилоксикарбонилдиме тилме тилоксифенил]проп-2-ен-1-он Указанное соединение синтезируют из 1-[4-метилтиофенил]-3-[3,5-диметил-4-гидроксифенил]проп 2-ен-1-она (промежуточное соединение 2) и трет-бутилбромизобутирата, согласно общему способу 4,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 8/2). Соединение 28: 1-[4-метилтиофенил]-3-[3,5-диметил-4-изопропилоксикарбонилдиметилметилоксиенил]проп-2-ен-1-он Указанное соединение синтезируют из 1-[4-метилтиофенил]-3-[3,5-диметил-4-гидроксифенил]проп 2-ен-1-она (промежуточное соединение 2) и изопропилбромизобутирата, согласно общему способу 4,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9/1). 1 Н ЯМР ДМСОч./млн: 1,25 (д, J=6,18 Гц, 6 Н), 1,39 (с, 6 Н), 2,18 (с, 6 Н), 2,57 (с, 3 Н), 4,99 (септ,J=6,18 Гц, 1 Н), 7,40 (д, J=8,28 Гц, 2 Н), 7,58 (с, 2 Н), 7,62 (д, J=15,5 Гц, 1 Н), 7,82 (д, 3 = 15,5 Гц, 1 Н), 8,10 Указанное соединение синтезируют из 1-[4-метилтиофенил]-3-[3,5-диметил-4-третбутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она (соединение 28), согласно общему способу 5, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 98/2). 1 Н ЯМР ДМСОч./млн: 1,39 (с, 6 Н), 2,22 (с, 6 Н), 2,57 (с, 3 Н), 7,40 (д, J=8,55 Гц, 2 Н), 7,57 (с, 2 Н),7,62 (д, J=15,5 Гц, 1 Н), 7,83 (д, J=15,5 Гц, 1 Н), 8,10 (д, J=8,55 Гц, 2 Н), 12,97 (с, 1 Н). Указанное соединение синтезируют из 1-[2-метоксифенил]-3-[3,5-диметил-4-гидроксифенил]проп 2-ен-1-она (промежуточное соединение 3) и трет-бутилбромизобутирата, согласно общему способу 4,описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: циклогексан/этилацетат 9:1). Соединение 31: 1-[2-метоксифенил]-3-[3,5-диметил-4-карбоксидиметилметилоксифенил]проп-2-ен 1-он Указанное соединение синтезируют из 1-[2-метоксифенил]-3-[3,5-диметил-4-третбутилоксикарбонилдиметилметилоксифенил]проп-2-ен-1-она (соединение 30), согласно общему способу 5, описанному ранее. Очистку проводят хроматографией на силикагеле (элюирование: дихлорметан/метанол 98/2). 1 Н ЯМР ДМСОч./млн: 1,38 (с, 6 Н), 2,19 (с, 6 Н), 3,93 (с, 3 Н), 7,05 (м, 1 Н), 7,20 (д, J=8,31 Гц, 1 Н),7,25 (д, J=15,5 Гц, 1 Н), 7,37 (д, J=15,5 Гц, 1 Н), 7,39 (с, 2 Н), 7,46 (д, J=7,2 Гц, 1 Н), 7,53 (м, 1 Н), 12,93 (с,1 Н).
МПК / Метки
МПК: C07C 323/09, C07C 59/88, C07C 69/712, C07C 251/48, C07C 59/90, C07C 67/00, C07C 51/00, C07C 281/00, C07C 69/67, C07C 59/84, C07C 323/63
Метки: 1,3-дифенилпроп-2-ен-1-она, основе, применение, замещенных, производных, композиция
Код ссылки
<a href="https://eas.patents.su/30-12699-kompoziciya-na-osnove-zameshhennyh-proizvodnyh-13-difenilprop-2-en-1-ona-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция на основе замещенных производных 1,3-дифенилпроп-2-ен-1-она и ее применение</a>
Предыдущий патент: Устройство и способ для удаления меркаптанов из сырьевых газов
Следующий патент: Фенилацетамиды и их применение в качестве модуляторов глюкокиназы
Случайный патент: Легкая головка крепежного средства, обеспечивающая улучшение сборки