Имидазопиридазиновые соединения
Номер патента: 12393
Опубликовано: 30.10.2009
Авторы: Такакува Такако, Лу Цзяньлян, Коллинз Элизабет Аарон, Томпсон Ричард Крейг, Амдоучи Чафик, Джонстон Ричард Дуэйн, Хембр Эрик Джеймс, Барбоса Хитер Джанелль, Хипскинд Филип Артур, Рупп Майкл Джон
Формула / Реферат
1. Соединение формулы I
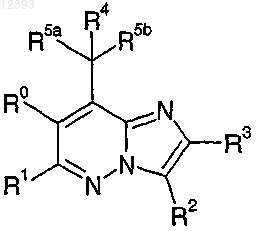
где R0 представляет собой водород, галоген, метил или этил;
R1 и R3 независимо представляют собой метил, метокси или трифторметил;
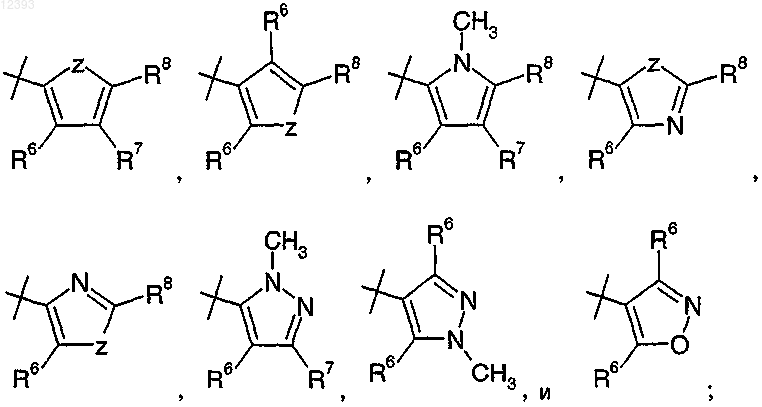
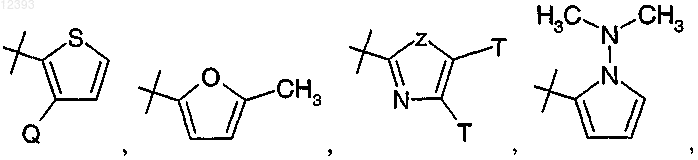
R2 выбирают из группы, включающей
R4 представляет собой водород, галоген или гидрокси;
R5a и R5b независимо представляют собой этил или н-пропил;
R6 в каждом случае независимо представляет собой водород, галоген, циано, (C1-C4)алкил, трифторметил, метокси или фенил;
R7 представляет собой водород, галоген, метил, метокси, диметиламино,
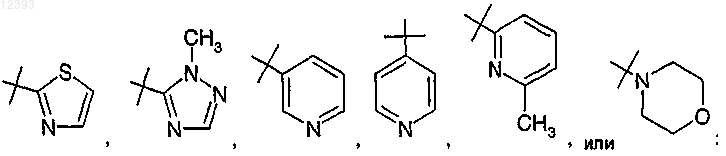
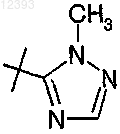
R8 выбирают из группы, включающей водород, галоген, циано, (C1-C4)алкил, RaRbN-, карбамил, (C1-С2)алкокси(C1-С2)алкил, R11-С(O)-,

R11 представляет собой метокси, метиламино, диметиламино или фенил;
R12 представляет собой водород, галоген, метил, этил, трифторметил, метокси, трифторметокси, диметиламино, ацетил или метилсульфонил;
R13 представляет собой водород, метил или галоген;
R14 представляет собой водород или гидрокси;
R15 представляет собой метилтио, циклопропил, фенил,
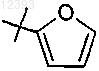 или
или 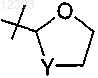
Ra представляет собой водород, (С1-С5)алкил, (С3-C5)циклоалкил, метокси(С2-С4)алкил, ацетил, (C1-С2)алкилсульфонил, (С3)алкенил, R15-(CH2)n- или (C1-С2)алкил, замещенный циано, формилом, винилом или этинилом;
Rb представляет собой водород или (C1-С3)алкил;
X представляет собой -СН2-, -СО-, -O-, -S- или -SO2-;
Y представляет собой -СН2- или -O-;
z представляет собой S или О;
n обозначает 1 или 2;
Q представляет собой водород или метил;
Т представляет собой водород или метил;
J представляет собой метил, трифторэтил или трет-бутил и
М представляет собой метил или галоген;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где R0 и R4 представляют собой водород, R1 и R3 представляют собой метил и R5a и R5b представляют собой этил.
3. Соединение по любому из пп.1-2, где R2 представляет собой
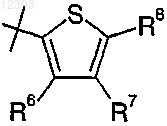 или
или 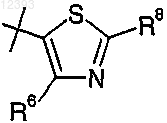
4. Соединение по любому из пп.1-3, где R8 представляет собой
 или
или 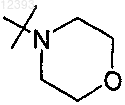
5. Соединение, представляющее собой N-{4-хлор-5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]тиазол-2-ил}морфолин или его фармацевтически приемлемую соль.
6. Соединение, представляющее собой гидрохлоридную соль N-{4-хлор-5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]тиазол-2-ил}морфолина.
7. Соединение, представляющее собой 3-[4-бром-2-(2-метил-2Н-[1,2,4]триазол-3-ил)тиазол-5-ил]-8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин или его фармацевтически приемлемую соль.
8. Соединение, представляющее собой 3-[4-хлор-2-(2-метил-2Н-[1,2,4]триазол-3-ил)тиазол-5-ил]-8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин или его фармацевтически приемлемую соль.
9. Соединение, представляющее собой 3-[3-хлор-5-(2-метил-2Н-[1,2,4]триазол-3-ил)тиофен-2-ил]-8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин или его фармацевтически приемлемую соль.
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент.
11. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в терапии.
12. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли для лечения симптомов отмены алкоголя или алкогольной зависимости.
Текст
012393 Область изобретения Настоящее изобретение относится к новым замещенным имидазо[1,2-b]пиридазиновым соединениям, фармацевтическим композициям на их основе и применению таких соединений в качестве антагонистов рецепторов фактора 1 высвобождения кортикотропина (CRF1) при лечении психиатрических расстройств и неврологических заболеваний. Предпосылки создания изобретения Фактор высвобождения кортикотропина (CRF), представляющий собой пептид, содержащий 41 аминокислоту, является основным физиологическим регулятором секреции пептидов аденогипофизом под действием проопиомеланокортина (РОМС) J. Rivier et al., Proc. Natl. Acad. Sci (USA) 80:4851 (1983);W. Vale et al., Science 213:1394 (1981)]. Иммуногистохимическая локализация CRF свидетельствует о том, что помимо выполнения эндокринной функции в гипофизе, этот гормон характеризуется широким распространением в центральной нервной системе вне гипоталамуса и оказывает целый ряд автономных,электрофизиологических и поведенческих воздействий, сопоставимых с ролью нейротрансмиттера или нейромодулятора в мозге [W. Vale et al., Rec. Prog. Horm. Res. 39:245 (1983); G.F. Koob, Persp. Behav.Med. 2:39 (1985); E.B. De Souza et al., J. Neurosci. 5:3189 (1985)]. Кроме того, известно, что CRF играет важную роль в реакции иммунной системы на физиологические, психологические и иммунологические стрессогенные факторы [J.E. Blalock, Physiological Reviews 69:1 (1989); J.E. Morley, Life Sci. 41:527(1987)]. Известно, что CRF имеет отношение к психиатрическим расстройствам и неврологическим заболеваниям, включая депрессию, расстройства, вызванные тревогой, и расстройства питания. Роль CRF также постулирована в этиологии и патофизиологии болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, прогрессирующего супрануклеарного паралича и болезни Шарко, так как все эти заболевания связаны с дисфункцией нейронов CRF в центральной нервной системе [для обзора см. Е.В. De Souze,Hosp. Practice 23:59 (1988)]. Кроме того, известно, что CRF имеет широкое распространение в ЦНС вне гипоталамуса, способствуя целому ряду автономных поведенческих и физиологических воздействий[см., например, Vale et al., 1983; Koob, 1985; и Е.В. De Souze et al., 1985]. Например, концентрации CRF существенно увеличиваются в спинномозговой жидкости у пациентов, страдающих от эмоционального расстройства или глубокой депрессии [СВ. Nemeroff et al., Science 226:1342 (1984); CM. Banki et al., Am.J. Psychiatry 144:873 (1987); R.D. France et al., Biol. Psychiatry 28:86 (1988); M. Arato et al., Biol. Psychiatry 25:355 (1989)]. Кроме того, известно, что чрезмерные уровни CRF оказывают анксиогенные воздействия в животных моделях [см., например, Britton et al., 1982; Berridge and Dunn, 1986 and 1987]. Плотность рецепторов CRF в передней части коры головного мозга значительно понижена у жертв суицида, что сопоставимо с гиперсекрецией CRF [СВ. Nemeroff et al., Arch. Gen. Psychiatry 45:577(1988)]. Помимо этого, у субъектов, страдающих от депрессии, наблюдается плохо выраженная реакция адренокортикотропина (АСТН) на CRF (внутривенное введение) [P.W. Gold et al., Am. J. Psychiatry 141:619 (1984); F. Holsboer et al., Psychoneuroendocrinology 9:147 (1984); P.W. Gold et al., New Engl. J.Med. 314:1129 (1986)]. Доклинические исследования на крысах и нечеловеческих приматах также подтверждают гипотезу о том, что гиперсекреция CRF может быть одним из симптомов депрессии у человека [R.M. Sapolsky, Arch. Gen. Psychiatry 46:1047 (1989)]. Существуют предварительные данные, свидетельствующие о том, что трициклические антидепрессанты могут изменять уровни CRF и, таким образом, модулировать количество рецепторов в мозге [Grigoriadis et al., Neuropsychopharmacology 2:53(1989)]. В результате проведения исследований по нейрохимическому и эндокринному связыванию, а также связыванию с рецепторами было продемонстрировано взаимодействие между CRF и бензодиазепиновыми анксиолитиками, что далее свидетельствует об участии CRF в этих расстройствах. Хлордиазепоксид ослабляет "анксиогенное" действие CRF, как в испытании с созданием конфликтной ситуации [K.Т. Britton et al., Psychopharmacology 86:170 (1985); K.Т. Britton et al., Psychopharmacology 94:306 (1988)], так и в испытании на акустический испуг [N.R. Swerdlow et al., Psychopharmacology 88:147 (1986)], которые выполняли с использованием крыс. Бензодиазепиновый антагонист рецепторов Ro15-1788, который не вызывал поведенческой активности в испытании с созданием оперантной конфликтной ситуации, ослаблял действие CRF в зависимости от дозы, в то время как бензодиазепиновый обратный агонист FG 7142 усиливал действие CRF [K.Т. Britton et al., Psychopharmacology 94:396 (1988)]. Предварительные исследования с использованием мнимого антагониста рецепторов CRF, в частности -спирального CRF овцы (941), в ряде поведенческих парадигм показывают, что этот антагонист оказывает действие, "подобное анксиолитику",- которое в качественном отношении схоже с действием бензодиазепинов [C.W. Berridgeand A.J. Dunn, Horm. Behav. 21:393 (1987), Brain Research Reviews 15:71 (1990)]. Были идентифицированы подтипы рецепторов CRF, CRF1 и CRF2, и они неоднородно распространены в мозге [D.T. Chalmers et al., TIPS 17:166-72 (1996)], таким образом, предполагая потенциальную функциональную разновидность [S.C. Heinrichs et al., Regul. Peptides 71:15 (1997)]. Например, широко распространенные рецепторы CRF1 в мозге интенсивно вовлечены в эмоциональность, сопровождающую воздействие стрессогенных факторов окружающей среды [G. Liebsch et al., Regul. Peptides 59: 22939 (1995); D.W. Schulz, PNAS 93: 10477-82 (1996)]. Существенно, обнаружено, что рецепторы CRF1, неCRF2, опосредствуют выбранные анксиогенно-подобные поведения [Heinrichs et al., 1997]. Более дискретное распространение в перегородке/гипоталлусе [D.T. Chalmers et al., J. Neurosci. 15(10): 6340-50(1995)] и наличие альтернативных эндогенных лигандов [J. Vaughan et al., Nature 378: 287-92 (1995)] предлагают совершенно другую функциональную роль для рецептора CRF2 [Heinrichs et al., 1997]. Например, описано, что новые нейропептиды семейства CRF с предпочтительным сродством с рецепторамиCRF2 относительно CRF1 подавляют аппетит, не создавая профиль поведенческой активации, наблюдаемый при селективном агонизме CRF1 (Н. Tezval et al., PNAS 101(25): 9468-9473 (2004)]. Во многих случаях агонизм CRF2 порождает эффекты, подобные эффектам, описанным для антагонистов CRF1 или для делеции гена CRF1 [S.C. Heinrichs, Trends in Pharmacological Sciences 20(8):311-5 (1999)]. Наряду с тем, что агонисты CRF2 были предложены как средства против ожирения, антагонисты CRF1 также могут быть полезными для лечения ожирения [С. Contoreggi et al., Neuroendocrinology 80(2):111-23 (2004)]. Принимая во внимание вышеизложенное, эффективные и селективные антагонисты CRF1 полезны в качестве потенциально ценных терапевтических средств для лечения психиатрических расстройств и неврологических заболеваний. Поэтому, остается потребность в открытии новых антагонистов CRF1. Краткое описание сути изобретения Соединения согласно настоящему изобретению включают антагонисты рецепторов CRF1. Одно осуществление настоящего изобретения представляет собой соединение формулы IR1 и R3 независимо представляют собой метил, метокси или трифторметил;R5a и R5b независимо представляют собой этил или н-пропил;R6 в каждом случае независимо представляет собой водород, галоген, циано, (C1-C4)алкил, трифторметил, метокси или фенил;R14 представляет собой водород или гидрокси;Rb представляет собой водород или (C1-С 3)алкил;Q представляет собой водород или метил; Т представляет собой водород или метил;J представляет собой метил, трифторэтил или трет-бутил и М представляет собой метил или галоген; и его фармацевтически приемлемые соли. Другое осуществление настоящего изобретения представляет собой соединение формулы I, где R0 и 4R представляют собой водород, R1 и R3 представляют собой метил, и R5a и R5b представляют собой этил. Еще одно осуществление настоящего изобретения представляет собой соединение формулы I, где где z представляет собой S. Дальнейшее осуществление настоящего изобретения представляет собой соединение формулы I,где R7 представляет собой водород. Другое осуществление настоящего изобретения представляет собой соединение формулы I, где R6 представляет собой галоген или метил. Еще одно осуществление настоящего изобретения представляет собой соединение формулы I, где где X представляет собой О. Другое осуществление настоящего изобретения представляет собой фармацевтическую композицию, которая содержит соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент. Еще одно осуществление настоящего изобретения представляет собой соединение формулы I для использования в качестве лекарственного средства. Дальнейшее осуществление настоящего изобретения представляет собой применение соединения формулы I для производства лекарственного средства для лечения тревоги, депрессии, большого депрессивного расстройства, симптомов отмены алкоголя или синдрома раздраженной кишки у млекопитающего. В другом дополнительном осуществлении млекопитающим является человек. Детальное описание изобретения Как используется выше и в описании изобретения, следует понимать, что следующие термины, если только не указано другое, имеют следующие значения."Алкокси" обозначает алкил-О-группу, где алкильная группа является такой, как описано в данной заявке. Примеры алкоксигрупп включают метокси, этокси, н-пропокси, i-пропокси и н-бутокси."Алкил" обозначает насыщенную алифатическую углеводородную группу, которая может быть прямой или разветвленной, содержащую 1-5 атомов углерода в цепи."Алкенил" обозначает ненасыщенную алифатическую углеводородную группу, которая может быть прямой или разветвленной, содержащую 2-4 атома углерода в цепи."Фармацевтически приемлемые соли" относятся к относительно нетоксическим, неорганическим и органическим кислотно-аддитивным солям и основно-аддитивным солям соединений согласно настоящему изобретению. Эти соли могут быть получены in situ во время окончательного выделения и очищения соединений. В частности, кислотно-аддитивные соли могут быть получены с помощью отдельной реакции очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения соли, полученной таким образом. Примеры кислотно-аддитивных солей включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат,сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бисгидроксинафтоаты, соли гентизаты, изетионаты, ди-п-толуоилтартраты,метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинатылаурилсульфонатные соли и подобные. См., например S.M. Berge, et al., "Pharmaceutical Salts," J.Pharm. Sci., 66, 1-19 (1977). Списки подходящих солей приведены в Remington's Pharmaceutical Sciences,17th ed. , Mack Publishing. Company, Easton, Pa., 1985, p. 1418. Понимают, что, как используется в данной заявке, при ссылке на соединения формулы I имеется в виду, что также включены их фармацевтически приемлемые соли."Терапевтически эффективное количество" или "эффективное количество" обозначает количество соединения формулы I согласно настоящему изобретению или фармацевтической композиции, которая-4 012393 содержит соединение формулы I согласно настоящему изобретению, которое вызывает биологическую или медицинскую реакцию или желаемый терапевтический результат на ткани, в системе, в животном или человеке, которую ожидает исследователь, ветеринар, доктор или другой клинический врач. Имеют в виду, что термины "лечение", "лечат", "лечащий" и подобные включают как замедление,так и изменение развития расстройства. Эти термины также включают облегчение, улучшение, ослабление, устранение или снижение одного или больше симптомов расстройства или состояния, даже если расстройство или состояние фактически не устраняются и даже если развитие расстройства или состояния само по себе не замедляется или не изменяется. Термин "лечение" и подобные термины также включают предупредительное (например, профилактическое) и паллиативное лечение. Предотвращение болезни проявляется продлением или задержкой начала симптомов болезни. Обозначение в молекулярной структуре указывает положение присоединения конкретного заместителя. Когда любая переменная встречается больше одного раза в любом компоненте или в формуле I, ее определение в каждом случае будет независимым от ее определения в любом другом случае. Также допустимы комбинации заместителей и/или переменных, только если такие комбинации приводят к устойчивым соединениям. При выборе соединений согласно настоящему изобретению специалист в данной области техники признает, что различные заместители, т.е. R1, R2 и т.п., должны быть выбраны в соответствии с хорошо известными принципами связности химической структуры. В соответствии со стандартной номенклатурой, которая используется в данном описании, сначала описывается конечная часть указанной боковой цепи, а потом соседняя с ней функциональность в направлении точки присоединения. Например, арилкарбониламиноалкильный заместитель эквивалентен арил-С(О)-NH-алкил-. В настоящем изобретении рассматриваются отдельные классы соединений формулы I. В следующих параграфах описаны такие отдельные классы: Поскольку все соединения формулы I являются полезными антагонистами рецептора CRF1, следующие параграфы описывают дополнительные отдельные классы:R6 представляет собой галоген или метил, и R8 представляет собойR6 представляет собой галоген или метил, иR6 представляет собой галоген или метил, и В следующих параграфах описаны еще более специфические классы антагонистов рецептора CRF1 согласно изобретению:R7 представляет собой водород,и R6 представляет собой галоген или метил, иR7 представляет собой водород, R6 представляет собой галоген и R8 представляет собойR6 представляет собой галоген или метил, и Предпочтительно соединения согласно изобретению проявляют значение Ki для связывания CRF1 1 мкмоль или меньше, более предпочтительно - 500 нмоль или меньше. Еще более предпочтительно, соединения согласно изобретению проявляют значение Ki для связывания CRF1 250 нмоль или меньше,даже более предпочтительно - 100 нмоль или меньше. Еще больше предпочтительно соединения согласно изобретению проявляют значение Ki для связывания CRF1 30 нмоль или меньше, тогда как еще наиболее предпочтительно - 15 нмоль или меньше. Наиболее предпочтительными являются соединения согласно изобретению, которые проявляют значение Ki для связывания CRF1 5 нмоль или меньше. В настоящем изобретении также приводится фармацевтическая композиция, которая содержит соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент. "Фармацевтически приемлемый носитель, разбавитель или эксципиент" представляет собой средство, общепринятое в уровне техники для доставки биологически активных агентов млекопитающим, например людям. Такие носители, в общем, получают в соответствии с целым рядом факторов, хорошо известных специалисту в области определения и установления таких факторов. Эти факторы включают, без ограничения тип и природу активного агента, который получают; субъекта,которому должны вводить композицию, содержащую агент; запланированный маршрут введения композиции; и терапевтическое указание, служащее целью. Фармацевтически приемлемые носители и эксципиенты включают как водные, так и неводные жидкие среды, а также и разнообразные твердые и полутвердые дозированные формы. Такие носители могут включать целый ряд различных ингредиентов и добавок дополнительно к активному агенту, такие дополнительные ингредиенты будут включены в препарат по целому ряду причин, как, например, стабилизация активного агента, хорошо известных специалисту в данной области техники. Описания подходящих фармацевтически приемлемых носителей и факторов, связанных с их выбором, могут быть найдены в разных легкодоступных источниках, например-8 012393 Эти соединения формулы I могут быть введены перорально, местно, парентерально, с помощью ингаляции или спрея или ректально в препаратах единичного дозирования, содержащих традиционные нетоксические фармацевтически приемлемые носители, вспомогательные средства и наполнители. Фармацевтические композиции, содержащие соединения общей формулы I, могут находиться в форме, подходящей для перорального применения, например, в форме таблеток, пастилок, лекарственных леденцов, водных или масляных суспензий, дисперсных порошков или гранул, эмульсии, твердых или мягких капсул, или сиропов, или эликсиров. Дозированные формы, подходящие для введения, в общем, содержат от приблизительно 1 до приблизительно 300 мг активного ингредиента на единицу. В этих фармацевтических композициях активный ингредиент будет обычно присутствовать в количестве приблизительно от 0,5 до 95 вес.%, основываясь на общем весе композиции. Могут применяться подходящие оболочки, чтобы увеличить вкусовую привлекательность или отсрочить адсорбцию. Соединения формулы I являются антагонистами при рецепторе CRF1 и полезны для лечения тревожных расстройств, депрессии, большого депрессивного расстройства и вызванных стрессом расстройств. Тревожные расстройства представляет собой группу болезней, идентифицированных в уровне техники, которая включает фобические расстройства, состояния тревоги, посттравматическое стрессовое расстройство и атипические тревожные расстройства [The Merck Manual of Diagnosis and Therapy, 16 thedition (1992)]. Эмоциональный стресс часто представляет собой ускоряющий фактор в тревожных расстройствах, и такие расстройства, в общем, реагируют на лекарственные средства, которые снижают реакцию на стресс. Соединения также полезны в программах отказа от курения. Способ лечения включает введение млекопитающему (например, человеку) эффективного количества соединения согласно изобретению. В частности, терапевтически эффективные количества соединений согласно данному изобретению являются количествами, эффективными для борьбы или снижения уровней фактора высвобождения кортикотропина (CRF) у млекопитающего (например, человека), таким образом, облегчения у млекопитающего состояний, которые характеризуются анормально высокими уровнями экспрессии CRF. Как таковое, настоящее изобретение обеспечивает способ лечения состояния, которое поддается лечению с помощью снижения стимулирования рецептора CRF1, который включает введение млекопитающему (например, человеку), который в этом нуждается, соединения формулы I или его фармацевтически приемлемой соли, в количестве, эффективном для борьбы со стимулированием рецептора CRF1. Настоящее изобретение также обеспечивает применение соединения формулы I для изготовления лекарственного средства для лечения состояния, которое поддается лечению с помощью снижения стимулирования рецептора CRF1. Настоящее изобретение также обеспечивает способ антагонизирования рецепторов CRF1 у теплокровного животного, который включает введение животному соединения согласно изобретению в количестве, эффективном для борьбы с рецепторами CRF1. Теплокровное животное предпочтительно представляет собой млекопитающее и более предпочтительно человека. Настоящее изобретение также обеспечивает способ лечения расстройства у теплокровного животного, где расстройство проявляет повышенную секрецию CRF, или где лечение такого расстройства может быть проведено или облегчено с помощью борьбы с рецепторами CRF1, который включает введение животному терапевтически эффективного количества соединения согласно изобретению. Теплокровное животное предпочтительно представляет собой млекопитающее и более предпочтительно человека. Соединения формулы I или его фармацевтически приемлемая соль полезны для лечения различных расстройств и состояний у млекопитающего (например, человека), включая социальное тревожное расстройство; расстройство панического типа; обсессивно-компульсивное расстройство; большое депрессивное расстройство; тревогу с болезненным депрессивным расстройством; аффективное расстройство; тревогу; депрессию; синдром раздраженной кишки; посттравматическое стрессовое расстройство; супрануклеарный паралич; иммунносупрессию; болезнь желудочно-кишечного тракта; нервную анорексию,булимию или другое расстройство питания; симптомы отмены лекарства или алкоголя; расстройство,связанное со злоупотреблением алкоголем или наркотиками (например, никотином, кокаином, этанолом,опиатами или другими лекарственными средствами); воспалительное расстройство; проблемы, связанные со способностью к оплодотворению; расстройства, лечение которых может быть произведено или облегчено с помощью антагонизирования CRF, включая, но не ограничиваясь, расстройства, которые вызваны или которым способствовал CRF; расстройство, выбранное из воспалительных расстройств,таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергия; генерализированное тревожное расстройство; панику; фобии; обсессивно-компульсивное расстройство; расстройства сна, вызванные стрессом; болезни, связанные со стрессом; восприятие боли, как, например, фибромиалгия; расстройства настроения, такие как депрессия, включая глубокую депрессию, большое депрессивное расстройство, одиночная эпизодическая депрессия, периодическая депрессия, депрессия, вызванная жестоким обращением с ребенком, и послеродовая депрессия; психическую депрессию; биполярные расстройства; циклотимию; синдром усталости; синдром хронической усталости; головную боль, вызванную стрессом; головную боль; рак; инфекции вируса иммунодефицита человека (ВИЧ); нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, старческое сла-9 012393 боумие типа Альцгеймера и слабоумие в результате множества инфарктов; болезни желудочнокишечного тракта, такие как язвы, синдром раздраженной кишки, болезнь Крона, спастический колит,диарея и послеоперационная кишечная непроходимость, и повышенная чувствительность толстой кишки, связанная с психопатологическими нарушениями или стрессом; расстройства питания, такие как анорексия и нейрогенная булимия; геморрагический стресс; психотические эпизоды, вызванные стрессом; эутиреоидный синдром с болезненными проявлениями; синдром неадекватной секреции антидиуретического гормона (ADH); ожирение; ожирение и метаболический синдром; бесплодие; преждевременные роды; травмы головы; травму спинного мозга; ишемическое повреждение нейронов (например, ишемия головного мозга, как, например, гиппокампальная ишемия головного мозга); экситотоксическое повреждение нейронов; эпилепсию; сердечно-сосудистые расстройства и расстройства, связанные с сердцем,включая повышенное кровяное давление, тахикардию и застойную сердечную недостаточность; инсульт; иммунные дисфункции, включая иммунные дисфункции, вызванные стрессом (например, повышенная температура, вызванная стрессом, инфекции людей и животных, вызванные стрессом, синдром стресса у свиней, транспортная лихорадка у коров, пароксизмальная фибрилляция у лошадей и дисфункции, вызванные содержанием в закрытом помещении, у цыплят, отклоненный стресс у овец или стресс у собак,связанный с отношениями человек-животное); мышечные спазмы; непроизвольное мочеиспускание; старческое слабоумие типа Альцгеймера; слабоумие в результате множества инфарктов; болезнь Шарко; химические зависимости и пагубные привычки (например, зависимости от алкоголя, кокаина, героина,бензодиазепинов или других лекарственных средств); симптомы отмены лекарства или алкоголя; остеопороз; психосоциальную карликовость и гипогликемию. Соединение согласно данному изобретению может быть введено для лечения упомянутых выше расстройств или нарушений с помощью средств, которые обеспечивают контакт активного агента с местом действия агента в теле млекопитающего (например, человека), как, например, с помощью перорального или парентерального введения, используя подходящие дозированные формы. Соединения могут быть введены с помощью любых стандартных средств, доступных для применения в сочетании с фармацевтическими препаратами или в качестве индивидуального терапевтического агента, или в комбинации терапевтических агентов. Соединения могут быть введены сами по себе, но, как правило, их будут вводить с фармацевтическим носителем, выбранным на основании избранного маршрута введения и стандартной фармацевтической практики. Терапевтически эффективные количества соединений согласно изобретению для лечения болезней или расстройств, описанных выше у теплокровного животного, могут быть определены разными путями,известными специалисту в данной области техники, например, с помощью введения различных количеств конкретного агента животному, страдающему от конкретного состояния, и потом определения эффекта на животном. Обычно, терапевтически эффективные количества соединения согласно настоящему изобретению могут быть введены перорально ежедневно в дозировке активного ингредиента от 0,002 до 200 мг/кг веса тела. Обычно, для получения желаемого фармакологического эффекта эффективной будет доза от 0,01 до 10 мг/кг в разделенных дозах один-четыре раза в день или в лекарственной форме с замедленным высвобождением. Однако будет понятно, что конкретные уровни дозы для любого отдельного пациента будут зависеть от разных факторов, включая активность используемого конкретного соединения, возраст, вес тела, общее состояние здоровья, пол, режим питания, время введения, маршрут введения и степень выведения, комбинацию лекарственных средств и серьезность конкретного заболевания. Частота дозирования также может изменяться в зависимости от используемого соединения и от конкретного заболевания, которое лечат. Однако для лечения большинства расстройств ЦНС предпочтительным является режим дозирования четыре раза в день или меньше. Для лечения стресса и депрессии особенно предпочтительным является режим дозирования один или два раза в день. Будет принято во внимание, что все комбинации отдельных и предпочтительных осуществлений,описанные выше, и примеры, приведенные ниже, рассматриваются как включенные в настоящее изобретение, обеспечивая такие комбинации, которые не содержат несовместимые группирования. Кроме того,все примеры, описанные в данной заявке, приведены для иллюстративных целей и, не имеется в виду,что они суживают границы изобретения каким-либо путем. Соединения согласно изобретению, в целом, могут быть получены, используя маршруты синтеза,проиллюстрированные на схемах ниже. Исходные вещества могут быть получены с помощью методик,описанных на этих схемах, или с помощью методик, которые будут хорошо известны специалисту в области органической химии. Переменные, используемые на схемах, являются такими, как определено ниже или в формуле изобретения. Специалист в данной области техники примет во внимание, что введение определенных заместителей будет создавать асимметрию в соединениях формулы I. Настоящее изобретение включает все энантиомеры и смеси энантиомеров и стереоизомеров, то есть как стереомерно чистую форму (например,геометрически чистую, энантиомерно чистую или диастереомерно чистую), так и энантиомерные и стереоизомерные смеси, включая рацематы. Энантиомерные и стереоизомерные смеси могут быть разделены на их составные энантиомеры или стереомеры с помощью хорошо известных способов, таких как газовая хроматография с хиральной фазой, высокоэффективная жидкостная хроматография с хиральной- 10012393 фазой или кристаллизация соединения в виде хирального комплекса соли. Энантиомеры и стереоизомеры также могут быть получены из стереомерно- или энантиомерно чистых промежуточных соединений,реагентов и катализаторов с помощью хорошо известных способов асимметрического синтеза. Подразумевают, что фармацевтически приемлемые соли включены в границы настоящего изобретения. Соединения согласно настоящему изобретению представляют собой основания, и могут быть образованы соли таких соединений с кислотами, например соль с неорганической кислотой, такой как соляная кислота, или соль с органической кислотой, такой как трифторуксусная кислота. Соединения согласно данному изобретению могут быть получены, используя реакции, приведенные на следующих схемах, дополнительно к другим стандартным процедурам, которые известны из литературы или проиллюстрированы в экспериментальных методиках. Таким образом, эти схемы не ограничиваются ни перечисленными соединениями, ни конкретными заместителями, которые используются для иллюстративной цели. Схема I. Синтез фрагмента имидазо[1,2-b]пиридазинаR1, R3, R5a и R5b определены выше. На схеме I замещенный 3-аминопиридазин 1 ацилируют пивалоил галогенидом и основанием, например триэтиламином, в полярном апротонном растворителе, например, метилен хлориде, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником с получением амида 2. Амид 2 обрабатывают реактивом Гриньяра в диэтиловом эфире или THF с получением 4-замещенного амида 3. Амид 3 гидролизуют водной HCl при температуре в диапазоне от комнатной температуры до 110 С, потом нейтрализуют, получая свободный амин 4. Амин 4 обрабатывают альфагалогенкетоном и основанием, например бикарбонатом натрия, в 95% этаноле при температуре в диапазоне от комнатной температуры до 110 С с получением имидазопиридазина 5. Имидазопиридазин 5 обрабатывают галогенирующим реагентом, например N-йод- или N-бромсукцинимид, в полярном апротонном растворителе (например, ацетонитриле) при температуре в диапазоне от 0 С до комнатной температуры с получением галогенида 6. Галогенид 6 подвергают обмену галоген-металл с алкиллитиевым реагентом, например, н-, втор- или трет-бутиллитием, в диэтиловом эфире или THF при температуре в диапазоне от -78 С до комнатной температуры, с последующей обработкой триалкилборатом, например триметилборатом, с получением промежуточного боронового эфира, который гидролизуют обработкой водной HCl с получением бороновой кислоты 7. Схема II. Синтез соединений формулы I с помощью катализатора на основе переходного металла Уравнение 1R1, R2, R3, R5a, R5b, R6, R7, R8, U и z определены выше. На схеме II уравнение 1 галогенид 6 может быть использован в реакции связывания с 5-членной кольцевой гетероциклической бороновой кислотой 8 в присутствии катализа на основе палладия, например, тетракис-трифенилфосфин палладия(0), в смеси низшего алканола (метанола или н- или iпропанола)/DME при 70-120 С с получением соединения формулы I. Альтернативно, в уравнении 2 бороновая кислота 7 может быть использована в реакции связывания с 5-членным гетероциклическим галогенидом 9 и в присутствии катализатора на основе палладия, например тетракис-трифенилфосфин палладия(0), в смеси низшего алканола (метанола или н- или iпропанола)/DME при 70-120 С с получением соединения формулы I. В уравнении 3 5-членные гетероциклические галогениды 9 могут подвергать обмену галоген-литий,например, с н-, втор- или трет-бутиллитием в THF или эфире при -65 С, с последующим обменом литийцинк с ZnCl2 или в диэтиловом эфире, или в THF при температурах до комнатной температуры. Непосредственно полученный цинкорганический реагент 10 потом могут подвергать соединению с галогенидом 6 в присутствии палладия, например PdCl2 (dppf) в THF при 70-120 С с получением соединения формулы I. В уравнении 4 5-членное гетероциклическое кольцо с кольцевым протоном может быть литировано алкиллитием, например н-, втор- или трет-бутиллитием, или диизопропил амидом лития в THF или эфире при -65 С до комнатной температуры, с последующим обменом литий-цинк с безводным галогенидом цинка или в диэтиловом эфире, или в THF, с получением цинкорганического реагента 10, который используется в уравнении 3 выше. Специалист в данной области техники также примет во внимание, что коммерчески доступные цинкорганические реактивы 10 могут использоваться непосредственно в качестве цинкорганического связывающего агента. К тому же, из уравнения 5 подходящим или пригодным может быть использование Zn Рейке, в THF для непосредственного превращения 5-членного гетероциклического галогенида 9 в цинкорганический реагент 10 для связывания с галогенидом 6. В уравнении 6 5-членный гетероциклический галогенид 9 может быть непосредственно связан с промежуточным имидазо[1,2-b] пиридазином 5 в присутствии палладия, например Pd2(dba)3, PdCl2, ацетата палладия/TDBPP или тетракис-трифенилфосфин палладия(0), в растворителе DMF, THF или NMP при 70-120 С с получением соединения формулы I.- 13012393 Альтернативно, из уравнения 7 имидазо[1,2-b]пиридазин галогенид 6 может быть непосредственно связан с 5-членным гетероциклом 11 в присутствии палладия, например Pd2(dba)3, PdCl2 или ацетата палладия/TDBPP, в растворителе DMF, THF или NMP при 70-120 С с получением соединения формулы I. Схема III. Синтез замещенных 5-членных гетероциклических галогенидовR6, R7, R8, L и z определены выше. Некоторые 5-членные гетероциклические кольца и/или их бромиды, и/или йодиды, которые используют в качестве исходных веществ для синтеза соединений формулы I, коммерчески доступны или могут быть получены с помощью способов, хорошо известных специалисту в данной области техники. Исходя из схемы III, они также могут быть получены с помощью галогенирования, например, бромом,NBS или NIS. К тому же, некоторые из промежуточных соединений 11 и 12 могут быть получены с помощью обмена литий-галоген, с последующим гашением водой. Соединения формулы I в качестве промежуточных соединений при получении других соединений формулы I включают соединения, полученные при добавлении ариллитиевых реагентов (получаемых способами, описанными в уравнениях 3 и 4 на схеме II) к карбонильным соединениям, например альдегидам, кетонам, эфирам и амидам Вайнреба. Полученные карбинолы или карбонильные соединения,кроме того, подвергают галогенированию в кислых условиях и дополнительно добавляют ариллитий,соответственно. СокращенияGFF - стеклянный микроволнистый фильтр ВЭЖХ - высокоэффективная жидкостная хроматография на силикагелеISCO - ISCO жидкостная хроматография низкого давления на силикагелеLDA - диизопропиламин лития КОАс - ацетат калия- 14012393 к.т., КТ - комнатная температура Примеры Без дополнительного уточнения полагают, что специалист в данной области техники может, используя вышеизложенное описание, применять на практике данное изобретение в его самых широких пределах. Следующие примеры приведены, чтобы более детально описать изобретение. Имеется в виду,что они иллюстрируют изобретение и не ограничивают его каким-либо образом. В примерах 1-255 приведены примеры соединений и проиллюстрированы их способы получения. В примерах A-D проиллюстрированы различные биологические исследования, которые могут использоваться для определения биологических свойств соединений согласно изобретению. Специалист в данной области техники быстро определит подходящие вариации, исходя из методик, описанных в примерах. Пример 1. Получение 8-(1-этилпропил)-3-(2,4-диметил-5-тиазолил)-2,6-диметилимидазо[1,2b]пиридазинаA. 6-Метилпиридизин-3-иламин 3-Хлор-6-метилпиридазин (25,0 г, 0,229 моль) растворяют в 250 мл NH4OH и нагревают до 170 С в герметичном сосуде в течение 24 ч. Растворители выпаривают. Остаток растирают в порошок в метиленхлориде и твердое вещество отфильтровывают. Эту процедуру растирания в порошок повторяют с фильтратом четыре раза. Отфильтрованные твердые вещества объединяют и сушат в вакуум-сушильном шкафу в течение ночи, получая указанное в заглавии соединение в виде не совсем белого твердого вещества 4,32 г (0,040 моль, 20%). 2 Н ЯМР (ДМСО-d6):7,1 (д, J=8,9 Гц, 1 Н); 6,67 (д, J=8,9 Гц, 1 Н); 6,04 (с, ушир., 2 Н); 2,33 (с, 3 Н) м.д. ES+=110 (100%, М+1).B. 2,2-Диметил-N-(6-метилпиридазин-3-ил)пропионамид Способ 1. В сухую колбу добавляют 7,12 г (0,065 моль) 6-метилпиридизин-3-иламина в 170 мл сухого метиленхлорида. Потом добавляют 14,5 мл триэтиламина и реакционную смесь охлаждают до 0 С. Осторожно добавляют пивалоил хлорид (2,7 мл, 1,2 экв.) и реакционную смесь перемешивают в течение 10 мин,вынимают из бани и перемешивают еще в течение 4 ч. Добавляют дихлорметан (200 мл) и реакционную смесь промывают 3 раза насыщенным водным бикарбонатом натрия, потом солевым раствором. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают до масла. Неочищенный продукт очищают с помощью хроматографии на силикагеле, используя градиент гексан:этилацетат,получая указанное в заглавии соединение в виде белой твердой массы 1,51 г (7,8 ммоль, 42,7%). 1(с, 9 Н) м.д. ES+=194 (M+1). Способ 2. В сухую пробирку повышенного давления добавляют 200 мг (1,56 моль) 3-хлор-5 метилпиридазина, 190 мг (1,87 ммоль) триметилацетамида, 14,6 мг (0,023 ммоль) рац-2,2'бис(дифенилфосфин)-1,1'-бинафтила, трис(дибензилиденацетон)дипалладия(0), 762,4 мг (2,34 ммоль) карбоната цезия и 1,5 мл сухого тетрагидрофурана. Пробирку повышенного давления очищают азотом и запаивают. Реакционную смесь нагревают до 100 С в течение ночи. Реакционную смесь потом охлаждают, разбавляют дихлорметаном и фильтруют через целит. Растворители выпаривают и неочищенный продукт очищают с помощью хроматографии на силикагеле, используя градиент этилацетат:гексан, получая 91 мг (0,47 ммоль, 30%) в виде белого твердого вещества. С. N-[4-(1-Этилпропил)-6-метилпиридазин-3-ил]-2,2-диметилпропионамид Активированный порошкоподобный магний (19,2 г, 0,792 моль) добавляют в сухую 3-л колбу, оснащенную холодильником и капельной воронкой. Весь прибор нагревают термопистолетом в вакууме и оставляют охлаждаться. Добавляют достаточное количество эфира, чтобы покрыть магний. 3 Бромпентан (100 г, 0,662 ммоль) добавляют в капельную воронку в 175 мл диэтилового эфира. 1/3 бромпентанового раствора добавляют к магнию и реакционную смесь перемешивают под азотом, пока происходит выделение пузырьков. Потом остаток прикапывают с такой скоростью, чтобы выделение пузырьков продолжалось умеренно. Реакционную смесь перемешивают в течение 30 мин после того, как выделение пузырьков прекращается. Потом по каплям добавляют 2,2-диметил-N-(6-метилпиридазин-3 ил)пропионамид (21,3 г, 0,110 ммоль), растворенный в 225 мл сухого THF. Реакционную смесь перемешивают в течение 1 ч. Осторожно добавляют насыщенный тартрат натрия (1 л) и реакционную смесь перемешивают в течение 30 мин. Реакционную смесь помещают в большую колбу, добавляют 2 л этилацетата и реакционную смесь перемешивают еще в течение 1 ч. Слои разделяют и водный слой экстраги- 15012393 руют несколько раз этилацетатом. Органические экстракты объединяют и растворители выпаривают. Остаток помещают в 600 мл дихлорметана и добавляют йод (28 г, 0,110 моль). Реакционную смесь перемешивают в течение 2 ч. Органический слой промывают один раз водным раствором сульфита натрия и потом водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают до красного масла. Неочищенный продукт очищают с помощью хроматографии на силикагеле, используя градиент гексаны:этилацетат. Фракции продукта объединяют и выпаривают. Остаток растирают в порошок в этилацетате и светло-желто-коричневое твердое вещество фильтруют, получая 12,0 г (45,6 ммоль, 41%) указанного в заглавии соединения. 1 Н ЯМР (ДМСО-d6),9,88 (с, 1 Н); 7,59 (с, 1 Н); 2,60 (с, 3 Н); 2,39-2,42 (м, 1 Н); 1,21-1,37 (м, 2 Н); 1,38-1,43 (м, 2 Н); 1,23 (с, 9 Н); 0,71 (т, J=7,49 Гц, 6 Н) м.д. MC/ES+=264.N-[4-(1-Этилпропил)-6-метилпиридазин-3-ил]-2,2-диметилпропионамид (12,0 г, 45 ммоль) растворяют в 60 мл концентрированной соляной кислоты. Реакционную смесь нагревают до 95 С в герметичном сосуде в течение 2 ч. Реакционную смесь обрабатывают очищением надо льдом и экстрагируют этилацетатом три раза. Органический слой откидывают, и рН водного слоя корректируют, используя 2 Н гидроксид натрия. Основной раствор экстрагируют этилацетатом пять раз. Органические экстракты объединяют, сушат над сульфатом магния, фильтруют и выпаривают, получая 6,68 г (37 ммоль, 81%) указанного в заглавии соединения в виде коричневатого масла. 1 Н ЯМР (ДМСО-d6),6,95 (с, 1 Н); 5,89 (с, ушир., 2 Н); 2,52-2,56 (м, 1 Н); 2,34 (с, 3 Н); 1,44-1,58 (м,4 Н); 0,72 (т, J=7,04 Гц, 6 Н) м.д. MC/ES+=180 (100%, М+1).E. 8-(1-Этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин 4-(1-Этилпропил)-6-метилпиридазин-3-иламин (850 мг, 4,74 ммоль), хлорацетон (0,415 мл, 5,22 мл) и 20 мл этанола нагревают в микроволнах при 110 С в течение 35 мин. Добавляют бикарбонат натрия(1,2 г, 14,2 ммоль) и реакционную смесь нагревают на масляной бане при 100 С в течение ночи. Растворитель выпаривают и остаток помещают в этилацетат и три раза промывают солевым раствором. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают до коричневого масла. Неочищенный продукт очищают с помощью хроматографии на силикагеле, используя градиент гексан:этилацетат. Указанное в заглавии соединение получают в виде маслянистой массы 3,69 г (17,0 ммоль, 84%). 1 Н ЯМР (ДМСО-d6),7,34 (с, 1 Н); 6,84 (с, 1 Н); 2,85-3,10 (м, 1 Н); 2,43 (с, 3 Н); 2,32 (с, 3 Н); 1,70-1,80F. 8-(1-Этилпропил)-3-йод-2,6-диметилимидазо[1,2-b]пиридазин 8-(1-Этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин (5,1 г, 0,023 моль) и 50 мл сухого ацетонитрила помещают в очищенную азотом колбу и охлаждают до 0 С. Добавляют NIS (5,54 г, 0,025 моль)в 90 мл сухого ацетонитрила. Баню оставляют нагреваться до комнатной температуры и реакционную смесь перемешивают в течение ночи. Растворители выпаривают. Остаток помещают в этилацетат, два раза промывают 50% водным раствором тиосульфата натрия и солевым раствором. Органический слой сушат над сульфатом натрия, фильтруют и снова выпаривают до остатка. Неочищенный продукт растирают в небольшом количестве ацетонитрила и твердое вещество отфильтровывают. Растирание в порошок повторяют несколько раз, получая указанное в заглавии соединение в виде светло-желто-коричневой массы 7,29 г (0,021 моль, 91%). 1 Н ЯМР (ДМСО-d6),6,96 (с, 1 Н); 3,0-3,3 (м, 1 Н); 2,51 (с, 3 Н); 2,35 (с, 3 Н); 1,71-1,80 (м, 4 Н); 0,71 (т,J=7,48 Гц, 6 Н) м.д. MC/ES+=344 (100%, М+1).G. 8-(1-Этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-илбороновая кислота В высушенной в печке, очищенной азотом 3-горлой 50-мл круглодонной колбе 1,00 г (2,91 ммоль) 8-(1-этилпропил)-3-йод-2,6-диметилимидазо [1,2-b]пиридазина в 60 мл сухого THF охлаждают до -78 С. Добавляют 4,12 мл (7,00 ммоль) 1,7 М трет-бутиллития в гексанах и реакционную смесь перемешивают при -78 С в течение 1 ч. Добавляют 0,818 мл (7,30 ммоль) триметилбората и реакционную смесь подвергают МС и ТСХ (1:1 гексан:ЕА). Индикацию продукта наблюдают с помощью масс-спектра. Реакционную смесь оставляют перемешиваться в течение дополнительного часа, гасят 1 Н соляной кислотой и разбавляют этилацетатом. Органический слой отделяют и водный слой три раза экстрагируют 100 мл зтилацетата. Экстракты объединяют, сушат над MgSO4, фильтруют и концентрируют. Остаток реакционной смеси растирают в порошок в гексанах, и твердое вещество отфильтровывают. МС, ES+=262,2(M+1). Н. 8-(1-Этилпропил)-3-(2,4-диметил-5-тиазолил)-2,6-диметилимидазо[1,2-b]пиридазин В микроволновую пробирку повышенного давления добавляют 0,340 г (1,30 ммоль) 8-(1 этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-илбороновой кислоты, 0,100 г (0,521 ммоль) 5-бром 2,4-диметилтиазола, 0,361 г (0,313 ммоль) Pd(PPh3)4, 0,650 мл (1,30 ммоль) 2 М водного Na2CO3 и 2 мл 7:3:2 DME:H2O:EtOH и смесь нагревают при 160 С в течение 40 мин. Протекание реакции проверяют с помощью МС, который указывает, что продукт присутствует. Реакционную смесь разделяют между 75 мл этилацетата и 75 мл воды. Слои разделяют и водный слой экстрагируют 350 мл этилацетата, сушат(MgSO4) и концентрируют в вакууме. Неочищенную смесь очищают с помощью хроматографии, используя гексаны/этилацетат в качестве системы растворителей. Продукт, содержащий фракции, объединяют,получая 0,100 г продукта, выход 58%. МС, ES+=329,2 (M+1); 1A. 5-Бром-2-этил-4-метилтиазол В высушенной в печке, очищенной N2, 50-мл круглодонной колбе, 1,00 г (7,86 ммоль) 2-этил-4 метилтиазола подвергают реакции с 0,487 мл (9,43 ммоль) брома в 7 мл уксусной кислоты при комнатной температуре. Прохождение реакции проверяют с помощью МС через 2 ч. Реакционную смесь разделяют между 50 мл H2O и 25 мл CH2Cl2. Слои разделяют и водный слой экстрагируют 325 мл CH2Cl2. Органические фазы объединяют и промывают 125 мл 1 Н Na2S2O3, сушат (MgSO4) и концентрируют в вакууме, получая 1,38 г указанного в заглавии соединения, выход 85%. МС, ES+=206,0 (М+1); 1 Н ЯМР (ДМСО-d6)=2, 940-2,810 (м, 2 Н); 2,253-2,251 (м, 3 Н); 1,225-1,222 (м, 3 Н) м.д. 3,00 г 8-(1-этилпропил)-3-йод-2,6-диметилимидазо[1,2-b]пиридазина (8,74 ммоль), 4,32 г 4-метил 2 Н-тиазола (43,6 ммоль), 453 мг трифенилфосфина (1,73 ммоль) и 5,85 г карбоната цезия (18,0 ммоль) помещают в герметичную пробирку с 20 мл DMF и барботируют N2 (газ) в течение 40 мин. Добавляют 3 9 мг Рd2dba3 (0,43 ммоль) и пробирку запаивают и нагревают при 130 С в течение ночи. Охлажденную реакционную смесь фильтруют и очищают на колонке с силикагелем (гексан гексан:AcOEt=3:1), получая 2,12 г указанного в заглавии соединения (77%). 1 Н ЯМР (ДМСО-d6)9,215 (с, 1 Н); 6,993 (с, 1 Н); 3,079 (м, 1 Н); 2,480 (с, 3 Н); 2,439 (с, 3 Н); 2,302 (с,3 Н); 1,824-1,751 (м, 4 Н); 0,780-0,743 (м, 6 Н) м.д. МС, ES+=315,2. Пример 7. Получение 8-(1-этилпропил)-2,6-диметил-3-(4-метил-2-пиридин-2-илтиазол-5 ил)имидазо[1,2-b]пиридазинаA. 8-(1-Этилпропил)-3-[2-бром-4-метил-5-тиазолил]-2,6-диметилимидазо[1,2-b]пиридазин В высушенной в печке, очищенной N2, 15-мл круглодонной колбе, 0,028 г (0,089 ммоль)8-(1 этилпропил)-3-[4-метил-5-тиазолил]-2,6-диметилимидазо[1,2-b]пиридазина в 1,5 мл сухого CH2Cl2 охлаждают до 0 С. Добавляют 0,019 г (0,107 ммоль)NBS и реакционную смесь перемешивают в течение ночи, разрешая бане нагреваться до комнатной температуры. Реакционную смесь непосредственно очищают с помощью хроматографии, используя гексан/этилацетат в качестве системы растворителей. Продукт,содержащий фракции, объединяют, получая 0,012 г, выход 34%. МС, ES+=395,1 (М+1); 1 Н ЯМР (ДМСО-d6)=7,070 (с, 1 Н); 3,10 (м, 1 Н); 2,49 (с, 3 Н); 2,36 (с, 3 Н); 2,25 (с, 3 Н); 1,85-1,78 (м,4 Н); 0,81-0,77 (м, 6 Н) м.д.THF (3 мл) нагревают при 80 С в течение 18 ч. Добавляют этилацетат (20 мл). Органический слой отделяют, сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме. Очищение проводят с помощью хроматографии на силикагеле, используя смесь 3:1 гексанов и этилацетата в качестве элюента,получая указанное в заглавии соединение 325 мг (86%). 1 Н ЯМР (CDCl3),9,55 (м, 1 Н); 8,10 (м, 1 Н); 7,73 (м, 1 Н); 7,26 (м, 1 Н); 6,58 (с, 1 Н); 3,24 (м, 1 Н); В микроволновую пробирку повышенного давления добавляют 0,070 г (0,178 ммоль) 8-(1 этилпропил)-3-[2-бром-4-метил-5-тиазолил]-2,6-диметилимидазо[1,2-b]пиридазина, 0,066 г (0,534 ммоль) пиридин-3-бороновой кислоты, 0,103 г (0,089 ммоль) Pd(PPh3)4, 0,267 мл (0,534 ммоль) 2 М водногоNa2CO3 и 1 мл 7:3:2 DME:H2O: EtOH, и смесь нагревают при 160 С в течение 60 мин. Реакционную смесь разделяют между 25 мл этилацетата и 25 мл воды. Слои разделяют и водный слой экстрагируют 325 мл этилацетата, сушат (MgSO4) и концентрируют в вакууме. Неочищенную смесь очищают с помощью хроматографии, используя гексаны/этилацетат в качестве системы растворителей. Продукт, содержащий фракции, объединяют, получая 0,045 г продукта, выход 64%. МС, ES+=392,2 (М+1); 1 Н ЯМР (ДМСО-d6)9,18 (с, 1 Н); 8,65 (м, 1 Н); 8,34 (д, 1 Н); 7,60 (м, 1 Н); 7,06 (с, 1 Н); 3,06 (м, 1 Н); 2,50 (с, 3 Н); 2,40 (с, 3 Н); 2,34 (с, 3 Н); 1,87-1,82 (м, 4 Н); 0,83-0,79 (м, 6 Н) м.д. Пример 9. Получение 8-(1-этилпропил)-3-[4-метил-2-(4-пиридил)-5-тиазолил]-2,6 диметилимидазо[1,2-b]пиридазина Используя методику, подобную примеру 8, 4-фторфенилбороновую кислоту, получают указанное в заглавии соединение с выходом 63%, где неочищенную смесь очищают с помощью хроматографии, используя 2% метанола в дихлорметане в качестве системы растворителей. МС, ES+=409,2 (М+1); 1 Н ЯМР (ДМСО-d6)=8,06-8,03 (м, 2 Н); 7,408-7,36 (м, 2 Н); 7,05 (с, 1 Н); 3,14-3,11 (м, 1 Н); 2,50 (с, 3 Н); 2,39 (с, 3 Н); 2,31 (с, 3 Н); 1,90-1,78 (м, 4 Н); 0,83-0,79 (м, 6 Н) м.д. Пример 13. Получение 8-(1-этилпропил)-3-[4-метил-2-(3-фторфенил)-5-тиазолил]-2,6 диметилимидазо[1,2-b]пиридазина Используя методику, подобную примеру 8, 3-фторфенилбороновую кислоту, получают указанное в заглавии соединение с выходом 77%, где неочищенную смесь очищают с помощью хроматографии, используя 2% метанола в дихлорметане в качестве системы растворителей. МС, ES+=409,2 (М+1); 1 Н ЯМР (ДМСО-d6)=7,84-7,78 (м, 2 Н); 7,64-7,57 (м, 2 Н); 7,41-7,36 (м, 1 Н); 7,06 (с, 1 Н); 3,15-3,111 (м,1 Н); 2,45 (с, 3 Н); 2,40 (с, 3 Н); 2,32 (с, 3 Н); 1,91-1,78 (м, 4 Н); 0,83-0,79 (м, 6 Н) м.д. Пример 14. Получение 8-(1-этилпропил)-3-[4-метил-2-(2,4-дифторфенил)-5-тиазолил]-2,6 диметилимидазо[1,2-b]пиридазина Используя методику, подобную примеру 8, о-толилбороновую кислоту, получают указанное в заглавии соединение с выходом 87%, где неочищенную смесь очищают с помощью хроматографии на силикагеле, используя 2% метанола в дихлорметане в качестве системы растворителей. МС, ES+=405,2 Используя методику, подобную примеру 8, 3,4-дифторфенилбороновую кислоту, получают указанное в заглавии соединение с выходом 74%, где неочищенную смесь очищают с помощью хроматогра- 20012393 фии, используя 2% метанола в дихлорметане в качестве системы растворителей. МС, ES+=427,2 (М+1); 1 В микроволновую пробирку повышенного давления добавляют 0,100 г (0,254 ммоль) 8-(1 этилпропил)-3-[2-бром-4-метил-5-тиазолил]-2,6-диметилимидазо[1,2-b]пиридазина, 0,157 г (0,762 ммоль) 4-(трифторметокси)бензолбороновой кислоты, 0,147 г (0,127 ммоль) Pd(PPh3)4, 0,381 мл (0,762 ммоль) 2 М водного карбоната натрия и 2 мл этанола. Реакционную смесь нагревают в микроволнах при 160 С в течение 1 ч. Реакционную смесь разделяют между 50 мл этилацетата и 50 мл воды. Слои разделяют и водный слой экстрагируют 350 мл этилацетата, сушат (MgSO4) и концентрируют в вакууме. Неочищенную смесь очищают с помощью хроматографии, используя 2% метанола в дихлорметане в качестве системы растворителей. Продукт, содержащий фракции, объединяют, получая 0,085 г продукта, выход 70%. МС, ES+=475,2 (М+1); 1 Н ЯМР (ДМСО-d6)=8,134-8,112 (д, 2 Н); 7,553-7,532 (д, 2 Н); 7,059 (с, 1 Н); 3,142-3,113 (м, 1 Н); 2,500A. 4,4,5,5-Тетраметил-2-(4-метилтиофен-3-ил)-[1,3,2]диоксаборолан В 250-мл круглодонную колбу помещают 3-бром-4-метилтиофен (5,00 г, 28,24 ммоль),бис(пинаколато)дибор (7,89 г, 31,06 ммоль) и KOAc (8,32 г, 84,72 ммоль) в ДМСО (85 мл). Смесь дегазируют, барботируя N2 в течение 5 мин, добавляют PdCl2 (dppf)2CH2Cl2 (1,15 г, 1,42 ммоль) и реакционную смесь нагревают до 85 С и перемешивают при этой температуре в течение ночи. Реакционную смесь охлаждают до комнатной температуры и разбавляют EtOAc (400 мл), промывают Н 2 О (3300 мл); сушатMgSO4, фильтруют и концентрируют. Неочищенное вещество очищают с помощью хроматографии, получая указанное в заглавии соединение (3,69 г, 16,5 ммоль, 58%). ES-MC (m/z): рассчитано дляB. 4-Метил 3-тиофенбороновая кислота Раствор 4,4,5,5-тетраметил-2-(4-метилтиофен-3-ил)-[1,3,2]диоксаборолана (3,69 г, 16,47 ммоль) в ацетоне (30 мл) обрабатывают Н 2 О (30 мл), потом NaIO4 (7,05 г, 32,95 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи. Органический растворитель удаляют в вакууме. Остаток разбавляют Н 2 О (50 мл), экстрагируют EtOAc (2100 мл). Органические экстракты объединяют,сушат Na2SO4, фильтруют и концентрируют. Неочищенное вещество очищают с помощью хроматографии, получая указанное в заглавии соединение (0,82 г, 5,78 ммоль, 35%). 1- 21012393 С. 8-(1-Этилпропил)-2,6-диметил-3-(4-метилтиофен-3-ил)имидазо[1,2-b]пиридазин В 100-мл круглодонную колбу, содержащую 4-метил-3-тиофенбороновую кислоту (0,27 г, 1,91 ммоль) и 8-(1-этилпропил)-3-йод-2,6-диметилимидазо[1,2-b]пиридазин (0,65 г, 1,91 ммоль) в 20 мл исходного раствора (DME:H2O:EtOH=7:3:2), добавляют 2 М Na2CO3 (1,9 мл). Полученную смесь дегазируют, барботируя N2 в течение 5 мин. Потом добавляют Pd(PPh3)4 (0,11 г, 0,096 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь разбавляют Н 2 О (20 мл); экстрагируют EtOAc (330 мл); сушат (Na2SO4), фильтруют, и неочищенное вещество очищают с помощью хроматографии, получая указанное в заглавии соединение (0,52 г, 1,66 ммоль, 87%). 1 Н ЯМР (CDCl3):0,89 (т, J=7,5 Гц, 6 Н), 1,75-1,90 (м, 4 Н), 2,13 (д, J=0,8 Гц, 3 Н), 2,44 (с, 3 Н), 2,49 (с,3 Н), 3,30-3,39 (м, 1 Н), 6,64 (с, 1 Н), 7,08-7,11 (м, 1 Н), 7,34 (д, J=3,1 Гц, 1 Н). ES-MC (m/z): рассчитано дляPdCl2(dppf) (1,28 г, 1,75 ммоль )добавляют 0,5 М раствор 3-метил-2-тиенилцинк бромида в THF (100 мл,50,0 ммоль). Смесь перемешивают при 65 С в течение ночи, разбавляют EtOAc (500 мл), промывают 10% лимонной кислотой (500 мл), водой (400 мл), солевым раствором (400 мл), сушат над MgSO4,фильтруют и концентрируют. Остаток очищают с помощью ISCO (градиент 10%-20% EtOAc/гексан),получая указанное в заглавии соединение (8,83 г, 28,17 ммоль, 81%). 1 Н ЯМР (CDCl3),0,92 (т, J=7,4 Гц, 6 Н), 1,78-1,95 (м, 4 Н), 2,18 (с, 3 Н), 2,50 (с, 3 Н), 2,54 (с, 3 Н),3,33-3,43 (м, 1 Н), 6,69 (с, 1 Н), 7,06 (д, J=4,9 Гц, 1 Н), 7,46 (д, J=4,9 Гц, 1 Н). LC/MC (m/z): рассчитано для К раствору 8-(1-этилпропил)-2,6-диметил-3-(3-метилтиофен-2-ил)имидазо[1,2-b]пиридазина (8,83 г,28,17 ммоль) и CH2Cl2 (90 мл) добавляют NBS (5,26 г, 29,58 ммоль). Раствор перемешивают при температуре окружающей среды в течение 2 ч. Раствор промывают водой (375 мл), сушат над MgSO4, фильтруют и концентрируют, получая указанное в заглавии соединение (10,5 г, 26,76 ммоль, 95%). 1 Н ЯМР (CDCl3),0,87 (т, J=7,3 Гц, 6 Н), 1,73-1,93 (м, 4 Н), 2,09 (с, 3 Н), 2,44 (с, 3 Н), 2,51 (с, 3 Н),3,26-3,36 (м, 1 Н), 6,68 (с, 1 Н), 6,98 (д, J=4,9 Гц, 1 Н) м.д. LC/MC (m/z): рассчитано для C18H22BrN3S(М+Н)+: 392,6; найдено: 392,1, 394,1. Пример 22. Получение метилового эфира 5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2b]пиридазин-3-ил]-4-метилтиофен-2-карбоновой кислоты(0,937 г, 1,69 ммоль) подвергают реакции в атмосфере СО (100 фунт/дюйм 2) при 80 С в течение 24 ч. Реакционную смесь разбавляют EtOAc (200 мл), промывают 0,1 М HCl (250 мл), солевым раствором (50 мл); сушат Na2SO4; фильтруют через силикагель и элюируют избытком EtOAc. Неочищенное вещество очищают с помощью хроматографии, получая указанное в заглавии соединение (0,79 г, 2,12 ммоль, 80%). 1 Н ЯМР (CDCl3):0,89 (т, J=7,7 Гц, 6 Н), 1,75-1,93 (м, 4 Н), 2,15 (с, 3 Н), 2,50 (с, 3 Н), 2,53 (с, 3 Н),3,32-3,42 (м, 1 Н), 3,91 (с, 3 Н), 6,72 (с, 1 Н), 7,73 (с, 1 Н). ES-MC (m/z): рассчитано для C20H25N3O2S А. 5-[8-(1-Этилпропил)-2,6-диметилимидазо [1,2-b]пиридазин-3-ил]-4-метилтиофен-2-карбоновая кислота Раствор метилового эфира(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]-4 метилтиофен-2-карбоновой кислоты (0,78 г, 2,10 ммоль)в СН 3 ОН (10 мл) обрабатывают 5,0 М NaOH (2,1 мл, 10,5 ммоль). Полученную реакционную смесь кипятят с обратным холодильником в течение 4 ч. Органический растворитель удаляют в вакууме; водный остаток подкисляют, добавляя 2,0 М HCl, до рН 5-6; потом экстрагируют EtOAc (350 мл); сушат (Na2SO4); фильтруют и концентрируют, получая указанное в заглавии соединение (0,74 г, 2,07 ммоль, 98%). 1(М+Н)+: 358,5; найдено: 358,2. В. Метиламид 5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]-4-метилтиофен-2 карбоновой кислоты 5-[8-(1-Этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]-4-метилтиофен-2-карбоновую кислоту (0,17 г, 0,47 ммоль) подвергают реакции с 2,0 М оксалил хлоридом в CH2Cl2 (3,0 мл) при комнатной температуре в течение 1 ч. Избыток реагента и растворитель удаляют в вакууме. Остаток растворяют в CH2Cl2 (3 мл), охлаждают до 0 С и обрабатывают 2,0 М метиламином в THF (3 мл). Реакционную смесь перемешивают при 0 С в течение 10 мин и при комнатной температуре в течение 30 мин. Смесь разбавляют EtOAc (50 мл), промывают Н 2 О (15 мл, 0,1 М NaOH (230 мл); сушат (Na2SO4); фильтруют и концентрируют. Неочищенное вещество очищают с помощью хроматографии, получая указанное в заглавии соединение (0,91 г, 0,25 ммоль, 53%). 1 Н ЯМР (CDCl3):0,89 (т, J=7,2 Гц, 6 Н), 1,75-1,91 (м, 4 Н), 2,14 (с, 3 Н), 2,47 (с, 3 Н), 2,52 (с, 3 Н), 3,02 3-(5-Бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6-диметилимидазо-[1,2-b]пиридазин (0,98 г,2,51 ммоль) и 1-метил-1 Н-имидазол (0,2 мл), Pd(OAc)2 (34 мг, 0,15 ммоль), PPh3 (79 мг, 0,299 ммоль),Cs2CO3 (1,95 г, 6,0 ммоль) в DMF (50 мл) перемешивают под N2 при 130-140 С в течение ночи. Реакционную смесь охлаждают, разбавляют EtOAc (300 мл), промывают Н 2 О (3100 мл), сушат (Na2SO4),фильтруют и концентрируют. Полученное неочищенное вещество очищают с помощью хроматографии,получая указанное в заглавии соединение (0,51 г, 1,29 ммоль, 51%). 1 Н ЯМР (CDCl3):0,89 (т, J=7,5 Гц, 6 Н), 1,77-1,92 (м, 4 Н), 2,17 (с, 3 Н), 2,51 (с, 3 Н), 2,54 (с, 3 Н),3,30-3,40 (м, 1 Н), 3,81 (с, 3 Н), 6,69 (с, 1 Н), 7,02 (с, 1 Н), 7,24 (с, 1 Н), 7,52 (с, 1 Н). ES-MC (m/z): рассчитано для C22H27N5S (М+Н)+: 394,6; найдено: 394,3. Пример 25. Получение 8-(1-этилпропил)-2,6-диметил-3-[3-метил-5-(2-метил-2 Н-[1,2,4]триазол-3 ил)тиофен-2-ил]имидазо[1,2-b]пиридазина- 23012393 при -78 С в течение 1,5 ч. Добавляют 0,5 М раствор ZnCl2 в THF (4,28 мл, 2,14 ммоль) и раствор нагревают при температуре окружающей среды. Добавляют 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)2,6-диметилимидазо[1,2-b]пиридазин (0,40 г, 1,019 ммоль) и PdCl2(dppf) (0,037 г, 0,051 ммоль) и раствор нагревают при 65 С в течение ночи, разбавляют CH2Cl2 (30 мл). Органический слой промывают 10% лимонной кислотой (20 мл), водой (20 мл), солевым раствором (20 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают с помощью ISCO (градиент 20%-60% EtOAc/гексан). Остаток растворяют в Et2O, обрабатывают Darco-60 в течение 15 мин, сушат Na2SO4 и фильтруют, получая указанное в заглавии соединение (0,24 г, 0,61 ммоль, 60%). 1 Н ЯМР (CDCl3),0,88 (т, J=7,4 Гц, 6 Н), 1,75-1,93 (м, 4 Н), 2,20 (с, 3 Н), 2,50 (с, 3 Н), 2,51 (с, 3 Н),3,28-3,37 (м, 1 Н), 4,14 (с, 3 Н), 6,69 (с, 1 Н), 7,45 (с, 1 Н), 7,87 (с, 1 Н). LC/MC (m/z): рассчитано для(0,50 г, 1,28 ммоль), DMF (5 мл) и Zn(CN)2 (0,090 г, 0,76 ммоль) дегазируют азотом в течение 15 мин. Добавляют Pd(PPh3)4 (0,74 г, 0,064 ммоль) и раствор нагревают при 100 С в течение ночи. Раствор разбавляют EtOAc (50 мл), промывают 2 М NH4OH (230 мл), солевым раствором (30 мл), сушат над MgSO4,фильтруют и концентрируют. Очищают с помощью ISCO колоночной хроматографии (градиент 15%20% EtOAc/гексан), получая указанное в заглавии соединение (0,39 г, 1,15 ммоль, 91%). 1 Н ЯМР (CDCl3),0,87 (т, J=7,5 Гц, 6 Н), 1,74-1,91 (м, 4 Н), 2,15 (с, 3 Н), 2,46 (с, 3 Н), 2,51 (с, 3 Н),3,26-3,34 (м, 1 Н), 6,72 (с, 1 Н), 7,53 (с, 1 Н). LC/MC (m/z): рассчитано для C19H22N4S (М+Н)+: 339,6; найдено: 339,2. Пример 27. Получение (2-5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]-4 метилтиофен-2-илпиррол-1-ил)диметиламина К охлажденному до 0 С раствору 1-(диметиламино)пиррола (0,24 мл, 2,04 ммоль) и THF (4 мл) добавляют 1,24 М н-BuLi (1,73 мл, 2,14 ммоль). Раствор нагревают до температуры окружающей среды и перемешивают в течение двух часов. Добавляют 0,5 М ZnCl2 (4,28 мл, 2,14 ммоль) и раствор перемешивают в течение одного часа. Добавляют 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазин (0,40 г, 1,02 ммоль) и PdCl2(dppf) (0,037 г, 0,051 ммоль) и раствор нагревают при 65 С в течение ночи. Раствор разбавляют EtOAc (30 мл), промывают насыщенным NH4C1 А. 8-(1-Этилпропил)-2,6-диметил-3-[3-метил-5-(1 Н-тетразол-5-ил)тиофен-2-ил]имидазо[1,2b]пиридазин К раствору 5-[8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин-3-ил]-4-метилтиофен-2 карбонитрила (0,25 г, 0,74 ммоль) и DMF (2,5 мл) добавляют Et3NHCl (0,31 г, 2,22 ммоль) и NaN3 (0,14 г,2,20 ммоль). Раствор нагревают при 100 С в течение ночи. Раствор разбавляют водой (20 мл) и экстрагируют EtOAc (315 мл), объединенные органические слои промывают 0,1 М HCl (20 мл), водой (20 мл),солевым раствором (20 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток перекристаллизо- 24012393 вывают из ацетонитрила, получая указанное в заглавии соединение (0,14 г, 0,37 ммоль, 50%). 1 Н ЯМР (CDCl3),0,81 (т, J=7,5 Гц, 6 Н), 1,66-1,87 (м, 4 Н), 2,17 (с, 3 Н), 2,50 (с, 3 Н), 2,53 (с, 3 Н),3,26-3,35 (м, 1 Н), 6,83 (с, 1 Н), 7,84 (с, 1 Н). LC/MC (m/z): рассчитано для C19H23N7S (M+H)+: 382,6; найдено: 382,2. В. 8-(1-Этилпропил)-2,6-диметил-3-[3-метил-5-(2-метил-2,5-дигидро-1 Н-тетразол-5-ил)тиофен-2 ил]имидазо[1,2-b]пиридазин и 8-(1-этилпропил)-2,6-диметил-3-[3-метил-5-(1-метил-1 Н-тетразол-5 ил)тиофен-2-ил]имидазо[1,2-b]пиридазин К раствору 8-(1-этилпропил)-2,6-диметил-3-[3-метил-5-(1 Н-тетразол-5-ил)тиофен-2-ил]имидазо[1,2b]пиридазина (0,14 г, 0,35 ммоль) и THF (3 мл) добавляют Et3N (0,1 мл, 0,71 ммоль) и Mel (0,024 мл, 0,39 ммоль). Раствор перемешивают в течение ночи, разбавляют EtOAc (20 мл), промывают водой (15 мл), 0,1 М HCl (15 мл), солевым раствором (15 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают с помощью ISCO колоночной хроматографии (градиент 20-40% EtOAc/гексан), получая пример 28 (0,71 г, 0,18 ммоль, 51%) и пример 29 (0,031 г, 0,078 ммоль, 22%). Пример 28. 1 Н ЯМР (CDCl3),0,88 (т, J=7,4 Гц, 6 Н), 1,75-1,92 (м, 4 Н), 2,18 (с, 3 Н), 2,50 (с, 3 Н), 2,51 (с, 3 Н),3,28-3,38 (м, 1 Н), 4,38 (с, 3 Н), 6,68 (с, 1 Н), 7,71 (с, 1 Н). LC/MC (m/z): рассчитано для C20H25N7S (М+Н)+: 396,6; найдено: 396,3. Пример 29. 1 Н ЯМР (CDCl3),0,89 (т, J=7,4 Гц, 6 Н), 1,73-1,94 (м, 4 Н), 2,23 (с, 3 Н), 2,50 (с, 3 Н), 2,52 (с, 3 Н),3,28-3,37 (м, 1 Н), 4,30 (с, 3 Н), 6,62 (с, 1 Н), 7,63 (с, 1 Н). LC/MC (m/z): рассчитано для C20H25N7S (М+Н)+: 396,6; найдено: 396,3. Пример 30. Получение 8-(1-этилпропил)-2,6-диметил-3-(3-метил-5-пиридин 4-илтиофен-2 ил)имидазо[1,2-b]пиридазинаA. 3-(5-Бороновая кислота-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6-диметилимидазо[1,2b]пиридазин К охлажденному до -78 С раствору 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазина (1,20 г, 3,06 ммоль) и THF (10 мл) по каплям добавляют 1,30 М н-BuLi (2,47 мл, 3,21 ммоль). Раствор перемешивают при -78 С в течение одного часа. Добавляют В(ОМе)3(0,38 мл, 3,65 ммоль) и раствор нагревают до температуры окружающей среды, и перемешивают в течение 2 ч. Добавляют 1 М HCl и раствор перемешивают в течение 10 мин, экстрагируют CH2Cl2 (230 мл),сушат над MgSO4, фильтруют и концентрируют, получая указанное в заглавии соединение (0,47 г, 1,32 ммоль, 43%). 1 Н ЯМР (CDCl3),0,92 (т, J=7,5 Гц, 6 Н), 1,71-1,98 (м, 4 Н), 2,02 (с, 3 Н), 2,64 (с, 3 Н), 2,69 (с, 3 Н),3,64-3,83 (м, 1 Н), 7,06 (д, J=5,3 Гц, 1 Н), 7,54 (д, J=5,3 Гц, 1 Н), 7,20 (с, 1 Н). LC/MC (m/z): рассчитано дляB. 6-(1-Этилпропил)-2,6-диметил-3-(3-метил-5-пиридин-4-илтиофен-2-ил)имидазо[1,2-b]пиридазин Раствор 3-(5-бороновая кислота-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6-диметилимидазо[1,2b]пиридазина (0,25 г, 0,70 ммоль), гидрохлорида 4-бромпиридина (0,16 г, 0,84 ммоль) и 2 М Na2CO3 (0,87 мл, 1,75 ммоль) и н-PrOH (2,5 мл) дегазируют азотом в течение 10 мин. Добавляют Pd(PPh3)4 (0,040 г,0,035 ммоль) и раствор нагревают при 85 С в течение ночи. Раствор разбавляют CH2Cl2 (40 мл), промывают 10% Na2CO3 (30 мл), водой (30 мл), солевым раствором (30 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают с помощью ISCO колоночной хроматографии (градиент 20-40% К охлажденному до -78 С раствору 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазина (0,50 г, 1,27 ммоль) и THF (5 мл) добавляют 1,34 М н-Bu-Li (1,0 мл,1,34 ммоль). Раствор перемешивают при -78 С в течение 30 мин и добавляют 0,5 М ZnCl2 в THF (2,7 мл,- 25012393 1,34 ммоль), и раствор нагревают до температуры окружающей среды. Через 30 мин добавляют 3 бромпиридин (0,15 мл, 1,53 ммоль) и PdCl2(dppf) (0,047 г, 0,064 ммоль) и раствор нагревают при 65 С в течение ночи. Раствор разбавляют CH2Cl2 (40 мл), промывают 10% лимонной кислотой (20 мл), водой (20 мл), солевым раствором (20 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают с помощью ISCO колоночной хроматографии (градиент 20%-40% EtOAc/гексан),концентрируют и повторно растворяют в Et2O. Раствор обрабатывают Darco-60 в течение 15 мин, сушат над Na2SO4 и фильтруют через целит, получая указанное в заглавии соединение (0,26 г, 0,67 ммоль, 52%). 1 Н ЯМР (CDCl3),0,88 (т, J=7,5 Гц, 6 Н), 1,74-1,92 (м, 4 Н), 2,17 (с, 3 Н), 2,50 (с, 3 Н), 2,52 (с, 3 Н),3,28-3,38 (м, 1 Н), 6,68 (с, 1 Н), 7,26-7,32 (м, 2 Н), 7,86 (дт, J=7,9, 1,8 Гц, 1 Н), 850 (д, J=3,2 Гц, 1 Н), 8,89 (с,1 Н). LC/MC (m/z): рассчитано для C23H26N4S (М+Н)+: 391,6; найдено: 391,2. Пример 32. Получение 8-(1-этилпропил)-2,6-диметил-3-(3-метил-5-пиридин-2-илтиофен-2 ил)имидазо[1,2-b]пиридазина(0,50 г, 1,27 ммоль)и PdCl2(dppf) (0,047 г, 0,064 ммоль) добавляют 0,5 М раствор 2-пиридилцинк бромида в THF (5,1 мл, 2,55 ммоль). Смесь перемешивают при 65 С в течение ночи, разбавляют EtOAc (50 мл),промывают 10% лимонной кислотой (50 мл), водой (40 мл), солевым раствором (40 мл), сушат над К раствору 8-(1-этилпропил)-2,6-диметил-3-(3-метил-5-пиридин-2-илтиофен-2-ил)имидазо[1,2b]пиридазина (0,15 г, 38 ммоль) и МеОН (2 мл) добавляют АсС 1 (0,028 мл, 0,39 ммоль). Через один час раствор концентрируют и остаток перекристаллизовывают из EtOAc/гексана, получая указанное в заглавии соединение (0,11 г, 0,26 ммоль, 69%). 1 Н ЯМР (CDCl3),0,97 (т, J=7,4 Гц, 6 Н), 1,75-2,03 (м, 4 Н), 2,17 (с, 3 Н), 2,66 (с, 3 Н), 2,77 (с, 3 Н),3,86-3,98 (м, 1 Н), 7,17 (с, 1 Н), 7,21-7,30 (м, 2 Н), 7,62 (ушир.с, 1 Н), 7,67-7,82 (м, 2 Н), 8,60 (д, J=4,8 Гц, 1 Н). Используя методику, подобную примеру 32, 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазин (0,50 г, 1,27 ммоль) и PdCl2 (dppf) (0,05 г, 0,069 ммоль) и 0,5 М раствор фенилцинк йодид в THF (5,5 мл, 2,76 ммоль), получают указанное в заглавии соединение (0,25 г, 0,64 ммоль, 50%). 1 Н ЯМР (CDCl3),0,90 (т, J=7,5 Гц, 6 Н), 1,76-1,94 (м, 4 Н), 2,17 (с, 3 Н), 2,52 (с, 3 Н), 2,53 (с, 3 Н),3,31-3,41 (м, 1 Н), 6,68 (с, 1 Н), 7,26 (с, 1 Н), 7,27-7,30 (м, 1 Н), 7,35-7,41 (м, 2 Н), 7,61-7,66 (м, 2 Н). LC/MC Суспензию 0,05 г/мл Zn Рейке в THF (0,26 г, 4,01 ммоль) и 1-бром-4-фторбензол (0,29 мл, 2,68 ммоль) нагревают при кипении с обратным холодильником в течение ночи. Раствор фильтруют под азотом. Добавляют 3-(5-бром-3-метилтиофен-2-ил)-8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазин(0,35 г, 0,89 ммоль) и PdCl2(dppf) (0,033 г, 0,045 ммоль) и раствор нагревают при кипении с обратным холодильником в течение ночи, разбавляют EtOAc (30 мл), промывают 10% лимонной кислотой (20 мл),водой (20 мл), солевым раствором (20 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очи- 27012393 щают с помощью ISCO колоночной хроматографии (градиент 10%-15% EtOAc/гексан), получая указанное в заглавии соединение (0,091 г, 0,22 ммоль, 25%). 1 Н ЯМР (CDCl3),0,88 (т, J=7,5 Гц, 6 Н), 1,74-1,92 (м, 4 Н), 2,15 (с, 3 Н), 2,50 (с, 3 Н), 2,52 (с, 3 Н),3,30-3,38 (м, 1 Н), 6,68 (с, 1 Н), 7,08 (д, J=8,8 Гц, 2 Н), 7,18 (с, 1 Н), 7,59 (дд, J=8,5, 5,3 Гц, 2 Н). LC/MC (m/z): рассчитано для C24H26FN3S (М+Н)+: 408,7; найдено: 408,3. Пример 40. Получение 8-(1-этиллропил)-2,6-диметил-3-[3-этил-5-(6-метилпиридин-2-ил)тиофен-2 ил]имидазо[1,2-b]пиридазина 82 мг 1-метил-1,2,4-триазола (0,99 ммоль) растворяют в 2 мл сухого THF и охлаждают до -78 С и добавляют 0,4 мл н-бутиллития 2,5 М в гексане (0,99 ммоль). Реакционную смесь перемешивают при от 78 С до комнатной температуры в течение 10 мин и снова охлаждают до -78 С. Добавляют 1,98 мл 0,5 М хлорида цинка, 0,5 М раствора в THF (0,99 ммоль) и перемешивают при от -78 С до комнатной температуры в течение 15 мин. Добавляют 265 мг 3-(2-бром-4-метилтиазол-5-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазина (0,66 ммоль) и 27 мг PdCl2(dppf) (0,033 ммоль) и колбу закрывают тефлоновой крышкой и нагревают при 80 С в течение 2 дней. Реакционную смесь охлаждают до комнатной температуры и гасят насыщенным NH4Cl, и экстрагируют CH2Cl2. Отделенный CH2Cl2 слой сушат над Na2SO4 и выпаривают. Неочищенный продукт очищают на хроматографической колонке с силикагелем (гексан:AcOEt: 2 М NH3 в МеОН=10:2:1), получая 57 мг указанного в заглавии продукта. Выход 22%. Масс-спектр (m/e): 396 (М+1). 82 мг 1-метил-1,2,4-триазола (0,99 ммоль) растворяют в 2 мл сухого THF и охлаждают до -78 С, и добавляют 0,4 мл 2,5 М н-бутиллития в гексане (0,99 ммоль). Реакционную смесь перемешивают при от-78 С до комнатной температуры в течение 10 мин и снова охлаждают до -78 С. Добавляют 1,98 мл 0,5 М хлорида цинка, 0,5 М раствор в THF (0,99 ммоль) и перемешивают при от -78 С до комнатной температуры в течение 15 мин. Добавляют 152 мг 3-(2,4-дибромтиазол-5-ил)-8-(1-этилпропил)-2,6 диметилимидазо[1,2-b]пиридазина (0,33 ммоль) и 27 мг PdCl2(dppf) (0,033 ммоль) и колбу закрывают тефлоновой крышкой и нагревают при 80 С в течение 2 дней. Реакционную смесь охлаждают до комнатной температуры и гасят насыщенным NH4Cl, и экстрагируют СН 2Cl2. Отделенный СН 2Cl2 слой сушат над Na2SO4 и выпаривают. Неочищенный продукт очищают на хроматографической колонке с силикагелем (гексан:AcOEt:2 М NH3 в МеОН=10:2:1), получая 88 мг указанного в заглавии продукта. Выход 54%. Масс-спектр (m/e): 461(М+1). 1 Н ЯМР (CDCl3): 7,98 (с, 1 Н), 6,77 (с, 1 Н), 4,44 (с, 3 Н), 3,35 (м, 1 Н), 2,59 175 мг 3-[4-бром-2-(2-метил-2 Н-[1,2,4]триазол-3-ил)тиазол-5-ил]-8-(1-этилпропил)-2,6-диметилимидазо[1,2-b]пиридазина (0,38 ммоль) и 56 мг хлорида меди (0,57 ммоль) помещают в 4-мл колбу с 3,0 мл сухого DMF, и колбу закрывают тефлоновой крышкой. Колбу нагревают при 130 С в течение ночи. Реакционную смесь очищают на хроматографической колонке с силикагелем (гексан:AcOEt=3:1 и гексан:AcOEt=8:1), получая 91 мг неочищенного продукта. Неочищенный продукт перекристаллизовывают из Et2O/гексан. 73 мг (46%). Масс-спектр (m/e): 416 (М+1). 1 Н ЯМР (CDCl3): 7,98 (с, 1 Н), 6,80 (с, 1 Н), 4,44 (с, 3 Н), 3,35 (м, 1 Н), 2,59 (с, 3 Н), 1,88 (м, 4 Н), 0,92 (т,J=7,5 Гц, 6 Н). Пример 50. Получение 8-(1-этилпропил)-2,6-диметил-3-(4-метилоксазол-5-ил)имидазо[1,2b]пиридазина(0,1 ммоль). Пробирку запаивают и нагревают при 130 С в течение ночи. Потом смесь охлаждают до комнатной температуры, добавляют воду и CH2Cl2. CH2Cl2 слой отделяют, промывают насыщеннымNaCl, сушат над Na2SO4 и выпаривают. Неочищенный продукт очищают на хроматографической колонке с силикагелем (гексан:AcOEt=5:1), получая 234 мг указанного в заглавии продукта. Выход 39%. Массспектр (m/e): 299 (М+1). 1 Н ЯМР (CDCl3): 8,06 (с, 1 Н), 6,75 (с, 1 Н), 3,34 (м, 1 Н), 2,56 (с, 3 Н), 2,50 (с, 3 Н), 2,29 (с, 3 Н), 1,86 (м,4 Н), 0,90 (т, J=7,4 Гц, 6 Н).
МПК / Метки
МПК: A61K 31/5025, A61P 25/20, C07D 487/04
Метки: имидазопиридазиновые, соединения
Код ссылки
<a href="https://eas.patents.su/30-12393-imidazopiridazinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Имидазопиридазиновые соединения</a>
Предыдущий патент: Твердая фармацевтическая композиция, содержащая валсартан
Следующий патент: Узел регенерации для жидкости, содержащий фильтровальный узел и нагревательный узел
Случайный патент: Буровой раствор переменной плотности