Сульфониламиноциклические соединения и их применение
Номер патента: 12266
Опубликовано: 28.08.2009
Авторы: Жоран-Лебрэн Катрин, Жербер Патрик, Свиннен Доминик, Бомбрэн Аньес
Формула / Реферат
1. Сульфониламиноциклическое соединение формулы (I)
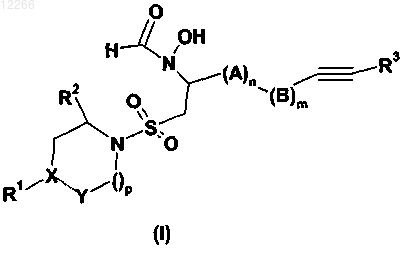
где А представляет собой -CR4R5;
В представляет собой -CR4'R5';
R1 выбран из необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного С3-С6-циклоалкила и необязательно замещенного гетероциклоалкила;
R2 выбран из Н, необязательно замещенного С1-С6-алкила, необязательно замещенного С2-С6-алкенила и необязательно замещенного С2-С6-алкинила;
R3 выбран из Н, -Si (C1-С6-алкила)3, необязательно замещенного амино-С1-С6-алкила, необязательно замещенного C1-C6-алкила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного арил-C1-C6-алкила, необязательно замещенного гетероарил-С1-С6-алкила, необязательно замещенного С3-С8-циклоалкил-С1-С6-алкила, необязательно замещенного гетероциклоалкил-С1-С6-алкила, необязательно замещенного С3-С8-циклоалкила и необязательно замещенного гетероциклоалкила;
R4, R5, R4' и R5' независимо выбраны из Н, галогена, необязательно замещенного С1-С6-алкила, необязательно замещенного С2-С6-алкенила и необязательно замещенного С2-С6-алкинила;
X выбран из С, СН или N;
Y выбран из СН и СН2 и группа -XЧЧЧЧY- выбрана из -С=СН-, -СН-СН2- и -N-CH2-;
m равно 0, 1 или 2;
n равно 0 или 1;
р равно 1 или 2;
где вышеуказанный термин арил относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо или несколько конденсированных колец; вышеуказанный термин гетероциклоалкил относится к С3-С8-циклоалкильной группе, в которой вплоть до 3 атомов углерода заменены на гетероатомы, выбранные из группы, состоящей из О, S, NR, причем R представляет собой водород или метил; вышеуказанный термин гетероарил относится к моноциклической гетероароматической или бициклической или трициклической конденсированной гетероароматической группе,
и где термин "необязательно замещенные" означает, что указанные группы могут быть необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, циклоалкила, гетероциклоалкила, арил-С1-С6-алкила, гетероарил-С1-С6-алкила, циклоалкил-С1-С6-алкила, гетероциклоалкил-С1-С6-алкила, амино, аммония, ацила, ацилокси, ациламино, аминокарбонила, алкоксикарбонила, уреидо, арила, карбамата, гетероарила, сульфинила, сульфонила, алкокси, сульфанила, галогена, карбокси, тригалогенметила, циано, гидрокси, меркапто и нитро,
а также его оптически активные формы, такие как энантиомеры, диастереомеры, и его рацемические формы, а также их фармацевтически приемлемые соли.
2. Сульфониламиноциклическое соединение по п.1, где R1 представляет собой арил.
3. Сульфониламиноциклическое соединение по п.1 или 2, где R1 представляет собой фенил.
4. Сульфониламиноциклическое соединение по п.1, где R1 представляет собой гетероарил.
5. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где R2 представляет собой Н или метил.
6. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где R3 выбран из арила и гетероарила.
7. Сульфониламиноциклическое соединение по пп.1-5, где R3 выбран из C1-С6-алкила, арил-С1-С6-алкила, гетероарил-С1-С6-алкила, С3-С8-циклоалкил-С1-С6-алкила и гетероциклоалкил-С1-С6-алкила.
8. Сульфониламиноциклическое соединение по пп.1-5, где R3 представляет собой Н.
9. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где Y представляет собой СН2.
10. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где n равно 0.
11. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где m равно 0.
12. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где m и n равны 1.
13. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где р равно 1.
14. Сульфониламиноциклическое соединение по любому из предыдущих пунктов, где р равно 2.
15. Сульфониламиноциклическое соединение по любомуиз предыдущих пунктов, где R1 выбран из арила и гетероарила; R2 выбран из Н или метила; Y представляет собой СН2; X, А, В, n, m, p и R3 имеют значения, указанные в предыдущих пунктах.
16. Сульфониламиноциклическое соединение по любому из пп.1-15, где R1 выбран из арила и гетероарила; R2 выбран из Н или метила, Y представляет собой СН2; A представляет собой С(СН3)2; В представляет собой СН2; m и n равны 1; X, р и R3 имеют значения, указанные в предыдущих пунктах.
17. Сульфониламиноциклическое соединение формулы (I) по любому из предыдущих пунктов, выбранное из группы, включающей
3-(1,3-бензодиоксол-5-ил)-1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-2-пропинил(гидрокси)формамид;
1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-3-(триметилсилил)-2-пропинил(гидрокси)формамид;
гидрокси-[1-{[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил}-3-(триметилсилил)проп-2-ин-1-ил]формамид;
1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-3-фенил-2-пропинил(гидрокси)формамид;
1-[({4-[4-(бензилокси)фенил]-1-пиперазинил}сульфонил)метил]-2-октинил(гидрокси)формамид;
1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-4-фенил-2-бутинил(гидрокси)формамид;
1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-2-октинил(гидрокси)формамид;
1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-3-(3-пиридинил)-2-пропинил(гидрокси)формамид;
гидрокси-[1-({[4-(4-метоксифенил)-1-пиперазинил]сульфонил}метил)-3-(3-пиридинил)-2-пропинил]формамид;
гидрокси-[3-(3-метоксифенил)-1-({[4-(4-метоксифенил)-1-пиперазинил]сульфонил}метил)-2-пропинил]формамид;
4-(диэтиламино)-1-({[4-(4-метоксифенил)-1-пиперазинил]сульфонил}метил)-2-бутинил(гидрокси)формамид;
гидрокси-(1-{[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил}проп-2-ин-1-ил)формамид;
гидрокси-{1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]-3-фенилпроп-2-ин-1-ил}формамид;
гидрокси-(1-{[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил}гекс-2-ин-1-ил)формамид;
[1-({[4-(2-фторфенил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-(1-{[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил}окт-2-ин-1-ил)формамид;
гидрокси-{1-[({4-[4-(трифторметил)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
[1-({[4-(4-фторфенил)пиперидин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-{1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
{1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-3-[3-(метилокси)фенил]проп-2-ин-1-ил}гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)гекс-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-3-хинолин-3-илпроп-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперидин-1-ил]сульфонил}метил)-3-фенилпроп-2-ин-1-ил]гидроксиформамид;
гидрокси-(3-фенил-1-{[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил}проп-2-ин-1-ил)формамид;
гидрокси-{3-фенил-1-[({4-[4-(трифторметил)фенил]пиперазин-1-ил}сульфонил)метил]проп-2-ин-1-ил}формамид;
гидрокси-{1-[({4-[4-(метилокси)фенил]пиперазин-1-ил}сульфонил)метил]-3-фенилпроп-2-ин-1-ил}формамид;
{1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-3-[4-(1,2,4-оксадиазол-3-ил)фенил]проп-2-ин-1-ил}гидроксиформамид;
гидрокси-{1-[({4-[4-(метилокси)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
(1-{[(4-бифенил-4-илпиперазин-1-ил)сульфонил]метил}-3-фенилпроп-2-ин-1-ил)гидроксиформамид;
[1-({[4-(5-хлорпиридин-2-ил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-(1-{[(4-пиримидин-2-илпиперазин-1-ил)сульфонил]метил}окт-2-ин-1-ил)формамид;
гидрокси-(1-{[(4-фенилпиперазин-1-ил)сульфонил]метил}окт-2-ин-1-ил)формамид;
[1-({[4-(4-хлорфенил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-{1-[({4-[2-(метилокси)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
гидрокси-{1-[({4-[3-(метилокси)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-2,2-диметил-5-фенилпент-4-ин-1-ил]гидроксиформамид;
{4-(диэтиламино)-1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]бут-2-ин-1-ил}гидроксиформамид;
гидрокси-{1-[({4-[5-(трифторметил)пиридин-2-ил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
гидрокси-{1-[({4-[4-(фенилокси)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)гепт-2-ин-1-ил]гидроксиформамид;
{3-(2-фторфенил)-1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]проп-2-ин-1-ил}гидроксиформамид;
{3-(4-фторфенил)-1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]проп-2-ин-1-ил}гидроксиформамид;
[1-({[4-(4-хлорфенил)пиперидин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-[1-({[4-(4-метилфенил)пиперидин-1-ил] сульфонил}метил)окт-2-ин-1-ил]формамид;
{3-(3-фторфенил)-1-[({4-[4-(метилокси)фенил]пиперидин-1-ил}сульфонил)метил]проп-2-ин-1-ил}гидроксиформамид;
гидрокси-{1-[({4-[5-(трифторметил)пиридин-2-ил]-1,4-диазепан-1-ил}сульфонил)метил]окт-2-ин-1-ил}формамид;
{1-[({4-[4-(этилокси)фенил]пиперазин-1-ил}сульфонил)метил]окт-2-ин-1-ил}гидроксиформамид;
[1-({[4-(5-бромпиридин-2-ил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-4-морфолин-4-илбут-2-ин-1-ил]гидроксиформамид;
[1-({[4-(3-хлорфенил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
[1-({[4-(1,3-бензодиоксол-5-ил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
гидрокси-{1-[({4-[3-(метилокси)фенил]пиперазин-1-ил}сульфонил)метил]-3-фенилпроп-2-ин-1-ил}формамид;
гидрокси-[1-({[4-(4-метилфенил)пиперидин-1-ил]сульфонил}метил)-3-фенилпроп-2-ин-1-ил]формамид;
[1-({[4-(4-хлорфенил)пиперазин-1-ил]сульфонил}метил)-3-фенилпроп-2-ин-1-ил]гидроксиформамид;
{1-[({4-[4-(этилокси)фенил]пиперазин-1-ил}сульфонил)метил]-3-фенилпроп-2-ин-1-ил}гидроксиформамид;
[1-({[4-(5-бромпиридин-2-ил)пиперазин-1-ил]сульфонил}метил)-2,2-диметил-5-фенилпент-4-ин-1-ил] гидроксиформамид;
{2,2-диметил-5-фенил-1-[({4-[4-(трифторметил)фенил]пиперазин-1-ил}сульфонил)метил]пент-4-ин-1-ил}гидроксиформамид;
[1-({[4-(5-хлорпиридин-2-ил)пиперазин-1-ил]сульфонил}метил)гекс-2-ин-1-ил]гидроксиформамид;
{1-[({4-[4-(этилокси)фенил]пиперазин-1-ил}сульфонил)метил]-2,2-диметил-5-фенилпент-4-ин-1-ил}гидроксиформамид;
[1-({[4-(3,4-диметоксифенил)пиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-этилоксифенил)-1,4-диазепан-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
[1-({[(2R)-4-(4-фторфенил)-2-метилпиперазин-1-ил]сульфонил}метил)окт-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-2,2-диметилпент-4-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-4-пирролидин-1-илбут-2-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-2,2-диметил-6-морфолин-4-илгекс-4-ин-1-ил]гидроксиформамид;
[1-({[4-(4-фторфенил)пиперазин-1-ил]сульфонил}метил)-2,2-диметилгепт-4-ин-1-ил]гидроксиформамид.
18. Применение сульфониламиноциклического соединения по пп.1-17 в качестве лекарственного средства.
19. Применение сульфониламиноциклического соединения по пп.1-17 для изготовления фармацевтического препарата для лечения нарушения, выбранного из аутоиммунных нарушений, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, удара, рака, преждевременных родов, респираторных заболеваний и фиброза.
20. Применение по п.19, где аутоиммунное нарушение выбрано из ревматоидного артрита и рассеянного склероза.
21. Фармацевтическая композиция, содержащая сульфониламиноциклическое соединение по любому из пп.1-17 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
22. Способ получения сульфониламиноциклического соединения по любому из пп.1-17, включающий стадию взаимодействия соединения формулы (II) с формилирующим агентом формулы (FA)
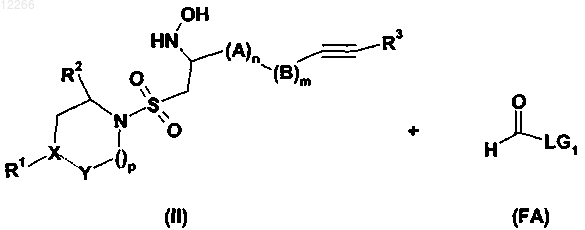
где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные в предыдущих пунктах; LG1 представляет собой группу, выбранную из ОН, -OAc, -O-Piv, -OCH2CN, -OCH2-CF3, -О-фенила и OPfp.
23. Соединение формулы (II)
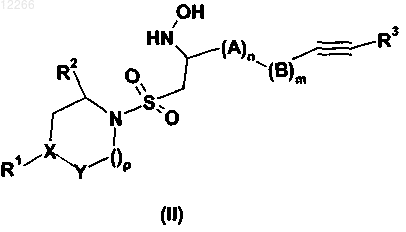
где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные в предыдущих пунктах.
24. Соединение формулы (II) по п.23, выбранное из группы, включающей
N-[3-(1,3-бензодиоксол-5-ил)-1-({[4-(4-фторфенил)-1-пиперазинил]сульфонил}метил)-2-пропинил]гидроксиламин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-4-(триметилсилил)-3-бутинил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)-4-(триметилсилил)-3-бутинил]сульфонил}-4-(2-пиридинил)пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-4-фенил-3-бутинил]сульфонил}пиперазин;
1-[4-(бензилокси)фенил]-4-{[2-(гидроксиамино)-3-нонинил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-5-фенил-3-пентинил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-3-нонинил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-4-(3-пиридинил)-3-бутинил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)-4-(3-пиридинил)-3-бутинил]сульфонил}-4-(4-метоксифенил)пиперазин;
1-{[2-(гидроксиамино)-4-(3-метоксифенил)-3-бутинил]сульфонил}-4-(4-метоксифенил)пиперазин;
N,N-диэтил-4-(гидроксиамино)-5-{[4-(4-метоксифенил)-1-пиперазинил]сульфонил}-2-пентин-1-амин;
1-{[2-(гидроксиамино)бут-3-ин-1-ил]сульфонил}-4-пиридин-2-илпиперазин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-{[2-(гидроксиамино)гепт-3-ин-1-ил]сульфонил}-4-пиридин-2-илпиперазин;
1-(2-фторфенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-пиридин-2-илпиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-[4-(трифторметил)фенил]пиперазин;
4-(4-фторфенил)-1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперидин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-4-(3-метоксифенил)бут-3-ин-1-ил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)гепт-3-ин-1-ил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-[4-(трифторметил)фенил]пиперазин;
3-[4-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}-3-(гидроксиамино)бут-1-ин-1-ил]хинолин;
4-(4-фторфенил)-1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}пиперидин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-пиридин-2-илпиперазин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперазин;
1-(4-фторфенил)-4-({2-(гидроксиамино)-4-[4-(1,2,4-оксадиазол-3-ил)фенил]бут-3-ин-1-ил}сульфонил)пиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперазин;
1-бифенил-4-ил-4-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}пиперазин;
1-(5-хлорпиридин-2-ил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
2-(4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин-1-ил)пиримидин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-фенилпиперазин;
1-(4-хлорфенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(2-метоксифенил)пиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(3-метоксифенил)пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-3,3-диметил-6-фенилгекс-5-ин-1-ил]сульфонил}пиперазин;
N,N-диэтил-4-(гидроксиамино)-5-{[4-(4-метоксифенил)пиперидин-1-ил]сульфонил}пент-2-ин-1-амин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-[5-(трифторметил)пиридин-2-ил]пиперазин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(4-феноксифенил)пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)окт-3-ин-1-ил]сульфонил}пиперазин;
1-{[4-(2-фторфенил)-2-(гидроксиамино)бут-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-{[4-(4-фторфенил)-2-(гидроксиамино)бут-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
4-(4-хлорфенил)-1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперидин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-(4-метилфенил)пиперидин;
1-{[4-(3-фторфенил)-2-(гидроксиамино)бут-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-4-[5-(трифторметил)пиридин-2-ил]-1,4-диазепан;
1-(4-этоксифенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-(5-бромпиридин-2-ил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
4-[5-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}-4-(гидроксиамино)пент-2-ин-1-ил]морфолин;
1-(3-хлорфенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-(1,3-бензодиоксол-5-ил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-(3-метоксифенил) пиперазин;
1-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}-4-(4-метилфенил)пиперидин;
1-(4-хлорфенил)-4-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}пиперазин;
1-(4-этоксифенил)-4-{[2-(гидроксиамино)-4-фенилбут-3-ин-1-ил]сульфонил}пиперазин;
1-(5-бромпиридин-2-ил)-4-{[2-(гидроксиамино)-3,3-диметил-6-фенилгекс-5-ин-1-ил]сульфонил}пиперазин;
1-{[2-(гидроксиамино)-3,3-диметил-6-фенилгекс-5-ин-1-ил]сульфонил}-4-[4-(трифторметил)фенил]пиперазин;
1-(5-хлорпиридин-2-ил)-4-{[2-(гидроксиамино)гепт-3-ин-1-ил]сульфонил}пиперазин;
1-(4-этоксифенил)-4-{[2-(гидроксиамино)-3,3-диметил-6-фенилгекс-5-ин-1-ил]сульфонил}пиперазин;
1-(3,4-диметоксифенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}пиперазин;
1-(4-этоксифенил)-4-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-1,4-диазепан;
(2R)-4-(4-фторфенил)-1-{[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил}-2-метилпиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-3,3-диметилгекс-5-ин-1-ил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-5-пирролидин-1-илпент-3-ин-1-ил]сульфонил}пиперазин;
4-[7-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}-6-(гидроксиамино)-5,5-диметилгепт-2-ин-1-ил]морфолин;
1-(4-фторфенил)-4-{[2-(гидроксиамино)-3,3-диметилокт-5-ин-1-ил]сульфонил}пиперазин.
25. Способ получения сульфониламиноциклического соединения по любому из пп.1-17, включающий стадию взаимодействия соединения формулы (III) с гидроксиламином или производным гидроксиламина формулы (НА)
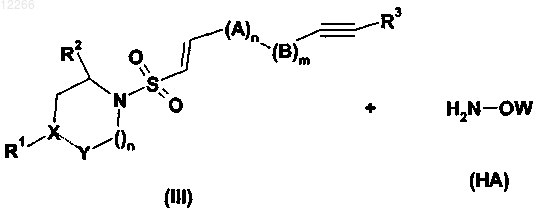
где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные в предыдущих пунктах; W выбран из Н, бензила, TMS, TBDMS и ТНР.
26. Соединение формулы (III)
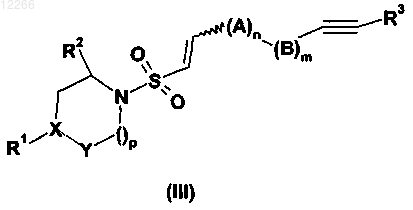
где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные в предыдущих пунктах.
27. Соединение по п.26, выбранное из группы, включающей
1-{[(1E)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил}-4-(4-фторфенил)пиперазин;
1-{[(1Z)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил}-4-(4-фторфенил)пиперазин;
1-(4-фторфенил)-4-{[(1E)-4-(триметилсилил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[(1Z)-4-(триметилсилил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(2-пиридинил)-4-{[(1Е)-4-(триметилсилил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(2-пиридинил)-4-{[(1Z)-4-(триметилсилил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[(1E)-4-фенил-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[(1Z)-4-фенил-1-бутен-3-инил]сульфонил}пиперазин;
бензил-4-{4-[(1E)-1-нонен-3-инилсульфонил]-1-пиперазинил}фениловый простой эфир;
бензил-4-{4-[(1Z)-1-нонен-3-инилсульфонил]-1-пиперазинил}фениловый простой эфир;
1- (4-фторфенил)-4-{[(1E)-5-фенил-1-пентен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[(1Z)-5-фенил-1-пентен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-[(1E)-1-нонен-3-инилсульфонил]пиперазин;
1-(4-фторфенил)-4-[(1Z)-1-нонен-3-инилсульфонил]пиперазин;
1-(4-фторфенил)-4-{[(1E)-4-(3-пиридинил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-фторфенил)-4-{[(1Z)-4-(3-пиридинил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-метоксифенил)-4-{[(1E)-4-(3-пиридинил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-метоксифенил)-4-{[(1Z)-4-(3-пиридинил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-метоксифенил)-4-{[(1E)-4-(3-метоксифенил)-1-бутен-3-инил]сульфонил}пиперазин;
1-(4-метоксифенил)-4-{[(1Z)-4-(3-метоксифенил)-1-бутен-3-инил]сульфонил}пиперазин;
N,N-диэтил-N-((4Е)-5-{[4-(4-метоксифенил)-1-пиперазинил]сульфонил}-4-пентен-2-инил)амин;
N,N-диэтил-N-((4Z)-5-{[4-(4-метоксифенил)-1-пиперазинил]сульфонил}-4-пентен-2-инил)амин;
1-[(1E)-бут-1-ен-3-ин-1-илсульфонил]-4-пиридин-2-илпиперазин;
1-[(1Z)-бут-1-ен-3-ин-1-илсульфонил]-4-пиридин-2-илпиперазин;
4-(4-метоксифенил)-1-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперидин;
1-[гепт-1-ен-3-ин-1-илсульфонил]-4-пиридин-2-илпиперазин;
1-(2-фторфенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-пиридин-2-илпиперазин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-[4-(трифторметил)фенил]пиперазин;
4-(4-фторфенил)-1-[нон-1-ен-3-ин-1-илсульфонил]пиперидин;
4-(4-метоксифенил)-1-[нон-1-ен-3-ин-1-илсульфонил]пиперидин;
1-(4-фторфенил)-4-{[4-(3-метоксифенил)бут-1-ен-3-ин-1-ил]сульфонил}пиперазин;
1-(4-фторфенил)-4-[гепт-1-ен-3-ин-1-илсульфонил]пиперазин;
1-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}-4-[4-(трифторметил)фенил]пиперазин;
3-((3Е)-4-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}бут-3-ен-1-ин-1-ил)хинолин;
4-(4-фторфенил)-1-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперидин;
1-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}-4-пиридин-2-илпиперазин;
1-(4-метоксифенил)-4-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперазин;
1-(4-фторфенил)-4-({4-[4-(1,2,4-оксадиазол-3-ил)фенил]бут-1-ен-3-ин-1-ил}сульфонил)пиперазин;
1-(4-метоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-бифенил-4-ил-4-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперазин;
1-(5-хлорпиридин-2-ил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
2-{4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин-1-ил}пиримидин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-фенилпиперазин;
1-(4-хлорфенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(2-метоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(3-метоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-{[3,3-диметил-6-фенилгекс-1-ен-5-ин-1-ил]сульфонил}-4-(4-фторфенил)пиперазин;
N,N-диэтил-5-{[4-(4-метоксифенил)пиперидин-1-ил]сульфонил}пент-4-ен-2-ин-1-амин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-[5-(трифторметил)пиридин-2-ил]пиперазин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-(4-феноксифенил)пиперазин;
1-(4-фторфенил)-4-[окт-1-ен-3-ин-1-илсульфонил]пиперазин;
1-{[4-(2-фторфенил)бут-1-ен-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-{[4-(4-фторфенил)бут-1-ен-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
4-(4-хлорфенил)-1-[нон-1-ен-3-ин-1-илсульфонил]пиперидин;
4-(4-метилфенил)-1-[нон-1-ен-3-ин-1-илсульфонил]пиперидин;
1-{[4-(3-фторфенил)бут-1-ен-3-ин-1-ил]сульфонил}-4-(4-метоксифенил)пиперидин;
1-[нон-1-ен-3-ин-1-илсульфонил]-4-[5-(трифторметил)пиридин-2-ил]-1,4-диазепан;
1-(4-этоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(5-бромпиридин-2-ил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
4-(5-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}пент-4-ен-2-ин-1-ил)морфолин;
1-(3-хлорфенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(1,3-бензодиоксол-5-ил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(3-метоксифенил)-4-{[4-фенилбут-1-ен-3-ин-1-ил] сульфонил}пиперазин;
4-(4-метилфенил)-1-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперидин;
1-(4-хлорфенил)-4-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперазин;
1-(4-этоксифенил)-4-{[4-фенилбут-1-ен-3-ин-1-ил]сульфонил}пиперазин;
1-(5-бромпиридин-2-ил)-4-{[3,3-диметил-6-фенилгекс-1-ен-5-ин-1-ил]сульфонил}пиперазин;
1-{[3,3-диметил-6-фенилгекс-1-ен-5-ин-1-ил]сульфонил}-4-[4-(трифторметил)фенил]пиперазин;
1-(5-хлорпиридин-2-ил)-4-[гепт-1-ен-3-ин-1-илсульфонил]пиперазин;
1-{[3,3-диметил-6-фенилгекс-1-ен-5-ин-1-ил]сульфонил}-4-(4-этоксифенил)пиперазин;
1-(3,4-диметоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-(4-этоксифенил)-4-[нон-1-ен-3-ин-1-илсульфонил]-1,4-диазепан;
(2R)-4-(4-фторфенил)-2-метил-1-[нон-1-ен-3-ин-1-илсульфонил]пиперазин;
1-{[3,3-диметилгекс-1-ен-5-ин-1-ил]сульфонил}-4-(4-фторфенил)пиперазин;
1- (4-фторфенил)-4-{[5-пирролидин-1-илпент-1-ен-3-ин-1-ил]сульфонил}пиперазин;
4-(7-{[4-(4-фторфенил)пиперазин-1-ил]сульфонил}-5,5-диметилгепт-6-ен-2-ин-1-ил)морфолин;
1-{[3,3-диметилокт-1-ен-5-ин-1-ил]сульфонил}-4-(4-фторфенил)пиперазин.
Текст
012266 Область техники, к которой относится изобретение Настоящее изобретение относится к сульфониламиноциклическим соединениям формулы (I), их фармацевтическим композициям, их применению для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, рака, респираторных заболеваний и фиброза и способам их получения. Конкретно, настоящее изобретение относится к применению сульфониламиноциклических соединений для модуляции, а именно ингибирования активности или функции металлопротеиназ матрикса, таких как желатиназы и металлоэластазы. Уровень техники Металлопротеиназы являются суперсемейством протеиназ (ферментов), названных вследствие их зависимости от иона металла (цинка) в активном сайте. Металлопротеиназы матрикса (ММР) образуют подсемейство металлопротеиназ, имеющих в качестве одной основной биологической функции катализ разрушения соединительной ткани или внеклеточного матрикса посредством их способности гидролизовать различные компоненты ткани или матрикса,такие как коллагены, желатины, протеогликаны, фибронектины и эластин. Семейство металлопротеиназ матрикса далее подразделяют согласно их функции и субстратам (Visse al., 2003, Circ. Res., 92, 827-839),и это семейство включает коллагеназы (ММР-1, MMP-8, ММР-13 и ММР-18), желатиназы (ММР-2 и ММР-9), стромелизины (ММР-3, ММР-10 и ММР-11), ММР мембранного типа (от МТ-ММР-1 до МТММР-6 и ММР-14, ММР-15, ММР-16, ММР-17, ММР-24 и ММР-25), матрилизины (ММР-7 и ММР-26) и другие неклассифицированные ММР, такие как металлоэластаза (ММР-12), енамелизин (ММР-20),эпилизин (ММР-28), ММР-19, ММР-22 и ММР-23. Независимо от их роли в разрушении соединительной ткани, ММР принимают участие в биосинтезе TNF- и в процессе посттрансляционного протеолиза или терминальной стадии образования биологически важных белков мембраны (Hooper et al., 1997, Biochem J. , 265-279). ММР, например, содействуют локальному росту и распространению злокачественных повреждений и поэтому являются мишенью для разработки противоопухолевого лекарственного средства (Fingleton et al., 2003, Expert Opin. Ther. Targets,7(3): 385-397). Показано, что нарушения, такие как воспалительные нарушения, подобные артриту (Clarket al., 2003, Expert. Opin. Ther Targets, 7(1): 19-34), респираторные нарушения, такие как эмфизема, атеросклероз (Galis et al., 2002, Circ. Res., 90:251-262), неврологические нарушения, такие как дегенеративные заболевания нервной системы, рассеянный склероз (Leppert: et al., 2001, Brain Res. Rev., 36:249-257), периодонтит (Ingman et al., 1996, J. clin. Periodontal., 23:127-1132), преждевременные роды (Makrakis et al.,2003, J. Matern FetalNeonatal Medicine, 14(3): 170-6) и заживление ран, связаны с экспрессией и/или активностью ММР. Разработано большое число ингибиторов металлопротеиназ матрикса (MMPI) (Skiles et al., 2001,Current Medicinal Chemistry, 8, 425-474; Peterson, 2004, Heart Failure Reviews, 9, 63-79; Henrotin et al.,2002, Expert Opin. Ther. Patents, 12(1): 29-43). Однако многие MMPI проявляют мышечно-скелетный синдром (тендинит, фиброплазию, милазию, артралазию) в качестве дозаограничивающего побочного действия. Было предположено, что ингибирование ММР-1 или ММР-14 может быть ответственным за эти действия. Следовательно, существует возрастающая потребность в разработке ингибиторов металлопротеиназ матрикса с профилем четко определенной специфичности. Описаны специфические ингибиторы, особенно в отношении ММР-1, в том числе ингибиторы ММР-13 (Stotnicki et al., 2003, Current Opinion in Drug Discovery and Development, 6(5): 742-759), ингибиторы ММР-12 (WO 01/83461; WO 03/070711), ингибиторы MMP-2 и ММР-9 (Wada et al., 2002, J. Med.Chem. 45, 219-232). Высокая релевантность пути металлопротеиназ при некоторых широко распространенных заболеваниях повышает необходимость разработки ингибиторов, в том числе селективных ингибиторов ММР,таких как желатиназы, подобные ММР-2, и/или ММР-9, и/или ММР-12. Сущность изобретения Задачей изобретения является предоставление веществ, которые являются подходящими для лечения и/или профилактики нарушений, относящихся к аутоиммунным нарушениям и/или воспалительным заболеваниям, сердечно-сосудистым заболеваниям, нейродегенеративным заболеваниям, удару, раку,респираторным заболеваниям, преждевременным родам и фиброзу. Следующей задачей настоящего изобретения является предоставление веществ, которые являются подходящими для лечения и/или профилактики рассеянного склероза, ревматоидного артрита, эмфиземы, хронического обструктивного заболевания легких и фиброза. Значительной задачей настоящего изобретения является предоставление химических соединений,которые способны модулировать, особенно ингибировать активность или функцию металлопротеиназ матрикса, таких как желатиназы и/или эластазы у млекопитающих, особенно у людей. Кроме того, задачей настоящего изобретения является предоставление нового класса фармацевтических препаратов для лечения и/или профилактики заболеваний, опосредуемых такими металлопротеиназами и выбранных из аутоиммунных нарушений, воспалительных заболеваний, сердечно-сосудистых-1 012266 заболеваний, нейродегенеративных заболеваний, удара, рака, респираторных заболеваний, преждевременных родов и фиброза. Кроме того, задачей настоящего изобретения является предоставление способов получения химических соединений согласно изобретению. Кроме того, задачей настоящего изобретения является предоставление новых соединений, пригодных для таких способов получения химических соединений согласно изобретению. Наконец, задачей настоящего изобретения является предоставление способа лечения и/или профилактики нарушений, выбранных из аутоиммунных нарушений, воспалительных заболеваний, сердечнососудистых заболеваний, нейродегенеративных заболеваний, удара, рака, респираторных заболеваний,преждевременных родов и фиброза. В первом аспекте изобретение предлагает сульфониламиноциклические соединения формулы (I) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные в подробном описании. Во втором аспекте изобретение предлагает сульфониламиноциклическое соединение формулы (I) для применения в качестве лекарственного средства. В третьем аспекте изобретение предлагает применение сульфониламиноциклического соединения формулы (I) для получения фармацевтической композиции для лечения нарушения, выбранного из аутоиммунных нарушений, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, удара, рака, респираторных заболеваний, преждевременных родов и фиброза. В четвертом аспекте изобретение предлагает фармацевтическую композицию, содержающую по меньшей мере одно сульфониламиноциклическое соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или эксципиент. В пятом аспекте изобретение предлагает способ лечения, включающий введение сульфониламиноциклического соединения формулы (I) нуждающемуся в этом пациенту. В шестом аспекте изобретение предлагает способы синтеза сульфониламиноциклического соединения формулы (I). В седьмом аспекте изобретение предлагает соединение формулы (II) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные в подробном описании. В восьмом аспекте изобретение предлагает соединение формулы (III) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные в подробном описании. В девятом аспекте изобретение предлагает соединение формулы (VIII) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные в подробном описании. В десятом аспекте изобретение предлагает соединение формулы (VII) где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные в подробном описании. Подробное описание изобретения В нижеследующих абзацах представлены определения различных химических фрагментов (остатков), которые составляют соединения согласно изобретению и предназначены для применения в одинаковом смысле на всем протяжении описания и формулы изобретения, если только в противном случае ясно выраженное указанное определение не обеспечивает более широкое значение. Термин "ММР" относится к металлопротеиназам матрикса. Последние обзоры по ММР см. в публикациях Visse et al., 2003, указана выше; Fingleton et al., 2003, указана выше; Clark et al., 2003, указана выше, и Doherty et al., 2002, Expert: Opinion Therapeutic Patents 12(5): 665-707. Иллюстративными, но не ограничиващими примерами таких ММР являются следующие ММР. Коллагеназы, обычно ассоциированные с заболеваниями, связанными с разрушением ткани на основе коллагена, например ревматоидным артритом и остеоартритом. ММР-1 (известна также, как коллагеназа 1 или фибробластная коллагеназа), субстраты: коллаген I,коллаген II, коллаген III, желатин, протеогликаны. Считается, что сверхэкспрессия этого фермента связана с эмфиземой, с гиперкератозом и атеросклерозом, он сверхэкспрессируется сам по себе в папиллокарциноме. ММР-8 (известна также, как коллагеназа 2 или нейтрофильная коллагеназа), субстраты: коллаген I,коллаген II, коллаген III, коллаген V, коллаген VII, коллаген IX, желатин, сверхэкспрессия этого фермента может привести к незаживающим хроническим язвам. ММР-13 (известна также, как коллагеназа 3), субстраты: коллаген I, коллаген II, коллаген III, коллаген IV, коллаген IX, коллаген X, коллаген XIV, фибронектин, желатин; недавно установлено, что этот фермент сверхэкспрессируется сам по себе в карциноме молочной железы и принимает участие в ревматоидном артрите. Стромелизины: ММР-3 (известна также, как стромелизин 1), субстраты: коллаген III, коллаген IV,коллаген V, коллаген IX, коллаген X, ларнинин, нидоген, считается, что сверхэкспрессия этого фермента принимает участие в атеросклерозе, аневризме и рестенозе. Желатиназы - считается, что их ингибирование оказывает благоприятное действие на развитие рака,особенно начало заболевания и метастазы. ММР-2 (известна также, как желатиназа А, желатиназа с 72 кДа, желатиназа базальной мембраны или протеогликаназа), субстраты: коллаген I, коллаген II, коллаген IV, коллаген V, коллаген VII, коллаген X, коллаген XI, коллаген XIV, эластин, фибронектин, желатин, нидоген, считается, что этот фермент связан с развитием опухоли посредством специфичности для коллагена типа IV (высокую экспрессию указанного фермента наблюдали в солидных опухолях и считают, что эта экспрессия связана с их способностью расти, распространяться, образовывать новые кровеносные сосуды и метастазировать) и принимает участие в остром воспалении легких и респираторном дистресс-синдроме (Krishna et al., 2004,Expert Opin. Invest. Drugs, 13(3): 255-267).MMP-9 (известна также, как желатиназа В или желатиназа с 92 кДа), субстраты: коллаген I, коллаген III, коллаген IV, коллаген V, коллаген VII, коллаген X, коллаген XIV, эластин, фибронектин, желатин, нидоген. Считается, что указанный выше фермент связан с развитием опухоли посредством специфичности для коллагена типа IV, высвобождается эозинофилами в ответ на экзогенные факторы, такие как загрязняющие воздух вещества, аллергены и вирусы, принимает участие в воспалительной реакции при рассеянном склерозе (Opdenakker et al., 2003, The Lancet Neurology, 2, 747-756) и астме и принимает участие в остром воспалении легких, респираторном дистресс-синдроме, хроническом обструктивном заболевании легких (COPD) и/или астме (Krishna et al., 2004, указана выше). Также считается, что ММР-3 012266 9 принимает участие в ударе (Horstmann et al., 2003, Stroke 34(9), 2165-70). Неклассифицированные ММР: ММР-12 (известна также, как металлоэластаза, эластаза макрофагов человека или НМЕ), субстраты: фибронектин, ларнинин. Считается, что ММР-12 играет роль в ингибировании роста опухоли и регуляции воспаления, такого как рассеянный склероз (Vos et al., 2003, Journalof Neuroimmunology, 138, 106-114) и ревматоидный артрит (Liu et al., 2004, ArthritisRheumatism,50(10), 3112-3117). Считается также, что ММР-12 играет патологическую роль при эмфиземе, COPD(Belvisi et al., 2003, Inflamm. Res. 52; 95-100), при атеросклерозе, аневризме и рестенозе. Выражение связанное с ММР нарушение относится к нарушению, которое поддается излечению согласно изобретению и которое включает все нарушения, в которых необходимо уменьшить экспрессию и/или активность по меньшей мере одной ММР, независимо от причины таких нарушений. Такие нарушения включают, например, нарушения, вызванные неподходящим разложением внеклеточного матрикса (ЕСМ). Иллюстративными, но не ограничивающими примерами таких связанных с ММР заболеваний являются следующие заболевания. Рак, такой как рак молочной железы и солидные опухоли; воспалительные нарушения, такие как,например, воспалительные заболевания кишечника и нейровоспаление, такое как рассеянный склероз; легочные заболевания, такие как хроническое обструктивное заболевание легких (COPD), эмфизема, астма, острое легочное повреждение и острый респираторный дистресс-синдром; преждевременные роды; болезни зубов, такие как периодонтальное заболевание и гингивит; заболевания суставов и костей, такие как остеоартрит и ревматоидный артрит; заболевания печени, такие как фиброз печени, цирроз и хроническое заболевание печени; фиброзные заболевания, такие как легочный фиброз, панкреатит, волчанка,гломерулосклероз, системный склероз, кожный фиброз, пострадиационный фиброз и муковисцидоз; сосудистые патологии, такие как аневризма аорты, атеросклероз, гипертензия, кардиомиопатия и инфаркт миокарда; рестеноз; офтальмологические нарушения, такие как диабетическая ретинопатия, сухой кератит, дегенерация желтого пятна и роговичная язва, и дегенеративные заболевания центральной нервной системы, такие как боковой амиотрофический склероз."C1-С 6-алкил" относится к одновалентным алкильным группам, имеющим 1-6 атомов углерода. Примерами этого термина являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, н-гексил и тому подобное. По аналогии "С 1-С 12-алкил" относится к одновалентным алкильным группам, имеющим 1-12 атомов углерода, включающим группы "C1-С 6-алкилов" и гептильные, октильные, нонильные, деканоильные, ундеканоильные и додеканоильные группы, и "C1-С 10 алкил" относится к одновалентным алкильным группам, имеющим 1-10 атомов углерода, "С 1-С 8-алкил" относится к одновалентным алкильным группам, имеющим 1-8 атомов углерода, и "C1-C5-алкил" относится к одновалентным алкильным группам, имеющим 1-5 атомов углерода."Гетероалкил" относится к С 1-С 12-алкилу, предпочтительно C1-С 6-алкилу, у которого по меньшей мере один атом углерода заменен на гетероатом, выбранный из О, N или S, включающему 2 метоксиэтил."Арил" относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо (например, фенилу) или несколько конденсированных колец (например,нафтилу). Арил включает фенил, нафтил, фенантренил и тому подобное."Гетероарил" относится к моноциклической гетероароматической, или бициклической, или трициклической конденсированной гетероароматической группе. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, пиримидинил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3 оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, 1,3-бензодиоксол-5-ил, бензотиенил,бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2 а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил,изохинолил, тетразолил, 5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил."С 2-С 6-алкенил" относится к алкенильным группам, предпочтительно имеющим 2-6 атомов углерода и имеющим по меньшей мере 1 или 2 участка алкенильной ненасыщенности. Алкенильные группы предпочтительно включают этенил (-СН=СН 2), н-2-пропенил (аллил,-4 012266"С 2-С 6-алкинил" относится к алкинильным группам, предпочтительно имеющим 2-6 атомов углерода и имеющим по меньшей мере 1 или 2 участка алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил (-С=СН), пропаргил (-СН 2 ССН) и тому подобное."С 3-С 8-циклоалкил" относится к насыщенной карбоциклической группе из 3-8 атомов углерода,имеющей одно кольцо (например, циклогексилу) или несколько конденсированных колец (например,норборнилу). С 3-С 8-циклоалкил включает циклопентил, циклогексил, норборнил и тому подобное."Гетероциклоалкил" относится к С 3-С 8-циклоалкильной группе согласно указанному выше определению, в которой вплоть до 3 атомов углерода заменены на гетероатомы, выбранные из группы, состоящей из О, S, NR, причем R представляет собой водород или метил. Гетероциклоалкил включает пирролидин, пиперидин, пиперазин, морфолин, тетрагидрофуран и тому подобное."Ацилокси-C1-С 6-алкил" относится к C1-С 6-алкильным группам, имеющим ацилоксизаместитель,включающим этиловый эфир пропионовой кислоты и тому подобное."Аминокарбонил" относится к группе -C(O)NRR', где каждый из R и R' включает независимо водород, или C1-С 6-алкил, или арил, или гетероарил, или арил-C1-С 6-алкил, или гетероарил-C1-С 6-алкил,включающей N-фенилформамид."Ациламино" относится к группе -NRC(O)R', где каждый из R и R' представляет собой независимо водород, C1-С 6-алкил, С 2-С 6-алкенил, C2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, арил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил,арил-С 2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-С 1-С 6-алкил, гетероциклоалкил-C1-С 6-алкил."Уреидо" относится к группе -NRC(О)NR'R", где каждый из R, R', R" представляет собой независимо водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, арил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил,арил-C2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-С 1-С 6-алкил, гетероциклоалкил-С 1-С 6-алкил,и где R' и R" вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 38-членное гетероциклоалкильное кольцо."Карбамат" относится к группе -NRC(O)OR', где каждый из R и R' представляет собой независимо водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или гетероарил-C1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил,арил-С 2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-C1-С 6-алкил, гетероциклоалкил-C1-С 6-алкил."Амино" относится к группе -NRR', где каждый из R и R' представляет собой независимо водород или C1-С 6-алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил, или циклоалкил или гетероциклоалкил, и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо."Аммоний" относится к положительно заряженной группе -N+RR'R", где каждый из R, R', R" представляет собой независимо С 1-С 6-алкил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил, или циклоалкил или гетероциклоалкил, и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо."Сульфанил" относится к группе -S-R, где R включает Н, C1-С 6-алкил, C1-С 6-алкил, замещенный атомами галогена, например группу -SO-CF3, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, арил-C1-С 6-алкил или гетероарил-C1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил, арил-С 2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-С 1-С 6-алкил, гетероциклоалкил-C1-С 6-алкил. Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и тому подобное."Сульфониламино" относится к группе -NRSO2-R', где каждый из R и R' включает независимо водород, C1-С 6-алкил, C2-С 6-алкенил, С 2-С 6-алкинил, C3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, арил-C1-С 6-алкил или гетероарил-C1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил, арилС 2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-C1-С 6-алкил, гетероциклоалкил-C1-С 6-алкил."Аминосульфонил" относится к группе -SO2-NRR', где каждый из R и R' включает независимо водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, арил-C1-С 6-алкил или гетероарил-C1-С 6-алкил, арил-С 2-С 6-алкенил, гетероарил-С 2-С 6-алкенил, арилС 2-С 6-алкинил, гетероарил-С 2-С 6-алкинил, циклоалкил-C1-С 6-алкил, гетероциклоалкил-C1-С 6-алкил."Аминосульфонил-C1-С 6-алкил" относится к C1-С 6-алкильным группам, имеющим аминосульфонильный заместитель, включающим 2-(циклогексиламиносульфонил)этил и тому подобное. Термин "замещенный или незамещенный": если нет ограничения определением отдельного заместителя, представленные выше группы, подобные группам алкенил, алкинил, арил, гетероарил, циклоалкил, гетероциклоалкил и т.д., могут быть необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, циклоалкила, гетероциклоалкила,арил-С 1-С 6-алкила, гетероарил-C1-С 6-алкила, циклоалкил-C1-С 6-алкила, гетероциклоалкил-C1-С 6-алкила,амино, аммония, ацила, ацилокси, ациламино, аминокарбонила, алкоксикарбонила, уреидо, арила, карбамата, гетероарила, сульфинила, сульфонила, алкокси, сульфанила, галогена, карбокси, тригалогенметила, циано, гидрокси, меркапто, нитро и тому подобное."Фармацевтически приемлемые соли или комплексы" относятся к солям или комплексам указанных ниже соединений формулы (I). Примеры таких солей включают, но не ограничиваются перечисленным,основно-аддитивные соли, полученные взаимодействием соединений формулы (I) с органическими или неорганическими основаниями, такими как гидроксид, карбонат или бикарбонат катиона металла, такого как металл, выбранный из группы, состоящей из щелочных металлов (натрия, калия или лития), щелочно-земельных металлов (например, кальция или магния), или с органическим первичным, вторичным или третичным алкиламином. Соли аминов, образованные из метиламина, диметиламина, триметиламина,этиламина, диэтиламина, триэтиламина, морфолина, N-Me-D-глюкамина, N,N'-бис(фенилметил)-1,2 этандиамина, трометамина, этаноламина, диэтаноламина, этилендиамина, N-метилморфолина, прокаина,пиперидина, пиперазина и тому подобное, рассматриваются как находящиеся в пределах объема настоящего изобретения. Также включены соли, которые являются кислотно-аддитивными солями, образованными с неорганическими кислотами (например, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и тому подобное), а также соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памоевая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота."Фармацевтически приемлемое производное" относится к любому соединению, которое при введении реципиенту способно обеспечить, непосредственно или опосредованно, описанную в настоящем описании активность. Термин "опосредованно" включает также пролекарства, которые могут быть сформированы в активную форму лекарственного средства посредством эндогенных ферментов или метаболизма. Указанное пролекарство состоит из активного лекарственного соединения и химической защищающей группы."Энантиомерный избыток" (ее) относится к продуктам, которые получают и которые можно разделить асимметричным синтезом, т.е. синтезом, включающим применение нерацемических исходных соединений и/или реагентов, или синтезом, включающим по меньшей мере одну энантиоселективную стадию, посредством которой получают избыток одного энантиомера порядка по меньшей мере приблизительно 52% ее. Имеется в виду, что термин "интерферон" или "IFN", применяемый в настоящем описании, включает любую молекулу, определенную как таковую в литературе, включая, например, любые типы IFN, указанные в приведенном выше разделе "Уровень техники". В частности, в указанное выше определение включены IFN-, IFN- и IFN-. IFN- является предпочтительным IFN согласно настоящему изобретению. IFN-, подходящий согласно настоящему изобретению, является коммерчески доступным, например, как ребиф (Serono), авонекс (Biogen) или бетаферон (Schering). Термин "интерферон-бета (IFN-бета или IFN-)", применяемый в настоящем описании, предназначен для включения в него фибробластного интерферона, особенно человеческого происхождения, получаемого выделением из биологических жидкостей или получаемого методами рекомбинантной ДНК из прокариотических или эукариотических клеток-хозяев, а также его солей, функциональных производных, вариантов, аналогов и активных фрагментов. Предполагается, что IFN-бета предпочтительно означает рекомбинантный интерферон бета-1 а.IFN-, подходящий для применения согласно настоящему изобретению, является коммерчески доступным, например, как ребиф (Serono), авонекс (Biogen) или бетаферон (Schering). Применение интерферонов человеческого происхождения является также предпочтительным согласно настоящему изобретению. Предполагается, что термин интерферон, применяемый в настоящем описании, включает его соли, функциональные производные, варианты, аналоги и активные фрагменты. Ребиф (рекомбинантный интерферон-) является самой последней разработкой в терапии интер-7 012266 фероном рассеянного склероза (MS) и обеспечивает значительный прогресс в лечении. Ребиф является интерфероном (IFN)-бета 1a, полученным из клеточных линий млекопитающих. Было установлено, что интерферон бета-1a, вводимый подкожно три раза в неделю, является эффективным при лечении рецидивирующего-ремиттирующего рассеянного склероза (RRMS). Интерферон бета-1a может иметь положительное действие на продолжительно протекающий MS снижением числа и тяжести рецидивов и снижением тяжести заболевания и интенсивности заболевания, измеряемой MRI. Доза IFN- при лечении MS для уменьшения рецидивов согласно изобретению зависит от типа применяемого IFN-. Согласно настоящему изобретению, когда IFN является рекомбинантным IFN-1b, продуцированным в Е. Coli, коммерчески доступным под товарным знаком бетазерон, его можно предпочтительно вводить подкожно каждый второй день при дозе приблизительно 250-300 мкг или от 8 до 9,6 ME на человека. Согласно настоящему изобретению, когда IFN является рекомбинантным IFN-1a, продуцированным в клетках яичников китайского хомячка (клетки СНО), коммерчески доступным под товарным знаком авонекс, его можно предпочтительно вводить внутримышечно один раз в неделю при дозе приблизительно 30-33 мкг или от 6 до 6,6 ME на человека. Согласно настоящему изобретению, когда IFN является рекомбинантным IFN-1a, продуцированным в клетках яичников китайского хомячка (клетки СНО), коммерчески доступным под товарным знаком ребиф, его можно предпочтительно вводить подкожно три раза в неделю (TIW) при дозе приблизительно 22-44 мкг или от 6 до 12 ME на человека. Соединения согласно настоящему изобретению включают также их фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами, подобными солям гидрохлориду, гидробромиду, сульфату или бисульфату, фосфату или гидрофосфату, ацетату, бензоату, сукцинату, фумарату, малеату, лактату, цитрату, тартрату, глюконату, метансульфонату, бензолсульфонату и паратолуолсульфонату. Теперь обнаружено, что соединения настоящего изобретения являются модуляторами металлопротеиназ матрикса, таких как желатиназы и эластаза, включая MMP-2 и/или ММР-9, предпочтительноMMP-12. Когда фермент металлопротеиназу матрикса ингибируют соединениями настоящего изобретения, ингибированная(ые) ММР не способна(ны) оказывать свое ферментативное, биологическое и/или фармакологическое действие. Соединения настоящего изобретения, следовательно, являются полезными при лечении и профилактике аутоиммунных нарушений и/или воспалительных заболеваний, сердечнососудистых заболеваний, нейродегенеративных заболеваний, удара, рака, преждевременных родов, респираторных заболеваний и фиброза. В одном варианте осуществления изобретение предлагает соединения формулы (I)R1 выбран из необязательно замещенного арила, включающего необязательно замещенный фенил,такой как фенил, галогенфенил (например, 4-фторфенил, 2-фторфенил, 4-хлорфенил, 3-хлорфенил), алкоксифенил (например, 4-фенилметил)окси)фенил, 4-метоксифенил, 2-метоксифенил, 3-метоксифенил,4-(фенилокси)фенил, 4-(этилокси)фенил, 3,4-диметоксифенил), необязательно замещенный C1-С 6 алкилфенил (например, 4-трифторметилфенил, 4-метилфенил) и необязательно замещенный бифенил(например, 4-бифенил-4-ил); необязательно замещенного гетероарила, включающего необязательно замещенный пиридинил, такой как пиридинил (например, пиридин-2-ил), необязательно замещенный C1 С 6-алкилпиридинил (например, 5-трифторметилпиридин-2-ил) и галогенпиридинил (например, 5 хлорпиридин-2-ил, 5-бромпиридин-2-ил), необязательно замещенный пиримидинил (например, пиримидин-2-ил), необязательно замещенный бензодиоксол (например, 1,3-бензодиоксол-5-ил); необязательно замещенного С 3-С 8-циклоалкила и необязательно замещенного гетероциклоалкила;-8 012266 4-диэтиламинометил; необязательно замещенного C1-С 6-алкила, включающего этил, пропил, бутил и пентил; необязательно замещенного арила, включающего замещенный фенил, такой как фенил, галогенфенил (4-фторфенил, 3-фторфенил, 2-фторфенил), алкоксифенил (например, 3-метоксифенил); необязательно замещенного гетероарилфенила, такого как оксадиазолфенил (например, 1,2,4-оксадиазол-3 илфенил); необязательно замещенного гетероарила, включающего необязательно замещенный пиридинил, такой как пиридинил (например, пиридин-3-ил), необязательно замещенный бензодиоксол (например, 1,3-бензодиоксол-5-ил), необязательно замещенный хинолинил (например, 3-хинолин-3-ил); необязательно замещенного арил-C1-С 6-алкила, включающего арилметил, такой как фенилметил; необязательно замещенного гетероарил-C1-С 6-алкила; необязательно замещенного С 3-С 8-циклоалкил-С 1-С 6-алкила; необязательно замещенного гетероциклоалкил-С 1-С 6-алкила, включающего морфолинометил (например,морфолино-4-илметил) и пирролидинилметил (например, пирролидин-1-илметил); необязательно замещенного С 3-С 8-циклоалкила и необязательно замещенного гетероциклоалкила;R4, R5, R4' и R5' независимо выбраны из Н; галогена; необязательно замещенного C1-С 6-алкила,включающего метил; необязательно замещенного С 2-С 6-алкенила и необязательно замещенного С 2-С 6 алкинила;Y выбран из СН и СН 2; и группа -XY- выбрана из -С=СН-, -СН-СН 2- и -N-CH2-;p равно 1 или 2; а также их оптически активные формы, такие как энантиомеры, диастереомеры, и их рацемические формы, а также их фармацевтически приемлемые соли. В предпочтительном варианте осуществления изобретение предлагает соединения формулы (I), гдеR1 представляет собой необязательно замещенный арил, включающий необязательно замещенный фенил, такой как 4-фторфенил, 4-бензилоксифенил, 4-метоксифенил, 2-фторфенил, 4-хлорфенил, 3 хлорфенил, 4-фенилметил)окси)фенил, 4-метоксифенил, 2-метоксифенил, 3-метоксифенил, 4(фенилокси)фенил, 4-(этилокси)фенил, 3,4-диметоксифенил, 4-трифторметилфенил, 4-метилфенил и 4 бифенил-4-ил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R1 представляет собой необязательно замещенный гетероарил, включающий необязательно замещенный пиридинил, такой как пиридин-2-ил, 5-трифторметилпиридин-2-ил, 5-хлорпиридин-2-ил, 5 бромпиридин-2-ил; включающий необязательно замещенный пиримидинил, такой как пиримидин-2-ил,и включающий необязательно замещенный бензодиоксол, такой как 1,3-бензодиоксол-5-ил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R2 представляет собой Н. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R3 выбран из необязательно замещенного арила, включающего необязательно замещенный фенил, такой как фенил, 3-метоксифенил, 4-фторфенил, 3-фторфенил, 2-фторфенил, 1,2,4-оксадиазол-3 илфенил, и необязательно замещенного гетероарила, включающего необязательно замещенный пиридинил, такой как пиридин-3-ил; включающего необязательно замещенный бензодиоксол, такой как 1,3 бензодиоксол-5-ил; включающего необязательно замещенный хинолинил, такой как 3-хинолин-3-ил, и включающего необязательно замещенный бензодиоксолил, такой как 1,3-бензодиоксол-5-ил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R3 выбран из необязательно замещенного C1-С 6-алкила, включающего этил, пропил, бутил и пентил; необязательно замещенного арил-C1-С 6-алкила, включающего 4-фенилметил, необязательно замещенного гетероарил-C1-С 6-алкила, необязательно замещенного гетероарил-C1-С 6-алкила; необязательно замещенного С 3-С 8-циклоалкил-C1-С 6-алкила; и необязательно замещенного гетероциклоалкил-C1-С 6 алкила, включающего морфолинометил, такой как морфолино-4-илметил, и пирролидинилметил, такой как пирролидин-1-илметил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R3 представляет собой Н. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R3 представляет собой необязательно замещенный амино-C1-С 6-алкил, включающий диэтиламинометил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где R3 представляет собой -Si(CH3)3. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где Y представляет собой СН 2. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где X представляет собой СН и Y представляет собой СН 2. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где X представляет собой N и Y представляет собой СН 2.-9 012266 В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где А представляет собой гем-диметил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где В представляет собой метил. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где n равно 0. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где m равно 0. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где n равно 1. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где m равно 1. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где n и m равно 1. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где р равно 1. В другом предпочтительном варианте осуществления изобретение предлагает соединения формулы(I), где р равно 2. В предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н или метил; Y представляет собой СН 2; X, А, В, n, m, p иR3 имеют значения, указанные выше. В другом предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н или метил; Y представляет собой СН 2; р равно 1; X,А, В, n, m и R3 имеют значения, указанные выше. В другом предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н или метил; X представляет собой N; Y представляет собой СН 2; p равно 2; А, В, n, m и R3 имеют значения, указанные выше. В другом предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н или метил; А представляет собой C(СН 3)2; В представляет собой СН 2; n и m равно 1; X, Y, В, р и R3 имеют значения, указанные выше. В другом предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н; X представляет собой N; Y представляет собой СН 2;n и m равно 0; р равно 1; R3 имеет значения, указанные выше. В следующем предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н; X представляет собой N; Y представляет собой СН 2; n и m равно 0; р равно 1; и R3 выбран из необязательно замещенного C1-С 6-алкила; необязательно замещенного арил-C1-С 6-алкила и необязательно замещенного гетероарил-C1-С 6-алкила. В другом предпочтительном варианте осуществления изобретение предлагает сульфониламиноциклическое соединение формулы (I), где R1 выбран из необязательно замещенного арила и необязательно замещенного гетероарила; R2 представляет собой Н; X представляет собой N; Y представляет собой СН 2;n и m равно 0; р равно 1; и R3 выбран из необязательно замещенного арила и необязательно замещенного гетероарила. Сульфониламиноциклическое соединение формулы (I) согласно изобретению включает, в частности, соединения, выбранные из следующей группы: 3-(1,3-бензодиоксол-5-ил)-1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-2-пропинил(гидрокси)формамид; 1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-3-(триметилсилил)-2-пропинил(гидрокси) формамид; гидрокси-[1-[(4-пиридин-2-илпиперазин-1-ил)сульфонил]метил-3-(триметилсилил)проп-2-ин-1 ил]формамид; 1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-3-фенил-2-пропинил(гидрокси)формамид; 1-[(4-[4-(бензилокси)фенил]-1-пиперазинилсульфонил)метил]-2-октинил(гидрокси)формамид; 1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-4-фенил-2-бутинил(гидрокси)формамид; 1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-2-октинил(гидрокси)формамид; 1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-3-(3-пиридинил)-2-пропинил(гидрокси) формамид;[1-([4-(4-фторфенил)пиперазин-1-ил]сульфонилметил)-2,2-диметилгепт-4-ин-1-ил]гидроксиформамид. В другом варианте осуществления изобретения предложено сульфониламиноциклическое соединение формулы (I) для применения в качестве лекарственного средства. В другом варианте осуществления изобретения предложена фармацевтическая композиция, содержащая сульфониламиноциклическое соединение согласно изобретению и его фармацевтически приемлемый носитель, разбавитель или эксципиент. В другом варианте осуществления изобретения предложено применение соединения формулы (I) для получения лекарственного средства для профилактики и/или лечения нарушения, выбранного из аутоиммунных нарушений и воспалительных заболеваний, включающих рассеянный склероз, воспалительное заболевание кишечника и ревматоидный артрит; удара, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, рака, преждевременных родов, респираторных заболеваний, включающих эмфизему, хроническое обструктивное заболевание легких (COPD); и фиброза, включающего фиброз печени и легких, панкреатический фиброз и фиброз печени. В другом варианте осуществления изобретения предложено применение соединений формулы (I) для модуляции, особенно, для ингибирования активности металлопротеиназы матрикса. В частности,предложено применение согласно изобретению, где указанная металлопротеиназа матрикса выбрана из ММР-2, ММР-9 и ММР-12. Предпочтительно соединения согласно изобретению являются селективными ингибиторами металлопротеиназы ММР-12 по сравнению с ММР-1. В другом варианте осуществления изобретение предлагает способ лечения и/или профилактики заболевания, включающий введение соединения формулы (I) пациенту, нуждающемуся в этом, где заболевание выбрано из аутоиммунных нарушений и воспалительных заболеваний, включающих рассеянный склероз, воспалительное заболевание кишечника и ревматоидный артрит; удара, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, рака, преждевременных родов, респираторных заболеваний, включающих эмфизему, хроническое обструктивное заболевание легких (COPD); и фиброза,включающего фиброз печени и легких, панкреатический фиброз и фиброз печени. В другом варианте осуществления изобретение предлагает способ получения соединения формулы(I) согласно изобретению, включающий стадию взаимодействия соединения формулы (II) с формилирующим агентом формулы (FA) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные выше; LG1 представляет собой группу, выбранную из ОН, -ОАс, -O-Piv, -OCH2CN, -OCH2-CF3, -O-фенил и OPfp. В другом варианте осуществления изобретение предлагает соединение формулы (II) где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные выше. В следующем варианте осуществления изобретение предлагает соединение формулы (II), выбранное из группы, содержащей(2R)-4-(4-фторфенил)-1-[2-(гидроксиамино)нон-3-ин-1-ил]сульфонил-2-метилпиперазин; 1-(4-фторфенил)-4-[2-(гидроксиамино)-3,3-диметилгекс-5-ин-1-ил]сульфонилпиперазин; 1-(4-фторфенил)-4-[2-(гидроксиамино)-5-пирролидин-1-илпент-3-ин-1-ил]сульфонилпиперазин; 4-[7-[4-(4-фторфенил)пиперазин-1-ил]сульфонил-6-(гидроксиамино)-5,5-диметилгепт-2-ин-1 ил]морфолин; 1-(4-фторфенил)-4-[2-(гидроксиамино)-3,3-диметилокт-5-ин-1-ил]сульфонилпиперазин. В другом варианте осуществления изобретение предлагает способ получения соединения формулы(I) или (II) согласно изобретению, включающий стадию взаимодействия соединения формулы (III) с гидроксиламином или производным гидроксиламина формулы (HA) где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные выше; W выбран из Н, бензила, TMS,TBDMS и ТНР. В другом варианте осуществления изобретение предлагает соединение формулы (III) где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные выше. В следующем варианте осуществления изобретение предлагает соединение формулы (III), выбранное из группы, содержащей 1-[(1E)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил-4-(4-фторфенил)пиперазин; 1-[(1Z)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил-4-(4-фторфенил)пиперазин; 1-(4-фторфенил)-4-[(1E)-4-(триметилсилил)-1-бутен-3-инил]сульфонилпиперазин; 1-(4-фторфенил)-4-[(1Z)-4-(триметилсилил)-1-бутен-3-инил]сульфонилпиперазин; 1-(2-пиридинил)-4-[(1E)-4-(триметилсилил)-1-бутен-3-инил]сульфонилпиперазин; 1-(2-пиридинил)-4-[(1Z)-4-(триметилсилил)-1-бутен-3-инил]сульфонилпиперазин;(2R)-4-(4-фторфенил)-2-метил-1-[нон-1-ен-3-ин-1-илсульфонил]пиперазин; 1-[3,3-диметилгекс-1-ен-5-ин-1-ил]сульфонил-4-(4-фторфенил)пиперазин; 1-(4-фторфенил)-4-[5-пирролидин-1-илпент-1-ен-3-ин-1-ил]сульфонилпиперазин; 4-(7-[4-(4-фторфенил)пиперазин-1-ил]сульфонил-5,5-диметилгепт-6-ен-2-ин-1-ил)морфолин; 1-[3,3-диметилокт-1-ен-5-ин-1-ил]сульфонил-4-(4-фторфенил)пиперазин. В другом варианте осуществления изобретение предлагает способ получения соединения формулы(I), (II) или (III) согласно изобретению, включающий стадию взаимодействия соединения формулы (VIII) с реагентом, таким как MsCl, TMSCl, DBU, HCl. где А, B, R1, R2, R3, X, Y, m, n и p имеют значения, указанные выше. В другом варианте осуществления изобретение предлагает соединение формулы (VIII) где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные выше. В другом варианте осуществления изобретение предлагает способ получения соединения формулы(I), (II), (III) или (VIII) согласно изобретению, включающий стадию восстановления кетонной группы соединения формулы (VII) в присутствии восстанавливающего агента, такого как NaBH4, в спиртовом растворителе, подобном MeOH или EtOH. где А, В, R1, R2, R3, X, Y, m, n и р имеют значения, указанные выше. В другом варианте осуществления изобретение предлагает соединение формулы (VII) где А, В, R1, R2, R3, X, Y, m, n и p имеют значения, указанные выше. Соединения изобретения названы согласно стандартам, применяемым в программе "ACD/Name"from Advanced Chemistry Development Inc., ACD/Labs (7.06 Release). Соединения формулы (I) являются пригодными для лечения и/или профилактики аутоиммунных нарушений, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, удара, рака, преждевременных родов, респираторных заболеваний и фиброза, включающих рассеянный склероз, артрит, эмфизему, хроническое обструктивное заболевание легких, фиброз печени и легких.- 16012266 Соединения согласно настоящему изобретению включают также их таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и рацемические формы, а также их фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами, подобные солям гидрохлориду, гидробромиду, сульфату или бисульфату,фосфату или гидрофосфату, ацетату, бензоату, сукцинату, фумарату, малеату, лактату, цитрату, тартрату,глюконату, метансульфонату, бензолсульфонату и пара-толуолсульфонату. Соединения, указываемые в качестве примеров в данном изобретении, можно получить из легко доступных исходных веществ с применением нижеследующих методов и методик. Должно быть понятно, что, когда указываются типичные или предпочтительные экспериментальные условия (т.е. температуры реакции, время реакции, моли реагентов, растворители и т.д.), можно также применять другие экспериментальные условия, если не оговорено особо. Оптимальные условия реакции могут варьировать в зависимости от применяемых конкретных реагентов или растворителей, но такие условия может определить специалист в данной области с применением обычных методик оптимизации. При применении в качестве фармацевтических средств соединения настоящего изобретения обычно вводят в форме фармацевтической композиции. Поэтому фармацевтические композиции, содержащие соединение изобретения и его фармацевтически приемлемый носитель, разбавитель или эксципиент,также находятся в пределах объема настоящего изобретения. Специалист в данной области знает большое число таких носителей, разбавителей или эксципиентов, подходящих для получения фармацевтической композиции. В другом варианте осуществления соединения изобретения можно применять при лечении аутоиммунных заболеваний, особенно демиелинизирующих заболеваний, таких как рассеянный склероз, как таковые или в сочетании с соагентом, пригодным для лечении аутоиммунных заболеваний,где соагент выбран, например, из следующих соединений:(a) интерферонов, например ПЭГилированных или непегилированных интерферонов, например,вводимых подкожными, внутримышечными или пероральными путями, предпочтительно интерферона;(c) иммуносупрессивных средств с необязательной антипролиферативной/противоопухолевой активностью, например митоксантрона, метотрексата, азатиоприна, циклофосфамида или стероидов, например метилпреднизолона, преднизона или дексаметазона, или секретирующих стероиды агентов, например АСТН;(e) ингибиторов экспрессии VCAM-1 или антагонистов его лиганда, например антагонистов 4/(1 интегрина VLA-4 и/или 4-7-интегринов, например натализумаба (АНТЕГРЕН). Дополнительные соагенты, такие как противовоспалительные агенты (особенно для демиелинизирующих заболеваний, таких как рассеянный склероз), описаны ниже. Дополнительным противовоспалительным агентом является терифлуномид, который описан в WO 02/080897. Еще одним дополнительным противовоспалительным агентом является финголимод, который описан в ЕР-727406, WO 2004/28251 и WO 2004/028251. Еще одним дополнительным противовоспалительным агентом является лаквинимод, который описан в WO 99/55678. Еще одним дополнительным противовоспалительным агентом является тензиролимус, который описан в WO 02/28866. Еще одним дополнительным противовоспалительным агентом является ксалипроден, который описан в WO 98/48802. Еще одним дополнительным противовоспалительным агентом является дескар пирфенидон, который описан в WO 03/068230. Еще одним дополнительным противовоспалительным агентом является указанное ниже производное бензотиазола, которое описано в WO 01/47920. Еще одним дополнительным противовоспалительным агентом является одно из производных гидроксамовой кислоты, описанных в WO 03/070711. Еще одним дополнительным противовоспалительным агентом является MLN3897, который описан в WO 2004/043965. Еще одним дополнительным противовоспалительным агентом является CDP323, который описан в Еще одним дополнительным противовоспалительным агентом является симвастатин, который описан в WO 01/45698. Еще одним дополнительным противовоспалительным агентом является фампридин, который описан в патенте США 5540938. Соединения изобретения вместе с обычно применяемым адъювантом, носителем, разбавителем или эксципиентом можно выпускать в форме фармацевтических композиций и их единичных доз, такую композицию можно применять в твердых формах, таких как таблетки или наполненные капсулы, или жидких формах, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, наполненные жидкими формами, причем все эти формы применяют перорально, или в форме стерильных инъецируемых растворов для парентерального (в том числе подкожного) применения. Такие фармацевтические композиции и их единичные дозированные формы могут включать ингредиенты в общепринятых пропорциях с дополнительными активными соединениями или составными частями или без них, и такие единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соразмеримое с предполагаемым для применения суточным диапазоном доз. Фармацевтические композиции, содержащие соединение данного изобретения, можно изготовить способом, хорошо известным в фармацевтической области, такие композиции содержат по меньшей мере одно активное соединение. Обычно соединения данного изобретения вводят в фармацевтически эффективном количестве. Количество фактически вводимого соединения обычно определяет врач в свете соответствующих обстоятельств, включающих подвергаемое лечению состояние, выбранный путь введения, конкретное вводимое соединение, возраст, массу и реакцию отдельного пациента, тяжесть симптомов заболевания пациента и тому подобное. Фармацевтические композиции настоящего изобретения можно вводить различными путями, включающими пероральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный и интраназальный пути. Композиции для перорального введения могут быть в форме нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Более часто, однако, композиции представляют в единичных дозированных формах для облегчения достижения точного дозирования. Термин единичные дозированные формы относится к физически дискретным единицам, подходящим в качестве единичных доз для субъектов-людей и других млекопитающих, причем каждая единица содержит предварительно определенное количество активного вещества, вычисленное для достижения требуемого терапевтического действия, в сочетании с подходящим фармацевтическим эксципиентом. Типичные единичные дозированные формы включают жидкие композиции в предварительно измеренном количестве, предварительно заполненные в ампулы или шприцы, или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях соединение изобретения обычно является компонентом меньшего количества (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от приблизительно 1 до приблизительно 40 мас.%), причем остальной частью являются различные наполнители или носители и вспомогательные средства, полезные для изготовления требуемой дозированной формы. Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный наполнитель с буферами, суспендирующими и диспергирующими агентами, красителями,корригентами и тому подобное. Твердые формы могут включать, например, любой из нижеследующих ингредиентов или соединений подобной природы: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния; глидант, такой как коллоидальный диоксид кремния; подслащивающий агент,такой как сахароза или сахарин; или корригент, такой как перечная мята, метилсалицилат или апельсиновый корригент. Инъецируемые композиции обычно имеют в качестве основы инъецируемый стерильный физиологический раствор или забуференный фосфатом физиологический раствор или другие инъецируемые носители, известные в данной области. Как указано выше, сульфониламиноциклические соединения формулы (I) в таких композициях обычно являются меньшим компонентом, часто присутствующим в диапазоне между 0,05 и 10 мас.%, причем остальной частью является инъецируемый носитель и тому подобное.- 19012266 Описанные выше компоненты для перорально вводимых или инъецируемых композиций являются только репрезентативными. Соединения данного изобретения можно также вводить в формах с замедленным высвобождением или в системах доставки лекарственного средства к участку действия с замедленным высвобождением. Дополнительные материалы, а также методики обработки и тому подобное представлены в публикации Remington's Pharmaceutical Sciences, 20th Edition, 2000, Marck PublishingCompany, Easton, Pennsylvania (например, в части 5), которая включена в настоящее описание в качестве ссылки. Синтез соединений изобретения Новые соединения формулы (I) можно получить из легкодоступных исходных веществ несколькими синтетическими подходами, применяющими протоколы как химии в фазе раствора, так и в твердой фазе или протоколы химии в смешанном растворе или в твердой фазе. Далее будут описаны примеры синтетических путей. Указанные нижеследующие аббревиатуры относятся к соответствующим определениям: вод. (водный), ч (час), г (грамм), л (литр), мг (миллиграмм), МГц (мегагерц), мин (минута), мм (миллиметр),ммоль (миллимоль), мМ (миллимолярный), т.пл. (температура плавления), экв. (эквивалент), мл (миллилитр), мкл (микролитр), CAN (ацетонитрил), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафталин), Boc(О-пивалоил), OPfp (О-пентафторфенол), OTs (О-тозил), к.т. (комнатная температура), SPE (твердофазная экстракция), TBDMS (трет-бутилдиметилсилил), TBTU (тетрафторборат 2-(1 Н-бензотриазол-1-ил)1,1,3,3-тетраметилурония), TEA (триэтиламин), TFA (трифторуксусная кислота), ТГФ (тетрагидрофуран), ТНР (тетрагидропиранил), ТСХ (тонкослойная хроматография), TMAD (N,N,N',N'тетраметилазодикарбоксамид), TMS (триметилсилил), TMSCl (триметилсилилхлорид), TsCl (тозилхлорид), УФ (ультрафиолет), Z (бензилоксикарбонил). Синтетические подходы. Соединения формулы (I) обычно получают формилированием соединения формулы (II), где R1, R2,3R , X, Y, А, В, n и m имеют значения, указанные выше (приведенная ниже схема 1). Общие протоколы для такого формилирования указаны ниже в примерах, применение формилирующих агентов, таких как формилирующие агенты формулы (FA), где LG1 представляет собой группу,выбранную из ОН, -ОАс, -O-Piv, -OCH2CN, -OCH2-CF3, -O-фенил и OPfp, хорошо известно специалистам в данной области. Например, формилирующий агент можно получить взаимодействием муравьиной кислоты с уксусным ангидридом. Схема 1 Предпочтительный способ получения соединения формулы (II) состоит во взаимодействии гидроксиламина с соединением формулы (III), где R1, R2, R3, X, Y, А, В, n, m и р имеют значения, указанные выше, в подходящем растворителе, подобном ТГФ, при температуре между 0 и 100 С (представленная ниже схема 2). Соединение формулы (III) можно получить взаимодействием сульфонамида формулы (IV), где R1,R , X и Y имеют значения, указанные выше, с альдегидом формулы (V), где R3, А, В, n, m и р имеют значения, указанные выше. Предпочтительные условия включают металлирование сульфонамида формулы(IV) основанием, подобным основаниям, но не ограничивающимся перечисленными, LiHMDS, LDA илиBuLi, с последующим взаимодействием образовавшегося металлированного сульфонамида с хлорфосфатом, таким как ClPO(OEt)2, и альдегидом формулы (V) в подходящем растворителе, таком как ТГФ. Другие условия могут включать металлирование сульфонамида формулы (IV) основанием с последующим непосредственным взаимодействием образовавшегося металлированного сульфонамида с альдегидом формулы (V) в присутствии или в отсутствие добавки, такой как TMSCl, MsCl или TsCl. Альтернативным путем получения соединений формулы (II) может быть начальное взаимодействие сульфонамида формулы (IV), который был сначала металлирован, как описано выше, со сложным эфиром формулы (VI), где R представляет собой C1-С 6-алкил или С 3-С 8-циклоалкил или бензил и R3, А, В, n и m имеют значения, указанные выше, с получением кетона формулы (VII), где R1, R2, R3, X, Y, А, В, n,m и p имеют значения, указанные выше (представленная ниже схема 3). Схема 3 2 Соединения формулы (II) можно получить взаимодействием кетона формулы (VII) с гидроксиламином в подходящем растворителе, таком как DCM, с последующим хемоселективным восстановлением образованного оксима формулы (IX), где R1, R2, R3, X, Y, А, В, n, m и p имеют значения, указанные выше. Предпочтительным восстанавливающим агентом для такого преобразования может быть, например,NaBH3CN. В альтернативном случае кетон формулы (VII) можно хемоселективно восстановить в присутствии восстанавливающего агента (такого как NaBH4, в спиртовом растворителе, подобном МеОН или EtOH) в спирт формулы (VIII), где R1, R2, R3, X, Y, А, В, n, m и р имеют значения, указанные выше (представленная выше схема 3). Спиртовую группу спирта формулы (VIII) можно элиминировать с получением алкена формулыTsCl. Соединение формулы (II) можно затем получить взаимодействием гидроксиламина с алкеном фор- 21012266 мулы (III), где R1, R2, R3, X, Y, А, В, n, m и p имеют значения, указанные выше, в подходящем растворителе, подобном ТГФ, при температуре между 0 и 100 С (представленная выше схема 3). Дополнительным путем получения соединений формулы (II) может быть преобразование гидроксигруппы спирта формулы (VIII) в уходящую группу, такую как OMs, OTs, Cl, Br или I, в условиях, хорошо известных специалисту в данной области, с последующей ее заменой гидроксиламином. Аналогично этому, спирт формулы (VIII) может взаимодействовать с фосфинами (например, PPh3, Р(nBu)3) в присутствии производных диазодикарбоновых кислот, таких как DEAD, TMAD, и гидроксиламина или производных гидроксиламина (таких как BocO-NHBoc, ZO-NHZ, где Z представляет собой бензилоксикарбонил). Промежуточные продукты формулы (IV) получают взаимодействием соединения формулы (X), гдеX, Y, R1, R2 и р имеют значения, указанные выше, с мезилхлоридом в условиях, хорошо известных специалисту в данной области (представленная ниже схема 4). Схема 4 Промежуточные продукты формулы (X) являются коммерчески доступными или их можно получить с применением условий, хорошо известных специалисту в данной области. Например, промежуточные продукты формулы (X), где X представляет собой атом углерода, можно получить по методике, описанной Wustrow et al., Synthesis, 1991, 993. Промежуточные продукты формулы (X), где X представляет собой атом азота, можно получить по методике, описанной Brenner et al., Tetrahedron, 2002, 58(34), 69136924, или Tetrahedron Letters, 1996, 37(26), 4463-4466. Промежуточные продукты формулы (V) либо являются коммерчески доступными, либо их можно получить способами и в условиях, хорошо известных специалисту в данной области. Один предпочтительный способ получения промежуточных продуктов формулы (V) состоит в окислении спирта формулы (XI), где А, В, m, n и R3 имеют значения, указанные выше, с применением условий окисления, хорошо известных специалисту в данной области (таких как применение реагента Десс-Мартина или MnO2, когда m и n равно 0) (представленная ниже схема 5). Схема 5 Промежуточные продукты формулы (VI) либо являются коммерчески доступными, либо их можно получить способами и в условиях, хорошо известных специалисту в данной области. Один предпочтительный способ получения промежуточных продуктов формулы (VI), где, по меньшей мере, m или n не равен 0 и R3 представляет собой необязательно замещенный арил или необязательно замещенный гетероарил, состоит во взаимодействии соединения формулы (XII), где А, В, n и m имеют значения, указанные выше, и R представляет собой С 1-С 6-алкил или циклоалкил или бензил, с R3-LG2, где R3 представляет собой необязательно замещенный арил или необязательно замещенный гетероарил и LG2 представляет собой галоген или -OSO2CF3, в присутствии катализатора Pd(0) (представленная ниже схема 6). Схема 6 Другой предпочтительный способ получения промежуточных продуктов формулы (VI), где n и m равны 1, состоит во взаимодействии соединения формулы (XIII), где А и R имеют значения, указанные выше, и n равно 1, с соединением формулы (XIV), где LG3 представляет собой уходящую группу, такую- 22012266 как OMs, OTs, Cl, Br или I, m равно 1 и R3 и В имеют значения, указанные выше. Предпочтительные условия включают металлирование промежуточного продукта (XIII) основанием, подобным, но без ограничения перечисленным, LiHMDS, LDA или BuLi, в подходящем растворителе, таком как ТГФ (представленная ниже схема 7). Схема 7 Согласно следующему общему способу соединения формулы (I) можно преобразовать в альтернативные соединения формулы (I) с применением подходящих методик взаимопреобразований, хорошо известных специалисту в данной области. Соединения формулы (I) и их предшественники формул (II) и (VIII) содержат по меньшей мере один хиральный центр, и все индивидуальные оптически активные формы и их комбинации, а также их соответствующие рацематы описаны как отдельные и конкретные варианты осуществления изобретения. Способы, описанные в указанных выше схемах, особенно в схемах 1 и 2, дают соединения формулы (I) и их предшественники формул (II) и (VIII) в рацемической форме или в виде смесей диастереомеров в случаях, когда присутствуют дополнительные хиральные центры. Чистые стереоизомеры можно получить из смесей с применением методик, хорошо известных специалисту в данной области и включающих,например, разделение изомеров хиральной ВЭЖХ или образование диастереоизомерных производных с применением подходящих оптически активных вспомогательных средств и последующее разделение и затем отщепление вспомогательного средства (см., например, Basha et al., 1994, J. Org. Chem., 59, 61036106). Далее настоящее изобретение будет иллюстрировано при помощи некоторых примеров, которые не должны истолковываться как ограничивающие объем изобретения. Применяют следующие коммерчески доступные реагенты/смолы: пропаргиловый спирт (от Fluka),оксид марганца (IV), или MnO2 (от Aldrich), 4-диэтиламино-2-бутин-1-ол (от Aldrich), 3-(3 метоксифенил)проп-2-ин-1-ол (от GFS), 2-бромпиримидин (от Aldrich), иодид меди(1) или CuI (от Aldrich), бензиловый эфир 2,2-диметилбут-3-иновой кислоты (от Betapharma), дигидрохлорид 1-(4 фторфенил)пиперазина (от Aldrich), метансульфонилхлорид (от Fluka), 1-(2-пиридил)пиперазин (от Aldrich), гидрохлорид 1-[4-(бензилокси)фенил]пиперазина (от EmkaChem), l-(4-метоксифенил)пиперазинMaybridge),1-(метилсульфонил)-4 фенилпиперазин (от Ambinter), 1-(2-фторфенил)-4-(метилсульфонил)пиперазин (от Ambinter), 1-(4 хлорфенил)-4-(метилсульфонил)пиперазин (от Ambinter), 1-(2-метоксифенил)-4-(метилсульфонил)пиперазин (от Ambinter), 4-диэтиламино-2-бутил-1-ол (от Aldrich), 2-гептин-1-ол (от Aldrich), 3-(3 фторфенил)проп-2-ин-1-ол (от Apollo), 1-(3-хлорфенил)-4-(метилсульфонил)пиперазин (от Ambinter). Данные ВЭЖХ, представленные в примерах, описанных ниже, получали следующим образом. Колонки для ВЭЖХ: колонка Waters Xterra MS C8 размером 504,6 мм при скорости потока 2 мл/мин, 8 мин градиент от 0,1% TFA в Н 2 О до 0,07% TFA в CH3CN. Препаративную ВЭЖХ проводили с колонкой Waters Xterra Prep MS C8, 10 мкм размером 30030 мм; УФ-детектирование (254 и 220 нм); скорость потока 30 мл/мин. Данные МС, представленные в примерах, описанных ниже, получали следующим образом: масс-спектрометр: LC/MS Waters ZMD (ESI). Данные ГХ/МС получали с применением газового хроматографа Agilent 68 90; колонка: DB-1 HS, 10 м- 23012266 0,1 мм I.D. (внутр. диаметр)0,1 мкм; газ-носитель: гелий при скорости потока 45 см/с и при 50 С (0,6 мл/мин); способ с постоянной скоростью потока; нагрев печи: 50 С 1 мин, 50 С/мин до 330 С, выдерживание при такой температуре в течение 5 мин. Дозатор: 250 С, 0,2 мкл. Детектор: Agilent 5973 MSD; линия переноса при 325 С, EI SIM. Данные 1 Н-ЯМР, представленные в примерах, описанных ниже, получали на ЯМР-приборе BrukerDPX-300 МГц. Опыты при микроволновом излучении проводили с применением Emrys Optimizer (от(2,70 г, 31,1 ммоль) на протяжении 2 ч. Образовавшуюся смесь перемешивают при к.т. в течение одного дополнительного часа, затем фильтруют через слой целита и фильтраты упаривают при пониженном давлении, получая при этом 123 мг (51%) указанного в заголовке соединения в виде коричневого твердого вещества. ВЭЖХ, Rt: 2,76 мин (чистота 98,9%). 1 Н-ЯМР (CDCl3) : 9,37 (с, 1 Н), 7,18 (м, 1 Н) , 7,00 (м, 1 Н), 6,82 (д, J=8,3 Гц, 1 Н), 6,03 (с, 2 Н). Промежуточный продукт А 2. Фенил-2-бутиналь. Промежуточный продукт А 2 4-Фенил-2-бутин-1-ол (550 мг; 3,76 ммоль, получен, как описано в Bull. Soc. Chim. Fr, 1954, 816) растворяют в DCM (10 мл) и добавляют MnO2 (1,64 г; 18,8 ммоль). Смесь перемешивают при к.т. и мониторинг реакции проводят ТСХ (EtOAc/c-Hex, 10/90, окрашивание иодом). Регулярно добавляют MnO2(1,64 Г; 18,8 ммоль; три раза). MnO2 удаляют фильтрованием через слой целита. После промывания целита DCM фильтраты затем концентрируют при пониженном давлении. Очистка сырого продукта флэшхроматографией на силикагеле (градиент EtOAc/c-Hex от 5:95 до 30:70) дает указанное в заголовке соединение в виде оранжевого масла (выход 60 мг, 11%). 1 Н-ЯМР (CDCl3) : 9,22 (с, 1 Н), 7,26 (м, 5 Н), 3,80 (с, 2 Н). Промежуточный продукт A3. 3-(3-Пиридинил)-2-пропиналь.Chem. 1998, 63, 1109-1118) в безводном DCM (10 мл) в атмосфере аргона добавляют порциями MnO2(3,66 г, 42 ммоль) на протяжении 1,5 ч. Реакционную смесь перемешивают при к.т. в течение одного дополнительного часа. Затем реакционную смесь выливают на верх колонки с силикагелем и элюируют смесью c-Hex/EtOAc (2:1, затем 1:1), получая при этом 43 мг (17%) указанного в заголовке соединения в виде желтого порошка. 1 Н-ЯМР (CDCl3) : 9,46 (с, 1 Н), 8,85 (дд, J=2,1, 0,8 Гц, 1 Н) , 8,71 (дд, J=5,0, 1,7 Гц,1 Н), 7,91 (ддд, J=8,0, 2,1, 1,7 Гц, 1 Н), 7,38 (ддд, J=8,0, 5,0, 0,8 Гц, 1 Н). Промежуточный продукт А 4. 4-(Диэтиламино)-2-бутиналь. Промежуточный продукт А 4 К раствору 4-(диэтиламино)-2-бутин-1-ола (1,00 г, 7,08 ммоль) в безводном DCM (60 мл) добавляют порциями MnO2 (20 г, 230 ммоль) на протяжении 1 ч. Образовавшуюся смесь перемешивают при к.т. в течение двух дополнительных часов, затем фильтруют через слой целита. Фильтраты упаривают при пониженном давлении, получая при этом 352 мг (36%) указанного в заголовке соединения в виде оранжевого масла (выход 352 мг, 36%). 1 Промежуточный продукт А 5 К раствору 3-(3-метоксифенил)проп-2-ин-1-ола (500 мг 3,08 ммоль) в безводном DCM (20 мл) в атмосфере аргона добавляют порциями MnO2 (7,8 г, 90 ммоль) на протяжении 2 ч. Реакционную смесь перемешивают при к.т. в течение одного дополнительного часа. Затем реакционную смесь фильтруют, растворитель удаляют при пониженном давлении. Очистка флэш хроматографией на силикагеле (cHex:EtOAc, градиент 9:1-4:1 дает 122 мг (25%) соединения в виде желтого масла. ВЭЖХ, Rt 2,9 мин К раствору этилизобутирата (530 мкл; 4,08 ммоль) в ТГФ (5 мл) добавляют бис(триметилсилил)амид лития (7,30 мл; 1,00 М раствор в ТГФ; 7,30 ммоль) при -78 С. Смесь убирают из охлаждающей бани и перемешивают в течение 30 мин. Затем ее переносят канюлей на суспензию гидрохлорида 4-(4-хлорбут-2-ин-1-ил)морфолина (получен, как описано Gomez et al., 1997, Tetrahedron,53(50), 17201-17210; 714 мг; 3,40 ммоль) в ТГФ (5 мл), в которой поддерживают -78 С. Реакционную смесь оставляют в охлаждающей бане и дают ей возможность нагреться до к.т. Через 3 ч ее гасят водой и экстрагируют дважды EtOAc. Объединенные органические фазы промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Очистка сырого продукта флэш-хроматографией на диоксиде кремния (градиент DM/MeOH 100:0-90:10) дает указанное в заголовке соединение в виде бесцветного масла (выход 600 мг, 70%). 1 Н-ЯМР (ДМСО-d6) : 4,11 (квд, J=7,l Гц, 2 Н), 4,14 (м, 4 Н), 3,31 (т, J=2,1 Гц, 0,6 Н), 3,25 (м, 1,4 Н),2,52 (м, 4 Н), 2,43 (т, J=2,3 Гц, 2 Н), 1,25 (с, 6 Н), 1,23 (т, J=7,0 Гц, 3 Н). Стадия b). Получение 2,2-диметил-6-морфолин-4-илгекс-4-ин-1-ола. К раствору этил-2,2-диметил-6-морфолин-4-илгекс-4-иноата (380 мг; 1,50 ммоль) в ТГФ (5 мл) при 0 С добавляют LiAlH4 (2,25 мл; 1,00 М раствор в ТГФ; 2,25 ммоль). Смесь перемешивают при 0 С в течение 1 ч и гасят водой (80 мкл), 15% NaOH (80 мкл) и водой (380 мкл). Полученную таким образом суспензию затем фильтруют через подушку целита и подушку промывают несколько раз EtOAc. Фильтрат концентрируют при пониженном давлении, получая при этом 302 мг указанного в заголовке соединения в виде оранжевого масла (выход 307 мг, 97%). ГХ/МС, m/z: 211, Rt: 4,13 мин. Стадия с). Получение 2,2-диметил-6-морфолин-4-илгекс-4-иналя (А 6). Промежуточный продукт А 6 К раствору оксалилхлорида (152 мкл; 1,74 ммоль) в DCM (4 мл) при -78 С добавляют раствор ДМСО (237 мкл; 3,34 ммоль) в DCM (2 мл). Смесь перемешивают в течение 5 мин перед добавлением раствора 2,2-диметил-6-морфолин-4-илгекс-4-ин-1-ола (307 мг; 1,45 ммоль) в DCM (2 мл). Смесь снова перемешивают при -78 С в течение 15 мин и добавляют TEA (1,05 мл). Смесь затем опять охлаждают до к.т. и перемешивают в течение 2 ч. Добавляют воду. Органическую фазу промывают насыщенным раствор NaHCO3 и насыщенным раствором соли. Ее сушат над сульфатом магния, фильтруют и концентрируют, получая при этом указанное в заголовке соединение в виде бесцветного масла (303 мг, количественный выход). 1DCM (50 мл) добавляют TEA (3,33 г; 33,0 ммоль; 3,3 экв.) и образовавшуюся смесь охлаждают при 0 С. По каплям добавляют 1 н. раствор метансульфонилхлорида (1,26 г; 11,0 ммоль; 1,1 экв.) в DCM (11 мл). После выдерживания 20 мин при 0 С реакционную смесь перемешивают при к.т. в течение 3 ч. Добавляют воду и смесь экстрагируют DCM. Объединенные органические слои промывают водным насыщенным раствором NaHCO3, водой, насыщенным раствором соли, затем сушат над MgSO4, фильтруют и упаривают, получая при этом белый порошок. Кристаллизация из EtOAc дает белое твердое вещество Промежуточный продукт В 2 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(2-пиридил)пиперазина (3,59 г, 22 ммоль, 1,0 экв.), в виде белого порошка (выход 3,14 г, 65%). 1 Промежуточный продукт В 3 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из гидрохлорида 1-[4-(бензилокси)фенил]пиперазина (2,0 г, 6,56 ммоль, 1 экв.), в виде белого порошка (выход 1,85 г, 82%). ВЭЖХ, Rt: 1,2 мин (чистота 99,8%). ЖХ/МС, М+ (ESI): 347,1, М(ESI): 345,0. Промежуточный продукт В 4. 1-(4-Метоксифенил)-4-(метилсульфонил)пиперазин. Промежуточный продукт В 4 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-метоксифенил)пиперазина (1920 мг, 10,0 ммоль), в виде не совсем белого порошка (выход 2180 мг, 81%). ВЭЖХ, Rt: 1,2 мин (чистота 99,8%). ЖХ/МС, М+ (ESI): 271,1. 1 Промежуточный продукт В 5 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 4-(4-метоксифенил)пиперидина (2,0 г), в виде белого порошка (2,2 г, 78,11%). ВЭЖХ,Rt: 3,04 мин (чистота: 100%). ЖХ/МС, М+ (ESI): 270,1. Промежуточный продукт В 6. 1-(Метилсульфонил)-4-[4-(трифторметил)фенил]пиперазин. Промежуточный продукт B6 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-трифторметилфенил)пиперазина (2,3 г), в виде желтого порошка (выход 2,34 г,76%). ВЭЖХ, Rt: 3,56 мин (чистота: 99,9%). ЖХ/МС, М+ (ESI): 309,1. Промежуточный продукт В 7. 4-(4-Фторфенил)-1-(метилсульфонил)пиперидин. Промежуточный продукт В 7 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 4-(4-фторфенил)пиперидин-HCl (2,15 г), в виде бежевого порошка (выход 1,79 г,70%). ВЭЖХ, Rt: 3,18 мин (чистота 100%). ЖХ/МС, М+ (ESI): 258,1. Промежуточный продукт В 8. 1-[1,1'-Бифенил]-4-ил-4-(метилсульфонил)пиперазин. Промежуточный продукт B8 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(бифенил-4-ил)пиперазина (1,79 г), в виде белого порошка (выход 2,12 г, 89%). ВЭЖХ, Rt: 3,60 мин (чистота: 99,8%). ЖХ/МС, М+ (ESI): 317,2. Промежуточный продукт В 9. 1-(5-Хлорпиридин-2-ил)-4-(метилсульфонил)пиперазин. Промежуточный продукт В 9 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(5-хлор-2-пиридинил)пиперазина (получен, как описано Swanson et al., 2005, Journalof Medicinal Chemistry, 48(6), 1857-1872, 395 мг, 2 ммоль), в виде бежевого порошка (выход 379 мг, 69%). ВЭЖХ, Rt: 1,60 мин (чистота: 100%). ЖХ/МС, М+ (ESI): 276,2. Промежуточный продукт В 10. 2-[4-(Метилсульфонил)пиперазин-1-ил]пиримидин. Промежуточный продукт В 10 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(2-пиримидил)пиперазина (2,10 г), в виде белого порошка (выход 2,49 г, 80%). ВЭЖХ, Rt: 1,14 мин (чистота: 100%). ЖХ/МС, М+ (ESI): 243,3. Промежуточный продукт В 11. 1-(4-Хлорфенил)-4-(метилсульфонил)пиперазин.- 27012266 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-хлорфенил)пиперазина (1,97 г, 10 ммоль), в виде белого порошка (выход 2,08 г,75%). ВЭЖХ, Rt: 3,02 мин (чистота 100%). ЖХ/МС, М+ (ESI): 275,2. Промежуточный продукт В 12. 1-(3-Метоксифенил)-4-(метилсульфонил)пиперазин. Промежуточный продукт В 12 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(3-метоксифенил)пиперазина (2,27 г), в виде белого порошка (выход 2,58 г, 81%). ВЭЖХ, Rt: 2,13 мин (чистота: 100%). ЖХ/МС, М+ (ESI): 271,3. Промежуточный продукт В 13. 1-(Метилсульфонил)-4-[5-(трифторметил)пиридин-2-ил]пиперазин. Промежуточный продукт В 13 К раствору 1-[5-(трифторметил)пиридин-2-ил]пиперазина (23 г, 0,099 моль) и TEA (42 мл, 0,298 моль) в сухом дихлорметане (400 мл), выдерживаемому при 0 С в атмосфере азота, добавляют метансульфонилхлорид (12,6 г, 0,109 моль) на протяжении периода 20 мин. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч и разбавляют водой. Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Неочищенный продукт перекристаллизовывают из смеси петролейный эфир:EtOAc (9:1), получая при этом указанное в заголовке соединение в виде твердого вещества (выход 27 г, 87%). ТСХ: Rf=0,75 (хлороформ:MeOH; 9:1). 1 Н-ЯМР (CDCl3, 300 МГц) : 2,82 (3 Н, с), 3,32 (4 Н, м), 3,79 (4 Н, м), 6,68 (1 Н, д, J=9 Гц), 7,68 (1 Н, д,J=9 Гц), 8,42 (1 Н, с). Промежуточный продукт В 14. 1-(Метилсульфонил)-4-(4-феноксифенил)пиперазин. Промежуточный продукт В 14 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-феноксифенил)пиперазина (получен, как описано Kiritsy et al., 1978, in Journal ofMedicinal Chemistry, 21(12), 1301-1307; 1,0 г; 3,93 ммоль), в виде бежевого порошка (выход 1,16 г, 89%). ВЭЖХ, Rt: 2,38 мин (чистота 99,7%). ЖХ/МС, М+ (ESI): 333,1, М- (ESI): 331,2. Промежуточный продукт В 15. 4-(4-Хлорфенил)-1-(метилсульфонил)пиперидин. Промежуточный продукт В 15 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 4-(4-хлорфенил)пиперидина (700 мг; 3,02 ммоль), в виде желтого порошка (выход 473 мг, 57%). ВЭЖХ, Rt: 3,80 мин (чистота: 97,5%). ЖХ/МС, М+ (ESI): 274,1. Промежуточный продукт 16. 4-(4-Метилфенил)-1-(метилсульфонил)пиперидин. Промежуточный продукт В 16 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 4-(4-метилфенил)пиперидина (700 мг; 3,02 ммоль), в виде белого твердого вещества Промежуточный продукт В 17 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-[5-(трифторметил)пирид-2-ил]-1,4-диазепана (500 мг; 2,04 ммоль), в виде не совсем белого порошка (выход 472 мг, 72%). ВЭЖХ, Rt: 2,09 мин (чистота: 99,9%). 1 Промежуточный продукт В 18 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-этоксифенил)пиперазина (2,0 г, 9,7 ммоль), в виде бежевого порошка (выход 2,55 г, 92%). ВЭЖХ, Rt: 1,74 мин (чистота: 99,5%). ЖХ/МС, М+ (ESI) : 285,1. Промежуточный продукт В 19. 1-(5-Бромпиридин-2-ил)-4-(метилсульфонил)пиперазин. Промежуточный продукт В 19 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(5-бромпиридин-2-ил)пиперазина (28 г, 0,116 моль), в виде бежевого твердого вещества (выход 29 г, 78%). 1 Н-ЯМР (CDCl3) : 2,82 (3 Н, с), 3,33 (4 Н, т), 3,67 (4 Н, т), 6,59 (1 Н, д, J=9 Гц), 7,58-7,59 (1 Н, м), 8,22 Промежуточный продукт В 20 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(1,3-бензодиоксол-5-ил)пиперазина (638 мг; 3,09 ммоль), в виде бежевого порошка Промежуточный продукт В 21 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из гидрохлорида 1-(3,4-диметоксифенил)пиперазина (2,0 г; 7,73 ммоль), в виде белого порошка (выход 1,89 г, 81%). ВЭЖХ, Rt: 1,58 мин (чистота: 99,6%). ЖХ/МС, М+ (ESI): 301,1. Промежуточный продукт В 22. 1-(4-Этоксифенил)-4-(метилсульфонил)-1,4-диазепан. Стадия а). Получение дигидрохлорида 1-(4-этоксифенил)-1,4-диазепана. Получают раствор гомопиперазина (2,74 г), 4-бромфенетола (5,0 г) и трет-бутоксида натрия (3,6 г) в безводном толуоле (50 мл). Через раствор в течение 5 мин барботируют аргон, затем добавляют Pd(OAc)2(280 мг) и (+/-)-BINAP (620 мг) и реакционную смесь нагревают при кипении с обратным холодильником в течение 15 ч. Реакционную смесь упаривают при пониженном давлении, получая при этом темнокоричневое твердое вещество, которое растворяют в DCM и адсорбируют на диоксиде кремния. Очистка флэш-хроматографией на диоксиде кремния (DCM/MeOH) дает основное соединение в виде желтого масла.- 29012266 Осаждение в Et2O дигидрохлоридной соли добавлением избытка 1 М раствора HCl в Et2O дает 1,06 г (15%) указанного в заголовке соединения в виде белого порошка. ЖХ/МС, М+ (ESI): 221,2. Стадия b). Получение 1-(4-этоксифенил)-4-(метилсульфонил)-1,4-диазепана. Промежуточный продукт В 22 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из дигидрохлорида 1-(4-этоксифенил)-1,4-диазепана (250 мг; 0,85 ммоль), в виде оранжевого твердого вещества (выход 141 мг, 55%). ВЭЖХ, Rt: 1,59 мин (чистота: 94,7%). ЖХ/МС, М+ (ESI): 299,2. Промежуточный продукт В 23. (2R)-4-(4-Фторфенил)-2-метил-1-(метилсульфонил)пиперазин. Стадия а). Получение (3R)-1-(4-фторфенил)-3-метилпиперазина. К смеси 1-бром-4-фторбензола (5,0 г, 0,0285 моль), (R)-2-метилпиперазина (3,15 г, 0,0313 моль) и трет-бутоксида натрия (4 г, 0,042 моль) в сухом толуоле (100 мл) в атмосфере азота добавляют Pd(OAc)2(0,25 г, 0,0011 моль) с последующим добавлением BINAP (0,75 г, 0,0012 моль). Реакционную смесь затем кипятят с обратным холодильником в течение 18 ч и охлаждают до к.т. Реакционную смесь промывают водой, сушат над сульфатом магния, фильтруют и концентрируют. Очистка сырого продукта хроматографией на диоксиде кремния (хлороформ:MeOH, 8:2) дает указанное в заголовке соединение в виде жидкости (выход 2,5 г, 46%). ТСХ: Rf=0,25 (хлороформ/МеОН, 9/1). Стадия b). Получение (2R)-4-(4-фторфенил)-2-метил-1-(метилсульфонил)пиперазина. Промежуточный продукт В 23 Указанное в заголовке соединение получают по методике, описанной для промежуточного продукта В 1, но исходя из 1-(4-фторфенил)-(3R)-метилпиперазина (500 мг; 2,57 ммоль), в виде желтого твердого вещества (выход 458 мг, 65%). ВЭЖХ, Rt: 2,85 мин (чистота: 96,9%). ЖХ/МС, М+ (ESI): 273,1. Пример 1. 3-(1,3-Бензодиоксол-5-ил)-1-([4-(4-фторфенил)-1-пиперазинил]сульфонилметил)-2 пропинил(гидрокси)формамид (1). Стадия а). Получение смеси 1-[(1E)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил-4-(4 фторфенил)пиперазина и 1-[(1Z)-4-(1,3-бензодиоксол-5-ил)-1-бутен-3-инил]сульфонил-4-(4-фторфенил)пиперазина. К раствору 1-(4-фторфенил)-4-(метилсульфонил)пиперазина (промежуточный продукт В 1, 175 мг; 0,68 ммоль) в ТГФ (5 мл) при -78 С в инертной атмосфере медленно добавляют бис(триметилсилил)амид лития (1,49 мл; 1,00 М раствор в толуоле; 1,49 ммоль). Смесь затем перемешивают при -78 С в течение 1 ч. По истечении этого времени добавляют диэтилхлорфосфат (98 мкл; 0,68 ммоль) и смесь перемешивают при -78 С в течение дополнительного 1 ч. Канюлей добавляют раствор 3-(1,3-бензодиоксол-5-ил)-2 пропиналя (промежуточный продукт А 1, 124 мг; 0,71 ммоль) в ТГФ (1 мл) и смеси дают возможность нагреться до комнатной температуры и ее перемешивают в течение 18 ч. Добавляют насыщенный водный раствор хлорида аммония и реакционную смесь экстрагируют EtOAc. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Очистка флэш-хроматографией на диоксиде кремния (EtOAc:с-Нех, 10:90-30:70) дает указанное в заголовке соединение (171 мг Е-изомера и 23 мг Z-изомера, общий выход 69%). Е-изомер: ВЭЖХ, Rt: 4,56 мин (чистота 93,0%). ЖХ/МС, М+ (ESI): 415,2. 1
МПК / Метки
МПК: A61P 29/00, C07D 213/42, C07F 7/08, A61K 31/495, A61P 37/00, C07D 295/22, A61K 31/496, C07D 213/74, C07D 317/58, C07D 243/08, C07D 211/96
Метки: применение, сульфониламиноциклические, соединения
Код ссылки
<a href="https://eas.patents.su/30-12266-sulfonilaminociklicheskie-soedineniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфониламиноциклические соединения и их применение</a>
Предыдущий патент: Шоколадная композиция
Следующий патент: Замещённые пирролы и имидазолы, содержащие их композиции, способ получения и применение
Случайный патент: Проточные реакторы для химических превращений с использованием гетерогенных катализаторов