Терапевтические пиразоло[3,4-b]пиридины и индазолы
Формула / Реферат
1. Соединение формулы I
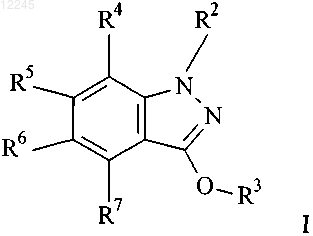
где R2 представляет собой фенил, возможно замещенный заместителями в количестве от одного до трех, независимо выбранными из галогено, метила, этила, CF3, метокси, CH2F, CHF2 и СН2ОН;
R3 выбран из группы: 3-пирролидинила, 4-пиперидинила, 3-пиперидинила и 2-морфолинила; и
R4, R5, R6 и R7 представляют собой Н или три из R4, R5, R6 и R7 представляют собой Н, а один из R4, R5, R6 и R7 выбран из группы: галогено, метокси и C1-С3алкила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R4, R5, R6 и R7 представляют собой Н и R2 представляет собой фенил, возможно замещенный одним или двумя заместителями фторо; или его фармацевтически приемлемая соль.
3. Соединение по п.2, где R3 представляет собой 3-пиперидинил или 4-пиперидинил; или его фармацевтически приемлемая соль.
4. Соединение по п.1, выбранное из группы, состоящей из
(S)-(-)-1-(2-фторфенил)-3-(пирролидин-2-илокси)-1Н-индазола,
1-(3-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола,
1-фенил-3-(пиперидин-4-илокси)-1Н-индазола,
1-(2,6-дифторфенил)-3-(пиперидин-4-илокси)-1Н-индазола,
1-(2,5-дифторфенил)-3-(пиперидин-4-илокси)-1Н-индазола,
4-фтор-1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола,
1-(2,5-дифторфенил)-4-фтор-3-(пиперидин-4-илокси)-1Н-индазола и
1-(2,4-дифторфенил)-4-фтор-3-(пиперидин-4-илокси)-1Н-индазола;
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
6. Способ лечения расстройства или состояния, выбранного из группы, состоящей из фибромиалгии, синдрома дефицита внимания и гиперактивности, невропатической боли, недержания мочи при напряжении, тревоги, депрессии и шизофрении, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
7. 1-(2-Фторфенил)-3-(пиперидин-4-илокси)-1Н-индазол или его фармацевтически приемлемая соль.
8. Соль по п.7, представляющая собой L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола.
9. Соль по п.7, выбранная из группы:
эдизилата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола;
фумарата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола;
гидробромида 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола;
геми-L-тартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола;
L-малата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола;
фосфата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола и
сульфата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
11. Композиция по п.10, где фармацевтически приемлемая соль представляет собой L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола.
12. Композиция по п.10, содержащая терапевтически эффективное количество кристаллического L-тартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола и фармацевтически приемлемый носитель.
13. Способ лечения фибромиалгии, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола или его фармацевтически приемлемой соли.
14. Способ лечения синдрома дефицита внимания и гиперактивности, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1H-индазола или его фармацевтически приемлемой соли.
15. Способ лечения расстройства или состояния, выбранного из группы, состоящей из невропатической боли, недержания мочи при напряжении, тревоги, депрессии и шизофрении, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1Н-индазола или его фармацевтически приемлемой соли.
Текст
012245 ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ Моноамины норэпинефрин и серотонин обладают множеством действий в качестве нейромедиаторов. Эти моноамины захватываются нейронами после высвобождения в синаптическую щель. Норэпинефрин и серотонин захватываются из синаптической щели соответствующими транспортерами норэпинефрина и серотонина. Лекарственные средства, которые ингибируют транспортеры норэпинефрина и серотонина, могут продлевать действия соответственно норэпинефрина и серотонина в синапсе, обеспечивая лечение множества заболеваний. Например, обнаружено, что ингибитор обратного захвата серотонина флуоксетин полезен при лечении депрессии и других расстройств нервной системы. Ингибитор обратного захвата норэпинефрина атомоксетин одобрен для лечения синдрома дефицита внимания и гиперактивности (СДВГ) в качестве STRATTERA. Дополнительно, ингибитор транспортеров норэпинефрина и серотонина милнаципран разработан для лечения фибромиалгии, представляющей собой заболевание, которое поражает приблизительно 2% взрослого населения в Соединенных Штатах Америки. Тем не менее, Управлением по контролю за качеством пищевых продуктов и медикаментов (FDA) в настоящее время не предложено никакого лекарственного средства для лечения фибромиалгии. Соответственно, существует постоянная потребность в области техники в соединениях, представляющих собой ингибиторы транспортеров норэпинефрина, ингибиторы транспортеров серотонина и ингибиторы как транспортеров норэпинефрина, так и транспортеров серотонина, для лечения заболеваний, включающих фибромиалгию, СДВГ, невропатическую боль, недержание мочи, расстройство генерализованной тревоги,депрессию, шизофрению. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ В одном из аспектов настоящего изобретения предложены соединения формулы I или их фармацевтически приемлемая соль; где X представляет собой N или C(R4); R2 представляет собой 2-пиридинил или фенил, где указанный 2-пиридинил или указанный фенил возможно могут быть замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из водорода, галогено, метила, этила,CF3, метокси, CH2F, CHF2 и СН 2 ОН; L отсутствует или представляет собой метилен; R3 выбран из группы, состоящей из 3-пирролидинила, 4-пиперидинила, 3-пиперидинила и 2-морфолинила; и R4, R5, R6 и R7 представляют собой Н; или три из R4, R5, R6 и R7 представляют собой Н, а один из R4, R5, R6 и R7 выбран из группы, состоящей из галогено, метокси и С 1-С 3 алкила. Примеры фенильной группы R2, замещенной заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из водорода, галогено, метила, этила, CF3, метокси, CH2F, CHF2 и СН 2 ОН, включают 3-хлорфенил, 2,6 дибромфенил, 2,4,6-трибромфенил, 2,6-дихлорфенил, 4-трифторметилфенил, 3-метилфенил, 4 метилфенил, 3,5-диметилфенил, 3,4,5-триметоксифенил, 3,5-диметоксифенил, 3,4-диметоксифенил, 3 метоксифенил, 4-метоксифенил, 3,5-дифторфенил, 4-хлорфенил, 3-трифторметилфенил, 3,5 дихлорфенил, 2-метокси-5-метилфенил, 2-фтор-5-метилфенил, 4-хлор-2-трифторметилфенил и тому подобное, но не ограничиваются ими. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил, a 4 5R , R , R6 и R7 представляют собой Н; или три из R4, R5, R6 и R7 представляют собой Н, а один из R4, R5,R6 и R7 выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила - соединение формулы II. В некоторых воплощениях формулы II R4, R5, R6, и R7 представляют собой Н, a R2 возможно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо. В некоторых воплощениях формулы II R3 представляет собой 3-пирролидинил. Примеры соединений формулы II, где R3 представляет собой 3-пирролидинил, включают (R)-1-(2,5-дифторфенил)-3-(пирролидин 3-илметокси)-1 Н-индазол; (R)-l-(2,4-дифторфенил)-3-(пирролидин-3-илметокси)-1 Н-индазол; (S)-1-(2,4 дифторфенил)-3-(пирролидин-3-илметокси)-1 Н-индазол;(S)-(-)-1-(2-фторфенил)-3-(пирролидин-3 илметокси)-1 Н-индазол; (S)-1-(2,6-дифторфенил)-3-(пирролидин-3-илметокси)-1 Н-индазол; (R)-1-фенил 3-(пирролидин-3-илметокси)-1 Н-индазол и (S)-(-)-l-(2-фторфенил)-3-(пирролидин-2-илокси)-1 Н-индазол. В некоторых воплощениях формулы II R3 представляет собой 3- или 4-пиперидинил. Примеры соединений формулы II, где R3 представляет собой 3- или 4-пиперидинил, включают -1-(2,5-дифторфенил)-3(пиперидин-3-илметокси)-1 Н-индазол; 1-(3-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазол; 1-фенил-3(пиперидин-4-илокси)-1 Н-индазол; 1-(2,6-дифторфенил)-3-(пиперидин-4-илокси)-1 Н-индазол; 1-(2,5 дифторфенил)-3-(пиперидин-4-илокси)-1 Н-индазол и -1-(3-фторфенил)-3-(пиперидин-3-илметокси)1 Н-индазол. Дополнительные соединения формулы II, где R3 представляет собой 3- или 4-пиперидинил,включают (S)-(-)-1-(2-фторфенил)-3-(пиперидин-3-илметокси)-1 Н-индазол; (S)-1-(2,6-дифторфенил)-3(пиперидин-3-илметокси)-1 Н-индазол и (S)-(-)-l-фенил-3-(пиперидин-3-илметокси)-1 Н-индазол. В неко-1 012245 торых воплощениях формулы II R3 представляет собой 2-морфолинил. Примеры соединений формулы II,где R3 представляет собой 2-морфолинил, включают: (S)-(+)-1-(2,5-дифторфенил)-3-(морфолин-2 илметокси)-1 Н-индазол; (S)-1-(2,6-дифторфенил)-3-(морфолин-2-илметокси)-1 Н-индазол; (S)-(+)-1-(2,4 дифторфенил)-3-(морфолин-2-илметокси)-1 Н-индазол;(S)-1-(3,4-дифторфенил)-3-(морфолин-2 илметокси)-1 Н-индазол; (S)-(+)-1-(2-фторфенил)-3-(морфолин-2-илметокси)-1 Н-индазол и (S)-(+)-3(морфолин-2-илметокси)-1-фенил-1H-индазол. В некоторых воплощениях соединение формулы I представляет собой (S)-1-(2,6-дифторфенил)-3-(морфолин-2-илметокси)-1 Н-индазол или его фармацевтически приемлемую соль. В некоторых воплощениях настоящего изобретения предложен 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н-индазол или его фармацевтически приемлемая соль. В еще одном воплощении в настоящем изобретении предложен L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил и 6R выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила - соединение формулы III. В некоторых воплощениях формулы III R2 возможно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо. В некоторых воплощениях формулы III R3 представляет собой 3-пирролидинил. Примером соединения формулы III, где R3 представляет собой 3 пирролидинил, является (R)-1-(2,5-дифторфенил)-5-фтор-3-(пирролидин-3-илметокси)-1 Н-индазол. В некоторых воплощениях формулы III R3 представляет собой 4-пиперидинил или 3-пиперидинил. Примером соединений формулы III, где R3 представляет собой 4-пиперидинил или 3-пиперидинил, является 1(2,6-дифторфенил)-5-фтор-3-(пиперидин-4-илокси)-1 Н-индазол. В некоторых воплощениях формулы IIIR3 представляет собой 2-морфолинил. Примеры соединений формулы II, где R3 представляет собой 2 морфолинил, включают (S)-l-(2,6-дифторфенил)-5-фтор-3-(морфолин-2-илметокси)-1 Н-индазол; (S)-l(2,5-дифторфенил)-5-фтор-3-(морфолин-2-илметокси)-1 Н-индазол; (S)-(+)-l-(2,4-дифторфенил)-5-фтор-3(морфолин-2-илметокси)-1 Н-индазол и (S)-(+)-5-фтор-1-(2-фторфенил)-3-(морфолин-2-илметокси)-1 Ниндазол. В некоторых воплощениях соединение формулы I представляет собой (S)-1-(2,5-дифторфенил)5-фтор-3-(морфолин-2-илметокси)-1 Н-индазол или его фармацевтически приемлемую соль. В некоторых воплощениях соединение формулы I представляет собой (S)-(+)-l-(2,4-дифторфенил)-5-фтор-3(морфолин-2-илметокси)-1 Н-индазол или его фармацевтически приемлемую соль. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил и 7R выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила - соединение формулы IV. В некоторых воплощениях формулы IV R2 возможно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо. В некоторых воплощениях формулы IV R3 представляет собой 3-пирролидинил. В некоторых воплощениях формулы IV R3 представляет собой 3- или 4 пиперидинил. Примеры соединений формулы IV, где R3 представляет собой 3- или 4-пиперидинил,включают 4-фтор-1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазол; 1-(2,5-дифторфенил)-4-фтор-3(пиперидин-4-илокси)-1 Н-индазол; 1-(2,4-дифторфенил)-4-фтор-3-(пиперидин-4-илокси)-1 Н-индазол;(S)-1-(2,5-дифторфенил)-4-фтор-3-(пиперидин-3-илметокси)-1 Н-индазол и (S)-4-фтор-1-(2-фторфенил)-3(пиперидин-3-илметокси)-1 Н-индазол. В некоторых воплощениях формулы IV R3 представляет собой 2 морфолинил. Примером соединения формулы IV, где R3 представляет собой 2-морфолинил, является (S)1-(2,5-дифторфенил)-4-фтор-3-(морфолин-2-илметокси)-1 Н-индазол. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил и 5R выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила - соединение формулы V. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил, и R4 выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила - соединение формулы VI. В некоторых воплощениях формулы I X представляет собой C(R4) и R2 представляет собой 2-пиридинил - соединение формулы VII. В некоторых воплощениях формулы I X представляет собой N и R2 представляет собой фенил - соединение формулы VIII. В некоторых воплощениях формулы I X представляет собой N и R2 представляет собой 2 пиридинил - соединение формулы IX. В некоторых воплощениях формулы I X представляет собой C(R4),R2 представляет собой фенил, возможно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо (например, 2,6-дифторфенил, 2-фторфенил, 4 фторфенил, 2,4-дифторфенил, 2,5-дифторфенил или 3,4-дифторфенил). В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил,возможно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо, и -L-R3 представляет собой,где волнистая линия указывает на точку присоединения к остальной части соединения.-2 012245 В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил,возможно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо, и-L-R3 представляет собой:,где волнистая линия указывает на точку присоединения к остальной части соединения. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой, фенил возможно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо, и-L-R3 представляет собой,где волнистая линия указывает на точку присоединения к остальной части соединения. В некоторых воплощениях-L-R3 представляет собой,где волнистая линия указывает на точку присоединения к остальной части соединения. В некоторых воплощениях формулы I X представляет собой C(R4), R2 представляет собой фенил,возможно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из водорода и фторо, и-L-R3 представляет собой:,где волнистая линия указывает на точку присоединения к остальной части соединения. В еще одном аспекте в настоящем изобретении предложены соединения формулы XI или их фармацевтически приемлемая соль; где X представляет собой N или C(R4); R2 представляет собой 2-пиридинил или фенил, где указанный 2-пиридинил или указанный фенил возможно могут быть замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из водорода, галогено, метила, этила, CF3, метокси, CH2F, CHF2 и СН 2 ОН; L отсутствует или представляет собой метилен; R4, R5, R6 и R7 представляют собой Н; или три из R4, R5, R6 и R7 собой Н, а один из R4 ,R5, R6 и R7 выбран из группы, состоящей из галогено, метокси и C1-С 3 алкила; R3 выбран из группы, состоящей из 3-пирролидинила, 4-пиперидинила, 3-пиперидинила и 2-морфолинила, где азот в кольце указанного 3-пирролидинила, 4-пиперидинила, 3-пиперидинила или 2-морфолинила замещен C1-С 3 алкилом или группой -С(О)-О-С 1-С 4 алкил. В некоторых воплощениях соединение формулы XI может быть подвергнуто снятию защиты путем удаления указанного(ой) C1-С 3 алкила или группы -С(О)-О-С 1-С 4 алкил с атома азота в кольце указанного 3-пирролидинила, 4-пиперидинила, 3-пиперидинила или 2-морфолинила с использованием подходящих реагентов и условий с образованием соединения формулы I. В еще одном аспекте в настоящем изобретении предложены способы лечения млекопитающего,страдающего от расстройства, опосредованного норэпинефрином и/или опосредованного серотонином,включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В еще одном аспекте в настоящем изобретении предложены способы лечения синдрома дефицита внимания и гиперактивности (СДВГ), включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В еще одном аспекте в настоящем изобретении предложены способы лечения расстройства или со-3 012245 стояния, выбранного из невропатической боли, недержания мочи при напряжении, депрессии и шизофрении, включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В еще одном аспекте в настоящем изобретении предложены способы лечения фибромиалгии,включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В некоторых воплощениях в настоящем изобретении предложены способы лечения фибромиалгии, включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола или его фармацевтически приемлемой соли. В некоторых воплощениях в настоящем изобретении предложены способы лечения фибромиалгии, включающие введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества L-тартрата 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н-индазола. В еще одном аспекте в настоящем изобретении предложены способы лечения млекопитающего,страдающего от расстройства, опосредованного норэпинефрином и/или опосредованного серотонином,включающие введение млекопитающему, нуждающемуся в таком лечении: (а) соединения формулы I или его фармацевтически приемлемой соли, (б) другого фармацевтически активного соединения, представляющего собой антидепрессант или противотревожное средство, или его фармацевтически приемлемой соли и (в) фармацевтически приемлемого носителя; где активные соединения "а" и "б" присутствуют в количествах, которые делают композицию эффективной в лечении такого расстройства или состояния. В еще одном аспекте в настоящем изобретении предложены фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель. В некоторых воплощениях эти композиции являются полезными в лечении расстройства, опосредованного норэпинефрином и/или опосредованного серотонином. В еще одном аспекте в настоящем изобретении предложены кристаллические 1-(2-фторфенил)-3(пиперидин-4-илокси)-1 Н-индазол или его фармацевтически приемлемая соль. В одном из воплощений в настоящем изобретении предложен кристаллический L-тартрат 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н-индазола. В некоторых воплощениях кристаллический L-тартрат 1-(2-фторфенил)-3(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 22,0, 20,9 и 18,6. В некоторых воплощениях кристаллический L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 13,2, 11,8 и 18,7. В некоторых воплощениях кристаллический L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 37,8, 33,8, 16,8, 11,9, 13,2, 29,0, 19,5,27,6, 31,9, 25,5, 17,9, 23,8, 20,1, 26,0, 23,2, 29,6, 21,4, 22,0, 20,9 и 18,6. В некоторых воплощениях кристаллический эдизилат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 22,5, 20,0 и 21,2. В некоторых воплощениях кристаллический эдизилат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 33,0, 15,7, 12,4, 14,1, 28,2, 30,1, 17,3, 27,1, 19,0, 25,5, 24,1, 11,6, 22,5, 20,0 и 21,2. В некоторых воплощениях кристаллический фумарат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 24,6, 20,1 и 23,2. В некоторых воплощениях кристаллический фумарат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 12,7, 31,5, 11,7, 27,8, 22,4, 26,6, 20,9, 17,2, 15,9, 29,5, 28,4, 25,3, 18,1, 24,6,20,1 и 23,2. В некоторых воплощениях кристаллический гидробромид 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 23,.8, 16,.8 и 25,1. В некоторых воплощениях кристаллический гидробромид 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1,измеренные с использованием CuK излучения: 18,0, 21,6, 38,0, 15,4, 14,1, 30,4, 26,3, 33,5, 28,0, 25,6,12,6, 29,3, 20,1, 24,0, 23,8, 16,8, 25,1 и 20,9. В некоторых воплощениях кристаллический геми-L-тартрат 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 34,5, 36,2 и 39,2. В некоторых воплощениях кристаллический геми-L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола-4 012245 имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2 тета 0,1, измеренные с использованием CuK излучения: 10,3, 14,9, 15,7, 17,0, 19,0, 20,5, 21,6, 22,7, 23,9,24,7, 25,6, 27,7, 29,8, 32,6, 34,5, 36,2 и 39,2. В некоторых воплощениях кристаллический L-малат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 21,9, 21,5 и 20,1. В некоторых воплощениях кристаллический L-малат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 36,8, 24,5, 26,3, 28,7, 12,2, 25,2, 23,1, 18,2, 30,4, 27,3, 14,7, 20,9, 11,4, 19,2,16,7, 21,9, 21,5 и 20,1. В некоторых воплощениях кристаллический фосфат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 21,2, 24,3 и 23,2. В некоторых воплощениях кристаллический фосфат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 12,1, 34,7, 14,0, 30,9, 25,6, 29,3, 33,4, 16,9, 20,6, 15,6, 26,9, 22,8, 20,0, 27,3, 17,9,21,2, 24,3 и 23,2. В некоторых воплощениях кристаллический сульфат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 24,3, 20,2 и 12,1. В некоторых воплощениях кристаллический сульфат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола имеет спектр дифракции рентгеновских лучей на порошке, включающий следующие значения 2-тета 0,1, измеренные с использованием CuK излучения: 26,7, 27,6, 17,2, 21,4, 25,4, 29,7, 16,4, 15,0, 20,0, 18,3, 23,0, 24,3, 20,2 и 12,1. ОПРЕДЕЛЕНИЯ Термин "алкильная группа" или "алкил" включает прямоцепочечные и разветвленные углеродные радикалы. Термин "алкилен" относится к бирадикалу незамещенного или замещенного алкана. Например"C1-6 алкил" представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода. Примеры C1 С 6 алкильных групп с прямой цепью включают метил, этил, н-пропил, н-бутил, н-пентил и н-гексил, но не ограничиваются ими. Примеры алкильных групп с разветвленной цепью включают изопропил, третбутил, изобутил и так далее, но не ограничиваются ими. Примеры алкиленовых групп включают -СН 2-,-CH2-CH2-, -СН 2-СН(СН 3)-СН 2- и -(CH2)1-3, но не ограничиваются ими. Алкиленовые группы могут быть замещены группами, изложенными ниже для алкила. Термин алкил включает как "незамещенные алкилы", так и "замещенные алкилы", причем "замещенные алкилы" относятся к алкильным группировкам, имеющим заместители, замещающие водород на одном или более чем одном атоме углерода углеводородного скелета. Такие заместители независимо выбраны из группы, состоящей из галогено, I, Br, Cl, F, -ОН, -СООН, трифторметила, -NH2, -OCF3 и О-С 1 С 3 алкил. Таким образом, типичные замещенные алкильные группы представляют собой 2,3-дихлорпентил, 3 гидрокси-5-карбоксигексил, 2-аминопропил, пентахлорбутил, трифторметил, метоксиэтил, 3 гидроксипентил, 4-хлорбутил, 1,2-диметилпропил и пентафторэтил."Галогено" включает фторо, хлоро, бромо и йодо. Некоторые из соединений по настоящему изобретению могут существовать в виде стереоизомеров,в том числе энантиомеров, диастереоизомеров и геометрических изомеров. Геометрические изомеры включают соединения по настоящему изобретению, которые имеют алкенильные группы, которые могут существовать в виде Е (entgegen, навстречу) или Z (zusammen, вместе) конформаций; в этом случае все их геометрические формы, как Е, так и Z, цис- и транс- и их смеси находятся в объеме настоящего изобретения. Некоторые соединения по настоящему изобретению имеют циклоалкильные группы, которые могут быть замещены более чем на одном атоме углерода; в этом случае все их геометрические формы,как цис-, так и транс-, и их смеси находятся в объеме настоящего изобретения. Все эти формы, в том числе (R), (S), эпимеры, диастереоизомеры, цис-, транс-, син-, анти-, (Е), (Z), сольваты (в том числе гидраты), таутомеры и их смеси предусмотрены в соединениях по настоящему изобретению. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ Фиг. 1-8 представляют собой спектры дифракции рентгеновских лучей на порошке (ДРЛП) для Lтартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1H-индазола (фиг. 1); эдизилата 1-(2-фторфенил)-3(пиперидин-4-илокси)-1 Н-индазола (фиг. 2); фумарата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола (фиг. 3); гидробромида 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 4); геми-Lтартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 5); L-малата 1-(2-фторфенил)-3(пиперидин-4-илокси)-1 Н-индазола (фиг. 6); фосфата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Ниндазола (фиг. 7) и сульфата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 8). Фиг. 9-16 представляют собой температурные профили дифференциальной сканирующей калори-5 012245 метрии для L-тартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 9); эдизилата 1-(2 фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 10); фумарата 1-(2-фторфенил)-3-(пиперидин-4 илокси)-1 Н- индазола (фиг. 11); гидробромида 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола(фиг. 12); геми-L-тартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 13); L-малата 1(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 14); фосфата 1-(2-фторфенил)-3-(пиперидин 4-илокси)-1 Н-индазола (фиг. 15) и сульфата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (фиг. 16). Фиг. 17 представляет собой рассчитанный спектр дифракции рентгеновских лучей на порошке(ДРЛП) для L-тартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Плучение соединений Соединения по настоящему изобретению (например, соединения формулы I) могут быть получены путем использования способов синтеза, известных в области техники, и способов синтеза, обозначенных на представленных ниже схемах. Схема 1 Фенилгидразин b (например, 2-фторфенилгидразин) или пиридинилгидразин (например, 2 гидразинопиридин), которые обработаны (или не обработаны) основанием, таким как N,Nдиизопропилэтиламин или триэтиламин, в подходящем растворителе (например, этаноле или тетрагидрофуране (ТГФ, подвергают взаимодействию с ангидридом а (например, изатоевым ангидридом) с получением гидразида с (например, N'-(2-фторфенил)гидразида 2-аминобензойной кислоты). Далее, с подкисляют и подвергают взаимодействию с нитритом натрия, а затем с этанолом, с получением индазола d(например, 1-(2-фторфенил)-1 Н-индазол-3-ола). Смесь 1-(2-фторфенил)-1 Н-индазол-3-ола d, соединения е (LG-O-L-R3-PG) и основания, такого как гидридное основание (например, гидрид натрия, гидрид калия), 2-трет-бутилимино-2-диэтиламино-1,3 диметилпергидро-1,3,2-диазафосфорин(ВЕМР),2-трет-бутилимино-2-диэтиламино-1,3 диметилпергидро-1,3,2-диазафосфорин на полистироле (смола PS-BEMP), Na2CO3, K2CO3 или Cs2CO3, в безводном ДМФ (диметилформамиде) подвергают взаимодействию с получением f (например, третбутилового эфира 4-[1-(2-фторфенил)-1H-индазол-3-илокси]пиперидин-1-карбоновой кислоты). LG в е представляет собой подходящую уходящую группу, такую как метансульфонилокси, бензолсульфонилокси, толуол-4-сульфонилокси и трифторметансульфонилокси. PG в е представляет собой подходящую защитную группу амина, такую как трет-бутиловый эфир (ВОС). Специалисту в данной области техники понятно, что, кроме ВОС, в качестве подходящей защитной группы амино для R3 может быть использовано широкое множество защитных групп (смотри, например, Greene and Wuts, Protective Groups in Organic Synthesis, Wiley-lnterscience; 3rd edition (1999. Таким образом, пример е представляет собой третбутиловый эфир 4-метансульфонилоксипиперидин-1-карбоновой кислоты. Заместитель PG в f затем удаляют с получением g (например, 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола). Группы, такие как ВОС, могут быть гидролизованы в кислых условиях. На схеме 2 изображен синтез ангидрида а. а (например, 6-фтор-1 Н-бензо[d][1,3]оксазин-2,4-дион) может быть синтезирован путем взаимодействия 2-аминобензойной кислоты j (например, 2-амино-5 фторбензойной кислоты) с основанием, таким как карбонат натрия, в воде, с последующим добавлением раствора фосгена в толуоле. Схема 3 На схеме 3 изображен альтернативный путь синтеза с. 2-Аминобензойную кислоту j (например, 2 амино-5-хлорбензойную кислоту) подвергают взаимодействию с гидразином b (например, 2,5 дифторфенилгидразином) в присутствии связывающего реагента,такого как 1-[3(диметиламино)пропил]-3-этилкарбодиимид(DCC),1,1'карбонилдиимидазол (CDI), и основания, такого как диметиламинопиридин (DMAP), N,Nдиизопропилэтиламин (DIPEA) или триэтиламин, с получением с (например, N'-(2,5 дифторфенил)гидразида 2-амино-5-хлорбензойной кислоты). Альтернативно, j можно подвергнуть взаимодействию с b и НОВТ (гидратом 1-гидроксибензотриазола) в растворителе, таком как сухой ТГФ (тетрагидрофуран). Затем добавляют N-Me-морфолин (NMM) и перед добавлением EDAC-HCl (гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида) с получением соединения с. Схема 4 На схеме 4 изображен синтез 1 Н-пиразоло[3,4-b]пиридина q. Никотиноилхлорид k (например, 2 хлорникотиноилхлорид) подвергают взаимодействию с гидразином m (например, фенилгидразином) и основанием, таким как триэтиламин, в растворителе, таком как безводный метиленхлорид, с получением о (например, 1-фенил-1 Н-пиразоло[3,4-b]пиридин-3-ола). Затем соединение о циклизуют путем нагревания при 175 С с получением р. р подвергают взаимодействию как при превращении d в g на схеме 1 с получением q. Оценка соединений Соединения по настоящему изобретению (например, соединения формулы I и их фармацевтически приемлемые соли) могут быть оценены в отношении их способности ингибировать транспортеры норэпинефрина и/или транспортеры серотонина. Способность соединений по настоящему изобретению ингибировать транспортеры норэпинефрина и/или транспортеры серотонина может быть определена с использованием обычных способов переноса меченых атомов с использованием радиоактивного лиганда. Рецепторы могут гетерологически экспрессироваться в клеточных линиях, и эксперименты проводили в мембранных препаратах клеточных линий,экспрессирующих транспортеры норэпинефрина и/или транспортеры серотонина. В некоторых воплощениях соединения формулы I могут быть оценены в отношении их способности облегчать механическую аллодинию, вызванную капсаицином, у крыс (например, Sluka, KA, (2002) Jof Neuroscience, 22(13): 5687-5693). Например, модель механической аллодинии, вызванной капсаици-7 012245 ном, у крыс может быть осуществлена следующим образом. На нулевые сутки крыс самцов Sprague-Dawley (приблизительно 150 г) в темновом цикле помещают в подвешенные клетки с проволочным дном и дают возможность акклиматизироваться в течение 0,5 ч в затемненной тихой комнате. На нулевые сутки определяют порог отдергивания левой задней лапы(PWT) при помощи оценки Фон-Фрея на волос с использованием способа перемещения вверх/вниз Диксона. После оценки в подошвенную мышцу правой задней лапы инъекцией вводят 100 мкл капсаицинаPWT для левой задней лапы (контралатерально от места инъекции) каждого животного. Животных, у которых на 6 сутки PWT меньше или равен 11,7 г, рассматривают как реагирующих через аллодинию и перегруппировывают таким образом, что для каждой клетки средние значения PWT являются похожими. На 7 сутки реагирующим животным вводят дозу (например, перорально, интраперитонеально и подкожно и так далее) 10 мл/кг разбавителя (0,5% НРМС (гидроксипропилметилцеллюлоза)/0,2% Tween 80) или разбавитель вместе с соединением. Контралатеральные значения PWT определяют через 2 ч (или приблизительно в момент времени, соответствующий оцениваемой Cmax) после разовой дозы, причем исследователь не владеет информацией о схеме введения доз. Специалист в данной области техники может оценить подходящее время определения контралатерального значения PWT (например, 1, 2 ч и так далее). Для каждого животного значение PWT на 6 сутки вычитают из значения PWT через 2 ч с получением значения дельта PWT, представляющей собой изменение PWT вследствие 2-часовой обработки лекарством. Кроме того, PWT на 6 сутки вычитают из PWT на 0 сутки с получением базового уровня аллодинии, присутствующего у каждого животного. Для определения % ингибирования аллодинии для каждого животного, нормализованного относительно контролей с разбавителем, используют следующую формулу:% ингибирования аллодинии=100(дельта PWT (лекарство) - средняя дельта PWT (разбавитель/(базовый уровень - средняя дельта PWT (разбавитель. ФАРМАЦЕВТИЧЕСКИЕ ПРИЕМЛЕМЫЕ СОЛИ И СОЛЬВАТЫ Соединения, которые используют в настоящем изобретении, могут существовать в несольватированных формах, а также сольватированных формах, включающих гидратированные формы. Вообще,подразумевают, что сольватированные формы, включающие гидратированные формы, охвачены объемом настоящего изобретения. Соединения по настоящему изобретению (например, соединения формулы I) способны дополнительно образовывать фармацевтически приемлемые соли, включающие соли присоединения кислоты и/или основания, но не ограничивающиеся ими. Фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислоты и основания (включающие, дисоли). Примеры подходящих солей можно найти, например, в Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection, and Use, Wiley-VCH, Weinheim, Germany (2002); и Berge et al., "Pharmaceutical Salts" J. of Pharmaceutical Science, 1977; 66: 1-19. Фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают нетоксичные соли, полученные из неорганических кислот, таких как соляная, азотная, фосфорная, серная,бромистоводородная, йодисто-водородная, фосфористая кислота и тому подобное, а также соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и так далее. Так, такие соли соединений формулы I включают соли: ацетат, аспартат, бензоат, безилат (бензолсульфонат), бикарбонат/карбонат, бисульфат, каприлат, камзилат (камфорсульфонат), хлорбензоат, цитрат, эдизилат (1,2-этандисульфонат),дигидрофосфат, динитробензоат, эзилат (этансульфонат), фумарат, глюцептат, глюконат, глюкуронат,гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изобутират, моногидрофосфат,изетионат, D-лактат, L-лактат, малат, малеат, малонат, манделат, мезилат (метансульфонат), метафосфат,метилбензоат, метилсульфат, 2-напсилат (2-нафталинсульфонат), никотинат, нитрат, оротат, оксалат,пальмоат, фенилацетат, фосфат, фталат, пропионат, пирофосфат, пиросульфат, сахарат, себакат, стеарат,суберат, сукцинат, сульфат, сульфит, D-тартрат, L-тартрат, тозилат (толуолсульфонат) и ксинафоат, и тому подобное. Также предусмотрены соли аминокислот, такие как аргинат, глюконат, галактуронат и тому подобное. Соли присоединения кислоты основных соединений могут быть получены путем приведения в контакт формы свободного основания и достаточного количества желаемой кислоты с получением соли. Форма свободного основания может быть регенерирована путем приведения в контакт солевой формы и основания и выделения свободного основания. Формы свободного основания отличаются от их соответствующих солевых форм отчасти некоторыми физическими свойствами, такими как растворимость в полярных растворителях. Фармацевтически приемлемые соли присоединения основания могут быть образованы с металлами или аминами, такими как гидроксиды щелочных и щелочно-земельных металлов или органические амины. Примерами металлов, используемых в качестве катионов, являются алюминий, кальций, магний, ка-8 012245 лий, натрий и тому подобное. Примеры подходящих аминов включают аргинин, холин, хлорпрокаин,N,N'-дибензилэтилендиамин, диэтиламин, диэтаноламин, диоламин, этилендиамин (этан-1,2-диамин),глицин, лизин, меглумин, N-метилглюкамин, оламин, прокаин (бензатин) и трометамин. Соли присоединения основания кислых соединений могут быть получены путем приведения в контакт формы свободной кислоты и достаточного количества желаемого основания с получением соли. Форма свободной кислоты может быть регенерирована путем приведения в контакт солевой формы и кислоты и выделения свободной кислоты. Формы свободной кислоты могут отличаться от их соответствующих солевых форм отчасти некоторыми физическими свойствами, такими как растворимость в полярных растворителях. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ВВЕДЕНИЯ В настоящем изобретении также предложены фармацевтические композиции, включающие терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли вместе с его фармацевтически приемлемым носителем, разбавителем или эксципиентом. Фраза "фармацевтическая композиция" относится к композиции, подходящей для введения при медицинском или ветеринарном применении. Фраза "терапевтически эффективное количество" означает количество соединения или его фармацевтически приемлемой соли, достаточное для ингибирования, остановки заболевания или улучшения при заболевании, которое лечат, при введении самого по себе или в сочетании с другим фармацевтическим агентом или лечением конкретного субъекта или популяции субъектов. Например, для человека или другого млекопитающего терапевтически эффективное количество может быть определено экспериментально в лаборатории или при клиническом испытании для конкретного заболевания и субъекта, которого лечат. Понятно, что определение правильных лекарственных форм, количеств доз и путей введения находится в пределах уровня знаний специалиста в фармацевтической и медицинской областях и описано ниже. Соединение по настоящему изобретению может быть приготовлено в виде фармацевтической композиции в форме сиропа, эликсира, суспензии, порошка, гранулы, таблетки, капсулы, лепешки, троше,водного раствора, крема, мази, лосьона, геля, эмульсии и так далее. Предпочтительно, соединение по настоящему изобретению вызывает ослабление симптомов или признаков заболевания, связанных с расстройством, опосредованным норэпинефрином и/или опосредованным серотонином, что измеряют количественно или качественно. Фармацевтически приемлемые носители для приготовления фармацевтических композиций из соединений по настоящему изобретению могут быть или твердыми, или жидкими. Твердые формы препаратов включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или более веществ, которые также могут действовать в качестве разбавителей, корригентов, связующих веществ, консервантов, разрыхлителей или инкапсулирующего материала. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешивают с носителем, обладающим необходимыми связующими свойствами, в подходящих соотношениях и прессуют до желаемых формы и размера. Порошки и таблетки содержат от 1 до 95% (мас./мас.) активного соединения. В некоторых воплощениях активное соединение находится в диапазоне от 5 до 70% (мас./мас.). Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакантовую камедь, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, легкоплавкий воск,масло какао и тому подобное. Предполагают, что термин "препарат" включает композицию активного соединения с инкапсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент с другими носителями или без них окружен носителем, который, таким образом, находится в ассоциации с ним. Аналогичным образом, включены облатки и лепешки. Таблетки, порошки,капсулы, пилюли, облатки и лепешки могут быть использованы в качестве твердых лекарственных форм,подходящих для перорального введения. Для приготовления суппозиториев легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала плавят и активный компонент гомогенно диспергируют в нем путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы подходящего размера, дают возможность остыть и, тем самым, затвердеть. Препараты в жидкой форме включают растворы, суспензии и эмульсии, например воду или водные/пропиленгликолевые растворы. Для парентеральной инъекции жидкие препараты могут быть приготовлены в водном полиэтиленгликолевом растворе. Водные растворы, подходящие для перорального применения, могут быть получены путем растворения активного компонента в воде и добавления подходящих желаемых красителей, корригентов, стабилизаторов и загустителей. Водные суспензии, подходящие для перорального применения, могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде с вязким материалом, таким как природные или синтетические смолы, каучуки, метилцеллюлоза, натриевая карбокси-9 012245 метилцеллюлоза и другие хорошо известные суспендирующие агенты. Также включены препараты в твердой форме, которые предназначены для превращения непосредственно перед применением, в препараты в жидкой форме для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать дополнительно к активному компоненту красители, корригенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизаторы и тому подобное. Фармацевтический препарат предпочтительно находится в стандартной лекарственной форме. В такой форме препарат разделен на стандартные дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препарата, такая как упакованные таблетки, капсулы и порошки в виалах или ампулах. Кроме того, стандартная лекарственная форма может представлять собой капсулу, таблетку, облатку или лепешку или она может представлять собой подходящее количество любых из них в упакованной форме. Количество активного компонента в препарате в виде стандартной дозы могут варьировать или устанавливать от 0,1 до 1000 мг, предпочтительно от 1,0 до 100 мг или от 1 до 95% (мас./мас.) стандартной дозы, в соответствии с конкретным применением и силой активного компонента. Например, стандартная доза может содержать 10, 15, 20, 25, 30, 40 или 50 мг соединения по настоящему изобретению. Если желательно, композиция также может содержать другие совместимые терапевтические агенты. Фармацевтически приемлемые носители частично определяются конкретной композицией, которую вводят, а также конкретным способом, который применяют для введения композиции. Соответственно,существует широкое множество подходящих препаратов фармацевтических композиций по настоящему изобретению (см., например, Remington: The Science and Practice of Pharmacy, 20th ed., Gennaro et al. Eds.,Lippincott Williams and Wilkins, 2000). Соединение по настоящему изобретению, само по себе или в комбинации с другими подходящими компонентами, может быть приготовлено в аэрозольных композициях (то есть они могут быть "распыленными"), которые должны быть введены путем ингаляции. Аэрозольные композиции могут быть помещены в приемлемые пропелленты под давлением, такие как дихлордифторметан, пропан, азот и тому подобное. Композиции, подходящие для парентерального введения, такого как, например внутривенный,внутримышечный, внутрикожный и подкожный пути, включают водные и неводные изотонические стерильные инъецируемые растворы, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые придают композиции изотоничность крови предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. При практическом применении настоящего изобретения композиции могут быть введены, например, путем внутривенной инфузии, перорально, местно, интраперитонеально, внутрипузырно или интратекально. Препараты соединений могут быть представлены в герметичных контейнерах, содержащих стандартную дозу или множество доз, таких как ампулы и виалы. Инъецируемые растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток ранее описанного типа. Доза, вводимая субъекту в контексте настоящего изобретения, должна быть достаточной для того,чтобы вызвать благоприятный терапевтический ответ у субъекта в течение времени. Термин "субъект" относится к члену класса Mammalia. Примеры млекопитающих включают людей, приматов, шимпанзе,грызунов, мышей, крыс, кроликов, лошадей, домашний скот, собак, кошек, овец и коров, но не ограничиваются ими. В некоторых воплощениях "субъект" представляет собой человека. Доза будет определяться эффективностью конкретного используемого соединения и состоянием субъекта, а также массой организма или площадью поверхности субъекта, которого лечат. Размер дозы также будет определяться присутствием, природой и длительностью каких-либо побочных эффектов,сопровождающих введение конкретного соединения конкретному субъекту. При определении эффективного количества соединения, вводимого при лечении или профилактики заболевания, врач может оценить факторы, такие как уровни соединения в циркулирующей плазме, токсичности соединения и/или прогрессирование заболевания и так далее. Как правило, эквивалент дозы соединения составляет приблизительно от 1 мкг/кг до 100 мг/кг для типичного субъекта. Специалистам в данной области техники известно множество различных способов введения. Соединения по настоящему изобретению могут быть введены со скоростью, определяемой факторами, которые могут включать фармакокинетический профиль соединения, противопоказанные лекарства и побочные эффекты соединения в различных концентрациях, применительно к массе и общему состоянию здоровья субъекта, но не ограничивающимися ими. Введение может быть осуществлено при помощи разовых или разделенных доз. Пример типичной таблетки включает следующее. Соединения по настоящему изобретению (например, соединение формулы I или его фармацевтически приемлемая соль) могут быть смешаны с лактозой и кукурузным крахмалом (для смеси) и перемешаны до однородности порошка. Кукурузный крахмал (для пасты) суспендируют в 6 мл воды и нагревают при перемешивании с получением пасты. Пасту добавляют к перемешанному порошку, и смесь гранулируют. Влажные гранулы пропускают через твердое сито 8 и сушат при 50 С. Смесь смазывают с использованием 1% стеарата магния и прессуют в таблетку. Таблетки вводят пациенту со скоростью от 1 до 4 в сутки для лечения расстройства, опосредованного норэпинефрином и/или опосредованного серотонином. СПОСОБЫ ЛЕЧЕНИЯ РАССТРОЙСТВ, ОПОСРЕДОВАННЫХ НОРЭПИНЕФРИНОМ И/ИЛИ ОПОСРЕДОВАННЫХ СЕРОТОНИНОМ Соединения по настоящему изобретению и фармацевтические композиции, содержащие соединение по настоящему изобретению, могут быть введены для лечения субъекта, страдающего от расстройства,опосредованного норэпинефрином и/или опосредованного серотонином, включая расстройства центральной нервной системы, симптомы которого ослабляются путем ингибирования транспортеров норэпинефрина и/или транспортеров серотонина. Соединения по настоящему изобретению в зависимости от природы заболевания можно применять для лечения расстройств, опосредованных норэпинефрином и/или опосредованных серотонином, в острых и хронических случаях и для профилактики. Типично, хозяин или субъект в каждом из этих способов представляет собой человека, хотя другие млекопитающие также могут получать пользу от введения соединения по настоящему изобретению. В терапевтических применениях соединения по настоящему изобретению могут быть получены и введены в широком множестве лекарственных форм для перорального и парентерального введения. Термин "введение" относится к способу приведения соединения в контакт с субъектом. Таким образом, соединения по настоящему изобретению могут быть введены путем инъекции, т.е. внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально, парентерально или интраперитонеально. Также описанные здесь соединения могут быть введены путем ингаляции, например интраназально. Дополнительно соединения по настоящему изобретению могут быть введены трансдермально, местно и путем имплантации. В некоторых воплощениях соединения по настоящему изобретению доставляют перорально. Соединения также можно доставлять ректально, трансбуккально, интравагинально, в глаза или путем инсуффляции. Соединения, используемые в фармацевтическом способе по изобретению, могут быть введены с исходной дозой, составляющей приблизительно от 0,001 до приблизительно 100 мг/кг в сутки. В некоторых воплощениях диапазон суточных доз составляет приблизительно от 0,1 до приблизительно 10 мг/кг. Тем не менее, дозы могут варьировать в зависимости от потребностей субъекта, тяжести заболевания, которое лечат, и используемого соединения. Определение правильной дозы для конкретной ситуации находится в пределах знаний практикующего специалиста. Как правило, лечение инициируют меньшими дозами, которые меньше оптимальной дозы соединения. После этого дозу увеличивают путем добавления небольших количеств до достижения оптимального эффекта при данных обстоятельствах. Для удобства общая суточная доза, если желательно, может быть разделена и введена порциями в течение суток. Термин "лечение" включает уменьшение при остром, хроническом состоянии или при профилактике или ослабление по меньшей мере одного симптома или характеристики, ассоциирующихся с или вызванных заболеванием, которое лечат. Например, лечение может включать уменьшение нескольких симптомов заболевания, ингибирование патологического прогрессирования заболевания или полную ликвидацию заболевания. Настоящее изобретение также относится к способу лечения расстройства, опосредованного норэпинефрином и/или опосредованного серотонином, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Примеры расстройств, опосредованных норэпинефрином и/или опосредованных серотонином, включают фибромиалгию, единичные эпизодические или периодические большие депрессивные расстройства, дистимические расстройства, депрессивный невроз и невротическую депрессию, меланхолическую депрессию, включающую анорексию, утрату массы организма, инсомнию, ранее пробуждение или психомоторную за- 11012245 держку; атипичную депрессию (или реактивную депрессию), включающую увеличенный аппетит, гиперсомнию, психомоторное возбуждение или раздражимость, сезонное аффективное расстройство и депрессию у детей; биполярные расстройства или маниакальную депрессию, например биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; кондуктивное расстройство; синдром дефицита внимания и гиперактивности (СДВГ); агрессивное поведенческое расстройство; нарушения поведения, ассоциирующиеся с умственной отсталостью, аутистическим расстройством и кондуктивным расстройством; тревожные расстройства, такие как паническое расстройство с агорафобией или без нее, агорафобия без панического расстройства, специфические фобии, например специфические фобии в отношении животных, страх общества, социофобия, обсессивно-компульсивное расстройство, стрессовые расстройства, включающие посттравматическое стрессовое расстройство и острое стрессовое расстройство и расстройства генерализованной тревоги; пограничное расстройство личности; шизофрению и другие психотические расстройства, например шизофрениформные расстройства, шизоаффективные расстройства, бредовые расстройства, кратковременные психотические расстройства, распределенные психотические расстройства, психотические расстройства с бредом или галлюцинациями,психотические эпизоды тревоги, тревогу, ассоциирующуюся с психозом, психотические расстройства настроения, такие как тяжелое большое депрессивное расстройство; расстройства настроения, ассоциирующиеся с психотическими расстройствами, такие как помрачнение сознания (acute mania) и депрессия,ассоциирующаяся с биполярным расстройством; расстройства настроения, ассоциирующиеся с шизофренией; делирий, деменция и амнестические и другие когнитивные или нейродегенеративные расстройства, такие как болезнь Паркинсона (БП), болезнь Гентингтона (БГ), болезнь Альцгеймера, старческая деменция, деменция типа Альцгеймера, расстройства памяти, утрата организующей функции, васкулярная деменция и другие деменции, например, вследствие заболевания вирусом иммунодефицита человека(HIV), травмы головного мозга, болезни Паркинсона, болезни Гентингтона, болезни Пика, болезни Крейтцфельда-Якоба или вследствие множества причин; нарушения движения, такие как акинезии, дискинезии, включающие семейные пароксизмальные дискинезии, спазмы, синдром Туретта, синдром Скотта, параличи (например, паралич Белла, церебральный паралич, родовой паралич, брахиальный паралич,прогрессивную мышечную атрофию, ишемическую атрофию, прогрессирующий бульбарный паралич и другие параличи) и акинетико-ригидный синдром; экстрапирамидные двигательные расстройства, такие как двигательные расстройства, вызванные лекарственной терапией, например паркинсонизм, вызванный нейролептиками, злокачественный нейролептический синдром, острая дистония, вызванная нейролептиками, острая акатизия, вызванная нейролептиками, поздняя дискинезия, вызванная нейролептиками и постуральный тремор, вызванный лекарственной терапией; химические зависимости и пристрастия (например, зависимости от или пристрастия к алкоголю, героину, кокаину, бензодиазепинам, никотину или фенобарбиталу) и поведенческие пристрастия, такие как пристрастие к азартным играм; и глазные расстройства, такие как глаукома и ишемическая ретинопатия. В одном из конкретных воплощений пациентам, страдающим от фибромиалгии, вводят терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли. Пациенты, страдающие от фибромиалгии, как правило демонстрируют историю обширной боли и присутствие боли в 11 из 18 точек пальпации (см., например Wolfe et al. (1990) Arthritis Rheum. 33:160-172). Пациенты, страдающие от фибромиалгии, как правило, проявляют аномалии восприятия боли в форме как аллодинии (боль от безопасной стимуляции), так и гипералгезии (увеличенной чувствительности к болезненной стимуляции). Пациенты, страдающие от фибромиалгии, как правило также проявляют ряд других симптомов,включающих нарушение сна и утомление. Несмотря на то, что множество других симптомов являются менее распространенными по сравнению с болью, утомлением и нарушениями сна, они также могут возникать. Эти симптомы включают головные боли, утренние спазмы, сложность концентрирования, проблему кровообращения, повреждающую небольшие кровеносные сосуды кожи (феномен Рейно) и синдром раздраженного кишечник. Как множество состояний, вызывающих хроническую боль, тревога и депрессия обычны для пациентов, страдающих от фибромиалгии, и могут усиливать симптомы. Симптомы могут иметь тенденцию появляться и проходить. Могут возникать периоды, когда симптомы являются постоянными (обострения), за которыми могут следовать периоды, когда симптомы отсутствуют (ремиссии). Некоторые пациенты, страдающие от фибромиалгии, ощущают, что холод, сырая погода, эмоциональный стресс, перенапряжение и другие факторы усугубляют их симптомы. Более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу,при котором расстройство или состояние, которое лечат, выбрано из общей депрессии, разовой эпизодической депрессии, рецидивов депрессии, депрессии, вызванной жестоким отношением с детьми, послеродовой депрессии, дистимии, циклотимии и биполярного расстройства. Еще одно более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу, при котором расстройство или состояние, которое лечат, выбрано из шизофрении, шизоаффективного расстройства, бредового расстройства, психотического расстройства, вызванного лекарствами,кратковременного психотического расстройства, распределенного психотического расстройства, психотического расстройства в результате общего медицинского состояния и шизофрениформного расстрой- 12012245 ства. Еще одно более конкретное воплощение настоящего изобретения относится к вышеуказанному способу, при котором расстройство или состояние, которое лечат, выбрано из аутизма, общего расстройства психологического развития и синдрома дефицита внимания и гиперактивности. Еще одно более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу, при котором расстройство или состояние, которое лечат, выбрано из генерализированного тревожного расстройства, панического расстройства, обсессивно-компульсивного расстройства, посттравматического стрессового расстройства и фобий, включающих социофобию, агорафобию и специфические фобии. Еще одно более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу, при котором расстройство или состояние, которое лечат, выбрано из нарушений движений, таких как акинезии, дискинезии, включающие семейные пароксизмальные дискинезии, спазмы, синдром Туретта, синдром Скотта, параличи (например, паралич Белла, церебральный паралич, родовой паралич,брахиальный паралич, прогрессивную мышечную атрофию, ишемическую атрофию, прогрессирующий бульбарный паралич и другие параличи) и акинетико-ригидный синдром; и экстрапирамидных двигательных расстройств, таких как двигательные расстройства, вызванные лекарственной терапией, например, паркинсонизм, вызванный нейролептиками, злокачественный нейролептический синдром, острая дистония, вызванная нейролептиками, острая акатизия, вызванная нейролептиками, поздняя дискинезия,вызванная нейролептиками и постуральный тремор, вызванный лекарственной терапией. Еще одно более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу, при котором расстройство или состояние, которое лечат, представляет собой боль. Боль относится к острой, а также хронической боли. Острая боль обычно является короткой и ассоциируется с гиперактивностью симпатической нервной системы. Примеры представляют собой послеоперационную боль и аллодинию. Хроническую боль обычно определяют как боль, продолжающуюся от 3 до 6 месяцев,и включающую соматогенную боль и психогенную боль. Другая боль является ноцицептивной. Примеры типов боли, которую можно лечить с помощью соединений формулы I по настоящему изобретению и их фармацевтически приемлемых солей, включают боль, являющуюся результатом повреждения мягкой ткани и периферической ткани, такую как острая травма, боль, ассоциирующуюся с остеоартритом и ревматоидным артритом, мышечно-скелетная боль, такую как боль, испытываемая после травмы; боль в спине, зубная боль, болевые мышечно-лицевые синдромы, эпизиотомическая боль и боль, являющаяся результатом ожогов; глубокую и висцеральную боль, такую как сердечная боль, мышечная боль, глазная боль, ротолицевая боль, например одонталгия, боль в животе, гинекологическая боль, например дисменорея, родовые схватки и боль, ассоциирующаяся с эндометриозом; боль, ассоциирующуюся с повреждением нервов и корешков, такую как боль, ассоциирующаяся с периферическими нервными расстройствами, например ущемление нерва и разрывы плечевого сплетения, ампутация, периферические невропатии, тригеминальная невралгия, атипичная лицевая боль, повреждение нервных корешков, тригеминальная невралгия, невропатическая боль в нижней части спины, невропатическая боль, связанная с вирусом иммунодефицита человека (HIV), невропатическая боль, связанная с раком,диабетическая невропатическая боль и арахноменингит; невропатическую и неневропатическую боль,ассоциирующуюся с карциномой, часто называемая раковой болью; боль в центральной нервной системе, такую как боль вследствие повреждения спинного мозга или ствола головного мозга; боль в нижней части спины; ишиас; фантомную боль в ампутированной конечности, головную боль, включающую мигрень и другие сосудистые головные боли, острую или хроническую тензионную головную боль, гистаминовую головную боль, височно-нижнечелюстную боль и боль в гайморовой пазухе; боль, возникающую вследствие анкилозирующего спондилоартрита и подагры; боль, вызванную усиленными сокращениями мочевого пузыря; боль после операций; боль в рубце; и хроническую неневропатическую боль,такую как боль, ассоциирующаяся с фибромиалгией, HIV, ревматоидным и остеоартритом, артралгией и миалгией, вывихами, растяжениями и травмами, такими как перелом костей; и боль после хирургического вмешательства. Другая боль вызвана повреждением или инфекцией периферических афферентных нервов. Она включает боль в результате травмы периферических нервов, инфекции вирусом герпеса, сахарного диабета, фибромиалгии, каузалгии, разрыва сплетения, невромы, ампутации конечности и васкулита, но не ограничивается ими. Невропатическая боль также вызвана повреждением нервов в результате хронического алкоголизма, инфекции вирусом иммунодефицита человека, гипотиреозом, уремией, или авитаминозом. Невропатическая боль включает боль, вызванную повреждением нервов, такую как, например боль, от которой страдают диабетики, но не ограничивается ими. Психогенная боль представляет собой боль, которая возникает без органической причины, такую как боль в нижней части спины, атипичная лицевая боль и хроническая головная боль. Другие типы боли представляют собой воспалительную боль, боль при остеоартрите, тригеминальную невралгию, раковую боль, диабетическую невропатию, синдром усталых ног, острую герпетическую невралгию и постгерпетическую невралгию, каузалгию, разрыв плечевого сплетения, затылочную невралгию, подагру, фантомную конечность, ожог и другие формы невралгии, невропатический и идиопа- 13012245 тический болевой синдром. Еще одно более конкретное воплощение настоящего изобретения относится к вышеупомянутому способу, при котором расстройство или состояние, которое лечат, выбрано из делирия, деменции и амнестических и других когнитивных или нейродегенеративных расстройств, таких как болезнь Паркинсона(БП), болезнь Гентингтона (БГ), болезнь Альцгеймера, старческая деменция, деменция типа Альцгеймера, расстройства памяти, утрата организующей функции, васкулярная деменция и другие деменции, например вследствие HIV-заболевания, травмы головного мозга, болезни Паркинсона, болезни Гентингтона, болезни Пика, болезни Крейтцфельда-Якоба или вследствие множества причин. Соединения по настоящему изобретению могут быть совместно введены субъекту. Термин "совместное введение" обозначает введение двух или более чем двух различных фармацевтических агентов или применение различных способов лечения (например, радиационное лечение), которые вводят субъекту путем комбинации в одной фармацевтической композиции или различными фармацевтическими композициями. Таким образом, совместное введение включает одновременное введение единичной фармацевтической композиции, включающей два или более чем два фармацевтических агента, или введение одному субъекту одновременно или в различные моменты времени двух или более чем двух или различных композиций. Например, субъекту, которому вводится первая доза, включающая соединение по настоящему изобретению в 8 часов утра, а затем через 1-12 ч, например в 6 часов вечера того же дня, вводится второй терапевтический агент, совместно вводится соединение по настоящему изобретению и второй терапевтический агент. Альтернативно, например, субъекту, которому может вводиться разовая доза,включающая соединение по настоящему изобретению и второй терапевтический агент в 8 часов утра,могли совместно вводить соединение по настоящему изобретению и второй терапевтический агент. Кроме того, соединения по настоящему изобретению могут быть введены для лечения фибромиалгии совместно с одним или более чем одним агентом, полезным для лечения одного или более чем одного признака фибромиалгии, выбранным из группы, состоящей из: нестероидных противовоспалительных средств (далее НСПВС), например пироксикама, локсопрофена, диклофенака, пропионовых кислот, таких как напроксен, флурбипрофен, фенопрофен, кетопрофен и ибупрофен, кеторолака, нимезулида, ацетаминофена, фенаматов, таких как мефенамовая кислота, индометацина, сулиндака, апазона, пиразолонов, таких как фенилбутазон, салицилатов, таких как аспирин, ингибиторов циклоокигеназы СОХ-2, таких как CELEBREX (целекоксиб), BEXTRA (вальдекоксиб) и эторикоксиб; стероидов, кортизона,преднизона, мышечных релаксантов, в том числе циклобензаприна и тизанидина; гидрокодона, декстропропоксифена, лидокаина, опиоидов, морфина, фентанила, трамадола, кодеина, Пароксетина (PAXIL),Диазепама, Фемоксетина, Карбамазепина, Милнаципрана (IXEL), Vestra, Венлафаксина(Veldona), Циклобензаприна, СРЕ-215, Оксбата калия (XYREM), Celexa (циталопрам HBr),ZOLOFT (сертралин HCl), антидепрессантов, трициклических антидепрессантов, Амитриптилина,Флуоксетина (PROZAC), Топирамата, Эсциталопрама, бензодиазепенов, в том числе диазепама, бромазепана и тетразепама, миансерина, кломипрамина, имипрамина, топирамата и нортриптилина. Соединение по настоящему изобретению также может быть введено совместно с альфа-2-дельта лигандами. Примеры аиьфа-2-дельта лигандов для применения по настоящему изобретению представляют собой соединения, в общем или конкретно раскрытые в патенте США 4024175, в частности габапентин(NEURONTIN), EP641330, в частности прегабалин (LYRICA), патенте США 5563175, WO9733858,WO9733859, WO9931057, WO9931074, WO9729101, WO02085839, в частности [(1R,5R,6S)-6(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту,WO9931075,в частности 3-(1 и С-[1-(1 Н-тетразол-5-илметил)циклоаминометилциклогексилметил)-4 Н-[1,2,4]оксадиазол-5-он гептил]метиламин, WO9921824, в частности (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусную кислоту, WO0190052, WO0128978, в частности (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3 ил)уксусную кислоту, ЕР 0641330, WO9817627, WO0076958, в частности (3S,5R)-3-аминометил-5 метилоктановую кислоту, PCT/IB03/00976, в частности (3S,5R)-3-амино-5-метилгептановую кислоту,(3S,5R)-3-амино-5-метилнонановую кислоту и (3S,5R)-3-амино-5-метилоктановую кислоту, ЕР 1178034,ЕР 1201240, WO9931074, WO03000642, WO0222568, WO0230871, WO0230881, WO02100392,WO02100347, WO0242414, WO0232736 и WO0228881, и их фармацевтически приемлемые соли и сольваты, все из которых включены здесь путем ссылки. Для лечения депрессии, тревоги, шизофрении или любого из других расстройств и состояний, указанных выше при описании способов и фармацевтических композиций по настоящему изобретению, соединения по настоящему изобретению могут быть использованы в сочетании с одним или более другими антидепрессантами или противотревожными средствами. Примеры классов антидепрессантов, которые могут быть использованы в комбинации с активными соединениями по настоящему изобретению, включают ингибиторы обратного захвата норэпинефрина, селективные ингибиторы обратного захвата серотонина (SRI), антагонисты рецептора NK-1, ингибиторы моноаминоксидазы (MAOI), обратимые ингибиторы моноаминоксидазы (RIMA), ингибиторы обратного захвата серотонина и норадреналина (SNRI),антагонисты кортикотропин-высвобождающего фактора (CRF), антагонисты -адренорецептора, альфа- 14012245 2-дельта лигандыLYRICA,[(1R,5R,6S)-6(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту,3-(1-аминометил-циклогексилметил)-4 Н[1,2,4]оксадиазол-5-он и С-[1-(1 Н-тетразол-5-илметил)циклогептил] метиламин, (3S,4S)-(1-аминометил 3,4-диметилциклопентил)-уксусную кислоту,(1,3,5)(3-аминометилбицикло[3.2.0]гепт-3 ил)уксусную кислоту,(3S,5R)-3-аминометил-5-метилоктановую кислоту,(3S,5R)-3-амино-5 метилгептановую кислоту, (3S,5R)-3-амино-5-метилнонановую кислоту и (3S,5R)-3-амино-5 метилоктановую кислоту и так далее и нетипичные антидепрессанты. Подходящие ингибиторы обратного захвата норэпинефрина включают трициклические третичные амины и трициклические вторичные амины. Подходящие трициклические третичные амины и трициклические вторичные амины включают амитриптилин, кломипрамин, доксепин, имипрамин, тримипрамин, дотиепин, бутрипилин, иприндол,лофепрамин, нортриптилин, протриптилин, амоксапин, дезипрамин и мапротилин. Подходящие селективные ингибиторы обратного захвата серотонина включают флуоксетин, флувоксамин, пароксетин, циталопрам и сертралин. Примеры ингибиторов моноаминоксидазы включают изокарбоксазид, фенелзин и транилциклопрамин. Подходящие обратимые ингибиторы моноаминоксидазы включают моклобемид. Подходящие ингибиторы обратного захвата серотонина и норадреналина для применения по настоящему изобретению включают венлафаксин и дулоксетин. Подходящие антагонисты CRF включают соединения, описанные в международных заявках на патенты WO 94/13643, WO 94/13644, WO 94/13661, WO 94/13676 и WO 94/13677. Подходящие нетипичные антидепрессанты включают бупропион, литий, нефазодон, тразодон и вилоксазин. Подходящие антагонисты рецептора NK-1 включают антагонисты, упомянутые в публикации международного патента WO 01/77100. Подходящие лиганды A2D включают лиганды, упомянутые в публикациях международных патентов WO 99/21824, WO 01/90052, WO 01/28978, WO 98/17627, WO 00/76958 и WO 03/082807, и в особенности NEURONTIN И LYRICA. Подходящие классы противотревожных средств, которые могут быть использованы в комбинации с активными соединениями по настоящему изобретению, включают бензодиазепины и агонисты или антагонисты серотонина IA (5-HTIA), В особенности частичные агонисты 5-HTIA, и антагонисты кортикотропин-высвобождающего фактора (CRF). Подходящие бензодиазепины включают альпразолам, хлордиазепоксид, клоназепам, хлоразепат, диазепам, галазепам, лоразепам, оксазепам и празепам. Подходящие агонисты или антагонисты рецептора 5-HTIA включают буспирон, флезиноксан, гепирон и ипсапирон. Подходящие антипсихотические средства включают в себя как обычные, так и нетипичные антипсихотические средства. Обычные антипсихотические средства представляют собой антагонисты допаминовых (D2) рецепторов. Нетипичные антипсихотические средства также обладают антагонистическими свойствами в отношении D2, но отличаются кинетикой связывания с этими рецепторами и активностью в отношении других рецепторов, в частности 5-НТ 2 А, 5-НТ 2 С И 5-HT2D (Schmidt В et al, Soc. Neurosci. Abstr. 24: 2177,1998). Класс нетипичных антипсихотических средств включает клозапин (CLOZARIL), 8-хлор-11-(4 метил-1-пиперазинил)-5 Н-дибензо[b,е] [1,4]диазепин (патент США 3539573); рисперидон (RISPERDAL),3-[2-[4-(6-фтор-1,2-бензизоксазол-3-ил)пиперидино]этил]-2-метил-6,7,8,9-тетрагидро-4 Нпиридо-[1,2-а]пиримидин-4-он (патент США 4804663); оланзапин (ZYPREXA), 2-метил-4-(4-метил 1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепин (патент США 5229382); кветиапин (SEROQUEL), 5-[2-(4-дибензо[b,f][1,4]тиазепин-11-ил-1-пиперазинил)этокси]этанол (патент США 4879288); арипипразол(патенты США 4734416 и 5006528); сертиндол, 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол-3-ил]-1 пиперидин]этил]имидазолидин-2-он (патент США 4710500); амисульприд (патент США 4410822); и зипразидон (GEODON), 5-[2-[4-(1,2-бензизотиазол-3-ил)пиперазин-3-ил]этил]-6-хлориндолин-2-она гидрохлорида гидрат (патент США 4831031). ПРИМЕРЫ Пример 1. Гидрохлорид 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1H-индазола. К суспензии гидрохлорида 2-фторфенилгидразина (40,1 г, 246,7 ммоль) в 411 мл EtOH добавляли диизопропилэтиламин (47,27 мл, 271,4 ммоль), а затем твердый изатоевый ангидрид (40,0 г, 246,7 ммоль). Суспензию нагревали до образования флегмы. При кипячении с обратным холодильником все твердые вещества переходили в раствор, и кипячение с обратным холодильником продолжали в течение 1,5 ч. Реакционной смеси давали возможность охлаждаться до комнатной температуры и оставляли на ночь. Выпавшее в осадок твердое вещество отфильтровывали и промывали EtOH (этанолом). Фильтрат концентрировали до сухого состояния и оставшийся материал переносили в EtOAc (этилацетат), промывали водой и сушили над Na2SO4. EtOAc раствор концентрировали и оставшееся масло переносили в минимальное количество эфира. Затем эфирный раствор растирали с гептаном. Выделенное твердое вещество объединяли с указанным выше с получением 34,89 г гидразида. Гидразид суспендировали в 307 мл 1 М раствора HCl. Суспензию охлаждали до 0 С и добавляли нитрит натрия (19,62 г, 284,4 ммоль) в 100- 15012245 мл воды. Далее добавляли 582 мл EtOH и суспензию кипятили с обратным холодильником в течение 2 часов, затем оставляли при комнатной температуре на ночь. Получающуюся в результате суспензию фильтровали и промывали EtOH. Фильтрат концентрировали с получением большего количества твердого вещества. После объединения с первой партией твердого вещества материал перекристаллизовывали из смеси EtOH:i-PrOH (изопропиловый спирт) (95:5) с получением 23,45 г 1-(2-фторфенил)-1 Н-индазол 3-ола (промежуточного соединения 1). Масс-спектр (МС) (химическая ионизация при атмосферном давлении (ХИАД: 229 (М+1, 100%). К раствору трет-бутил-4-гидрокси-1-пиперидинкарбоксилата (0,94 г, 4,66 ммоль) и метансульфонилхлорида (0,43 мл, 5,56 ммоль) в 10 мл безводного CH2Cl2 при 0 С добавляли триэтиламин (0,71 мл,5,09 ммоль). Бесцветный раствор превращался в белую суспензию. Реакционную смесь перемешивали при 0 С в течение 2 ч. К белой суспензии добавляли эфир (50 мл) и осадки удаляли фильтрованием. Остаток два раза промывали 10 мл эфира. Объединенный фильтрат и промывные воды концентрировали на роторном испарителе. Оставшееся масло подвергали хроматографии на силикагеле с 50% EtOAc в гексанах с получением 1,06 г промежуточного соединения 2 (трет-бутилового эфира 4-метансульфонилоксипиперидин-1-карбоновой кислоты) в виде белого твердого вещества. МС (ХИАД): 224 (100%), 180(32%). Смесь промежуточного соединения 1 (0,41 г, 1,80 ммоль), промежуточного соединения 2 (0,53 г,1,90 ммоль) и гидрида натрия (60%-ная дисперсия в минеральном масле, 0,099 г, 2,48 ммоль) в 13 мл безводного ДМФ (диметилформамида) перемешивали при 100 С в течение 7 ч. После охлаждения до комнатной температуры для гашения реакционной смеси добавляли насыщенный раствор NH4Cl (40 мл) и воду (15 мл). Смесь три раза экстрагировали 50 мл эфира. Объединенные экстракты сушили над MgSO4 и затем концентрировали на роторном испарителе. Оставшееся масло подвергали хроматографии на силикагеле с 20% EtOAc в гексанах с получением 0,52 г промежуточного соединения 3 (трет-бутилового эфира 4-[1-(2-фторфенил)-1 Н-индазол-3-илокси]пиперидин-1-карбоновой кислоты) в виде бледно-желтого масла. МС (ХИАД): 412 (М+1, 62%), 356 (46%), 312(100%). К раствору промежуточного соединения 3 (0,52 г, 1,26 ммоль) в 4 мл EtAc при комнатной температуре добавляли 4 мл 4 М раствора HCl в диоксане. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали на роторном испарителе. Для растворения маслянистого остатка добавляли EtOAc (30 мл). Раствор снова концентрировали на роторном испарителе для удаления последних следов диоксана. Добавляли метанол (3 мл) для повторного растворения маслянистого остатка. К раствору медленно добавляли эфир (30 мл). Мутный раствор концентрировали на роторном испарителе с получением твердого материала. Твердое вещество растирали с 5 мл смесиEtOAc в эфире (1:1) в течение 15 мин. Добавляли дополнительные 20 мл эфира и фильтрованием собирали осадки. После двукратной промывки 5 мл эфира твердое вещество сушили при 95 С в вакууме в течение ночи с получением 0,36 г указанного в заголовке продукта в виде белого порошка. Пример 2. Малеат (S)-(+)-1-(2-фторфенил)-3-(морфолин-2-илметокси)-1H-индазола.(S)-3-Гидроксиметилморфолин получали в соответствии с методикой, описанной в J. Med. Chem. 1998, 41, 1934-1942. Промежуточное соединение 5 (трет-бутиловый эфир (S)-2-гидроксиметилморфолин 4-карбоновой кислоты) получали в стандартных условиях (NaOH, ди-трети-бутилдикарбонат, Н 2 О/ТГФ,0 С). Температура плавления (т.пл.)=67-68 С. Промежуточное соединение 6 (трет-бутиловый эфир 2-метансульфонилокси-метилморфолин-4 карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединение 2 с использованием промежуточного соединения 5 в качестве исходного вещества. []D24 =+18,4 (CHCl3, с=8,9), МС (ХИАД): 240 (95%), 196 (100%). Промежуточное соединение 7 (трет-бутиловый эфир (S)-2-[1-(2-фторфенил)-1 Н-индазол-3 илоксиметил]морфолин-4-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 6 в качестве исходного вещества и перемешивали при 100 С в течение 3,5 ч. []D24 = +16,0 (CHCl3, с=5,0), МС (ХИАД): 410 (М+Н, 80%), 310(100%). К раствору промежуточного соединения 7 (0,86 г, 2,00 ммоль) в 6 мл EtOAc добавляли 6 мл 4 М раствора HCl в диоксане при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Реакционную смесь концентрировали на роторном испарителе. Остаток загружали в колонку Varian Mega Bond Elut SCX, предварительно промытую 5% HOAc в МеОН. Колонку четыре раза промывали 50 мл МеОН для удаления HCl. Амин элюировали 1 н. раствором NH3 в МеОН(340 мл) с получением 0,52 г свободного основания в виде бесцветного масла. Затем масло растворяли в 75 мл эфира. К раствору амина при комнатной температуре медленно добавляли раствор малеиновой кислоты (0,187 г, 1,61 ммоль) в 2 мл МеОН. Образовывался белый осадок, и суспензию перемешивали при комнатной температуре в течение 10 мин. Белое твердое вещество собирали путем фильтрования,два раза промывали 10 мл эфира и затем сушили в вакууме в течение ночи при 100 С с получением 0,661 г указанного в заголовке продукта в виде белого порошка. Пример 3. Малеат (S)-(+)-1-(2,4-дифторфенил)-3-(морфолин-2-илметокси)-1H-индазола.- 16012245 К суспензии гидрохлорида 2,4-дифторфенилгидразина (15,2 г) в 140 мл EtOH при комнатной температуре добавляли 15,64 мл диизопропилэтиламина. Смесь перемешивали в течение 20 мин до тех пор,пока почти весь материал не оказывался в растворе, затем добавляли изатоевый ангидрид (14,0 г). Смесь нагревали до температуры образования флегмы, получая раствор. Через 1,5 ч реакционную смесь охлаждали до комнатной температуры и оставляли на ночь. Выпавшее в осадок твердое вещество отфильтровывали, промывали EtOH и сушили с получением 9,36 г (выход 44%) N'-(2,4-дифторфенил)гидразида 2 аминобензойной кислоты (промежуточного соединения 17). МС (ХИАД): (М+1)=264, (М-1)=262. Промежуточное соединение 17 (9,80 г, 37,3 ммоль) перемешивали в 82 мл 1 М HCl (водн.), охлаждали до 0 С и осторожно, через пипетку, добавляли раствор нитрита натрия (5,1 г, 74 ммоль) в 18 мл воды. Образовывалась густая суспензия. Добавляли 106 мл EtOH и реакционную смесь нагревали до образования флегмы. Образовывалась густая пена, которую не перемешивали. Реакционную смесь охлаждали до комнатной температуры, разбавляли 100 мл смеси EtOH:H2O (1:1), возобновляли хорошее перемешивание и смесь нагревали до образования флегмы в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры в течение ночи, осадок отфильтровывали, промывали Н 2 О и сушили в воронке Бюхнера с получением 7,55 г пластичного окрашенного твердого вещества, 1-(2,4-дифторфенил)-1 Н-индазол-3 ола (промежуточного соединения 18), в качестве продукта. МС (ХИАД): (М+1)=247. Промежуточное соединение 19 трет-бутиловый эфир 2-[1-(2,4-дифторфенил)-1 Н-индазол-3 илоксиметил]морфолин-4-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 6 и промежуточного соединения 18 в качестве исходных веществ и перемешивали при 100 С в течение 3 ч. []D24 =+19,4 (CHCl3, с=5,4), МС (ХИАД): 446 (М+Н, 100%), 346 (90%). Указанный в заголовке продукт получали из промежуточного соединения 19 в соответствии с описанной выше методикой получения примера 2. Примеры 4-13 синтезировали способом, аналогичным описанному для примера 1. Пример 14. Гидрохлорид (R)-1-фенил-3-(пирролидин-3-илметокси)-1 Н-индазола. К суспензии изатоевого ангидрида (50,0 г, 308,3 ммоль) в 514 мл EtOH добавляли фенилгидразин(30,33 мл, 308,3 ммоль) и суспензию нагревали до образования флегмы. При кипячении с обратным холодильником все твердое вещество переходило в раствор. Кипячение с обратным холодильником продолжали в течение 1,5 ч. Реакционному раствору давали возможность охлаждаться до комнатной температуры и оставляли на ночь. Выпавшее в осадок твердое вещество отфильтровывали и промывали EtOH с получением 46,55 г (выход 66%) белого твердого вещества в качестве желаемого гидразида. Гидразид(46,55 г, 204,8 ммоль) суспендировали в 442,3 мл 1 М раствора HCl. Суспензию охлаждали до 0 С и добавляли нитрит натрия (28,26 г, 409,6 ммоль) в 100 мл воды. Добавляли следующие 582 мл EtOH и суспензию нагревали до образования флегмы в течение 2 ч, затем охлаждали до комнатной температуры и давали возможность стоять в течение ночи. Получающуюся в результате суспензию фильтровали с получением 15 г желтого твердого вещества. Объем фильтрата уменьшали и выделяли дополнительное количество твердого вещества. Твердые вещества объединяли и перекристаллизовывали из смеси EtOH:iPrOH(95:5) с получением 26,50 г (61%) светло-желтого твердого вещества в качестве промежуточного соединения 28 (1-фенил-1 Н-индазол-3-ола): т.пл.=209-211oC. Промежуточное соединение 29(R)-3-(1-фенил-1 Н-индазол-3 илоксиметил)пирролидин-1-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 28 (0,250 г,1,19 ммоль) и трет-бутилового эфира (R)-3-метансульфонилоксиметилпирролидин-1-карбоновой кислоты (0,370 г, 1,30 ммоль, полученного в соответствии с J. Med. Chem. 1999, 42, 677) в качестве исходных веществ и 1,70 ммоль 95% NaH, нагревания при 100 С в течение 18 ч, затем добавления 1,70 ммоль 60%NaH и нагревания при 100 С в течение 20 ч. Оставшееся масло подвергали хроматографии на силикагеле с 10% ацетона в гексанах с получением 0,275 г Промежуточного соединения 29 в виде прозрачного масла. МС(М+1)=394, 294 (М-ВОС). Промежуточное соединение 29 (0,275 г, 0,699 ммоль) растворяли в 2,3 мл EtOAc и добавляли 2,3 млHCl (4 М в диоксане) при комнатной температуре. После перемешивания в течение ночи растворитель выпаривали. Остаток растирали приблизительно с 30 мл EtOAc и затем концентрировали. Эту процедуру повторяли для удаления всего диоксана и HCl. Получающееся в результате белое твердое вещество растирали приблизительно с 20 мл смеси EtOAc:эфир (1:2), фильтровали, два раза промывали 5 мл эфира и сушили в вакуумном сушильном шкафу при 60 С в течение ночи с получением указанного в заголовке продукта в виде светло-желто-коричневого порошка (0,192 г, выход 83%): Примеры 15-26 синтезировали способом, аналогичным описанному для примера 14. Пример 27. Гидрохлорид 1-(2,5-дифторфенил)-3-(пиперидин-4-илокси)-1H-индазола. Промежуточное соединение 33 (1-(2,5-дифторфенил)-1 Н-индазол-3-ол) получали в соответствии с методикой, упомянутой выше, для получения промежуточного соединения 28 с использованием 2,5 дифторфенилгидразина (15,1 г, 105 ммоль) и изатоевого ангидрида (17,0 г, 101 ммоль) в качестве исходных веществ и кипячения реакционной смеси с обратным холодильником в течение 3,5 ч. Гидразид выделяли в виде твердого вещества светло-песочного цвета (15,6 г, выход 59%). МС (ХИАД): (М+1)=264,- 17012245(М-1)=262. В соответствии с той же самой методикой гидразид (15,6 г, 59,3 ммоль) превращали в промежуточное соединение 33 (12,89 г, выход 88%) в виде пластичного окрашенного твердого вещества. МС(ХИАД): (М+1)=247, (М-1)=245. К раствору промежуточного соединения 33 (0,300 г, 1,22 ммоль) в 12 мл ДМФ добавляли 0,600 г(1,80 ммоль) карбоната цезия, а затем промежуточное соединение 2 (0,370 г, 1,30 ммоль). Смесь нагревали до 80 С в течение 24 ч, а затем охлаждали до комнатной температуры. Реакционную смесь гасили насыщенным NH4Cl и некоторым дополнительным количеством Н 2 О, затем 3 раза экстрагировали Et2O. Экстракты один раз промывали Н 2 О, затем один раз рассолом, сушили над MgSO4 и концентрировали с получением 0,515 г желтого масла. Продукт очищали флэш-хроматографией (5-10% EtOAc/гексаны, 90 г диоксида кремния) с выделением промежуточного соединения 34 (трет-бутилового эфира 4-[1-(2,5 дифторфенил)-1 Н-индазол-3-илокси]пиперидин-1-карбоновой кислоты) в виде желтого масла (0,340 г,выход 65%). МС (М+1)=430 (минорный), 330 (М-ВОС). Промежуточное соединение 34 (0,334 г, 0,778 ммоль) обрабатывали HCl в смеси диоксан/EtOAc в соответствии с методикой для промежуточного соединения 30 с перемешиванием при комнатной температуре в течение 3,5 ч. После обычной обработки твердое вещество растирали с 20 мл смеси EtOAc:эфир(1:1), фильтровали, два раза промывали 5 мл эфира и сушили в вакуумном сушильном шкафу при 60 С с получением указанного в заголовке продукта в виде белого порошка (0,240 г, выход 84%). МС (ХИАД):(М+1)=330. Примеры 28-40 синтезировали способом, аналогичным описанному для примера 27. Пример 41. Гидрохлорид 1-(4-хлорфенил)-3-(пиперидин-4-илокси)-1H-индазола. Гидрохлорид 4-хлорфенилгидразина (2,105 г, 14,76 ммоль) суспендировали в EtOH (25 мл), обрабатывали диизопропилэтиламином (2,253 мл, 12,93 ммоль) и перемешивали в течение 30 мин. Добавляли изатоевый ангидрид (1,918 г , 11,76 ммоль) и смесь нагревали до образования флегмы в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Материал концентрировали до сухого состояния, и получающийся в результате остаток распределяли между EtOAc(приблизительно 25 мл) и 50%-ным насыщенным NaCl (330 мл). Органический слой (также содержащий небольшое количество эмульсии, которая не разрушилась бы за 3 экстракции) сушили над MgSO4 и концентрировали до оранжевого твердого вещества. Материал растирали с EtOAc, фильтровали и промывали дополнительным количеством EtOAc. Фильтрат концентрировали до сухого состояния и обрабатывали ДХМ (дихлорметаном). Смесь перемешивали в течение ночи. Смесь фильтровали, промывали ДХМ и твердое вещество сушили с получением 1,538 г (50%) N'-(4-хлорфенил)гидразида 2 аминобензойной кислоты (промежуточного соединения 40) в виде розовато-лилового твердого вещества. МС (ХИАД): (М+1)=262,1, (М-1)=260,0. Промежуточное соединение 40 (1,538 г, 5,877 ммоль) суспендировали в 1 М HCl (12 мл), охлаждали до 0 С и по каплям обрабатывали раствором нитрита натрия (811 мг, 11,75 ммоль) в воде (5 мл). Смесь перемешивали в течение 10 мин при 0 С, разбавляли смесью EtOH/H2O (1:1, 25 мл), нагревали до образования флегмы в течение 3 ч, затем охлаждали до комнатной температуры и перемешивали в течение приблизительно 1 ч. Смесь фильтровали и промывали водой. Выделенное твердое вещество растирали сEt2O и EtOAc, а затем с 1 н. NaOH. Оставалось большое количество нерастворенного твердого вещества. Смесь выливали в делительную воронку и давали ей возможность разделяться. Все твердое вещество распределялось в органическом слое, поэтому водный слой сливали (обозначенный, как водный слой 1). Затем органический слой обрабатывали дополнительным количеством 1 н. NaOH. Твердое вещество распределялось в водном слое, и его тоже сливали (с твердым веществом; обозначенный, как водный слой 2). Оба водных слоя обрабатывали концентрированной HCl до приблизительно нейтральной среды. Водный слой 1 приводил к получению твердого вещества хорошего качества, которое отфильтровывали,промывали водой и сушили. Твердое вещество сушили в вакуумном сушильном шкафу при 50 С в течение 2 суток с получением 141 мг (9,8%) 1-(4-хлорфенил)-1 Н-индазол-3-ола (промежуточного соединения 41) в виде желто-коричневого твердого вещества. Водный слой 2, однако, приводил к образованию крупных агрегатов похожих на эмульсию твердых частиц. Этому материалу давали возможность стоять при комнатной температуре в течение 2 суток, затем интенсивно перемешивали до разрушения всех агрегатов. Затем добавляли этилацетат, смесь делали щелочной с использованием 1 н. NaOH, и твердое вещество отфильтровывали и промывали EtAc. Твердое вещество сушили в вакуумном сушильном шкафу при 50 С в течение 3 суток с получением 522 мг (36%) промежуточного соединения 41 в виде белого твердого вещества. МС (ХИАД): (М+1)=245,1, (М-1)=243,0. Промежуточное соединение 41 (300 мг, 1,226 ммоль) объединяли с сухим ДМФ (10 мл), обрабатывали смолой PS-BEMP (2-трет-бутилимино-2-диэтиламино-1,3-диметил-пергидро-1,3,2-диазафосфорином на полистироле) (1,115 г) и перемешивали в течение 30 мин. Медленно, по каплям добавляли раствор промежуточного соединения 2 (377 мг, 1,349 ммоль) в сухом ДМФ (5 мл) и смесь нагревали до 70 С в течение ночи. Смесь фильтровали для удаления смолы и смолу промывали горячим ДМФ. Фильтрат концентрировали в вакууме. Неочищенный материал подвергали хроматографии на 20 г силикагеля,элюируя смесью 8% EtOAc/гексаны. Подходящие фракции объединяли и концентрировали с получением 212 мг (40%) трет-бутилового эфира 4-[ 1-(4-хлорфенил)-1 Н-индазол-3-илокси]пиперидин-1-карбоновойHCl в диоксане (1,61 мл, 6,44 ммоль) и перемешивали в течение ночи при комнатной температуре. Смесь концентрировали в вакууме, обрабатывали EtOAc и снова концентрировали. Этот процесс повторяли 5 раз. Получающееся в результате белое твердое вещество растирали с Et2O, фильтровали, промывали Et2O и сушили в вакуумном сушильном шкафу при 50 С с получением 155 мг (86%) указанного в заголовке продукта - гидрохлорида 1-(4-хлорфенил)-3-(пиперидин-4-илокси)-1 Н-индазола в виде белого твердого вещества. Примеры 42-43 синтезировали способом, аналогичным описанному для примера 41, за исключением того, что диизопропилэтиламин заменяли триэтиламином, а этанол заменяли тетрагидрофураном(ТГФ). Пример 44. Малеат (S)-(-)-3-(пиперидин-3-илметокси)-1-пиридин-2-ил-1H-индазола. Смесь изатоевого ангидрида (3,51 г, 2,15 ммоль) и 2-гидразинопиридина (2,40 г, 2,20 ммоль) в 35 млEtOH кипятили с обратным холодильником в течение 17 ч. После кипячения с обратным холодильником в течение 15 мин суспензия превращалась в коричневый раствор, и наблюдалось выделение газа. К концу 17-часового периода времени реакционную смесь охлаждали до комнатной температуры и коричневый раствор концентрировали на роторном испарителе. Остаток подвергали хроматографии на силикагеле с 65% EtOAc в гексанах. Фракции, содержащие продукт, собирали и концентрировали. Твердое вещество растирали с эфиром (100 мл) в течение 15 мин и собирали фильтрованием. Его сушили на воздухе с получением 2,68 г N'-пиридин-2-илгидразида 2-аминобензойной кислоты (промежуточное соединение 9) в виде белого твердого вещества. МС (ХИАД): 229 (М+1, 100%). К раствору промежуточного соединения 9 (1,38 г, 6,04 ммоль) в 21 мл 1 М раствора HCl при 0 С добавляли раствор нитрита натрия (0,90 г, 1,31 ммоль) в 5 мл воды. При добавлении раствора нитрита натрия получали белый осадок. Затем добавляли EtOH (30 мл) и смесь кипятили с обратным холодильником в течение 2 ч. При кипячении с обратным холодильником белая суспензия превращалась в желтый раствор. Через 2 ч смесь охлаждали до комнатной температуры. Оранжевый раствор превращался в оранжевую суспензию. Смесь концентрировали на роторном испарителе. Твердый остаток растворяли в смеси EtOAc (70 мл), ТГФ (30 мл), насыщенного раствора NaHCO3 (80 мл) и воды (40 мл). Смесь перемешивали при комнатной температуре в течение 15 мин. Органический слой собирали и водный слой два раза экстрагировали 70 мл EtOAc. Объединенные органические слои сушили над MgSO4 и концентрировали с получением 1,05 г 1-пиридин-2-ил-1 Н-индазол-3-ола (промежуточное соединение 10) в виде бледно-желтого твердого вещества. МС (ХИАД): 212 (М+1, 100%). Промежуточное соединение 11 (трет-бутиловый эфир (S)-3-метансульфонилоксиметилпиперидин 1-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 2 с использованием (S)-3-гидроксиметил-1-N-Вос-пиперидина (Astatech) в качестве исходного вещества. (Boc представляет собой трет-бутилоксикарбонил). []D24 = +18,8 (CHCl3, с=4,9), МС(ХИАД): 238 (100%), 194 (73%). Промежуточное соединение 12 (трет-бутиловый эфир (S)-3-(1-пиридин-2-ил-1 Н-индазол-3 илоксиметил)пиперидин-1-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 11 и промежуточного соединения 10 в качестве исходных веществ и перемешивали при 100 С в течение 1,5 ч. []D24 =+21,8 (CHCl3, с=5.5), МС (ХИАД): 409 (М+Н, 100%), 309 (100%). Указанный в заголовке продукт получали из промежуточного соединения 12 в соответствии с описанной выше методикой получения примера 2. Пример 45. Малеат (S)-(-)-5-фтор-1-(2-фторфенил)-3-(пиперидин-3-илметокси)-1 Н-индазола. К раствору 2-амино-5-фторбензойной кислоты (15,34 г, 98,86 ммоль) и карбоната натрия (10,66 г,100,6 ммоль) в 260 мл воды при комнатной температуре медленно при интенсивном перемешивании добавляли 1,93 М раствор фосгена в толуоле (63 мл, 121,6 ммоль). Во время добавления образовывался желтый осадок. После прекращения добавления фосгена смесь перемешивали при комнатной температуре в течение 30 мин. Осадок собирали фильтрованием и четыре раза промывали 100 мл воды. Твердое вещество сушили на воздухе в течение 30 мин, затем промывали смесью эфира в гексанах (1:1, 340 мл). Твердое вещество снова сушили на воздухе с получением 17,36 г промежуточного соединения 21 (6 фтор-1 Н-бензо[d][1,3]оксазин-2,4-диона) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6 млн-1 7.16 (dd, J=8.78, 3.90 Гц, 1 Н) 7.62 (dd, J=8.66, 3.29 Гц, 1 Н) 7.66 (m, 1 Н), 11.75 (s, 1H). Смесь промежуточного соединения 21 (8,42 г, 46,48 ммоль) и 2-фторфенилгидразина (6,00 г, 47,57 ммоль) в 100 мл безводного ТГФ кипятили с обратным холодильником в течение 4 ч. Реакционная смесь постепенно превращалась из желтой суспензии в оранжевый раствор. К концу четырехчасового периода времени реакционную смесь охлаждали до комнатной температуры и концентрировали на роторном испарителе. Остаток растирали со смесью эфира в гексанах (1:1, 215 мл) в течение 15 мин и фильтрованием собирали твердое вещество. Его сушили на воздухе с получением 7,62 г промежуточного соединения 22 (N'-(2-фторфенил)гидразида 2-амино-5-фторбензойной кислоты) в виде белого твердого вещества. МС(ХИАД): 264 (М+1, 100%). К суспензии промежуточного соединения 22 (7,61 г, 28,92 ммоль) в 65 мл 1 М раствора HCl при 0 С добавляли раствор нитрита натрия (4,20 г, 60,93 ммоль) в 17 мл воды. Затем добавляли EtOH (95 мл) и суспензию кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали на роторном испарителе. Для растворения твердого материала добавляли насыщенный раствор NaCl (40 мл), воду (30 мл), EtOAc (150 мл) и ТГФ (100 мл). Органический слой собирали, и водный слой экстрагировали EtOAc (100 мл). Объединенные органические слои сушили над MgSO4 и затем концентрировали на роторном испарителе. Остаток растирали с эфиром(40 мл) и фильтрованием собирали твердое вещество. Твердое вещество снова промывали смесью эфира в гексанах (1:1, 210 мл) и сушили на воздухе с получением 5,66 г промежуточного соединения 23 (5 фтор-1-(2-фторфенил)-1 Н-индазол-3-ола) в виде не совсем белого порошка. МС (ХИАД): 247 (М+1,100%), 248 (27%). Промежуточное соединение 24 (трет-бутиловый эфир (S)-3-[5-фтор-1-(2-фторфенил)-1 Н-индазол-3 илоксиметил]пиперидин-1-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 11 и промежуточного соединения 23 в качестве исходных веществ и перемешивали при 100 С в течение 4 ч. Указанный в заголовке продукт получали из промежуточного соединения 24 в соответствии с описанной выше методикой получения примера 2. Пример 46. Малеат (S)-(+)-5-фтор-1-(2-фторфенил)-3-(морфолин-2-илметокси)-1 Н-индазола. Промежуточное соединение 26 (трет-бутиловый эфир (S)-2-[5-фтор-1-(2-фторфенил)-1 Н-индазол-3 илоксиметил]морфолин-4-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 6 и промежуточного соединения 23 в качестве исходных веществ и перемешивали при 100 С в течение 3 ч. []D24 =+18,2 (CHCl3, с=5,1), МС (ХИАД): 446 (М+Н, 86%), 447 (22%), 390 (21%), 346 (100%), 347 (20%). Указанный в заголовке продукт получали из промежуточного соединения 26 в соответствии с описанной выше методикой получения примера 2. Примеры 47-49 синтезировали способом, аналогичным описанному для примера 45. Пример 50 синтезировали способом, аналогичным описанному для примера 45 за исключением того, что вместо фосгена использовали CDI (1,1'-карбонилдиимидазол). Пример 51. Гидрохлорид 5-фтор-1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. Промежуточное соединение 23 (1,00 г, 4,10 ммоль) растворяли в 41 мл CH3CN и 10 мл ДМФ. К раствору при 50 С добавляли 2,0 г карбоната цезия (6,10 ммоль). Через 10 мин добавляли промежуточное соединение 2 (1,14 г, 4,06 ммоль) и смесь нагревали до 80 С. Через 22 ч реакционную смесь охлаждали до комнатной температуры, гасили насыщенным NH4Cl и некоторым дополнительным количеством Н 2 О,затем три раза экстрагировали Et2O. Экстракты один раз промывали Н 2 О, затем один раз рассолом, сушили над MgSO4 и концентрировали с получением 2,61 г желтого масла. Неочищенный продукт очищали флэш-хроматографией (110-20% EtOAc/гексаны, 110% EtOAc/гексаны) с выделением промежуточного соединения 31 (трет-бутилового эфира 4-[5-фтор-1-(2-фторфенил)-1 Н-индазол-3-илокси]пиперидин 1-карбоновой кислоты) в виде желтого масла (1,13 г, 65%). МС (ХИАД): (М+1)=430, 330 (М-ВОС). Промежуточное соединение 31 (1,13 г, 2,63 ммоль) растирали с HCl в смеси диоксан/EtOAc в соответствии с методикой примера 14 с перемешиванием при комнатной температуре в течение ночи. После обычной обработки твердое вещество растирали с 40 мл Et2O, фильтровали и промывали двумя дополнительными порциями Et2O с получением указанного в заголовке продукта в виде белого твердого вещества (0,721 г, выход 75%): МС (М+1)=330. Примеры 56-57 синтезировали способом, аналогичным описанному для примера 51. Пример 52. Гидрохлорид 5-фтор-1-(2-фторфенил)-3-(1-метилпиперидин-3-илметокси)-1H-индазола. К находящемуся при комнатной температуре раствору 1-трет-бутилового эфира пиперидин-1,3 дикарбоновой кислоты (5,00 г, 21,81 ммоль) в смеси 20% МеОН/толуол (100 мл) по каплям добавляли 14,18 мл (триметилсилил)-диазометана (2,ОМ, 28,35 ммоль) и реакцию контролировали путем тонкослойной хроматографии (ТСХ) до тех пор, пока она на завершилась, затем реакционную смесь концентрировали при пониженном давлении с получением 4,44 г (83,7%) 1-трет-бутилового эфира 3-метилового эфира пиперидин-1,3-дикарбоновой кислоты (промежуточное соединение 53). 1 Н ЯМР (400 МГц, CDCl3)млн-1 1.4 (s, 9H), 1.6 (d, J=3.4 Гц, 1H), 1.6 (m, 1H), 1.7 (m, 1H), 2.0 (m, 1 Н), 2.4 (m, 1H), 2.8 (m, 1H), 3.0 (s,1H), 3.7 (s, 3 Н), 3.9 (d, J=13.2 Гц, 1 Н), 4.1 (s, 1H). К перемешанному при -78 С раствору промежуточного соединения 53 (2,22 г, 9,13 ммоль) в сухом ТГФ (30 мл) по каплям добавляли NaHMDS (гексаметилдисилазан натрия) (1,0 М в ТГФ, 10,03 ммоль). Реакционную смесь перемешивали при этой температуре в течение 30 мин и затем по каплям добавляли йодметан (0,682 мл, 10,95 ммоль). Реакционной смеси давали возможность нагреваться до комнатной температуры в течение ночи при хорошем перемешивании. Реакционную смесь охлаждали и затем гасили насыщенным NH4Cl. Слои разделяли, водный слой три раза экстрагировали 20 мл EtOAc и органические экстракты объединяли. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали- 20012245 при пониженном давлении. Масло очищали хроматографией на диоксиде кремния с использованием смеси гексаны/EtOAc (0-15%) с получением 2,25 г (95,8%) 1-трет-бутилового эфира 3-метилового эфира 3-метилпиперидин-1,3-дикарбоновой кислоты (промежуточное соединение 54). 1 НЯМР (400 МГц,CDCl3)млн-1 1.0 (s, 3H), 1.3 (s, 9H), 1.4 (m, 2H), 1.9 (m, 2 Н), 3.0 (d, J=13.2 Гц, 1 Н), 3.1 (m, 1H), 3.3 (m,1 Н), 3.5 (s, 3 Н), 3.7 (d, J=13.4 Гц, 1 Н). К перемешанному при 0 С раствору промежуточного соединения 54 (1,17 г, 4,56 ммоль) в сухом ТГФ (20 мл) по каплям добавляли LiAlH4 (l,0M в ТГФ, 9,11 мл, 9,11 ммоль) и реакционной смеси давали возможность нагреваться до комнатной температуры. После завершения реакции, в соответствии с ТСХ,реакционную смесь осторожно гасили насыщенным NH4Cl и добавляли EtOAc. Слои разделяли, водный слой экстрагировали EtOAc (315 мл) и органические экстракты объединяли. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 0,844 г (42,1%) трет-бутилового эфира 3-гидроксиметил-3-метилпиперидин-1 -карбоновой кислоты (промежуточное соединение 55). 1 Н ЯМР (400 МГц, CDCl3)млн-1 0.9 (s, 3 Н), 1.3 (m, 2H), 1.5 (s, 9H), 1.5 (m, 3 Н), 2.9 (s, 1H),3.1 (s, 1 Н), 3.5 (d, J=l 1.5 Гц, 1 Н), 3.8 (m, 2H). К перемешанному при 0 С раствору промежуточного соединения 55 (0,844 г, 3,68 ммоль) в сухомCH2Cl2 (25 мл) добавляли Et3N (0,513 мл, 3,682 ммоль) и реакционную смесь перемешивали в течение 15 мин. По каплям добавляли метансульфонилхлорид (0,285 мл, 3,682 ммоль) и реакционной смеси давали возможность нагреваться до комнатной температуры в течение ночи при хорошем перемешивании. Реакцию завершали, в соответствии с ТСХ и добавляли Et2O (100 мл). Смесь фильтровали и осадок на фильтре промывали дополнительным количеством Et2O. Затем при пониженном давлении концентрировали фильтрат. Остаток подвергали хроматографии со смесью гексаны/EtOAc (0-25%) с получением 1,05 г (93,1%) трет-бутилового эфира 3-метансульфонилметил-3-метилпиперидин-1-карбоновой кислоты(0,596 г, 1,83 ммоль) и смесь перемешивали в течение 30 мин. Добавляли промежуточное соединение 56 (0,412 г, 1,34 ммоль) и реакционную смесь нагревали до 80 С в течение ночи при хорошем перемешивании. Реакцию не завершали (в соответствии с высокоэффективной жидкостной хроматографией (ВЭЖХ) превращение 81%), тем не менее, нагревание отключали и реакционной смеси давали возможность охлаждаться до комнатной температуры. Реакционную смесь гасили насыщенным NH4Cl с последующим добавлением небольшого количества Н 2 О и затем выливали в Et2O. Слои разделяли и водную фазу экстрагировали Et2O (315 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Масло очищали хроматографией на диоксиде кремния с использованием смеси гексаны/EtOAc (0-10%) с получением 0,127 г (22,8%) трет-бутилового эфира 3-[5-фтор-1-(2-фторфенил)-1 Н-индазол-3-илоксиметил]-3 метилпиперидин-1-карбоновой кислоты (промежуточного соединения 57). МС (ХИАД): (М+1)=458. 1 Н ЯМР (400 МГц, CDCl3)млн-1 1.1 (s, 3H), 1.4 (s, 9H), 1.5 (m, 1H) 1.6 (m, 2 Н), 1.7 (m, 1H), 3.3 (s, 1H), 3.5(m, 3 Н), 4.2 (d, J=30.0 Гц, 2 Н), 7.2 (m, 2 Н), 7.3 (s, 1 Н), 7.3 (s, 1 Н), 7.3 (m, 2 Н), 7.6 (m, 1H). К перемешанному при комнатной температуре раствору промежуточного соединения 57 (0,127 г,0,278 ммоль) в EtOAc (0,925 мл) добавляли 0,902 мл 4.0 М раствора HCl в диоксане. Реакционной смесь давали возможность перемешиваться в течение ночи при комнатной температуре. После завершения реакции в соответствии с ВЭЖХ реакционную смесь концентрировали при пониженном давлении. К твердому веществу добавляли EtOAc и затем концентрировали при пониженном давлении. Этот процесс повторяли пять раз. Твердое вещество растирали со смесью EtOAc/Et2O (2:1), твердое вещество отфильтровывали и затем промывали Et2O (215 мл). Твердое вещество помещали в сушильный шкаф при пониженном давлении и получали 0,089 г (81,7%) указанного в заголовке продукта. Пример 53. Гидрохлорид 1-(2-фторфенил)-3-(3-метилпиперидин-3-илметокси)-1H-индазола. Указанный в заголовке продукт синтезировали тем же самым способом, что и пример 52, из промежуточного соединения 1 с получением 0,121 г (76,1%) продукта. Пример 54. Гидрохлорид 5-фтор-1-(2-фторфенил)-3-(4-метилпиперидин-4-илметокси)-1H-индазола. Соединение синтезировали тем же самым способом, что и пример 52, из 5-фтор-1-(2-фторфенил)1H-индазол-3-ола (промежуточное соединение 23) и трет-бутилового эфира 4-метансульфонилоксиметил-4-метилпиперидин-1-карбоновой кислоты, синтезированного из моно-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты тем же самым способом, что и промежуточное соединение 56, с получением 0,068 г (50,3%) указанного в заголовке продукта. Пример 55. Малеат (R)-5-фтор-1-(2-фторфенил)-3-(пиперидин-3-илметокси)-1 Н-индазола. трет-Бутиловый эфир 3-[5-фтор-1-(2-фторфенил)-1 Н-индазол-3-илоксиметил]пиперидин-1 карбоновой кислоты получали в соответствии с методикой получения промежуточного соединения 57 из промежуточного соединения 23 (0,500 г, 2,03 ммоль) и трет-бутилового эфира (R)-3 метансульфонилоксиметилпиперидин-1-карбоновой кислоты (0,655 г, 2,23 ммоль). Перемешанный при комнатной температуре раствор карбамата в EtOAc (5,43 мл) обрабатывали 5,30 мл 4,0 М раствора HCl в- 21012245 диоксане. Реакционной смеси давали возможность перемешиваться в течение ночи при комнатной температуре, концентрировали при пониженном давлении, растирали с EtOAc и снова концентрировали при пониженном давлении. Этот процесс повторяли три раза. Попытки перекристаллизации пены из смеси гексаны/EtOAc и смеси ацетон/гексаны оказались безуспешными. Путем добавления анионнообменной смолы Dowex 550A (ОН) к перемешанному раствору соли в МеОН (10 мл) получали свободное основание. Смесь перемешивали в течение 30 мин, фильтровали, и гранулы три раза промывали 20 мл метанола. Органическую фазу концентрировали при пониженном давлении с получением 0,3628 г свободного основания в виде желтого масла. К перемешанному раствору масла в EtOAc (10 мл) добавляли малеиновую кислоту (0,111 г, 1,0 эквивалент). Твердое вещество выпадало в осадок, и смесь концентрировали при пониженном давлении. Твердое вещество растирали со смесью гексаны/Et2O, фильтровали и промывали Et2O. Белое твердое вещество сушили в термостате при пониженном давлении при 80 С в течение ночи с получением 0,390 г (69,6%) указанной в заголовке соли малеата. Пример 58. Гидрохлорид 5-хлор-1-(2,5-дифторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. Раствор 2-амино-5-хлорбензойной кислоты (3,0 г, 17,0 ммоль) и гидрохлорида (2,5 дифторфенил)гидразина (3,2 г, 17,5 ммоль) в сухом ТГФ (тетрагидрофуране) (20 мл) обрабатывали НОВТ (гидратом 1-гидроксибензотриазола) (5,4 г, 35,0 ммоль). Получающуюся в результате смесь охлаждали приблизительно до -12 С. Добавляли N-Me-морфолин (3,7 г, 36,7 ммоль) и перед добавлениемEDAC-HCl (гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида) (3,4 г, 17,5 ммоль), смесь перемешивали в течение 5 мин. Смесь перемешивали при -12 С в течение 1 ч и затем давали возможность нагреваться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь распределяли между EtOAc (50 мл) и водой (50 мл). Слои разделяли, и органический слой четыре раза промывали насыщенным водным NaCl, сушили над MgSO4 и концентрировали в вакууме. Получающееся в результате твердое вещество растирали с эфиром, фильтровали и сушили в вакуумном сушильном шкафу в течение ночи при 70 С и 15 мм рт.ст. (приблизительно 2000 Па) с получением промежуточного соединения 36 (N'-(2,5-дифторфенил)гидразида 2-амино-5-хлорбензойной кислоты) (4,0 г, выход 77%) в виде светло-желтого твердого вещества. МС (ХИАД): (М+1)=298,0. К находящемуся при 0 С раствору промежуточного соединения 36 (3,9 г, 13,0 ммоль) в 1 М HCl (35 мл) медленно добавляли раствор NaNO2 в 10 мл воды. Получающуюся в результате смесь перед разбавлением смесью EtOH/H2O (1:1, 50 мл) перемешивали в течение 10 мин. Смесь нагревали до образования флегмы в течение 3 ч, охлаждали до комнатной температуры и оставляли перемешиваться в течение 1 ч. Твердое вещество отфильтровывали, два раза промывали 20 мл воды и сушили в вакуумном сушильном шкафу в течение ночи при 70 С (15 мм рт.ст. (приблизительно 2000 Па с получением промежуточного соединения 37 (5-хлор-1-(2,5-дифторфенил)-1 Н-индазол-3-ола) (3,7 г, выход 95%) в виде коричневого твердого вещества. МС (ХИАД): (М+1)=281,0. Промежуточное соединение 38 получали в соответствии с методикой, описанной выше для промежуточного соединения 34, с использованием промежуточного соединения 37 (0,5 г, 1,8 ммоль) и промежуточного соединения 2 в качестве исходных веществ для получения целевого продукта - промежуточного соединения 38(трет-бутилового эфира 4-[5-хлор-1-(2,5-дифторфенил)-1 Н-индазол-3 илокси]пиперидин-1-карбоновой кислоты) (0,48 г, выход 58%). МС (ХИАД): (М+1)=464,0. Промежуточное соединение 39 получали в соответствии с методикой, описанной выше для примера 14, с использованием промежуточного соединения 38 (0,45 г, 0,97 ммоль) в качестве исходного вещества с получением желаемого указанного в заголовке продукта - гидрохлорида 5-хлор-3-циклогексилокси-1(2,5-дифторфенил)-1 Н-индазола (0,35 г, выход 90%). Примеры 59-95 синтезировали способом, аналогичным описанному для примера 58 с использованием подходящей 2-аминобензойной кислоты. Примеры 96-97 синтезировали способом, аналогичным описанному для примера 58, за исключением того, что в реакции индазол-3-ола с Cs2CO3 вместо ДМФ использовали CH3CN/ДМФ. Пример 98 синтезировали способом, аналогичным описанному для примера 58, за исключением того, что Cs2CO3 заменяли на NaH. Пример 99 синтезировали способом, аналогичным описанному для примера 58, за исключением того, что вместо фенилгидразина использовали пиридилгидразин. Пример 100. Гидрохлорид 4-фтор-1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. 2-Амино-6-фторбензойную кислоту (2,00 г, 12,89 ммоль) объединяли с гидрохлоридом 2 фторфенилгидразина (2,096 г, 12,89 ммоль) и HOBt (3,949 г, 25,79 ммоль) в сухом ТГФ (75 мл) и охлаждали приблизительно до -12 С. Добавляли N-метилморфолин (2,835 мл, 25,79 ммоль), смесь перемешивали в течение 5 мин, затем добавляли гидрохлорид EDC (2,66 г, 13,88 ммоль). Смесь выдерживали при температуре от -14 до -10 С в течение 1 ч, затем давали возможность медленно нагреваться до комнатной температуры и перемешивали в течение 18 ч. Смесь охлаждали до 0 С, затем фильтровали черезCELITE (диатомитовая земля). Фильтрат разбавляли EtOAc, обрабатывали насыщенным NaHCO3 и разделяли слои. Органический слой два раза промывали 50%-ным насыщенным NaHCO3 и затем сушили над MgSO4 и концентрировали. Получающееся в результате твердое вещество растирали с дихлорметаном, фильтровали, промывали очень небольшим количеством дихлорметана и сушили. Фильтрат после растирания повторно растирали с небольшим количеством дихлорметана, фильтровали, промывали- 22012245 очень малым количеством дихлорметана и сушили. Фильтрат концентрировали до сухого состояния,растирали с небольшим количеством Et2O, фильтровали, промывали очень малым количеством эфира и сушили. Три твердых вещества объединяли, получая в итоге 2,182 г (64%) N'-(2-фторфенил)гидразида 2 амино-6-фторбензойной кислоты (промежуточное соединение 44) в виде не совсем белого твердого вещества. МС (ХИАД): (М-1)=262,0. Промежуточное соединение 44 (2,182 г, 8,289 ммоль) суспендировали в 1 М HCl (20 мл), охлаждали до 0 С и по каплям обрабатывали раствором нитрита натрия (1,144 г, 16,58 ммоль) в воде (7 мл). Смесь перемешивали в течение 10 мин при 0 С, разбавляли смесью EtOH/H2O (1:1, 30 мл) и нагревали до образования флегмы в течение 3 часов, затем перемешивали при комнатной температуре в течение 18 ч. Твердое вещество отфильтровывали, промывали водой и сушили с получением 1,939 г (95%) 4-фтор-1(2-фторфенил)-1 Н-индазол-3-ола (промежуточное соединение 45) в виде желто-коричневого твердого вещества. МС (ХИАД): (М+1)= 247.1, (М-1)=245.0. трет-Бутиловый эфир 4-[4-фтор-1-(2-фторфенил)-1 Н-индазол-3-илокси]-пиперидин-1-карбоновой кислоты (промежуточное соединение 46) получали, как описано выше для промежуточного соединения 42, с использованием промежуточного соединения 45 (300 мг, 1,218 ммоль), смолы PS-BEMP (1,108 г) и трет-бутилового эфира 4-метансульфонилоксипиперидин-1-карбоновой кислоты (промежуточное соединение 2) (374 мг, 1,34 ммоль) в ДМФ (10 мл) с образованием 265 мг (51%) промежуточного соединения 46 в виде желтого масла. МС (М+1)=430,2. Указанный в заголовке продукт получали, как описано выше для примера 41, с использованием промежуточного соединения 46 (265 мг, 0,617 ммоль) и 4 М HCl в диоксане (2,00 мл) в EtOAc (2 мл) с образованием 202 мг (89%) белого твердого вещества. Примеры 101-103 синтезировали способом, аналогичным описанному для примера 100. Пример 104. Гидрохлорид (S)-(-)-1-фенил-3-(пиперидин-3-илметокси)-1 Н-пиразоло[3,4-b]пиридина. К раствору 2-хлорникотиноилхлорида (5,05 г, 2,87 ммоль) в 50 мл безводного метиленхлорида при 0 С добавляли триэтиламин (4,5 мл, 3,23 ммоль), а затем фенилгидразин (2,9 мл, 2,95 ммоль). Реакционную смесь концентрировали на роторном испарителе. Добавляли воду (40 мл) и смесь три раза экстрагировали 80 мл EtOAc. Объединенные органические слои сушили над MgSO4 и затем концентрировали. Твердый остаток растирали со смесью EtOAc и гексанов (1:1, 60 мл). Твердое вещество собирали фильтрованием и затем, после двукратной промывки 10 мл эфира, сушили на воздухе. Затем чистое твердое вещество нагревали до 175 С в течение приблизительно 15 мин. Твердое вещество в начальной стадии плавилось при 175 С до оранжевой жидкости, а затем затвердевало с получением 1,84 г коричневого твердого вещества, промежуточного соединения 14 (1-фенил-1 Н-пиразоло[3,4-b]пиридин-3-ола). МС(ХИАД): 212 (М+1, 100%). Промежуточное соединение 15 (трет-бутиловый эфир 3-(1-фенил-1 Н-пиразоло[3,4-b]пиридин-3 илоксиметил)пиперидин-1-карбоновой кислоты) получали в соответствии с описанной выше методикой получения промежуточного соединения 3 с использованием промежуточного соединения 11 и промежуточного соединения 14 в качестве исходных веществ и перемешивали при 100 С в течение 1,5 ч. []D24 =+17,4 (CHCl3, с=10,8), МС (ХИАД): 409 (М+Н, 60%), 309 (100%). К раствору промежуточного соединения 15 (0,72 г, 1,75 ммоль) в 7 мл EtOAc при комнатной температуре добавляли 4 М раствор HCl в диоксане (5 мл, 20,0 ммоль). Бледно-желтый раствор превращался в ярко-желтый раствор, после перемешивания в течение 5 мин образовывался осадок. Смесь перемешивали при комнатной температуре в течение 2 ч. Твердое вещество собирали фильтрованием и промывали эфиром (510 мл). Желтое твердое вещество сушили в течение ночи в вакууме при 90 С с получением 0,52 г указанной в заголовке хлористо-водородной соли в виде белого твердого вещества. Пример 105 синтезировали способом, аналогичным описанному для примера 104. Пример 106. L-тартрат 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1H-индазола. К перемешанной суспензии гидрохлорида 2-фторфенилгидразина (100 г, 0,614 моль) в этаноле(1,0 л) струйкой, в течение 10-минутного периода времени при 22-23 С добавляли триэтиламин (68,4 г,0,68 моль). Суспензию перемешивали в течение 5 мин и затем добавляли изатоевый ангидрид (100 г,0,614 моль). Получающуюся в результате суспензию перемешивали при температурах, достигающих температуры дефлегмации (78 С) в течение следующего часа, после чего образовывался раствор. Раствор перемешивали при температуре дефлегмации в течение 2,5 ч. Затем раствор перемешивали при -10 С в течение 2 ч и фильтровали. Твердое вещество промывали этилацетатом (100 мл) и сушили под прессом при разрежении. Твердое вещество суспендировали в воде (400 мл) и перемешивали при комнатной температуре в течение 0,5 ч. Твердое вещество отфильтровывали, промывали водой (530 мл) и сушили под прессом при разрежении. Дополнительная сушка в вакууме при 33 С в течение 17 ч позволила получить 63,3 г (42%) промежуточного соединения 48 (N'-(2-фторфенил)гидразида 2-аминобензойной кислоты). Органический фильтрат концентрировали в вакууме до сухого состояния. Остаток растирали с водой(500 мл, затем 3200 мл) и суспендировали в смеси этанол:этилацетат (1:1, 150 мл). Твердое вещество отфильтровывали, промывали этилацетатом (50 мл) и сушили под прессом при разрежении. Дополнительная сушка в вакууме при 32 С в течение 6 ч позволила получить дополнительно 13,7 г (9%) продук- 23012245 та. Общий выход составил 77,0 г (51%). 1 Н ЯМР (ДМСО-d6) : 10.1 (s, 1H), 7.6 (m, 1H), 7.2 (t, 1 Н), 7.1 (m,1H), 6.95 (m, 1 Н), 6.8 (t, 1 Н), 6.7 (m, 2 Н), 6.5 (t, 1H), 6.4 (s, 2 Н). К перемешанной суспензии промежуточного соединения 48 (150 г, 0,257 моль) в 1 н. HCl (560 мл) при температуре от -3 до -2 С по каплям в течение 40 мин добавляли раствор нитрита натрия (35,5 г,0,514 моль) в воде (175 мл). Наблюдали выделение газа. Пенистую суспензию перемешивали при температуре от 0 до -5 С в течение 0,5 ч. Добавляли этанол (1,05 л) и раствор нагревали до образования флегмы в течение 45-минутного периода времени. Суспензию перемешивали при кипячении с обратным холодильником в течение 1,5 ч. В течение следующих 45 мин при атмосферном давлении отгоняли этанол(приблизительно 250 мл). Суспензию охлаждали при перемешивании до -10 С в течение 0,5 ч и фильтровали. Твердое вещество четыре раза промывали 30 мл изопропилового спирта и сушили под прессом при разрежении. Дополнительная сушка в вакууме при 58 С в течение 7 ч позволила получить 52,5 г (89,5%) помежуточного соединения 1 (1-(2-фторфенил)-1H-индазол-3-ола). 1H ЯМР (ДМСО-d6 : 7.7 (d, 1H), 7.6(t, 1H), 7.3-7.5 (m, 4H), 7.2 (m, lH), 7.1 (t, 1H). К промежуточному соединению 1 (52 г, 0,228 моль) в диметилформамиде (480 мл) при перемешивании добавляли карбонат цезия (111,5 г, 0,342 моль). Смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли трет-бутиловый эфир 4-метансульфонилоксипиперидин-1-карбоновой кислоты промежуточное соединение 2 (70 г, 0,251 моль) и смесь перемешивали при 80-85 С в течение 18 час. Получающуюся в результате суспензию охлаждали до 10 С в бане лед-вода. В течение 20-минутного периода времени струйкой добавляли насыщенный водный хлорид аммония (250 мл). Смесь выливали в перемешанную смесь лед-вода (2 л). Смесь экстрагировали эфиром (1 л, 500 мл). Экстракт сушили над сульфатом магния и концентрировали в вакууме до масла оранжево-янтарного цвета (124 г). Это масло растворяли в смеси гексан:этилацетат (1:8, 150 мл). К мутному раствору добавляли силикагель (230-400 меш, 150 г). Суспензию выливали на слой силикагеля (230-400 меш, 850 г). Слой элюировали этилацетатом в гексане (5%8%). Общий используемый объем растворителя составлял 21 л. Объединенные элюаты концентрировали в вакууме до 88 г (94%) промежуточного соединения 3 (трет-бутилового эфира 4-[1(2-фторфенил)-1 Н-индазол-3-илокси]пиперидин-1-карбоновой кислоты) в виде бледно-желтой смолы. 1 Н ЯМР (CDCl3) : 7.7 (d, 1 Н), 7.6 (t, 1H), 7.4 (t, 1H), 7.2-7.4 (m, 4H), 7.15 (t, 1H), 5.1 (m, 1H), 3.8 (m, 2H), 3.4(m, 2H), 2.1 (m, 2H), 2.05 (s, 3H), 1.9 (m, 2H), 1.5 (s, 9H). К перемешанному раствору промежуточного соединения 3 (85 г, 0,207 моль) в этилацетате (600 мл) при 21 С тонкой струйкой, в течение 35 мин добавляли 4 М HCl в диоксане (600 мл), вызывая увеличение температуры до 24 С. Раствор перемешивали при 22-23 С в течение 3 ч. Раствор концентрировали в вакууме до густого масла, которое начинало затвердевать. Добавляли этилацетат (200 мл) и получающуюся в результате густую суспензию перемешивали при 0 С в течение 1 ч. Твердое вещество отфильтровывали, два раза промывали 30 мл этилацетата и сушили под прессом при разрежении. Дополнительная промывка в вакууме при 35 С в течение 16 ч позволила получить 66,5 г (93%) гидрохлорида 1-(2 фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола. 1 Н ЯМР (CD3OD) : 7.7 (d, 1H), 7.6 (t, 1H), 7.5-7.6 (m,2H), 7.3-7.5 (m, 2H), 7.25 (m, 1H), 7.2 (t, 1H), 5.2 (m, 1H), 3.4-3.5 (m, 2H), 3.2-3.3 (m, 2H), 2.3-2.4 (m, 2H),2.2-2.3 (m, 2H). MC (ХИАД): (M+l)=311. Смесь гидрохлорида 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола (9,0 г, 0,026 моль) в тетрагидрофуране (20 мл) и воде (100 мл) перемешивали при комнатной температуре в течение 0,5 ч,после чего образовывался раствор. Порциями, в течение 5-минутного периода времени, добавляли карбонат натрия (15 г, 0,142 моль), а затем эфир (150 мл). Смесь встряхивали и слои разделяли. Водный слой экстрагировали эфиром (100 мл). Объединенные органические слои сушили над сульфатом магния и концентрировали в вакууме до смолы (8,0 г, 99% неочищенная). К этой смоле сразу добавляли раствор Lвинной кислоты (4,0 г, 0,0267 моль) в воде (80 мл). Смесь перемешивали в течение приблизительно 2 мин до завершения образования раствора. Перемешивание продолжали, и приблизительно через 2 мин начинало выпадать в осадок твердое вещество. Суспензию перемешивали при 0 С в течение 3 ч и фильтровали. Твердое вещество промывали водой (15 мл) и сушили под прессом при разрежении. Дополнительная сушка в вакууме при 50 С в течение 16 ч позволила получить 10,2 г (85,5%) соли L-тартрата (Lтартрата 1-(2-фторфенил)-3-(пиперидин-4-илокси)-1 Н-индазола). Пример 107. L-тартрат (S)-5-фтор-1-(2-фторфенил)-3-(пиперидин-3-илметокси)-1 Н-индазола. 2-Амино-5-фторбензойную кислоту (20,0 г, 129 ммоль) растворяли в сухом ТГФ (390 мл). Одной порцией добавляли 1,1-карбонилдиимидазол (CDI, 22,0 г, 135 ммоль). Наблюдали некоторое выделение газа, и очень густое бежевое твердое вещество выпадало в осадок. Суспензию перемешивали в течение 1 ч 20 мин при комнатной температуре. В конечном итоге осадок уменьшался. Добавляли N,Nдиизопропилэтиламин (DIPEA, 27 мл, 155 ммоль), который приводил к полному растворению осадка, с последующим добавлением гидрохлорида (2-фторфенил)гидразина (23,1 г, 142 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь осторожно гасили водой (1 л) и добавляли этилацетат (500 мл). Два слоя разделяли и водный слой два раза промывали 200 мл воды, затем два раза 100 мл насыщенного водного раствора NaHCO3, затем насыщенным рассолом и сушили надMgSO4. Растворитель удаляли с получением 32,21 г (выход 95%) промежуточного соединения 22 (N'-(2- 24012245 фторфенил)гидразида 2-амино-5-фторбензойной кислоты) в виде коричнево-красного твердого вещества. МС (ХИАД): (М+1)=264. 1 Н и 19F ЯМР спектры соответствовали структуре. Твердое вещество использовали на следующей стадии без какой-либо дополнительной очистки. В трехгорлую круглодонную колбу объемом 500 мл, оборудованную магнитной мешалкой, капельной воронкой и термометром, загружали суспензию промежуточного соединения 22 (10,00 г, 38 ммоль) в 1 н. HCl (130 мл) и этаноле (130 мл). Суспензию нагревали до 76 С, что приводило к полному растворению твердого вещества. По каплям в течение 15 мин добавляли раствор NaNO2 (5,24 г, 76 ммоль) в воде(12 мл). Наблюдали выделение газа и через несколько минут из раствора выпадало бежевое твердое вещество. После завершения добавления раствора NaNO2 смесь кипятили с обратным холодильником в течение 1 ч. Смеси давали возможность охлаждаться до комнатной температуры, и твердое вещество отфильтровывали, промывали водой (350 мл) и сушили при 50 С в течение 24 ч в вакуумном сушильном шкафу при 17 торр (приблизительно 2267 Па) с получением 4,18 г (92%) промежуточного соединения 23 (5-фтор-1-(2-фторфенил)-1 Н-индазол-3-ола) в виде бежевого твердого вещества. МС (ХИАД):(М+1)=247. 1 Н и 19F ЯМР спектры соответствовали структуре. Твердое вещество использовали на следующей стадии без какой-либо дополнительной очистки. Промежуточное соединение 23 (9,86 г, 40 ммоль) растворяли в ДМФ (100 мл). Добавляли K2CO3(8,30 г, 60 ммоль) и смесь перемешивали при комнатной температуре в течение 10 мин. Затем одной порцией добавляли раствор трет-бутилового эфира (S)-3-метансульфонилоксиметилпиперидин-1 карбоновой кислоты (промежуточного соединения 11) (11,75 г, 40 ммоль) в 10 мл ДМФ и получающуюся в результате смесь перемешивали при 80-85 С в течение 18 ч. Добавляли насыщенный водный растворNH4Cl (200 мл) и воду (1 л) и водную фазу экстрагировали МТВЕ (метил-трет-бутиловый эфир) (3200 мл). Объединенные органические экстракты два раза промывали 100 мл воды, затем насыщенным рассолом и сушили над MgSO4. Растворитель удаляли в вакууме с получением коричневого твердого вещества, которое пропускали через слой силикагеля (гексаны/этилацетат (3/1) в качестве подвижной фазы) с получением 16,37 г (выход 92%) промежуточного соединения 24 трет-бутилового эфира (S)-3-[5-фтор-1-(2-фторфенил)-1 Ниндазол-3-илоксиметил]пиперидин-1-карбоновой кислоты) в виде очень густого желтого масла. МС(ХИАД): (М+1)= 444. 1 Н и 19F ЯМР спектры соответствовали структуре. Промежуточное соединение 24 (20,6 г, 46 ммоль) растворяли в этилацетате (150 мл) и раствор охлаждали в бане лед-вода. Одной порцией добавляли 4 М HCl в диоксане (150 мл) и смеси давали возможность нагреваться до комнатной температуры. Через 1 ч растворитель удаляли в вакууме с получением очень густого бледно-желтого масла. Этилацетат добавляли для растворения масла и удаляли в вакууме с получением пенистого желтого твердого вещества. К маслу добавляли диэтиловый эфир (300 мл) и суспензию перемешивали в течение 18 ч при комнатной температуре. Получающееся в результате твердое вещество отфильтровывали, два раза промывали 50 мл диэтилового эфира и сушили в вакуумном сушильном шкафу при 50 С в течение 24 ч с получением 15,39 г (87%) гидрохлорида (S)-5-фтор-1-(2 фторфенил)-3-(пиперидин-З-илметокси)-1H-индазола в виде бледно-желтого твердого вещества. МС(ХИАД): (М+1)=344. 1H и 19F ЯМР спектры соответствовали структуре. Гидрохлорид (S)-5-фтор-1-(2-фторфенил)-3-(пиперидин-3-илметокси)-1H-индазола (14,0 г, 37 ммоль) суспендировали в этилацетате (100 мл) и добавляли 1 М раствор K2CO3 в воде (100 мл). Получающуюся в результате смесь интенсивно перемешивали, что приводило к полному растворению твердого вещества. Через 1 ч два слоя разделяли, и водный слой два раза экстрагировали 50 мл этилацетата. Объединенные органические экстракты промывали рассолом и сушили над MgSO4. Растворитель удаляли в вакууме с получением 11,9 г (94%) свободного основания (S)-5-фтор-1-(2-фторфенил)-3(пиперидин-3-илметокси)-1 Н-индазола в виде очень густого желтого масла. 1 Н и 19F ЯМР спектры соответствовали структуре. Свободное основание (20,9 г, 61 ммоль) растворяли в метаноле (200 мл). Одной порцией добавлялиL-винную кислоту (9,1 г, 61 ммоль) и смесь перемешивали при комнатной температуре в течение 10 мин с получением прозрачного раствора. Растворитель удаляли в вакууме с получением бледно-желтого твердого вещества, которое суспендировали в диэтиловом эфире (500 мл) в течение 2 ч. Твердое вещество отфильтровывали, промывали диэтиловым эфиром (50 мл) и сушили в вакуумном сушильном шкафу при 50 С и 17 торр (приблизительно 2267 Па) в течение 2 ч, а затем при комнатной температуре в течение 48 ч с получением 27,8 г (93%) соли L-тартрата (L-тартрата (S)-5-фтор-1-(2-фторфенил)-3(пиперидин-3-илметокси)-1 Н-индазола) в виде белого твердого вещества. 1 Н и 19F ЯМР спектры соответствовали структуре. ВЭЖХ: химическая чистота: 98,7% а/а; хиральный: 100% ее (энантиомерный избыток). Анализ методом сжигания образца (CHN): пропущен. Примеры 108-111 синтезировали способом, аналогичным описанному для примера 107, за исключением того, что для удаления защиты и образования соли вместо K2CO3 и HCl использовали Cs2CO3.
МПК / Метки
МПК: C07D 471/04, A61P 25/00, C07D 231/56, A61K 31/4162, A61K 31/416
Метки: индазолы, пиразоло[3,4-b]пиридины, терапевтические
Код ссылки
<a href="https://eas.patents.su/30-12245-terapevticheskie-pirazolo34-bpiridiny-i-indazoly.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтические пиразоло[3,4-b]пиридины и индазолы</a>
Предыдущий патент: Агент, ингибирующий гидратацию сланца, и способ применения
Следующий патент: Способ лечения или профилактики разрушения кости или остеопороза
Случайный патент: Способ борьбы с грызунами на защищаемом объекте и устройство для его осуществления












