Фосфонатзамещенные пиримидиновые соединения (варианты), способ их получения (варианты), фармацевтическая композиция на их основе и способ лечения вирусной инфекции
Номер патента: 11948
Опубликовано: 30.06.2009
Авторы: Гоцкова Дана, Голи Антонин, Бальзарини Жан Мари Рене, Де Клерк Эрик Десире Алиса
Формула / Реферат
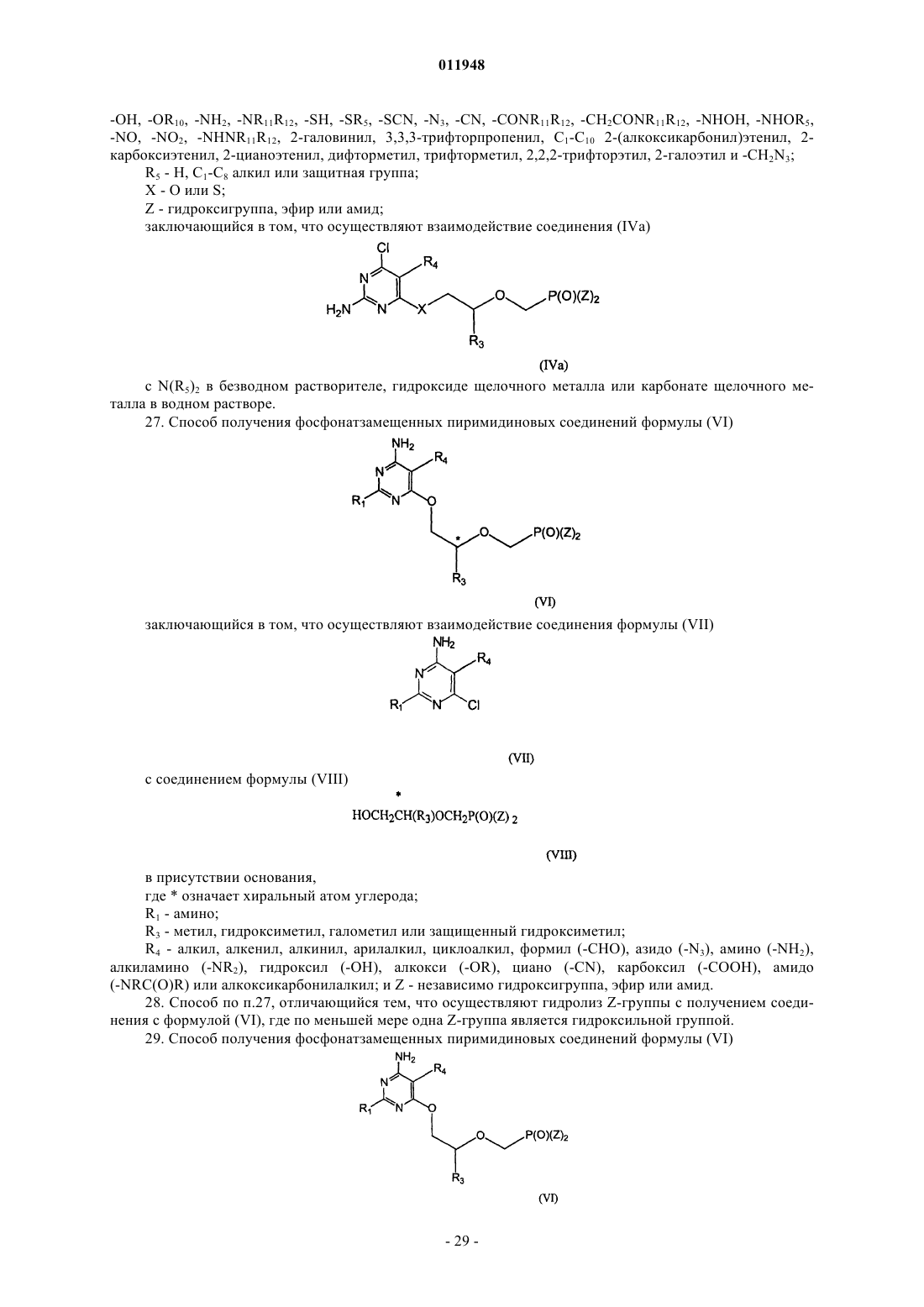
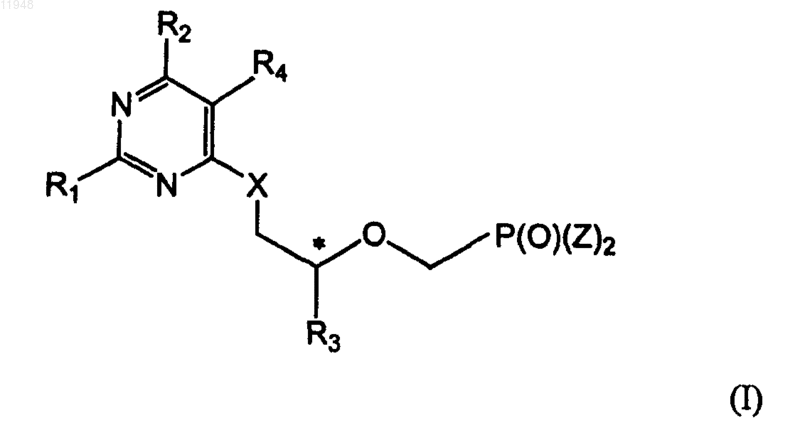
1. Фосфонатзамещенные пиримидиновые соединения общей формулы (I)
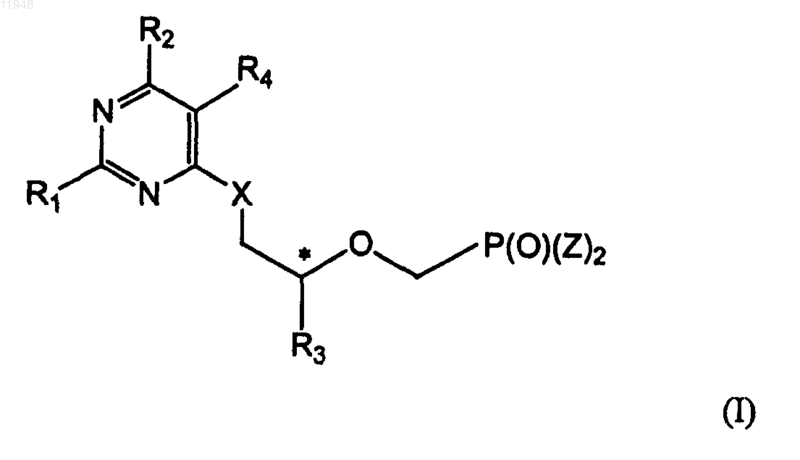
где * означает хиральный атом углерода; и
R1 - амино;
R2 - H, гало, гидроксигруппа или защищенная гидроксигруппа;
R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - C1-C10 алкил, C2-C10 алкенил,C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5,
-CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN, -CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5,
-CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2,
-CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2, -ОН, -OR10, -NH2, -NR11R12, -SH, -SR5, -SCN, -N3, -CN,
-CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5, -NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
X - кислород, сера или связь;
Z - гидроксигруппа, эфир или амид;
R5 - H, C1-C10 алкил или защитная группа;
R6 - F, Cl, Br и I;
R7 - боковая цепь любой незащищенной или N-защищенной a-амино кислоты;
R8 - H или -C(O)CH(R7)(NH2);
R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;
R11, R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома;
их соли и сольваты.
2. Соединения по п.1, отличающиеся тем, что R1 и R2 - амино, a X - кислород.
3. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - метил, X - кислород и R3 имеет конфигурацию (R).
4. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - гидроксиметил, X - кислород R3 имеет конфигурацию (R).
5. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, a X - сера.
6. Соединения по п.1, отличающиеся тем, что R1 - амино, R2 - гидрокси, a X - кислород.
7. Соединения по п.1, отличающиеся тем, что они являются кристаллическими веществами.
8. Соединения по п.1, отличающиеся тем, что они представлены в значительной степени чистыми энантиомерами при хиральном атоме углерода.
9. Соединения по п.8, отличающиеся тем, что имеют конфигурацию (R).
10. Соединения по п.8, отличающиеся тем, что имеют конфигурацию (S).
11. Фосфонатзамещенные пиримидиновые соединения общей формулы (Iaa)
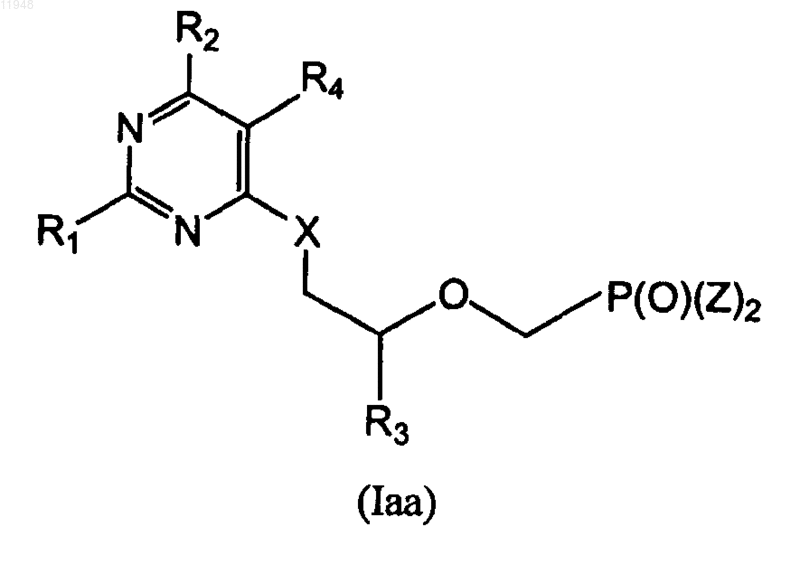
где R1 - амино;
R2 - H, гало, гидроксигруппа или защищенная гидроксигруппа;
R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил,
C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5,
-CH2C(O)R5, -CH2R6, -CH2OC(O)R5, -CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN, -CO2R5,
-CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5, -CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2, -CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2, -OH, -OR10,
-NH2, -NR11R12, -SH, -SR5, -SCN, -N3, -CN, -CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5, -NO, -NO2,
-NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
X - кислород, сера или связь;
Z - гидроксигруппа, эфир или амид;
R5- H, C1-C10 алкил или защитная группа;
R6 - F, Cl, Br и I;
R7 - боковая цепь любой незащищенной или N-защищенной a-амино кислоты;
R8 - H, -C(O)CH(R7)(NH2);
R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;
R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома;
их соли и сольваты.
12. Соединения по п.11, отличающиеся тем, что R1 и R2 - амино, R3 - водород, a X - кислород.
13. Соединения по п.11, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - водород, a X - сера.
14. Соединения по п.11, отличающиеся тем, что R1 - амино, R2 - гидрокси, R3 - водород, a X - кислород.
15. Композиция, обладающая антивирусной активностью, содержащая фармацевтически приемлемый наполнитель и антивирусный агент, отличающаяся тем, что в качестве последнего она содержит фосфонатзамещенное пиримидиновое соединение по п.1.
16. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (I)
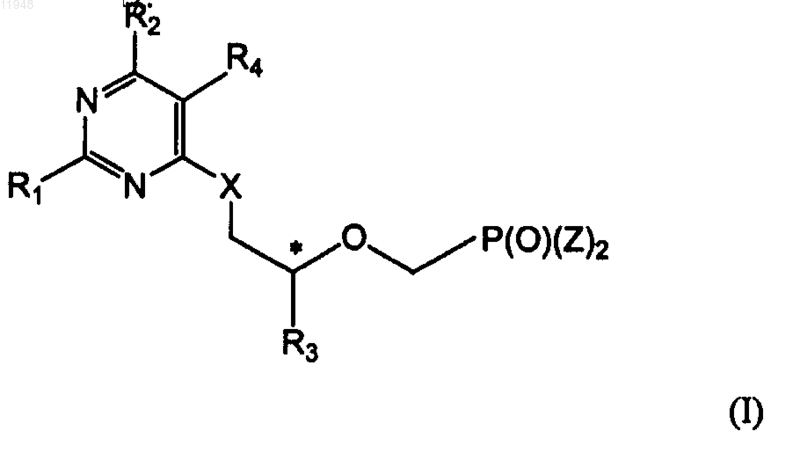
заключающийся в том, что осуществляют взаимодействие соединения формулы (II)
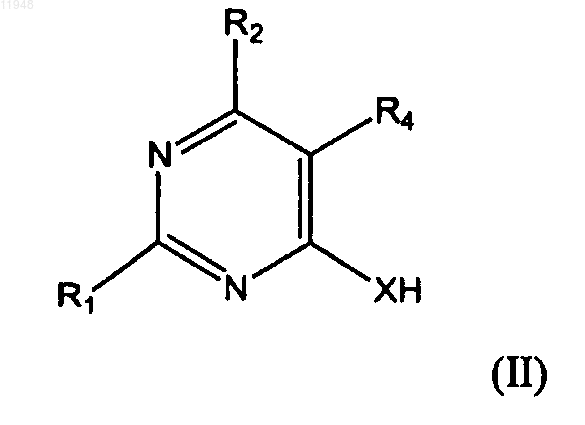
с соединением формулы (III)
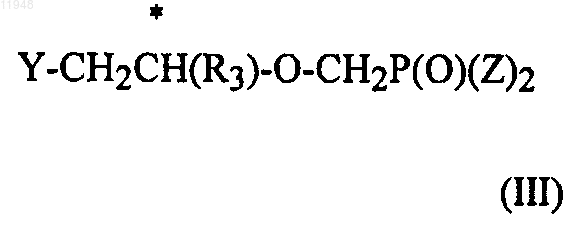
где Y - уходящая группа в диполярном апротонном растворителе в присутствии основания,
где * означает хиральный атом углерода и
R1 - амино;
R2 - H, гало, гидроксигруппа, защищенная гидроксигруппа или группа, имеющая формулу (Ia):

R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил; R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил,
-CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5, -CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN,
-CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5, -CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H,
-CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2, -CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2,
-ОН, -OR10, -NH2, -NR11R12, -SH, -SR5, -SCN, -N3, -CN, -CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5,
-NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
X - О или S;
Z - гидроксигруппа, эфир или амид;
R5 - H, C1-C10 алкил или защитная группа;
R6 - F, Cl, Br и I;
R7 - боковая цепь любой незащищенной или N-защищенной a-амино кислоты;
R8 - H,-C(O)CH(R7)(NH2);
R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила, или они вместе образуют цикл с участием или без участия гетероатома; и
R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома.
17. Способ по п.16, отличающийся тем, что осуществляют выделение конечного соединения формулы (I).
18. Способ по п.16, отличающийся тем, что Z представляет собой эфир или амид и при этом дополнительно гидролизуют одну или обе Z-группы с получением соединения формулы (I), где по меньшей мере одна Z-группа - гидроксильная группа.
19. Способ по п.16, отличающийся тем, что в конечном соединении формулы (I) Z представляет собой (OR4)2, a R4 - изопропил.
20. Способ по п.16, отличающийся тем, что в конечном соединении формулы (I) R3 - метил, a Y - п-толуолсульфонилокси или бром.
21. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (Iaa)

заключающийся в том, что осуществляют взаимодействие соединения формулы (II)
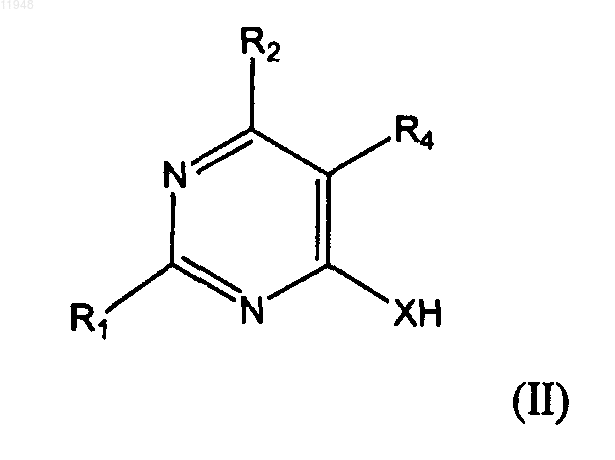
с соединением формулы (III)
Y-CH2CH(R3)O-CH2P(O)(Z)2,
где Y - уходящая группа в диполярном апротонном растворителе в присутствии основания,
где R1 - амино;
R2 - H, гало, гидроксигруппа или защищенная гидроксигруппа или группа с формулой (Ia):
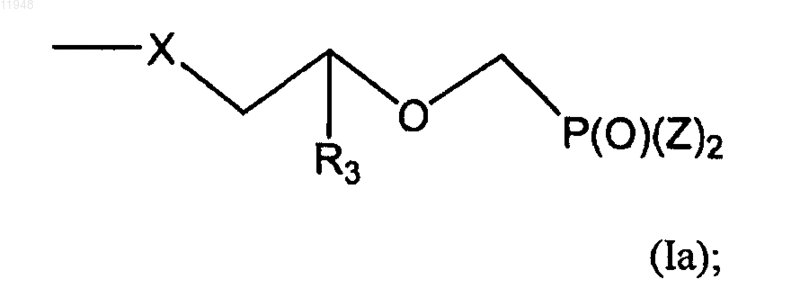
R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - C1- C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5,
-CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN, -CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5,
-CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2,
-CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2, -ОН, -OR10, -NH2, -NR11R12 -SH, -SR5, -SCN, -N3, -CN,
-CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5, -NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2- цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
X - О или S;
Z - гидроксигруппа, эфир или амид;
R5 - H, C1-C10 алкил или защитная группа;
R6 - F, Cl, Br и I;
R7 - боковая цепь любой незащищенной или N-защищенной a-аминокислоты;
R8 - H или -C(O)CH(R7)(NH2);
R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила, или они вместе образуют цикл с участием или без участия гетероатома; и
R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила, или они вместе образуют цикл с участием или без участия гетероатома.
22. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (I)
где R2 - N(R5)2,
заключающийся в том, что осуществляют взаимодействие соединения (IV)
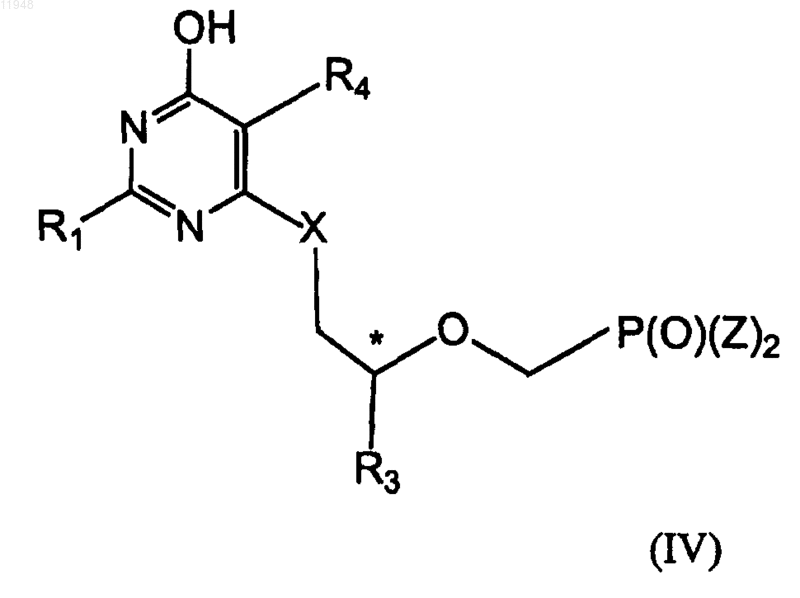
с амином NH(R5)2,
где * означает хиральный атом углерода;
R1 - амино;
R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5,
-CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN, -CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5,
-CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2,
-CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2, -OH, -OR10, -NH2, -NR11R12 ,-SH, -SR5, -SCN, -N3, -CN,
-CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5, -NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
X - О или S;
Z - гидроксигруппа, эфир или амид;
R5 - H, C1-C8 алкил или защитная группа.
23. Способ по п.22, отличающийся тем, что осуществляют гидролиз одной или обеих Z-групп с получением соединения с формулой (I), где по меньшей мере одна Z-группа является гидроксильной группой.
24. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (Iaa):
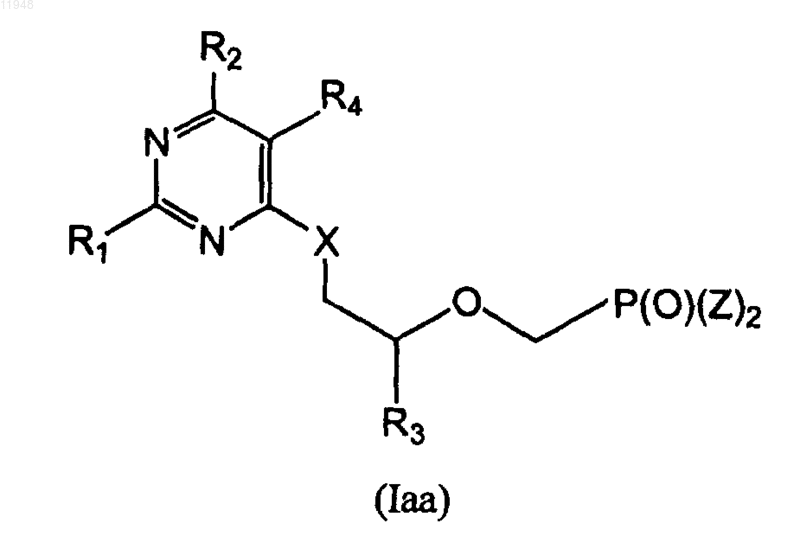
где R2 формулы (I) - это -N(R5)2,
заключающийся в том, что осуществляют взаимодействие соединения (IV)
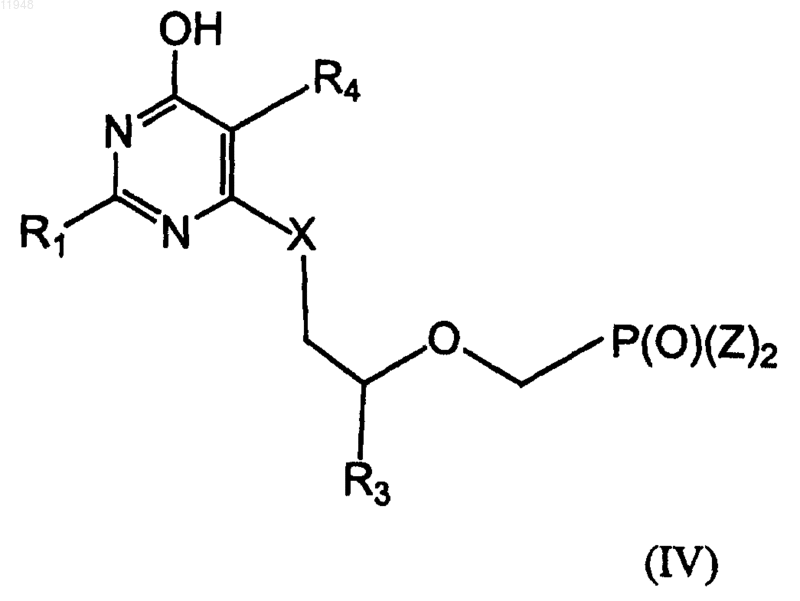
с амином HN(R5)2,
где R1 - амино;
R3 - независимо H, метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5,
-CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN, -CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5,
-CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2,
-CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2, -ОН, -OR10, -NH2, -NR11R12, -SH, -SR5, -SCN, -N3, -CN,
-CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5, -NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и CH2N3;
X - О или S;
Z - гидроксигруппа, эфир или амид;
R5 - H, C1-C8 алкил или защитная группа.
25. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (V)
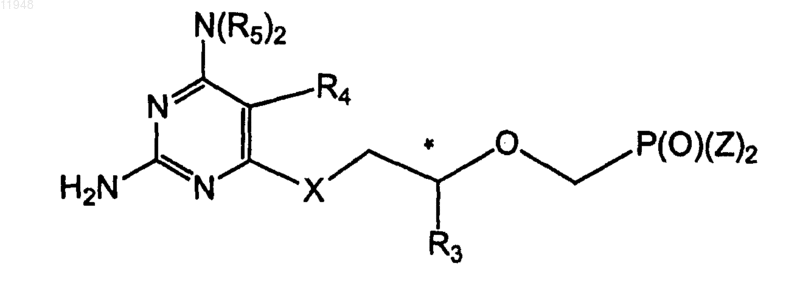
где R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4-C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил, -CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5, -CH2OC(O)CH(R7)(NHR8),
-CH2NR9R10, -CH2CN, -CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5, -CH2CH2OC(O)CH(R7)(NHR8),
-CH2SH, -C(O)H, -CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2, -CH2CH2OCH2PO3H2, -CH2OPO3H2,
-OCH2PO3H2, -ОН, -OR10, -NH2, -NR11R12 -SH, -SR5, -SCN, -N3, -CN, -CONR11R12, -CH2CONR11R12, -NHOH,
-NHOR5, -NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
R5 - H, C1-C8 алкил или защитная группа;
X - О или S;
Z - гидроксигруппа, эфир или амид; и
* означает хиральный атом углерода, заключающийся в том, что осуществляют взаимодействие соединения (IVa):
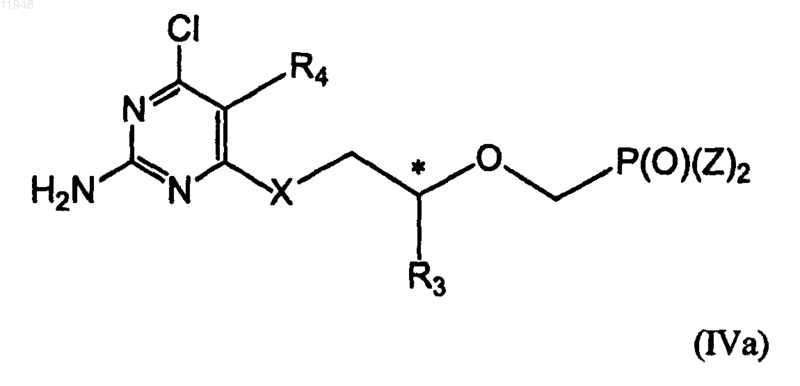
с NH(R5)2 в безводном растворителе, гидроксиде щелочного металла или карбонате щелочного металла в водном растворе.
26. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (V)
где R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил; R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил,
-CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5, -CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN,
-CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5, -CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H,
-CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2, -CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2,
-OH, -OR10, -NH2, -NR11R12, -SH, -SR5, -SCN, -N3, -CN, -CONR11R12, -CH2CONR11R12, -NHOH, -NHOR5,
-NO, -NO2, -NHNR11R12, 2-галовинил, 3,3,3-трифторпропенил, C1-C10 2-(алкоксикарбонил)этенил, 2-карбоксиэтенил, 2-цианоэтенил, дифторметил, трифторметил, 2,2,2-трифторэтил, 2-галоэтил и -CH2N3;
R5 - H, C1-C8 алкил или защитная группа;
X - О или S;
Z - гидроксигруппа, эфир или амид;
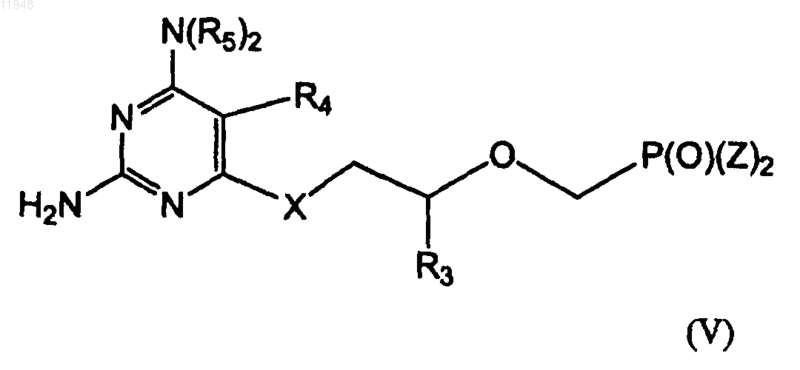
заключающийся в том, что осуществляют взаимодействие соединения (IVa)
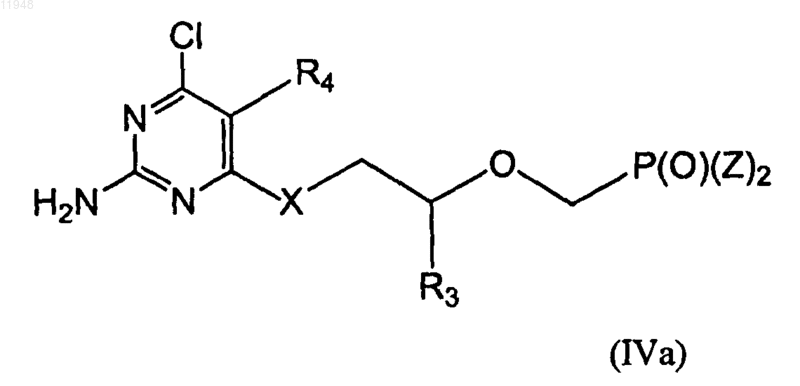
с N(R5)2 в безводном растворителе, гидроксиде щелочного металла шыш карбонате щелочного металла в водном растворе.
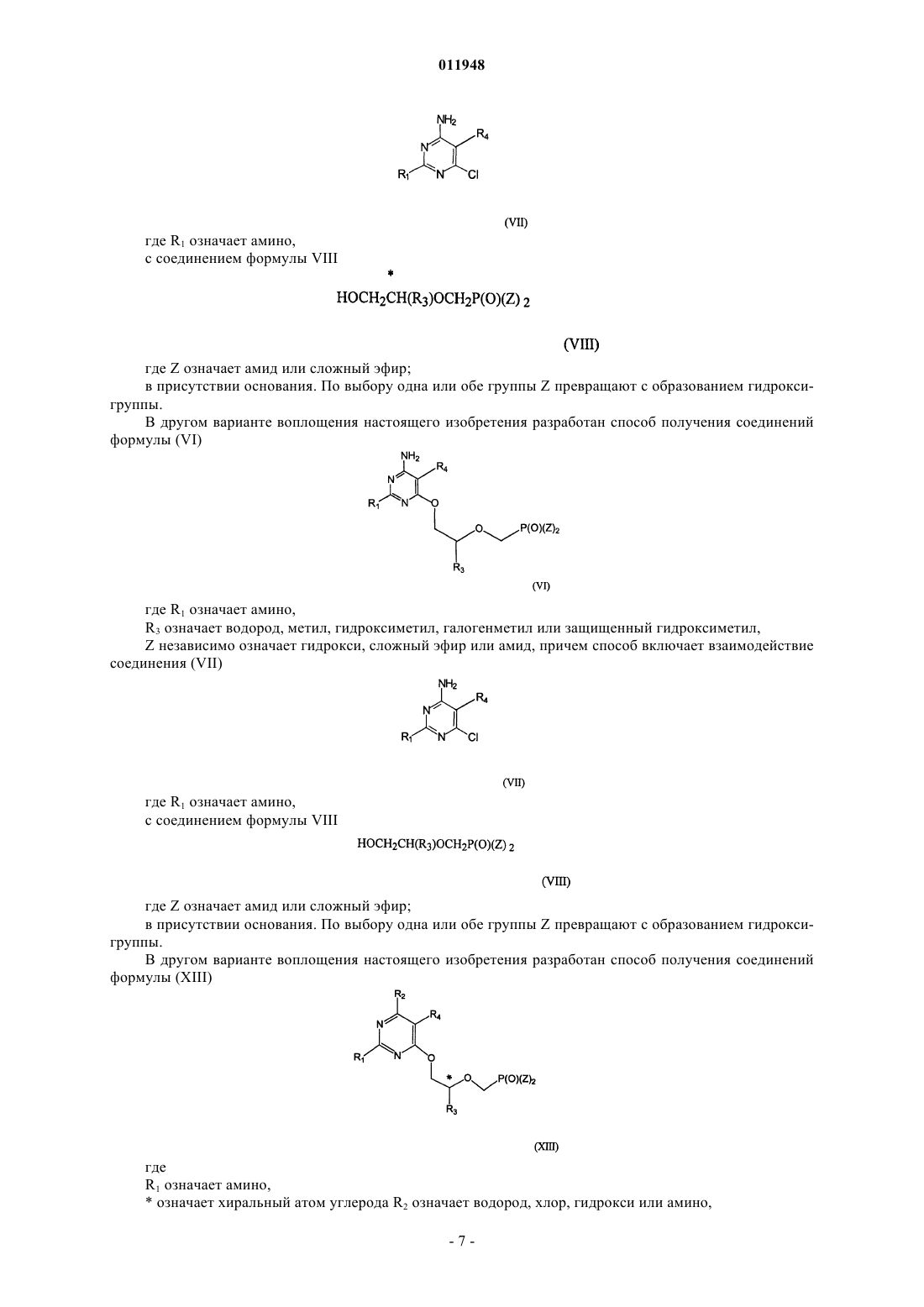
27. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (VI)
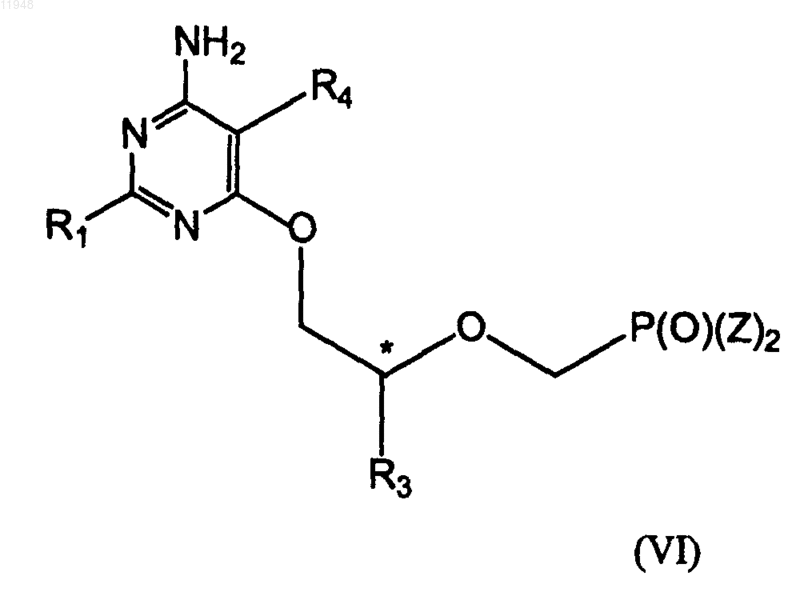
заключающийся в том, что осуществляют взаимодействие соединения формулы (VII)
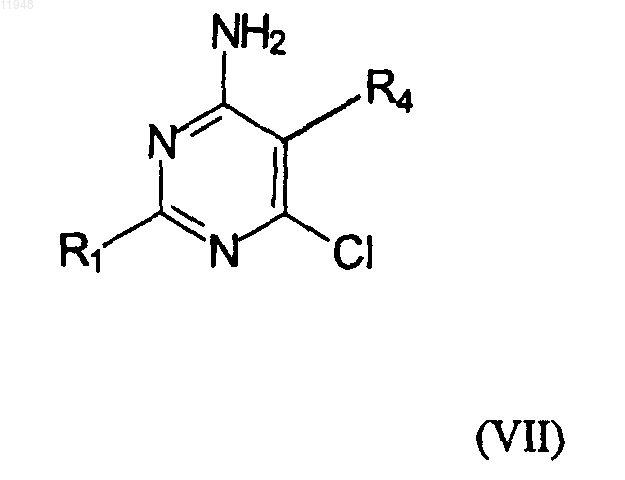
с соединением формулы (VIII)
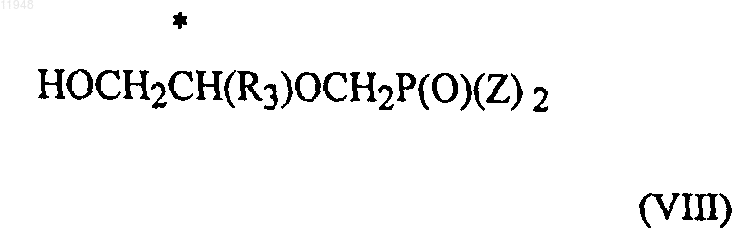
в присутствии основания,
где * означает хиральный атом углерода;
R1 - амино;
R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - алкил, алкенил, алкинил, арилалкил, циклоалкил, формил (-СНО), азидо (-N3), амино (-NH2), алкиламино (-NR2), гидроксил (-ОН), алкокси (-OR), циано (-CN), карбоксил (-СООН), амидо
(-NRC(O)R) или алкоксикарбонилалкил; и Z - независимо гидроксигруппа, эфир или амид.
28. Способ по п.27, отличающийся тем, что осуществляют гидролиз Z-группы с получением соединения с формулой (VI), где по меньшей мере одна Z-группа является гидроксильной группой.
29. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (VI)
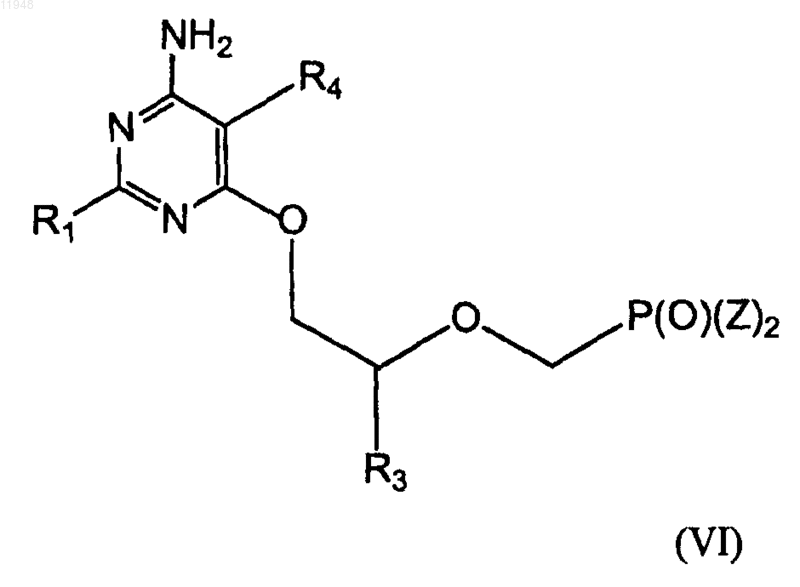
заключающийся в том, что осуществляют взаимодействие соединения формулы (VII)
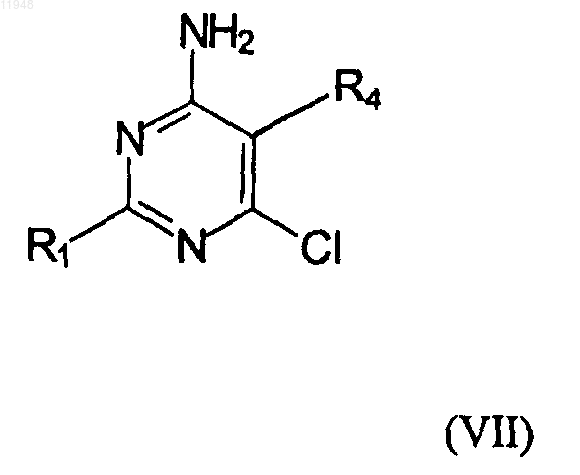
с соединением, имеющим формулу (VIII)
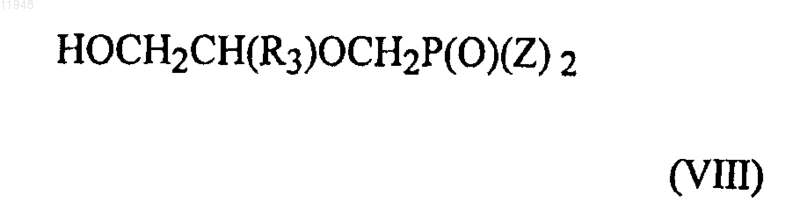
в присутствии основания,
где R1 - амино;
R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - алкил, алкенил, алкинил, арилалкил, циклоалкил, формил (-СНО), азидо (-N3), амино (-NH2), алкиламино (-NR2), гидроксил (-ОН), алкокси (-OR), циано (-CN), карбоксил (-СООН), амидо
(-NRC(O)R) или алкоксикарбонилалкил; и
Z - независимо оксигруппа, эфир или амид.
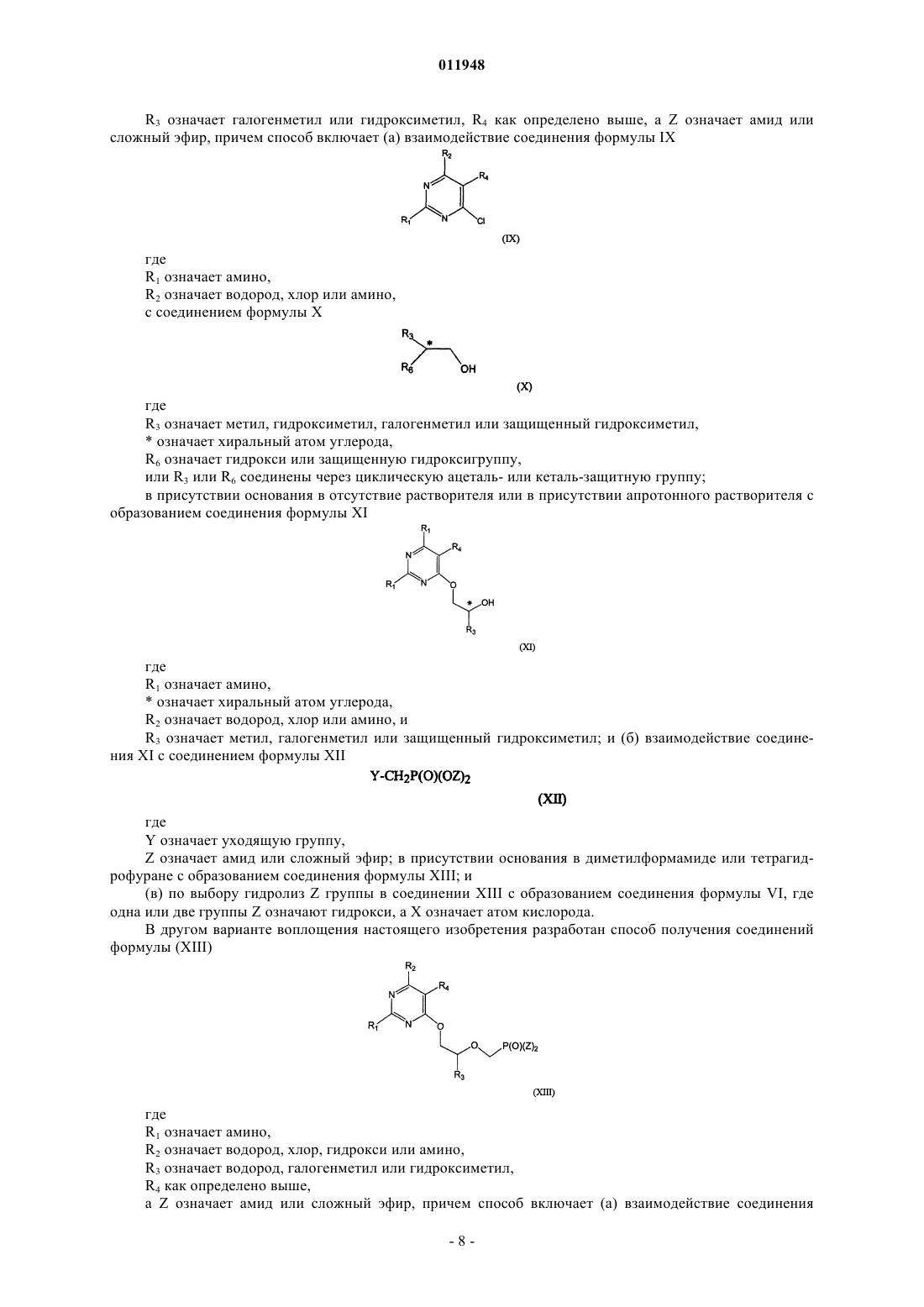
30. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (XIII)
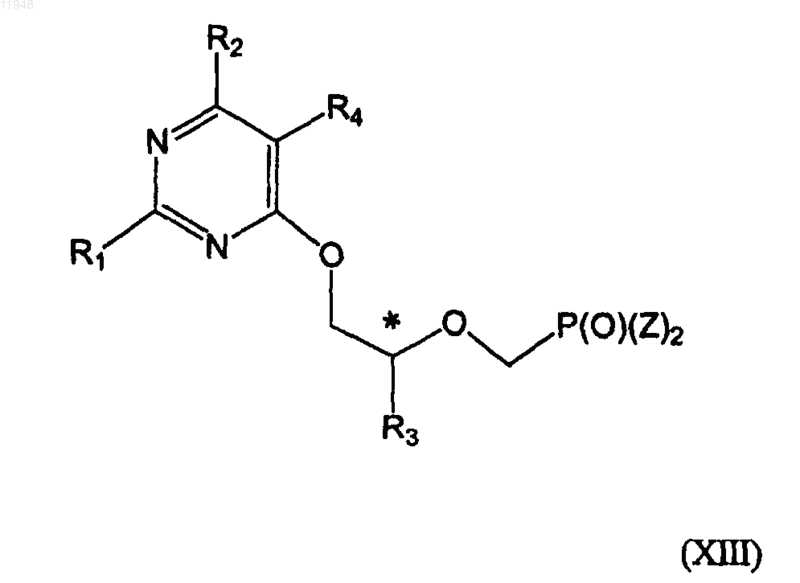
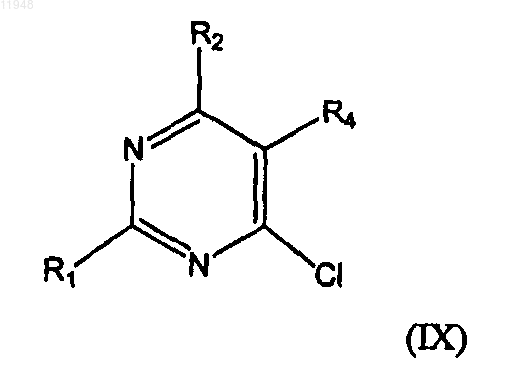
заключающийся в том, что осуществляют взаимодействие соединения формулы (IX)
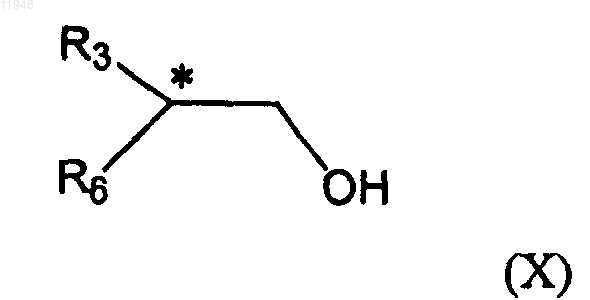
с соединением формулы (X)
в присутствии основания без растворителя или в присутствии апротонного растворителя с образованием соединения формулы (XI)
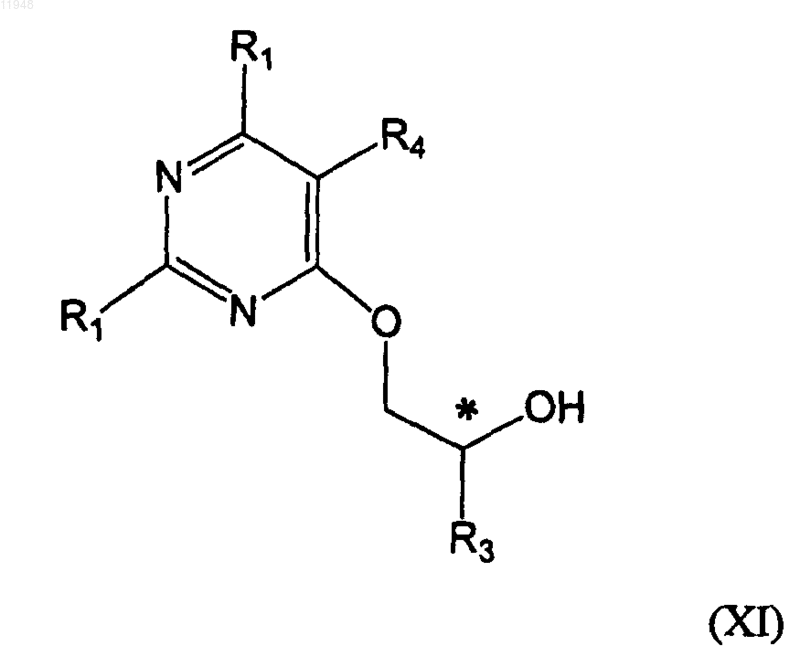
и его взаимодействия с соединением формулы (XII)
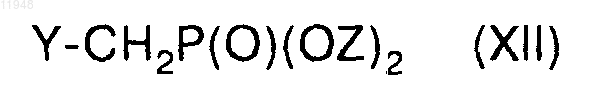
в присутствии основания в диметилформамиде или тетрагидрофуране с получением целевого соединения формулы XIII,
где * означает хиральный атом углерода; и
R1 - амино;
R2 - H, хлор, гидрокси или амино;
R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - алкил, алкенил, алкинил, арилалкил, циклоалкил, формил (-СНО), азидо (-N3), амино (-NH2), алкиламино (-NR2), гидроксил (-ОН), алкокси (-OR), циано (-CN), карбоксил (-СООН), амидо (-NRC(O)R) или алкоксикарбонилалкил;
R6 - гидрокси или защищенная гидрокси; или R3 и R6 соединяются по протекторной группе циклического ацеталя или кеталя;
Y - уходящая группа и
Z - гидроксигруппа, эфир или амид.
31. Способ по п.30, отличающийся тем, что осуществляют гидролиз Z-группы с получением соединения формулы (XIII), где по меньшей мере одна Z-группа является гидроксильной группой.
32. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (XIII)
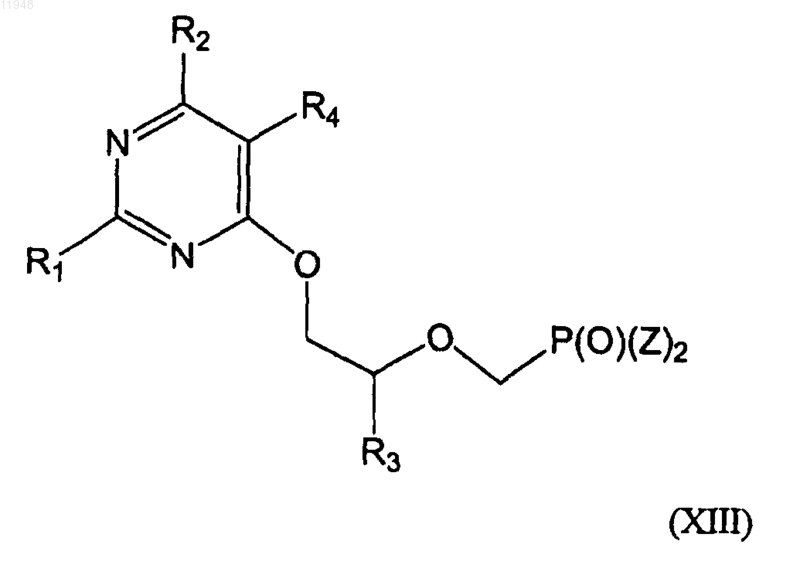
заключающийся в том, что осуществляют взаимодействие соединения формулы (IX)
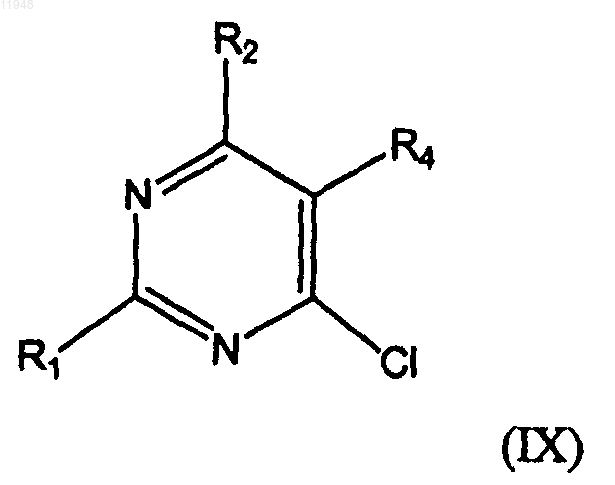
с соединением формулы (X):

в присутствии основания без растворителя или в присутствии апротонного растворителя с получением соединения формулы (XI)
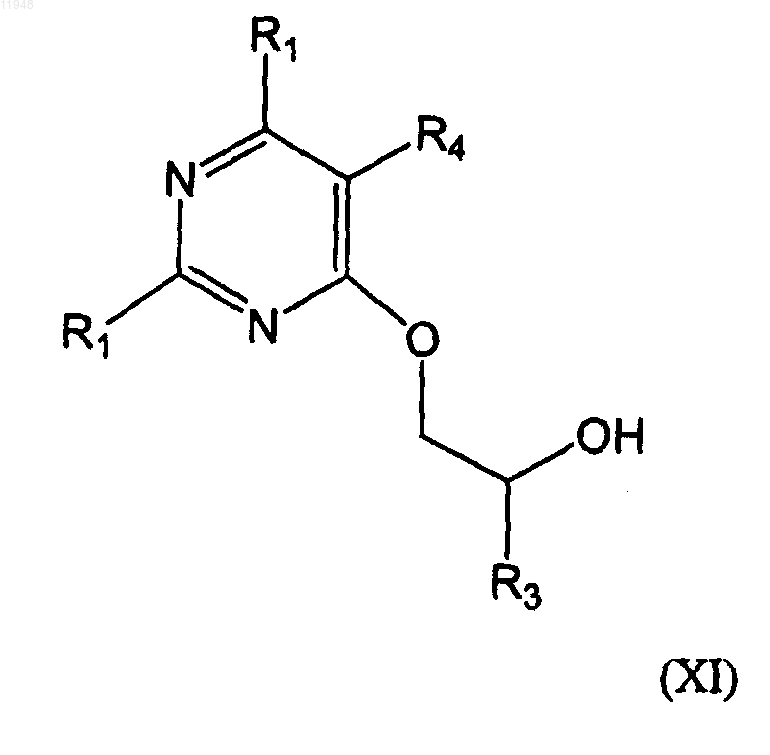
и его взаимодействия с соединением формулы (XII)
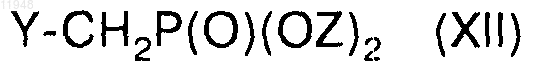
в присутствии основания в диметилформамиде или тетрагидрофуране с образованием целевого соединения формулы (XIII),
где R1 - амино
R2 - H, хлор, гидрокси или амино;
R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;
R4 - алкил, алкенил, алкинил, арилалкил, циклоалкил, формил (-СНО), азидо (-N3), амино (-NH2), алкиламино (-NR2), гидроксил (-ОН), алкокси (-OR), циано (-CN), карбоксил (-СООН), амидо
(-NRC(O)R) или алкоксикарбонилалкил;
R6 - гидрокси или защищенная гидроксигруппа; или
R3 и R6 объединены в протективный циклический ацеталь или кеталь;
Y - уходящая группа и
Z - гидроксигруппа, эфир или амид.
33. Способ лечения вирусной инфекции, заключающийся в введении пациенту терапевтически эффективного количества противовирусного агента, отличающийся тем, что в качестве последнего используют фосфонатзамещенное пиримидиновое соединение по п.1.
34. Способ по п.33, отличающийся тем, что вирус представляет собой ДНК-вирус.
35. Способ по п.34, отличающийся тем, что вирус представляет собой ретровирус или гепаднавирус.
Текст
011948 Область техники, к которой относится изобретение Данное изобретение относится к области органической химии, медицине и фармацевтики, а именно к соединениям, обладающим антивирусной активностью, прежде всего, в отношении РНК или ДНК вирусов. Сведения о предшествующем уровне техники Ациклические аналоги нуклеотидов, содержащие фосфонатные группы, описаны, например, в патентах США 4659825, 4808716, 4724233, 5142051, 5302585, 5208221, 5352786, 5356886, в европейских патентах EP269947, 481214, 630381, 369409, 454427, 468119, 434450, 618214 и 398231, а также в заявках WO 95/07920, WO 94/03467 и WO 96/33200. В описания этих патентов включены соединения, в которых фосфонатная группа присоединена к определенному пуриновому или пиримидиновому основанию, в основном в положении 1 или 9 пиримидинового или пуринового основания соответствнно, например, через 2-(метокси)пропильную группу, 2-(метокси)этильную группу, 2-метокси-3-гидроксипропильную группу или 2-метокси-3-фторпропильную группу, причем такие производные пурина или пиримидина известны под следующими названиями PMP, PME, HPMP и FPMP соответственно. Такие соединения обладают антивирусной и цитостатической активностью.Daluge et al. (доклады на конференции 34th Interscience Conference on Antimicrobial Agents and Chemotherapy, Oct. 4-7, 1994) описывают производные карбовира, в которых пурин замещен в положении 6 циклопропиламино-, N-циклопропил-N-метиламино- или N-азиридиновой группами.Holy et al. ("ACS Symp. Ser." 401:57-71 (1989 и Holy (Kem. Ind. 38(10):457-462( 1989 описывают антивирусную активность определенных N6-замещенных аналогов нуклеотидов. Другие аналоги фосфонатзамещенных пиримидинов описаны Holy et al. (Collect. Czech. Chem.Commun. 64:242-256(1999, Eger et al. (J. Med. Chem. 37:3057-3061 (1994, Wormstadt et al. (J. Heterocyclic Chem. 37:1187-1191 (2000 и Franchetti et al. (NucleosidesNucleotides 14(3-5):607-610 (1995. B последних трех публикациях описана фосфонатсодержащая боковая цепь, присоединенная через 6-Nзаместитель 2,4-дизамещенного пиримидина. Сущность изобретения Целью изобретения является разработка новых соединений, обладающих антивирусной активностью, прежде всего, в отношении РНК или ДНК вирусов, таких как вирус иммунодефицита человека ВИЧ (HIV), папилломавирус HPV или вирус герпеса HSV. Дополнительной целью изобретения является синтез соединений, пригодных для получения ионообменных смол или хиральных сред. Другой целью изобретения являеются промежуточные соединения и способы получения таких соединений. Эти и другие цели изобретения более подробно описаны в описании изобретения. Новые соединения по настоящему изобретению формулы (Iaa) где R1 означает амино,R2 означает водород, галоген, гидрокси или защищенную гидроксигруппу,R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 выбирают из следующих групп:R5- независимо H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -амино кислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома; и их соли и сольваты. Согласно изобретению, новые предложенные соединения имеют формулу (I)-2 011948 гдеозначает хиральный атом углерода; иR2 - H, гало, гидроксигруппа или защищенная гидроксигруппа;R3 - независимо означает метил, гидроксиметил, галометил или защищенный гидроксиметил;R4 выбирают из следующих групп:R5- независимо H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -амино кислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома; и их соли и сольваты. Типичные соединения по изобретению включают соединения с формулой (laa), в которых R1 и R2 =NH2, R3 = H, X = О, a R4 = CH3, CN, CH=O, CO2H. Объектом настоящего изобретения является способ получения соединений формулы (I), где R1, R2, R3, R4, X, Z, R5 иопределены выше, причем способ включает взаимодействие соединения формулы IIR1 и R4 определены выше,R2 означает водород, галоген, гидрокси или защищенную гидроксигруппу, аZ означает сложный эфир или амид, означает хиральный атом углерода,R3 означает метил, галогенметил или защищенный гидрокси, аY означает уходящую группу; в диполярном апротонном растворителе в присутствии основания с образованием соединения формулы I, где Z означает сложный эфир или амид; (б) по выбору превращение одной или обеих групп Z с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. Другим объектом настоящего изобретения является способ получения соединений формулы (laa), где R1, R2, R3, R4, X, Z и R5 определены выше, причем способ включает взаимодействие соединения формулы IIR1 и R4 определены выше,R2 означает водород, галоген, гидрокси или защищенную гидроксигруппу, аZ означает сложный эфир или амид,R3 означает водород, метил, галогенметил или защищенный гидрокси, аY означает уходящую группу; в диполярном апротонном растворителе в присутствии основания с образованием соединения формулы I, где Z означает сложный эфир или амид; (б) по выбору превращение одной или обеих групп Z с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (I), гдеR1 означает водород или метилсульфанил,R2 означает -N(R5)2,R3 независимо означает метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 означает, как определено выше и включает алкил, алкенил, алкинил, арилалкил, циклоалкил,формил (-СНО), азидо (-N3), амино (-NH2), алкиламино (-NR2), гидроксил (-ОН), алкокси (-OR), цианоR5- независимо означает H, C1-C8 алкил или защитную группу; аобозначает хиральный атом углерода; причем способ включает взаимодействие соединения формулы IV с амином N(R5)2. где R3 означает метил, галогенметил или защищенный гидроксиметил,X означает О или S, аZ означает амид или сложный эфир; По выбору одну или обе группы Z превращают с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (laa), гдеR1 означает водород или метилсульфанил,R2 означает -N(R5)2,R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 означает, как определено выше и включает алкил, алкенил, алкинил, арилалкил, циклоалкил,формил(-СНО), азидо(-N3), амино(-NH2), алкиламино(-NR2), гидроксил(-ОН), алкокси(-OR), циано(-CN),карбоксил(-СООН), амидо(-NRC(O)R) или алкоксикарбонилалкил;R5- независимо означает H, C1-C8 алкил или защитную группу; причем способ включает взаимодействие соединения формулы IV с амином N(R5)2. где R3 означает водород, метил, галогенметил или защищенный гидроксиметил,X означает О или S, аZ означает амид или сложный эфир. По выбору одну или обе группы Z превращают с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (V) где R3 означает метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R5 независимо означает водород, С 1-С 8 алкил или защитную группу,X означает кислород или серу,Z независимо означает гидрокси, сложный эфир или амид, означает хиральный атом углерода; причем способ включает взаимодействие соединения IVa с N(R5)2 в безводном растворителе, в присутствии гидроксида щелочного металла или карбоната щелочного металла и по выбору превращение Z в соединение формулы V, где одна или две группы Z означают гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (V)R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R5 независимо означает водород, С 1-С 8 алкил или защитную группу,X означает кислород или серу,Z независимо означает гидрокси, сложный эфир или амид, причем способ включает взаимодействие соединения IVa с N(R5)2 в безводном растворителе, в присутствии гидроксида щелочного металла или карбоната щелочного металла и по выбору превращение Z в соединение формулы V, где одна или две группы Z означают гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (VI)R1 означает амино,R3 означает метил, гидроксиметил, галогенметил или защищенный гидроксиметил,Z независимо означает гидрокси, сложный эфир или амид, означает хиральный атом углерода; причем способ включает взаимодействие соединения (VII) где Z означает амид или сложный эфир; в присутствии основания. По выбору одна или обе группы Z превращают с образованием гидроксигруппы. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (VI) где R1 означает амино,R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,Z независимо означает гидрокси, сложный эфир или амид, причем способ включает взаимодействие соединения (VII) где Z означает амид или сложный эфир; в присутствии основания. По выбору одна или обе группы Z превращают с образованием гидроксигруппы. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (XIII)R1 означает амино, означает хиральный атом углерода R2 означает водород, хлор, гидрокси или амино,-7 011948R3 означает галогенметил или гидроксиметил, R4 как определено выше, a Z означает амид или сложный эфир, причем способ включает (а) взаимодействие соединения формулы IXR3 означает метил, гидроксиметил, галогенметил или защищенный гидроксиметил, означает хиральный атом углерода,R6 означает гидрокси или защищенную гидроксигруппу,или R3 или R6 соединены через циклическую ацеталь- или кеталь-защитную группу; в присутствии основания в отсутствие растворителя или в присутствии апротонного растворителя с образованием соединения формулы XIR1 означает амино, означает хиральный атом углерода,R2 означает водород, хлор или амино, иR3 означает метил, галогенметил или защищенный гидроксиметил; и (б) взаимодействие соединения XI с соединением формулы XIIY означает уходящую группу,Z означает амид или сложный эфир; в присутствии основания в диметилформамиде или тетрагидрофуране с образованием соединения формулы XIII; и(в) по выбору гидролиз Z группы в соединении XIII с образованием соединения формулы VI, где одна или две группы Z означают гидрокси, a X означает атом кислорода. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (XIII)R1 означает амино,R2 означает водород, хлор, гидрокси или амино,R3 означает водород, галогенметил или гидроксиметил,R4 как определено выше,a Z означает амид или сложный эфир, причем способ включает (а) взаимодействие соединения где R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R6 означает гидрокси или защищенную гидроксигруппу, илиR3 или R6 соединены через циклическую ацеталь- или кеталь-защитную группу; в присутствии основания в отсутствие растворителя или в присутствии апротонного растворителя с образованием соединения формулы XIR3 означает водород, метил, галогенметил или защищенный гидроксиметил; и где Y означает уходящую группу,Z означает амид или сложный эфир; в присутствии основания в диметилформамиде или тетрагидрофуране с образованием соединения формулы XIII; и(в) по выбору гидролиз Z группы в соединении XIII с образованием соединения формулы VI, где одна или две группы Z означают гидрокси, a X означает атом кислорода. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (I), гдеR1 означает амино,R3 означает метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 как определено выше,X означает кислород,Z независимо означает гидрокси, сложный эфир или амид, иозначает хиральный атом углерода, причем способ включает (а) взаимодействие соединения формулы VI,где R1 означает амино,R2 означает водород, гидроксиметил, галогенметил или защищенный гидроксиметил,Z независимо означает сложный эфир, иозначает хиральный атом углерода, с галогеном в инертном растворителе с образованием соединения формулы I. По выбору одна или обе группы Z превращают в гидроксигируппу. Другие цели настоящего изобретения относятся к способу, включающему введение терапевтически эффективного количества соединения формулы I пациенту, нуждающемуся в таком лечении, включая инфекции HIV, HBV, HSV. Иллюстрирующие материалы После формулы изобретения представлена таблица, демонстрирующая антивирусную активность анализируемых соединений из примеров 1-9.-9 011948 Сведения, подтверждающие возможность осуществления изобретения Переменные заместители соединений по данному изобретению включают те переменные заместители, которые описаны в патенте США 5952375, столбцы 2-8, кроме тех для которых специально сделана оговорка. Дескрипторы подписей и надписей следует рассматривать и интерпретировать как взаимозаменяемые и эквивалентные. Следуя номенклатуре определенные подписи указывают число групп заместителя. Как принято здесь, исключая изменения в конкретном контексте, "алкил" значит разветвленные,нормальные или циклические насыщенные углеводороды и включает метил, этил, пропил, циклопропил,циклобутил, изопропил, H-, втор-, изо- и трет-бутил, пентил, изопентил, 1-метилбутил, 1-этилпропил,неопентил и t-пентил. Термины "замещенный алкил", "замещенный арил" и "замещенный арилалкил" означают алкил,арил и арилалкил, соответственно, в которых один или более атомов водорода, каждый независимо, замещены заместителем. Типичные заместители включают, но не ограничены, -X, -R, -О-, -OR, -SR, -S-,-NR2,-NR3, -CX3, -CN,- OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, -N3, NC(=O)R, -C(=O)R, -C(=O)NRR,-S(=O)2O-, -S(=O)2OH, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR, -S(=O)R, -OP(=O)O2RR, -P(=O)O2RR, -P(=O)NRR, -C(NR)NRR, где каждый X независимо является галогеном: F, Cl, Br или I; а каждый R - независимо -H, алкил, арил, гетероцикл, защитная группа или составляющая пролекарства. Алкиленовая, алкениленовая и алкиниленовая группы могут быть аналогично замещены. Термин "гетероцикл", как он используется здесь, включает в качестве примера, но не ограничения,те гетероциклы, которые описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry"J.Am.Chem.Soc. (1960) 82:5566. Примеры гетероциклов включают в качестве примера, но не ограничения, пиридил, дигидрориридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, сернокислый тетрагидротиофенил,пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил,пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6 Н-1,2,5-тиадиазинил,2 Н,6 Н-1,2,5-дитиадиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3 Н-индолил, 1 Н-индазолил, пиринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил,хиназолинил, циннолинил, птеридинил, 4 аН-карбазолил, карбазолил, -карболинил, фенантридинил, акридинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил,имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил,хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил. В качестве примера, но не ограничения, углерод, связывающий гетероциклы, присоединяется в положении 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола,в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Еще более типично, когда углерод, связывающий гетероциклы включает 2-пиридил, 3 пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6 пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3 пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил. В качестве примера, но не ограничения, азот, связывающий гетероциклы, присоединяется в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имдазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина,пиперазина, индола, индолина, 1 Н-индазола, в положении 2 изоиндола или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или -карболина. Еще более типично, когда азот, связывающий гетероциклы, включает 1-азиридил, 1-азетидил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил. Соединения с формулами I и Ia могут содержать ассиметрический атом углерода и, таким образом,могут существовать в виде чистых энантиомеров, смеси энантиомеров или рацематов. Настоящее изобретение включает в сферу рассмотрения все эти формы. Термины "R" и "S" конфигурация, используемые в данной работе, соответствуют определению, данному IUPAC 1974 Recommendations for Section E,Fundamental Stereochemistry, Pure. Appl.Chem.(1976) 45, 13-30. Термин "C1 до C10 алкил", как используется в данной работе, относится к прямым или разветвлен- 10011948 ным алкильным радикалам, содержащим от 1 до 10 атомов углерода, включая (но не ограничиваясь) метил, этил, изопропил, н-бутил, изобутил, втор-бутил, н-пентил, 1-метилбутил, 2,3-диметилбутил, 2 метилпентил, 2,2-диметилпропил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и т.п. Термин "алкенил",используемый в данной работе, относится к C2-C10 прямым или разветвленным углеродным цепям, которые содержат двойную углерод-углеродную связь, в том числе винил, аллил, пропенил и т.п., не ограничиваясь ими. Термин "алкинил", используемый в данной работе, относится к C2-C6 прямым или разветвленным углеродным цепям, которые содержат тройную углерод-углеродную связь, в том числе этинил,пропинил, бутинил и т.п., не ограничиваясь ими. Термин "алкокси", как используется здесь, относится к"галоген", как принято здесь, относится к Cl, Br, F или I. Термин "алкиламино", как принято здесь, относится к -NHR15, где R15 - C1-С 10-алкильная группа. Термин "диалкиламино", как принято здесь, относится к -NR16R17, где R16 и R17 независимо выбраны из C1-C10 алкилов или они вместе образуют цикл с участием или без участия гетероатома. Термин "боковая цепь любой природной аминокислоты", как принято в работе, относится к функциональной группе, присоединенной к -углероду любой природной аминокислоты, и включает, не ограничиваясь ими, метил, изопропил, оксиметил, бензил и т.п. Термин "аралкилC7-C12", как принято здесь, относится к замещенной арилметильной или 2-арилэтильной группе. Термин"арил", как принято здесь, относится к фенильной или нафтильной группе. Термин "гетероарил", как здесь принято, относится к гетероциклической группе, которая имеет сходную структуру и сходные свойства, при сравнении с арильной группой. Кроме того, гетероарил может содержать разные атомы и необязательно то же самое число атомов, пока он имеет то же самое число общих или валентных электронов при таком же расположении, как в случае арильной группы. Гетероарильные группы включают,но не ограничены ими, заместители, полученные путем вытеснения водорода из CH или CH2 групп в пирроле, пирролидине, имидазоле, пиридине, пиримидине, пиридазине, хинолине, пиперидине, морфолине, 1,3-диоксолане или 1,4-диоксане и т.п. Термин "гетероарилалкил", как принято в данной работе,относится к гетероциклической группе, связанной атомом углерода с C1-C6 алкилом. Термин "Nпротекторная группа", как принято здесь, относится к тем группам, которые должны защитить атомы азота от нежелательных реакций во время синтетических процессов, и включает, но не ограничивается ими, формил, ацетил, пивалоил, t-бутилоксикарбонильную (BOC), бензилоксикарбонильную (Cbz) или бензоильную группы или другие защищающие азот группы, известные специалистам.R3 - это, как правило, H или метил, но, возможно, гидроксиметил (обычно S-конфигурации, в основном, свободный (90% S и 10% R) от R-энантиомера) или галометил. Если R3 - это метил или галометил, углерод может быть в (2R)-конфигурации, в основном, свободным от (2S)-конфигурации. Галометил может быть, например, фторметилом. Как далее описано ниже, Z - любой эфир или амид, уже известный в связи с использованием с нуклеотид-фосфонатами. Когда Z является эфиром он имеет структуру OR7. R7 - это обычно H (т.е., Z является гидроксилом) в соединениях, имеющих антивирусную активность per se, хотя другие R7-эфирные группы, описанные ниже, пригодны для применения в качестве протекторных групп или в качестве профункциональных групп для осуществлений пролекарств.Z - эфир или амид, когда он нужен для того, чтобы защитить соединения по данному изобретению от нежелательных реакций, или когда целью является получить пролекарство соединения in vivo. B ином случае Z - это ОН. Эфиры или амиды полезны в качестве защитных интермедиатов в процессе синтеза соединений по данному изобретению, где Z = ОН. В этом воплощении выбор эфира или амида может не быть важным,завися от природы используемой реакции. Все, что необходимо, это чтобы заместитель Z не был удален на протяжении стадии синтеза, в которой он необходим, и если это не очевидно теоретически, его можно легко обнаружить путем элементарных экспериментов. Например, эфиры, в частности, используются для защиты гидрокси-групп фосфонатов от алкилирования. Когда Z служит в качестве функциональной группы пролекарства, эфир или амид удаляется in vivo из фосфоната. Подходящие эфиры или амидаты пролекарств выбирают на основании субстратной специфичности эстераз и/или карбоксипептидаз, предположительно присутствующих в клетке, где гидролиз предшественника является желательным. До тех пор пока специфичность этих ферментов неизвестна,будут проводить проверку множества аналогов нуклеотидов по данному изобретению, пока нужная субстратная специфичность не будет обнаружена. Это будет ясно на основании появления свободного фосфоната или антивирусной активности. Обычно выбирают соединения, которые (i) не гидролизуются или гидролизуются сравнительно медленно в верхней кишке, (ii) проницаемы для кишки и клетки и (iii) гидролизуются в цитоплазме клетки и/или в большом круге кровообращения. Фильтры из клеток отдельных тканей использовали для того, чтобы обнаружить предщественников, которые высвободились в органах,чувствительных к вирусным и микробным инфекциям направленного действия, например, в случае пе- 11011948 чени, предшественники лекарств подвергаются гидролизу в печени. Другие инфекции, например, CMV иHIV, выборочно подвергают воздействию предшественника, который гидролизуется, в основном, с одинаковой скоростью и, практически, в одинаковой степени во всех тканях. Известные методы анализа являются пригодными для этих целей, включая анализ стабильности в кишечном просвете, анализ клеточной проницаемости, стабильности печеночного гомогената и плазматической стабильности. Эти методы анализа используются для того, чтобы определить параметры биодоступности предшественников. Типичные примеры эфирных и амидных заместителей группы Z встречаются в WO95/07920,WO98/04569 и EP 481214 А 1. Каждый тип или вид эфира или амида, описанный в этих публикациях (а в таких публикациях изложение ведется в порядке значимости), может быть использован в качестве Zгруппы в данной работе. Обычно обе Z-группы являются гидроксилами или обе - эфир и/или амид, т.е. обычно 2 или ни одной Z-группы представлены гидроксилом. В общем, когда обе Z-группы не являются ОН, одна Z - это амид и одна - эфир. Амиды с природными аминокислотами и эфиры с фенилом являютя типичными. Свободные карбоксилы аминокислоты Z-групп могут быть этерифицированы С 1-С 8-алкилом. В общем, Z - это гидроксигруппа в соединениях, которые используются прямо для антивирусных целей, т.е. такие соединения используют без каких-либо требований к гидролизу in vivo эфира или амида. Защитные (протекторные) группы для гидроксила включают ацетали, кетали или C1-C8-алкил. Типичная протекторная группа для аминогруппы - это тритил. Известны другие подходящие группы (Greenet al., "Protecting Groups in Organic Senthesis", 2nd Ed.1991, pp. 10-142 and 309-405). Использование Соединения по изобретению полезны для воздействия на вирусы или в качестве промежуточных соединений при получении таких соединений. Типичные вирусные инфекции, которые подвергались лечению или протестировались в отношении чувствительности к соединениям по этому изобретению,включают инфекции, вызываемые ДНК- или РНК-вирусами, такими как вирусы герпеса (CMV, HSV 1,HSV 2, EBV, вирус ветряной оспы [VZV], вирус герпеса быка типа 1, вирус герпеса лошади типа 1,HHV-6, вирусы папилломы (HPV типы 1-55, в том числе карциногенный HPV), флавивирусы (включая вирус желтой лихорадки, вирус лихорадки африканских свиней и вирус японского энцефалита), тогавирусы( в том числе вирус венесуэльского лошадиного энцефаломиелита), вирусы гриппа (типы A-C), ретровирусы (HIV-1, HIV-2, HTLV-I, HTLV-II, SIV, FeLV, FIV, MoMSV), аденовирусы (типы 1-8), поксвирусы (вирус коровьей оспы), энтеровирусы (полиовирус типов 1-3, вирус герпангины, вирус гепатита А иECHO вирус), вирусы гастроэнтерита (вирусы Norwalk, ротавирусы), хантавирусы (вирус Hantaan), полиомавирус, паповавирус, риновирусы, вирус парагриппа типов 1-4, вирус бешенства, респираторносинцитиальный вирус (RSV), вирусы гепатитов A,B,C и E и т.п. Соединения по изобретению включают соединения, эффективные для применения в отношении вирусов герпеса, гепадна-вирусов и HIV, в которых R1 = NH2, R2 = NH2 или ОН, X = О и R3 = H или метил. Другие антивирусные активности соединений по изобретению определяют с помощью рутинных методов, используя определение ингибирования ферментов, методы культивирования тканей, модельные системы на животных и т.п., которые хорошо известны специалистам. Новые соединения по изобретению также полезны per se или в качестве интермедиатов при получении полимеров, имеющих широкий диапазон диагностического, терапевтического и промышленного использования. Соединения по этому изобретению пригодны в качестве интермедиатов для получения сред для аффинной абсорбции, связывающих группы заместителя, имеющие свойства, необходимые для адсорбции веществ из неочищенных смесей. Они готовятся и используются, как другие ионообменные среды,содержащие те же заместители, например, фосфонат или амино. Например, фосфонатная группа соединений, представленных здесь, ковалентно связана с нерастворимым матриксом, и свободные амино заместители R1 на гетероциклическом основании служат в качестве ионообменных площадок. Иначе, аминогруппа гетероциклического основания связывается с матриксом, и свободная фосфонатная группа затем оказывается полезной при хроматографической адсорбции положительно заряженных молекул. Другие иммобилизованные воплощениям соединений в данной работе полезны для очистки белков, например, ферментов, с которыми соединения поданному изобретению могут связываться, например, транспортные белки (смотри Cihlar, выше). Соответствующие методы включения соединений по данному изобретению в нерастворимые матриксы, такие как полимерные смолы, должны быть очевидны для специалиста. Приводимые здесь соединения могут быть иммобилизованы с помощью ковалентно связанных амино- или гидроксигрупп пиримидина с нерастворимым матриксом. Аналогично, соединения по этому изобретению включаются в нерастворимые смолы путем связывания гидроксила фосфонатной группы или гидроксиметила R3-группы с матриксом или смолой, используя ковалентные связывающие агенты, известные ранее. Соответствующие методы связывания описаны у Cihlar (выше). Соединения по изобретению применимы также в качестве поперечных мостиков или спейсеров(распорок) при получении матриксов для связывания по сродству (что противоположно их функциони- 12011948 рованию в качестве аффинного компонента per se, как отмечалось в предыдущем абзацах). Представленные здесь соединения содержат многообразие функциональных групп, которые очень удобны в качестве сайтов для поперечной сшивки требуемых веществ. Принято связывать по сродству такие реагенты, как гормоны, петиды, антитела, ферменты, лекарства и т.п. с нерастворимыми субстратами. Эти нерастворяемые реагенты служат, известным образом, чтобы адсорбировать вещества из коммерческих препаратов, диагностических образцов и других неочищенных смесей. Аналогично, иммобилизованные ферменты используются для того, чтобы совершать каталитические превращения с легко осуществляемым отделением фермента от продукта. В некоторых воплощениях необязательно, чтобы соединения по изобретению были пришиты к нерастворимым материалам. Например, они могут быть использованы для связывания анализируемых веществ с детектируемыми группами при приготовлении растворимых диагностических реагентов. Методы для поперечного сшивания с использованием групп-заместителей, представленных в соединениях по изобретению, хорошо известны специалистам. Например, фосфоновая кислота используется, чтобы получать эфиры со спиртами или амиды с аминами. Аналогично, пригодными являются амино,гало, гидрокси и другие реакционные площадки, находящиеся на пиримидине. Конечно, там, где необходимо, будет применяться защита реакционных групп во время сборки реагента с поперечными связями. В общем, созданные соединения применяют, пришивая их через фосфоновую кислоту к гидрокси- или аминогруппам присоединяемого партнера, и ковалентно связанными с другим участником связывания через другой заместитель соединения по изобретению. Например, первый участник связывания, такой как стероидный гормон, через эфирную связь присоединяется к фосфоновой кислоте по настоящему изобретению и потом этот конъюгат поперечными связями через гидроксиметил R3 пришивается к цианоген-бромид-актифированной Сефарозе, посредством чего получают иммобилизованный стероид. Другие химизмы для конъюгации хорошо известны. Смотри, например, Maggio, "Enzyme-lmmunoassay" (CRC,1988, pp.71-135) и ссылки, которые приводятся там. Фармацевтические составы Соединения по настоящему изобретению, их физиологически приемлемые соли и сольваты (далее в тексте названные активными компонентами) используют при получении составов для введения любым способом, соответствующим состоянию, которое подвергается лечению. Соединения и составы предпочтительно должны быть стерильными. Активные компоненты включают в фармацевтические составы. Составы для использования в ветеринарии и в медицине содержат по крайней мере один активный компонент, как описано выше, в смеси с одним или более приемлемыми носителями и по выбору с другими терапевтическими компонентами."Приемлемый" носитель (носители) означает, что он совместим с другими компонентами состава и не оказывает отрицательного действия на реципиента. Обычно составы представлены в форме однократной дозы и могут быть получены любым методом,известным в области фармацевтики. В основном, составы готовят при равномерном и тщательном перемешивании активного компонента с жидкими носителями или с тонко измельченными твердыми носителями или и с теми и другими, а затем при необходимости формуют в продукт. Составы по настоящему изобретению, пригодные для перорального введения, могут быть представлены в виде дискретных форм, таких как капсулы, крахмальные облатки или таблетки, каждая из которых содержит предварительно определенное количество активного компонента в виде порошка или гранул, раствора или суспензии в водной жидкости или неводной жидкости, в виде жидкой эмульсии типа масло-в-воде или эмульсии типа вода-в-масле. Активный компонент может быть также представлен в виде болюса (шарика), электуария или пасты. Для лечения инфекций внешних глазных тканей или других внешних тканей, например, рта и кожи,составы предпочтительно наносят в виде мази или крема для наружного применения, содержащих активный компонент (компоненты) в количестве, например, от 0,075 до 20% мас./мас. (включая активный компонент (компоненты) в диапазоне от 0,1% до 20% с приращением по 0,1% мас./мас. таким как 0,6% мас./мас. 0,7% мас./мас. и т.д.), обычно от 0,2 до 15% мас./мас. и наиболее предпочтительно от 0,5 до 10% мас./мас. Если составом является мазь, то активные компоненты можно использовать в смеси с парафиновой или смешиваемой с водой основой мази. В другом варианте активные компоненты можно включать в крем с основой типа масло-в-воде. При необходимости водная фаза основы крема может включать, например, по крайней мере 30% мас./мас. многоатомного спирта, то есть спирта, содержащего две или более гидроксильных групп, такого как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин или полиэтиленгликоль (включая ПЭГ 400) или их смеси. Составы для наружного применения могут при необходимости включать соединение, которое повышает впитывание или проникновение активного компонента через кожу или другие поверхности, на которые оказывается действие. Примеры таких усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги. Масляная фаза эмульсий по изобретению может быть составлена из известных ингредиентов известным способом. Эта фаза может содержать только эмульгатор или смесь, по крайней мере, одного эмульгатора с жиром или маслом или с ними двумя: жиром и маслом. Гидрофильный эмульгатор может- 13011948 быть включен вместе с липофильным эмульгатором для того, чтобы действовать как стабилизатор. Стабилизаторы эмульсий, пригодные для использования в формуле по представленному изобретению, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурил-сульфат натрия. Подходящие масла и жиры включают эфиры одно- и двухосновных алкилов с прямой и разветвленной цепью, таких как диизоадипат, изоцетил стеарат, пропиленгликолевый диэфир жирных кислот кокоса, изопропил-миристат, децил олеат, изопропил-пальмитат,бутил-стеарат или 2-этилгексил пальмитат. Они могут быть использованы по одному или в комбинации,в зависимости от требуемых свойств. Альтернативно, можно использовать липиды с высокой точкой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла. Лекарственные препараты, пригодные для местного применения на глаза, включают также глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, особенно водном растворителе для активного ингредиента. Активный ингредиент обычно присутствует в таких препаратах в концентрации от 0,01 до 20% по весу. Составы, пригодные для введения в нос и в которых носителем является твердое вещество, включают порошок грубого помола с размером частиц в диапазоне от 20 до 500 мкм (включая частицы размером в диапазоне от 20 до 500 мкм с приращением в 5 мкм, таким как 30 мкм, 35 мкм и т.д.), который вводят путем быстрой ингалиции через носовой ход из контейнера с порошком. Подходящие составы, содержащие жидкий носитель, для введения в виде, например, назального спрея или назальных капель,включают водные или масляные растворы активного компонента. Составы, пригодные для аэрозольного введения, можно получить с использованием известных методов и такие составы могут быть доставлены в смеси с другими терапевтическими агентами, такими как пентамидин для лечения пневмоцитозной пневмонии. Составы, пригодные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, составов в виде пены или спрея, содержащие кроме активного компонента соответствующие носители, известные в данной области техники. Составы, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферные вещества, бактериостатические агенты и растворимые вещества, которые придают составу изотонические свойства, аналогичные крови реципиента, нуждающегося в лечении, и водные или неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть представлены в виде контейнеров с однократной или многократной дозой, например, запаянные ампулы или флаконы; могут храниться в замороженном (лиофилизированном) виде, и перед использованием которых требуется только добавить стерильный жидкий носитель, например, воду для инъекций. Растворы и суспензии для инъекций для немедленного введения можно приготовить из стерильных порошков, гранул и таблеток, описанных выше. Препочтительными составами с однократной дозой являются составы, содержащие суточную дозу или суточную поддозу, как описано выше, или соответствующую часть активного компонента. Настоящее изобретение относится также к ветеринарным композициям, включающим по крайней мере один активный компонент, как определено выше, в смеси с ветеринарным носителем. Ветеринарными носителями являются материалы для введения композиции, которые могут быть твердыми, жидкими или газообразными и которые в любом случае считаются инертными или приемлемыми в ветеринарии и совместимы с активным компонентом. Такие ветеринарные композиции можно вводить пероральным, парентеральным или любым другим требуемым способом. Описанные в настоящем изобретении соединения по выбору используют в фармацевтических композициях с контролируемым высвобождением активного компонента, содержащих одно или более активных соединений, причем в такой композиции контролируется и регулируется высвобождение активного компонента, чтобы обеспечить менее частую дозировку или улучшить фармакокинетические или токсические свойства данного соединения. В основном соединения вводят с использованием систем с контролируемым высвобождением, таких как имплантат, описанный в заявке WO 92/14450 или патенте США 5098443, или матрицы, описанные в патентах США 4740365 или 5141752. Подходящим является множество других известных систем. Терапевтическое введение Пригодные способы введения включают пероральный, ректальный, назальный, местный (включая глазной, буккальный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, введение в стекловидное тело, внутривенный, интрадермальный, интратекальный и эпидуральный способы). Предпочтительный способ введения зависит от состояния пациента, токсичности соединения и участка инфекции, а также других факторов, известных врачам-клиницистам. Требуемое количество активного компонента (как описано выше) в каждом случае выше упомянутых терапевтических показаний зависит от ряда факторов, включающих тяжесть состояния, подвергающегося лечению, инфицирующего агента, профилактические цели или лечение острой инфекции, участок инфекции или патологического процесса и другие факторы на усмотрение лечащего терапевта или ветеринара. Однако, в основном подходящая доза, определенная врачом-клиницистом, находится в диапазоне доз, известных для аналогичных метоксифосфонатов (см. выше), причем учитывается различие в ак- 14011948 тивности, определенной при испытаниях in vitro, в основном от 0,1 до 250 мг/кг массы тела реципиента на дозу (включая активный компонент (компоненты) в диапазоне от 0,1 мг до 400 мг/кг/доза с приращением в 0,5 мг/кг/доза, например, 2,5 мг/кг/доза, 3,0 мг/кг/доза, 3,5 мг/кг/доза и т.п.), в типичном случае в диапазоне от 0,5 до 50 мг/кг/доза и наиболее предпочтительно в диапазоне от 1 до 300 мг/кг/доза. Требуемую дозу вводят через соответствующие интервалы в форме однократных доз, обычно вводят инициирующую, относительно более высокую дозу, а затем более низкие поддерживающие дозы,вводимые менее часто. Соединения можно также вводить с профилактической целью, например, в определенный период до инфекции приблизительно от 1 до 7 дней. Опухоли или новообразования полиомавирусов (HPV) и поражения герпесом в большинстве случаев лечат местным способом, или локальной инъекцией, или гелями, мазями и т.п. для наружного применения. Соединения по настоящему изобретению по выбору используют в комбинации с другими терапевтическими агентами для лечения или профилактики инфекций или состояний, упомянутых выше. Примеры таких дополнительных терапевтических агентов включают агенты, эффективные для лечения или профилактики вирусных инфекций. Такие агенты включают, без ограничения перечисленным, NRTI, 3'азидо-3'-дезокситимидин (зидовудин, AZT), 2'-дезокси-3'-тиацитидин (3 ТС), 2',3'-дидезокси-2',3'дидегидротимидин (D4T), карбовир (карбоциклический 2',3'-дидезокси-2',3'-дидегидрогуанозин), абакавир (ABC), 2',3'-дидезоксиинозин (ddl), диданозин, 2',3'-дидезоксицитидин(ddc,зальцитабин),3'-азидо-2,3 дидезоксиуридин, (Е)-5-(2-бромвинил)-2'-дезоксиуридин (BVDU), 2-хлор-2'-дезоксиаденозин, 2 дезоксикоформицин, 5-фторурацил, 5-фторуридин, 5-фтор-2'-дезоксиуридин, 5-трифторметил-2'-дезоксиуридин, 6-азауридин, 5-фтороротовая кислота, метотрексат, триацетилуридин, 1 -(2'-дезокси-2'-фтор 1D-арабинозил)-5-иодцитидин (FIAC), тетрагидроимидазо(4,5,1-jk)-(1,4)-бензодиазепин-2(1H)-тион(TIBO) или другие ненуклеозидные ингибиторы обратной транскриптазы (например, невирапин, делавиридин, эфавирены, дапаривин и т.п.), ингибиторы протеаз, (например, саквинавир, индинавир, ритоновир, ампренавир и т.п.), 2'-нециклический ГМФ, 6-метоксипуринарабинозид (ара-M), 2'-O-валерат 6 метоксипуринарабинозида, цитозинарабинозид (ара-С), ациклические нуклеозиды, такие как ацикловир,валацикловир, пенцикловир, фамцикловир, ганцикловир, ациклические аналоги нуклеотидов, такие как(тринатрия фосфоноформиат). Способы синтеза Соединения формулы I синтезируют алкилированием соответствующего 6-гидроксипиримидинового основания диалкиловым эфиром 2-хлорэтоксиметилфосфоновой кислоты (или его аналогами, содержащими другие группы R3) в присутствии NaH, Cs2CO3 или DBU (1,8-диазабицикло[5.4.0]ундец-7-ена) в диполярном апротонном растворителе, обычно ДМФ, по выбору с последующим удалением защитных групп, например, с помощью бромтриметилсилана и последующего гидролиза. Образование продукта формулы I сопровождается образованием различного количества соответствующегоN1-изомера, то есть 2,4-дизамещенного 1-[2-(фосфонометокси)этил]пиримидин-6-она. Последний можно удалить хроматографическим методом в виде нейтрального диэфира перед стадией обработки бромтриметилсиланом. Другой способ получения соединений формулы I включает превращение 2-замещенных производных 4-хлор-6-[2-(фосфонометокси)этокси]пиримидина (и его R3-аналогов) при взаимодействии с первичными или вторичными аминами в безводных растворителях (например, этаноле), в присутствии гидроксида щелочного металла или карбоната щелочного металла в воде. Эту реакцию можно проводить в присутствии катализатора, например, 1,3,5-триазола, имидазола или предпочтительно в присутствииDABCO (диазабициклоокстана). Затем по выбору удаляют защитные группы, например, обработкой бромтриметилсиланом и гидролизом. Соединения формулы I можно также получить при взаимодействии 2,4-замещенных 6-галогенпиримидинов с натрий алкоксидом диалкилового эфира 2-гидроксиэтилфосфоновой кислоты (или его аналогами, содержащими другие группы R3), и по выбору с последующим удалением защитных групп. Преимущество этой методики заключается в образовании только требуемого О-6-изомера. Выбор подходящего метода синтеза зависит от имеющегося в наличии гетероциклического производного пиримидина, используемого в качестве исходного соединения. Соединения формулы I можно также получить при взаимодействии 2,4-дизамещенных 6-(2 гидроксиалкил)пиримидинов с диалкиловым эфиром п-толуолсульфонилоксиметилфосфоновой кислоты или диалкил бромометилфосфонатом в присутствии NaH. Исходные материалы получают обработкой соответствующего 6-хлорпиримидина защищенным или незащищенным диолом в присутствии основания. Соединения формулы I, кроме того, можно получить замещением в ряде положений пиримидинового кольца. Таким образом, 5-галогенпроизводные можно получить при взаимодействии галогена или с помощью галоген-анионнообменных реакций.- 15011948 Группы Z в амидах или эфирах превращают в гидроксильные группы с помощью гидролиза. Моноэфиры легко получить из диэфира или смеси ди- и моноэфиров с помощью обработки азидом лития или натрия в ДМФ (см. статью A.Holy, "Synthesis 1998), 381-385 (1998. Все цитируемые документы включены в данное описание в качестве ссылок. Настоящее изобретение более подробно описано в следующих примерах. Пример 1. 5-Аллил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин. 5-Аллил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин (0,66 г, 4 ммоль) совместно перегоняли с толуолом, а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 100C в течение 20 ч, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом,фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получитьN1- и О 6-изомеры в виде бесцветных пен (0,25 г, 16% каждого). О 6-Изомер 5-аллил-2,4-диамино-6-[2-(диизопропилфосфорилметокси)этокси]пиримидин, 0,2 г, 0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (113 мг, 75%),т.пл. 240-241C. Для C10H17N4O5P (304,2) рассчитали 39,48% С, 5,63% H, 18,42% N, 10,18% P; определили 39,16% С, 5,69% H, 18,19% N, 10,17% P. FAB-MS: 303 (M-H-) (25).1H ЯМР (DMSO-d6): 5,98 brs, 2H, и 5,92- 16011948 5-Бензил-2,4-диамино-6-оксипиримидин (0,86 г, 4 ммоль) совместно перегоняля с толуолом, а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 110C в течение 26 часов, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1-изомер (0,25 г, 14%) и 06-изомер (0,40 г, 32%). О 6-Изомер 5-бензил-2,4-диамино-6-[2-(диизопропилфосфорилметокси)этокси]пиримидин (0,22 г,0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (121 мг,68%),т.пл.241-242 С. Для C14H19N4O5P2/3H2O (366,3) рассчитали 45,31 % С, 5,66% H, 15,46% N; определили 45,64% С, 5,38% H, 15,28% N. FABMS: 355 (M-H+) (50).1H ЯМР (DMSO-d6): 5,98 m, 4 H, и 7,10 m,1H (аром-Н); 6,15 brs , 4 H (NH2); 4,30 m, 2 H, (H-1'); 3,74 m, 2 H, (Н-2); 3,62 s, 2 H,(H-1); 3,58 d, 2 H,J(P,CH)= 8,6 (P-CH2). 13C ЯМР (D2O): 168,05 (С-6); 163,70 (С-4); 160,70 (С-2); 139,95, 128,74, 2 С, 127,89,2 С, и 126,32 (аром-С); 90,38 (С-5); 70,66 d, J(P,C)= 8,8 (С-2'); 67,75 d, J(P,C)= 149,4 (P-C); 65,66 (C-1'); 27,50 (C-1). Пример 3. 5-Цианометил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин. 5-Цианометил-2,4-диамино-6-оксипиримидин (0,66 г, 4 ммоль) совместно перегоняля с толуолом, а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 110C в течение 10 ч, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1-изомер (0,25 г, 16%) и(0,19 г, 0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (123 мг,81%),т.пл.258-259 С, разл. Для C9H14N4O5P (303,2) рассчитали 35,65% С, 4,65% H, 23,10% N, 10,22% P; определили 35,21% С, 4,70% H, 22,65% N, 10,11% P.FABMS: 304 (MH+) (60). 1H ЯМР (DMSO-d6): 6,28 5-Этоксикарбонилметил-2,4-диамино-6-оксипиримидин( 1,70 г, 8 ммоль) совместно перегоняля с толуолом, а полученный осадок гомогенизировали с диметилформамидом (15 мл) и карбонатом цезия(3,4 г, 8,8 ммоль, 1,1 эк.), реакционную смесь нагревали при 100C в течение 20 ч, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1 изомер (0,50 г, 15%) и O6-изомер (0,44 г, 13%).O6-Изомер 5-этоксикарбонилметил-2,4-диамино-6-[2-(диизопропилфосфорилметокси)этокси]пиримидин (0,38 г, 1 ммоль), ацетонитрил (20 мл) и BrSiMe3 (2 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508(Н+-форма, 40 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 40 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Две основных поглощающих UV фракции выпаривали, осадки 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что приводило к получению обоих продуктов в виде белого порошка: 5-Этоксикарбонилметил-2,4-диамино-6-[2(фосфонометокси) этокси] пиримидин: элюирован 0,25 M AcOH, (130 мг, 34%),т.пл.199-200 С. Для C11H19N4O7P2H2O- 18011948 5-Метил-2,4-диамино-6-оксипиримидин (0,56 г, 4 ммоль) совместно перегоняли с толуолом, а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 110C в течение 25 ч, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1-изомер (0,39 г, 27%) и 06-изомер (0,61 г, 42%). О 6-Изомер 5-метил-2,4-диамино-6-[2-(диизопропилфосфорилметокси)этокси]пиримидин (0,18 г, 0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (81 мг, 57%),т.п.253-254 С. Для C8H15N4O5PH2O (296,2) рассчитали 32,44% С, 5,78% H, 18,91% N; определили 32,23% С, 5,86% H, 18,56% N. FABMS: 279 (MH+) (70).1 Н ЯМР (D2O+NaOD): 4,37 m, 2 H, (H-1'); 3,91 m, 2 H, (Н 2'); 3,58 d, 2 H, J(P,CH)= 8,4 (P-CH2); 1,84 s, 3 H (CH3). 13C ЯМР: 167,06 (С-6); 163,58 (С-4); 160,01 (С-2); 85,75 (С-5); 70,47 d, J(P,C)= 10,3 (С-2'); 68,96 d, J(P,C)= 148,9 (P-C); 65,42 (C-1'); 10,54 (CH3). Пример 6. 5-Фенил-2,4-диамино-6-[2-(фосфонометокси)этокси] пиримидин. 5-Фенил-2,4-диамино-6-оксипиримидин (0,81 г, 4 ммоль) совместно перегоняли с толуолом, а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 110C в течение 23 ч, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1-изомер (0,18 г, 10%) и 06-изомер (0,36 г, 21%). О 6-Изомер 5-фенил-2,4-диамино-6-[2-(диизопропилфосфорилметокси)этокси]пиримидин (0,21 г,0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (133 мг,75%), т.пл.230-231C. Для C13H17N4O5P3/2H2O (367,3) рассчитали 42,51% С, 5,49% H, 15,25% N, 8,43% P; определили 42,71% С, 5,50% H, 15,27% N, 8,50% P. FABMS: 341 (MH+) (40).1H ЯМР (DMSO-d6): 7,36 m,2 H и 7,25 m, 3 H (аром-Н); 6,35 brs, 2 H и 5,79 brs, 2 H (NH2); 4,27 m, 2 H,(H-1'); 3,65 m, 2 H (Н-2'); 3,48 d,- 19011948 2 H, J(P,CH)= 8,4 (P-CH2). Пример 7. 5-Циклопропил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин. 5-Циклопропил-2,4-диамино-6-оксипиримидин (0,66 г, 4 ммоль) совместно перегоняля с толуолом,а полученный осадок гомогенизировали с диметилформамидом (7 мл) и карбонатом цезия (0,65 г, 2 ммоль) и нагревали до 80C. Добавляли 2-[(диизопропоксифосфорил)метокси]этил тозилат (1,7 г, 4,4 ммоль, 1,1 эк.), реакционную смесь нагревали при 110C в течение 14 часов, выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок обрабатывали горячим хлороформом, фильтровали и фильтрат помещали в вакуум. Препаративная HPLC-хроматография позволяла получить N1-изомер(0,19 г, 0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получить неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-1 M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (125 мг,82%), т.пл.255-256 С. Для C10H17N4O5P (304,2) рассчитали 39,48% С, 5,63% H, 18,42% N, 10,18 P; определили 39,14% С, 5,63% H, 18,10% N, 10,23% P. FABMS: 305 (MH+) (95).1H ЯМР (D2O+NaOD): 4,38 m, 2 H(Реагент 5-циано-2,4-диамино-6-(2-оксиэтокси)пиримидин получали в две стадии из тетрацианоэтилена: (a) Middleton W.J., Engelhardt V.A.: J. Am. Chem. Soc. 1958,80,2788. (b) Middleton W.J., Engelhardt V.A.: J. Am. Chem. Soc. 1958,80,2829). К суспензии 5-циано-2,4-диамино-6-(2-оксиэтокси) пиримидина (2,4 г, 12 ммоль) в триэтиламине (8 мл) добавляли (диизопропоксифосфорил)метил тозилат (4,8 г,13,7 ммоль, 1,1 эк.) с последующим добавлением диметилформамида (20 мл) и NaH (60% дисп. в минеральном масле, 1,3 г). Реакционную смесь перемешивали при комнатной температуре в течение часа,выпаривали в вакууме и перегоняли совместно с толуолом и этанолом. Осадок хроматографировали на силикагеле. Фракции, элюированные 4% MeOH в CHCl3, давали 2 г (45%) 5-циано-2,4-диамино-6-[2- 20011948(диизопропоксифосфорилметокси)этокси] пиримидина. Это соединение (0,19 г, 0,5 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение ночи при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли концентрированный водный раствор аммония до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонкуDowex 508 (Н+-форма, 20 мл) и промывали водой. Элюирование 2,5% водным раствором аммония и выпаривание в вакууме позволяли получать неочищенный продукт в виде соли аммония. Этот осадок в минимальном объеме воды наносили на колонку Dowex 1 X 2 (ацетат, 25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-3 М). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (120 мг, 86%), т.пл.294-295 С. Для C8H12N5O5PH2O (307,2) рассчитали 31,28% С, 4,59% H, 22,80% N, 10,08 P; определили 31,27% С, 4,67% H, 22,54% N, 9,94% P. FABMS: 290 (MH+) 5-Циано-2,4-диамино-6-[2-(диизопропоксифосфорилметокси) этокси]пиримидин (1,5 г, 4 ммоль) восстанавливали в воде (36 мл) и серной кислоте (6 мл) над 5% палладии на угле (0,25 г) при перемешивании в течение 20 часов при комнатной температуре. Смесь фильтровали через фильтр из Целита, а катализатор промывали горячей водой и горячим метанолом (100 мл каждого). Фильтрат нейтрализовали водным раствором NaOH растворители выпаривали. Осадок смешивали с горячим метанолом, соли отфильтровывали и получали смесь. Продукт подвергали очистке с помощью колоночной хроматографии на силикагеле (элюция 3% MeOH в CHCl3), получая 0,63 г (42%) 5-формил-2,4-диамино-6-[2(диизопропоксифосфорилметокси)этокси] пиримидина. Это соединение (0,36 г, 0,95 ммоль), ацетонитрил (10 мл) и BrSiMe3 (1 мл) перемешивали в течение 2,5 ч при комнатной температуре. После выпаривания в вакууме и совместной перегонки с ацетонитрилом осадок подвергали обработке водой и добавляли триэтиламин до щелочной реакции. Смесь выпаривали до получения сухого осадка, а осадок помещали на колонку Dowex 1 X 2 (ацетат,25 мл), которую затем промывали водой, используя градиент уксусной кислоты (0-2M). Основную поглощающую UV фракцию выпаривали, осадок 3 раза перегоняли с водой и подвергали кристаллизации из воды-этанола, что привело к получению белого вещества: (230 мг, 82%), т.пл.225-227 С. ДляChem. Chemother. 5:13-19, 1994; Popovic et al., Science 224:497-500,1984). Исходные штаммы вирусов ВИЧ-1(IIIB) и ВИЧ-2(ROD) получают из супернатантов вирус-инфицированных культуральных клеток МТ-4. Вирус ВИЧ-1BaL культивируют в первичных макрофагах М/М человека, супернатант которых собирают, фильтруют и хранят при -80C. Характеристики исходных штаммов вирусов, использованных в данном исследовании, определяют методом титрования в других первичных культуральных макрофагах М/М: 2,1108 РНК-ВИЧ геномов/мл (соответствует 35 нг антигена р 24) и 5000 инфекционных культуральнотканевых доз, 50% на мл (TCID50/мл). Выделение и характеристика клинических изолятов ВИЧ-1Van Laethem et al., AIDS 15:563-561, 2001). Клинический изолят ВИЧ-1/L1S получали от пациента, не прошедшего курс лечения NRTI (нуклеозидными ингибиторами обратной транскриптазы) или препара- 21011948 тами ациклических фосфонатов нуклеозидов (АНФ), и культивировали без селективной обработки какими-либо лекарственными средствами. Таким образом, изоляты не содержали заметных мутаций, которые характерны для пациентов, прошедших курс лечения NRTI или АНФ. Клинический изолят ВИЧ-1/L6S получали от пациента, прошедшего курс лечения лекарственными средствами, и изолят культивировали без селективной обработки какими-либо лекарственными средствами. Изолят, полученный от пациентов,прошедших курс лечения NRTI, характеризуется содержанием в обратной транскриптазе мутаций S68G,К 70 Т, V75I, F77L, F116Y и Q151M. Изолят ВИЧ-1/L6S/PMEA выделяли из клинического изолята ВИЧ 1/L6S после культивирования вируса с помощью 11 пассажей в присутствии возрастающих концентраций PMEA (адефовира). В результате кроме упомянутых мутаций получают характерную для PMEA мутацию K65R в обратной транскриптазе. Пример 11. Антивирусная активность соединений по изобретению. Антивирусная активность соединений, представленных здесь, определяли в соответствии с общепринятыми методами, описываемыми в следующих работах: J. Balzarini, et al. "9-(2-phosphonylmethoxyethyl)adenine (PMEA) effectively inhibits retrovirus replication in vitro and simian immunodeficiency virusAgents and Chemotherapy. 37:332-338,1993. Ряд разных 5-замещенных 2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидинов исследовали в отношении их ингибиторной активности против ряда ДНК- и ретровирусов (данные табл. 1 и 2). 5-Метил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин (пример 5) продемонстрировал умеренную анти-VZV активность. Однако несколько соединений оказали довольно заметное ингибиторное действие против ретровирусов мышей (MSV) и человека (HIV-1, HIV-2). 5-Циано- и 5-формилпроизводные (примеры 8 и 9, соответственно) оказывали ингибиторный эффект в отношении HIV при содержании 0,8 - 3,3 мкг/мл и против MSV при 2,7 - 6 мг/мл. Эти антивирусные способности были сравнимы с теми, которые были показаны для 5-незамещенного 2,4-диамино-6-[2-(фосфонометокси)этокси] пиримидина и для его 5-хлор-производного против HIV, но хуже в отношении MSV. Интересно, что 5 метил-производное оказалось весьма эффективным ингибитором не только для MSV (EC50: 0,04-0,06 мкг/мл), но также для HIV-1, HIV-2 (EC50: 0,065 мкг/мл). В противоположность 5-незамещенному соединению, чья анти-HIV активность была в 20 раз ниже, чем анти-MSV , активность, 5-метил-производное(пример 5) проявил сравнимую анти-HIV и анти-MSV активность. Как выяснилось, эта активность против HIV была более выражена, чем это наблюдалось для любого другого ациклического нуклеозидфосфонатного производного когда-либо тестируемого прежде. Поэтому может быть не исключено, что это соединение оказывает также чрезвычайно высокую анти-HIV активность у HIV-инфицированных лиц по сравнению с рекомендованными препаратами PMEA (адефовир) и (R)-PMPA (тенофовир). Это соединение, однако, оказалось также незначительно более цитостатическим в СЕМ клеточных культурах(CC50: 1,3-4,1 мкг/мл), чем PMEA (CC50: 11 мкг/мл) (табл. 2). 5-Циано (пример 8), 5-метил (пример 5) и 5-хлор-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин были также подвергнуты оценке в отношении антиретровирусной активности у MSVинфицированных новорожденных мышей NMRI в сравнении с PMEA и (R)-PMPA. Изученные производные распологались в порядке возрастания их антивирусной активности от 5-циано-производного (является наименее эффективным агентом), через 5-хлор-производное к 5-метил-производному (является наиболее эффективным агентом). 5-Циано-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин препятствовал индуцированному MSV образованию раковых клеток и связанную с этим гибель животного менее эффективно, чем PMEA. Также 5-хлор-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин был слабее, чем PMEA, как в отношении стимулирования индуцированного MSV образования опухоли, так и в отношении связанной с MSV гибелью животных (табл. 1). Однако 5-метил-производное было значительно эффективнее, чем PMEA и (R)-PMPA. При дозировке 50 и 20 мг/кг 5-метил-2,4-диамино-6-[2(фосфонометокси)этокси]пиримидин, PMEA и (R)-PMPA полностью предотвращали образование опухоли. При 5 мг/кг 90% мышей освобождались от образования опухоли в присутствии 5-метилпроизводного по сравнению с 70 и 10% в случае PMEA и (R)-PMPA. Однако при самой высокой дозе 5 метил-2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидина (50 мг/кг) наблюдали смерть животных (в среднем: 10,1 дней) у мышей свободных от рака, по-видимому, из-за токсичности препарата. Такое явление наблюдали также и с PMEA при 50 и 20 мг/кг, но не с (R)-PMPA при 50 мг/кг. Таким образом, в то время как 5-метил-производное было несколько более эффективным в предотвращении индуцированного MSV образования опухоли, чем (R)-PMPA, и значительно более эффективным, чем PMEA, оно было также несколько более токсичным. Поэтому оба препарата, видимо, имеют сравнимую антиретровирусную селективность in vivo.- 22011948 Таблица 1. Ингибиторная активность тестируемых соединений в отношении индуцированного MSV образования опухоли у новорожденных мышей NMRI Соединения вводили в/б в 1-, 2-, 3-, 4- и 5-й день. Вирус вводили в/б в 1-й день. Гибель животных происходила у ряда мышей из-за токсичности лекарства. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фосфонатзамещенные пиримидиновые соединения общей формулы (I) гдеозначает хиральный атом углерода; иR2 - H, гало, гидроксигруппа или защищенная гидроксигруппа;R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;R5 - H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -амино кислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;R11, R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома; их соли и сольваты. 2. Соединения по п.1, отличающиеся тем, что R1 и R2 - амино, a X - кислород. 3. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - метил, X - кислород и R3 имеет конфигурацию (R). 4. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - гидроксиметил, X- кислород R3 имеет конфигурацию (R). 5. Соединения по п.1, отличающиеся тем, что R1 и R2 - одновременно амино, a X - сера. 6. Соединения по п.1, отличающиеся тем, что R1 - амино, R2 - гидрокси, a X - кислород. 7. Соединения по п.1, отличающиеся тем, что они являются кристаллическими веществами. 8. Соединения по п.1, отличающиеся тем, что они представлены в значительной степени чистыми энантиомерами при хиральном атоме углерода. 9. Соединения по п.8, отличающиеся тем, что имеют конфигурацию (R). 10. Соединения по п.8, отличающиеся тем, что имеют конфигурацию (S). 11. Фосфонатзамещенные пиримидиновые соединения общей формулы (Iaa)R2 - H, гало, гидроксигруппа или защищенная гидроксигруппа;R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;R5- H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -амино кислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила или они вместе образуют цикл с участием или без участия гетероатома;R11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома; их соли и сольваты. 12. Соединения по п.11, отличающиеся тем, что R1 и R2 - амино, R3 - водород, a X - кислород. 13. Соединения по п.11, отличающиеся тем, что R1 и R2 - одновременно амино, R3 - водород, a X сера. 14. Соединения по п.11, отличающиеся тем, что R1 - амино, R2 - гидрокси, R3 - водород, a X - кислород. 15. Композиция, обладающая антивирусной активностью, содержащая фармацевтически приемлемый наполнитель и антивирусный агент, отличающаяся тем, что в качестве последнего она содержит фосфонатзамещенное пиримидиновое соединение по п.1. 16. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (I) заключающийся в том, что осуществляют взаимодействие соединения формулы (II) где Y - уходящая группа в диполярном апротонном растворителе в присутствии основания,гдеозначает хиральный атом углерода иR2 - H, гало, гидроксигруппа, защищенная гидроксигруппа или группа, имеющая формулу (Ia):R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил; R4 - C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил,- 25011948R5 - H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -амино кислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила, или они вместе образуют цикл с участием или без участия гетероатома; иR11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила или они вместе образуют цикл с участием или без участия гетероатома. 17. Способ по п.16, отличающийся тем, что осуществляют выделение конечного соединения формулы (I). 18. Способ по п.16, отличающийся тем, что Z представляет собой эфир или амид и при этом дополнительно гидролизуют одну или обе Z-группы с получением соединения формулы (I), где по меньшей мере одна Z-группа - гидроксильная группа. 19. Способ по п.16, отличающийся тем, что в конечном соединении формулы (I) Z представляет собой (OR4)2, a R4 - изопропил. 20. Способ по п.16, отличающийся тем, что в конечном соединении формулы (I) R3 - метил, a Y - птолуолсульфонилокси или бром. 21. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (Iaa) заключающийся в том, что осуществляют взаимодействие соединения формулы (II)Y-CH2CH(R3)O-CH2P(O)(Z)2,где Y - уходящая группа в диполярном апротонном растворителе в присутствии основания,где R1 - амино;R2 - H, гало, гидроксигруппа или защищенная гидроксигруппа или группа с формулой (Ia):R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;R5 - H, C1-C10 алкил или защитная группа;R7 - боковая цепь любой незащищенной или N-защищенной -аминокислоты;R9 и R10 - независимо выбирают из H, C1-C10 алкила, карбоксиалкила, аминоалкила и C2-C10 алкенила, или они вместе образуют цикл с участием или без участия гетероатома; иR11 R12 - независимо выбирают из H, C1-C10 алкила, C3-C8 циклоалкила, гетероарила и C7-C12 арилалкила, или они вместе образуют цикл с участием или без участия гетероатома. 22. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (I) где R2 - N(R5)2,заключающийся в том, что осуществляют взаимодействие соединения (IV) с амином NH(R5)2,гдеозначает хиральный атом углерода;R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;R5 - H, C1-C8 алкил или защитная группа. 23. Способ по п.22, отличающийся тем, что осуществляют гидролиз одной или обеих Z-групп с получением соединения с формулой (I), где по меньшей мере одна Z-группа является гидроксильной группой. 24. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (Iaa): где R2 формулы (I) - это -N(R5)2,заключающийся в том, что осуществляют взаимодействие соединения (IV)R3 - независимо H, метил, гидроксиметил, галометил или защищенный гидроксиметил;R5 - H, C1-C8 алкил или защитная группа. 25. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (V) где R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;R5 - H, C1-C8 алкил или защитная группа;Z - гидроксигруппа, эфир или амид; иозначает хиральный атом углерода, заключающийся в том, что осуществляют взаимодействие соединения (IVa): с NH(R5)2 в безводном растворителе, гидроксиде щелочного металла или карбонате щелочного металла в водном растворе. 26. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (V) где R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил; R4 - C1-C10 алкил, C2C10 алкенил, C2-C10 алкинил, C3-C8 циклоалкил, арил, гетероарил, C7-C14 арилалкил, гетероарилалкил,-CH2OH, -CH2OR5, -CH2C(O)R5, -CH2R6, -CH2OC(O)R5, -CH2OC(O)CH(R7)(NHR8), -CH2NR9R10, -CH2CN,-CO2R5, -CH2CH2OH, -CH2CH2OR5, -CH2CH2OC(O)R5, -CH2CH2OC(O)CH(R7)(NHR8), -CH2SH, -C(O)H,-CH2CO2R9, -CH2SO3H, -CH2CH2SO3H, -CH2CH2PO3H2, -CH2CH2OCH2PO3H2, -CH2OPO3H2, -OCH2PO3H2,- 28011948R5 - H, C1-C8 алкил или защитная группа;Z - гидроксигруппа, эфир или амид; заключающийся в том, что осуществляют взаимодействие соединения (IVa) с N(R5)2 в безводном растворителе, гидроксиде щелочного металла или карбонате щелочного металла в водном растворе. 27. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (VI) заключающийся в том, что осуществляют взаимодействие соединения формулы (VII) в присутствии основания,гдеозначает хиральный атом углерода;R3 - метил, гидроксиметил, галометил или защищенный гидроксиметил;(-NRC(O)R) или алкоксикарбонилалкил; и Z - независимо гидроксигруппа, эфир или амид. 28. Способ по п.27, отличающийся тем, что осуществляют гидролиз Z-группы с получением соединения с формулой (VI), где по меньшей мере одна Z-группа является гидроксильной группой. 29. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (VI)- 29011948 заключающийся в том, что осуществляют взаимодействие соединения формулы (VII)R3 - H, метил, гидроксиметил, галометил или защищенный гидроксиметил;Z - независимо оксигруппа, эфир или амид. 30. Способ получения фосфонатзамещенных пиримидиновых соединений формулы (XIII) заключающийся в том, что осуществляют взаимодействие соединения формулы (IX) в присутствии основания без растворителя или в присутствии апротонного растворителя с образованием соединения формулы (XI) и его взаимодействия с соединением формулы (XII) в присутствии основания в диметилформамиде или тетрагидрофуране с получением целевого соединения формулы XIII,гдеозначает хиральный атом углерода; и
МПК / Метки
МПК: C07F 9/6512, A61K 31/505, A61P 31/12
Метки: композиция, инфекции, вирусной, лечения, соединения, фармацевтическая, варианты, фосфонатзамещенные, основе, получения, пиримидиновые, способ
Код ссылки
<a href="https://eas.patents.su/30-11948-fosfonatzameshhennye-pirimidinovye-soedineniya-varianty-sposob-ih-polucheniya-varianty-farmacevticheskaya-kompoziciya-na-ih-osnove-i-sposob-lecheniya-virusnojj-infekcii.html" rel="bookmark" title="База патентов Евразийского Союза">Фосфонатзамещенные пиримидиновые соединения (варианты), способ их получения (варианты), фармацевтическая композиция на их основе и способ лечения вирусной инфекции</a>
Предыдущий патент: Лечебный и косметический состав для лечения аллергических и иммунологических кожных заболеваний
Следующий патент: Масляный суспензионный концентрат, жидкое гербицидное средство, способ их получения, их применение, и способ борьбы с нежелательным ростом растений на их основе
Случайный патент: Совместная подача мелочи для поддержания эффективной гидродинамики в реакторе