Азолидинонвинильные производные конденсированного бензола
Номер патента: 11807
Опубликовано: 30.06.2009
Авторы: Черч Деннис, Фаллоттон Таня, Рюккле Томас, Цзян Сюйляан, Геллар Паскаль
Формула / Реферат
1. Применение соединения формулы (I)
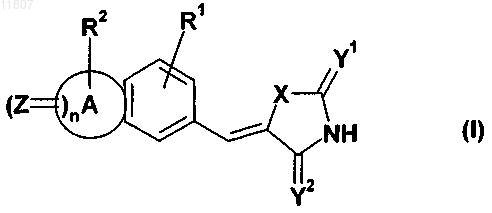
а также его геометрических изомеров, его оптически активных форм в виде энантиомеров, диастереомеров и его рацематов, а также его фармацевтически приемлемых солей и фармацевтически активных производных, где
А означает 5-8-членную гетероциклическую или карбоциклическую группу, где упомянутая карбоциклическая группа может быть сконденсирована с арилом, гетероарилом, циклоалкилом или гетероциклоалкилом;
X означает S, О или NH;
Y1 и Y2 означают независимо S, О или -NH;
Z означает S или О;
R1 означает водород, циангруппу, карбоксильную группу, ацил, (C1-С6)алкоксигруппу, галоген, гидроксил, ацилоксигруппу, (C1-С6)алкилкарбоксильную группу, (C1-С6)алкилацилоксигруппу, (C1-С6)алкилалкоксигруппу, алкоксикарбонил, (C1-С6)алкилалкоксикарбонил, аминокарбонил, (C1-С6)алкиламинокарбонил, ациламиногруппу, (C1-С6)алкилациламиногруппу, уреидогруппу, (C1-С6)алкилуреидогруппу, аминогруппу, (C1-С6)алкиламиногруппу, аммоний, сульфонилоксигруппу, (C1-С6)алкилсульфонилоксигруппу, сульфонил, (C1-С6)алкилсульфонил, сульфинил, (C1-С6)алкилсульфинил, сульфанил, (C1-С6)алкилсульфанил, сульфониламиногруппу, (C1-С6)алкилсульфониламиногруппу или карбамат;
R2 выбирают из группы, включающей или состоящей из водорода, галогена, ацила, аминогруппы, (C1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, (C1-С6)алкилкарбоксильной группы, (C1-С6)алкилацила, (C1-С6)алкилалкоксикарбонила, (C1-С6)алкиламинокарбонила, (C1-С6)алкилацилоксигруппы, (C1-С6)алкилациламиногруппы, (C1-С6)алкилуреидогруппы, (C1-С6)алкиламиногруппы, (C1-С6)алкилалкоксигруппы, (C1-С6)алкилсульфанила, (C1-С6)алкилсульфинила, (C1-С6)алкилсульфонила, (C1-С6)алкилсульфониламиноарила, арила, (С3-С8)циклоалкила или гетероциклоалкила, (C1-С6)алкиларила, (C2-С6)алкениларила, (С2-С6)алкиниларила, карбоксильной группы, циангруппы, гидроксильной группы, (C1-С6)алкоксигруппы, нитрогруппы, ациламиногруппы, уреидогруппы, (C1-С6)алкилкарбамата, сульфониламиногруппы, сульфанила или сульфонила;
n означает 0, 1 или 2;
для приготовления лекарственного средства для модуляции PI3-киназной активности, и предназначенного для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, отторжения трансплантата или легочных нарушений;
при условии, что следующие соединения исключаются:
где R1 означает низший алкил или аралкил и R2 означает водород или галоген.
2. Применение по п.1 для ингибирования PI3-киназной активности.
3. Применение соединения по п.1, когда упомянутые заболевания выбираются из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, воспаление легких, тромбоз или мозговую инфекцию/воспаление, как, например, менингит или энцефалит.
4. Применение соединения по п.1, когда упомянутые заболевания выбираются из группы, включающей болезнь Альцгеймера, хорею Гентингтона, травму центральной нервной системы, удар или ишемические состояния.
5. Применение соединения по п.1, когда упомянутые заболевания выбираются из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию мышечных клеток сердца, повышенное кровяное давление или сужение кровеносных сосудов.
6. Применение соединений по п.1, когда упомянутые заболевания выбираются из группы, включающей хроническое обструктивное заболевание легких, фиброз вследствие анафилактического шока, псориаз, аллергические заболевания, астму, удар или ишемические состояния, ишемию-реперфузию, агрегацию тромбоцитов/активацию, атрофию скелетных мышц/гипертрофию, рекруитмент лейкоцитов в раковой ткани, панкреатит, недостаточность многих органов, развитие кровеносных сосудов, инвазивное метастазирование, в частности меланому, саркому Карпоши, острые и хронические бактериальные и вирусные инфекции, сепсис, отторжение трансплантата после трансплантации, гломерулосклероз, гломерулонефрит, прогрессирующий фиброз почек, эндотелиальные и эпителиальные нарушения в легком или общее воспаление дыхательных путей.
7. Применение по любому из предшествующих пунктов, когда Y1 и Y2 оба означают кислород.
8. Применение по любому из предшествующих пунктов, когда n означает 1 или 2 и R1 и R2 оба означают водород.
9. Применение соединений по любому из предшествующих пунктов, когда X означает серу, Y1 и Y2 оба означают кислород, R1 и R2 являются такими, как указано выше, и n означает 0.
10. Применение по любому из предшествующих пунктов, когда тиазолидинонвинильное производное конденсированного бензола имеет формулу (Ia)
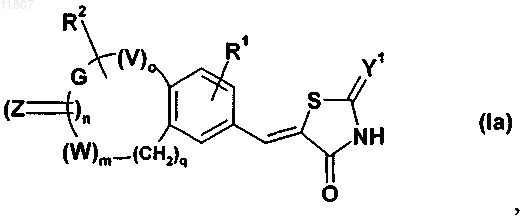
где Y1, R1, R2, Z и n являются такими, как определено выше;
V и W означают, каждый независимо друг от друга, кислород, серу или -NR3, где R3 означает водород или (C1-С6)алкил;
G означает (С1-С5)алкилен или (C1-С5)алкениленовую группу;
о и m означают, каждый независимо друг от друга, 0 или 1;
q означает целое число от 0 до 4.
11. Применение по п.10, когда тиазолидинонвинильное производное конденсированного бензола имеет фомулу (Ib)
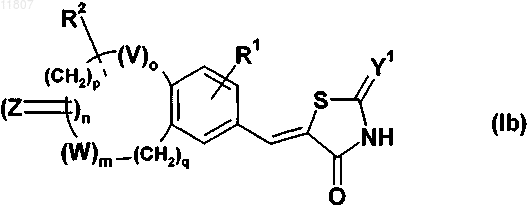
где Y1, R1, R2, V, Z, W, m, n, о, q являются такими, как определено выше, и р является целым числом от 1 до 4.
12. Применение по любому из пп.10 или 11, когда тиазолидинонвинильное производное конденсированного бензола имеет формулу (Ic)

где W, а также R1 и Y1 являются такими, как определено выше.
13. Применение по любому из пп.10 или 11, где тиазолидинонвинильное производное конденсированного бензола имеет формулу (Id)
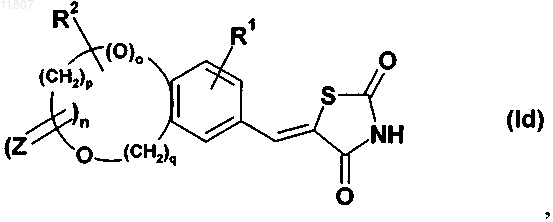
где R1, R2, Z и n являются такими, как определено выше;
о означает 0 или 1;
р означает целое число от 1 до 4 и
q означает целое число от 0 до 4.
14. Применение соединений по любому из пп.10, 11 или 13, где Z означает кислород, m означает 0, n означает 1, p означает 1 или 2, q означает 1, R1 и R2 являются каждый таким, как определено выше.
15. Применение соединений по любому из пп.10, 11 или 13, где m означает 1, n означает 0, р означает 1 или 2, q означает 0, R1 и R2 являются каждый таким, как определено выше.
16. Применение по любому из пп.10, 11 и 13-15, где m означает 0, n означает 1, р означает 1 или 2, q означает 0, R1 и R2 являются каждый таким, как определено в п.1.
17. Применение по любому из пп.10, 11 и 13-15, где R1 означает галоген шыш водород.
18. Применение по п.1, где упомянутой PI3-киназой является киназа PI3Kg.
19. Тиазолидинонвинильное производное конденсированного бензола формулы (IIa)

где А выбирается из группы, включающей диоксол, диоксин, дигидрофуран, (дигидро)фуранил, (дигидро)оксазинил, пиридинил, изооксазолил, оксазолил, (дигидро)нафталинил, пиримидинил, триазолил, имидазолил, пиразинил, тиазолидинил, тиадиазолил, оксадиазолил;
R2 выбирается из группы, включающей или состоящей из водорода, галогена, ацила, аминогруппы, (C1-С6)алкила, (C2-С6)алкенила, (C2-С6)алкинила, (С1-С6)алкилкарбоксильной группы, (C1-С6)алкилацила, (С1-С6)алкилалкоксикарбонила, (C1-С6)алкиламинокарбонила, (С1-С6)алкилацилоксигруппы, (C1-С6)алкилациламиногруппы, (С1-С6)алкилуреидогруппы, (C1-С6)алкилкарбамата, (C1-С6)алкиламиногруппы, (C1-С6)алкилалкоксигруппы, (C1-С6)алкилсульфанила, (С1-С6)алкилсульфинила, (C1-С6)алкилсульфонила, (С1-С6)алкилсульфониламиноарила, арила, (С3-С8)циклоалкила или гетероциклоалкила, (C1-С6)алкиларила, (С2-С6)алкениларила, (С2-С6)алкиниларила, карбоксильной группы, циангруппы, гидроксильной группы, (С1-С6)алкоксигруппы, нитрогруппы, ациламиногруппы, уреидогруппы, сульфониламиногруппы, сульфанила или сульфонила.
20. Тиазолидинонвинильное производное конденсированного бензола формулы (II)
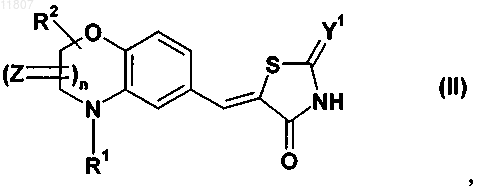
а также его геометрические изомеры, его оптически активные формы в виде энантиомеров, диастереомеры и его рацематы, а также их фармацевтически приемлемые соли и фармацевтически активные производные, где Z, Y1, R1, R2 являются такими, как установлено выше, n означает 0 или 1.
21. Тиазолидинонвинильное производное конденсированного бензола по п.20, где Y1 означает кислород.
22. Тиазолидинонвинильное производное конденсированного бензола по п.20 или 21, где R1 выбирается из группы, включающей (C1-С6)алкил, (C1-С6)алкиларил, арил, (С3-С8)циклоалкил или гетероциклоалкил, (C2-С6)алкениларил или (С2-С6)алкиниларил.
23. Тиазолидинонвинильное производное конденсированного бензола формулы (III)
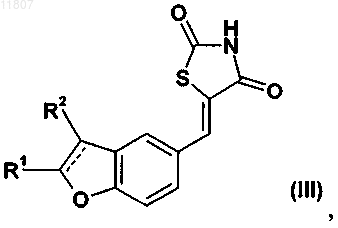
а также его геометрические изомеры, его оптически активные формы в виде энантиомеров, диастереомеры и его рацематы, а также их фармацевтически приемлемые соли и фармацевтически активные производные, где R1 и R2 являются такими, как установлено выше.
24. Тиазолидинонвинильное производное конденсированного бензола согласно любой из формул (IV), (V) и (VI)

где R1 выбирают из группы, включающей водород, галоген, циангруппу, (C1-С6)алкил, (C1-С6)алкоксигруппу, ацил, алкоксикарбонил, в то время как R2 является таким, как определено выше.
25. Тиазолидинонвинильное производное конденсированного бензола по любому из пп.19-24, выбранное из группы, включающей
5-(1,3-бензодиоксол-5-илметилен)-1,3-тиазолидин-2,4-дион,
5-(1,3-бензодиоксол-5-илметилен)-2-тиоксо-1,3-тиазолидин-4-он,
5-(2,3-дигидро-1,4-бензодиоксин-6-илметилен)-1,3-тиазолидин-2,4-дион,
5-(2,3-дигидро-1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион,
5-[(7-метокси-1,3-бензодиоксол-5-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-[(9,10-диоксо-9,10-дигидроантрацен-2-ил)метилен]-1,3-тиазолидин-2,4-дион,
(5-[(2,2-дифтор-1,3-бензодиоксол-5-ил)метилен]-1,3-тиазолидин-2,4-дион,
(5Z)-5-(1,3-дигидро-2-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион,
5-(1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион,
5-[(4-метил-3-оксо-3,4-дигидро-2Н-1,4-бензоксазин-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-(1,3-бензодиоксол-5-илметилен)-2-имино-1,3-тиазолидин-4-он,
5-хинолин-6-илметилентиазолидин-2,4-дион,
5-хинолин-6-илметилен-2-тиоксотиазолидин-4-он,
2-имино-5-хинолин-6-илметилентиазолидин-4-он,
5-(3-метилбензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион,
5-(4-фенилхиназолин-6-илметилен)тиазолидин-2,4-дион,
5-(4-диметиламинохиназолин-6-илметилен)тиазолидин-2,4-дион,
5-[(4-аминохиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-[(4-пиперидин-1-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-[(4-морфолин-4-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-{[4-(бензиламино)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-{[4-(диэтиламино)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-({4-[(пиридин-2-илметил)амино]хиназолин-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({4-[(пиридин-3-илметил)амино]хиназолин-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
этиловый эфир 1-{6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-ил}пиперидин-3-карбоновой кислоты,
этиловый эфир 1-{6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-ил}пиперидин-4-карбоновой кислоты,
трет-бутиловый эфир 1-{6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-ил}-L-пролина,
5-{[4-(4-метилпиперазин-1-ил)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-{[4-(4-пиримидин-2-илпиперазин-1-ил)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-({4-[4-(4-фторфенил)пиперидин-1-ил]хиназолин-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-{[4-(4-бензилпиперидин-1-ил)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-({4-[4-(2-фенилэтил)пиперидин-1-ил]хиназолин-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-{[4-(4-метилпиперидин-1-ил)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-{[4-(4-гидроксипиперидин-1-ил)хиназолин-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-4-карбоновую кислоту,
1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-3-карбоновую кислоту,
1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пирролидин-2-карбоновую кислоту,
5-(4-метиламинохиназолин-6-илметилен)тиазолидин-2,4-дион,
5-(4-метоксихиназолин-6-илметилен)тиазолидин-2,4-дион,
2-имино-5-(4-метиламинохиназолин-6-илметилен)тиазолидин-4-он,
2-имино-5-(4-пиперидинхиназолин-6-илметилен)тиазолидин-4-он,
2-имино-5-(4-диметиламинохиназолин-6-илметилен)тиазолидин-4-он,
5-(2-метил-2Н-бензотриазол-5-илметилен)тиазолидин-2,4-дион,
5-(3-метил-3Н-бензотриазол-5-илметилен)тиазолидин-2,4-дион,
5-(3-этил-3Н-бензимидазол-5-илметилен)тиазолидин-2,4-дион,
5-{[1-(4-фенилбутил)-1Н-бензимидазол-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-[(1-проп-2-ин-1-ил-1Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-[(1-{2-[4-(трифторметил)фенил]этил}-1Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-({1-[2-(4-гидроксифенил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
метиловый эфир 4-{6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1Н-бензимидазол-1-ил}циклогексанкарбоновой кислоты,
5-({1-[2-(5-метокси-1H-индол-3-ил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({1-[(1-метил-1Н-пиразол-4-ил)метил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({1-[2-(3,4-диметоксифенил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({1-[2-(4-феноксифенил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидиэ-2,4-дион,
5-({1-[4-(трифторметил)бензил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
4-{6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1Н-бензимидазол-1-ил}циклогексанкарбоновую кислоту,
5-[(1-изобутил-1Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-({1-[2-(1,3-бензодиоксол-4-ил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({1-[2-(2-феноксифенил)этил]-1Н-бензимидазол-6-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-{[1-(3,3-дифенилпропил)-1H-бензимидазол-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-{[1-(2-метоксибензил)-1Н-бензимидазол-6-ил]метилен }-1,3-тиазолидин-2,4-дион,
5-{[1-(3-фурилметил)-1Н-бензимидазол-6-ил]метилен}-1,3-тиазолидин-2,4-дион,
5-[(1-пропил-1Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион,
5-хиноксалин-6-илметилентиазолидин-2,4-дион,
5-хиноксалин-6-илметилен-2-тиоксотиазолидин-4-он,
2-имино-5-хиноксалин-6-илметилентиазолидин-4-он,
5-бензотиазол-6-илметилентиазолидин-2,4-дион,
5-(3-метилбензофуран-5-илметилен)тиазолидин-2,4-дион,.
5-(2-бром-3-метилбензофуран-5-илметилен)тиазолидин-2,4-дион,.
5-(3-бромбензофуран-5-илметилен)тиазолидин-2,4-дион,
этиловый эфир 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]акриловой кислоты,
3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]акриловая кислота,
5-[3-(3-оксо-3-пиперидин-1-илпропенил)бензофуран-5-илметилен]тиазолидин-2,4-дион,
метиловый эфир 1-(3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}проп-2-еноил)пролина,
метиловый эфир 1-(3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}проп-2-еноил)-D-пролина,
5-({3-[3-оксо-3-пирролидин-1-илпроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({3-[3-морфолин-4-ил-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
метиловый эфир 1-(3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}проп-2-еноил)-L-пролина,
N-циклогексил-3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}-N-метилакриламид,
3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}-N-этил-N-(2-гидроксиэтил)акриламид,
N-циклобутил-3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}акриламид,
5-({3-[3-азетидин-1-ил-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
5-({3-[3-(1,3-дигидро-2Н-изоиндол-2-ил)-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-гиазолидин-2,4-дион,
5-({3-[3-азепан-1-ил-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}-N-пиперидин-1-илакриламид,
3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}-N-(пиридин-3-илметил)акриламид,
N-циклогексил-3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}акриламид,
5-({3-[3-(4-метилпиперазин-1-ил)-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
N-циклогептил-3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}акриламид,
5-({3-[3-(2,5-дигидро-1Н-пиррол-1-ил)-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-ил}метилен)-1,3-тиазолидин-2,4-дион,
N-циклопентил-3-{5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-ил}акриламид,
этиловый эфир 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]пропионовой кислоты,
3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]пропионовая кислота,
5-[3-(3-оксо-3-пиперидин-1-илпропил)бензофуран-5-илметилен]тиазолидин-2,4-дион,
трет-бутиловый эфир 6-(2,4-диоксотиазолидин-5-илиденметил)-2,3-дигидробензо[1,4]оксазин-4-карбоновой кислоты,
5-(3,4-дигидро-2Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион,
5-(4-бензоил-3,4-дигидро-2Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион,
5-(4-ацетил-3,4-дигидро-2Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион,
трет-бутиловый эфир 6-(2,4-диоксотиазолидин-5-илиденметил)бензо[1,4]оксазин-4-карбоновой кислоты,
метиловый эфир [6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил]уксусной кислоты,
N-бензил-2-[6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3-дигидробензо[1,4]оксазин-4-ил]ацетамид,
5-(4-бутил-3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион,
5-(4-бензил-3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион,
5-(2-хлорбензофуран-5-илметилен)тиазолидин-2,4-дион,
5-(3-аминобензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион,
5-(3-фенилэтинилбензофуран-5-илметилен)тиазолидин-2,4-дион,
5-бензо[1,2,5]тиадиазол-5-илметилентиазолидин-2,4-дион,
5-бензо[1,2,5]оксадиазол-5-илметилентиазолидин-2,4-дион,
5-(2-метилбензофуран-6-илметилен)тиазолидин-2,4-дион,
5-(2-карбоксиметилбензофуран-6-илметилен)тиазолидин-2,4-дион,
5-(3-бром-2-фтор-2,3-дигидробензофуран-6-илметилен)тиазолидин-2,4-дион,
5-(2-фторбензофуран-6-илметилен)тиазолидин-2,4-дион.
26. Применение тиазолидинонвинильного производного конденсированного бензола по любому из пп.19-25 в качестве лекарственного средства.
27. Фармацевтическая композиция, содержащая, как минимум, одно тиазолидинонвинильное производное конденсированного бензола по любому из пп.19-25 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
28. Применение тиазолидинонвинильного производного конденсированного бензола по любому из пп.19-25 для получения лекарственного средства для модуляции PI3-киназной активности и предназначенного для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, отторжения трансплантата или легочных нарушений.
29. Применение по п.28 для ингибирования PI3-киназной активности.
30. Применение тиазолидинонвинильного производного конденсированного бензола по п.28, когда упомянутые заболевания выбираются из группы, включающей рассеянный склероз, псориаз, ревматоидный артрит, системную красную волчанку, воспалительное заболевание кишечника, воспаление легких, тромбоз или мозговую инфекцию/воспаление, как, например, менингит или энцефалит.
31. Применение тиазолидинонвинильного производного конденсированного бензола по п.28, когда упомянутые заболевания выбираются из группы, включающей болезнь Альцгеймера, хорею Гентингтона, травму центральной нервной системы, удар или ишемические состояния.
32. Применение тиазолидинонвинильного производного конденсированного бензола по п.28, когда упомянутые заболевания выбираются из группы, включающей атеросклероз, гипертрофию сердца, дисфункцию мышечных клеток сердца, повышенное кровяное давление или сужение кровеносных сосудов.
33. Применение тиазолидинонвинильного производного конденсированного бензола по п.28, когда упомянутые заболевания выбираются из группы, включающей хроническое обструктивное заболевание легких, фиброз вследствие анафилактического шока, псориаз, аллергические заболевания, астму, удар или ишемические состояния, ишемию-реперфузию, агрегацию тромбоцитов/активацию, атрофию скелетных мышц/гипертрофию, рекруитмент лейкоцитов в раковой ткани, развитие кровеносных сосудов, инвазивное метастазирование, в частности меланому, саркому Карпоши, острые и хронические бактериальные и вирусные инфекции, сепсис, трансплантацию, отторжение трансплантата, панкреатит, недостаточность многих органов, гломерулосклероз, гломерулонефрит, прогрессирующий фиброз почек, эндотелиальные и эпителиальные нарушения в легком или общее воспаление дыхательных путей.
34. Применение по п.28, где PI3-киназа представляет собой киназу PI3Kg.
35. Способ получения тиазолидинонвинильных производных конденсированного бензола формулы (II) согласно п.20, включающий следующую стадию:
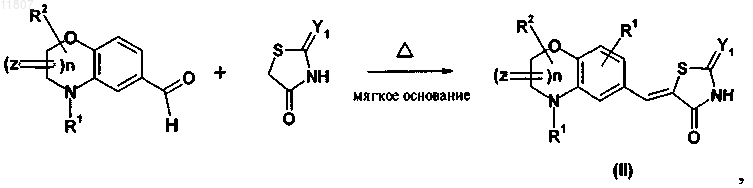
где R1, R2, Y1, Z и n являются такими, как указано выше.
36. Способ получения тиазолидинонвинильных производных конденсированного бензола формулы (III) по п.23, включающий следующую стадию:

где R1, R2 и Y1 являются такими, как указано выше.
Текст
011807 Область техники, к которой относится изобретение Настоящее изобретение относится к применению азолидинонвинильных производных конденсированного бензола формулы (I) для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, отторжения трансплантата или легочных нарушений. Конкретно, настоящее изобретение относится к замещенным азолидинонвинильным производным конденсированного бензола для модуляции, особенно для подавления активности или функции семейства фосфоинозитид-3'ОН-киназ, PI3K, в частности, PI3K. Предпосылки создания изобретения Клеточные плазматические мембраны могут рассматриваться как большое хранилище вторичного мессенджера, который может быть вовлечен в различные пути трансдукции сигнала. Принимая во внимание функцию и регуляцию эффекторных ферментов в метаболических путях передачи сигнала фосфолипидов, эти ферменты генерируют вторичные мессенджеры из фосфолипидного пула мембран (PI3 киназы класса I /например, PI3K/), являются двойственно специфическими киназами, что означает, что они проявляют как липидкиназную активность (фосфорилирование фосфоинозитидов), так и протеинкиназную активность, что продемонстрировано их способностью фосфорилировать другие белковые субстраты, включая аутофосфорилирование в качестве внутримолекулярного регуляторного механизма. Такие ферменты передачи сигнала фосфолипидов активируются в ответ на множество внеклеточных сигналов, как, например, факторы роста, митогены, интегрирующие (взаимодействия клетка-клетка) гормоны, цитокины, вирусы и нейромедиаторы, как, например, описанные здесь ниже на схеме 1, а также путем внутриклеточной перекрестной регуляции с помощью других передающих сигнал молекул (взаимное влияние, когда первоначальный сигнал может активировать некоторые параллельные пути обмена, которые на второй стадии передают сигналы PI3-киназам путем актов внутриклеточной передачи сигналов),как, например, малые гуанозин-5'-трифосфатазы, киназы или фосфатазы. Содержащие в молекуле остаток инозита фосфолипиды (фосфоинозитиды) начинают внутриклеточную передачу сигнала со связывания передающей сигнал молекулы (внеклеточные лиганды, раздражители, рецептор димеризации, трансактивация с помощью ксеногенного рецептора (например, рецептор тирозинкиназы связанного с G-белком трансмембранным рецептором, интегрированным в плазматическую мембрану.PI3K превращает мембранный фосфолипид PIP (4,5)2 в PIP (3,4,5)3, который в свою очередь может дальше превращаться в другую 3'-фосфорилированную форму фосфоинозитидов с помощью 5'специфических фосфоинозитидфосфатаз, таким образом, ферментативная активность PI3K приводит в результате или непосредственно, или косвенно к генерации двух подтипов 3'-фосфоинозитида, которые действуют как вторичные мессенджеры во внутриклеточной трансдукции сигнала (Vanhaesebroeck В. и др., Trends Biochem. Sci., 22(7), 1997, сс.267-72; Leslie N.R. и др., Chem. Rev., 101(8), 2001, cc.2365-80;Katso R. и др., Annu. Rev. Cell Dev. Biol., 17, 2001, cc.615-75, и Toker А. и др., Cell Mol. Life Sci., 59(5),2002, cc.761-79). Множественные изоформы PI3K, классифицированные по их каталитическим субъединицам, по их регуляции с помощью соответствующих регуляторных субъединиц, по типу экспрессии и специфическим функциям передачи сигнала (p110 и ), осуществляют такую ферментативную реакцию (Vanhaesebroeck В., Exp. Cell Res., 25(1), 1999, сс.239-54, и Katso R. и др., Annu. Rev. Cell Dev.Biol., 17, 2001, cc.615-75). Эволюционно сохраненные изоформы p110 иэкспрессируются повсеместно, в то время какиболее специфически экспрессированы в кроветворной клеточной системе, клетках гладких мышц, миоцитах и клетках эндотелия (Vanhaesebroeck В. и др., Trends Biochem. Sci., 22(7), 1997, cc. 267-72). Их экспрессия также может регулироваться индуцируемым способом в зависимости от типа клеток, типа ткани и раздражителей, а также вида заболевания. До настоящего времени было идентифицировано восемь PI3K млекопитающих, разделенных на три основные класса (I, II и III) на основании гомологии последовательностей, структуры, партнеров при связывании, способа активации и субстратной предпочтительности in vitro. PI3K класса I могут фосфорилировать фосфатидилинозит (PI), фосфатидилинозит-4-фосфат и фосфатидилинозит-4,5-дифосфат (PIP2) для продуцирования фосфатидилинозит-3-фосфата (PIP), фосфатидилинозит-3,4-дифосфата и фосфатидилинозит-3,4,5-трифосфата, соответственно. PI3K класса II фосфорилируют PI и фосфатидилинозит-4 фосфат. PI3K класса III могут фосфорилировать только фосфатидилинозит (Vanhaesebroeck В. и др.,Trends Biochem. Sci., 22(7), 1997, сс.267-72, Vanhaesebroeck В. и др., Exp. Cell Res., 25(1), 1999, сс.239-54,и Leslie N.R. и др., Chem. Rev., 101(8), 2001, стр.2365-80) рецепторов, сопряженных с G-белком, опосредованных активацией фосфоинозитид-3'ОН-киназы посредством малых гуанозин-5'-трифосфатаз, как,например, G и Ras, и в результате передача сигнала PI3K играет главную роль в установлении и координировании полярности клетки и динамической организации цитоскелета, что вместе обеспечивает побудительную силу у клеток к движению. Как проиллюстрировано выше на схеме 1, фосфоинозитид-3-киназа (PI3K) вовлечена в фосфорилирование фосфатидилинозита (Ptdlns) по третьему атому углерода кольца инозита. ФосфорилированиеPtdIns в 3,4,5-трифосфат (PtdIns(3,4,5)P3), PtdIns(3,4)P2 и PtdIns(3)P действует в качестве вторичных мессенджеров для ряда метаболических путей трансдукции сигнала, включая таковые, существенные для пролиферации клеток, дифференциации клеток, роста клеток, размера клеток, выживания клеток, апоптоза, адгезии, подвижности клеток, миграции клеток, хемотаксиса, инвазии, перестройки цитоскелета,изменений формы клеток, передвижения пузырьков и обмена веществ (Katso и др., Аnnu. Rev. Cell Dev.Biol., 17, 2001, cc.615-75, и Stein R.C., Mol. Med. Today 6(9), 2000, cc.347-57). Хемотаксис означает направленное движение клеток к градиенту концентрации химических аттрактантов, также называемый хемокинезом, вовлечен в многие серьезные заболевания, как, например, воспаление/аутоиммунная реакция, нейродегенерация, развитие кровеносных сосудов, инвазия/метастазирование и заживление ран(Wyman N.P. и др., Immunol.Today 21(6), 2000, cc. 260-4; Hirsch и др., Science, 287(5455), 2000, cc.104953; Hirsch и др., FASEB J., 15(11), 2001, cc. 2019-21, и Gerard С. и др., Nat. Immunol, 2(2), 2001, cc. 10815). Недавние успехи, достигнутые с применением генетических подходов и фармакологических способов, обеспечили способность проникнуть в сущность передачи сигнала и молекулярных путей метаболизма, которые опосредуют хемотаксис в ответ на активированные хемоаттрактантом сопряженные с Gбелком рецепторы PI3-киназы, ответственной за генерирование таких фосфорилированных передающих сигнал продуктов, что было исходно идентифицировано как активность, ассоциированная с вирусными онкобелками и фактором роста рецепторных тиразинкиназ, которые фосфорилируют фосфатидилинозит(PI) и его фосфорилированные производные по гидроксилу в положении 3' кольца инозита (Panayotou и др., Trends Cell Biol., 2, 1992, cc. 358-60). Однако более новые биохимические исследования показали, что PI3-киназы класса I (например,изоформа PI3K класса IB) представляет двойственно-специфические киназы, что означает, что они проявляют как липидкиназную активность (фосфорилирование фосфоинозитидов), так и протеинкиназную активность, показано, что они способны фосфорилировать другие белки в качестве субстратов, включая аутофосфорилирование в качестве внутримолекулярного регуляторного механизма. Таким образом, считают, что активация PI3-киназы вовлечена в область клеточных ответных реакций, включая рост клеток, дифференциацию и апоптоз (Parker и др., Current Biology, 5, 1995, сс.577-99,Yao и др., Science , 267, 1995, сс.2003-05). Показано, что PI3-киназа вовлечена в ряд аспектов активации лейкоцитов. Было показано, что связанная с р 85 активность PI3-киназы физически ассоциирована с цитоплазматическим доменом CD28,который является важной костимуляторной молекулой для активации Т-лимфоцитов в ответ на антиген-2 011807 помощью CD28 понижает порог для активации антигеном и повышает величину и продолжительность пролиферативной ответной реакции. Такие эффекты связаны с возрастаниями транскрипции ряда генов,включая интерлейкин-2 (IL-2), важный фактор роста Т-лимфоцитов (Fraser и др., Science, 251, 1991,cc.313-16). Мутация CD28 таким образом, что он может длительнее взаимодействовать с PI3-киназой,приводит к нарушению инициирования продуцирования IL-2, предполагая решающую роль PI3-киназы в активации Т-лимфоцитов. PI3K была идентифицирована как медиатор зависящей от Gрегуляции активности JNK (c-Jun N-терминальная киназа), и G являются субъединицами гетеротримерных Gбелков (J. Biol. Chem., 273(5), 1998, ее.2505-8). Клеточные процессы, в которых PI3K играют существенную роль, включают подавление апоптоза, реорганизацию остова актина, рост сердечных миоцитов,стимуляцию инсулином гикогенсинтазы, опосредованные фактором некроза опухоли (TNF) примирование нейтрофилов и генерирование перекисей, и миграцию лейкоцитов и слипание с эндотелиальными клетками. Недавно (Immunity, 16(3), 2002, сс.441-51) было описано, что PI3K передает сигналы воспаления через различные связанные с G(i) рецепторы и ее главная деятельность в отношении тучных клеток, раздражителей применительно к лейкоцитам, иммунологии охватывает цитокины, хемокины, аденозины, антитела, интегрины, факторы агрегации, ростовые факторы, вирусы или гормоны, например(Lawlor M.A. и др., J.Cell. Sci., 114(Pt 16), 2001, сс.2903-10; Laffargue M. и др., Immunity, 16(3), 2002,сс.441-51, и Stephens L. и др., Curr.Opinion Cell Biol., 14(2), 2002, сс.203-13). Специфические ингибиторы против отдельных членов семейства ферментов обеспечивают неоценимые способы для расшифровки функций каждого фермента. Два соединения, LY294002 и вортманнин(ср. ниже), были широко использованы в качестве ингибиторов PI3-киназы. Эти соединения являются неспецифическими ингибиторами PI3K, поскольку они не распознают различия между четырьмя членами PI3-киназ класса I. Например, значения IC50 (концентрация, вызывающая 50%-ное ингибирование) вортманнина против каждой из различных PI3-киназ класса I находятся в пределах от 1 до 10 нМ. Аналогично значения IC50 для LY294002 против каждой из этих PI3-киназ составляют примерно 15-20 мкМ(Fruman и др., An. Rev. Biochem., 67, 1998, cc.481-507 ), также 5-10 мкМ для протеинкиназы CK2 и наблюдается некоторое ингибирующее действие на фосфолипазы. Вортманнин является грибковым метаболитом, который необратимо ингибирует активность PI3K путем ковалентного связывания с каталитическим доменом этого фермента. Ингибирование активности PI3K с помощью вортманнина уничтожает последующий клеточный ответ на внеклеточный фактор. Например, нейтрофилы реагируют на хемокинfMet-Leu-Phe (fMLP), стимулируя PI3K и синтезируя PtdIns(3,4,5)Р 3. Такой синтез коррелирует с активацией респираторных импульсов, вовлеченных в деструкцию нейтрофилов внедряющихся микроорганизмов. Обработка нейтрофилов вортманнином предотвращает вызванную fMLP ответную реакцию на респираторный импульс (Thelen и др. PNAS, 91, 1994, сс.4960-64). Действительно эти эксперименты с вортманнином, как и другое экспериментальное доказательство, показывают, что активность PI3K в клетках кроветворного ряда, в частности, нейтрофилов, моноцитов и других типов лейкоцитов, вовлечена в многие нерегистрируемые иммунные ответные реакции, связанные с острым и хроническим воспалением. На основании исследований с применением вортманнина имеется свидетельство того, что деятельность PI3-киназы также требуется для некоторых аспектов передачи сигнала лейкоцитов через сопряженные с G-белком рецепторы (Thelen и др., Proc. Natl. Acad. Sci. USA, 91, 1994, сс.4960-64). Более того,было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение перекиси. Однако, поскольку именно эти соединения не делают различия между различными изоформамиPI3K, остается неясным, какая особая изоформа или изоформы вовлечены в эти явления. Азолидинонвинильные производные бензола, содержащие все же обязательную бензимидазольную составляющую, описываются в международной заявке на патент WO 02/051409. Считают, что эти соединения ингибируют теломеразу и претендуют на полезность при лечение рака. Краткое изложение сущности изобретения Настоящее изобретение относится к применению азолидинонвинильных производных конденсированного бензола формулы (I) где А, X, Y, Z, n, R1 и R2 подробно представлены далее в описании, а также их фармацевтически приемлемых солей для приготовления фармацевтических композиций для лечения и/или профилактики аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, осложнений после трансплантации, отторжения трансплантата или легочных нарушений. Соединения по настоящему изобретению являются ингибиторами фосфоинозитид-3-киназ(PI3K), в частности, фосфоинозитид-3-киназы у (PI3K). Описание изобретения В настоящее время известно, что соединения по настоящему изобретению являются модуляторами фосфоинозитид-3-киназ (PI3K), в частности, фосфоинозитид-3-киназы у (PI3K). Когда фермент фосфоинозитид-3-киназа (PI3K) ингибируется соединениями по настоящему изобретению, PI3K не в состоянии оказывать свои ферментативные, биологические и/или фармакологические эффекты. Соединения по настоящему изобретению поэтому полезны при лечении и предупреждении аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, осложнений после трансплантации, отторжения трансплантата или легочных нарушений. В следующих параграфах приводятся определения различных химических составляющих, которые входят в соединения по изобретению и упоминаются постоянно всюду в спецификации и пунктах формулы изобретения, если только в каком-то другом случае специально предусмотренное определение не обеспечивает более широкое толкование. Термин "(С 1-С 6)алкил" относится к одновалентным алкильным группам с 1-6 атомами углерода. Этот термин представляет группы, как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, н-пентил, н-гексил и им подобные. Термин "арил" относится к ненасыщенной ароматической карбоциклической группе из 6-14 углеродных атомов, содержащей одно кольцо (например, фенил) или сложные конденсированные кольца(например, нафтил). Предпочтительные арилы включают фенил, нафтил, фенантренил и им подобные. Термин "(С 1-С 6)алкиларил" относится к (С 1-С 6)алкильным группам, имеющим арильный заместитель, включающий бензил, фенетил и им подобные. Термин "гетероарил" относится к моноциклической гетероароматической или бициклической, или трициклической с конденсированными кольцами гетероароматической группе. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил,имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил. Термин "(С 1-С 6)алкилгетероарил" относится к (С 1-С 6)алкильным группам с гетероарильным заместителем, включающим 2-фурилметил, 2-тиенилметил, 2-(1H-индол-3-ил)этил и им подобные. Термин "(С 2-С 6)алкенил" относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и имеющим, как минимум, 1 или 2 участка с непредельными двойными связями. Предпочтительно алкенильные группы включают винил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и им подобные группы. Термин "(С 2-С 6)алкениларил" относится к (С 2-С 6)алкенильным группам с арильным заместителем,включающим 2-фенилвинил и ему подобные группы. Термин "(С 2-С 6)алкенилгетероарил" относится к (С 2-С 6)алкенильным группам с гетероарильным заместителем, включающим 2-(3-пиридинил)винил и ему подобные группы. Термин "(С 2-С 6)алкинил" относится к алкинильным группам, предпочтительно с 2-6 углеродными атомами и содержащими, как минимум, 1-2 участка с тройной связью, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и им подобные группы. Термин "(С 2-С 6)алкиниларил" относится к (С 2-С 6)алкинильным группам с арильным заместителем,включающим фенилэтинил и ему подобные группы. Термин "(С 2-С 6)алкинилгетероарил" относится к (С 2-С 6)алкинильным группам с гетероарильным-4 011807 заместителем, включающим 2-тиенилэтинил и ему подобные группы. Термин "(С 3-С 8)циклоалкил" относится к насыщенной карбоциклической группе с 3-8 атомами углерода, содержащей одно кольцо (например, циклогексил) или сложные конденсированные кольца (например, норборнил). Предпочтительные циклоалкилы включают циклопентил, циклогексил, норборнил и им подобные. Термин "гетероциклоалкил" относится к (С 3-С 8)циклоалкильной группе согласно приведенному выше определению, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R является водородом или метилом. Предпочтительные гетероциклоалкилы включают пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и им подобные. Термин "(С 1-С 6)алкилциклоалкил" относится к (С 1-С 6)алкильным группам с циклоалкильным заместителем, включающим циклогексилметил, циклопентилпропил и им подобные группы. Термин "(С 1-С 6)алкилгетероциклоалкил" относится к (С 1-С 6)алкильным группам с гетероциклоалкильным заместителем, включающим 2-(1-пирролидинил)этил, 4-морфолинилметил, (1-метил-4 пиперидинил)метил и им подобные группы. Термин "карбокси" относится к группе -С(О)ОН. Термин "(С 1-С 6)алкилкарбокси" относится к (С 1-С 6)алкильным группам с заместителем в виде карбоксила, включающим 2-карбоксиэтил и им подобные группы. Термин "ацил" относится к группе -C(O)R, где R включает "(С 1-С 6)алкил", "арил", "гетероарил","(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил". Термин "(С 1-С 6)алкилацил" относится к (С 1-С 6)алкильным группам с ацильным заместителем,включающим 2-ацетилэтил и им подобные группы. Термин "арилацил" относится к арильным группам, имеющим ацильный заместитель, включающим 2-ацетилфенил и ему подобные группы. Термин "гетероарилацил" относится к гетероарильным группам с ацильным заместителем, включающим 2-ацетилпиридил и ему подобные группы. Термин "(С 3-С 8)(гетеро)циклоалкилацил" относится к 3-8-членным циклоалкильным или гетероциклоалкильным группам, имеющим ацильный заместитель. Термин "ацилокси" относится к группе -OC(O)R, где R означает Н, "(C1-С 6)-алкил", "(С 2 С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "(С 1 С 6)алкиларил" или "(C1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2-С 6)алкенилгетероарил", "(С 2 С 6)алкиниларил","(С 2-С 6)алкинилгетероарил","(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "(С 1-С 6)алкилацилокси" относится к (С 1-С 6)алкильным группам с заместителем в виде ацилоксигруппы, включающим 2-(ацетилокси)этил и ему подобные группы. Термин "алкокси" относится к группе -O-R, где R означает "(С 1-С 6)алкил" или "арил", или "гетероарил", или "(С 1-С 6)алкиларил", или "(C1-С 6)алкилгетероарил". Предпочтительные алкоксигруппы включают, например, метокси-, этокси-, феноксигруппу и им подобные группы. Термин "(С 1-С 6)алкилалкокси" относится к (С 1-С 6)алкильным группам с заместителем в виде алкоксигруппы, включающим 2-этоксиэтил и ему подобные группы. Термин "алкоксикарбонил" относится к группе -C(O)OR, где R означает водород, "(С 1-С 6)алкил" или "арил", или "гетероарил", или "(С 1-С 6)алкиларил", или "(С 1-С 6)алкилгетероарил". Термин "(С 1-С 6)алкилалкоксикарбонил" относится к (С 1-С 6)алкильным группам с алкоксикарбонильным заместителем, включающим 2-(бензилоксикарбонил)этил и ему подобные группы. Термин "аминокарбонил" относится к группе -C(O)NRR', где каждый R, R' независимо означает водород или (С 1-С 6)алкил, или арил, или гетероарил, или "(С 1-С 6)-алкиларил", или "(С 1 С 6)алкилгетероарил". Термин "(С 1-С 6)алкиламинокарбонил" относится к (С 1-С 6)алкильным группам, имеющим аминокарбонильный заместитель, включающим 2-(диметиламинокарбонил)-этил и ему подобные группы. Термин "ациламино" относится к группе -NRC(O)R', где каждый R, R' означает независимо водород, "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил","арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2 С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2-С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "(С 1-С 6)алкилациламино" относится к (С 1-С 6)алкильным группам с заместителем в виде ациламиногруппы, включающим 2-(пропиониламино)этил и ему подобные группы. Термин "уреидо" относится к группе -NRC(O)NR'R", где каждый R, R', R" означает независимо водород, "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(C2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил","арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2 С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2-С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил" и где R' и R" вместе с атомом азота, с которым они связаны, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "(С 1-С 6)алкилуреидо" относится к (С 1-С 6)алкильным группам с заместителем в виде уреи-5 011807 догруппы, включающим 2-(N'-метилуреидо)этил и ему подобные группы. Термин "карбамат" относится к группе -NRC(O)OR', где каждый R, R' означает независимо водород, "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(C2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил","арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(C2 С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2-С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "амино" относится к группе -NRR', где каждый R, R' означает водород или "(С 1-С 6)алкил",или "арил", или "гетероарил", или "(С 1-С 6)алкиларил", или "(С 1-С 6)алкилгетероарил", или "циклоалкил",или "гетероциклоалкил", и где R и R' вместе с атомом азота, с которым они связаны, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "(С 1-С 6)алкиламино" относится к (С 1-С 6)алкильным группам с заместителем в виде аминогруппы, включающим 2-(1-пирролидинил)этил и ему подобные группы. Термин "аммоний" относится к положительно заряженной группе N+RR'R", где каждый R, R', R" означает независимо "(С 1-С 6)алкил" или "(С 1-С 6)алкиларил", или "(С 1-С 6)алкилгетероарил", или "циклоалкил", или "гетероциклоалкил" и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "(С 1-С 6)алкиламмоний" относится к (С 1-С 6)алкильным группам с аммониевым заместителем, включающим 2-(1-пирролидинил)этил и ему подобные группы. Термин "галоген" относится к атомам фтора, хлора, брома и иода. Термин "сульфонилокси" относится к группе -OSO2-R, где R выбирается из Н, из групп, представляющих "(С 1-С 6)алкил", "(С 1-С 6)алкил", замещенный галогенами, например, группа -OSO2-CF3, "(С 2 С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "(C1 С 6)алкиларил" или "(С 1-С 6)алкил-гетероарил", "(С 2-С 6)алкениларил", "(С 2-С 6)алкенилгетероарил", "(С 2 С 6)алкиниларил","(С 2-С 6)алкинилгетероарил","(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "(С 1-С 6)алкилсульфонилокси" относится к (С 1-С 6)алкильным группам с представляющим сульфонилоксигруппу заместителем, включающим 2-(метил-сульфонилокси)этил и ему подобные группы. Термин "сульфонил" относится к группе "-SO2-R", где R выбирают из Н, из групп, представляющих"арил", "гетероарил", "(С 1-С 6)алкил", "(С 1-С 6)алкил", замещенный галогенами, например группа -SO2CF3, "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил", "арил", "гетероарил","(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2-С 6)алкенил-гетероарил","(С 2-С 6)алкиниларил","(С 2-С 6)алкинилгетероарил","(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "(С 1-С 6)алкилсульфонил" относится к (C1-С 6)алкильным группам с сульфонильным заместителем, включающим 2-(метилсульфонил)этил и ему подобные группы. Термин "сульфинил" относится к группе "-S(O)-R", где R выбирается из Н, из групп, представляющих "(С 1-С 6)алкил", "(С 1-С 6)алкил", замещенный галогенами, например, группа -SO-CF3, "(С 2 С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "(C1 С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2-С 6)алкенилгетероарил", "(С 2 С 6)алкиниларил","(С 2-С 6)алкинилгетероарил","(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил". Термин "(С 1-С 6)алкилсульфинил" относится относится к (С 1-С 6)алкильным группам с сульфинильным заместителем, включающим 2-(метилсульфинил)этил и ему подобные группы. Термин "сульфанил" относится к группам -S-R, где R включает Н, "(С 1-С 6)-алкил", "(С 1-С 6)алкил",замещенный галогенами, например группа -SO-CF3, "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "(С 3 С 8)циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1 С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2-С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2 С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил", "(C1-С 6)алкилгетероциклоалкил". Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и им подобные. Термин "(С 1-С 6)алкилсульфанил" относится к (С 1-С 6)алкильным группам с сульфанильным заместителем, включающим 2-(этилсульфанил)этил и ему подобные группы. Термин "сульфониламино" относится к группе -NRSO2-R', где каждый R, R' включает независимо водород, "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил","арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2 С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2-С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил. Термин "(С 1-С 6)алкилсульфониламино" относится к (С 1-С 6)алкильным группам с заместителем в виде сульфониламиногруппы, включающим 2-(этилсульфониламино)-этил и ему подобные группы. Термин "аминосульфонил" относится к группе -SO2-NRR', где каждый R, R" включает независимо водород, "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "(С 3-С 8)циклоалкил", "гетероциклоалкил","арил", "гетероарил", "(С 1-С 6)алкиларил" или "(С 1-С 6)алкилгетероарил", "(С 2-С 6)алкениларил", "(С 2-6 011807 С 6)алкенилгетероарил", "(С 2-С 6)алкиниларил", "(С 2-С 6)алкинилгетероарил", "(С 1-С 6)алкилциклоалкил","(С 1-С 6)алкилгетероциклоалкил. Термин "(С 1-С 6)алкиламиносульфонил" относится к (С 1-С 6)алкильным группам с аминосульфонильным заместителем, включающим 2-(циклогексиламиносульфонил)-этил и ему подобные группы. Термин "замещенные или незамещенные", если каким-то образом описание не ограничено определением отдельного заместителя, представленные выше группы, например "алкил", "алкенил", "алкинил","арил" и "гетероарил" и т.д., могут необязательно быть замещены 1-5 заместителями, выбранными из группы, включающей "(С 1-С 6)алкил", "(С 2-С 6)алкенил", "(С 2-С 6)алкинил", "циклоалкил", "гетероциклоалкил", "(С 1-С 6)алкиларил", "(С 1-С 6)алкилгетероарил", "(C1-С 6)алкилциклоалкил", "(С 1-С 6)алкилгетероциклоалкил", "аминогруппу", "аммоний", "ацил", "ацилоксигруппу", "ациламиногруппу", "аминокарбонил", "алкоксикарбонил", "уреидную группу", "арил", "карбамат", "гетероарил", "сульфинил","сульфонил", "алкоксигруппу", "сульфанил", "галоген", "карбоксил", тригалоидметил, циангруппу, гидроксильную группу, меркаптогруппу, нитрогруппу и им подобные группы. Альтернативно, упомянутое замещение может также включать ситуации, когда соседние заместители подверглись циклизации, особенно когда вовлечены смежные функциональные заместители, с образованием, таким образом, например, лактамов, лактонов, циклических ангидридов, но также ацеталей, тиоацеталей, аминалей, образованных путем образования циклической структуры, например, при попытке получить защитную группу. Термин "фармацевтически приемлемые катионные соли или комплексы" подразумевает такие соли,как соли щелочных металлов (например, натрия и калия), соли щелочно-земельных металлов (например,кальция или магния), соли алюминия, соли аммония и соли с органическими аминами, как, например, с метиламином, диметиламином, триметиламином, этиламином, триэтиламином, морфолином, N-Me-Dглюкамином, N,N'-бис(фенилметил)-1,2-этандиамином, этаноламином, диэтаноламином, этилендиамином, N-метилморфолином, пиперидином, бензатином (N,N'-дибензилэтилендиамином), холином, меглумином (N-метил-глюкамином), бенетамином (N-бензилфенетиламином), диэтиламином, пиперазином,трометамином (2-амино-2-гидроксиметил-1,3-пропандиолом), прокаином, а также с аминами формулы NR,R',R", где R, R', R" означают независимо друг от друга водород, алкил или бензил. Особенно предпочтительными солями являются натриевые и кальциевые соли. Термин "фармацевтически приемлемые соли или комплексы" относится к солям или комплексам идентифицированных ниже соединений по настоящему изобретению, которые обладают желаемой биологической активностью. Примеры таких солей включают, но не ограничиваются кислотно-аддитивными солями, образованными с неорганическими кислотами (например, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и им подобные), и солями, образованными с органическими кислотами, как, например, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памоевая кислота, альгиновая кислота, полиглутаминовая кислота,нафталинсульфокислота, нафталиндисульфокислота и полигалактуроновая кислота. Упомянутые соединения могут также применяться в виде фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, которые конкретно включают четвертичные аммониевые соли формулыZ является противоионом, включая хлорид, бромид, иодид, -О-алкил, толуолсульфонат, метилсульфонат,сульфонат, фосфат или карбоксилат (как, например, бензоат, сукцинат, ацетат, гликолят, малеат, малат,фумарат, цитрат, тартрат, аскорбат, циннамат, манделат и дифенилацетат). Термин "фармацевтически активное производное" относится к любому соединению, которое после введения реципиенту способно проявить прямо или косвенно указанную в описании активность. Термин "энантиомерный избыток" относится к продуктам, полученным с помощью асимметрического синтеза, т.е., синтеза, при котором используются нерацемические исходные вещества и/или реагенты, или синтеза, включающего, как минимум, одну энантиоселективную стадию, когда получают избыток одного энантиомера порядка, как минимум, около 52%. Общая формула (I) соединений по настоящему изобретению также включает их таутомеры, геометрические изомеры, оптически активные формы, как энантиомеры, диастереомеры и их рацематы, а также их фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединений формул по настоящему изобретению являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами, например гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат,глюконат, метансульфонат, бензолсульфонат и п-толуолсульфонат. Соединения по настоящему изобретению могут быть получены в виде смеси E/Z-изомеров или в виде, по существу, чистых Е-изомеров или Z-изомеров. E/Z-изомерия преимущественно касается винильной составляющей, связывающей фенил с азолидиноновым участком. В специфическом варианте осуществления изобретения соединения формулы (I) являются Z-изомерами. Первый аспект настоящего изобретения состоит в применении соединений формулы (I) а также их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей и фармацевтически активных производных для приготовления лекарственного средства для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, осложнений после трансплантации в результате реакций отторжения, отторжения трансплантата или легочных нарушений. В предпочтительном варианте осуществления изобретения эти соединения полезны для лечения и/или профилактики аутоиммунных заболеваний или воспалительных заболеваний, как, например, рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, воспалительное заболевание кишечника, воспаление легких, тромбоз или мозговая инфекция/воспаление, как, например, менингит или энцефалит. В другом предпочтительном варианте осуществления изобретения соединения по изобретению полезны для лечения и/или профилактики нейродегенеративных заболеваний, включающих рассеянный склероз, болезнь Альцгеймера, хорею Гентингтона, травму центральной нервной системы, удар или ишемические состояния. В особо предпочтительном варианте осуществления изобретения соединения по изобретению полезны для лечения и/или профилактики сердечно-сосудистых заболеваний, как, например, атеросклероз,гипертрофия сердца, дисфункция мышечных клеток сердца, повышенное кровяное давление или сужение кровеносных сосудов. В другом особенно предпочтительном воплощении согласно изобретению такие соединения полезны для лечения и/или профилактики хронического обструктивного легочного заболевания, фиброза вследствие анафилактического шока, псориаза, аллергических заболеваний, астмы, удара или ишемических состояний, ишемии-реперфузии, агрегации тромбоцитов/активации, атрофии скелетных мышц/гипертрофии, рекруитмента лейкоцитов в раковой ткани, развития кровеносных сосудов, инвазивного метастазирования, в частности меланомы, саркомы Карпоши, острых и хронических бактериальных и вирусных инфекций, сепсиса, осложнений после трансплантации из-за реакций отторжения, отторжения трансплантата, гломерулосклероза, гломерулонефрита, прогрессирующего фиброза почек, эндотелиальных и эпителиальных легочных нарушений или в случае обычного воспаления легких. Заместители в формуле (I) определяются следующим образом: А является незамещенной или замещенной 5-6-членной гетероциклической группой или незамещенной, или замещенной карбоциклической группой. Упомянутая карбоциклическая группа может быть сконденсирована с незамещенным или замещенным арилом, незамещенным или замещенным гетероарилом, незамещенным или замещенным циклоалкилом или с незамещенным или замещенным гетероциклоалкилом. Такие гетероциклические или карбоциклические группы включают арил, гетероарил, циклоалкил и гетероциклоалкил, включая фенил, фенантренил, циклопентил, циклогексил, норборнил, пирролидин,пиперидин, пиперазин, 1-метилпиперазин, морфолин, пирролил, фуранил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3 оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил,1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил. Другие примеры гетероциклических или карбоциклических групп А включают незамещенный или замещенный диоксол, незамещенный или замещенный диоксин, незамещенный или замещенный дигидрофуран, незамещенный или замещенный (дигидро)фуранил, незамещенный или замещенный (дигидро)оксазинил, незамещенный или замещенный оксазиноил, незамещенный или замещенный пиридинил,незамещенный или замещенный изооксазолил, незамещенный или замещенный оксазолил, незамещенный или замещенный (дигидро)нафталинил, незамещенный или замещенный пиримидинил, незамещенный или замещенный триазолил, незамещенный или замещенный имидазолил, незамещенный или замещенный пиразинил, незамещенный или замещенный тиазолил, незамещенный или замещенный тиадиазолил, незамещенный или замещенный оксадиазолил.Y1 и Y2 независимо друг от друга выбираются из группы, состоящей из S, О или -NH, предпочтительно О.R1 выбирают из группы, включающей или состоящей из Н, циангруппы, карбоксильной группы,ацила, (С 1-С 6)алкоксигруппы, галогена, гидроксила, ацилоксигруппы, незамещенной или замещенной(C1-С 6)алкилкарбоксильной группы, незамещенной или замещенной (C1-С 6)алкилацилоксигруппы, незамещенной или замещенной (C1-С 6)алкилалкоксигруппы, алкоксикарбонила, незамещенного или замещенного (С 1-С 6)алкилалкоксикарбонила, аминокарбонила, незамещенного или замещенного (С 1 С 6)алкиламинокарбонила, ациламиногруппы, незамещенной или замещенной (С 1-С 6)алкилациламиногруппы, уреидогруппы, незамещенной или замещенной (C1-С 6)алкилуреидогруппы, аминогруппы,незамещенной или замещенной (С 1-С 6)алкиламиногруппы, аммония, сульфонилоксигруппы, незамещенной или замещенной (С 1-С 6)алкилсульфонилоксигруппы, сульфонила, незамещенного или замещенного(С 1-С 6)алкилсульфонила, сульфинила, незамещенного или замещенного (С 1-С 6)алкилсульфинила, сульфанила, незамещенного или замещенного (С 1-С 6)алкилсульфанила, сульфониламиногруппы, незамещенной или замещенной (C1-С 6)алкилсульфониламиногруппы или карбамата. В специальном варианте осуществления изобретения R означает водород.R2 выбирают из группы, включающей или состоящей из Н, галогена, ацила, аминогруппы, незамещенного или замещенного (С 1-С 6)алкила, незамещенного или замещенного (С 2-С 6)алкенила, незамещенного или замещенного (С 2-С 6)алкинила, незамещенной или замещенной (С 1-С 6)алкилкарбоксильной группы, незамещенного или замещенного (C1-С 6)алкилацила, незамещенного или замещенного (C1 С 6)алкилалкоксикарбонила, незамещенного или замещенного (C1-С 6)алкиламинокарбонила, незамещенной или замещенной (С 1-С 6)алкилацилоксигруппы, незамещенной или замещенной (С 1 С 6)алкилациламиногруппы, незамещенной или замещенной (С 1-С 6)алкилуреидогруппы, незамещенного или замещенного (С 1-С 6)алкилкарбамата, незамещенной или замещенной (С 1-С 6)алкиламиногруппы, незамещенной или замещенной (С 1-С 6)алкилалкоксигруппы, незамещенного или замещенного (С 1 С 6)алкилсульфанила, незамещенного или замещенного (С 1-С 6)алкилсульфинила, незамещенного или замещенного(С 1-С 6)алкилсульфониламиноарила, незамещенного или замещенного арила, незамещенного или замещенного(С 3-С 8)циклоалкила или гетероциклоалкила, незамещенного или замещенного (С 1-С 6)алкиларила, незамещенного или замещенного (С 2-С 6)алкениларила, незамещенного или замещенного (С 2-С 6)алкиниларила, карбоксильной группы, цианогруппы, гидроксильной группы, (С 1-С 6)алкоксигруппы, нитрогруппы, ациламиногруппы, уреидогруппы, сульфониламиногруппы, сульфанила или сульфонила.n означает целое число 0, 1 или 2, предпочтительно n означает 0 или 1. Наиболее предпочтительно n = 0. Согласно особому варианту осуществления изобретения R1 и R2 оба означают водород. В другом специальном варианте осуществления изобретения X означает S, Y и Y оба означают кислород, R1 и R2 являются такими, как определено выше, и n означает 0. Другой особенно предпочтительный аспект настоящего изобретения касается применения тиазолидиндионвинильных производных конденсированного бензола формулы (Ia), (Ib), (Ic) и (Id) для приготовления лекарственного средства для профилактики и/или лечения аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, осложнений после трансплантации из-за реакций отторжения, отторжения трансплантата или легочных нарушений:G в формуле (Ia) является незамещенным или замещенным (C1-С 5)алкиленом (например, метиленом, этиленом, пропиленом и т. д.) или незамещенной или замещенной (С 1-С 5)алкениленовой группойW и V в формуле (Ia) выбираются каждый независимо друг от друга из О, S, -NR3, где R3 означает Н или незамещенную или замещенную (C1-С 6)алкильную группу, m и n означают каждая независимо друг от друга 0 или 1; о означает целое число от 1 до 4 и q означает целое число от 0 до 4. Даже более предпочтительны соединения формулы (Ia), где G означает (C1-С 4)алкилен, таким образом имеются в виду соединения формулы (Ib) (т.е., р = 1, 2, 3 или 4, предпочтительно 1 или 2). Специфической подгруппой соединений формулы (Ib) являются соединения формулы (Ic), где W,R1, Y1 являются такими, как определено выше; конкретно R1 может быть незамещенной или замещенной(С 1-С 4)алкильной группой или незамещенной или замещенной (С 1-С 5)алкенильной группой, карбоксильной группой, циангруппой, (С 1-С 4)алкоксигруппой, нитрогруппой, ациламиногруппой, уреидогруппой. Еще другой специфической подгруппой соединений формулы (Ia) являются соединения, где V, W иY1 все означают кислород, таким образом обеспечиваются соединения формулы (Id). В предпочтительном варианте воплощения соединений формул (Ia), (Ib) или (Id) n означает 0, m означает 1, р означает 1 или 2, о означает 0, q означает 1 и R1 и R2 являются такими, как определено выше. В другом специальном варианте воплощения соединений формул (Ia), (Ib) или (Id) m означает 1, n означает 0, р означает 1 или 2, q означает 0, о означает 1, в то время как R1 и R2 являются такими, как определено выше, более предпочтительно R1 означает галоген или атом водорода. В другом специальном варианте воплощения соединений формул (Ia), (Ib) или (Id) р означает 1 или 2, q означает 0, m означает 0, n означает 1 и R1 и R2 являются такими, как определено выше. Соединения по настоящему изобретению годятся для модуляции, особенно для подавления активности фосфоинозитид-3-киназ (PI3K), в особенности, фосфоинозитид-3-киназы (PI3K). Поэтому считают, что соединения по настоящему изобретению также особенно полезны для лечения и/или предупреждения нарушений, опосредованных PI3K, в особенности, PI3K. Упомянутое лечение включает модулирование - в особенности, ингибирование или понижающую регуляцию - фосфоинозитид-3-киназ. Следующие соединения не охватываются формулой (I)R означает низший алкил или аралкил и R2 означает Н или галоген. Соединения ТЕ раскрываются вJP 55 045648 как промежуточные соединения, не обладающие какой-либо биологической активностью, в то же время JA упоминается в Journal of Medicinal Chemistry (1998), 41(18), 3515-3529, как не проявляющее активности в анализе на "опухшей лапе". Соединения по настоящему изобретению охватывают, в частности, соединения из группы, включающей: 5-(1,3-бензодиоксол-5-илметилен)-1,3-тиазолидин-2,4-дион 5-(1,3-бензодиоксол-5-илметилен)-2-тиоксо-1,3-тиазолидин-4-он 5-(2,3-дигидро-1,4-бензодиоксин-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(2,3-дигидро-1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион 5-[(7-метокси-1,3-бензодиоксол-5-ил)метилен]-1,3-тиазолидин-2,4-дион 5-[(9,10-диоксо-9,10-дигидроантрацен-2-ил)метилен]-1,3-тиазолидин-2,4-дион- 10011807 5-(1,3-бензодиоксол-5 -илметилен)-2-имино-1,3-тиазолидин-4-он 5-хинолин-6-илметилентиазолидин-2,4-дион 5-хинолин-6-илметилен-2-тиоксотиазолидин-4-он 2-имино-5-хинолин-6-илметилентиазолидин-4-он 5-(3-метилбензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион 5-(4-фенилхиназолин-6-илметилен)тиазолидин-2,4-дион 5-(4-диметиламинохиназолин-6-илметилен)тиазолидин-2,4-дион 5-[(4-аминохиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-[(4-пиперидин-1-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-[(4-морфолин-4-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-[4-(бензиламино)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[4-(диэтиламино)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-(4-[(пиридин-2-илметил)амино]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(4-[(пиридин-3-илметил)амино]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион этиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-илпиперидин-3 карбоновой кислоты этиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-илпиперидин-4 карбоновой кислоты трет-бутиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-ил-L-пролина 5-[4-(4-метилпиперазин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[4-(4-пиримидин-2-илпиперазин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-(4-[4-(4-фторфенил)пиперидин-1-ил]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 5-[4-(4 бензилпиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-(4-[4-(2-фенилэтил)пиперидин-1-ил]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 5-[4-(4-метилпиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4- дион 5-[4-(4-гидроксипиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-4-карбоновую кислоту 1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-3-карбоновую кислоту 1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пирролидин-2-карбоновую кислоту 5-(4-метиламинохиназолин-6-илметилен)тиазолидин-2,4-дион 5-(4-метоксихиназолин-6-илметилен)тиазолидин-2,4-дион 2-имино-5-(4-метиламинохиназолин-6-илметилен)тиазолидин-4-он 2-имино-5-(4-пиперидинхиназолин-6-илметилен)тиазолидин-4-он 2-имино-5-(4-диметиламинохиназолин-6-илметилен)тиазолидин-4-он 5-(2-метил-2 Н-бензотриазол-5-илметилен)тиазолидин-2,4-дион 5-(3-метил-3 Н-бензотриазол-5-илметилен)тиазолидин-2,4-дион 5-(3-этил-3 Н-бензимидазол-5-илметилен)тиазолидин-2,4-дион 5-[1-(4-фенилбутил)-1 Н-бензимидазол-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[(1-проп-2-ин-1-ил-1 Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-[(1-2-[4-(трифторметил)фенил]этил-1 Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-(1-[2-(4-гидроксифенил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион метиловый эфир 4-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1 Н-бензимидазол-1 илциклогексанкарбоновой кислоты 5-(1-[2-(5-метокси-1 Н-индол-3-ил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5 -(1-[(1-метил-1 Н-пиразол-4-ил)метил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(1-[2-(3,4-диметоксифенил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(1-[2-(4-феноксифенил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(1-[4-(трифторметил)бензил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 4-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1 Н-бензимидазол-1-ил-циклогексанкарбоновую кислоту 5-[(1-изобутил-1H-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-(1-[2-(1,3-бензодиоксол-4-ил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5-(1-[2-(2-феноксифенил)этил]-1 Н-бензимидазол-6-илметилен)-1,3-тиазолидин-2,4-дион 5-[1-(3,3-дифенилпропил)-1 Н-бензимидазол-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[1-(2-метоксибензил)-1 Н-бензимидазол-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[1-(3-фурилметил)-1 Н-бензимидазол-6-ил]метилен-1,3-тиазолидин-2,4-дион 5-[(1-пропил-1 Н-бензимидазол-6-ил)метилен]-1,3-тиазолидин-2,4-дион 5-хиноксалин-6-илметилентиазолидин-2,4-дион 5-хиноксалин-6-илметилен-2-тиоксотиазолидин-4-он 2-имино-5-хиноксалин-6-илметилентиазолидин-4-он 5-бензотиазол-6-илметилентиазолидин-2,4-дион 5-(3-метилбензофуран-5-илметилен)тиазолидин-2,4-дион- 11011807 5-(2-бром-3-метилбензофуран-5-илметилен)тиазолидин-2,4-дион 5-(3-бромбензофуран-5-илметилен)тиазолидин-2,4-дион этиловый эфир 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]акриловой кислоты 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]акриловую кислоту 5-[3-(3-оксо-3-пиперидин-1-илпропенил)бензофуран-5-илметилен]тиазолидин-2,4-дион метиловый эфир 1-(3-5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-илпроп-2 еноил)пролина метиловый эфир 1-(3-5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-илпроп-2 еноил)-D-пролина 5-(3-[3-оксо-3-пирролидин-1-илпроп-1-ен-1-ил]-1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4 дион 5-(3-[3-морфолин-4-ил-3-оксопроп-1-ен-1-ил]-1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4 дион метиловый эфир 1-(3-5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-илпроп-2 еноил)-L-пролинаN-циклопентил-3-5-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]-1-бензофуран-3-илакриламид этиловый эфир 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]пропионовой кислоты 3-[5-(2,4-диоксотиазолидин-5-илиденметил)бензофуран-3-ил]пропионовая кислота 5-[3-(3-оксо-3-пиперидин-1-илпропил)бензофуран-5-илметилен]тиазолидин-2,4-дион трет-бутиловый эфир 6-(2,4-диоксотиазолидин-5-илиденметил)-2,3-дигидробензо[1,4]оксазин-4 карбоновой кислоты 5-(3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 5-(4-бензоил-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 5-(4-ацетил-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион трет-бутиловый эфир 6-(2,4-диоксотиазолидин-5-илиденметил)бензо[1,4]оксазин-4-карбоновой кислоты метиловый эфир [6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3-дигидробензо[1,4]оксазин-4 ил]уксусной кислотыN-бензил-2-[6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3-дигидробензо[1,4]оксазин-4 ил]ацетамид 5-(4-бутил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 5-(4-бензил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 5-(2-хлорбензофуран-5-илметилен)тиазолидин-2,4-дион 5-(3-аминобензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион 5-(3-фенилэтинилбензофуран-5-илметилен)тиазолидин-2,4-дион 5-бензо[1,2,5]тиадиазол-5-илметилентиазолидин-2,4-дион 5-бензо[1,2,5]оксадиазол-5-илметилентиазолидин-2,4-дион 5-(2-метилбензофуран-6-илметилен)тиазолидин-2,4-дион 5-(2-карбоксиметилбензофуран-6-илметилен)тиазолидин-2,4-дион 5-(3-бром-2-фтор-2,3-дигидробензофуран-6-илметилен)тиазолидин-2,4-дион 5-(2-фторбензофуран-6-илметилен)тиазолидин-2,4-дион. Другой аспект изобретения включает новые тиазолидиндионвинильные производные конденсированного бензола формулы (II-а) А выбирают из группы, включающей незамещенный или замещенный диоксол, незамещенный или замещенный диоксин, незамещенный или замещенный дигидрофуран, незамещенный или замещенный(дигидро)фуранил, незамещенный или замещенный (дигидро)оксазинил, незамещенный или замещенный оксазиноил, незамещенный или замещенный пиридинил, незамещенный или замещенный изооксазолил,незамещенный или замещенный оксазолил, незамещенный или замещенный (дигидро)нафталинил, незамещенный или замещенный пиримидинил, незамещенный или замещенный триазолил, незамещенный или замещенный имидазолил, незамещенный или замещенный пиразинил, незамещенный или замещенный тиазолил, незамещенный или замещенный тиадиазолил, незамещенный или замещенный оксадиазолил.R выбирают из группы, включающей или состоящей из водорода, галогена, ацила, аминогруппы,незамещенного или замещенного (С 1-С 6)алкила, незамещенного или замещенного (С 2-С 6)алкенила, незамещенного или замещенного(C1 С 6)алкилкарбоксильной группы, незамещенного или замещенного (С 1-С 6)алкилацила, незамещенного или замещенного(C1 С 6)алкиламинокарбонила, незамещенной или замещенной (C1-С 6)алкилацилоксигруппы, незамещенной или замещенной (C1-С 6)алкилациламиногруппы, незамещенной или замещенной (С 1-С 6)алкилуреидогруппы, незамещенного или замещенного (С 1-С 6)алкилкарбамата, незамещенной или замещенной (С 1-С 6)алкиламиногруппы, незамещенной или замещенной (С 1-С 6)алкилалкоксигруппы, незамещенного или замещенного (C1-С 6)алкилсульфанила, незамещенного или замещенного (C1 С 6)алкилсульфинила, незамещенного или замещенного (С 1-С 6)алкилсульфонила, незамещенного или замещенного (С 1-С 6)алкилсульфониламиноарила, незамещенного или замещенного арила, незамещенного или замещенного (С 3-С 8)циклоалкила или гетероциклоалкила, незамещенного или замещенного (C1 С 6)алкиларила, незамещенного или замещенного (С 2-С 6)алкениларила, незамещенного или замещенного(С 2-С 6)алкиниларила,карбоксильной группы,циангруппы,гидроксильной группы,(С 1 С 6)алкоксигруппы, нитрогруппы, ациламиногруппы, уреидогруппы, сульфониламиногруппы, сульфанила или сульфонила. Более специфическими являются новые тиазолидинонвинильные производные конденсированного бензола формулы (II) а также их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеры и их рацематы, а также их фармацевтически приемлемые соли и их фармацевтически активные производные, где Y1, Z, R1, R2 являются такими, как определено выше, и n означает 0 или 1. В специальном варианте осуществления изобретения R означает незамещенный или замещенный(С 1-С 6)алкил, незамещенный или замещенный (С 1-С 6)алкиларил, незамещенный или замещенный арил,незамещенный или замещенный (С 3-С 8)циклоалкил или -гетероциклоалкил, незамещенный или замещенный (С 2-С 6)алкениларил, незамещенный или замещенный (С 2-С 6)алкиниларил. В другом предпочтительном варианте осуществления настоящего изобретения Y1 означает кислород. Согласно еще одному аспекту изобретение предусматривает новые тиазолидинонвинильные производные конденсированного бензола формулы (III) а также их геометрические изомеры, оптически активные формы в виде энантиомеров, диастереомеры и их рацематы, а также их фармацевтически приемлемые соли и фармацевтически активные производные,где R1 и R2 являются такими, как определено выше, (пунктирная линия означает необязательное присутствие двойной связи).- 13011807 Еще другой вариант осуществления изобретения включает соединения формул (IV), (V) и (VI):R выбирается из группы, состоящей из водорода, галогена, циангруппы, (C1-С 6)алкила, (C1 С 6)алкоксигруппы, ацила, алкоксикарбонила, в то время как R2 является таким, как определено выше. В особом варианте осуществления изобретения R2 является амино-составляющей. Другим аспектом настоящего изобретения является применение новых соединений формул (II), (IIа), (III), (IV), (V) или (VI) в качестве лекарственного средства. Еще один аспект изобретения представляет фармацевтическую композицию, содержащую, как минимум, одно тиазолидинонвинильное производное конденсированного бензола согласно формулам (II),(III), (IV), (V) или (VI) и фармацевтически приемлемый носитель, разбавитель или наполнитель. Еще одним аспектом изобретения является применение соединений согласно формуле (II), (III),(IV), (V) или (VI) для приготовления лекарственного средства для профилактики и /или лечения заболеваний, опосредованных PI3-киназой, особенно киназой PI3K. Специфическими заболеваниями являются заболевания, выбранные из группы, включающей или состоящей из аутоиммунных нарушений и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, бактериальных или вирусных инфекций, заболеваний почек, агрегации тромбоцитов, рака, осложнений после трансплантации из-за реакций отторжения, отторжения трансплантата или легочных нарушений. В предпочтительном варианте осуществления изобретения упомянутые соединения полезны для лечения и/или профилактики аутоиммунных нарушений или воспалительных заболеваний, как, например, рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, воспалительное заболевание кишечника, воспаление легких, тромбоз или мозговая инфекция/воспаление, как, например,менингит или энцефалит. В другом предпочтительном варианте осуществления изобретения такие соединения полезны для лечения и/или профилактики нейродегенеративных заболеваний, включая рассеянный склероз, болезнь Альцгеймера, хорею Гентингтона, травму центральной нервной системы, удар или ишемические состояния. В особо предпочтительном варианте осуществления изобретения такие соединения полезны для лечения и/или профилактики сердечно-сосудистых заболеваний, как, например, атеросклероз, гипертрофия сердца, дисфункция сердечных мышечных клеток, повышенное кровяное давление или сужение кровеносных сосудов. В другом особенно предпочтительном варианте осуществления изобретения такие соединения полезны для лечения и/или профилактики хронического обструктивного легочного заболевания, фиброза,вызванного анафилактическим шоком, псориаза, аллергических заболеваний, астмы, удара или ишемических состояний, ишемии-реперфузии, агрегации тромбоцитов/активации, атрофии скелетных мышц/гипертрофии, рекруитмента лейкоцитов в раковой ткани, развития кровеносных сосудов, инвазивного метастазирования, в частности, меланомы, саркомы Карпоши, острых и хронических бактериальных и вирусных инфекций, сепсиса, осложнений после трансплантации в результате реакций отторжения, отторжения трансплантата, гломерулосклероза, гломерулонефрита, прогрессирующего фиброза почек, эндотелиальных и эпителиальных легочных нарушений и обычного воспаления легких. Согласно настоящему изобретению соединения формулы (II), (II-а), (III), (IV), (V) или (VI) годятся для модуляции, в частности, для подавления активности PI3-киназы и, в особенности, активности PI3K. Еще другим объектом настоящего изобретения является способ получения азолидинонвинильных производных конденсированного бензола согласно формуле (I), (Ia), (Ib), (Ic) или (Id), но также тиазолидинонвинильных производных конденсированного бензола формул (II), (II-а), (III), (IV), (V) или (VI). Азолидинонвинильные производные конденсированного бензола, представленные примерами в настоящем изобретении, могут быть получены из легко доступных исходных веществ при использовании обычных способов и методик. Понятно, что там, где упоминаются типичные или предпочтительные экспериментальные условия (т.е., температуры реакций, время, количества молей реагентов, растворители и т. д.), другие условия эксперимента могут быть также применены, если не указано иначе. Оптимальные условия реакции могут варьироваться в зависимости от конкретно используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области при применении обычных методик оптимизации. В способе, проиллюстрированном в следующих схемах, R1, R2, G, V, W, Y1, Y2, Z, m, n, о, р и q являются каждый таким, как определено выше в описании.- 14011807 Обычно азолидинонвинильные производные конденсированного бензола согласно общей формуле(I) могут быть получены с помощью нескольких синтетических подходов, использующих протоколы проведения химических реакций как в растворе, так и в твердой фазе (Brummond et.al., J.O.C., 64, 1999,1723-1726), или с помощью общепринятых способов, или с помощью методик, использующих возбуждение микроволнами. Схема 1 На первой стадии примерно эквимолярные количества альдегидного реагента P1 (P1a) и соединения 2 (в частности, тиазолидиндиона или роданина Р 3) нагревают в присутствии предпочтительно мягкого основания для получения соответствующего олефина формулы (Ia). На первой стадии P1a может быть заменен предшественниками P1b и Р 1 с для получения конечных соединений (Ib) и (Ic), соответственно,как представлено выше в описании. Особенно предпочтительный способ согласно изобретению иллюстрируется следующими схемами 3 и 4, в которых соединения формулы (II) и (III), соответственно, могут быть получены с применением таких же реакций, как и упомянутые выше. Схема 3 В то время как эта стадия может быть проведена в отсутствии растворителя при температуре, достаточно высокой, чтобы вызвать, как минимум, частичное плавление реакционной смеси, предпочтительно проводить эту стадию в присутствии инертного растворителя. Предпочтительный диапазон температур составляет примерно от 100 до 250 С и особенно предпочтительной является температура примерно от 120 до 200 С. Примеры таких растворителей для вышеупомянутых реакций включают растворители, подобные диметоксиметану, ксилолу, толуолу, о-дихлорбензолу и т. д. Примеры подходящих мягких оснований для упомянутой выше реакции представляют соли слабых кислот с щелочными и щелочно-земельными металлами, как, например, (С 1-С 12)алкилкарбоновых кислот и бензойной кислоты,карбонаты и бикарбонаты щелочных и щелочно-земельных металлов, как, например, карбонат кальция,карбонат магния, бикарбонат калия, и вторичные амины, как, например, пиперидин, морфолин, а также- 15011807 третичные амины, как, например, пиридин, триэтиламин, диизопропилэтиламин, N-метилморфолин, Nэтилпиперидин, N-метилпиперидин и им подобные соединения. Особенно предпочтительными мягкими основаниями с точки зрения экономии и эффективности являются ацетат натрия или пиперидин. В такой типичной реакции (Tietze и др., в "The Knoevenagel reaction", cc.341 и следующие стр., изд.Pergamon Press, Оксфорд, 1991, Ред.: Trost B.M., Fleming I.) представляющее альдегид исходное вещество Р 1a и другое исходное вещество (например, тиазолидиндион) Р 3 смешивают примерно в эквимолярных количествах с 0,5-1 эквивалентом пиперидина в диметоксиметане или похожем растворителе и нагревают при температуре между 120 и 200 С, при этой температуре реакция, в основном, завершается примерно за период от 15 мин до 3 ч. Желаемый олефин формулы (Ia) затем выделяют путем фильтрации в случае, если он выпадает в осадок из реакционной смеси при охлаждении, или, например, путем смешивания с водой и последующей фильтрации для получения технического продукта, который очищают,если нужно, например, путем кристаллизации или с применением стандартных хроматографических способов. Альтернативно, соединения формулы (Ia) могут быть обычно получены при смешивании эквимолярных количеств тиазолидиндиона Р 3 и альдегида P1 а и молярного избытка, предпочтительно 2-4 кратного избытка, безводного ацетата натрия и нагревании полученной смеси при температуре, достаточно высокой, чтобы добиться плавления, при этой температуре реакция в основном завершается в течение периода от 5 до 60 мин. Предпочтительно вышеупомянутая реакция проводится в кислых средах, как, например, уксусная кислота, в присутствии ацетата натрия или -аланина. Описанные выше реакции могут проводиться альтернативно при нагревании с помощью микроволнового излучения. Обычно представляющее альдегид исходное вещество P1a и тиазолидиндион Р 3 смешивают примерно в эквимолярных количествах с 0,5-1 эквивалентом пиперидина в диметоксиметане или похожем растворителе и нагревают при температуре между 140 и 240 С, при такой температуре реакция в основном завершается в течение периода от 3 до 10 мин. Фармацевтически приемлемые катионные соли соединений по настоящему изобретению легко получают при реакции кислотных форм с подходящим основанием, обычно с одним эквиавалентом, в совместном растворителе. Типичными основаниями являются гидроокись натрия, метилат натрия, этилат натрия, гидрид натрия, гидроокись калия, метилат калия, гидроокись магния, гидроокись кальция, бензатин, холин, диэтаноламин, этилендиамин, меглюмин, бенетамин, диэтиламин, пиперазин и трометамин. Соль выделяют при концентрировании досуха или при прибавлении осадителя. В некоторых случаях соли могут быть получены при смешении раствора кислоты с раствором катиона (натриевая соль этилкапроновой кислоты, олеат магния), применяя растворитель, в котором желаемая катионная соль выпадает в осадок, или может быть выделена иным способом путем концентрирования и прибавления осадителя. Производные 2,4-азолидинона Р 3 коммерчески доступны из различных источников. Альдегиды формулы Р 1a получают с помощью разнообразных хорошо известных способов, например, исходя из соответствующего алкилового эфира карбоновой кислоты или из карбоновой кислоты путем окислениявосстановления, используя стандартные методики восстановления алкилового эфира карбоновой кислоты или карбоновой кислоты в бензиловые спирты с помощью алюмогидрида лития, диизопропилалюминийгидрида и т.д. и в конечном счете повторного окисления соответствующего бензилового спирта в соответствующий альдегид путем мягкого окисления с помощью реагентов, как, например, двуокись марганца, хромовая кислота, реагент Десса-Мартина, или путем окисления по Сверну, или в условиях,известных для получения альдегидов из первичных спиртов. Альтернативный путь может представлять прямое восстановление соответствующего алкилового эфира карбоновой кислоты или карбоновой кислоты в соответствующий альдегид с использованием диизобутилалюминийгидрида при низкой температуре или с применением любых других методик, известных в данной области. Схема 5 Альтернативный путь получения подходящих альдегидов представляет селективное восстановление представляющей нитрил составляющей в соответствующий альдегид с использованием известных способов, как, например, с применением диизобутилалюминийгидрида и т.д. Другой путь подхода к альдегидам формулы Р 1a представляет селективное восстановление соответствующего хлорангидрида карбоновой кислоты с применением, например, алюминий-три-трет-бутоксигидрида лития (Cha J.S., Brown Н.С., J.O.C., 58, 1993, cc.4732-34). Другим альтернативным путем получения соответствующих альдегидов является реакция соответствующего бензольного производного по типу реакции Фриделя-Крафтса,когда субстрат Р 4, как показано на схеме 5 выше, подвергается реакции с простым (1,1-дихлорметил)- 16011807 метиловым эфиром в присутствии кислоты Льюиса, как, например, четыреххлористый титан или треххлористый алюминий, или любых соответствующих кислот Льюиса, подходящих для реакции такого типа. Согласно особо более предпочтительному способу по изобретению, как описано в литературе (Petrov O.I., Kalcheva V.B., Antonova А.T., Collect. Czech. Chem. Commun., 62, 1997, cc.494-7) и проиллюстрировано далее схемой 6, реагент Р 2 может быть получен, исходя из Р 5, при реакции с простым (1,1 дихлорметил)метиловым эфиром, как описано выше. Схема 6 Согласно другому, более, в частности, предпочтительному способу по изобретению, как здесь проиллюстрировано далее схемой 7, реагент Р 6 может быть получен из Р 7 при реакции с диметилформамидом и в присутствии магния или н-бутиллития или любым другим способом, известным специалисту в данной области. Схема 7 Согласно другому, особенно более предпочтительному способу по изобретению, как далее проиллюстрировано схемой 8, реагент Р 6 может быть получен из Р 9 при реакции с н-бутиллитием или диизопропиламидом лития в присутствии подходящего электрофильного реагента R1-X, или любым другим способом, известным специалисту в данной области. Этот способ может быть повторен и для соединения Р 8 при получении Р 6, соответственно. Схема 8 Аналогично, насыщенные предшественники Р 6 могут быть получены при проводимой в одном аппарате реакции с применением Р 9 и подходящих электрофильных реагентов R1-X и R2-X, как представлено на схеме 9. Схема 9 Если представленные выше общие синтетические способы не являются пригодными для получения соединений формулы (I) и/или нужных промежуточных продуктов для синтеза соединений формулы (I),должны быть использованы подходящие способы получения, известные специалисту в данной области. Обычно, пути синтеза для любого отдельного соединения формулы (I) будут зависеть от конкретных заместителей каждой молекулы и от легкой доступности необходимых промежуточных соединений; опять же, такие факторы оцениваются специалистами в данной области. Чтобы ознакомиться со всеми способами защиты и снятия защиты, см. Philip J. Kocienski, в "Protecting Groups", изд-во Georg Thieme Verlag Stuttgart, Нью-Йорк, 1994, и Theodora W. Greene и Peter G. M.Wuts в "Protective Groups in Organic Synthesis", изд. Wiley Interscience, 3-е издание, 1999. Соединения по настоящему изобретению могут быть выделены вместе с молекулами растворителя при кристаллизации после выпаривания соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений по настоящему изобретению, которые содержат основной центр,могут быть получены обычным способом. Например, раствор свободного основания может быть обработан подходящей кислотой, либо чистой, либо в подходящем растворе и получаемую соль выделяют либо путем фильтрации, либо путем выпаривания в вакууме использованного в реакции растворителя. Фармацевтически приемлемые основно-аддитивные соли могут быть получены аналогично при обработке раствора соединения по настоящему изобретению подходящим основанием. Оба типа солей могут быть об- 17011807 разованы или подвергнуты взаимному превращению с применением методик с использованием ионообменных смол. Когда их используют в качестве фармацевтических препаратов, азолидиндион-винильные производные конденсированного бензола по настоящему изобретению обычно применяются в виде фармацевтической композиции. Следовательно, фармацевтические композиции, включающие соединение по настоящему изобретению, фармацевтически приемлемый носитель, разбавитель или наполнитель, также входят в объем настоящего изобретения. Специалист в данной области осведомлен о всем разнообразии таких носителей, разбавителей или наполнителей, годящихся для приготовления фармацевтической композиции. Соединения по изобретению вместе с обычно применяемым адъювантом, носителем, разбавителем или наполнителем могут быть представлены в виде фармацевтических композиций и их стандартных доз и в такой форме могут применяться в виде твердых веществ, как, например, таблетки или заполненные капсулы, или жидкостей, как, например, растворы, суспензии, эмульсии, эликсиры, или в виде капсул,заполненных этими же жидкостями, или в форме для перорального применения, или в виде стерильных инъекционных растворов для парентерального (включая подкожное) применения. Такие фармацевтические композиции и их лекарственные формы с унифицированными дозами могут включать ингредиенты в обычных соотношениях с дополнительными или без них активными соединениями или элементами, и такие формы с унифицированными дозами могут содержать любое подходящее эффективное количество активного ингредиента, соизмеримое с предполагаемым диапазоном применяемой дневной дозы. Фармацевтические композиции, содержащие азолидиндионвинильные производные конденсированного бензола могут быть приготовлены способом, хорошо известным в фармацевтике, и содержать,как минимум, одно активное соединение. Обычно соединения по данному изобретению применяют в фармацевтически эффективном количестве. Количество фактически применяемого соединения обычно определяет врач, учитывая относящиеся к делу обстоятельства, включающие подвергающееся лечению состояние, выбранный путь введения, фактически вводимое соединение, возраст, массу тела и реакцию отдельного пациента, тяжесть симптомов у больного и им подобные обстоятельства. Фармацевтические композиции по настоящему изобретению могут вводиться разнообразными способами, включая пероральное введение, введение через прямую кишку, чрескожное введение, подкожное введение, внутривенное, внутримышечное введение и введение через нос. Композиции для перорального введения могут быть в виде жидких растворов или суспензий в объеме, или в виде нерасфасованных порошков. Более обычно, однако, композиции присутствуют в лекарственных формах с унифицированными дозами для облегчения точной дозировки. Термин "лекарственные формы с унифицированной дозой" относится к физически дискретным единицам, подходящим в качестве унитарных доз для людей и других млекопитающих, каждая единица содержит предварительно установленное количество активного вещества, рассчитанное так, чтобы вызвать желаемый терапевтический эффект, в сочетании с подходящим фармацевтическим наполнителем. Обычные лекарственные формы с унифицированными дозами включают предварительно заполненные ранее измеренными количествами жидких композиций ампулы или шприцы или порошки, таблетки, капсулы или им подобные формы в случае твердых композиций. В таких композициях тиазолидиндионвинильное производное конденсированного бензола обычно является меньшим компонентом (примерно от 0,1 до примерно 50 мас.% или предпочтительно примерно от 1 до примерно 40 мас.%), а остальное составляют различные растворители или носители и вспомогательные средства, помогающие в создании желаемой дозированной лекарственной формы. Жидкие формы, подходящие для перорального применения могут включать подходящий водный или неводный носитель с буферами, суспендирующими и диспергирующими средствами, красителями,ароматизаторами и им подобными веществами. Твердые формы могут включать, например, любой из следующих ингредиентов или любое из соединений похожей природы: связывающее вещество, как, например, микрокристаллическая целлюлоза, трагакант или желатина; наполнитель, как, например, крахмал или лактоза, дезинтегрирующее средство, как, например, альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, как, например, стеарат магния; придающее скользкость вещество, как, например, коллоидная двуокись кремния; подсластитель, как, например, сахароза или сахарин; или вкусовая добавка, как, например, мята перечная, метиловый эфир салициловой кислоты или вкусовая добавка с апельсиновым вкусом. Инъецируемые композиции обычно готовят на основе инъецируемого стерильного физиологического раствора или забуференного фосфатом физиологического раствора, или других инъецируемых носителей, известных в данной области. Как указывалось выше, тиазолидиндионвинильные производные конденсированного бензола формулы (I) в таких композициях обычно представляют меньший компонент, часто находящийся в пределах от 0,05 до 10 мас.%, остальное представляет инъецируемый носитель и ему подобные средства. Описанные выше компоненты для вводимых перорально или инъецируемых композиций являются только примерами. Другие материалы, а также методики для приготовления и им подобные материалы приведены в Remington's Pharmaceutical Sciences, часть 5, 20-е издание, 2000, изд-во Marck Publishing- 18011807 Соединения по данному изобретению могут также вводиться в формах с поддерживаемым высвобождением или с помощью систем доставки лекарственного средства с поддерживаемым высвобождением. Описание типичных материалов с поддерживаемым высвобождением можно также найти в материалах, включенных в Remington's Pharmaceutical Sciences. В дальнейшем настоящее изобретение будет иллюстрироваться некоторыми примерами, которые не должны рассматриваться как ограничивающие объем изобретения. В представленных далее примерах используются следующие сокращения: мин (минута), ч (час), г (грамм), ммоль (миллимоль), tпл (температура плавления), экв.(эквиваленты), мл (миллилитр), мкл (микролитры), АЦН (ацетонитрил), Boc (бутоксикарбонил), КБЗ (карбоксибензил), CDCl3 (дейтерированный хлороформ), сНех (циклогексан), ДБА(тетрафторборат О-бензотриазолил-N,N,N',N'-тетраметилурония), ТЭА (триэтиламин), ТФК (трифторуксусная кислота), ТГФ (тетрагидрофуран, ТМОФ (триметилортоформиат), ТМАД (N,N,N',N'тетраметилазодикарбоксамид), TosCl (толуолсульфохлорид). Примеры Приведенные в следующем списке соединения были синтезированы согласно указанным далее способам: 1. 5-(1,3-бензодиоксол-5-илметилен)-1,3-тиазолидин-2,4-дион 2. 5-(1,3-бензодиоксол-5-илметилен)-2-тиоксо-1,3-тиазолидин-4-он 3. 5-(2,3-дигидро-1,4-бензодиоксин-6-илметилен)-1,3-тиазолидин-2,4-дион 4. 5-(2,3-дигидро-1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион 5. 5-[(7-метокси-1,3-бензодиоксол-5-ил)метилен]-1,3-тиазолидин-2,4-дион 6. 5-[(9,10-диоксо-9,10-дигидроантрацен-2-ил)метилен]-1,3-тиазолидин-2,4-дион 7. (5-[(2,2-дифтор-1,3-бензодиоксол-5-ил)метилен]-1,3-тиазолидин-2,4-дион 8. (5Z)-5-(1,3-дигидро-2-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион 9. 5-(1-бензофуран-5-илметилен)-1,3-тиазолидин-2,4-дион 10. 5-[(4-метил-3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 11. 5-(1,3-бензодиоксол-5-илметилен)-2-имино-1,3-тиазолидин-4-он 12. 5-хинолин-6-илметилентиазолидин-2,4-дион 13. 5-хинолин-6-илметилен-2-тиоксотиазолидин-4-он 14. 2-имино-5-хинолин-6-илметилентиазолидин-4-он 15. 5-(3-метилбензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион 16. 5-(4-фенилхиназолин-6-илметилен)тиазолидин-2,4-дион 17. 5-(4-диметиламинохиназолин-6-илметилен)тиазолидин-2,4-дион 18. 5-[(4-аминохиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 19. 5-[(4-пиперидин-1-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 20. 5-[(4-морфолин-4-илхиназолин-6-ил)метилен]-1,3-тиазолидин-2,4-дион 21. 5-[4-(бензиламино)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 22. 5-[4-(диэтиламино)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 23. 5-(4-[(пиридин-2-илметил)амино]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 24. 5-(4-[(пиридин-3-илметил)амино]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 25. этиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-илпиперидин-3 карбоновой кислоты 26. этиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-илпиперидин-4 карбоновой кислоты 27. трет-бутиловый эфир 1-6-[(2,4-диоксо-1,3-тиазолидин-5-илиден)метил]хиназолин-4-ил-Lпролина 28. 5-[4-(4-метилпиперазин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 29. 5-[4-(4-пиримидин-2-илпиперазин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 30. 5-(4-[4-(4-фторфенил)пиперидин-1-ил]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 31. 5-[4-(4-бензилпиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 32. 5-(4-[4-(2-фенилэтил)пиперидин-1-ил]хиназолин-6-илметилен)-1,3-тиазолидин-2,4-дион 33. 5-[4-(4-метилпиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 34. 5-[4-(4-гидроксипиперидин-1-ил)хиназолин-6-ил]метилен-1,3-тиазолидин-2,4-дион 35. 1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-4-карбоновая кислота 36. 1-[6-(2,4-диоксотиазолидин-5-илиденметил)хиназолин-4-ил]пиперидин-3-карбоновая кислота[6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3 дигидробензо[1,4]оксазин-4-ил]уксусной кислоты 101. N-бензил-2-[6-(2,4-диоксотиазолидин-5-илиденметил)-3-оксо-2,3-дигидробензо[1,4]оксазин-4 ил]ацетамид 102. 5-(4-бутил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 103. 5-(4-бензил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-илметилен)тиазолидин-2,4-дион 104. 5-(2-хлорбензофуран-5-илметилен)тиазолидин-2,4-дион 105. 5-(3-аминобензо[d]изоксазол-5-илметилен)тиазолидин-2,4-дион 106. 5-(3-фенилэтинилбензофуран-5-илметилен)тиазолидин-2,4-дион 107. 5-бензо[1,2,5]тиадиазол-5-илметилентиазолидин-2,4-дион 108. 5-бензо[1,2,5]оксадиазол-5-илметилентиазолидин-2,4-дион 109. 5-(2-метилбензофуран-6-илметилен)тиазолидин-2,4-дион 110. 5-(2-карбоксиметилбензофуран-6-илметилен)тиазолидин-2,4-дион 111. 5-(3-бром-2-фтор-2,3-дигидробензофуран-6-илметилен)тиазолидин-2,4-дион 112. 5-(2-фторбензофуран-6-илметилен)тиазолидин-2,4-дион Следующие промежуточные альдегиды являются коммерчески доступными: 2,2-дифтор-1,3 бензодиоксол-5-карбальдегид, 1,3-бензодиоксол-5-карбальдегид, 1,4-бензодиоксан-6-карбальдегид, 9,10 диоксо-9,10-дигидроантрацен-2-карбальдегид, 2,3-дигидробензо[b]фуран-5-карбальдегид, 3-метокси-4,5 метилендиоксибензальдегид. Тиазолидиндион и роданин являются коммерчески доступными. Промежуточные альдегиды синтезировали согласно протоколам, как указано ниже. Данные высокоэффективной жидкостной хроматографии (ВЭЖХ), ядерного магнитного резонанса(ЯМР) и масс-спектрометрии (МС), приведенные в примерах, описанных ниже, были получены следующим образом: ВЭЖХ: колонка Waters Symmetry C8 504,6 мм, условия: MeCN/H2O, 5 - 100% (8 мин),детектирование в диапазоне 230-400 нм; масс-спектры: PE-SCIEX API 150 EX (химическая ионизация при атмосферном давлении /APCI/ и ионизация электрораспылением /ESI/), ЖХ/МС: Waters ZMD (электрораспыление /ES/); 1 Н-ЯМР: Bruker DPX-300 МГц. Операции очистки проводили следующим образом: препаративная ВЭЖХ с использованием системы Waters Prep LC 4000, снабженной колонками Prep Nova-Pak HR С 186 мкм 60 , 4030 мм (до 100 мг) или 40300 мм (до 1 г). Все операции очистки проводили с градиентом MeCN/Н 2 О 0,09% ТФК. Промежуточное соединение 1. Получение 5-формил-1-бензофурана- 21011807 Стадия I: Этил-2-формил-4-бромфеноксиацетат: Смесь 5-бромсалицилового альдегида (50 г, 0,248 моля), этилбромацетата (42 г, 0,248 моля) и карбоната калия (68 г, 0,49 моля) в безводном ДМФА (200 мл) перемешивали 12 ч при комнатной температуре. Реакционную смесь фильтровали и фильтрат разбавляли водой. Смесь экстрагировали диэтиловым эфиром (4200 мл), промывали соляным раствором и концентрировали, получали технический этил-2 формил-4-бромфеноксиацетат (64 г, 90%) в виде твердого вещества. Стадия II: 4-Бром-2-формилфеноксиуксусная кислота: Смесь этил-2-формил-4-бромфеноксиацетата (60 г, 0,209 моля), гидроокиси лития (7,5 г, 0,31 моля),тетрагидрофурана (250 мл) и воды (100 мл) перемешивали при комнатной температуре 24 ч. Реакционную смесь концентрировали в вакууме и остаток подкисляли 1,5 н. HCl до рН=2. Полученный твердый осадок отфильтровывали и сушили,получали 4-бром-2 формилфеноксиуксусную кислоту (50 г, 94%). Стадия III: 5-Бром-1-бензофуран: К смеси 2-формил-4-бромфеноксиуксусной кислоты (50 г, 0,192 моля), ацетата натрия (100 г, 1,21 моля) в уксусной кислоте (250 мл) при 100 С прибавляли порциями уксусный ангидрид (100 мл) в течение 3 ч. Реакционную смесь затем кипятили с обратным холодильником 20 ч. Растворитель удаляли путем дистилляции и остаток разбавляли 3 н. HCl (500 мл) и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь затем концентрировали в вакууме и продукт экстрагировали петролейным эфиром (3200 мл). Органический слой затем промывали 10%-ным раствором бикарбоната натрия и упаривали, получали 5-бром-1-бензофуран (15 г, 40%) в виде бледно-желтой жидкости. Стадия IV: 5-Формил-1-бензофуран (Р 1 а на схеме 2 для примера 9) Смесь 5-бром-1-бензофурана (0,5 г), магния (0,92 г, 0,038 моля), I2 (1 кристалл) в безводном ТГФ(2,5 мл) кипятили с обратным холодильником в атмосфере азота в течение 30 мин. К смеси прибавляли раствор 5-бром-1-бензофурана (4,5 г) в 25 мл безводного ТГФ, как только исчезало вызванное I2 окрашивание, и кипятили с обратным холодильником еще 2 ч. Реакционную смесь затем охлаждали до -40 С и прибавляли по каплям безводный диметилформамид (3,6 г) и медленно нагревали до комнатной температуры в течение 12 ч. Реакционную смесь затем охлаждали до 0 С и подкисляли 3 н. HCl до рН=2 и перемешивали 30 мин. Реакционную смесь затем разбавляли водой (500 мл), экстрагировали этилацетатом(2200 мл), промывали соляным раствором и сушили. Растворитель удаляли в вакууме и очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/дихлорметан), получали 5 формил-1-бензофуран (2 г, 54%) в виде жидкости. ЖХ-МС: m/z ESI: 1,47 мин, 147,34 (М+1). Промежуточное соединение 2. Получение 4-метил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6 карбальдегида Стадия I: 2-(N-метиламино)фенол Растворяли 1 г бензоксазола в 20 мл ТГФ. Прибавляли при перемешивании в атмосфере азота 0,9 г боргидрида натрия. Суспензию охлаждали до 0 С и медленно прибавляли 0,86 мл уксусной кислоты,растворенной в 5 мл ТГФ, поддерживая температуру реакции ниже 5 С. Реакционную смесь перемешивали при 0 С в течение 30 мин и еще 12 ч при комнатной температуре. Реакционную смесь опять охлаждали до 0 С и осторожно прибавляли 50 мл насыщенного раствора хлористого аммония. Фазы разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали соляным раствором, сушили над сульфатом магния и фильтровали. После удаления растворителя получали 0,97 г чистого 2-(N-метиламино)фенола. Стадия II: 4-Метил-4 Н-бензо[1,4]оксазин-3-он Растворяли в хлороформе 1 г 2-(N-метиламино)фенола, затем прибавляли 10 мл насыщенного раствора бикарбоната натрия в воде. К полученной суспензии медленно прибавляли при интенсивном перемешивании раствор 1 г 2-хлорацетилхлорида в ацетоне. Реакционную смесь перемешивали 2 ч при комнатной температуре. Слои разделяли. Органический слой промывали водой и сушили над сульфатом натрия. После выпаривания растворителя маслообразный продукт красного цвета растворяли в 30 мл ДМФА и прибавляли 1 г карбоната калия, суспензию нагревали при 70 С в течение дополнительных 2 ч. За циклизацией следили с помощью тонкослойной хроматографии (ТСХ). Прибавляли 200 мл этилацетата и органический слой промывали три раза 0,1 н. HCl и пять раз соляным раствором. Оставшийся органический слой сушили над сульфатом магния и фильтровали. Этилацетат удаляли в вакууме, получали 1,45 г чистого 4-метил-4 Н-бензо[1,4]оксазин-3-она. Стадия III: 4-Метил-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-карбальдегид Суспендировали 1 г AlCl3 в 10 мл ДХМ, прибавляли 0,5 мл нитрометана для растворения АlСl3 и раствор охлаждали до 0 С. Растворенный в ДХМ 4-метил-4 Н-бензо[1,4]оксазин-3-он (0,5 г, 3,06 ммоля) прибавляли к вышеуказанному раствору и перемешивали 15 мин при 0 С. К полученному раствору далее- 22011807 прибавляли 0,36 мл бис(хлорметил)метилового эфира в дихлорметане. Реакционную смесь перемешивали при 0 С в течение 15 мин и 3 ч при комнатной температуре. Техническую реакционную смесь затем выливали в лед, слои разделяли и органическую фазу промывали бикарбонатом натрия и соляным раствором. После сушки над сульфатом магния и фильтрации растворитель выпаривали, получали 0,43 г технического продукта. Маслообразный продукт темного цвета очищали с помощью флэшхроматографии, используя в качестве элюентов этилацетат и циклогексан, получали 0,2 г (37%) 4-метил 3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-карбальдегида в виде бесцветного твердого вещества. ВЭЖХ: 2,07 мин. ЖХ-МС: m/z ESI: 1,31 мин, 192,28 (М+1). Промежуточное соединение 3. Получение 4-метил-3,4-дигидро-2 Н-бензо[1,4]оксазин-7 карбальдегида Стадия I: 4-Метил-3,4-дигидро-2 Н-бензо[1,4]оксазин Растворяли 0,97 г 2-(N-метиламино)фенола в 50 мл ацетона, затем прибавляли 2 г карбоната калия,растворенного в воде. К полученной суспензии медленно прибавляли раствор 2,66 г дибромметана в ацетоне. Реакционную смесь перемешивали 22 ч при кипячении с обратным холодильником. Ацетон выпаривали и прибавляли 200 мл этилацетата и органический слой промывали трижды 0,1 н. HCl и трижды соляным раствором. Оставшийся органический слой сушили над сульфатом магния и фильтровали. Этилацетат удаляли в вакууме, получали 1 г чистого 4-метил-3,4-дигидро-2 Н-бензо[1,4]оксазина. Стадия II: 4-Метил-3,4-дигидро-2 Н-бензо[1,41 оксазин-7-карбальдегид Растворяли 4-метил-3,4-дигидро-2 Н-бензо[1,4]оксазин в 200 мкл ДМФА в атмосфере аргона. Прибавляли хлорокись фосфора в атмосфере аргона. Реакционную смесь нагревали в закупоренной ампуле при 90 С в течение 75 мин. Прибавляли 1 мл раствора ацетата натрия в воде и перемешивали пока не образовывалось масло коричневого цвета. Масло экстрагировали дихлорметаном. Органический слой промывали соляным раствором, сушили и упаривали досуха, получали 0,18 г (76%) 4-метил-3,4-дигидро 2 Н-бензо[1,4]оксазин-7-карбальдегида в виде твердого бесцветного вещества. ЖХ-МС: m/z ESI: 1,37 мин, 178,35 (М+1). Промежуточное соединение 4. Получение 1,3-дигидроизобензофуран-5-карбальдегида Стадия I: (1,3-Дигидроизобензофуран-5-ил)метанол В круглодонную колбу, снабженную обратным холодильником, помещали 1,0 г 3-проп-2 инилоксипропина и 2,08 г пропаргилового спирта в 10 мл этанола, затем прибавляли 9,8 мг хлорида трис(трифенилфосфин)родия (катализатор Вилкинсона) при комнатной температуре. Реакционную смесь нагревали до 70 С, в это время цвет реакционной массы быстро становился желтым. После перемешивания в течение 1 дня при комнатной температуре анализ с помощью ТСХ указывал на полное превращение исходного вещества. Растворитель выпаривали, разбавляли дихлорметаном и экстрагировали водой,сушили над сульфатом магния. Смесь коричневого цвета очищали с помощью флэш-хроматографии,применяя в качестве подвижной фазы циклогексан/этилацетат 8/2, получали (1,3-дигидроизобензофуран 5-ил)метанол в виде чистого бесцветного твердого вещества (0,92 г, 60%). Стадия II: 1,3-Дигидроизобензофуран-5-карбальдегид(1,3-Дигидроизобензофуран-5-ил)метанол (440 мг, 2,9 ммоля) растворяли в 20 мл дихлорметана. Прибавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он (реагент Десса-Мартина) (1,3 г,3,2 ммоля) и реакционную смесь перемешивали при комнатной температуре 4 ч. Реакционную смесь разбавляли диэтиловым эфиром и экстрагировали дважды 1 н. гидроокисью натрия, дважды водой и сушили над сульфатом магния. Технический продукт был достаточно чистым и его использовали без дальнейшей очистки. ВЭЖХ: 2,00 мин. ЖХ-МС: m/z ESI: 1,50 мин, 149,18 (М+1). Промежуточное соединение 5. Получение хинолин-6-карбальдегида Стадия I: Хинолин-6-илметанол Растворяли 5 г метилового эфира хинолин-6-карбоновой кислоты в безводном ТГФ. В атмосфере аргона прибавляли 1 М раствор алюмогидрида лития в ТГФ (2 экв.) при -20 С. Раствор перемешивали при этой температуре в течение 1 ч. Медленно прибавляли изопропанол и технический продукт фильтровали через целит, и промывали дихлорметаном. После концентрирования получали 3,6 г (85%) чистого- 23011807 спирта. ВЭЖХ: 1,10 мин. ЖХ-МС: m/z ESI: 0,91 мин, 160,43 (М+1). Стадия II: Хинолин-6-карбальдегид Растворяли 2 г хинолин-6-илметанола в дихлорметане, прибавляли 15 г двуокиси марганца и реакционную смесь перемешивали в течение 5 ч. Технический продукт фильтровали через целит и тщательно промывали дихлорметаном. После концентрирования получали 1,85 г (93%) чистого альдегида. ВЭЖХ: 0,8 мин. ЖХ-МС: m/z ESI: 1,07 мин, 158,37 (М+1). 1 Н-ЯМР (ДМСО-d6)10,19 (s, 1H), 9,06 (t, J=3 Гц, 1H), 8,6-8,66 (m, 2H), 8,15 (s, 2H), 7,68 (dd, J=3 Гц, 9 Гц, 1H). Соответственно синтезировали следующее промежуточное соединение, применяя подходящие исходные вещества. Промежуточное соединение 6. Получение 3-метилбензо[d]изоксазол-5-карбальдегида ВЭЖХ: 2,06 мин. ЖХ-МС: m/z ESI: 1,26 мин, 162,31 (М+1). 1 Н-ЯМР (ДМСО-d6)10,10 (s, 1H), 8,52 (s, 1H), 8,16 (d, J=12 Гц, 1H), 8,15 (s, 2H), 7,90 (d, J=9 Гц,1H), 2,63 (s, 3 Н). Промежуточное соединение 7. Получение метилового эфира 4-хлорхиназолин-6-карбоновой кислоты Стадия I: 4-Нитроизофталевая кислота Смесь 3-метил-4-нитробензойной кислоты (150 г, 0,825 моля), пиридина (1,5 л) и воды (1,5 л) нагревали до температуры кипения с обратным холодильником. К горячей реакционной смеси прибавляли порциями перманганат калия (10 молей) и кипятили с обратным холодильником в течение 72 ч. Горячую реакционную смесь фильтровали через целит и промывали горячей водой. Фильтрат концентрировали в вакууме, остаток разбавляли водой (750 мл) и подкисляли концентрированной соляной кислотой при 0 С. Полученное твердое вещество отфильтровывали, промывали водой и сушили в вакууме, получали 4 нитроизофталевую кислоту (98 г, 56%). ТСХ, хлороформ/метанол, 7:3, Rf = 0,2. Стадия II: 4-Аминоизофталевая кислота К раствору 4-нитроизофталевой кислоты (98 г, 0,457 моля) в метаноле (5 л) прибавляли Pd/C (20%) и гидрировали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме, получали 4-аминоизофталевую кислоту (72 г, 87%) в виде твердого вещества. ТСХ, хлороформ/метанол, 7:3, Rf = 0,4. Стадия III: 4-Оксо-3,4-дигидрохиназолин-6-карбоновая кислота Смесь 4-аминоизофталевой кислоты (17 г, 0,093 моля) и формамида (85 мл) нагревали при 180 С в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и прибавляли ацетон. Полученный таким образом твердый остаток перемешивали 2 ч, фильтровали и высушивали, получали 4-оксо 3,4-дигидро-хиназолин-6-карбоновую кислоту (11 г, 61%). ТСХ, хлороформ/метанол, 8:2, Rf = 0,25. Стадия IV: Метиловый эфир 4-оксо-3,4-дигидрохиназолин-6-карбоновой кислоты К раствору 4-оксо-3,4-дигидрохиназолин-6-карбоновой кислоты (24 г, 0,126 моля) в безводном метаноле (800 мл) прибавляли тионилхлорид (37 г) при 5 С и затем кипятили с обратным холодильником при 80 С в течение 5 ч. Реакционную смесь концентрировали в вакууме и технический продукт растворяли в этилацетате (250 мл). Органический слой промывали 10%-ным водным раствором бикарбоната натрия, водой, соляным раствором и сушили. Растворитель удаляли в вакууме, получали метиловый эфир 4-оксо-3,4-дигидрохиназолин-6 карбоновой кислоты (24 г, 92%) в виде твердого вещества. ТСХ, хлороформ/метанол, 8:2, Rf = 0,6. Стадия V: Метиловый эфир 4-хлорхиназолин-6-карбоновой кислоты Смесь метилового эфира 4-оксо-3,4-дигидрохиназолин-6-карбоновой кислоты (12 г, 0,058 моля) и хлорокиси фосфора (180 мл) кипятили с обратным холодильником 7 ч. Избыток хлорокиси фосфора отгоняли и технический продукт растворяли в этилацетате (250 мл). Органический слой промывали 10%ным водным раствором бикарбоната натрия, водой, соляным раствором и сушили. Растворитель удаляли в вакууме и технический продукт очищали с помощью колоночной хроматографии на силикагеле (30% этилацетат в петролейном эфире), получали метиловый эфир 4-хлор-хиназолин-6-карбоновой кислоты- 24011807 Гц, 1 Н), 3,90 (s, 3 Н). Промежуточное соединение 8. Получение метилового эфира 4-метокси-хиназолин-6-карбоновой кислоты Перемешивали 200 мг метилового эфира 4-хлорхиназолин-6-карбоновой кислоты в 5 мл метанола в присутствии 1 экв. диизопропилэтиламина при 60 С в течение 24 ч. Метанол выпаривали и технический остаток растворяли в этилацетате и промывали хлористым аммонием, получали твердое вещество белого цвета, достаточно чистое для использования на следующей стадии. ВЭЖХ: 2,3 мин. ЖХ-МС: m/z ESI: 1,19 мин, 219,17 (М+1). Следующее промежуточное соединение синтезировали согласно синтезу промежуточного соединения 8: Промежуточное соединение 9. Получение метилового эфира 4-метиламино-хиназолин-6 карбоновой кислоты Это промежуточное соединение получали согласно способу синтеза промежуточного соединения 5,исходя из метилового эфира 4-метоксихиназолин-6-карбоновой кислоты. ВЭЖХ: 1,41 мин. ЖХ-МС: m/z Это промежуточное соединение получали согласно способу синтеза промежуточного соединения 5,исходя из метилового эфира 4-метиламинохиназолин-6-карбоновой кислоты. ВЭЖХ: 1,3 мин. ЖХ-МС: Стадия I: 4-Хлорхиназолин-6-илметанол К раствору метилового эфира 4-хлорхиназолин-6-карбоновой кислоты (3,5 г, 0,015 моля) в безводном ТГФ (35 мл) при -25 С прибавляли диизобутилалюминий-гидрид (4,4 г, 0,031 моля) и перемешивали при температуре от -25 С до комнатной в течение 2 ч. Реакционную смесь охлаждали до -10 С и смешивали с 10%-ным водным раствором бикарбоната натрия (9 мл). Реакционную смесь экстрагировали этилацетатом (100 мл), промывали водой, соляным раствором и сушили. Растворитель удаляли в вакууме,получали 4-хлорхиназолин-6-илметанол (2 г, 66%). ТСХ, хлороформ/метанол, 8:2, Rf = 0,35. Стадия II: 4-Хлорхиназолин-6-карбальдегид К раствору 4-хлорхиназолин-6-илметанола (3,5 г, 0,018 моля) в безводном дихлорметане (100 мл) прибавляли периодинан Десса-Мартина (8,4 г, 0,019 моля) и перемешивали 30 мин при комнатной температуре. Реакционную смесь промывали 10%-ным водным раствором бикарбоната натрия (75 мл), водой, соляным раствором и сушили. Растворитель удаляли в вакууме и получали 4-хлорхиназолин-6 карбальдегид (3 г, 88%) в виде твердого вещества бледно-желтого цвета. ТСХ, хлороформ/метанол, 9:1, Rf = 0,6. 4-Хлорхиназолин-6-карбальдегид (50 мг, 0,26 ммоля), Pd(PPh3)4 (13 мг, 0,01 ммоля), фенилборную кислоту (63 мг, 0,52 ммоля) и карбонат натрия (насыщенный раствор: 50 мкл) нагревали в толуоле при 100 С в течение 12 ч. После выпаривания растворителей остаток растворяли в этилацетате и дважды промывали соляным раствором. Органические фазы затем концентрировали и неочищенный продукт очищали на силикагеле, применяя в качестве элюентов дихлорметан/этанол 95:5, получали 50 мг (82%) желаемого соединения с чистотой 85%. ВЭЖХ: 2,68 мин. ЖХ-МС: m/z ESI: 1,25 мин, 235,30 (М+1). Промежуточное соединение 14. Получение 4-диметиламинохиназолин-6-карбальдегида 4-Хлорхиназолин-6-карбальдегид (200 мг, 1 ммоль) растворяли в 10 мл диоксана. К полученному раствору прибавляли раствор диметиламина в воде (5 экв.). Смесь перемешивали 2 ч при комнатной температуре. После выпаривания растворителей и остаточного амина в высоком вакууме получали чистый 4-диметил-аминохиназолин-6-карбальдегид в виде твердого вещества желтого цвета, который использовали на следующей стадии без дополнительной очистки (190 мг = 91%). ВЭЖХ: 0,91 мин. ЖХ-МС: m/z ESI: 1,23 мин, 202,33 (М+1). 1 Н-ЯМР (CDCl3):10,19 (s, 1H), 8,70 (s, 1H), 8,50 (d, J=3 Гц, 1H), 8,15 (dd, J=3 Гц, 9 Гц, 1H), 7,88 (d,J=9 Гц, 1H). Подобным же образом были синтезированы следующие промежуточные соединения с применением подходящих аминов в качестве нуклеофилов. Промежуточные соединения 32. Получение метилового эфира метилбензотриазол-5-карбоновой кислоты Растворяли 1 г метилового эфира бензотриазол-5-карбоновой кислоты (5,64 мл) в 20 мл ДМФА при 0 С. К полученному раствору прибавляли 1 экв. гидрида натрия (60%) при 0 С. Смесь перемешивали 30 мин при 0 С, медленно прибавляли 801 мг (1 экв.) йодистого метила и полученную в результате реакционную смесь перемешивали 2 ч при комнатной температуре. Прибавляли этилацетат и органический слой тщательно промывали соляным раствором и водой, сушили над сульфатом магния и фильтровали,получали 1 г технического метилового эфира метилбензотриазол-5-карбоновой кислоты в виде трех различных региоизомеров. Разделение проводили на силикагеле, применяя в качестве элюентов этилацетат/хлороформ 3:7. Промежуточное соединение 32 а. Метиловый эфир 2-метил-2 Н-бензотриазол-5-карбоновой кислоты Метиловый эфир 2-метил-2 Н-бензотриазол-5-карбоновой кислоты элюировали в виде первой фракции (250 мг, 22%). ВЭЖХ: 2,32 мин. 1 Н-ЯМР (ДМСО-d6)8,56 (s, 1 Н), 8,02 (d, J=9 Гц, 1 Н), 7,93 (d, J=9 Гц, 1 Н), 4,55 (s, 3H), 3,90 (s, 1H). Промежуточное соединение 32 б. Метиловый эфир 3-метил-3 Н-бензотриазол-5-карбоновой кислоты Метиловый эфир 3-метил-3 Н-бензотриазол-5-карбоновой кислоты элюировали в виде второй фракции (130 мг, 12%). ВЭЖХ: 2,03 мин. 1 Данное соединение синтезировали аналогично синтезу промежуточного соединения 5, применяя метиловый эфир 2-метил-2 Н-бензотриазол-5-карбоновой кислоты (промежуточное соединение 32 а) в качестве исходного вещества. ВЭЖХ: 1,88 мин. 1 Н-ЯМР (ДМСО-d6)10,12 (s, 1H), 8,65 (s, 1H), 8,06 (d, J=9 Гц, 1H), 7,85 (d, J=9 Гц, 1 Н), 4,57 (s, 3 Н). Промежуточное соединение 34. 3-Метил-3 Н-бензотриазол-5-карбальдегид Данное соединение синтезировали аналогично промежуточному соединению 5, используя метиловый эфир 3-метил-3 Н-бензотриазол-5-карбоновой кислоты (промежуточное соединение 32 б) в качестве исходного вещества. ВЭЖХ: 1,49 мин. 1H-ЯМР (ДМСО-d6)10,18 (s, 1H), 8,54 (s, 1H), 8,20 (d, J=9 Гц, 1H), 7,88(d, J=9 Гц, 1H), 4,41 (s, 3H). Промежуточное соединение 35. 1-Метил-1H-бензотриазол-5-карбальдегид Это промежуточное соединение синтезировали аналогично промежуточному соединению 5, применяя метиловый эфир 1-метил-1H-бензотриазол-5-карбоновой кислоты в качестве исходного вещества Стадия I: 3-Фтор-4-нитробензиловый спирт (Bioorg. Med. Chem. 7. 1999, 2647) К охлажденной до температуры льда суспензии боргидрида натрия (204 мг, 5,4 ммоля, 2 экв.) в тетрагидрофуране (10 мл) прибавляли по каплям 3-фтор-4-нитро-бензойную кислоту (500 мг, 2,7 ммоля, 1 экв.) в тетрагидрофуране (10 мл) в течение 30 мин. Затем прибавляли по каплям в течение 30 мин BF3Et2O (7,3 ммоля, 2,7 экв.). Раствор перемешивали в течение ночи при комнатной температуре. Прибавляли по каплям 1 н. соляную кислоту, чтобы убрать избыток боргидрида натрия. Растворитель удаляли в вакууме, остаток растворяли в дихлорметане, промывали водой, соляным раствором. Органический слой затем сушили над сульфатом магния и растворитель удаляли в вакууме, получали 425 мг 3-фтор-4 нитробензилового спирта (выход 92%). Вещество использовали на следующей стадии без дополнительной очистки. 1H-ЯМР: =(400 МГц, CDCl3): 7,97 (m, 1H), 7,28 (m, 1H), 7,18 (m, 1H), 4,75 (m, 2H). Стадия II: 3-Фтор-4-нитробензилальдегид 3-Фтор-4-нитробензиловый спирт (116 мг, 0,68 ммоля, 1 экв.) растворяли в дихлорметане (10 мл) и обрабатывали двуокисью марганца (580 мг, 6,73 ммоля, 10 экв.), и суспензию перемешивали при комнатной температуре в течение ночи. Двуокись марганца отфильтровывали от суспезии, используя целит,и растворитель выпаривали, получали соответствующий альдегид в виде твердого вещества белого цвета- 28011807 ммоля, 1 экв.) и -аланина (95 мг, 1,1 ммоля, 0,65 экв.) в уксусной кислоте (5 мл) перемешивали в течение ночи при 100 С. Охлажденную реакционную смесь прибавляли к воде и перемешивали в течение 1 ч. Выпавший в осадок продукт отфильтровывали и промывали водой, сушили и получали конечный продукт в виде твердого вещества желто-оранжевого цвета (выход 77%). 1H-ЯМР: =(400 МГц, (CD3)2CO): 8,0 (m, 1H, ArH), 7,68 (m, 2 Н, ArH), 7,53 (s, 1H, CH=C). Стадия IV: 5-(3-Этиламино-4-нитробензилиден)тиазолидин-2,4-дион 5-(3-Фтор-4-нитробензилиден)тиазолидин-2,4-дион (200 мг, 0,75 ммоля, 1 экв.) растворяли в диметоксиэтане (6 мл) и триэтиламине (208 мкл, 1,5 ммоля, 2 экв.) и прибавляли раствор этиламина (2 экв.). Реакционную смесь встряхивали при 60 С в течение ночи. Растворитель удаляли в вакууме и остаток растворяли в этилацетате и промывали 10%-ным водным раствором хлористого аммония. Органический слой сушили над сульфатом натрия и растворитель выпаривали, получали соответствующее производное анилина в виде масла красного цвета, которое использовали на следующей стадии без дополнительной очистки. Стадия V: 5-(3-Этиламино-4-аминобензилиден)тиазолидин-2,4-дион К перемешиваемому раствору 5-(3-этиламино-4-нитробензилиден)тиазолидин-2,4-диона в тетрагидрофуране медленно прибавляли раствор гидросульфита натрия (3 экв.) в воде, а затем водный раствор карбоната калия. Реакционную смесь кипятили с обратным холодильником в течение ночи. Тетрагидрофуран удаляли в вакууме и остаток экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и растворитель выпаривали, получали соответствующее производное анилина, которое применяли без какой-либо дополнительной очистки. Следующие промежуточные соединения синтезировали аналогичным способом, используя подходящие амины в качестве нуклеофилов, как описано для стадии IV при получении промежуточного соединения 36. Полученные таким образом 5-(3-алкил-амино-4-нитробензилиден)тиазолидин-2,4-дионы восстанавливали, как описано для стадии V при получении промежуточного соединения 36, получали 5(3-алкиламино-4-аминобензилиден)тиазолидин-2,4-дионы. Стадия I: Хлорангидрид хиноксалин-6-карбоновой кислоты В трехгорлую колбу емкостью 1 л помещали хиноксалин-6-карбоновую кислоту (20,2 г) в 500 мл тетрагидрофурана. К указанному раствору медленно прибавляли тионилхлорид (42 мл, 5 экв.). Механически перемешиваемую реакционную смесь нагревали с обратным холодильником до кипения и, контролируя с помощью ВЭЖХ, смешивали образец с гидрокисью аммония. После трех часов кипячения с обратным холодильником исходное вещество больше не присутствовало, растворитель удаляли в вакууме и
МПК / Метки
МПК: A61P 37/06, C07D 417/06, A61K 31/00, C07D 277/18
Метки: азолидинонвинильные, производные, бензола, конденсированного
Код ссылки
<a href="https://eas.patents.su/30-11807-azolidinonvinilnye-proizvodnye-kondensirovannogo-benzola.html" rel="bookmark" title="База патентов Евразийского Союза">Азолидинонвинильные производные конденсированного бензола</a>
Предыдущий патент: Устройство и способ извлечения обломков из скважины
Следующий патент: Антибактериальные агенты
Случайный патент: Содержащие бензоксазины лекарственные комбинации для лечения заболеваний дыхательных путей












