Макролиды
Номер патента: 11281
Опубликовано: 27.02.2009
Авторы: Канеко Такуси, Чупак Луис Стэнли, Рейлли Юса, Ное Марк Карл, Мэджи Томас Виктор, Флэнэган Марк Эдвард
Формула / Реферат
1. Соединение формулы
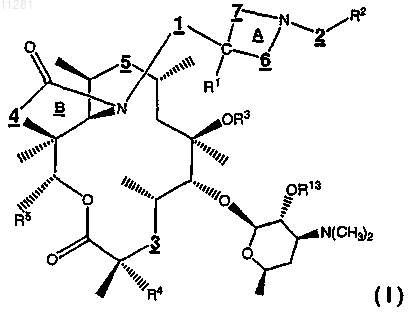
где дирадикал 1 является отсутствующим, означает >СН2 или >С(СН3)Н;
дирадикал 2 означает -С(О)(СН2)m-, -S(О)2(СН2)m-, -SO2N(R6)-, -(C(R6)(R7))m-, -C(O)O(CHR20)m- или
-C(O)N(R6)-, где m равно целому числу от 0 до 3;
дирадикал 3 означает >С(О), >СН(ОС(О)R14), >CH(OC(O)N(R14)R15), >CH(OC(O)OR15), >СН(ОС(О)CH(N(R14)R15)(CRaRb)nAr), >СН(ОС(О)CH(N(R14)R15)R14), >CH(OC(O)C(=NOR14)(CRaRb)nAr), >CH(ОС(О)С(=NOR14)R14), >CH(OC(O)(CRaRb)nAr), >CH(OC(O)(CRaRb)nN((CRaRb)nAr)R14) или
где n равно целому числу от 0 до 5;
дирадикал 4 означает >О или >N(R10), при условии, что, когда дирадикал 3 не является >C(О), дирадикал 4 означает >O;
дирадикал 5 означает >С(O), -C(O)NH-, -N(H)C(O)-, >CH(N(R8)R9), >C(=NC(O)R19) или >C(=NOR19);
дирадикал 6 означает -(C(Rc)(Rd))x-, где х равно целому числу от 0 до 5;
дирадикал 7 означает -(C(Rc)(Re))y-, где у равно целому числу от 0 до 5, при условии, что сумма х+у равна от 1 до 5;
R1 означает Н, ОН, F или (C1-С6)алкил, при условии, что, когда дирадикал 1 отсутствует, R1 означает Н;
R2 означает Ar;
R3 означает (C1-C6)алкил, (С2-С6)алкенил или (С2-С6)алкинил, любой из которых может быть замещен посредством Ar;
R4 означает Н или F, при условии, что, когда дирадикал 3 не является >С(O), R4 означает Н;
каждый из R5 и R20 независимо означает (C1-С6)алкил;
каждый из R6 и R7 независимо означает Н, (С1-С12)алкил, (С2-С12)алкенил или 4-6-членное гетероциклическое кольцо; где любая из указанных групп, за исключением Н, может быть замещена 1-3 заместителями группы S; и где независимо указанные (C1-С12)алкил и (С2-С12)алкенил могут содержать от 1 до 2 углеродов, независимо замещенных дирадикалами группы Т; и где независимо не более одной пары R6/R7 вместе с углеродом, к которому присоединены R6 и R7, могут образовывать 3-8-членное карбоциклическое кольцо; при условии, что не больше чем всего две из R6 и R7 групп отличны от Н;
R8 независимо означает Н, (C1-C6)алкил, -С(О)(C1-C6)алкил, -S(О2)(C1-С6)алкил, любой из которых, за исключением Н, может быть замещен 1-3 заместителями группы S;
R9 означает Н или (C1-С6)алкил, который может быть замещен 1-3 заместителями группы S;
R10 означает Н или (C1-С6)алкил;
каждый из R11 и R12 независимо означает: (а) Н, (C1-С12)алкил, (С2-С12)алкенил, (С2-С12)алкинил, любой из которых, за исключением Н, может быть заменен посредством -NH-, -N(CH3)-, -N(4-10-членное карбо- или гетероциклическое кольцо), -O-, -S-, -S(O)- или -S(O)2-, где вышеуказанные R11 и R12 вместе с атомом, к которому присоединены, могут образовывать 3-8-членное кольцо, или (b) 9-10-членное гетероциклическое кольцо, 9-10-членное карбоциклическое кольцо, 4-6-членное гетероциклическое кольцо или 4-6-членное карбоциклическое кольцо, где любой из (а) или (b), за исключением Н, может быть независимо замещен 1-3 заместителями, выбираемыми из группы, включающей F, Cl, ОН, (C1-С3)алкокси, (C1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алкил, галогензамещенный (C1-С3)алкил или (C1-С3)алкокси-(C1-С3)алкил;
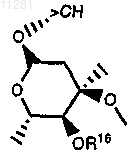
каждый из R13 и R16 независимо означает Н, -С(О)(С1-С6алкил), -C(О)Ar, (фенил)(С1-С6алкил)2Si- или (С1-С6алкил)3Si-;
каждый из R14 и R15 независимо означает Н или (C1-С10)алкил; где алкил может быть замещен 1-3 заместителями группы S; где независимо 1-2 углерода алкила могут быть заменены дирадикалами группы Т и где каждая из пар R14/R15 независимо может вместе с атомом, к которому присоединены R14 и R15, образовывать 3-8-членное кольцо;
R17 означает OR19, -С(О)(С1-С6алкил) или -С(О)(4-10-членное карбо- или гетероциклическое кольцо);
R19 означает Н, 4-10-членное карбо- или гетероциклическое кольцо, (С1-С6)алкил или -(С1-С6алкил)-(4-10-членное карбо- или гетероциклическое кольцо), любая из указанных групп может содержать алкильный углерод, замещенный посредством -NH-, -N(CH3)-, -N(4-10-членное карбо- или гетероциклическое кольцо), -O-, -S-, -S(О)- или -S(O)2-; и, за исключением Н, может быть замещена 1-3 заместителями, выбираемыми из группы, включающей F, Cl, ОН, (С1-С3)алкокси, (C1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алкил, галогензамещенный (C1-С3)алкил или (C1-C3)алкокси-(C1-С3)алкил;
каждый из Ra и Rb независимо означает Н или (C1-C6)алкил, где алкил может быть замещен 1-3 заместителями группы S; и где независимо 1-2 углерода алкила могут быть заменены дирадикалами группы Т; и каждая из пар Ra/Rb независимо может вместе с углеродом, к которому присоединены Ra и Rb, образовывать 3-10-членное кольцо;
каждая из Rc групп независимо означает Н, F, Cl, (C1-С3)алкил, гидрокси, (C1-С3)алкокси или CN, при условии, что, когда х дирадикала 6 равен от 2 до 5, только одна Rc группа может быть иной, чем Н;
каждая из групп Rd и Re означает Н, за тем исключением, что не более одной Rd группы вместе с одной Re группой могут образовывать мостиковую простую углерод-углеродную связь или мостиковый (C1-С3)алкильный дирадикал, так что цикл А является бициклическим;
каждый из Ar независимо означает: (а) 9-10-членное гетероциклическое кольцо, (b) 9-10-членное карбоциклическое кольцо, (с) 4-6-членное гетероциклическое кольцо или (d) 4-6-членное карбоциклическое кольцо, где (с) или (d) группа может быть замещена 4-6-членным гетероциклическим кольцом или 4-6-членным карбоциклическим кольцом; где любая из вышеуказанных циклических систем Ar может быть замещена 1-3 заместителями группы S;
заместителями группы S являются нитро, галоген, гидрокси, CF3, OCF3, OCHF2, CHF2, CN, СНО, (C1-С3)алкокси-(C1-C3)алкокси, (C1-С3)алкокси-(C1-С3)алкил, окёю, (C1-С10)алканоил, (С1-С10)алкил, (С2-С10)алкенил, (С2-С10)алкинил, 4-10-членное гетероциклическое кольцо или карбоциклическое кольцо, гидроксизамещенный (C1-C6)алкил, -C(O)R11, -С(О)(4-10-членное гетероциклическое кольцо), -C(О)(4-10-членное карбоциклическое кольцо), -С(О)2(4-10-членное гетероциклическое кольцо), -O(4-10-членное карбоциклическое кольцо), -О(4-10-членное гетероциклическое кольцо), -С(О)2(4-10-членное карбоциклическое кольцо), -С(О)OR11, -OC(O)R11, -С(О)NR11R12, -ОС(О)NR11R12, -NR11R12, -SO2NR11R12, -S(O)pR11, где р равно 0-2, и (С1-С10)алкокси, необязательно замещенный посредством CN; и в случаях, когда заместитель группа S замещает неароматический углерод, группа S может также включать =N-NR11R12, =N-(4-10-членное гетероциклическое кольцо), =N-(4-10-членное карбоциклическое кольцо), =N-NHC(О)R11, =N-NHC(О)NR11R12, -N(R11)SO2R12 или =N-R17; где любая из гетероциклических и карбоциклических групп может быть замещена посредством заместителей, выбираемых из группы, включающей Cl, F, (C1-С10)алкил, (C1-С10)алкокси, оксо или CN;
дирадикалы группы Т включают -О-, -S-, -S(O)-, -S(O)2-, -N((C1-C6)алкил)-, -NH-, -С(О)-, -ОС(О)-,
-С(O)O-, -N(Ar)- и -OC(O)O-.
2. Соединение по п.1, где
дирадикал 1 отсутствует или означает -СН2-;
дирадикал 2 означает -CH(R6)-, -C(O)O-, -C(O)N(R6)-, -С(O)(CH2)m-, -S(O)2(CH2)m-, где m равно 0-2;
дирадикал 3 означает >C(O);
дирадикал 4 означает >O;
дирадикал 5 означает >C(O) или >С(=NOR19);
дирадикал 6 означает -(СН2)x-, где х равно от 0 до 4;
дирадикал 7 означает -(СН2)y-, где у равно от 0 до 4, при условии, что сумма х+у равна от 2 до 4;
R1 означает Н, ОН или метил;
каждый из R11 и R12 независимо означает Н, (C1-С6)алкил, (С2-С6)алкенил или (С2-С6)алкинил, который, за исключением Н, может быть замещен 1-2 заместителями, выбираемыми из группы, включающей Cl, F, ОН, (C1-С3)алкокси, (C1-C3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алкил, галогензамещенный (C1-С3)алкил или (C1-С3)алкокси-(C1-С3)алкил;
R13 означает Н;
R19 означает Н или (C1-С6)алкил, который может прерываться 1-3 атомами кислорода и независимо может быть замещен 4-10-членным карбо- или гетероциклическим кольцом;
каждый из Ar независимо означает: (а) 9-10-членное гетероциклическое кольцо, (b) 9-10-членное карбоциклическое кольцо, (с) 4-6-членное гетероциклическое кольцо или (d) 4-6-членное карбоциклическое кольцо, где (с) или (d) группа может быть замещена 4-6-членным гетероциклическим кольцом или 4-6-членным карбоциклическим кольцом; где вышеуказанная циклическая система может быть замещена 1-2 заместителями, выбираемыми из группы, включающей CF3, OCF3, OCHF2, CHF2, нитро, Cl, F, Br, гидрокси, (C1-С6)алкил, CN, CHO, (C1-С3)алкокси-(C1-С3)алкокси, (C1-С3)алкокси-(C1-С3)алкил, оксо, (C1-С6)алканоил, (C2-C6)алкенил, (С2-С6)алкинил, гидроксизамещенный (C1-С6)алкил, -C(O)R11, -OC(O)R11,
-C(O)OR11, С(О)N(R11)R12-, -ОС(О)N(R11)R12-, -NHC(O)R11, -N(R11)R12, -N(R11)SO2R12, -SO2N(R11)R12, -S(O)pR11, где p равно 0-2, или (C1-С6)алкокси, необязательно замещенный посредством CN.
3. Соединение по п.1 или 2, где
дирадикал 2 означает >CH(R6), -C(O)O-, -C(O)N(R6)-, -С(О)(CH2)m-, -S(O)2(CH2)m-, где m равно от 0 до 2;
дирадикал 3 означает >СН(ОС(О)R14), >СН(ОС(О)N(R14)R15)-, >CHOC(O)OR15, >CHOC(O)CH(N(R14)R15)((CRaRb)nAr), >CHOC(O)CH(N(R14)R15)R14, >CHOC(О)С(=NOR14)((CRaRb)nAr), >CHOC(O)C(=NOR14)R14, >CHOC(O)((CRaRb)nAr) или
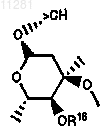
дирадикал 4 означает >O;
дирадикал 5 означает >C(O) или >C(=NOR19);
дирадикал 6 означает -(СН2)x-, где х равно от 0 до 4;
дирадикал 7 означает -(СН2)y-, где у равно от 0 до 4 и где сумма х+у равна от 2 до 4;
R1 означает Н, ОН или метил;
R3 означает (C1-С6)алкил, (С2-С6)алкенил или (С2-С6)алкинил, любой из которых может быть замещен посредством Ar;
каждый из R11 и R12 независимо означает Н, (C1-С6)алкил, (С2-С6)алкенил или (С2-С6)алкинил;
R13 и R16, оба означают Н;
каждый из R14 и R15 независимо означает Н или (C1-С6)алкил, 1-3 метиленовых звена которого могут быть заменены на О, S, S(О), S(O)2, С(О) или NH; каждая из пар R14/R15 независимо может вместе с атомом, к которому присоединены R14 и R15, образовывать 3-8-членное кольцо и указанное 3-8-членное кольцо может быть замещено посредством Ar или 1-2 заместителями группы S;
R19 означает Н или (C1-С6)алкил, который может прерываться 1-3 атомами кислорода и независимо может быть замещен 4-10-членным карбо- или гетероциклическим кольцом; и
заместителями группы S являются нитро, Cl, F, Br, CF3, OCF3, OCHF2, CHF2, гидрокси, (C1-C6)алкил, CN, CHO, (С1-С3)алкокси-(C1-С3)алкокси, (C1-С3)алкокси-(C1-С3)алкил, оксо, (C1-С6)алканоил, (С2-С6)алкенил, (С2-С6)алкинил, гидроксизамещенный (C1-C6)алкил, -C(O)R11, -OC(O)R11, -С(О)OR11, С(О)N(R11)R12-, -OC(O)N(R11)R12-, -NHC(O)R11, -N(R11)R12, -N(R11)SO2R12, -SO2N(R11)R12, -S(O)pR11, где р равно 0-2, и (C1-C6)алкокси, необязательно замещенный посредством CN.
4. Соединение по п.1 или 2, где
дирадикал 2 означает >CH(R6);
дирадикал 5 означает >С(O);
R3 означает метил;
R5 означает этил;
R6 означает Н или (С1-С5)алкил, необязательно замещенный ОН или (C1-С3)алкокси.
5. Соединение по любому из пп.1, 2 или 4, где
дирадикал 1 отсутствует или означает метилен;
дирадикал 6 означает -(СН2)x-, где x равно от 0 до 3;
дирадикал 7 означает -(СН2)у-, где у равно от 0 до 3 и где сумма х+у равна от 2 до 3;
R1 означает Н и
R6 означает Н или (C1-С3)алкил.
6. Соединение по любому из пп.1, 2, 4 или 5, где
дирадикал 1 отсутствует;
R2 означает: (а) 9-10-членное гетероциклическое кольцо или карбоциклическое кольцо или (b) 4-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) может быть замещена посредством 4-6-членного гетероциклического кольца или карбоциклического кольца и R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, СНО, нитро, F, Cl, Br, CF3, OCF3, OCHF2, CHF2, гидрокси, (C1-C3)алкокси-(C1-С3)алкокси, оксо, (C1-C3)алканоил, (С2-С6)алкенил, (С2-С6)алкинил или (C1-С3)алкокси, необязательно замещенный посредством CN; и
R6 означает Н или метил.
7. Соединение по любому из пп.1, 2 или 4-6, где
дирадикалы 6 и 7, оба означают метилен и
R2 означает: (а) 9-10-членное гетероциклическое кольцо или (b) 5-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) замещена посредством 5-6-членного гетероциклического кольца или карбоциклического кольца и где R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, СНО, Br, Cl, F, CF3, OCF3, OCHF2, CHF2, нитро, гидрокси, (C1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алканоил, (C1-С6)алкенил, (C2-С6)алкинил или (C1-С3)алкокси, необязательно замещенный посредством CN.
8. Соединение по любому из пп.1, 2 или 4-7, где
R2 означает содержащий 1-3 гетероатома 9-10-членный гетероарил, который может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, CHO, Cl, F, CF3, нитро, гидрокси, (C1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алканоил, (С2-С6)алкенил, (С2-С6)алкинил или (C1-C3)алкокси, необязательно замещенный посредством CN.
9. Соединение по любому из пп.1, 2 или 4-8, где
R2 означает хинолинил, изохинолинил, хиназолинил, 4Н-хинолизинил, хиноксалинил, 1,5-нафтиридинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил, циннолинил, фталазинил, пиридо[2,3-b]пиразинил, пиридо[3,4-b]пиразинил, пиридо[3,2-b]пиразинил, пиридо[2,3-d]пиримидинил, пиридо[2,3-с]пиридазинил, бензимидазолил, индолил, индазолил, 1Н-бензотриазолил, 1Н-пирроло[3,2-b]пиридинил, 1Н-пирроло[3,2-с]пиридинил, 1Н-пирроло[2,3-c]пиридинил, 1Н-пирроло[2,3-b]пиридинил, 1Н-имидазо
[4,5-b]пиридинил, 3Н-имидазо[4,5-b]пиридинил, 1Н-имидазо[4,5-c]пиридинил, 1Н-[1,2,3]триазоло[4,5-b]пиридинил, 1Н-[1,2,3]триазоло[4,5-с]пиридинил, пиразоло[1,5-а]пиридинил, имидазо[1,5-а]пиридинил, имидазо[1,2-а]пиридинил, пирроло[1,2-а]пиридинил, пирроло[1,2-а]пиразинил, пирроло[1,2-е]пиримидинил, пирроло[1,2-b]пиридазинил, пирроло[1,5-а]пиримидинил, имидазо[1,5-а]пиримидинил, имидазо[1,2-а]пиримидинил, бензо[d][1,3]диоксолил или 1Н-инден-2(3Н)-сульфонил, любой из которых может быть замещен 1-2 заместителями, выбираемыми из группы, включающей (C1-C3)алкил, CN, CHO, Cl, F, CF3, нитро, гидрокси, оксо, (C1-С3)алканоил, (С2-С3)алкенил, (С2-С3)алкинил или (C1-С3)алкокси.
10. Соединение по п.1 или 2, где
дирадикал 2 означает >SO2;
дирадикал 5 означает >C(О);
R3 означает метил и
R5 означает этил.
11. Соединение по п.10, где
дирадикал 1 отсутствует или означает метилен;
дирадикал 6 означает -(СН2)x-, где х равно от 0 до 3;
дирадикал 7 означает -(СН2)y-, где у равно от 0 до 3 и где сумма х+у равна 2-3; и
R1 означает Н и
R2 означает: (а) 9-10-членное гетероциклическое кольцо или карбоциклическое кольцо или (b) 4-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) может быть замещена 4-6-членным гетероциклическим кольцом или карбоциклическим кольцом и R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, CHO, Br, Cl, F, CF3, OCF3, OCHF2, CHF2, нитро, гидрокси, (C1-C3)алкокси-(С1-С3)алкокси, оксо, (C1-C3)алканоил, (С2-С6)алкенил, (С2-С6)алкинил или (C1-С3)алкокси, необязательно замещенный посредством CN.
12. Соединение по п.10 или 11, где
дирадикал 1 отсутствует;
дирадикалы 6 и 7, оба означают метилен и
R2 означает: (а) 9-10-членное гетероциклическое кольцо или (b) 5-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) может быть замещена 5-6-членным гетероциклическим кольцом или карбоциклическим кольцом и где R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, CHO, Br, Cl, F, CF3, OCF3, OCHF2, CHF2, нитро, гидрокси, (С1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-C3)алканоил, (С2-С6)алкенил, (С2-С6)алкинил или (C1-С3)алкокси, необязательно замещенный посредством CN.
13. Соединение по любому из пп.10-12, где
R2 означает содержащий 1-3 гетероатома 9-10-членный гетероарил, который может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-С3)алкил, (C1-С3)алкил, CN, CHO, Cl, F, CF3, нитро, гидрокси, (C1-С3)алкокси-(C1-С3)алкокси, оксо, (C1-С3)алканоил, (С2-С6)алкенил, (С2-С6)алкинил или (C1-С3)алкокси, необязательно замещенный посредством CN.
14. Соединение по любому из пп.10-12, где
R2 означает хинолинил, изохинолинил, циннолинил, хиноксалинил, хиназолинил, 1,8-нафтиридинил, 1,7-нафтиридинил, 1,6-нафтиридинил, 1,5-нафтиридинил, фталазинил, бензо[d]тиазолил, 2,1,3-бензотиадиазол-2,2-диоксидил, бензо[с][1,2,5]оксадиазолил, бензо[d]изооксазолил, бензо[d]оксазолил, бензо
[d]изотиазолил, имидазо[2,1-b]тиазолил, 5-фенилтиазолил, 2-фенил-1,3,4-тиадиазолил, 4-фенилтиазолил, 4-фенил-1,2,3-тиадиазолил, 5-фенилоксазолил, 2-фенил-1,3,4-оксадиазолил, 5-фенил-1,2,4-оксадиазолил, 3-фенил-1,2,4-оксадиазолил, 1-фенил-1Н-пиразолил, 4-фенил-4Н-1,2,4-триазолил, 1-фенил-1Н-1,2,4-триазолил, 2-(1Н-1,2,4-триазол-1-ил)пиридинил, 2-(1Н-пиразол-1-ил)пиридинил, 2-(4Н-1,2,4-триазол-4-ил)пиридинил, 1Н-индазолил, 1,3-дигидробензо-2,2-диоксо[с]тиофенил, 4-(2-оксооксазолидин-3-ил)фенил или 2Н-индазолил, любой из которых может быть замещен 1-2 заместителями, выбираемыми из группы, включающей (C1-С3)алкил, CN, СНО, Cl, F, CF3, нитро, гидрокси, оксо, (C1-С3)алканоил, (С2-С3)алкенил, (С2-С3)алкинил или (C1-С3)алкокси.
15. Соединение по п.1 или 2, где
дирадикал 1 отсутствует или означает метил;
дирадикал 2 означает >С(О), -C(O)N(R6)- или -С(О)O-;
дирадикал 5 означает >C(О);
дирадикал 6 означает -(СН2)x-, где х равно от 0 до 3;
дирадикал 7 означает -(СН2)y-, где у равно от 0 до 3 и где сумма х+у равна от 2 до 3;
R3 означает метил;
R5 означает этил и
R6 означает Н или метил.
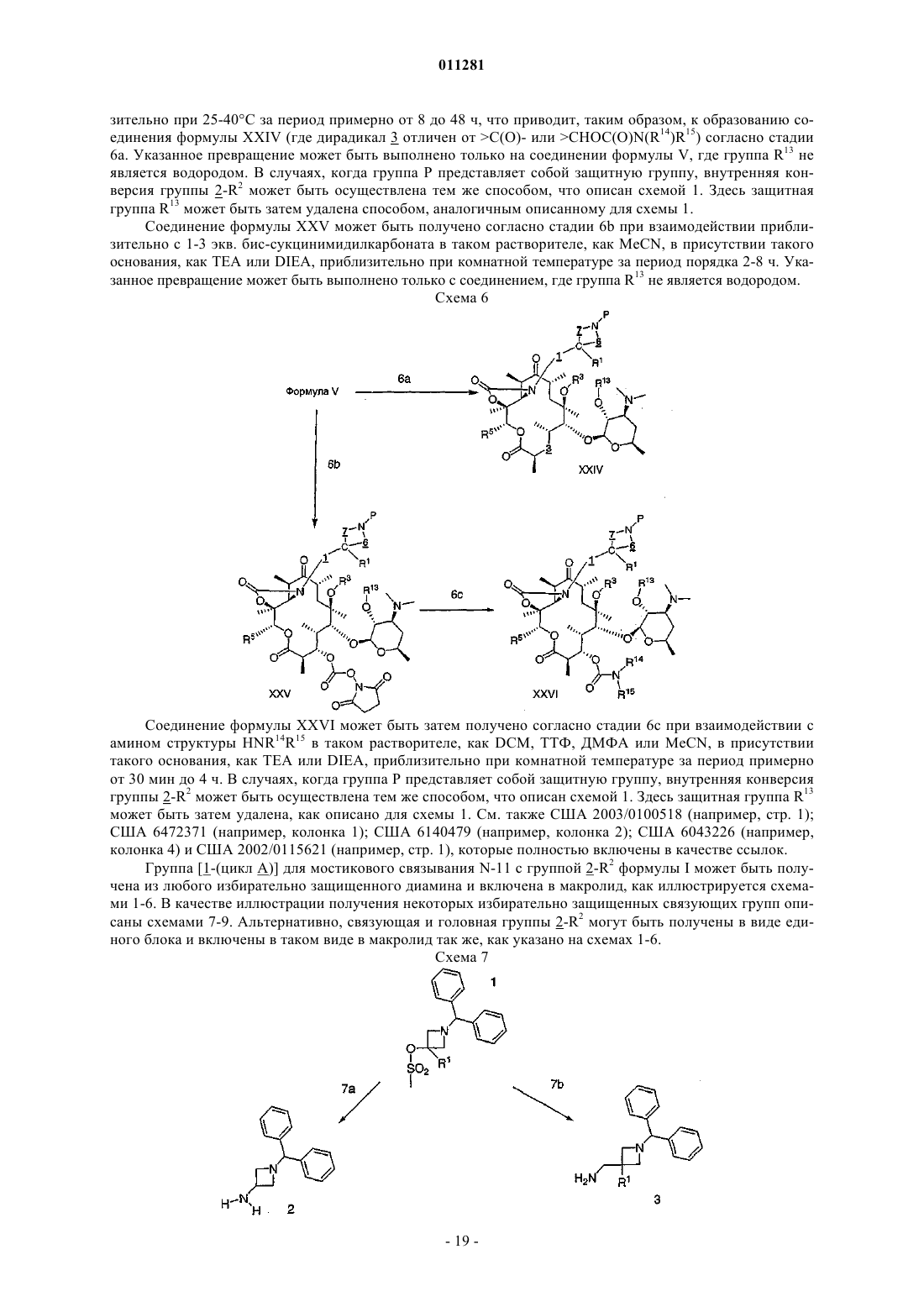
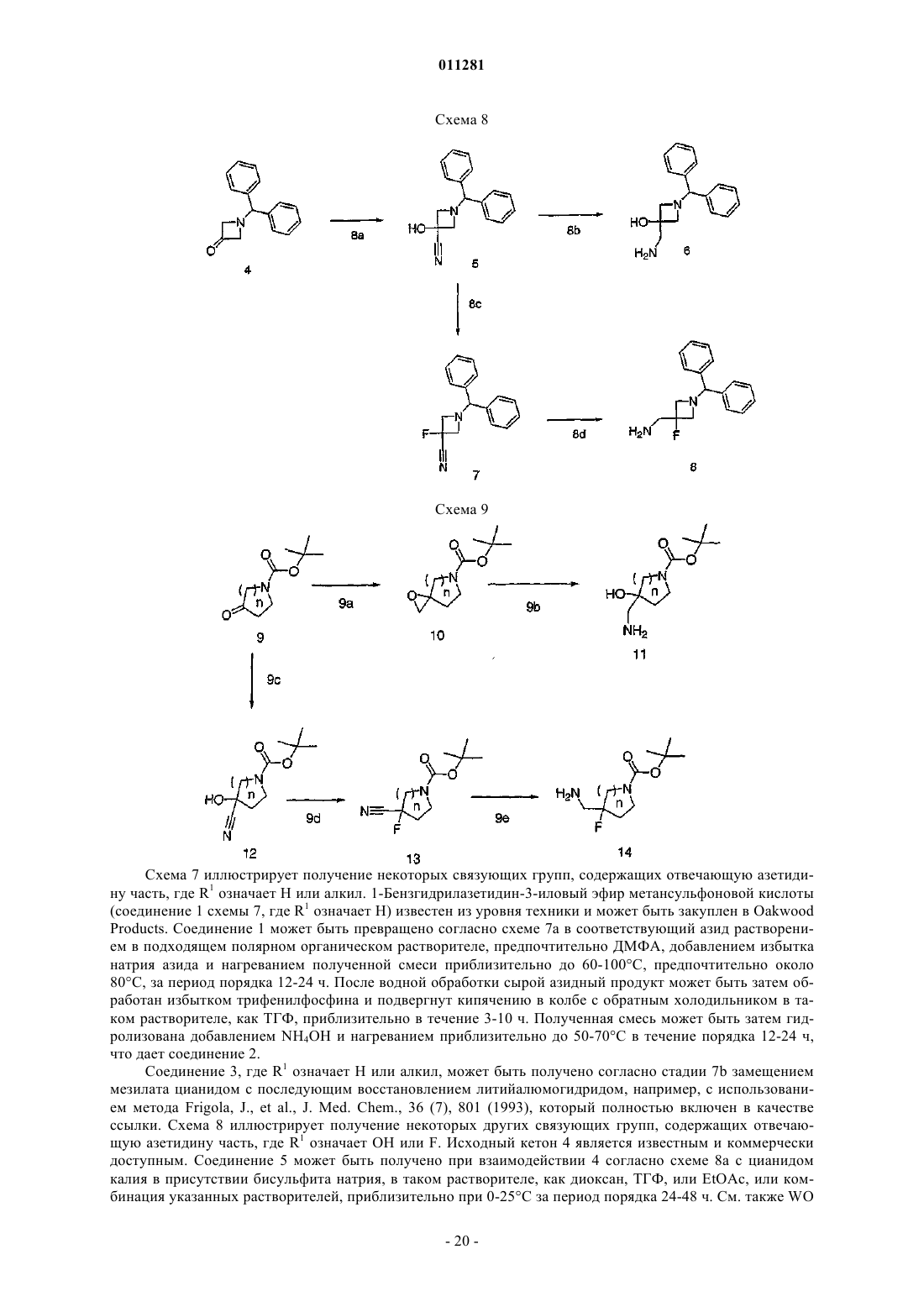
16. Соединение по п.1, которое выбирают из группы, включающей
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-((хинолин-5-ил)метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-((хинолин-4-ил)метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-((1,8-нафтиридин-4-ил)метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-((1,5-нафтиридин-4-ил)метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1R-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)бутил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(8-метоксихинолин-5-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-метоксихинолин-4-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-метокси-1,8-нафтиридин-4-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-бром-1,8-нафтиридин-4-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-хлор-1,8-нафтиридин-4-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-этокси-1,8-нафтиридин-4-метил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(4-(оксазол-5-ил)бензолсульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-(1Н-пиразол-3-ил)бензолсульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-(1,2,3-тиадиазол-4-ил)бензолсульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(хиноксалин-5-сульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1,3-дигидробензо-2,2-диоксо[с]тиофен-5-сульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(8-метоксихинолин-5-сульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(8-этоксихинолин-5-сульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-циано-4-этоксибензол-1-сульфонил)азетидин-3-ил)имино)эритромицин А,
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(4-этокси-3-метоксибензол-1-сульфонил)азетидин-3-ил)имино)эритромицин А или
3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(8-метоксихиноксалин-5-сульфонил)азетидин-3-ил)имино)эритромицин А.
17. Соединение по любому из пп.1-16, имеющее MIC in vitro в отношении S. pyogenes, являющегося резистентным к кларитромицину, 8 мкг/мл или менее.
18. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1R-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил)имино)эритромицин А.
19. Способ лечения бактериальной инфекции, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-18.
20. Применение соединения по любому из пп.1-18 в производстве медикамента для лечения бактериальной инфекции.
Текст
011281 Область техники, к которой относится изобретение Настоящее изобретение касается макролидных соединений и применения указанных соединений,например, в качестве антибактериальных и антипротозойных средств для млекопитающих, в том числе человека. Изобретение также касается способов получения соединений, промежуточных соединений,полезных для получения указанных соединений, и фармацевтических композиций, содержащих указанные соединения. Кроме того, изобретение включает способы лечения и/или профилактики заболевания,например бактериальных и/или протозойных инфекций (или в случае другие показаний, например при раке, воспалении, атеросклерозе или для восстановления моторики желудка), введением соединений или композиций нуждающимся в такой терапии пациентам. Эритромицин и кларитромицин являются хорошо известными макролидами. Были также получены другие макролидные соединения на основе эритромицина, например, введением модификаций в различные положения эритромицина или кларитромицина, например, как описано в США 4331803; США 4474768; США 4517359; США 5523399; США 5527780; США 5635485; США 5804565; США 6020521; США 6025350; США 6075133; США 6162794; США 6191118; США 6248719; США 6291656; США 6437151; США 6472371; США 6555524; США 2002/0052328; США 2002/0061856; США 2002/0061857; США 2002/0077302; США 2002/0151507; США 2002/0156027; США 2003/0100518; США 2003/0100742; США 2003/0199458; США 2004/0077557; WO 99/11651; WO 99/21866; WO 99/21869; WO 99/35157; ЕР 1114826 и J. Med. Chem., 46, 2706 (2003). Дополнительные релевантные публикации приведены ниже в качестве ссылки. Эти и все противопоставленные документы полностью включены в качестве ссылки по всем направлениям, включая основные положения, модификации и способ(ы) модифицирования указанных позиций на макролидных циклах в различных комбинациях. Так, производные могут включать, например, модификации по положениям С-2, С-3, С-6, С-9, С-10, С-11, С-12 и С-13 эритромицина и проч. и соответствующие производные азалида. Желательно, чтобы для новых макролидов при возрастании проявления сопротивляемости организмов, среди прочих показателей, возрастала безопасность и наблюдался улучшенный спектр активности. Сущность изобретения Настоящее изобретение касается некоторых макролидных соединений как таковых, получения указанных соединений и полезных промежуточных соединений, фармацевтических композиций, содержащих указанные соединения, и способов лечения и профилактики, например, инфекций с помощью указанных соединений. В большинстве вариантов осуществления соединения являются активными и эффективными против микроорганизмов, устойчивых к другим антибиотикам, включая другие макролиды. Настоящее изобретение включает соединения общей формулы где С 11 и С 12 согласно общепринятой нумерации означают углероды в положениях С-11 и С-12 цикла C макролида на основе эритромицина, и другие указанные переменные описаны ниже; получение этих соединений и промежуточных соединений, композиций; и применение указанных соединений для лечения,например, бактериальной инфекции. Структура цикла C не имеет ограничений. Группа 2-R2 является"головной группой", присоединенной к циклу А. В некоторых аспектах настоящее изобретение, в частности, касается соединений формулы I-1 011281 где дирадикал 1 может отсутствовать (отсутствие означает, что цикл А непосредственно связан с циклом В простой ковалентной связью), означать СН 2, С(СН 3)Н или другой алкильный или замещенный алкильный дирадикал (символ означает простые связи с циклами А и В; -СН 2- имеет то же значение, что и СН 2). Дирадикал 2 может означать -С(О)(CH2)m-, -S(О)2(СН 2)m-, -SO2N(R6)-, -C(O)O(CHR20)m-, -(C(R6)(R7mили -C(O)N(R6)-, где m равно целому числу от 0 до 3. Дирадикал 3 означает углерод С-3 макролидного цикла, непосредственно связанный с С-2 и C-4,который может быть замещенным, например дирадикал 3 может означать С(O), (CH(OC(O)R14), где символ означает простые связи с С-2 и С-4, подразумевается, что С-3 замещен посредством где n равно целому числу от 0 до 5. Дирадикал 4 может означать O или N(R10), предпочтительно, при условии, что, когда дирадикал 3 не является С(О), дирадикал 4 означает O. Дирадикал 5, который связан с С-8 и С-10 макролидного цикла и может быть замещенным, может означать С(О), -C(O)NH-, -N(H)C(O)-, CH(N(R8)R9), C(=NC(O)R19) или C(=NOR19). В дополнение к указанной группе, дирадикал 5 может также означать C(=NR17). Дирадикал 6 может означать -(C(Rc)(Rdx-, где х равно целому числу от 0 до 5; дирадикал 7 может означать -(C(Rc)(Rey-, где у равно целому числу от 0 до 5; предпочтительно, при условии, что сумма х+у в 6 и 7 равна от 1 до 5. Группа R1 может означать Н, ОН, галоген или (С 1-С 6)алкил, предпочтительно, при условии, что, когда 1 отсутствует, R1 означает Н. Группа R2 может означать Н или Ar. В некоторых вариантах осуществления R2 или 2-R2 означает защитную группу, например Н, Bn, Bzh, CBZ, бензилоксиметил или ВОС, либо любую другую подходящую группу. Группа R3 может означать (C1-C6)алкил, (С 2-С 6)алкенил или (С 2-С 6)алкинил, любой из которых может быть замещен, например, посредством Ar. Группа R4 может означать Н или F, предпочтительно, при условии, что, когда дирадикал 3 не является С(O), R4 означает Н. Группы R5 и R20 могут независимо означать (C1-C6)алкил, который может быть замещен, например,1-3 заместителями группы S. Каждый из R6 и R7 может независимо означать Н, (С 1-С 12)алкил, (С 2-С 12)алкенил или 4-6-членное гетероциклическое кольцо; где любая из указанных групп, за исключением Н, может быть замещена,например, 1-3 заместителями группы S; и где независимо указанный (С 1-С 12)алкил и (С 2-С 12)алкенил могут содержать от 1 до 2 углеродов, независимо замещенных, например, дирадикалами группы Т; и независимо не более одной пары R6/R7 вместе с углеродом, к которому присоединены R6 и R7, могут образовывать 3-8-членное (предпочтительно, карбоциклическое) кольцо; предпочтительно, при условии, что не больше чем всего две из R6 и R7 групп отличны от Н. Каждый из R8 и R9 может независимо означать Н, (С 1-С 6)алкил, -С(О)(C1-С 6)алкил, -S(О 2)(C1-С 6)алкил,любой из которых, за исключением Н, может быть замещен, например, 1-3 заместителями группы S. Предпочтительно, и в особенности когда R8 означает -С(О)(C1-С 6)алкил или -S(О 2)(C1-С 6)алкил, R9 означает Н или (C1-С 6)алкил, который, за исключением Н, может быть замещен, например, 1-3 заместителями группы S. Группа R10 может означать Н или (C1-С 6)алкил, который может быть замещен, например, 1-3 заместителями группы S. Каждый из R11 и R12 независимо означает: (а) Н, (C1-C12)алкил, (С 2-С 12)алкенил, (С 2-С 12)алкинил,любой из которых, за исключением Н, может быть замещен, например, посредством -NH-, -N(СН 3)-,-N(4-10-членное гетероциклическое кольцо), -N(4-10-членное карбоциклическое кольцо), -O-, -S-, -S(O)или -S(O)2-, где вышеуказанные R11 и R12 вместе с атомом, к которому присоединены, могут образовывать 3-8-членное кольцо, или (b) 9-10-членное гетероциклическое кольцо, 9-10-членное карбоциклическое кольцо, 4-6-членное гетероциклическое кольцо или 4-6-членное карбоциклическое кольцо, где любой из (а) или (b), за исключением Н, может быть замещен, например, 1-3 заместителями, выбираемыми из группы, включающей F, Cl, ОН, (C1-С 3)алкокси, (C1-С 3)алкокси-(C1-C3)алкокси, оксо, (C1-С 3)алкил,галогензамещенный (C1-С 3)алкил или (C1-С 3)алкокси-(C1-С 3)алкил. Группы R13 и R16 могут независимо означать Н, -С(О)(C1-С 6 алкил), который может быть замещенным, -C(O)Ar, -Si(фенил)(C1-С 6 алкил)2, -Si(C1-С 6 алкил)3 или защитные группы.-2 011281 Каждый из R14 и R15 может независимо означать Н или (C1-С 10)алкил; указанный алкил может быть замещен, например, 1-3 заместителями группы S; и где независимо 1-2 углерода алкила могут быть замещены, например, дирадикалами группы Т; и где каждая из пар R14/R15 независимо может вместе с атомом, к которому присоединены R14 и R15, образовывать 3-8-членное кольцо. Группа R17 может означать OR19, -С(О)(C1-С 6 алкил) или -C(О)(4-10-членное карбо- или гетероциклическое кольцо), любая из указанных групп может быть замещена, например, 1-3 заместителями группы S. Группа R19 может означать Н, (C1-С 6)алкил, -(С 1-С 6 алкил)-(4-10-членное карбо- или гетероциклическое кольцо) или (4-10-членное карбо- или гетероциклическое кольцо); любая из указанных групп, за исключением Н, может быть замещена, например, 1-3 заместителями группы S (или посредством заместителя, выбираемого из группы, включающей F, Cl, ОН, (C1-С 3)алкокси, (C1-С 3)алкокси-(C1-С 3)алкокси,оксо, (C1-С 3)алкил, галогензамещенный (C1-С 3)алкил или (С 1-С 3)алкокси-(C1-С 3)алкил); не более 1 углерода указанных групп может быть замещено, например, дирадикалами группы Т (или посредством заместителя, выбираемого из группы, включающей -NH-, -N(СН 3)-, -N(4-10-членное карбо- или гетероциклическое кольцо), -О-, -S-, -S(О)- или -S(О)2-). Каждый из Ra и Rb может независимо означать Н или (C1-С 6)алкил, указанный алкил может быть замещен, например, 1-3 заместителями группы S; и где 1-2 углерода алкила могут быть замещены, например, дирадикалами группы Т; и каждая из пар Ra/Rb может вместе с углеродом, к которому присоединены Ra и Rb, образовывать 3-10-членное кольцо. Каждая из Rc групп может независимо означать Н, F, Cl, (C1-С 3)алкил, гидрокси, (C1-С 3)алкокси илиCN, предпочтительно, при условии, что, когда х дирадикала 6 равен от 2 до 5, только одна Rc группа может быть иной, чем Н. Каждая из групп Rd и Re означает Н, за тем исключением, что не более одной Rd группы вместе с одной Re группой могут образовывать мостиковую простую углерод-углеродную связь или мостиковый(C1-С 3)алкильный дирадикал, так что цикл А является бициклическим. Каждый из Ar может независимо означать: (а) 9-10-членное гетероциклическое кольцо, (b) 9-10 членное карбоциклическое кольцо, (с) 4-6-членное гетероциклическое кольцо или (d) 4-6-членное карбоциклическое кольцо, где (с) или (d) группа может быть замещена 4-6-членным гетероциклическим кольцом или 4-6-членным карбоциклическим кольцом. Циклическая система Ar может быть замещена 1-3 заместителями группы S. Однако Ar и R2 не ограничиваются вышеуказанными размерами цикла, и могут включать, например, циклические системы большего размера, и могут быть замещены посредством или конденсированы до дополнительных циклических систем. Заместители группы S включают нитро, галоген, гидрокси, CF3, OCF3, OCHF2, CHF2, CN, CHO, (C1 С 10)алкокси (необязательно замещенный посредством CN), (C1-C3)алкокси-(C1-C3)алкокси, (C1-С 3)алкокси-(С 1-С 3)алкил, оксо, (C1-С 10)алканоил, (C1-С 10)алкил, (С 2-С 10)алкенил, (С 2-С 10)алкинил, 4-10-членное гетероциклическое кольцо или карбоциклическое кольцо, включая 9-10- и 5-6-членное, гидроксизамещенный (C1-С 6)алкил, -C(O)R11, -C(O)(4-10-членное гетероциклическое кольцо), -C(О)(4-10-членное карбоциклическое кольцо), -С(О)2(4-10-членное гетероциклическое кольцо), -С(О)2(4-10-членное карбоциклическое кольцо), -O(4-10-членное карбоциклическое кольцо), -O(4-10-членное гетероциклическое кольцо), -С(О)OR11, -OC(O)R11, -С(О)NR11R12, -OC(O)NR11R12, -NR11R12, -SO2NR11R12 и -S(O)pR11, где р равно 0-2, и в случаях, когда заместитель группы S замещает неароматический углерод, группа S может также включать =N-NR11R12, =N-(4-10-членное гетероциклическое кольцо), =N-(4-10-членное карбоциклическое кольцо), =N-NHC(О)R11, =N-NHC(О)NR11R12, -N(R11)SO2R12 или =N-R17; где любая из гетероциклических и карбоциклических групп может быть замещена посредством заместителей, выбираемых из группы, включающей Cl, F, (С 1-С 10)алкил, (C1-С 10)алкокси, оксо или CN. Дирадикалы группы Т включают -О-, -S-, -S(O)-, -S(O)2-, -NC1-C6)алкил)-, -NH-, -С(О)-, -ОС(О)-,-С(O)O-, -N(Ar)- и -OC(O)O-. Каждое значение переменной формулы I включает любое подмножество этого определения, и определение формулы I включает любую комбинацию подмножеств области определений переменных. По другим аспектам изобретения представлены способы получения соединений по изобретению и промежуточных соединений. Согласно другим аспектам изобретения представлены фармацевтические композиции, содержащие соединения по изобретению. Согласно иным аспектам изобретения разработаны способы лечения нуждающихся в этом пациентов соединениями и композициями по изобретению, включая терапию бактериальной и/или протозойной инфекции и профилактику. Подробное описание изобретения В следующем подробном описании приведены дополнительные неограничивающие подробности изобретения, включающие общее получение и примеры по изобретению. Соединения Как указано выше, настоящее изобретение включает макролиды на основе эритромицина, содержащие С-11/С-12-группу циклической мочевины или циклического карбамата (цикл B), связанную (непосредственно или опосредованно) с циклическим амином (цикл А), который, в свою очередь, связан с головной группой (группа 2-R2). По некоторым аспектам изобретение включает соединения формулы I.-3 011281 Кроме того, изобретение включает подклассы объектов и раскрытые видовые признаки (варианты осуществления), включающие предпочтительные варианты осуществления, охватываемые формулой I, в частности включающие следующее. По некоторым аспектам изобретения дирадикал 1 может отсутствовать или означать метилен; или в некоторых предпочтительных вариантах осуществления дирадикал 1 специально не существует. Дирадикал 2 по некоторым аспектам может означать -(C(R6)(R7m- (в частности, CH(R6), -C(O)O-,-C(O)N(R6)-, -С(О)(CH2)m- или -S(О)2(CH2)m-, где m равно 0-2); или дирадикал 2, в частности, может означать С(O), S(O)2 или CH(R6). В некоторых вариантах осуществления R6 может означать Н или (C1-С 5) алкил, который, за исключением Н, может быть замещен, например, посредством ОН или (C1-С 3)алкокси; или, конкретнее, R6 может означать Н или незамещенный (C1-C3)алкил, в частности Н или метил. Дирадикал 3 по некоторым аспектам может означать C(О). По другим вариантам осуществления дирадикал 3 может означать кладинозил. В иных вариантах осуществления дирадикал 3 может означать СНОС(О)R14,СНОС(О)NR14R15, CHOC(О)OR15, CHOC(O)CH(NR14R15)CRaRb)nAr), СНОС(О)СН(NR14R15)R14,CHOC(O)C(=NOR14)CRaRb)nAr), CHOC(О)С(=NOR14)R14, СНОС(О)CRaRb)nAr) или По некоторым аспектам каждый из R14 и R15 может независимо означать Н или (C1-С 6)алкил, в котором 1-3 метиленовых звена могут быть заменены на -O-, -S-, -S(O)-, -S(O)2-, -С(О)- или -NH-; и каждая из пар R14/R15 может вместе с атомом, к которому присоединены как R14, так и R15, образовывать 3-8-членное кольцо; и указанное 3-8-членное кольцо может быть замещено, например, посредством Ar или 1-2 заместителей группы S. Дирадикал 4 по некоторым аспектам может, в частности, означать O. Дирадикал 5 по некоторым аспектам может означать C(O) или C(=NOR19) или, конкретней,C(O). В некоторых вариантах осуществления, R19 может означать Н или (C1-С 6)алкил, который может прерываться 1-3 атомами кислорода и/или может быть замещен 4-10-членным карбо- или гетероциклическим кольцом. Дирадикал 6 по некоторым аспектам может означать -(СН 2)x-, и дирадикал 7 может означать -(СН 2)у-,где х и у независимо означают целые числа от 0 до 4 и где сумма х+у равна от 2 до 4; или, конкретнее, х и у могут означать целые числа от 0 до 3 (или от 1 до 2) для суммы от 2 до 3; или, в частности, дирадикалы 6 и 7, оба могут означать метилен. По некоторым аспектам R1 может означать Н, ОН или метил; или R1 может означать, в частности, Н. По некоторым аспектам R3 может означать (C1-С 6)алкил, (С 2-С 6)алкенил или (С 2-С 6)алкинил, любой из которых может быть замещен, например, посредством Ar; или, в частности, R3 может означать незамещенный метил. По некоторым аспектам R5 может означать незамещенный этил. В некоторых вариантах осуществления R13 и R16 (когда присутствуют), оба могут означать Н. По некоторым аспектам Ar или цикл(ы) R2 имеют вышеуказанные значения и могут быть замещены,например, 1-2 заместителями, выбираемыми из группы, включающей нитро, Br, Cl, F, гидрокси, (C1C6)алкил, CF3, OCF3, OCHF2, CHF2, CN, CHO, (C1-С 6)алкокси (необязательно замещенный посредством CN),(С 1-С 3)алкокси-(C1-С 3)алкокси, (C1-C3)алкокси-(C1-C3)алкил, оксо, (C1-C6)алканоил, (С 2-С 6)алкенил, (С 2 С 6)алкинил, гидроксизамещенный (C1-C6)алкил, -C(O)R11, -OC(O)R11, -С(О)OR11, -С(O)NR11R12, -OC(O)NR11R12-,-NHC(O)R11, -NR11R12, -NR11SO2R12, -SO2NR11R12 и -S(O)nR11, где n равно 0-2. В некоторых вариантах осуществления каждый из R11 и R12 может независимо означать Н, (C1-С 6)алкил, (С 3-С 6)алкенил или (С 3 С 6)алкинил, любой из которых, за исключением Н, может быть замещен 1-3 заместителями, например,независимо выбираемыми из группы, включающей Cl, F, ОН, (C1-С 3)алкокси, (C1-C3)алкокси-(C1-С 3)алкокси, оксо, (C1-С 3)алкил, галогензамещенный (C1-С 3)алкил или (C1-С 3)алкокси-(С 1-С 3)алкил. В некоторых вариантах осуществления R2 может означать: (а) 9-10-членное гетероциклическое кольцо, (b) 9-10-членное карбоциклическое кольцо, (с) 4-6-членное гетероциклическое кольцо или (d) 4-6 членное карбоциклическое кольцо, где группа (с) или (d) может быть замещена 4-6-членным гетероциклическим кольцом или 4-6-членным карбоциклическим кольцом; и вышеуказанный цикл(ы) R2 может быть замещен, например, 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-C3)алкил, (C1-C3)алкил, CN, CHO, F, Cl, Br, гидрокси, (C1-C3)алкокси-(C1-C3)алкокси, оксо, (C1 С 3)алканоил, (С 2-С 6)алкенил, (С 2-С 6)алкинил или (C1-С 3)алкокси (необязательно замещенный посредствомCN). Кроме того, указанные циклы могут быть замещены нитро, CF3, OCF3, OCHF или CHF2. Как определено и описано здесь, вышеуказанные циклы включают, среди прочего, как арилы, так и гетероарилы. В некоторых вариантах осуществления R2 может означать: (а) 9-10-членное гетероциклическое кольцо или (b) 5-6-членное гетероциклическое кольцо или 5-6 членное карбоциклическое кольцо, где (b)-4 011281 замещено 5-6-членным гетероциклическим кольцом или 5-6-членным карбоциклическим кольцом, где R2 может быть замещен, например, 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-С 3)алкил, (С 1-С 3)алкил, CN, нитро, CF3, OCF3, OCHF2, CHF2, CHO, Br, Cl, F, CF3,гидрокси, (C1-С 3)алкокси (необязательно замещенный посредством CN), (C1-C3)алкокси-(C1-C3)алкокси,оксо, (C1-C3)алканоил, (С 2-С 6)алкенил или (С 2-С 6)алкинил. В некоторых предпочтительных вариантах осуществления вышеуказанные гетероциклические кольца представляют собой гетероарилы. В некоторых вариантах осуществления R2 может означать замещенный или незамещенный 9-10-членный гетероарил, включающий 1-3 атома азота, или другое 9-10-членное гетероциклическое кольцо. В некоторых вариантах осуществления R2 может означать 5-6-членный арил или гетероарил, замещенный 5-6-членным арилом или гетероарилом непосредственно или с помощью промежуточного гетероатома. В некоторых предпочтительных вариантах осуществления R2 может быть выбран из любых радикалов, относящихся к числу гетероциклических колец, перечисленных в разделе неограничивающих общих определений данного описания, пунктах формулы изобретения, примерах или где-либо еще в описании. В некоторых вариантах осуществления R2 может означать фенил, пиридинил, нафталинил, хинолинил, изохинолинил, 4 Н-хинолизинил, хиназолинил, хиноксалинил, 1,5-нафтиридинил, 1,6-нафтиридинил,1,7-нафтиридинил, 1,8-нафтиридинил, циннолинил, фталазинил, пиридо[2,3-b]пиразин, пиридо[3,4-b]пиразин, пиридо[2,3-d]пиримидин, пиридо[2,3-c]пиридазин, пиридо[3,2-b]пиридазин, бензимидазолил, индолил, индазолил, 1 Н-бензотриазолил, 1 Н-пирроло[3,2-b]пиридинил, 1 Н-пирроло[3,2-с]пиридинил, 1 Нпирроло[2,3-c]пиридинил, 1 Н-пирроло[2,3-b]пиридинил, 1 Н-имидазо[4,5-b]пиридинил, 1 Н-имидазо[1,5-a]пиридинил, имидазо[2,1-b]тиазолил, 3 Н-имидазо[4,5-b]пиридинил, имидазо[1,5-а]пиридинил, имидазо[1,2-а]пиридинил, пирроло[1,2-а]пиридинил, пирроло[1,2-а]пиразинил, пирроло[1,2-с]пиримидинил,пирроло[1,2-b]пиридазинил, пирроло[1,5-а]пиримидинил, имидазо[1,5-а]пиримидинил, имидазо[1,2-а]пиримидинил, бензо[d]тиазолил, бензо[с][1,2,5]оксадиазолил, бензо[d]изооксазолил, бензо[d][1,3]диоксолил,бензо[d]оксазолил, бензо[d]изотиазолил, 5-фенилтиазолил, 2-фенил-1,3,4-тиадиазолил, 4-фенилтиазолил,4-фенил-1,2,3-тиадиазолил, 5-фенилоксазолил, 2-фенил-1,3,4-оксадиазолил, 5-фенил-1,2,4-оксадиазолил,3-фенил-1,2,4-оксадиазолил, 1-фенил-1 Н-пиразолил, 4-фенил-4 Н-1,2,4-триазолил, 1-фенил-1 Н-1,2,4-триазолил, 2-(1 Н-1,2,4-триазол-1-ил)пиридинил, 2-(1 Н-пиразол-1-ил)пиридинил, 1,3-дигидробензо-2,2-диоксо[с]тиофен, бензо[d][1,3]диоксол, 1 Н-инденил-2(3 Н)сульфон, феноксифенил, 4-(2-оксооксазолидин-3 ил)фенил, 2,1,3-бензотиадиазолил-2,2-диоксид или 2-(4 Н-1,2,4-триазол-4-ил)пиридинил. Такие R2 группы могут быть замещенными, как указано в данном описании. Например, возможно замещение 1-2 заместителями, выбираемыми из группы, включающей (C1-C3)алкил, CN, CHO, Cl, F, CF3, нитро, гидрокси, оксо,(C1-C3)алканоил, (C2-C3)алкенил, (С 2-С 3)алкинил или (C1-С 3)алкокси. Могут быть также использованы другие гетероциклические кольца. См., например, США 5747467 (колонки 2-4) или США 2004/0157787(там группа Ar2), которые полностью включены в качестве ссылок. Может быть использована любая ориентация (т.е. атом цикла, связанный с дирадикалом 2) R2 относительно дирадикала 2, даже если не оговорено выше, если не указано особо. Например, 1,8-нафтиридинил является предпочтительной группой, которая в некоторых вариантах осуществления присоединена в 4-положение и которая может быть замещена, например, по 3-положению (орто в отношении положения присоединения к макролиду). Таким образом, первым подклассом (1) является подгруппа формулы I, где дирадикал 1 отсутствует или означает СН 2; дирадикал 2 означает CH(R6), -C(O)O-, -C(O)N(R6)-, -С(О)(CH2)m- или -S(О)2(CH2)m-,где m равно 0-2; дирадикал 3 означает C(О); дирадикал 4 означает O; дирадикал 5 означает С(O) илиC(=NOR19); дирадикал 6 означает -(СН 2)x-, где х равно целому числу от 0 до 4; дирадикал 7 означает -(СН 2)y-,где у равно целому числу от 0 до 4; и где сумма х+у равна от 2 до 4; R1 означает Н, ОН или метил; каждый из R11 и R12 независимо означает Н, (C1-С 6)алкил, (С 3-С 6)алкенил или (С 3-С 6)алкинил, любой из которых, за исключением Н, может быть замещен 1-2 заместителями, выбираемыми из группы, включающей Cl, F, ОН, (C1-C3)алкокси, (C1-C3)алкокси-(C1-C3)алкокси, оксо, (C1-C3)алкил, галогензамещенный(C1-C3)алкил или (C1-C3)алкокси-(C1-C3)алкил; R13 означает Н; R19 означает Н или (C1-C6)алкил, который может прерываться 1-3 атомами кислорода и может быть замещен 4-10-членным карбо- или гетероциклическим кольцом; каждый из Ar независимо означает: (а) 9-10-членное гетероциклическое кольцо, (b) 910-членное карбоциклическое кольцо, (с) 4-6-членное гетероциклическое кольцо или (d) 4-6-членное карбоциклическое кольцо, где (с) или (d) группа может быть замещена 4-6-членным гетероциклическим кольцом или 4-6-членным карбоциклическим кольцом; и где любая из вышеуказанных циклических систем Ar (т.е. отдельный цикл, конденсированные циклы или неконденсированные бициклические системы) может быть замещена 1-2 (альтернативно, 3) заместителями, выбираемыми из группы, включающей нитро, Br, Cl, F, гидрокси, (C1-C6)алкил, CF3, OCF3, OCHF2, CHF2, CN, CHO, (C1-С 6)алкокси (необязательно замещенный посредством CN), (C1-C3)алкокси-(C1-C3)алкокси, (C1-C3)алкокси-(C1-C3)алкил, оксо,(C1-С 6)алканоил, (С 2-С 6)алкенил, (С 2-С 6)алкинил, гидроксизамещенный (C1-С 6)алкил, -C(O)R11, -OC(O)R11,-С(О)OR11, -C(O)NR11R12, -ОС(О)NR11R12-, -NHC(O)R11, -NR11R12, -NR11SO2R12, -SO2NR11R12 или -S(O)pR11,где р равно 0-2. Альтернативно, R13 в вышеуказанной формуле может означать -С(О)(С 1-С 6 алкил). Независимо дирадикал 3, альтернативно, может означать CHOC(O)R14, СНОС(О)NR14R15, CHOC(О)OR15,CHOC(O)CH(NR14R15)CRaRb)nAr), СНОС(О)СН(NR14R15)R14, CHOC(O)C(=NOR14)CRaRb)nAr),-5 011281 Вторым подклассом (2) формулы I (подразумевается формула I в широком смысле) является подгруппа формулы I или подкласса 1, где дирадикал 5 означает С(O); R3 означает метил; R5 означает этил и R6 означает Н или (С 1-С 5)алкил, который может быть замещен посредством ОН или (C1-C3)алкокси. В некоторых предпочтительных аспектах дирадикал 2 в этом подклассе может означать CH(R6) (подкласс 2 а) или, альтернативно, может означать SO2 (подкласс 2b). Третьим подклассом (3) формулы I является подгруппа формулы I или подклассов 1-2, где дирадикал 1 отсутствует или означает метилен; R1 означает Н и R6 (когда присутствует) означает Н или (C1-C3) алкил, например метил. Четвертым подклассом (4) формулы I является подгруппа формулы I или подклассов 1-3, где дирадикал 6 означает -(СН 2)x-, где х равно целому числу от 0 до 3; дирадикал 7 означает -(СН 2)y-, где у равно целому числу от 0 до 3 и где сумма х+у равна 2-3. Изобретение также включает подкласс, объединяющий все ограничения, и (3), и (4). Пятым подклассом (5) формулы I является подгруппа формулы I или подклассов 1-4, где дирадикал 1 отсутствует; R2 означает: (а) 9-10-членное гетероциклическое кольцо или карбоциклическое кольцо или (b) 4-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) может быть замещена 4-6-членным гетероциклическим кольцом или карбоциклическим кольцом; R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1C3)алкил, (C1-C3)алкил, CN, нитро, CF3, OCF3, OCHF2, CHF2, CHO, F, Cl, Br, гидрокси, (C1-С 3)алкокси(необязательно замещенный посредством CN), (C1-C3)алкокси-(C1-C3)алкокси, оксо, (C1-C3)алканоил, (С 2 С 6)алкенил или (С 2-С 6)алкинил; и R6 (когда присутствует) означает Н. В некоторых предпочтительных вариантах осуществления R2 означает замещенный или незамещенный 9-10-членный гетероарил, содержащий 1-3 атома азота. Изобретение также включает подкласс, объединяющий все ограничения (3), (4) и (5). Шестым подклассом (6) формулы I является подгруппа формулы I или подклассов 1-5, где дирадикалы 6 и 7, оба означают метилен. Седьмым подклассом (7) формулы I является подгруппа формулы I или подклассов 1-6, где R2 означает: (а) 9-10-членное гетероциклическое кольцо или (b) 5-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа (b) замещена 5-6-членным гетероциклическим кольцом или карбоциклическим кольцом и где R2 может быть замещен 1-2 заместителями, выбираемыми из группы, включающей -SO2R11, гидроксизамещенный (C1-C3)алкил, (C1-C3)алкил, CN, CHO, Br, Cl, F, CF3, OCF3, CHF2,OCHF2, нитро, гидрокси, (C1-С 3)алкокси (необязательно замещенный посредством CN), (C1-C3)алкокси(C1-C3)алкокси, оксо, (C1-С 3)алканоил, (С 2-С 6)алкенил или (С 2-С 6)алкинил. Изобретение также включает подкласс, объединяющий все ограничения, и (6), и (7). Восьмым подклассом (8) формулы I является подгруппа формулы I или подклассов 1-7, где R2 означает 9-10-членное гетероциклическое кольцо, в частности гетероарил, содержащее 1-3 гетероатома,независимо выбираемых из группы, включающей N, S или О. Альтернативно, R2 может означать 5-6 членный арил или гетероарил, который замещен 5-6-членным арилом или гетероарилом. R2 может быть замещен, например, 1-2 заместителями, выбираемыми из группы, включающей SO2R11, гидроксизамещенный (C1-C3)алкил, (C1-C3)алкил, CN, CHO, Cl, F, CF3, нитро, гидрокси, (С 1-С 3)алкокси-(C1-C3)алкокси, оксо, (C1-С 3)алканоил, (С 2-С 6)алкенил, (С 2-С 6)алкинил или (C1-С 3)алкокси, необязательно замещенный посредством CN. R2 может также означать любую из конкретно указанных головных групп. В некоторых более специфических вариантах осуществления изобретения дирадикал 1 отсутствует,2 означает СН 2, СН(СН 3) или SO2, 3 означает C(O), 4 означает O, 5 означает С(O), 6 и 7, оба означают СН 2, R1 означает Н, R3 означает метил, R4 означает Н или F, R5 означает этил и R13 означает Н. В этих и других вариантах осуществления R2 может быть выбран из любого значения для групп R2 согласно примерам или другим приведенным материалам, таким как описаны и перечислены выше. Девятым подклассом (9) является подгруппа формулы I или подкласса I, где дирадикал 2 означает С(O), -C(O)N(R6)- или -С(O)O-; дирадикал 5 означает С(O); R3 означает метил; R5 означает этил и R6 означает Н или (С 1-С 5)алкил. В частности, в указанной выше формуле дирадикал 1 может отсутствовать или означать метил; дирадикал 6 может означать -(СН 2)x-, где х равно от 0 до 3; дирадикал 7 может означать -(СН 2)y-, где у равно от 0 до 3 и где сумма х+у равна 2-3; и R6 может означать Н или метил. Также R2 в указанной выше формуле может означать: (а) 9-10-членное гетероциклическое кольцо или карбоциклическое кольцо или (b) 4-6-членное гетероциклическое кольцо или карбоциклическое кольцо, где группа(b) может быть замещена 4-6-членным гетероциклическим кольцом или карбоциклическим кольцом; и R2 может быть замещен 1-2 группами, выбираемыми из группы, включающей SO2, гидроксизамещенный(необязательно замещенный посредством CN), (C1-С 3)алкокси-(C1-C3)алкокси, оксо, (C1-C3)алканоил,(С 2-С 6)алкенил или (С 2-С 6)алкинил. Изобретение также включает соединения, определяемые любой подгруппой значений переменных,указанных для формулы I и любого подкласса. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хинолин-5-ил)метил) азетидин-3-ил)имино)эритромицин А (пр. 1.06). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-бензоимидазол-7 ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.11). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хиноксалин-8-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.12). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хинолин-4-ил)метил) азетидин-3-ил)имино)эритромицин А (пр. 1.16). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1,8-нафтиридин-4-ил) метил)азетидин-3-ил)имино)эритромицин А (пр. 1.20). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1S-(1,8-нафтиридин-4 ил)этил)азетидин-3-ил)имино)эритромицин А (пр. 1.23). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-пиридо[2,3-b]пиразин 8-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.24). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1R-(1,8-нафтиридин-4 ил)этил)азетидин-3-ил)имино)эритромицин А (пр. 1.25). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1,5-нафтиридин-4-ил) метил)азетидин-3-ил)имино)эритромицин А (пр. 1.26). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1,6-нафтиридин-4-ил) метил)азетидин-3-ил)имино)эритромицин А (пр. 1.27). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хиноксалин-6-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.28). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-индазол-3-ил)метил) азетидин-3-ил)имино)эритромицин А (пр. 1.29). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-изохинолин-4-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.30). 3-Дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1R-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил)имино)эритромицин А (пр. 1.32). 3-Дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1,8-нафтиридин 4-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.33). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-тиазоло[4,5-b]пиридин 7-ил)метил)азетидин-3-ил)имино)эритромицин А (пр. 1.35). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1R-(1,5-нафтиридин-4 ил)этил)азетидин-3-ил)имино)эритромицин А (пр. 1.37). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1S-(1,5-нафтиридин-4 ил)этил)азетидин-3-ил)имино)эритромицин А (пр. 1.38). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)пропил)азетидин-3-ил)имино)эритромицин А (пр. 1.61). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)этил) азетидин-3-ил)имино)эритромицин А (пр. 1.62). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)этил) азетидин-3-ил)имино)эритромицин А (пр. 1.63). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)бутил) азетидин-3-ил)имино)эритромицин А (пр. 1.64). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1-(хинолин-4-ил)бутил) азетидин-3-ил)имино)эритромицин А (пр. 1.65). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(фенил(пиридин-4-ил) метил)азетидин-3-ил)имино)эритромицин А (пр. 1.69). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(8-метоксихинолин-5 метил)азетидин-3-ил)имино)эритромицин А (пр. 1.70). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-метоксихинолин-4 метил)азетидин-3-ил)имино)эритромицин А (пр. 1.71). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(3-метокси-1,8-нафтиридин-4-метил)азетидин-3-ил)имино)эритромицин А (пр. 1.72). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(хинолин-3-карбонитрил 4-метил)азетидин-3-ил)имино)эритромицин А (пр. 1.73). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(7-бромпиридо[3,2-b](азетидин-3-ил)метил)имино)эритромицин А (пр. 4.14). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3-ил)метил)(азетидин-3-ил)метил)имино)эритромицин А (пр. 4.18). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-6-метил-1 Н-бензо[d] имидазол-7-ил)метил)(азетидин-3-ил)метил)имино)эритромицин А (пр. 4.44). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3 ил)метил)(азетидин-3-ил)метил)имино)-3-2-метилпирролидин)-1-карбонил)эритромицин А (пр. 5.03). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-(1-хинолин-8-ил)метил)(азетидин 3-ил)метил)имино)-3-2-метилпирролидин)-1-карбонил)эритромицин А (пр. 5.04). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3-ил) метил)(азетидин-3-ил)метил)имино)-3-2-(3-фторфенил)пирролидин)-1-карбонил)эритромицин А (пр. 5.05). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3-ил) метил)(азетидин-3-ил)метил)имино)-3-2-(3-фторфенил)пирролидин)-1-карбонил)эритромицин А (пр. 5.06). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3- 11011281 ил)метил)(азетидин-3-ил)метил)имино)-3-(пирролидин-1-карбонил)эритромицин А (пр. 5.10). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хинолин-5-ил)метил)(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.02). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3-ил)метил)-(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.03). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1,8-нафтиридин-4-ил) метил)-(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.05). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-бензо[d]имидазол 4-ил)метил)-(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.06). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-изохинолин-5-ил)метил)-(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.07). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-индазол-3-ил)метил)-(R)-пирролидин-3-ил)имино)эритромицин А (пр. 9.09). 3-Дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(1 Н-бензо[d] имидазол-2-карбоксил)-R)-пирролидин-2-ил)метил)имино)эритромицин А (пр. 10.27). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хиноксалин-8-ил)метил)-S)-пирролидин-3-ил)метил)имино)эритромицин А (пр. 11.02). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-1 Н-пирроло[2,3-b]пиридин-3-ил)метил)-S)-пирролидин-3-ил)метил)имино)эритромицин А (пр. 11.05). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-хинолин-4-ил)метил)S)-пирролидин-3-ил)метил)имино)эритромицин А (пр. 11.11). Другие варианты осуществления включают приведенные здесь примеры и соединения в рамках объема данного документа. Внимание заслуживают соединения, имеющие MIC in vitro порядка 8 мкг/мл или менее (предпочтительно 4 мкг/мл или менее) в отношении S. руо., являющегося резистентным к кларитромицину, например, по erm В механизму (например, S. pyogenes 1079) и/или MIC in vitro порядка 0,5 мкг/мл или менее в отношении S. pneumo., являющегося резистентным к кларитромицину, например, по механизму оттока. Примеры приводятся. Настоящее изобретение не ограничивается вышеуказанными модификациями эритромицина. Например, могут быть использованы С-3 модификации, упомянутые в США 2003/0100518 (например, стр. 1); США 6472371 (например, колонка 1); США 6140479 (например, колонка 2); США 6043226 (например,колонка 4) и США 2002/0115621 (например, стр. 1); могут быть использованы С-5 модификации, упомянутые в США 2003/0100518 (например, стр. 4); могут быть использованы С-6 модификации, упомянутые в США 2003/0100742 (например, стр. 3); США 2003/0100518 (например, стр. 4); США 6075133 (например, колонки 4-7) и США 2002/0115621 (например, стр. 2); могут быть использованы С-8 модификации,упомянутые в США 2003/0100518 (например, стр. 1); могут быть использованы С-9 модификации, упомянутые в США 4474768, США 4517359 и США 2003/0100518 (например, стр. 1); могут быть использованы С-12 модификации, упомянутые в США 2003/0013665 (например, стр. 12-14) и WO 03/004509; могут быть использованы С-13 модификации, упомянутые в США 2003/0100518 (например, стр. 5) и США 2003/0013665 (например, стр. 2). Вышеуказанные документы также дают ссылки на способы получения аналогов. Эти документы полностью включены в качестве ссылок. Настоящее изобретение включает промежуточные соединения. Например, изобретение включает соединения, где 2-R2 означает Н или защитную группу, такую как Bzh, например 3-дезкладинозил-11,12 дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил(азетидин-3-ил)имино)эритромицин А или 3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-1-бензгидрил)азетидин-3-ил)имино)эритромицин А. Изобретение также включает предшественники 2-R2,такие как 1-[1,8]нафтиридинил-4 илэтанол или 1-[1,8]нафтиридинил-4-илэтанон. Общие способы получения Соединения по настоящему изобретению могут быть получены согласно приведенным здесь описаниям, схемам и примерам, которые не являются ограничивающими, в сочетании с знаниями, известными специалистам в данной области из уровня техники. Соединения эритромицина и кларитромицина, многие из которых известны из уровня техники и доступны коммерчески, являются подходящими исходными веществами для получения соединений по изобретению. См., например, США 2653899; 2823203 и 4331803. Эти документы полностью включены в качестве ссылок. Известные ферментативные способы могут быть использованы для введения различных С-13 модификаций (формула I, R5). Например, США 2003/0100518 описывает получение таких соединений на стр. 22-27 и ссылается, например, на США 6437151 и WO 99/35157. См. также США 6472371, колонки 25-32. Все вышеуказанные документы полностью включены в качестве ссылок. Известные способы могут быть использованы для введения вариации в положении С-6 (формула I,R3). Например, США 6075133, колонки 55-58, описывает алкилирования по С-6. Вышеуказанные документы полностью включены в качестве ссылок. Для некоторых превращений могут потребоваться соот- 12011281 ветствующая защита функциональных групп и снятие защиты. Известные способы могут быть использованы для защиты по 2' и 4" (формула I, R13 и R16). Включение R13 и R16 групп может быть выполнено взаимодействием соединения формулы II (схема I), где R13 иR16 означают водород, с ангидридом кислоты или хлорангидридом кислоты, содержащим R13 группу, в таком растворителе, как DCM, ТГФ или толуол, в присутствии такого основания, как TEA, и в присутствии активатора или катализатора, такого как DMAP, при температуре, близкой к комнатной температуре,приблизительно за 2-24 ч. Если использовать 2 экв. ангидрида или хлорангидрида кислоты, R13 группа будет введена как по R13 (С-2'), так и R16 (С-4"). Если использовать 1 экв., будет введена только группаR13. Группа R16 может быть затем введена (по С-4") на последующей стадии, таким образом возможна дифференциация R13 от R16. Могут быть использованы различные защитные группы (R13 и R16), такие как описаны в Greene et al., ниже, включая известные защитные группы: ацил, карбамоил, и силил, и т.п.,которые могут быть введены известными способами. В некоторых предпочтительных вариантах осуществления защитным реагентом является уксусный ангидрид. Другие примеры гидроксизащитных групп включают метилтиометил, TMS, TBDMS, TBDPS, простые эфиры, такие как метоксиметил, и сложные эфиры, включая Ac, Bz и т.п. Примеры апротонных растворителей включают DCM, хлороформ, ДМФА,ТГФ, NMP, ДМСО, диэтилсульфоксид, ДМФА, N,N-диметилацетамид, гексаметилфосфорный триамид,смесь любого из вышеуказанных растворителей, содержащая или не содержащая любой растворитель из группы, включающей диэтиловый эфир, ТГФ, 1,2-диметоксиэтан, MeCN, EtOAc, ацетон или т.п. Другие варианты известны из литературы и знакомы квалифицированному специалисту в данной области. Соединения могут быть в дальнейшем модифицированы, например, снятием защиты согласно схемам 1-3 с получением соединений формул IV-VII, XVI и XVII, т.е. соединений, где дирадикал 3 означает С(O), 4 означает -О- и 5 означает -С(О)-. Схема 1 Схема 1 иллюстрирует получение соединений формул III-VII. Соединение формулы III может быть получено, как указано на стадии 1 а, взаимодействием соединения формулы II (где R13 и R16 отличны от- 13011281 водорода и группы R13 и R16 не содержат никаких незащищенных первичных спиртов или первичных или вторичных аминов) приблизительно с 3-5 экв. CDI. См., например, J. Org. Chem., 53, 2340 (1988), который включен полностью в качестве ссылки. Взаимодействие может быть проведено в апротонном растворителе, таком как MeCN, ТГФ, IPE, ДМФА или смесь указанных растворителей, в присутствии приблизительно 2-5 экв. такого основания, как DBU, приблизительно при 25-40 С за период порядка 2-12 ч. Соединение формулы IV может быть получено согласно стадии 1b из соответствующего соединения формулы III взаимодействием с первичным амином заданной N-11 боковой цепи в таком растворителе, как MeCN или ДМФА, в присутствии такого основания, как TEA или DBU, приблизительно при 4080 С за период порядка 12-72 ч. Группа Р в формуле IV означает подходящую защитную группу или может означать головную группу 2-R2, указанную для формулы I. Отвечающая клидинозе часть формулы IV может быть затем удалена согласно стадии 1 с взаимодействием с кислотой, такой как HCl, например, в бинарной смеси растворителей, содержащей воду и спирт,такой как EtOH, при интервале температур от близкой к комнатной температуре до 45 С, предпочтительно от близкой к комнатной температуре до 40 С, за период порядка 6-24 ч, что дает, таким образом, соединение формулы V. Характерные примеры кислот включают такие кислоты, как разбавленная HCl, серная кислота, перхлорная кислота, хлоруксусная кислота, дихлоруксусная кислота или трифторуксусная кислота. Подходящие для взаимодействия растворители включают МеОН, EtOH, IPA, бутанол или т.п. и смеси. Стадия Id иллюстрирует окисление С-3 гидроксильной группы до оксогруппы, приводящее к образованию соединения формулы VI. Это может быть выполнено, например, с использованием модифицированного окисления Сверна. Например, соединение формулы VI может быть подвергнуто взаимодействию с EDC и пиридинийтрифторацетатом в таком растворителе, как DCM, в интервале температур приблизительно от комнатной температуры до 50 С за период порядка 6-24 ч. Когда Р означает защитную группу, снятие защиты соединения формулы VI и введение требуемого заместителя могут быть осуществлены гидрированием. В случае соединения формулы VI, где группа Р представляет собой защитную группу, такую как Bzh, Bn или CBZ, эта группа может быть удалена при взаимодействии с газообразным водородом при давлении около 1-4 атм в присутствии катализатора, такого как палладий на угле или гидроксид палладия на угле, в таком растворителе, как МеОН, EtOH,EtOAc или ТГФ, в интервале температур приблизительно от 25 до 60 С за период порядка 4-24 ч. В случае,когда группа Р представляет собой защитную группу, такую как ВОС, эта группа может быть удалена взаимодействием с TFA в таком растворителе, как DCM, приблизительно при 0-25 С за период порядка 0,5 ч или может быть удалена взаимодействием с кислотой, такой как HCl, например, в смеси растворителей, содержащей воду с МеОН, EtOH или ТГФ, приблизительно при 25-50 С за период порядка 1-6 ч. После того, как защитная группа будет удалена, новая группа структуры 2-R2 может быть введена в соединение формулы VI, например, одним из следующих способов: 1) когда дирадикал 2 означает-С(О)(СН 2)n-, карбоновая кислота, содержащая группу (CH2)nR2, может быть подвергнута взаимодействию в присутствии такого карбодиимида, как EDC, в присутствии активатора, такого как НОВТ и/илиDMAP, в таком растворителе, как DCM, ДМФА, ТГФ или MeCN, приблизительно при 25-40 С за период порядка 2-20 ч. Альтернативно, хлорангидрид кислоты, содержащий группу R2, может быть связан в таком растворителе, как DCM, ТГФ или MeCN, в присутствии такого основания, как TEA, DIEA, NaHCO3 или карбонат калия, приблизительно при 0-40 С за период порядка 1-8 ч; 2) когда дирадикал 2 означает-SO2(CH2)m- или -SO2N(R6)-, сульфонилхлорид или сульфамоилхлорид, содержащий группу (CH2)mR2 или N(R6)R2, может быть подвергнут взаимодействию в присутствии такого основания, как TEA, DIEA,NaHCO3 или карбонат калия, в таком растворителе, как DCM, ДМФА, ТГФ или MeCN, приблизительно при 25-40 С за период приблизительно от 30 мин до 4 ч; 3) когда дирадикал 2 означает -(С(R6)(R7n-,альдегид, содержащий группу R2 или кетон, содержащий R6-C(О)-(С(R6)(R7n-, может быть аналогичным образом подвергнут взаимодействию в присутствии основания в таком растворителе, как МеОН, EtOH,DCM или ТГФ, при этом в некоторых случаях требуется добавление молекулярных сит 4 , приблизительно при 25-60 С за период порядка 2-18 ч, что приводит к образованию соответствующего имина,который может быть в дальнейшем подвергнут взаимодействию с таким восстанавливающим агентом,как натрийцианоборгидрид или натрийтриацетоксиборгидрид, приблизительно при 25-40 С, за период порядка 4-24 ч; 4) когда дирадикал 2 означает -(С(R6)(R7n-, галогенид или сульфонат, содержащий группу -(С(R6)(R7n-R2, может быть подвергнут взаимодействию в присутствии основания приблизительно при 25-150 С в таком растворителе, как DCM, ТГФ или MeCN, за период порядка 0,1-12 ч; 5) когда дирадикал 2 означает C(O)N(R6), изоцианат, содержащий группу R2, или карбамоилхлорид структурыClC(O)N(R2)(R6) может быть подвергнут взаимодействию в присутствии такого основания, как TEA,DIEA, NaHCO3 или карбонат калия, в таком растворителе, как DCM, ДМФА, ТГФ или MeCN, приблизительно при 25-60 С за период порядка 2-8 ч; и 5) когда дирадикал 2 означает С(О)О(СН 2)n, хлорформиат,содержащий группу (CH2)n-R2, может быть подвергнут взаимодействию в присутствии такого основания,как TEA, DIEA, NaHCO3 или карбонат калия, в таком растворителе, как DCM, ТГФ или MeCN, приблизительно при 25-40 С за период приблизительно от 30 мин до 4 ч, что позволяет, таким образом, завершить внутреннюю конверсию группы 2-R2. (Получение реагентов для введения 2-R2 в макролид описано ниже.) Соединение формулы VII может быть получено согласно стадии 1 е образованием анион/енолят на- 14011281 углероде С-2 при взаимодействии VI с таким основанием, как гидрид натрия, литийдиизопропиламид или литийгексаметилдисилазид, в таком растворителе, как ДМФА, приблизительно при температуре от -50 до -30 С за период порядка 10-30 мин. Данный анион может быть затем подвергнут взаимодействию с рядом электрофилов, включая электроположительный фторирующий агент, такой как Selectfluor (поставляемый Air Products and Chemicals, Inc.). Включение группы R4 таким способом может быть осуществлено до или после внутренней конверсии группы 2-R2, описанной на стадии 1d, однако, в некоторых случаях возможны ограничения в отношении совместимости группы 2-R2 с только что описанными условиями ввода R4. При переходе к этой химической структуре группа R13 не может означать водород. На конечной стадии неводородная группа R13, принадлежащая VI или VII, может быть удалена (заменена на водород),как известно из уровня техники, при взаимодействии в таком растворителе, как МеОН, приблизительно при 25-60 С за период порядка 6-24 ч при удалении ацила или TBAF в ТГФ в случае силила. Группа R13 илиR16 может быть подобным образом удалена из любого конечного соединения по настоящему изобретению. Схема 2 Альтернативно, соединение формулы VI, где 3 означает С(O), 4 означает -О- и 5 означает -С(О)-,может быть получено, как показано на схеме 2. Согласно стадии 2 а соединение формулы II может быть превращено в циклический карбонат VIII обработкой в безводных условиях таким фосгеновым эквивалентом, как CDI, дисукцинилкарбонат или этиленкарбонат, в таком растворителе, как DCM, MeCN, бензол, толуол или смесь указанных растворителей, в присутствии такого основания, как TEA, DIEA,NaHCO3 или карбонат калия, приблизительно при 25-50 С за период порядка 2-20 ч. Отвечающая клидинозе часть может быть затем удалена согласно стадии 2b либо гидролизом слабой водной кислотой, либо ферментативным гидролизом, как описано для стадии 1 с, что дает соединение формулы IX. Стадия 2 с иллюстрирует окисление соединения формулы IX до кетона X с применением модифицированной методики окисления Сверна, как описано выше для схемы 1. Альтернативно, указанное превращение может быть осуществлено при взаимодействии IX с комплексом, образованным между N-хлорсукцинамидом и диметилсульфидом, в таком растворителе, как DCM, приблизительно при температуре от -20 до 0 С за период около 1 ч, при последующим взаимодействии по меньшей мере приблизительно с 2 экв. такого основания, как TEA, приблизительно при температуре от -20 до 0 С за период около 1 ч и с последующим дополнительным временем взаимодействия за период около 1 ч приблизительно при 25 С. Соединение формулы XI может быть получено согласно стадии 2d обработкой в безводных условиях при взаимодействии с CDI в присутствии такого основания, как DBU, в таком растворителе, как DCM- 15011281 или ДМФА, приблизительно при 25-40 С за период порядка 24-48 ч. Данная конверсия может быть также выполнена постадийно первоначальной обработкой соединения формулы X приблизительно 1-3 экв. такого основания, как DBU, в таком растворителе, как бензол или толуол, приблизительно при 40-80 С за период порядка 4-24 ч. Полученный аллиловый спирт может быть затем обработан таким основанием,как гидрид натрия, в таком растворителе, как ТГФ или ДМФА, приблизительно при температуре от -40 до 0 С за период порядка 10-30 мин. Образовавшийся анион может быть затем подвергнут взаимодействию с CDI, что дает соответствующее соединение формулы XI. Соединение формулы VI может быть получено согласно стадии 2 е при обработке требуемым первичным амином в соответствии с общим способом, представленным схемой 1. Когда Р означает защитную группу, указанная группа может быть заменена требуемым заместителем, как описано схемой 1. Кроме того, соединение формулы VI может быть галогенировано и т.д., как обсуждалось выше для схемы 1. Схема 3 Соединения по настоящему изобретению, где дирадикал 3 означает С(O), 4 означает группу N-R10 и 5 означает -С(О)-, могут быть получены согласно схеме 3, исходя из соединения формулы XI. Подобные способы упомянуты в США 2003/0013665 (стр. 7-14) и США 2002/0052328 (стр. 5), которые полностью включены в качестве ссылок. Кетенацеталь XII может быть получен согласно стадии 3 а при обработке XI таким основанием, какDBU, 1,5-диазабицикло[4,3,0]нон-5-ен, DIEA, TEA, литийгексаметилдисилазид или калийгексаметилдисилазид, предпочтительно DBU, в присутствии полярного апротонного растворителя, такого как MeCN,ДМФА или ТГФ, предпочтительно MeCN. Реакционную смесь можно перемешивать приблизительно при 20-100 С, предпочтительно около 60-80 С, в течение периода приблизительно от 30 мин до 3 ч. Азид XIII может быть получен согласно стадии 3b приблизительно с 3 экв. такого азидирующего реагента, как триметилсилилазид, азид натрия или азид трибутилолова, предпочтительно триметилсилилазид,в присутствии такой кислоты Льюиса, как тетрахлорид олова, хлорид титана(IV), диэтилэфират трифторида бора или трихлорид алюминия, предпочтительно тетрахлорид олова, и апротонного растворителя. Подходящие растворители включают DCM, дихлорэтан, хлороформ или четыреххлористый углерод, предпочтительно DCM. Взаимодействие может начинаться примерно при -80 С, после чего реакционную смесь нагревают примерно до 25 С, и затем взаимодействие протекает приблизительно за период 4-24 ч. Восстановление согласно стадии 3 с соединения формулы XIII с образованием соединения формулыXIV может быть достигнуто обработкой таким металлом-восстановителем, как цинк, в такой кислоте,- 16011281 как уксусная кислота, приблизительно при комнатной температуре за период примерно от 30 мин до 2 ч. Амин XIV может быть превращен в соответствующий изоцианат обработкой фосгеном или трифосгеном в присутствии такого основания, как TEA или пиридин, и такого апротонного растворителя, как ТГФ или диоксан. Взаимодействие может быть проведено приблизительно при 0-50 С, предпочтительно около 0 С, за период около 0,5-12 ч, предпочтительно примерно за 30 мин. Изоцианат может быть превращен в циклическую мочевину XV согласно стадии 3d при взаимодействии с требуемым первичным амином в присутствии такого апротонного растворителя, как ТГФ, диоксан или ДМФА, для получения линейной мочевины. Взаимодействие может быть проведено приблизительно при 0-100 С, предпочтительно примерно при 25 С, за период порядка 0,5-12 ч, предпочтительно около 6 ч. Полученный продукт может быть затем нагрет в присутствии такого основания, как гидроксид калия, в таком растворителе, как толуол, примерно до 60-80 С примерно в течение 10-30 мин, что приводит к образованию соответствующей циклической мочевины XV. Взаимодействие может быть проведено приблизительно при 25-100 С, предпочтительно примерно при 80 С, за период порядка 0,5-12 ч, предпочтительно около 3 ч. Когда R10 отличен от Н, соединение может быть обработано таким сильным основанием, какKHMDS, приблизительно при температуре от -10 до 25 С в таком растворителе, как ТГФ, за период порядка 1-4 ч в присутствии, например, алкил- или аллилгалогенида, например примерно по меньшей мере 1 экв. R10-L, где L означает подходящую уходящую группу, такую как галоген или, альтернативно, мезилат или тозилат, в вышеуказанных временных и температурных условиях. Группа Р соединения формулы XV представляет собой защитную группу, внутренняя конверсия 2R2 группы может быть осуществлена тем же способом, что описан для схемы 1. Включение группы R4(согласно стадии 3 е) с образованием соединения формулы XVI может быть выполнено способом, аналогичным описанному для схемы 1. Схема 4- 17011281 Соединения по настоящему изобретению, где дирадикал 3 означает С(O), 4 означает -О- или-N(R10)- и 5 отличен от -С(О)-, могут быть получены согласно схеме 4. Исходное соединение формулы VI или XV может быть обработано гидроксиламином структуры R19-O-NH2 в качестве свободного основания или хлористо-водородной солью в присутствии такого основания, как TEA, в таком растворителе,как DCM или ТГФ, приблизительно при комнатной температуре за период порядка 4-24 ч, таким образом получают соединение формулы XVII согласно стадии 4 а. Когда R19 означает Н, соединение формулыXVII, где R19 отличен от водорода, может быть получено при взаимодействии соответствующего соединения, где R19 означает водород, с алкилгалогенидом или замещенным алкилгалогенидом в таком растворителе, как DCM, MeCN или ДМФА, в присутствии такого основания, как TEA, DIEA или NaHCO3,приблизительно при 25-60 С за период порядка 1-24 ч. Когда R19 в XVII означает Н, соединение формулы XVIII может быть затем получено согласно стадии 4b при взаимодействии XVII с таким восстанавливающим агентом, как TiCl3, в таком растворителе,как MeOH или EtOH, приблизительно при комнатной температуре за период порядка 4-24 ч. Соединение формулы XIX может быть получено согласно стадии 4 с при взаимодействии XVIII, например, описанного в США 2004/0171818, который полностью включен в качестве ссылки, в DCM в присутствии TEA с ацилирующим агентом, содержащим требуемую R19 группу. Соединение формулы XX может быть получено согласно стадии 4d при взаимодействии с таким восстанавливающим агентом, как натрийцианоборгидрид или натрийтриацетоксиборгидрид, в таком растворителе как вода, МеОН, EtOH или смесь указанных растворителей, приблизительно при комнатной температуре за период порядка 12-24 ч. Соединение формулы XXI может быть получено согласно стадии 4 е восстановительным аминированием с использованием альдегида, содержащего R8 группу, как описано в J. Med. Chem., 33, 3086(1990), который полностью включен в качестве ссылки. Альтернативно, может быть использовано прямое алкилирование. В случае, когда R8 и R9, оба не являются водородом, последовательные восстановительные аминирования могут быть выполнены на соединении формулы XX с использованием альдегидов, содержащих группы R8 и R9. XXI может быть фторировано. Для специалистов в данной области модификации по С-9 (дирадикал 5 в формуле I) являются обычными для соединений формулы I. См. также ЕР 0345627 и WO 02/57286, которые полностью включены в качестве ссылок. Схема 5 Соединения по настоящему изобретению, где дирадикал 3 означает С(О), 4 означает -О- или-N(R10)- и 5 означает -C(O)NR19- или -N(R19)С(О)-, могут быть получены согласно схеме 5 и ссылкам,например в США 6262030, который полностью включен в качестве ссылки. Соединения, где дирадикал 3 отличен от C(О), могут быть получены по схеме 6. Подобные превращения известны, например, из JP2001-72669, который полностью включен в качестве ссылки. Соединение формулы V или соответствующее промежуточное соединение в модифицированном виде, например С-9 (дирадикал 5), как описано или известно из уровня техники, может быть подвергнуто взаимодействию с требуемой карбоновой кислотой в присутствии такого карбодиимида, как EDC, в присутствии такого активирующего агента, как НОВТ или DMAP, в таком растворителе, как DCM, прибли- 18011281 зительно при 25-40 С за период примерно от 8 до 48 ч, что приводит, таким образом, к образованию соединения формулы XXIV (где дирадикал 3 отличен от C(O)- или СНОС(O)N(R14)R15) согласно стадии 6 а. Указанное превращение может быть выполнено только на соединении формулы V, где группа R13 не является водородом. В случаях, когда группа Р представляет собой защитную группу, внутренняя конверсия группы 2-R2 может быть осуществлена тем же способом, что описан схемой 1. Здесь защитная группа R13 может быть затем удалена способом, аналогичным описанному для схемы 1. Соединение формулы XXV может быть получено согласно стадии 6b при взаимодействии приблизительно с 1-3 экв. бис-сукцинимидилкарбоната в таком растворителе, как MeCN, в присутствии такого основания, как TEA или DIEA, приблизительно при комнатной температуре за период порядка 2-8 ч. Указанное превращение может быть выполнено только с соединением, где группа R13 не является водородом. Схема 6 Соединение формулы XXVI может быть затем получено согласно стадии 6 с при взаимодействии с амином структуры HNR14R15 в таком растворителе, как DCM, ТТФ, ДМФА или MeCN, в присутствии такого основания, как TEA или DIEA, приблизительно при комнатной температуре за период примерно от 30 мин до 4 ч. В случаях, когда группа Р представляет собой защитную группу, внутренняя конверсия группы 2-R2 может быть осуществлена тем же способом, что описан схемой 1. Здесь защитная группа R13 может быть затем удалена, как описано для схемы 1. См. также США 2003/0100518 (например, стр. 1); США 6472371 (например, колонка 1); США 6140479 (например, колонка 2); США 6043226 (например,колонка 4) и США 2002/0115621 (например, стр. 1), которые полностью включены в качестве ссылок. Группа [1-(цикл А)] для мостикового связывания N-11 с группой 2-R2 формулы I может быть получена из любого избирательно защищенного диамина и включена в макролид, как иллюстрируется схемами 1-6. В качестве иллюстрации получения некоторых избирательно защищенных связующих групп описаны схемами 7-9. Альтернативно, связующая и головная группы 2-R2 могут быть получены в виде единого блока и включены в таком виде в макролид так же, как указано на схемах 1-6. Схема 7 Схема 7 иллюстрирует получение некоторых связующих групп, содержащих отвечающую азетидину часть, где R1 означает Н или алкил. 1-Бензгидрилазетидин-3-иловый эфир метансульфоновой кислоты(соединение 1 схемы 7, где R1 означает Н) известен из уровня техники и может быть закуплен в OakwoodProducts. Соединение 1 может быть превращено согласно схеме 7 а в соответствующий азид растворением в подходящем полярном органическом растворителе, предпочтительно ДМФА, добавлением избытка натрия азида и нагреванием полученной смеси приблизительно до 60-100 С, предпочтительно около 80 С, за период порядка 12-24 ч. После водной обработки сырой азидный продукт может быть затем обработан избытком трифенилфосфина и подвергнут кипячению в колбе с обратным холодильником в таком растворителе, как ТГФ, приблизительно в течение 3-10 ч. Полученная смесь может быть затем гидролизована добавлением NH4OH и нагреванием приблизительно до 50-70 С в течение порядка 12-24 ч,что дает соединение 2. Соединение 3, где R1 означает Н или алкил, может быть получено согласно стадии 7b замещением мезилата цианидом с последующим восстановлением литийалюмогидридом, например, с использованием метода Frigola, J., et al., J. Med. Chem., 36 (7), 801 (1993), который полностью включен в качестве ссылки. Схема 8 иллюстрирует получение некоторых других связующих групп, содержащих отвечающую азетидину часть, где R1 означает ОН или F. Исходный кетон 4 является известным и коммерчески доступным. Соединение 5 может быть получено при взаимодействии 4 согласно схеме 8 а с цианидом калия в присутствии бисульфита натрия, в таком растворителе, как диоксан, ТГФ, или EtOAc, или комбинация указанных растворителей, приблизительно при 0-25 С за период порядка 24-48 ч. См. также WO- 20011281 04/94407, который полностью включен в качестве ссылки. Согласно стадии 8b восстановление соединения 5 до амина 6 может быть осуществлено при взаимодействии с избытком, равным порядка 2 экв., литийалюмогидрида в таком растворителе, как ТГФ, при температуре приблизительно 0-25 С за период порядка 4-6 ч. Соединение 7 может быть получено согласно стадии 8 с при взаимодействии соединения 5 с DAST по способу Stelzer et al., Tetrahedron Asymmetry, 4, 161 (1993), который полностью включен в качестве ссылки. Восстановление соединения 7 до амина 8 может быть проведено согласно стадии 8d способом,аналогичным описанному для стадии 8b. Получение связующих промежуточных соединений 11 и 14 может быть проведено, как описано схемой 9. Исходя из соединения 9, где n равно 1-3, эпоксидирование с образованием соединения 10 может быть осуществлено при взаимодействии с триметилсульфонийиодидом в присутствии сильного основания, такого как гидрид натрия, в таком растворителе, как ДМФА, DCM или ДМСО, предпочтительно ДМФА, приблизительно при комнатной температуре за период порядка 8-18 ч. Соответствующее соединение 11 может быть получено при взаимодействии с NH4OH приблизительно при 25-80 С за период порядка 1-6 ч согласно стадии 9b. Соединение 15 может быть получено из 9 согласно стадиям 9 с-е способом, аналогичным описанному схемой 8. Реагенты для получения головной группы (т.е. реагенты для формирования 2-R2 формулы I или группы Р, схема 1), подвергаемые взаимодействию с азотом циклического амина (формула I, цикл А) макролидного темплата, используемые в примерах, являются коммерчески доступными, известными из уровня техники, относящимися к области компетенции специалиста с учетом данного описания или описанными или обеспеченными схемой 10 и примерами получений 9-26. Сульфонилхлориды, используемые для получения сульфонамидов, могут быть получены различными способами. Ароматические или гетероароматические системы могут быть подвергнуты взаимодействию с избытком хлорсульфоновой кислоты в таком растворителе, как хлороформ, приблизительно при 50-80 С за период порядка 12-48 ч. После концентрации промежуточная сульфоновая кислота может быть превращена в соответствующий сульфонилхлорид обработкой оксихлоридом фосфора при нагревании до температуры кипения с обратным холодильником в течение приблизительно 12-24 ч. Схема 10 Альтернативно, сульфонилхлориды могут быть получены из ароматических или гетероароматических нитро- или аминосодержащих соединений, как иллюстрируется схемой 10. Нитросоединение может быть превращено в соответствующее аминосоединение согласно стадии 10 а разнообразными известными способами, включающими восстановление индием или каталитическое гидрирование с использованием катализаторов на основе палладия или платины. Соответствующий ароматический или гетероароматический сульфонилхлорид может затем быть получен из амина согласно стадии 10b при взаимодействии с нитритом натрия в смеси ледяной уксусной кислоты и концентрированной HCl приблизительно при 05 С за период порядка 5-15 мин. Затем могут быть добавлены насыщенный раствор диоксида серы и избыток хлорида меди(II) в водной уксусной кислоте и выполнено перемешивание приблизительно при комнатной температуре в течение порядка 12-3-6 ч с последующей водной обработкой основанием. Примеры соединений Получены и идентифицированы соединения, перечисленные в табл. 1-16. В частности, получены макролидные промежуточные соединения (темплаты) с последующим сочетанием азота циклического амина (формула I, цикл А) темплата с требуемой головной группой, с целью включения группы 2-R2 формулы I. Ниже приведены неограничивающие примеры получения макролидных темплатов, неограничивающие примеры получения головного реагента и неограничивающие примеры конечных соединений по изобретению. Пример получения 1. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил(азетидин-3-ил)имино)эритромицин А. Стадия 1.DBU (10 мл, 67 ммоль) добавляют к 1-бензгидрилазетидин-3-иламину (9,0 г, 37,8 ммоль), растворенному в безводном MeCN (100 мл) при комнатной температуре. К полученному раствору добавляют 11-деокси-2',4"-диацетил-10,11-дидегидро-12-О-1 Н-имидазол-1-ил)карбонил)-6-O-метилэритромицин А(32,5 г, 35,8 ммоль) и образовавшуюся смесь нагревают (50 С) в течение 7,5 ч, затем оставляют перемешиваться в течение ночи при комнатной температуре. Осадок белого цвета собирают фильтрованием (21 г,19,5 ммоль). Фильтрат концентрируют приблизительно до 25 мл, после чего добавляют воду (20 мл), насыщенный водный раствор NaHCO3 (30 мл) и экстрагируют полученную смесь с помощью DCM (50 мл).- 21011281 Органический слой промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют в вакууме до пенистого вещества желтовато-коричневого цвета. МС (ESI+) для m/z 540 (M/2+Н)+. Стадия 2. Продукт со стадии 1 растворяют в EtOH (100 мл) и 2 н. HCl (100 мл), нагревают (40 С) в течение 3 ч,затем охлаждают до 30 С и перемешивают в течение ночи. Полученную смесь концентрируют в вакууме,поддерживая температуру бани при 28 С, приблизительно до половины исходного объема. К образовавшемуся концентрату добавляют DCM (100 мл) с последующим осторожным добавлением твердого карбоната калия для подщелачивания водного слоя (до рН 10). Органический слой отделяют и водный слой повторно экстрагируют DCM (3100 мл). Объединенные органические слои сушат над Na2SO4 и концентрируют до пенистого вещества белого цвета. MC (ESI+) для m/z 440 (М/2+Н)+. Стадия 3. Сырой продукт со стадии 2 повторно растворяют в безводном DCM (200 мл) и добавляют безводный ДМСО (20 мл, 282 ммоль), пиридинийтрифторацетат (15 г, 77,7 ммоль) и, наконец, EDC (30 г, 156,5 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч и затем обрабатывают насыщенным водным раствором NaHCO3 (30 мл), водой (30 мл). Реакционную смесь помещают в делительную воронку и оставляют для разделения слоев на несколько часов. Водный слой повторно экстрагируют с помощьюDCM (375 мл) и объединенные органические слои промывают водой (50 мл). После высушивания органических веществ над Na2SO4 растворитель удаляют в вакууме, получая пенистое вещество желтого цвета. МС (ESI+) для m/z 439 (М+Н)+. Стадия 4. Пенистое вещество желтого цвета со стадии 3 повторно растворяют в МеОН (200 мл) и нагревают(50 С) в течение 24 ч, затем концентрируют в вакууме досуха. Полученный твердый продукт споласкивают смесью гексан/диэтиловый эфир (2/1), обрабатывают МеОН (50 мл) и образовавшуюся суспензию нагревают на паровой бане до температуры кипения, после чего охлаждают до комнатной температуры. Полученный твердый продукт белого цвета фильтруют и сушат в вакууме (10,5 г, 12,6 ммоль, 35% выход с четырех стадий). МС (ESI+) для m/z 418 (М/2+Н)+. 1 Н ЯМР (CDCl3)7,41 (м, 4 Н), 7,21 (м, 4 Н), 7,16 (м,2 Н), 4,88 (ушир.д, 1 Н), 4,60 (с, 1 Н). Стадия 5. Твердый продукт белого цвета со стадии 4 растворяют в МеОН и обрабатывают концентрированной водной HCl (2,4 мл, 28 ммоль). К полученному раствору добавляют катализатор Pearlman'а (гидроксид палладия, 20 мас.% Pd, около 6 г) и суспензию обрабатывают газообразным водородом (40-50 фунт/кв.дюйм) в вибраторе Парра при нагревании (35 С) за период до 2 ч. Колбу Парра охлаждают до комнатной температуры, продувают азотом и твердые продукты отделяют фильтрованием. Фильтрат обрабатывают TEA(6,0 мл, 43 ммоль) и концентрируют в вакууме, получая указанное в заголовке соединение наряду с дифенилметаном (1 экв.) и хлористо-водородной солью TEA (2,2 экв.) в виде сыпучего сырого твердого вещества (всего 14 г; порядка 59 мас.% указанного в заголовке соединения). MC (ESI+) для m/z 335 (М/2+Н)+. 1H ЯМР (CD3OD)4,71-4,59 (м, 2 Н), 4,46 (ушир.т, 1 Н), 4,33 (д, 1 Н), 4,27 (д, 1 Н), 4,16 (ушир.т, 1 Н). Продукт примера получения 1 соответствует макролидному темплату табл. 1-3. Пример получения 2 а. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил 1-(бензгидрил)азетидин-3-ил)метил)имино)эритромицин А. Стадия 1. К 11-деокси-2',4"-диацетил-10,11-дидегидро-12-O-1 Н-имидазол-1-ил)карбонил)-6-О-метилэритромицину А (18,8 г, 20,7 ммоль) добавляют безводный MeCN (25 мл), TEA (20 мл, 144 ммоль) и С-(1-бензгидрилазетидин-3-ил)метиламин (5,5 г, 21,8 ммоль). Смесь нагревают (60 С) в течение 7,5 ч, фильтруют с конденсатором с обратным холодильником, затем концентрируют в токе азота, продолжая нагревание в течение ночи, что дает твердую массу. МС (ESI+) для m/z 1093 (М+Н)+. Стадия 2. К сырому твердому веществу со стадии 1 добавляют EtOH (100 мл) и 2 н. HCl (100 мл) и смесь перемешивают при комнатной температуре в течение 2,5 дней. В связи с неполным завершением взаимодействия, смесь нагревают (30 С) 16 ч, затем температуру немного повышают (до 40 С), выдерживая еще 24 ч, после чего вновь охлаждают до комнатной температуры. Объем растворителя снижают (в вакууме) наполовину, поддерживая 28 С. Полученный концентрат экстрагируют EtOAc (2100 мл). Объединенные органические слои промывают обратной струей воды (20 мл), водные слои соединяют и рН медленно поднимают до 10 с помощью насыщенного водного раствора NaHCO3, после чего (теперь щелочной) водный слой экстрагируют EtOAc (4100 мл). Объединенные органические слои сушат(Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение. МС (ESI+) для m/z 447 (М/2+Н)+. Пример получения 2b. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил азетидин-3-ил)метил)имино)эритромицин А. Стадия 1. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-1-(бензгидрил)азетидин- 22011281 3-ил)метил)имино)эритромицин А (10 г, 11,2 ммоль) растворяют в DCM (75 мл) при комнатной температуре. К полученному перемешиваемому раствору добавляют безводный ДМСО (10 мл, 140,8 ммоль),пиридинийтрифторацетат (7,6 г, 39 ммоль) и EDC (7,5 г, 39 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем обрабатывают насыщенным водным NaHCO3 (30 мл),водой (30 мл) и образовавшуюся смесь экстрагируют DCM (430 мл). Объединенные органические слои сушат (Na2SO4), фильтруют, концентрируют в вакууме, затем повторно растворяют в МеОН (70 мл) и нагревают (40 С) в течение 24 ч. К реакционной смеси добавляют TEA (2 мл) и нагревание продолжают еще 24 ч для гарантии завершения деацетилирования. Затем метанольный раствор концентрируют в вакууме до пенистого вещества золотистого цвета, которое очищают (SGC, используя в качестве элюента смесь DCM:MeOH:NH4OH в соотношении 93:7:0,4), что дает 6,4 г (7,55 ммоль) промежуточного соединения. МС (ESI+) для m/z 425 (М/2+Н)+. Стадия 2. Промежуточное соединение со стадии 1 (6,2 г, 7,3 ммоль) растворяют в МеОН (100 мл), и к полученному раствору добавляют катализатор Pearlman'а (гидроксид палладия, 20 мас.% Pd, 3 г), и образовавшуюся суспензию встряхивают под давлением водорода (система Парра, 50 фунт/кв.дюйм) при нагревании (40 С). Через 5 ч добавляют еще катализатор (8 г) и взаимодействие продолжают осуществлять в течение 18 ч, используя мониторинг (ЖХ-МС), позволяющий достигать замедленной конверсии до требуемого продукта. После чего добавляют концентрированную водную HCl (2 мл) и взаимодействие осуществляют, как описано выше, в течение еще 4 дней, до завершения превращения. Затем суспензию фильтруют для удаления твердых продуктов и фильтрат концентрируют, получая указанное в заголовке соединение в виде хлористо-водородной соли (5,23 г, 7,28 ммоль), которая может быть использована для генерирования аналога. МС (ESI+) для m/z 342 (М/2+Н)+. 1 Н ЯМР (CD3OD)4,59 (ушир.д, 1 Н), 4,23 (д,1 Н), 4,06 (м, 2 Н). Продукт по примеру получения 2b соответствует макролидному темплату табл. 4. Пример получения 2 с. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонилазетидин 3-ил)метил)имино)-3-(пирролидин-1-карбонил)эритромицин А и 3-дезкладинозил-11,12-дидеокси-6-Ометил-12,11-(оксикарбонилазетидин-3-ил)метил)имино)-3-(азетидин-1-карбонил)эритромицин А. Стадия 1. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-О-метил-12,11-(оксикарбонил-1-(бензгидрил)азетидин 3-ил)метил)имино)эритромицин А (3,0 г, 3,4 ммоль) растворяют в безводном MeCN (15 мл) и TEA (1,4 мл,10 ммоль). Добавляют бис(N-сукцинимидил)карбонат (1,29 г, 5 ммоль) и раствор перемешивают 24 ч при комнатной температуре, после чего добавляют дополнительное количество TEA (1,4 мл, 10 ммоль) и бис(N-сукцинимидил)карбоната (1,29 г, 5 ммоль) и реакционную смесь перемешивают еще 24 ч. Добавляют дополнительное количество MeCN (15 мл) и полученный исходный раствор делят на две части (стадии 2 а и 2b). Стадия 2 а. Основную часть исходного раствора со стадии 1 (24 мл) обрабатывают пирролидином (1 мл, 12 ммоль) и осуществляют мониторинг методом ЖХ-МС до тех пор, пока образование карбамата не будет признано завершенным. МС (ESI+) для m/z 496 (М/2+Н)+. Полученный раствор концентрируют в вакууме, повторно растворяют в МеОН (80 мл) и нагревают (60 С) в течение 20 ч для удаления 2'-ацетил-защитной группы. Удаление МеОН с последующей очисткой (SGC при использовании в качестве элюента смесиDCM:MeOH:NH4OH в соотношении 95:4:1) дает очищенный промежуточный продукт (3,32 г). МС (ESI+) для m/z 475 (М/2+Н)+. Стадия 2b. Меньшую часть исходного раствора со стадии 1 (6 мл) обрабатывают азетидином (1 мл, 18 ммоль) и проводят мониторинг, как указано выше для стадии 2 а. MC (ESI+) для m/z 489 (M/2+Н)+. Удаляют 2'-ацетил-защитную группу и промежуточный продукт очищают, как указано выше для стадии 2 а (получено 0,32 г). МС (ESI+) для m/z 468 (М/2+Н)+. Стадия 3 а. Продукт со стадии 2 а растворяют в МеОН (100 мл) и концентрированной водной HCl (0,331 мл,3,85 ммоль). К полученному раствору добавляют катализатор Pearlman'a (гидроксид палладия, 20 мас.%Pd, 3,0 г). Суспензию обрабатываю газообразным водородом (40 фунт/кв.дюйм) при нагревании (35 С) и встряхивании (система Парра) в течение 18 ч. После удаления твердых продуктов фильтрат концентрируют в вакууме, получая 3-дезкладинозил-11,12-дидеокси-6-О-метил-12,11-(оксикарбонилазетидин-3 ил)метил)имино)-3-(пирролидин-1-карбонил)эритромицин А в виде хлористо-водородной соли (2,74 г). МС (ESI+) для m/z 385 (М/2+Н)+. Стадия 3b. Продукт со стадии 2b подвергают гидрогенолизу согласно стадии 3 а, получая 3-дезкладинозил 11,12-дидеокси-6-О-метил-12,11-(оксикарбонилазетидин-3-ил)метил)имино)-3-(азетидин-1-карбонил) эритромицин А в виде хлористо-водородной соли (0,25 г). МС (ESI+) для m/z 385 (М+Н)+. Продукт по примеру получения 2 с соответствует темплату табл. 5.- 23011281 Пример получения 2d. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонилазетидин 3-ил)метил)имино)-3-2-метилпирролидин)-1-карбонил)эритромицин А. Получают согласно примеру получения 2 с, стадии 1, 2 а и 3 а, заменяя пирролидин на стадии 2 а на 2 метилпирролидин. МС (ESI+) для m/z 399 (М/2+Н)+. Продукт по примеру получения 2d соответствует темплату табл. 5. Пример получения 2 е. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонилазетидин 3-ил)метил)имино)-3-2-(3-фторфенил)пирролидин)-1-карбонил)эритромицин А. Получают согласно примеру получения 2 с, стадии 1, 2 а и 3 а, заменяя пирролидин на стадии 2 а на 2(3-фторфенил)пирролидин. МС (ESI+) для m/z 439 (М/2+Н)+. Продукт по примеру получения 2 е соответствует темплату табл. 5. Пример получения 3. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-3-метилазетидин-3-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 1, при замене 1 бензгидрилазетидин-3-иламина на С-(1-бензгидрил-3-метилазетидин-3-ил)метиламин. МС (ESI+) для m/z 349 (М/2+Н)+. Продукт по примеру получения 3 соответствует темплату табл. 6. Пример получения 4. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-3-гидроксиазетидин-3-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 1, при замене 1-бензгидрилазетидин-3-иламина на 3-аминометил-1-бензгидрилазетидин-3-ол. МС (ESI+) для m/z 350 (М/2+Н)+. Продукт по примеру получения 4 соответствует темплату табл. 7. Пример получения 5 а. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилS)-пирролидин-3-ил)имино)эритромицин А. Следуют методике, аналогичной описанной для примера получения 1, стадии 1-4, заменяя 1-бензгидрилазетидин-3-иламин на (S)-1-бензилпирролидин-3-иламин, что дает 3-дезкладинозил-11,12-дидеокси 6-O-метил-3-оксо-12,11-(оксикарбонил-S)-1-бензилпирролидин-3-ил)имино)эритромицин А. МС (ESI+) для m/z 387 (М/2+Н)+. Полученный продукт (4 г, 5,2 ммоль) растворяют в 4,4% муравьиной кислоте в МеОН (360 мл), обрабатывают палладиевой чернью (0,30 г) и перемешивают 4 ч при нагревании (40 С). Смесь фильтруют и фильтрат нейтрализуют насыщенным водным NaHCO3. Полученную смесь концентрируют в вакууме и экстрагируют (3EtOAc). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение (3 г, 4,4 ммоль). МС (ESI+) для m/z 342 (М/2+Н)+. 1 Н ЯМР (CD3OD)1,11 (дд, 3 Н), 0,87 (т, 3 Н). Продукт примера получения 5 а соответствует темплату табл. 8. Пример получения 5b. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилR)-пирролидин-3-ил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 5 а, при замене (S)1-бензилпирролидин-3-иламина на (R)-1-бензилпирролидин-3-иламин. 1H ЯМР (CD3OD)1,28 (д, 3 Н),1,17 (д, 3 Н), 1,07 (д, 3 Н), 0,88 (т, 3 Н). Продукт по примеру получения 5b соответствует темплату табл. 9. Пример получения 6 а. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-S)-пирролидин-2-ил)метил)имино)эритромицин А. Стадия 1. Защищенное промежуточное соединение может быть пслучено способом, аналогичным описанному в примере получения 1, стадии 1-4, при замене 1-бензгидрилазетидин-3-иламина на трет-бутиловый эфир(S)-2-аминометилпирролидин-1-карбоновой кислоты. Стадия 2. Сырой продукт стадии 1 может быть подвергнут взаимодействию с избытком трифторуксусной кислоты в дихлорэтане при комнатной температуре в течение 3 ч с последующей концентрацией досуха в вакууме,что дает указанное в заголовке соединение в виде трифторацетатной соли. МС (ESI+) для m/z 370 (М/2+Н)+. Продукт по примеру получения 6 а соответствует темплату табл. 12. Пример получения 6b. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилR)-пирролидин-2-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 1, стадии 1-4, при замене 1-бензгидрилазетидин-3-иламина на трет-бутиловый эфир (R)-2-аминометилпирролидин-1-карбоновой кислоты и впоследствии согласно примеру получения 6 а, стадия 2. МС (ESI+) для m/z 349 (M/2+Н)+. Продукт по примеру получения 6b соответствует темплату табл. 10. Пример получения 7 а. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилS)-пирролидин-3-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 6b, при замене трет-бутилового эфира (R)-2-аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир- 24011281 Продукт по примеру получения 7 а соответствует темплату табл. 11. Пример получения 7b. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилR)-пирролидин-3-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 6b, при замене трет-бутилового эфира (R)-2-аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир(S)-3-аминометилпирролидин-1-карбоновой кислоты. МС (ESI+) для m/z 349 (М/2+Н)+. Продукт по примеру получения 7b соответствует темплату табл. 13. Пример получения 8. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-О-метил-12,11-(оксикарбонил 3-азабицикло[3,1,0]гексан-6-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 6 а, при замене трет-бутилового эфира (S)-2-аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир 6 аминометил-3-азабицикло[3,1,0]гексан-3-карбоновой кислоты. МС (ESI+) для m/z 750 (М+Н)+. Пример получения 8.1. 2'-Ацетил-3-дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил пиперидин-4-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 6 а, при замене трет-бутилового эфира (S)-2-аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир 4 аминометилпиперидин-1-карбоновой кислоты. МС (ESI+) для m/z 710 (М+Н)+. Пример получения 8.2. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-12,11-(оксикарбонил-4-гидроксипиперидин-4-ил)метил)имино)эритромицин А. Может быть получен способом, аналогичным описанному в примере получения 6 а, стадия 1, при замене трет-бутилового эфира (S)-2-аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир 4-аминометил-4-гидроксипиперидин-1-карбоновой кислоты. МС (ESI+) для m/z 869 (М+Н)+. Затем продукт обрабатывают избытком MeOH при комнатной температуре в течение ночи, концентрируют в вакууме досуха, повторно растворяют в DCM (1 мл) и обрабатывают избытком TFA (1 мл) в течение 4 ч при комнатной температуре. После концентрирования в вакууме остаток непосредственно используют для получения производного. МС (ESI+) для m/z 727 (М+Н)+. Пример получения 9. 3-Циано-4-[1,2,4]триазол-1-илбензолсульфонилхлорид. Для превращения анилинов в сульфонилхлориды следуют, с небольшим изменением, методикам,приведенным в J. Med. Chem. 29, 427-433 (1986), который полностью включен в качестве ссылки. Стадия 1. 5-Амино-2-[1,2,4]триазол-1-илбензонитрил (0,40 г, 2,16 ммоль) в ледяной уксусной кислоте (2,16 мл) обрабатывают концентрированной водной HCl (0,45 мл, 5 ммоль) и смесь охлаждают до температуры в пределах 0-5 С с помощью бани лед-вода. Добавляют нитрит натрия (0,150 г, 2,17 ммоль) и суспензию перемешивают около 10 мин. Стадия 2. В отдельной колбе дигидрат хлорида меди(II) (1,8 г, 10,6 ммоль) обрабатывают уксусной кислотой(36 мл) и водой (2,2 мл). Затем барботируют газообразным диоксидом серы до насыщения (до постоянной массы), поддерживая хорошую вентиляцию системы. (Полученная на данной стадии смесь может быть использована для ряда взаимодействий.) Стадия 3. Часть (3 мл) смеси со стадии 2 добавляют к суспензии со стадии 1 и реакционную колбу оставляют нагреваться до комнатной температуры в течение ночи при постоянном перемешивании (обеспечивая вентиляцию). Затем смесь разбавляют водой и многократно экстрагируют DCM. Объединенные органические слои промывают насыщенным водным NaHCO3, сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение (0,20 г), которое используют без дополнительной очистки. 1H ЯМР (CDCl3)9,06 (с, 1 Н), 8,50 (с, 1 Н), 8,39 (д, J=9 Гц, 1 Н), 8,25 (с, 1 Н), 8,19 (д, J=9 Гц, 1 Н). Пример получения 10. Имидазо[1,2-а]пиридин-3-сульфонилхлорид. Стадия 1. Хлорсульфоновую кислоту (0,170 мл, 2,55 ммоль) растворяют в хлороформе (1 мл) и полученный раствор добавляют по каплям к имидазо[1,2-а]пиридину (0,100 г, 0,85 ммоль) в хлороформе (4 мл) за период 10 мин. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 24 ч, затем дают охладиться до комнатной температуры и концентрируют досуха в вакууме. Сырой маслянистый продукт обрабатывают диэтиловым эфиром (10 мл) и этанолом (5 мл), получая осадок белого цвета. Твердый продукт собирают фильтрованием, промывают EtOH и сушат, получая имидазо[1,2 а]пиридин-3-сульфоновую кислоту (0,128 мг). МС (ESI-) для m/z 131 (M-Н)-. Стадия 2. Продукт со стадии 1 (0,10 г, 0,5 ммоль) обрабатывают оксихлоридом фосфора (3 мл) и нагревают до температуры кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и обрабатывают DCM (50 мл), выливают в смесь лед-вода (100 мл) и затем экстрагируют DCM (4100 мл). Органические слои объединяют и сушат (Na2SO4), фильтруют и концентрируют досуха в вакууме, получая указанное в заголовке соединение (0,10 г). 1 Н ЯМР (ДМСО-d6)8,87 (м,- 25011281 1H), 8,25 (с, 1 Н), 7,98 (м, 2 Н), 7,57 (м, 1 Н). Пример получения 11. Имидазо[1,2-а]пиримидин-2-карбальдегид и имидазо[1,2-а]пиримидин-3 карбальдегид. Имидазо[1,2-а]пиримидин (0,30 г, 2,5 ммоль) растворяют в безводном ДМФА (10,0 мл) и добавляют к заранее полученному раствору оксихлорида фосфора (0,26 мл, 2,8 ммоль) в безводном ДМФА (10,0 мл). Раствор оставляют перемешиваться на 72 ч в атмосфере азота при комнатной температуре. Затем раствор выливают в воду (100 мл) и остаточные органические вещества экстрагируют диэтиловым эфиром (330 мл). Оставшуюся водную часть концентрируют досуха в токе азота, получая смесь сырого имидазо[1,2-а]пиримидин-3-карбальдегида и имидазо[1,2-а]пиримидин-2-карбальдегида (всего 0,10 г), которую используют на последующей стадии восстановительного аминирования без дополнительной очистки. МС(ESI+) для m/z 148 (М+Н)+. Изомеры разделяют методом ОФ-ВЭЖХ после сочетания с 3-дезкладинозил 11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилазетидин-3-ил)метил)имино)эритромицином А. Пример получения 12. Имидазо[1,2-а]пиразин-3-карбальдегид. Имидазо[1,2-а]пиразин (0,30 г, 2,5 ммоль) растворяют в безводном ДМФА (10,0 мл) и добавляют к заранее полученному раствору оксихлорида фосфора (0,26 мл, 2,8 ммоль) в безводном ДМФА (10,0 мл). Раствор оставляют перемешиваться на 72 ч в атмосфере азота при комнатной температуре. Затем раствор выливают в воду (100 мл) и остаточные органические вещества экстрагируют диэтиловым эфиром (330 мл). Оставшуюся водную часть концентрируют досуха в токе азота, получая указанное в заголовке соединение (0,050 г). МС (ESI+) для m/z 148 (М+Н)+. Пример получения 13. Пирроло[1,2-а]пиразин-6-карбальдегид. Стадия 1. Пирроло[1,2-а]пиразин (1,92 г, 16,3 ммоль) растворяют в воде (16 мл) и обрабатывают концентрированной водной HCl (4 мл, 4 6,4 ммоль) и 37 мас.% водным формальдегидом (5,6 мл, 67 ммоль). Раствор нагревают до 60 С в течение 4 ч, дают охладиться до комнатной температуры и рН доводят до 10. Раствор экстрагируют EtOAc (350 мл) и объединенные фракции сушат над Na2SO4 и концентрируют досуха в вакууме. Органический остаток очищают (SGC, при использовании в качестве элюента смесиDCM:MeOH:NH4OH в соотношении 96:3:1). Выделенный исходный материал растворяют в воде (20 мл),и концентрированной HCl (5 мл, 0,6 моль), и формальдегиде (7 мл, 0,9 моль). Раствор нагревают до 60 С в течение 120 ч и затем оставляют перемешиваться при комнатной температуре на 240 ч. После чего рН раствора доводят до 12 с помощью раствора гидроксида натрия (водного 30%) и экстрагируют с помощью EtOAc (430 мл). Органические фракции объединяют, сушат над Na2SO4 и концентрируют досуха в вакууме. Продукт очищают (SGC, при использовании в качестве элюента смеси DCM:MeOH:NH4OH в соотношении 95:4:1), получая указанное в заголовке соединение (0,46 г). MC (ESI+) для m/z 149 (M+Н)+. 1IBX (0,34 г, 1,2 ммоль) и нагревают до 80 С в течение 3 ч. Раствору дают охладиться до комнатной температуры и фильтруют через фильтровальную фритту пипетки-шприца. Раствор концентрируют в токе азота, получая указанное в заголовке соединение (0,06 г), которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3)9,87 (с, 1 Н), 9,34 (д, 1 Н), 9,02 (с, 1 Н), 7,93 (д, 1 Н), 7,47 (д, 1 Н), 6,82 (д, 1 Н). Пример получения 14. Имидазо[1,2-а]пиридин-6-карбальдегид. Стадия 1. 1 Н-Имидазо[1,2-а]пиридин-6-карбоновую кислоту (2,0 г, 5,1 ммоль) растворяют в безводном DCM(30 мл) и охлаждают до 0 С. К раствору добавляют этилхлорформиат (1,30 мл, 13,6 ммоль) и TEA (4,31 мл,30,8 ммоль) и оставляют перемешиваться на 1 ч, в то время как температуре позволяют подняться до уровня окружающей среды. Добавляют этантиол (2,0 мл, 27 ммоль) и раствор оставляют перемешиваться в течение ночи. Вещества подвергаются частичному превращению, поэтому добавляют TEA (2,0 мл, 14 ммоль) и этилхлорформиат (7,8 мл, 82 ммоль) и оставляют перемешиваться на 15 мин, после чего добавляют дополнительное количество этантиола (80 мл, 1,1 моль). Раствор оставляют перемешиваться на 2 ч и затем выливают в насыщенный водный раствор NaHCO3. Слой DCM удаляют и водную часть экстрагируют EtOAc (470 мл). Объединенные органические фракции сушат над Na2SO4, фильтруют и концентрируют в вакууме. Продукт очищают (SGC, используя градиентное элюирование смесью ацетон:гексан в соотношениях от 1:4 до 3:1), получая промежуточное соединение, сложный тиоэфир (0,2 г). 1 Н ЯМР(CDCl3)8,82 (с, 1 Н), 7,67-7,57 (м, 4H), 3,07 (кв, 2 Н), 1,32 (т, 3 Н). Стадия 2. Сложный тиоэфир со стадии 1 (0,11 г, 0,53 ммоль) растворяют в ацетоне (1,0 мл) и добавляют 10% палладий на угле (0,027 г) с последующим добавлением триэтилсилана (0,089 мл, 0,558 ммоль). Смесь оставляют перемешиваться на 1 ч и добавляют другую порцию триэтилсилана (0,089 мл, 0,558 ммоль). Спустя 1,5 ч реакционную смесь пропускают через фильтрующий шприц и очищают (SGC, используя градиентное элюирование смесью ацетон:гексан от 3:17 до 3:1), получая указанное в заголовке соедине- 26011281 ние (0,049 г). MC (ESI+) для m/z 147 (M+Н)+. 1 Н ЯМР (CDCl3)9,90 (с, 1 Н), 8,66 (с, 1 Н), 7,70 (д, 2 Н),7,66-7,60 (м, 2 Н). Пример получения 15. 1-Пиридин-2-ил-1 Н-пиразол-4-карбальдегид. Смесь 2-бромпиридина (3,4 ммоль), 3-пиразолкарбоксальдегида (3,2 ммоль) и карбоната калия (3,4 ммоль) в безводном ДМФА (6 мл) нагревают до 120 С в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой и экстрагируют EtOAc (3). Органические слои объединяют и сушат (Na2SO4), фильтруют и концентрируют. Указанное в заголовке соединение получают очисткой(SGC, при использовании градиентного элюирования смесью EtOAc:гексан от 0 до 100% EtOAc). Пример получения 16. [1,8]Нафтиридин-4-карбальдегид. 4-Метил-[1,8]нафтиридин (0,743 г, 5,15 ммоль) растворяют в диоксане (32 мл) и воде (4 мл). Добавляют диоксид селена (1,14 г, 103 ммоль) и раствор нагревают до 80 С в течение 1 ч. Потом добавляют дополнительное количество диоксида селена (0,020 г, 1,80 ммоль), раствор нагревают в течение 30 мин и затем дают охладиться до комнатной температуры. Раствор пропускают через фильтрующий шприц для удаления твердых веществ и выливают в раствор вода:насыщенный водный NaHCO3 (1:1) (60 мл). Органический слой отделяют и оставшуюся водную часть экстрагируют DCM (2100 мл) и (150 мл). Органические фракции объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Продукт очищают (SGC, используя смесь MeCN:гексан в соотношении 1:1), что дает указанное в заголовке соединение (0,63 г). MC (ESI+) для m/z 159 (M+Н)+. 1 Н ЯМР (CDCl3)10,39 (с, 1 Н), 9,39-9,37 (м, 2 Н), 9,16[1,8]Нафтиридин-4-карбальдегид (0,300 г, 1,90 ммоль) растворяют в смеси безводного толуола (10 мл) и безводного ТГФ (10 мл). Раствор охлаждают до 0 С, и медленно добавляют метилмагнийбромид (1,62 мл 1,4 М в смеси ТГФ/толуол), и перемешивают раствор 1 ч, позволяя при этом нагреться до комнатной температуры. Добавляют насыщенный водный хлорид аммония до достижения раствором желто-коричневого цвета и видимого появления осадка. Раствор пропускают через фильтрующий шприц и выливают в воду, где экстрагируют EtOAc (330 мл). Объединенные органические фракции сушат над Na2SO4,фильтруют и концентрируют в вакууме. Продукт очищают (SGC, используя в качестве элюента сначала смесь MeCN:гексан в соотношении 1:1, затем переходя к смеси DCM:MeOH:NH4OH в соотношении 89:10:1 для завершения элюирования соединения), получая указанное в заголовке соединение (0,079 г). МС (ESI+) для m/z 175 (М+Н)+. 1H ЯМР (CDCl3)8,73 (м, 1 Н), 8,64 (д, 1 Н), 8,38 (м, 1 Н), 7,52 (д, 1 Н), 7,25(7,8 г, 24,8 ммоль) и нагревают до 80 С в течение 6 ч. Раствор охлаждают до комнатной температуры и твердые продукты удаляют фильтрованием. Продукт очищают (SGC, при использовании в качестве элюента MeCN), получая указанное в заголовке соединение (1,22 г). MC (ESI+) для m/z 173 (М+Н)+. 1H ЯМР(CDCl3)9,13 (д, 1 Н), 9,03 (дд, 1 Н), 8,85 (дд, 1 Н), 7,70 (д, 1 Н), 7,46 (дд, 1 Н), 2,64 (с, 3 Н). Пример получения 19. 5-Нитро-2-[1,2,4]триазол-1-илбензонитрил. 2-Фтор-5-нитробензонитрил (1,0 г, 6,0 ммоль) растворяют в безводном ДМФА (6 мл), затем обрабатывают [1,2,4]триазолом (0,46 г, 6,7 ммоль), карбонатом цезия (2,9 г, 8,9 ммоль) и нагревают (50 С) в течение ночи. После охлаждения до комнатной температуры смесь обрабатывают водой и указанное в заголовке соединение в виде твердого вещества собирают фильтрованием (1,14 г). МС (ESI+) для m/z 216 (М+Н)+. Пример получения 20. 2-Метил-5-(4-нитрофенил)[1,3,4]оксадиазол. Гидразид 4-нитробензойной кислоты (1,0 г, 5,6 ммоль) нагревают в триметилортоацетате до температуры кипения с обратным холодильником в течение 4 дней. После охлаждения до комнатной температуры смесь порошкуют с гексаном и указанное в заголовке соединение собирают фильтрованием (0,93 г). МС (ESI+) для m/z 206 (М+Н)+. Пример получения 21. 5-Амино-2-[1,2,4]триазол-1-илбензонитрил. 5-Нитро-2-[1,2,4]триазол-1-илбензонитрил (1,14 г, 5,3 ммоль) растворяют в этаноле (23 мл) и насыщенном водном хлориде аммония (5,3 мл), после чего добавляют индий в порошке (3,25 г, 28,2 ммоль). Затем смесь нагревают до температуры кипения с обратным холодильником в течение 3 ч, охлаждают до комнатной температуры и твердые вещества фильтруют (промывают MeOH). Фильтрат разбавляют водой, подщелачивают с помощью 1 н. NaOH (водный) и экстрагируют EtOAc. Органический слой сушат(ESI+) для m/z 186 (М+Н)+. Пример получения 22. 2-Метил-5-(4-аминофенил)-[1,3,4]оксадиазол. 2-Метил-5-(4-нитрофенил)-[1,3,4]оксадиазол (0,930 г, 4,54 ммоль) растворяют в МеОН. К полученному раствору добавляют 10% палладий на угле (0,06 г) и смесь встряхивают при давлении водорода(35 фунт/кв.дюйм, аппарат Парра) до завершения взаимодействия (мониторинг методом ЖХ-МС). Твердые вещества отделяют фильтрованием и споласкивают МеОН. Фильтрат концентрируют, получая указанное в заголовке соединение (0,76 г). МС (ESI+) для m/z 176 (М+Н)+.(0,068 г, 0,059 ммоль) смешивают в 1,2-диметоксиэтане (11 мл) и воде (3,8 мл) в атмосфере азота. Реакционную смесь нагревают (110 С) в течение 12 ч, охлаждают до комнатной температуры, разбавляют насыщенным раствором соли и экстрагируют EtOAc. Объединенные органические слои сушат (Na2SO4),фильтруют и концентрируют в вакууме до сырого твердого вещества, которое растворяют в DCM и экстрагируют в 1 н. HCl (водная). DCM-слой отбрасывают и водный слой подщелачивают с помощью 1 н.NaOH (водной) и повторно экстрагируют EtOAc. EtOAc-слой сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение (0,395 г). MC (ESI+) для m/z 206 (М+Н)+. Пример получения 24. 5-Оксазол-5-илпиридин-3-иламин. Стадия 1. 5-(3-Пиридин)оксазол (21,2 ммоль) превращают в соответствующий N-оксид с помощью м-хлорпербензойной кислоты (46,9 ммоль) в хлороформе (40 мл) при комнатной температуре (3 ч). К реакционной смеси добавляют гидроксид кальция (109 ммоль) и DCM (250 мл) и оставляют перемешиваться на 45 мин,после чего твердые вещества отделяют фильтрованием. Фильтрат концентрируют, получая N-оксидное промежуточное соединение (2,9 г, 17,9 ммоль). Стадия 2. Нитрат тетрабутиламмония (6,54 г, 21,6 ммоль) в DCM (90 мл) охлаждают на бане лед-вода в атмосфере азота. К полученному раствору добавляют трифторуксусный ангидрид (3,0 мл, 21,6 ммоль) и полученную смесь перемешивают в течение 20 мин, после чего добавляют продукт со стадии 1 (в 90 млDCM) и полученную суспензию перемешивают сначала на бане лед-вода, затем оставляют нагреваться до комнатной температуры на 2 ч. После чего смесь нагревают (40 С) в течение 9 ч, охлаждают до комнатной температуры и обрабатывают насыщенным водным NaHCO3. Затем смесь экстрагируют DCM(3250 мл) и объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме,получая 5-(N-оксид-5-нитро-3-пиридин)оксазол (0,73 г, 3,53 ммоль), после очистки (SGC, при использовании смеси MeOH:DCM в соотношении 1:10). Стадия 3. 5-(N-Оксид-5-нитро-3-пиридин)оксазол (0,159 г, 0,77 ммоль) со стадии 2 обрабатывают MeOH (30 мл) и суспензией никеля Ренея 2800 (2 мл) и смесь встряхивают в атмосфере водорода (45 фунт/кв.дюйм) в течение 6 ч на аппарате Парра. Фильтрование (Celite) дает указанное в заголовке соединение. МС (ESI+) для m/z 162 (М+Н)+. Пример получения 25. Фениловый эфир хинолин-5-илкарбаминовой кислоты. 6-Аминохинолин (0,5 г, 3,5 ммоль) обрабатывают фенилхлорформиатом (0,597 г, 3,81 ммоль) и TEA(1 мл) в DCM при комнатной температуре в течение 4 ч. К полученной смеси добавляют насыщенный водный NaHCO3 и воду и смесь экстрагируют DCM. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение, после очистки (SGC, используя градиентное элюирование смесью EtOAc:гексан в соотношениях от 2:3 до 7:3). MC (ESI+) для m/z 265 (М+Н)+. Пример получения 26. 1-Бензгидрилазетидин-3-иламин. 1-Бензгидрилазетидин-3-иловый эфир метансульфоновой кислоты (14,8 г, 47 ммоль, Oakwood Products) растворяют в безводном ДМФА (60 мл) и к полученному раствору добавляют азид натрия (9,0 г, 138 ммоль). Смесь нагревают (80 С) в течение 18 ч, охлаждают до комнатной температуры, затем обрабатывают водой (20 мл) и насыщенным водным NaHCO3 (20 мл). Полученную смесь экстрагируют DCM (460 мл) и органический слой сушат над Na2SO4. Удаление растворителя дает сырое масло (11 г), которое повторно растворяют в ТГФ (85 мл) и обрабатывают трифенилфосфином (15 г, 57 ммоль). После перемешивания при комнатной температуре (30 мин; отмечается выделение газа и незначительный экзотермический эффект) смесь нагревают до температуры кипения с обратным холодильником (6 ч), затем снова охлаждают до комнатной температуры, после чего добавляют NH4OH (7 мл) и вновь нагревают до температуры кипения с обратным холодильником (5 ч). После охлаждения до комнатной температуры растворитель удаляют и остаток обрабатывают 3 н. HCl (35 мл), доводя рН до 1. Полученный кислый раствор экстрагируют DCM (350 мл) и органические слои отбрасывают. Затем водный слой подщелачивают с помощью твердого гидроксида калия до рН 10 и потом вновь экстрагируют DCM (375 мл). После чего водный слой насыщенный с помощью твердого хлорида натрия и повторно экстрагируют DCM (375 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая сырой 1 бензгидрилазетидин-3-иламин (9,0 г, 37,8 ммоль). МС (ESI+) для m/z 239 (M+H)+. Следующие примеры получения иллюстрируют получение образцов по примерам табл. 1-16, включая используемые способы сочетания головной группы. Пример получения 27 (пример 1.20). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11(оксикарбонил-(1-1,8-нафтиридин-4-ил)метил)азетидин-3-ил)имино)эритромицин А. Конечное сырое твердое вещество по примеру получения 1 (1,20 г, 1,06 ммоль, 3-дезкладинозил 11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил(азетидин-3-ил)имино)эритромицин А) обрабатывают- 28011281 безводным ТГФ (10 мл), 1,8-нафтиридин-4-карбальдегидом (0,20 г, 1,3 ммоль), TEA (0,44 мл, 3,2 ммоль),уксусной кислотой (0,095 мл, 1,6 ммоль), измельченными в порошок до размера частиц 4 молекулярными ситами (3 г) и суспензию нагревают при перемешивании в течение 4 ч при 47 С. По истечении указанного времени добавляют натрийтриацетоксиборгидрид (0,33 г, 1,6 ммоль) и нагревание продолжают еще 30-60 мин, после чего удаляют источник теплоты и дают реакционной колбе достичь комнатной температуры, выдерживая в течение ночи при постоянном перемешивании. Затем реакционную смесь разбавляют DCM и фильтруют для удаления твердых веществ. К фильтрату добавляют насыщенный водный NaHCO3 (15 мл) и воду (15 мл) и полученную смесь экстрагируют DCM (530 мл). Полученный на фильтре твердый продукт смывают в делительную воронку и экстрагируют, поскольку присутствует фильтрат. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме. Очистка (SGC, с использованием градиентного элюирования смесью DCM:MeOH:NH4OH в соотношениях от 96:4:0,5 до 93:7:0,5) дает указанное в заголовке соединение (0,557 г, после превращения в соль, диформиат, в МеОН с избытком муравьиной кислоты, и концентрации в вакууме). Пример получения 28. 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1(S-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил)имино)эритромицин А (пример 1.23) и 3-дезкладинозил 11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(R-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил) имино)эритромицин А (пример 1.25). Конечное сырое твердое вещество по примеру получения 1 (4,21 г, 3,72 ммоль, 3-дезкладинозил 11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил(азетидин-3-ил)имино)эритромицин А) обрабатывают безводным ТГФ (35 мл), 1-[1,8]нафтиридин-4-илэтаноном (0,7 г, 4,07 ммоль), уксусной кислотой(0,33 мл, 5,8 ммоль), TEA (1,55 мл, 11,1 ммоль) и измельченными в порошок до размера частиц 4 молекулярными ситами (4,5 г) и суспензию нагревают при перемешивании в течение 4 ч при 49 С. По истечении указанного времени добавляют натрийтриацетоксиборгидрид (2,35 г, 11 ммоль) и нагревание продолжают еще 1 ч, после чего удаляют источник теплоты и дают реакционной колбе достичь комнатной температуры, выдерживая в течение ночи при постоянном перемешивании. Затем твердые вещества отделяют фильтрованием, и к фильтрату добавляют насыщенный водный NaHCO3 (15 мл) и воду (15 мл), и слои разделяют. Водный слой повторно экстрагируют с помощью DCM (540 мл). Полученный на фильтре твердый продукт смывают в делительную воронку и экстрагируют, поскольку присутствует фильтрат. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая 4 г сырой смеси диастереомеров. Диастереомеры разделяют на порции (ОФ-ВЭЖХ с использованием градиента от 8 до 30% А в В за период 10 мин). Более полярный пик (пик 1) вымывается на 4,00 мин(собрано 1,1 г) и менее полярный пик (пик 2) сразу следом на 4,38 мин (собрано 1,0 г). Вещество пика 1 может быть перекристаллизовано из EtOAc, MeOH, МеОН/вода, EtOH, EtOH/вода, IPA или вода/вода. При использовании перекристаллизации из EtOAc получают приемлемые для рентгеновского спектрального анализа кристаллы, структура которых однозначно идентифицирована как 3-дезкладинозил-11,12 дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(R-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил)имино) эритромицин А (пример 1.25). По аналогии, вещество пика 2 идентифицировано как 3-дезкладинозил 11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(1-(S-(1,8-нафтиридин-4-ил)этил)азетидин-3-ил) имино)эритромицин А (пример 1.23). Пример получения 29 (пример 1.33). 3-Дезкладинозил-11,12-дидеокси-2-фтор-6-O-метил-3-оксо 12,11-(оксикарбонил-(1-1,8-нафтиридин-4-ил)метил)азетидин-3-ил)имино)эритромицин А. Стадия 1. Свободное основание 3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-(11,8-нафтиридин-4-ил)метил)азетидин-3-ил)имино)эритромицина А (0,10 г, 0,12 ммоль) растворяют в безводном DCM (1,5 мл). Добавляют TEA (0,069 мл, 0,50 ммоль) и уксусный ангидрид (0,015 мл, 0,16 ммоль) и реакционную смесь оставляют стоять в течение ночи. К смеси добавляют насыщенный водныйNaHCO3 и воду (1:1) и органический слой отделяют. Водный слой повторно экстрагируют с помощьюDCM (32 мл) и объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая сырое промежуточное соединение. Стадия 2. Промежуточное соединение со стадии 1 растворяют в безводном ДМФА (3 мл) и безводном толуоле (3 мл) и охлаждают на бане сухой лед/ацетон, поддерживая давление водорода выше атмосферного. Твердый калий-бис(триметилсилил)амид (0,042 г, 0,21 ммоль) взвешивают в атмосфере азота и быстро добавляют к охлажденному раствору, который затем перемешивают в течение 1 ч, давая охладиться. Затем добавляют твердый [1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2,2,2]октан-бис(тетрафторборат)](0,062 г, 0,176 ммоль) и реакционную смесь оставляют нагреваться до комнатной температуры в течение 1 ч. Добавляют DCM (20 мл) с последующим добавлением насыщенного водного NaHCO3 (5 мл) и воды(5 мл) и слои разделяют. Водный слой повторно экстрагируют с помощью DCM (210 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Стадия 3. Сырой продукт со стадии 2 растворяют в МеОН (100 мл) и нагревают (32 С) в течение ночи. После- 29011281 концентрирования в вакууме сырую смесь очищают методом ОФ-ВЭЖХ, получая указанное в заголовке соединение (0,023 г, 0,028 ммоль). Пример получения 30 (пример 2.06). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11(оксикарбонил-(1-(N-(хинолин-5-ил)аминокарбонил)азетидин-3-ил)имино)эритромицин А. Конечный сырой твердый продукт по примеру получения 1 (0,076 г, 0,067 ммоль) обрабатываютTEA (1,0 мл) и фениловым эфиром хинолин-5-илкарбаминовой кислоты (0,030 г, 0,113 ммоль) в безводном MeCN и нагревают (50 С) в течение ночи. Реакционную смесь упаривают досуха в вакууме и очищают (ОФ-ВЭЖХ), получая указанное в заголовке соединение. Пример получения 31 (пример 3.15). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11(оксикарбонил-(1-(имидазо[1,2-а]пиридинсульфонил)азетидин-3-ил)имино)эритромицин А. Конечный сырой твердый продукт по примеру получения 1 (0,20 г, 0,18 ммоль) обрабатывают безводным MeCN (5 мл) с последующей обработкой TEA (0,076 мл, 0,54 ммоль) и имидазо[1,2-а]-пиридин 3-сульфонилхлоридом (0,039 г, 0,18 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем обрабатывают насыщенным водным NaHCO3 (15 мл), водой (15 мл) и экстрагируют DCM (430 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют в вакууме. Очистка методом ОФ-ВЭЖХ дает указанное в заголовке соединение (0,055 г, 0,065 ммоль). Пример получения 32 (пример 4.34). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11(оксикарбонил-1-(хинолин-8-карбонил)азетидин-3-ил)метил)имино)эритромицин А. Стадия 1. Хинолин-8-карбоновую кислоту (0,182 г, 1,05 ммоль) растворяют в безводном DCM (3 мл) с добавлением ДМФА (0,025 мл). К полученной смеси добавляют оксалилхлорид (0,526 мл 2 М раствора в дихлорметане, 1,05 ммоль) и оставляют перемешиваться на 15 мин при комнатной температуре с последующим добавлением TEA (0,550 мл, 3,9 ммоль) и N-гидроксисукцинимида (0,140 г, 1,22 ммоль). Реакционную смесь дополнительно перемешивают еще 30 мин, затем обрабатывают водой (10 мл), насыщенным водным NaHCO3 (10 мл), и потом экстрагируют DCM (230 мл). Объединенные органические слои сушат (Na2SO4), фильтруют, концентрируют досуха и повторно растворяют в безводном ТГФ (8 мл) иTEA (0,550 мл, 3,9 ммоль), чтобы использовать в качестве исходного раствора для приведенной ниже стадии 2. Стадия 2. Хлористо-водородную соль 3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилазетидин-3-ил)метил)имино)эритромицина А по примеру получения 2 а (0,050 г, 0,073 ммоль) обрабатывают непосредственно с помощью исходного раствора, полученного на вышеуказанной стадии 1 (2 мл),и дают взаимодействовать в течение 15 мин при комнатной температуре, после чего обрабатывают водой(15 мл), насыщенным водным NaHCO3 (10 мл) и потом экстрагируют DCM (330 мл). Объединенные органические слои сушат (Na2SO4) и очищают (SGC при использовании в качестве элюента смеси(ESI+) для m/z 420 (M/2+Н)+. 1 Н ЯМР (CD3OD)3,94 (ушир.д, 1 Н), 8,37 (ушир.т, 1 Н), 8,02 (ушир.д, 1 Н),7,76 (ушир.д, 1 Н), 7,64 (т, 1 Н), 7,56 (м, 1 Н). Пример получения 33 (пример 10.14). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонил-1-(пиразоло[1,5-а]пиридин-2-карбонил)-(R)-пирролидин-2-ил)метил)имино)эритромицин А. Стадия 1. Пиразоло[1,5-а]пиридин-2-карбоновую кислоту (0,228 г, 1,41 ммоль), EDC (0,455 г, 2,38 ммоль),НОВТ (0,328 г, 2,38 ммоль) и трифторацетатную соль 2'-ацетил-3-дезкладинозил-11,12-дидеокси-6-Oметил-3-оксо-12,11-(оксикарбонил-S)-пирролидин-2-ил)метил)имино)эритромицина А по примеру получения 6 а (0,80 г) смешивают в безводном ДМФА (7 мл) при комнатной температуре в течение ночи,затем нагревают (45) 2 дня. Реакционную смесь обрабатывают насыщенным водным NaHCO3, водой и экстрагируют многократно DCM. Объединенные органические слои сушат (Na2SO4) и концентрируют в вакууме досуха. Стадия 2. Сырой продукт со стадии 1 повторно растворяют в МеОН и нагревают (40 С) в течение 3 ч для удаления 2'-ацетилгруппы и после очистки методом ОФ-ВЭЖХ получают указанное в заголовке соединение. Пример получения 34 (пример 12.11). 3-Дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11(оксикарбонил-1-(хинолин-5-карбонил)-(S)-пирролидин-2-ил)метил)имино)эритромицин А. Стадия 1. Хинолин-5-карбоновую кислоту (0,04 г, 0,23 ммоль) помещают в безводный MeCN (1,5 мл) и обрабатывают TEA (0,078 мл, 0,56 ммоль) с последующей обработкой О-(N-сукцинимидил)-N,N,N',N'-тетраметилуронийтетрафторборатом (0,056 г, 0,185 ммоль) и оставляют смесь перемешиваться в течение 3 ч. Стадия 2. Трифторацетную соль 3-дезкладинозил-11,12-дидеокси-6-O-метил-3-оксо-12,11-(оксикарбонилR)-пирролидин-2-ил)метил)имино)эритромицина А по примеру получения 6b (0,075 г, 0,081 ммоль) в безводном MeCN добавляют к смеси со стадии 1 и полученную смесь перемешивают в течение ночи.
МПК / Метки
МПК: A61K 31/7048, A61P 31/04, C07H 17/08
Метки: макролиды
Код ссылки
<a href="https://eas.patents.su/30-11281-makrolidy.html" rel="bookmark" title="База патентов Евразийского Союза">Макролиды</a>
Предыдущий патент: Пиперазиновые производные алкилоксиндолов
Следующий патент: Бактериальные упаковывающие штаммы, используемые для генерирования и продуцирования рекомбинантных нуклеокапсидов с двухцепочечной рнк и их применение
Случайный патент: Комплексная добавка для бетонов и строительных растворов