Макролиды
Номер патента: 7433
Опубликовано: 27.10.2006
Авторы: Шёнфельд Вольфганг, Мутак Степан, Тибаско Джессика, Стимак Владо, Чирако Мануэла, Павловик Дразен, Марусик-Истук Зорика, Лазаревски Горяна, Бьонди Стефано, Бердик Андреа, Квалья Анна, Алиходзик Сулейман, Дьерек Марко, Марсик Натаса, Думик Мильенко, Дамиани Фредерика, Хутинек Антун, Лочиуро Серджио, Андреотти Даниэле, Пайо Альфредо, Бьентинези Илария, Эракович Весна
Формула / Реферат
1. Соединение формулы (I)
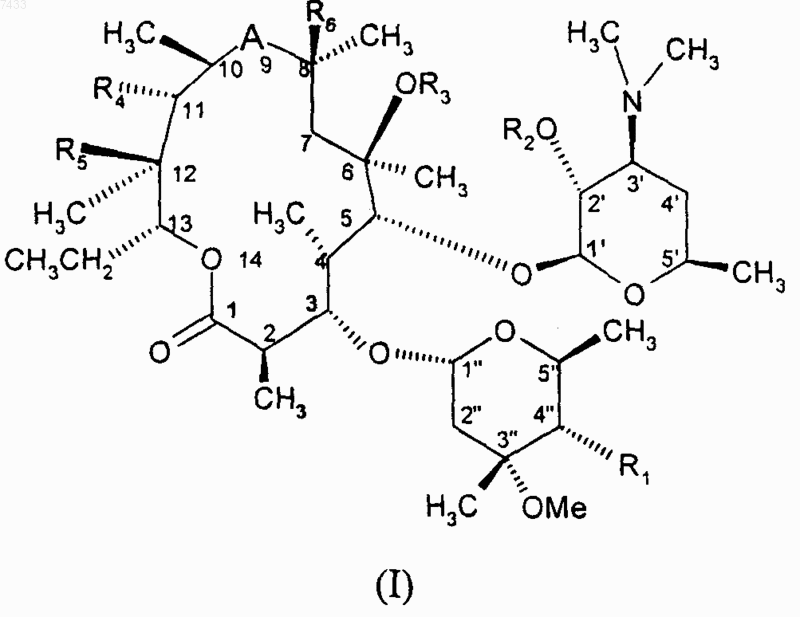
где А обозначает бивалентный радикал, выбранный из -С(О)-, -C(O)NH-, -NHC(O)-, -N(CH3)-CH2-, -CH2-N(CH3)- или -C(NOCH2OCH2CH2OCH3)-;
R1 представляет собой OC(O)(CH2)nXR7;
R2 представляет собой водород или группу, защищающую гидроксил;
R3 представляет собой водород, С1-4алкил или C3-6алкенил, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом;
R4 представляет собой гидрокси или C3-6алкенилокси, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом;
R5 представляет собой гидрокси или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры:
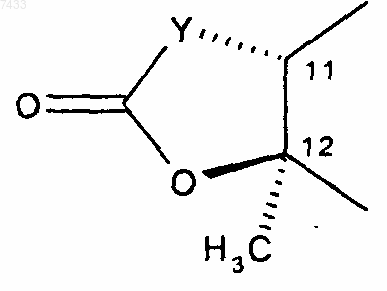
где Y представляет собой бивалентный радикал, выбранный из -СН2-, -CH(CN)-, -О-, -N(R8)- и -CH(SR8)-;
R6 представляет собой водород или фтор;
R7 представляет собой гетероциклическую группу следующей структуры:

или
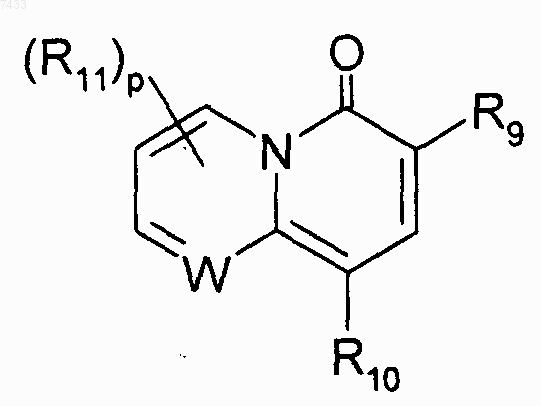
R8 представляет собой водород или С1-4алкил, замещенный группой, выбранной из
возможно замещенного фенила,
возможно замещенного 5- или 6-членного гетероарила,
возможно замещенного 9-10-членного конденсированного бициклического гетероарила;
R9 представляет собой водород, C(O)OR12, C(O)NHR12 или C(O)CH2NO2;
R10 представляет собой водород, С1-4алкил, С3-7циклоалкил, возможно замещенный фенил или бензил;
R11 представляет собой галоген, С1-4алкил, С1-4тиоалкил, С1-4алкокси, NH2, NH(С1-4алкил) или N(C1-4алкил)2;
R12 представляет собой водород или С1-4алкил;
R13 представляет собой водород, С1-4алкил, С3-7циклоалкил, возможно замещенный фенил или бензил, ацетил или бензоил;
X представляет собой -U(CH2)mZ- или X представляет собой группу, выбранную из
или
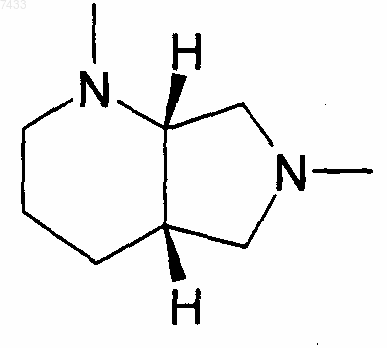
U и Z независимо представляют собой двухвалентный радикал, выбранный из
-N(R13)-, -О-, -S(O)q-, -N(R13)C(O)-, -C(O)N(R13)-, -N[C(O)R13]-,
W представляет собой атом углерода или азота;
n представляет собой целое число от 1 до 5;
m представляет собой целое число от 2 до 8;
р представляет собой 0, 1 или 2;
q представляет собой 0, 1 или 2;
где термин "возможно замещенный" относится к группе, которая замещена 1-3 группами, выбранными из галогена, С1-4алкила, С1-4алкокси, гидрокси, нитро, циано, амино, С1-4алкиламино или диС1-4алкиламино, фенила или 5- или 6-членного гетероарила,
и его фармацевтически приемлемые соли и сольваты.
2. Соединение по п.1, где X представляет собой NH(CH2)2-3NH.
3. Соединение по п.1 или 2, где R7 представляет собой гетероциклическую группу следующей структуры:
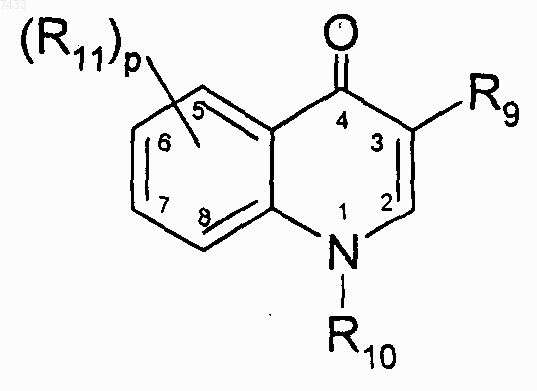
где R9, R10, R11 и р такие, как определено в п.1.
4. Соединение по п.1, как определено в любом из примеров 1-119, или его фармацевтически приемлемая соль или сольват.
5. Соединение, выбранное из следующих:
4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-6-O-метил-8а-аза-8а-гомоэритромицин А;
11,12-карбонат-4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин;
11,12-карбонат-4"-O-[3-[[2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин;
11,12-карбонат-4"-O-[3-[[2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин;
4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]азитромицин;
4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-11,12-дидезокси-11,12-(этиламинокарбонилокси)-6-О-метил-эритромицин А;
4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-6-O-метил-эритромицин А;
4"-O-[3-[[2-[(3-карбокси-1,4-дигидро-1-этил-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-6-O-метил-эритромицин А;
4"-O-[3-[[2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-6-O-метил-эритромицин А;
4"-O-[3-[[2-[(3-карбокси-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино]этил]амино]пропионил]-6-О-метил-эритромицин А;
(11S,11аR)-4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино] этил]амино]пропионил]-11-(карбоксицианометил)-11-дезокси-6-O-метил-эритромицин А;
(11S,11аR)-11-(карбоксицианометил)-4"-O-[3-[[2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-11-дезокси-6-(O-метил-эритромицин А;
4"-O-[3-[4-(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино] пропионил]рокситромицин;
4"-O-(3-(2-(3-карбокси-7-хлор-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино)этил)метил-амино)пропионил)-11,12-дидезокси-11,12-(этиламинокарбонилокси)-6-О-метил-эритромицин А;
4"-O-{3-[(2-[(3-карбоксиметил-7-хлор-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино]этил)амино]пропионил}-6-O-метил-эритромицин А;
11,12-(аминокарбонилокси)-4"-O-{3-[(2-[(3-карбокси-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино]этил)амино]пропионил}-11,12-дидезокси-6-O-метил-эритромицин А;
4"-O-[3-[[2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]метиламино]пропионил]азитромицин;
11,12-карбонат-4"-O-[3-[[2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]метиламино]пропионил]-11,12-дидезоксиазитромицин;
4"-O-(3-{[2-(7-хлор-1-циклопропил-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-6-иламино)этил]амино}пропионил)азитромицин;
4"-O-(3-{[2-(7-хлор-1-циклопропил-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-6-иламино)этил]метиламино}пропионил)азитромицин;
4"-O-{3-[(2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил)метиламино]пропионил}азитромицин и
4"-O-[3-[[2-[(3-карбокси-1-этил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-6-О-метил-эритромицин А.
6. Способ получения соединения по п.1, при котором приводят во взаимодействие соединение формулы (II)
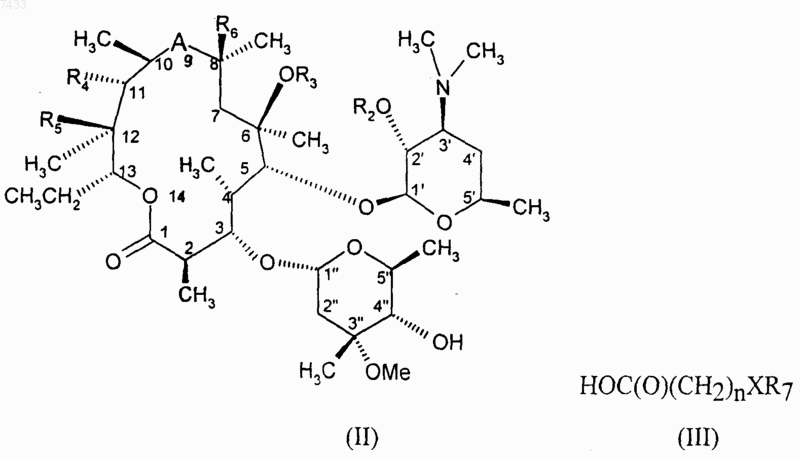
с подходящим активированным производным кислоты (III), где n представляет собой целое число от 1 до 5, X и R7 имеют значения, определенные в п.1, с получением соединения формулы (I), где n представляет собой целое число от 1 до 5, и после этого, если требуется, подвергают полученное соединение одной или более чем одной из следующих операций:
i) удаляют защитную группу R2 и
ii) превращают полученное соединение формулы (I) в его фармацевтически приемлемую соль и сольват.
7. Способ получения соединения по п.1, при котором приводят во взаимодействие соединение формулы (VII)

с соединением формулы XR7 (IV), где R7 и X имеют значения, определенные в п.1, где U представляет собой группу, выбранную из -N(R13)-, -О- и -S-, и L представляет собой подходящую уходящую группу, с получением соединения формулы (I), где n представляет собой число от 1 до 5 и U представляет собой группу, выбранную из -N(R13)-, -О- и -S-, и после этого, если требуется, подвергают полученное соединение одной или более чем одной из следующих операций:
i) удаляют защитную группу R2 и
ii) превращают полученное соединение формулы (I) в его фармацевтически приемлемую соль и сольват.
8. Способ получения соединения по п.1, при котором приводят во взаимодействие соединение формулы (IХ) с соединением формулы XR7 (IV)
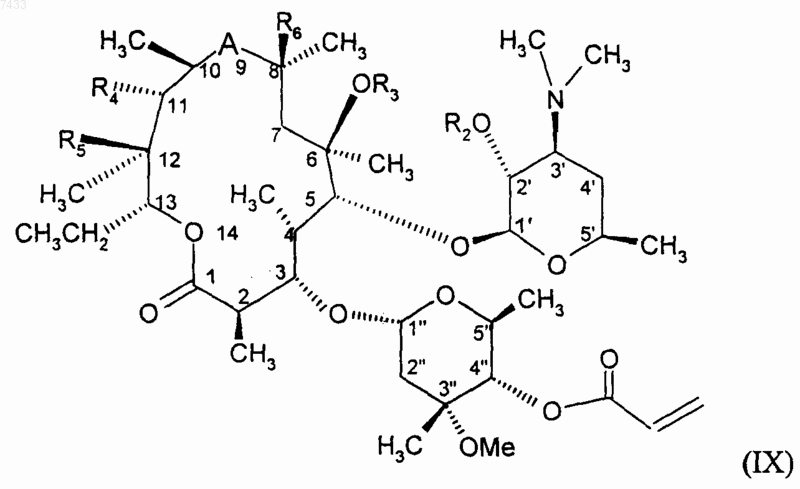
где R7 и X имеют значения, определенные в п.1, где U представляет собой группу, выбранную из -N(R13)-, -О- и -S-, с получением соединения формулы (I), где n представляет собой 2 и U представляет собой группу, выбранную из -N(R13)-, -О- и -S-, и после этого, если требуется, подвергают полученное соединение одной или более чем одной из следующих операций:
i) удаляют защитную группу R2 и
ii) превращают полученное соединение формулы (I) в его фармацевтически приемлемую соль и сольват.
9. Применение соединения по любому из пп.1-5 в терапии.
10. Применение соединения по любому из пп.1-5 в приготовлении лекарства для применения в терапии системных или местных бактериальных инфекций организма человека или животного.
11. Применение соединения по любому из пп.1-5 для применения в лечении или профилактике системных или местных бактериальных инфекций организма человека или животного.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-5 в смеси с одним или более чем одним фармацевтически приемлемым носителем или эксципиентом.
13. Способ лечения организма человека или животного, не являющегося человеком, для борьбы с бактериальной инфекцией, при котором назначают эффективное количество соединения по любому из пп.1-5.
Текст
007433 Настоящее изобретение относится к новым полусинтетическим макролидам, обладающим антибактериальной активностью. Конкретнее, это изобретение относится к 14- или 15-членным макролидам, замещенным в 4" положении, к способам их получения, к содержащим их композициям и к их применению в медицине.EP 0508699 описывает ряд макролидных соединений, которые представляют собой производные эритромицина А, и о которых сообщается, что они обладают антибактериальной активностью.EP 0895999 описывает ряд макролидных производных, о которых сообщается, что они обладают антибактериальной активностью. Таким образом, согласно настоящему изобретению предложены соединения общей формулы (I)R2 представляет собой водород или группу, защищающую гидроксил;R4 представляет собой гидрокси или C3-6 алкенилокси, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом;R5 представляет собой гидрокси, или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: где Y представляет собой бивалентный радикал, выбранный из -СН 2-, -CH(CN)-, -О-, -N(R8)- иR6 представляет собой водород или фтор;R7 представляет собой гетероциклическую группу следующей структуры:R8 представляет собой водород или С 1-4 алкил, замещенный группой, выбранной из возможно замещенного фенила,возможно замещенного 5- или 6-членного гетероарила,возможно замещенного 9- или 10-членного конденсированного бициклического гетероарила;R10 представляет собой водород, С 1-4 алкил, С 3-7 циклоалкил, возможно замещенный фенил или бенR12 представляет собой водород или C1-4 алкил;R13 представляет собой водород, С 1-4 алкил, С 3-7 циклоалкил, возможно замещенный фенил или бензил, ацетил или бензоил;U и Z независимо представляют собой двухвалентный радикал, выбранный из -N(R13)-, -O-, -S(O)q-,-N(R13)C(O), -C(O)N(R13)-, -N[C(O)R13]-,W представляет собой атом углерода или азота;n представляет собой 0 или целое число от 1 до 5;m представляет собой целое число от 2 до 8; р представляет собой 0, 1 или 2;q представляет собой 0, 1 или 2; и их фармацевтически приемлемые соли и сольваты. Подходящие фармацевтически приемлемые соли соединений общей формулы (I) включают в себя соли присоединения кислот, образованные с фармацевтически приемлемыми органическими или неорганическими кислотами, например гидрохлориды, гидробромиды, сульфаты, алкил- или арилсульфонаты(например метансульфонаты или n-толуолсульфонаты), фосфаты, ацетаты, цитраты, сукцинаты, тартраты, фумараты и малеаты. Сольваты могут, например, быть гидратами. Ссылки здесь на соединение по изобретению подразумевают как соединения формулы (I), так и их фармацевтически приемлемые соли присоединения кислот, а также фармацевтически приемлемые сольваты. Соединения формулы (I) и их соли могут образовывать сольваты (например, гидраты), и изобретение охватывает все такие сольваты. В общей формуле (I), как она нарисована, сплошная клиновидная связь указывает, что эта связь выступает над плоскостью бумаги. Связь, нарисованная штрихом, указывает, что эта связь уходит за плоскость бумаги. Соединения, в которых R2 представляет собой группу, защищающую гидроксил, вообще говоря являются промежуточными соединениями для получения других соединений формулы (I). Когда группа OR2 является защищенной гидроксильной группой, удобно, чтобы это был эфир или ацилоксигруппа. В качестве примеров особенно подходящих эфирных групп можно указать такие группы, в которых R2 является триалкилсилилом (например, триметилсилилом). Когда группа OR2 представляет собой ацилоксигруппу, тогда примерами подходящих групп R2 могут служить ацетил или бензоил. Когда R7 является гетероциклической группой следующей структуры: где W обозначает углерод или азот,указанный гетероцикл соединен в 7 или 6 положении с Z группой, определенной выше, или с одним из атомов азота, содержащихся в следующих структурах: Когда R7 является гетероциклической группой следующей структуры: указанный гетероцикл соединен в 8 или 7 положении с Z группой, определенной выше, или с одним из атомов азота, содержащихся в следующих структурах: Когда R7 является гетероциклической группой следующей структуры: указанный гетероцикл соединен в 2 или 3 положении с Z группой, определенной выше, или с одним из атомов азота, содержащихся в следующих структурах: Термин С 1-4 алкил, как он использован здесь по отношению к группе или части группы, относится к неразветвленной или разветвленной алкильной группе, содержащей от 1 до 4 атомов углерода; примерами таких групп являются метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил. Термин С 2-6 алкенильная группа, как он использован здесь по отношению к группе или части группы, относится к неразветвленной или разветвленной алкенильной группе, содержащей от 2 до 6 атомов углерода; примерами таких групп являются 2-пропенил, 1-пропенил, изопропенил, 2-бутенил, 2 пентенил, 2-гексенил и подобные. Нужно принять во внимание, что в группах формы -O-С 2-6 алкенил,двойная связь предпочтительно не является смежной с кислородом. Термин С 3-7 циклоалкильная группа обозначает неароматический моноциклический углеводородный цикл из 3-7 атомов углерода, например, такой как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Термин 5- или 6-членный гетероарил, как он использован здесь по отношению к группе или части группы, относится к фуранилу, тиофенилу, имидазолилу, оксазолилу, тиазолилу, пиразолилу, пиридилу,пиридинию, пиридазинилу или пиримидинилу. Термин галоген относится к атому фтора, хлора, брома или иода. Термин С 1-4 алкоксигруппа может означать алкоксигруппу с неразветвленной или разветвленной цепью, например, метокси, этокси, пропокси, проп-2-окси, бутокси, бут-2-окси или метилпроп-2-окси. Термин 9-10-членный конденсированный бициклический гетероарил, как он использован здесь по отношению к группе или части группы, относится к хинолинилу, изохинолинилу, 1,2,3,4 тетрагидроизохинолинилу, бензофуранилу, бензимидазолилу, бензотиенилу, бензоксазолилу, 1,3 бензодиоксазолилу, индолилу, бензотиазолилу, фурилпиридину, оксазолопиридилу или бензотиофенилу. Термины возможно замещенный фенил, возможно замещенный 5- или 6-членный гетероарил или возможно замещенный 9-10-членный конденсированный бициклический гетероарил относится к группе,которая замещена 1-3 группами, выбранными из галогена, С 1-4 алкила, С 1-4 алкокси, гидрокси, нитро, циано, амино, С 1-4 алкиламино или диС 1-4 алкиламино, фенила или 5- или 6-членного гетероарила. Предпочтительными соединениями формулы (I) являются те, в которых R2 обозначает водород. В одном воплощении R3 обозначает водород или С 1-4 алкил, например метил, этил или пропил. Когда А обозначает -С(О)-, R6 предпочтительно является водородом и R3 предпочтительно является С 1-4 алкилом (например, метилом), или R6 предпочтительно является фтором и R3 предпочтительно является водородом. Когда А обозначает -С(О)-, R4 и R5 предпочтительно являются гидрокси или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: где Y предпочтительно является -N(R8)- и R8 является водородом или С 1-4 алкилом, таким как метил или этил. Когда А обозначает-C(NOCH2OCH2CH2OCH3)-, и R4 или R5 являются гидрокси или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры:-C(NOCH2OCH2CH2OCH3)-, и R4 и R5 , взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: где Y является бивалентным радикалом, выбранным из -СН 2-, -CH(CN)-, -N(R8)-,R6 предпочтительно является водородом и R3 предпочтительно является С 1-4 алкилом (например,метилом) или 2-пропенилом. Когда n обозначает 0, U предпочтительно выбран из -N(R13)-, -О- и -S-. В соединениях формулы (I) n предпочтительно является 1 или 2. Внутри этого класса соединения, в которых n равно 2, являются особенно предпочтительными. Предпочтительный класс соединений формулы (I) составляют те, в которых X обозначает внутри этого класса соединения, в которых X представляет собой NH(CH2)2-3NH, являются особенно предпочтительными. Другой предпочтительный класс соединений формулы (I) составляют те, в которых X обозначаетN(R13)(CH2)2-3NH и R13 обозначает С 1-4 алкил, такой как метил или ацетил. В следующем предпочтительном классе соединений формулы (I) R7 представляет собой гетероцикл следующей формулы: Внутри этого класса соединений, те соединения, в которых р равно 0 или 1, R11 обозначает галоген(например, хлор или фтор) в положении 6 или 7, R9 обозначает карбокси, и R10 обозначает метил, этил или циклопропил, являются особенно предпочтительными. Особенно предпочтительный класс соединений по изобретению составляют те, в которых R2 обозначает водород, X обозначает NH(CH2)2-3NH, R7 обозначает гетероциклическую группу следующей формулы: где р обозначает 0 или 1, R11 обозначает галоген (например, хлор или фтор) в положении 6 или 7, R9 обозначает карбокси, и R10 обозначает этил или циклопропил. Другой предпочтительный класс соединений составляют те, в которых R9 обозначает C(O)OR12, иR12 обозначает С 1-4 алкил, в частности метил. Следующий предпочтительный класс соединений составляют те, в которых R11 обозначает С 1-4 алкокси, например, метокси в положении 8. Когда R3 обозначает С 3-6 алкенил, замещенный 9-10-членным конденсированным бициклическим гетероарилом, 9-10-членный конденсированный бициклический гетероарил предпочтительно представляет собой 2-хинолил или 3-хинолил, R4 и R5 предпочтительно являются гидрокси и R6 обозначает водород. Внутри этого класса соединений соединения, в которых R2 обозначает водород, X обозначаетNH(CH2)2-3NH, R7 обозначает гетероцикл следующей формулы: где р обозначает 1, R11 обозначает галоген (например, хлор или фтор) в положении 6 или 7, R9 обозначает карбокси и R10 обозначает этил или циклопропил, являются особенно предпочтительными. В одном воплощении Y обозначает бивалентный радикал, выбранный из -СН 2-, -CH(CN)-, -О- и-N(R8)-. Особенно предпочтительными соединениями по изобретению являются 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино]этил] амино]пропионил]-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино]этил] амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(7-хлор-1-циклопропил-1,4-дигидро-3-метоксикарбонил-4-оксо-6-хинолинил)амино] этил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-1,4-дигидро-1-этил-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-6O-метил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино] пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-этил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-пропил-8 а-аза-8 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метил-9 а-аза-9 а-гомоэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-11,12-дидезокси-6-O-метил-11,12-(метиламинокарбонилокси)-эритромицин А; 11,12-(аминокарбонилокси)-4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-4-оксо-1,4-дигидро-6 хинолинил)амино]этил]амино]пропионил]-11,12-дидезокси-6-O-метилэритромицин А; 11,12-(аминокарбонилокси)-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7 хинолинил)амино]этил]амино]пропионил]-11,12-дидезокси-6-O-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-хинолинил)амино]этил] амино]пропионил]-6-О-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино]этил]амино] пропионил]-6-О-метилэритромицин А;(11S,11 аR)-4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-11-(карбоксицианометил)-11-дезокси-6-O-метилэритромицин А; 4"-O-[3-4-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]рокситромицин; 4"-O-[3-4-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино]этил] амино]пропионил]рокситромицин; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-3-хинолинил)амино]этил] амино]пропионил]азитромицин; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил) амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-3-хинолинил)амино]этил] амино]пропионил]-6-O-метилазитромицин; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил) амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин. Дальнейшими предпочтительными соединениями по изобретению являются 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил) амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин; 11,12-карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино] этил]амино]пропионил]-11,12-дидезоксиазитромицин; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино] этил] амино]пропионил] -азитромицин; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-11,12-дидезокси-11,12-(этиламинокарбонилокси)-6-О-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-1,4-дигидро-1-этил-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-6O-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино] пропионил]-6-O-метилэритромицин А; 4"-O-[3-2-[(3-карбокси-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил)амино]этил]амино] пропионил]-6-O-метилэритромицин А;-6 007433 11,12-карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино] этил]метиламино]пропионил]-11,12-дидезоксиазитромицин; 4"-O-(3-[2-(7-хлор-1-циклопропил-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-6-иламино) этил]аминопропионил)азитромицин; 4"-O-(3-[2-(7-хлор-1-циклопропил-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-6-иламино) этил]метиламинопропионил)азитромицин; 4"-O-3-[(2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил)метиламино] пропионилазитромицин;и 4"-O-[3-2-[(3-карбокси-1-этил-1,4-дигидро-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-6O-метилэритромицин А. Соединения по изобретению также демонстрируют широкий спектр антибактериальной активности против широкого ряда клинических патогенных микроорганизмов. Например, при использовании стандартного теста с серийными разведениями микротитрационного бульона было обнаружено, что соединения по изобретению обладают полезными уровнями активности против широкого ряда патогенных микроорганизмов, включая штаммы Staphylococcus aureus, Streptopococcus pneumoniae, Moraxella catarrhalis,Streptococcus pyogenes, Haemophilus influenzae, Chlamydia pneumoniae, Mycoplasma pneumoniae и Legionella pneumophila. Соединения по изобретению, таким образом, могут быть использованы для лечения множества заболеваний, вызванных патогенными бактериями у человека и животных. Соединения по изобретению могут быть также активными против устойчивых штаммов, например штаммов, устойчивых к эритромицину. В частности, соединения по изобретению могут быть активными против устойчивых к эритромицину штаммов Streptococcus pneumoniae и Streptococcus pyogenes. Таким образом, согласно другому аспекту настоящего изобретения предложено соединение формулы (I) или его физиологически приемлемая соль для применения в терапии или профилактике системных или местных бактериальных инфекций у человека или животного. Согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или его физиологически приемлемой соли для производства терапевтического средства для лечения или профилактики системных или местных бактериальных инфекций организма человека или животного. Согласно еще одному аспекту настоящего изобретения, предложен способ лечения организма человека или животного, не являющегося человеком, для борьбы с бактериальными инфекциями, при котором в организм вводят эффективное количество соединения формулы (I) или его физиологически приемлемой соли. Хотя для применения в терапии возможно вводить соединение по изобретению в виде химического вещества как такового, предпочтительно представлять активный ингредиент в виде фармацевтического препарата. Соединения по изобретению могут быть приготовлены для введения любым удобным путем для применения в медицине или ветеринарии, и изобретение, таким образом, включает в свой объем фармацевтические композиции, содержащие соединение по изобретению, приспособленное для применения в медицине или ветеринарии. Такие композиции могут быть представлены для применения традиционным образом с помощью одного или более чем одного подходящего носителя или эксципиента. Композиции по изобретению включают в себя композиции в форме, специально созданной для парэнтерального, перорального, буккального, ректального, местного, имплантантного, офтальмологического, назального или генетоуретального применения. Соединения по изобретению могут быть приготовлены для применения в медицине или ветеринарии путем инъекции (например, внутривенной болюсной инъекции или инфузии, или внутримышечным,подкожным или интратекальным путем) и могут быть представлены в единичной дозовой форме, в ампулах, или в других контейнерах для единичной дозы, или в мультидозовых контейнерах с добавлением консерванта при необходимости. Композиции для инъекции могут быть в форме суспензий, растворов или эмульсий в масляных или водных носителях, и могут содержать вспомогательные средства, такие как суспендирующие, стабилизирующие, солюбилизирующие и/или диспергирующие агенты. В качестве альтернативы активный ингредиент может находиться в форме стерильного порошка для разбавления перед использованием подходящим носителем, например стерильной не содержащей пирогенов водой. Соединения по изобретению также могут быть представлены для применения у человека или животных в форме, подходящей для орального или буккального введения, например в форме растворов,гелей, сиропов, жидкостей или суспензий для полоскания рта или сухого порошка для разбавления перед использованием водой или другим подходящим носителем, возможно с корригентами и красителями. Также могут быть использованы твердые композиции, такие как таблетки, капсулы, леденцы, пастилки,пилюли, болюсы, порошки, пасты, гранулы, пульки или премикс-препараты. Твердые и жидкие композиции для орального использования могут быть приготовлены согласно методам, хорошо известным из уровня техники. Такие композиции также могут содержать один или более чем один фармацевтически приемлемый носитель и эксципиент, который может быть в твердой или жидкой форме.-7 007433 Соединения по изобретению также могут водиться перорально в ветеринарии в форме больших жидких доз лекарства, таких как раствор, суспензия или дисперсия активного ингредиента с фармацевтически приемлемым носителем или эксципиентом. Соединения по изобретению могут также, например, быть приготовлены в виде суппозиториев, например, содержащих традиционные для применения в медицине или ветеринарии основания для суппозиториев, или в виде пессариев, например, содержащих традиционные основания для пессариев. Соединения по изобретению могут быть приготовлены для местного введения для применения в медицине и ветеринарии, в форме мазей, кремов, гелей, лосьонов, шампуней, порошков (включая распыляемые порошки), пессариев, тампонов, распыляемых растворов, пропиток, аэрозолей, капель (например,глазных капель или капель в нос) или орошений. Распыляемые аэрозоли удобно доставлять с помощью упаковок, находящихся под повышенным давлением, с использованием подходящего пропелланта, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. Для местного введения путем ингаляции соединения по изобретению для применения в медицине или ветеринарии можно доставлять с помощью небулайзера. Фармацевтические композиции для местного введения также могут содержать другие активные ингредиенты, такие как кортикостероиды или противогрибковые средства, если считается целесообразным. Композиции могут содержать от 0,01 до 99% активного материала. Для местного введения, например, композиция должна, вообще говоря, содержать от 0,01 до 10%, более предпочтительно 0,01-1% активного материала. Для системного введения суточная доза, применяемая для лечения взрослого человека, должна находиться в пределах от 2 до 100 мг/кг веса тела, предпочтительно 5-60 мг/кг веса тела, и ее можно вводить в 1-4 суточных дозах, например, в зависимости от пути введения и состояния пациента. Когда композиция содержит единицы дозирования, каждая единица должна предпочтительно содержать от 200 мг до 1 г активного ингредиента. Продолжительность лечения должна определяться скорее степенью ответа, а не условным количеством дней. Соединения общей формулы (I) и их соли могут быть получены по общим методикам, приведенным далее. В последующем описании группы R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, A, X, Y, U, Z,W, n, m, р и q имеют значения, определенные для соединений формулы (1), если не указано иное. Группы XR7 и ZR7 обозначают XR7 и ZR7 , как они определены для формулы (I), или группы, которые можно превратить в XR7 и ZR7 соответственно. Превращение некоторой группы в группу XR7 или ZR7 обычно имеет место, если при проведении реакций, описанных ниже, необходимо использовать защитную группу. Всеобъемлющее описание методик, с помощью которых такие группы могут быть защищены, а также способов обработки полученных защищенных производных приведено, например в T.W. Greene andP.G.M Wuts in Protective Groups in Organic Synthesis 2nd ed., John WileySon, Inc 1991. Соединения формулы (I), где n - целое число от 1 до 5, могут быть получены взаимодействием 4" гидрокси формулы (II) с подходящим активированным производным карбоновой кислоты (III), с последующим при необходимости удалением группы R2, защищающей гидроксил. Подходящие активированные производные карбоксильной группы включают в себя соответствующие ацилгалогенид, смешанный ангидрид или активированный эфир, такой как тиоэфир. Реакцию предпочтительно осуществляют в подходящем апротонном растворителе, таком как галогенуглеводород (например, дихлорметан) или N,N-диметилформамид, возможно в присутствии третичного органического основания, такого как диметиламинопиридин или триэтиламин, или в присутствии неорганического основания (например, гидрида натрия) и при температуре в пределах интервала от 0 до 120 С. Соединения формулы (I), где n равно 0 и U - это группа, выбранная из -N(R13)-, -О- и -S(O)q- , где q равно 0, могут быть получены путем взаимодействия соединений формулы (II), в которой 4" гидрокси подходящим образом активирована, с соединением формулы XR7 (IV), с последующим при необходимости удалением группы R2, защищающей гидроксил. Подходящие активированные производные 4" гидроксигруппы включают в себя, например, карбонил имидазол. Реакцию предпочтительно осуществляют в-8 007433 подходящем апротонном растворителе, таком как галогенуглеводород (например, дихлорметан) или N,Nдиметилформамид, возможно в присутствии третичного основания, такого как диметиламинопиридин или триэтиламин, и при температуре в пределах интервала от 0 до 120 С. Соединения формулы (I), где n равно 0 и U обозначает -N(R13)C(O)-, могут быть получены взаимодействием соединений формулы (V) с соединением формулы HOC(O)C(O)(CH2)mZR7 (VI), с последующим при необходимости удалением группы R2, защищающей гидроксил. Реакцию предпочтительно осуществляют в подходящем апротонном растворителе, таком как галогенуглеводород (например, дихлорметан) или N,N-диметилформамид,возможно в присутствии третичного основания, такого как диметиламинопиридин или триэтиламин, и при температуре в пределах интервала от 0 до 120 С. Соединения формулы (V) могут быть получены путем обработки соединений формулы (II), в которой 4" гидрокси подходящим образом активирована, с амином NR13 (VIIa). Подходящие активированные производные 4" гидроксигруппы включают в себя, например, карбонилимидазол. Соединения формулы (I), где n равно 0 и U обозначает -C(O)N(R13)- могут быть получены взаимодействием 4" гидрокси формулы (II) с подходящим активированным производным карбоновой кислотыHOC(O)N(R13)(CH2)mZR7 (VIIb), с последующим при необходимости удалением группы R2, защищающей гидроксил. В предпочтительном воплощении изобретения соединения формулы (I), где n равно 1-5 и U обозначает группу, выбранную из -N(R13)-, -O-, -S-, могут быть получены путем взаимодействия соединений формулы (VII) где n обозначает целое число от 1 до 5 и L обозначает подходящую уходящую группу, с XR7 (IV), где U обозначает группу, выбранную из -N(R13)-, -O-, -S-. Реакцию предпочтительно осуществляют в растворителе, таком как галогенуглеводород (например, дихлорметан), эфир (например, тетрагидрофуран, диметоксиэтан), ацетонитрил или этилацетат и подобные, диметилсульфоксид, N,N-димeтилфopмaмид, 1 метил-пирролидон, и в присутствии основания с последующим, при желании, удалением группы R2, защищающей гидроксил. Примерами оснований, которые могут быть использованы, являются органическое основание, такое как диизопропилэтиламин, триэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен, или неорганическое основание, такое как гидроксид калия, гидроксид цезия, гидроксид тетраалкиламмония,гидрид натрия, гидрид калия и подобные. Подходящие уходящие группы для этой реакции включают галоген (например, хлор, бром или йод) или сульфонилоксигруппу (например, тозилокси или метансульфонилокси). Соединения формулы (VII) могут быть получены путем взаимодействия соединения формулы (II),где R2 - это группа, защищающая гидроксил, с подходящим активированным производным карбоновой кислоты HOC(O)(CH2)nL (VIII), где L обозначает подходящую уходящую группу, как определено выше. Подходящие активированные производные карбоксильной группы являются такими же как те, которые-9 007433 определены выше для карбоновой кислоты (III). Реакцию осуществляют, используя условия, описанные выше для реакции соединения формулы (II) с карбоновой кислотой (III). В дальнейшем воплощении изобретения соединения формулы (I), где n равно 2 и U обозначает группу, выбранную из -N(R13)-, -О- и -S-, могут быть получены реакцией Михаэлиса соединения формулы (IX), где R2 - это группа, защищающая гидроксил, с соединением формулы XR7 (IV). Реакцию подходящим образом осуществляют в растворителе, таком как диметилсульфоксид, N,N-диметилформамид, 1-метилпирролидон, галогенуглеводород (например,дихлорметан), эфир (например, тетрагидрофуран, диметоксиэтан), ацетонитрил или этилацетат или спирт (например, метанол, изопропанол) и подобные, и в присутствии основания с последующим, при желании, удалением группы R2, защищающей гидроксил. Соединения формулы (I) могут быть превращены в другие соединения формулы (I). Таким образом,соединения формулы (I), где U обозначает -S(O)q и q равно 1 или 2, могут быть получены путем окисления соответствующего соединения формулы (I), где q равно 0. Окисление предпочтительно осуществляют, используя перкислоты, например пероксибензойную кислоту, с последующей обработкой фосфином,таким как трифенилфосфин. Реакцию подходящим образом осуществляют в органическом растворителе,таком как метиленхлорид. Соединения формулы (II), где А обозначает -C(O)NH- или -NHC(O)-, R4 или R5 являются гидрокси,R3 обозначает водород, и R6 обозначает водород, являются известными соединениями или могут быть получены способами, аналогичными известным из уровня техники. Так они могут быть получены согласно способам, описанным в EP 507595 и EP 503932. Соединения формулы (II), где А обозначает -C(O)NH- или -NHC(O)-, R4 или R5 являются гидрокси,и R3 обозначает С 1-4 алкил или C3-6 алкенил, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом, и R6 обозначает водород, являются известными соединениями или могут быть получены способами, аналогичными известным из уровня техники. Так они могут быть получены согласно способам, описанным в WO 9951616 и WO 0063223. Соединения формулы (II), где А обозначает -C(O)NH- или -NHC(O)-, -N(CH3)-СН 2-, -CH2-N(CH3)-,R4 и R5 , взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры:R3 обозначает С 1-4 алкил или C3-6 алкенил, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом, и R6 обозначает водород, являются известными соединениями или могут быть получены способами, аналогичными известным из уровня техники. Так они могут быть получены согласно способам, описанным в USP6262030. Соединения формулы (II), где А обозначает -С(О)-, R4 или R5 являются гидрокси, или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: где Y обозначает бивалентный радикал, выбранный из -О- и -N(R8)-, и R3 обозначает С 1-4 алкил или С 3-6 алкенил, возможно замещенный 9-10-членным конденсированным бициклическим гетероарилом, являются известными соединениями или могут быть получены способами, аналогичными известным из- 10007433 уровня техники. Так они могут быть получены согласно способам, описанным в EP 307177, EP 248279,WO 0078773, WO 9742204. Соединения формулы (II), где А обозначает -N(CH3)-CH2-, -CH2-N(CH3)-, R4 или R5 являются гидрокси, или R4 и R5 взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: и R6 обозначает водород, являются известными соединениями или могут быть получены способами, аналогичными известным из уровня техники. Так они могут быть получены согласно способам, описанным в EP 508699 и J.Chem. Res.Synop (1988, cc. 152-153), USP 6262030. Соединения формулы (II), где А обозначает -С(NOСН 2OСН 2 СН 2OСН 3)-, R4 или R5 являются гидрокси, или R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: и R6 обозначает водород, являются известными соединениями или могут быть получены способами, аналогичными известным из уровня техники. Так они могут быть получены согласно способам, описанным в EP 284203. Соединения формулы (II), где А обозначает С(О)-, R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры:R6 обозначает водород, и R3 обозначает С 1-4 алкил, могут быть получены декарбоксилированием соединения формулы (X), где R14 обозначает группу, защищающую гидроксил, с последующим, при необходимости, удалением защитной группы R2 или R14. Декарбоксилирование можно осуществлять в присутствии литиевой соли, такой как хлорид лития,предпочтительно в органическом растворителе, таком как диметилсульфоксид. Соединения формулы (II), где А обозначает С(О)-, R4 и R5, взятые вместе с промежуточными атомами, образуют циклическую группу следующей структуры: и R3 обозначает С 1-4 алкил, могут быть получены циклизацией хлорпроизводного (XI) с цианидом калия, реакцию удобно осуществлять в присутствии растворителя, такого как N-N диметилформамид. Соединения формулы (X) могут быть получены реакцией соединения формулы (XII) в присутствии сильного основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен. Эту реакцию удобно осуществлять в органическом растворителе, таком как ацетонитрил, N,N-диметилформамид и подобные. Соединения формулы (XII) могут быть получены взаимодействием соединений формулы (XIII) с ацилхлоридом формулы СlСОСН 2 СООМе (XIV) в присутствии третичного основания, такого как пиридин, диметиламинопиридин или триэтиламин и при температуре в пределах интервала от 0 до 30 С. Соединения формулы (XIII) могут быть получены путем взаимодействия соединения формулы (II),где R14 обозначает группу, защищающую гидроксил, R4 и R5, взятые вместе с промежуточными атомами,образуют циклическую группу следующей структуры: с сильным основанием, таким как 1,8 диазабицикло[5.4.0]ундец-7-ен. Соединения формулы (XI) могут быть получены путем взаимодействия соединений формулы (XIII) с подходящим активированным производным кислоты HOCOCH2Cl (XV). Так, например, этерификация может быть осуществлена путем взаимодействия с ангидридом (СlСН 2 СО)2O (XVI) в подходящем апро- 12007433 тонном растворителе, таком как галогенуглеводород (например дихлорметан) или N,Nдиметилформамид и в присутствии третичного основания, такого как пиридин, диметиламинопиридин или триэтиламин и при температуре в пределах интервала от 0 до 120 С. Соединения формулы (III), где X обозначает -U(CH2)mN(R13)-, в которой U обозначает -N(R13)-, -Oили -S-, или X обозначает группу, выбранную из могут быть получены взаимодействием XR7 (IV), где X имеет значение, определенное выше, сR15OC(O)(CH2)nL (XV), где R15 обозначает группу, защищающую карбоксил, и L обозначает подходящую уходящую группу, с последующим удалением R15. Соединения формулы (IV), где X обозначает -U(CH2)mZ, в которой Z обозначает -N(R13)-, -О- или могут быть получены взаимодействием соединения формулы R7L (XVI), где L обозначает подходящую уходящую группу, такую как хлор, фтор или бром, с соединением формулы -U(CH2)mZ (XVII), в которойZ обозначает -N(R13)-, -О- или -S-, или с пиперазином, или с октагидро-1H-пирроло[3,4-b]пиридином. Подходящие реагенты для защиты гидроксигруппы описаны T.W. Greene and P.G.M Wuts в Protective Groups in Organic Synthesis 2nd ed., John WileySon, Inc 1991, которая включена сюда путем ссылки на нее. Примеры подходящих реагентов для защиты гидроксигруппы включают в себя уксусный ангидрид, бензойный ангидрид или триалкилсилилхлорид в апротонном растворителе. Примерами апротонных растворителей являются дихлорметан, N,N-диметилформамид, диметилсульфоксид, тетрагидрофуран и подобные. Подходящая группа R15, защищающая карбоксил, включает трет-бутилокси, аллил или бензилокси. Соли присоединения кислот соединений общей формулы (I) могут быть получены различными способами, известными специалистам в данной области техники. Например, водный раствор кислоты, такой как соляная кислота, может быть добавлен к водной суспензии соединения формулы (I), и полученная в результате смесь выпарена досуха (лиофилизирована) с получением соли присоединения кислоты в виде твердого вещества. В качестве альтернативы соединение формулы (I) может быть растворено в подходящем растворителе, например спирте, таком как изопропанол, и кислота может быть добавлена в том же растворителе или другом подходящем растворителе. Полученная соль присоединения кислоты может затем быть осаждена непосредственно или путем добавления менее полярного растворителя, такого как диизопропиловый эфир или гексан, и выделена фильтрацией. Для того чтобы настоящее изобретение было более понятно, с целью его иллюстрации приводятся следующие примеры. В приготовлениях и примерах, если не указано иное, спектры протонного магнитного резонанса (1 Н-ЯМР) были сняты на Bruker Avance DRX 300 и DRX 500 или Varian 500 МГц в растворах в хлороформе d-1. Химические сдвиги даны в м.д. со сдвигом внизcпектры углеродного магнитного резонанса (13C-NMR) были сняты на Bruker Avance DPX 75 и DRX 125 МГц в растворах в хлороформе d-1. Химические сдвиги даны в м.д. со сдвигом внизотносительно(Agilent Technologies), работающей на позитивной ионизации в электроспрее;LC/MS данные были получены с использованим HP 1100 LC системы (Agilent Technologies), снабженной Sedex Evaporative Light Scattering Detector model 75 (Sedere), соединенной с Platform LCZ MassSpectometer (Micromass), работающей на позитивной ионизации в электроспрее. Условия хроматографического анализа: колонка Waters XTerra MS C18 (4,630 мм, 2,5 мкм); скорость потока 0,8 мл/мин; подвижная фаза: водный раствор NH4OAc (10 мМ, рН 6,8) (А) и ацетонитрил (В);LC очистки осуществляли с Waters 600 полупрепаративной системой, снабженной бинарной насосной системой и детектором Jasco-UV. Условия хроматографического анализа: колонка Supelcosil(10 мМ, рН 6,8) (А) и ацетонитрил (В); колоночную хроматографию проводили на силикагеле 60 (сито 230-400 ASTM - Merck AG Darmstaadt, Germany). Мониторинг TLC осуществляли с использованием Merck 60 F254 в качестве TLC пластины; отмывки смолы осуществляли на Extract-clean Tube от Alltech; очистки сырого продукта осуществляли с SCX-картриджем от Varian. В тексте использованы следующие аббревиатуры: рассол для насыщенного водного раствора хлорида натрия, DBU для 1,8-диазабицикло[5.4.0]ундец-7-ена, DCE для 1,2-дихлорэтана, DCM для дихлорметана, NMP для 1-метил-2-пирролидинона, DIPEA для N,N-диизопропилэтиламина, DMAP для 4 диметиламинопиридина, DMF для N,N-диметилформамида, DMSO для диметилсульфоксида, EDC для 1(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида, Et2O для диэтилового эфира, EtOAc для этилацетата, HATU для O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата,МеОН для метанола, iPrOH для изопропанола; TEA для триэтиламина, АсОН для уксусной кислоты, THF для тетрагидрофурана, Ас 2 О для уксусного ангидрида, TFA для трифторуксусной кислоты, и петрол относится к петролейному эфиру с точкой кипения 40-60 С. Растворы были высушены над безводным сульфатом натрия или карбонатом калия. Промежуточное соединение 1. 6-[(2-Аминоэтил)амино]-1-бензил-1,4-дигидро-4-оксохинолин-3 карбоновая кислота. К раствору 1-бензил-6-хлор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (300 мг) в 1-метил 2-пирролидиноне (6 мл) добавляли этилендиамин (170 мг) в атмосфере аргона. Смесь нагревали при 120 С в течение 18 ч и затем при 145 С в течение 4 ч. Реакционную смесь охлаждали и выливали в воду(12 мл). Величину рН подводили уксусной кислотой до 7,0-7,5. Реакционную смесь экстрагировали DCM(530 мл). Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Необработанный продукт очищали на силикагелевой SPE-колонке (элюент: от DCM 100% до DCM/MeOH/NH4OH 85/13/2) с получением соединения, указанного в заголовке (80 мг). 13 С-ЯМР (75 МГц, DMSO-d6) : 176,1; 165,4; 149,0; 138,1; 134,2; 133,5; 131,9; 129,8; 129,5; 129,2; 127,1; 126,4; 118,9; 58,3; 42,8; 42,2. Промежуточное соединение 2. 7-[(2-Аминоэтил)амино]-1-бензил-1,4-дигидро-4-оксохинолин-3 карбоновая кислота. К раствору 7-хлор-1-бензил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (1,0 г) в 1-метил-2 пирролидиноне (10 мл) добавляли этилендиамин (0,95 г). Смесь нагревали при 130 С в течение 10 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН,фильтровали с получением соединения, указанного в заголовке (560 мг). 1 Н-ЯМР (300 МГц, DMSO-d6) : 8,95 (s, 1 Н); 8,05 (d, 1H); 7,36 (m, 5H); 6,94 (d, 1H); 6,83 (m, 1H); 6,56 (s, 1H); 5,68 (s, 4H); 3,09 (m, 2H). 13 С-ЯМР (75 МГц, DMSO-d6) : 176,3; 166,5; 153,6; 148,6; 142,3; 135,5; 128,7; 127,8; 126,8; 126,7; 114,5; 94,9; 56,3; 45,8. Промежуточное соединение 3. 7-[(2-Аминоэтил)амино]-1-этил-1,4-дигидро-4-оксохинолин-3 карбоновая кислота. К раствору 7-хлор-1-этил-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1,7 г) в 1-метил-2 пирролидиноне (20 мл) добавляли этилендиамин (2,1 г). Смесь нагревали при 130 С в течение 10 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН,фильтровали с получением соединения, указанного в заголовке (830 мг). MS; m/z (ES): 276 [МН]+. 1 Н ЯМР (500 МГц, DMSO-d6) : 8,80 (s, 1 Н), 8,03 (d, 1H), 7,17 (m, 1H), 6,95 (dd, 1H), 6,65 (s, 1H),4,46 (q, 2H), 3,28 (q, 2H), 2,84 (q, 2H), 1,40 (t, 3H). 13C ЯМР (125 МГц, DMSO-d6) : 176,1, 166,8, 153,7,147,8, 141,8, 126,9, 115,0, 106,5, 95,9, 48,5, 44,6,39,9, 14,2. Промежуточное соединение 4. 7-[(2-Аминоэтил)амино]-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота. К раствору 7-хлор-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (2,0 г) в 1 метил-2-пирролидиноне (20 мл) добавляли этилендиамин (2,3 г). Смесь нагревали при 130 С в течение 10 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН, фильтровали с получением соединения, указанного в заголовке (910 мг).N,N-диметилацетамиде (5 мл) и добавляли этилендиамин (223 мг). Реакционную смесь перемешивали в течение 10 ч при 100 С, затем оставляли на ночь при комнатной температуре и снова нагревали при 100 С в течение 7 ч. Добавляли воду (5 мл) и полученный осадок фильтровали, промывали водой (5 мл) и сушили с получением смеси, содержащей соединения, указанные в заголовке (120 мг).MS; m/z (ES): 310,2 [МН]+ (промежуточное соединение 5), 294,2 [МН]+ (промежуточное соединение 6). Промежуточное соединение 7 и промежуточное соединение 8. 6-[(2-Аминоэтил)амино]-7-хлор-1 циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты гидрохлорид (7) и 7-[(2-аминоэтил)амино]-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновой кислоты гидрохлорид (8). 7-Хлор-1 -циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновую кислоту (56,3 г) и этилендиамин (36 г) растворяли в N,N-диметилацетамиде (650 мл) при 100 С и перемешивали в течение 8,5 ч при 115 С. В реакционную смесь, охлажденную до комнатной температуры, добавляли воду (700 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали при 0-5 С и перемешивали в течение 1 ч. Полученный осадок фильтровали, промывали холодной водой, холоднымEtOH и сушили при 110 С при пониженном давлении в течение 1 ч. Необработанный продукт обработали HCl (6% водный раствор), нагревая в течение 1 ч в присутствии древесного угля. После фильтрации раствор охлаждали до 35-40 С и получали первый осадок. Этот осадок фильтровали, промывали водой и сушили при 110 С в течение 1 ч. Соединение 7, указанное в заголовке, (6,4 г) получали в виде гидрохлорида. После первого осаждения маточный раствор охлаждали при комнатной температуре и перемешивали в течение ночи. Осадок фильтровали, промывали водой и сушили при 110 С в течение 1 ч с получением смеси, содержащей соединения 7 и 8, указанные в заголовке (14,18 г). При необходимости гидрохлориды превращали в соответствующие свободные основания перед использованием с применением стандартных условий. Промежуточное соединение 7. 1H-ЯМР (300 МГц, CF3COOD) : 8,94 (s, 1H), 8,40 (s, 1H), 7,40 (s, 1H), 3,85 (m, 1H), 3,76 (m, 2H),5,45 (m, 2H), 1,42 (m, 2H), 1,77 (m, 2H). Промежуточное соединение 9. 7-[(2-Аминобутил)амино]-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота. К раствору 7-хлор-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (1,0 г) в 1 метил-2-пирролидиноне (10 мл) добавляли бутилендиамин (1,7 г). Смесь нагревали при 130 С в течение 16 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН и фильтровали с получением соединения, указанного в заголовке (450 мг).MS; (ES) m/z: 316,4 [MH]+. Промежуточное соединение 10. 6-[(2-Аминоэтил)амино]-3-карбоксихинолин-7-хлор-1-циклопропил-1,4-дигидро-4-оксометиловый эфир. Суспензию промежуточного соединения 7 (120 мг) в растворе HCl в МеОН (3%, 30 мл) диспергировали с помощью ультразвука в ультразвуковой водяной бане при 60 С в течение 3 ч и затем при комнатной температуре в течение 48 ч. Растворитель выпаривали при пониженном давлении и необработанный продукт очищали флэш-хроматографией (элюент: MeOH/DCM/NH4OH 9/5/0,5) с получением соединения, указанного в заголовке (80 мг). 1H-ЯМР (300 МГц, DMSO-d6) : 8,37 (s, 1 Н), 8,04 (s, 1H), 7,36 (s, 1H), 5,77 (t, 1H), 3,37 (s, 3H, O-Me),3,64 (m, 1H), 3,20 (q, 2H), 2,85 (t, 2H), 1,23 (m, 2H), 1,08 (m, 2H). Промежуточные соединения 11 и 12. 6-[(3-трет-Бутоксикарбониламинопропил)амино]-7-хлор-1 циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (11) и 7-[(3-трет-бутоксикарбониламинопропил)амино]-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновая кислота (12). В герметичной тубе 1-N-(трет-бутоксикарбонил)-3-пропандиамин (5 мл) добавляли к раствору 7 хлор-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновой кислоты (3 г) в DMSO (6 мл). Реакционную смесь перемешивали при 110 С в течение 15 ч. Оставляли реакционную смесь охлаждаться при 50 С и выливали в лед, добавляли уксусную кислоту, чтобы достичь рН=5. Появившийся осадок отделяли фильтрацией и промывали эфиром с получением смеси 11 и 12 в виде твердого желтого вещества- 15007433 Промежуточное соединение 13. 6-[(3-Аминопропил)амино]-7-хлор-1-циклопропил-1,4-дигидро-4 оксохинолин-3-карбоновая кислота. Раствор промежуточного соединения 11 (100 мг) в 10% TFA/DCM (1 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель частично выпаривали при пониженном давлении. Остаток разбавляли DCM (2 мл) и концентрировали при пониженном давлении пять раз. Окончательное выпаривание растворителя давало соединение, указанное в заголовке (103 мг).H-ЯМР (500 МГц, DMSO) : 8,56 (s, 1 Н), 8,22 (s, 1H), 7,35 (s, 1H), 6,54 (bt, 1H), 3,82 (m, 1H), 2,69 (t,2H), 2,49 (m, 2H), 1,71 (m, 2H), 1,28 (m, 2H), 1,16 (m, 2H). Промежуточное соединение 14. 7-[(3-Аминопропил)амино]-1-циклопропил-1,4-дигидро-6-фтор-4 оксохинолин-3-карбоновая кислота. Раствор промежуточного соединения 12 (100 мг) в 10% TFA/DCM (1 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель частично выпаривали при пониженном давлении. Остаток разбавляли DCM (2 мл) и концентрировали при пониженном давлении пять раз. Окончательное выпаривание растворителя давало соединение, указанное в заголовке (103,4 мг).(t, 2 Н), 2,50 (m, 2 Н), 1,74 (m, 2 Н), 1,29 (m, 2 Н), 1,15 (m, 2 Н). Промежуточные соединения 13 и 14 (смесь). 6-[(3-Аминопропил)амино]-7-хлор-1-циклопропил-1,4 дигидро-4-оксохинолин-3-карбоновая кислота и 7-[(3-аминопропил)амино]-1-циклопропил-1,4-дигидро 6-фтор-4-оксохинолин-3-карбоновая кислота. К раствору 7-хлор-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновой кислоты (300 мг) в DMSO (1 мл) добавляли N-(трет-бутоксикарбонил)-3-пропандиамин (0,37 мл) и смесь перемешивали при 110 С в течение 3 ч. Реакционную смесь разбавляли DCM (3 мл), промывали водой (350 мл),сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Необработанный продукт растворяли в НСООН (5 мл) и перемешивали при комнатной температуре в течение 12 ч. Растворитель удаляли in vacuo, необработанный продукт промывали несколько раз DCM (350 мл) и Et2O (150 мл) и каждый раз растворитель выпаривали при пониженном давлении. Полученный необработанный продукт очищали на SCX картридже (элюент:DCM, а за ним МеОН и NH3 (0,2N в МеОН с получением смеси соединений, указанных в заголовке (180 мг). Промежуточное соединение 15 и промежуточное соединение 16. 6-[(2-трет-Бутоксикарбониламиноэтил)амино]-7-хлор-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (15) и 7-[(2 трет-бутоксикарбониламиноэтил)амино]-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновая кислота (16). В герметичной тубе N-(трет-бутоксикарбонил)этилендиамин (5 мл) добавляли к раствору 7-хлор-1 циклопропил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (3 г) в DMSO (6 мл). Реакционную смесь перемешивали при 110 С в течение 15 ч. Реакционной смеси давали остыть при 50 С и выливали в лед, добавляли уксусную кислоту, чтобы получить рН=5. Появившийся осадок отделяли фильтрацией и промывали эфиром с получением 40:60 смеси соединений, указанных в заголовке (4,4 г). Промежуточное соединение 17 и промежуточное соединение 18. 6-[(2-трет-Бутоксикарбониламиноэтил)амино]-7-хлор-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты амид (17) и 7-[(2-трет-бутоксикарбониламиноэтил)амино]-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновой кислоты амид (18). К раствору 40:60 смеси промежуточных соединений 15 и 16 (1 г) в безводном DCM (20 мл) и безводном THF (30 мл) при -5 С добавляли N-метилморфолин (0,56 мл), а затем по каплям добавляли изобутилхлорформат (0,64 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и добавляли NH4OH (33%, 20 мл). Реакционную смесь концентрировали при пониженном давлении и добавляли насыщенный водный раствор NH4Cl (20 мл). Полученную смесь экстрагировали DCM (320 мл), объединенную органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Необработанный продукт очищали флэш-хроматографией (элюент DCM/MeOH от 99:1 до 95:5) с получением 40:60 смеси соединений, указанных в заголовке (528 мг). Промежуточное соединение 19 и промежуточное соединение 20. Соль трифторуксусной кислоты амида 6-[(2-аминоэтил)амино]-7-хлор-1-циклопропил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты(19) и соль трифторуксусной кислоты амида 7-[(2-аминоэтил)амино]-1-циклопропил-1,4-дигидро-6-фтор 4-оксохинолин-3-карбоновой кислоты (20). 40:60 смесь промежуточных соединений 17 и 18 (528 мг) растворяли в растворе TFA (30 мл, 10% вDCM) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением 40:60 смеси соединений, указанных в заголовке (544 мг). HPLC/MS анализ (подвижная фаза: А/В от 95/5 до 10/90 за 10 мин, 10/90 в течение 5 мин, массовый интервал 100-800 а.е.м.): время удержания: 6,19 мин (321 [МН]+) и 5,63 (305 [МН]+). Промежуточное соединение 21. 2'-O-Ацетил-8 а-аза-8 а-гомоэритромицин А.Ac2O (0,280 мл). Полученный раствор перемешивали в течение ночи при комнатной температуре. К этой смеси добавляли рассол (100 мл) и воду (50 мл). Отделяли органический слой, промывали рассолом (50 мл), сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (2,1 г).MS; m/z (ES): 791,1 [MH]+. Промежуточное соединение 22. 2'-O-Ацетил-4"-O-пропеноил-8 а-аза-8 а-гомоэритромицин А. Промежуточное соединение 21 (290 мг) растворяли в толуоле (10 мл) и растворитель выпаривали. Эту операцию повторяли дважды. Остаток снова растворяли в толуоле (15 мл) и раствор перемешивали под аргоном. Добавляли TEA (0,470 мл), а затем 3-хлорпропионилхлорид (0,101 мл) тремя порциями за 10 мин. Через 15 ч добавляли TEA (0,235 мл) и 3-хлорпропионил хлорид (0,050 мл). Еще через 3 ч добавлялиTEA (0,170 мл) и 3-хлорпропионил хлорид (0,025 мл). Через 1 ч добавляли насыщенный водный растворNaHCO3 (30 мл) и водную фазу экстрагировали толуолом (320 мл). Органическую фазу высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (261 мг). Промежуточное соединение 23. 4 -O-Пропеноил-8 а-аза-8 а-гомоэритромицин А. Промежуточное соединение 22 (225 мг) растворяли в МеОН (30 мл) и перемешивали в течение ночи. Растворитель выпаривали при пониженном давлении с получением соединения, указанного в заголовке (221 мг).(713 мг) и Ac2O (0,230 мл) и перемешивали в течение ночи. К этой смеси добавляли рассол (100 мл) и воду (50 мл). Отделяли органический слой, промывали рассолом (50 мл), сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (1,67 г).MS; m/z (ES): 805,1 [МН]+. Промежуточное соединение 25. 2'-O-Ацетил-4"-O-пропеноил-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 24 (1,80 г) в сухом толуоле (30 мл) в атмосфере аргона одной порцией добавляли TEA (2,90 мл). К реакционной смеси в течение нескольких минут добавляли 3 хлорпропионил хлорид (0,63 мл). Реакционную смесь перемешивали в течение 2 ч. К реакционному раствору добавляли еще два эквивалента TEA и один эквивалент 3-хлорпропионил хлорида и перемешивали в течение дополнительных 2 ч. Реакцию гасили путем добавления насыщенного NaHCO3 (60 мл). Слои разделяли и водный слой экстрагировали толуолом (330 мл). Объединенные толуоловые экстракты промывали рассолом (20 мл), сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (1,8 г).MS; m/z (ES): 859 [МН]+. Промежуточное соединение 26. 4"-O-Пропеноил-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Промежуточное соединение 25 (1,8 г) растворяли в МеОН (100 мл) и раствор перемешивали при комнатной температуре в течение 24 ч и затем при 60 С в течение 2 ч. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией (элюент MeOH/DCM/NH4OH 5/90/0,5) с получением соединения, указанного в заголовке (1,54 г).MS; m/z (ES): 817,5 [МН]+. Промежуточное соединение 27 и промежуточное соединение 28. 6-O-Этил-8 а-аза-8 а-гомоэритромицин А (27) и 6-O-этил-9 а-аза-9 а-гомоэритромицин А (28). К суспензии 9(E)- и 9(Z)-оксимов 6-О-этилэритромицина А (3,76 г) в ацетоне и воде (230 мл, смесь 1/1) при 0 С добавляли NaHCO3 (5,69 г). По каплям добавляли раствор p-толуолсульфонилхлорида (6,46 г) в ацетоне (55 мл) в течение 30 мин и полученную суспензию перемешивали в течение 15 ч при комнатной температуре. Ацетон выпаривали при пониженном давлении, добавляли DCM (100 мл) и H2O(100 мл). Величину рН полученного раствора подводили до 9,5 с помощью NaOH (2M). Отделяли органический слой и промывали рассолом (50 мл), сушили над К 2 СО 3, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией (элюент: этилацетат/нгексан/диэтиламин 6/3/0,2) с получением соединения 27, указанного в заголовке (0,835 г) и соединения 28, указанного в заголовке (1,38 г).MS; m/z (ES): 777,5 [МН]+. Промежуточное соединение 29. 2'-O-Ацетил-6-O-этил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 27 (735 мг) в DCM (20 мл) добавляли NaHCO3 (358 мг) и уксусный ангидрид (0,098 мл) с перемешиванием при комнатной температуре в течение 20 ч. Добавляли насыщенный раствор NaHCO3 (20 мл), водный слой промывали DCM (210 мл), органический слой промывали рассолом (20 мл), сушили над K2 СО 3, фильтровали и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (661 мг).MS; m/z (ES): 819,4 [МН]+. Промежуточное соединение 30. 2'-O-Ацетил-6-O-этил-4"-O-пропеноил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 29 (149 мг) в сухом толуоле (5 мл) в атмосфере азота добавляли TEA (0,229 мл) при комнатной температуре, затем тремя порциями в течение 3 ч добавляли 3 хлорпропионил хлорид (0,05 мл). Добавляли насыщенный раствор NaHCO3 (5 мл), водный слой промывали толуолом (25 мл), органический слой промывали рассолом (10 мл), сушили над K2 СО 3, фильтровали и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (139 мг).MS m/z (ES) 873,4 [МН]+. Промежуточное соединение 31 и промежуточное соединение 32. 6-O-(2-Пропенил)-8 а-аза-8 агомоэритромицин А (31) и 6-O-(2-пропенил)-9 а-аза-9 а-гомоэритромицин А (32). К суспензии 9(E)- и 9(Z)-оксимов 6-O-2-пропенилэритромицина А (4,25 г) в ацетон/воде 1/1 (250 мл), охлажденной до 0 С, добавляли NaHCO3 (6,34 г). Затем по каплям добавляли раствор ртолуолсульфонил хлорида (7,19 г) в ацетоне (55 мл) за 30 мин и полученную суспензию перемешивали в течение 15 ч, позволяя нагреться до комнатной температуры. Ацетон выпаривали при пониженном давлении и добавляли DCM (100 мл) и воду (100 мл). Величину рН раствора подводили до 9,5 путем добавления NaOH (2M). Органический слой промывали рассолом (50 мл), сушили над K2 СО 3, фильтровали и выпаривали при пониженном давлении. Остаток очищали флэш-хроматографией (элюент: EtOAc/нгексан/Et2NH 6/3/0,2) с получением соединения 31, указанного в заголовке (2,36 г) и соединения 32, указанного в заголовке (0,97 г).MS; m/z (ES): 789,4 [МН]+. Промежуточное соединение 33. 6-O-Пропил-8 а-аза-8 а-гомоэритромицин А. Раствор промежуточного соединения 31 (2,3 г) в МеОН (40 мл) подкисляли до рН 5-5,5 с помощьюHCl (1 М). Затем добавляли 10% Pd/C (0,82 г) и смесь гидрогенизировали при 20 бар в течение 20 ч. МеОН выпаривали при пониженном давлении, затем добавляли DCM (50 мл) и воду (50 мл). Величину рН подводили до 9,5 с использованием NaOH (1M). В водную фазу экстрагировали DCM (10 мл) и органический слой промывали рассолом (50 мл), сушили над K2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (1,84 г).MS; m/z (ES): 791,4 [МН]+. Промежуточное соединение 34. 2 '-O-Ацетил-6-O-пропил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 33 (0,27 г) в DCM (10 мл) при комнатной температуре добавляли NaHCO3 (131 мг) и уксусный ангидрид (0,039 мл). Полученную суспензию перемешивали при комнатной температуре в течение 20 ч. Добавляли насыщенный раствор NaHCO3 (10 мл) и водный слой экстрагировали DCM (210 мл). Органическую фазу промывали рассолом (10 мл), сушили над K2 СО 3,фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовкеMS; m/z (ES): 833,4 [МН]+. Промежуточное соединение 35. 2'-O-Ацетил-4"-O-пропеноил-6-O-пропил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 34 (149 мг) в сухом толуоле (5 мл) при комнатной температуре в атмосфере азота добавляли TEA (0,229 мл), затем тремя порциями каждый час добавляли 3 хлорпропионил хлорид (0,052 мл) и перемешивали в течение 2 ч. Добавляли насыщенный растворNaHCO3 (5 мл) и водную фазу промывали толуолом (25 мл). Органический раствор промывали рассолом (10 мл), сушили над K2 СО 3, фильтровали, и фильтрат выпаривали при пониженном давлении с получением соединения, указанного в заголовке (139 мг).MS; m/z (ES): 887,5 [МН]+. Промежуточное соединение 36. 2'-O-Ацетил-11,12-карбонат-11,12-дидезокси-4"-O-(1H-1 имидазолилкарбонил)-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Раствор промежуточного соединения 24 (2,0 г) в сухом DMF (20 мл) охлаждали до 0 С в водноледяной бане в атмосфере аргона. Затем одной порцией добавляли 1,1'-карбонилдиимидазол (3,20 г), а затем порциями добавляли NaH (60% масляная суспензия, 0,47 г). Полученную смесь перемешивали в атмосфере аргона при 0 С в течение 1 ч. Реакцию гасили добавлением по каплям холодной воды (100 мл), во время чего осаждался твердый материал. Твердое вещество фильтровали и сушили с получением соединения, указанного в заголовке (2,02 г).MS; m/z (ES): 925,9 [МН]+. Промежуточное соединение 37. 2'-O-Ацетил-4"-O-триметилсилил-8 а-аза-8 а-гомоэритромицин А. Промежуточное соединение 21 (1,0 г) растворяли в DCM (10 мл) и охлаждали до 0-5 С, затем добавляли пиридин (0,31 мл) и триметилсилилхлорид (0,33 мл) и полученную смесь перемешивали в течение 2 ч. Реакционную смесь промывали водным раствором NaH2PO4 (30 мл), водой (30 мл) и рассолом(30 мл) и растворитель концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,94 г).MS; m/z (ES): 862 [МН]+. Промежуточное соединение 38. 11-O-[3-(3-Хинолил)-2-пропенил]-8 а-аза-8 а-гомоэритромицин А. Промежуточное соединение 37 (0,9 г) и cis-пропенилхинолила трет-бутил карбонат (0,630 г) растворяли в толуоле (18 мл), затем растворитель удаляли при пониженном давлении. Эту операцию повторяли дважды, затем остаток растворяли в толуоле (25 мл) и примерно 7 мл растворителя удаляли invacuo. Остаточный раствор переносили в трехгорлую круглодонную колбу и дезоксигенировали аргоном. Добавляли трис(дибензилиденацетон)дипалладий(0) (40 мг) и 1,4-бис(дифенилфосфин)бутан (37 мг) и смесь нагревали при 80 С в течение 1 ч. Растворитель удаляли при пониженном давлении. Остаток растворяли в МеОН (200 мл), добавляли муравьиную кислоту, подводя рН до 5, и раствор перемешивали в течение ночи. Смесь выпаривали при пониженном давлении с получением необработанного продукта,который очищали флэш-хроматографией (элюент: CHCl3/MeOH/NH4OH 6/1/0,1) с получением соединения, указанного в заголовке (260 мг).MS; m/z (ES): 917 [MH]+. Промежуточное соединение 39. 2'-O-Ацетил-11-O-[3-(3-хинолил)-2-пропенил]-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 38 (0,30 г) при комнатной температуре добавляли NaHCO3(900 мг) и Ac2O (0,280 мл). Полученный раствор перемешивали в течение ночи. К этой смеси добавляли рассол (100 мл) и воду (50 мл). Отделяли органический слой, промывали рассолом (50 мл), сушили,фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовкеMS; m/z (ES): 958 [МН]+. Промежуточное соединение 40. 4"-O-Пропеноил-11-O-[3-(3-хинолил)-2-пропенил]-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 39 в сухом толуоле (5 мл) добавляли TEA (0,26 мл) и 3 хлорпропионил хлорид (0,070 мл). Реакционную смесь перемешивали в течение 0,5 ч, затем гасили добавлением насыщенного водного раствора бикарбоната натрия (15 мл). Водную фазу экстрагировали толуолом (10 мл). Объединенные толуоловые экстракты промывали рассолом (20 мл), сушили над карбонатом калия, фильтровали и концентрировали при пониженном давлении. Необработанный продукт растворяли в МеОН (60 мл) и перемешивали при комнатной температуре в течение 24 ч. Растворитель выпаривали с получением соединения, указанного в заголовке (0,25 г).MS; m/z (ES): 971 [МН]+. Промежуточное соединение 41. 2'-O-Ацетил-6-O-метил-9 а-аза-9 а-гомоэритромицин А. К раствору 6-O-метил-9 а-аза-9 а-гомоэритромицина А (4,0 г) в DCM (60 мл) и ацетоне (10 мл) добавляли NaHCO3 (2,2 г) и Ac2O (1,5 мл). Реакционную смесь перемешивали в течение 1 ч затем добавляли DCM (75 мл) и воду (75 мл). Органическую фазу отделяли, промывали рассолом (50 мл), сушили надNa2SO4, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (4,02 г). Промежуточное соединение 42. 2'-O-Ацетил-4"-O-пропенил-6-O-метил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 41 (3,0 г) в сухом толуоле (30 мл), добавляли TEA (2,07 мл) в атмосфере аргона. Реакционную смесь охлаждали до 15 С и по каплям добавляли 3-хлорпропионил хлорид (0,71 мл). Водяную баню удаляли и реакционную смесь перемешивали в течение 2 ч, затем добавляли TEA (1 мл) и 3-хлорпропионил хлорид (0,48 мл) и реакционный раствор перемешивали в течение дополнительных 2 ч. Добавляли насыщенный водный раствор NaHCO3 (60 мл) и EtOAc (30 мл) и экстрагировали водную фазу EtOAc (230 мл). Объединенные органические экстракты сушили надK2 СО 3, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (3,17 г).MS; m/z (ES): 859 [МН]+. Промежуточное соединение 43. 4"-O-Пропеноил 6-O-метил-9 а-аза-9 а-гомоэритромицин А. Промежуточное соединение 42 (2,9 г) растворяли в МеОН (100 мл) и раствор перемешивали при комнатной температуре в течение 24 ч, а затем при 60 С в течение 2 ч. Растворитель выпаривали и остаток очищали флэш-хроматографией (элюент: МеОН/DCM/NH4 ОН 5/90/0,5) с получением соединения,указанного в заголовке (1,8 г).MS; m/z (ES): 817 [MH]+. Промежуточное соединение 44. 2'-O-Ацетил-6-O-этил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 28 (1,33 г) в DCM (30 мл) при комнатной температуре добавляли NaHCO3 (650 мг) и Ас 2 О (0,178 мл). Полученную суспензию перемешивали при комнатной температуре в течение 20 ч. Добавляли насыщенный водный раствор NaHCO3 (20 мл), водную фазу экстрагировали DCM (220 мл) и объединенный органический раствор промывали рассолом (20 мл), сушили над K2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (1,29 г).- 19007433 Промежуточное соединение 45. 2'-O-Ацетил-4"-O-пропеноил-6-O-этил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 44 (0,21 г) в сухом толуоле (5 мл) при комнатной температуре в атмосфере азота добавляли TEA (0,321 мл). Затем тремя порциями за 3 ч добавляли 3 хлорпропионил хлорид (0,073 мл) и затем перемешивали в течение 2 ч. Добавляли насыщенный растворNaHCO3 (5 мл) и водную фазу промывали толуолом (210 мл). Органический раствор промывали рассолом (10 мл), сушили над К 2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (0,20 г).MS; m/z (ES): 873,4 [МН]+. Промежуточное соединение 46. 6-O-Пропил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 32 (1,27 г) в МеОН (40 мл) добавляли водный раствор HCl(1 М) до получения рН=5-5,5. К раствору добавляли 10% Pd/C (0,45 г) и смесь гидрогенизировали при 15 бар в течение 20 ч. Раствор концентрировали при пониженном давлении и добавляли DCM (50 мл) и воду (50 мл). Величину рН полученной смеси подводили до 9,5 путем добавления NaOH (1M). Водную фазу промывали DCM (30 мл) и органические растворы объединяли и промывали рассолом (50 мл), сушили над К 2 СО 3 и выпаривали при пониженном давлении с получением соединения, указанного в заголовкеMS; m/z (ES): 791,4 [MH]+. Промежуточное соединение 47. 2'-O-Ацетил-6-O-пропил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 46 (0,97 мг) в DCM (50 мл) при комнатной температуре добавляли NaHCO3 (0,46 г) и Ас 2 О (0,139 мл). Полученную суспензию перемешивали при комнатной температуре в течение 20 ч. Добавляли насыщенный водный раствор NaHCO3 (50 мл) и экстрагировалиDCM (220 мл). Объединенный органический раствор промывали рассолом (40 мл), сушили над К 2 СО 3,фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовкеMS; m/z (ES): 833,4 [МН]+. Промежуточное соединение 48. 2'-O-Ацетил-4"-O-пропеноил-6-O-пропил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 47 (0,95 г) в сухом толуоле (25 мл) при комнатной температуре в атмосфере азота добавляли триэтиламин (0,958 мл), затем тремя порциями каждый час добавляли 3-хлорпропионил хлорид (0,218 мл) и затем перемешивали в течение 2 ч. Добавляли насыщенный водный раствор NаНСО 3 (25 мл) и водную фазу промывали толуолом (225 мл). Органическую фазу промывали рассолом (50 мл), сушили над К 2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (0,92 г).MS; m/z (ES): 887,4 [МН]+. Промежуточное соединение 49. 2'-O-Ацетил-11,12-карбонат-11,12-дидезокси-4"-O-пропеноилазитромицин. Раствор промежуточного соединения 2'-O-ацетил-11,12-карбонат-11,12-дидезокси-азитромицина(10,9 г) в толуоле (300 мл) перемешивали при комнатной температуре в атмосфере аргона. К этому раствору двумя порциями за 10 мин добавляли TEA (12,66 мл) и 3-хлорпропионил хлорид (1,94 мл). Через 20 мин раствор разбавляли насыщенным водным раствором NaHCO3 (300 мл) и экстрагировали толуолом(480 мл). Собранную органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (11,0 г).MS; m/z (ES): 872 [МН]+. Промежуточное соединение 50. 11,12-Карбонат-11,12-дидезокси-4"-O-пропеноил азитромицин. Раствор промежуточного соединения 49 (11,0 г) в МеОН (200 мл) перемешивали при комнатной температуре в течение 48 ч. Растворитель выпаривали при пониженном давлении с получением соединения, указанного в заголовке (9,81 г).(m, 1 Н), 2,44-2,38 (m, 2 Н), 2,32 (s, 6H), 2,21 (s, 3H), 2,06 (m, 1 Н), 2,00 (m, 1 Н), 1,92 (m, 1H), 1,84 (m, 1 Н),1,70-1,56 (m, 4 Н), 1,45 (s, 3H), 1,40 (dd, 1 Н), 1,29 (s, 3H), 1,25 (m, 1 Н), 1,22 (d, 3H), 1,18 (d, 6 Н), 1,12 (s,3H), 1,08-1,06 (2d, 6 Н), 0,93 (m, 6 Н). Промежуточное соединение 51. 4"-O-Пропеноил-азитромицин. К раствору промежуточного соединения 50 (1,3 г) в ацетонитриле (50 мл) при комнатной температуре добавляли насыщенный водный раствор карбоната калия (30 мл). Полученную смесь нагревали до 70 С в течение 8 ч. Смесь затем разбавляли водой (100 мл), экстрагировали EtOAc (430 мл). Собранную органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении. Необработанный продукт очищали флэш-хроматографией (элюент: DCM/MeOH/NH3 90/9/0,5) с получением соединения, указанного в заголовке (530 мг).- 20007433 Промежуточное соединение 52. 2'-O-Ацетил-4"-O-имидазолилкарбонил-азитромицин. К раствору 2'-O-ацетил азитромицина (0,8 г) в сухом толуоле (30 мл) в атмосфере аргона добавляли К 2 СО 3 (420 м) и 1,1'-карбонилдиимидазол (0,170 г). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и при 40 С в течение дополнительных 5 ч. Добавляли насыщенный раствор NaHCO3 (30 мл) и водную фазу промывали толуолом (230 мл). Объединенный органический раствор высушивали над К 2 СО 3 и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,82 г).(0,030 мл). Смесь перемешивали при комнатной температуре в течение 20 ч, затем добавляли рассол (20 мл). Раствор экстрагировали DCM и органическую фазу высушивали. Растворитель концентрировали при пониженном давлении с получением соединения, указанного в заголовке (220 мг).MS; m/z (ES): 805 [МН]+. Промежуточное соединение 54. 4"-O-Пропеноил-6-O-метил-азитромицин. Раствор промежуточного соединения 53 (215 мг) в DCM (10 мл) перемешивали в атмосфере аргона в течение 10 мин. Двумя порциями добавляли TEA (0,222 мл) и 3-хлорпропионилхлорид (0,051 мл). Через 15 мин снова добавляли TEA (0,111 мл) и 3-хлорпропионилхлорид (0,026 мл). Через 12 ч добавлялиTEA (0,111 мл) и 3-хлорпропионилхлорид (0,026 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли насыщенный водный раствор NaHCO3 (20 мл). Слои разделяли и органическую фазу высушивали. Растворитель концентрировали при пониженном давлении и остаток(240 мг) растворяли в МеОН (20 мл) и перемешивали при комнатной температуре в течение 14 ч. Растворитель концентрировали при пониженном давлении с получением соединения, указанного в заголовкеMS; m/z (ES): 817,6 [МН]+. Промежуточное соединение 55. 2'-O-Ацетил-11,12-(аминокарбонилокси)-11,12-дидезокси-6-Oметил-эритромицин А. К раствору 11,12-(аминокарбонилокси)-11,12-дидезокси-6-О-метил-эритромицина А в DCM (50 мл) при комнатной температуре добавляли NaHCO3 (478 мг). К этому раствору добавляли Ac2O (0,153 мл) и перемешивали в течение ночи. К этой смеси добавляли рассол (50 мл) и воду (20 мл). Отделяли органический слой, промывали рассолом (20 мл), сушили, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (1,2 г).MS; m/z (ES): 816,2 [MH]+. Промежуточное соединение 56. 2'-O-Ацетил-11,12-(аминокарбонилокси)-11,12-дидезокси-6-Oметил-4-O-пропеноил-эритромицин А. Промежуточное соединение 55 растворяли в толуоле (50 мл) и растворитель выпаривали. Это повторяли дважды. После этого остаток снова растворяли в толуоле (45 мл) и перемешивали под аргоном. К этому раствору добавляли TEA (1,8 мл) и 3-хлорпропионилхлорид (0,40 мл) (тремя порциями за 20 мин). Чрез 20 мин добавляли насыщенный водный раствор NaHCO3 (50 мл). Водный раствор экстрагировали толуолом (350 мл), объединенный органический раствор сушили над К 2 СО 3 и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке (1,04 г).MS; m/z (ES): 870,1 [MH]+. Промежуточное соединение 57. 11,12-(Аминокарбонилокси)-11,12-дидезокси-6-O-метил-4"-Oпропеноил-эритромицин А. Раствор промежуточного соединения 56 в МеОН (30 мл) перемешивали при комнатной температуре в течение ночи. Растворитель концентрировали при пониженном давлении с получением соединения,указанного в заголовке (1,2 г).DCM (20 мл) и ацетоне (3 мл). Твердый NaHCO3 (0,6 г) и Ac2O (0,6 мл) добавляли и реакционную смесь перемешивали в течение 1 ч, затем добавляли DCM (50 мл) и воду (50 мл). Органическую фазу отделяли,промывали рассолом (20 мл), сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,875 г).MS; m/z (ES): 829,2 [МН]+. Промежуточное соединение 59. 11,12-Дидезокси-6-O-метил-11,12-(метиламинокарбонилокси)-4"O-пропеноил-эритромицин А. К раствору промежуточного соединения 58 (0,85 г) в сухом толуоле (10 мл) в атмосфере аргона добавляли TEA (0,85 мл) и 3-хлорпропионил хлорид (0,196 мл, двумя порциями за 20 мин) и реакционную смесь перемешивали в течение 1 ч. Затем добавляли насыщенный раствор NaHCO3 (30 мл) и смесь экстрагировали толуолом (260 мл). Объединенный органический раствор промывали рассолом (20 мл), сушили над К 2 СО 3, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН (70 мл) и нагревали при 60 С в течение 4 ч, затем оставляли стоять при комнатной температуре в течение 24 ч. Растворитель концентрировали при пониженном давлении с получением соединения, указанного в заголовке (620 мг).NaH (1,2 г, 50% суспензия в масле). Реакционную смесь перемешивали в течение 4 ч, затем добавлялиH2O (60 мл). Осадок фильтровали, промывали водой и сушили с получением соединения, указанного в заголовке (4,1 г). Промежуточное соединение 61. 2'-O,4"-O-Диацетил-11,12-дидезокси-11,12-(этиламинокарбонилокси)-6-O-метил-эритромицин А. Промежуточное соединение 60 (3,5 г) растворяли в CH3CN (35 мл) и H2O (4 мл) при комнатной температуре и реакционный раствор охлаждали до 0 С на водно-ледяной бане в атмосфере аргона. Добавляли EtNH2 (1,7 г) и реакционную смесь перемешивали в течение 20 ч. Добавляли воду (50 мл) и осадок фильтровали, промывали водой и сушили с получением соединения, указанного в заголовке (2,6 г). Промежуточное соединение 62. 11,12-Дидезокси-11,12-(этиламинокарбонилокси)-6-O-метилэритромицин А. Промежуточное соединение 61 (2,5 г) растворяли в МеОН (140 мл), добавляли насыщенный водный раствор К 2 СО 3 (10 мл) и реакционную смесь перемешивали при 75 С в течение 4 ч и при комнатной температуре в течение ночи. Уменьшали объем раствора вдвое при пониженном давлении и добавляли к остатку EtOAc (100 мл) и воду (50 мл). Отделяли органический слой, сушили и выпаривали с получением соединения, указанного в заголовке (2,4 г). Промежуточное соединение 63. 2'-O-Ацетил-11,12-дидезокси-11,12-(этиламинокарбонилокси)-6-Oметил-эритромицин А. Промежуточное соединение 62 (1,5 г) растворяли в DCM (40 мл) и ацетоне (5 мл). Добавляли твердый NaHCO3 (1,2 г) и Ac2O (0,8 мл) и смесь перемешивали в течение 1 ч. Затем добавляли DCM (60 мл) и воду (60 мл) и органическую фазу отделяли, промывали рассолом (20 мл), сушили и выпаривали с получением соединения, указанного в заголовке (1,5 г).MS; m/z (ES): 843,2 [МН]+. Промежуточное соединение 64. 11,12-Дидезокси-11,12-(этиламинокарбонилокси)-6-O-метил-4"-Oпропеноил-эритромицин А. К раствору промежуточного соединения 63 (1,45 г) в сухом толуоле (17 мл) в атмосфере аргона добавляли TEA (1,42 мл) и 3-хлорпропионил хлорид (0,49 мл, тремя порциями за 20 мин). Реакционную смесь перемешивали в течение 1 ч, затем добавляли насыщенный раствор NaHCO3 (50 мл) и водную фазу экстрагировали толуолом (270 мл). Объединенный органический раствор промывали рассолом (20 мл),сушили над К 2 СО 3, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН (100 мл) и нагревали при 60 С в течение 4 ч, а затем при комнатной температуре в течение 24 ч. Растворитель выпаривали и необработанный продукт очищали флэш-хроматографией (элюент:- 22007433 К раствору 11,12-дидезокси-11,12-[(N-(4-фенилбутил)амино)карбонилокси]-6-O-метил-эритромицина А (0,550 г) в DCM (17 мл) добавляли уксусный ангидрид (0,101 мл) и NaHCO3 (0,140 г). Смесь перемешивали при комнатной температуре в течение 24 ч, затем добавляли насыщенный растворMS; m/z (ES): 904 [МН]+. Промежуточное соединение 66. 2'-O-Ацетил-11,12-дидезокси-11,12-[(N-(4-фенилбутил)амино) карбонилокси]-6-O-метил-4"-O-пропеноил-эритромицин А. К раствору промежуточного соединения 65 (0,500 г) в сухом толуоле (8 мл) в атмосфере аргона добавляли двумя порциями TEA (0,440 мл) и 3-хлорпропионил хлорид (0,116 мл). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли насыщенный раствор NaHCO3 (25 мл) и водную фазу экстрагировали толуолом (210 мл). Объединенные органические экстракты промывали рассолом (25 мл), сушили над К 2 СО 3, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,450 г). Промежуточное соединение 67. 11,12-Дидезокси-11,12-[(N-(4-фенилбутил)амино)карбонилокси]-6O-метил-4"-O-пропеноил-эритромицин А. Промежуточное соединение 66 (0,450 г) перемешивали в МеОН (110 мл) при комнатной температуре в течение 48 ч. Выпаривание при пониженном давлении давало соединение, указанное в заголовкеMS; m/z (ES): 959 [МН]+. Промежуточное соединение 68. 2'-O-Ацетил-6-O-метил-4"-O-пропеноил-эритромицин А. К раствору 2'-O-ацетил-6-O-метил-эритромицина А (1,1 г) в DCM (20 мл) при 0 С добавляли пиридин (1,7 мл) и акрилоилхлорид (1,1 мл). Через 2 ч осуществляли дополнительное добавление пиридина(1,7 мл) и акрилоилхлорида (1,1 мл). Реакционную смесь гасили насыщенным раствором NH4Cl (10 мл) и экстрагировали DCM (320 мл). Органическую фазу промывали насыщенным раствором NaHCO3 (10 мл), водой (10 мл), сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении. Необработанный продукт очищали флэш-хроматографией (DCM/MeOH/NH3 95/5/0,5) с получением соединения,указанного в заголовке (470 мг). Промежуточное соединение 69. 6-О-Метил-4-О-пропеноил-эритромицин А. Промежуточное соединение 68 (1,82 г, ммоль) растворяли в МеОН (100 мл) и перемешивали при 60 С в течение 4 ч, а затем при комнатной температуре в течение 16 ч. Растворитель выпаривали при пониженном давлении и необработанный продукт очищали флэш-хроматографией (элюент:(m, 2 Н), 3,04 (s, 3 Н), 3,00 (m, 1H), 2,92 (m, 1 Н), 2,56 (m, 2H), 2,43 (d, 1H), 2,31 (s, 6H). 13 С-ЯМР (75 МГц) : 221,0; 175,7; 165,8; 131,5; 128,0; 102,1; 96,0; 80,5,78,8, 78,3; 78,0; 76,6; 74,3; 72,7; 71,1; 69,1; 67,8; 65,3; 63,2; 50,7; 49,5; 45,3; 44,9; 40,3; 39,2; 38,8; 37,2; 35,2; 28,9; 21,7; 21,1; 19,7; 18,3; 18,0; 15,9; 12,3; 10,6; 9,1. Промежуточное соединение 70. 2'-O-Ацетил-4"-O-иодэтаноил-6-O-метил-эритромицин А. К раствору 2'-O-ацетил-6-O-метил-эритромицина А (600 мг) в безводном DCM (40 мл) добавляли пиридин (0,18 мл) и хлорацетилхлорид (0,06 мл) и реакционную смесь перемешивали при комнатной температуре в течение 15 мин. Осуществляли второе добавление пиридина (0,18 мл) и хлорацетилхлорида (0,06 мл). Через еще 15 мин проводили третье добавление пиридина (0,18 мл) и хлорацетилхлорида(0,06 мл), после чего через еще 30 мин пиридин (0,18 мл) и хлорацетилхлорид (0,06 мл) добавляли четвертый раз. Реакционную смесь перемешивали дальше в течение 1 ч, затем добавляли рассол (20 мл). Водную фазу экстрагировали DCM (320 мл) и объединенные органические слои промывали насыщенным водным раствором NaHCO3 (20 мл). Органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении. К необработанному продукту, растворенному в ацетоне (4 мл), добавляли раствор йодида натрия (570 мг) в ацетоне (6 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 1 ч, фильтровали и фильтрат концентрировали при пониженном давлении. Необработанный продукт растворяли в EtOAc (10 мл), добавляли воду (10 мл) и водную фазу экстрагировали EtOAc (310 мл). Объединенные органические слои промывали насыщенным водным растворомNa2S2O5 (10 мл), сушили, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (546 мг). 1H-ЯМР (500 МГц) : 5,00 (d, 1H), 4,81 (bt, 1H), 4,74 (d, 1H), 4,66 (d, 1H), 4,34 (m, 1H), 3,76 (m, 1 Н),3,71 (d+d, 2 Н), 3,37 (s, 3H), 2,40 (d, 1 Н), 2,10 (s, 3H), 1,67 (m, 2 Н), 1,32 (m, 1 Н), 1,24 (d, 3H), 1,13 (d, 3H). Промежуточное соединение 71. 6-О-Пропил-эритромицин А. К раствору 6-O-(2-пропенил)эритромицина А (2,5 г) в МеОН (60 мл) добавляли Pd/C (10%, 0,85 г) и смесь гидрогенизировали при комнатной температуре при 15 бар в течение 20 ч. Катализатор отфильтро- 23007433 вывали и промывали МеОН и растворитель выпаривали при пониженном давлении. Добавляли DCM (50 мл) и воду (50 мл) и рН подводили до 9,5 путем добавления NaOH (1M). Органическую фазу высушивали над К 2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (2,27 г).MS; m/z (ES): 776,6 [МН]+. Промежуточное соединение 72. 2'-О-Ацетил-6-О-пропил-эритромицин А. К раствору промежуточного соединения 71 (1,0 г) в DCM (30 мл) при комнатной температуре добавляли NaHCO3 (0,487 г) и Ac2O (0,134 мл). Раствор перемешивали в течение 24 ч, затем добавляли воду(20 мл), рН подводили до 9,5 путем добавления NaOH (1M), органический слой высушивали над К 2 СО 3,фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке(0,513 мл) и 3-хлорпропионилхлорид (0,116 мл), и раствор перемешивали в течение 30 мин. Дополнительные количества TEA (0,513 мл) и 3-хлорпропионил хлорида (0,116 мл) добавляли через 1 ч и через 2 ч. Реакционную смесь гасили путем добавления насыщенного водного раствора NaHCO3 (30 мл), органический слой промывали рассолом, сушили над К 2 СО 3, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (1,01 г). Промежуточное соединение 74. 4"-O-Пропенил-6-O-пропил-эритромицин А. Промежуточное соединение 73 (1,01 г) растворяли в МеОН (50 мл) и перемешивали при комнатной температуре в течение 20 ч. Растворитель удаляли при пониженном давлении и добавляли DCM (50 мл) и воду (30 мл). Величину рН подводили до 9,5 путем добавления NaOH (1M) и органическую фазу высушивали над К 2 СО 3, фильтровали и выпаривали при пониженном давлении с получением соединения,указанного в заголовке (0,92 г).MS; m/z (ES): 830,6 [МН]+. Промежуточное соединение 75. 11,12-Карбонат-2',4"-O-диацетил-11,12-дидезокси-6-O-метилэритромицин А. К раствору 2',4"-O-диацетил-6-О-метил-эритромицина А (200 г) в безводном DCM (1,6 л) при 0 С в атмосфере азота добавляли пиридин (117 мл) и раствор трифосгена (71,2 г) в DCM (400 мл). Полученную смесь перемешивали при 0 С в течение 30 мин и затем при комнатной температуре в течение 15 ч. Смесь затем разбавляли водой (750 мл) и экстрагировали DCM (2500 мл). Органическую фазу промывали водой (3300 мл), сушили, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (200 г).MS; m/z (ES): 858 [МН]+. Промежуточное соединение 76. 11-Дезокси-2',4"-О-диацетил-10,11-дидегидро-6-О-метил-эритромицин А. К раствору промежуточного соединения 75 (50,5 г) в 2/1 смеси безводный толуол/EtOAc (675 мл) при комнатной температуре добавляли DBU (9,24 мл). Полученную смесь нагревали до 85 С в течение 8 ч. Осуществляли дальнейшее добавление DBU (4,4 мл) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Смесь затем разбавляли рассолом (250 мл), экстрагировали EtOAc (2350 мл), сушили и фильтровали. Выпаривание растворителя при пониженном давлении и кристаллизация из смеси ацетон/вода давали соединение, указанное в заголовке (46 г).MS; m/z (ES): 814 [MH]+. Промежуточное соединение 77. 12-Хлорэтаноил-11-дезокси-2',4"-О-диацетил-10,11-дидегидро-6-Ометил-эритромицин А. К раствору промежуточного соединения 76 (20 г) в безводном DCM (340 мл) при 0 С добавляли пиридин (6 мл) и хлоруксусный ангидрид (8,4 г) и позволяли реакционной смеси нагреться до комнатной температуры. Через 16 ч реакционную смесь промывали водой (300 мл), органическую фазу сначала промывали насыщенным водным раствором NH4Cl (150 мл) и затем рассолом (150 мл). Объединенную водную фазу экстрагировали DCM (2300 мл). Органическую фазу высушивали, фильтровали и выпаривали при пониженном давлении. Необработанный продукт осаждали из смеси ацетон/вода с получением соединения, указанного в заголовке (20,4 г).MS; m/z (ES): 890 [МН]+. Промежуточное соединение 78. (11S,11aR)-11-(Карбоксицианометил)-11-дезокси-2',4"-O-диацетил 6-O-метил-эритромицин А. Промежуточное соединение 77 (27,4 г) растворяли в безводном DMF (275 мл) и добавляли цианид калия (5 г). Смесь перемешивали при комнатной температуре в течение 4,5 ч, гасили насыщенным водным раствором NaHCO3 (250 мл) и экстрагировали DCM (3300 мл). Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в ацетоне(100 мл) и соединение осаждали добавлением воды (250 мл). Фильтрация давала соединение, указанное в заголовке (25,8 г).MS; m/z (ES): 881 [MH]+. Промежуточное соединение 79. (11S,11aR)-11-(Карбоксицианометил)-11-дезокси-6-O-метилэритромицин А. К раствору промежуточного соединения 78 (300 мг) в безводном МеОН (40 мл) добавляли водный раствор гидроксида лития (1 М, 4 мл) и реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Раствор HCl (10% об./об.) медленно добавляли до достижения рН = 8 и растворитель частично выпаривали при пониженном давлении. Раствор разбавляли водой (20 мл) и экстрагировали DCM(820 мл). Собранную органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Необработанный продукт очищали флэш-хроматографией (элюент: DCM/MeOH 85/15) с получением соединения, указанного в заголовке (150 мг).TLC: MeOH/DCM 10/90 (Rf=0,23). Промежуточное соединение 80. (11S,17 аR)-2'-O-Ацетил-11-(карбоксицианометил)-11-дезокси-6-Oметил-эритромицин А. К раствору промежуточного соединения 79 (150 мг) в безводном DCM (20 мл) добавляли NaHCO3(48 мг), а затем уксусный ангидрид (0,020 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Отфильтровывали NaHCO3, органическую фазу промывали водой (320 мл), объединенную органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,145 г).TLC: MeOH/DCM 5/95 (Rf=0,24). Промежуточное соединение 81. (11S,11aR)-2'-O-Ацетил-4"-O-пропеноил-11-(карбоксицианометил)11-дезокси-6-О-метил-эритромицин А. К раствору промежуточного соединения 80 (90 мг) в безводном DCM (10 мл), охлажденном до 0 С,добавляли пиридин (0,174 мл), а затем пропеноилхлорид (0,174 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 24 ч, затем промывали водой (310 мл). Затем органическую фазу сначала промывали насыщенным водным раствором NaHCO3 (210 мл), а затем рассолом(210 мл). Объединенную водную фазу экстрагировали DCM (210 мл) и объединенную органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении. Необработанный материал фильтровали через силикагель (элюент: DCM/MeOH 95/5) с получением соединения, указанного в заголовке (90 мг).TLC: MeOH/DCM 5/95 (Rf=0,42). Промежуточное соединение 82. 2'-O-Ацетил-рокситромицин. К раствору рокситромицина (500 мг) и NaHCO3 (150 мг) в безводном DCM (50 мл) добавляли уксусный ангидрид (0,062 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, фильтровали и фильтрат промывали водой (320 мл). Объединенную водную фазу экстрагировалиDCM (320 мл) и объединенную органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (510 мг).TLC: MeOH/DCM 5/95 (Rf=0,28). Промежуточное соединение 83. 2'-O-Ацетил-4"-O-пропеноил-рокситромицин. К раствору промежуточного соединения 82 (50 мг) в безводном толуоле (10 мл) добавляли триэтиламин (0,016 мл) и 3-хлорпропионилхлорид (0,008 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (3 мл) и реакционную смесь экстрагировали EtOAc(310 мл). Объединенную органическую фазу высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Необработанный материал фильтровали через силикагель (элюент:TLC: MeOH/DCM 5/95 ( 0,36). Промежуточное соединение 84. 6-(2-Аминоэтиламино)-7-хлор-1-циклопропил-1H-хинолин-4-он и 7-(2-аминоэтиламино)-1-циклопропил-6-фтор-1H-хинолин-4-он. Раствор 40:60 смеси промежуточных соединений 15 и 16 (147 мг) в водном HCl (2N, 5 мл) нагревали при 100 С в течение 4 дней в герметичной тубе. Реакционную смесь концентрировали при пониженном давлении. Необработанный продукт очищали препаративной TLC (элюент: DCM/MeOH/NH4OH 90/10/1,5) с получением соединений, указанных в заголовке (23 мг, 70/30 смесь Cl/F производных). 1 Н-ЯМР (500 МГц)для 6-(2-аминоэтиламино)-7-хлор-1-циклопропил-1H-хинолин-4-она: 8,05 (s,1H), 7,85 (d, 1H), 7,35 (s, 1H), 6,10 (d, 1H), 3,50-2,70 (m, 5H), 1,30-0,98 (m, 4 Н). Н-ЯМР (500 МГц)для 7-(2-аминоэтиламино)-1-циклопропил-6-фтор-1H-хинолин-4-она: 7,81 (d,1H), 7,65 (d, 1H), 7,00 (d, 1H), 6,03 (d, 1H), 3,50-2,70 (m, 5H), 1,30-0,98 (m, 4 Н). Промежуточное соединение 85. 7-(2-Аминоэтиламино)-1-циклопропил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты метиловый эфир. Суспензию промежуточного соединения 8 (2,0 г, 6,55 ммоль) в 3% H2SO4 в МеОН (170 мл) перемешивали при 60 С в течение 48 ч, причем за это время реакционная смесь становилась раствором. Реакционный раствор нейтрализовали и растворитель выпаривали. Необработанный продукт очищали флэшхроматографией на силикагеле с использованием MeOH-CH2Cl2-NH4OH=9-5-0,5 с получением соединения, указанного в заголовке (720 мг). Промежуточное соединение 86. 7-[(2-Аминобутил)амино]-1-метил-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. К раствору 7-хлор-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоновой кислоты (1,0 г, полученной согласно Н. Agui and Т. Nakagome, J. Heterocycl. Chem. (1979), 16(7), 1353-60) в 1-метил-2-пирролидиноне (10 мл) добавляли 1,4-диаминобутан (1,84 г). Смесь нагревали при 130 С в течение 17 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН и фильтровали с получением соединения, указанного в заголовке (860 мг).MS (ES) m/z: [MH]+ 290,3. Промежуточное соединение 87. 7-[(2-Аминоэтил)амино]-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоновая кислота. К раствору 7-хлор-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоновой кислоты (1,5 г, полученной согласно Н. Agui and Т. Nakagome, J. Heterocycl. Chem., (1979), 16(7), 1353-60) в 1-метил-2 пирролидиноне (15 мл) добавляли этилендиамин (1,9 г). Смесь нагревали при 130 С в течение 24 ч. Реакционную смесь охлаждали и выливали в DCM (20 мл). Полученный осадок диспергировали в МеОН и фильтровали с получением соединения, указанного в заголовке (500 мг).MS (ES) m/z: [MH]+ 262,3. Промежуточное соединение 88. 7-[(2-Аминоэтил)амино]-1-циклопропил-1,4-дигидро-4-оксо-6 фтор-8-метокси-3-хинолин карбоновая кислота. К раствору 1-циклопропил-1,4-дигидро-4-оксо-6,7-дифтор-8-метокси-3-хинолин карбоновой кислоты (1,0 г) в N,N-диметилацетамиде (10 мл) добавляли N-BOC-этилендиамин (0,82 мг). Смесь нагревали при 120 С в течение 12 ч. Добавляли трифторуксусную кислоту (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Растворитель выпаривали при пониженном давлении. Необработанный продукт растворяли в воде (5 мл) и подводили рН с помощью 20% NaOH до 7. Полученный осадок диспергировали в МеОН и фильтровали с получением соединения, указанного в заголовке (1,01 г).MS; m/z (ES): 336,0 [МН]+. Пример 1. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино] этил]амино]пропионил]-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 23 (20 мг) в CH3CN (0,4 мл) добавляли промежуточное соединение 7 (16 мг). Полученную смесь нагревали при 70 С в течение 24 ч. Растворитель концентрировали при пониженном давлении и остаток очищали на силикагелевой SPE-колонке с использованием системы градиента растворителя DCM/MeOH/NH4OH с получением соединения, указанного в заголовке (11 мг).(m, 1 Н), 3,58-3,55 (m, 2 Н), 3,49 (s, 1 Н), 3,39 (m, 1 Н), 3,29 (s, 3H). Пример 2. 4"-O-[3-2-[(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино] этил]амино]пропионил]-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 23 (20 мг) в МеОН (0,4 мл) добавляли промежуточное соединение 8 (36 мг). Полученную смесь нагревали при 70 С в ультразвуковой ванне в течение 60 ч. Смесь фильтровали и фильтрат выпаривали при пониженном давлении. Остаток очищали на силикагелевойMs (ES) m/z: 1108 [МН]+. Пример 3. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)амино] этил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 25 (5 г) в iPrOH (40 мл) добавляли промежуточное соединение 7 (2,8 г). Реакционную смесь перемешивали при 80 С в течение 24 ч. Избыток амина отфильтровывали из реакционной смеси и добавляли МеОН (100 мл). Реакционную смесь перемешивали в течение 4 дней. Реакционную смесь фильтровали и выпаривали при пониженном давлении с получением смеси- 26007433 необработанного продукта (5,94 г). Необработанный продукт очищали флэш-хроматографией в системе градиента растворителя DCM/MeOH/NH4OH с получением соединения, указанного в заголовке (1,385 г).(dd, 1 Н), 4,70 (d, 1H), 4,50 (d, 1 Н), 4,37 (m, 1H), 4,19 (m, 1 Н), 3,98 (d, 1H), 3,71-3,66 (m, 2 Н), 3,58-3,54 (m,1H), 3,50 (s, 1 Н), 3,38 (m, 1 Н), 3,31 (s, 3H). 13 С-ЯМР (75 МГц) : 177,5; 177,2; 174,3; 172,3; 167,3; 145,8; 143,1; 132,5; 127,6; 126,3; 118,0; 107,6; 104,5; 102,6; 95,3; 80,1; 78,9; 78,8; 77,4; 74,2; 72,9; 70,8; 70,3; 68,2; 65,4; 62,8; 51,8; 49,5; 47,5; 45,5; 44,4; 43,0; 42,8; 42,4; 42,3; 40,9; 40,4; 35,3; 35,1; 34,7; 29,0; 23,9; 21,7; 21,6; 21,3; 21,2; 18,0; 16,1; 15,0; 11,2; 9,6; 9,3; 8,1. Пример 4. 4"-O-[3-2-[(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино] этил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 26 (134 мг) в i-PrOH (2,5 мл) добавляли промежуточное соединение 8 (100 мг) и встряхивали при 85 С в течение 14 дней. Реакционную смесь охлаждали до комнатной температуры и фильтровали через силикагелевый картридж (2 г), элюируя DCM (10 мл). Растворитель выпаривали с получением 100 мг необработанного остатка, который очищали на силикагелевойSPE-колонке в системе градиента растворителя DCM/MeOH/NH4OH с получением соединения, указанного в заголовке (9,3 мг).MS; m/z (ES): 1122,3 [МН]+. Пример 5. 4"-O-[3-2-[(7-Хлор-1-циклопропил-1,4-дигидро-3-метоксикарбонил-4-оксо-6-хинолинил)амино]этил]амино]пропионил]-6-О-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 25 (100 мг) в i-PrOH (1 мл) добавляли промежуточное соединение 10 (60 мг). Эту смесь нагревали при 70 С в течение 18 ч. Растворитель выпаривали и остаток растворяли в МеОН и перемешивали при комнатной температуре в течение 24 ч. Растворитель выпаривали и остаток очищали на силикагелевой SPE-колонке (элюент: от DCM 100% до DCM/MeOH/NH4OH 85/13/2) с получением соединения, указанного в заголовке (62 мг).MS; m/z (ES): 1152,6 [MH]+. Пример 6. 4"-O-[3-[4-(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)-1-пиперазинил]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Смесь промежуточного соединения 26 (100 мг) и 1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7 пиперазинил-хинолин-3-карбоновой кислоты (203 мг) в МеОН (20 мл) перемешивали при 60 С в течение 2 дней, затем при комнатной температуре в течение 2 дней и затем при 60 С в течение 24 ч. Полимерсвязанный изоцианат (600 мг) и DCM (60 мл) добавляли и перемешивали при комнатной температуре в течение 48 ч. Суспензию фильтровали и промывали DCM (10 мл). Фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (150 мг).MS; m/z (ES): 1149,4 [MH]+. Пример 7. 4"-O-[3-[4-(3-Карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)пиперазинил] пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Реакция промежуточного соединения 26 (10 мг) и 1-циклопропил-4-оксо-7-пиперазинил-1,4 дигидрохинолин-3-карбоновой кислоты (19 мг), проведенная согласно методике, описанной для примера 6, давала соединение, указанное в заголовке (4,2 мг).MS; m/z (ES): 1131,6 [MH]+. Пример 8. 4"-O-[3-[4-(1-Циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)пиперазинил] пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Реакция промежуточного соединения 26 (10 мг) и 1-циклопропил-5-фтор-4-оксо-7-пиперазинил-1,4 дигидро-4-хинолинона (18 мг), проведенная согласно методике, описанной для примера 6, давала соединение, указанное в заголовке (5,1 мг).MS; m/z (ES): 1105,6 [МН]+. Пример 9. 4"-O-[3-[4-(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил)-1-пиперазинил]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Реакция промежуточного соединения 26 (10 мг) и 7-хлор-1-циклопропил-4-оксо-6-пиперазинил-1,4 дигидрохинолон-3-карбоновой кислоты (21 мг), проведенная согласно методике, описанной для примера 6, давала соединение, указанное в заголовке (4,8 мг).MS; m/z(ES): 1165,8 [MH]+. Пример 10. 4"-O-[3-4-[(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил) амино]бутил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 26 (100 мг) в i-PrOH (2 мл) добавляли 7-4 аминобутил)амино)-1-циклопропил-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновую кислоту (61 мг) и встряхивали при 70 С в течение 2 дней. Растворитель выпаривали и остаток очищали флэшхроматографией в системе градиента растворителя DCM/MeOH/NH4OH с получением соединения, указанного в заголовке (48 мг).MS m/z (ES): 1150,9 [MH]+. Пример 11. 4"-O-[3-3-[(3-Карбокси-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-хинолинил) амино]пропил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 25 (10 мг) в i-PrOH (3 мл) добавляли промежуточное соединение 14 (17 мг) и реакционную смесь нагревали при 70 С в течение 42 ч. Реакционную смесь фильтровали, промывали твердое вещество i-PrOH, объединенные фильтраты концентрировали при пониженном давлении и перемешивали в МеОН в течение 72 ч. Выпаривание растворителя давало необработанный продукт, который очищали препаративной TLC (элюент: MeOH/NH4OH 97/3) с получением соединения, указанного в заголовке (3,6 мг). 1 Н-ЯМР (500 МГц) : 8,73 (s, 1H), 7,93 (d, 1H), 7,00 (bm, 1H), 6,91 (d, 1H), 5,60 (bd, 1H), 4,70 (d, 1H),4,40 (m, 1H), 4,20 (m, 1H), 3,50 (m, 1H), 3,40 (m, 2H), 2,94-2,90 (m, 4H), 2,65 (m, 2H), 1,95 (m, 2H), 1,39 (m,2H), 1,16 (m, 2H). Пример 12. 4"-O-[3-3-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил) амино]пропил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 25 (10 мг) в i-PrOH (3 мл) добавляли промежуточное соединение 13 (20 мг) и реакционную смесь нагревали при 70 С в течение 42 ч. Реакционную смесь фильтровали, промывали твердое вещество i-PrOH, объединенные фильтраты концентрировали при пониженном давлении и перемешивали в МеОН в течение 72 ч. Выпаривание растворителя давало необработанный продукт, который очищали препаративной TLC (элюент: МеОН/NH4 ОН 97/3) с получением соединения, указанного в заголовке (3,9 мг). 1H-ЯМР (500 МГц) : 8,73 (s, 1H), 8,02 (s, 1H), 7,52 (s, 1H), 5,86 (bs, 1H), 5,59 (bd, 1H), 4,70 (d, 1 Н),4,38 (m, 1H), 3,55 (m, 1 Н), 3,40 (m, 2 Н), 2,93 (m, 2 Н), 2,85 (m, 2 Н), 2,71-2,55 (m, 2 Н), 2,00 (m, 2 Н), 1,40 (m,2 Н), 1,16 (m, 2 Н). Пример 13. 4"-O-[3-2-[(3-Карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино] этил]амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 26 (100 мг) в i-PrOH (1 мл) добавляли промежуточное соединение 4 (105 мг) и встряхивали при 70 С в течение 22 ч. Растворитель выпаривали и остаток растирали с DCM (2 мл). Полученную суспензию фильтровали и промывали DCM (1 мл). Фильтрат концентрировали при пониженном давлении. Необработанный продукт осаждали из смеси EtOAc/н-гексан с получением соединения, указанного в заголовке (20 мг).MS; m/z (ES): 1105,0 [MH]+. Пример 14. 4"-O-[3-2-[(3-Карбокси-1,4-дигидро-1-этил-4-оксо-7-хинолинил)амино]этил]амино] пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. Раствор промежуточного соединения 26 (90 мг) и промежуточного соединения 3 (90 мг) в i-PrOH (1 мл) нагревали при 70 С в течение 20 ч. Растворитель выпаривали, остаток растирали с DCM (2 мл). Полученную суспензию фильтровали и промывали DCM (1 мл). Маточный раствор концентрировали при пониженном давлении. Необработанный продукт осаждали из смеси EtOAc/н-гексан с получением соединения, указанного в заголовке (38 мг).MS; m/z (ES): 1093,3 [МН]+. Пример 15. 4"-О-[3-4-(3-Карбокси-1-этил-6-фтор-1,4-дигидро-[1,8]нафтиридинил)-4-оксо-[1-пиперазинил]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 25 (20 мг) в безводном МеОН (2 мл) добавляли 1-этил-6 фтор-4-оксо-7-пиперазин-1-ил-1,4-дигидро-[1,8]нафтиридин-3-карбоновую кислоту (22 мг). Реакционную смесь перемешивали при 40 С в течение ночи, растворитель выпаривали и остаток растворяли вDCM (3 мл). Добавляли смолу из полимерсвязанного изоцианата и смесь встряхивали при комнатной температуре в течение ночи. Смолу фильтровали и промывали DCM (3 мл), МеОН (3 мл) и DCM (3 мл). Собранные органические экстракты выпаривали при пониженном давлении. Остаток растворяли в DCM(5 мл) и промывали водой (33 мл). Органическую фазу высушивали, фильтровали и концентрировали при пониженном давлении. Необработанный материал очищали флэш-хроматографией (элюент:DCM/MeOH 90/10) с получением соединения, указанного в заголовке (18 мг). 1 Н-ЯМР (500 МГц) : 15,0 (bs, 1 Н), 8,71 (s, 1H), 8,12 (d, 1 Н), 5,57 (bd, 1 Н), 4,72 (d, 1H), 4,41 (q, 2 Н),4,39 (m, 1 Н), 4,19 (m, 1 Н), 3,85 (m, 4 Н), 2,83-2,55 (m, 4 Н), 2,64 (m, 4 Н), 1,51 (t, 3H). Пример 16. 4"-O-[3-2-[(1-Бензил-3-карбокси-1,4-дигидро-4-оксо-6-хинолинил)амино]этил] амино]пропионил]-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 26 (80 мг) в i-PrOH (1,5 мл) добавляли помежуточное соединение 1 (49 мг). Полученную смесь перемешивали при 70 С в течение 18 ч. Добавляли DBU (0,04 мл) и реакционную смесь перемешивали при 50 С в течение дополнительных 24 ч. Растворитель выпаривали при пониженном давлении и необработанный продукт очищали флэш-хроматографией (элюент:- 28007433 Пример 17. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-6-О-этил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 30 (139 мг) в МеОН (5 мл) добавляли промежуточное соединение 7 (102,5 мг) и перемешивали при 60 С в течение 24 ч. Реакционную суспензию фильтровали,концентрировали при пониженном давлении и остаток очищали флэш-хроматографией (элюент:MS; m/z (ES): 1153,7 [MH]+. 13 С-ЯМР (500 МГц) (/м.д.): 177,5, 175,2, 172,3, 167,4, 145,8, 143,1, 132,5, 127,6, 126,3, 118,0, 107,6,104,5, 103,1, 97,4, 78,8, 78,7, 77,5, 74,1, 73,1, 71,0, 70,9, 68,6, 65,4, 62,9, 49,5, 47,5, 45,4, 44,5, 42,8, 42,5,41,9, 41,8, 40,7, 40,4, 35,8, 35,4, 34,5, 23,2, 21,5, 21,4, 21,3, 17,5, 16,1, 15,4, 10,8, 10,5, 9,9, 8,1. Пример 18. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-6-O-пропил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 48 (220 мг) в МеОН (5 мл) добавляли промежуточное соединение 7 (182 мг) и перемешивали при 60 С в течение 24 ч. Реакционную суспензию фильтровали,выпаривали метанол при пониженном давлении и остаток очищали флэш-хроматографией (элюент:MS; m/z (ES): 1167,3 [MH]+. 13 С-ЯМР (500 МГц) (/м.д.): 177,5, 175,1, 172,2, 167,4, 145,8, 143,1, 132,5, 127,7, 126,4, 118,0, 107,6,104,4, 102,9, 97,3, 78,9, 78,7, 77,4, 74,2, 73,0, 71,1, 70,9, 68,5, 65,4, 62,9, 49,5, 47,5, 45,4, 44,5, 42,8, 42,5,42,0, 40,7, 40,4, 35,8, 35,4, 34,6, 23,2, 21,6, 21,5, 21,4, 21,3, 17,6, 16,2, 16,0, 10,8, 10,5, 9,9, 8,1. Пример 19. 11,12-Карбонат-4"-O-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6 хинолинил)амино]этил]амино]карбонил]-11,12-дидезокси-6-O-метил-8 а-аза-8 а-гомоэритромицин А. К раствору промежуточного соединения 36 (105 мг) в DMF добавляли промежуточное соединение 7(73 мг) и DBU (0,2 мл). Полученную смесь перемешивали в атмосфере аргона при 60 С в течение 1 ч. Затем добавляли EtOAc (30 мл) и насыщенный водный раствор NaHCO3 (30 мл). Водную фазу промывали EtOAc (215 мл) и органические растворы объединяли, сушили и концентрировали при пониженном давлении. Необработанный остаток растворяли в МеОН (50 мл) и раствор перемешивали в течение ночи. Растворитель выпаривали и необработанный продукт очищали флэш-хроматографией (элюент:(d, 1H), 4,93 (dd, 1H), 4,60 (d, 1H), 4,41 (d, 1H), 4,38 (d, 1H), 4,34 (m, 1H), 4,13 (m, 1 Н), 4,02 (m, 1 Н), 3,673,62 (m, 3H), 3,57-3,55 (m, 2 Н), 3,47-3,43 (m, 2 Н), 3,31 (s, 3H),3,18 (s, 3H). 13 С-ЯМР (75 МГц) : 177,5; 176,4; 170,4; 167,3; 157,5; 153,3; 145,9; 142,9; 132,7; 127,5; 126,2; 118,1; 107,6; 103,9; 102,9; 96,1; 85,6; 82,2; 80,38; 79,7; 79,6; 75,4; 73,2; 70,7; 68,7; 65,3; 63,1; 51,1; 49,6; 45,8; 45,05; 42,6; 42,4; 42,0; 40,3; 39,8; 35,4; 29,1; 22,8; 22,5; 21,9; 21,3; 21,1; 17,7; 14,6; 14,0; 12,3; 11,0; 10,5; 8,1. Пример 20. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-4-оксо-1,4-дигидро-6-хинолинил) амино]этил]амино]пропионил]-11-O-[3-(3-хинолил)-2-пропенил]-8 а-аза-8 а-гомоэритромицин А. К суспензии промежуточного соединения 40 (0,1 г) в i-PrOH (4 мл) добавляли промежуточное соединение 7 (0,2 г). Полученную смесь перемешивали при 80 С в течение 3 дней, затем растворитель выпаривали и остаток очищали флэш-хроматографией (элюент: CHCl3/MeOH/NH4OH 6/1/0,1) с получением соединения, указанного в заголовке (45 мг).MS; m/z (ES): 1291,9 [MH]+. Пример 21. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-6-O-метил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 43 (200 мг) в i-PrOH (2 мл) добавляли промежуточное соединение 7 (125 мг) и встряхивали в течение 7 ч при 70 С, затем при 80 С в течение ночи. Реакционную смесь фильтровали и фильтрат выпаривали при пониженном давлении. Остаток очищали флэшхроматографией в системе градиента растворителя DСМ/МеОН/NH4 ОН с получением соединения, указанного в заголовке (48 мг).MS; m/z (ES): 1139,8 [МН]+. Пример 22. 4"-O-[3-4-[(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил) амино]бутил]амино]пропионил]-6-O-метил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 43 (100 мг) в i-PrOH (2 мл) добавляли 7-2 аминобутил)амино)-1-циклопропан-1,4-дигидро-6-фтор-4-оксохинолин-3-карбоновую кислоту (122 мг) и встряхивали при 70 С в течение 24 ч. Растворитель концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией в системе градиента растворителя DCM/MeOH/NH4OH с получением соединения, указанного в заголовке (34 мг).- 29007433 К раствору промежуточного соединения 45 (200 мг) в метаноле (5 мл) добавляли промежуточное соединение 7 (148 мг) и перемешивали при 60 С в течение 24 ч. Реакционную суспензию фильтровали,метанол выпаривали при пониженном давлении и остаток очищали флэш-хроматографией (элюент:MS; m/z (ES): 1153,0 [MH]+. 13 С-ЯМР (500 МГц) : 179,2, 177,1, 172,2, 167,4, 145,9, 143,1, 132,5, 127,6, 126,3, 118,0, 107,6, 104,5,101,3, 96,1, 80,0, 79,0, 78,6, 77,7, 74,2, 73,8, 72,8, 71,3, 67,3, 65,0, 63,3, 58,9, 50,8, 49,4, 47,6, 45,6, 44,5, 42,8,40,6, 40,4, 39,8, 35,4, 35,2, 34,7, 34,3, 21,7, 21,3, 20,8, 20,7, 18,6, 18,3, 16,4, 16,1, 15,9, 11,2, 9,7, 8,1. Пример 24. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]-6-O-пропил-9 а-аза-9 а-гомоэритромицин А. К раствору промежуточного соединения 48 (100 мг) в метаноле (5 мл) добавляли промежуточное соединение 7 (73 мг) и перемешивали при 60 С в течение 24 ч. Реакционную суспензию фильтровали и растворитель выпаривали при пониженном давлении. Остаток очищали флэш-хроматографией (элюент:MS; m/z (ES): 1167,3 [МН]+. Пример 25. 11,12-Карбонат-4"-O-[3-2-[(3-карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6 хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин. К суспензии промежуточного соединения 50 (1,0 г) в i-PrOH (45 мл) добавляли промежуточное соединение 7 (2,0 г). Эту смесь нагревали при 70 С в течение 48 ч. Растворитель выпаривали и остаток очищали флэш-хроматографией (элюент: СНСl3/МеОН/NH3 6/1/0,1) с получением соединения, указанного в заголовке (120 мг).MS; m/z (ES): 1151 [МН]+. 1 Н-ЯМР (500 МГц) : 8,72 (s, 1 Н), 8,04 (s, 1H), 7,52 (s, 1H), 5,10 (d, 1H), 4,87 (dd, 1H), 4,72 (d, 1H),4,48 (d, 1H), 4,44-4,37 (m, 3H), 3,70 (m, 1H), 3,58 (d, 1H), 3,31 (s, 3H), 3,27 (m, 1H), 2,87-2,84 (m, 2H), 2,672,55 (m, 3H), 2,44-2,36 (m, 8H), 2,21 (s, 3H), 2,07 (m, 1H), 2,00 (m, 1H), 1,92 (m, 1H), 1,87-1,79 (m, 2H),1,68-1,55 (m, 3H), 1,45 (s, 3H). Пример 26. 11,12-Карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7 хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин. К суспензии промежуточного соединения 50 (1,0 г) в i-PrOH (45 мл) добавляли промежуточное соединение 8 (2,0 г). Эту смесь нагревали при 70 С в течение 48 ч. Растворитель выпаривали и остаток очищали флэш-хроматографией (элюент: СНСl3/МеОН/NH3 6/1/0,1) с получением соединения, указанного в заголовке (150 мг).MS; m/z (ES): 1135 [MH]+. Пример 27. 11,12-Карбонат-4"-O-[3-2-[(3-карбокси-1-циклопропил-1,4-дигидро-4-оксо-7-хинолинил)амино]этил]амино]пропионил]-11,12-дидезоксиазитромицин. К суспензии промежуточного соединения 50 (200 мг) в МеОН (2 мл) добавляли промежуточное соединение 4 (210 мг). Эту смесь нагревали при 70 С в течение 20 ч. Растворитель удаляли при пониженном давлении, затем добавляли DCM (10 мл) и осадок отфильтровывали. Органическую фазу выпаривали при пониженном давлении и остаток очищали флэш-хроматографией (элюент: СНСl3/МеОН/NH3 6/1/0,1) с получением соединения, указанного в заголовке (55 мг).(m, 2 Н), 2,68-2,63 (m, 3H), 2,44-2,35 (m, 8 Н), 2,30 (s, 3H), 2,06 (t, 1H), 1,99 (m, 1 Н), 1,93 (m, 1H), 1,83 (m,1 Н), 1,74 (br d, 1H), 1,66-1,57 (m, 3H), 1,45 (s, 3H). Пример 28. 4"-O-[3-2-[(3-Карбокси-7-хлор-1-циклопропил-1,4-дигидро-4-оксо-6-хинолинил) амино]этил]амино]пропионил]азитромицин. К суспензии промежуточного соединения 51 (70 мг) в ацетонитриле (10 мл) добавляли промежуточное соединение 7 (60 мг) и DBU (0,05 мл). Эту смесь нагревали при 70 С в течение 18 ч. Растворитель выпаривали и остаток очищали флэш-хроматографией (элюент: DCM/MeOH/NH3 90/9/1,5) с получением соединения, указанного в заголовке (13 мг).MS; m/z (ES): 1125 [MH]+. 13 С-ЯМР (75 МГц) : 178,5; 176,8; 171,7; 166,8; 145,2; 142,5; 131,9; 127,0; 125,6; 117,5; 106,8; 103,7; 101,8; 82,4; 78,2; 77,1; 76,9; 73,5; 73,0; 72,7; 72,3; 70,3; 69,4; 67,3; 64,9; 62,4; 62,0; 48,9; 46,9; 44,7; 43,8; 42,2; 41,9; 41,5; 39,8; 35,5; 34,8; 34,2; 34,0; 28,4; 27,0; 26,1; 21,4; 21,3; 20,7; 20,6; 17,1; 15,7; 13,8; 10,6; 8,3; 7,5; 6,5. Пример 29. 4"-O-4-[(3-Карбокси-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-7-хинолинил)амино] бутил]амино]карбонил]азитромицин. К раствору промежуточного соединения 52 (130 мг) в DMF (1 мл) добавляли 7-2 аминобутил)амино)-1-циклопропил-1,4-дигидро-6-фтор-4-оксо-хинолин-3-карбоновую кислоту (54 мг) иDBU (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем до- 30
МПК / Метки
МПК: A61P 31/04, C07H 17/08, A61K 31/70
Метки: макролиды
Код ссылки
<a href="https://eas.patents.su/30-7433-makrolidy.html" rel="bookmark" title="База патентов Евразийского Союза">Макролиды</a>
Следующий патент: Ингибиторы dpiv на основе глутаминила
Случайный патент: Способы изготовления восстановленных табачных листов







